SKRIPSI
Disusun oleh : Imam Syaifullah
20120210083
Program Studi Agroteknologi
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
YOGYAKARTA
SKRIPSI
Diajukan Kepada Fakultas Pertanian Universitas Muhammadiyah Yogyakarta Untuk Memenuhi Syarat Dari Persyaratan Guna Memperoleh Derajat Sarjana
Pertanian
Disusun oleh : Imam Syaifullah
20120210083
Program Studi Agroteknologi
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
YOGYAKARTA
1. Karya tulis saya, skripsi ini, adalah asli dan belum pernah diajukan untuk mendapatkan gelar akademik, baik di Universitas Muhammadiyah Yogyakarta maupun perguruan tinggi lainnya.
2. Karya tulis ini murni gagasan, rumusan dan penelitian saya sendiri, tanpa bantuan pihak lain, kecuali arahan Tim Pembimbing.
3. Karya tulis ini murni gagasan, rumusan dan penilaian saya setelah mendapatkan arahan dan saran dari Tim Pembimbing. Oleh karena itu, saya menyutujui pemanfaatan karya tulis ini dalam berbagai forum ilmiah, maupun pengembangannya dalam bentuk karya ilmiah lain oleh Tim Pembimbing. 4. Dalam karya tulis ini tidak terdapat karya atau pendapat yang telah ditulis atau
dipublikasikan orang lain, kecuali secara tertulis dengan jelas dicantumkan sebagai acuan dalam naskah dengan disebutkan nama pengarang dan dicantumkan dalam daftar pustaka.
5. Pernyataan ini saya buat sesungguhnya dan apabila dikemudian hari terdapat penyimpangan dan ketidakbenaran dalam pernyataan ini, maka saya bersedia menerima sanksi akademik berupa pencabutan gelar yang telah saya peroleh. Karena karya tulis ini, serta sanksi lainnya yang sesuai dengan norma yang berlaku di perguruan tinggi ini.
Yogyakarta, September 2016
Yang membuat pernyataan
Sembah sujud serta syukur kepada Allah yang maha pengasih lagi maha penyayang. Taburan cinta dan kasih sayang-Mu telah memberikanku kekuatan, membekaliku dengan ilmu serta memperkenalkanku dengan cinta. Atas karunia serta kemudahan yang Engkau berikan akhirnya skripsi yang sederhana ini bisa terselesaikan. Sholawat dan salam selalu terlimpahkan keharibaan Rasullah Muhammad SAW.
Dengan ini saya persembahan karya kecil ini kepada orang yang sangat kukasihi dan kusayangi
Sri Kresna Rohyani dan Nazir Oesman, ibu dan ayahanda tersayang terimakasih atas limpahan kasih dan memberikan rasa rindu yang berarti kepada Imam. Tak cukup ku tuliskan ucapan terimakasihku untuk kalian dengan selembar kertas yang bertuliskan kata cinta dan persembahan. Semoga keluarga kita selalu diselimuti kebahagian. Ayah masih teringat dikeningku saat kau pulang mencari rezki ditengah panas terik matahari, wajah lelah serta keriputmu menjadi semangatmu. Ayah tak sempat kau lihat bukti kesuksesanmu ini, bukti kerja kerasmu ini. Semoga keringat serta lelahmu itu membawa imam selalu menjadi anak yang berhasil. Ayah, semoga ayah ditempatkan disisi yang
terbaik oleh Allah SWT. Terima Kasih Ibu… Terima Kasih Ayah…
Mbak Yulia Rizki Pertiwi S.Pd dan adik-adikku Octaviano Nugraha dan Caesar Febrianto, tiada yang paling mengharukan dibandingkan saat kumpul bersama kalian, walaupun sering bertengkar tapi hal ini selalu menjadi warna yang tak bisa tergantikan, terima kasih atas doa serta bantuan kalian selama ini. Mbak, no, ca, alhamdllah mas jadi sarjana.
Rahajeng Yusti Rismaya, “my princess & my best friend”, aku persembahkan karya kecil ini buatmu. Terima kasih atas kasih sayang, perhatian, dan kesabaranmu yang telah memberi semangat dan inspirasiku. Semoga engkau pilihan terbaik dan masa
depanku. Terima kasih “Aii”
iii
iv
Puji syukur penulis panjatkan ke hadiran Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi ini. Skripsi yang
berjudul „‟Uji Efektifitas Bioaktivator Tanah Rayap Dan Makrofauna Uret
Terhadap Aktivitas Dekomposisi Dan Kualitas Kompos Baglog‟‟ ini disusun untuk memenuhi sebagian syarat yang diperlukan untuk memperoleh gelar Sarjana Pertanian di Universitas Muhammadiyah Yogyakarta.
Penulis menyadari bahwa dalam penyusunan proposal, pelaksanaan penelitian sampai tersusunnya skripsi ini tidak lepas dari bantuan banyak pihak, untuk itu penulis menyampaikan banyak terimakasih kepada :
1. Ir. Agung Astuti, M.Si selaku Dosen Pembimbing Akademik, Dosen Pembimbing Utama, yang telah dengan sabar memberikan bimbingan dan arahan selama penelitian dan penyusunan skripsi ini.
2. Ir. Mulyono, MP selaku Dosen Pembimbing Pendamping, yang telah dengan sabar memberikan bimbingan dan pengarahan kepada penulis sehingga tersusunnya skripsi ini.
3. Ir. Bambang Heri Isnawan, M.P selaku Dosen Penguji Skripsi, yang telah memberikan masukan dan bimbingan dalam penyusunan skripsi ini.
4. Ir. Agus Nugroho Setiawan, M.P selaku dosen pembimbing akademik, yang telah memberikan masukan didalam setiap permasalahan akademik
5. Ir. Sarjiah, MS selaku Dekan Fakultas Pertanian Universitas Muhammadiyah Yogyakarta.
6. Seluruh dosen dan karyawan Fakultas Pertanian Universitas Muhammadiyah Yogyakarta, yang telah membantu memperlancar dan mengarahkan kepada penulis sehingga tersusunnya skripsi ini.
7. Bapak, Ibu dan kakak-kakak atas bantuan dan dukungannya yang mendampingi dari awal sampai selesai.
v
Wassallammu’allaikum Wr Wb
Yogyakarta, Agustus 2016
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
INTISARI ... xi
ABSTRACT ... xii
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 3
C. Tujuan Penelitian ... 3
II. TINJAUAN PUSTAKA ... 4
A. Baglog Sisa Jamur Tiram ... 4
B. Kompos ... 5
C. Mikrobia Tanah Rayap ... 12
D. Makrofauna Uret... 15
E. Aktifator Kompos ... 17
F. Hipotesis ... 22
III. TATA CARA PENELITIAN ... 23
A. Tempat dan Waktu Penelitian ... 23
B. Bahan dan Alat Penelitian ... 23
C. Metode Penelitian ... 24
D. Cara Penelitian ... 24
E. Parameter yang Diamati ... 32
F. Analisis Data ... 39
IV. HASIL DAN PEMBAHASAN ... 40
vii
Halaman
B. Uji Efektivitas Aktivator Terhadap Kompos Baglog ... 48
C. Pengamatan Perubahan Fisik ... 52
D. Pengamatan Sifat Kimia ... 62
E. Uji Kematangan Kompos Pada Perkecambahan ... 65
F. SNI Kompos ... 67
V. KESIMPULAN DAN SARAN ... 70
A. Kesimpulan ... 70
Tabel 2. Komposisi Kadar Hara Dari Berbagai Sumber Kotoran Hewan ... 19
Tabel 3. Skoring Warna ... 34
Tabel 4. Skor Bau (%) ... 34
Tabel 5. Skor Distribusi Ukuran Partikel (%) ... 35
Tabel 6. Hasil Identifikasi dan Karakterisasi Bakteri Tanah Rayap ... 40
Tabel 7. Hasil Identifikasi Dan Karakterisasi Isolate Jamur Tanah Rayap ... 43
Tabel 8. Kadar Air Inokulum Jamur pada media inokulum beras ... 47
Tabel 9. Perubahan Warna Kompos Selama Proses Pengomposan ... 56
Tabel 10. Kadar Air Kompos Baglog ... 59
Tabel 11. Perubahan Bau/Aroma Selama Pengomposan ... 61
Tabel 12. Perkecambahan jagung selama 5 hari... 65
Selama 48 Jam ... 46
Gambar 3. Grafik Pertumbuhan Bakteri Selama Pengomposan Baglog ... 48
Gambar 4. Grafik Pertumbuhan Berat Rata – Rata Makrofauna Uret Selama Dekomposisi Baglog. ... 51
Gambar 5. Grafik Suhu Selama Proses Pengomposan Limbah Baglog ... 53
Gambar 6. Perubahan Ukuran Partikel Selama Pengomposan ... 57
Gambar 7. Grafik Perubahan pH Selama Proses Pengomposan ... 63
Lampiran 2. Lay Out Penelitian
Lampiran 3. Sidik Ragam Kadar Air Jamur dan Kompos
Lampiran 4.Dokumentasi penelitian : Sumber Isolat, Hasil Pemurnian & Hasil Identifikasi
Lampiran 5. Dokumentasi Penelitian : Identifikasi Kenampakan Spora, Pengomposan & Pengamatan Mikroba
Lampiran 6. Dokumentasi Penelitian : Pengamatan Suhu, Pengamatan Asam Titrasi, Kadar Air & Uji Kematangan Kompos
Lampiran 7. Laporan Hasil Uji
The Effectiveness Testing Of Termites’ Soil Bio-Activator And Uret Macro Fauna Toward The Decomposition Activity And The Quality of Baglog
Imam Syaifullah
Ir. Agung Astuti, M.Si / Ir. Mulyono, M.P Agrotecnology Department Faculty of Agriculture
Muhammadiyah University of Yogyakarta
ABSTRACT
A study that aims to assess the activity and changes of baglog compost during
decomposition by termites’ soil activator and uret macro fauna, as well as testing the quality of the termites’ soil activator and uret macro fauna in accelerate the process of composting the baglog.
The study was compiled by using a completely randomized design (CRD) with the design of single factor treatment, consisting of four treatments, i.e. fungus baglog composting with : 40 ml / 20 kg of Termites’ Soil Activator, 250 g / 5 kg of Uret Macro Fauna, 20 ml / 20 kg of Commercial Activators and without Activator. The parameters that were observed encompassing observation of changes in physical, chemical, microbiological and compost maturity test.
The result shows the treatment of termites’ soil activator and uret macro fauna experience physical, chemical and microbiology changes in the process of maturation of the compost. However, the treatment that tends to be better is the treatment of termites’
soil activator. The quality of the termites’ soil activator is better than other treatments
in composting baglog to yield 27.90% organic ingredients. Baglog compost that is compliance by the standards of SNI 19-7030 - 2004 uses termites’ soil activator (C / N 15.86%), uret macro fauna (C / N 10.07%), commercial activator (C / N 13.24% ) and without activator (C / N 11.93%).
1
A. Latar Belakang
Peningkatan produksi dan produktivitas komoditas pertanian telah melahirkan petani yang sangat tergantung pada pupuk kimia. Di lain pihak, penggunaan lahan secara terus menerus berakibat pada penurunan bahan organik tanah dan bahkan sebagian besar lahan pertanian mengandung bahan organik rendah (< 2 %), padahal kandungan yang ideal adalah > 3 %. Tanah dengan kandungan bahan organik rendah akan berkurang kemampuannya dalam mengikat pupuk kimia, sehingga efektivitas dan efisiensinya menurun akibat pencucian dan fiksasi.
Perbaikan kesuburan tanah dan peningkatan bahan organik tanah dapat dilakukan melalui penambahan bahan organik atau kompos. Namun demikian, kandungan hara pupuk organik tergolong rendah dan sifatnya slow release, sehingga diperlukan dalam jumlah yang banyak (Anonim, 2014b). Pupuk organik adalah pupuk yang sebagian besar atau seluruhnya terdiri dari bahan organik yang berasal dari tanaman dan atau hewan yang telah melalui proses rekayasa, dapat berbentuk padat atau cair yang digunakan untuk mensuplai bahan organik serta memperbaiki sifat fisik, kimia dan biologi tanah (Djuarnani dkk,. 2004).
mendapatkan energi, serta karbon dan nutrisi untuk pertumbuhan dan perkembangan. Dekomposer dapat memecah sel-sel dari organime lain menggunakan reaksi biokimia yang mengkonversi jaringan organisme mati menjadi senyawa kimia metabolik, tanpa menggunakan pencernaan internal. Dekomposer menggunakan organisme yang sudah mati sebagai sumber nutrisi mereka (Balittanah, 2006).
mengguntungkan. Namun belum ada yang menggunakan mikrobia tanah rayap sebagai bioaktivator pengkomposan sisa Baglog jamur Tiram (Fulkiadi, 2008).
B. Perumusan Masalah
1. Bagaimana aktivitas antara aktivator tanah rayap dan makrofauna uret dalam mempercepat proses pengomposan baglog ?
2. Bagaimana kualitas kompos Baglog antara yang dihasilkan dari aktivator tanah rayap dan yang dihasilkan dari makrofauna uret ?
3. Bagaimana SNI kompos Baglog antara yang dihasilkan dari aktivator tanah rayap dan yang dihasilkan dari makrofauna uret ?
C. Tujuan Penelitian Penelitian ini bertujuan untuk :
1. Mengkaji aktivitas dan perubahan kompos baglog selama proses dekomposisi oleh aktivator tanah rayap dan makrofauna uret.
2. Menguji kualitas antara aktivator tanah rayap dan makrofauna uret dalam mempercepat proses pengomposan baglog.
4
A. Baglog Sisa Jamur Tiram
Budidaya jamur Tiram banyak dilirik para pelaku usaha, baik yang berskala kecil maupun yang berskala besar sebagai industri, sehingga secara tidak langsung juga menimbulkan permasalahan mengenai limbah, yaitu Baglog Jamur Tiram yang sudah habis masa tanamnya. Pemanfaatan limbah Baglog saat ini baru mendaur ulang lagi sebagai media Baglog, untuk budidaya cacing dan untuk bahan bakar dalam proses steamer Baglog (Anonim, 2014a). Limbah Baglog dapat dimanfaatkan sebagai pupuk organik yang berguna memperbaiki struktur dan kesuburan tanah, meningkatkan daya simpan dan daya serap air, memperbaiki kondisi biologi dan kimia tanah, memperkaya unsur hara makro dan mikro serta tidak mencemari lingkungan dan aman bagi manusia. Kandungan baglog jamur tiram ini meliputi, 90 % serbuk gergaji, 7 % bekatul, 1% kapur, 2 % tapioka dan 45-60 % volume air (Muchlisin, 2012), sedangkan menurut Siti dkk. (2012) Komposisi media tanam 80 – 95 % serbuk kayu gergaji, 3 – 18 % bekatul, 1 % kapur, 1 % gips memberikan pertumbuhan dan hasil jamur tiram segar yang baik. Menurut Cahyana dan Muchroji (2000) kayu atau serbuk kayu gergaji yang digunakan sebagai tempat tumbuh jamur mengandung serat organik selulosa, hemi selulosa, serat, lignin, karbohidrat. Menurut Trubus (2007) bekatul yang kaya karbohidrat, karbon dan vitamin B komplek bisa mempercepat pertumbuhan dan mendorong perkembangan tubuh buah jamur. Gips atau CaSO4 digunakan sebagai sumber kalsium (Ca) dan
berguna untuk memperkokoh media baglog, dalam keadaan kokoh media tidak akan cepat rusak (Rachmatullah, 2009). Menurut Cahyana, dkk (1997) CaCO3 berupa kapur
dalam pertumbuhannya. Komponen utama pada kandungan baglog jamur tiram ini adalah serbuk gergaji. Serbuk gergaji yang biasa digunakan sebagai bahan baglog adalah kayu albasia dan kayu jati. Menurut Sukahar (1999) kayu albasia memiliki kandungan selulosa sebesar 48.33 %, lignin 27.28 %, dan hemiselulosa sebesar 16,75 %. Sedangkan menurut Abdurrahim (2015) kayu jati memiliki kandungan kimia berupa selulosa sebesar 47.5 %, lignin 29.9 %, dan hemiselulosa 14.4 %. Bahan pembuatan Baglog Jamur Tiram 90 % berupa serbuk kayu, setelah budidaya jamur selesai, Baglog terdapat banyak selulosa (bahan utama penyusun kayu) (Fulkiadi, 2008). Laporan hasil uji C/N ratio yang dihasilkan dari penelitian Imam dkk. (2015) mendapatkan bahwa C/N ratio pada baglog tanpa perlakuan adalah 19,05.
B. Kompos
diaktifkan selama proses pembuatan kompos (proses fermentasi 3-4 hari). (3) Sekam/ Arang sekam/ serbuk gergaji sangat baik untuk meningkatkan kualitas kompos yang dihasilkan dari segi teksturnya. Untuk mengkomposkan 1 ton bahan organik, diperlukan 1 liter EM4 yang dilarutkan ke dalam 10 lt air dan proses dekomposisi < 15 hari (Hidayat, 2010).
1. Faktor dalam a. C/N rasio
Proses pengomposan akan berjalan baik jika C/N rasio bahan organik yang dikomposkan sekitar 25-35. C/N rasio bahan organik yang terlalu tinggi akan menyebabkan proses pengomposan berlangsung lambat. Begitu juga sebaliknya. Setiap bahan organik memiliki C/N rasio yang berbeda, oleh sebab itu dalam penggunaan sebagai bahan baku kompos harus dicampur dengan bahan organik yang memiliki imbangan C/N tinggi sehingga dapat menghasilkan C/N rasio yang optimal.
b. Jumlah dan jenis Mikroorganisme yang terlibat
2. Faktor Luar
Menurut Hidayat (2010) sebagai berikut : a. Temperatur
Temperatur optimum bagi pengomposan adalah 40 – 600C dengan maksimum 750C.
b. Tingkat Keasaman (pH)
Pengaturan pH perlu dilakukan karena merupakan salah satu faktor yang kritis bagi pertumbuhan mikroorganisme yang terlibat dalam proses pengomposan. Pada awal pengomposan cenderung agak asam. Namun akan mulai naik sejalan dengan waktu pengomposan dan akan stabil pada pH sekitar netral.
c. Aerasi
Pengomposan yang cepat dapat terjadi dalam kondisi yang cukup oksigen (aerob). Aerasi ditentukan oleh porositas dan kandungan air bahan (kelembaban).
d. Kelembaban (RH)
Kelembaban yang baik untuk berlangsungnya proses dekomposisi secara aerobik adalah 50-60%.
e. Ukuran Bahan Baku
Dekomposisi bahan yang memiliki C/N rasio yang tinggi perlu ditambah hijauan untuk menurunkan kadar C/N rasio, sehingga proses dekomposisi akan berjalan lebih cepat.
Proses pengomposan akan berlangsung ketika bahan – bahan mentah telah dicampur. Proses pengomposan dapat dibagi menjadi dua tahap, yaitu tahap aktif dan tahap pematangan. Dalam proses pengomposan, mikroba selulotik mengeluarkan enzim selulase yang dapat menghidolisis selulosa menjadi selobiosa lalu dihidrolisis lagi menjadi D-Glukosa dan difermentasikan menjadi asam Laktat, Etanol, CO2, dan
Amonia. Selama tahap awal proses, oksigen dan senyawa – senyawa yang mudah terdegradasi akan segera dimanfaatkan oleh mikroba mesofilik. Suhu tumpukan kompos akan meningkat dengan cepat. Demikian pula akan diikuti dengan peningkatan pH kompos. Suhu akan meningkat hinga di atas 500 – 700C. Suhu akan tetap tinggi selama waktu tertentu. Mikroba yang aktif pada kondisi ini adalah mikroba Termofilik, yaitu mikroba yang aktif pada suhu tinggi. Pada saat ini terjadi dekomposisi bahan organik yang sangat aktif. Mikroba – mikroba di dalam kompos dengan menggunakan oksigen akan menguraikan bahan organik menjadi CO2, uap air dan panas. Setelah sebagian
besar bahan telah terurai, maka suhu akan berangsur – angsur mengalami penurunan. Pada saat ini terjadi pematangan kompos tingkat lanjut, yaitu pembentukan komplek liat humus. Selama proses pengomposan akan terjadi penyusutan volume maupun biomasa bahan. Penguraian ini dapat mencapai 30-40% dari volume/bobot awal bahan (Isroi, 2007).
amonia, CO dan HO; (3). Peruraian senyawa organik menjadi senyawa yang dapat diserap oleh tanaman. Dengan perubahan tersebut kadar karbohidrat akan hilang atau turun dan senyawa N yang larut (Amonia) akan meningkat. Dengan demikian C/N rasio semakin rendah dan relative stabil mendekati C/N rasio tanah. Pengomposan berdasarkan kebutuhan oksigen di klasifikasikan menjadi pengomposan aerob dan pengomposan anaerob. Pengomposan aerobic adalah proses dekomposisi oleh mikroba yang memanfaatkan oksigen untuk menghasilkan humus, karbondioksida, air dan energi. Beberapa energinya digunakan untuk pertumbuhan mikroba dan sisanya dikeluarkan dalam bentuk panas (Suhut dan Salundik, 2006).
Menurut Gaur (1980), reaksi – reaksi penting yang terjadi selama proses dekomposisi aerobik adalah sebagai berikut :
Gula
Selulose (CH2O)2 + xO2 xCO2 + xH2O + E
Hemiselulose
Protein (organik N) NH3 → NO2 → NO3 + E
Sulfur – organik S+ xO SO4
Phospat organik H3PO4 Ca (HPO4)2
Secara keseluruhan, reaksinya akan berlangsung seperti berikut :
Mikroba aerob
Bahan organik CO2 + H2O + unsur hara + humus + energy
Sedangkan pengomposan secara anaerob akan menghasilkan gas metana (CH3),
karbondioksida (CO2), dan asam organik yang memiliki bobot molekul rendah (Suhut
dan Salundik, 2006).
(CH2O)x xCH3COOH
CH3COOH CH4 + CO2
N-organik NH3
2H2S + CO2 + sinar (CH2O)x + S2 +H2O
Menurut Yustianti (2013), prinsip-prinsip proses biologis yang terjadi pada proses pengomposan meliputi :
a. Kebutuhan Nutrisi
Untuk perkembangbiakan dan pertumbuhannya, mikroorganisme memerlukan sumber energi, yaitu karbon untuk proses sintesa jaringan baru dan elemen-elemen anorganik seperti Nitrogen, Fosfor, Kapur, Belerang dan Magnesium sebagai bahan makanan untuk membentuk sel-sel tubuhnya. Selain itu, untuk memacu pertumbuhannya, mikroorganisme juga memerlukan nutrien organik yang tidak dapat disintesa dari sumber-sumber karbon lain. Nutrien organik tersebut antara lain asam amino, purin/pirimidin, dan vitamin.
b. Mikroorganisme
Mikroorganisme pengurai dapat dibedakan antara lain berdasarkan kepada struktur dan fungsi sel, yaitu:
1. Eucaryotes, termasuk dalam dekomposer adalah eucaryotes bersel tunggal, antara lain: ganggang, jamur, protozoa.
a. Kelompok I (Konsumen tingkat I) yang mengkonsumsi langsung bahan organik dalam sampah, yaitu : jamur, bakteri, Actinomycetes.
b. Kelompok II (Konsumen tingkat II) mengkonsumsi jasad kelompok I, dan; c. Kelompok III (Konsumen tingkat III), akan mengkonsumsi jasad kelompok I dan
Kelompok I. Kondisi Lingkungan Ideal Efektivitas proses pembuatan kompos sangat tergantung kepada mikroorganisme pengurai.
Standar kualitas kompos sampah organik domestik yang sesuai dengan SNI 19-7030-2004 adalah rasio C/N 10-20, kandungan Nitrogen minimal 0,40%, kandungan Phosphor minimal 0,10%, kandungan Kalium minimal 0,20%, dan Kadar air maksimum 50% (Kurniawan, 2013). Pupuk kompos tidak diberikan sepenuhnya pada tanah sebagai pengganti pupuk anorganik, karena kandungan hara yang dimiliki oleh pupuk kompos sangat rendah sehingga fungsinya hanya mengurangi penggunaan pupuk anorganik. Meski begitu setidaknya pupuk kompos memiliki empat manfaat, yaitu sebagai sumber nutrisi, memperbaiki struktur fisik tanah, memperbaiki kimia tanah, meningkatkan daya simpan air dan meningkatkan aktivitas biologi tanah.
Adapun standar kematangan kompos sampah organik domestik berdasarkan (SNI 19 – 7030 – 2004), sebagai berikut :
Tabel 1. Standar Kualitas Kompos
No Parameter Sat Min Maks. No Parameter Sat Min Maks.
1 Kadar Air % 50 6 Bau Berbau tanah
2 Temperatur Suhu air tanah 7 Bahan Organik % 27 58
3 Warna Kehitaman 8 Nitrogen % 0,4
4 Ukuran partikel Mm 0,55 25 9 Karbon % 9,8 32
5 pH 6,8 7,49 10 C/N Ratio 10 20
C. Mikrobia Tanah Rayap
Rayap merupakan salah satu kelompok serangga dengan jumlah keragaman yang besar. Rayap (Ordo Isoptera) terdiri atas tujuh famili, yaitu Mastotermitidae, Kalotermitidae, Termopsidae, Hodotermitidae, Rhinotermitidae, Serritermitidae, dan
Termitidae. Rayap pekerja mencari makanan, mencernakannya, lalu membagikannya
dengan anggota koloni lain. Mulut rayap pekerja cukup kuat untuk menggigit kayu dan sekaligus membawa kayu hasil gigitannya. Untuk mencernakan selulosa di perlukan enzim selulase. Kebanyakan jenis rayap tidak mampu menghasilkan enzim ini, di bantu oleh hewan ber sel satu (protozoa) yang hidup dalam saluran cerna rayap pekerja (Fulkiadi, 2008).
Protozoa yang bersimbiosis dengan rayap tingkat rendah berbeda pada tiap spesies. Zootermopsis angusticollis bersimbiosis dengan Tricercomitis, Hexamastix, dan Trichomitopsis. Mastotermes darwiniensis bersimbiosis dengan Mixotricha paradoxa (Breznak, 2000). Coptotermes formosanus bersimbiosis dengan Pseudotrichonympha grasii, Spirotrichonympha leidy, Holomastigoides mirabile (Inoue et al., 2005; Nakashima et al., 2002b), dan Holomastigoides hartmanni (Tanaka et al., 2006). Coptotermes lacteus bersimbiosis dengan Holomastigoides mirabile (Watanabe et al., 2002 dalam Todaka et al., 2007). Reticulitermes speratus bersimbiosis dengan Teranympha mirabilis, Triconympha agilis (Ohtoko et al., 2000), Dinenympha exilis dan Pyrsonympha grandis (Todaka et al., 2007) Sedangkan, beberapa contoh bakteri simbion pemecah selulosa pada rayap adalah bakteri fakultatif Serratia marcescens, Enterobacter erogens, Enterobacter cloacae, dan Citrobacter farmeri yang menghuni usus belakang rayap spesies Coptotermes formosanus (famili Rhinotermitidae) dan berperan memecah selulosa, hemiselulosa dan menambat nitrogen.
Jamur 2, berwarna putih, bentuk bulat, hifa spora dan diameter 0,36 cm. Jamur 3, berwarna putih, bentuk bulat, hifa spora dan diameter 0,36 cm.
Protozoa yang menghuni usus rayap tidaklah bekerja sendirian, tetapi melakukan simbiosis mutualisme dengan sekelompok bakteri. Flagella yang dimiliki oleh protozoa tersebut ternyata adalah sederetan sel bakteri yang tertata dengan baik sehingga mirip flagella pada protozoa umumnya. Bakteri yang menyusun flagella memberikan motilitas pada protozoa untuk mendekati sumber makanan, sedangkan ia sendiri menerima nutrien dari protozoa. Contoh genus bakteri ini adalah Spirochaeta dengan Trichomonas termopsidis sebagai simbionnya. Mikroorganisme mencernakan selulosa memerlukan enzim selulase. Telah diketahui mikroorganisme tersebut hidup dalam saluran cerna rayap pekerja, didalam pencernaan rayap terdapat bakteri penghasil enzim selelosae yang kemudian mikroorganisme tersebut keluar bersama kotoran rayap. Kotoran/sarang rayap ini banyak terdapat bakteri dekomposer yang dapat digunakan sebagai perombak bahan organik dan dapat digunakan sebagai dekomposer pembuatan kompos (Balittanah, 2006) .
proses dekomposisi yang terbaik menggunakan 200 ml aktivator tanah rayap untuk mengomposkan 100 kg baglog jamur tiram, dilihat dari tekstur dan warna kompos.
D. Makrofauna Uret
(memasuki puncak kemarau), hingga keluar menjadi serangga dewasa di bulan Oktober atau apabila curah hujan mulai meningkat kembali. Serangga dewasa praktis hidup hanya untuk kawin dan bertelur saja (Wikipedia, 2015).
Menurut penelitian yang dilakukan oleh Iftitah dkk. (2005) Aktivitas organisme tanah bervariasi, mulai dari sebagian besar penghancuran sisa tumbuhan oleh insekta dan cacing tanah sampai dekomposisi total sisa tumbuhan oleh organisme yang lebih kecil seperti bakteri, fungi, dan Actinomycetes. Keberadaan makrofauna tanah yang berperan sebagai dekomposer diduga berhubungan erat dengan kandungan bahan organik tanaman. Penelitian Iftitah dkk. (2005) menunjukkan bahwa kandungan C-organik tertinggi selama perlakuan dekomposisi (awal-hari ke-20) terdapat pada perlakuan CU (cacing + uret). Hal ini dapat diartikan bahwa karbon yang terurai lebih banyak dan dekomposisi berjalan lebih cepat. Pada perlakuan CU, cacing menghasilkan kast (kotoran) yang juga mengandung bahan organik tinggi, sehingga dimungkinkan pada saat mengambil sampel tanah, bagian yang terambil mengandung lebih banyak kast. Dari hasil kandungan N tanah tertinggi selama 20 hari masa dekomposisi adalah pada perlakuan U (uret) sebesar 0,48%.
E. Aktifator Kompos
Menurut Firmansyah (2010) mikroba yang berperan dalam proses pengomposan ada dua jenis yang dominan, yaitu: bakteri dan jamur. Jenis-jenis bakteri penting yang mempengaruhi proses pengomposan dapat dikelompokkan berdasarkan asal bakteri, kebutuhan oksigen, suhu, dan jenis makanannya. Berikut ini kelompok bakteri tersebut :
1. Bakteri berdasarkan asalnya:
a. Autoktron adalah bakteri asli, contoh Arthrobacter dan Nocardio.
b. Zimogar adalah bakteri pendatang, contoh Pseudomonas dan Bacillus. Jumlah bakteri autotrof seragam dan tetap karena berasal dari bahan organik tanah asalnya, jika ada bahan organik yang ditambahkan ke dalam tanah maka bakteri zimogar akan meningkat namun akan menurun lagi jika bahan organik tersebut habis.
2. Bakteri berdasarkan kebutuhan terhadap oksigen (O2):
a. Anaerobik, yaitu bakteri yang berkembang biak tanpa O2.
b. Aerobik, yaitu bakteri yang berkembang biak dengan O2.
c. Anaerobik Fakultatif, yaitu bakteri yang mampu berkembang biak tanpa atau dengan O2.
3. Bakteri yang dikelompokkan berdasarkan suhu:
a. Psikrofil, bakteri yang optimal berkembang di suhu < 20oC. b. Mesofil, bakteri yang berkembang optimal di suhu 15 – 45oC.
d. Superthermofil, bakteri yang berkembang optimal > 70oC. Contohnya: B. Stearothermophilus.
4. Bakteri yang dikelompokkan berdasarkan makanannya:
a. Autotrof, bakteri yang dapat menyusun makanannya sendiri. b. Heterotrof, bakteri tergantung pada makanan yang tersedia.
c. Fotoautotrof, bakteri memperoleh energinya dari sinar matahari. Mikroorganisme yang dominan dalam pengomposan setelah bakteri adalah jamur (fungi), umumnya jamur dapat berkembang di lingkungan asam, kebanyakan bersifat aerobik, dan perkembangannya akan menurun jika kelembaban terlalu tinggi.
Dalam aktivator telah terkandung berbagai macam jenis mikroba baik bakteri maupun jamur yang dapat mendekomposisikan bahan organik, oleh sebab itu penambahan aktivator pada pengomposan akan mempercepat proses dekomposisi bahan organik. Mikroorganisme yang terdapat dalam bioaktivator secara genetik bersifat asli alami dan bukan rekayasa.
1. Aktivator Alam
fotosintetik, serta bakteri menguntungkan yang lain (bakteri penambat N dan pelarut fosfat) (Budiyanto, 2013).
Mikroorganisme pengurai yang hidup dialam jumlahnya sangat banyak, hal tersebut ditandai dengan adanya proses pelapukan pada bahan organik yang dibantu oleh jamur maupun bakteri. Seperti penelitian Gusmaliana (2015) yang memanfaatkan isolat alami sebagai aktivator dari jamur kayu, untuk mendekomposisikan limbah kulit Acacia mangium, ternyata dari 46 isolat (23 bakteri & 23 fungi) yang didapatkan, terpilih 7 isolat fungi yang potensial mendekomposisikan limbah kulit Acacia mangium. Dapat diambil kesimpulan bahwa isolat dari alam berpotensi untuk dikembangkan menjadi aktivator alami. Menurut penelitian Balittanah (2006), pengomposan pupuk kandang akan meningkatkan kadar hara makro. Zat-zat hara yang terkandung dalam kotoran, akan diubah menjadi bentuk yang mudah diserap tanaman. Seperti unsur N yang mudah menguap akan dikonversi menjadi bentuk lain seperti protein. Menurut penelitian Hartatik dkk (2005) perlakuan pengomposan dapat meningkatkan kadar hara N, P, K, Ca, dan Mg serta menurunkan kadar rasio C/N dan kadar air.
Tabel 2.Komposisi Kadar Hara Dari Berbagai Sumber Kotoran Hewan
Beberapa contoh bakteri simbion pemecah pada rayap adalah bakteri fakultatif Serratia marcescens, Enterobacter erogens, Enterobacter cloacae, dan Citrobacter farmeri yang menghuni usus belakang rayap spesies Coptotermes formosanus (famili Rhinotermitidae) dan berperan memecah selulosa, hemiselulosa dan menambat nitrogen. Telah diketahui mikroorganisme tersebut hidup dalam saluran cerna rayap pekerja, yang kemudian mikroorganisme tersebut keluar bersama kotoran rayap bersama bakteri penghasil enzim selelosae.
Aktivator tanah rayap merupakan bioaktivator yang berupa mikroorganisme dari tanah rayap yang diisolasi sehingga didapatkan mikroorganisme yang dapat digunakan sebagai aktivator dekomposer.
Penelitian Imam dkk. (2015) mengatakan bahan limbah baglog dengan aktivator dengan tanah rayap 1, 100 kg limbah baglog dengan aktivator 100 ml dan tanah rayap 2, 100 kg limbah baglog dengan aktivator 200 ml menunjukkan pemberian aktivator yang terbaik terhadap kualitas tekstur dan warna kompos yaitu pada perlakuan Tanah Rayap 2 yang memiliki tekstur paling remah dibanding perlakuan lain dan perlakuan 100 ml EM 4 dengan 100 kg limbah baglog memiliki warna coklat gelap.
3. EM-4
memfermentasi bahan organik (sisa-sisa tanaman, pupuk hijau, pupuk kandang, dll.) yang terdapat dalam tanah (Kurniawan, 2013).
Hasil fermentasi bahan organik tersebut adalah berupa senyawa organik yang mudah diserap langsung oleh perakaran tanaman misalnya gula, alkohol, asam amino, protein, karbohidrat, vitamin dan senyawa organik lainnya.
Selain mendekomposisi bahan organik di dalam tanah, EM-4 Pertanian juga merangsang perkembangan mikroorganisme lainnya yang menguntungkan untuk pertumbuhan tanaman, misalnya bakteri pengikat nitrogen, bakteri pelarut fosfat dan mikoriza. Mikoriza membantu tumbuhan menyerap fosfat di sekilingnya. Ion fosfat dalam tanah yang sulit bergerak menyebabkan tanah kekurangan fosfat. Dengan EM-4 Pertanian hife mikoriza dapat meluas dari misellium dan memindahkan fosfat secara langsung kepada inang dan mikroorganisme yang bersifat antagonis terhadap tanaman (Kurniawan, 2013).
EM-4 Pertanian memiliki beberapa keuntungan seperti, Memperbaiki sifat fisik, kimia dan biologi tanah, meningkatkan produksi tanaman dan menjaga kestabilan produksi, memfermentasi dan mendekomposisi bahan organik tanah dengan cepat (Bokashi), menyediakan unsur hara yang dibutuhkan tanaman dan meningkatkan keragaman mikroba yang menguntungkan di dalam tanah.
Penambahan starter EM4 meningkatkan kandungan hara lebih tinggi dibandingkan dengan penambahan Trichoderma Koningii.
F. Hipotesis
23
Penelitian ini telah dilaksanakan di Green House, Laboraturium Tanah dan Laboraturium Agrobiotekmilik Fakultas Pertanian Universitas Muhammadiyah Yogyakarta. Mulai dari bulan Januari 2016 hingga bulan Juni 2016.
B. Bahan dan Alat Penelitian
Bahan yang digunakan untuk penelitian ini adalah limbah baglog jamur tiram, aktivator alami (Isolat tanah rayap), Larva uret berwarna putih krem berbentuk C dengan panjang ± 75 mm, kepala berwarna coklat pucat dengan lebar 10-11 mm didapat dari Greenhouse Fakultas Pertanian Universitas Muhammadiyah Yogyakarta, beras, Chloramphenicol, EM-4, Dedak, Kapur, Gula/ Molase, Glukosa, Eksrak Jerami, Ekstrak Daging, Ekstrak Kentang, Sukrosa, K2HPO4, (NH4)2SO4, FeSO4.7H2O 1 N, Indikator
PP, Air, NaOH 0,5 N, MgSO4.7H2O, KOH, NaCl, Pepton, H2O (Aquades), KCl 1 M,
H2SO4 0,5 N, H2SO4 pekat, H2SO4 0,1 N, Indikator campuran Phenolptalein (PP),
Methyl Red (MR), Bromocresol Green (BCG), K2Cr2O71 N, H3PO4 85%, MgSO4.7H2O,
CMC (Carboxymetil cellulose), MgSO47H2O, KNO3, K2HPO4,FeSO47H2O,
CaCl22H2O, Yeast Ekstrak, selulosa, Indikator Dipenilamin, Campuran Katalisator
K2SO4 dan CuSO4, Air Suling, jagung.
Erlenmeyer, gelas piala, gelas arloji piranti destruksi, piranti distilasi, tabung kjedahl 250 ml.
C. Metode Penelitian
Penelitian dilakukan dengan menggunakan metode percobaan disusun dalam RAL (Rancangan Acak Lengkap), dengan rancangan perlakuan faktor tunggal 4 perlakuan yaitu baglog yang dikomposkan dengan:
A = Aktivator Tanah Rayap 40 ml/20 kg B = Makrofauna Uret 250 gram/5 kg C = Aktivator Komersial 20 ml/20 kg K = Tanpa Aktivator
Masing – masing perlakuan diulang sebanyak 3 kali sehingga ada 12 karung terdiri dari, perlakuan aktivator tanah rayap @20 kg baglog, makrofauna uret @5 kg baglog, aktivator komersial @20 kg baglog dan Tanpa Aktivator @20 kg baglog. Setiap ulangan diambil 3 sampel, pada bagian atas, tengah dan bawah sehingga diperoleh rerata dari 36 data (Lay out lampiran 2).
D. Cara Penelitian
1. Tahap Persiapan
a. Aktivator tanah rayap 1) Sterilisasi
Sterilisasi alat dimulai dengan merebus alat berupa Petridish, Erlenmeyer, Botol Kultur, Tabung Reaksi, Tip, Drigalsky dan Jarum Ose, kemudian di cuci dan dikeringkan. Setelah kering petridish dimasukan dalam plastik dengan ketebalan 0,5 mm, botol kultur di isi air sebanyak 99 ml dan di tutup dengan plastik diikat menggunakan karet gelang, tabung rekasi dan Erlenmeyer ditutup menggunakan kapas dan dilapisi menggunakan kertas payung lalu diikat menggunakan karet gelang. Semua alat tersebut dimasukan dalam otoklaf dan di sterilkan pada suhu 1210C selama 25 menit. Setelah steril, alat tersebut dimasukan dalam ruang penyimpanan.
2) Pembuatan media
Media yang digunakan sebagai media isolasi adalah media Dickerman dan Czapek selulosa. Tujuan isolasi adalah untuk memisahkan isolat dari lingkungannya dan ditumbuhkan pada media spesifik, dickerman untuk bakteri dan czapek untuk jamur.
Medium Dickermen
Pembuatan dickerman dimulai dengan menimbang bahan berupa K2HPO4 0,8 g, KH2PO4 sebanyak 0,2 g, MgSO4.7H2O sebanyak 0,2 g, NaCl
sebanyak 0,2 g, Yeast Ekstrak 0,01 g, (NH4)2SO4 1 g, selulosa 20 g, agar 15
memasukan larutan ke dalam tabung reaksi, Erlenmeyer dan wadah lain, selanjutnya mensterilkan larutan menggunakan autoklaf pada suhu 1210 C dengan tekanan 1 atm selama 15 menit.
Medium Czapek
Pembuatan dickerman dimulai dengan menimbang bahan berupa NaNO3/
(NH4)2SO4 sebanyak 2 g, KCl sebanyak 0,5 g, MgSO4.7H2O sebanyak 0,5 g,
K2HPO4 sebanyak 1 g, FeSO4. 7H2O sebanyak 0,001 g, selulosa 10 g,
aquades 1000 ml dan pH 6,4-7. Kemudian tambahkan agar – agar sebanyak 15 g. Larutan dipanaskan diatas pemanas sambil terus diaduk hingga homogen, lalu dimasukan dalam tabung rekasi dan Erlenmeyer. Selanjutnya medium di sterilkan menggunakan autoklaf pada suhu 1210 C dengan tekanan 1 atm selama 15 menit.
3) Isolasi dan skrining
4) Perbanyakan menjadi aktivator tanah rayap
Perbanyakan aktivator tanah rayap dimulai dengan mengukus beras menggunakan panci, kemudian setelah matang di angin – anginkan sambil ditetesi Chloramphenicol agar media tersebut bebas dari mikroba kontaminan. Media + Chloramphenicol kemudian dimasukan dalam plastik yang dibentuk segi tiga, dengan tujuan memberikan ruang pada medium sehingga tetap dalam keadaan lembab. Setelah pertumbuhan miselium terlihat, aktifator ini siap diaplikasikan pada baglog.
b. Makrofauna Uret 1) Menernakkan Uret
Uret bertelur di tumpukkan sampah/sisa-sisa daun, sehingga untuk memunculkan uret maka akan dibuat lingkungan dimana uret bisa muncul. Sampah/sisa-sisa daun dimasukkan kedalam karung yang di letakkan dalam keadaan lembab dan tidak terpapar sinar matahari langsung.
2) Menimbang Uret
2. Tahap Pengomposan a. Pencacahan baglog
Baglog yang telah didapatkan dan masih didalam plastik kemudian di buka menggunakan pisau. Kemudian, dimasukkan menjadi satu karung dan diremah-remah. Tujuan diremah-remah adalah untuk memperluas permukaan dan memperkecil ukuran partikel sehingga pengomposan akan berjalan lebih cepat.
b. Pengenceran aktivator
1) Pengenceran aktivator tanah rayap dengan mencampuran 40 ml aktivator dengan air sebanyak 100 ml, dengan dosis 2 ml/kg.
2) Untuk aktivator tanah rayap dengan media inokulum cukup dikering anginkan kemudian ditaburkan diatas tumpukan kompos dengan dosis 2 g/kg.
3) Untuk pengenceran aktivator komersial (EM4) adalah dengan mencampurkan 20 ml aktivator dengan air sebanyak 100 ml. dosis pemberian aktivaor adalah 1 ml/kg.
c. Pencampuran bahan sesuai perlakuan
diberi perlakuan yang sama seperti awal. Semua bahan kemudian dicampur/diaduk menggunakan cangkul, lalu dicek kadar airnya dengan cara menggenggam bahan kompos, apabila saat digenggam dan dilepaskan bahan kompos sudah menggumpal, maka kadar air kompos tersebut sudah ideal, kemudian bahan dimasukkan kedalam karung. 2) Makrofauna uret : bahan yang akan dikomposkan berupa 5 kg baglog
jamur tiram, mula – mula dijadikan lapisan dasar, kemudian ditaburi dengan bahan tambahan (0,25 kg dedak/bekatul, 10 g gula, 50 g kapur) (lampiran 2). Semua bahan kemudian dicampur/diaduk menggunakan cangkul, lalu dicek kadar airnya dengan cara menggenggam bahan kompos, apabila saat digenggam dan dilepaskan bahan kompos sudah menggumpal, maka kadar air kompos tersebut sudah ideal, kemudian bahan dimasukkan kedalam karung bersamaan dengan pemberian bahan tambahan, makrofauna uret (250 gram) dimasukkan kedalam karung. 3) Aktivator komersial : bahan yang akan dikomposkan berupa 20 kg
bahan kompos sudah menggumpal, maka kadar air kompos tersebut sudah ideal, kemudian bahan dimasukkan kedalam karung.
4) Tanpa aktivator (kontrol) : bahan yang akan dikomposkan berupa 20 kg baglog jamur tiram, mula – mula dijadikan lapisan dasar, kemudian ditaburi dengan bahan tambahan (1 kg dedak/bekatul, 40 g gula, 200 g kapur) (lampiran 2). Semua bahan kemudian dicampur/diaduk menggunakan cangkul, lalu dicek kadar airnya dengan cara menggenggam bahan kompos, apabila saat digenggam dan dilepaskan bahan kompos sudah menggumpal, maka kadar air kompos tersebut sudah ideal, kemudian bahan dimasukkan kedalam karung.
d. Inkubasi
suhu kompos dalam karung tersebut. Apabila suhu terlalu tinggi maka bakteri yang aktif hanya bakteri jenis termofil, sedangkan bakteri mesofil akan mati, begitupun sebaliknya. Dalam proses pembalikan juga diikuti pengecekan kelembaban, hal tersebut berhubungan dengan pemberian air guna memberikan suasana lembab agar bakteri maupun jamur dapat berkembang biak dan aktif dalam mendekomposisikan bahan organik tersebut.
Bila kompos yang sudah jadi akan disimpan atau dikemas, sebelum dimasukkan ke dalam kantung plastik/karung, kompos tadi dikeringkan dulu atau dikeringkan terlebih dahulu (bukan di jemur) (Hidayat, 2010).
3. Tahap pengamatan
a. Pengamatan selama pengomposan
dilakukan setiap satu minggu sekali selama proses pengomposan, sedangkan pengamatan asam total dan pH dilakukan setiap satu minggu sekali selama proses pengomposan. Pengamatan mikrobiologi dilakukan dengan menghitung jumlah total mikroorganisme selama proses dekomposisi dengan metode totalplate count – surface platting pada medium NA.
b. Pengamatan akhir kompos (SNI)
Pengamatan akhir kompos adalah berupa pengujian kematangan kompos yang sesuai standar Nasional Indonesia (SNI), pengujian ini dilakukan setelah minggu ke 4 (kompos matang), adapun cara pengujian kematangan kompos adalah sebagai berikut:
Uji kematangan kompos pada perkecambahan. Untuk menguji kematangan kompos, maka dilakukan uji perkecambahan pada benih kacang hijau disetiap perlakuannya. Sebelum pengujian, benih direndam dalam larutan garam terlebih dahulu, kemudian diambil biji yang tenggelam. Pengujian dilakukan dengan cara meletakkan pada bak steroform yang telah diisi masing – masing kompos sebagai media. Setiap bak diletakkan masing – masing 20 benih. Pada saat yang bersamaan dikecambahkan juga masing – masing benih pada kapas basah. Pengujian dilakukan selama 10 hari dengan menghitung presentase daya berkecambah pada masing – masing benih.
E. Parameter yang Diamati
1. Pengamatan perubahan fisik selama proses dekomposisi
Perubahan fisik pada proses dekomposisi baglog yang diamati, yaitu : a. Suhu (oC)
Pengamatan ini dilakukan setiap hari selama proses pengomposan berlangsung. Pengukuran suhu dilakukan menggunakan alat thermometer dengan derajat celcius (0C) dengan melihat skala yang ditunjukan pada alat tersebut. Pengamatan suhu pada bahan kompos dilakukan dengan cara menancapkan thermometer, dengan mengamati suhu bagian atas, bagian tengah dan bagian bawah.
b. Perubahan warna
Tabel 1. Skoring Warna
n : Jumlah sampel yang memiliki nilai skor sama v : Nilai skor yang menunjukkan intensitas warna Z : Skor yang tertinggi
N : jumlah sampel yang diamati
c. Kadar air (%)
a = berat cawan timbang kosong (g)
b = berat cawan timbang kosong (g) + inokulum basah (g) c = berat cawan timbang kosong (g) + inokulum kering (g) d. Bau (%)
n : Jumlah sampel yang memiliki nilai skor sama v : Nilai skor yang menunjukkan intensitas warna Z : Skor yang tertinggi
e. Distribusi Ukuran Partikel (%)
Ukuran partikel kompos dilakukan dengan saringan 0,5 mm, 1 mm, 2 mm dan > 2 mm, hasil yang tersaring dinyatakan dalam persen (%)
Tabel 3. Skor Distribusi Ukuran Partikel (%)
Skor 4 3 2 1
Keterangan 0,5mm 1mm 2mm .>2mm
% Distribusi Ukuran Partikel = � ℎ �ℎ�� ��� �� �����
� ℎ �ℎ�� 100 %
2. Pengamatan mikrobiologi selama proses dekomposisi (CFU/ml)
Maksud dari pengujian mikrobiologi adalah guna mengetahui dinamika aktivitas populasi mikroba selama proses dekomposisi. Pengamatan mikrobiologi dilakukan dengan metode total plate count – surface platting untuk menghitung jumlah total mikroorganisme jamur dan bakteri selama dekomposisi. Pengamatan dilakukan pada masing – masing medium.
a. Bakteri pada medium Nutrient Agar (NA)
b. Jamur pada medium Potato Dextose Agar (PDA)
Variable yang diamati adalah jumlah yeast dari masing – masing perlakuan. Metode perhitungan jumlah mikroba dengan menggunakan metode plate count pada medium NA dan PDA dengan seri pengenceran 10-6, 10-7 dan 10-8. Adapun rumus perhitungan bakteri adalah :
�ℎ � ��������� ���� ��� ℎ�� �ℎ � ��������� ���� � � � � dengan memenuhi syarat sebagai berikut :
1. Jumlah koloni tiap cawan petri antara 30-300 koloni (CFU/ml)
atau lebih kecil dari 2 maka hasilnya dirata – rata, dan jika lebih besar dari 2 maka yang dipakai adalah jumlah dari hasil pengenceran sebelumnya.
3. Jika ulangan telah memenuhi syarat maka hasilnya dirata – rata.
3. Pengamatan makrofauna uret selama proses dekomposisi
Pengamatan aktivitas uret meliputi perubahan berat uret selama proses dekomposisi.
a. Berat uret (%)
Pengamatan terhadap perubahan berat uret dilakukan setiap satu minggu sekali, Caranya adalah, uret yang belum diaplikasikan sebagai makrofauna ditimbang berat awalnya. Kemudian pada saat membalikkan bahan pengomposan, uret diambil satu persatu dari kompos, selanjutnya uret ditimbang berdasarkan perlakuan sebagai berat akhirnya dengan menggunakan timbangan analitik. Kemudian uret dimasukkan kembali kedalam perlakuan. Persentasi berat uret dapat ditentukan dengan rumus:
��� �� % = − × 100%
Keterangan :
A = berat uret awal sebelum perlakuan (g)
B = berat uret pada saat pengambilan setelah diperlakukan (g)
4. Pengamatan perubahan kimia selama proses dekomposisi
a. Tingkat keasaman (pH)
Pengamatan pH berfungsi sebagai indikator proses dekomposisi kompos baglog pada berbagai Aktivator. Mikroba kompos akan berkerja pada keadaan pH netral sampai sedikit masam, dengan kisaran pH antara 5,5 sampai 8. Tingkat keasaman (pH) dalam pengomposan diukur menggunakan pH universal.
b. Total asam tertitrasi (%)
Persentase total asam tertitrasi dimaksudkan untuk mengetahui jumlah asam yang dihasilkan dalam proses dekomposisi tongkol jagung dari berbagai Aktivator. Asam adalah bentuk lain dari hasil proses dekomposisi dari suatu biomassa. Pada proses dekomposisi, asam terbentuk bersamaan dengan proses dekomposisi. Pengamatan dilakukan setiap satu minggu sekali dengan menggunakan metode titrasi NaOH. Untuk menghitung kadar asam tertitrasi menggunakan rumus sebagai berikut :
Total asam tertitrasi (ml NaOH 0,1 N/100g) = V x N xFP x 100
0,1
Keterangan :
V = volume NaOH yang digunakan (ml) N = normalitas NaOH yang sesungguhnya (N) FP = faktor pengenceran
A = berat sample (g)
c. Kandungan C dan BO total (%)
prapenelitian pada baglog dan setelah penelitian pada kompos tongkol jagung menggunakan rumus sebagai berikut :
Kadar C (%) = 100 − ��� 4 3
77 = nisbah ketelitian antara metode volumetric dan oksidimetris 100
58 = kadar rata – rata unsur C dalam bahan organik
Angka 3 brasal dari 1 ml K2Cr2O7 IN = 3 gram
d. Kadar N total (%)
Kandungan N total pada baglog dianalisis dengan metode Kjeldhal, pengujian dilakukan setelah penelitian pada kompos baglog menggunakan rumus sebagai berikut :
Kadar N (%) = 100 − � � 14
100 + ��� � � � ( �)
100 %
Keterangan :
A = banyaknya NaOH yang digunakan dalam titrasi baku B = banyaknya NaOH yang digunakan dalam titrasi ulangan KL = kadar lengan contoh tanah yang digunakan
5. Uji kematangan kompos (%)
hingga hari ke-7. Kemudian dibandingkan jumlah kecambah yang tumbuh pada setiap perlakuan media kompos dan pada media kapas sebagai kontrol.
Kompos yang matang dan stabil ditunjukan oleh banyaknya benih yang berkecambah. Untuk mengetahui daya berkecambah suatu benih, dapat dihitung menggunakan rumus sebagai berikut :
DB (%) = 1+ 2…..+ 7 100% Keterangan :
DB = Daya Berkecambah
∑ KN 1 = Jumlah kecambah normal pada pengamatan hari pertama ∑ KN 2 = Jumlah kecambah normal pada pengamatan hari kedua ∑ KN 7 = Jumlah kecambah normal pada pengamatan hari ketujuh ∑ BT = Jumlah benih yang disemai
F. Analisis Data
Aktivitas proses dekomposisi dari berbagai perlakuan disajikan dalam bentuk grafik. Hasil pengamatan kuantitatif dianalisis dengan menggunakan sidik ragam atau analysis of variance pada taraf α 5%. Apabila ada perbedaan nyata antar perlakuan yang
40 1. Bakteri
Isolasi adalah memisahkan mikroba dari alam dan menumbuhkannya pada media tertentu. Mikroba yang diisolasi berasal dari tanah rayap. Di Desa Argorejo, Kecamatan Sedayu, Kabupaten Bantul, tanah rayap kemudian diisolasi untuk diidentifikasi bentuk dan sifatnya (Lampiran 4.a).
Setelah proses isolasi, dan dimurnikan dengan memindahkan masing-masing koloni pada petri lain yang telah berisi media NA (Lampiran 4.b). Dari hasil pemurnian tersebut didapatkan 3 jenis bakteri dan 3 jenis jamur (Lampiran 4.a.b).
Bakteri yang telah dimurnikan, kemudian diidentifikasi untuk dilihat karakterisasi dengan mikroskop (Tabel 6), adapun penampakan hasil karakterisasi bakteri dapat dilihat pada gambar 1 dan tabel 6.
Tabel 1.Hasil Identifikasi dan Karakterisasi Bakteri Tanah Rayap
Identifikasi RYB1 RYB2 RYB3
Warna Cream Cream Cream
Diameter 0,2 mm 0,3 mm 0,2 mm
Bentuk Koloni Curled Circular Irregular Bentuk Tepi Undulate Lacerate Lobate
Struktur Dalam Smooth Filamentous Finely Granular
Elevasi Law Convex Raised Conver Papillate
Sifat Aerobisitas Aerob Aerob Aerob
Sifat Gram Postif Postif Postif
Gambar 1.hasil identifikasi bakteri dari tanah rayap
Dari hasil identifikasi bakteri, dapat dilihat bahwa bakteri memiliki karakterisasi yang berbeda – beda. RYB1, memiliki bentuk koloni Curled, bentuk tepi Undulate, struktur dalamnya Smooth dan bentuk elevasinya adalah Law Convex. Sifat aerobisitas yang dimiliki RYB1 adalah aerob, yang ditandai dengan adanya substrat padat dibagian atas pada media NC (Lampiran 4.d). Hasil cat gram RYB1 adalah memiliki sel berwarna ungu, yang berarti memiliki sifat gram positif dengan bentuk sel basil.
Menurut Albert et al (1988) menyebutkan bahwa salah satu jenis bakteri dekomposer adalah memiliki bentuk basil dan gramnya positif. Didukung dari hasil penelitian Khamid dan Mulasari (2012), yang mengidentifikasi bakteri aerob pada lindi hasil sampah dapur, ditemukan bakteri dengan warna putih kekuningan (cream) dengan hasil gram positif dan berbentuk basil adalah salah satu bakteri dekomposer. Beberapa bakteri dekomposer yang memiliki bentuk sel bacil dan gram positif adalah genus Bacillus dan Streptococcus. Berdasarkan hasil penelitian Khamid dan Mulasari (2012), maka bakteri cream termasuk dalam bakteri dekomposer dengan sifat gram positif dan bentuk basil.
Hasil cat gram RYB2 adalah memiliki sel berwarna ungu, yang berarti memiliki sifat gram positif dengan bentuk sel basil. Menurut Imelda (2015), yang mengidentifikasi isolat bakteri dengan kode S2 terlihat memiliki bentuk circular (bulat) adalah salah satu bakteri selulotik dan memiliki kemampuan mendegradasi selulosa. Didukung dengan hasil penelitian Dinda dkk (2013) menyebutkan bahwa isolat C5 cenderung masuk ke dalam genus Bacillus, yang ditunjukkan dengan karakter Gram positif basil, endospora positif berbentuk bulat atau oval dan bersifat aerob hingga fakultatif anaerob.
RYB3, memiliki bentuk koloni Irregular, bentuk tepi Lobate, struktur dalamnya Finely Granular dan bentuk elevasinya adalah Conver Papillate. Sifat aerobisitas yang dimiliki RYB3 adalah aerob, yang ditandai dengan adanya substrat padat dibagian atas pada media NC. Hasil cat gram bakteri 3 adalah memiliki sel berwarna ungu, yang berarti memiliki sifat gram positif dengan bentuk sel basil.
Didukung oleh penelitian Imelda (2015), yang meneliti dan mengkarakterisasi bakteri selulotik dari air rendaman pelepah tanaman salak (Zalacca edulis, Reinw.), ditemukan bakteri dengan kose S1 memiliki karakterisasi bentuk koloni irregular, bentuk tepi lobate dan memiliki sifat gram positif. Menurut Imelda (2015), bakteri dengan karakter seperti diatas adalah salah satu bakteri selulotik dan memiliki kemampuan mendegradasi selulosa.
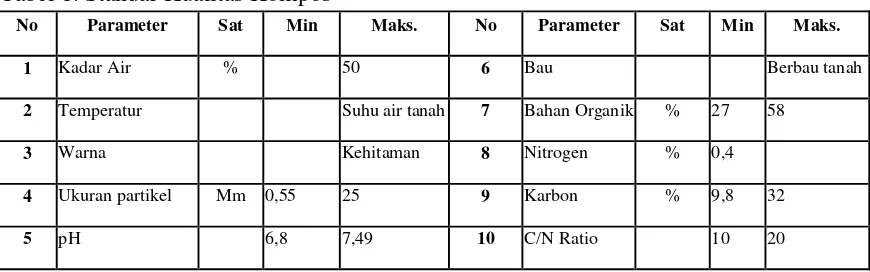
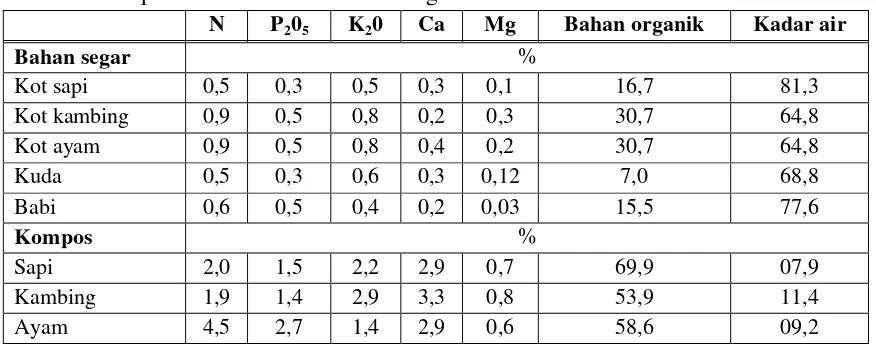
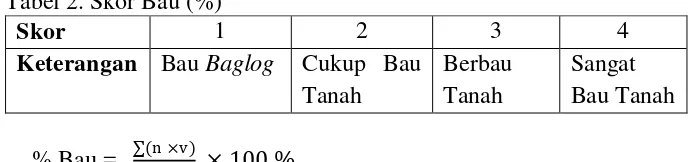
1. Jamur
Beberapa isolat jamur yang telah dimurnikan, kemudian diidentifikasi dan dikarakterisasi berdasarkan warna, diameter dan morfologi jamur (spora dan miselia). Adapun hasil karakterisasi jamur, tersaji dalam tabel 7.
Identifikasi RYJ1 RYJ2 RYJ3
Warna Hujau Putih Putih
Diameter 0,5 cm 0,3 cm 0,4 cm
Miselia
Spora
Identifikasi jamur menggunakan mikroskop tujuannya adalah untuk mengetahui pertumbuhan jamur pada inokulum. Dari hasil identifikasi dan karakterisasi (Tabel 7) koloni jamur yang dapat dimurnikan hanya 3 jenis jamur (Lampiran 4.c), yaitu jamur hijau dan jamur putih. Dari ketiga jamur memiliki bentuk miselia dan bentuk spora yang berbeda. RYJ1 memiliki koloni berwarna hijau dengan permukaan bawah berwarna putih, spora yang bercabang, kecil dan berkantung. Berdasarkan pada Sriyanto (2012) yang mengemukakan bahwa filum / divisi Ascomycota memiliki bentuk miselia bersekat dan memiliki banyak inti yang banyak, juga membentuk spora seperti kantung, sehingga diduga RYJ1 masuk dalam filum / divisi Ascomycot.
Selanjutnya, menurut Sriyanto (2012), beberapa contoh jamur yang termasuk dalam filum / divisi Ascomycota diantaranya adalah Aspergilus, Penicillium dan Saccharomices. Berdasarkan hasil identifikasi spora, RYJ1 lebih cenderung mirip jamur Penicillium sp. Hal ini berdasarkan pada karakerisasi spora yang cenderung lebih mirip dengan jamur Penicillium sp (Lampiran 5.a). Berdasarkan hasil penelitian Widi dkk. (2013) mengemukakan bahwa spessies Penicillium simplicissimum memiliki karakter morfologi koloni hijau dengan permukaan bawah berwarna putih. Koloni dapat menyebar kesegala arah dan berbentuk bulat-bulat tidak teratur, permukaan tebal dan halus. Penicillium simplicissimum memiliki hifa bersekat, konidiofor bersekat dan memanjang. Didukung oleh Vhey (2012) yang mengatakan bahwa jamur Penicillium sp, sering dalam warna hijau.
RYJ2 mempunyai hifa berseptat, miselium bercabang memiliki spora menyerupai bunga dan berkantung. Menurut Sriyanto (2012) filum / divisi Ascomycota memiliki bentuk miselia bersekat dan memiliki inti yang banyak, juga membentuk spora seperti kantung. Secara bentuk spora, diduga RYJ2 yang memiliki bentuk spora berkantung masuk dalam filum Ascomycota. Filum Ascomycota ada yang berbentuk askus dan ada yang tidak membentuk askus (ujung hifa). Beberapa contoh jamur yang membentuk askus adalah Aspergillus, penicillium dan Saccharomices.
Masniawati dkk. (2013) yang mengemukakan bahwa Aspergillus memiliki hifa bersekat.
RYJ3 memiliki bentuk spora menyerupai bunga dan berkantung, menurut Sriyanto (2012) filum / divisi Ascomycota memiliki bentuk miselia bersekat dan memiliki inti yang banyak, juga membentuk spora seperti kantung. Secara bentuk spora, diduga RYJ3 yang memiliki bentuk spora berkantung masuk dalam filum Ascomycota. Filum Ascomycota ada yang berbentuk askus dan ada yang tidak membentuk askus (ujung hifa). Beberapa contoh jamur yang membentuk askus adalah Aspergillus, penicillium dan Saccharomices.
Hasil identifikasi bentuk spora RYJ3 cenderung lebih mirip dengan jamur Aspergillus, hal tersebut berdasarkan gambar bentuk spora yang mirip dengan spora Aspergillus (Lampiran 5.a), sehingga diduga RYJ3 masuk dalam genus Aspergillus sp. Didukung oleh penelitian Heny (2015) yang mengemukakan bahwa Aspergillus memiliki bentuk spora yang menyerupai bunga dan berkantung. Selanjutnya, menurut Masnawati dkk. (2013) yang mengemukakan bahwa Aspergillus memiliki hifa bersekat.
3. Perbanyakan aktivator
bakteri. Viabilitas bakteri selama proses perbanyakan (shaker), diamati dengan cara platting dengan metode surface pada 0 jam, 24 jam dan 48 jam
Hasil perkembangan bakteri selama 48 jam tersaji pada gambar 2 :
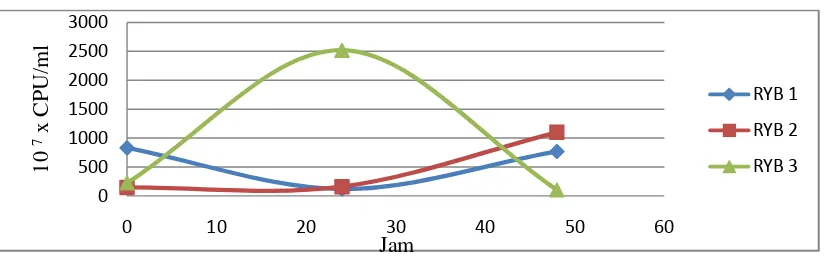
Gambar 2.Hasil Perkembangan Bakteri Selama 48 Jam
Berdasarkan hasil perkembangan bakteri (gambar 2) menunjukkan bahwa pada inkubasi 48 jam, bakteri RYB2 adalah bakteri yang paling banyak dengan hasil 1097,7 x 107 CFU/ml. Sedangkan bakteri yang berkembang yang relatif lebih rendah adalah bakteri RYB3 dengan hasil 104,3 x 107 CFU/ml. Sementara, bakteri RYB1 menunjukkan jumlah bakteri yang lebih banyak (767,3 x 107 CFU/ml) dibandingkan dengan perkembangan bakteri RYB3. Dapat dilihat berdasarkan perkembangan bakteri (Gambar 2) menunjukkan pertumbuhan bakteri RYB3 pada 24 jam lebih tinggi dibandingkan dengan perkembangan pada saat 48 jam. Hal ini dimungkinkan berkurangnya substrat sumber makanan pada mikroba sehingga menimbulkan kematian pada mikroba. Hal ini sesuai dengan pernyataan Lisa (2013) yang menyatakan bahwa berkurangnya substrat sumber energi akan menimbulkan kematian pada mikroba (bakteri maupun jamur), sehingga aktivitas metabolisme akan menurun.
lingkungan bakteri RYB1 pada 24 jam sehingga banyak mikroba yang mati. Didukung oleh penelitian Lisa (2013), yang menyatakan bahwa penurunan jumlah bakteri aktivator EM4 yang seharusnya meningkat pada awal pengembangbiakan dimungkinkan karena ketidaksesuaiannya kondisi mikroba dengan lingkungannya.
4. Perbanyakan aktivator jamur berbeda dengan perbanyakan bakteri, jamur yang telah diuji tersebut akan diperbanyak pada media inokulum yang terbuat dari beras. Inokulum beras dipilih karena kandungan karbohidrat, protein, mineral dan vitamin yang lebih tinggi dibandingkan dengan bahan lainnya. Setelah diperbanyak pada media inokulum, akan dilakukan pengamatan berupa kadar air seperti yang tersaji pada tabel 8.
Tabel 3. Kadar Air Inokulum Jamur pada media inokulum beras
Perlakuan Pengamatan kadar air jamur (%)
RYJ1 26,95 b
RYJ2 32,41 b
RYJ3 44,54 a
Hasil sidik ragam tabel 8, menunjukkan bahwa kadar air inokulum yang telah ditumbuhi jamur beda nyata (Lampiran 3.b). Kadar air RYJ 3 nyata lebih tinggi (44,54 %) dibandingkan dengan RYJ 2 (32,41 %) dan RYJ1 (26,95). Tingginya kadar air pada inokulum beras yang ditumbuhi RYJ3 dikarenakan RYJ3 yang diduga Aspergillus sp memiliki kemampuan memperbanyak spora lebih cepat, sehingga jumlah spora dan miselliumnya akan semakin banyak. Dalam kondisi aerob, proses respirasi menghasilkan H20 (air) dan CO2 (karbondioksida), semakin banyak spora yang
B. Uji Efektivitas Aktivator Terhadap Kompos Baglog
Proses pengomposan ini terjadi interaksi antara bahan organik dengan mikroorganisme maupun mikroorganisme dengan mikroorganisme lainnya.
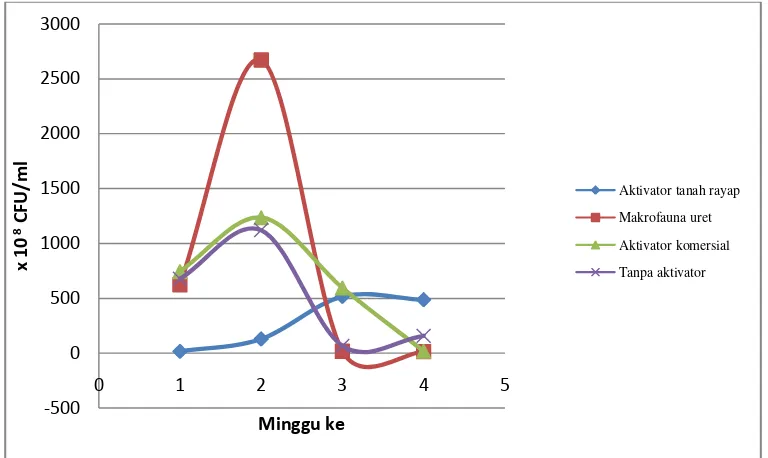
Uji mikrobiologi dimaksudkan untuk mengetahui dinamika populasi mikrobia dan aktivitasnya dalam proses pengomposan selama 4 minggu (Lampiran 5.c). Populasi mikrobia selama pengomposan disajikan pada gambar 3.
Gambar 3. Grafik Pertumbuhan Bakteri Selama Pengomposan Baglog
1. Bakteri
Gambar 3 menunjukkan bahwa peran aktivator sangat jelas terlihat pada proses pengomposan. Pada minggu pertama jumlah bakteri yang relatif lebih banyak terdapat pada perlakuan aktivator komersial (744,8 x 108 CFU/ml), diikuti oleh perlakuan tanpa aktivator (676,9 x 108 CFU/ml), sedangkan jumlah yang relatife lebih sedikit yaitu pada perlakuan aktivator tanah rayap (15,3 x 108 CFU/ml) dan makrofauna uret (624,5 x 108 CFU/ml). Hal tersebut karena aktivator komersial mengandung berbagai macam
mikroba (Aktinomisetes, bakteri decomposer dan jamur decomposer), sedangkan aktivator tanah rayap hanya mengandung bakteri yang lebih sedikit, yaitu 3 jenis bakteri dengan jumlah 107 CFU/ml.
Perlakuan tanpa aktivator memiliki jumlah bakteri yang lebih banyak dari pada aktivator rayap. Hal ini dimungkinkan terdapat mikroba dekomposer dari bahan kompos tersebut. Didukung oleh Lisa (2013) yang meneliti aktivitas dekomposer pada limbah blotong dari pabrik gula yang menyatakan bahwa pada bahan kompos terdapat jumlah jamur 2 x 106 CFU/ml dan jumlah bakteri 25,5 x 106 CFU/ml, dari hasil tersebut menunjukkan bahwa jamur dan bakteri dapat tumbuh dan berkembang biak dibahan kompos.
Pada minggu kedua, bakteri telah masuk dalam fase logaritmik, yaitu fase mikroorganisme membelah dengan cepat dan konstan (Fardiaz, 1989) karena ketersediaan makanan masih banyak, sehingga mempengaruhi pertumbuhan mikroba. Jumlah mikroba yang terdapat pada tiap perlakuan akan berhubungan dengan dekomposisi bahan organik, semakin banyak mikroba yang terdapat pada suatu bahan, maka dekomposisi bahan akan semakin cepat. Aktivitas mikroba ditandai dengan adanya peningkatan suhu karena mikroba tersebut merombak bahan organik menjadi energy kemudian dilepaskan berupa panas sehingga suhu pengomposan akan mengalami peningkatan.
Saat suhu mulai meningkat, aktivitas bakteri mesofil digantikan dengan bakteri thermofil yang tahan terhadap panas. Begitupun sebaliknya, saat suhu sudah kembali turun, aktivitas bakteri thermofil diganti kembali oleh bakteri mesofil. Selain dikarenakan suhu yang tinggi, menurut Fardiaz (1989) penurunan jumlah bakteri dikarenakan nutrisi dalam medium sudah mulai berkurang karena bahan telah terombak diminggu pertama.
Ketika jumlah bakteri pada kompos dengan aktivator makrofauna uret, aktivator komersial dan tanpa perlakuan menurun diminggu ketiga, hal sebaliknya justru terlihat pada jumlah bakteri pada kompos dengan aktivator tanah rayap yang mengalami peningkatan, peningkatan bakteri aktivator tanah rayap ini dikarenakan kompos dengan aktivator tanah rayap masih aktif bekerja dalam merombak bahan organik. Selanjutnya pada minggu terakhir pengomposan, jumlah bakteri kompos disemua perlakuan mengalami penurunan. Penurunan jumlah bakteri akan disertai dengan penurunan suhu pada tumpukan kompos juga. Hal ini dikarenakan kompos telah masuk dalam fase pematangan / pendinginan. Pendinginan, yaitu berkurangnya substrat dan tingginya suhu yang akan menimbulkan kematian pada mikroba (bakteri maupun jamur), sehingga aktivitas metabolisme menurun. Dengan demikian suhu akan kembali turun kembali ke fase awal (suhu ruang).
2. Jamur
digunakan untuk pertumbuhan jamur sudah habis. Tidak tampak adanya pertumbuhan jamur (Lampiran 5.c). Hal ini sesuai dengan pernyataan saat komunikasi pribadi dengan Ir. Mulyono, MP yang menyatakan bahwa tidak tumbuhnya jamur dikarenakan adanya perebutan sumber energi antara bakteri dan jamur yang mengakibatkan jamur tersebut tidak bisa tumbuh dan bahan yang digunakan adalah limbah dari budidaya jamur tiram.
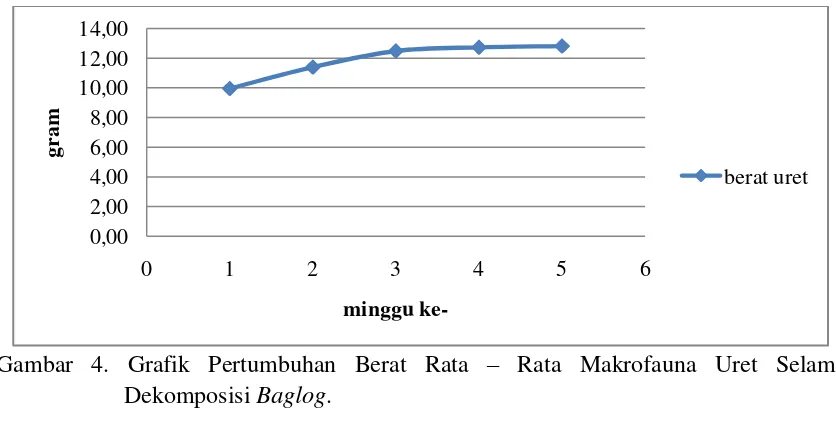
3. Makrofauna Uret
Berbeda dengan bakteri dan jamur, pertumbuhan berat rata-rata makrofauna uret mengalami peningkatan, seperti yang terlihat pada gambar 4.
Gambar 4. Grafik Pertumbuhan Berat Rata – Rata Makrofauna Uret Selama Dekomposisi Baglog.
Pada gambar 4 terlihat bahwa pertumbuhan berat rata – rata uret semakin tinggi, ini menunjukkan bahwa uret memakan bahan yang digunakan sebagai sumber energinya. Hal ini diikuti dengan distribusi ukuran partikel yang menunjukkan pada makrofauna uret disetiap minggu, partikel yang tersaring semakin kecil. Ini menunjukkan bahwa uret melakukan proses pelapukan melalui pencernaannya dan menjadikan partikel lebih kecil. Menurut Heny (2015), saat melakukan proses penyaringan ukuran partikel ditemukan larva kumbang badak (uret) pada perlakuan tanpa aktivator, diduga uret
berkembang selama proses dekomposisi dan membantu proses perombakan bahan organik.
C. Pengamatan Perubahan Fisik
1. Suhu
Pengamatan suhu dilakukan untuk mengetahui perubahan aktivitas mikroorganisme karena suhu merupakan salah satu indikator dalam mengurai bahan organik. Menurut Miller (1991), suhu merupakan penentu dalam aktivitas pengomposan.
Menurut Heny (2015), proses pengomposan akan berjalan dalam empat fase, yaitu fase mesofilik, termofilik, pendinginan dan pematangan. Namun secara sederhana dapat dibagi menjadi dua tahap, yaitu tahap aktif dan tahap pematangan. Pada awal proses dekomposisi, oksigen dan senyawa yang mudah terdegradasi akan dimanfaatkan oleh mikroba mesofilik sehingga suhu tumpukan kompos akan meningkat cepat.
Mikrobia yang aktif pada fase ini adalah mikrobia termofilik, yaitu mikrobia yang aktif pada suhu tinggi. Pada kondisi ini terjadi dekomposisi atau penguraian bahan organik yang sangat aktif, karena mikroba dalam kompos menggunakan oksigen dan menguraikan bahan organik menjadi CO2, uap air dan panas. Setelah semua bahan telah
terurai, maka suhu akan berangsur-angsur mengalami penurunan. Pada saat ini terjadi pematangan kompos tingkat lanjut, yaitu pembentukan kompleks liat humus (Isroi, 2007).