ABSTRAK
KARAKTERISASI PLANLET CABAI MERAH (Capsicum annum L.) HASIL SELEKSI DENGAN ASAM SALISILAT SECARA IN VITRO
Oleh
Rita Asmara
Tanaman cabai merah merupakan salah satu tanaman hortikultura yang banyak di budidayakan oleh masyarakat Indonesia. Produksi tanaman cabai merah mengalami penurunan, salah satunya disebabkan oleh infeksi mikroba patogen
yang menyerang tanaman cabai merah yaitu Fusarium oxysporium f.sp capsisi
(Foca). Salah satu alternatif cara pengendalian penyakit yang efisien, efektif dan
aman terhadap lingkungan, yaitu menggunakan varietas yang tahan atau resisten. Asam salisilat diketahui sebagai salah satu senyawa yang berperan penting terhadap ketahanan tanam. Penelitian ini bertujuan untuk mengetahui dan menganalisis : 1) kisaran konsentrasi asam salisilat toleran untuk seleksi planlet
cabai merah secara in vitro, 2) karakter ekspresi yang spesifik pada planlet cabai
merah tahan asam salisilat secara in vitro meliputi ketebalan lignin, kandungan
klorofil a, b dan total, serta perbedaan struktur anatomi batang. Penelitian ini menggunakan rancangan acak lengkap dengan satu faktor yaitu konsentrasi asam salisilat yang terdiri atas 5 taraf yaitu 0 ppm, 15 ppm, 30 ppm, 45 ppm dan 60 ppm. Analisis ragam dan uji BNT (Beda Nyata Terkecil) pada taraf 5%.
Penelitian ini dilaksanakan di Laboratorium Botani, ruang in vitro dan
Mikrobiologi Fakultas MIPA Universitas Lampung dari bulan Juni sampai Agustus 2014. Hasil penelitian menunjukkan bahwa kandungan klorofil a, b, dan total planlet daun cabai merah mengalami penurunan pada konsentrasi asam salisilat dalam medium MS 15, 30, 45, dan 60 ppm, dibandingkan dengan kontrol. Tebal lignin pada konsentrasi 15 dan 60 ppm lebih besar dibandingkan kontrol, pada konsentrasi 30 dan 45 ppm lebih kecil. Struktur anatomi batang pada planlet cabai merah yang diberi pengimbasan AS mengalami penebalan dibagian kambium.
KARAKTERISASI PLANLET CABAI MERAH (Capsicum annum L.) HASIL SELEKSI DENGAN ASAM SALISILAT SECARA IN VITRO
(Skripsi)
Oleh RITA ASMARA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahikan di Way Kanan pada tanggal 03
Desember 1991 dari pasangan ibu Agus Sumiyati dan
bapak Basuki. Penulis merupakan anak pertama dari dua
bersaudara. Penulis memulai pendidikan di Taman
Kanak-kanak Pertiwi pada tahun 1996-1998
dan melanjutkan pendidikan di Sekolah Dasar Negeri 1 Bhakti Negara pada tahun
1998-2004. Pada tahun 2004-2007 penulis melanjutkan pendidikan di Sekolah
Menengah Pertama Bhakti. Pada Tahun 2007-2010 melanjutkan pendidikan di
Sekolah Menengah Kejuruan YP 17 Baradatu Way Kanan. Pada tahun 2010
penulis telah diterima di Fakultas Matematika dan Ilmu Pengetahuan Alam
jurusan Biologi melalui jalur UM (Ujian Mandiri) dan penulis dapat
menyelesaikan pendidikan pada tahun 2014.
Selama duduk di perguruan tinggi, penulis menjadi anggota Himpunan
Mahasiswa Biologi (HIMBIO) pada tahun 2010-2011. Pada tahun 2011-2012
penulis mengemban amanah sebagai Anggota Biro Rumah Tangga dan
Pengembangan Organisasi di HIMBIO. Selain itu, selama menjalankan
perkuliahan penulis pernah menjadi asisten praktikum mata kuliah Biologi Umum
(2012), Botani Umum (2013) dan Kultur Jaringan (2011-2012) di jurusan Biologi
Penulis melaksanakan Kuliah Kerja Nyata pada bulan Juli-Agustus 2013 di Pekon
Pampangan, Kec. Sekincau, Kab. Lampung Barat. Pada bulan Januari-Februari
2014 penulis melaksanakan Kerja Praktek di Balai Pengawasan dan Sertifikasi
Benih Tanaman Pangan Hortikultura (BPSB TPH). Dan melaksanakan penelitian
pada bulan Juni 2014 – Agustus 2014 di Laboratorium Kultur Jaringan Jurusan
Ku Persembahkan Karya Kecilku ini:
Kepada orang tua terkasih ku ibu Agus Sumiyati dan
bapak Basuki yang tak pernah lelah perjuangan dan
pengorbanannya serta kasih sayang dan cinta yang telah
diberikan untuk kami. Dan teruntuk sodara sekandungku
“Sahabat adalah Mereka yang bisa melihat kamu terluka dari matamu, ketika
orang lain percaya dengan senyum diwajahmu’’ (By me)
“Belajar memang melelahkan, Namun akan lebih melelahkan lagi bila
saat ini Kamu tidak belajar ‘’ (By me)
Ya Tuhan Kami...
“Kami telah beriman kepada apa yang telah Engkau turunkan dan telah
Kami ikuti Rasul, karena itu masukanlah Kami kedalam golongan orang-orang yang menjadi saksi (tentang keesaan Allah) Qs. Ali ‘ Imran: 53
Sesungguhnya orang-orang yang beriman ialah Mereka yang bila disebut
nama Allah gemetarlah hati Mereka dan apabila dibacakan ayat-ayatnya
bertambahlah iman Mereka (Karenanya), dan hanya kepada Tuhanlah
Mereka bertawakal (Al Anfaal (8): 2)
“Setiap manusia pernah melakukan salah, dan hanya orang hebat yang
iii
SANWACANA
Puji syukur kehadirat Tuhan Yang Maha Esa karena atas Rahmat dan
Hidayah-Nya penulis dapat menyelesaikan Skripsi yang berjudul “Karakterisasi Planlet
Cabai Merah (Capsicum annum L.) Hasil Seleksi dengan Asam Salisilat Secara In vitro” tepat pada waktunya.
Penulis menyadari banyak sekali pihak yang telah membantu baik secara moril
maupun materil hingga terselesainya skripsi ini, untuk itu dalam kesempatan ini
penulis menyampaikan terimakasih yang sebesar-besarnya kepada:
1. Ibu Dr. Endang Nurcahyani, M.Si. selaku Pembimbing I atas segala
bimbingan, arahan, saran, dan semangat selama penulis melaksanakan
penelitian hingga terselesainya skripsi ini.
2. Bapak Ir. Zulkifli, M.Si selaku pembimbing II atas segala bimbingan, arahan,
dan semangat kepada penulis selama pelaksanaan penelitian hingga
terselesainya skripsi ini.
3. Ibu Dra. Tundjung Tripeni Handayani, M.S. selaku Pembahas atas segala
bimbingan, motivasi, saran, serta semangat kepada penulis selama
4. Bapak Drs. Achmad Nugraha, M.Si. selaku Pembimbing Akademik atas
bimbingan, kritik, dan sarannya kepada penulis dalam menempuh pendidikan
di Jurusan Biologi.
5. Ibu Dra. Nuning Nurcahyani, M.Sc. selaku Ketua Jurusan Biologi Fakultas
Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Lampung.
6. Bapak Prof. Suharso, Ph.D. selaku Dekan Fakultas Matematika dan Ilmu
Pengetahuan Alam (FMIPA) Universitas Lampung.
7. Bapak Ibu Dosen yang tidak dapat penulis sebutkan satu-persatu penulis
mengucapkan terimakasih atas bimbingan dan ilmu yang sudah diberikan
kepada penulis selama penulis melaksanakan studi di Jurusan Biologi.
8. Ibu dan Bapak serta adikku Candra Adi Pratama yang telah memberikan
semangat, perhatian, dukungan, dan do’a kepada penulis yang tiada hentinya.
9. Agus yang telah memberikan semangat, perhatian, canda tawa, dan
bantuannya selama penelitian.
10. Sahabat-sahabatku Mala, Khusnul, Linda, Dwi, Eka, Neni dan Aprilia atas
semangat, perhatian, canda tawa, yang selalu diberikan sejak awal
perkuliahan sampai akhir terselesainya skripsi ini.
11. Teman-teman Biologi 2010 Eko, Billi, Aris, Putra, Fais, Aviy, Adi, Ana,
Nova, Kiki, Tari, Ita, Anggi, Arin, Dewi, Isma, Rodi, Rika, Gigih, Dito,
Wikke, Pipin, Ayu, Elisa, Elga, Dimas, Yusrina, Citra, Ara, Suci, Nisa, Ipeh,
Puput, Meita, Aul, Nurul, Feabo, Reffy, Rendy, Tina, Sofi, Sonia, Windi.
13. Karyawan dan staff di Jurusan Biologi serta seluruh pihak yang tidak dapat
penulis sebutkan satu-persatu yang telah membantu dalam penyelesaian
SKRIPSI ini penulis mengucapkan terimakasih yang sebesar-besarnya.
Akhir kata, penulis berharap semoga tulisan ini dapat bermanfaat dan berguna
bagi kita semua.
Bandar Lampung, Desember 2014 Penulis
DAFTAR ISI
Halaman HALAMAN JUDUL
ABSTRAK ... i
LEMBAR PENGESAHAN ... ii
HALAMAN PENGESAHAN ... iii
DAFTAR ISI ... iv
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... ix
I. PENDAHULUAN 1.1. Latar Belakang dan Masalah ... 1
1.2. Tujuan Penelitian ... 5
1.3. Manfaat Penelitian ... 5
1.4. Kerangka Pikir ... 5
1.5. Hipotesis ... 7
II. TINJAUAN PUSTAKA 2.1. Sejarah Tanaman Cabai... 8
2.2. Taksonomi Tanaman Cabai... 8
2.3. Anatomi Tanaman Cabai 2.3.1. Daun ... 12
2.3.2. Batang ... 13
2.3.3. Akar ... 13
2.3.4. Bunga ... 13
2.4. Nilai Ekonomi Cabai ... 14
2.5. Perbanyakan Tanaman Secara in vitro 2.5.1. Regenerasi tanaman secara in vitro ... 16
2.5.2. Medium Kultur Jaringan ... 17
2.6. Penyakit layu Fusarium ... 18
2.7. Ketahanan Terimbas ... 18
v
III. METODE KERJA
3.1.Waktu dan Tempat ... 23
3.2. Alat dan Bahan Penelitian ... 23
3.3. Rancangan Penelitian ... 24
3.4. Bagan Alir Penelitian ... 25
3.5. Pelaksanan Penelitian ... 27
3.5.1. Persiapan medium tanam ... 27
3.5.2. Persiapan medium seleksi ... 27
3.5.3. Sterilisasi dan Penanaman benih dalam medium seleksi ... 28
3.6. Pengamatan ... 29
3.6.1. Analisis lignin ... 29
3.6.2. Analisis klorofil ... 30
3.6.3. Analisis anatomi jaringan batang ... 30
3.7. Analisis Data ... 31
IV.HASIL DAN PEMBAHASAN 4.1. Seleksi planlet cabai merah dengan asam salisilat ... 32
4.2. Kandungan klorofil a... 34
4.3. Kandungan klorofil b ... 37
4.4. Kandungan klorofil total ... 40
4.5. Lignifikasi ... 45
4.6. Analisis antomi jaringan batang ... 49
V.SIMPULANDAN SARAN 5.1 Simpulan ... 52
5.2 Saran ... 53
DAFTAR PUSTAKA ... 54
DAFTAR TABEL
Halaman
Tabel 1. Biaya produksi cabai merah per hektar pada lahan kering ... 14
Tabel 2. Produksi cabai merah di Dunia ... 15
Tabel 3. Para penelitian yang menggunakan AS dan AF
dengan berbagai konsentrasi ... 22
Tabel 4. Kandungan klorofil a
planlet cabai merah (mg/g jaringan) ... 34
Tabel 5. Kandungan klorofil b
planlet cabai merah (mg/g jaringan) ... 37
Tabel 6. Kandungan klorofil total
planlet cabai merah (mg/g jaringan) ... 40
Tabel 7. Rata-rata ketebalan lignin (µm)
planlet cabai merah ... 47
Tabel 8. Komposisi Medium Murashige and Skoog (MS) ... 60
Tabel 9. Kandungan klorofil a, b dan total daun planlet cabai merah ... 61
Tabel 10. Rata-rata, Standar Deviasi, kandungan klorofil a
pada daun planlet cabai merah... 62
x
Tabel 12. Analisis ragam kandungan klorofil a
daun planlet cabai merah ... 63
Tabel 13. Perbedaan kandungan klorofil a
daun planlet cabai merah ... 63
Tabel 14. Rata-rata, Standar Deviasi,
klorofil b pada daun planlet cabai merah... 64
Tabel 15. Ʃy, Ʃy2, (Ʃy)2 Kandungan
Klorofil b daun planlet cabai merah ... 64
Tabel 16. Analisis Ragam kandungan klorofil b
daun planlet cabai merah ... 65
Tabel 17. Perbedaan kandungan klorofil b
daun planlet cabai merah ... 65
Tabel 18. Rata-rata, Standar Deviasi,
kandungan klorofil total pada daun planlet cabai merah ... 66
Tabel 19. Ʃy, Ʃy2, (Ʃy)2. Kandungan Klorofil total
daun planlet cabai merah ... 66
Tabel 20. Analisis Ragam kandungan klorofil total
daun planlet cabai merah ... 67
Tabel 21. Perbedaan kandungan klorofil b
daun planlet cabai merah ... 67
Tabel 22. Rata-rata ketebalan lignin batang palnlet cabai merah ... 68
Tabel 23. Rata-rata, Standar Devisiasi,
ketebala lignin pada batang planlet cabai merah ... 68
Tabel 24. Analisis Ragam kandungan ketebalan lignin
xi
Tabel 25. Analisis ragam ketebalan lignin
pada batang planlet cabai merah ... 70
DAFTAR GAMBAR
Halaman
Gambar 1. Tanaman cabai merah (Capsicum annum L)... 12
Gambar 2. Tanaman cabai yang terserang layu Fusariumoxysporum f.sp.capsici Schlecht ... 19
Gambar 3. Struktur asam salisilat………... 21
Gambar 4. Bagan rancangan tahapan penelitian ... 25
Gambar 5. Bagan alir tahapan penelitian ... 26
Gambar 6. Planlet cabai merah umur 8 minggu yang ditumbuhkan dalam medium MS dengan penambahan asam salisilat berbagai konsentrsai. ... 32
Gambar 7. Grafik kandungan klorofil a planlet cabai merah pada medium MS dengan berbagai konsentrasi asam salisilat ... 35
Gambar 8. Kurva hubungan antara konsentrasi asam salisilat dalam medium MS ... 36
viii
Gambar 10. Kurva hubungan antara konsentrasi
asam salisilat dalam medium MS ... 39
Gambar 11. Grafik kandungan klorofil total planlet cabai merah pada media MS dengan berbagai konsentrasi asam salisilat ... 41
Gambar 12. Kurva hubungan antara konsentrasi asam salisilat dalam medium MS ... 42
Gambar 13. Irisan melintang batang planlet cabai merah yang mengandung lignifikasi K0=kontrol, K1, K2, K3, K4= Planlet cabai merah yang diimbas AS konsentrasi 15, 30, 45 dan 60 ppm ... 46
Gambar 14. Penampang melintang anatomi batang planlet cabai merah, memperlihatkan struktur umum penyusun batang planlet. A. Kontrol dan B. 60 ppm. Ep= Epidermis, Kor= Korteks, Em= Empulur, Kamb= Kambium, BP= Berkas Pengangkut ... 49
Gambar 15. Penampang melintang jaringan batang pada bagian epidermis dan kambium, A= Kontrol dan B= 60 ppm ... 50
Gambar 16. Penampang melintang batang planlet cabai merah yang menujukkan berkas pengangkut. A.Kontrol dan B. 60 ppm. Ep= Epidermis, Kor= Korteks, BP= Berkas Pengangkut, Kamb= Kambium ... 50
Gambar 17. Benih yang akan ditumbuhkan ke medium MS ... 71
Gambar 18. Penanaman benih dalam medium ... 71
Gambar 19. Planlet cabai merah yang berumur 8 minggu ... 71
ix
Gambar 21. Sampel yang akan dipanaskan di Water bath... 72
Gambar 22. Larutan sampel yang akan di ukur
menggunakan spektofotometer ... 72
Gambar 23. Larutan sampel yang dihitung panjang
gelombangnya menggunakan spektofotometer ... 73
Gambar 24. Mikroskop yang digunakan untuk pengamatan
1
I. PENDAHULUAN
1.1. Latar Belakang dan Masalah
Cabai merah (Capsicum annuum L.) merupakan salah satu hasil pertanian
yang penting dan banyak dibudidayakan di Indonesia. Buah cabai memiliki
aroma, rasa pedas dan warna yang spesifik, sehingga banyak digunakan oleh
masyarakat sebagai rempah dan bumbu masakan. Seiring dengan
pertambahan penduduk yang pesat dan berkembangnya industri makanan,
maka kebutuhan cabai di Indonesia pun meningkat (Soelaiman & Ernawati,
2013).
Petani cabai umumnya mendapatkan benih dari tanaman cabai yang telah
dibudidayakan sebelumnya secara turun temurun, hal ini menyebabkan
kualitas benih tidak murni lagi, selanjutnya akan berpengaruh pada
keragaman tumbuh, produktifitas dan kerentanan terhadap gangguan hama
dan penyakit. Kualitas benih atau galur cabai masih terlihat sebagai kendala
yang menyebabkan rendahnya produksi. Untuk meningkatkan produk
tanaman cabai harus menggunakan benih varietas unggul, penerapan
teknologi budidaya yang tepat dan pemupukan yang berimbang (Nawangsih,
2
Produktivitas cabai di Indonesia saat ini masih tergolong rendah. Selain itu,
permasalahan yang dihadapi adalah mutu cabai yang kurang baik.
Faktor-faktor yang menyebabkan rendahnya produktivitas cabai Indonesia antara lain
penggunaan benih yang kurang bermutu, teknik budidaya yang belum efisien
dan penanaman kultivar cabai yang tidak tahan terhadap hama serta penyakit
(Soelaiman & Ernawati, 2013; Wiratama et al., 2013).
Salah satu kendala utama dalam budidaya tanaman cabai adalah gangguan
penyakit layu Fusarium yang disebabkan oleh jamur Fusarium oxysporum
f.sp.capsici (Foca). Jamur patogen ini dapat menyerang tanaman cabai merah
mulai dari masa perkecambahan sampai dewasa. Adanya serangan Foca menjadi
salah satu pembatas yang menyebabkan terjadinya penurunan produksi cabai.
Kerugian akibat penyakit layu fusarium pada tanaman cabai cukup besar.
Menurut Rostini (2011), penyakit ini dapat menyebabkan kerugian dan gagal
panen hingga 50% pada saat pascapanen. Penyakit ini menyerang bagian
tanaman yaitu pada batang, ini merupakan masalah serius bagi petani
(Sujatmiko et al., 2012; Sitohang, 2005).
Di Indonesia, selama ini para petani cabai masih menggunakan pestisida
sintetis untuk mengendalikan penyakit layu Fusarium tersebut. Pestisida
kerap menimbulkan polusi terhadap lingkungan padahal tanaman cabai
merupakan tanaman yang dikonsumsi langsung oleh konsumen, maka perlu
3
Salah satu alternatif cara pengendalian penyakit yang aman, efisien dan
efektif dan aman terhadap lingkungan, antara lain menggunakan varietas yang
tahan (Nurcahyani, 2013). Penggunaan varietas unggul yang tahan terhadap
Foca dengan daya hasil tinggi merupakan salah satu alternatif pengendalian
penyakit yang penting dan tidak menimbulkan dampak negatif seperti
penggunaan pestisida. Pengembangan kultivar Capsicum annum tahan Foca
tersebut dapat dilakukan antara lain dengan metode seleksi in vitro yaitu
mengkulturkan eksplan berupa jaringan atau organ pada medium yang
mengandung asam salisilat konsentrasi selektif (Soetrisno & Setiawati, 2010).
Asam salisilat (AS) merupakan signal penting dalam ketahanan tanaman,
digunakan sebagai senyawa pengimbas ketahanan tanaman terhadap penyakit
layu Fusarium (Sujatmiko et al., 2012).
Seleksi ketahanan terhadap layu fusarium dapat dilakukan menggunakan
filtrat dari kultur fusarium atau menggunakan racun murni fusarium yaitu
asam salisilat. Penggunaan asam salisilat pada seleksi in vitro disebabkan
asam salisilat yang bersifat pathogenesis dan general terhadap tumbuhan
sehingga bisa diaplikasikan untuk banyak tanaman. Beberapa penelitian
menunjukkan bahwa penambahan asam salisilat pada media sebagai
komponen seleksi berkorelasi dengan tingkat ketahanan tanaman terhadap
fusarium. Pendekatan seleksi in vitro dilaporkan telah menghasilkan banyak
varietas tanaman tahan diantaranya pada tanaman vanili (Nurcahyani, 2013),
4
Asam salisilat memegang peranan penting dalam ketahanan sistemik
terinduksi. Asam salisilat di gunakan pada tanaman sebagai reaksi terhadap
infeksi patogen, dan digunakan sebagai racun murni pada penyakit layu
Fusarium. Mekanisme ketahanan tanaman terhadap penyakit dapat berupa
ketahanan secara fisik maupun kimia. Salah satu bentuk ketahanan secara
kimia adalah asam salisilat. Asam salisilat lebih dominan untuk mengatasi
serangan patogen biotrof (patogen yang aktif pada jaringan hidup) dan virus.
Mekanisme ketahanan melalui jalur asam salisilat berhubungan dengan
protein-protein yang terkait dengan pathogenesis (Pathogenesis-Related-
proteins/PR -proteins) seperti kitinase, peroksidase, β-glukanase dan PR-1.
Pada tanaman melon dengan konsentrasi 0 ppm, 15 ppm, 30 ppm dan 60 ppm
(Corina et al., 2009; dalam Sujatmiko et al., 2012; Rebecca et al., 2007,
dalam Sujatmiko et al., 2012).
Penelitian ini dilakukan untuk mendapatkan kandidat planlet cabai merah C.
annum L. yang tahan terhadap asam salisilat secara in vitro. Planlet cabai
merah yang tahan asam salisilat nantinya diharapkan apabila diregenerasikan
menjadi tanaman dapat menghasilkan galur yang tahan terhadap infeksi Foca,
dengan demikian diharapkan akan dapat meningkatkan kembali kualitas dan
5
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengetahui kisaran konsentrasi asam salisilat toleran untuk seleksi planlet
cabai merah secara in vitro.
2. Mengetahui dan menganalisis karakter ekspresi yang spesifik pada planlet
cabai merah yang insensitif terhadap asam salisilat secara in vitro meliputi
ketebalan lignin, konsentrasi klorofil total, klorofil a, dan klorofil b, serta
perbedaan struktur anatomi batang.
1.3 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai
penggunaan asam salisilat untuk mendapatkan planlet cabai merah yang
insensitif terhadap asam salisilat secara in vitro. Planlet yang insensitif
terhadap asam salisilat diharapkan juga tahan terhadap penyakit layu
fusarium. Secara ilmiah diharapkan dapat memberikan kontribusi bagi
pengembangan ilmu pengetahuan terutama di bidang pemuliaan tanaman,
penyakit tanaman dan ilmu terapan yang terkait.
1.4 Kerangka Pikir
Cabe merah (Capsicum annum L.) merupakan salah satu komoditas
hortikultura yang memiliki nilai ekonomi penting di Indonesia.
Produktivitasnya akhir-akhir tahun ini menurun akibat dari gangguan
6
Fusarium oxysporum (Fo) secara umum dapat bertahan di dalam tanah
sebagai klamidospora yang merupakan bentuk modifikasi dari miselium.
Patogen ini dalam bentuk klamidospora dapat bertahan hingga
bertahun-tahun. Hal ini menyebabkan pengendalian serangan Fo menggunakan
fungisida tidak efektif. Penggunaan fungisida hanya bisa menurunkan tingkat
serangan Fo pada maksimal sebesar 40%.
Teknik in vitro merupakan teknik yang berkembang dan sering diaplikasikan
untuk perbaikan karakter tanaman termasuk pada karakter ketahanan
tanaman. Variasi somaklonal dan seleksi in vitro adalah dua teknik yang
sering digunakan pada kultur in vitro untuk perbaikan karakter tanaman.
Mekanisme pengimbasan terhadap penyakit erat hubungannya dengan
karakter normal dari tanaman, seperi kutikula yang tebal, pembukaan
stomata, lignin, klorofil, anatomi jaringan batang dan kemampuan
membentuk senyawa antimikroba.
Asam salisilat dikenal dapat mempengaruhi berbagai fisiologi dan biokimia
tanaman dan mempunyai peran penting dalam mengatur pertumbuhan serta
produktifitasnya. Beberapa penelitian menunjukkan bahwa penambahan
asam salisilat pada media sebagai komponen seleksi berkorelasi dengan
tingkat ketahanan tanaman terhadap fusarium pada tingkat lapang.
Pendekatan seleksi in vitro dilaporkan telah menghasilkan banyak varietas
tanaman tahan diataranya pada tanaman vanili (Nurcahyani, 2013), tomat
7
1.5 Hipotesis
1. Terdapat konsentrasi asam salisilat yang toleran untuk seleksi planlet cabai
merah secara in vitro.
2. Adanya karakter ekspresi yang spesifik pada planlet cabai merah yang
insensitif terhadap asam salisilatmeliputi peningkatan: ketebalan lignin,
kadar klorofil total, klorofil a, dan klorofil b, serta perbedaan struktur
II. TINJAUAN PUSTAKA
2.1 Sejarah Tanaman Cabai
Christophorus Columbus adalah seorang petualang dunia yang menemukan
tanaman cabai (Capsicum sp), karena habitatnya di Amerika tropik banyak
masyarakat luar daerah tidak banyak mengenalnya. Kisah tanaman cabai
tidak akan seperti ini, apabila tidak ada perhatian dari petualang terhadap
tanaman yang rasa buahnya sangat pedas. Petualang yang berkebangsaan
Spanyol ini bermula pada tahun 1490. Pada saat ekspedisi yang dipimpinnya
mendarat disebuah daerah berhawa panas yang dikiranya sebagai salah satu
dari benua Asia. Namun, kenyataannya diketahui bahwa daerah yang
didaratinya merupakan daerah Guanahani, dan sekarang merupakan wilayah
San Salvador (Setiadi, 2006).
2.2 Taksonomi Tanaman Cabai
Tanaman cabai populer dengan sebutan pepper atau chili. Cabai terdiri dari
dua jenis, secara umum yaitu cabai besar dan cabai pedas. Cabai besar
biasanya memiliki rasa yang tidak terlalu pedas, berukuran besar, dan
digunakan sebagai hiasan kuliner. Yang termasuk dalam cabai ini adalah
cabai besar dan cabai manis atau cabai paprika. Cabai jenis ini biasa disebut
9
rasanya yang pedas. Biasanya ukurannya kecil sehingga cabai ini lebih
dikenal dengan istilah chili. Cabai jenis ini banyak di sukai di Indonesia,
contohnya cabai rawit (Suriyana, 2012).
Buah cabai digunakan untuk memperlezat masakan sejak pertama kali
dibudidayakan oleh suku Inca, Maya, dan Aztek di Amerika. Sampai saat ini,
penggunaan terbesar cabai dalam kehidupan sehari-hari sebagai bumbu
masakan. Pada abad XIV melalui kepulauan Maluku, bangsa Portugis dan
Belanda membawa cabai ke Indonesia , setelah itu masyarakat Indonesia
mengenal cabai sebagai bumbu. Masyarakat kita menggunakan
rempah-rempah seperti lada (Piper ningrum L), jahe (Zingiber officinalis Rosc), cabai
jawa (Piper retrofractum Vahl) dan kapulaga (Amomum cardamomum Willd)
untuk mendapatkan rasa pedas dalam masakan, sebelum tanaman cabai
masuk ke Indonesia (Taringan & Wiryanto, 2003).
Salah satu komoditas sayuran yang penting adalah cabai merah (Capsicum
annum L.). Dikenal sebagai bahan penyedap dan pelengkap berbagai menu
masakan khas Indonesia adalah buahnya (Nawangsih et al., 1994).
Hampir setiap hari produksi ini dibutuhkan. Kebutuhan akan komoditas ini
meningkat, karena dengan bervariasinya jenis, dan menu makanan, yang
memanfaatkan produk ini. Cabai merah besar termasuk tanaman yang dapat
mengadakan penyerbukan sendiri, dan dalam tingkatan yang cukup besar juga
10
Cabai merah di Indonesia di bedakan dalam 2 kelompok yaitu cabai merah
besar dan cabai merah keriting. Perbedaan yang mencolok dari dua jenis
cabai tersebut terletak pada bentuk buah dan cita rasa pedas yang dimiliki.
Pada cabai merah keriting bentuknya lebih ramping dan cita rasanya sangat
pedas, sedangkan padai cabai merah besar permukaan buahnya halus dan
rasanya pedas. Varietas cabai besar umumnya diberi nama berdasarkan
tempat dan daerah dimana tanaman ini dibudidayakan, misalnya (Capsicum
annum L.) dari Brastagi, Semarang, dan Indragir. Buah cabai merah besar ini
mempunyai ukuran panjang mencapai 6-10 cm, dan berdiameter 0,7-1,3 cm.
Cabai merah besar ini dapat tumbuh baik didataran rendah dan tinggi
(Nawangsih et al., 1994).
Umur cabai sangat bervariasi tergantung jenis cabai. Tanaman cabai besar
dan keriting yang ditanam di dataran rendah sudah dapat dipanen pertama kali
umur 70–75 hari setelah tanam. Sedangkan waktu panen di dataran tinggi
lebih lambat yaitu sekitar 4–5 bulan setelah tanam. Panen dapat
terus-menerus dilakukan sampai tanaman berumur 6–7 bulan. Pemanenan dapat
dilakukan dalam 3–4 hari sekali atau paling lama satu minggu sekali
11
Klasifikasi tanaman cabai merah menurut Prajnanta (2001) adalah sebagai
berikut:
Regnum : Plantae
Divisio : Spermatophyta
Sub-divisio : Angiospermae
Classis : Dicotyledoneae
Sub-classis : Sympetalae
Ordo : Solanales
Familia : Solanaceae
Genus : Capsicum
Species : Capsicum annum L
Secara morfologi tanaman cabai termasuk tanaman semusim (annual)
berbentuk perdu, berdiri tegak dengan batang berkayu,dan memiliki banyak
cabang. Tinggi tanaman dewasa antara 65-120 cm. Dalam dunia
tumbuh-tumbuhan, cabai hibrida tergolong dalam tumbuhan yang menghasilkan biji.
Bijinya tertutup oleh bakal buah sehingga termasuk dalam golongan
12
Gambar 1. Tanaman cabai merah (Capsicum annum L.) (Sumber. Prajnanta, 2007 ).
2.3 Morfologi tanaman cabai
2.3.1 Daun
Bentuk daun cabai bervariasi tergantung pada jenis daun varietasnya. Secara
umum daun berbentuk oval atau lonjong, namun ada juga yang berbentuk
lanset. Daun cabai berukuran panjang antara 3-11 cm dengan lebar 1-5 cm.
Pada umumnya permukaan cabai halus, namun pada beberapa spesies ditemui
juga permukaan daun yang berkerut. Umumnya warna daun cabai berbeda
antara permukaan atas dan bawah daun. Warna permukaan bagian atas daun
cabai berkisar antara hijau muda, hijau sedang, dan hijau tua. Sementara
permukaan daun bagian bawah biasanya berwarna hijau muda hingga hijau
13
2.3.2 Batang
Batang dibedakan menjadi dua macam: batang utama dan percabangan.
Batang utama berwarna coklat hijau, berkayu, panjang antara 20-28 cm, dan
berdiameter 1,5-2,5 cm. Percabangan berwarna hijau dengan panjang antara
5-7 cm. Diameter percabangan lebih kecil dari batang utama, berkisar antara
0,5-1 cm. Sifat percabangan adalah dikotom atau menggarpu. Cabang setiap
waktu membentuk cabang baru yang berpasangan (Nawangsih et al., 2001).
2.3.3 Akar
Perakaran cabai merupakan akar tunggang yang terdiri atas akar utama
(primer) dan akar lateral (sekunder). Dari akar lateral keluar serabut-serabut
akar (akar tersier). Panjang akar primer berkisar 35-50 cm. Akar lateral
menyebar sekitar 35-45 cm (Prajnanta, 2001).
2.3.4 Bunga
Tanaman cabai merupakan salah satu jenis tanaman yang masuk dalam
sub-class Asteridae (berbunga bintang) sehingga pada umumnya menemukan
tanaman cabai yang memiliki bunga berbentuk bintang. Warna mahkota
bunga beragam, ada yang putih, kehijaun, bahkan ungu. Bunga tanaman
cabai keluar dari ketiak daun. Ada yang tunggal dan ada juga yang tumbuh
bergerombol dalam tandan. Biasanya dalam satu tandan terdapat tidak lebih
dari tiga kuntum bunga. Bunga jantan dan bunga betina pada tanaman cabai
terdapat dalam satu bunga sehingga bunga cabai dikenal sebagai tanaman
berbunga sempurna. Pada waktu pemasakan bunga jantan dan bunga betina
14
penyerbukan sendiri. Tetapi tidak menutupi kemungkinan terjadinya
penyerbukan silang. Penyerbukan biasanya dibantu oleh angin dan serangga
(Suriyana, 2012).
2.4 Nilai ekonomi cabai
Cabai merah (Capsicum annuum L.) merupakan salah satu sayuran yang
permintaannya cukup tinggi, baik untuk pasar domestik maupun ekspor ke
mancanegara, seperti Malaysia dan Singapura (Sembiring, 2009). Selama ini
dikenal dua jenis cabai merah, yakni cabai merah besar dan cabai merah
keriting. Sebagian besar penduduk Indonesia mengkonsumsi cabai dalam
bentuk segar, kering atau olahan. Adapun biaya yang dikeluarkan untuk
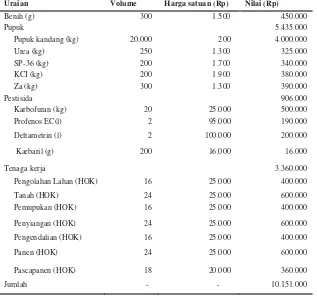
[image:34.595.136.453.432.728.2]penanaman adalah sebagai berikut (Tabel 1).
Tabel 1. Biaya produksi cabai merah per hektar pada lahan kering
Uraian Volume Harga satuan (Rp) Nilai (Rp)
Benih (g) 300 1.500 450.000 Pupuk 5.435.000 Pupuk kandang (kg) 20.000 200 4.000.000 Urea (kg) 250 1.300 325.000 SP-36 (kg) 200 1.700 340.000 KCI (kg) 200 1.900 380.000 Za (kg) 300 1.300 390.000 Pestisida 906.000 Karbofuran (kg) 20 25.000 500.000 Profenos EC(l) 2 95.000 190.000 Deltametrin (l) 2 100.000 200.000
Karbaril (g) 200 16.000 16.000
Tenaga kerja 3.360.000 Pengolahan Lahan (HOK) 16 25.000 400.000 Tanah (HOK) 24 25.000 600.000 Pemupukan (HOK) 16 25.000 400.000
Penyiangan (HOK) 24 25.000 600.000 Pengendalian (HOK) 16 25.000 400.000
Panen (HOK) 24 25.000 600.000
Pascapanen (HOK) 18 20.000 360.000 Jumlah - - 10.151.000
15
Biaya produksi pada prinsipnya merupakan penjumlahan dari biaya tetap dan
biaya variabel. Biaya tetap meliputi sewa lahan, peralatan, dan bahan
pembantu lainnya. Biaya variabel meliputi benih, pupuk, pestisida, dan
tenaga kerja. Dilihat dari komponen biaya, pemupukan dan tenaga kerja
memerlukan biaya tertinggi, yaitu masing-masing Rp5,44 juta dan Rp3,36
juta/ha. Biaya total usaha tani cabai merah pada lahan kering mencapai
[image:35.595.137.484.303.506.2]Rp10,15 juta/ha (Tabel 1) (Rajab dan Taufik, 2008).
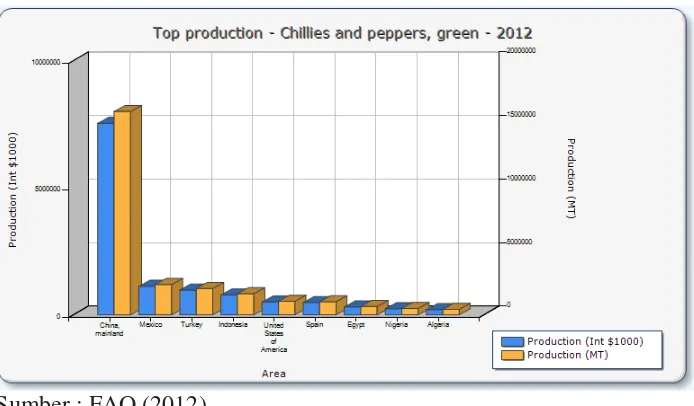
Tabel 2. Produksi cabai merah di Dunia
Sumber : FAO (2012)
Karena tanaman cabai mempunyai keanekaragaman jenis yang besar,
sehingga pemanfaatannyapun dapat beragam pula. Meskipun cabai
bukanlah merupakan tanaman ekonomi utama, tetapi sudah diakui beberapa
negara termasuk Indonesia bahwa tanaman ini merupakan salah satu tanaman
rempah-rempah. Akibatnya pemanfaatan dan pembudidayaan secara
lokalpun menjadi besar, sehingga tanaman ini mempunyai nilai ekonomi yang
16
2012, yang memperlihatkan bahwa cabai telah dibudidayakan di seluruh
Dunia dengan areal dan produksi yang cukup bervariasi (Tabel.2).
2.5 Perbanyakan tanaman secara in vitro
Perbanyakan tanaman dengan teknik in vitro secara vegetatif (menggunakan
bagian organ pertumbuhan tanaman) merupakan alternatif dalam upaya untuk
mendapatkan tanaman baru yang mempunyai sifat sama dengan induknya.
Sistem perbanyakan tanaman ini dikenal sebagai teknik kultur jaringan.
Sistem kultur jaringan ini mempunyai keuntungan yaitu penghematan tenaga,
waktu, tempat dan biaya. Kultur jaringan menggunakan dasar teori sel. Sel
mempunyai kemampuan otonom (mampu tumbuh mandiri), bahkan
mempunyai kemampuan totipotensi. Totipotensi adalah kemampuan setiap
sel, dari bagian mana pun sel tersebut diambil, apabila diletakkan dalam
lingkungan yang sesuai akan tumbuh menjadi tanaman yang sempurna
(Nugroho & Sagito, 2005).
2.5.1 Regenerasi tanaman secara in vitro
Perbanyakan tanaman secara vegetatif dilakukan dengan menggunakan
bagian dari tanaman tersebut. Teknik perbanyakan secara vegetatif antara
lain cangkok, stek dan okulasi, sedangkan perbanyakan vegetatif secara
modern dilakukan dengan teknik kultur jaringan. Kegunaan utama kultur
jaringan adalah untuk mendapatkan tanaman baru dalam jumlah banyak dan
waktu yang relatif singkat, yang mempunyai sifat fisiologis dan morfologis
17
Eksplan adalah bagian dari tanaman yang digunakan dalam kultur jaringan
tanaman. Seluruh bagian tanaman (daun, batang, dan akar) dapat di
pergunakan sebagai eksplan, namun yang biasanya dipergunakan adalah
jaringan muda, mata tunas dan tunas pucuk (Yusnita, 2003 dalam
Nurcahyani, 2013).
Secara in vitro, eksplan dapat berkembang membentuk organ atau embrio.
Pembentukan organ pada tanaman secara in vitro dengan secara langsung
apabila eksplan diindukasi lansung membentuk organ tanpa pembentukan
kalus terlebih dahulu. Sel-sel yang sudah terinduksi menjadi embriogenik,
sehingga dapat melanjutkan pertumbuhannya menjadi embrio dan selanjutnya
tanaman utuh (Hendrayono & Wijayanto, 1994)
2.5.2 Medium kultur jaringan
Medium merupakan faktor utama dalam perbanyakan dengan kultur jaringan.
Medium merupakan tempat bagi jaringan untuk tumbuh dan mengambil
nutrisi yang mendukung kehidupan jaringan. Medium tanam pada kultur
jaringan terdiri dari dua jenis yaitu media cair dan padat. Medium MS yang
diformulasikan dan diperkenalkan oleh Murashinge dan Skoong pada tahun
18
2.6 Penyakit layu Fusarium
Berberapa penyakit yang menyerang tanaman cabai merah (Capsicum annum
L.) antara lain layu Ralstonia solanacearum , Cucumber
Mosaic Virus (CMV), dan layu Fusarium (Goto, 1992).
Penyakit layu Fusarium (Fusarium oxysporium f.sp. capsici Schlecht.) pada
umumnya terjadi pada saat tanaman berumur 60-70 hari. Namun, pada
musim penghujan serangan penyakit ini datang lebih cepat yakni pada saat
tanaman berumur 40 hari. Jamur akan menyerang akar tanaman hingga layu
dan batang berwarna coklat, diikuti layu pada daun sehingga mengakibatkan
tanaman tidak berbuah. Penurunan produksi cukup besar sampai dengan 50
persen. Jika tanaman cabai normal bisa berbuah sampai dengan enam kali
bahkan tujuh kali, tanaman yang diserang Fusarium hanya berbuah dua kali,
langsung mati. Jenis tanaman cabai yang paling rentan terhadap penyakit
Fusarium adalah cabai besar. Dari 17,5 hektar tanaman cabai yang diserang,
19
Gambar.2. Tanaman Cabai yang Terserang Layu Fusariumoxysporum f.sp. capsici Schlecht (Duriat, 2007).
Gejala yang paling menonjol adalah daun kekuningan dan layu yang dimulai
dari daun bagian atas. Kelayuan ini terjadi secara bertahap sampai terjadi
kelayuan permanen beberapa waktu kemudian dan daun tetap menempel pada
batang (Gambar 2). Jaringan vaskular berwarna coklat terutama pada batang
bagian bawah dekat akar. Menjelang kematian tanaman tidak ada perubahan
warna, secara eksternal pada batang maupun akar, jaringan kortikal masih
tetap utuh. Gejala yang sama akan nampak pada tanaman dalam masa
generatif (Duriat et al., 2007).
2.7 Ketahanan terimbas
Ketahanan terimbas adalah aktifitas tanaman sehubungan dengan mekanisme
pertahanan terhadap agensi yang berbahaya. Akibat adanya ketahanan
terimbas adalah pengurangan gejala penyakit, perubahan faktor-faktor
biokimia dalam tanaman yang menyebabkan tanaman tahan terhadap
20
pengaktifan potensi genetik ketahanan (Kalix et al., 1996). Fenomena
ketahanan terimbas telah diketahui untuk sejumlah penyakit tanaman. Dalam
ketahanan terimbas terjadi pengurangan gejala karena terjadinya perubahan
biokimia di dalam tanaman. Ketahaan terimbas dapat bersifat lokal atau
sismetik (Sumardiyono, 2000).
Telah diketahui bahwa dalam pengimbasan ketahanan terdapat interaksi
antara bahan pengimbas dan tanaman. Tanaman yang rentan terimbas untuk
menjadi tahan oleh bahan pengimbas. Pengimbasan harus diberikan kepada
tanaman sebelum terjadi penularan oleh patogen (Baker dan Paulizt, 1993).
2.8 Asam salisilat
Asam salisilat (AS) memiliki rumus molekul C6H4COOHOH berbentuk
kristal berwarna merah muda terang hingga kecokelatan yang memiliki berat
molekul sebesar 138,123 g/mol dengan titik leleh sebesar 1560C dan densitas
pada 250C sebesar 1,443 g/mL. Mudah larut dalam air dingin tetapi dapat
melarutkan dalam keadaan panas. Asam salisat dapat terdekomposisi dengan
mudah menjadi karbon dioksida dan phenol bila dipanaskan secara cepat pada
suhu sekitar 2000C (Anonymous, 2014).
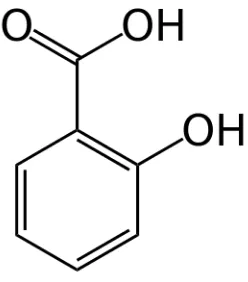
Asam salisilat memiliki struktur bangun seperti yang disajikan pada Gambar
21
Gambar 3. Struktur Asam Salisilat (Anonymous, 2014).
Bahan baku utama dalam pembuatan asam salisilat adalah phenol, NaOH,
karbon dioksida dan asam sulfat. Asam salisilat kebanyakan digunakan
sebagai obat-obatan dan sebagai bahan intermediet pada pabrik obat dan
pabrik farmasi seperti aspirin dan beberapa turunannya (Anonymous, 2014).
Asam salisilat mempunyai peranan penting dalam penginduksiaan dari
tanaman yang resisten terhadap patogen. Menurut Yalpani et al., (1993) cit
Leon et al., (1993) AS disintesis melalui dekarboksilasi dari asam sinamik
membentuk asam benzoat (BA), yang dihidroksilasi menjadi AS.
Penginduksian dari aktifitas BA2H dibatasi untuk pengekspresian jaringan
sebuah respon hipersensitif pada 24 0C. Tembakau Muzaik Virus (TMV)
pada daun tembakau di induksi dari aktifitas BA2H dan akumulasi AS yang
dihalangi ketika tanaman-tanaman tembakau diinokulasi yang diinkubasi
32 0C (Leon et al., 1993).
Mekanisme ketahanan tanaman terhadap penyakit dapat berupa ketahanan
secara fisik maupun kimia. Salah satu bentuk ketahanan secara kimia adalah
22
patogen biotrof (patogen yang aktif pada jaringan hidup) dan virus.
Pembentukan senyawa asam salisilat ini merupakan bentuk pengaktifan gen
ketahanan pada tanaman akibat adanya gen pada patogen. Mekanisme
ketahanan melalui jalur asam salisilat berhubungan dengan protein-protein
yang terkait dengan patogenesis (pathogenesis-related proteins/PR proteins)
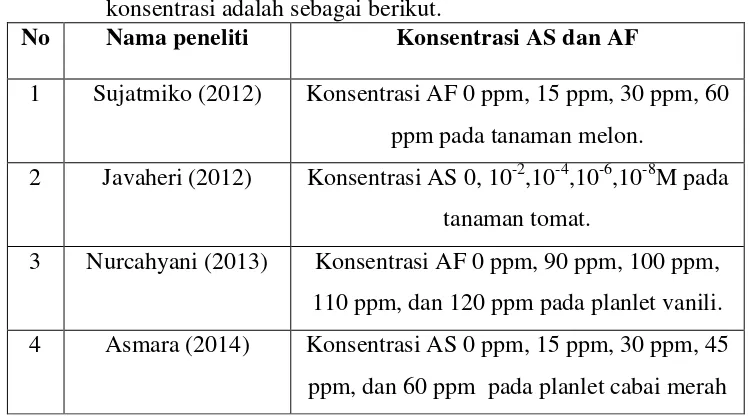
[image:42.595.131.506.267.476.2]seperti kitinase, peroksidase, β-glukanase dan PR-1 (Sujatmiko et al., 2012).
Tabel. 3 Para peneliti yang menggunakan AS dan AF dengan berbagai konsentrasi adalah sebagai berikut.
No Nama peneliti Konsentrasi AS dan AF
1 Sujatmiko (2012) Konsentrasi AF 0 ppm, 15 ppm, 30 ppm, 60
ppm pada tanaman melon.
2 Javaheri (2012) Konsentrasi AS 0, 10-2,10-4,10-6,10-8M pada
tanaman tomat.
3 Nurcahyani (2013) Konsentrasi AF 0 ppm, 90 ppm, 100 ppm,
110 ppm, dan 120 ppm pada planlet vanili.
4 Asmara (2014) Konsentrasi AS 0 ppm, 15 ppm, 30 ppm, 45
III. METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Juni sampai dengan bulan Agustus
2014 di Laboratorium Botani (ruang penelitian in vitro) dan Laboratorium
Mikrobiologi, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan
Alam, Universitas Lampung.
3.2 Alat dan Bahan Penelitian
3.2.1 Alat–alat Penelitian
Alat–alat yang digunakan untuk penelitian cabai secara in-vitro adalah
Laminar Air Flow Cabinet (LAF) merk ESCO, autoklaf, mortar,pestle, freeze
dryer, sentrifuge, pinset, scalpel, mata pisau scalpel, ketas filter Whatman no
1 dan no 42, syringe filter0,45 μm dan 0,22 μm, Erlenmeyer berukuran 100
ml, 500 ml,dan 1000 ml, cawan petri berdiameter 10 cm, botol kultur
berukuran 250 ml, gelas ukur bervolume 100 ml dan 500 ml, mikropipet,
24
3.2.2 Bahan–bahan penelitian
Bahan-bahan yang digunakan dalam penelitian adalah benih cabai merah
(Capsicum annum L) berasal dari toko pertanian di Bandar Lampung dengan
merek dagang Laris, asam salisilat yang diproduksi oleh Darmstadt Germany,
alkohol 70%, aquades, Benzine Amino Purine (BAP), Indole-3-Acetic Acid
(IAA),sukrosa, PlantPreservative Mixture (PPM), Kalium Hidroksida
(KOH), Asam Chlorida (HCl), Formalin Aseto Alcohol (FAA) dan bahan
kimia medium MS (Murashige & Skoog) padat yang komposisinya disajikan
dalam Lampiran 1.
3.3 Rancangan Penelitian
Penelitian ini disusun dalam Rancangan Acak Lengkap (RAL) dengan
sepuluh ulangan. Konsentrasi terdiri dari 5 taraf perlakuan yaitu 0 ppm, 15
ppm, 30 ppm, 45 ppm dan 60 ppm. Pada setiap botol berisi 3 eksplan cabai
25
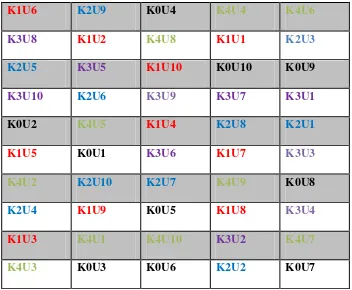
K1U6 K2U9 K0U4 K4U4 K4U6
K3U8 K1U2 K4U8 K1U1 K2U3
K2U5 K3U5 K1U10 K0U10 K0U9
K3U10 K2U6 K3U9 K3U7 K3U1
K0U2 K4U5 K1U4 K2U8 K2U1
K1U5 K0U1 K3U6 K1U7 K3U3
K4U2 K2U10 K2U7 K4U9 K0U8
K2U4 K1U9 K0U5 K1U8 K3U4
K1U3 K4U1 K4U10 K3U2 K4U7
[image:45.595.133.485.83.373.2]K4U3 K0U3 K0U6 K2U2 K0U7
Gambar 4. Tata letak rancangan penelitian
Keterangan :
Konsentrasi : K0=kontrol, K1=15ppm, K2=30ppm, K3=45ppm, K4=60ppm. U1,2,3,4,5,6,7,8,9,10 = Ulangan 1, 2, 3, 4, 5, 6, 7,8,9,10
3.4 Bagan alir penelitian
Penelitian ini terdiri atas beberapa tahap, yaitu: 1) Penentuan medium tanam
untuk perkecambahan benih cabai, dengan menggunakan media MS; 2)
Penentuan kisaran konsentrasi AS toleran untuk seleksi cabai dengan
pertumbuhan optimum; 3) Pengamatan jumlah planlet cabai yang hidup, dari
medium yang sudah ditambahkan AS; 4) Analisis karakter ekpresi yang
spesifik pada plantlet cabai meliputi anatomi batang, kandungan lignin, dan
analisis klorofil total, klorofil a dan klorofil b. Tahap penelitian ini disajikan
26
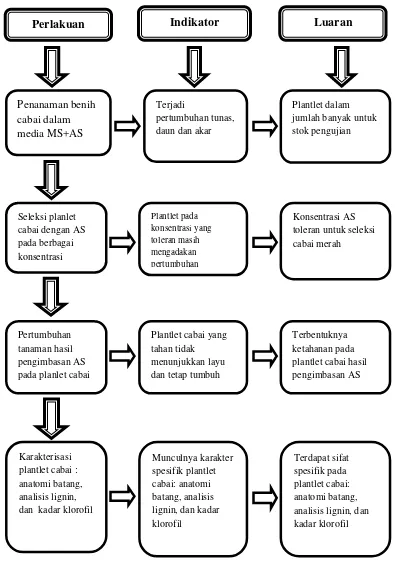
Gambar 5. Bagan alir tahap penelitian
Perlakuan Indikator Luaran
Penanaman benih cabai dalam media MS+AS
Terjadi
pertumbuhan tunas, daun dan akar
Plantlet dalam jumlah banyak untuk stok pengujian
Seleksi planlet cabai dengan AS pada berbagai konsentrasi Plantlet pada konsentrasi yang toleran masih mengadakan pertumbuhan Konsentrasi AS toleran untuk seleksi cabai merah
Pertumbuhan tanaman hasil pengimbasan AS pada planlet cabai
Plantlet cabai yang tahan tidak menunjukkan layu dan tetap tumbuh
Terbentuknya ketahanan pada plantlet cabai hasil pengimbasan AS
Karakterisasi plantlet cabai : anatomi batang, analisis lignin, dan kadar klorofil
Munculnya karakter spesifik plantlet cabai: anatomi batang, analisis lignin, dan kadar klorofil
27
3.5 Pelaksanaan Penelitian
Pelaksanaan penelitian meliputi beberapa langkah sebagai berikut.
3.5.1 Persiapan medium tanam
Medium yang digunakan dalam penelitian ini adalah Murashige & Skoog
(MS) padat. Pembuatan medium tanam MS sebanyak 1 liter adalah dengan
cara memipet sejumlah larutan stok (Lampiran 1), kemudian dimasukkan ke
dalam labu takar 1 liter. Aquades ditambahkan sampai tanda (1 liter) dan pH
diatur sampai 5,5. Untuk mendapatkan pH 5,5 dilakukan penambahan KOH
1 N atau HCl 1 N. Larutan tersebut kemudian dipindahkan ke dalam wadah
yang lebih besar kemudian ditambahkan agar-agar sebanyak 7 g/l, sukrosa 30
g/l, dan PPM 0,5 ml/l tanpa penambahan zat pengatur tumbuh (ZPT).
Larutan medium dipanaskan untuk melarutkan agar-agar (sambil diaduk)
sampai mendidih kemudian dituangkan ke dalam botol kultur sebanyak 20
ml/botol. Sterilisasi medium dengan menggunakan autoklaf dengan tekanan
17,5 psi, 121 0C selama 15 menit.
3.5.2 Persiapan medium seleksi
Medium Murashige & Skoog (MS) ditambah asam salisilat (AS) dengan
konsentrasi 0 ppm, 15 ppm, 30 ppm, dan 45 ppm menurut metode Sujatmiko
et al., (2012). Sebelum digunakan, asam salisilat yang telah dilarutkan
dengan aquades pada konsentrasi tertentu disaring menggunakan syringe
filter yang mempunyai diameter 0,45 µm sebanyak 2 kali, dilanjutkan filter
berdiameter 0,22 µm satu kali. Penyaringan dilakukan dalam ruang steril
28
Sebelum digunakan, medium ini diinkubasikan selama 7 hari pada suhu
kamar (25 oC) untuk memastikan bahwa AS telah tersaring dengan baik.
Apabila dalam waktu 7 hari tidak terjadi kontaminasi pada medium, maka
medium dapat digunakan.
3.5.3 Sterilisasi dan Penanaman benih dalam medium seleksi
Benih cabai direndam dalam aquades, lalu dimasukkan ke dalam larutan
chlorox 10% dikocok selama 10 menit. Benih dibilas dengan aquades,
pembilasan dilakukan dua kali dan dikocok masing-masing 3 dan 2 menit.
Setelah itu dipindahkan ke dalam cawan petri yang berisi betadine (bahan
aktif: Povidone iodine 10%) ditambah aquades dan dibiarkan selama 30
menit, kemudian benih ditanam pada medium MS tanpa ZPT. Penanaman
benih dilakukan di dalam LAF Cabinet. Setiap botol kultur ditanami 5 benih,
sehingga total benih yang ditanam sebanyak 200 dalam 40 botol kultur.
Benih-benih cabai tersebut di kecambahkan pada medium MS sampai
terbentuk planlet berumur 21 hari. Inkubasi kultur dilakukan pada ruangan
29
3.6 Pengamatan
Pengamatan dilakukan pada akhir minggu ke-8 dan dievaluasi untuk
mengetahui konsentrasi AS yang toleran untuk seleksi planlet cabai merah
secara in vitro.
Setelah 8 minggu inkubasi, planlet yang masih hidup di dalam botol,
kemudian dikarakterisasi dengan parameter sabagai berikut.
3.6.1 Analisis lignin
Pengamatan lignifikasi pada irisan melintang batang planlet cabai yang telah
dilakukan pengimbasan dengan AS menggunakan metode dari Ruzin (1999).
Langkah kerja dilakukan sebagai berikut.
Planlet cabai dicabut kemudian batangnya dibersihkan. Batang yang sudah
bersih difiksasi dengan cara direndam dalam FAA dan disimpan selama 24
jam. Batang selanjutnya dijepit dibagian tengah gabus, dan diiris dengan
sliding microtom secara melintang dengan ketebalan 5-10 μm. Potongan
irisan melintang direndam dalam safranin encer (1% w/v) selama 1,5 jam,
kemudian dibilas dengan aquades. Potongan batang yang telah dibilas
direndam dalam larutan etanol konsentrasi 25% selama 2-5 menit kemudian
direndam dalam safranin dan dikering anginkan. Sesudah kering, potongan
batang diletakkan di atas gelas preparat dan ditutup dengan gelas penutup.
Selanjutnya gelas preparat diamati di bawah mikroskop dengan perbesaran
400 kali. Jaringan batang yang terlignifikasi akan tampak berwarna merah
muda. Pengaruh AS, selanjutnya dideteksi efeknya antara lain melalui
pengukuran ketebalan lignin pada dinding xilem. Pengukuran ketebalan
30
3.6.2 Analisis klorofil
Bahan untuk analisis klorofil adalah daun planlet cabai merah yang sudah
diimbas dengan asam salisilat. Kadar klorofil dihitung dengan menggunakan
metode Arnon (1949).
Daun planlet cabai merah ditimbang sebanyak 0,0128 g, dihilangkan ibu
tulang daunnya, kemudian didestruksi dengan 5 ml alkohol 70%, dan
dimasukkan kedalam elenmeyer. Selanjutnya, alkohol dipanaskan dan
ditambahkan berturut-turut 5 ml alkohol sehingga volume alkohol yang
ditambahkan mencapai 20 ml. Pemanasan dihentikan setelah alkohol yang
tersisa kurang lebih 5 ml.
Larutan disentrifius, dan filtrat yang diperoleh dimasukkan kedalam kuvet
sebanyak 5 ml. Absorbansi diukur dengangn spektrofotometer UV pada
panjang gelombang 645 nm, 663 nm dan 683 nm. Ulangan tiap sampel
sebanyak 3 kali. Kadar klorofil dihitung dengan menggunakan rumus adalah
sebagai berikut:
-Klorofil total = [12,7(D683) – 2,69 (D645)] x
-Klorofil a = [22,9(D645) – 4,68 (D663)] x
-Klorofil b = [20,2(D645) + 8,02(D663)] x
3.6.3 Analisis anatomi jaringan batang
Pembuatan preparat awetan penampang melintang batang planlet cabai
menurut Ruzin (1999) sebagai berikut:
Batang planlet cabai difiksasi menggunakan larutan alkohol 70%. Setelah itu
dilakukan pengirisan melintang batang dengan menggunakan sliding
31
yang diberi alkohol 70%. Lalu dilanjutkan pewarnaan dengan safranin 1%
dalam alkohol 70% selama 24 jam, setelah itu dicuci dengan menggunakan
aquades kemudian ditambah anilin blue 1% dalam alkohol 70%. Kemudian
preparat diletakkandi atas gelas benda, ditutup dengan gelas penutup yang
sebelumnya diberi balsam kanada. Preparat dikeringkan di atas hot plate
dengan suhu 45 ºC hingga balsam kanada mengering. Terakhir dilakukan
pemberian namadisebelah kiri gelas penutup dengan melekatkan etiket yang
diberi keterangan nama spesies.
3.7 Analisis data
Data yang diperoleh dari pertumbuhan planlet cabai merah selama seleksi
dengan AS berupa data kualitatif dan data kuantitatif. Data kualitatif
disajikan dalam bentuk deskriptif komparatif dan di dukung foto. Data
kuantitatif dari setiap parameter dianalisis dengan menggunakan analisis
ragam (Analysis of Variance) atau Anova dengan tingkat kepercayaan 5%.
Apabila ada beda nyata dilanjutkan dengan Uji Beda Nyata Terkecil (BNT)
V. SIMPULAN DAN SARAN
5.1 Simpulan
Berdasarkan hasil pengamatan yang telah dilakukan pada uji klorofil,
lignifikasi dan anatomi batang pada planlet cabai merah di peroleh simpulan
sebagai berikut.
1. Kisaran konsentrasi AS toleran untuk seleksi planlet cabai merah secara in
vitro adalah 15 - 60 ppm. Hasil seleksi menghasilkan jumlah planlet cabai
merah sebesar 10% (0 ppm), 10% (15, 30, 45, dan 60 ppm) yang insensitif
terhadap AS.
2. Planlet cabai merah yang terimbas asam salisilat memiliki karakter
ekspresi yang berbeda dengan planlet cabai merah yang tidak diimbas
asam salisilat.
a. Kandungan klorofil pada daun planlet cabai merah yang diimbas AS
pada konsentrasi 15, 30, 45 dan 60 ppm mengalami penurunan,
dibandingkan dengan kontrol.
b. Analisis lignin yang terdapat pada xilem pada batang planlet cabai
merah yang diimbas AS mengalami penebalan, dibandingkan dengan
53
c. Analisis anatomi batang planlet cabai merah yang diimbas AS pada
batang planlet cabai merah yang tidak diimbas terdapat perbedaan pada
bagian kambium dan epidermis.
5.2 Saran
Perlu dilakukan penelitian lebih lanjut tentang penambahan konsentrasi asam
salisilat yang lebih tinggi terhadap planlet cabai merah yang mengalami
54
DAFTAR PUSTAKA
Agrawal AA, Tuzun S, & Bent E. 1999. Induced Plant Defenses Againts
Phatogens and Herbivores, Biovhemistry, Ecology and Agriculture. APS Prees, St. Paul, Minnesota. 390 p.
Anjum T, Akram W, Ahmad A, Hussain M, Aslam H, & Fatimah S. 2003. An
Insight Into The Basis of Resistance in Sorghum bicolor Against
Colletrichum sublineolum. Academic Journals 7(15): 1397-1408.
Anonymous. 2014. http://www.wikepedia org/struktur-asam-salisilat.htm.
Diakses 12 Mei 2104, pukul 14.00.
Arnon, D. I.1949. Copper enzymes in Isolated Chloroplasts Polyphenoloxidase in Beta vulgaris, Plants Physiol. 24: 1-15.
Baker, R & T C Paulitz.1993. Theoritical basis for microbial interaction leadingto
biological contol of soil borne pathogen . St Paul Minn :50-70.
Bouizgarne, B, Bouteau HEM, Frankart C, Reboutier D, Madiona K, Pennarun AM, Monestiez M, Trouverier J, Amiar Z, Briand J, Brault M, Rona JP, Ouhdouch Y, & Hadrami EI. 2006. Early Physiological Responses of Arabidopsis thaliana Cells to Fusaric Acid :Toxic and Signalling Effects. New Phytologist 169: 209-218.
De Ascensao, A. R. D. C. F., and Dubery, I. A. 2000. Panama disease: Cell wall
reinforcement in banana roots in response to elicitors from Fusarium
oxysporum f. sp. cubense race fuor. Phytopathology 90:1173-1180.
Duriat, A.S, Gunaeni,N dan Wulandari, A.E. 2007. Penyakit Penting Tanaman
Cabai dan Pengendaliannya. Monografi No.31,Balai Penelitian Tanaman Sayuran Pusat Penelitian dan Pengembangan Hortikultura Badan
Penelitian dan Pengembangan Pertanian.
Goodman RN, Kiraly Z, & Wood KR. 1986. The Biochemistry and Physiologi of
55
Goto, M. 1992. Fundamental of Bacterial Plant Pathology. Academic Press,
Tokyo. 342 p.
Hamza A, Derbalah A, & El-Nady M. 2012. Identification and Mechanism of Echinochloa crus-galli Resistance to Fenoxaprop-p-ethyl with respect to
Physiological and Anatomical Differences. Scientific World Journal.
2012: 1-8
He CY, Hsiang T, & Wolyn DJ. 2002. Induction of Systemic Disease Resistance
and Pathogen Defence Responses in Asparagus officinalis Inoculated
with Pathogenic Strains of Fusarium oxysporum. Plant Pathology 51:
225-230
Hendrayono, D.P.S dan Wijayanti A. 1994. Teknik Kultur Jaringan. Penerbit
Kanisius. Yogyakarta.
Jayasankar S, Li Z, & Gray DJ. 2000. In Vitro Selection of Vitis vinifera
‘Chardonnay’ withElsinoe ampelina Culture Filtrate is Accompanied by
Fungal Resistance and Enhanced Secretion of Chitinase. Planta .
211:200-208.
Javaheri, M. Mashayekhi, K. Dadkhah, A, dan Tavallaee, F, Z. 2012. Effects of salicylic acid on yield and quality characters of tomato fruit
(Lycopersicum esculentum Mill.). International Journal of Agriculture and Crop Sciences. Vol.,4 (16) , 1184-1187.
Kalix, S.G .Antoka , Y L and Buchenauer, B. 1996. Modern Fungicides and
Antifungal Compounds. Intercept Ltd, Andover:451-460.
Lea P. & Leegood RC. 1999. Plant Biochemistry and Moleculer Biology. 2nd ed.
John Wiley & Sons Ltd. Chichester. 364 p.
Leon, J. Yalpani N, Raskin.I, & Lawton.M.A. 1993. Induction of Benzoic Acid
2-Hydrokxylase in Virus-Inoculated Tabacco. Plant Physiol.103:323-328.
Moharekar, S.T, Lokhande, S.D, Hara. T, Tanaka.R, and Chavan, P.D. 2003. Effect of Salicylic Acid and on Clorophyll and Caretenoid Contents of
Wheat and Moong Seedling. Photosynthetica. pp 315-317.
Nawangsih, A.A, Imdad H.P, Wahyudi A. 1994. Cabai Hot Beauty. Penerbit
56
Nugroho, A dan Sugito H. 2005. Pedoman Pelaksanaan Teknik Kultur
Jaringan.Penerbit Penebar Swadaya. Bogor.
Nurcahyani, E. 2013. Karakterisasi Plantlet Vanili (Vanilla planifolia Andrews)
Hasil Seleksi In vitro dengan Asam Fusarat Terhadap Fusarium
oxyporum f.sp.vanillae. Universitas Gajah Mada. Yogyakarta. Desertasi.(Tidak dipublikasikan).
Prajnanta, F. 2007. Agribisnis Cabai Hibrida. Penerbit PT Penebar
Swadaya.Bogor.
Radwan. D.E.M. and Soltan D.M. 2012. The Negative Effect of Clethodhim in Photosynthesis and gas- exchange Status of Maize Plants are
Ameliorated by Salicylic Acid Pretreatment. Photosynthetica. pp
012-016.
Rajab, A. dan M. Taufik. 2008. Introduksi beberapa jenis sayuran di lahan kering
iklim kering. Laporan Hasil Penelitian. Balai Pengkajian Teknologi Pertanian Sulawesi Selatan, Makassar.
Rostini, N. 2011. 6 Jurus Bertanam Cabai Bebas Hama dan Penyakit. PT
AgroMedia Pustaka, Jakarta. Hal. 41.
Ruzin S.E. 1999. Plant Microtechnique and Microscopy. Oxford University Press.
New York. 307 p.
Saravanan T, Bhaskaran R, & Muthusamy M. 2004. Pseudomonas fluorescens
Induced Enzymological Changes in Banana Roots (cv. Rasthali) against Fusarium Wilt Disease. Plant Pathology Journal 3 : 72-80.
Sembiring, N.N. 2009. Pengaruh Jenis Bahan Pengemas terhadap Kualitas Produk
Cabai Merah (Capsicum annuum L.). Tesis. Pascasarjana Universitas
Sumatera Utara, Medan..
Serap cag, Gul cevahir.O.Z, Mine Sarsag and Wahal Goren Saglam. 2009. Effect of Salicylic Acid on Pigment, Protein Content, and Peroxidase Activity
in Excised Sunflower Cotyledons. Pak.J.Bot 41(5) :2297-2303. Istanbul
University. Istambul, Turkey
Sitohang, N. 2005. Multiplikasi Porpagula Pisang Barangan (Musa paradisiaca
57
Soelaiman, V dan Ernawati A. 2013. Pertumbuhan dan Perkembangan Cabai
Keriting (Capsicum annuum L.) secara In vitro pada beberapa
Konsentrasi BAP dan IAA. Bul. Agrohorti 1 (1) : 62–66.
Soesanto, L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Penerbit
Raja Grafindo Persada, Jakarta. Hal. 573.
Soetrisno, T.A,dan Setiawati, W. 2010. Sajian Teknis dan Ekonomis Sistem
Tanam Dua Varietas Cabai Merah. J Hort.20(3):284-298.2010.
Sticher L, Mauch-Mani B & Metraux JP. 1997. Systemic Acquired Resistance. Annual Review Phytopathology 35: 235-270.
Suharyanto E, Vautein M, & Jacobs M. 2007. Overproduction of Lysine by Engineering The Lysine Biosynthetic Pathway of Plant for Improving the Nutritional Quality, Contribution Towards a Better Human Prosperity. Proceeding International Seminar Advances in Biological Science. Yogyakarta. pp. 13, 170.
Sujatmiko, B. Sulistyaningsih, E, dan Murti, R.H. 2012. Studi Ketahanan Melon (Cucumis Melo L) Terhadap Layu Fusarium Secara In vitro Dengan
Asam Salisilat. Ilmu Pertanian. Vol 15 No.2; 1-18.
Sumardiyono, C. 2000. Ketahanan Terimbas, Kendala dan Prosesnya Dalam
Pengendalain Penyakit Tumbuhan. Universitas Gajah Mada. Yogyakarta
Suriyana, N. 2012. Cabai Sehat dan Berkhasiat. Penerbit CV Andi
Offset.Yogyakarta.
Svabova L & Lebeda A. 2005. In Vitro Selection for Improved Plant Resistance to
Toxin-Producing Pathogens. J. Phytopathol 153 : 52-64.
Taringan,S. dan Wiryanto.W.2003. Bertanamn Cabai Hibrida Secara Intensif.
Penerbit PT Agromedia Pustaka.Depok.
Vance CP & Sherwood RT. 1976. Regulation of Lignin Formation in Reed
Canarygrass in Relation to Disease Resistence. Plant Physiol. 57:
58
Wiratama, D.N.P, Sudiarta, P, dan Utama M.S. 2013. Kajian Ketahanan Beberapa
Galur dan Varietas Cabai Terhadap Serangan Antraknosa.E.Jurnal
Agroteknologi Tropika.Vol 2. No 2.