ABSTRAK
KARAKTERISASI PRODUKSI EKSOPOLISAKARIDA (EPS) DARI LIMBAH JERAMI PADI OLEH ISOLAT
BAKTERI ASAM LAKTAT LOKAL
Oleh
Karlina Widiyanti
Eksopolisakarida (EPS) merupakan polimer dari gula pereduksi dengan berat molekul tinggi yang disekresikan oleh mikroorganisme ke lingkungan eksternalnya. Polimer ini memiliki beberapa keunggulan untuk diaplikasikan dalam bidang farmasi dan bidang lainnya. Beberapa mikroba mampu menghasilkan EPS terutama bakteri asam laktat dengan memanfaatkan sumber karbon gula-gula pereduksi disintesis dan disekresikan keluar sel. Pada penelitian ini dilakukan modifikasi pembuatan EPS dari sirup gula-gula pereduksi hasil penguraian limbah jerami padi yang disintesis dengan bantuan isolat bakteri asam laktat lokal. Kondisi fermentasi meliputi pH dan waktu fermentasi dioptimasi untuk mengetahui kondisi optimum media fermentasi EPS, selain itu dilakukan karakterisasi EPS yang dihasilkan, meliputi Berat Molekul dengan menggunakan viskometer Ostwald, dan total gula dengan menggunakan metode Dubois (fenol-asam sulfat). Kondisi optimum media fermentasi EPS yang diperoleh dengan menambahkan larutan sukrosa 5% ke dalam filtrat jerami padi, pada pH 6,0 dan waktu inkubasi selama 48 jam. Kondisi ini digunakan untuk memproduksi EPS oleh isolat bakteri asam laktat LbK-19 dan menghasilkan EPS dengan kuantitas 2,51 mg mL-1. Karakterisasi terhadap EPS yang dihasilkan diperoleh berat molekul EPS sebesar 94592,99 g mol-1 dan pengukuran kandungan gula total sebesar 32,64 mg mL-1.
DAFTAR ISI
II. TINJAUAN PUSTAKA A. Eksopolisakarida ... 4
D. Kromatografi Cair Kinerja Tinggi (KCKT) atau High Performance Liquid Chromatography (HPLC) ... 14
III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian ... 17
B. Alat dan Bahan ... 17
C. Prosedur Penelitian ... 18
1. Pembuatan Media dan Pereaksi ... 18
a. Pembuatan Larutan Garam Fisiolois (NaCl 0,85%). ... 18
b. Pembuatan Media Inokulum Yeast Maltosa Cair (YM). ... 18
c. Pembuatan Media de Man,Rogosa,Sharpe (MRS) Cair. ... 18
d. Pembuatan Pereaksi DNS. ... 18
1) Larutan Stok A (NaH2PO4.H2O 0,2M). ... 19
5. Seleksi Bakteri Asam Laktat Penghasil EPS ... 21
6. Optimasi Produksi EPS Skala Laboratorium ... 22
7. Isolasi dan Pemurnian EPS ... 23
8. Karakterisasi EPS. ... 23
a. Pengukuran Berat Molekul (BM) Berdasarkan Metode Viskometri. ... 23
b. Analisis Kandungan Gula Pereduksi Total. ... 24
IV. HASIL DAN PEMBAHASAN A. Analisis Kandungan Gula pada Media Filtrat ... 25
B. Seleksi Bakteri Asam Laktat Penghasil EPS ... 29
C. Optimasi Produksi EPS Skala Laboratorium ... 33
D. Isolasi dan Pemurnian EPS. ... 36
E. Karakterisasi EPS. ... 36
1. Pengukuran Berat Molekul Berdasarkan Metode Viskometri. ... 36
2. Analisis Kandungan Gula Pereduksi Total. ... 38
V. SIMPULAN DAN SARAN A. Simpulan ... 39
B. Saran ... 39
DAFTAR PUSTAKA ... 40
I. PENDAHULUAN
A. Latar Belakang
Salah satu limbah pertanian yang jumlahnya cukup besar dan tersebar di
Indonesia adalah limbah jerami padi. Potensi limbah jerami padi sampai saat ini
sekitar sebesar 5 ton/ton padi (Majalah padi, 2009). Limbah pertanian seperti
jerami, bonggol jagung, kulit kacang-kacangan merupakan limbah lignoselulosa
yang masih mempunyai nilai ekonomis bila dilakukan pengolahan lebih lanjut
(Anindyawati, 2010). Lignoselulosa mengandung senyawa polisakarida yang
dapat dibiokonversi untuk berbagai kepentingan (Howard et al., 2003).
Hidrolisis lignoselulosa dari jerami padi oleh isolat Actinomycetes AcP-1 dan
AcP-7 pernah dilakukan oleh Satria dkk. (2010) yang mampu menghasilkan gula
total masing-masing sebesar 6,88 dan 7,03 mg/mL. Hasil ini berpotensi untuk
dikembangkan ke arah biokonversi lebih lanjut seperti pengembangan bahan baku
untuk produksi bioetanol, fermentasi asam-asam organik, dan sintesis polimer
seperti eksopolisakarida.
Eksopolisakarida (EPS) adalah salah satu polisakarida yang memiliki potensi
untuk aplikasi di bidang industri farmasi, kesehatan dan pangan. Polimer ini
dihasilkan oleh mikroba terutama bakteri asam laktat dengan memanfaatkan
and Mollet, 2001). Banyak mikroorganisme laut menghasilkan polimer
ekstraseluler yang berbentuk lapisan mengelilingi sel untuk melindungi dari
pengaruh buruk dan kondisi lingkungan yang ekstrem. Lingkungan yang ekstrem
juga memberi keanekaragaman mikroba novel untuk memproduksi jenis EPS
yang beraneka jenis dan menarik (Surekha et al., 2010).
Bakteri asam laktat merupakan penghasil EPS yang menarik perhatian para
peneliti beberapa tahun belakangan ini. Bakteri asam laktat adalah bakteri jenis
food-grade, dan eksopolisakarida yang dihasilkan mengkontribusi pada reologi
tertentu dan tekstur pada produk susu fermentasi dan aplikasi lain pada produk
olahan non susu (Frengova et al., 2002). Mikroorganisme penghasil EPS dapat
ditemukan di dalam berbagai lingkup ekologi, yaitu pada lingkungan yang
memiliki kandungan organik tinggi. Mikroba penghasil EPS merupakan
mikroorganisme termofilik pada setiap phylum dari Archaea dan bakteria, dan
dapat diisolasi dari berbagai lingkungan termofilik baik dari perairan laut dalam
dan dangkal, serta sumber air panas (Singha, 2012). Lingkungan laut adalah
lingkungan yang dinamis, dimana mikroorganisme akan mengubah salinitas,
tekanan, tingkat nutrisi dan sebagainya, yang dapat mempengaruhi produksi EPS
pada mikroorganisme. Pada lingkungan asli dan di laboratorium, mikroorganisme
cenderung menghasilkan EPS berlebih pada kondisi terbatas-kadar nitrogen
rendah. Faktor lain yang mempengaruhi pertumbuhan organisme seperti pH,
salinitas, aerasi dan temperatur juga dapat mempengaruhi produksi EPS (Bhaskar
Pada penelitian ini telah dilakukan suatu inovasi yaitu membuat EPS dari sirup
gula-gula pereduksi hasil penguraian limbah jerami padi yang disintesis dengan
bantuan isolat bakteri asam laktat lokal. Pemilihan bahan berlignoselulosa
diharapkan akan menghasilkan EPS yang beragam baik secara fisika maupun
kimia, mengingat material ini merupakan polimer yang monomer penyusunnya
bukan hanya glukosa tetapi monosakarida lainnya seperti xilosa, manosa, dan
arabinosa.
B. Tujuan Penelitian
Adapun tujuan pada penelitian ini adalah:
1. Untuk memperoleh kondisi optimum fermentasi EPS dengan beberapa
parameter meliputi substrat optimum, waktu inkubasi, dan pH.
2. Mengkarakterisasi eksopolisakarida yang dihasilkan dengan beberapa
parameter antara lain: berat molekul dan pengukuran kandungan gula total.
C. Manfaat Penelitian
Penelitian ini diharapkan dapat meningkatkan pemanfaatan hasil fermentasi
limbah jerami padi berbahan lignoselulosa berupa sirup gula-gula pereduksi.
Hasil fermentasi tersebut dapat dimanfaatkan sebagai bahan dalam sintesis EPS
dengan bantuan mikroorganisme dari sumber daya lokal berupa isolat-isolat
Actinomycetes dan bakteri asam laktat lokal. Sehingga penelitian ini
dikembangkan untuk memanfaatkan sumber daya lokal dalam pengembangan
II. TINJAUAN PUSTAKA
A. Eksopolisakarida (EPS)
Eksopolisakarida (EPS) merupakan polimer dari gula pereduksi dengan berat
molekul tinggi yang disekresikan oleh mikroorganisme ke lingkungan
eksternalnya. Polimer ini merupakan salah satu polimer yang mampu disintesis
oleh bakteri asam laktat. EPS umumnya terdiri dari monosakarida dan beberapa
substituen non-karbohidrat seperti asetat, piruvat, suksinat, dan fosfat (van Hijum
et al., 2002) juga biomolekul seperti protein, asam nukleat, lipid dan zat humat
(Vu et al., 2009).
EPS biasanya dihasilkan oleh bakteri asam laktat yang merupakan ciri kontribusi
bakteri ini sebagai probiotik yang memiliki efek positif bagi kesehatan (Suresh
and Mody, 2009). Polimer ini memiliki daya bioaktivasi yang dapat digunakan
dalam penggunaan obat seperti fungsinya sebagai anti virus, anti inflamasi
(Llamas et al., 2010). Dalam industri makanan EPS dapat berfungsi sebagai
pengental, pembuatan gel hingga pengemulsi. Beberapa EPS yang telah banyak
digunakan dalam bidang kesehatan diantaranya β-glukan, β-mannan, xanthan,
Struktur eksopolisakarida sangat beragam, beberapa jenis eksopolisakarida antara
lain :
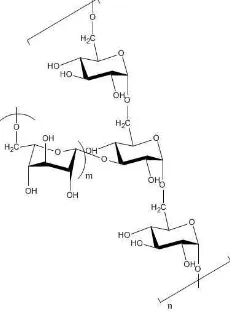
1. Dekstran
Dekstran merupakan polimer kompleks dari glukosa yang mengalami
percabangan dengan membentuk ikatan α-1,6 dan α-1,3 glikosidik. Dekstran yang
di biosintesis oleh bakteri asam laktat memiliki berat molekul yang besar antara
10-150 kDa. Dalam bidang kesehatan dekstran memiliki fungsi yang beragam
seperti anti inflamasi, anti trombotik, anti koagulan, hingga memiliki peran yang
penting sebagai intraarterial dan intravenous (Veronese and Caliceti, 2006).
Gambar 1. Struktur Dextran (Lapasin, 1999)
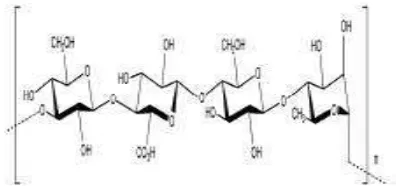
2. Kefiran
Kefiran merupakan kapsular polisakarida yang diproduksi oleh strain
Lactobacillus pada pembuatan susu fermentasi kefir. Struktur polimer kefiran
dibentuk dari monomer D-glukosa atau heteropolisakarida D-galaktosa yang
mengalami percabangan pada dua unit rantai serta delapan unit rantai. Polimer ini
Gambar 2. Struktur Kefiran (Micheli et al., 1999)
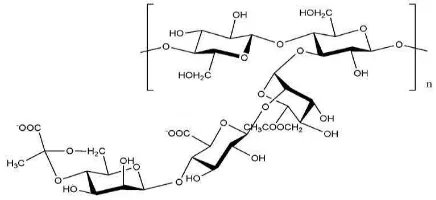
3. Gellan
Gellan merupakan polimer linier yang bermuatan negatif (anionik polisakarida).
Polimernya tersusun dari perulangan tetrasakarida unit yang merupakan
kombinasi antara dua molekul glukosa dengan asam D-glukoronat atau
L-ramnosa. Gellan biasanya digunakan untuk mensubtitusi agar, juga dapat
digunakan sebagai eksipien obat sebagai bagian dari drug delivery system (Vu et
al., 2009; Fialho et al., 2008).
Gambar 3. Struktur Gellan (Lapasin, 1999)
4. Curdlan
Curdlan merupakan polimer linier yang terbentuk dari ikatan β-1,3 glikosidik dari
D-glukosa. Polimer ini bersifat sangat larut dalam air. Curdlan dapat dihasilkan
dari bakteri strain Alcaligenes faecalis dan juga Agrobacterium. Keunikan
curdlan adalah sifat gelnya yang elastis ketika dipanaskan pada suhu di atas 55°C,
farmasi dijadikan sebagai polimer yang berfungsi sebagai eksipien drug delivery
(Rehm, 2009; Gumadi et al., 2005).
Gambar 4. Struktur Curdlan (Jin et al., 2006)
5. Xanthan
Xanthan merupakan heteropolimer anionik yang disusun oleh glukosa dengan
rantai samping trisakarida dari α-D-manosa yang memiliki gugus asetil. Xanthan
diproduksi oleh strain Xanthomonas dengan berat molekul yang sangat besar
(Rehm, 2009). Sifat yang ditunjukkan xanthan adalah pseudoplastik dan
pengemulsi yang stabil, sehingga kegunaannya sangat luas dibidang industri
makanan, kosmetik, maupun farmasi (Sutherland, 1998).
Gambar 5. Struktur Xanthan (Sutherland, 2001)
6. Alginat
Alginat merupakan homopolimer linier dari kopolimer D-manuronat yang
membentuk ikatan β-1,4-glikosidik dan epimer α-L-glukoronat. Alginat banyak
ditemukan pada tumbuh-tumbuhan terutama rumput laut. Dalam bidang farmasi
membentuk gel yang stabil. Sediaan bahan obat yang banyak beredar di pasaran
adalah kalsium alginat (Raymond, 2009).
Gambar 6. Struktur Alginat (Ertesvag, 1998)
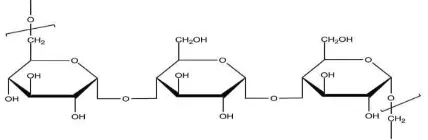
7. Pullulan
Pullulan merupakan polimer yang tersusun atas unit maltotriosa. Ikatan yang
terdapat pada unit maltotriosa adalah α-1,4-glikosidik, sedangkan unit-unit
maltotriosa dihubungkan dengan ikatan α-1,6-glikosidik. Penggunaan pullulan
yang paling dikenal adalah pada produk-produk yang berhubungan dengan
penyegar dan pembersih mulut (Raymond, 2009).
Gambar 7. Struktur Pullulan (Vu et al., 2009)
Polisakarida disekresikan kepermukaan sel atau dilepaskan ke lingkungannya
bersamaan dengan senyawa lipoprotein gabungan keduanya dikenal sebagai
glikokaliks (Ruas-Madiedo and Reyes-Gavila’n, 2005). EPS sebenarnya melekat
pada permukaan sel tetapi terjadi akumulasi yang berlebihan sehingga polimer ini
dapat diperoleh pada media cair pertumbuhan mikrobanya. Gambaran letak EPS
Gambar 8. Letak senyawa glikokaliks yang merupakan gabungan antara
lipoprotein (CPS) dan eksopolisakarida (EPS) pada bakteri gram
positif (kiri) dan bakteri gram negatif (kanan) (Ruas-Madiedo and
Reyes-Gavila’n, 2005)
B. Bakteri Asam Laktat
Bakteri asam laktat seperti Lactobacillus termasuk golongan organisme
food-grade yang memiliki status GRAS (Generally Recognized as Safe) dan diketahui
memproduksi sejumlah jenis molekul ekstraseluler polisakarida (EPS) yang
berkontribusi untuk tekstur pada makanan fermentasi. EPS dibagi dua golongan
yaitu homopolisakarida dan heteropolisakarida. EPS dari bakteri ini
memungkinkan pengembangan generasi baru dari food-grade polisakarida.
Bakteri asam laktat juga sering berkontribusi positif pada rasa, bau, atau
preservasi dari produk akhir (van Hijum et al., 2002; de Vuyst et al., 2001).
Beberapa jenis bakteri asam laktat penghasil EPS yang telah diteliti oleh beberapa
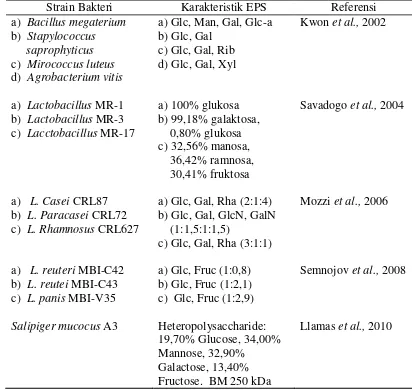
Tabel 1. Bakteri Asam Laktat yang Diteliti Mampu Menghasilkan EPS
Strain Bakteri Karakteristik EPS Referensi
a) Bacillus megaterium
Media yang digunakan untuk mengoptimalkan produksi EPS sangat beragam,
karena rantai utama dari polimer ini adalah glukosa. Banyak peneliti yang
menggunakan glukosa sebagai sumber karbon pada media fermentasi. Velasco et
al., (2006) menggunakan konsentrasi glukosa sebanyak 75 g/L untuk memperoleh
EPS sebanyak 1,08 g/L pada akhir fermentasi (120 jam) oleh bakteri Pediacoccus
parvulus 2.6. Sementara peneliti lainnya menggunakan konsentrasi glukosa
sebesar 30 g/L untuk menghasilkan EPS menggunakan isolat L. delbrueckii B-3,
selama masa inkubasi 18 jam masing-masing 255 mg/L, 224 mg/L, dan 174 mg/L
(Yuksekdag and Salim, 2008). Xu et al. (2010) menggunakan media modifikasi
yang dinamakan Chemically Defined Medium (CDM) yang mengandung 50 g/L
sukrosa dan beberapa mineral menghasilkan EPS sebesar 238,23 mg/L selama
fermentasi 48 jam menggunakan isolat L. paracasei. Beberapa kondisi fermentasi
untuk menghasilkan EPS disajikan pada Tabel 2.
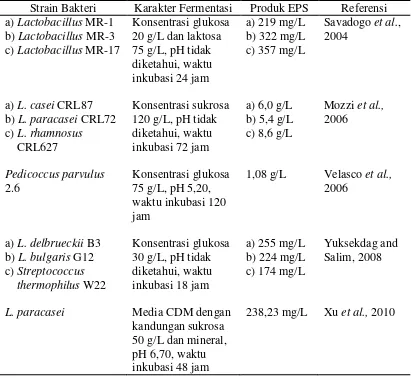
Tabel 2. Kondisi Fermentasi untuk Menghasilkan EPS
Strain Bakteri Karakter Fermentasi Produk EPS Referensi
a) Lactobacillus MR-1
b) Lactobacillus MR-3
c) Lactobacillus MR-17
a) L. casei CRL87
Sumber kabon yang digunakan pada penelitian tersebut merupakan gula-gula
lignoselulosa yang banyak terdapat pada limbah pertanian. Satria dkk. (2010)
melakukan degradasi lignoselulosa dari jerami padi menggunakan isolat
Actinomycetes AcP-1 dan AcP-7 dan berhasil memperoleh kandungan gula
pereduksi total sebesar masing-masing dengan kisaran 20,65-27,51 g/L dan
20,98-22,80 g/L dengan fermentasi fase padat. Sementara penelitian lanjutan (belum
dipublikasikan) menggunakan fermentasi cair dengan kandungan substrat jerami
padi sebesar 30% mampu menghasilkan gula pereduksi total pada kisaran
50,55-67,45 g/L. Sumber gula ini berpotensi untuk digunakan sebagai sumber media
yang dapat menghasilkan EPS menggunakan isolat-isolat bakteri asam laktat
isolat lokal yang sedang dikerjakan.
C. Viskositas
Viskositas adalah ukuran kekentalan fluida yang menyatakan besar-kecilnya
gesekan di dalam fluida. Semakin besar viskositas fluida, maka semakin sulit
suatu benda bergerak di dalam fluida tersebut. Di dalam zat cair, viskositas
dihasilkan oleh gaya kohesi antara molekul zat cair. Sedangkan dalam gas,
viskositas timbul sebagai akibat tumbukan antara molekul gas. Dalam suatu
fluida ideal (fluida tidak kental) tidak ada viskositas (kekentalan) yang
menghambat lapisan-lapisan fluida ketika lapisan-lapisan tersebut menggeser satu
di atas lainnya. Untuk fluida yang sangat kental seperti madu, diperlukan gaya
yang lebih besar, sedangkan untuk fluida yang kurang kental (viskositasnya kecil),
seperti air, diperlukan gaya yang lebih kecil.
Tingkat kekentalan suatu fluida juga bergantung pada suhu. Semakin tinggi suhu
suatu zat gas, semakin kental zat gas tersebut. Tingkat kekentalan fluida
dinyatakan dengan koefisien viskositas. Jika fluida makin kental maka gaya tarik
yang dibutuhkan juga makin besar. Dalam hal ini, gaya tarik berbanding lurus
dengan koefisien kekentalan.
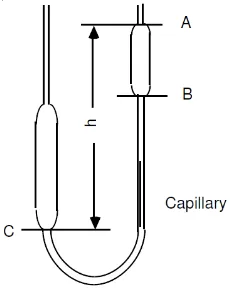
Gambar 9. Viskometer Ostwald`(Moechtar,1990).
Viskositas terbagi tiga jenis yaitu viskositas spesifik (ɳsp), kinematik, dan intrinsik
(ɳ). Viskositas spesifik dihitung berdasarkan perbandingan antara kecepatan
aliran suatu larutan dengan pelarutnya. Viskositas kinematik diperoleh dengan
mempertimbangkan densitas larutan. Viskositas spesifik dan kinematik
dipengaruhi oleh konsentrasi larutan. Viskositas intrinsik dihitung dari
perbandingan antara viskositas spesifik dengan konsentrasi larutan (ɳsp/C) di
ekstrapolasi sehingga nilai konsentrasi larutan mendekati nol. Dengan demikian
nilai kelarutan tidak berpengaruh terhadap viskositas intrinsik (Hwang et al.,
1997).
Viskositas dari larutan polimer bergantung pada konsentrasi dan ukuran (berat
molekul) dari polimer terlarut. Untuk menghitung viskositas suatu larutan kita
harus mengetahui tentang berat molekul larutan polimer tersebut. Teknik
sederhana. Salah satu alat untuk mengukur viskositas suatu larutan dapat
digunakan viskometer sederhana, dengan menghitung waktu alir dan densitas
larutan (Parthasarathi, 2011).
D. Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi Cair Kinerja Tinggi (KCKT) merupakan salah satu metode kimia
dan fisikokimia. KCKT termasuk metode analisis terbaru yaitu suatu teknik
kromatografi dengan fasa gerak cairan dan padat. Banyak kelebihan metode ini
jika dibandingkan dengan metode lainnya (Snyder and Kirkland, 1979; Johnson
and Stevenson, 1978).
Kelebihan-kelebihan dari KCKT yaitu:
1. Cepat
Waktu analisis umumnya kurang dari 1 jam. Banyak analisis yang dapat
diselesaikan sekitar 15-30 menit. Untuk analisis yang tidak rumit, waktu
analisis kurang dari 5 menit bisa dicapai.
2. Resolusi
Berbeda dengan kromatografi gas, kromatografi cair mempunyai dua rasa
dimana interaksi selektif dapat terjadi. Pada kromatografi gas, gas yang
mengalir sedikit berinteraksi dengan zat padat, pemisahan terutama
dicapai hanya dengan fasa diam. Kemampuan zat padat berinteraksi
secara selektif dengan fasa diam dan fasa gerak pada KCKT memberikan
3. Sensitivitas detektor
Detektor absorbsi UV yang biasa digunakan dalam KCKT dapat
mendeteksi kadar dalam jumlah nanogram (10-9 g) dari bermacam-macam
zat. Detektor-detektor Fluoresensi dan Elektrokimia dapat mendeteksi
jumlah sampai pikogram (10-12 g). Detektor-detektor seperti
Spektrofotometer Massa, Indeks Refraksi, Radiometri, dapat juga
digunakan dalam KCKT.
4. Kolom yang dapat digunakan kembali
Berbeda dengan kolom kromatografi klasik, kolom KCKT dapat
digunakan kembali. Banyak analisis yang bisa dilakukan dengan kolom
yang sama sebelum dari jenis sampel yang diinjeksi, kebersihan dari
solven yang digunakan.
5. Ideal untuk zat bermolekul besar dan berionik
Zat-zat yang tidak bisa dianalisis dengan kromatografi gas karena
volatilitas rendah, biasanya diderivatisasi untuk menganalisis spesies
ionik. KCKT dengan tipe eksklusi dan penukar ion ideal sekali untuk
analisis zat-zat tersebut.
6. Sampel dapat diperoleh kembali
Umumnya detektor yang digunakan dalam KCKT tidak menyebabkan
destruktif (kerusakan) pada komponen sampel yang diperiksa, oleh karena
itu komponen sampel tersebut dapat dengan mudah dikumpulkan setelah
melewati detektor. Solvennya dapat dihilangkan dengan diuapkan, kecuali
Berdasarkan polaritas relatif fasa gerak dan fasa diamnya, KCKT dibagi menjadi
dua, yaitu fasa normal yang umumnya digunakan untuk identifikasi senyawa
nonpolar sehingga fasa gerak yang digunakan kurang polar dibandingkan fasa
diam dan fasa terbalik yang umumnya digunakan untuk identifikasi senyawa
polar, menggunakan fasa gerak lebih polar dibandingkan fasa diam (Gritter dkk,
1991). Prinsip pemisahan senyawa menggunakan KCKT adalah perbedaan
distribusi komponen diantara fasa diam dan fasa geraknya. Semakin lama
III. METEDOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan dari bulan Maret sampai bulan Nopember 2013
di Laboratorium Instrumentasi dan Laboratorium Biokimia Jurusan Kimia FMIPA
Universitas Lampung.
B. Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini antara lain autoklaf merek Speed
Clave Model S-90 N, Laminar air flow CRUMA model 9005-FL, inkubator
merek P-Selecta, Spektrofotometer UV-VIS merek Agilent Cary 100, shaker
merek Stuart model SSL2, Kromatografi Cair Kinerja Tinggi (KCKT) FLD &
RID merek KNAUER, viskometer Ostwald, sentrifugasi, freeze drying, oven,
rotary evaporator, lemari pendingin, neraca analitik, jarum ose, magnetic stirrer,
penangas air, effendroft dan tip, pH meter, dan peralatan gelas laboratorium
lainnya.
Bahan-bahan yang digunakan adalah media inokulum Yeast Maltosa Cair (YM),
media deMan, Ragosa, and Sharpe (MRS) Cair, buffer fosfat, buffer asetat, asam
sulfat (H2SO4), fenol 5%, natrium klorida (NaCl), asam asetat (CH3COOH) 0,5M,
trikloroasetik (TCA), air suling dan kertas saring. Sampel yang digunakan yaitu
limbah jerami padi dan susu kambing segar berasal dari Batang Hari, Lampung
Timur.
C. Prosedur Penelitian
1. Pembuatan Media dan Pereaksi
a. Pembuatan Larutan Garam Fisiologis (NaCl 0,85%)
Sebanyak 0,85 g NaCl dilarutkan dengan air suling hingga volume
100 ml.
b. Pembuatan Media Inokulum Yeast Maltosa Cair (YM)
Medium YM terdiri dari 4 g ekstrak khamir, 10 g ekstrak malt, 15
g glukosa per 1 liter media, kemudian diautoklaf selama 15 menit
pada suhu 121ºC dan tekanan 1 atm.
c. Pembuatan Media de Man, Rogosa, Sharpe (MRS) Cair
Media MRS sebanyak 52 g dilarutkan dalam 1 L air suling yang
dipanaskan pada suhu 60°C. Diaduk sampai tercampur, kemudian
diautoklaf selama 15 menit pada suhu 121°C dan tekanan 1 atm.
d. Pembuatan Pereaksi DNS
Larutan A: 3 g NaOH; 0,6 g fenol; 3 g DNS dalam 240 mL air
suling.
Larutan B: 0,25 g Na-sulfit; 2 g Na-K-tartrat dan 5 mL air suling.
Sebanyak 3 mL larutan B ditambahkan pada 240 mL larutan A dan
e. Pembuatan Buffer Fosfat
1) Larutan Stok A (NaH2PO4.H2O 0,2M)
Sebanyak 27,8 g NaH2PO4·H2O dilarutkan dengan air
suling hingga volume 1000 mL.
2) Larutan Stok B (Na2HPO4·2H2O 0,2M)
Sebanyak 35,6 g Na2HPO4.2H2O dilarutkan dengan air
suling hingga volume 1000 mL.
f. Pembuatan Buffer Asetat
1) Larutan Stok A (CH3COOH 0,2M)
Sebanyak 11,36 mL CH3COOH dilarutkan dengan air
suling hingga volume 1000 mL.
2) Larutan Stok B (CH3COONa 0,2M)
Sebanyak 16,4 g CH3COONa dilarutkan dengan air suling
hingga volume 1000 mL.
2. Pembuatan Inokulum
Inokulum isolat Actinomycetes AcP-1 dan Acp-7 dibuat menggunakan
media yeast maltosa cair (YM) dengan komposisi 4 g ekstrak khamir
ditambahkan 10 g ekstrak malt dan 15 g glukosa dalam 1 liter media,
kemudian disterilkan pada suhu 121ºC dengan tekanan 1 atm selama 15
menit. Kedalam 10 mL media inokulum diinokulasikan 1 ose isolat dan
3. Fermentasi Jerami Padi
Sebanyak 10 mL inokulum isolat Actinomycetes AcP-1 dan AcP-7 yang
telah ditumbuhkan pada media YM selama 96–120 jam diinokulasikan ke
dalam media fermentasi steril yang berisi 10 g substrat jerami padi hasil
bio-pretreatment dengan ukuran ± 40 mesh, yang telah ditambahkan
dengan 30 mL buffer fosfat pH 7,5 sebagai moisture (pelembab),
kemudian diinkubasi sampai dengan 21 hari (Beg et al., 2000). Kultur
dilakukan dengan menggunakan wadah kaca dengan memperhatikan sisa
ruang di atasnya untuk memberikan suasana fakultatif aerobik. Setelah
periode fermentasi dilakukan pemanenan dengan cara penambahan 100
mL akuades yang telah disterilkan kemudian diaduk, dan disaring untuk
mendapatkan filtrat yang akan digunakan sebagai media pada sintesis EPS.
4. Analisis Gula pada Media Filtrat
Filtrat yang diperoleh dianalisis kandungan gula pereduksi total.
Kandungan gula pereduksi diukur menggunakan prosedur DNS (Miller,
1959). Sebanyak 1,5 mL filtrat ditambahkan 1,5 mL pereaksi DNS dan
dipanaskan pada 100°C selama 15 menit lalu didinginkan pada suhu
ruang. Larutan hasil reaksi diukur absorbansinya pada λ 540 nm,
menggunakan spektrofotometer. Komponen gula pada filtrat dianalisis
dengan menggunakan KCKT dengan kondisi reaksi pengukuran sebagai
berikut:
Kolom : Karbohidrat
Detektor : Indeks bias
Konsentrasi standar : 400 ppm
Volume injeksi : 10-20 µL
Temperatur kolom : Suhu ruang
Standar yang digunakan adalah glukosa dan xilosa yang berkualifikasi
proanalisa.
5. Seleksi Bakteri Asam Laktat Penghasil EPS
Isolat-isolat bakteri asam laktat diperoleh dari penapisan bakteri asam
laktat dari susu kambing segar. Sampel diencerkan dengan seri
pengenceran 100 sampai 10-6 kali lalu sebanyak 100 µL secara aseptis
ditebar ke atas media MRS agar (difco). Media diinkubasi selama 18-24
jam pada suhu 37°C. Koloni yang diperoleh dimurnikan untuk
mendapatkan galur murni. Seleksi dilakukan pada media MRS yang
diperkaya dengan susu skim (90 g/L), isolat diambil secara aseptis
menggunakan tusuk gigi steril dan ditumbuhkan kepermukaan media.
Setelah inkubasi selama 24 jam pada suhu 30°C koloni yang tumbuh
diseleksi berdasarkan fenotip yang ditunjukkan. Isolat-isolat yang
menunjukkan aktivitas positif menghasilkan EPS secara fenotip tampak
ropy dan mucoid. Isolat-isolat yang menunjukkan aktivitas positif
menghasilkan EPS diinokulasikan ke dalam 10 mL media MRS cair
(Kimmel and Robert, 1988) dan diinkubasi secara aerobik selama 24-48
jam pada suhu 37°C. Setelah masa inkubasi sel dipisahkan dengan cara
disentrifugasi, 1 mL filratnya ditambahkan 2 mL etanol yang telah
didinginkan (van Geel-schutten et al., 1998). Isolat yang positif
penambahan etanol dingin pada filtrat. Secara kualitatif EPS yang
terbentuk ditimbang setelah dikeringkan menggunakan freeze drying.
Isolat yang menghasilkan EPS terbanyak akan digunakan untuk
memproduksi EPS pada tahap selanjutnya.
6. Optimasi Produksi EPS Skala Laboratorium
Media hasil fermentasi jerami padi oleh Actinomycetes dikarakterisasi
kandungan gula, jenis gula, dan pHnya. Optimasi yang akan dilakukan
adalah pengaruh pH awal media dengan memberikan pH awal fermentasi
4,0;4,5;5,0;5,5; 6,0; dan 6,5 yang diatur menggunakan buffer asetat.
Sebanyak 100 mL media diinokulasikan dengan 1 mL inokulum bakteri
asam laktat (18-24 jam kultur) yang telah dipersiapkan sebelumnya lalu
diinkubasi secara aerobik pada suhu 37°C selama 48 jam. Pertumbuhan
sel diketahui dengan melakukan sub-sampling setiap 2 jam mulai jam ke 6
inkubasi hingga diperoleh jumlah sel yang mulai menurun (fase kematian).
Pertumbuhan sel dilihat menggunakan spektrofotometer dengan mengukur
OD pada λ 610 nm. Hasil yang diperoleh diplotkan ke dalam bentuk
grafik untuk mengetahui fase pertumbuhan sel dikaitkan dengan waktu
inkubasi. EPS yang dihasilkan selama fermentasi diukur dengan
melakukan sub-sampling pada mulai jam ke 12 setiap 4 jam sekali.
Sebanyak 2 mL media hasil sub-sampling disentrifugasi lalu filtratnya
ditambahkan 4 mL etanol yang telah didinginkan lalu disimpan pada suhu
dingin. EPS akan terlihat seperti lapisan gel, kemudian dikeringkan
menggunakan freeze drying. Secara kuntitatif EPS ditimbang lalu hasil
produksi EPS oleh bakteri asam laktat pada media. Sehingga diperoleh
informasi pH optimum.
7. Isolasi dan Pemurnian EPS
Isolasi dan pemurnian EPS mengikuti prosedur yang dilakukan oleh
Garicia dan Marshall (1991). Sel bakteri asam laktat dipisahkan dengan
cara sentrifugasi, filtrat yang diperoleh ditambahkan 1/3 volume 40%
asam trikloroasetik (TCA) untuk mengendapkan protein, lalu
disentrifugasi dengan kecepatan 10.000 rpm selama 20 menit pada suhu
4°C. Supernatan yang diperoleh dipekatkan dengan menggunakan rotary
evaporator, EPS diperoleh dengan menambahkan 3x volume etanol dingin
atau aseton dingin dan dibiarkan selama satu malam pada suhu dingin.
EPS akan mengendap dan dipisahkan dengan filtratnya lalu dikeringkan
dengan menggunakan freeze drying. Secara kuantitatif berat EPS yang
diperoleh ditimbang untuk mengetahui perolehan rendemen hasil produksi.
8. Karakterisasi EPS
a. Pengukuran Berat Molekul Berdasarkan Metode Viskometri
Viskositas EPS diukur menggunakan viskometer Ostwald.
Sebanyak 0,1 g EPS dilarutkan dalam 100 mL asam asetat 0,5M,
kemudian diambil sebanyak 5 mL dan dimasukkan ke dalam
viskometer Ostwald untuk ditentukan waktu alirnya. Pengukuran
dilakukan dengan konsentrasi berbeda dan waktu alir dibaca
dengan tiga kali pengulangan (Tarbojevich and Cosani, 1996).
Viskositas relatif : � =
0 ≈
Viskositas spesifik : ɳ � = ɳ − 1
Viskositas kinematika : ɳ���= × ����
Keterangan:
kkin = koefisien kinematika ostwald (9,671 x 10-3 cSt per detik)
t = waktu alir larutan sampel (detik) t0 = waktu alir pelarut (detik)
Berat molekul EPS diukur berdasarkan viskositas intrinsik (ɳ).
Data yang diperoleh dipetakan pada grafik ɳsp/C terhadap C.
Viskositas intrinsik adalah titik pada grafik yang menunjukkan
nilai C = 0. Berat molekul ditentukan berdasarkan persamaan
Mark-Houwink (Hwang et al., 1997) yaitu:
� =���
Keterangan:
[ɳ] = viskositas intrinsik
k = konstanta pelarut (k = 3,5 × 10-4 mL/g)
α = konstanta (α = 0,76) M = berat molekul
b. Analisis Kandungan Gula Pereduksi Total
Sebanyak 40,0 mg EPS ditambahkan ke dalam 1 mL air suling
dalam tabung ulir kaca lalu ditambahkan 2 N H2SO4 sampai larut
dan dipanaskan pada suhu 100°C selama 2 jam. Analisis total gula
pereduksi dilakukan menggunakan metode Dubois (Dubois et al.,
V. SIMPULAN DAN SARAN
A. Simpulan
Dari hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa:
1. Kondisi fermentasi yang optimum untuk EPS adalah dengan menggunakan
media fermentasi yang mengandung larutan sukrosa 5%, dengan waktu
inkubasi 48 jam, pada pH 6, dan menghasilkan EPS sebesar 2,51 mg/mL.
2. Karakterisasi EPS yang dihasilkan:
a. Pengukuran viskositas EPS menghasilkan viskositas intrinsik [ɳ] sebesar
2,117 mL/g dan berat molekul EPS yang didapat sebesar 94592,99 g/mol.
b. Pengukuran kandungan gula total dengan metode Dubois, menghasilkan
kadar glukosa 32,64 mg/mL untuk isolat LbK-19.
B. Saran
Berdasarkan hasil penelitian yang telah diperoleh, maka untuk penelitian
selanjutnya disarankan untuk mengoptimasikan waktu inkubasi isolat LbK-19
agar mendapatkan waktu yang lebih optimum. Mempelajari lebih lanjut
karakterisasi EPS yang dihasilkan secara kimia dan mempelajari tentang
DAFTAR PUSTAKA
Anindyawati, T. 2010. Potensi selulase dalam mendegradasi lignoselulosa limbah pertanian untuk pupuk organik. Berita Selulosa. 45:70-77.
Beg, Q.K., M. Kapoor, K. Mahajan, G.S. Hoondal. 2000. Microbial Xylanases and their industrial applications: a review. Appl. Microbiol. Biothecnol.
56:326-338.
Bradford, Marion M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72:248-254.
Bhaskar, P.V. and N.B. Bhosle. 2005. Microbial extracelluler polymeric substances in marine biogeochemical process. Current Sci. 88:45-53.
Clark, J. 2007. Kromarografi Cair Kinerja Tinggi (KCKT). http://www.Chem-is-try.org diakses pada tanggal 04 Maret 2013. 10.07 WIB.
De Vuyst, L., F. De Vin, F. Vaningelgem, and B. Degeest. 2001. Recent developments in the biosynthesis and applications of
heteropolysaccharides from lactic acid bacteria. Int.Dairy J. 11:687-708.
Duboc, P., B. Mollet. 2001. Application of exopolysaccharides in the dairy industry. Int. Dairy J. 11:759-768.
Dubois, M., K.A. Gilles, J.K. Hamilton, P.A. Rebers, and F. Smith. 1956. Colorimetric method for determination of sugar and related substances.
Anal.Chem. 28:350-356.
Ekawati, I. 2008. Dekomposisi Komponen Lignoselulosa Jerami Padi oleh Beberapa Isolat Bakteri. J. Natural vol.7.
Ertesvåg, H., S. Valla. 1998. Biosynthesis and applications of alginates. Polym.
Degrad. Stab. 59:85-91.
Frengova, G.I., E.D. Simova, D.M. Besshkova, and Z.I. Simo. 2002.
Exopolysaccharides prodeced by Lactic acid bacteria of Kefir Grains. Z Naturforsh. 57c:805-810.
Garcia-Garibay, M., M. Marshall. 1991. Polymer production by Lactobacillus
delbrueckii bulgaris.J. Appl. Bacteriol. 70:325-328.
Gritter, R.J., Bobbit J.M., dan Schwarting A.E. 1991. Pengantar Kromatografi. Terbitan kedua. Diterjemahkan oleh Kosasih Padmawinata. Bandung. ITB. Hal 108-109, 160-179.
Gummadi, S.N., K. Kumar. 2005. Production of extracelluler water insoluble β -1,3-glucan (curdlan) from Bacillus sp. SN07. Biotechnol. Bioprocess Eng. 10:546-551.
Howard, R.L., E. Abotsi, E.L. Jansen van Rensburg, S. Howard. 2003. Lignocellulose biotechnology: issues of bioconversion and enzyme production. Afr. J. Biotechnol. 2:602-619.
Hwang, J.K., S.P. Hong, and C.T. Kim. 1997. Effect of molecular weight and NaCl concentration on dilute solution properties of chitosan. J. Food
Sci.Nutr. 2:1-5.
Jin, Y., H. Zhang, Y. Yin, K. Nishinari. 2006. Conformation of curdlan as observed by tapping mode atomic force microscopy. Colloid Polym. Sci. 284:1371-1377.
Johnson, E. L. and R. Stevenson. 1978 . Basic liquid chromatography. Varian. California
Kimmel, S. A. and R.F.Roberts. 1998. Development of a growth medium suitable for exopolysaccharide production by Lactobacillus delbrueckii ssp.
bulgaricus RR. Int. J. Food Microbiol. 40:87–92.
Kwon, K.K., H.S. Lee, Jung Sung-Young, J.H. Yim, J.H. Lee, H.K. Lee. 2002. Isolation and identification of biofilm-forming marine bacteria on glass surfaces in Dae-Ho Dike, korea. The J. of Microbiol. 4:260-266.
Lapasin, R.,and S. Pricl. 1999. Rheology of industrial polysaccharides: Theory and applications. Aspen Publisher: New York. USA. pp.1-118.
Llamas, I., J.A. Mata, R. Tallon, P. Philippe Bressollier, M.C. Urdaci, E. Quesada, V. Béjar. 2010. Characterization of the exopolysaccharide produced by
Salpiger mucosus A3T, a halophilic species belonging to the
Alphaproteobacteria, isolated on the Spanish Mediterranean Seaboard.
Malik, A., D.M. Ariesanti, A. Nurfactiyani, A. Yanuar. 2008. Skrining gen glukosiltransferase (gtf) dari bakteri asam laktat penghasil
eksopolisakarida. Makara Sains. 12:1-6.
Micheli, L., D. Uccelletti, C. Palleschi, V. Crescenzi. 1999. Isolation and characterisation of a ropy Lactobacillus strain producing the exopolysaccharide kefiran. Appl.Environ. Microbiol. 53:69-74.
Miller, G.I. 1959. Dinitrosalicylic assay. Analytical Chemistry. 31:426-428.
Mozzi, F., G. Rollán, G.S. de Giori, and G.F. de Valdez. 2006. Effect of galactose and glucose on the exopolysaccharide production and the activities of biosynthetic enzymes in Lactobacillus casei CRL87.
J.Appl.Microbiol. 91:160-167.
Moechtar. 1990. Farmasi Fisik. UGM-Press. Yogyakarta.
Noermala, S.R., Purbowatiningrum, R.S., Nies, S.M. 2013. Aktivitas Fusarium
oxysporum dalam Menghidrolisis Eceng Gondok (Eichhornia crassipes)
dengan variasi Temperatur. 1: 220-225.
Parthasarathi, S., K. Saravanakuamr, R. Baskaran, T.R. Kubendran. 2011. A volumetric and viscosity study for the binary mixtures of
dimethylsulfoxide with benzen, ethyl benzene, chlorobenzene and bromobenzene at temperatures of (303.15, 308.15 and 313.15) K and a Pressure of 0,1MPa. Int. J. of Sci. And Technol. Vol. 1. 2:96-101.
Raymond, R. 2009. “Adipic Acid”, Handbook of Pharmaceutical Excipients. pp.11-12.
Rehm, B. 2009. Microbial exopolisaccharides: Variety and potential applicatoins. In Microbial production of biopolymers and polymer
precursors: applications and perspectives. Caister Academic: Norfolk,
UK. pp. 229-254.
Rohaeti, E., R. Heryanto, M. Rafi, A. Wahyuningrum, dan L.K. Darusman. 2011.
Prediksi kadar flavonoid total tempuyung (Sonchus arvensis L.)
Menggunakan kombinasi spektroskopi IR dengan Regresi kuadrat terkecil parsial. J. Kimia. 5:101-108.
Ruas-Mediedo, P. And C.G. de Los reyes-Gavilan. 2005. Invited review: methods for the screening, isolation, and characterization of
exopolysaccharides produced by lactic acid bacteria. J. Dairy Sci. 88:843-856.
Satria, H., Nurhasanah, F. Martasih. 2010. Aktivitas selulase isolat
Actinomycetes terpilih pada fermentasi padat jerami padi. Proseeding
Savadogo, A., C.A.T. Outtara, P.W. Savadogo, N. Barro, A.S. Outtara, A.S. Traore. 2004. Identification of exopolysaccharides-producing lactic acid bacteria from Burkina faso fermented milk samples. Afr. J. Biothecnol. 3:189-194.
Semnojovs, P., J. Jasko, L. Auzina, P. Zikmanis. 2008. The use of
exopolysaccharides-production cultures of lactic acid bacteria to improve the functional value of fermented food. J. Food Technol. 6:101-109.
Silverstein, R.M., G.C. Basseler, dan T.C. morril. 1986. Penyelidikan
Soektrimerik senyawa organik. Edisi keempat. Alih bahasa. A.J.Hatono
dan Purba A.V. Erlangga. Jakarta. Hal: 17-33.
Singha, T.K. 2012. Microbial extracelluler polymeric substances: Production, Isolation and Applications. IOSR. J of Pharm. 2:276-281.
Snyder, L.R. and J.J. Kirkland. 1979. Introduction to modern liquid
chromatography. Second edition. John Wiley & Sons Inc. New York. Chihester. Briebane. Toronto. Singapore.
Stuart, B. 2004. Infrared Spectroscopy: Fundamentals and Applications. John Willey & Sons. Ltd.
Surekha, K.S., G.B. Arun, A.C. Balu, M.B. Ibrahim, and K.D. Prashant. 2010. Biosurfactants, bioemulsifiers and exopolisaccharides from marine microorganisms. J. Biotechnol. Adv. 28:436-450.
Suresh and Mody. 2009. Microbiol Exopholysaccharides: Variety and Potential Applications Microbial Production of Biopolymer and Polymer Precursors. Caister Academic Press. USA.
Sutherland, I.W. 2001. Microbial polysaccharides from Gram-negative bacteria.
Int. Dairy J. 11:663-674.
Sutherland, I.W. 1998. Novel and established application of microbial polysaccharides. Trends Biotechnol. 16:4146.
Tarbojevich, M., & Cosani, A. 1996. Molecular weight determination of chitin and chitosan. Di dalam Muzarelli RAA & Peter MG (Editor) 1997. Chitin
Handbook. Ancona: European chitin society 85-108.
van Hijum. S.A.F.T., G.H. van Geel-Schuten, H. Rahaouni, M.J.E.C. van der Maarel, and L. Dijkhuizen. 2002. Characterizazion of a novel
fructosiltransferase from Lactobacillus reuteri that synthesizes high-moleculer-weight inulin and inulin oligosaccharides. Appl. And Env.
Van Geel-Schutten, G.H., F. Flesch, B. ten Brink, M.R. Smith, and L. Dijkhuizen. 1998. Screening and characterization of Lactobacillus strains producing large amounts of exopolysaccharides. Appl. Microbiol. Biotechnol. 50:697–703.
Velasco, S., E. Arskold, M. Paese, H. Grage, A. Irastorza, P. Radstrom, E.W.J. van Niel. 2006. Environmental factor influencing growth of and
exopolysaccharide formation by Peddiococcus parvullus 2.6. Int. J. Food
Microb. 111:252-258.
Veronese, F.M., P. Caliceti. In: Meibohm (Editor). 2006. Pharmacokinetics and Pharmacodynamics of Biotech Drugs: Principles and Case Studies in Drus Development. Wiley CH. Weinhem. pp 272-273.
Vu, B, M. Chen, R.J. Crawford, and E.P. Ivanova. 2009. Bacterial extracelluler polysaccharides involved in biofilm formation. Molecules. 14:2535-2554.
Xu, R., S. Ma, Y. Wang, L. Liu, and P. Li. 2010. Screening, identification and statistic optimatization of a novel exopolysaccharide producing
Lactobacillus paracasei HTC. Afr. J. of Microbiol Research. 4:783-795.
Yuksekdag, Z.N. and B. Salim. 2008. Influence of different carbon sources on exopolysaccharide production by Lactobacillus delbruekii sub sp
bulgaricus (B3, G12) and Streptococcus thermophilus (W22).
Lampiran 1
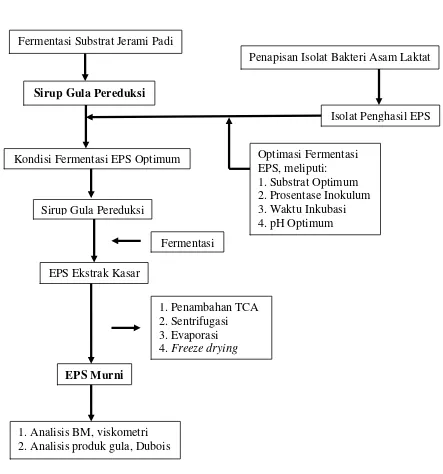
Gambar 20. Skema Tahapan Penelitian Fermentasi Substrat Jerami Padi
Sirup Gula Pereduksi
Penapisan Isolat Bakteri Asam Laktat
Isolat Penghasil EPS
Kondisi Fermentasi EPS Optimum Optimasi Fermentasi EPS, meliputi: 1. Substrat Optimum 2. Prosentase Inokulum 3. Waktu Inkubasi 4. pH Optimum Sirup Gula Pereduksi
EPS Ekstrak Kasar
Fermentasi
EPS Murni
1. Penambahan TCA 2. Sentrifugasi 3. Evaporasi
4. Freeze drying
Lampiran 2
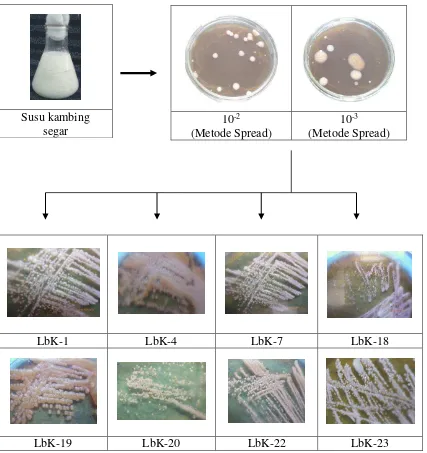
Susu kambing segar
LbK-1 LbK-4 LbK-7 LbK-18
LbK-19 LbK-20 LbK-22 LbK-23
Gambar 21. Sampel Susu Kambing Segar dan Isolat Bakteri Asam Laktat 10-2
(Metode Spread)
10-3
Lampiran 3
Tabel 5. Hasil Pengukuran Berat EPS yang dihasilkan
No. Nama Isolat
Berat EPS (mg/mL)
MRS + Larutan sukrosa Media Fermentasi
2% 5%
1 LbK-1 1,70 2,13 2,54
2 LbK-4 2,00 2,43 3,70
3 LbK-7 1,37 1,90 3,44
4 LbK-18 1,73 2,67 3,28
5 LbK-19 2,03 2,50 4,20
6 LbK-20 1,93 2,06 3,44
7 LbK-22 1,93 2,70 4,04
Lampiran 4
Tabel 6. Optimasi pH Awal Media MRS Broth (Larutan Sukrosa 5%)
No. Kode pH berat EPS (mg/mL)
1 4,0 0,853
2 4,5 1,835
3 5,0 2,531
4 5,5 2,416
5 6,0 2,607
6 6,5 2,312
Tabel 7. Optimasi Waktu Inkubasi Bakteri Isolat LbK-19
No Jam ke - OD (λ 610 nm)
1 0 0,6805
2 8 0,7833
3 16 2,4561
4 24 4,1434
5 32 4,1583
6 40 4,1643
7 48 4,1797
8 56 4,1651
9 64 3,9871
Lampiran 5
Tabel 8. Uji Viskositas dan Penentuan Bobot Molekul Eksopolisakarida (EPS)
Konsentrasi
Dari perhitungan di atas,dibuat kurva hubungan antara ɳsp/c dengan c sehingga
diperoleh persamaan:
lnɳ� = [ɳ]+ ′[ɳ]
y a b x
Viskositas intrinsik : [ɳ]= (ɳ� ⁄ )�
=
Bobot molekul EPS dihitung menggunakan persamaan Mark-Houwink:
ɳ = �
Dengan menggunakan model regresi linier diperoleh persamaan:
lnɳ� = [ɳ]+ ′[ɳ] sama dengan y = 8,375x + 0,750
untuk rumus ɳ = � , maka 0,750 = 3,5 x 10-4 M0,76
sehingga diperoleh M = 94592,99 g/mol.
y = 8.3753x + 0.7506 R² = 0.9699
ln ns
p/c
Konsentrasi
Lampiran 6
Tabel 9. Penentuan Kurva Standar Glukosa
Konsentrasi Glukosa
(mg/mL) Absorbansi
0 0
0,1 0,1691
0,2 0,3703
0,3 0,4573
0,4 0,5554
0,5 0,7176
x 0,4837
y = 1.3811x + 0.033 R² = 0.9827
Ab
so
rbans
i
Konsentrasi Glukosa (mg/mL)
Persamaan kurva standar:
= +
Dimana;
a = 0,033
b = 1,381
Absorbansi sampel (y) = 0,4837
Sehingga,
= , + ,
, = , + ,
= , , − ,
= ,
Karena sampel awal di lakukan pengenceran 100 kali, maka:
= , ×
= , × = , /