INDUKSI MATURASI GONAD, OVULASI DAN PEMIJAHAN
PADA IKAN TORSORO (Tor soro) MENGGUNAKAN
KOMBINASI HORMON
EKO RINI FARASTUTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
DenganinisayamenyatakanbahwaTesisberjudulInduksi Maturasi Gonad, Ovulasi dan Pemijahan Ikan Torsoro (Tor soro)Menggunakan Kombinasi Hormonadalahbenarkaryasayadenganarahandarikomisipembimbingdanbelumdiaju kandalambentukapa pun kepadaperguruantinggimana pun. Sumberinformasi yang
berasalataudikutipdarikarya yang
diterbitkanmaupuntidakditerbitkandaripenulislaintelahdisebutkandalamteksdandic antumkandalamDaftarPustaka di bagianakhirTesisini.
DenganinisayamelimpahkanhakciptadarikaryatulissayakepadaInstitutPertani an Bogor.
Bogor, Februari 2014
Eko Rini Farastuti
SUMMARY
EKO RINI FARASTUTI. Induction of Gonad Maturation, Ovulation and Spawn in Torsoro (Tor soro) used Hormon Combination. Supervised by AGUS OMAN SUDRAJAT and RUDHY GUSTIANO.
Torsoro fish populations continue to decline due to overfishing and habitat destruction on the natural environment. Artificial breeding of fish has to do with hormonal stimulation, but the results are not optimal. The purpose of this study was to manipulate the reproduction of fish Torsoro through induction of gonadal maturation, ovulation, and spawning to increase the success of artificial breeding. Research on the induction of gonadal maturation performed by Oodev.Oodev containing PMSG and antidopamin that functions as a hormone regulator that works to stimulate the target organs (hypothalamic-pituitary-gonadal) for the initial development of the gonads. Induction of final maturation (final maturation) and spawning is done by using some hormones and their combinations; sGnRH (D-Arg6, Trp7, Leu8, Pro9Net)-LH-RH and 10 mg of domperidone (ovaprim), aromatase inhibitors and oytocin.
Females Torsoro size 750-800 grams / fish, injected with oodev 0 ml, 0.5 ml oodev, oodev 1 ml, 1.5 ml oodev for induction of maturation. Fish injected every week for 5 weeks. Furthermore, female of Torsoro which is maturating gonads were injected with a combination of hormones that is ovaprim 0.5 ml / kg of fish, ovaprim 0.25 ml / kg of fish + HCG 500 IU / kg fish, ovaprim 0.25 ml / kg + 0.25 mg AI / kg; AI 0.50 mg / kg + 0.5 IU oxytocin (spawnprim) for final gonadal maturation and spawning of fish.
The results showed that the injection of 1 ml Oodev give the best results in inducing gonadal maturation among other treatments. Injection with 1 ml oodev can induce the fish to mature gonads as much as 60%, with higher levels of estradiol-17ß as much as 102.12 ± 21.6 ng / ml, egg diameter of 3 mm.
The best results showed that ovulation induction treatment combination of AI 0.50 mg/kg + 0.5 IU oxytocin (spawnprime) has a latency period of the fastest in stimulating ovulation 17.5 ± 0.52 h; fertilization rate of 96.60 ± 0.12%; hatching rate 81.05 ± 0.19%, and the survival rate of larvae reached 98.88 ± 0.41%. The results indicate that AI 0.50 mg / kg + 0.5 IU oxytocin (spawnprime) is the best hormone combination in inducing ovulation and spawning to semi-natural (spawning without stripping) on Torsoro.
Induction of maturation of the gonads can be done by injecting Torsoro with Oodev that can induce axis hypothalamus-pituitary-gonads for vitellogenesis process through increased plasma estradiol that causes gonadal maturation in female fish. whereas, Spawnprim able to induce more effective for the final maturation of the gonads, which includes ovulation and spawning and reproductive performance are better than the results obtained ovaprim. Spawnprim also able to induce spawning reflex so that the fish can spawn with a semi-natural way (without stripping). The success in the induction of maturation by using Oodev, and also in the induction of ovulation and spawning by using Spawnprim, provide great opportunities to increase production of seed in artificial breeding Torsoro.
RINGKASAN
EKO RINI FARASTUTI.Induksi Maturasi Gonad, Ovulasi dan Pemijahan pada Ikan Torsoro (Tor soro) Menggunakan Kombinasi Hormon. Dibimbing oleh AGUS OMAN SUDRAJAT dan RUDHY GUSTIANO.
PopulasiikanTorsoroterusmenurunakibatpenangkapanberlebihdanperusaka PMSG danantidopamin yang memilikifungsisebagaihormon regulator yang bekerjauntukmerangsang organ target (hipotalamus-hipofisis-gonad) untukperkembanganawal gonad. Induksipematanganakhir (final maturation) danpemijahandilakukandenganmenggunakanbeberapahormondankombinasinya; sGnRH (D-Arg6,Trp7,Leu8,Pro9Net)-LH-RH dan 10 mg domperidone (ovaprim), aromatase inhibitor danoytocin.
Torsoroukuran 750-800 gram/ekor, disuntikdenganoodev 0 ml, oodev 0,5 ml, oodev 1 ml, oodev 1,5 ml untukinduksipematangan. Ikandisuntiksetiapmingguselama 5 minggu.Selanjutnyainduk yang sudahmatang gonad disuntikdengankombinasihormonyaituOvaprim 0,5 ml/kg ikan, Ovaprim 0,25 ml/kg ikan+HCG 500 IU/kg ikan, Ovaprim 0,25 ml/kg+AI 0,25 mg/kg; AI 0,50 mg/kg+oxytocin 0,5 IU (spawnprime) untukpematanganakhir gonad danpemijahandariikan.
HasilmenunjukkanbahwapenyuntikanOodev 1 ml
memberikanhasilterbaikdalammenginduksipematangan gonad di
antaraperlakuanlainnya.Injeksidengan 1 ml
oodevdapatmenginduksiikanmenjadimatang gonad sebanyak 60% , dengankadar estradiol-17ß sebanyak 102,12 ± 21,6 ng/ml, diameter telur 3 mm.
Hasilterbaikinduksiovulasimemperlihatkanbahwaperlakuankombinasiantara AI
0,50 mg/kg+oxytocin 0,5 IU (spawnprime)
memilikiperiodelatentercepatdalammerangsangovulasi 17.5±0.52 jam; tingkatfertilisasi 96,60±0,12 %; tingkatpenetasan 81,05±0,19 %, dantingkatkelangsunganhidup larva mencapai 98,88±0,41 %. Hasilmengindikasikanbahwa AI 0,50 mg/kg+oxytocin 0,5 IU (spawnprime) merupakankombinasihormonterbaikdalammenginduksiuntukovulasidanpemijahan semi-alami ( pemijahantanpa stripping) padaTorsoro.
Induksimaturasigonad
dapatmenginduksiporosHipotalamus-Pituitari-Gonad untuk proses vitelogenesismelaluipeningkatan estradiol plasma yang menyebabkanpematangan
gonad padaikanbetina. sedangkan,
Spawnprimmampumenginduksilebihefektifuntukpematanganakhir gonad, yang meliputiovulasidanpemijahandankinerjareproduksi yang lebihbaikdibandingkandenganhasil yang yangdiperolehOvaprim. Spawnprimjugamampumenginduksireflekspemijahansehinggaikandapatmemijahd
engancara semi-alami (tanpa stripping).
KeberhasilandalaminduksimaturasidenganmenggunakanOodev,
danjugadalaminduksiovulasidanpemijahandenganmenggunakanSpawnprim, memberikanpeluangbesarpeningkatanproduksibenihdalampengembangbiakanbuat anTorsoro.
Kata kunci : Maturasi, ovulasi, spawnprime, Torsoro.
@ HakCiptaMilik IPB, Tahun 2014
HakCiptaDilindungiUndang-Undang
atautinjauansuatumasalah; danpengutipantersebuttidakmerugikankepentingan IPB.
Tesis
sebagaisalahsatusyaratuntukmemperolehgelar Magister Sainspada
Program StudiIlmu Akuakultur
INDUKSI MATURASI GONAD, OVULASI DAN PEMIJAHAN
PADA IKAN TORSORO (Tor soro) MENGGUNAKAN
KOMBINASI HORMON
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
JudulTesis : Induksi Maturasi Gonad, Ovulasi dan Pemijahan pada IkanTorsoro (Tor soro) Menggunakan Kombinasi Hormon.
Nama : Eko Rini Farastuti
NIM : C151120271
Disetujuioleh
KomisiPembimbing
Dr. Ir. Agus Oman Sudradjat,M.Sc Ketua
Dr. Ir.Rudhy Gustiano, M.Sc Anggota
Diketahuioleh
Ketua Program Studi Ilmu Akuakultur
Dr. Ir.Widanarni, M.Si
DekanSekolahPascasarjana
Dr.Ir.DahrulSyah, MSc.,Agr
TanggalUjian: 06 Februari 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga laporan hasil penelitian ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2013 hingga Oktober 2013 ini ialah Induksi Maturasi Gonad, Ovulasi dan Pemijahan ikan Torsoro (Tor soro) menggunakan kombinasi hormon.
Tesis ini diharapkan dapat memberikan tambahan informasi dalam bidang teknik reproduksi ikan terutama yang berhubungan dengan pematangan akhir, ovulasi dan pemijahan ikan Torsoro (Tor soro). Saran dan kritik untuk penyempurnaan dari semua pihak sangat diharapkan. Pada kesempatan ini penulis ucapkan terima kasih kepada semua pihak yang selalu membantu selama penyusunan tesis ini terutama :
1. Bapak Dr. Ir. Agus Oman Sudrajat, M.Sc selaku ketua komisi pembimbing dan Bapak Dr. Ir. Rudhy Gustiano, M.Sc selaku anggota komisi pembimbing, yang telah banyak memberikan arahan, bimbingan, dan semangat selama penyusunan tesis ini.
2. Ketua Program Studi Ilmu Akuakultur FPIKIPB, yang selalu memberikan pelayanan selama menempuh studi (Dr.Ir. Widanarni, M.Si)
3. Dosen penguji Luar (Dr. Ir. Odang Carman, M.Sc)
4. Suami, Muhammad Suhendra, S.T dan anakku Muhammad Rehan Fatih Suhendra serta Ibu Yohanna Tarminah S.Pd, Bapak Hi. Syamsudin, Ibu Mertua Sanniah dan Bapak Mertua Saring Supiyanto, serta asisten Resti Lestari yang selalu memberikan doa dan support tiada henti selama menempuh pendidikan di Pascasarjana IPB Pogram Studi Ilmu Akuakultur (PS AKU).
5. Bapak Ir. Jojo Subagja, M.Si yang telah banyak memberi saran dan dukungan di lapangan. Bapak Deni Radona, S.Pi selaku Kepala Instalasi, Wahyulia Cahyanti, S.Pi sebagai staf peneliti, Bapak Sudarmaji dan rekan rekan selaku teknisi di Balai Penelitian dan Pengembangan Plasma Nutfah Ikan air Tawar, Cijeruk, Bogor, yang telah banyak membantu dan bekerjasama dengan sangat baik selama kegiatan penelitian dan pengumpulan data di lapangan
6. Rekan rekan PS AKU angkatan 2012, sahabat ku (Ibu Novi Susianti,M.Si dan Ibu Erna Yuniarsih, M.Si), teman teman seperjuangan, Pak Musa, bu Iskandariah dan pak Farid MHatas bantuan dan dorongan semangat yang diberikan selama ini.
Semoga tesis ini dapat bermanfaat di masa yang akan datang.
Bogor, Februari 2014
iv
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga laporan hasil penelitian ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2013 hingga Oktober 2013 ini ialah Induksi Maturasi Gonad, Ovulasi dan Pemijahan ikan Torsoro (Tor soro) menggunakan kombinasi hormon.
Tesis ini diharapkan dapat memberikan tambahan informasi dalam bidang teknik reproduksi ikan terutama yang berhubungan dengan pematangan akhir, ovulasi dan pemijahan ikan Torsoro. Saran dan kritik untuk penyempurnaan dari semua pihak sangat diharapkan. Pada kesempatan ini penulis ucapkan terima kasih kepada semua pihak yang selalu membantu selama penyusunan tesis ini terutama :
1. Bapak Dr Ir Agus Oman Sudrajat, MSc selaku ketua komisi pembimbing dan Bapak Dr Ir Rudhy Gustiano, MSc selaku anggota komisi pembimbing, yang telah banyak memberikan arahan, bimbingan, dan semangat selama penyusunan tesis ini.
2. Ketua Program Studi Ilmu Akuakultur FPIK IPB, yang selalu memberikan pelayanan selama menempuh studi (Dr Ir Widanarni, MSi)
3. Dosen penguji Luar Komisi (Dr Ir Odang Carman, MSc)
4. Suami, Muhammad Suhendra, ST dan anakku Muhammad Rehan Fatih Suhendra serta Ibu Yohanna Tarminah SPd, Bapak Hi. Syamsudin, Ibu Mertua Sanniah dan Bapak Mertua Saring Supiyanto, serta asisten Resti Lestari yang selalu memberikan doa dan support tiada henti selama menempuh pendidikan di Pascasarjana IPB Program Studi Ilmu Akuakultur (PS AKU).
5. Bapak Ir Jojo Subagja, MSi yang telah banyak memberi saran dan dukungan di lapangan. Bapak Deni Radona, SPi selaku Kepala Instalasi, Wahyulia Cahyanti, SPi sebagai staf peneliti, Bapak Sudarmaji dan rekan rekan selaku teknisi di Balai Penelitian dan Pengembangan Plasma Nutfah Ikan air Tawar, Cijeruk, Bogor, yang telah banyak membantu dan bekerjasama dengan sangat baik selama kegiatan penelitian dan pengumpulan data di lapangan.
6. Rekan rekan Program Studi Akuakultur angkatan 2012, sahabatku (ibu Novi Susianti, MSi dan ibu Erna Yuniarsih, MSi), teman teman seperjuangan, pak Ahmad Musa Said, MSi, ibu Iskandariah, MSi dan pak Farid, MSi atas bantuan dan dorongan semangat yang diberikan selama ini.
Semoga tesis ini dapat bermanfaat di masa yang akan datang.
Bogor, Maret 2014
v
1. Induksi Maturasi Gonad 8
2. Induksi Ovulasi dan Pemijahan 9
3. Analisis Kualitas Air 11
4. Analisis Data 11
3 HASIL DAN PEMBAHASAN 11
1. Induksi Maturasi gonad 11
Konsentrasi Estradiol-17ß 12
Tingkat Kebuntingan Ikan Torsoro 14
Diameter Telur Ikan Torsoro 15
2. Induksi Ovulasi dan Pemijahan 16
Masa Laten 17
Jumlah Telur yang diovulasikan 18
Tingkat Pembuahan Telur Ikan Torsoro 19
Tingkat Penetasan Telur Ikan Torsoro 20
Tingkat Kelangsungan Hidup Larva 12 hari 21
vi
1. Perlakuan induksi maturasi gonad 8
2. Perlakuan induksi ovulasi dan pemijahan 9
3. Nilai rataan masa laten, jumlah telur yang diovulasi, Tingkat pembuahan, Tingkat penetasan, dan Tingkat kelangsungan hidup larva (12 hari) 17
4. Keberhasilan dan lama waktu ovulasi serta pemijahan pada ikan Torsoro 17
5. Kisaran kualitas air pada hatchery dan kolam pemeliharaan 24
DAFTAR GAMBAR
1. Diagram alur mekanisme kerja hormon perlakuan induksi maturasi 42. Diagram alur mekanisme kerja hormon perlakuan induksi ovulasi 5
3. Konsentrasi estradiol-17ß ikan Torsoro selama penelitian 12
4. Konsentrasi estradiol-17ß setiap minggu 13
5. Tingkat kebuntingan ikan Torsoro per minggu 14
6. Diameter telur ikan Torsoro 15
7. Bentuk gonad ikan Torsoro 15
8. Pemijahan semi alami pada ikan Torsoro menggunakan perlakuan AI+oxytocin 18
9. Jumlah telur ikan Torsoro yang diovulasikan 19
10. Tingkat pembuahan telur ikan Torsoro 20
11. Tingkat penetasan telur ikan Torsoro 21
12. Tingkat kelangsungan hidup larva ikan Torsoro 22
vii
1. Analisis konsentrasi estradiol dalam plasma darah ikan Torsoro 30 2. Analisis ragam hubungan antara kombinasi hormon dengan
masa laten ovulasi pada ikan Torsoro 31
3. Analisis ragam hubungan antara kombinasi hormon dengan
jumlah telur yang di ovulasi pada ikan Torsoro 31 4. Analisis ragam hubungan antara kombinasi hormon dengan
Tingkat pembuahan telur pada ikan Torsoro 31 5. Analisis ragam hubungan antara kombinasi hormon dengan
Tingkat penetasan pada ikan Torsoro 32 6. Analisis ragam hubungan antara kombinasi hormon dengan
Kelangsungan hidup (SR) larva ikan Torsoro 12 hari 32
7. Persiapan penelitian 33
8. Perlakuan induksi maturasi dan ovulasi 34
9. Pengambilan sampel darah 34
10. Pengamatan tingkat kematangan gonad 34
11. Teknik pemijahan buatan 35
12. Hasil dan pengamatan telur yang di ovulasikan 35 13. Jurnal Induksi Maturasi, Ovulasi serta Pemijahan ikan Torsoro
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara yang memiliki tingkat keanekaragaman hayati tinggi termasuk ikan di dalamnya. Kottelat et al. (1993) menyebutkan bahwa jumlah jenis ikan air tawar di wilayah Indonesia Barat dan Sulawesi sekitar 900 jenis, diantaranya adalah dari anggota Cyprinidae. Salah satu anggota Cyprinidae yang potensial dikembangkan sebagai ikan budidaya adalah ikan dari genus Tor,
dan salah satu jenis Tor yang memiliki nilai ekonomi dan nilai budaya yang tinggi yaitu ikan Torsoro (Tor soro).
Saat perayaan hari-hari besar maupun untuk disajikan kepada tamu penting, ikan Torsoro merupakan sajian yang prestisus karena selain ikan ini merupakan ikan khas suatu daerah, ikan Torsoro memiliki nilai ekonomis tinggi. Hal ini diindikasikan oleh tingginya permintaan terhadap daging ikan Torsoro dengan harga yang tinggi pula. Contohnya di kabupaten Pemalang, ikan Torsoro dapat diperoleh dengan harga yang cukup tinggi, mencapai Rp. 200.000 - 400.000/kg. Sementara di Malaysia mencapai 300 RM atau setara Rp. 750.000/kg (Haryono, 2006).
Ikan Torsoro di Indonesia memiliki nama-nama lain di setiap daerah seperti: Ikan Jurung (Sumatra Utara), Ikan Garing (Sumatera Barat), Ikan Kerling (Aceh), Ikan Pedih (Gayo/Aceh Tengah), Ikan Gariang (Padang), Ikan Semah (Sumatera selatan), Ikan Lomi (Kalimantan), Ikan dewa, Ikan Kancra bodas, Kencara (Kuningan Jawa Barat), Ikan Tambra, Tombro (Jawa), Ikan Kelah, Ikan Sultan (Malaysia), Ikan Mahseer (Internasional).
Dalam publikasi dilaporkan terdapat 24 jenis Tor atau Mahseer yang sebarannya meliputi daerah pegunungan Himalaya hingga ke Asia Tenggara. Untuk Genus Tor terdapat empat yaitu Tor douronensis, Tor tambra, Tor soro dan
Tor tambroides yang ada di Indonesia.
Menurut Gustiano et al. (2013), domestikasi Torsoro telah dilakukan sejak tahun 1996. Di mulai dari mengumpulkan spesimen hidup, karakterisasi genetik dan morfometrik, pembenihan dan evaluasi pertumbuhan. Total 445 spesimen hidup dari Sumatera Utara berukuran 500-800 g dikumpulkan dari Samosir, Ambarita, Tarutung, Aek Sirambe, Asahan,dan Bahorok di Sumatera Utara, Identifikasi T. soro dilakukan sesuai dengan kunci identifikasi menurut Kottelat et al. (1993). Heterozigositas (0,008-0,1250) dan persentase nilai loki polimorfik (22-33%) menunjukkan bahwa genetik variasi Torsoro dari Sumatera Utara rendah. Pada tahun 2010 teknologi pengembangbiakan Torsoro telah dinyatakan berhasil, namun demikian, produksi benih masih dirasakan kurang optimal karena kematangan telur ikan masih terkendala oleh musim.
Aspek maturasi dan pemijahan akhir pada ikan Torsoro dengan teknik induksi hormon merupakan salah satu solusi dalam menyediakan induk yang matang gonad dan induk siap pijah. Induksi hormonal dapat dilakukan dengan menyuntikkan hormon PMSG, AD dengan kombinasinya. Begitu juga dalam aspek ovulasi, dapat dilakukan induksi menggunakan kombinasi hormon pada induk ikan Torsoro betina.
Pengembangan teknologi untuk meningkatkan efisiensi reproduksi telah banyak dilakukan melalui penambahan hormon agar didapatkan pematangan oosit secara in vivo dan masa-masa reproduksi yang lebih efisien. Penambahan hormon eksogen untuk perkembangan pematangan akhir gonad dan pemijahan pada ikan Torsoro sebelumnya telah dilakukan. Pemberian implantasi Human Chorionic Gonadotropin (HCG) dengan dosis 500 IU/kg bobot badan ternyata menunjukkan adanya perkembangan diameter oosit terbaik setelah hari ke-50 dengan tingkat keberhasilan pemijahan 100% (Subagja & Gustiano 2006). Namun demikian, untuk lebih meningkatkan efisiensi reproduksi dan memacu pematangan gonad ikan Torsoro sejak dari awal tahap reproduksi diperlukan pemanfaatan hormon yang memiliki kemampuan untuk mengontrol proses pembentukan vitelogenin dan memacu pematangan akhir gonad.
Penelitian ini selain melakukan induksi maturasi gonad, kegiatan induksi ovulasi juga dilakukan dengan memberikan induksi hormonal berupa kombinasi ovaprim, HCG, aromatase inhibitor, dan oxytocin sebagai percepatan ovulasi dan pemijahan akhir pada ikan Torsoro.
Kegiatan reproduksi tidak terlepas dari produksi benih dan penyediaan calon induk. Selama ini benih yang dihasilkan tidaklah sebanyak yang diharapkan oleh pembudidaya, selain terkendala oleh musim kawin, ikan torsoro yang hanya terjadi pada waktu waktu tertentu, juga karena terbatasnya kesediaan calon induk. Selama ini para pembudidaya hanya mengandalkan induk matang gonad yang berasal dari alam maupun mengambil benih dari alam. Produksi benih secara massal tanpa bergantung dengan musim kawin dan benih dari alam perlu didukung dengan adanya ilmu pengetahuan dan teknologi yang dapat memberikan informasi mengenai kegiatan maturasi, ovulasi dan pemijahan ikan torsoro dengan menggunakan kombinasi hormon.
Perumusan Masalah
Salah satu contoh produk yang bisa digunakan dalam kegiatan maturasi adalah Oodev yang mengandung Pregnant Mare Serum Gonadotropin (PMSG) dan antidopamin. Hormon ini banyak mengandung unsur daya kerja Folicle Stimulating Hormone (FSH) yang berperan dalam pematangan gonad awal atau vitelogenesis. Penyerapan vitelogenin akan membuat oosit mencapai ukuran tertentu yang kemudian siap untuk diovulasikan.
dan memacu perkembangan gonad hingga TKG IV dengan diameter telur 3,19 mm.
Domperidone merupakan jenis anti dopamin yang umumnya digunakan dalam campuran ovaprim beserta pemberian LHRHa. Sekresi gonadotropin oleh LHRH dihambat oleh suatu mekanisme yang dilakukan oleh senyawa dopamin. Dopamin dalam hal ini berfungsi sebagai GRIF yang melengkapi alur pematangan gonad pada ikan. Bila kerja dopamin dihambat dengan antagonisnya (AD), maka peranan dopamin terhenti sehingga sekresi gonadotropin akan meningkat.
Di antara produk komersial, ovaprim yang merupakan produk yang
dikeluarkan oleh Syndel Laboratories, Ltd dengan kandungan 20 μg salmon
gonadotropin hormon releasing hormon (sGnRH) (D-Arg6,Trp7,Leu8,Pro9 Net)-LH-RH dan 10 mg domperidone, dopamin antagonis (Nandeesha et al. 1990), merupakan jenis yang paling banyak digunakan. Mengingat tingkat harga yang tinggi dan bukan merupakan produk dalam negeri, maka perlu dicari bahan alternatif yang dapat mengurangi ketergantungan pada ovaprim. Alfonso et al.
(1999) melakukan pemberian “aromatase inhibitor” (AI) sebesar 10 mg/Kg pada
induk coho Salmon siap pijah, melaporkan bahwa pada hari ke 10 ikan mulai ovulasi sebesar 67% dengan fertilitas 85%.
Aromatase merupakan anggota dari sitokrom P450 yang berisi enzim kompleks. Enzim ini mengkatalisis tahap akhir proses pembentukan estrogen yaitu hidroksilaksi androstenedion menjadi estron dan testosteron menjadi
estradiol 17β. Pada mamalia, aktivitasnya dapat dilihat dalam beberapa jaringan seperti ovari, jaringan7 adipose, plasenta, otak, otot, fibroblas, osteoblas, hati dan payudara (Holzer et al. 2006).
Ankley et al. (2002) menyatakan bahwa mekanisme yang terjadi pada ikan betina maupun Jantan Fathead Minnow yang di beri perlakuan aromatase inhibitor
(fradozole) yang dilarutkan di air dengan dosis antara 2 hingga 50 μg/l yang
diamati selama 21 hari, menunjukkan bahwa pada ikan betina, terjadi penurunan plasma estradiol dan konsentrasi vittelogenin, sedangkan pada jantan dapat meningkatkan konsentrasi plasma androgen testosteron (T) dan 11-ketotestosteron (KT) dan ditandai dengan akumulasi sperma di dalam testis. Permana (2009)
menyimpulkan bahwa penggunaan AI dan LHRHa pada dosis optimal 20 μg/ml
terbukti mampu menstimulus ovulasi pada kisaran waktu 9-16 jam setelah penyuntikan.Menurut Dewanthara (2013), kombinasi LHRHa+ AD+ AI+
PGF2α+ Oxytocin (spawnprime) dapat merangsang terjadinya ovulasi dan pemijahan semi alami pada ikan patin.
Penggunaan hormon lainnya berupa penambahan oxytocin diharapkan dapat merangsang induk ikan Torsoro untuk ovulasi dan memijah secara semi alami, hal ini disebabkan karena oxytocin merupakan hormon yang terdapat pada mamalia yang berfungsi untuk merangsang kontraksi yang kuat pada dinding rahim/uterus yang dapat mempermudah dalam membantu proses kelahiran (Caldwell et al.
2006), sehingga pemberian oxytocin diharapkan dapat memberikan pengaruh yang baik bagi ovulasi dan pemijahan semi alami pada ikan Torsoro.
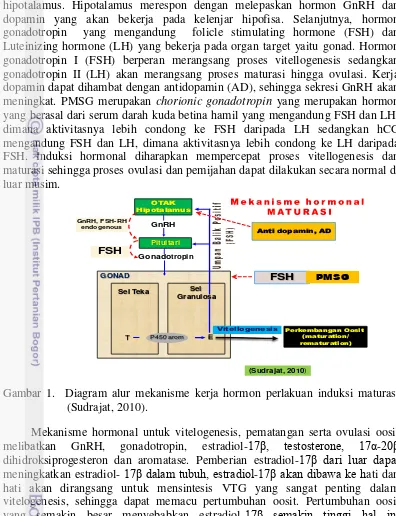
hipotalamus. Hipotalamus merespon dengan melepaskan hormon GnRH dan dopamin yang akan bekerja pada kelenjar hipofisa. Selanjutnya, hormon gonadotropin yang mengandung folicle stimulating hormone (FSH) dan Luteinizing hormone (LH) yang bekerja pada organ target yaitu gonad. Hormon gonadotropin I (FSH) berperan merangsang proses vitellogenesis sedangkan gonadotropin II (LH) akan merangsang proses maturasi hingga ovulasi. Kerja dopamin dapat dihambat dengan antidopamin (AD), sehingga sekresi GnRH akan meningkat. PMSG merupakan chorionic gonadotropin yang merupakan hormon yang berasal dari serum darah kuda betina hamil yang mengandung FSH dan LH, dimana aktivitasnya lebih condong ke FSH daripada LH sedangkan hCG mengandung FSH dan LH, dimana aktivitasnya lebih condong ke LH daripada FSH. Induksi hormonal diharapkan mempercepat proses vitellogenesis dan maturasi sehingga proses ovulasi dan pemijahan dapat dilakukan secara normal di luar musim.
Gambar 1. Diagram alur mekanisme kerja hormon perlakuan induksi maturasi (Sudrajat, 2010).
Mekanisme hormonal untuk vitelogenesis, pematangan serta ovulasi oosit melibatkan GnRH, gonadotropin, estradiol-17β, testosterone, 17α-20β dihidroksiprogesteron dan aromatase. Pemberian estradiol-17β dari luar dapat meningkatkan estradiol- 17β dalam tubuh, estradiol-17β akan dibawa ke hati dan hati akan dirangsang untuk mensintesis VTG yang sangat penting dalam vitelogenesis, sehingga dapat memacu pertumbuhan oosit. Pertumbuhan oosit yang semakin besar menyebabkan estradiol-17β semakin tinggi hal ini menyebabkan umpan balik negatif terhadap FSH (follicle stimulating hormone) dan umpan balik positif terhadap LH.
Berkurangnya FSH dan meningkatnya LH dengan pemberian HCG yang mengandung FSH dan LH, dimana aktivitasnya lebih condong ke LH daripada FSH menyebabkan penurunan aktivitas aromatase, akibatnya produksi
estradiol-17β turun dan meningkatkan produksi testosterone, kadar testosterone yang tinggi
dapat merangsang pematangan oosit. Di lain pihak peningkatan LH akan
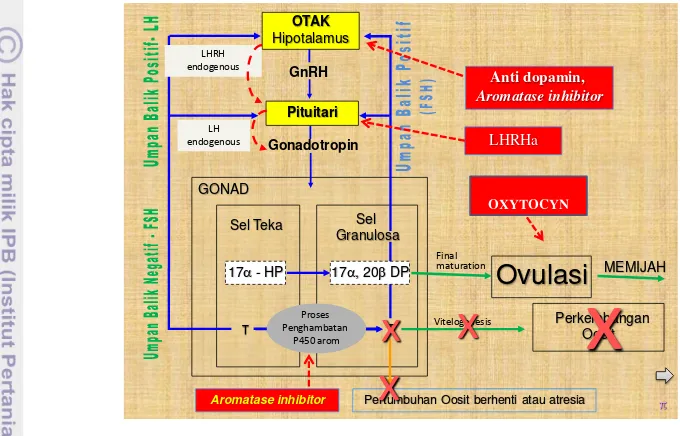
meningkatkan aktivitas 20β-HSD sehingga memacu peningkatan produksi 17α -20β dihidroksiprogesteron akibatnya terjadi pematangan yang diikuti ovulasi oosit. Pemberian AI dari luar akan menurunkan aktivitas aromatase akibatnya
produksi estradiol-17β turun dan meningkatkan produksi testosterone, keadaan ini diharapkan menyebabkan terjadinya pematangan dan ovulasi. Aromatase inhibitor masuk ke otak dirangsang oleh LHRH ke pituitary sedangkan LHRH masuk ke pituitary diekskresikan ke gonadotropin, dari gonadotropin masuk ke sel teka,
menghasilkan 17α HP diubah menjadi 17α-20β DP pada sel granulose sehingga terjadi final maturation, dengan bersamaannya pemberian oxytocin sehingga mengakibatkan ovulasi dan ikan itu memijah.
Gambar 2. Diagram alur mekanisme kerja hormon perlakuan induksi ovulasi (Sudrajat 2010).
Tujuan Penelitian
1. Mendapatkan dosis terbaik oodev (PMSG, Antidopamin dan kombinasinya) dalam induksi untuk mempercepat proses maturasi induk ikan Torsoro.
2. Mendapatkan dosis dan kombinasi hormon yang tepat pada penggunaan ovaprim, aromatase inhibitor, HCG dan oxytocin terhadap keberhasilan induksi ovulasi dan pemijahan ikan Torsoro.
Manfaat Penelitian
Manfaat dari penelitian ini adalah mendapatkan ilmu pengetahuan dan teknologi (IPTEK) dalam induksi pematangan gonad dan pemijahan akhir sebagai tahap awal dalam pengembangan domestikasi dan pembenihan ikan Torsoro.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah proses pematangan gonad akhir akibat penggunaan PMSG + anti dopamin (oodev) dengan dosis yang berbeda, serta ovulasi dan pemijahan buatan dan semi alami pada ikan Torsoro yang disebabkan
OTAK
Aromatase inhibitor Pertumbuhan Oosit berhenti atau atresia
karena penggunaan kombinasi hormon LHRHa + anti dopamine (ovaprim) dengan hCG, dan atau Aromatase Inhibitor dan atau oxytocin.
2
METODE PENELITIAN
Penelitian dilaksanakan selama 5 bulan dari bulan Juni 2013 hingga Oktober 2013, di kolam pembesaran di Balai Penelitian dan Pengembangan Plasma Nutfah Ikan Air Tawar, Cijeruk, Bogor.
Rancangan penelitian induksi maturasi gonad serta ovulasi dan pemijahan akhir pada ikan Torsoro menggunakan rancangan acak lengkap (RAL). Rancangan penelitian ini adalah :
1. Rancangan penelitian induksi maturasi gonad ikan Torsoro menggunakan oodev terdiri atas 4 perlakuan dan menggunakan 10 ekor ikan uji untuk tiap perlakuan :
Perlakuan oodev 0 ml/kg
Perlakuan oodev 0,5 ml/kg
Perlakuan oodev 1 ml/kg
Perlakuan oodev 1,5 ml/kg
2. Rancangan induksi ovulasi dan pemijahan akhir ikan Torsoro menggunakan kombinasi hormonyang terdiri atas 4 perlakuan dan 10 ekor ikan uji untuk setiap perlakuan :
Perlakuan ovaprim 0,5 ml /kg
Perlakuan ovaprim + HCG
Perlakuan ovaprim + AI
Perlakuan AI + Oxytocin
Bahan
Ikan Torsoro yang digunakan dalam kegiatan maturasi adalah induk Torsoro muda (TKG I) dengan ukuran berkisar 750-800 gram/ekor. Sedangkan untuk kegiatan ovulasi dan pemijahan akhir digunakan induk ikan Torsoro yang telah matang gonad dengan ciri ciri sudah memiliki telur dengan diameter ± 3,00 mm dan berwarna kuning orange. Induk jantan ikan Torsoro sebagai sumber sperma untuk uji fertilisasi. Ikan diperoleh dari koleksi Balai Penelitian dan Pengembangan Plasma Nutfah Ikan air Tawar, Cijeruk, Bogor.
Pemeriksaan kondisi kematangan gonad dan pengambilan contoh telur pada ikan dilakukan dengan cara kanulasi menggunakan kateter kanula polietilen. Ovari spesies Tor memiliki keragaan yang relatif sama, seperti yang terlihat pada
Tor douronensis. Perkembangan ovari dari Tor douronensis adalah sebagai berikut (Hardjamulia et al. 1995) :
indeks gonadosomatik (IGS) sekitar 0,57-0,7 dan hanya terdapat oosit stadium I yang secara acak berderet berada di tepi dinding lamela.
Tingkat II. Ovari tingkat II ditemukan pada ikan berukuran 38-42 cm dan bobot sekitar 580-820 g, dengan IGS sekitar 1,6-2,1. Pada ovari tampak butir-butir telur dan secara mikroskopis terdapat oosit tertua dari stadium II dan oosit stadium I dengan persentase paling tinggi.
Tingkat III. Ovari tingkat III ditemukan pada ikan berukuran 42-51 cm dan bobot 840-1.380 g dengan nilai IGS 3,1-4,7. Secara visual pada ovari terdapat butir-butir telur yang lebih besar dan bervariasi ukurannya. Ovari mengisi sekitar 70% rongga perut. Pada tingkat ini, terdapat oosit tertua pada stadium III, di samping oosit stadium I dengan frekuensi tertinggi 60% dan oosit stadium II 26%.
Tingkat IV. Ovari tingkat IV ditemukan pada ikan berukuran 58-61 cm dan bobot 2.390-2.496 g dengan IGS 5,99-6,51. Ikan pada tingkat ini sudah siap memijah, yang dicirikan oleh perut yang membengkak terutama di daerah atas urogenital. Lubang urogenital berwarna putih. Ovari dengan panjang antara 19,5-22,1 cm mengisi seluruh rongga perut. Butir-butir telur yang berukuran relatif besar terlihat dengan mata telanjang. Pengamatan histologi menunjukkan ovari pada tingkat ini mempunyai oosit stadium tertua (stadium IV) yang terlihat dari inti sel yang sudah migrasi ke tepi, selain itu terdapat oosit stadium I, II, dan III dan oosit yang atresia.
Tingkat V. Ovari pada tingkat ini terdapat pada ikan yang sudah siap memijah. Status Kelamin Penentuan status kelamin dari torsoro dilakukan dengan cara mengambil foto bentuk gonad maupun testis, anus, tubuh (kepala, badan dan perut) dan perbandingan bobot gonad maupun kantung sperma. Pengamatan ini dilakukan pada awal, minggu ke-2, minggu ke-4, dan akhir penelitian (minggu ke-6).
Hormon yang digunakan untuk induksi maturasi gonad adalah produk oodev yang mengandung PMSG dan antidopamin dengan kombinasinya, sedangkan hormon yang digunakan untuk ovulasi adalah ovaprim yang mengandung LHRH dan antidopamin; yang akan dikombinasikan dengan aromatase inhibitor, dan atau HCG dan atau oxytocin.
Anasthesi yang digunakan pada penelitian ini adalah MS222 (tricaine methanesulfonate) dengan dosis 15 – 30 mg/L (Kathleen et al. 2011)
Adaptasi Ikan
pemeliharaan atau lingkungan yang baru. Pada tahap ini ikan Torsoro diberi pakan dengan kadar protein 30%, ransum diberikan sebesar 3% dari biomassa sebanyak 2 kali sehari yaitu pagi dan sore hari. Ikan dipelihara di dalam kolam dengan kedalaman ± 0,7 m. Kolam mendapat pasokan air yang berasal dari mata air.
Pemasangan Tanda (chips)
Setelah ikan benar benar sehat dan dapat memiliki pola makan yang baik, sebelum diberi perlakuan ikan tersebut diberi tanda berupa penanaman chips pada tubuh ikan. Chips tersebut terbuat dari kaca yang di dalamnya terdapat alat elektronik yang dapat memunculkan kode unik apabila dibaca menggunakan tag reader. Sebelum ikan diberi chips, terlebih dahulu ikan dipingsankan menggunakan anasthesi (obat bius) MS222 (tricaine methanesulfonate) dengan dosis 15 – 30 mg/L (Kathleen et al. 2011). Chips dipasang dengan menggunakan
implanter ke dalam tubuh ikan secara hati hati, setelah itu bagian tubuh ikan yang luka bekas implanter, diberi antiseptik untuk mencegah infeksi.
Penelitian ini terdiri atas 2 kegiatan, yaitu kegiatan induksi maturasi gonad serta induksi ovulasi. Berikut adalah uraian dari masing masing kegiatan penelitian tersebut :
1. Induksi Maturasi Gonad
Ikan Torsoro yang digunakan pada kegiatan induksi maturasi gonad adalah ikan betina (TKG I) yang berasal dari kolam pembesaran di Balai Penelitian dan Pengembangan Plasma Nutfah Ikan air Tawar, Cijeruk, Bogor, dengan ukuran berkisar antara 750-850 gram/ekor.
Parameter yang diamati pada kegiatan maturasi gonad ini adalah profil hormon estradiol-17ß, tingkat kebuntingan dan tingkat kematangan gonad, serta diameter telur. Perlakuan kegiatan maturasi gonad disajikan pada Tabel 1.
Tabel 1. Perlakuan induksi maturasi gonad
Perlakuan Hormon/Kg berat badan
Pengukuran konsentrasi estradiol-17β dalam darah dilakukan pada awal (minggu 0), minggu ke-1, ke-2, ke-3, ke-4 dan minggu ke-5. Mekanisme pengambilan sampel darah adalah:
1. Ikan yang akan diambil sampel darahnya, terlebih dahulu dibius dengan menggunakan anasthesi MS222.
kemudian dimasukkan ke dalam microtube volume 1.5 ml dan disimpan dalam cool box.
3. Contoh darah yang ditampung dalam microtube disentrifusi pada kecepatan 10000 rpm selama 10-50 menit.
4. Supernatan plasma darah diambil dan dimasukkan ke dalam microtube baru. Bila pengukuran supernatan plasma tidak dilakukan secara langsung, sampel disimpan dalam freezer pada suhu minus 4oC. Pengukuran konsentrasi hormon estradiol-17β dalam plasma darah ikan Torsoro dilakukan dengan menggunakan metode ELISA
Tingkat Kebuntingan
Tingkat kebuntingan pada penelitian ini dihitung dengan menjumlahkan dan mempersentasikan induk ikan Torsoro yang telah terdapat gamet (telur) di dalam gonadnya dari awal hingga akhir penelitian.
Diameter Telur
Diameter telur diukur dibawah mikroskop yang menggunakan mikrometer dengan perbesaran 40 kali. Pengamatan diameter telur dilakukan pada awal dan akhir penelitian (minggu ke-6). Hasil pengukuran menggunakan lensa okuler (µm) dikalikan dengan pembesaran 4x10 (40 kali) dan hasil dari perkalian dalam satuan µm dibagi dengan 1000, maka didapatkan hasil diameter sebenarnya dalam satuan mm.
2. Induksi Ovulasi dan Pemijahan
Ikan Torsoro yang digunakan dalam kegiatan induksi ovulasi dan pemijahan adalah ikan yang sudah matang gonad dengan ciri ciri telah memiliki telur dengan diameter 3 mm dan berwarna kuning orange, ikan Torsoro yang telah matang gonad disuntik menggunakan kombinasi hormon sesuai dengan dosisnya, masing masing perlakuan di berikan satu kali, penyuntikan dilakukan intramuscular pada bagian otot di bawah sirip punggung. Parameter yang diamati setelah penyuntikan meliputi keberhasilan dan lama waktu ovulasi, diameter telur, jumlah telur yang diovulasi, Tingkat pembuahan, Tingkat penetasan, tingkat kelangsungan hidup larva sampai 12 hari (SR12) dan abnormalitas larva. Susunan rancangan perlakuan kegiatan ovulasi disajikan pada Tabel 2.
Tabel 2. Perlakuan induksi ovulasi dan pemijahan
Perlakuan Hormon/Kg berat badan
O1 Ovaprim 0,5 ml
O2 Ovaprim + HCG
O3 Ovaprim + AI
Waktu Ovulasi
Lamanya waktu ovulasi menunjukkan seberapa cepat reaksi dari ikan dalam menerima rangsangan hormonal yang diberikan hingga menyebabkannya berovulasi. Penghitungan waktu ovulasi dimulai dari setelah dilakukan penyuntikan kombinasi hormon perlakuan hingga terjadinya ovulasi
Jumlah Telur yang diovulasikan (Spawned Eggs)
Setelah diberikan perlakuan (penyuntikan), setiap 6 jam pasca penyuntikan dilakukan pengamatan dengan cara pemijahan buatan atau dengan cara stripping, kemudian menghitung seluruh telur yang dikeluarkan oleh induk ikan Torsoro saat ovulasi.
Tingkat Pembuahan
Tingkat pembuahan ditentukan dari jumlah telur yang dibuahi dibagi dengan jumlah total telur dan dinyatakan dalam persen. Tingkat pembuahan dapat dihitung dengan menggunakan rumus :
Tingkat pembuahan = Jumlah telur yang keluar x 100% Jumlah telur yang dibuahi
Tingkat Penetasan
Tingkat penetasan ditentukan dari jumlah telur yang menetas dibagi dengan total telur yang dibuahi dan dinyatakan dalam persen. Tingkat penetasan dapat dihitung dengan menggunakan rumus sebagai berikut :
Tingkat penetasan = Jumlah telur yang menetas x 100% Jumlah telur yang dibuahi
Tingkat Kelangsungan Hidup Larva setelah 12 hari (SR12)
Tingkat kelangsungan hidup larva setelah 12 hari (SR12) dihitung berdasarkan jumlah larva pada hari kedua setelah menetas dibagi jumlah total larva yang menetas. Menggunakan rumus yaitu :
Tingkat Abnormalitas larva
Tingkat abnormalitas larva dilihat untuk mengetahui berapa banyak larva yang tidak normal pertumbuhan dan perkembangannya. Cara melihat larva yang tidak normal adalah dengan megamati pergerakan dan bentuk tubuh larva ikan torsoro setelah umur 12 hari.
Tingkat Abnormalitas larva = Jumlah larva abnormal x 100% Jumlah total larva yang hidup
3. Analisis Kualitas Air
Kualitas air diamati setiap minggu kecuali amoniak diamati pada awal, pertengahan dan akhir penelitian (minggu ke-6). Parameter kualitas air yang diamati di antaranya: temperatur, nilai pH, kandungan oksigen terlarut (DO), dan amoniak. Kandungan oksigen terlarut diukur dengan menggunakan DO meter. Temperatur air diukur menggunakan termometer (oC), nilai pH diukur dengan kertas lakmus atau pH meter (angka 1-14) dan amoniak diukur menggunakan spektrofotometer (mg/L).
4. Analisis Data
Data kegiatan maturasi gonad ikan Torsoro yang diperoleh pada penelitian ini dianalisis secara deskriptif, sedangkan data kegiatan ovulasi dianalisis dengan sidik ragam untuk mengetahui pengaruh perlakuan. Jika terdapat perbedaan yang
nyata antar perlakuan (P<0.05) dilanjutkan dengan uji Tukey’s (Steel dan Torrie
1993).
3
HASIL DAN PEMBAHASAN
Perkembangan gonad ikan adalah proses berkembang folikel oosit sampai kemudian berhenti apabila telah mencapai ukuran maksimum (fase dorman). Untuk mempercepat perkembangan gonad ikan Torsoro, perlu adanya induksi hormonal, pada penelitian ini menggunakan kombinasi PMSG + antidopamin yang terdapat di dalam produk oodev dengan dosis tertentu.
1. Induksi Maturasi Gonad
Konsentrasi Estradiol-17ß
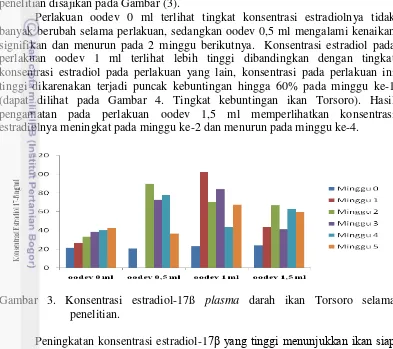
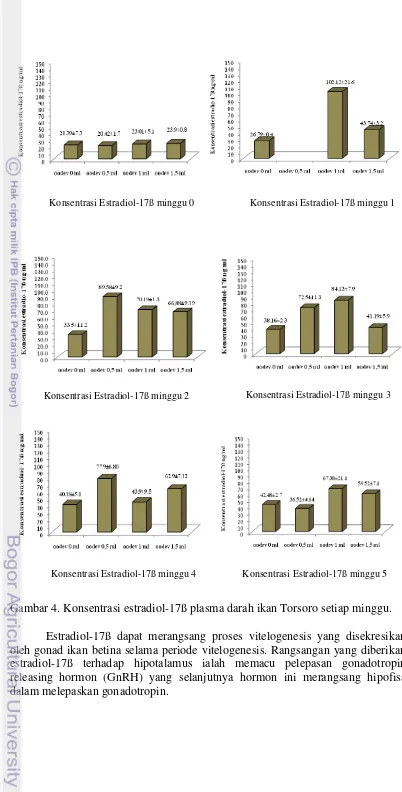
Konsentrasi estradiol adalah banyaknya kandungan hormon estradiol (hormon betina) pada plasma darah untuk merangsang hati mensintesis vitelogenin. Pengambilan contoh darah diambil setiap minggu. Secara umum konsentrasi estradiol pada plasma darah ikan Torsoro yang diberikan induksi oodev terjadi peningkatan setiap kali pengamatan, kadar estradiol-17ß selama penelitian disajikan pada Gambar (3).
Perlakuan oodev 0 ml terlihat tingkat konsentrasi estradiolnya tidak banyak berubah selama perlakuan, sedangkan oodev 0,5 ml mengalami kenaikan signifikan dan menurun pada 2 minggu berikutnya. Konsentrasi estradiol pada perlakuan oodev 1 ml terlihat lebih tinggi dibandingkan dengan tingkat konsentrasi estradiol pada perlakuan yang lain, konsentrasi pada perlakuan ini tinggi dikarenakan terjadi puncak kebuntingan hingga 60% pada minggu ke-1 (dapat dilihat pada Gambar 4. Tingkat kebuntingan ikan Torsoro). Hasil pengamatan pada perlakuan oodev 1,5 ml memperlihatkan konsentrasi estradiolnya meningkat pada minggu ke-2 dan menurun pada minggu ke-4.
Gambar 3. Konsentrasi estradiol-17ß plasma darah ikan Torsoro selama penelitian.
Peningkatan konsentrasi estradiol-17β yang tinggi menunjukkan ikan siap untuk memulai tahap perkembangan gonad. Perubahan estradiol-17β yang terjadi berhubungan dengan perkembangan oosit dan peningkatan gonadosomatik indeks (Lee &Yang 2002). Menurut Zairin (2003), estradiol-17ß akan merangsang hati mensintesis vitelogenin, selanjutnya dibawa oleh aliran darah menuju gonad dan secara selektif akan diserap oleh lapisan folikel oosit akibat penyerapan vitelogenin, oosit akan tumbuh membesar sampai kemudian berhenti apabila telah mencapai ukuran maksimum.
Oodev sendiri mengandung PMSG (Pregnant Mare Serum Gonadotropin) yang memiliki aktifitas ganda, yaitu FSH dan LH, tetapi lebih dominan FSH dalam tanggung jawabnya terhadap perkembangan oosit (vitelogenesis), sedangkan diketahui LH sendiri memicu dalam proses kematangan oosit. FSH akan merangsang sel sel teka untuk memproduksi estradiol-17ß yang selanjutnya akan berperan dalam perkembangan oosit.
Gambar 4. Konsentrasi estradiol-17ß plasma darah ikan Torsoro setiap minggu. Estradiol-17ß dapat merangsang proses vitelogenesis yang disekresikan oleh gonad ikan betina selama periode vitelogenesis. Rangsangan yang diberikan estradiol-17ß terhadap hipotalamus ialah memacu pelepasan gonadotropin releasing hormon (GnRH) yang selanjutnya hormon ini merangsang hipofisa dalam melepaskan gonadotropin.
Konsentrasi Estradiol-17ß minggu 5 Konsentrasi Estradiol-17ß minggu 4
Konsentrasi Estradiol-17ß minggu 3 Konsentrasi Estradiol-17ß minggu 2
Konsentrasi Estradiol-17ß minggu 5 Konsentrasi Estradiol-17ß minggu 4
Berg et al. (2004) mengemukakan bahwa hewan ovipar betina yang matang kelamin menghasilkan produksi vitelogenin dalam vitelogenesis yang sangat dipengaruhi oleh kontrol estrogen dari dalam hati. Penghubung kontrol estrogenik yang berada pada vitelogenin ini adalah suatu pengikat estrogen yang sangat kuat, yaitu estradiol-17ß, yang berada pada reseptor estrogen.
Tingkat Kebuntingan Ikan Torsoro
Untuk mempercepat perkembangan gonad ikan Torsoro, perlu adanya induksi hormonal, pada penelitian ini menggunakan produk oodev dengan dosis tertentu. Berdasarkan hasil pengamatan tingkat kebuntingan ikan Torsoro yang diamati setiap minggu dapat dilihat pada Gambar 5.
Gambar 5. Tingkat kebuntingan ikan Torsoro per minggu.
Gambar di atas menunjukkan bahwa tingkat kebuntingan terbaik ditunjukkan oleh perlakuan oodev 1 ml, kebuntingan terjadi pada minggu pertama sebesar 60%, minggu ke-2 sebanyak 10%, minggu ke-3 20%, minggu ke-4 0% dan minggu ke-5 sebanyak 10% dengan total tingkat kebuntingan 100%. Perlakuan oodev dosis 1,5 ml, kebuntingan dimulai pada minggu ke-2 memiliki hasil tingkat kebuntingan sebesar 50% , minggu ke-3 0%, minggu ke-4 30%, dan minggu ke-5 10% dengan total kebuntingan 90%. Perlakuan oodev dosis 0,5 ml kebuntingan juga mulai terjadi pada minggu ke-2 sebesar 40%, selanjutnya minggu ke-3 dan ke-4 sebesar 20%, minggu ke-5 tidak ada terjadi kebuntingan atau 0% dengan total tingkat kebuntingan yaitu 80%. Perlakuan kontrol oodev dosis 0 ml, tidak mengalami kebuntingan sama sekali hingga penelitian berakhir.
Setelah vitelogenesis, proses selanjutnya adalah pematangan akhir yang ditunjukkan dengan (a) penambahan kematangan oosit, (b) produksi maturation inducing hormone (MIH), (c) pembentukan maturation promoting factor (MPF) dan (d) pematangan sitoplasma yang menyebabkan perubahan protein dan lemak dalam kuning telur. Tahap-tahap ini diikuti dengan ovulasi yang ditandai dengan pecahnya folikel dan melepaskan telur ke dalam rongga ovari. Proses maturasi ini secara morfologi ditandai dengan pergerakan germinal vesicle (GV) menuju kutub/animal pole dan terjadi peleburan inti atau GV break down (GVBD) (Yaron & Sivan 2006).
merupakan komponen penting dalam proses pematangan gonad karena proses vitelogenesis pada dasarnya adalah proses akumulasi nutrien dalam sel telur sehingga ketersediaan nutrien pada sel telur akan menentukan kualitas telur dan pada akhirnya juga pada perkembangan larva. Di pihak lain, faktor internal yang terpenting adalah tersedianya hormon-hormon steroid gonad terutama estradiol-17ß pada tingkat yang dapat merangsang vitelogenesis.
Diameter Telur Ikan Torsoro
Ukuran rata-rata diameter telur ikan Torsoro yang diamati selama penelitian menunjukkan adanya perkembangan. Vitelogenesis merupakan suatu penggabungan protein-protein vitelogenin oleh oosit dan memprosesnya menjadi protein kuning telur sehingga menyebabkan peningkatan ukuran gonad ikan betina hingga maturasi akhir (Glasser et al. 2004; Lubzens et al. 2010). Hasil pengamatan diameter telur ikan Torsoro disajikan pada Gambar 6.
Gambar 6. Diameter telur ikan Torsoro a.) Sebelum penyuntikan oodev; b).Setelah penyuntikan oodev
Berdasarkan Gambar 6, hasil pengamatan menunjukkan bahwa kisaran diameter telur rata rata sebelum dilakukan penyuntikan oodev adalah 0,633 ± 0,027 mm, sedangkan diameter telur setelah penyuntikan oodev adalah sekitar 3mm, dengan berat rata rata berkisar 0,0125 gram/butir.
Sebelum terjadi ovulasi, sel telur akan mengalami pembesaran. Folikel membentuk semacam benjolan yang semakin membesar sehingga menyebabkan dinding folikel pecah. Pecahnya dinding folikel terjadi pada bagian yang paling lemah (bagian membran) dengan bantuan enzim. Sel-sel teka secara faal bertindak sebagai otot halus yang dapat mendorong oosit keluar dari folikel. Hal ini disebabkan adanya semacam sel otot halus yang pipih dan serat kolagen yang terletak berdekatan dengan basal lamina.
Hasil pengamatan terhadap bentuk gonad serta tipe pemijahan ikan Torsoro memperlihatkan bahwa pada ikan Torsoro memiliki tipe pemijahan parsial atau asinkronous, hal ini terlihat dari ukuran telur yang berbeda beda di dalam satu gonad. Bentuk gonad ikan Torsoro tersaji pada Gambar 7 berikut ini :
Gambar 7. Bentuk gonad ikan Torsoro dengan ukuran telur yang berbeda yang terdapat di dalam satu gonad.
Berdasarkan gambar gonad ikan Torsoro tersebut, maka serupa dengan yang dikemukakan oleh Ingram et al. (2007) bahwa pada genus Tor memiliki tipe pemijahan parsial atau asinkronous. Menurut Wallace dan Selman (1981) ovarium dibedakan menjadi 3 tipe, yaitu (1) sinkronisme total yaitu seluruh oosit berada pada tingkat perkembangan atau stadia yang sama, (2) sinkronisme per grup yaitu sedikitnya terdapat 2 populasi oosit yang berada dalam stadia yang sama
dan (3) asinkronisme yaitu oosit pada ovarium terdiri dari semua stadia.
Telur merupakan hasil akhir dari proses gametogenesis setelah oosit mengalami fase pertumbuhan yang sangat bergantung pada adanya hormon gonadotropin. Perkembangan diameter telur pada oosit telesotei ini umumnya disebabkan adanya akumulasi kuning telur. Pemahaman mengenai mekanisme proses pertumbuhan dan perkembangan oosit sangat penting diperlukan untuk memahami faktor-faktor yang mempengaruhi kualitas dan fertilisasi telur (Ismail
et al. 2011).
Evans (2000) menyatakan bahwa Pematangan oosit meliputi periode berakhirnya profase I dan berhentinya metafase II, secara morfologi adalah terjadinya perpindahan inti yang dikenal dengan istilah germinal vesicle migration. Gonadotropin hormon II (GtH II) merangsang produksi oocyte
maturation inducing substance (MIS) oleh folikel ovarium dalam dua tahapan. Tahapan pertama GtH merangsang sintesis 17α-hydroxy-4-pregnen-3-one oleh sel teka, tahapan kedua masih di bawah kontrol GtH, prekursor steroid yang diubah
oleh sel granulosa menjadi 17α-hydroxy-4-pregnen-3-one (Nagahama et al.,1995) 2. Induksi Ovulasi dan Pemijahan
Pada penelitian ini, kegiatan induksi ovulasi dan pemijahan diperoleh hasil bahwa induksi ovulasi ikan Torsoro dengan kombinasi hormon menghasilkan seluruh induk ikan Torsoro melakukan ovulasi. Pada perlakuan ini juga terlihat bahwa induksi hormon perlakuan memiliki pengaruh terhadap jumlah telur yang diovulasi, tingkat pembuahan, tingkat penetasan dan tingkat kelangsungan hidup larva 12 hari (Tabel 3).
Tabel 3. Nilai rataan masa laten, jumlah telur yang di ovulasi, tingkat pembuahan, tingkat penetasan, dan tingkat kelangsungan hidup larva (12 hari)
Perlakuan
Nilai dengan superscript yang berbeda pada kolom yang sama menunjukkan perbedaan nyata (α = 0,05)
Masa Laten
Dari hasil pengamatan, perlakuan dengan penyuntikan ovaprim saja (kontrol) maupun penyuntikan dengan kombinasi hormon, mampu memberikan rangsangan sehingga terjadi ovulasi pada ikan Torsoro dengan tingkat keberhasilan hingga 100%.
Penghitungan masa laten pada penelitian ini adalah jarak waktu dari dilakukannya induksi kombinasi hormon perlakuan hingga terjadinya ovulasi yang dideteksi dengan adanya keberhasilan koleksi telur. Masa laten merupakan masa yang dibutuhkan agar terjadi ovulasi dari telur yang sudah matang.
Respon ikan setelah induksi hormon perlakuan terhadap kecepatan masa laten dapat dilihat pada Tabel 4. Masa laten tercepat diperoleh pada perlakuan AI+oxytocin yaitu 17.5 ± 0.52 jam. Pada perlakuan tersebut, induk betina yang diinduksi perlakuan AI+oxytocin berhasil memijah secara semi alami.
Tabel 4. Keberhasilan dan lama waktu ovulasi serta pemijahan pada ikan Torsoro Perlakuan Tingkat keberhasilan
Masa laten tercepat diperoleh pada perlakuan AI + Oxytocin dengan rata-rata masa laten 17.5 ± 0.52 jam. Perlakuan yang membutuhkan waktu laten yang paling lama adalah perlakuan ovaprim dengan rata-rata waktu laten 55.38 ± 1.91 jam. Hasil analisis sidik ragam menunjukkan bahwa induksi kombinasi hormon berpengaruh nyata (p<0,05) terhadap lama waktu ovulasi ikan Torsoro. Berdasarkan hasil uji lanjut diketahui bahwa AI+Oxytocin berbeda nyata (p<0,05) dibandingkan dengan seluruh perlakuan.
pada kedua permukaan tersebut sedikit demi sedikit terpisah, hal tersebut dimungkinkan dilakukan oleh enzim proteolitik.
Dalam setiap perkembangan secara biologi termasuk oosit ikan, perkembangan antara satu fase ke fase yang berikutnya membutuhkan waktu tertentu. Brooks et al. (2003) menjelaskan bahwa pada oosit yang telah matang, sitoplasma akan menjadi bening, oil droplet bergabung menjadi satu dan berukuran besar serta terjadi breakdown germinal vesikel.
Menurut Nagahama et al. (1995), aktivitas aromatase pada ikan meningkat dan mencapai puncaknya pada pascavitelogenesis. Setelah mencapai pascavitelogenesis produksi estradiol-17β akan menurun drastis, demikian juga aktivitas aromatase. Menurunnya produksi estradiol-17β dan aktivitas aromatase,
ternyata diikuti peningkatan 17α,20β-dihidroksi-4-pregnen-3-one (17α,20β-DP) sehingga oosit mengalami GVBD dan berakhir pada ovulasi.
Pada perlakuan AI+oxytocin menunjukkan bahwa induk ikan Torsoro yang di induksi dengan perlakuan ini dapat terjadi ovulasi dan pemijahan semi alami (tanpa stripping). Pemijahan semi alami pada ikan Torsoro dapat dilihat pada Gambar 8.
Gambar 8. Pemijahan semi alami pada ikan Torsoro mengunakan perlakuan AI+Oxytocin. Keterangan : Anak panah menunjukkan telur yang dipijahkan (spawned egg) oleh ikan Torsoro.
Aromatase inhibitor (AI) mampu membloking produksi estrogen dengan menghambat proses aromatisasi pada hipothalamus-hipophisis-gonad axis dari umpan balik negatif estrogen, sehingga menyebabkan sekresi FSH meningkat dan menyebabkan rangsangan yang menghasilkan perkembangan ovari hingga terjadinya ovulasi (Casper and Mitwally 2006),
Menurut Basuki (2007), penambahan aromatase inhibitor (AI) juga memungkinkan kerja LH dalam menurunkan enzim aromatase tadi akan diperkuat atau digantikan oleh AI, sehingga peranan LH dalam proses pematangan dan ovulasi akan lebih efisien, sehingga menurut hasil penelitian ini, AI (aromatase inhibitor) terbukti dapat digunakan sebagai induksi ovulasi menggantikan peran LH yang terkandung di dalam ovaprim. Sedangkan penambahan oxytocin dapat menyebabkan induk ikan Torsoro melakukan pemijahan secara semi alami.
Jumlah Telur yang diovulasikan
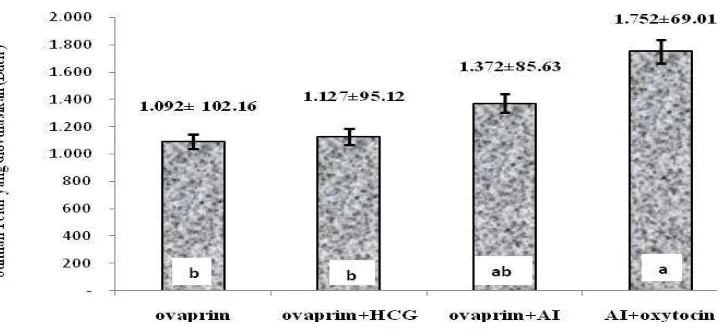
Seluruh telur yang dikeluarkan oleh induk ikan Torsoro saat ovulasi dihitung dan diperoleh hasil sebagaimana di sajikan pada Gambar (9).
Jumlah telur yang diovulasikan tertinggi terjadi pada ikan Torsoro yang diberi perlakuan AI + Oxytocin yaitu 1752 ± 69.01 butir, terendah pada perlakuan ovaprim saja yaitu 1092 ± 102.16 butir. Berdasarkan hasil analisis sidik ragam diketahui bahwa induksi kombinasi hormon pada perlakuan AI+oxytocin memberikan pengaruh nyata (P<0,05) terhadap jumlah telur yang diovulasikan. Selanjutnya, berdasarkan uji rentang Tukey diketahui bahwa perlakuan AI+oxytocin tidak berbeda nyata terhadap perlakuan ovaprim+AI tetapi berbeda nyata (P<0,05) terhadap kombinasi hormon yang lain yaitu perlakuan ovaprim+HCG dan perlakuan ovaprim serta menunjukkan perbedaan pengaruh yang signifikan.
Gambar 9. Jumlah telur ikan Torsoro yang diovulasikan .
Kemampuan dari LHRHa dalam merangsang pengeluaran hormon gonadotropin dibantu dengan adanya anti dopamin yang mampu menghambat kerja dopamin telah cukup terbukti untuk mempercepat dan memicu terjadinya ovulasi. Pemberian aromatase inhibitor juga dapat memicu terjadinya ovulasi. Hal ini dikarenakan, aromatase inhibitor memiliki peran dalam menurunkan aktivitas aromatase dalam gonad akibatnya produksi estrogen-17β turun dan meningkatkan produksi testosteron, hal tersebut merupakan awal sinyal balik positif terhadap LH sehingga proses pematangan oosit akan berlangsung lebih cepat.
positif terhadap gonadotropin terutama LH. Sehingga kerja LH dari pituitari ditambah dengan adanya efek aromatase inhibitor pada gonad yang juga menyebabkan terjadinya umpan positif pada LH akan semakin mempercepat pematangan oosit hingga nanti berakhir pada ovulasi.
Tingkat Pembuahan Telur Ikan Torsoro
Tingkat pembuahan telur ikan Torsoro tertinggi ditemukan pada induk ikan yang diinduksi dengan perlakuan AI + oxytocin yaitu sebesar 96.60 ± 0.18 % dan tingkat pembuahan terendah terjadi pada ikan yang diinduksi perlakuan ovaprim+HCG yaitu 94.08 ± 0.12 %, berdasarkan analisis sidik aragam diketahui bahwa induksi menggunakan perlakuan AI + oxytocin memberikan pengaruh yang nyata (P<0,05) terhadap tingkat pembuahan telur. Selanjutnya, berdasarkan uji rentang Tukey diketahui bahwa perlakuan AI + oxytocin menunjukkan perbedaan pengaruh nyata terhadap seluruh perlakuan.
Hasil perlakuan AI + oxytocin berbeda nyata (P<0,05) dibandingkan dengan perlakuan perlakuan ovaprim+AI, ovaprim+HCG dan perlakuan ovaprim. Rata-rata tingkat pembuahan disajikan pada Gambar 10.
Gambar 10. Tingkat pembuahan telur ikan Torsoro;
Pembuahan atau fertilisasi merupakan penggabungan gamet, dimana penggabungan ini merupakan mata rantai awal dan sangat penting pada proses fertilisasi. Penggabungan gamet biasanya disertai dengan pengaktifan telur. Selama fertilisasi dan pengaktifan, telur-telur ikan teleostei mengalami reaksi kortikal. Kortikal alveoli melebur, melepaskan cairan koloids, dan selanjutnya memulai pembentukan ruang periviteline (Kjorsvik E et al.1990).
Kortikal alveoli muncul setelah terjadinya fertilisasi dan reaksi kortikal yang tidak lengkap artinya menunjukkan kualitas telur yang buruk. Beberapa hal yang mempengaruhi pembuahan adalah berat telur ketika terjadi pembengkakan oleh air, pH cairan ovari, dan konsentrasi protein (Lahnsteiner et al. 2001).
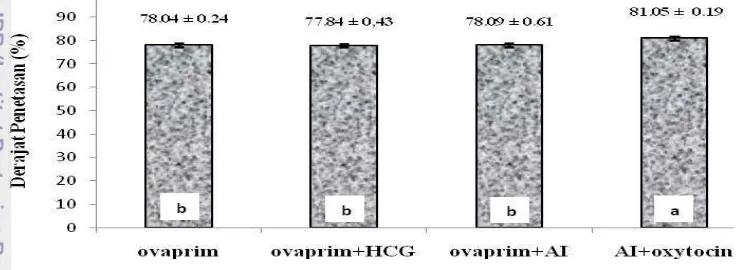
Tingkat Penetasan Telur Ikan Torsoro
menggunakan perlakuan AI + oxytocin memberikan pengaruh yang nyata (P<0,05) terhadap tingkat penetasan telur. Selanjutnya, berdasarkan uji rentang Tukey diketahui bahwa perlakuan AI + oxytocin menunjukkan perbedaan pengaruh nyata (P<0,05) terhadap seluruh perlakuan.
Menurut Blaxter (1969) penetasan terjadi karena menurunnya kekerasan khorion yang disebabkan oleh substansi enzim khorionase yang bersifat mereduksi. Di samping itu dapat pula disebabkan oleh gerakan-gerakan akibat peningkatan suhu, intensitas cahaya atau penyerapan tekanan oksigen.
Oyen et al. (1991) menyatakan bahwa prosentase daya tetas telur selalu ditentukan oleh persentase fertilitas telur, dimana semakin tinggi persentase fertilitas telur maka akan semakin tinggi pula persentase daya tetas telur, kecuali bila ada faktor lingkungan yang mempengaruhi seperti perubahan suhu yang mendadak, oksigen dan pH. Tingkat penatasan ikan Torsoro di sajikan pada Gambar 11 :
Gambar 11. Tingkat penetasan telur ikan Torsoro;
Telur dengan kualitas yang baik adalah telur yang memiliki kemampuan untuk difertilisasi dan berkembang menjadi embrio normal. Kualitas telur yang berubah-ubah adalah salah satu faktor pembatas produksi benih ikan. Kualitas telur ikan ini dipengaruhi oleh beberapa factor, antara lain a) nutrisi, b) faktor lingkungan, c) perlakuan ikan yang meliputi induksi pemijahan, akhir ovulasi telur, dan pemeliharaan gamet setelah pengurutan perut, d) stress (Bobe & Labbé, 2010).
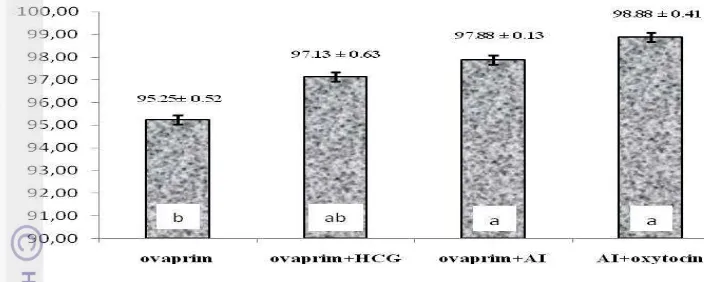
Tingkat Kelangsungan Hidup Larva 12 Hari
Gambar 12. Tingkat kelangsungan hidup larva ikan Torsoro;
Hasil tingkat kelangsungan hidup larva 12 hari terbaik terjadi pada perlakuan AI+oxytocin yaitu 98.88 ± 0.41 %. Pengamatan tingkat kelangsungan hidup larva 12 hari diperoleh data bahwa menurut uji sidik ragam, induksi kombinasi hormon memberikan pengaruh nyata (p<0,05) terhadap kelangsungan hidup larva ikan Torsoro. Setelah dilakukan uji lanjut, diketahui bahwa perlakuan AI+oxytocin hanya berbeda nyata (p<0,05) terhadap perlakuan ovaprim saja.
Penelitian ini menghasilkan larva yang normal hingga 99.8 % lebih baik dibandingkan dengan hasil penelitian yang pernah dilakukan oleh Subagja & Gustiano (2006), yaitu dengan Pemberian implantasi Human Chorionic Gonadotropin (HCG) dengan dosis 500 IU/kg bobot badan, menghasilkan larva yang normal sebesar 90.12%.
Ukuran telur berkorelasi dengan ukuran larva. Larva yang besar lebih tahan tanpa pakan dibandingkan dengan larva berukuran kecil yang dipijahkan dari telur kecil.
Hubungan positif antara ukuran larva dan ukuran telur telah dilaporkan untuk Salmo salar, Onchorhynchus mykiss, Onchorhynchus keta, dan Clupea harengus (Kamler 1992). Keuntungan ukuran awal yang dimiliki larva yang menetas dari telur besar dapat kurang berarti selama perkembangan selanjutnya, atau bahkan hilang. Pada Salmo salar keuntungan ini hilang setelah 5 minggu pertama pertumbuhan; pada Oncorhynchus mykiss keuntungan ini hilang setelah 16 minggu (Kamler 1992).
Kemampuan larva yang kecil untuk bertumbuh sehingga mempunyai kecepatan yang sama dengan larva yang lebih besar sangat penting untuk tujuan komersial. Potensi yang sangat penting adalah menemukan kelangsungan hidup telur dan larva tidak dipengaruhi oleh ukuran telur (Kjorsvik et al. 1990).
Embriogenesis Larva
Menurut Balon (1975) embriogenesis di bagi ke dalam tiga stadium yaitu pembelahan, embrionik dan eleutheroembrionik (stadium ikan menetas sampai ikan dapat mencari makanan sendiri dari luar). Nikolsky (1963) Embrionik adalah periode perkembangan mulai dari pembuahan sampai ikan mendapat makanan dari luar. Telur ikan Torsoro menetas setelah hari ke-4, pada kisaran suhu sekitar 22-24oC. Tahap embriogenesis hasil ovulasi ikan Torsoro pada penelitian ini, dapat dilihat pada Gambar 13.
Gambar 13. Embriogenesis ikan Torsoro; a).1sel; b).2sel; c).Morula; d).Blastula; e).Gastrula; f).Organogenesis; g).Organ tubuh hampir sempurna sebelum menetas h).Penetasan embrio ikan Torsoro; i.) Larva ikan Torsoro.
Menurut Sukra et al (2000), cleavage yaitu tahapan proses pembelahan sel. Proses ini berjalan teratur dan berakhir hingga mencapai balastulasi. Bisa juga dikatakan proses pembelahan sel yang terus menerus hingga terbentuk bulatan, seperti bola yang di dalamnya berisi rongga. Gastrulasi merupakan proses kelanjutan blastulasi. Hasil proses ini adalah terbentuknya tiga lapisan, yaitu ektoderrm, modeterm dan entoderm.
Organogenesis adalah tahapan terjadinya pembentukan organ-organ tubuh dari tiga lapisan diatas, yaitu ektoderm, metoderm dan entoderm. Setiap lapisan membentuk organ yang berbeda. Ektoterm membentuk lapisan epidermis pada gigi, mata dan saraf pendengaran. Mesoderm membentuk sistem respirasi, pericranial, peritonial, hati dan tulang.
Adapun proses-proses secara terperinci setelah pembuahan terjadi adalah sebagai berikut (Nagy 1981):
2. Proses blastulasi; proses yang menghasilkan blastula, yaitu campuran sel-sel blastoderm yang membentuk rongga penuh cairan sebagai blastokoel. Pada akhir blastulasi, sel-sel blastoderm akan terdiri atas neural, epidermal,notokhordal, mesodermal,dan entodermal yang merupakan bakal pembentuk organ-organ.
3. Proses grastulasi; proses pembelahan bakal organ yang sudah terbentuk pada saat blastulasi. Bagian-bagian yang terbentuk nantinya akan menjadi suatu organ.
4. Proses organogenesis; proses pebentukan berbagai organ tubuh secara berturut-turut, antara lain susunan saraf, notochord, mata, somit, rongga kupffer, olfaktorin sac, subnotokhordrod, linear lateralis, jantung, aorta, insang, infundibulum, dan lipatan-lipatan sirip.
Data Kualitas Air
Kualitas air diamati pada awal, minggu ke-1, ke-2, ke-3, dan minggu ke-4. Parameter kualitas air yang diamati diantaranya: kandungan oksigen terlarut (DO meter mg/L), temperatur air (termometer (oC)), nilai pH (pH meter) dan amoniak (spektrofotometer (mg/L)), Nitrit dan Nitrat (mg/L).
Kualitas air pada saat penelitian dijaga pada kondisi seperti Tabel 5 di bawah ini : Kualitas air yang diamati selama penelitian diperoleh hasil sebagaimana disajikan pada Tabel 5.
Tabel 5. Kisaran kualitas air pada hatchery dan kolam pemeliharaan
Parameter Kisaran Hatchery Kisaran Kolam
4
SIMPULAN DAN SARAN
Simpulan
1. Pemberian oodev 1 ml dapat menghasilkan induk ikan Torsoro matang gonad dalam waktu 1 minggu. Perlakuan AI+oxytocin menghasilkan nilai pengamatan yang terbaik di antara seluruh perlakuan serta memiliki perbedaan yang nyata antar perlakuan pada hasil waktu ovulasi, tingkat pembuahan dan tingkat penetasan.
2. Perlakuan AI+Oxytocin dapat memberikan rangsangan pada induk ikan Torsoro dalam melakukan pemijahan semi alami
3. Tipe pemijahan ikan Torsoro adalah parsial (asinkronous) Saran
DAFTAR PUSTAKA
Alfonso LOB, Iwama GK, Smith J, dan Donaldson EM. 1999. Effect of Aromatase Inhibitor Fadrozol on Plasma Sex Steroid and Ovulation Rate in Female Coho Salmon, Onchorhynchus kisuth, Close to Final Maturation. Gen. Comp. Endocrinol 113 : 221-229
Ankley G.T, et al. 2002. Evaluation of the Aromatase Inhibitor Fadrozole in a Short-Therm Reproduction Assay with the Fathead Minnow (Pimephales promelas). Society of Toxycology. Toxicological Science 67, 121-130
Balon, E. K. 1975. Terminology of intervals in Fish Development, J. Fish. Res. Board. Can., 32:1163-1670.
Basuki F. 2007. Optimalisasi Pematangan Oosit dan Ovulasi pada Ikan Mas Koki (Carassius auratus) melalui Penggunaan Inhibitor Aromatase. Disertasi. Sekolah Pascasarjana. Institut Pertanian Bogor.
Berg H, Modig C, Olsson PE. 2004. 17beta-estradiol induced vitellogenesis is inhibited by cortisol at the post-transcriptional level in Arctic char (Salvelinus alpinus). Reproductive Biology and Endocrinology 2: 1-10.
Bobe J, Labbé C. 2010. Egg and sperm quality in fish. General and Comparative Endocrinology 165: 535-548.
Brooks S, Tyler CR and Sumpter JP. 1997. Egg quality in fish: what makes a good eggs. Rev in Fish Biology and Fisheries 7: 387-416.
Blaxter HS. 1969. Development of egg and larvae. In Hoar W.S, Randall DJ and Donaldson EM (eds). Fish Physiology Vol III. Academic Press Inc. p: 184-190. Caldwell, H.K. and Young, W.S., III. 2006. Oxytocin and Vasopressin: Genetics and Behavioral Implications in Lim, R. (ed.) Handbook of Neurochemistry and Molecular Neurobiology, 3rd edition, Springer, New York, pp. 573-607.
Casper RF dan Mitwally MFM. 2006. Review : Aromatase Inhibitors for Ovulation Induction. The Journal of Clinical Endocrinology & Metabolism 91(3) : 760–771.
Dhewantara, Y.L., 2013. Induksi ovulasi dan pemijahan ikan patin siam (Pangasionodon hypopthalmus) secara hormonal. [Tesis]
Glasser F, Mikolajczyk T, Jalabert B, Baroiller JF, Breton F. 2004. Temperature effects along the reproductive axis during spawning induction of grass carp (Ctenopharyngodon idella). General and Comparative Endocrinology, 136:171-179.
Gustiano R., Kontara E.K, Wahyuningsih H, Subagja J, Asih S, Saputra A. 2013. Domestication of Mahseer (Tor soro) in Indonesia. Fish & Shellfish Larviculture Symposium. European Aquaculture Society, Special Publication No. XX, Oostende, Belgium.
Hardjamulia, Suhenda N, Wahyudi E. 1995. Perkembangan oosit dan ovari ikan semah (Tor douronensis) di sungai Selabung, danau Ranau, Sumatera Selatan. Jurnal Penelitian Perikanan Indonesia 1: 36-46.
Haryono. 2006. Domestikasi ikan Tambra (Tor tambroides) yang sangat langka dan mahal untuk pemanfaatan berkelanjutan [laporan kompetitif ]. Puslit Biologi-LIPI, Bogor
Holzer H, Casper R, dan Tulandi T. 2006. A New Era in Ovulation Induction. Fertile Sterile 85(2) : 277-284.
Ismail MFS, Siraj SS, Daud SK, Harmin SA. 2011. Association of annual hormone profile with gonad maturity of mahseer (Tor tambroides) in captivity. General and Comparative Endocrinology,170: 125-130.
Ingram B, Sungan S, Tinggi D, Sim SY and De Silva SS. 2007. Breeding performance of Malaysian mahseer, Tor tambroides and Tor douronensis
broodfish in captivity. Aquaculture Reseach 38: 809-818.
Kamler E. 1992. Early life history of fish. An energetic approach. Chapman and Hill. London. 267p.
Kathleen M. Carter, Christa M. Woodley, Richard S. Brown. 2011. A review of tricaine methanesulfonate for anesthesia of fish. Fish Biol Fisheries, 21:51–59. Kjorsvik E, Mangor-Jensen A and Holmfjord I. 1990. Egg quality in fishes.
Advances in Marine Biology, 26: 71-113.
Kottelat, M., A.J. Whitten, S.N. Kartikasari & S.Wiroatmodjo. 1993. Freshwater Fishes of Western Indonesia and Sulawesi. Periplus Edition (HK) Ltd., Jakarta.67 – 68
Lahnsteiner F, Urbanyi B, Horvarth A and Weismann. 2001. Bio-markers for egg quality determination in cyprinid fish. Aquaculture 195: 331-352.