PENINGKATAN AKTIVITAS ENZIM L-ARABINOSA
ISOMERASE DARI
Geobacillus stearothermophilus
DENGAN
TEKNIK
SITE-DIRECTED MUTAGENESIS
NOVITRIA HARRIYANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Peningkatan produksi D-tagatosa dari enzim L-arabinosa isomerase dari Geobacillus stearothermophilus
dengan teknik site directed mutagenesis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Lembaga Ilmu Pengetahuan Indonesia.
Bogor, September 2016
Novitria Harriyani
RINGKASAN
NOVITRIA HARRIYANI. Peningkatan aktivitas enzim L-arabinosa isomerase dari Geobacillus stearothermophilus dengan teknik site directed mutagenesis. Dibimbing oleh ANTONIUS SUWANTO dan WIEN KUSHARYOTO.
Enzim L-arabinosa isomerase (L-AI) merupakan enzim yang berperan dalam mediasi isomerisasi antara D-galaktosa menjadi D-tagatosa. D-tagatosa, adalah pemanis yang paling mirip dalam rasa dan sifat fisik dengan sukrosa dari seluruh pemanis, selain itu juga dikenal sebagai pengganti gula alami. D-tagatosa merupakan gula langka yang bersifat malabsorbsi atau sulit diserap oleh usus halus. Keunggulan sifat tersebut yang menjadikan D-tagatosa merupakan gula langka dapat dijadikan sebagai salah satu alternatif pengganti sukrosa. Sehingga banyak metode digunakan untuk meningkatkan hasil produksi D-tagatosa dari proses enzimatik L-AI. Produksi enzim L-AI pada umumnya memiliki berbagai kendala, seperti rendahnya aktivitas enzim dari galur murni yang telah diisolasi sebelumnya.
Pendekatan rekayasa genetik merupakan alternatif yang dapat dilakukan untuk mendapatkan enzim L-AI dengan aktivitas yang lebih baik, salah satunya adalah dengan melakukan mutasi pada suatu posisi tertentu untuk memperbaiki sifat enzim. Oleh karena itu penelitian ini dilakukan dengan tujuan mengkonstruksi gen araA pada vektor pRHA dan mengekspresikan protein rekombinan L-AI di sitoplasma Escherichia coli serta meningkatkan produksi D-tagatosa dengan berbagai variasi mutasi. Gen penyandi enzim L-AI telah berhasil dikloning ke dalam vektor pRHA, dan diekspresikan di sitoplasma E. coli NiCo21 dengan ukuran protein 57 kDa.
Gen tersebut telah berhasil dimutasi dengan menggunakan teknik site directed mutagenesis pada titik mutasi S393T, F280N, F280L dan mutasi ganda S393T-F280L dan S393T-F280N. Lebih lanjut lagi hasil uji aktivitas enzim L-AI dari kelima mutan dan tipe liar, empat diantaranya menunjukkan adanya peningkatan aktivitas enzim L-AI. Mutan S393T memiliki aktivitas spesifik tertinggi yakni 0.518 atau 159% dan diikuti oleh mutan F280L, F280N dan S393T-F280L yakni 24.7%, 15%, dan 14% berturut-turut, dibandingkan dengan tipe liar. Sedangkan penurunan aktivitas enzim ditunjukkan pada mutan S393T-F280N dengan penurunan aktivitas 6% di bandingkan tipe liar. Mutan S393T memiliki nilai untuk dikembangkan di dunia industri.
SUMMARY
NOVITRIA HARRIYANI. Improvement of L-arabinose isomerase activity from
Geobacillus stearothermophilus by site-directed mutagenesis. Supervised by ANTONIUS SUWANTO and WIEN KUSHARYOTO.
L-arabinose isomerase is an enzyme converting D-galactose to D-tagatose. D-tagatose is the most similar in taste and physical properties to sucrose of the entireknown natural sugar substitutes. D-tagatose is rare sugar, it is poorly abosorbed in the small intestine. The advantages that make D-tagatose can be used as an alternative to change sucrose. Several methods have been studied to increase production of D-tagatose from enzymatic processes. Production of the enzyme L-AI in general have various constraints, such as low activity of enzymes of wild type strains that have been isolated previously.
Genetic engineering is an alternative approach that can be conducted to obtain enzyme L-AI with higher activity through mutation at a certain position to improve enzymatic properties. The present study is aimed to construct a recombinant pRHA, investigated the expression of araA gene in E. coli cytoplasm, and mutated L-AI to increase production rate of D-tagatose. We have successfully sub cloned it into pRHA vector and expressed recombinant protein L-AI in E. coli
NiCo21 cytoplasm with molecular mass 57 kDa.
Site directed mutagenesis araA gen was conducted. The site variants of the single mutants were identified as S393T, F280N, and F280L. Those variants obtained by site-directed mutagenesis were further analyzed for double site variants which are S393T-F280L, and S393T-F280L. The results showed that among those five L-AI mutants there were four mutants which exhibited higher in D-galactose isomerization specific activity. The S393T mutant showed the highest specific activity (0.518 U/mg) or 159% than wild type followed by F280L, F280N and S393T-F280L mutants, i.e. approximately 24.7% ,15%, 14% higher than wild type control. The S393T-F280N mutant exhibited decreased in specific activity compared to wild type i.e 6% fold than wild type. Mutant S393T enzyme can be potential for industrial production of D-tagatose.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
PENINGKATAN AKTIVITAS ENZIM L-ARABINOSA
ISOMERASE DARI
Geobacillus stearothermophilus
DENGAN
TEKNIK
SITE-DIRECTED MUTAGENESIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini ialah “Peningkatan Aktivitas Enzim L-arabinosa isomerase dari Geobacillus stearothermophilus dengan teknik site-directed mutagenesis”.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Antonius Suwanto, MSc dan Bapak Dr rer nat Wien Kusharyoto selaku pembimbing yang telah memberikan bimbingan, arahan dan ilmu kepada penulis, serta Dr Ir Utut Widyastuti, MSi selaku penguji pada ujian yang telah memberikan saran dan masukan yang sangat berguna demi kesempurnaan tesis ini. Terima kasih juga penulis sampaikan kepada Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) yang telah memberikan dukungan dana penelitian; Kementerian Pendidikan dan Kebudayaan yang telah memberikan dukungan dana pendidikan melalui Program Beasiswa Fresh Graduate a.n. Novitria Harriyani.
Terima kasih penulis ucapkan pula kepada keluarga besar Laboratorium
Genetic Engineering and Protein Design di Pusat Penelitian Bioteknologi, LIPI yang telah memberikan bantuan dan diskusi selama penelitian. Terima kasih penulis ucapkan pula kepada segenap sahabat mahasiswa di Program Studi Bioteknologi, Sekolah Pascasarjana (SPs), Institut Pertanian Bogor (IPB) yang telah memberikan kebersamaan dan dukungannya. Ungkapan terima kasih juga disampaikan kepada mama, ayah, adik, kakak, serta seluruh keluarga atas segala doa, perhatian dan kasih sayangnya. Serta semua pihak yang telah banyak memberikan motivasi, dukungan dan inspirasi bagi penulis. Semoga karya ilmiah ini bermanfaat.
Bogor, September 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 3
Produksi D-tagatosa dengan Enzim L-arabinosa isomerase dari G.
stearothermophilus 3
Teknik QuickChangeTMSite Directed Mutagenesis 4 Sistem Ekspresi dengan Promotor Teregulasi Berbasis Rhamnosa (PRHA) 6 Purifikasi Protein Menggunakan Sistem Immobilized Metal-ion Affinity
Chromatography Co2+ 7
3 METODE 9
Bahan 9
Prosedur Analisis Data 9
4 HASIL DAN PEMBAHASAN 13
Subkloning, Mutasi pada pRHA-araA dan Ekspresi 13
Uji Aktivitas Mutan Enzim L-AI 15
5 SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 18
LAMPIRAN 22
DAFTAR TABEL
1 Primer konstruksi gen araA 9
2 Primer site directed mutagenesis 11
3 Uji aktivitas enzim L-arabinosa isomerase 16
DAFTAR GAMBAR
1 Struktur model 2 dimensi enzim L-AI pada posisi F280 2 2 Struktur model 3 dimensi enzim L-AI pada posisi S393 3
3 Skema metode QuickChangeTM SDM 5
4 Induksi dan represi operon RHA 7
5 Sistem IMAC Co2+ 8
6 Skema vektor rekombinan PRHA-araA 10
7 Hasil visualisasi elektroforesis plasmid rekombinan pRHA-araA dan
analisis ekspresi protein L-AI 14
8 Analisis sekuensing gen araA 15
DAFTAR LAMPIRAN
1 Sekuen DNA gen araA 22
2 Sekuen DNA vektor Rhamex rekombinan pJExpress804-araA 24
3 Skema rancangan penelitian 27
4 Analisis sekuensing DNA dari pRHA-araA 28
5 Analisis SDS-PAGE pemilihan konsentrasi induser L-rhamnosa 29 6 Perhitungan konsentrasi protein dari enzim L-AI 30
7 Perhitungan standar tagatosa 32
1
PENDAHULUAN
Latar Belakang
Enzim L-arabinosa isomerase (L-AI) merupakan enzim yang berperan dalam mediasi isomerisasi antara D-galaktosa menjadi D-tagatosa. D-tagatosa, adalah pemanis yang paling mirip dalam rasa dan sifat fisik dengan sukrosa dari seluruh pemanis, selain itu juga dikenal sebagai pengganti gula alami (Kim et al. 2005). D-tagatosa merupakan gula ketohexosa alami rendah kalori. Selain itu tingkat kemanisan D-tagatosa mencapai 92% dari sukrosa, dalam 10% larutan (Levin et al. 1994). D-tagatosa merupakan gula langka yang bersifat malabsorbsi atau sulit diserap oleh usus halus sehingga dapat digunakan sebagai anti diabetes, dan anti hiperglikemik (Donner et al. 1999). Keunggulan sifat tersebut yang menjadikan D-tagatosa sebagai salah satu alternatif pengganti sukrosa. Sehingga banyak metode digunakan untuk meningkatkan hasil produksi D-tagatosa dari proses enzimatik L-AI.
Gen araA yang digunakan untuk penelitian ini bersumber dari Geobacillus stearothermophilus yang di isolasi dari Tanjung Api, Danau Poso, Indonesia dan merupakan gen penyandi L-AI (Fitriani dan Saksono 2010). Enzim L-AI dari strain ini bersifat termoaktif dan termostabil pada temperatur hingga 60°C. Faktor inilah yang menjadikan enzim ini berpeluang untuk dikembangkan. Namun tingkat biokonversi D-galaktosa menjadi D-tagatosa dari enzim ini masih relatif rendah sehingga perlu dilakukan penelitian lebih lanjut untuk meningkatkan aktivitas dari enzim ini.
Vektor yang digunakan dalam keperluan kloning dan ekspresi, adalah vektor pRHA, vektor ini memiliki promotor berbasis rhamnosa dan teregulasi dengan ketat oleh induser L-rhamosa dan represor D-glukosa, serta telah dilaporkan merupakan sistem ekspresi Escherichia coli alternatif yang layak untuk kloning dan ekspresi protein rekombinan fungsional yang stabil (Giacalone et al. 2006). Vektor ini berpeluang mampu mengatasi kendala tingkat ekspresi yang rendah dan kebocoran ekspresi.
Mayoritas L-AI yang dijelaskan pada penelitian sebelumnya merupakan enzim yang bukan termoaktif. Isomerisasi pada temperatur tinggi dapat meningkatkan laju reaksi dan memungkinkan pergeseran keseimbangan antara D-galaktosa dan D-tagatosa yang lebih tinggi dari yang diinginkan. Alasan ini yang menyebabkan banyak L-AI yang bersifat termoaktif dan termostabil diisolasi dan dipelajari.
Rekayasa genetika merupakan pendekatan yang banyak dilakukan untuk mendapatkan L-AI dengan aktivitas tinggi, salah satunya adalah dengan melakukan mutasi pada suatu posisi tertentu untuk memperbaiki sifat enzimatik. Beberapa penelitian sebelumnya melaporkan mutasi dapat meningkatkan temperatur optimal L-AI dari 30-60°C. Selain itu, mutasi ini mampu meningkatkan sifat katalitik L-AI pada E. coli dengan mengeser 50% tingkat biokonversi hingga 20-30% dari enzim tipe liar (Kim dan Oh 2005).
Sampai saat ini, tidak ada analisis rinci mekanisme isomerisasi dan residu katalitik terlibat dalam isomerisasi D-galaktosa ke D-tagatosa di protein L-AI dari
2
(2007) berhasil mengidentifikasi residu katalitik L-AI dari Bacillus stearothermophilus dan semua data tersebut digunakan sebagai dasar dari pemodelan molekul L-AI dari G. stearothermophilus.
Model struktur L-AI terikat dengan Mn2+ dan D-galaktosa sebagai substrat dibuat dengan menggunakan teknik pemodelan molekul dan percobaan di dalam
silico docking. Dalam struktur model ini Mn2+ terikat oleh residu asam amino yang diprediksi sebagai asam amino esensial dalam mekanisme katalitik. Berdasarkan pemodelan (Gambar 1) residu F280, diperkirakan berperan dalam pengenalan substrat, dan memiliki kontak dengan bagian tulang punggung karbon dari D-galaktosa dalam situs aktif L-AI.
Gambar 1 Struktur 3 dimensi dari situs aktif L-AI secara kompleks berikatan dengan substrat D-galaktosa (representasi bola dan tongkat). Atom karbon D-galaktosa (abu-abu), atom oksigen (merah). Rantai residu yang membangun situs aktif dari L-AI diberi label. Logam kation Mn2+ (bola ungu), ikatan hidrogen antara residu dan substrat (merah muda).
3
Gambar 2 Struktur 3 dimensi situs aktif L-AI dengan logam kation Mn2+ (bola ungu). Posisi mutasi S393T terhadap situs aktif enzim L-AI dari G. stearothermophilus ditunjukkan lingkaran merah.
Tujuan Penelitian
Penelitian ini bertujuan untuk melakukan kloning, ekspresi dan meningkatkan aktivitas enzim L-AI yang berasal dari G. stearothermophilus
dengan mengkonstruksi variasi gen araA menggunakan teknik SDM.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini, yaitu konstruksi gen L-AI yang didisain dapat digunakan sebagai kandidat gen untuk memproduksi enzim L-AI dan produksi D-tagatosa dari D-galaktosa dengan hasil yang lebih tinggi dari galur sebelumnya.
2
TINJAUAN PUSTAKA
Produksi D-tagatosa dengan Enzim L-Arabinosa Isomerase dari G. stearothermophilus
4
D-tagatosa merupakan gula yang bersifat malabsorbsi atau sulit diserap oleh usus halus. Uji klinis pada manusia dilakukan dengan kedua penderita diabetes tipe 2 dan subjek kontrol yang menerima rejimen sehari-hari D-tagatosa selama 12 bulan menunjukkan bahwa, kedua kelompok secara bertahap dan konsisten kehilangan berat badan pada tingkat medis yang diinginkan (Donner et al. 1999). Hal ini juga telah terbukti memiliki banyak manfaat kesehatan, seperti, pengurangan gejala yang berhubungan dengan diabetes tipe 2, hiperglikemia, anemia, dan hemofilia (Buemann et al 1999; Levin 2002). Kelebihan ini menjadikan D-tagatosa produk yang sangat menarik untuk diproduksi sebagai bahan pangan, dan obat di Amerika Serikat (Lee et al. 2004).
D-tagatosa merupakan gula langka yang dapat diproduksi melalui dua cara yakni metode kimia, mengubah D-galaktosa menjadi D-tagatosa dengan katalis kalsium hidroksida (Beadle et al. 1991) namun proses kimia memiliki beberapa kelemahan seperti proses purifikasi yang kompleks, menghasilkan limbah kimia dan produk samping yang dapat mencemari lingkungan, sedangkan produksi dengan metode biologi dapat dilakukan melalui proses biokatalis enzim. Produksi D-tagatosa secara biologi telah dipelajari menggunakan beberapa sumber biokatalis seperti, Arthrobacter globiformis (Izumori et al. 1984), dan G. thermodenitrificans (Kim et al. 2005).
L-arabinosa isomerase (L-AI; EC 5.3.1.4) adalah enzim yang mengkatalis isomerisasi dari L-arabinosa menjadi L-ribulosa (Izumori et al. 1984). Selain itu L-AI juga dapat mengkatalis D-galaktosa menjadi D-tagatosa (Cheetam dan Wootton 1993). Kemampuan L-AI dalam mengkatalis reaksi isomerisasi D-galaktosa menjadi D-tagatosa dikarenakan kemiripan struktur konfigurasi antara D-galaktosa dengan L-arabinosa (Yoon et al. 2003). Karena kemampuannya dalam mengkatalis reaksi isomerisasi pada D-galaktosa, enzim L-AI sering juga disebut sebagai galaktosa isomerase.
Gen araA terdiri dari 1494-1535 pasang basa. Jumlah pasang basa yang dimiliki gen araA tergantung dari mikroorganisme yang menghasilkannya. Gen
araA yang dimiliki G. stearothermophilus strain lokal yang telah di isolasi dari Tanjung Api, Poso adalah 1494 pasang basa (Fitriani dan Saksono 2010). Selain itu enzim L-AI yang berasal dari G. stearothermophilus merupakan enzim yang bersifat termofilik dan termostabil (Jung et al. 2005). Isomerisasi pada temperatur tinggi dapat meningkatkan laju reaksi dan memungkinkan terjadi pergeseran kesetimbangan antara D-galaktosa dan D-tagatosa, dan keduanya diinginkan dalam dunia industri (Kim et al. 2002). Umumnya proses isomerisasi terbentuk pada temperatur tinggi (>70°C) dan memiliki beberapa keuntungan seperti, meningkatkan laju reaksi, tingginya nilai konversi yield, dan rendahnya viskositas substrat pada aliran produk (Liu et al. 1996). Sehingga sifat termostabil dan termoaktif pada enzim L-AI lebih diinginkan.
Teknik QuickChangeTMSite Directed Mutaganesis
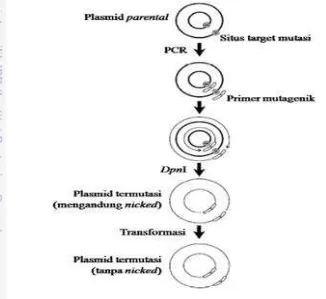
5 memperbaiki karakteristik struktural (Liu dan James 2008). Strategi yang telah dikembangkan adalah sistem QuickChangeTM SDM. SDM adalah teknik yang digunakan untuk memodifikasi urutan DNA, berdasarkan pada PCR tunggal dengan sepasang primer yang mengandung titik mutasi yang diinginkan.
Hasil PCR tersebut akan menghasilkan plasmid mutan dan plasmid inang yang selanjutnya ditambahkan dengan enzim DpnI. Enzim restriksi DpnI digunakan untuk memfasilitasi seleksi plasmid hasil SDM yang mengandung mutasi yang tidak termetilasi karena enzim ini memiliki sekuen target 5´-GmATC-3´ yang spesifik untuk digesti DNA parental (non mutasi) yang diisolasi dari inang E. coli yang termetilasi oleh inang E. coli tersebut (Stratagene 1998; Munteanu et al. 2012; Gambar 3). Sedangkan transformasi dilakukan untuk memperbaiki celah dalam plasmid termutasi karena celah tersebut dapat diligasi oleh enzim perbaikan dari inang E. coli tersebut (Munteanu et al. 2012; Gambar 3).
6
Sistem Ekspresi dengan Promotor Teregulasi Berbasis Rhamnosa (PRHA) Sistem ekspresi pada E. coli telah banyak dipelajari, dengan salah satu tujuan untuk meningkatkan ekspresi protein rekombinan. Sistem ekspresi pada E. coli berbasis plasmid yang merupakan vektor ekspresi. Vektor ekspresi yang umumnya digunakan, seperti pLac dan T7 polimerase, dalam sistem ekspresi protein rekombinan memiliki banyak kendala, salah satunya adalah rendahnya tingkat produksi protein rekombinan karena represi terhadap promotor, atau tingkat kebocoran ekspresi yang dikarenakan tidak adanya induser (Giacalone et al. 2006). Salah satu strategi untuk meningkatkan sistem ekspresi protein, dengan menggunakan vektor ekspresi yang dapat teregulasi dengan ketat (Giacalone et al. 2006).
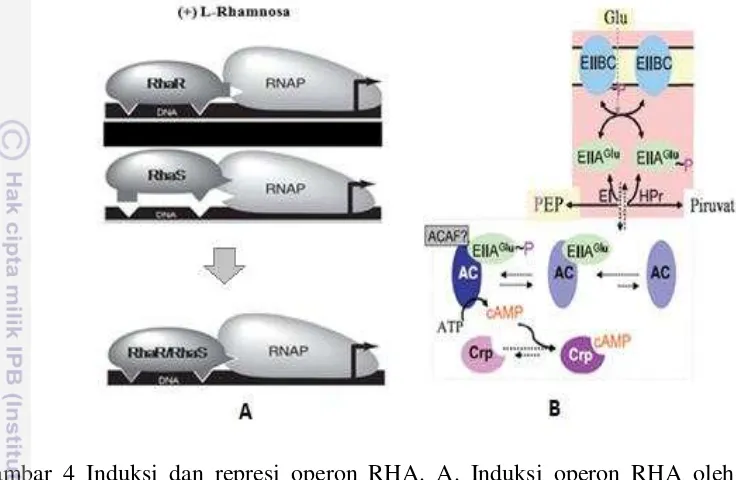
Vektor pRHA telah dilaporkan sebelumnya, sebagai vektor ekspresi alternatif yang digunakan pada sistem ekspresi protein rekombinan di E. coli yang berbasis pada lokus rhaTRS. Vektor ini teregulasi dengan ketat oleh induser L-rhamnosa, dan direpresi oleh glukosa. Mekanisme induksi PRHA dengan adanya L-rhamnosa, yaitu L-rhamnosa diambil oleh protein sistem transpor RhaT dari luar sel masuk ke dalam sel, dan selanjutnya L-rhamnosa dikenali dan diikat oleh RhaR dan RhaS, dan membuat kedua protein tersebut mengalami perubahan struktural yang memungkinkan mengaktivasi transkrip (Tobin dan Schleif 1987, 1990a, 1990b; Egan dan Schleif 1993; Via et al. 1996; Giancalone et al. 2006; Kolin et al. 2008).
L-rhamnosa terikat disitus pengikatan L-rhamnosa pada daerah N terminal dari RhaR atau RhaS, dan menginduksi perubahan struktur dari daerah N terminal tersebut, kemudian sinyal respon terhadap L-rhamnosa tersebut ditransmisikan dari situs pengikatan L-rhamnosa ke situs pengikatan DNA dan aktivasi transkrip pada daerah C-terminal, sehingga RhaR efektif berinteraksi secara langsung dengan RNA polymerase (RNAP) untuk mengaktivasi PrhaSR untuk transkripsi rhaSR dan menghasilkan RhaR (yang akan kembali mengaktivasi transkrip
rhaSR), sehingga menyebabkan akumulasi RhaS (Tobin dan Schleif 1987, 1990a,b; Wickstrum et al. 2007; Kolin et al. 2008). Selanjutnya RhaS bertindak sebagai regulator positif, bersama dengan kompleks CRP-cAMP, yang efektif mengikat secara spesifik situs DNA untuk mengaktivasi PRHA untuk transkripsi gen target (Kolin et al. 2008).
Selain itu, RhaS juga bertindak sebagai regulator positif yang secara langsung mengaktivasi rhaT yang berperan mengontrol sistem transport L-rhamnosa (Tobin dan Schleif 1987; Via et al. 1996). Sebaliknya, dalam ketiadaan
upstream dari situs pengikatan RNAP ada PrhaSR dan RhaR juga tidak efektif
berikatan dengan situs RNAP untuk mengaktivasi PrhaSR, dan RhaS juga tidak
efektif berikatan dengan situs DNA untuk mengaktivasi PRHA (Tobin dan Schleif 1990a,b; Kolin et al. 2008; Gambar 4A).
Regulasi operon RHA juga direpresi dengan adanya D-glukosa, yaitu dengan terjadinya efek penghambatan terhadap aktivitas enzim adenylatecyclase
7 aktivitas PRHA. Selain itu, D-glukosa juga memberikan efek represi terhadap fungsi promotor rhaT (PrhaT) (Via et al.1996). Sebaliknya, ketiadaan D-glukosa
menyebabkan produksi cAMP tinggi, sehingga menstimulasi pembentukan komplek CRP-cAMP yang juga bertindak sebagai regulator positif untuk PRHA (Via et al. 1996; Stulke dan Hillen 1999; Deutscher et al.2006).
Gambar 4 Induksi dan represi operon RHA. A. Induksi operon RHA oleh L-rhamnosa (Kolin et al. 2008). B. Represi operon RHA oleh D-glukosa (Deutscher et al. 2006). Glu. Glukosa, EII. Enzim II, AC. dan Crp. cAMP receptor protein.
Hasil penelitian sebelumnya menunjukkan bahwa pRHA telah berhasil digunakan untuk mengekspresikan protein nontoksik TphoA, sedikit toksik GFP, dan tosik MaIE-NTR pada E. coli MG1655 sebagai protein rekombinan yang utuh dan fungsional (Giacalone et al. 2006). Selain itu penelitian lain menunjukkan keberhasilan ekspresi protein Int282 dari O157:H7 di periplasma, sebagai protein terlarut dan tidak terpotong (Hariyatun et al. 2014). Oleh karena itu, sistem ekspresi pRHA memungkinkan kloning dan ekspresi protein rekombinan yang stabil dengan hasil ekspresi protein yang fungsional serta memiliki tingkat ekspresi yang tinggi tanpa menganggu intergritas sel (Giacalone et al. 2006).
Purifikasi Protein Menggunakan Sistem Immobilized Metal-ion Affinity Chromatography (IMAC) Co2+
8
purifikasi protein dengan tag His agar dengan mudah menghasilkan protein dengan kemurnian tinggi dalam satu tahap proses (Judge et al. 2004; McMurry dan Macnab 2004). Metode ini didasarkan prinsip interaksi reversibel antara rantai samping asam amino seperti histidin, sistein dan triptofan, dengan ion logam (Gambar 5).
Gambar 5 Mekanisme molekular dari pengikatan polihistidin terhadap TALON resin IMAC Co2+ (Clontech Laboratories 2009). Tetradendat khelator mengikat ion kolbat, sehingga menghasilkan ikatan yang kuat dengan polihistidin.
Pemilihan histidin dikarenakan memiliki peran yang sangat selektif dalam mengikat logam tertentu dan memiliki utilitas besar pada resin IMAC. Selanjutnya pemilihan resin untuk purifikasi menggunakan IMAC sangat mempengaruhi kemurnian protein hasil purifikasi (McMurry dan Macnab 2004). Ion logam yang umum digunakan pada resin IMAC adalah Co2+, Ni2+ atau Zn2+.
9 berukuran 5008 sebagai sumber vektor pRHA (Hariyatun et al. 2014). Sedangkan
E. coli Top10 dan E. coli NiCo21 berturut-turut digunakan untuk kloning dan ekspresi (Invitogen 2013; Robichon et al. 2011).
Prosedur Analisis Data Isolasi Gen Target
Preparasi tahap isolasi gen target, dilakukan melalui isolasi plasmid rekombinan yang mengandung gen araA dari E. coli BL21 yang membawa plasmid tersebut menggunakan QIAprep Spin Miniprep Kit menurut protokol produsen. Plasmid yang diperoleh diverifikasi dengan analisis elektroforesis gel agarosa (Ausubel et al. 2002). Gen araA yang menyandi L-AI pada penelitian ini memiliki situs restriksi NdeI di tengah gen, kemudian dilakukan penghilangan situs resriksi ditengah gen untuk memfasilitasi dan mempermudah proses ligasi, penghilangan situs restriksi dilakukan dengan teknik QuickChangeTM(SDM), primer spesifik SDM-NdeI-F/R yang didisain dengan program Bioedit (Stratagen 1998; Kusharyoto et al. 2002; Munteanu et al. 2012; Tabel 1).
Tabel 1 Sekuen primer yang digunakan dalam mengkonstruksi gen araA
Primer Sekuen nukleotida 53
L-AI-F GCGAGCATATGATGCTGTCATTACGTCCTTATGAATTTTGG
L-AI-R GTCACCTCGAGTTAATGGTGATGGTGATGGTGCCGCCCCCG CCAAAATACTTCATTCCATC
SDM-NdeI-F CTCGGCGCTCACATGCTCGAAGTATG SDM-NdeI- R CATACTTCGAGCATGTGAGCGCCGAG
F : Primer forward, R : primer reverse, underline (situs restriksi)
Amplifikasi polymerase chain reaction (PCR) untuk proses SDM dilakukan pada tahap-tahap berikut: pradenaturasi 95°C selama 2 menit, denaturasi 95°C selama 1 menit, penempelan 68.4°C selama 50 detik, pemanjangan pada temperatur 72°C selama 10 menit, dan pemanjangan akhir 72°C selama 3 menit. Selanjutnya produk PCR didigesti dengan enzim restriksi DpnI. Hasil PCR yang telah didigesti dengan DpnI ditransformasi ke dalam E. coli Top10 dengan metode
10
150 rpm. Kemudian dilakukan isolasi plasmid pET21b-araA yang telah termutasi. Selanjutnya plasmid didigesti dengan enzim restriksi NdeI, dan dilakukan visualisasi dengan analisis elektroforesis gel agarosa 1%, dan sekuensing DNA.
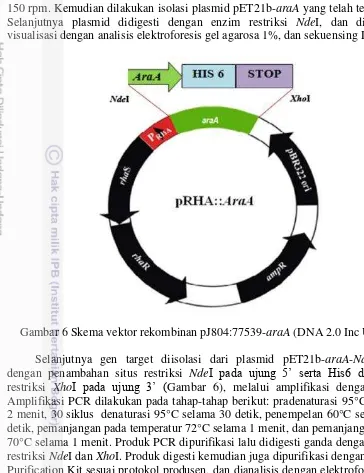
Gambar 6 Skema vektor rekombinan pJ804:77539-araA (DNA 2.0 Inc USA) Selanjutnya gen target diisolasi dari plasmid pET21b-araA-NdeI-Mut, dengan penambahan situs restriksi NdeI pada ujung 5’ serta His6 dan situs
restriksi XhoI pada ujung 3’ (Gambar 6), melalui amplifikasi dengan PCR. Amplifikasi PCR dilakukan pada tahap-tahap berikut: pradenaturasi 95°C selama 2 menit, 30 siklus denaturasi 95°C selama 30 detik, penempelan 60°C selama 30 detik, pemanjangan pada temperatur 72°C selama 1 menit, dan pemanjangan akhir 70°C selama 1 menit. Produk PCR dipurifikasi lalu didigesti ganda dengan enzim restriksi NdeI dan XhoI. Produk digesti kemudian juga dipurifikasi dengan Qiagen Purification Kit sesuai protokol produsen, dan dianalisis dengan elektroforesis gel agarosa 1%.
Subkloning dan Transformasi
11 Pemodelan Homologi L-AI dan Substrat Docking
Struktur model 3 dimensi (3D) dari L-AI dibangun berdasarkan struktur kristalografi dari L-AI yang berasal dari E. coli (PDB entri: 4f2d). Model 3D dibentuk dengan menggunakan Swiss-model Workspace (Arnold, et al. 2006). Kualitas model diverifikasi dengan program ProCheck (Laskowski et al. 1996), Verify3D (Luthy et al. 1992) dan QMEAN (Benkert et al.2008).
Stuktur model dari substrat docking D-galaktosa, ke situs katalitik L-AI dari
G. stearothermophilus dilakukan dengan menggunakan AutoDock Vina (Trott dan Olson 2010). Sebagai informasi awal digunakan L-AI yang berasal dari E. coli, enzim tersebut berikatan dengan substrat D-ribulosa untuk menentukan katalitik domain L-AI (PDB entri: 4f2d) data tersebut digunakan untuk menentukan posisi awal D-galaktosa dalam kantong pengikat. Atom hidrogen ditambahkan untuk mempersiapkan file enzim, struktur 3D disimpan dalam format pdbqt dalam AutoDock Tools. File substrat disiapkan dengan cara yang sama. Selama percobaan docking, substrat dan asam amino residu disekitar substrat dibuat menjadi fleksibel.
Rekayasa Gen Target
Kandidat mutasi gen dimodifikasi dengan teknik QuickChangeTMSDM, untuk mengganti nukleotida pada titik yang diinginkan. SDM dilakukan melalui amplifikasi PCR menggunakan primer spesifik SDM-S393T-F/R, SDM-F280L-F/R dan SDM-F280N-SDM-F280L-F/R yang didisain dengan program Bioedit (Tabel 2). Selanjutnya produk PCR menghasilkan vektor rekombinan yang ditransfromasi ke dalam E. coli Top10, dengan metode heatshock (Chung et al. 1989). Klon positif diseleksi, dan vektor rekombinan kemudian diisolasi kembali. Kemudian plasmid tersebut digunakan untuk ditransformasikan ke dalam E. coli NiCo21 dengan metode heatshock, plasmid mutan kemudian diisolasi dan diverifikasi dengan sekuensing DNA menggunakan primer spesifik (Tabel 2).
Tabel 2 Sekuen nukleotida dari primer yang digunakan dalam teknik SDM
Primer Sekuen nukelotida 53
12
Ekspresi Gen Target
Ekspresi gen penyandi araA dilakukan melalui koloni tunggal dari klon positif E. coli NiCo21 yang mengandung vektor rekombinan pRHA-araA tipe liar dan pRHA-araA dengan variasi mutan ditumbuhkan dalam 5 mL media cair LB yang mengandung 100 µg/mL ampisilin, pada temperatur 26°C dan digoyang dengan kecepatan 150 rpm selama semalam (16 jam; OD600 0.6-0.8). Selanjutnya prekultur tersebut diinokulasi 1:20 ke dalam 200 mL media LB yang mengandung ampisilin 100 µg/mL dan 0.2 % glukosa diinkubasi pada temperatur 26°C dan digoyang dengan kecepatan 150 rpm hingga fase eksponensial (OD600 0.5-0.6). Kemudian L-rhamnosa ditambahkan ke dalam kultur dengan konsentrasi akhir 2000 µM berdasarkan optimasi konsentrasi induksi L-rhamnosa (Lampiran 5). Pertumbuhan dilanjutkan selama semalam (Kusharyoto et al. 2002; Giacalone
et al. 2006). Setelah itu sel dipanen dengan sentrifugasi kecepatan 6000× g pada temperatur 4ºC selama 15 menit, kemudian pelet sel diresuspensi dengan 20 mL
lysis buffer, yang mengandung 50 mM Tris-Cl, 300 mM NaCl dan ditambahkan
phenylmethanesulfonyl fluoride (PMSF) dengan konsentrasi akhir 1 mM. Isolasi dan Purifikasi Protein Target
Isolasi protein dari sel dilakukan melalui metode sonikasi selama 30 detik sebanyak tiga kali pengulangan dalam keadaan dingin, kemudian disentrifugasi dengan kecepatan 20.000× g pada temperatur 4°C selama 15 menit (Kusharyoto et al. 2002). Kemudian enzim L-AI dipurifikasi dengan menggunakan sistem
Immobilized Metal-ion Affinity Chromatography (IMAC) Co2+ pada matrix TALON (Kusharyoto et al. 2002; McMurry dan Macnab 2004; Giacalone et al. 2006).
Analisis Hasil Ekspresi
Ekspresi protein target dianalisis dengan SDS-PAGE. Sebanyak 10 µL sample protein ditambahkan dengan 10 µL buffer Leammli (Leammli 1970). Sampel kemudian didenaturasi pada temperatur 95-100ºC. Selanjutnya sample dimasukan ke dalam agar dengan volume total 20 µL. Konsentrasi gel stacking
dan separating berturut-turut 12%, tegangan 70 volt selama 120 menit. Kadar protein enzim dihitung menggunakan standar BSA 0.4-2.4 µM yang dilarikan bersamaan dengan protein rekombinan di dalam agar. Kemudian pita sampel dan standar, dianalisis berdasarkan luas area dengan menggunakan program ImageJ. Uji Aktivitas Enzim L-Arabinosa Isomerase
13 560 nm. Uji aktivitas dilakukan sebanyak dua kali dengan teknik triplo pada setiap pengujiannya. Kemudian dilakukan analisis perhitungan untuk mengetahui aktivitas spesifik enzim atau jumlah tagatosa yang dihasilkan oleh 1 unit enzim L-AI persatuan waktu.
4
HASIL DAN PEMBAHASAN
Subkloning, Mutasi pada pRHA-araA dan Ekspresi
Penelitian ini telah berhasil melakukan subkloning gen araA (1512 bp) yang mengkode enzim L-AI ke dalam plasmid pRHA (4177 bp) sebagai vektor ekspresi (Gambar 7a), pada ujung C-terminal gen tersebut telah didisain membawa His6 untuk memfasilitasi purifikasi protein (Judge et al. 2004; Kuhne et al. 2004; Tabel 1 dan Lampiran 4). Selanjutnya plasmid rekombinan pRHA-araA di transformasi ke dalam E. coli NiCo21 sebagai inang ekspresi protein rekombinan L-AI.
Pemilihan strain E. coli NiCo21 (DE3) sebagai inang ekspresi karena strain ini memiliki keunggulan dalam mempermudah proses purifikasi protein rekombinan dengan IMAC. Strain NiCo21 merupakan E. coli turunan dari BL21 yang telah direkayasa untuk meminimalisasi kontaminasi protein rekombinan oleh protein endogen E. coli yang terikat di fraksi IMAC, selain itu NiCo21 memiliki tingkat efisiensi transformasi yang baik, defisiensi protease Lon dan OmpT, serta resisten terhadap phage T1 (Robichon et al. 2011). Hasil menunjukkan pRHA dengan baik mampu mengekspresikan protein rekombinan L-AI secara utuh di dalam sitoplasma E. coli NiCo21 (Gambar 7b; Lampiran 6).
Konstruksi vektor rekombinan pRHA-araA dilakukan untuk mempelajari ekspresi gen penyandi fragmen protein L-AI pada sitoplasma E. coli di bawah kontrol PRHA. Vektor pRHA yang digunakan dalam penelitian ini merupakan sistem ekspresi E. coli alternatif yang layak untuk kloning dan ekspresi protein rekombinan fungsional yang stabil (Giacalone et al. 2006). Vektor ini memiliki PRHA yang teregulasi dengan ketat oleh induser L-rhamnosa dan represor D-glukosa (Egan dan Schleif 1993), sehingga penggunaan vektor ini dimaksudkan untuk mengatasi kendala tingkat ekspresi yang rendah dan kebocoran ekspresi.
Vektor ini juga digunakan untuk berbagai strain E. coli karena vektor ini memiliki PRHA yang berasal dari E. coli. Selain itu vektor ini memiliki terminator untuk mencegah transkripsi lebih lanjut dari gen selain dari gen yang diinginkan, sehingga mencegah pengeluaran energi yang tidak perlu dari sel agar stabilitas sistem ekspresi terjaga (Wegerer et al. 2008). Vektor ini juga memiliki origin of replication (ori) pBR322, sekuen ribosom binding site (RBS), dan gen penanda
ampR (Lampiran 4). Lebih lanjut pemilihan vektor pRHA yang berbasis induksi rhamnosa dipilih karena induksi berbasis rhamnosa memiliki nilai ekonomis yang jauh lebih murah dibandingkan dengan induksi menggunakan IPTG, sehingga vektor ini layak untuk dikembangkan di dunia industri sebagai salah satu langkah dalam efisiensi biaya produksi.
14
Kemudian dilakukan sekuensing (1st BASE, Malaysia). Hasil analisis tersebut menunjukkan bahwa gen telah terligasi ke dalam vektor pRHA dengan orientasi yang benar (Lampiran 4).
Ekspresi protein rekombinan telah diverifikasi dengan SDS-PAGE. Berat molekul dari protein L-AI dengan penambahan His6 diestimasikan sekitar 57 kDa. Hasil yang diperoleh menunjukkan bahwa protein rekombinan L-AI telah berhasil diekspresikan di dalam sitoplasma E. coli dengan ukuran protein 57 kDa sesuai dengan yang diharapkan (Gambar 7b), dimana pRHA tanpa induksi L-rhamnosa menunjukkan tidak terekspresinya protein rekombinan, sedangkan penambahan L-rhamnosa mampu meregulasi ekspresi protein rekombinan L-AI.
Penambahan glukosa ke dalam media sebanyak 0.2% bertujuan untuk memblok ekspresi yang bocor sebelum induksi (Giacalone et al. 2006), proses induksi dilakukan setelah proses represi dilakukan, agar sel inang mampu tumbuh dengan optimal sebelumnya, sehingga menghasilkan tingkat ekspresi yang lebih tinggi. pRHA-araA tanpa induksi L-rhamnosa tidak mengekspresikan protein rekombinan AI, selanjutnya hasil analisis dari ekspresi protein rekombinan L-AI pada berbagai konsentrasi telah dilakukan untuk mengetahui konsentrasi optimal induksi L-rhamnosa (Lampiran 5), pada konsentrasi 0 µM tidak terlihat adanya pita yang menunjukkan terekspresinya protein rekombinan L-AI dan konsentrasi L-rhamnosa terbaik untuk induksi yaitu 2000 µM. Hal ini membuktikan bahwa keberadaan L-rhamnosa penting dalam menginduksi protein rekombinan target dan glukosa sebagai repressor dengan ketat mampu merepresi ekspresi protein rekombinan L-AI.
Gambar 7 7a. Hasil visualisasi elektroforesis plasmid rekombinan pRHA-araA. M. Marker 1 kb. K1 dan K2. PCR plasmid koloni 1 dan koloni 2 dengan primer isolasi gen araA. Plasmid rekombinan koloni 1 didigesti dengan NdeI. Plamid koloni 1 didigesti dengan NdeI dan
15 Analisis hasil sekuensing dilakukan dengan Blast dan CrustalW. Hasil yang diperoleh menunjukkan bahwa mutasi dengan metode SDM telah berhasil dilakukan, dengan lima variasi mutasi yakni, S393T (Gambar 8). Selanjutnya gen
araA dari tipe liar dan kelima mutan diekspresikan, kemudian seluruh protein L-AI dipurifikasi dengan TALON IMAC (Co2+). Hasil purifikasi protein L-AI diverifikasi dengan SDS-PAGE, kemudian dianalisis nilai aktivitas dari enzim L-AI (Lampiran 6; Lampiran 8).
Gambar 8 Analisis sekuensing dengan multiple alignments dan crustalW terhadap gen araA mutan. 8a. Mutan F280L menunjukkan perubahan nukleotida TTCTTG dan mutan F280N, menunjukkan perubahan nukleotida TTCAAC. 8b. Mutan S393T, menunjukkan perubahan nukleotida GTCGAC.
Uji Aktivitas Mutan Enzim L-AI
Uji aktivitas enzim L-AI yang telah dipurifikasi dengan TALON IMAC (Co2+), telah dilakukan dengan metode cysteine-carbazole, dan diukur pada panjang gelombang 560 nm (Dische dan Borenfreund 1951). Uji aktivitas dengan metode cysteine-carbazole, menggunakan prinsip perubahan warna dari larutan uji sebelum dan sesudah ditambahkan sampel.
Perubahan warna larutan uji menjadi ungu sesudah sampel yang ditambahkan, terjadi karena pemutusan ikatan rangkap pada gugus O yang dimiliki gula ketohexosa oleh sulfur yang terkandung dalam larutan H2SO4 dan sistein, yang kemudian bereaksi dengan karbazol. Sehingga semakin banyak gula ketohexosa yang berada dalam larutan sampel, maka semakin pekat perubahan warna yang terjadi dan mempengaruhi nilai serapan ketika sampel diukur pada panjang gelombang optimal λ 560 nm (Dische dan Borenfreund 1951).
16
aktivitas spesifik tertinggi. Mutasi pada titik ini mampu meningkatkan aktivitas spesifik enzim 2.59 kali atau sebanyak 159% menjadi 0.518 U/mg dibandingkan tipe liar (Tabel 3). Mutasi pada asam amino serin menjadi threonin, diduga mampu mengubah konformasi enzim. Menurut Lehninger (1994), serin dan threonin merupakan asam amino yang bersifat polar, hidrofilik, dengan gugus R tidak bermuatan. Namun berdasarkan struktur 3D, posisi 393 berada pada lapisan kedua dari situs pengikatan enzim. Perubahan asam amino threonin yang memiliki volume asam amino lebih besar dibandingkan serin, dan mendesak lapisan pertama enzim yang merupakan asam amino yang berperan sebagai situs pengikatan enzim dengan substrat sehingga menyebabkan substrat lebih dekat dengan situs katalitik enzim.
Tabel 3 Uji aktivitas enzim L-AI pada substrat D-galaktosa
Mutan Aktivitas enzim
(% ) Nilai persentase dari aktivitas spesifik mutan terhadap tipe liar 100%
Penelitian lain yang telah dilakukan oleh Oh et al. (2006) mengubah asam amino yang sama S393T pada strain G. thermodenitrificans. Mampu meningkatkan aktivitas enzim sebesar 18% dari tipe liar yaitu sebesar 0.14 U/mg menjadi 0.165 U/mg. Verifikasi dilakukan terhadap sekuen nukleotida dan asam amino penyusun enzim L-AI yang berasal dari G. stearothermophilus dan L-AI dari G. thermodenitrificans. Diketahui terdapat 8 asam amino yang berbeda antara keduanya, dengan tingkat kemiripan sekuen nukleotida senilai 98%. Sehingga dapat diperkirakan bahwa perbedaan asam amino tersebut yang mempengaruhi enzim L-AI tipe liar yang berasal dari strain G. stearothermophilus memiliki aktivitas yang lebih tinggi jika dibandingkan L-AI yang berasal dari G. thermodenitrificans.
Mutasi pada posisi F280, menjadi leusin dan asparagin menunjukkan peningkatan aktivitas spesifik enzim berturut-turut, sekitar 1.25 dan 1.15 kali dari tipe liar. Perubahan asam amino dari fenilalanin yang merupakan asam amino aromatik, hidrofobik, dan relatif non polar, menjadi leusin yang merupakan asam amino dengan gugus alifatik (Lehninger 1994) akan mengubah konformasi dari enzim L-AI, sehingga mampu meningkatkan afinitas secara signifikan. Hal ini mengacu pada penelitian yang dilakukan oleh Kusharyoto et al. (2002) yang telah melakukan mutasi pada wilayah ikatan hapten anti-atrazine, dengan memutasi F32 menjadi leusin, diperoleh hasil peningkatan afinitas 2 kali dari sebelumnya.
17 lebih stabil (Kim et al. 2014). Penelitian sebelumnya telah dilakukan untuk mengidentifikasi bahwa titik F280 dekat dengan residu D-galaktosa. Lebih lanjut mutasi pada titik F280N enzim L-AI dari strain G. thermodenitrificans C450S-N475K, perubahan tersebut mampu meningkatkan aktivitas enzim L-AI 2.3 kali dari tipe liar (Kim et al. 2014).
Mutasi ganda S393T-F280L meningkatkan 1.14 kali aktivitas spesifik L-AI lebih tinggi dari tipe liar. Hal ini diduga karena ikatan hidrogen yang terbentuk dari kedua titik mutasi tersebut lebih kuat dibandingkan dengan tipe liar. Namun nilai tersebut tidak lebih tinggi dibandingan dengan mutasi tunggal. Hal ini diduga karena posisi F280L terletak cukup jauh dengan S393T sehingga tidak ada interaksi secara langsung antara kedua situs tersebut terhadap situs aktif enzim dan interaksi salah satu atau keduanya terhadap kofaktor enzim yaitu Mn2+.
Selanjutnya Mutasi ganda S393T-F280N menunjukkan menurunkan aktivitas spesifik 0.94 kali dibandingkan tipe liar. Penambahan F280N pada mutan S393T memberikan efek yang tidak menguntungkan yaitu penurunan aktivitas spesifik enzim sebanyak 6%.
5
SIMPULAN DAN SARAN
Simpulan
Gen penyandi enzim L-AI telah berhasil dikloning ke dalam vektor pRHA. Gen tersebut telah berhasil dimutasi dengan menggunakan teknik SDM pada titik mutasi tunggal, S393T, F280N, F280L, dan mutasi ganda S393T-F280L serta S393T-F280N. Selain itu enzim L-AI mutan juga telah berhasil diekspresikan di sitoplasma E. coli NiCo21. Protein rekombinan tipe liar dan mutan memiliki berat molekul yang sama yaitu 57 kDa. Lebih lanjut, hasil uji aktivitas enzim L-AI dari kelima mutan, tersebut menunjukkan bahwa empat diantaranya memberikan peningkatan aktivitas spesifik enzim L-AI.
Mutan S393T memiliki aktivitas spesifik tertinggi yaitu 0.518 U/mg atau sekitar 2.58 kali dibandingkan dengan tipe liar dan diikuti oleh mutan F280L, F280N dan S393T-F280L berturut-turut yaitu 1.24, 1.15, dan 1.14 kali dibandingkan dengan tipe liar. Sedangkan mutan S393T-F280N menunjukkan penurunan aktivitas spesifik enzim 0.94 kali dibandingkan tipe liar.
Saran
18
DAFTAR PUSTAKA
Ausubel FM, Brent R, Kingston RE, Moore DD, Seidman JG, Smith JA, Struhl K (Eds). 2002. Short protocols in molecular biology. John Wiley andSons, Inc. New York, USA. ISBN: 978-0-471-25092-0.
Arnold K, Bordoli L, Kopp J, Schwede T. 2006. The SWISS-MODEL workspace: A web-based environment for protein structure homology modelling. Bioinfo.
22: 195–201.
Beadle JR, Sauder JP, Wajada TJ. 1991. Process for manufacturing tagatosa. US patent 500261.
Benkert P, Tosatto SC, Schomburg D. 2008. QMEAN: A comprehensive scoring function for model quality assessment. Prot: StrucFunctBioinfor. 71(1): 261-277.
Buemann B, Toubro S, Raben A, Astrup A. 1999. Human tolerance to a single, high dose of D-tagatosa. Regul ToxicPharm. 29: S66–S70.
Cheetam PS and Wootton AN. 1993. Bioconversion of D-galactose to D-tagatose.
EnzyMicrobTechnol. 15: 105-108.
Chung CT, Niemela SL, Miller RH. 1989. One-step preparation of competent
Escherichia coli: transformation and storage of bacterial cells in the same solution. Proc Natl Acad Sci USA. 86: 2172-2175.
Clontech Laboratories. 2009. TALON® metal affinity resins user manual. Technical Support. Protocol No. PT1320-1. Version No. PR993342. Clontech Laboratories, Inc. California. United States.
Deutscher J, Francke C, Postma PW. 2006. How phosphotransferase systemrelated protein phosphorylation regulates carbohydrate metabolism in bacteria. Microbiol MolecBiol Reviews. 70 (4): 939-1031.
Dische Z and Borenfreund E. 1951. A new spectrophotometric method for the detection and determination of keto sugar and trioses. J BiolChem. 192: 583– 587.
Donner TW, Wilber JF, Ostrowski D. 1999. D-tagatose, a novel hexose: acute effects on carbohydrate tolerance in subjects with and without type 2 diabetes.
Diab Obes Metab. 1: 285–291.
Egan SM and Schleif RF. 1993. A regulatory cascade in the induction of rhaBAD.
J.MolBio. 23: 87-98.
Fitriani D and Saksono B. 2010. Cloning of araA gene encoding L-arabinose isomerase from marine G. stearothermophilus isolated from Tanjung Api Poso Indonesia. J Hayati. 17: 58-62.
Giacalone MJ, Gentile AM, Lovitt BT, Berkley NL, Gunderson CW, Surber MW. 2006. Toxic protein expression in Escherichia coli using a rhamnose-based tightly regulated and tunable promoter system. BioTechniques. 40: 355-364. Hariyatun, Suwanto A, Kusharyoto W. 2014. Expression of an Immunogenic
Intimin Fragment of EHEC O157:H7 in Escherichia coli periplasm under the control of a rhamnose-based regulated promoter. Annales Bogor. 18 (1): 25-34 Holcroft CC and Egan SM. 2000. Interdependence of activation at rhaSR by
19 Invitrogen. 2013. One Shot® TOP10 Competent Cells. User Guide. Catalog
C4040-10, C4040-03, C4040-06, C4040-50, and C4040-52. Revision A.0 Izumori K, Miyoshi T, Tokuda S, Yamabe K. 1984. Production of D-tagatose
from dulcitol by Acetobacter globiformis. Appl EnvironMicrobio. 46: 1055- 1057.
Judge NA, Mason HS, O’Brien AD. 2004. Plant cell-based Intimin vaccine given orally to mice primed with Intimin reduces time of Escherichia coli O157:H7 shedding in feces. Infect Immun. 72 (1): 168-175.
Jung ES, Kim HJ, Oh DK. 2005. Tagatose production by immobilized recombinant Escherichia coli cells containing G. stearothermophilus L-arabinose isomerase mutant in a packed-bed bioreactor. BiotechProg. 21: 1335-1340.
Jørgensen F, Hancen OC, Stougaard P. 2004. Enzymatic conversion of D-galactose to D-tagatose: heterologous expression and characterization of thermostable L-arabinose isomerase from Thermoanaerobacter mathranii.
Appl Microb Biotec. 64: 816- 822.
Kim BC, YH Lee, HS Lee, DW Lee, EA Choe, YR Pyun. 2002. Cloning, expression and characterization of L-arabinose isomerase from
Thermotoga neapolitana: bioconversion of D-galactose to D-tagatose using the enzyme. FEMS MicrobiolLett. 212: 121–126.
Kim BJ, Hong SH, Shin KC, Jo YS, Oh DK. 2014. Characterization of F280N varian of L-arabinose isomerase from G. thermodenitricans identified as a D-galactose isomerase. Appl MicBiotech. 98(22): 9271-81
Kim JW, Kim YW, Roh HJ, Kim HY, Cha JH, Park KH, Park CS. 2003. Production of tagatose by a recombinant thermostable L-arabinose isomerase from Thermus sp. IM6501. Biotech Lett. 25: 963-967.
Kim HJ and Oh DK. 2005. Purification and characterization of an L-arabinose isomerase from an isolated strain of G. thermodenitrificans producing D-tagatose. J Biotechnol. 120: 162-173.
Kim P. 2004. Current studies on biological tagatose production using L-arabinose isomerase: a review and future perspective. Appl Microb Biotech. 65(3): 243– 249
Kolin A, Balasubramaniam V, Skredenske JM, Wickstrum JR, Egan SM. 2008. Differences in the mechanism of the allosteric L-rhamnose responses of the AraC/XylS family transcription activators RhaS and RhaR. Mol Microbiol. 68: 448-461.
Kühne SA, Hawes WS, La Ragione RM, Woodward MJ, Whitelam GC, Gough KC. 2004. Isolation of recombinant antibodies against EspA and Intimin of
Escherichia coli O157:H7. J Clin Microb. 42 (7): 2966-2676.
Kusharyoto W, Pleiss J, Bachman TT, Schmid RD. 2002. Mapping of a hapten binding site: molecular modeling and site directed mutagenesis study of an anti-atrazine antibody. Prot Eng. 15(3): 233-241.
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227: 680-685.
20
Lee D, H Jang, E Choe, B Kim, S Lee, S Kim, Y Hong, Y Pyun. 2004. Characterization of a thermostable L-arabinose isomerase from the hyperthermophilic eubacterium Thermotoga maritima. Appl Environ Microbiol . 70: 1397–1404.
Levin GV, Zehner JP, Saunders JR, Beadle. 1994. Sugar substitutes: their energy values, bulk characteristics, and potential health benefits. Am J Clin Nutr. 62: 1161S–1168S.
Levin GV. 2002. Tagatose, the new GRAS sweetener and health product. J. Med. Food. 5: 23–36.
Liu H and James HN. 2008. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC biotech. 8: 91 Liu S, Wiegel J, FC Gherardini. 1996. Purification and cloning of a
thermostable xylose (glucose) isomerase with an acidic pH optimum from
Thermoanaerobacterium strain JW/SL-YS 489. J Bacteriol. 178: 5938–5945. Lüthy R, Bowie JU, Eisenberg D. 1992. Assessment of protein models with
threedimensional profiles. Nature. 356: 83–5.
McMurry JL and Macnab RM. 2004. BD TALON™ resin does not bind
Escherichia coli SlyD, a common contaminant in Ni-NTA IMAC. Technical Note. BD Biosciences Clontech.
Munteanu B, Braun M, Boonrod K. 2012. Improvement of PCR reaction conditions for site-directed mutagenesis of big plasmids. J Zhejiang Uni-Sci B.
13(4): 244-247.
Oh DK, Oh HJ, Kim HJ, Cheon J, Kim P. 2006. Modification of optimal pH in L-arabinose isomerase from G. stearothermophilus for D-tagatose isomerization.
J Mol Cat. 43: 108-112.
Rhimi M, Juy M, Aghajari N, Haser R, Bejar S. 2007. Probing the essensial catalytic residue and substrate affinity in the thermoactive Bacillus stearothermophilus US100 L-arabinose isomerase by site-directed mutagenesis.
J Bacteriol. 189: 3556-3563.
Robichon C, Luo J, Causey TB, Benner JS, Samuelson JC. 2011. Engineering
Escherichia coli BL21 (DE3) derivative strains to minimize E. coli protein contamination after purification by immobilized metal affinity chromatography. Appl Envir Micro. 77(13): 4634–4646.
Stratagen. 1998. QuikChange™ Site-Directed Mutagenesis Kit. Instruction Manual. Catalog #200518. Revision #108005h.
Stülke J and Hillen W. 1999. Carbon repression in bacteria. Curr Opin Microbiol . 2: 195-201.
Tobin JF and Schleif RF. 1987. Positive regulation of the Escherichia coli L-rhamnose operon is mediated by the products of tandemly repeated regulatory genes. J Mol Biol. 196: 789-799.
Tobin JF and Schleif RF. 1990a. Transcription from the rha operon psr promoter.
J Mol Biol. 211: l-4.
Tobin JF and Schleif RF. 1990b. Purification and properties of RhaR, the positive regulator of the L-rhamnose operons of Escherichia coli. J Mol Biol. 211: 75-89.
21 Vía P, Badía J, Baldomà L, Obradors N, Aguilar J. 1996. Transcriptional
regulation of the Escherichia coli rhaT gene. Microbiol. 142: 1833-1840. Wang W and Marcolm BA. 1999. Two-stage PCR protocol allowing introduction
of multiple mutations, deletions and insertions using QuickChangeTM site-directed mutagenesis. BioTechniques. 26: 680–682.
Wegerer A, Sun T, Altenbuchner J. 2008. Optimization of an E. coli L-rhamnose inducible expression vector: test of various genetic module combinations. BMC Biotechnol. 8(1): 2-9.
Wickstrum JR, Skredenske JM, Kolin A, Jin DJ, Fang J, Egan SM. 2007. Transcription activation by the DNA-binding domain of the AraC family protein RhaS in the absence of its effector-binding domain. J Bacteriol. 189 (14): 4984-4993.
Yoon SH, Kim P, Oh DK. 2003. Properties of L-arabinose isomerase from Escherichia coli as biocatalyst for tagatose production. World J Micro Biotech. 19: 47–51.
22
Lampiran 1 Sekuen DNA gen araA dari strain G. stearothermophilus, Indonesia
Sekuen asam amino dari gen araA:
23
1216 AAT GAA GTC GAT GCG GTG AAA CCG GAA CAC GAC ATG CCG AAA TTA N E V D A V K P E H D M P K L 1261 CCA GTC GCC CGC ATT TTA TGG AAG CCT CGC CCG TCG CTC CGC GAC
P V A R I L W K P R P S L R D 1306 TCC GCT GAA GCA TGG ATT TTA GCT GGC GGC GCC CAC CAT ACG TGC
S A E A W I L A G G A H H T C 1351 TTC TCA TTT GCG GTT ACA ACA GAA CAG CTG CAA GAC TTT GCG GAA F S F A V T T E Q L Q D F A E 1396 ATG GCA GGG ATT GAA TGT GTC GTG ATC AAT GAA CAT ACG TCC GTC
M A G I E C V V I N E H T S V 1441 CCC TCA TTC AAG AAC GAA CTA AGA TGG AAT GAA GTA TTT TGG CGG
P S F K N E L R W N E V F W R 1486 GGG CGG CAC CAT CAC CAT CAC CAT TAA*
G R H H H H H H stop
Keterangan :
Hitam : nukleotida
Merah : asam amino
Kuning : nukleotida yang menyandi kodon stop
24
Lampiran 2 Sekuen DNA vektor Rhamex rekombinan pJExpress804::araA
1 TTAATCTTTC TGCGAATTGA GATGACGCCA CTGGCTGGGC GTCATCCCGG 51 TTTCCCGGGT AAACACCACC GAAAAATAGT TACTATCTTC AAAGCCACAT 101 TCGGTCGAAA TATCACTGAT TAACAGGCGG CTATGCTGGA GAAGATATTG 151 CGCATGACAC ACTCTGACCT GTCGCAGATA TTGATTGATG GTCATTCCAG 201 TCTGCTGGCG AAATTGCTGA CGCAAAACGC GCTCACTGCA CGATGCCTCA 251 TCACAAAATT TATCCAGCGC AAAGGGACTT TTCAGGCTAG CCGCCAGCCG 301 GGTAATCAGC TTATCCAGCA ACGTTTCGCT GGATGTTGGC GGCAACGAAT 351 CACTGGTGTA ACGATGGCGA TTCAGCAACA TCACCAACTG CCCGAACAGC 401 AACTCAGCCA TTTCGTTAGC AAACGGCACA TGCTGACTAC TTTCATGCTC 451 AAGCTGACCA ATAACCTGCC GCGCCTGCGC CATCCCCATG CTACCTAAGC 501 GCCAGTGTGG TTGCCCTGCG CTGGCGTTAA ATCCCGGAAT CGCCCCCTGC 551 CAGTCAAGAT TCAGCTTCAG ACGCTCCGGG CAATAAATAA TATTCTGCAA 601 AACCAGATCG TTAACGGAAG CGTAGGAGTG TTTATCATCA GCATGAATGT 651 AAAAGAGATC GCCACGGGTA ATGCGATAAG GGCGATCGTT GAGTACATGC 701 AGGCCATTAC CGCGCCAGAC AATCACCAGC TCACAAAAAT CATGTGTATG 751 TTCAGCAAAG ACATCTTGCG GATAACGGTC AGCCACAGCG ACTGCCTGCT 801 GGTCGCTGGC AAAAAAATCA TCTTTGAGAA GTTTTAACTG ATGCGCCACC 851 GTGGCTACCT CGGCCAGAGA ACGAAGTTGA TTATTCGCAA TATGGCGTAC 901 AAATACGTTG AGAAGATTCG CGTTATTGCA GAAAGCCATC CCGTCCCTGG 951 CGAATATCAC GCGGTGACCA GTTAAACTCT CGGCGAAAAA GCGTCGAAAA 1001 GTGGTTACTG TCGCTGAATC CACAGCGATA GGCGATGTCA GTAACGCTGG 1051 CCTCGCTGTG GCGTAGCAGA TGTCGGGCTT TCATCAGTCG CAGGCGGTTC 1101 AGGTATCGCT GAGGCGTCAG TCCCGTTTGC TGCTTAAGCT GCCGATGTAG 1151 CGTACGCAGT GAAAGAGAAA ATTGATCCGC CACGGCATCC CAATTCACCT 1201 CATCGGCAAA ATGGTCCTCC AGCCAGGCCA GAAGCAAGTT GAGACGTGAT 1251 GCGCTGTTTT CCAGGTTCTC CTGCAAACTG CTTTTACGCA GCAAGAGCAG 1301 TAATTGCATA AACAAGATCT CGCGACTGGC GGTCGAGGGT AAATCATTTT 1351 CCCCTTCCTG CTGTTCCATC TGTGCAACCA GCTGTCGCAC CTGCTGCAAT 1401 ACGCTGTGGT TAACGCGCCA GTGAGACGGA TACTGCCCAT CCAGCTCTTG 1451 TGGCAGCAAC TGATTCAGCC CGGCGAGAAA CTGAAATCGA TCCGGCGAGC 1501 GATACAGCAC ATTGGTCAGA CACAGATTAT CGGTATGTTC ATACAGATGC 1551 CGATCATGAT CGCGTACGAA ACAGACCGTG CCACCGGTGA TGGTATAGGG 1601 CTGCCCATTA AACACATGAA TACCCGTGCC ATGTTCGACA ATCACAATTT 1651 CATGAAAATC ATGATGATGT TCAGGAAAAT CCGCCTGCGG GAGCCGGGGT 1701 TCTATCGCCA CGGACGCGTT ACCAGACGGA AAAAAATCCA CACTATGTAA 1751 TACGGTCATA CTGGCCTCCT GATGTCGTCA ACACGGCGAA ATAGTAATCA 1801 CGAGGTCAGG TTCTTACCTT AAATTTTCGA CGGAAAACCA CGTAAAAAAC 1851 GTCGATTTTT CAAGATACAG CGTGAATTTT CAGGAAATGC GGTGAGCATC 1901 ACATCACCAC AATTCAGCAA ATTGTGAACA TCATCACGTT CATCTTTCCC 1951 TGGTTGCCAA TGGCCCATTT TCCTGTCAGT AACGAGAAGG TCGCGAATTC
2001 AGGCGCTTTT TAGACTGGTC GTAATGAAAT TCTTTTGAAG GAGATATACA
2051 TATGATGCTG TCATTACGTC CTTATGAATT TTGGTTTGTA ACGGGAAGCC
2101 AGCACTTGTA CGGAGAAGAA GCATTAAGGC AAGTTGAAGA GCATTCAATG
2151 ATGATTGTCA ATGAGCTGAA TCAAGATTCA GTGTTCCCGT TCCCACTTGT
2201 TTTCAAATCA GTTGTCACAA CACCAGAGGA AATTCGGCGC GTTTGCCTTG
2251 AGGCGAATGC GAGCGAACAA TGCGCTGGGG TCATCACTTG GATGCATACA
2301 TTCTCGCCAG CGAAGATGTG GATTGGCGGC CTTTTGGAGC TGCGAAAACC
2351 GTTATTGCAT CTTCACACTC AATTTAACCG TGATATTCCG TGGGACAGCA
2401 TCGATATGGA CTTTATGAAC TTAAACCAAT CGGCTCACGG TGACCGGGAA
2451 TACGGATTTA TCGGCGCGAG AATGGGCGTG GCCCGGAAAG TGGTGGTCGG
2501 GCACTGGGAA GACCCAGAAG TCCGCGAGCG GCTGGCGAAA TGGATGCGGA
2551 CGGCTGTCGC GTTTGCGGAA AGCCGCAACC TAAAAGTGGC TCGTTTTGGC
2601 GACAACATGC GTGAAGTGGC TGTGACGGAA GGGGACAAAG TCGGAGCGCA
2651 AATTCAATTC GGCTGGTCGG TCAGCGGCTA TGGCATCGGG GATTTGGTGC
2701 AATACATCCG CGATGTTTCT GAACAAAAAG TGAACGAGTT GCTCGATGAA
25
2801 TCGCGAATCA ATTCGTGAAC AGGCGCGGAT TGAACTCGGG CTGAAAGCCT
2851 TTTTGCAGGA TGGGAACTTT ACCGCTTTCA CGACGACGTT CGAGGACTTG
2901 CATGGGATGA AGCAGCTCCC GGGACTTGCC GTTCAGCGAC TCATGGCGGA
2951 AGGCTACGGC TTTGGCGGCG AAGGCGACTG GAAAACAGCC GCCCTCGTCC
3001 GGTTGATGAA AGTCATGGCC GACGGCAAAG GGACGTCGTT CATGGAAGAT
3051 TACACGTATC ACTTCGAGCC GGGCAACGAA CTGATTCTCG GCGCTCATAT
3101 GCTCGAAGTA TGTCCGACGA TCGCGGCAAC CAAACCAAGA ATCGAAGTTC
3151 ATCCGCTTTC CATCGGCGGA AAAGAAGATC CGGCCCGTCT TGTGTTTGAC
3201 GGCGGCGAGG GTGCGGCGGT CAACGCGTCA TTGATCGACT TAGGGCACCG
3251 TTTCCGACTC ATCGTCAATG AAGTCGATGC GGTGAAACCG GAACACGACA
3301 TGCCGAAATT ACCAGTCGCC CGCATTTTAT GGAAGCCTCG CCCGTCGCTC
3351 CGCGACTCCG CTGAAGCATG GATTTTAGCT GGCGGCGCCC ACCATACGTG
3401 CTTCTCATTT GCGGTTACAA CAGAACAGCT GCAAGACTTT GCGGAAATGG
3451 CAGGGATTGA ATGTGTCGTG ATCAATGAAC ATACGTCCGT CCCCTCATTC
3501 AAGAACGAAC TAAGATGGAA TGAAGTATTT TGGCGGGGGC GGCACCATCA
3551 CCATCACCAT TAACTCGAGC CCCTCATCCG AAAGGGCGTA TTCGTATGCG
3601 GTGTGAAATA CCGCACAGAT GCGTAAGGAG AAAATACCGC ATCAGGCGCT 3651 CTTCCGCTTC CTCGCTCACT GACTCGCTGC GCTCGGTCGT TCGGCTGCGG 3701 CGAGCGGTAT CAGCTCACTC AAAGGCGGTA ATACGGTTAT CCACAGAATC
3751 AGGGGATAAC GCAGGAAAGA ACATGTGAGC AAAAGGCCAG CAAAAGGCCA
3801 GGAACCGTAA AAAGGCCGCG TTGCTGGCGT TTTTCCATAG GCTCCGCCCC
3851 CCTGACGAGC ATCACAAAAA TCGACGCTCA AGTCAGAGGT GGCGAAACCC
3901 GACAGGACTA TAAAGATACC AGGCGTTTCC CCCTGGAAGC TCCCTCGTGC
3951 GCTCTCCTGT TCCGACCCTG CCGCTTACCG GATACCTGTC CGCCTTTCTC
4001 CCTTCGGGAA GCGTGGCGCT TTCTCATAGC TCACGCTGTA GGTATCTCAG
4051 TTCGGTGTAG GTCGTTCGCT CCAAGCTGGG CTGTGTGCAC GAACCCCCCG
4101 TTCAGCCCGA CCGCTGCGCC TTATCCGGTA ACTATCGTCT TGAGTCCAAC
4151 CCGGTAAGAC ACGACTTATC GCCACTGGCA GCAGCCACTG GTAACAGGAT
4201 TAGCAGAGCG AGGTATGTAG GCGGTGCTAC AGAGTTCTTG AAGTGGTGGC
4251 CTAACTACGG CTACACTAGA AGGACAGTAT TTGGTATCTG CGCTCTGCTG
4301 AAGCCAGTTA CCTTCGGAAA AAGAGTTGGT AGCTCTTGAT CCGGCAAACA
4351 AACCACCGCT GGTAGCGGTG GTTTTTTTGT TTGCAAGCAG CAGATTACGC
4401 GCAGAAAAAA AGGATCTCAA GAAGATCCTT TGATCTTTTC TACGGGGTCT
4451 GACGCTCAGT GGAACGAAAA CTCACGTTAA GGGATTTTGG TCATGAGATT
4501 ATCAAAAAGG ATCTTCACCT AGATCCTTTT AAATTAAAAA TGAAGTTTTA
4551 AATCAATCTA AAGTATATAT GAGTAAACTT GGTCTGACAG TTACCAATGC
4601 TTAATCAGTG AGGCACCTAT CTCAGCGATC TGTCTATTTC GTTCATCCAT
4651 AGTTGCCTGA CTCCCCGTCG TGTAGATAAC TACGATACGG GAGGGCTTAC
4701 CATCTGGCCC CAGTGCTGCA ATGATACCGC GAGACCCACG CTCACCGGCT
4751 CCAGATTTAT CAGCAATAAA CCAGCCAGCC GGAAGGGCCG AGCGCAGAAG
4801 TGGTCCTGCA ACTTTATCCG CCTCCATCCA GTCTATTAAT TGTTGCCGGG
4851 AAGCTAGAGT AAGTAGTTCG CCAGTTAATA GTTTGCGCAA CGTTGTTGCC
4901 ATTGCTGCAG GCATCGTGGT GTCACGCTCG TCGTTTGGTA TGGCTTCATT
4951 CAGCTCCGGT TCCCAACGAT CAAGGCGAGT TACATGATCC CCCATGTTGT
5001 GCAAAAAAGC GGTTAGCTCC TTCGGTCCTC CGATCGTTGT CAGAAGTAAG
5051 TTGGCCGCAG TGTTATCACT CATGGTTATG GCAGCACTGC ATAATTCTCT
5101 TACTGTCATG CCATCCGTAA GATGCTTTTC TGTGACTGGT GAGTACTCAA
5151 CCAAGTCATT CTGAGAATAG TGTATGCGGCnGACCGAGTTG CTCTTGCCCG
5201 GCGTCAACAC GGGATAATAC CGCGCCACAT AGCAGAACTT TAAAAGTGCT
5251 CATCATTGGA AAACGTTCTT CGGGGCGAAA ACTCTCAAGG ATCTTACCGC
5301 TGTTGAGATC CAGTTCGATG TAACCCACTC GTGCACCCAA CTGATCTTCA
5351 GCATCTTTTA CTTTCACCAG CGTTTCTGGG TGAGCAAAAA CAGGAAGGCA
5401 AAATGCCGCA AAAAAGGGAA TAAGGGCGAC ACGGAAATGT TGAATACTCA
5451 TACTCTTCCT TTTTCAATAT TATTGAAGCA TTTATCAGGG TTATTGTCTC
5501 ATGAGCGGAT ACATATTTGA ATGTATTTAG AAAAATAAAC AAATAGGGGT
5551 TCCGCGCACA TTTCCCCGAA AAGTGCCACC TGACGTCTAA GAAACCATTA
5601 TTATCATGAC ATTAACCTAT AAAAATAGGC GTATCACGAG GCCCTTTCGT
26
Keterangan:
Sekuen pada posisi 1963-2029 (biru muda): PRHA
Sekuen pada posisi 2037-2048 (bergaris bawah;awal): RBS.
Posisi situs restriksi yang dipilih untuk keperluan kloning dalam sekuen DNA sumber vektor pRHA (diblok hijau): NdeI pada 2048 dan 2907; XhoI pada 3563
Sekuen pada posisi 3570-3588 (bergaris bawah; akhir) : Terminator
Sekuen pada posisi 3746-4497 (biru tua): ori pBR322
27 Lampiran 3 Skema rancangan penelitian
28
Lampiran 4 Hasil analisis sekuensing DNA dari pRHA-araA Primer SeqC01-F
Primer SeqC01-R
Keterangan :
RBS: Ribosom binding site, berfungsi sebagai situs penempelan ribosom dalam melakukan inisiasi translasi terhadap mRNA dari gen target dalam proses ekspresi (Tobin dan Schlief 1990).
NdeI dan XhoI: Situs restriksi yang digunakan untuk memfasilitasi subkloning gen araA dengan plasmid pRHA.
29 Lampiran 5 Hasil analisis SDS-PAGE dari ekspresi protein L-AI pada berbagai
konsentrasi L-rhamnosa (µM)
Keterangan :
M. Marker protein 20-120 kDa ( PierceTM
Prestained Protein MW Marker, ThermoFisher).
30
Lampiran 6 Perhitungan konsentrasi protein dari enzim L-AI
Keterangan :
A: Visualisasi SDS-PAGE protein rekombinan L-AI tipe liar dan mutan yang telah dipurifikasi dengan TALON IMAC Co2+ . Marker protein 10-250 kDa (Precision Plus ProteinTM Dual Color, BIO-RAD).
B: Standar BSA dengan konsentrasi (µg) 0.4 ; 0.6 ; 0.9 ; 1.2 ; 2 ; 2.4
Analisis kadar protein dengan program ImageJ sebagai berikut : Konsentrasi BSA (µg) Luas Area Gel imageJ
0.4 4940.134
0.6 6438.296
0.9 9035.418
1.2 11852.468
2 18894.012
2.4 24192.125
31
*Tabel perhitungan dari luas area dari pita protein hasil SDS-PAGE dengan menggunakan program ImageJ
y = 9461,9x + 731,31 R² = 0,995
0 5000 10000 15000 20000 25000 30000
0 0,5 1 1,5 2 2,5 3
L
u
as
Ar
ea
Konsentrasi BSA (µg)
Konsentrasi BSA
Mutan Total Protein (mg/mL)
Wildtype 1,631
S393T 0,765
F280L 2,037
F280N 1,722
S393T-F280L 1,62
32
33
Lampiran 8 Uji aktivitas enzim L-AI pada substrat D-galaktosa
Perlakuan Absorbansi I Absorbansi II x S
1 2 3 1 2 3
Blanko 0 0 0 0 0 0 0 0
Substrat 0.09 0.085 0.093 0.092 0.09 0.09 0.09 0.004
E1 0.025 0.027 0.027 0.03 0.027 0.026 0.027 0.001
E2 0.016 0.014 0.013 0.012 0.016 0.014 0.014 0.001
E3 0.02 0.025 0.018 0.019 0.018 0.023 0.0205 0.002
E4 0.015 0.013 0.012 0.012 0.012 0.016 0.013 0.001
E5 0.018 0.017 0.017 0.016 0.015 0.019 0.017 0.001
E6 0.022 0.024 0.024 0.02 0.022 0.017 0.021 0.002
CR1 tipe liar 0.062 0.064 0.06 0.065 0.061 0.063 0.0625 0.001
CR2 S393T 0.0734 0.072 0.073 0.071 0.07 0.073 0.072 0.001
CR3 F280L 0.91 0.87 0.865 0.87 0.87 0.95 0.889 0.034
CR4 F280N 0.73 0.72 0.75 0.725 0.71 0.69 0.72 0.02
CR5 S393T-F280L 0.7 0.69 0.66 0.685 0.68 0.683 0.683 0.013
CR6 S393T-F280N 0.705 0.718 0.716 0.69 0.697 0.692 0.703 0.012
34
Keterangan:
Nilai Absorbansi I merupakan hasil dari uji aktivitas pertama dengan teknik triplo pada setiap sampel uji.
Nilai Absorbansi II merupakan hasil uji aktivitas kedua (pengulangan) dengan teknik triplo pada setiap sampel uji.
x : Rata-rata dari nilai absoransi
S : Simpangan baku
Perlakuan Rata-rata Absorbansi (B+S+E) λ Tagatosa Kons.Tagatosa (mM)
Blanko (B) 0
Substrat (S) 0.09
E1 0.027 0.117
E2 0.014 0.104
E3 0.02 0.11
E4 0.013 0.103
E5 0.017 0.107
E6 0.021 0.111
CR1 tipe liar 0.63 0.513 1.964
CR2 S393T 0.721 0.617 2.378
CR3 F280L 0.889 0.779 3.024
CR4 F280N 0.72 0.617 2.378
CR5 S393T-F280L 0.683 0.576 2.215
CR6 S393T-F280N 0.703 0.592 2.279
35
Keterangan :
E1: enzim (tipe liar), E2 : enzim S393T, E3 : enzim F280L, E4: enzim F280N, E5: enzim S393T-F280N, E6: enzim S393T-F280L.
CR : campuran reaksi (substrat dan enzim L-AI)
λ Tagatosa : CR – (B+S+E)
Kons. Tagatosa : (K-b)/a (kurva standar tagatosa)
Mutan Aktivitas Enzim
(U/mL)
Aktivitas Spesifik
(U/mg) %
Tipe liar 0.327 0.201 100
S393T 0.396 0.518 259
F280L 0.504 0.247 124
F280N 0.396 0.230 115
S393T-F280L 0.369 0.227 114
S393T-F280N 0.380 0.188 94
Perhitungan :
Nilai tagatosa : (Abs. Blanko + Abs. Substrat + Abs. Enzim) – Abs. CR
Konsentrasi tagatosa : (x-b)/a
Persentase (%) : Persentase dari nilai aktivitas spesifik terhadap tipe liar
x: nilai tagatosa
a: nilai regresi kurva standar
b: nilai regresi kurva standar
Aktivitas enzim U/mL :
Aktivitas spesifik U/mg :