INISIASI DAN PROLIFERASI KALUS SERTA INDUKSI
KALUS EMBRIOGENIK PADA KULTUR ANTERA
KEDELAI (
Glycine max
L. Merrill)
RUFAI’AH FAISOL DZURAIBAK
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Inisiasi dan Proliferasi Kalus serta Induksi Kalus Embriogenik pada Kultur Antera Kedelai (Glycine max L. Merrill) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Rufai’ah Faisol Dzuraibak
RINGKASAN
RUFAI’AH FAISOL DZURAIBAK. Inisiasi dan Proliferasi Kalus serta Induksi Kalus Embriogenik pada Kultur Antera Kedelai (Glycine max L. Merrill). Dibimbing oleh ENCE DARMO JAYA SUPENA dan IKA MARISKA SOEDHARMA.
Pengembangan teknologi haploid melalui kultur antera, merupakan teknik alternatif untuk mempercepat proses perbaikan genetik dan pemuliaan tanaman. Namun, kultur antera untuk tanaman kedelai (Glycine max L. Merrill) belum berhasil diterapkan karena keberhasilannya masih sangat rendah, dan bahkan di Indonesia belum dilaporkan berhasil. Penelitian yang dilakukan adalah untuk mengembangkan kultur antera kedelai melalui tahapan inisiasi dan proliferasi kalus, kemudiaan induksi kalus embriogenik.
Media yang digunakan dalam penelitian ini adalah media dasar Murashige dan Skoog dan kedelai yang digunakan adalah varietas Wilis. Perlakuan inisiasi kalus menggunakan picloram (1, 3, 5 mg L-1) secara tunggal maupun dikombinasikan dengan BA 0.5 mg L-1, sedangkan untuk proliferasi kalus menggunakan kombinasi NAA, picloram, dan BA. Induksi kalus embriogenik diberikan perlakuan BA dan kinetin yang dikombinasikan dengan beberapa asam amino.
Hasil penelitian menunjukkan bahwa penambahan picloram secara tunggal tidak mampu menginisiasi kalus, tetapi bila dikombinasikan dengan BA dapat menginisiasi kalus. Proliferasi kalus dapat dilakukan pada semua kombinasi NAA, picloram, dan BA. Hasil induksi kalus embriogenik yang dicirikan dengan kalus berstruktur remah dan noduler terjadi pada perlakuan BA 1 mg L-1 dan Kinetin 2 mg L-1 dengan penambahan asam amino glutamin 100 mg L-1, arginin 100 mg L-1, prolin 100 mg L-1, dan kasein hidrolisat 200 mg L-1. Berdasarkan hasil studi ploidi dan histologi, ternyata kalus yang dihasilkan adalah diploid.
SUMMARY
RUFAI’AH FAISOL DZURAIBAK. Callus Initiation and Proliferation Along with Embryogenic Callus Induction in Anther Culture of Soybean (Glycine max L. Merrill). Supervised by ENCE DARMO JAYA SUPENA and IKA MARISKA SOEDHARMA.
The development of haploid technology through anther culture is an alternative technique to accelerate the genetic improvement process and plant breeding. However, the anther culture of soybean (Glycine max L. Merrill) has not been successfully implemented yet because of its very low success rates, even in Indonesia there is no report of soybean anther culture having succeeded. The objective of study was to develop soybean anther culture through callus initiation and proliferation, then followed by embryogenic callus induction.
The medium used was Murashige and Skoog’s base medium and the soybean used was Wilis cultivar. Treatments for callus initiation were picloram only (1, 3, 5 mg L-1) or combined with 0.5 mg L-1 BA, whereas callus proliferation used a combination of NAA, picloram, and BA. Embryogenic callus inductions were treated with BA and kinetin which were combined with several amino acids. The results of this study showed that treatment with picloram only was unable to initiate callus formation, but when combined with BA, it was able to initiate callus formation. Callus proliferation can be done in all NAA, picloram, and BA combinations. The embryogenic callus induction that characterized as crumbly and nodular callus were successfully induced with 1 mg L-1 BA and 2 mg L-1 Kinetin with the addition of the amino acids 100 mg L-1 glutamine, 100 mg L-1 arginine, 100 mg L-1 proline, dan 200 mg L-1 hydrolyzed casein. Based on the ploidy and histological studies, the calluses formed were diploid.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
INISIASI DAN PROLIFERASI KALUS SERTA INDUKSI
KALUS EMBRIOGENIK PADA KULTUR ANTERA
KEDELAI (
Glycine max
L. Merrill)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Inisiasi dan Proliferasi Kalus serta Induksi Kalus Embriogenik pada Kultur Antera Kedelai (Glycine max L. Merrill)
Nama : Rufai’ah Faisol Dzuraibak NIM : G353100051
Disetujui oleh Komisi Pembimbing
Dr Ir Ence Darmo Jaya Supena, MSi Ketua
Dr Ir Ika Mariska Soedharma, APU Anggota
Diketahui oleh
Ketua Program Studi Biologi Tumbuhan
Dr Ir Miftahudin, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: (06 Agustus 2014)
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2012 sampai April 2013 ialah kultur antera, dengan judul Inisiasi dan Proliferasi Kalus serta Induksi Kalus Embriogenik pada Kultur Antera Kedelai (Glycine max L. Merrill). Hasil dari penelitian sedang diajukan untuk publikasi di Jurnal Agronomi Indonesia.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Ence Darmo Jaya Supena, MSi dan Ibu Dr Ir Ika Mariska Soedharma, APU selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada semua pihak yang telah membantu selama penelitian dan penyusunan karya ilmiah ini yang tidak bisa saya sebutkan satu per satu. Ungkapan terima kasih juga disampaikan kepada Ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
2 METODE 3
Bahan 3
Alat 3
Prosedur Penelitian 3
Pra perlakuan kuncup bunga dan kultur antera 3
Induksi dan proliferasi kalus 4
Pembentukan kalus embriogenik 4
Studi Sitologi dan Histologi 5
Analisis Data 5
3 HASIL DAN PEMBAHASAN 6
Hasil 6
Induksi dan proliferasi kalus 6
Induksi kalus embriogenik 7
Histologi dan sitologi kalus 8
Pembahasan 10
4 SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
DAFTAR GAMBAR
1 Pengaruh perlakuan zat pengatur tumbuh terhadap induksi kalus 6 2 Keragaan kalus setelah dilakukan subkultur pada media dengan zat
pengatur tumbuh berbeda 7
3 Kalus noduler dan berwarna hijau setelah dilakukan subkultur pada
media induksi kalus embriogenik 8
4 Visual dan histologi kalus embriogenik 8
5 Hasil analisis tingkat ploidi sel-sel kalus dan daun kedelai dengan alat
flowcytometer 9
6 Penampang melintang kalus umur 45 hari setelah kultur 10
DAFTAR LAMPIRAN
1 Komposisi Media Murashige and Skoog (1962) 15
1
PENDAHULUAN
kebutuhannya mencapai kurang lebih 2.2 juta ton per tahun. Tingginya kebutuhan kedelai yang tidak diimbangi dengan pasokan produksinya, mendorong perlu dilakukannya peningkatan produksi kedelai di Indonesia. Salah satu upaya yang dapat dilakukan yaitu melalui program pemuliaan tanaman untuk mengupayakan tersedianya bibit unggul yang berkualitas.Pemuliaan tanaman kedelai di Indonesia masih dilakukan secara konvensional, yaitu dengan menyilangkan antar varietas yang dilanjutkan dengan proses seleksi untuk menghasilkan varietas baru. Proses ini membutuhkan waktu yang lama karena untuk memperoleh galur-galur yang stabil secara genetik memerlukan 5-6 generasi, sehingga diperlukan teknologi alternatif lainnya yang mempercepat proses pemuliaan.
Teknologi haploid melalui kultur mikrospora atau antera tanaman memiliki beberapa kelebihan yang dapat mendukung kegiatan pemuliaan tanaman, jika dibandingkan dengan cara konvensional. Teknologi haploid menawarkan peluang untuk mendapatkan galur-galur homozigot lebih cepat dan lebih efisien hanya 1-2 generasi dibandingkan dengan teknik konvensional melalui penyerbukan sendiri terkendali, yang membutuhkan waktu 5-6 generasi. Oleh karena itu, pengembangan dan penerapan teknologi haploid akan mempercepat proses seleksi. Selain itu, sifat-sifat unggul yang dikendalikan alel-alel resesif pada suatu tanaman, dapat dideteksi secara dini pada tanaman haploid dan haploid ganda (Dewi et al. 1996; Datta 2005; Forster et al. 2007).
Kultur haploid tanaman yang paling banyak dikembangkan adalah melalui induksi androgenesis, baik melalui kultur antera pada media padat maupun kultur mikrospora pada media cair. Proses androgenesis adalah induksi embriogenesis dari mikrospora (sel gamet jantan) sampai menjadi embrio dan selanjutnya beregenerasi membentuk tanaman. Prinsip dasar dan tahapan awal induksi androgenesis adalah membelokkan perkembangan sel-sel mikrospora dari perkembangan dan pembelahan gametofitik ke arah pembelahan sporofitik menuju embriogenesis, yang pada keadaan normal mikrospora tersebut mengalami perkembangan gametofitik menjadi polen (Datta 2005).
2
pemuliaan kedelai karena keberhasilan dalam kultur antera kedelai masih rendah. Di Indonesia, pengembangan kultur antera kedelai baru sampai tahap fase kalus dan belum mampu menginduksi embriogenesisnya (Zulkarnain 2005, 2008; Fathia dan Zulkarnain 2007). Oleh karena itu kultur antera pada tanaman kedelai masih perlu terus dikembangkan, untuk mendapatkan teknologi kultur haploid yang optimal.
Ketepatan fase perkembangan mikrospora yang digunakan pada kultur antera merupakan salah satu faktor keberhasilan induksi androgenesis. Fase perkembangan mikrospora terbaik untuk tanaman kedelai pada media padat adalah fase berinti tunggal awal sampai akhir (Lauxen et al. 2003), sedangkan dalam kultur antera kedelai sistem media dua-lapis fase perkembangan mikrospora terbaik untuk induksi pembelahan sporofitik adalah fase berinti tunggal akhir dan berinti dua awal. Fase ini terdapat dalam antera yang diisolasi dari kuncup bunga yang mempunyai rasio panjang braktea terhadap panjang kuncup yaitu 2/2.5-2/3.5 (Budiana 2010).
Pemberian pra perlakuan juga menjadi salah satu faktor keberhasilan kultur antera. Pra perlakuan berupa cekaman dapat membelokkan jalur perkembangan gametofitik ke pembelahan dan perkembangan sporofitik (Datta 2005). Pra perlakuan dapat berupa temperatur (rendah atau tinggi), osmotik, starvasi nitrogen atau karbon. Pra perlakuan dapat diaplikasikan pada tanaman utuh, kuncup bunga atau langsung pada mikrospora (Touraev et al. 1997). Pra perlakuan pada bunga sebelum dikulturkan pada temperatur 2-4 °C selama 3-12 hari merupakan pra perlakuan yang efektif untuk menginduksi kalus antera kedelai varietas Chinese (Hu et al. 1996).
Zat pengatur tumbuh tanaman juga mempunyai peran yang sangat penting untuk menginduksi embriogenesis mikrospora dalam kultur antera kedelai. Penambahan kombinasi 2,4-dichlorophenoxyacetic acid (2,4-D) 2 mg L-1 dengan 6-benzyladenine (BA) 0.5 mg L-1 pada media padat memberikan respon terbaik untuk menginduksi embriogenesis pada kultur antera kedelai (Kaltchuk-Santos et al. 1997). Pengaruh lain pemberian 2,4-D 2 mg L-1 dengan IBA 0,5 mg L-1 dalam media padat dapat meningkatkan terbentuknya kalus pada kultur antera kedelai (Tiwari et al. 2004). Pada kultur antera kedelai kultivar China, konsentrsi 2,4-D 2 mg L-1 dapat menginduksi kalus sebesar 22.4%, (Hu et al. 1996). Namun, penggunaan 2,4-D yang terlalu tinggi pada kultur antera kedelai kultivar IAS5 dapat mempercepat plasmolisis mikrospora dan tidak meningkatkan proses androgenesis (Rodrigues et al. 2004).
Perumusan Masalah
3 Tujuan Penelitian
Penelitian ini bertujuan untuk mengembangkan kultur antera kedelai varietas Wilis pada media padat melalui tahapan inisiasi dan proliferasi kalus, kemudian induksi kalus embriogenik, dan pengujian tingkat ploidi dari kalus yang dihasilkan.
2
METODE
Penelitian ini merupakan penelitian eksperimen yang berlangsung selama enam bulan mulai bulan Oktober 2012 sampai April 2013 di Laboratorium Biologi Seluler dan Molekuler Tanaman, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB Bogor.
Bahan
Bahan tanaman yang digunakan adalah kuncup bunga kedelai varietas Wilis. Penanaman dilakukan di dalam polybag ukuran 50x26 cm dengan media campuran tanah:kasting (3:1) seberat 8 kg/polybag dengan 3 tanaman/polybag dan dipupuk dengan NPK (15-15-15) dengan dosis 0.8 g/polybag. Pemupukan Weatmore (1951), masing-masing secara lengkap disajikan pada Tabel Lampiran 1 dan 2. Sumber karbon yang ditambahkan pada media adalah maltosa 20 g L-1 pada media induksi dan proliferasi kalus, selanjutnya digunakan sukrosa 30 g L-1 pada media pembentukan kalus embriogenik. Media dibuat padat dengan penambahan agar-agar gelrite 2 g L-1 dan pH media diatur hingga mencapai pH 5.8±0.1.
Alat
Penentuan tingkat ploidi kalus diidentifikasi menggunakan flowcytometer. Penyayatan pada metode pembenaman parafin menggunakan mikrotom putar.
Prosedur Penelitian
Pra perlakuan kuncup bunga dan kultur antera
4
antera. Kuncup bunga disterilisasi dalam alkohol 70% selama 30 detik, dibilas 3 kali dengan aquades steril, kemudian direndam dalam NaOCl 2% yang ditambah Tween-20 0.05% (v/v) selama 10 menit, kemudian dibilas 3 kali dengan aquades steril masing-masing 1, 5, 10 menit. Selanjutnya antera dari setiap kuncup bunga yang berjumlah 10 secara acak dimasukkan dalam petri sesuai perlakuan hingga tiap petri berisi 10 antera yang berasal dari 10 kuncup bunga berbeda.
Induksi dan proliferasi kalus
Perlakuan yang diuji pada tahapan induksi kalus adalah 3 taraf konsentrasi picloram (auksin) secara tunggal maupun kombinasi dengan BA (sitokinin) terhadap induksi kalus yaitu:
Selanjutnya kultur diinkubasi pada suhu ruang 25 °C ± 1 °C pada kondisi gelap selama satu bulan. Pengamatan meliputi waktu inisiasi kalus, struktur dan warna kalus, dan dilakukan pengamatan histologi kalus.
Tahap berikutnya, kalus dari hasil perlakuan sebelumnya disubkultur pada 4 taraf perlakuan konsentrasi auksin picloram dan NAA yang dikombinasikan dengan BA 0.1 mg L-1. Perlakuan yang diuji pada tahap ini yaitu : dilakukan terhadap morfologi kalus, kemudian disubkulturkan pada media pembentukan kalus embriogenik.
Pembentukan kalus embriogenik
5 Studi Sitologi dan Histologi
Pengamatan tingkat ploidi dilakukan dengan mengidentifikasi dan memastikan tingkat ploidi, yaitu kalus berumur 45 hari setelah tanam dan daun kedelai yang masih muda (kontrol) diidentifikasi menggunakan alat flowcytometer Partec Cyflow Space. Kandungan DNA dalam inti sel kalus dan daun diisolasi secara mekanis dengan memotong dan mencacah menggunakan silet dalam 250 µl buffer nuclei extraction (Partec®) yang mengandung 4,6 diamidino-2-phenylindole (DAPI). Setelah hancur ditambahkan lagi 750 µl buffer nuclei extraction dan suspensi disaring dengan nylon mess 35 µm, kemudian dianalisis dengan flowcytometer (Dolezel et al. 2007). Penentuan tingkat ploidi dilakukan dengan melihat posisi puncak grafik pada histogram yang diperlihatkan di display monitor. Kemudian dibandingkan tingkat ploidi kalus dengan kontrolnya.
Metode pembenaman dalam parafin (Sass 1958) untuk mengetahui struktur dan asal sel-sel kalus. Material berupa kalus pada umur 45 hari setelah kultur dan kalus yang noduler sebelumnya difiksasi dengan FAA (Formalin Acetic Acid Alkohol) selama tiga hari. Kemudian dilakukan pencucian dengan etanol 50%. Selanjutnya tahap dehidrasi dan penjernihan yang dilakukan secara bertahap dengan larutan Johansen I-VI. Tahapan selanjutnya dilakukan infiltrasi sebelum dilakukan penanaman dalam parafin. Penyayatan dilakukan dengan mikrotom putar, dan pewarnaan menggunakan pewarnaan ganda yaitu safranin dan fastgreen. Preparat histologi diamati di bawah mikroskop cahaya dan dipotret dengan kamera.
Analisis Data
6
3
HASIL DAN PEMBAHASAN
Hasil
Induksi dan proliferasi kalus
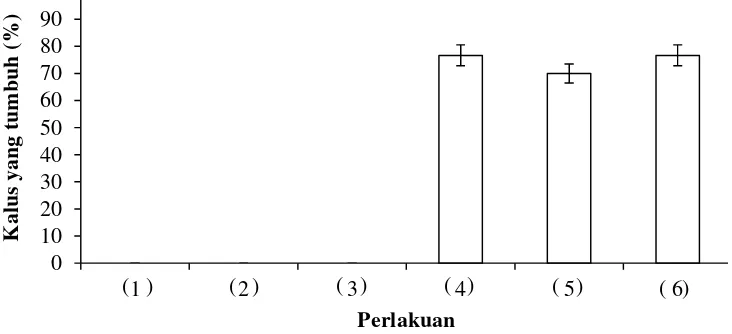
Hasil percobaan induksi kalus menunjukkan bahwa penggunaan picloram tunggal yang ditambahkan pada media MS padat tidak mampu menginduksi kalus pada kultur antera kedelai varietas Wilis, tetapi bila picloram tersebut dikombinasikan dengan BA dapat menginduksi kalus (Gambar 1). Persentase kalus yang terbentuk tidak berbeda nyata antar perlakuan picloram 1 mg L-1 + BA 0.5 mg L-1; picloram 3 mg L-1 + BA 0.5 mg L-1 dan picloram 5 mg L-1 + BA 0.5 mg L-1 yaitu masing-masing 76.7% ; 70.0% dan 76.7%.
Kalus mulai terbentuk sekitar 2 minggu setelah kultur, ditandai dengan antera mulai membesar dari ukuran normalnya, warna berubah dari hijau menjadi kuning kecoklatan, kemudian kalus semakin membesar dan kekuningan dengan struktur yang sangat kompak. Kalus ini selanjutnya disubkultur pada media yang memiliki zat pengatur tumbuh yang berbeda agar kalus yang kompak lebih remah dan embriogenik. Zat pengatur tumbuh yang dipergunakan berupa picloram, NAA, dan BA.
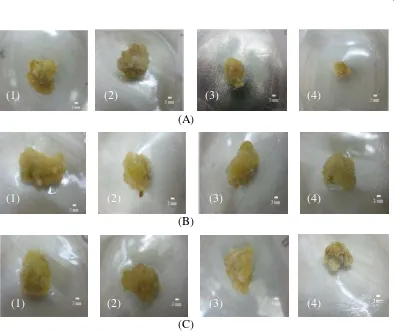
Hasil yang diperoleh menunjukkan bahwa kalus yang disubkultur pada media dengan zat pengatur tumbuh berupa picloram, NAA, dan BA tidak berbeda secara visual antar perlakuan yang dicobakan, yaitu struktur masih kompak dan berwarna kekuningan (Gambar 2). Pemberian NAA yang dikombinasikan dengan picloram dan BA hanya menyebabkan pertumbuhan kalus pada tahap ini lebih cepat dibandingkan dengan pertumbuhan kalus pada tahap induksi kalus sebelumnya.
7
Induksi kalus embriogenik
Upaya untuk mendapatkan kalus embriogenik dilakukan dengan penambahan asam amino dan penggunaan zat pengatur tumbuh berupa kinetin dan BA. Hasil dari semua perlakuan yang dicobakan yaitu, kalus mulai remah dan noduler, serta berwarna hijau (Gambar 3). Namun, penambahan asam amino dan dua sitokinin yang dikombinasikan pada kultur antera kedelai dalam penelitian ini hanya mampu membentuk kalus yang remah dan noduler tetapi tidak mampu menginduksi embriogenesis. Kalus yang noduler ini diharapkan akan dapat membentuk embrio, bila kondisi yang diperlukan kalus terpenuhi.
8
Histologi dan Sitologi Kalus
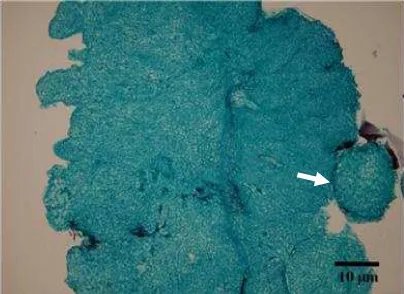
Kalus yang noduler dijadikan sebagai preparat penampang histologi kalus dengan metode parafin. Hasil pengamatan menunjukkan bahwa terdapat sel-sel yang bersifat embriogenik pada kalus tersebut (Gambar 4B).
Hasil yang diharapkan dari kultur antera adalah diperolehnya tanaman yang berasal dari sel gamet sehingga menghasilkan tanaman haploid atau haploid ganda. Namun, pada kultur antera kedelai Wilis dalam penelitian ini, belum berhasil meregenerasikan tanaman, melainkan hanya sampai tahap kalus yang Gambar 3 Kalus noduler dan berwarna hijau setelah dilakukan subkultur pada
media induksi kalus embriogenik: (A) kalus dari perlakuan BA 1 mg L-1 + kinetin 2 mg L-1 + glutamin 100 mg L-1 + arginin 100 mg L-1 + prolin 100 mg L-1; (B) kalus dari perlakuan BA 1 mg L-1 + kinetin 2 mg L-1 + kasein hidrolisat 200 mg L-1 + prolin 100 mg L-1.
Tanda panah menunjukkan kalus noduler
Gambar 4 Visual dan histologi kalus embriogenik: (A) kalus noduler; (B) penampang melintang kalus noduler.
Tanda panah menunjukkan sel kalus embriogenik
A) (A) B)
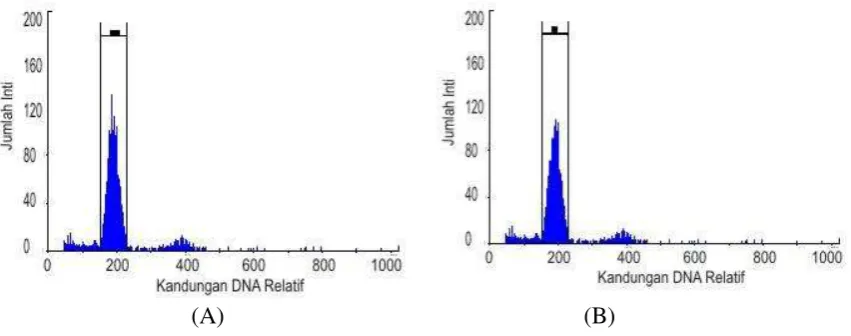
9 embriogenik. Oleh karena itu pengecekan tingkat ploidi dengan menggunakan flowcytometer hanya dapat dilakukan terhadap sel-sel kalus yang dihasilkan. Kandungan DNA relatif ditentukan dari nilai intensitas fluoresen yang dihasilkan dari ikatan pewarna inti DAPI dan molekul DNA. Intensitas fluoresen yang dipancarkan akan mencerminkan jumlah dan kandungan DNA pada sejumlah inti yang terwarnai oleh DAPI. Penentuan tingkat ploidi dilakukan dengan melihat posisi puncak grafik pada histogram. Berdasarkan analisis flowcytometer, puncak grafik antara sel-sel kalus hasil kultur antera kedelai dengan kontrol (daun muda kedelai) memiliki kandungan DNA relatif dan jumlah inti yang sama, maka tingkat ploidi sel-sel kalus antera kedelai yang diperoleh yaitu diploid (Gambar 5). Hal tersebut terjadi dikarenakan sel yang berkembang kemungkinan bukan berasal dari mikrospora melainkan dari jaringan dinding antera kedelai yang memiliki ploidi yang sama dengan sel somatiknya.
(A) (B)
Gambar 5 Hasil analisis tingkat ploidi sel-sel kalus dan daun kedelai dengan alat flowcytometer:(A) tingkat ploidi dari sel-sel daun kedelai varietas Wilis (kontrol) adalah diploid; (B) tingkat ploidi sel-sel dari kalus yang diuji adalah diploid
10
Gambar 6 Penampang melintang kalus umur 45 hari setelah kultur. Tanda panah menunjukkan antera kedelai
Pembahasan
Berdasarkan hasil penelitian yang diperoleh menunjukkan bahwa kultur antera kedelai varietas Wilis ini hanya mampu menginduksi kalus pada media dengan perlakuan kombinasi picloram (auksin) dengan BA (sitokinin). Fathia dan Zulkarnain (2007) juga melaporkan bahwa untuk meningkatkan pembentukan kalus pada kultur antera kedelai membutuhkan penambahan kombinasi 2,4 D (auksin) dengan kinetin (sitokinin).
Pemberian NAA yang dikombinasikan dengan picloram dan BA hanya menyebabkan pertumbuhan kalus pada tahap ini lebih cepat dibandingkan dengan pertumbuhan kalus pada tahap induksi. Pertumbuhan kalus yang cepat disebabkan sel-sel dalam kalus membelah secara aktif. Sel yang membelah cepat tersebut menyebabkan sel berada dalam ketidakseimbangan aktivitas mitosis, sehingga menyebabkan terjadinya variasi jenis kalus dan respon organogenesisnya (Bouman dan De Klerk 2001). Profase merupakan aktivitas mitosis dominan yang terjadi pada kalus, metafase dan telofase berada pada frekuensi yang rendah, sedangkan anafase sangat jarang terjadi (Cellarova et al. 1990).
11 Analisis sitologi eksplan hasil kultur antera pada level in vitro sangat diperlukan untuk mengetahui tingkat ploidi. Keberhasilan pengungkapan tingkat ploidi sangat menentukan arah pengembangan tanaman, khususnya tanaman haploid, terkait dengan perbanyakan eksplan, penyiapan planlet, penggandaan kromosom hingga produksi tanaman haploid ganda. Winarto (2011) telah melakukan pengujian tingkat ploidi pada kultur Anthurium menggunakan pewarnaan kromosom dengan donor berupa kalus, ujung tunas, dan akar. Namun, pemanfaatan kalus dan ujung tunas tidak sesuai bila digunakan sebagai donor eksplan dalam penentuan tingkat ploidi eksplan karena hasil utama yang dapat diamati di bawah mikroskop berupa titik-titik kromosom yang tersebar dalam sel atau mosaik kromosom. Pengecekan tingkat ploidi pada tahap kalus dalam penelitian ini menggunakan alat flowcytometer, dimana hasil yang diperoleh ploidi kalus sama dengan ploidi daun muda kedelai yaitu diploid.
Berdasarkan hasil pengamatan histologi pada saat kalus berumur 45 hari setelah kultur, maka kemungkinan kalus berasal dari jaringan dinding antera kedelai, dimana jaringan dinding antera kedelai terluka sehingga menginduksi terbentuknya kalus. Mikrospora di dalam dinding antera kedelai tidak terinduksi dan masih dalam keadaan seperti semula. Seperti halnya penelitian pada kultur antera Anthurium selama perkembangan kalus, mikrospora dalam dinding antera tidak tumbuh, dan tetap dalam keadaan semula sampai tiga bulan dalam kultur (Winarto et al. 2010). Hal ini dikarenakan dinding antera yang terinduksi.
12
4 SIMPULAN DAN SARAN
Simpulan
Penambahan picloram secara tunggal dalam media dasar MS untuk kultur antera kedelai tidak mampu menginisiasi kalus, tetapi bila dikombinasikan dengan BA dapat menginisiasi kalus. Proliferasi kalus dapat dilakukan pada semua kombinasi NAA, picloram, dan BA. Hasil induksi kalus embriogenik yang dicirikan dengan kalus berstruktur remah dan noduler terjadi pada perlakuan BA 1 mg L-1 dan kinetin 2 mg L-1 dengan penambahan asam amino glutamin 100 mg L-1, arginin 100 mg L-1, prolin 100 mg L-1, dan kasein hidrolisat 200 mg L-1. Berdasarkan hasil studi ploidi dan histologi, kalus yang dihasilkan adalah diploid.
Saran
Untuk penelitian selanjutnya dalam upaya mengembangkan kultur antera kedelai, disarankan menggunakan metode dan media yang dapat meminimalisir terbentuknya kalus.
DAFTAR PUSTAKA
Bouman H, De Klerk GJ. 2001. Measurement of the extent of somaclonal variation in Begonia plants regenerated under various conditions comparison of three assays. TheorAppl Genet. 102(1): 111-117.
[BPS] Badan Pusat Statistik. 2013. Berita Resmi Statistik No. 73/11/Th. XVI tentang Produksi Padi, Jagung, dan Kedelai. Jakarta: BPS.
Budiana. 2010. Induksi pembelahan sporofitik mikrospora kedelai melalui kultur antera pada sistem media dua lapis. Tesis. Bogor. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor.
Burbulis N, Kupriene R, Ûilenaite L. 2004. Embryogenesis, callogenesis and plant regeneration from anther cultures of spring rape (Brassica napus L.). Acta Universitatis Latviensis. 676:153–158.
Cellarova E, Rycglova M, Seidelova A, Honcriv R. 1990. Comparison of mitotic activity and growth in two long term callus culture of Matricaria recutita L. Acta Biotech. 10(3): 245-251.
Cordoso MB, Bodanese-Zanettini MH, Mundstock EC, Kaltchuk-Santos E. 2007. Evaluation of gelling agents on anther culture: response of two soybean cultivars. Braz Arch Biol Technol. 50(6): 933-939.
Datta SK. 2005. Androgenic haploids: factors controlling development and its application in crop improvement. Curr Sci. 89: 1870-1878.
13 Dolezel J, Greilhuber J, Suda J. 2007. Flow Cytometry with Plant Cells: Analysis
of Genes, Chromosomes, and Genomes. Weinhem: Wiley-VCH.
Dumas de Vaulx R, Chambonnet D, Pochard E. 1981. Culture in vitro d’anthe`res de piment (Capsicum annuum L.): ame`lioration destaux d’obtenction de plantes chez diffe´rents ge´notypes par destraitments a` +35°C. Agronomie. 1: 859–864.
Fathia NME, Zulkarnain. 2007. Respon in vitro antera kedelai terhadap zat pengatur tumbuh. Jurnal Agronomi. 11(2): 59-67.
Forster BP, Heberle-Bors E, Kasha KJ, Touraev A. 2007. The resurgence of haploids in higher plants. Trends in Plant Sci. 12(8): 368-375.
Fu Y, Nicolodi C, Santini L, Spano L, Mariotti D. 1997. Development and germination of somatic embryos from immature soybean kotiledons: role of auksin like compounds and organic nitrogen. J Genet Breed. 51: 341-345. Guzma´n M, Francisco JZA. 2000. Increasing anther culture efficiency in rice
(Oryza sativa L.) using anthers from ratooned plants. Plant Science. 151: 107–114.
Hu CY, Yin GC, Bodanese-Zanettini MH. 1996. Haploid of Soybean. Di dalam: Jain SM, Sopory SK, Veilleux RE, editors. In Vitro Production in Higher Plant. Dordrecht: Kluwer Academic Publisher. hlm 377-395.
Kaltchuk-Santos E, Mariath JE, Mundstock E, Yeh-Hu C, Bodanese-Zanetti MH. 1997. Cytologycal analysis of early microspore divisions and embryo formation in cultured soybean anther. Plant Cell Tiss Organ Cult. 49: 107-115.
Lauxen MS, Kaltchuk-Santos E, Hu C, Callegarri-Jacques SM, Bodanese-Zanettini MH. 2003. Floral bud size and developmental stage in soybean microspores. Braz Arch Biol Technol. 46(4): 515-520.
Lestari EG, Yunita R. 2008. Induksi kalus dan regenerasi tunas padi varietas Fatmawati. Bul Agron. 36(2): 106-110.
Loganathan M, Maruthasalam S, Shiu LY, Lien WC, Hsu WH, Lee PF, Yu CW, Lin CH. 2010. Regeneration of soybean (Glycine max L. Merrill) through direct somatic embryogenesis from the immature embryonic shoot tip. In Vitro Cell Dev Biol Plant. 46: 265-273.
Moraes AP, Bodanese-Zanettini MH, Callegarri-Jacques SM, Kaltchuk-Santos E. 2004. Effect of temperature shock on soybean microspore embryogenesis. Braz Arch Biol Technol. 47(4): 537-544.
Morel G, Wetmore RH. 1951. Tissue culture of monocotyledons. Am J Bot. 38: 138-140.
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bio-assays with tobacco tissue cultures. Plant Physiol. 15: 473-497.
Parra-Vega V, Renau-Morata B, Sifres A, Segui-Simarro JM. 2013. Stress treatments and in vitro culture conditions influence microspore embryogenesis and growth of callus from anther walls of sweet pepper (Capsicum annum L.). Plant Cell Tiss Organ Cult. 112: 353-360.
Purnamaningsih P. 2002. Regenerasi tanaman melalui embryogenesis somatic dan beberapa gen yang mengendalikannya. Buletin Agrobio. 5(2): 51-58.
14
Rodrigues LR, Forte BC, Bodanese-Zanettini MH. 2006. Isolation and culture of soybean (Glycine max L. Merrill) microspores and pollen grains. Braz Arch Biol Technol. 49(4): 537-544.
Sass JE. 1958. Botanical Microtechnique. Edisi ke-3. The Iowa State Collage Press. Ames. Iowa.
Supena EDJ, Suharsono S, Jacobsen E, Custers JBM. 2006. Succesfull development of a shed-microspore culture protocol for double haploid production in Indonesian hot pepper (Capsicum annuum L.). Plant Cell Rep. 25: 1-10.
Touraev A, Vicente O, Heberle-Bors E. 1997. Initiation of microspore embryogenesis by stress. Trends in Plant Sci. 2: 298-300.
Tiwari S, Shanker P, Tripathi M. 2004. Effects of genotype and culture medium on in vitro androgenesis in soybean (Glycine max L. Merr.). Ind Jour Biotech. 3: 441-444.
Winarto B, Mattjik NA, Purwito A, Marwoto B. 2010. Improvement of selected induction culture media on callus induction in anther culture of anthurium and a histological study on its callus formation. Jurnal Natur Indonesia. 12(2): 93-101.
Winarto B. 2011. Pewarnaan kromosom dan pemanfaatannya dalam penentuan tingkat ploidi eksplan hasil kultur anter Anthurium. J Hort. 21(2): 113-123. Yang C, Zhao Y, Wei J, Zhao L, Sui C, Zhang Z, Cui L. 2011. Factors affecting
embryogenic callus production and plant regeneration in anther culture of Bupleurum chinense. Chinese Herbal Medicines. 3(3): 214-220.
Zheng MY. 2003. Microspore culture in wheat (Triticum aestivum) doubled haploid production via induced embryogenesis. Plant Cell Tiss Organ Cult. 73: 213-230.
Zulkarnain. 2005. Pengaruh pra-perlakuan stres pada kultur antera empat kultivar kedelai. JurnalAkta Agrosia. 8: 56-6.
15 Lampiran 1 Komposisi Media Murashige and Skoog (1962)
Jenis Bahan Kimia Konsentrasi (mg L-1)
Lampiran 2 Komposisi Vitamin Morel and Weatmore (1951)
16