FORMULASI INOKULUM CENDAWAN MIKORIZA
ARBUSKULA DAN APLIKASINYA SEBAGAI PUPUK
HAYATI TANAMAN
SORGUM (Sorghum bicolor L. Moench)
DAN GANDUM (
Triticum aestivum L.)ERWIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Formulasi Inokulum Cendawan Mikoriza Arbuskula dan Aplikasinya sebagai Pupuk Hayati Tanaman Sorgum (Sorghum bicolor L. Moench) dan Gandum (Triticum aestivum L.) adalah benar karya bersama saya dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ERWIN. Formulasi Inokulum Cendawan Mikoriza Arbuskula dan Aplikasinya sebagai Pupuk Hayati Tanaman Sorgum (Sorghum bicolor L. Moench) dan Gandum (Triticum aestivum L.). Dibimbing oleh NAMPIAH SUKARNO dan UTUT WIDYASTUTI.
Peranan mikoriza arbuskula (MA) dalam bidang pertanian telah terbukti sangat signifikan, namun terkendala dengan ketersediaan inokulum terformulasi untuk diaplikasikan di lapang. Penelitian ini bertujuan untuk mempelajari formulasi inokulum MA dan pemanfaatannya sebagai pupuk hayati tanaman sorgum (Sorghum bicolor L. Moench) dan gandum (Triticum aestivum L.). Formulasi yang dibentuk ialah tablet yang mengandung inokulum (Z) dan bahan pengisi gipsum (G) dan tanah liat (C). Parameter yang diuji ialah diameter pori permukaan dan dalam tablet, dan stabilitas tablet. Perlakuan inokulasi pada tanaman sorgum ialah jumlah tablet, sedangkan perlakuan inokulasi pada tiga belas galur gandum ialah hasil tablet yang terbaik dari pertumbuhan sorgum. Parameter yang diuji pada tanaman sorgum dan gandum ialah pertumbuhan MA, berupa persen kolonisasi, jumlah entry point, hifa internal, arbuskula dan vesikula, sedangkan pertumbuhan tanamannya yaitu tinggi tajuk, berat basah akar,berat basah dan kering tajuk. Data hasil analisis menunjukkan bahwa penambahan tanah liat pada formula menurunkan diameter pori tablet dan meningkatkan stabilitasnya. Tablet dengan komposisi Z:G:C 1:1:5 menghasilkan diameter pori terendah dan stabilitas tablet tertinggi. Hasil uji tablet pada tanaman menunjukkan bahwa inokulum tablet dapat menkolonisasi akar dengan baik. Kolonisasi akar dan struktur cendawan dalam akar yaitu entry point, hifa internal arbuskula dan vesikula meningkat dengan meningkatnya jumlah tablet yang diinokulasikan. Peningkatan kolonisasi juga berkorelasi positif dengan pertumbuhan sorgum yaitu tinggi tajuk, bobot basah, bobot kering tajuk, dan bobot basah akar. Respon terbaik pada kolonisasi MA dan pertumbuhan tanaman sorgum diperoleh pada perlakuan jumlah tablet sebanyak 30 buah. Tablet inokulum sebanyak 30 buah hasil formulasi meningkatkan pertumbuhan tinggi tajuk, bobot basah dan kering tajuk, bobot basah akar dari 13 galur gandum. Seluruh galur gandum terkolonisasi MA, dengan kolonisasi terendah sebesar 62% pada galur S03 dan tertinggi sebesar 80% pada galur Oasis dan SBR.
SUMMARY
ERWIN.Inoculum Formulation of Arbuscular Mycorrhiza and its Aplication as Biofertilizer for Sorghum (Sorghum bicolor L. Moench) and Wheat (Triticum aestivum L.). Supervised by NAMPIAH SUKARNO and UTUT WIDYASTUTI.
Arbuscular mycorrhiza is a mutualistic symbiosis between plant and soil fungi. The role of arbuscular mycorrhiza in agriculture as bio-fertilizer to improve plant growth and yield are already well known. The application of the mycorrhiza in field however was limited by availability of formulated inoculum. Sorghum (Sorghum bicolor L. Moench) and wheat (Triticum aestivum L.) are subtropical plants that are selected to be cultivated in Indonesia. The plants are reported to have higher dependency on arbuscular mycorrhiza for their growth and development. This research aimed to develop inoculum formulation of arbuscular mycorrhizal fungi for biofertilizer of S. bicolor and T. aestivum. The inoculum formulation was developed in the form of tablet using composition of inoculum, gypsum and clay. The quality of inoculum was tested based on its pore and stability as well as the viability of the fungi to colonize S. bicolor root system. Thirteen varieties of T. aestivum were tested in this research. The results indicated that the tablet formulated inoculum had pore size of 1 mm and stable in wet soil for 65 hours. In addition, the tablet had good quality by producing entry point, intercellular hyphae, arbuscules, and vesicles. All the 13 varieties of T.aestivum were heavily infected by the arbuscular mycorrhizal fungi and the inoculation increased both root and shoot of 30 days old plants. The colonization ranged from 62 to 80%. The lowest colonization found in S03 varieties, whereas the highest was observed in Oasis and SBR.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
FORMULASI INOKULUM CENDAWAN MIKORIZA
ARBUSKULA DAN APLIKASINYA SEBAGAI PUPUK
HAYATI TANAMAN SORGUM (Sorghum bicolor L. Moench)
DAN GANDUM (Triticum aestivum L.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Formulasi Inokulum Cendawan Mikoriza Arbuskula dan Aplikasinya sebagai Pupuk Hayati Tanaman Sorgum (Sorghum bicolor L. Moench) dan Gandum (Triticum aestivum L.)
Nama : Erwin
NIM : G351100031
Disetujui oleh Komisi Pembimbing
Dr Ir Nampiah Sukarno Ketua
Dr Ir Utut Widyastuti, MS Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis dengan topik Formulasi Inokulum Mikoriza Arbuskula dan Aplikasinya sebagai Pupuk Hayati pada Tanaman Sorgum (Sorghum bicolor L. Moench) dan Tanaman Gandum (Triticum aestivum L.) berhasil diselesaikan.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Nampiah dan Ibu Dr Ir Utut Widyastuti, MS selaku pembimbing atas kesabarannya dalam memberikan saran, bimbingan, dukungan dana pendidikan, semangat serta kesempatan dalam pelaksanaan penelitian dan penyempurnaan penyusunan karya ilmiah ini. Terima kasih pula penulis ucapkan kepada Bapak Dr Ir Aris Tjahjoleksono, DEA selaku penguji luar komisi atas masukan dan Ibu Prof Dr Anja Meryandini selaku ketua program studi Mikrobiologi yang telah memberikan masukan dan dukungan yang berharga dalam penyelesaian studi.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Gayuh Rahayu yang telah banyak membantu dalam penelitian. Terima kasih kepada Ibu Ir Agustin Widya Gunawan, MS yang telah membantu dalam memberikan masukan penelitian. Terima kasih kepada Ibu Dr Nisa Rachmania Mubarik atas nasihat berharganya. Penulis mengucapkan terima kasih kepada Bapak Adel, Ibu Dr Trikoesoemaningtyas, Bapak Dr Miftahudin, dan Kakak Karlina yang telah memberikan bantuan dalam mendapatkan benih tiga belas galur gandum untuk penelitian ini. Penulis juga berterima kasih kepada saudara Mafrikhul Muttaqien, Sepriyadi Rihi, Yessy Velina yang telah banyak membantu dalam menyelesaikan tesis ini. Terima kasih kepada teman Mikrobiologi 2010 dan 2011, teman-teman laboratorium Mikologi (Nicho, Ivan, Oktan, Ginanjar, Fajar, Ladie, Siti, Evi Lestari, Riana, Ibu Dini, Ibu Efry, Ibu Yuyun, Ibu Cinta,Uni Dezi, Uni Ade, Pak Basri, Ujang, Ikbar, Agil, Dwi). Terima kasih juga kepada Ibu Ir Helyu Mizawati, Bapak Kusnaidi, Ibu Ratna, Ibu Noor Faiqoh, Ibu Hasanah, Ibu Susan, Bapak Adi, Bapak Entis, Bapak Jaka, Mas Achmad, Aldian atas bantuan selama ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, kakak Fitriana, kakak Emira, kakak Achmad Yani dan keponakan tercinta Hadi, Raihan, Rizki Abdillah atas doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Mikoriza 3
Produksi Inokulum dan Pengembangan Formulasi Inokulum MA 4
Tanah liat 5
Gipsum 5
Zeolit 6
Sorgum 7
Gandum 8
3 METODE 10
Waktu dan Tempat Penelitian 10
Alat dan Bahan Penelitian 10
Alat Penelitian 10
Bahan Penelitian 10
Prosedur Penelitian 10
Persiapan Media Tanam 10
Persemaian Benih 10
Produksi Massal Inokulum 11
Formulasi Mikoriza Arbuskula 11
Pengukuran Diameter Pori dan Kestabilan Tablet Inokulum Hasil
Formulasi 11
UjiAplikasi Inokulum Hasil Formulasi pada Tanaman Sorgum (S.
bicolor L. Moench). 11
Uji Aplikasi Inokulum Hasil Tablet Terbaik untuk Tanaman Gandum
(Triticum aestivum L.) 12
Analisis Data 12
4 HASIL DAN PEMBAHASAN 13
Hasil 13
Formulasi Tablet Inokulum MA 13
Pengaruh Inokulasi Tablet pada Tanaman Sorgum (S.bicolor
L.Moench) 14
Pembahasan 21
Formulasi Tablet Inokulum 21
Pengaruh Inokulasi Tablet pada Tanaman Sorgum (S.bicolor L.
Moench) dan Tanaman Gandum (T.aestivum L) 21
5 SIMPULAN DAN SARAN 23
Simpulan 23
Saran 24
DAFTAR PUSTAKA 24
LAMPIRAN 29
DAFTAR TABEL
1 Stabilitas tablet inokulum mikoriza arbuskula hasil formulasi yang dinyatakan dalam waktu hancur tablet (jam) pada 3 perlakuan. 14 2 Struktur cendawan mikoriza arbuskula pada akar tanaman inang sorgum (S.
bicolor L. Moench.) umur 30 hari setelah diinokulasi. 15 3 Parameter pertumbuhan tanaman sorgum (S. bicolor L. Moench.) pada usia
30hari setelah diinokulasi. 16
4 Struktur cendawan mikoriza arbuskula pada akar tanaman gandum (T.
aestivum L.) umur 30 hari setelah diinokulasi. 18
5 Parameter pertumbuhan tanaman gandum (T. aestivum L.) pada usia 30 hari
setelah diinokulasi. 19
DAFTAR GAMBAR
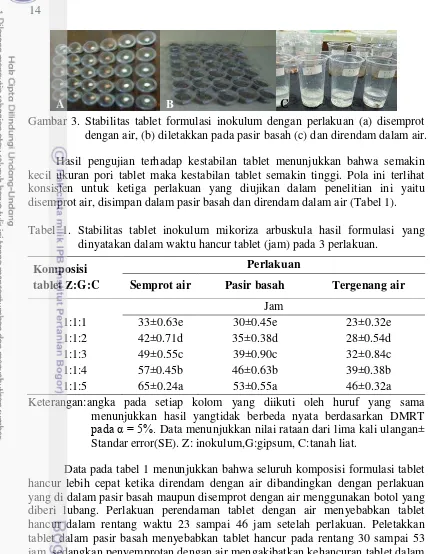
1 Diameter pori bagian luar ( ) dan bagian dalam ( ) tablet inokulum cendawan mikoriza arbuskula hasil formulasi yang mengandung berbagai komposisi inokulum (Z), gipsum (G), dan tanah (C) (Z:G:C). 13 2 Morfologi bentuk formulasi tablet inokulum MA. 13 3 Stabilitas tablet formulasi inokulum dengan perlakuan (a) disemprot dengan
air, (b) diletakkan pada pasir basah (c) dan direndam dalam air. 14 4 Persen kolonisasi cendawan mikoriza arbuskula pada akar tanaman sorgum
(S. bicolor L. Moench.) umur 30 hari setelah diinokulasi (HSI). 15 5 Panjang akar terkolonisasi ( ), dan total panjang akar ( ) tanaman sorgum
(S. bicolor L. Moench.) per pot pada umur 30 hari setelah inokulasi (HSI)
pada perlakuan jumlah tablet inokulum. 16
6 Struktur mikoriza arbuskula pada akar tanaman sorgum (S. bicolor) umur 30
hari setelah diinokulasi tablet inokulum. 16
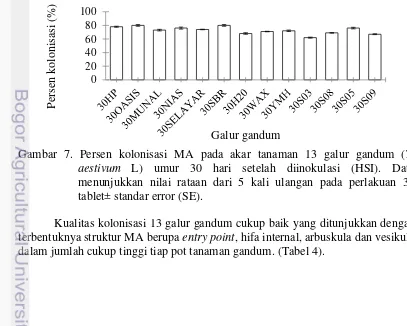
7 Persen kolonisasi MA pada akar tanaman 13 galur gandum (T. aestivum L)
umur 30 hari setelah diinokulasi (HSI). 17
8 Struktur mikoriza arbuskula pada akar tanaman 13 galur gandum (T. aestivum L.) umur 30 hari setelah diinokulasi tablet inokulum. 18 9 Panjang akar terkolonisasi ( ), dan total panjang akar ( ) tanaman 13
galur gandum (T. aestivum L.) tiap pot pada umur 30 hari setelah inokulasi
DAFTAR LAMPIRAN
1 Diameter pori tablet formulasi inokulum MA. 30
2 Persen Kolonisasi mikoriza arbuskula pada tanaman sorgum (S. bicolor L.
Moench) umur 30 hari setelah diinokulasi. 30
3 Panjang akar terkolonisasi dan total panjang akar tanaman sorgum (S. bicolor L. Moench) umur 30 hari setelah diinokulasi. 30 4 Persen kolonisasi MA pada tanaman gandum (T. aestivum L.) umur 30 hari
setelah diinokulasi. 30
5 Panjang akar terkolonisasi dan total panjang akar tanaman gandum (T.
aestivum L.) umur 30 hari setelah diinokulasi. 31
1
PENDAHULUAN
Latar Belakang
Mikoriza ialah simbiosis mutualisme antara cendawan asal tanah dengan akar tumbuhan yang fungsi utamanya sebagai pupuk hayati. Mikoriza arbuskula ialah salah satu tipe mikoriza yang membentuk kolonisasi hifa secara interseluler, intraseluler, arbuskula, dan kadang-kadang vesikula di dalam akar tumbuhan inang, serta jalinan miselia di dalam tanah yang disebut hifa eksternal. Arbuskula ialah struktur yang berperan dalam transfer nutrisi dari cendawan ke dalam tumbuhan inang (Bucking et al. 2012), sedangkan transfer unsur karbon hasil fotosintesis dari tumbuhan terhadap cendawan. Smith dan Read (2008) melaporkan bahwa transfer karbon dilakukan melalui struktur hifa internal berdasarkan bukti bahwa terdapat aktivitas ATP-ase pada daerah awal pertumbuhan hifa internal dan bagian membran peri-arbuskula (Requena et al. 2003). Vesikula ialah struktur yang dibentuk sebagai makanan cadangan makanan. Kuantitas dan kualitas seluruh struktur cendawan tersebut menentukan efisiensi dan efektivitas simbiosis dari cendawan mikoriza arbuskula. Oleh karena itu, kualitas inokulum mikoriza arbuskula ditentukan oleh kemampuan cendawan dalam membentuk struktur-struktur simbiosis tersebut.
Sebagai pupuk hayati, hifa eksternal cendawan tumbuh membentuk jalinan hifa mengeksplorasi seluruh rizosfer tanaman inang untuk melakukan penyerapan unsur makro hara diantaranya P, K, N dalam bentuk amonium (NH4+), S, Mg, dan Ca, sedangkan jenis unsur mikro yang diserap ialah Zn, Cu, B, Co, Fe, Mn, Cl, Na, Mo, dan Si. Hifa eksternal juga mampu menyerap dan melindungi perakaran dari logam berat Cd, Ni, Sr, Cs serta penyerap anion Br, dan I (Sieverding 1991) baik di tanah masam, netral maupun basa. Hifa cendawan berukuran 5-30 µm sehingga dapat tumbuh ke dalam pori-pori tanah yang berukuran kecil yang pori-pori tersebut tidak dapat ditembus oleh akar tanaman inang.
Sorgum (S. bicolor L. Moench) dan gandum (T. aestivum L.) ialah tanaman pertanian yang mempunyai nilai ekonomi penting. Sorgum selain sebagai sumber pangan juga digunakan sebagai bahan baku produksi bio-etanol, sebagai bahan ransum pakan ternak, bahan alternatif pembuatan gula, monosodium glutamat, asam amino dan minuman (Sirappa 2003). Tanaman sorgum juga bersifat mikotropik yaitu mampu bersimbiosis dengan cendawan mikoriza arbuskula. Ketergantungan tanaman sorgum terhadap mikoriza arbuskula cukup tinggi sehingga sering digunakan sebagai salah satu tanaman inang dalam produksi inokulum mikoriza arbuskula (Carrenho et al. 2007).
2
Ketergantungan tanaman sorgum dan gandum terhadap mikoriza arbuskula cukup tinggi sehingga sering digunakan sebagai salah satu tanaman inang dalam produksi inokulum mikoriza arbuskula.
Ketersediaan inokulum yang berkualitas sering menjadi kendala dalam pemanfaatan mikoriza arbuskula sebagai pupuk hayati karena cendawannya bersifat simbion obligat yaitu hanya dapat tumbuh jika bersimbiosis dengan akar tumbuhan inang (Smith dan Read 2008). Perbanyakan cendawan biasanya dilakukan dengan kultur pot menggunakan media tumbuh tanaman seperti zeolit, pasir atau tanah steril (Anas dan Tampubolon 2004). Cendawan bersama-sama dengan akar tanaman yang terkolonisasi dan seluruh media tumbuh tanaman digunakan sebagai sumber inokulum. Penggunaan inokulum tanpa formulasi biasanya mengalami berbagai hambatan yang diantaranya ialah penurunan kualitas inokulum dengan cepat serta kesulitan dalam penyimpanan, distribusi dan aplikasi di lapang. Formulasi inokulum dapat dilakukan dengan berbagai cara diantaranya ialah dengan formulasi tablet yaitu formulasi inokulum mikoriza arbuskula yang paling murah dan efektif untuk skala aplikasi lapang. Salah satu standar utama yang harus dipenuhi dalam formulasi inokulum ialah viabilitas inokulum yang ditunjukkan dengan kemampuan cendawan dalam mengkolonisasi akar inang dan membentuk struktur-struktur kolonisasi seperti entry point, hifa internal, arbuskula dan vesikula.
Permintaan terhadap inokulum mikoriza arbuskula untuk pertanian, perkebunan dan kehutanan di Indonesia sangat tinggi, namun ketersediaan inokulum yang berkualitas dan terformulasi belum tersedia dengan baik. Hampir seluruh tanaman pertanian kecuali Brasicaceae, Amaranthaceae, Cruciferae bersimbiosis dengan mikoriza arbuskula dan peran simbiosis dalam peningkatan pertumbuhan tanaman baik di rumah kaca maupun di lapang telah terbukti sangat signifikan (Adewole et al. 2010; Jiao et al. 2011). Pemanfaatan mikoriza arbuskula sebagai pupuk hayati di lapang terkendala ketidaktersediaan inokulum yang mudah dan murah untuk diaplikasikan di lapang
Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan sebagai berikut :
1. Mendapatkan formulasi inokulum mikoriza arbuskula yang berkualitas. 2. Mempelajari respon pertumbuhan sorgum terhadap aplikasi pupuk hayati. 3. Mempelajari respon pertumbuhan gandum terhadap aplikasi pupuk hayati.
Manfaat Penelitian Manfaat penelitian ini adalah :
3
2
TINJAUAN PUSTAKA
Mikoriza
Mikoriza berasal dari kata mykes (cendawan) dan riza (akar), yang dikemukakan oleh Albert Bernhard Frank pada tahun 1885 (Mosse 1981) untuk menggambarkan asosiasi antara dua organisme yang berbeda, membentuk satu organ morfologi yang khas. Mikoriza ialah simbiosis mutualisme antara cendawan asal tanah dengan akar tumbuhan yang memiliki peran utama sebagai pupuk hayati. Menurut Smith dan Read (2008) mikoriza dibagi menjadi 2 kelompok besar yaitu ektomikoriza dan endomikoriza. Endomikoriza dibagi menjadi 6 subtipe yaitu, ektendomikoriza, mikoriza monotropoid, mikoriza ericoid, mikoriza arbutoid, mikoriza anggrek dan mikoriza arbuskula. Mikoriza arbuskula termasuk filum Glomeromycota, yang selanjutnya dikelompokkan berdasarkan morfologi dan struktur molekulernya (Scuβler dan Walker 2001). Mikoriza arbuskula ialah salah satu tipe mikoriza yang membentuk kolonisasi hifa secara interseluler dan intraseluler, arbuskula dan vesikula di dalam akar tumbuhan inang, serta membentuk jalinan miselia di dalam tanah yang disebut hifa eksternal (Smith dan Read 2008). Di alam hampir semua tanaman dapat melakukan asosiasi dengan Mikoriza Arbuskula (MA) dan hanya beberapa suku tertentu tanaman yang tidak bersimbiosis dengan MA antara lain Brassicaceae, Amaranthaceae, Commelinaceae, Juncaceae, Proteaceae, Capparaceae, Polygonaceae, Resedaceae, Urticaceae, Caryophyllaceae, Cruciferae dan Chenopodiaceae (Aguilar et al. 2009).
4
yang jauh, keefektifan MA untuk meningkatkan serapan hara dan pertumbuhan tanaman ditunjukkan oleh respon tanaman yang berbeda tergantung pada tanaman inang dan jenis MA yang diinokulasikan.
Produksi Inokulum dan Pengembangan Formulasi Inokulum MA Indonesia memiliki iklim tropis yang kondisinya basah (intensitas hujan tinggi) sampai kering (sedikit hujan), tentunya kondisi ini menyebabkan keanekaragaman MA sangat besar. Sumber MA yang beranekaragam ini, mempunyai potensi untuk dikembangkan sebagai inokulum.MA bersifat simbion obligat, artinya tidak dapat ditumbuhkan pada medium buatan tanpa tanaman inang. Untuk memperbanyak MA harus dilakukan menggunakan tanaman inang seperti jenis tanaman Centrosema pubescens dan Pueraria phaseoloides. Hal ini menimbulkan kendala pada produksi perbanyakan MA untuk produksi inokulum dalam skala besar. Untuk menghasilkan inokulum secara sederhana maka digunakan kultur pot (Sieverding 1991) dan inokulum yang diperoleh merupakan campuran yang terdiri dari spora, akar tanaman dan medium tumbuh (Brundrett et al. 1996). Tanaman harus ditumbuhkan pada kondisi bebas dari kontaminasi patogen, dan selama penyimpanan kualitasnya tidak berubah. Pada proses perbanyakan yang dilakukan selama ini kontaminasi dari lapang sulit dihindari. Di luar negeri telah berhasil dikembangkan produksi inokulum yang dapat dilakukan oleh petani yang biayanya relatif murah. Pada cara ini digunakan inokulum starter yang diproduksi secara massal oleh perusahaan agroindustri. Inokulum starter ini selanjutnya digunakan oleh petani atau pengguna budidaya tanaman untuk produksi inokulum yang digunakan untuk kebutuhan mereka sendiri (Khasa et al. 2009; Sieverding 1991).
5 Tanah liat
Tanah liat merupakan partikel mineral yang berukuran kecil dari 0.002 mm sampai dengan submikroskopis yang berasal dari pelapukan unsur-unsur kimiawi penyusun batuan, tanah liat sangat keras dalam keadaan kering dan bersifat plastis pada kadar air sedang, pada kadar air lebih tinggi bersifat lengket (kohesif) dan sangat lunak, partikel ini merupakan sumber utama dari kohesi di dalam tanah yang lunak, susut kering dan susut bakar tinggi, unsur besi dan karbon lebih tingi karena warna mendekati abu-abu muda (Bowles 1991; Das 1994). Mineral lempung liat merupakan senyawa aluminium silikat yang kompleks dan terdiri dari satu atau dua unit dasar yaitu silikat tetrahedral dan aluminium oktahedral. Mineral kaolinit terdiri dari tumpukan lapisan-lapisan dasar, setiap lapisan dasar mempunyai ketebalan sekitar 7,2 Angstrom (1 A = 10 -10 m). Luas permukaan partikel kaolinit per unit massa adalah sekitar 15 m2/ gram. Pada tanah berbutir halus dan liat perlu diperhatikan tingkat plastisitas, hal ini disebabkan adanya mineral lempung dalam tanah. Plastisitas adalah kemampuan tanah menyesuaikan perubahan bentuk pada volume konstan tanpa mengalami keretakan atau kerusakan, bergantung pada keadaan air, tanah dapat berbentuk cair, plastis, semipadat atau padat. Kedudukan fisik tanah berbutir halus dan liat pada kadar air tertentu disebut konsistensi. Untuk mengetahui sifat karakteristik tanah dapat dilakukan pengujian atternberg limit. Pengujian ini menjelaskan sifat karakterisasi tanah lempung liat pada kadar air yang bervariasi (Rachmansyah et al. 2008).
Gipsum
Gipsum merupakan kalsium klorida (CaCl2) dan kalsium sulfat (CaSO4). kristal bening. CaCl2 berstruktur rutil terdistorsi dan kalsium dikelilingi oleh enam khlorin dalam koordinasi oktahedral. CaCl2 larut dalam air, etanol, dan aseton. CaCl2 menyerap air dan digunakan sebagai desikan. Dikenal hidratnya dengan 1, 2, 4, atau 6 molekul air terkoordinasi (Saito 1996). Gipsum termasuk mineral dengan sistem kristal monoklin 2/m, namun kristal gipsnya masuk ke dalam sistem kristal orthorombik. Gipsum umumnya berwarna putih, kelabu, cokelat, kuning, dan transparan. Hal ini tergantung mineral lain yang bercampur dengan gipsum. Gipsum umumnya memiliki sifat lunak dengan skala Mohs 1,5 –2. Berat jenis gipsum antara 2,31 – 2,35, kelarutan dalam air 1,8 gr/liter pada 0 °C yang meningkat menjadi 2,1 gr/liter pada 40 °C, tetapi menurun lagi ketika suhu semakin tinggi. Gipsum memiliki pecahan, antara 66 sampai dengan 114 dan belahannya adalah jenis choncoidal. Gipsum memiliki kilap sutra hingga kilap lilin, tergantung dari jenisnya. Gores gipsum berwarna putih, memiliki derajat ketransparanan dari jenis transparan hingga translucent, serta memiliki sifat menolak magnet atau disebut diamagnetit (Khatib et al. 2012).
6
sebagainya. Jumlahnya meliputi 75% dari seluruh volume perdagangan. Gipsum sebagai perekat mineral mempunyai sifat yang lebih baik dibanding dengan perekat organik sebab tidak menimbulkan pencemaran udara, murah, tahan api, dan kahat terhadap zat kimia. Gipsum mempunyai sifat cepat mengeras adalah sekitar 10 menit. Karena itu dalam pembuatan papan gipsum harus menggunakan bahan kimia untuk memperlambat proses pengerasan tanpa mengubah sifat gipsum sebagai perekat. Perlambatan tersebut dimaksudkan agar tersedia cukup waktu mulai dari tahap pencampuran bahan sampai tahap pengempakan.Waktu pengerasan gipsum bervariasi tergantung pada kandungan bahan dan airnya. Dalam proses pengerasan gipsum setelah dicampur dengan air maka terjadi hidratasi yang menyebabkan kenaikan suhu. Kenaikan suhu tersebut tidak boleh
melebihi suhu 400 ˚C. Suhu yang lebih tinggi lagi akan mengakibatkan
pengeringan gipsum dalam bentuk CaSO4.2H2O sehingga mengurangi bobot air hidratasi. Pengurangan tersebut akan menyebabkan berkurangnya kekokohan gipsum (Trisna dan Mahyudin 2012).
Zeolit
Zeolit merupakan material yang memiliki banyak kegunaan.Zeolit telah banyak diaplikasikan sebagai adsorben, penukar ion dan sebagai katalis.Zeolit adalah mineral kristal alumina silika tetrahidrat berpori yang mempunyai struktur kerangka tiga dimensi, terbentuk oleh tetrahedral (SiO4)4 dan (AlO4)5 yang saling terhubungkan oleh atom-atom oksigen sedemikian rupa, sehingga membentuk kerangka tiga dimensi terbuka yang mengandung kanal-kanal dan rongga-rongga yang didalamnya terisi oleh ion-ion logam, biasanya adalah logam-logam alkali atau alkali tanah dan molekul air yang dapat bergerak bebas (Chetam 1992). Zeolit alam terbentuk karena adanya proses kimia dan fisika yang kompleks dari batu-batuan yang mengalami macam perubahan di alam. Para ahli geokimia dan mineralogi memperkirakan bahwa zeolit merupakan produk gunung berapi yang membeku menjadi batuan vulkanik, batuan sedimen dan batuan metamorfosis yang selanjutnya mengalami proses pelapukan karena pengaruh panas dan dingin sehingga akhirnya terbentuk mineral-mineral zeolit. (Firdaus et al. 2013).
7
Struktur khas dari zeolit ialah hampir sebagian besar merupakan kanal dan pori, menyebabkan zeolit memiliki luas permukaan yang besar. Keadaan ini dapat dijelaskan bahwa masing-masing pori dan kanal maupun antar kristal dianggap berbentuk silinder, maka luas permukaan total zeolit adalah akumulasi dari luas permukaan dinding pori dan kanal-kanal penyusun zeolit. Semakin banyak jumlah pori yang dimiliki, semakin besar luas permukaan total yang dimiliki zeolit. Menurut Dyer (1988) luas permukaan internal zeolit dapat mencapai puluhan bahkan ratusan kali lebih besar dibanding bagian permukaan luarnya. Luas permukaan yang besar ini sangat menguntungkan dalam pemanfaatan zeolit baik sebagai adsorben ataupun sebagai katalis heterogen.
Sorgum
Sorgum (Sorghum bicolor L. Moench) merupakan salah satu jenis tanaman serealia yang memiliki potensi besar untuk dikembangkan di Indonesia karena mempunyai daerah adaptasi yang luas. Indonesia termasuk negara yang masih ketinggalan baik dalam penelitian, produksi, pengembangan, penggunaan, maupun ekspor sorgum, meskipun dalam jumlah terbatas, produksi sorgum Indonesia telah mampu diekspor ke Singapura, Hongkong, Taiwan, Malaysia dan Jepang. (Sirappa 2003) Tanaman sorgum toleran terhadap kekeringan dan genangan air, dapat berproduksi pada lahan marginal serta relatif tahan terhadap gangguan hama dan penyakit. Biji sorgum dapat digunakan sebagai bahan pangan serta bahan baku industri pakan ransum ternak, hijauan pakan ternak dan pangan seperti industri gula, monosodium glutamat, asam amino, pati, bioetanol, industri minuman.
Menurut Beti et al. (1990), Direktorat Jenderal Tanaman Pangan dan Hortikultura (1996), sorgum merupakan komoditas sumber karbohidrat yang cukup potensial karena kandungan karbohidratnya cukup tinggi, sekitar 73 g/100 g bahan. Namun, masalah utama penggunaan biji sorgum sebagai bahan pangan maupun pakan adalah kandungan tanin yang cukup tinggi, mencapai 0,40-3,6% (Rooney dan Sullines 1977) sehingga hasil olahannya kurang enak. Menurut Sudaryono (1996), masalah ini dapat diatasi dengan menmperbaiki teknologi pengolahan kulit biji dan lapisan testa dikikis menggunakan mesin penyosoh beras. Sorgum juga merupakan tanaman penghasil pakan hijauan sekitar 15-20t/ha/tahun dan pada kondisi optimum dapat mencapai 30-45 t/ha/tahun, (Wardhani 1996). Limbah sorgum (daun dan batang segar) dapat dimanfaatkan sebagai hijauan pakan ternak. (Soebarinoto dan Hermanto 1996). Areal yang berpotensi untuk pengembangan sorgum di Indonesia sangat luas, meliputi daerah beriklim kering atau musim hujannya pendek serta tanah yang kurang subur sebab sorgum mempunyai daya adaptasi lingkungan yang cukup luas (Sirappa 2003).
8
tingkat salinitas tinggi (Nasr et al. 2013). Inokulasi MA pada sorgum juga meningkatkan pertumbuhan dan produksi tanaman karena daya serap nutrisi dan mencegah tanaman dari serangan penyakit (Olagunju et al. 2014). MA juga mempengaruhi sorgum dan aktivitas mikroba tanah lainnya dengan menstimulasi produksi eksudat akar phytoalexins dan senyawa fenolik yang mampu meningkatkan aktivitas gen pertahanan khususnya kandungan zat chitinase, glukanase, biosintesis flavonoid.
Pemberian MA pada sorgum mampu meningkatkan trehalose, ameliorasi dan protein di daerah lahan kering (Kadiri 2014). Pada kombinasi pemberian kompos, vermikompos pada tanaman sorgum tidak memberikan efek penghambatan pada kolonisasi MA, justru peningkatan luas area daun menjadi lebih meningkat dan pemberian kombinasi jenis MA mampu meningkatkan produktivitas biji sorgum manis, meningkatkan nira tanaman sorgum (Hameeda et al. 2009).
Gandum
Gandum (Triticum aestivum L.) merupakan tanaman serealia pertanian yang sangat penting, memiliki peran strategis dalam mendukung ketahanan pangan dan pemenuhan kebutuhan pangan manusia. Ditinjau dari kandungan nutrisi, gandum merupakan tanaman serealia yang memiliki nutrisi cukup tinggi dengan komposisi protein 13%, karbohidrat 69%, namun yang paling penting adalah gandum memiliki kandungan glutein tinggi mencapai 80%. Kandungan glutein merupakan karakter kandungan fitokimia khas untuk gandum dibanding serealia lain. Glutein adalah protein yang bersifat kohesif dan liat yang berperan sebagai zat penentu elastisitas adonan berbasis tepung (Sleper dan Poehlman 2006).
Gandum digunakan sebagai sumber tepung terigu yang banyak digunakan dalam pembuatan roti, mie, biskuit, kue, semolina, bulgar dan sereal. Tepung terigu sebagai produk olahan dari biji gandum sebagai bahan baku makanan. Beragamnya produk olahan berbasis terigu menyebabkan produksi terigu dan permintaan gandum meningkat sebanding dengan tingkat konsumsi masyarakat terkait dengan tingkat pendapatan dan laju pertambahan penduduk yang selalu meningkat (Adnyana et al. 2006).
9
Gandum sebagai tanaman subtropis, pengembangannya di Indonesia yang merupakan lingkungan tropis terkendala masalah iklim, sehingga pengembangannya selama ini masih di daerah dataran tinggi yang memiliki iklim mirip dengan lingkungan subtropis, khususnya suhu yang rendah. Proses adaptasi tanaman gandum dilingkungan tropis khususnya dataran rendah dibatasi faktor iklim yang memiliki variasi cukup tinggi, utamanya suhu, kelembaban, lama penyinaran dan intensitas penyinaran. Wahyu et al. (2013) menyatakan bahwa terbatasnya luas dataran tinggi yang banyak ditanami dengan komoditas hortikultura yang mempunyai nilai ekonomis tinggi juga berpengaruh terhadap pengembangan gandum di Indonesia sehingga diperlukan pengembangan gandum di dataran rendah. Kendala utama yang dihadapi dalam pengembangan gandum ini adalah cekaman lingkungan di dataran rendah khususnya cekaman lingkungan di dataran rendah khususnya cekaman suhu tinggi.
Beberapa penelitian dalam rangka pengembangan gandum yang toleran dataran rendah sedang dilakukan di Indonesia (Wahyu et al. 2013). Adanya variasi lingkungan tidak akan menjamin suatu genotipe atau varietas tanaman gandum akan tumbuh baik dan memberikan hasil panen tinggi di semua wilayah. Hal ini terkait dengan kemungkinan ada tidaknya interaksi antara galur tanaman dengan kisaran keragaman lingkungan. Memahami mekanisme genetik dan fisiologis tanaman gandum sangat penting untuk menciptakan strategi efisien untuk mengembangkan kultivar gandum tahan cekaman suhu tinggi untuk sistem produksi yang berkelanjutan (Rao 2001). Saat ini pemerintah sedang melakukan uji coba kultivar gandum yang sesuai untuk dataran rendah .
10
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Januari 2011 sampai Mei 2013 di laboratorium Mikologi dan Rumah Kaca Departemen Biologi FMIPA IPB.
Alat dan Bahan Penelitian Alat Penelitian
Alat yang digunakan ialah saringan bertingkat (450µm, 250µm, 180 µm, 125 µm, 106 µm, 90 µm), sentrifugasi, mikroskop stereo, mikroskop majemuk, autoklaf, pinset spora, plastik tahan panas, cawan Petri, timbangan analitik, oven, water bath, cetakan inokulum, pot ukuran 300 gram, aluminium foil.
Bahan Penelitian
Bahan yang digunakan ialah isolat Glomus manihotis koleksi bagian Mikologi Departemen Biologi IPB, tanaman inokulum Centrosema pubescens, Pueraria phaseoloides, tanaman aplikasi formulasi Sorghum bicolor galur mutiara dan Triticum aestivum galur HP, Oasis, SBR, YMH, Wax, Munal, H20, SO3, SO5, S805, S809, Nias, Selayar. Bahan formulasi yang digunakan ialah zeolit berisi inokulum mikoriza arbuskula, gipsum dan tanah liat. Bahan pewarnaan akar berupa KOH 10 %, HCl 1 N, Biru tripan 0,05 %, gliserol 50 %, PVLG, Melzer’s, sukrosa 60 %, larutan hara Johnson P 25 %, aquades, air steril.
Prosedur Penelitian Persiapan Media Tanam
Zeolit dicuci bersih dengan air mengalir agar debu yang melekat pada permukaan zeolit hilang (sampai air cuciannya bening atau tidak keruh), setelah bersih zeolit dimasukkan ke wadah penampungan untuk dijemur dibawah sinar matahari sampai kering dan kemudian zeolit ditimbang dan siap dimasukkan ke dalam kantong plastik tahan panas untuk disterilisasi dengan autoklaf selama 120 menit pada suhu 121°C. Zeolit steril kemudian digunakan sebagai media tanam. Persemaian Benih
11 Produksi Massal Inokulum
Produksi inokulum dilakukan dengan menumbuhkan mikoriza arbuskula jenis G. manihotis dan tanaman inang C. pubescens, P. phaseoloides dengan diinokulasi mikoriza arbuskula jenis G. manihotis sebanyak 250 spora, yang sebelumnya telah disaring dan dibersihkan dengan teknik tuang saring basah (Gerdermann dan Nicolson, 1963) dan modifikasi dengan larutan sukrosa 60 % (Brundrett et al. 1996). Pot dipelihara di rumah kaca selama 10 minggu. Penyiraman dilakukan setiap hari dan pemupukan dilakukan setiap minggu menggunakan larutan hara Johnson dengan konsentrasi fosfor (P) sebanyak seperempat dari konsentrasi normal. Pot kontrol tanpa inokulasi diproduksi dengan cara yang sama. Pada umur tanaman mendekati delapan minggu, dilakukan pengamatan terhadap kolonisasi mikoriza arbuskula dengan metode Philips dan Hayman (1970) dan Giovanetti dan Mosse (1980). Pot yang mempunyai nilai kolonisasi akar lebih besar dari 75 % dilakukan penghentian penyiraman dan pemupukan selama dua minggu. Selanjutnya akar dan media tumbuh zeolit yang mengandung spora dan miselia cendawan mikoriza arbuskula dipanen dan digunakan sebagai inokulum dalam pembuatan formulasi tablet. Pot kontrol mendapat perlakuan yang sama seperti pot yang diinokulasi.
Formulasi Mikoriza Arbuskula
Zeolit yang berisi inokulum (Z) yang sudah kering udara dihomogenkan dengan cara diaduk perlahan-lahan, kemudian dicampur dengan gipsum (G) dengan perbandingan 1:1 (v/v). Selanjutnya campuran inokulum dan gipsum dicampur dengan berbagai komposisi tanah liat (C) sebagai perlakuan yaitu 1, 2, 3, 4, dan 5 bagian. Sebelum dicampurkan ke dalam gipsum, tanah liat dilarutkan dalam air terlebih dahulu dengan perbandingan 1:5 (w/v).Campuran bahan tersebut dicetak dengan alat berukuran diameter 1 cm dan tinggi 1 cm. Tablet yang sudah dicetak dikeringkan di dalam oven pada suhu 45 ˚C selama 36 jam. Bobot rata-rata tablet yang dihasilkan ialah sekitar 200 mg. Tablet selanjutnya diukur diameter pori permukan dan bagian dalamnya menggunakan mikroskop stereo serta diuji stabilitasnya. Stabilitas tablet diukur dengan cara mengamati perubahan fisik tablet.
Pengukuran Diameter Pori dan Kestabilan Tablet Inokulum Hasil Formulasi Diameter pori tablet hasil formulasi diamati dibawah mikroskop stereo dan diukur. Pengukuran dilakukan terhadap tablet utuh untuk mengukur diameter pori bagian luar tablet dan yang disayat melintang untuk mengukur pori bagian dalam. Stabilitas tablet hasil formulasi diukur secara fisik dengan 3 macam perlakuan yaitu disemprot dengan air, ditanam di pasir basah dan direndam pada air tergenang. Perubahan yang diamati ialah daya hancur tablet dalam satuan jam. Formulasi terbaik dipilih untuk digunakan dalam pengujian aplikasi inokulum pada tanaman inang sorgum.
UjiAplikasi Inokulum Hasil Formulasi pada Tanaman Sorgum (S. bicolor L.
Moench).
12
berukuran 300 gram yang berisi zeolit steril, selanjutnya pot ditanami benih sorgum berumur 4 hari. Pot kontrol diberi tablet tanpa inokulum cendawan MA. Tanaman ditumbuhkan di rumah kaca, disiram setiap hari dan dipupuk setiap minggu dengan larutan hara Johnson dengan konsentrasi P sebanyak seperempat dari konsentrasi normal (Lampiran 6).Tanaman dipelihara sampai berumur 30 hari setelah tanaman. Setiap perlakuan diulang sebanyak 5 kali. Pada saat panen, bagian tajuk setiap tanaman diukur tingginya, selanjutnya tajuk dipotong secara terpisah dan ditimbang untuk mendapatkan berat basahnya, kemudian dimasukkan ke dalam oven pada suhu 65 ˚C selama 48 jam sampai beratnya konstan untuk mendapatkan berat kering. Bagian akar dicuci dengan air mengalir, kemudian dikeringkan dengan kertas merang dan ditimbang. Akar kemudian diwarnai dengan metode Philips dan Hayman (1970). Parameter yang diukur ialah persen kolonisasi akar, panjang akar terkolonisasi, entry point, hifa internal, arbuskula, dan vesikula.
Uji Aplikasi Inokulum Hasil Tablet Terbaik untuk Tanaman Gandum (Triticum aestivum L.)
Tablet inokulum yang terbaik dari pertumbuhan tanaman sorgum yaitu 30 tablet digunakan untuk uji aplikasi pada tanaman gandum 13 galur yaitu Oasis, konsentrasi P sebanyak seperempat dari konsentrasi normal untuk kontrol negatif dan pot kontrol positif diberi larutan hara Johnson P 100 %. Pot berisi inokulum mikoriza arbuskula juga disiram setiap hari dan dipupuk setiap minggu dengan larutan hara Johnson dengan konsentrasi P sebanyak seperempat dari konsentrasi normal. Tanaman dipelihara sampai berumur 30 hari setelah tanaman. Setiap perlakuan diulang sebanyak 3 kali. Pada saat panen, bagian tajuk setiap tanaman diukur tingginya, selanjutnya tajuk dipotong secara terpisah dan ditimbang untuk mendapatkan berat basahnya, kemudian dimasukkan ke dalam oven pada suhu 65 ˚C selama 48 jam sampai beratnya konstan untuk mendapatkan berat kering. Bagian akar dicuci dengan air mengalir, kemudian dikeringkan dengan kertas HVS dan ditimbang. Akar kemudian diwarnai dengan metode Philips dan Hayman (1970). Parameter yang diukur ialah persen kolonisasi akar, panjang akar terkolonisasi, entry point, hifa internal, arbuskula, dan vesikula.
Analisis Data
13
Gambar 2. Morfologi bentuk formulasi tablet inokulum MA. Permukaan luar (a), permukaan dalam (b), bentuk utuh tablet (c).
A B C
4
HASIL DAN PEMBAHASAN
Hasil Formulasi Tablet Inokulum MA
Diameter pori bagian permukaan dan dalam tablet merupakan karakteristik tablet yang sangat penting karena menentukan aerasi dan merupakan habitat pertumbuhan cendawan MA. Gambar 1 menunjukkan ukuran diameter pori tablet inokulum MA hasil formulasi.
14
Gambar 3. Stabilitas tablet formulasi inokulum dengan perlakuan (a) disemprot dengan air, (b) diletakkan pada pasir basah (c) dan direndam dalam air. Hasil pengujian terhadap kestabilan tablet menunjukkan bahwa semakin kecil ukuran pori tablet maka kestabilan tablet semakin tinggi. Pola ini terlihat konsisten untuk ketiga perlakuan yang diujikan dalam penelitian ini yaitu disemprot air, disimpan dalam pasir basah dan direndam dalam air (Tabel 1). Tabel 1. Stabilitas tablet inokulum mikoriza arbuskula hasil formulasi yang
dinyatakan dalam waktu hancur tablet (jam) pada 3 perlakuan. Komposisi
tablet Z:G:C
Perlakuan
Semprot air Pasir basah Tergenang air Jam
1:1:1 33±0.63e 30±0.45e 23±0.32e
1:1:2 42±0.71d 35±0.38d 28±0.54d
1:1:3 49±0.55c 39±0.90c 32±0.84c
1:1:4 57±0.45b 46±0.63b 39±0.38b
1:1:5 65±0.24a 53±0.55a 46±0.32a
Keterangan:angka pada setiap kolom yang diikuti oleh huruf yang sama menunjukkan hasil yangtidak berbeda nyata berdasarkan DMRT pada α = 5%. Data menunjukkan nilai rataan dari lima kali ulangan± Standar error(SE). Z: inokulum,G:gipsum, C:tanah liat.
Data pada tabel 1 menunjukkan bahwa seluruh komposisi formulasi tablet hancur lebih cepat ketika direndam dengan air dibandingkan dengan perlakuan yang di dalam pasir basah maupun disemprot dengan air menggunakan botol yang diberi lubang. Perlakuan perendaman tablet dengan air menyebabkan tablet hancur dalam rentang waktu 23 sampai 46 jam setelah perlakuan. Peletakkan tablet dalam pasir basah menyebabkan tablet hancur pada rentang 30 sampai 53 jam, sedangkan penyemprotan dengan air mengakibatkan kehancuran tablet dalam rentang 33 sampai 65 jam. Perlakuan stabilitas tablet ditunjukkan pada gambar 3. Pengaruh Inokulasi Tablet pada Tanaman Sorgum (S. bicolor L.Moench)
Formulasi tablet terpilih menghasilkan kolonisasi akar yang baik pada tanaman sorgum dan peningkatan jumlah tablet yang diinokulasikan menyebabkan peningkatan kolonisasi akar secara signifikan. Secara berturut-turut kolonisasi akar yang diinokulasi dengan 5, 10, 15, 30 tablet ialah 58%, 65%, 70%, dan 80% (Gambar 4). Peningkatan kolonisasi MA dengan meningkatnya jumlah tablet yang digunakan juga diikuti dengan peningkatan struktur MA pada
15 formulasi Z:G:C (1:1:5) yang ditunjukkan dengan jumlah entry point, hifa internal, arbuskula dan vesikula di dalam akar tiap pot tanaman (Tabel 2).
Gambar 4. Persen kolonisasi cendawan mikoriza arbuskula pada akar tanaman sorgum (S. bicolor L. Moench.) umur 30 hari setelah diinokulasi (HSI). Data menunjukkan nilai rataan dari lima kali ulangan ± Standar error (SE). 5TM, 10TM, 15 TM, dan 30 TM = 5, 10, 15, dan 30 tablet MA.
Tabel 2. Struktur cendawan mikoriza arbuskula pada akar tanaman inang sorgum(S. bicolor L. Moench.) umur 30 hari setelah diinokulasi (HSI). Jumlah
5 58.8±0.66d 53.45±1.40d 33.36±1.03d 44.11±1.40d 10 72.2±1.43c 94.24±1.14c 49.60±1.21c 84.62±1.21c 15 88.2±1.02b 133.62±1.23b 63.23±1.08b 121.27±0.86b 30 99.8±1.16a 189.90±1.02a 93.10±1.16a 174.95±1.11a Keterangan: angka pada setiap kolom yang diikuti oleh huruf yang sama
menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRTpada α = 5%. Data menunjukkan nilai rataan dari lima kali ulangan ± Standar error (SE). Angka 5, 10, 15, dan 30 pada perlakuan jumlah tablet = jumlah tablet yang diinokulasikan.
Jumlah entry point pada perlakuan 5 tablet ialah sekitar 58,8 setiap pot tanaman, jumlah entry point semakin meningkat pada perlakuan tablet 10, 15 dan 30 tablet menjadi masing-masing 72, 88, dan 99.8 entry point setiap pot tanaman. Jumlah hifa internal meningkat setiap perlakuan jumlah tablet 5, 10, 15, dan 30 tablet yaitu sekitar 53, 94, 134 dan 190 hifa internal tiap pot.Jumlah arbuskula dan vesikula juga memiliki pola yang sama dengan jumlah entry point dan hifa internal tiap pot tanaman. Dari keempat parameter yang diuji pada struktur MA, hifa internal mempunyai jumlah lebih tinggi dibandingkan dengan entry point, arbuskula dan vesikula. Peningkatan kolonisasi dan struktur MA pada sorgum yang dihasilkan selaras dengan meningkatnya panjang akar terkolonisasi dan total
16
panjang akar tiap pot tanaman sorgum (Gambar 6). Karakter struktur MA pada tanaman sorgum (S.bicolor L. Moench) ditunjukkan pada gambar 6.
Gambar 5. Panjang akar terkolonisasi ( ), dan total panjang akar ( ) tanaman sorgum (S. bicolor L. Moench.) per pot pada umur 30 hari setelah inokulasi (HSI) pada perlakuan jumlah tablet inokulum. Data menunjukkan nilai rataan dari lima kali ulangan ± standar error (SE). 5 TM, 10 TM, 15 TM, dan 30 TM = jumlah tablet MA.
Peningkatan persentase kolonisasi pada akar tanaman sorgum menyebabkan korelasi positif pada peningkatan tinggi tajuk, bobot basah dan bobot kering tajuk, serta bobot basah akar tiap pot tanaman sorgum (Tabel 3). Mikoriza ialah simbiosis mutualisme antara mikoriza arbuskula dan tumbuhan, oleh karena itu tingkat kolonisasi cendawan pada akar akan mempengaruhi tingkat pertumbuhan tanaman inangnya. Tinggi tajuk, bobot basah dan kering tajuk, serta bobot basah akar tanaman inang sorgum yang ditunjukkan pada tabel 3 meningkat cukup baik terutama pada perlakuan pemberian inokulum MA sebanyak 30 meningkat signifikan, sedangkan pemberian 30 tablet tanpa inokulum MA juga mampu meningkatkan tinggi tajuk, bobot basah dan kering tajuk, serta bobot basah akar namun tidak secepat peningkatan jika diberi inokulum MA.
Gambar 6. Struktur mikoriza arbuskula pada akar tanaman sorgum (S. bicolor) umur 30 hari setelah diinokulasi tablet inokulum. (a) entry point, (b) hifa internal, (c) arbuskula, (d) vesikula. Perbesaran 400x.
Tabel 3. Parameter pertumbuhan tanaman sorgum (S. bicolor L. Moench.) pada 5TG 32.28±0.35g 412±0.15g 59.4±1.08f 49.0±1.79g 5TGM 37.30±0.23e 618±0.11e 83.6±2.16c 76.6±3.36e 10TG 35.16±0.17f 480±0.12f 65.8±1.16e 57.4±1.03f
17 10TGM 41.50±0.23c 826±0.17c 92.0±0.95b 98.8±1.93c 15TG 39.16±0.21d 592±0.08e 70.8±1.24d 70.8±1.24e 15TGM 43.66±0.11b 938±0.04b 97.4±0.4a 112.6±1.25b
30TG 41.54±0.54c 740±0.25d 90.6±3.06b 90.6±3.06d 30TGM 46.90±0.15a 998±0.12a 100.6±0.51a 119.8±0.67a Keterangan: angka pada setiap kolom yang diikuti oleh huruf yang sama
menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRTpada α = 5%. Data menunjukkan nilai rataan dari lima kali ulangan ± Standar error (SE). Angka 5, 10, 15, 30 pada perlakuan jumlah tablet = jumlah tablet yang diinokulasi TG = tablet tanpa MA, TGM = tablet mengandung MA.
Pengaruh Inokulasi Tablet pada Tanaman Gandum (T. aestivum L.)
Berdasarkan data persen kolonisasi yang disajikan pada gambar 7. menunjukkan bahwa seluruh galur gandum (T. aestivum) yang diuji terkolonisasi dengan cendawan mikoriza arbuskula dengan rentang nilai antara 62% sampai 80%. 13 galur gandum yang diuji dapat digolongkan ke dalam tiga kelompok berdasarkan pada persen kolonisasi yaitu terkolonisasi diatas 75% seperti galur Oasis, SBR dan HP. Kolonisasi 65- 75% seperti galur Nias, S805, Munal, H20, Ymh, Wax, S08 dan S09, dan yang dibawah 65% yaitu galur S03. Nilai kolonisasi cukup tinggi menunjukkan bahwa gandum merupakan tanaman yang cukup responsif terhadap kolonisasi cendawan mikoriza arbuskula, sedangkan perbedaan tingkat kolonisasi antar galur gandum diduga akibat perbedaan respon adaptasi terhadap kondisi lingkungan tropis. Data kolonisasi MA pada tanaman gandum tertera pada gambar 7.
Gambar 7. Persen kolonisasi MA pada akar tanaman 13 galur gandum (T. aestivum L) umur 30 hari setelah diinokulasi (HSI). Data menunjukkan nilai rataan dari 5 kali ulangan pada perlakuan 30 tablet± standar error (SE).
Kualitas kolonisasi 13 galur gandum cukup baik yang ditunjukkan dengan terbentuknya struktur MA berupa entry point, hifa internal, arbuskula dan vesikula dalam jumlah cukup tinggi tiap pot tanaman gandum. (Tabel 4).
18
Tabel 4. Struktur cendawan mikoriza arbuskula pada akar tanaman gandum (T. aestivum L.) umur 30 hari setelah diinokulasi.
Perlakuan Jumlah menunjukkan nilai rataaan dari 5 kali ulangan ± standar error (SE).
Galur Oasis mempunyai jumlah entry point, hifa internal, arbuskula dan vesikula tertinggi jika dibandingkan dengan ke 12 galur lainnya, pola ini sama dengan tingkat persentase kolonisasi dengan galur Oasis paling responsif struktur MA yang terbentuk dan kurang responsif adalah galur SO3 yang terkecil untuk struktur MA yang terbentuk di akar gandum. Bentuk karakter struktur MA yang terbentuk pada akar tanaman gandum ditampilkan pada gambar 8.
Peningkatan kolonisasi dan stuktrur MA tidak terlepas dari panjang total akar yang terbentuk masing-masing galur gandum dan panjang akar terkolonisasi (Gambar 9). Pada panjang akar terkolonisasi dan total panjang akar seiring dengan kolonisasi MA, didapatkan galur Oasis dan SBR yang tertinggi dan galur H20 dan S03 yang terendah. Hal ini diduga pengaruh adaptasi masing-masing galur gandum terhadap lingkungan tropis mengingat 13 galur gandum adalah introduksi gandum yang umumnya hidup di daerah beriklim subtropis.
Gambar 8. Struktur mikoriza arbuskula pada akar tanaman 13 galur gandum (T. aestivum L.) umur 30 hari setelah diinokulasi tablet inokulum. entry point, (b) hifa internal, (c) arbuskula, (d) vesikula. Perbesaran 400x.
19
Gambar 9. Panjang akar terkolonisasi ( ), dan total panjang akar ( ) tanaman 13 galur gandum (T. aestivum L.) tiap pot pada umur 30 hari setelah inokulasi (HSI). Data menunjukkan nilai rataan dari lima kali ulangan ± standar error (SE).
Tabel 5. Parameter pertumbuhan tanaman gandum (T. aestivum L.) pada usia 30 hari setelah diinokulasi.
Kontrol Negatif 41±0.14cd 764± 2.73j 81±0.88ghi 91±1.20hi
20
Galur 809 41±0.14cd 1064± 2.73j 81±0.88ghi 91±1.20hi
Keterangan: angka pada setiap kolom yang diikuti oleh huruf yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRT pada α = 5 %. Data menunjukkan nilai rataan dari lima kaliulangan ± standar error (SE). Kontrol negatif = pemberian 30 tablettanpa inokulum dan pupuk P 25 %. Kontrol positif = pemberian 30tablet tanpa inokulum dan pupuk P 100 %. Galur = pemberian 30tabletinokulum MA setiap galur gandum.
Tiga belas galur gandum yang diuji pada respon pertumbuhan panjang tajuk, bobot basah dan kering tajuk serta bobot basah akar ditunjukkan pada tabel 5. Dari tabel 5 terlihat bahwa pertumbuhan akar dan tajuk yang lebih baik masih ditunjukkan oleh galur gandum yang memiliki tingkat persentase kolonisasi yang tinggi. Inokulasi cendawan mikoriza arbuskula meningkatkan pertumbuhan tajuk ke 13 galur gangum dengan peningkatan pertumbuhan secara umum lebih tinggi jika dibandingkan dengan kontrol negatif yaitu kontrol dengan pemupukan unsur P 25 % maupun dengan kontrol positif yaitu kontrol mendapatkan pemupukan unsur P 100 % (Tabel 5). Inokulasi MA pada galur Oasis, SBR, HP, Nias, S805 meningkatkan pertumbuhan panjang tajuk lebih tinggi dari kedua kontrol negatif dan positif tersebut. Sedangkan pada galur Munal, Selayar, lebih sedikit baik pertumbuhan panjang tajuk dibandingkan kontrol positif, sedangkan galur YMH, Wax, H20, S08, S09, S03 peningkatan pertumbuhan akibat kolonisasi mikoriza setara dengan pemupukan dosis normal (100%) kontrol positif. Hal ini menunjukkan bahwa kolonisasi MA sangat penting untuk pertumbuhan dan keberhasilan adaptasi tanaman gandum dengan iklim daerah tropis.
21 mempunyai jumlah struktur MA yaitu entry point, hifa internal, arbuskula dan vesikula paling tinggi dibandingkan dua belas galur yang diuji.
Pembahasan
Formulasi Tablet Inokulum
Diameter pori tablet bagian permukaan dan dalam merupakan karakteristik tablet yang sangat penting karena menentukan aerasi dan tempat pertumbuhan cendawan. Penurunan diameter tablet diduga karena tanah liat ialah tanah berbutiran halus dengan ukuran partikel kurang dari 0.002 mm sampai dengan sub mikroskopis sehingga penambahan tanah tersebut menyebabkan penurunan ukuran diameter pori-pori tablet baik pada permukaan maupun pada bagian dalamnya. Penambahan komposisi gipum dalam formulasi bertujuan untuk membantu pengerasan formula yang dibentuk sehingga tidak mudah hancur. Gipsum mempunyai sifat cepat mengeras sekitar 10 menit sehingga mempercepat peran gipsum sebagai perekat dan desikan (Khatib et al. 2012).
Hasil pengujian terhadap kestabilan tablet menunjukkan bahwa semakin kecil ukuran pori tablet maka kestabilan tablet semakin tinggi dan pola ini terlihat konsisten untuk ketiga perlakuan yang diujikan dalam penelitian ini yaitu disemprot dengan menggunakan air, disimpan dalam pasir basah dan direndam dalam air. Dari seluruh komposisi formulasi tablet tampak bahwa perendaman dalam air menyebabkan kehancuran tablet lebih cepat daripada diletakkan di dalam pasir basah maupun disemprot dengan air. Stabilitas tablet merupakan parameter yang sangat penting dalam formulasi karena dapat melindungi cendawan mikoriza dari kondisi lingkungan yang kurang menguntungkan di alam sebelum terjadi perkecambahan spora dan pertumbuha hifa yang akan melakukan kontak dengan akar tanaman inang. Namun demikian, tablet yang terlalu stabil juga mempunyai kelemahan, karena akan menghambat pertumbuhan cendawan yang berada di dalam tablet, serta menjadi penghambat fisik untuk propagasi cendawan akibat berkurangnya proses penyerapan air. Berdasarkan data diameter pori dan kestabilan tablet. Tablet yang mempunyai komposisi inokulum : gipsum : tanah liat 1:1:5 ialah komposisi terpilih untuk produksi inokulum.
Pengaruh Inokulasi Tablet pada Tanaman Sorgum (S. bicolor L. Moench) dan Tanaman Gandum (T. aestivum L.)
22
Dari empat sturktur MA yang terbentuk di akar, hifa internal mempunyai jumlah lebih tinggi. Hal ini sesuai dengan Smith dan Read (2008) melaporkan bahwa hifa internal ialah struktur utama yang terbentuk di dalam akar yang selanjutnya merupakan struktur yang akan berkembang membentuk arbuskula dan kadang-kadang vesikula. Arbuskula yang terbentuk memiliki umur antara 2-14 hari yang kemudian dapat tumbuh kembali atau arbuskula dibentuk pada tempat yang baru. Vesikula ialah struktur yang terbentuk pada tahapan akhir proses kolonisasi dan berfungsi sebagai cadangan makanan cendawan MA. Dari data tersebut diatas menunjukkan bahwa kualitas inokulum hasil formulasi berupa tablet dalam penelitian ini mempunyai kualitas yang baik.
Mikoriza ialah simbiosis mutualisme antara cendawan dan tumbuhan, oleh karena itu tingkat kolonisasi cendawan pada akar akan mempengaruhi tingkat pertumbuhan tanaman inangnya. Dari pertumbuhan tanaman inang sorgum yang baik, maka diujicobakan formulasi terbaik sebanyak 30 tablet pada tanaman uji selanjutnya yaitu gandum menggunakan sebanyak 13 galur gandum yang berasal dari introduksi gandum impor subtropis ke kawasan tropis untuk dikembangkan di Indonesia. Pada inokulasi tablet MA terhadap 13 galur gandum juga didapatkan hasil yang memiliki pola mirip sama dengan tanaman sorgum, didapatkan pertumbuhan 13 galur gandum meningkat dengan pemberian inokulum MA jika dibandingkan dengan tanpa pemberian inokulum MA hanya diberi pemupukan P 100% dan P 25%. Peningkatan kolonisasi, struktur MA yang terbentuk di akar, dan peningkatan laju pertumbuhan panjang tajuk, bobot basah, bobot kering tajuk, dan bobot basah akar pada ke 13 galur gandum menghasilkan ukuran variasi. Hal ini diduga karena tanaman gandum adalah tanaman tropis dan tanaman kategori C3 sehingga pengembangannya selama ini masih di daerah dataran tinggi yang memiliki iklim mirip dengan lingkungan subtropis, khususnya suhu rendah. Wahyu et al.(2013) menyatakan adanya variasi lingkungan tidak akan menjamin suatu genotipe atau varietas tanaman gandum akan tumbuh baik dan memberikan hasil panen tinggi di semua wilayah. Hal ini terkait dengan kemungkinan ada tidaknya interaksi antara galur tanaman gandum dengan kisaran keragaman lingkungan terutama suhu, kelembaban, lama penyinaran dan intensitas penyinaran. Memahami mekanisme genetik dan fisiologis tanaman gandum sangat penting untuk menciptakan strategi efisien untuk mengembangkan kultivar gandum tahan cekaman suhu tinggi untuk sistem produksi yang berkelanjutan (Rao 2001).
Tiga belas galur gandum yang diuji,Oasis merupakan galur yang sangat responsif terhadap kolonisasi MA dan struktur MA berupa entry point, hifa internal, arbuskula, dan vesikula yang terbentuk di akar juga tinggi. Dari persentase kolonisasi yang beragam dan tetap tinggi jika dibandingkan tanpa pemberian MA pada galur tanaman gandum, menunjukkan gandum bersifat mikotropik yaitu tanaman yang mampu bersimbiosis dengan cendawan mikoriza arbuskula. Hal ini sesuai dengan penelitian Sing dan Adholeya 2004 juga didapatkan pada perlakuan berbagai varietas gandum dengan aplikasi MA memberikan repson pertumbuhan yang beragam pada tanaman gandum.
23 tanaman mendapatkan sumber nutrisi yang cukup dari cendawan MA yang diserap melalui hifa eksternal yang tumbuh mengeksplorasi media tumbuh tanaman (Bucking et al. 2012; Koltai dan Kapulnik 2010). Selain itu tingginya jumlah hifa internal menyebabkan cendawan mendapatkan cukup nutrisi untuk pertumbuhannya termasuk untuk pembentukan jalinan hifa yang berfungsi menyerap nutrisi sebagai perpanjangan dari rambut akar (Aguilar et al. 2009). Oleh karena itu, alokasi unsur karbon yang cukup dari tanaman inang kepada cendawan akan menyebabkan transfer nutrisi dari cendawan ke dalam tanaman inang juga meningkat (Parniske 2008).
Pertumbuhan panjang tajuk, bobot basah dan kering tajuk, serta bobot basah akar pada galur Oasis, SBR, HP, S805, Nias menunjukkan pemberian inokulum MA maupun kontrol positif dan kontrol negatif tetap memberikan respon pertumbuhan terbaik dibandingkan galur gandum lainnya, pada galur gandum lainnya respon terbaik terdapat pada perlakuan pemberian inokulum MA. Peningkatan pertumbuhan pada tanaman gandum pada perlakuan tanpa pemberian inokulum MA diduga oleh bahan pembawa inokulasi tablet dan pemberian larutan hara Johnson, dan karena terdapat penambahan unsur hara dari bahan pengisi seperti Ca2+ dari gipsum dan nutrisi lainnya berupa mineral lempung liat serta zeolit yang memiliki peran sebagai adsorben , penukar ion dan katalis. Dari data 13 galur gandum yang semuanya mampu mempercepat pertumbuhan dengan pemberian inokulum MA berarti inokulum MA juga tetap berkualitas baik untuk pupuk hayati pada tanaman gandum sehingga berpeluang galur-galur gandum yang dujicobakan untuk dikembangkan di Indonesia.
Peran cendawan mikoriza arbuskula dalam pertumbuhan gandum diduga tidak saja melalui penyediaan unsur hara dan hormon pertumbuhan, namun juga berperan dalam resistensi tanaman terhadap kekeringan untuk tetap tumbuh (Al-Karaki et al. 2004; Hooda et al. 2008). MA membantu dalam peningkatan kadar klorfil a dan b pada tanaman gandum yang mengalami cekaman kekeringan (Mouchechi et al. 2012). Hal ini karena jalinan-jalinan miselia yang tumbuh di daerah rizosfer berfungsi tidak saja dalam penyerapan nutrisi tetapi juga dalam penyerapan air dan proteksi tanaman terhadap serangan penyakit (Morales et al. 2012). Tanaman bersimbiosis umumnya resistensi terhadap kekeringan (Song 2005).
5
SIMPULAN DAN SARAN
Simpulan
24
meningkatkan pertumbuhan tajuk 13 galur gandum (T. aestivum L). Seluruh galur terkolonisasi cendawan mikoriza arbuskula dengan kolonisasi terendah sebesar 62 % pada galur SO3 dan tertinggi sebesar 80 % pada galur Oasis dan SBR.
Saran
Penelitian lanjutan terhadap formulasi inokulum MA perlu dilakukan terhadap waktu daya simpan dan aplikasi di rumah kaca dan tanah lapang pada berbagai komoditas tanaman pangan seperti sorgum dan gandum sampai tahap panen.
Ucapan Terima Kasih
Disampaikan ucapan terima kasih kepada komisi pembimbing dan Departemen Biologi FMIPA IPB yang telah memberi bantuan dana pendidikan dan dana penelitian untuk produksi inokulum MA melalui proyek pupuk hayati PT Pupuk KaltimTbk dan terima kasih kepada Departemen Agronomi dan Hortikultura yang telah memberi bantuan benih introduksi 13 galur gandum tropis.
DAFTAR PUSTAKA
Adewole MB, Awotoye DO, Ohienbor MO, Salami AO.2010. Influence of mycorrhiza fungi on phytoremediating potential and yield of sunflower in Cd and Pb polluted soils. J Agr Sci 55(1):17–28. doi 10.2298/jas10010174. Aguilar C, Barea JM, Gianinazzi V, Pearson VG. 2009. Mycorrhizal Functional
Processes and Ecological Impact. Berlin (DE): Springer-Verlag.
Agustina K, Sopandie D, Trikoesoemaningtyas,Wirnas D. 2010. Tanggap fisiologi akar sorgum (Sorghum bicolor L. Moench) terhadap cekaman aluminium dan defisiensi fosfor di dalam rhizotron. J Agron Indones 38:88-94.
Al-Karaki GN, Al-Omoush M. 2002. Wheat response to phosphor gypsum and mycorrhizal fungi in alkaline soils. J Plant Nutri 25: 873-883.
Al-Karaki GN, McMichael B, Zahl J. 2004. Field response of wheat to arbuscular mycorrhizal fungi and drought stress. Mycorrhiza 14: 263-269.
Anas I, Tampubolon JLO. 2004. Media campuran tanah pasir dan pupuk anorganik untuk memproduksi inokulan CMA. Bul Agron 92 (1) : 26-31. Avinash R, Sumit R, Amitava. 2013. Mycorrhiza mediated phosphorus use
efficiencyin plants. J Environ Exp Biol 11:107-117.
Behl RK, Sharma H, Kumar V, Narula N. 2003. Interaction among mycorrhiza, Azotobacter chrococcum and root characteristics of wheat varieties. J Agron Crop Sci 189: 151-155.
Beti YA, Ispandi A, Sudaryono.1990. Sorgum Monografi. No 5. Balai Penelitian Tanaman Pangan Malang. 25 hlm.
25 Brundrett M. N Bougher. B Dell. T Groove. N Malajczuk. 1996. Working with Mycorrhizas in Forestry and Agriculture. Wembley (AU) CSIRO Centre for Meditrreanean Agriculture Research.
Bucking H, Liepold E, Amilwade P.2012.The role the mycorrhizal symbiosis in nutrient uptake of plants and the regulatory mechanisms underlying these transport processes. J Plant Sci 53:1593–1601.
Carrenho R, Trofem SFB, Bononi VLR, Silva ES.2007. The effects of different soil properties on arbuscular mycorrhizal colonization of peanuts, sorghum and maize. Act Bot Bras 21(3) :723–730.
Castillo CG, Pucclo F, Morales D, Bone F, Sieverding E. 2012. Early arbuscular mycorrhiza colonization of wheat, barley and oats in andosols of southern Chile. J Soil Sci Plant Nutr 12(3) : 511-524.
Cheetam DA, 1992. Solid State Compound, Oxford university press. p. 234-237 Christie P. Xiaolin C, Baodong.2004. Arbucular mycorrhiza can different
translocation of zinc to shoots of host plants in soil moderately polluted with zinc. J Plant Soil 261:209-217.
Daei G, Ardekani MR, Rajali F, Teimuri S, Miransanri M. 2009. Allevation of salinity stress on wheat yield, yield components and nutrient uptake using arbuscular mycorrhizal fungi under field conditions. J Plant Physiol 166: 617-625.
Das DK. 1994. Introductory Soil Science. Kalyani Publisher (US).
Direktorat Jenderal Tanaman Pangan dan Hortikultura.1996. Prospek sorgum sebagai bahan pangan dan industri pangan. Risalah Simposium Prospek tanaman sorgum untuk pengembangan agroindustri, 17-18 januari 1995. Edisi khusus Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian no 4. 1996 : 2-5.
Dyer A. 1988An introduction to zeolite molecular sieves, John Wiley and Sons Ltd (UK) : Chichester.
Fasaei RG, Mayel S. 2012. Influence of arbuscular mycorrhizal fungus, phosphorus and zinc on wheat grown on a calcareous soil international research. J Basic Appl Sci 3(7):1411–1416.
Ferrol N, Barrea JM, AguilarA.2002. Mechanisms of nutrient transport across interfaces in arbuscular mycorrhizas. Plant Soil 244:231–237.
Firdaus LH, Wicaksono AR, Widayat. 2013. Kajian metode dan penetapan kapasitas tukar kation zeolit sebagai pembenah tanah untuk lahan pertanian terdegradasi. JTKI 2(2) : 148-154.
Gamal HR. 2005. Contribution of arbuscular mycorrhizal fungus to red kidney and wheat plant tolerance grown in heavy metal-polluted soils. J Afr Biotech. 4: 332-345.
Gerdeman JW, Nicolson TH. 1963. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. Trans Br Mycol Soc 46 (2) : 489-500.
26
Hooda H, Ghalia A, Khalafallah A. Responses of wheat plants associated with arbuscular mycorrhizal fungi to short term water stress followed by recovery at three growth stages. J Appl Sci Res. 4: 570-580.
Jackson C, Magan N. 2001. Fungi as Biocontrol agent progress, prblems and potential . (US) :CABI Publishing
Jiao H, Chen Y, Lin X, Liu R. 2011. Diversity of arbuscular mycorrhizal fungi in greenhouse soils continously planted to watermelon in North China. Mycorrhiza 21: 681–688.doi.10.1007/500572-011-0377-z.
Kadiri, M. 2014. Studies on physiological amelioration of deterious effects of drought on Sorghum bicolor (L).Moench. J Agric Food Sci 2: 25:27.
Karandashov V, Nagy R, Wegmuller S, Amrhein N, Bucher M. 2004. Evolutionary conservation of a phosphatte transporter in the arbuscular mycorrhizal symbiosis. PROC Natl Acad Sci 101: 6285-6290.
Khasa D, Piche’ P, Yves AP. Coughlan .2009. Advances in mycorrhizal science and technology. Canada (CA) : NRC Press.
Khatib JM, Wright PS, Mangut E, Negim EM. 2012. Porosity and pore size distribution of well hydrated cement fly ash gypsum pastes. J Eurasi Scin. Res. 7: 142-145.
Majid J, Erfandiar F, Ayneh A. 2013. Effect of mycorrhiza and Azospirillum on some germination characteristics of wheat cultivars. J Eng Appl Sci. 3: 2216-2221.
Mohammad A, Mitra B, Khan AG. 2004. Effects of sheared root inoculum of Glomus intraradices of wheat grown at different phosphorus levels in the field. Agri Eco Environ. 103: 245-249.
Moradi M, Mojtaba YR, Adele D.2013. Studying capability of soil cadmium phytoremediation by sorghum in the presence of mycorrhizal fungi. J Int Biosci. 3: 233-239.
Morales VC, Navarro RC, Garrido JMG, Illana A, Ocampo JA, Steinkellner S, Vierheilig H. 2012. Bioprotectif agains Gaeumannomyces graminis in barley – ce comparison between arbuscular mycorrhizal fungi. Plant Soil Environ 58(6) : 256–267.
Mosse B. 1981. Vesicular arbuscular mycorrhiza for tropical agriculture. Hawaii Institute of tropical Agriculture and Human Resources. University of Hawaii (US) 82 p.
Mouchechi A, Heidar B, Assad MT. 2012. Allevation of drought stress effects on wheat using arbuscular mycorrhizal symbiosis. J Agri Sci. 2: 35-47.
Nasr, A.H., M. Zare, O. Alizadeh, N.M. Naderi. 2013. Improving effect of mycorrhizal symbiosis on Sorghum bicolor under for levels of drought stress .J Agri Res.8 :5347-5353.
Nasrullah, Sharif M, Rubina K, Burni T. 2010. Occurence and distribution of arbuscular mycorrhizal fungi in wheat and maize crops of malakand division of north west fronties province. Pak J Bot. 42: 1301-1312.
Noori M, Reza H, Rigi K, Heidari M, Keykha A. 2014. Effect of mycoorhiza and nitrogen fertilizer on quantitative traints of wheat. JNAS. 3: 295-297.