PENGARUH KONSENTRASI AIR LERI DAN BAP
TERHADAP MULTIPLIKASI ANGGREK TEBU
(Grammatophyllum speciosum) SECARA IN VITRO
SKRIPSI
Oleh: Siti Safitri Nafi’ah
20120210110
Program Studi Agroteknologi
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
YOGYAKARTA
ii
PENGARUH KONSENTRASI AIR LERI DAN BAP
TERHADAP MULTIPLIKASI ANGGREK TEBU
(Grammatophyllum speciosum) SECARA IN VITRO
Diajukan kepada Fakultas Pertanian Universitas Muhammadiyah Yogyakarta sebagai syarat untuk memperoleh derajat Sarjana Pertanian
Oleh: Siti Safitri Nafi’ah
20120210110
Program Studi Agroteknologi
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
YOGYAKARTA
iv
v
HALAMAN PERSEMBAHAN
Alhamdulillahirobbil’alamiin berkat rahmat Allah SWT penulis dapat menyelesaikan skripsi ini. Alhamdulillah atas kemudahan, petunjuk, kesehatan serta kenikmatan yang tiada hentinya. Semoga ilmu yang penulis peroleh akan bermanfaat dunia akhirat. Kupersembahkan karya ini untuk:
1. Ayahanda Mulyadi dan Ibunda Nur Arifah, terima kasih atas doa, cinta, kasih sayang, pengorbanan dan segala dukungan baik moriil maupun materiil kepada penulis, sehingga dapat menyelesaikan tugas ini.
2. Adikku Muhammad Anditia Basith terima kasih atas doa dan dukungannya, semoga kita bisa membanggakan orang tua kita, dan kepada keluarga besar terima kasih atas dukungan dan semangat yang telah diberikan.
3. Sahabatku Linda Kusumastuti, Nadia Dwi Larasati dan Galuh Wahyuningtyas terima kasih untuk doa, dukungan dan kebersamaan yang telah diberikan selama menduduki bangku kuliah.
4. Imanudin, Bagus Arrasyid, dan teman-teman Agroteknologi yang telah membantu dalam penyelesaian skripsi ini, semoga persahabatan kita selalu terjaga sepanjang waktu.
5. Almamaterku, terima kasih atas kesempatannya untuk menuntut ilmu.
viii
A. Anggrek Tebu (Grammatophyllum speciosum) ... 6
B. Kultur In Vitro ... 8
C. Air Leri ... 9
D. Hipotesis ... 12
III.TATA CARA PENELITIAN ... 13
A. Tempat dan Waktu Penelitian ... 13
B. Bahan dan Alat Penelitian ... 13
C. Metode Penelitian ... 13
D. Cara Penelitian ... 14
E. Parameter yang Diamati ... 17
F. Analisis Data ... 19
IV.HASIL ANALISIS DAN PEMBAHASAN ... 20
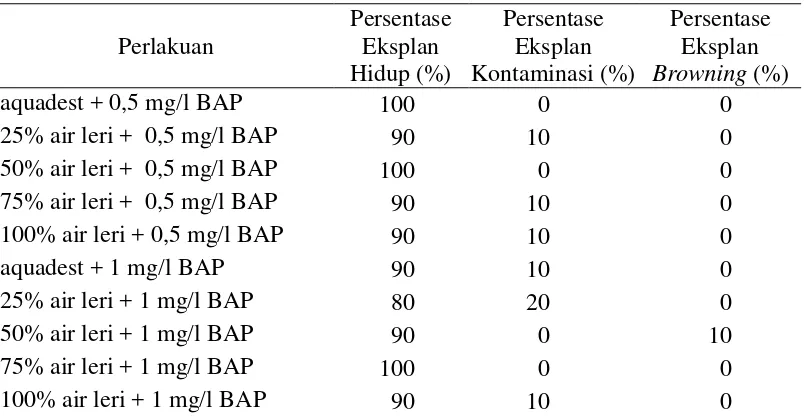
A. Persentase Eksplan Hidup, Browning dan Kontaminasi (%) ... 20
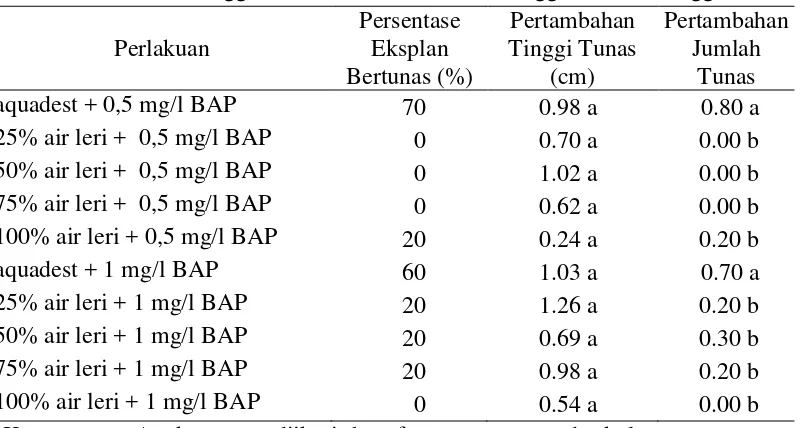
B. Persentase Eksplan Bertunas (%) ... 26
C. Pertambahan Tinggi Tunas ... 28
D. Pertambahan Jumlah Tunas ... 29
E. Pertambahan Jumlah Daun ... 31
F. Persentase Eksplan Berakar (%) ... 33
ix
DAFTAR TABEL
Tabel Halaman
1. Hasil Analisis Kandungan Air Leri Beras Putih... 10 2. Pengaruh Konsentrasi Air Leri dan BAP terhadap Persentase Eksplan Hidup,
Browning dan Kontaminasi Anggrek Tebu pada minggu ke-8.... 21 3. Pengaruh Konsentrasi Air Leri dan BAP terhadap Persentase Eksplan
Bertunas, Tinggi Tunas dan Jumlah Tunas Anggrek Tebu pada minggu ke-8. ... 26 4. Pengaruh Konsentrasi Air Leri dan BAP terhadap Jumlah Daun, Persentase
xi
DAFTAR LAMPIRAN
Lampiran Halaman
I. Komposisi Medium Murashige and Skoog (MS) ... 42
II. Perhitungan Pembuatan Medium MS... 43
III. Bagan Pembuatan Medium ... 44
IV. Lay Out Penelitian ... 45
V. Hasil Sidik Ragam ... 46
xiii
ABSTRACT
Grammatophyllum speciosum is the largest orchid ever. This plant grow as an epiphyte plant on the trees in the forest. The natural breeding Grammatophyllum speciosum are very slow and become rare. Therefore, the techniques that can reproduce the orchid buds in a short time, with significant amounts and no disease is needed to be done. The purpose of this research was to determine the effect and the best concentration of rice extract and BAP for the multiplication of Grammatophyllum speciosum buds. The research was conducted in the In Vitro Laboratory, Faculty of Agriculture, Universitas Muhammadiyah Yogyakarta from November 2015 to April 2016.
The research used a single factor which arranged in Completely Randomized Design (CRD). The treatments consist of aquadest + 0,5 mg/l BAP, 25% rice extract + 0,5 mg/l BAP, 50% rice extract + 0,5 mg/l BAP, 75% rice extract + 0,5 mg/l BAP, 100% rice extract + 0,5 mg/l BAP, aquadest + 1 mg/l BAP, 25% rice extract + 1 mg/l BAP, 50% rice extract + 1 mg/l BAP, 75% rice extract + 1 mg/l BAP dan 100% rice extract + 1 mg/l BAP. Each treatment has 10 replication. The data were analyzed by using The Analysis of Variance and followed by The Duncan Multiple Range Test (DMRT) at α=5%.
The results of this research showed that the various concentrations of the rice extract and BAP were able to multiply the orchid bud and affect the growth of orchid root length. The use of 75% rice extract + 1 mg / l BAP on ½ MS medium was the best concentration for orchid multiplication.
1 A. Latar Belakang
Indonesia memiliki kondisi yang memenuhi persyaratan bagi pertumbuhan berbagai macam tanaman hias. Pengembangan komoditi tanaman hias dilakukan atas berbagai pertimbangan yang mengacu pada tersedianya pangsa pasar, keuntungan kompetitif dan nilai ekonomi. Hal tersebut ditunjukkan dengan perkembangan pasar yang semakin meluas dengan peningkatan permintaan di dalam maupun di luar negeri. Salah satu komoditas tanaman hias yang prospektif untuk dikembangkan secara nasional yaitu anggrek. Berdasarkan data BPS yang diolah Pusat Data dan Informasi Pertanian (2013), volume ekspor tanaman hias di Indonesia masih didominasi oleh tanaman anggrek yaitu sebesar 58.656 ton, baik itu berupa bibit seperti aranda, dendrobium, grammatophyllum, vanda, cattelya, phalaenopsis, maupun berupa tanaman.
Peraturan Pemerintah Republik Indonesia Nomor 7 Tahun 1999 mengenai jenis-jenis tumbuhan dan satwa yang dilindungi menetapkan bahwa Grammatophyllum speciosum adalah anggrek yang dilindungi (Peraturan Pemerintah, 1999).
Pelestarian anggrek tebu masih digunakan cara konvensional dengan perbanyakan vegetatif dan generatif. Perbanyakan vegetatif biasanya dilakukan melalui pemecahan atau pemisahan rumpun anggrek yang kemudian ditanam ke media yang sama seperti induknya. Perbanyakan vegetatif seperti ini akan menghasilkan tanaman yang memiliki sifat genetik sama dengan induknya. Namun, perbanyakan konvensional secara vegetatif ini tidak praktis dan jumlah anakan yang diperoleh sangat terbatas. Demikian pula dengan perbanyakan konvensional secara generatif menggunakan biji. Biji anggrek berukuran sangat kecil dan tidak memiliki endosperm (cadangan makanan), sehingga akan menyulitkan proses perkecambahan di alam. Oleh sebab itu, dibutuhkan alternatif lain yaitu menggunakan teknik kultur in vitro (Iswanto, 2001).
dan Nursandi, 2004). Salah satu tahap yang menentukan perbanyakan anggrek dalam kultur in vitro adalah tahap multiplikasi. Tahap multiplikasi bertujuan untuk menggandakan bahan tanam yang digunakan (Yusnita, 2004).
Keberhasilan perbanyakan anggrek secara kultur in vitro salah satunya didukung oleh medium yang digunakan. Medium yang sering digunakan adalah MS (Murashige and Skoog) yang mempunyai kandungan nitrat, kalium dan amonium tinggi. Medium MS juga mengandung jumlah hara anorganik yang layak untuk memenuhi kebutuhan sel tanaman dalam kultur (Wetter dan Constabel, 1982). Sjahril dkk. (2011) juga menyatakan bahwa medium kultur tidak hanya mengandung unsur hara makro dan mikro, tetapi juga vitamin atau bahan organik lainnya namun, biaya yang dibutuhkan untuk menggunakan medium MS ini terbilang mahal karena unsur-unsur murni yang ada di dalamnya. Oleh karenanya, penambahan bahan organik pada medium MS dapat dilakukan untuk mengurangi biaya pada pembuatan medium kultur. Penambahan bahan organik ini juga dapat melengkapi unsur-unsur yang justru tidak terdapat di medium MS, sebagaimana dinyatakan oleh Pramesyanti (1999) bahwa penambahan bahan organik kompleks, merupakan salah satu cara untuk memperkaya nutrisi pada medium kultur.
kesuburan tanah dan meningkatkan pertumbuhan tanamannya. Air leri memiliki kandungan seperti fosfor dan magnesium yang baik untuk pembelahan sel tanaman. Oleh karenanya, air leri juga dapat dimanfaatkan untuk memperkaya nutrisi medium kultur. Selain itu, penggunaan air leri sebagai medium kultur dapat digunakan untuk memanfaatkan limbah di masyarakat dan mengurangi biaya pembuatan medium kultur. Livi dkk. (2014) menyatakan bahwa penambahan air leri beras putih dan tanpa zat pengatur tumbuh dalam medium MS menghasilkan jumlah tunas terbaik pada anggrek Grammatophyllum speciosum. Sitokinin endogen anggrek tebu sudah mampu memultiplikasi tunas
B. Perumusan Masalah
Anggrek tebu (Grammatophyllum speciosum) merupakan anggrek hutan yang keberadaannya cukup langka. Perbanyakan anggrek tebu secara konvensional dengan memisahkan rumpun anggrek sangat terbatas sehingga ketersediaan bibit kurang. Alternatif lain untuk perbanyakan anggrek tebu dapat dilakukan dengan metode kultur in vitro. Keberhasilan dari metode tersebut terdapat pada medium yang digunakan, medium kultur in vitro mengandung unsur-unsur murni sehingga harganya mahal. Oleh karena itu, untuk mengurangi biaya pembuatan medium dapat dilakukan penambahan unsur hara dari bahan organik seperti air cucian beras atau air leri. Air leri memiliki unsur makro seperti P dan Mg yang dapat dimanfaatkan untuk pertumbuhan tanaman. Selain itu, penggunaan air leri sebagai medium kultur juga merupakan salah satu upaya pemanfaatan limbah masyarakat. Adapun permasalahan dalam pemanfaatan air leri yaitu, belum diketahui bagaimana pengaruh kombinasi konsentrasi air leri dan BAP serta kombinasi konsentrasi air leri dan BAP yang tepat terhadap multiplikasi anggrek tebu secara in vitro.
C. Tujuan Penelitian
1. Mengetahui pengaruh kombinasi konsentrasi air leri dan BAP terhadap multiplikasi potongan tunas anggrek tebu (Grammatophyllum speciosum). 2. Menentukan konsentrasi terbaik air leri dan BAP terhadap multiplikasi
6
A. Anggrek Tebu (Grammatophyllum speciosum)
Anggrek tebu (Grammatophyllum speciosum) merupakan anggrek yang diyakni merupakan anggrek terbesar yang pernah ada. Anggrek ini tersebar tersebar dari Myanmar, Thailand, Laos, Vietnam, Malaysia, Indonesia, sampai New Guinea. Sementara di Indonesia tanaman ini menyebar mulai dari pulau Sumatera, Kalimantan, Jawa, Sulawesi, Maluku hingga Papua.
Gambar 1. Habitus Tanaman Anggrek Tebu
Klasifikasi anggrek tebu (Grammatophyllum speciosum) menurut Plantamor (2012) adalah sebagai berikut:
Kerajaan : Plantae
Divisi : Magnoliophyta Kelas : Liliopsida Ordo : Orchidales Famili : Orchidaceae Genus : Grammatophyllum
Tanaman ini tumbuh secara epifit pada pohon-pohon di hutan-hutan yang agak terbuka. Anggrek tebu termasuk jenis anggrek dengan pertumbuhan monopodial, yaitu anggrek yang ujung-ujung batangnya memiliki pertumbuhan tidak terbatas dengan pertumbuhan satu arah ke atas. Ciri utama anggrek tebu adalah ukurannya yang besar. Panjang malai dapat tumbuh mencapai 2,5 – 3 meter dengan diameter sekitar 1,5-2 cm. Setiap malai memiliki puluhan, bahkan mencapai seratus kuntum bunga yang masing-masing bunga berdiameter sekitar 10 cm. Penduduk lokal sering menjulukinya dengan sebutan anggrek macan berdasarkan corak bunganya, akan tetapi sebutan ini sering rancu dengan kerabatnya, G. scriptum yang memiliki corak serupa. Oleh sebab itu, anggrek ini populer juga dengan sebutan sebagai anggrek tebu, karena bentuk batang tanamannya yang menyerupai batang pohon tebu (Puspita, 2011).
Pengalihan fungsi habitat aslinya seperti pembukaan lahan pertanian, perumahan dan perindustrian diduga sebagai faktor utama pemicu kelangkaan anggrek tebu. Berdasarkan Peraturan Pemerintah Republik Indonesia Nomor 7 Tahun 1999 tanggal 27 Januari 1999, anggrek tebu termasuk ke dalam daftar tanaman yang dilindungi. Perkembangbiakan alami anggrek tebu sangat lambat, sehingga anggrek ini mengalami kelangkaan dan berada diambang kepunahan.
sama dengan induknya. Namun, perbanyakan konvensional secara vegetatif ini tidak praktis dan jumlah anakan yang diperoleh sangat terbatas. Demikian pula dengan perbanyakan konvensional secara generatif menggunakan biji. Biji anggrek berukuran sangat kecil dan tidak memiliki endosperm (cadangan makanan), sehingga akan menyulitkan proses perkecambahan di alam. Oleh sebab itu, dibutuhkan terobosan menggunakan teknik kultur in vitro untuk perbanyakannya (Iswanto, 2001).
B. Kultur In Vitro
Kultur In vitro merupakan metode pengisolasian bagian tanaman (sel, jaringan, atau organ) kemudian menumbuhkannya pada medium buatan dalam wadah tembus pandang dan kondisi aseptik, hingga bagian-bagian tanaman tersebut dapat memperbanyak diri, tumbuh menjadi tanaman lengkap (plantlet) kembali (Sjahril, 2011). Metode ini merupakan salah satu metode yang mulai banyak digunakan dalam perbanyakan tanaman anggrek untuk peningkatan perbanyakan tanaman.
lainnya yang memiliki kandungan vitamin tinggi dapat meningkatkan pertumbuhan dan diferensiasi sel pada tanaman tertentu. Penambahan bahan organik kompleks, merupakan salah satu cara untuk memperkaya nutrisi pada medium in vitro tanaman anggrek (Pramesyanti, 1999).
C. Air Leri
Air cucian beras merupakan salah satu limbah rumah tangga yang dihasilkan dari proses pencucian beras yang selama ini belum banyak dimanfaatkan. Padahal, air leri memiliki kandungan unsur hara makro dan mikro yang dapat dimanfaatkan untuk pertumbuhan tanaman. Hasil analisis kandungan air leri beras putih menurut Wulandari (2011) disajikan pada Tabel 1.
Tabel 1. Hasil Analisis Kandungan Air Leri Beras Putih
Kandungan Mineral Jumlah (%)
Nitrogen (N) 0,02
Fosfor (P) 16,31
Kalium (K) 0,02
Kalsium (Ca) 2,94
Magnesium (Mg) 14,25
Sulfur (S) 0,03
Besi (Fe) 0,04
Vitamin B1 0,04
kecil. Selain itu, Sulfur dalam metabolisme tanaman memiliki peran dalam sintesis protein dan bagian dari asam amino sistein, biotin dan thiamin (Wulandari, 2011).
Air leri berwarna putih susu, hal itu berarti bahwa protein dan vitamin B1 yang terdapat dalam beras juga ikut terkikis. Secara tidak langsung, air cucian beras mengandung protein dan vitamin B1. Vitamin B1 merupakan kelompok vitamin B yang mempunyai peranan di dalam metabolisme tanaman (Wulandari, 2011). Vitamin memiliki fungsi katalitik pada sistem enzim dan dibutuhkan dalam jumlah kecil. Satu-satunya vitamin yang dianggap esensial pada kultur in vitro adalah tiamin (Vitamin B1). Perlunya kehadiran tiamin pada kultur in vitro terutama pada kondisi kandungan sitokinin yang rendah (Sjahril, 2011).
Livi dkk. (2014) menyatakan bahwa penambahan air leri beras putih dan tanpa zat pengatur tumbuh dalam medium MS menghasilkan jumlah tunas terbaik pada anggrek Grammatophyllum speciosum. Sitokinin endogen anggrek Grammatophyllum speciosum sudah mampu memultiplikasi tunas karena
disintesis pada bagian tertentu meskipun dalam jumlah yang sedikit. Sementara air leri mengandung vitamin B1 sebagai pembentuk hormon auksin, yang apabila dikombinasikan dengan hormon sitokinan mampu menginduksi tunas.
(Wetherell, 1982). Golongan auksin yang ditambahkan pada medium penelitian ini adalah Naphtalene Acetic Acid (NAA) dan golongan sitokininnya adalah Benzyl Amino Purine (BAP). Hormon auksin dapat merangsang pembentukan
akar, sedangkan sitokinin dapat merangsang pembelahan sel dalam jaringan yang dibuat oleh eksplan serta merangsang pertumbuhan tunas daun (Wetherell, 1982).
D. Hipotesis
13
A.Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kultur In vitro Fakultas Pertanian Universitas Muhammadiyah Yogyakarta, pada Bulan November 2015 hingga Bulan April 2016.
B. Bahan dan Alat Penelitian
Bahan-bahan yang digunakan untuk penelitian ini adalah eksplan anggrek tebu (Grammatophyllum speciosum) dalam botol kultur berusia kurang lebih 12 bulan, MS (Murashige and Skoog), air leri, NAA, BAP, alkohol 70%, spirtus, betadine dan aquades. Sementara, alat-alat yang digunakan adalah timbangan
analitik, pH stik, timer, alumunium foil, karet, plastik, sprayer, kertas payung, label, dissecting kits, autoklaf, petridish, botol kultur, gelas ukur, erlenmeyer, pipet tetes, pinset, pengaduk kaca, Laminar Air Flow (LAF), bunsen, penggaris dan Munsell Color Chart.
C. Metode Penelitian
Semua perlakuan menggunakan medium ½ MS dan ditambahkan 0,1 mg/l NAA (Livi, dkk., 2014).
D. Cara Penelitian
Tahapan penelitian yang dilakukan meliputi persiapan alat dan bahan, pembuatan medium, inokulasi, inkubasi, pengamatan dan analisis.
a. Persiapan alat dan bahan
Persiapan alat dan bahan dilakukan dengan mempersiapkan alat-alat dan bahan-bahan yang digunakan. Persiapan alat meliputi sterilisasi alat menggunakan autoklaf pada suhu 1210C dengan tekanan 1 atm selama 30 menit. Sebelum dimasukkan ke autoklaf, alat-alat yang akan disterilisasi dibungkus terlebih dahulu dengan kertas payung. Persiapan bahan dilakukan dengan mempersiapkan eksplan dan bahan-bahan lainnya. Eksplan yang digunakan berupa tunas anggrek tebu dari penelitian Livi, dkk (2014).
b. Pembuatan medium - Penyiapan air leri
Untuk membuat air leri, beras dicuci dengan aquadest sesuai takaran yang telah ditentukan, yaitu 0,25 kg/l untuk konsentrasi 25% air leri, 0,50 kg/l untuk A = aquadest + 0,5 mg/l BAP
B = 25% air leri + 0,5 mg/l BAP C = 50% air leri + 0,5 mg/l BAP D = 75% air leri + 0,5 mg/l BAP E = 100% air leri + 0,5 mg/l BAP
50% air leri, 0,75 kg/l untuk 75% air leri dan 1 kg/l untuk 100% air leri. Selanjutnya air leri disaring dengan keras saring menggunakan corong yang diletakkan di atas gelas ukur atau erlenmeyer. Setelah didapatkan air leri, selanjutnya dilakukan pembuatan larutan medium.
- Pembuatan medium perlakuan
Pembuatan medium dilakukan menggunakan medium ½ MS dengan air leri sebagai pelarutnya pada berbagai macam konsentrasi. Bahan-bahan yang telah disiapkan kemudian ditimbang sesuai dengan kebutuhan medium. Untuk membuat 200 ml medium ½ MS takaran yang digunakan adalah sebagai berikut: MS 0,4 g, stok mikro 2 ml (10 ml/l), Fe 2 ml (10 ml/l), vitamin MS 2 ml (10 ml/l), mio inositol 0,02 g, ppm 0,04 ml, sukrosa 6 g dan gellan gum 0,8 g. Bagan pembuatan terlampir pada lampiran 2.
MS, sukrosa, Fe, vitamin MS dan mio inositol dimasukkan ke erlenmeyer steril. Kemudian air leri dimasukkan ke erlenmeyer tersebut sesuai konsentrasi yang ditentukan dan dihomogenkan dengan menggoyangkan erlenmeyer tersebut. Selanjutnya pH diukur dengan pH stik, jika pH < 6 maka ditambahkan NaOH 1 N beberapa tetes dan jika pH > 6 maka ditambahkan HCl 1 N beberapa tetes. Gellan gum dimasukkan dengan menggoyangkan erlenmeyer dan diaduk supaya homogen. Selanjutnya, larutan tersebut dipanaskan hingga mendidih di dalam microwave. Sebelum dituang ke botol, medium ditambahkan PPM dan diaduk
menghambat kontaminasi dari udara, air dan kontak manusia, ppm juga dapat digunakan untuk mengurangi kontamiansi endogen. Larutan dituang ke botol sebanyak 20 ml tiap botol kemudian ditutup dengan plastik dan diikat dengan karet. Selanjutnya disterilkan dengan autoklaf pada suhu 121 0C dan tekanan 1 atm selama 20 menit. Setelah itu, medium disimpan di ruang inkubasi.
c. Inokulasi
1. Inokulasi untuk homogenisasi eksplan
Eksplan tunas anggrek tebu yang telah disiapkan kemudian dihomogenkan dengan cara ditanam pada medium MS0. Hal ini dilakukan supaya eksplan anggrek tidak terpengaruh oleh bahan-bahan dari medium sebelumnya dan diharapkan hanya dipengaruhi oleh medium yang diujikan. Inokulasi untuk homogenisasi dilakukan pada awal penelitian, kemudian setelah eksplan tumbuh di medium MS0 dilakukan inokulasi tahap kedua untuk multiplikasi eksplan di medium perlakuan.
2. Inokulasi untuk multiplikasi eksplan
d. Inkubasi
Botol kultur yang telah ditanami kemudian diletakkan di rak inkubasi dan diatur sesuai rancangan perlakuan yang ada. Suhu ruang inkubasi kultur antara 24-27 0C dan kelembaban berkisar 70% serta intensitas cahaya 1000 lux selama 24 jam setiap harinya (Zulkarnain, 2009).
E. Parameter yang Diamati
Parameter yang diamati untuk mengetahui pengaruh penambahan air leri terhadap multiplikasi eksplan anggrek tebu, yaitu:
a. Persentase eksplan hidup (%)
Persentase eksplan hidup dihitung setelah selesai pengamatan. Perhitungan dilakukan dengan melihat jumlah eksplan yang hidup pada hari terakhir pengamatan dan dinyatakan dalam persen untuk melihat tingkat adaptasi dari eksplan terhadap medium yang diberikan, dengan rumus: Persentase eksplan hidup = Jumlah eksplan hidup x 100%
Jumlah total eksplan tiap perlakuan b. Persentase eksplan kontaminasi (%)
Persentase eksplan kontaminasi dilakukan dengan mengamati medium atau eksplan yang terkontaminasi dan diamati setiap hari berdasarkan penyebab kontaminasi baik berupa jamur ataupun bakteri dan dinyatakan dalam persen, dengan menggunakan rumus:
Persentase eksplan kontaminasi = Jumlah eksplan kontaminasi x 100%
c. Persentase eksplan browning (%)
Persentase eksplan dihitung setelah selesai pengamatan. Perhitungan dilakukan dengan melihat jumlah eksplan yang mengalami pencoklatan pada bagian eksplan hingga mencakup 50% dari bagian eksplan selama pengamatan per minggu dan dinyatakan dengan persen untuk melihat pengaruh dari medium terhadap eksplan yang diinokulasi.
Persentase eksplan Browning = Jumlah eksplan browning x 100% Jumlah total eksplan tiap perlakuan
d. Persentase eksplan bertunas (%)
Persentase eksplan bertunas dihitung setelah selesai pengamatan. Perhitungan dilakukan dengan melihat pertambahan tunas baru pada eksplan dan dinyatakan dalam persen untuk mengetahui pengaruh medium terhadap pertumbuhan tunas baru pada eksplan, dengan rumus:
Persentase eksplan bertunas = Jumlah eksplan bertunas x 100% Jumlah total eksplan tiap perlakuan
e. Tinggi tunas
Tinggi tunas diukur setiap minggu untuk seluruh eksplan menggunakan penggaris dengan satuan centimeter (cm). Hal ini dilakukan untuk melihat pengaruh dari medium terhadap pertambahan tinggi tunas. f. Jumlah tunas
g. Persentase eksplan berakar (%)
Persentase eksplan berakar dihitung setelah selesai pengamatan. Perhitungan dilakukan dengan melihat jumlah eksplan yang berakar pada hari terakhir pengamatan dan dinyatakan dalam persen, dengan rumus: Persentase eksplan berakar = Jumlah eksplan berakar x 100% Jumlah total eksplan tiap perlakuan
h. Jumlah akar
Pengamatan dilakukan dengan cara menghitung jumlah akar baru per minggu, dari awal penanaman hingga minggu ke-8 setelah tanam untuk melihat pengaruh medium terhadap pertumbuhan dan perkembangan akar.
F. Analisis Data
20
Air leri merupakan bahan organik dengan kandungan fosfor, magnesium dan vitamin B1 yang efektif bila dimanfaatkan sebagai bahan tambahan pada proses perbanyakan tanaman secara in vitro. Pada penelitian ini, air leri digunakan untuk menambahkan nutrisi pada medium ½ MS pada multiplikasi anggrek tebu. Berdasarkan penelitian yang telah dilakukan, eksplan anggrek tebu secara umum menunjukkan adanya respon pertumbuhan pada saat minggu kedua dengan adanya pertambahan pada tinggi eksplan. Selain itu, ada pula respon dari eksplan anggrek tebu saat minggu ke-4 dengan munculnya tunas pada eksplan.
A. Persentase Eksplan Hidup, Browning dan Kontaminasi (%)
Tabel 2. Pengaruh Konsentrasi Air Leri dan BAP terhadap Persentase Eksplan Hidup, Browning dan Kontaminasi Anggrek Tebu pada Minggu ke-8.
Perlakuan
Persentase eksplan hidup merupakan kemampuan eskplan untuk hidup dan tumbuh dalam medium perlakuan. Kemampuan hidup eksplan pada kultur in vitro sangat tergantung dari eksplan itu sendiri, jenis dan komposisi medium, serta kandungan zat pengatur tumbuh yang diberikan (Miryam dkk., 2008). Semakin tinggi persentase eksplan hidup maka keberhasilan dari kultur in vitro itu sendiri semakin tinggi. Eksplan hidup diamati dengan melihat eksplan yang tidak mengalami kontaminasi baik berupa bakteri maupun jamur serta eksplan yang tidak mengalami browning atau pencoklatan.
eksplan hidup sebesar 90%, sedangkan pada perlakuan 25% air leri + 1 mg/l BAP menunjukkan persentase eksplan hidup yaitu 80%. Secara umum persentase eksplan hidup anggrek tebu cukup tinggi. Tingginya persentase eksplan hidup menunjukkan bahwa pada perlakuan tersebut eksplan tidak mengalami kontaminasi dan browning. Hal ini dikarenakan eksplan merupakan eksplan steril dari subkultur penelitian Livi, dkk. (2014). Selain itu, medium yang digunakan memiliki komposisi yang cocok sehingga eksplan dapat beradaptasi dan tidak mengalami browning (Rahman, 2013). Eksplan hidup pada penelitian ini disajikan pada Gambar 2.
Gambar 2. Eksplan Hidup Anggrek Tebu pada 8 Minggu Setelah Tanam.
2. Persentase Eksplan Kontaminasi (%)
Persentase eksplan kontaminasi menunjukkan tingkat kontaminasi yang terjadi pada seluruh eksplan yang ditanam. Menurut Gunawan (1987) dalam Hartati (2013) kontaminasi merupakan faktor pembatas dalam keberhasilan kultur in vitro yang dapat berasal dari bahan tanaman baik eksternal maupun internal,
terkontaminasi oleh bakteri atau jamur maka pertumbuhan eksplan akan
terhambat bahkan dapat menyebabkan kematian. Zulkarnain (2009)
menambahkan kontaminasi kadang dapat ditemukan setelah beberapa generasi
pada kultur yang steril. Hal tersebut diduga disebabkan oleh agen kontaminan
yang telah bertahan di dalam jaringan sampai kondisi yang menguntungkan untuk
pertumbuhannya. Selain itu, kontaminasi juga dapat terjadi selama proses
subkultur atau dapat pula masuk melalui tutup wadah.
Berdasarkan Tabel 2, persentase eksplan kontaminasi terendah yaitu pada
perlakuan aquadest + 0,5 mg/l BAP, 50% air leri + 0,5 mg/l BAP, 50% air leri +
1 mg/l BAP dan 75% air leri + 1 mg/l BAP dengan persentase 0% eksplan kontaminasi. Persentase eksplan kontaminasi tertinggi yaitu pada perlakuan 25% air leri + 1 mg/l BAP dengan persentase 20% eksplan yang terkontaminasi. Hasil pengamatan menunjukkan bahwa kontaminasi secara umum disebabkan oleh bakteri berwarna merah muda yang menyerang bagian eksplan dan medium. Menurut Anis dan Oetami (2010), eksudat lendir yang berwarna merah merupakan gejala kontaminasi dari bakteri internal yang biasanya terdapat pada tepi bekas potongan eksplan. Beberapa saat kemudian eksudat menyebar ke seluruh bagian eksplan dan menyebabkan eksplan mengalami kematian.
(a) (b)
adalah tumbuhnya hifa-hifa jamur pada permukaan medium maupun eksplan setelah inokulasi. Hifa-hifa yang terbentuk berwarna putih yang selanjutnya dalam kurun waktu tertentu berubah menjadi berwarna coklat dan hitam. Ketika jamur tumbuh pada medium atau eksplan maka pertumbuhan eksplan akan terhambat bahkan dapat menyebabkan kematian pada eksplan.
Pada penelitian ini, seluruh medium perlakuan ditambahkan PPM (Plant Preservative Mixture) yang dapat menghambat pertumbuhan patogen sehingga
kontaminasi dipastikan bukan berasal dari medium yang digunakan. PPM merupakan biosida spektrum luas yang sangat efektif untuk mencegah atau menurunkan tingkat kontaminasi mikroba pada kultur in vitro (Syatria, 2010). Eksplan yang terkontaminasi disajikan pada Gambar 3.
Gambar 3. (a) Eksplan Terkontaminasi Bakteri pada 4 MST (B) Eksplan Terkontaminasi Jamur pada 1 MST.
3. Persentase Eksplan Browning (%)
Luka pada jaringan tanaman memacu stres dan menyebabkan peningkatan aktivitas Fenilalanin amonia liase (PAL) yang diikuti oleh aktivitas enzim oksidase (PPO) dan menyebabkan pencoklatan (Tabiyeh et.al. 2006 dalam Hutami, 2008). Hal ini juga didukung oleh penelitian Hutami (2008) yang menyatakan bahwa perubahan warna menjadi coklat (browning) dalam kultur in vitro terjadi karena akumulasi senyawa fenolik yang dilepas atau disintesis
jaringan dan mengalami oksidasi ketika sel dilukai.
Berdasarkan Tabel 2, dapat diketahui bahwa eksplan pada perlakuan aquadest + 0,5 mg/l BAP, 25% air leri + 0,5 mg/l BAP, 50% air leri + 0,5 mg/l BAP, 75% air leri + 0,5 mg/l BAP, 100% air leri + 0,5 mg/l BAP, aquadest + 1 mg/l BAP, 25% air leri + 1 mg/l BAP, 75% air leri + 1 mg/l BAP dan 100% air leri + 1 mg/l BAP tidak mengalami browning yang mengakibatkan kematian. Hal ini menujukkan bahwa eksplan dapat beradaptasi dengan baik pada medium yang diberikan. Menurut Miryam dkk. (2008) kemampuan hidup eksplan bergantung pada eksplan yang digunakan, jenis dan komposisi medium serta kandungan zat pengatur tumbuh yang diberikan. Oleh karenanya, medium yang sesuai pada eksplan membuat eksplan mudah untuk beradaptasi dan tumbuh dengan baik.
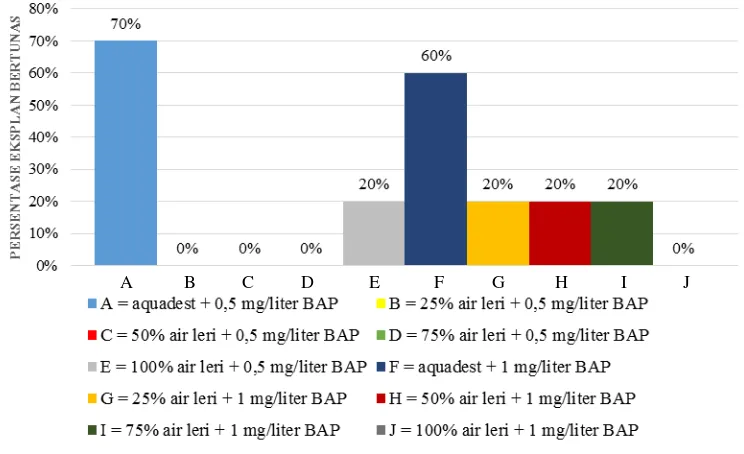
B. Persentase Eksplan Bertunas (%)
Persentase eksplan bertunas merupakan jumlah eksplan yang mampu menumbuhkan tunas pada tiap perlakuan dan dinyatakan dalam satuan persen. Semakin tinggi persentase eksplan bertunas maka semakin tinggi pula eksplan mampu melakukan regenerasi. Keberhasilan eksplan dalam melakukan regenerasi dipengaruhi oleh kombinasi auksin dan sitokinin yang dapat memperbaiki efisiensi regenerasi eksplan, tergantung pada konsentrasi yang ditambahkan. Hasil pengamatan persentase eksplan bertunas, pertambahan tinggi tunas dan pertambahan jumlah tunas disajikan pada Tabel 3.
Tabel 3. Pengaruh Konsentrasi Air Leri dan BAP terhadap Persentase Eksplan Bertunas, Tinggi Tunas dan Jumlah Tunas Anggrek Tebu Minggu ke-8.
Perlakuan menunjukkan tidak ada pengaruh yang berbeda nyata menurut analisis DMRT pada taraf α=5%.
jika dibandingkan dengan perlakuan yang dikombinasikan dengan air leri (0-20%). Hal ini dikarenakan kandungan fosfor yang cukup tinggi dan juga nitrogen pada media mengarah pada pembentukan dan perkembangan akar. Kandungan nitrogen memacu perakaran lebih dalam dan lebih banyak karena adanya peningkatan hasil asimilasi untuk pertumbuhan akar. Sementara, kandungan fosfor juga meningkatkan fotosintesis yang selanjutnya meningkatkan pertumbuhan akar (Zulkarnain, 2009). Selain itu, ada pula kandungan sulfur pada air leri yang memacu sintesis thiamin (vitamin B1) yang berfungsi untuk mempercepat pembelahan sel pada meristem akar. Oleh sebab itu, perlakuan medium yang diberi air leri cenderung memiliki persentase eksplan bertunas yang lebih rendah baik pada penambahan 0,5 mg/l maupun 1 mg/l BAP.
Gambar 4. Pengaruh Konsentrasi Air Leri dan BAP terhadap Persentase Eksplan Bertunas Anggrek Tebu.
C. Pertambahan Tinggi Tunas
Pertambahan tinggi tunas terjadi karena adanya penambahan jumlah sel atau pemanjangan sel yang dipengaruhi oleh unsur hara maupun ZPT. Tinggi tunas digunakan sebagai indikator pertumbuhan suatu tanaman yang penting untuk diamati karena menggambarkan seberapa besar pengaruh perlakuan konsentrasi air leri dan BAP terhadap tinggi eksplan. Pengamatan terhadap tinggi tunas dilakukan setiap minggu dan diukur dari pangkal tunas sampai titik tumbuh. Berdasarkan data dari Tabel 3 yang sudah dicantumkan sebelumnya dan hasil sidik ragam pada Lampiran V, konsentrasi air leri dan BAP tidak berpengaruh nyata terhadap tinggi tunas anggrek tebu. Artinya, baik medium yang diberi air leri maupun hanya menggunakan aquadest memberikan pengaruh yang sama terhadap tinggi tunas. Namun, secara umum bila dilihat dari rata-rata tinggi tunas, pada medium yang ditambahkan 1 mg/l BAP tinggi tunas menunjukkan nilai yang cenderung lebih tinggi dibandingkan pada medium yang ditambahkan 0,5 mg/l BAP. Hal ini dikarenakan BAP yang merupakan hormon sitokinin lebih kepada memacu pembelahan sel dan belum menyebabkan penambahan tinggi. Sementara, NAA yang merupakan hormon auksin untuk pemanjangan sel diberikan pada seluruh perlakuan dengan konsentrasi yang sama yaitu 0,5 mg/l sehingga tidak menunjukkan perbedaan yang nyata terhadap tinggi tunas
konsentrasi yang tinggi ataupun rendah, karena kandungan sitokinin endogen sudah mencukupi. Akibatnya penambahan sitokinin eksogen tidak lagi berpengaruh bahkan dapat menghambat pertumbuhan.
Gambar 5. Tinggi Eksplan Anggrek Tebu pada 8 Minggu Setelah Tanam.
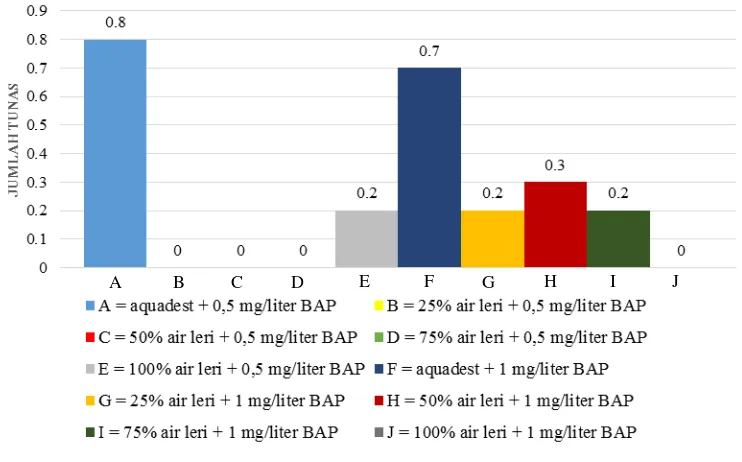
D. Pertambahan Jumlah Tunas
Pertambahan jumlah tunas merupakan faktor yang penting dalam mengetahui kemampuan eksplan untuk mendiferensiasi selnya. Perhitungan pertambahan jumlah tunas dilakukan pada keseluruhan tunas di tiap perlakuan yang muncul pada eksplan baik tunas yang berasal dari pemanjangan mata tunas maupun tunas adventif. Di antara berbagai zat pengatur tumbuh sitokinin sintetik, BAP paling sering digunakan karena sangat efektif menginduksi pembentukan daun dan penggandaan tunas, mudah didapat dan harganya relatif murah (George dan Sherrington, 1984 dalam Laela, 2005).
tunas. Artinya, perlakuan medium yang diberi air leri memberikan pengaruh yang berbeda dengan medium yang hanya diberi aquadest terhadap pertambahan jumlah tunas. Perlakuan medium yang diberi air leri rata-rata mengalami pertambahan jumlah tunas yang sangat sedikit dibandingkan dengan perlakuan medium yang hanya diberi aquadest. Rata-rata jumlah tunas eksplan anggrek tebu pada berbagai konsentrasi air leri dan BAP disajikan pada gambar berikut.
Gambar 6. Pengaruh Konsentrasi Air Leri dan BAP terhadap Jumlah Tunas Anggrek Tebu
Gambar 6 menunjukkan bahwa pertambahan jumlah tunas tertinggi diperoleh pada perlakuan aquadest + 0,5 mg/l BAP dan aquadest + 1 mg/l BAP. Sementara pada perlakuan yang diberi air leri hanya memiliki pertambahan jumlah tunas yang sangat sedikit. Hal ini dikarenakan air leri memiliki kandungan fosfor yang cukup tinggi sehingga tingkat pembelahan sel pada eksplan tinggi, namun pembelahan sel terjadi pada akar eksplan karena adanya kandungan sulfur pada medium yang memacu sintesis thiamin (vitamin B1) yang berfungsi untuk
(a) (b) (c)
memacu pertumbuhan dan perkembangan akar. Hal ini ditunjukkan oleh akar pada eksplan yang diberi air leri pertumbuhan dan perkembangannya lebih baik.
Selain itu, pada Gambar 6 dapat dilihat pula bahwa eksplan dengan perlakuan penambahan 1 mg/l BAP memiliki rata-rata pertambahan jumlah tunas yang lebih baik dibandingkan dengan perlakuan penambahan 0,5 mg/l BAP meskipun belum berbeda nyata. BAP merupakan hormon sitokinin yang berfungsi untuk merangsang pembelahan sel. Pemberian BAP yang tinggi memacu pula tingginya pembelahan sel pada tunas. Menurut George dan Sherrington (1984) dalam Nursetiadi (2008) konsentrasi sitokinin yang lebih tinggi dibandingkan dengan konsentrasi auksin akan memacu multiplikasi tunas.
Gambar 7. Eksplan Anggrek Tebu Bertunas pada 8 MST (a) aquadest + 1 mg/l BAP, (b) 50% air leri + 1 mg/l BAP, (c) 25% air leri + 1 mg/l BAP.
E. Pertambahan Jumlah Daun
Tabel 4. Pengaruh Konsentrasi Air Leri dan BAP terhadap Jumlah Daun, menunjukkan tidak ada pengaruh yang berbeda nyata menurut analisis DMRT pada taraf α=5%.
Selain itu, perlakuan penambahan 1 mg/l BAP memiliki nilai pertambahan jumlah daun yang cenderung lebih tinggi dibandingkan dengan perlakuan penambahan 0,5 mg/l BAP. Hal ini dikarenakan dengan penambahan BAP pada media dapat mendorong sel–sel meristem pada eksplan untuk membelah dan mempengaruhi sel lainnya untuk berkembang membentuk daun. Meskipun pada konsentrasi 0,5 mg/l terdapat rata-rata jumlah daun yang tidak berbeda nyata namun pada konsentrasi 1 mg/l rata-rata jumlah daun pada tiap perlakuan lebih banyak. Hal ini diduga dengan pemberian 1 mg/l BAP telah mampu merangsang pertumbuhan daun tanpa mengesampingkan kandungan hara yang terkandung dalam setiap media perlakuan.
F. Persentase Eksplan Berakar (%)
Persentase eksplan berakar merupakan jumlah eksplan yang mampu menumbuhkan akar pada tiap perlakuan dan dinyatakan dalam satuan persen. Semakin tinggi persentase eksplan berakar maka penyerapan unsur hara pada eksplan anggrek tebu akan semakin efektif.
(a) (b) (c)
juga memacu sintesis thiamin (vitamin B1) yang diberfungsi untuk memacu pertumbuhan dan perkembangan akar.
Selain itu, banyaknya akar yang terbentuk pada perlakuan tersebut diduga karena konsentrasi auksin dalam bentuk NAA pada medium lebih rendah dibandingkan konsentrasi sitokinin yang terdapat pada medium, sehingga menyebabkan pemunculan akar lebih cepat. Wightman et al (1980) menyatakan bahwa pemberian auksin pada medium dapat mempercepat pembentukan akar dan mempengaruhi pemanjangan akar juka digunakan dalam konsentrasi yang rendah.
Perlakuan 50% air leri + 1 mg/l BAP menunjukkan persentase terendah yaitu 40% eksplan berakar. Pertumbuhan akar terhambat diduga karena sitokinin dalam bentuk BAP diberikan pada konsentrasi yang lebih tinggi. Menurut Lakitan (1996), akar terbentuk apabila ada auksin yang dikombinasikan dengan sitokinin pada konsentrasi yang rendah. Sitokinin diberikan dalam konsentasi rendah karena apabila diberikan dalam konsentrasi yang tinggi dapat menghambat pertumbuhan akar.
G. Jumlah Akar
Jumlah akar merupakan faktor yang penting dalam mengetahui kemampuan eksplan untuk menyerap nutrisi pada medium kultur. Semakin banyak jumlah akar dapat mengoptimalkan penyerapan nutrisi pada medium. Fungsi lain akar yang juga berperan penting dalam pertumbuhan eksplan adalah sebagai pengangkut. Perhitungan jumlah akar dilakukan pada keseluruhan eksplan di tiap perlakuan yang sudah terlihat adanya pertumbuhan akar.
(a) (b) (c)
Perlakuan aquadest + 0,5 mg/l BAP menunjukkan nilai terbaik untuk jumlah akar yaitu sebesar 1,70 akar namun, nilai tersebut tidak berbeda nyata dengan perlakuan aquadest + 1 mg/l BAP dan 25% air leri + 1 mg/l BAP yaitu sebesar 1,30 akar. Meskipun jumlah akar cenderung sedikit pada perlakuan pemberian air leri dibandingkan aquadest, namun perlakuan pemberian air leri dan cenderung menghasilkan akar yang lebih panjang. Hal ini dikarenakan kandungan fosfor untuk pembelahan sel dilakukan untuk pemanjangan akar eksplan. Selain itu, hormon auksin yang diberi dalam jumlah sedikit juga dimanfaatkan untuk pemanjangan sel akar sehingga akar lebih panjang namun jumlahnya lebih sedikit.
Gambar 9. Akar Eksplan Anggrek Tebu pada 22 MST (a) aquadest + 1 mg/l BAP, (b) 25% air leri + 0,5 mg/l BAP, (c) 25% air leri + 1 mg/l BAP
B1 mengandung tiamin yang berfungsi untuk mempercepat pembelahan sel pada meristem akar (Sudarmiyatun, 2012). Oleh karenanya, pembelahan sel cenderung terjadi pada ujung akar untuk pemanjangan akar.
38 A. Kesimpulan
1. Penggunaan air leri dan BAP dengan berbagai konsentrasi mampu memultiplikasi potongan tunas anggrek tebu dan berpengaruh terhadap pertumbuhan dan panjang akar anggrek tebu.
2. Penggunaan 75% air leri + 1 mg/l BAP pada medium ½ MS merupakan konsentrasi terbaik untuk multiplikasi anggrek tebu.
B. Saran
39 DAFTAR PUSTAKA
Acima. 2006. Pengaruh jenis medium dan konsentrasi BAP terhadap multiplikasi adenium (Adenium obesum) secara in Vitro. Skripsi S1 Fakultas
Pertanian UNS. Surakarta.
Anis S. dan Oetami D.H. 2010. Pengaruh Sterilan dan Waktu Perendaman pada Eksplan Daun Kencur (Kaemferia galanga L) untuk Meningkatkan Keberhasilan Kultur Kalus. Fakultas Pertanian. Universitas
Muhammadiyah Purwokerto.
Anonim. 2010. Peluang Pemanfaatan Air Limbah Cucian Beras Sebagai Pupuk Organik. http://selaputs.blogspot.com/2010/12/peluang-pemanfaatan-air-limbah-cucian.html., diakses Juni 2014.
Campbell, Neil A., Jane B. Reece, dan Lawrence G. Mitchell. 2003. Biologi Edisi Kelima-Jilid 2. Erlangga. Jakarta.
Farah R. L., Evie R. dan Rahmad W. 2013. Pengaruh 6-benzylamino purine (BAP) dan 6-furfuryl amino purine (Kinetin) pada Medium MS terhadap Pertumbuhan Eksplan Ujung Apikal Tanaman Jati secara In Vitro. Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Negeri Surabaya.
Gunawan, L.W. 1987. Teknik Kultur Jaringan Tumbuhan. Pusat Antar Universitas (PAU), Bioteknologi, IPB. Bogor.
Hartati, Yunita. 2013. Produksi Tunas Tumbuhan Kebiul Eksplan Asal Embrio pada Berbagai Komposisi Hormon secara In Vitro dan Implementasinya sebagai Bahan Life Skill pada Pembelajaran Biologi. Tesis. Universitas Bengkulu.
Hutami S. 2008. Masalah Pencoklatan pada Kultur Jaringan. Jurnal AgroBiogen 4(2):83-88.
Iswanto, H. 2001. Anggrek Phalaenopsis. Agro Medium Pustaka. Jakarta.
Katuuk, J.R.P. 1989. Teknik Kultur Jaringan dalam Mikropropagasi Tanaman. Departemen P&K. Jakarta.
Lakitan, B. 1996. Fisiologi Pertumbuhan dan Perkembangan Tanaman. PT Raja Grafindo Persada. Jakarta.
Livi Takliviyah., dkk. 2014. Evektivitas Numeri “Nutrisi Alami Air Leri” sebagai Pengganti Nutrisi Sintetis pada Anggrek Grammatophyllum speciosum secara In Vitro. Laporan Program Kreativitas Mahasiswa Fakultas Pertanian Universitas Muhammadiyah Yogayakarta. Yogyakarta. Miryam, A, I. Suliansyah, dan A. Djamaran. 2008. Multiplikasi Jeruk Kacang
(Citrus nobilis L.) pada Beberapa Konsentrasi NAA dan BAP pada Medium WPM secara In Vitro. Jerami.1(2): 1-8.
Nurhasanah, E. 2009. Perbanyakan Anggrek Grammatophylum scriptum Melalui Proliferasi Tunas Adventif Secara In Vitro. Program Studi Hortikultura, Fakultas Pertanian IPB. Bogor.
Nursetiadi, Eka. 2008. Kajian Macam Medium Dan Konsentrasi BAP terhadap Multiplikasi Tanaman Manggis (Garcinia Mangostana L.) secara In Vitro. Fakultas Pertanian. Universitas Sebelas Maret. Surakarta.
Peraturan Pemerintah. 1999. Jenis-jenis Tumbuhan dan Satwa yang Dilindungi. Lampiran Peraturan Pemerintah Republik Indonesia Nomor 7 Tahun 1999 Tanggal 27 Januari 1999.
Perhimpunan Anggrek Indonesia Cabang Batu. 2005. Budidaya Tanaman Anggrek. http://anggrek.org/budidaya-tanaman-anggrek.html/3., diakses Mei 2015.
Plantamor. 2012. Informasi Spesies Anggrek Tebu. http://www.plantamor.com/. Diakses September 2016
Pramesyanti, A. 1999. Pengaruh Bubur Buah Beberapa Kutivar Pisang terhadap Pertumbuhan Vegetatif Plantlet Dendrobium Kamiya’s Pride x Dendrobium Rulita Beauty pada Medium Vacin dan Went Modifikasi. Skripsi FMIPA. Jurusan Biologi. Universitas Indonesia. Jakarta.
Pusat Data dan Sistem Informasi Pertanian. 2013. Buletin Bulanan Indikator Makro Sektor Pertanian. Kementrian Pertanian RI. Volume 8, Nomor 3. Puspita, Y. 2011. Mikropropagasi Tanaman Anggrek Tebu (Grammatophyllum speciosum Bl.) Secara In Vitro Dari Sumber Eksplan Tunas Pucuk Pada Medium MS (Murashige-Skoog) Dengan Penambahan Madu. Jurusan Biologi FMIPA Universitas Mulawarman. Volume 10, Nomor 1.
Rimando, Tito J. 2001. Ornamental Horticulture A Little Giant in The Tropics. SEAMO SEARCA and UPLB. Philipines. 99p.
Santoso, U. dan F. Nursandi. 2004. Kultur Jaringan Tanaman. Universitas Muhammadiyah Malang Press. Malang.
Sjahril, Rinaldi. 2011. Bahan Ajar Mata Kuliah: Pembiakan In Vitro. Program Studi Agroteknologi. Fakultas Pertanian. Universitas Hasanuddin. Makassar.
Sudarmiyatun, Sri. 2012. Budidaya Tanaman Hias. Balai Pustaka. Jakarta.
Syatria N. 2010. Plant Preservative Mixture (PPM) bahan kimia pengurang Kontaminasi Mikroba. http://tissuecultureandorchidologi.blogspot.com /2010/04/plant-preservative-mixtur-ppm.html., diakses Mei 2016. Wattimena, G.A. 1992. Zat pengatur tumbuh tanaman. PAU Bioteknologi. IPB.
Bogor.
Wetherell, D.F. 1982. Pengantar Propagasi Secara In Vitro Kultur Jaringan Tanaman, Edisi Indonesia. IKIP Semarang Press. Semarang.
Wetter, L.R. dan F. Constebel. 1982. Plant Tissue Culture Methods. Diterjemahkan oleh Widianto, Mathilda. 1991. Metode Kultur Jaringan Tanaman, edisi kedua. Penerbit: ITB. Bandung.
Widiastoety dan Santi. 1996. Pembibitan dan Budidaya Anggrek. Balai Penelitian Tanaman Hias. Jakarta.
Wulandari, C.G.M, Sri, M dan Sri, T. 2011. Pengaruh Air Cucian Beras Merah dan Beras Putih Terhadap Pertumbuhan dan Hasil Selada (Lactuca sativa L.). Fakultas Pertanian UGM. Yogyakarta.
Yuanita Wijayani, Solichatun dan Widya Mudyantini.2004. Pertumbuhan Tunas dan Struktur Anatomi Protocorm Like Body Anggrek Grammatophyllum scriptum (Lindl.) Bl. dengan Pemberian Kinetin dan NAA. Fakultas Matematika dan Ilmu Pengetahuan Alam UNS. Surakarta.
Yusnita. 2004. Kultur Jaringan Cara Memperbanyak Tanaman secara Efisien. Agro Medium Pustaka. Jakarta.
LAMPIRAN
Lampiran I. Komposisi Medium Murashige and Skoog (MS)
Lampiran III. Bagan Pembuatan Medium
Stok diambil sesuai kebutuhan
Dimasukkan ke Erlenmeyer
BAP dan NAA dimasukkan sesuai kebutuhan
Sukrosa ditambahkan
Air leri/aquadest dimasukkan 190 ml
Cek pH
Air leri/aquadest dimasukkan kembali hingga mencapai 200 ml
Agar dimasukkan dan dihomogenkan
Direbus hingga mendidih
Dimasukkan ke botol dan ditutup dengan plastik dan karet
Sterilisasi 20 menit
J11 H52 B22 C22
Lampiran IV. Lay Out Penelitian
Lampiran V. Hasil Sidik Ragam a. Tabel Sidik Ragam Tinggi Tunas
Sumber Varian db JK KT F Hitung Pr>F
Model 9 1,332101 0,14801122 1,64 0,1167 ns
Galat 90 8,138790
Total 99 9,470891
Keterangan: ns : perlakuan tidak memberikan pengaruh berbeda secara signifikan pada taraf α=5%.
b. Tabel Sidik Ragam Jumlah Tunas
Sumber Varian db JK KT F Hitung Pr>F
Model 9 1,826649 0,202961 4,89 < 0,0001 s
Galat 90 3,735810 0,041509
Total 99 5,562459
Keterangan: s : perlakuan memberikan pengaruh berbeda secara signifikan pada taraf α=5%.
c. Tabel Sidik Ragam Jumlah Daun
Sumber Varian db JK KT F Hitung Pr>F
Model 9 3,9336760 0,43707511 2,23 0,0267 s
Galat 90 17,614100 0,19571222
Total 99 21,547776
Keterangan: s : perlakuan memberikan pengaruh berbeda secara signifikan pada taraf α=5%.
d. Tabel Sidik Ragam Jumlah Akar
Sumber Varian db JK KT F Hitung Pr>F
Model 9 2,0781040 0,23090044 2,40 0,0172 s
Galat 90 8,6448600 0,09605400
Total 99 10,722964
47 Lampiran VI. Hasil Analisis Data Pengamatan Seluruh Perlakuan
1
MULTIPLIKASI ANGGREK TEBU (Grammatophyllum speciosum)
SECARA IN VITRO
Siti Safitri Nafiah, Innaka Ageng Rineksane dan Sukuriyati Susilo Dewi Program Studi Agroteknologi Fakultas Pertanian UMY
ABSTRACT
Grammatophyllum speciosum is the largest orchid ever. This plant grow as an epiphyte plant on the trees in the forest. The natural breeding Grammatophyllum speciosum are very slow and become rare. Therefore, the techniques that can reproduce the orchid buds in a short time, with significant amounts and no disease is needed to be done. The purpose of this research was to determine the effect and the best concentration of rice extract and BAP for the multiplication of Grammatophyllum speciosum buds. The research was conducted in the In Vitro Laboratory, Faculty of Agriculture, Universitas Muhammadiyah Yogyakarta from November 2015 to April 2016.
The research used a single factor which arranged in Completely Randomized Design (CRD). The treatments consist of aquadest + 0,5 mg/l BAP, 25% rice extract + 0,5 mg/l BAP, 50% rice extract + 0,5 mg/l BAP, 75% rice extract + 0,5 mg/l BAP,
Keyword : White Rice, BAP, Grammatophyllum speciosum.
PENDAHULUAN
Indonesia memiliki kondisi yang memenuhi persyaratan bagi pertumbuhan berbagai macam tanaman hias. Pengembangan komoditi tanaman hias dilakukan atas berbagai pertimbangan yang mengacu pada tersedianya pangsa pasar, keuntungan kompetitif dan nilai ekonomi. Hal tersebut ditunjukkan dengan perkembangan pasar yang semakin meluas dengan peningkatan permintaan di dalam maupun di luar negeri. Salah satu komoditas tanaman hias yang prospektif untuk dikembangkan secara nasional yaitu anggrek. Berdasarkan data BPS yang diolah Pusat Data dan Informasi Pertanian (2013), volume ekspor tanaman hias di Indonesia masih didominasi oleh tanaman anggrek yaitu sebesar 58.656 ton, baik itu berupa bibit maupun tanaman.
bintik-2
bintik cokelat yang terlihat kontras dengan warna dasar bunga yaitu warna kuning. Selain itu, bunga anggrek ini mampu bertahan lama dan tidak mudah layu.
Perbanyakan vegetatif biasanya dilakukan melalui pemecahan atau pemisahan rumpun anggrek yang kemudian ditanam ke media yang sama seperti induknya. Namun, perbanyakan konvensional secara vegetatif ini tidak praktis dan jumlah anakan yang diperoleh sangat terbatas. Demikian pula dengan perbanyakan konvensional secara generatif menggunakan biji. Biji anggrek berukuran sangat kecil dan tidak memiliki endosperm (cadangan makanan), sehingga akan menyulitkan proses perkecambahan di alam. Oleh sebab itu, dibutuhkan alternatif lain yaitu teknik kultur in vitro.
Keberhasilan perbanyakan anggrek secara kultur in vitro salah satunya didukung oleh medium yang digunakan. Medium yang sering digunakan adalah MS (Murashige and Skoog) yang mempunyai kandungan nitrat, kalium dan ammonium tinggi. Sjahril dkk. (2011) juga menyatakan bahwa medium kultur tidak hanya mengandung unsur hara makro dan mikro, tetapi juga vitamin atau bahan organik lainnya namun, biaya yang dibutuhkan untuk menggunakan medium MS ini terbilang cukup mahal karena unsur-unsur murni yang ada di dalamnya tersebut. Oleh karenanya, penambahan bahan organik pada medium MS dapat dilakukan untuk mengurangi biaya pada pembuatan medium kultur. Pramesyanti (1999) menyatakan bahwa penambahan bahan organik kompleks, merupakan salah satu cara untuk memperkaya nutrisi pada medium kultur.
Salah satu bahan organik yang dapat digunakan adalah air cucian beras. Air cucian beras atau air leri biasa dimanfaatkan masyarakat untuk menyiram tanaman yang ada di sekitar rumah. Air leri memiliki kandungan seperti fosfor yang baik untuk pembelahan sel tanaman. Oleh karenanya, air leri juga dapat dimanfaatkan untuk memperkaya nutrisi medium kultur. Livi dkk. (2014) menyatakan bahwa penambahan air leri beras putih dan tanpa zat pengatur tumbuh dalam medium MS menghasilkan jumlah tunas terbaik pada anggrek Grammatophyllum speciosum. Sitokinin endogen anggrek tebu sudah mampu memultiplikasi tunas karena disintesis pada bagian tertentu meskipun dalam jumlah yang sedikit. Sementara air leri mengandung vitamin B1 sebagai pembentuk hormon auksin, yang apabila hormon auksin ini dikombinasikan dengan hormon sitokinan mampu menginduksi tunas. Selain auksin, air leri juga mengandung hormon giberelin yang dapat menginduksi mata tunas yang dorman.
Penambahan zat pengatur tumbuh sebagai bentuk modifikasi medium kultur in vitro perlu dilakukan untuk meningkatkan persentase keberhasilannya. Hormon tanaman yang banyak dipakai dalam propagasi secara in vitro ada dua yaitu auksin dan sitokinin (Wetherell, 1982). Golongan auksin yang ditambahkan pada medium penelitian ini adalah Naphtalene Acetic Acid (NAA) dan golongan sitokininnya adalah Benzyl Amino Purine (BAP). Dengan penambahan NAA dan BAP pada konsentrasi yang tepat, diharapkan zat pengatur tumbuh berinteraksi dengan air leri sehingga dapat meningkatkan multiplikasi anggrek tebu secara in vitro.
Penelitian ini bertujuan untuk mengetahui pengaruh dan menentukan kombinasi terbaik dari konsentrasi air leri dan BAP terhadap multiplikasi potongan tunas anggrek tebu (Grammatophyllum speciosum).
METODOLOGI PENELITIAN
3
alumunium foil, karet, plastik, sprayer, kertas payung, label, dissecting kits, autoklaf, petridish, botol kultur, gelas ukur, erlenmeyer, pipet tetes, pinset, pengaduk kaca, Laminar Air Flow (LAF), bunsen, penggaris dan Munsell Color Chart.
Penelitian dilakukan dengan metode percobaan di laboratorium yang disusun dalam Rancangan Acak Lengkap faktor tunggal. Perlakuan yang diuji adalah kombinasi konsentrasi air leri dan BAP yang terdiri dari 10 perlakuan, yaitu: aquadest + 0,5 mg/l BAP, 25% air leri + 0,5 mg/l BAP, 50% air leri + 0,5 mg/l BAP, 75% air leri + 0,5 mg/l BAP, 100% air leri + 0,5 mg/l BAP, aquadest + 1 mg/l BAP, 25% air leri + 1 mg/l BAP, 50% air leri + 1 mg/l BAP, 75% air leri + 1 mg/l BAP dan 100% air leri + 1 mg/l BAP. Setiap perlakuan diulang sebanyak 10 kali sehingga terdapat 100 unit percobaan. Data pengamatan dianalisis menggunakan sidik ragam dengan tingkat kesalahan 5% dan diuji lanjut menggunakan Duncan Multiple Range (DMRT) dengan tingkat kesalahan 5%. HASIL DAN PEMBAHASAN
Persentase Eksplan Hidup, Browning dan Kontaminasi (%)
Hasil pengamatan persentase eksplan hidup, terkontaminasi dan browning disajikan pada Tabel 1.
Tabel 1. Pengaruh Konsentrasi Air Leri dan BAP terhadap Persentase Eksplan Hidup, Browning dan Kontaminasi Anggrek Tebu pada minggu ke-8.
Perlakuan
Persentase eksplan hidup merupakan kemampuan eskplan untuk hidup dan tumbuh dalam medium perlakuan. Kemampuan hidup eksplan pada kultur in vitro sangat tergantung dari eksplan itu sendiri, jenis dan komposisi medium, serta kandungan zat pengatur tumbuh yang diberikan (Miryam dkk., 2008). Berdasarkan data pada tabel 1, secara umum persentase eksplan hidup anggrek tebu masih cukup tinggi. Hal ini dikarenakan eksplan yang digunakan merupakan eksplan yang sudah steril.
Persentase eksplan kontaminasi menunjukkan tingkat kontaminasi yang terjadi pada seluruh eksplan yang ditanam. Kontaminasi dapat ditemukan setelah beberapa generasi pada kultur yang steril. Hal tersebut diduga disebabkan oleh agen kontaminan yang telah bertahan di dalam jaringan sampai kondisi yang menguntungkan
untuk pertumbuhannya (Zulkarnain, 2009). Hasil pengamatan menunjukkan bahwa
4
kontaminasi dari bakteri internal yang biasanya terdapat pada tepi bekas potongan eksplan. Selain itu, ada pula eksplan kontaminasi yang disebabkan oleh jamur berwarna putih. Gejala yang ditimbulkan dari adanya serangan jamur adalah tumbuhnya hifa-hifa jamur pada permukaan medium maupun eksplan setelah inokulasi.
Pada penelitian ini, seluruh medium perlakuan ditambahkan PPM (Plant Preservative Mixture) yang dapat menghambat pertumbuhan patogen sehingga kontaminasi dipastikan bukan berasal dari medium yang digunakan. PPM merupakan biosida spektrum luas yang sangat efektif untuk mencegah atau menurunkan tingkat kontaminasi mikroba pada kultur in vitro (Syatria, 2010).
Masalah lain yang sering dihadapi pada teknik perbanyakan kultur in vitro adalah terjadinya pencoklatan atau penghitaman bagian eksplan (browning). Salah satu penyebab utama pencoklatan dalam kultur in vitro adalah luka karena pemotongan pada jaringan. Luka tersebut memacu stres dan menyebabkan peningkatan aktivitas Fenilalanin amonia liase (PAL) yang diikuti oleh aktivitas enzim oksidase (PPO) dan menyebabkan pencoklatan (Tabiyeh et.al. 2006 dalam Hutami, 2008). Berdasarkan data pada tabel 1, persentase browning tertinggi sebesar 10%. Hal ini dikarenakan senyawa fenolik yang keluar saat pemotongan eksplan, selanjutnya senyawa fenolik tersebut mengalami oksidasi yang kemudian menyebabkan eksplan menjadi berwarna cokelat. Persentase Eksplan Bertunas (%)
Hasil pengamatan persentase eksplan bertunas, pertambahan tinggi tunas dan pertambahan jumlah tunas disajikan pada tabel 2.
Tabel 2. Pengaruh Konsentrasi Air Leri dan BAP terhadap Persentase Eksplan Bertunas, Tinggi Tunas dan Jumlah Tunas Anggrek Tebu pada minggu ke-8.
Perlakuan
5
pembentukan dan perkembangan akar. Selain itu, ada pula kandungan sulfur pada air leri yang memacu sintesis thiamin (vitamin B1) yang berfungsi memacu pertumbuhan dan perkembangan akar. Oleh sebab itu, perlakuan medium yang diberi air leri cenderung memiliki persentase eksplan bertunas yang lebih rendah baik pada penambahan 0,5 mg/l maupun 1 mg/l BAP.
Gambar 1. Pengaruh Konsentrasi Air Leri dan BAP terhadap Persentase Eksplan Bertunas Anggrek Tebu.
Pertambahan Tinggi Tunas
Pertambahan tinggi tunas terjadi karena adanya penambahan jumlah sel atau pemanjangan sel yang dipengaruhi oleh unsur hara maupun ZPT. Tinggi tunas digunakan sebagai indikator pertumbuhan suatu tanaman yang penting untuk diamati karena menggambarkan seberapa besar pengaruh perlakuan konsentrasi air leri dan BAP terhadap tinggi eksplan. Berdasarkan data hasil pengamatan, konsentrasi air leri dan BAP tidak berpengaruh nyata terhadap tinggi tunas anggrek tebu. Artinya, baik medium yang diberi air leri maupun hanya menggunakan aquadest memberikan pengaruh yang sama terhadap tinggi tunas. Namun, secara umum bila dilihat dari rata-rata tinggi tunas, pada medium yang ditambahkan 1 mg/l BAP tinggi tunas menunjukkan nilai yang lebih baik dibandingkan pada medium yang ditambahkan 0,5 mg/l BAP. Hal ini dikarenakan BAP yang merupakan hormon sitokinin lebih kepada memacu pembelahan sel dan belum menyebabkan penambahan tinggi. Sementara, NAA yang merupakan hormon auksin untuk pemanjangan sel diberikan pada seluruh perlakuan dengan konsentrasi yang sama yaitu 0,5 mg/l sehingga tidak menunjukkan perbedaan yang nyata terhadap tinggi tunas pada seluruh perlakuan.
Pertambahan Jumlah Tunas
Pertambahan jumlah tunas merupakan faktor yang penting dalam mengetahui kemampuan eksplan untuk mendiferensiasi selnya. Perhitungan pertambahan jumlah tunas dilakukan pada keseluruhan tunas di tiap perlakuan yang muncul pada eksplan baik tunas yang berasal dari pemanjangan mata tunas maupun tunas adventif. Di antara berbagai zat pengatur tumbuh sitokinin sintetik, BAP paling sering digunakan karena sangat efektif menginduksi pembentukan daun dan penggandaan tunas, mudah didapat dan harganya relatif murah (George dan Sherrington, 1984 dalam Laela, 2005).
Berdasarkan data hasil pengamatan, perlakuan berbagai konsentrasi air leri dan BAP memberikan pengaruh yang berbeda nyata terhadap jumlah tunas. Artinya,
6
perlakuan medium yang diberi air leri memberikan pengaruh yang berbeda dengan medium yang hanya diberi aquadest terhadap pertambahan jumlah tunas. Perlakuan medium yang diberi air leri rata-rata mengalami pertambahan jumlah tunas yang sangat sedikit dibandingkan dengan perlakuan medium yang hanya diberi aquadest. Rata-rata jumlah tunas eksplan anggrek tebu pada berbagai konsentrasi air leri dan BAP disajikan pada gambar berikut.
Gambar 2. Pengaruh Konsentrasi Air Leri dan BAP terhadap Jumlah Tunas Anggrek Tebu
Gambar 2 menunjukkan bahwa pertambahan jumlah tunas tertinggi diperoleh pada perlakuan aquadest + 0,5 mg/l BAP dan aquadest + 1 mg/l BAP. Sementara pada perlakuan yang diberi air leri hanya memiliki pertambahan jumlah tunas yang sangat sedikit. Hal ini dikarenakan air leri memiliki kandungan fosfor yang cukup tinggi sehingga tingkat pembelahan sel pada eksplan tinggi, namun pembelahan sel terjadi pada akar eksplan karena adanya kandungan sulfur pada medium yang memacu sintesis thiamin (vitamin B1) yang berfungsi untuk memacu pertumbuhan dan perkembangan akar. Hal ini ditunjukkan oleh akar pada eksplan yang diberi air leri pertumbuhan dan perkembangannya lebih baik.
Pertambahan Jumlah Daun
Pertambahan jumlah daun merupakan perhitungan dari daun yang tumbuh pada eksplan di tiap perlakuan yang diujikan. Berdasarkan data hasil pengamatan, konsentrasi air leri dan BAP memberikan pengaruh yang berbeda nyata terhadap pertambahan jumlah daun. Artinya, berbagai konsentrasi air leri dan BAP memiliki pengaruh yang berbeda terhadap pertambahan jumlah daun pada eksplan anggrek tebu. Pertambahan jumlah daun terbanyak ditunjukkan oleh perlakuan 75% air leri + 1 mg/l BAP sebanyak 2,40 helai dan berbeda nyata dengan perlakuan 50% air leri + 0,5 mg/l BAP. Hal ini diduga kandungan nutrisi yang terdapat pada air leri dan BAP mampu diserap dan dioptimalkan oleh eksplan untuk pembentukan daun. Hasil pengamatan pertambahan jumlah daun, persentase eksplan berakar dan jumlah akar disajikan pada tabel 3.
7
Tabel 3. Pengaruh Konsentrasi Air Leri dan BAP terhadap Jumlah Daun, Persentase Eksplan Berakar, dan Jumlah Akar Anggrek Tebu pada Minggu ke-8.
Perlakuan
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama, menunjukkan tidak ada pengaruh yang berbeda nyata menurut UJGD pada taraf α=5%. Persentase Eksplan Berakar (%)
Persentase eksplan berakar merupakan jumlah eksplan yang mampu menumbuhkan akar pada tiap perlakuan dan dinyatakan dalam satuan persen. Semakin tinggi persentase eksplan berakar maka penyerapan unsur hara pada eksplan anggrek tebu akan semakin baik. Berdasarkan data pada tabel 3, secara umum nilai persentase eksplan berakar cukup tinggi. Hal ini dapat dilihat dari beberapa perlakuan yang persentase eksplan berakarnya mencapai 100%. Tingginya nilai persentase eksplan berakar diduga karena adanya kandungan air leri yang mendukung pertumbuhan akar eksplan anggrek tebu seperti fosfor, sulfur serta vitamin B1. Unsur hara fosfor digunakan sebagai penyusun asam amino dalam pembelahan sel. Selain itu fosfor juga memiliki peran untuk sintesis protein bersama dengan sulfur yang juga memacu sintesis thiamin (vitamin B1) untuk memacu pertumbuhan dan perkembangan akar.
Jumlah Akar
Jumlah akar yang banyak dapat mengoptimalkan penyerapan nutrisi pada medium. Berdasarkan data tabel 3, konsentrasi air leri dan BAP memberikan pengaruh yang berbeda nyata terhadap penambahan jumlah akar. Artinya, berbagai konsentrasi air leri dan BAP memberikan pengaruh yang berbeda terhadap pertumbuhan akar eksplan anggrek tebu. Hal ini dikarenakan kandungan fosfor pada air leri memacu pembelahan sel akar serta didukung pula oleh kandungan sulfur dari air leri yang berfungsi memacu sintesis thiamin (vitamin B1) untuk merangsang pertumbuhan dan perkembangan akar. Selain itu, kandungan magnesium yang cukup tinggi pada media yang diberi air leri juga dapat dimanfaatkan sebagai aktivator enzim-enzim fotosintesis serta respirasi yang diperlukan untuk sintesis protein.
8
pembelahan sel pada meristem akar (Sudarmiyatun, 2012). Oleh karenanya, pembelahan sel cenderung terjadi pada ujung akar untuk pemanjangan akar.
Bahan organik dalam perombakannya hingga tersedia untuk eksplan membutuhkan waktu yang lebih lama sehingga unsur fosfor dan magnesium yang digunakan untuk pembelahan sel dan kofaktor enzim dalam pembelahan sel baru dapat dimanfaatkan untuk pembentukan akar. Oleh karenanya, pengaruh dari medium baru terlihat lama setelah dipindahkan di medium yang terdapat bahan organik didalamnya. Selain itu, terdapat hormon pertumbuhan tanaman yang mampu mensintesis pembentukan akar tanaman seperti auksin dan sitokinin. Hormon auksin dapat meningkatkan aktivitas pembentukan akar adventif pada pangkal potongan dari suatu batang dengan adanya transpor auksin yang dilakukan dari ujung tunas ke pangkal tunas, yang disebut dengan transpor polar basipetal. Transpor polar basipetal merupakan transpor yang tidak dapat bergerak dengan arah sebaliknya dan membutuhkan energi. Sementara hormon sitokinin berperan terhadap pembelahan sel pada eksplan. Sitokinin diproduksi pada bagian pangkal batang yang kemudian di translokasikan ke seluruh tanaman melalui aliran transpirasi (Campbell, dkk. 2003).
KESIMPULAN
Penggunaan air leri dan BAP dengan berbagai konsentrasi mampu memultiplikasi potongan tunas anggrek tebu dan berpengaruh terhadap pertumbuhan dan panjang akar anggrek tebu. Adapun penggunaan 75% air leri + 1 mg/l BAP pada medium ½ MS merupakan konsentrasi terbaik untuk multiplikasi anggrek tebu.
SARAN
Berdasarkan hasil penelitian, perlu dilakukan penelitian lebih lanjut dengan menggunakan media 1 MS dan waktu pengamatan yang lebih lama untuk dapat melihat pengaruh air leri terhadap pertumbuhan eksplan anggrek tebu.
DAFTAR PUSTAKA
Anis S. dan Oetami D.H. 2010. Pengaruh Sterilan dan Waktu Perendaman pada Eksplan Daun Kencur (Kaemferia galanga L) untuk Meningkatkan Keberhasilan Kultur Kalus. Fakultas Pertanian. Universitas Muhammadiyah Purwokerto. Campbell, Neil A., Jane B. Reece, dan Lawrence G. Mitchell. 2003. Biologi Edisi
Kelima-Jilid 2. Erlangga. Jakarta.
Hutami S. 2008. Masalah Pencoklatan pada Kultur Jaringan. Jurnal AgroBiogen 4(2).
Laela Sari. 2005. Optimalisasi Medium untuk Jumlah Daun dan Multiplikasi Tunas Lidah Buaya (Aloe vera) dengan Pemberian BAP dan Adenin. Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong. Bogor
9
Miryam, A, I. Suliansyah, dan A. Djamaran. 2008. Multiplikasi Jeruk Kacang (Citrus nobilis L.) pada Beberapa Konsentrasi NAA dan BAP pada Medium WPM secara In Vitro. Jerami.1(2): 1-8.
Pramesyanti, A. 1999. Pengaruh Bubur Buah Beberapa Kutivar Pisang terhadap Pertumbuhan Vegetatif Plantlet Dendrobium Kamiya’s Pride x Dendrobium Rulita Beauty pada Medium Vacin dan Went Modifikasi. Skripsi FMIPA. Jurusan Biologi. Universitas Indonesia. Jakarta.
Pusat Data dan Sistem Informasi Pertanian. 2013. Buletin Bulanan Indikator Makro Sektor Pertanian. Kementrian Pertanian RI. Volume 8, Nomor 3.
Rimando, Tito J. 2001. Ornamental Horticulture A Little Giant in The Tropics. SEAMO SEARCA and UPLB. Philipines. 99p.
Sjahril, Rinaldi. 2011. Bahan Ajar Mata Kuliah: Pembiakan In Vitro. Program Studi Agroteknologi. Fakultas Pertanian. Universitas Hasanuddin. Makassar.
Syatria N. 2010. Plant Preservative Mixture (PPM) bahan kimia pengurang Kontaminasi Mikroba. http://tissuecultureandorchidologi.blogspot.com /2010/04/plant-preservative-mixtur-ppm.html., diakses Mei 2016.
Wetherell, D.F. 1982. Pengantar Propagasi Secara In Vitro Kultur Jaringan Tanaman, Edisi Indonesia. IKIP Semarang Press. Semarang.