KETAHANAN KOROSI BAJA AISI 4130 PADA TEMPERATUR 850º C DENGAN DILAPISI ALUMINIUM CELUP PANAS
Oleh JONI YANTO
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA TEKNIK
Pada
JurusanTeknikMesin
FakultasTeknikUniversitas Lampung
FAKULTAS TEKNIK UNIVERSITAS LAMPUNG
BEHAVIOR OXIDATION OF STEEL AISI 1020 AT TEMPERATURE OF 700 ºC IN THE ENVIRONMENT OF Na2SO4
By
BAKUNG KUNTOWIJAYANDANU
AISI 1020 steel is a low carbon steel that is used as a material for steam pipeline system at the plant. Over time usage, carbon steel will undergo degradation or damage from corrosion. Especially high temperature corrosion in the environments containing corrosive gases such as chlorine and sulfur. For it is necessary to study the corrosion resistance of AISI 1020 steel with Na2SO4 deposit at temperatures of 700
ºC for 1-64 hours. To determine the mechanism and the phases that form on the material after the process of oxidation-corrosion, some tests carried out, testing the SEM (Scanning Electron Microscope), EDS (Energy Dispersive Spectroscope), OM (Optical Microscope), and XRD (X-Ray Diffraction).
The results showed that the presence of sulfur from Na2SO4 deposit will increase the
rate of oxidation kinetics of a higher order. Rate of oxidation kinetics (kp) AISI 1020
steel is at 8,456 × 10-10 g2cm-4s-1 in normal air environment [25]. In this study the kinetics of the oxidation rate (kp) AISI 1020 steel was obtained at 2,40 × 10 9 g2cm-4s -1
(10% Na2SO4), 2,00 × 10 9 g2cm-4s-1 (20% Na2SO4), and 2,75 × 10 9 g2cm-4s-1 (30%
Na2SO4). XRD shows that the phases are formed Fe2O3, Fe3O4, FeO, NaFeO2, and
FeS. Overall oxidation-corrosion steel AISI 1020 in the Na2SO4 higher than in
normal environments at temperatures 700 ºC for 1-64 hours time.
ABSTRAK
KETAHANAN KOROSI BAJA AISI 4130 PADA TEMPERATUR 850º C DENGAN DILAPISI ALUMINIUM CELUP PANAS
Oleh JONI YANTO
Baja AISI 4130 adalah salah satu baja paduan rendah yang dapat digunakan sebagai bahan untuk pipa uap panas pada Pembangkit Listrik Tenaga Panas Bumi. Seiring waktu penggunaannya, baja ini akan mengalami degradasi atau kerusakan akibat korosi, terutama korosi temperatur tinggi. Untuk itu perlu dilakukan penelitian ketahanan korosi baja AISI 4130 pada temperatur 850 ºC dengan dilapisi aluminium celup panas selama 49 jam. Proses pencelupan spesimen ke dalam bak aluminium cair dilakukan pada temperatur 700 ºC selama 3-16 detik. Beberapa pengujian yang dilakukan, yakni pengujian SEM (Scanning Electron Microscope), EDS (Energy Dispersive Spectroscope), OM (Optical Microscope), dan XRD (X-Ray Diffraction). Hasil penelitian menunjukan bahwa ketebalan lapisan Al dan lapisan FeAl meningkat dengan seiring dengan lamanya waktu pencelupan pada proses aluminium celup panas. Hasil dari pengujian EDS menunjukkan terbentuknya lapisan intermetalik yaitu FeAl3 dan Fe2Al5. Tingkat laju kinetika (kp) baja AISI 4130 (bare steel) ialah
sebesar 5,43 × 10-9 g2cm–4s–1, sedangkan laju kinetika oksidasi (kp) baja AISI 4130
yang dilapisi aluminium celup panas ialah sebesar 6,74 × 10-12 g2cm–4s–1. Laju kinetika baja AISI 4130 yang dilapisi aluminium celup panas mengalami penurunan dikarenakan pembentukan lapisan protektif Al2O3 yang berperan dalam mengontrol
laju difusi anion oksigen.
Halaman
DAFTAR ISI xiii
DAFTAR GAMBAR xvi
DAFTAR TABEL xviii
DAFTAR SIMBOL xix
BAB I. PENDAHULUAN
1.1.Latar Belakang ... 1
1.2.Tujuan Penelitian ... 4
1.3.Batasan Masalah ... 5
1.4.Sistematika Penulisan ... 5
BAB II. KAJIAN PUSTAKA 2.1. Baja ... 7
2.1.1. Klasifikasi Baja ... 8
2.1.1.1. Baja Karbon ... 8
2.1.1.2. Baja Paduan ... 9
2.2.Baja AISI 4130 ... 13
2.3.Hot Dipping ... 13
2.4.Aluminium... 15
2.5.Hot Dipping Aluminium ... 16
2.6.1. Faktor-Faktor yang Mempengaruhi Korosi ... 20
2.6.2. Klasifikasi Korosi ... 21
2.6.3. Penyebab Korosi Temperatur Tinggi ... 21
2.7.Oksidasi ... 23
2.7.1. Pengertian Oksidasi ... 23
2.7.2. Penebalan Lapisan Oksida ... 24
2.8.Oksidasi Pada Temperatur Tinggi ... 27
2.9.Kinetika Oksidasi ... 29
2.10.SEM (Scanning Electron Microscopy) ... 33
2.11.XRD (X-Ray Difraction) ... 35
BAB III. METODOLOGI PENELITIAN 3.1. Tempat Penelitian ... 37
3.2. Alat dan Bahan ... 37
3.3. Prosedur Penelitian ... 38
3.4. Diagram Alir ... 42
BAB IV. HASIL DAN PEMBAHASAN 4.1.Karakterisasi baja AISI 4130 lapis Al-celup panas ... 43
4.2.Pengujian Oksidasi baja yang dilapisi Al celup panas ... 48
4.3.Struktur mikro dan fasa-fasa yang terbentuk pada baja yang dioksidasi ... 53
DAFTAR PUSTAKA
DAFTAR TABEL
Tabel Halaman 3.1. Jumlah spesimen yang digunakan pada bagian pertama untuk masing-masing
pengujian ... 38 3.2. Jumlah spesimen yang digunakan pada bagian kedua untuk masing-masing
pengujian ... 39 4.1. Nilai weight gain baja AISI 4130 yang dilapisi Al pada oksidasi 850 °C ... 50 4.2. Laju kinetika baja AISI 4130 yang dilapisi Al pada oksidasi temperatur 850 °C
selama periode 49 jam ... 52 4.3. Komposisi kimia elemen Al, Fe, Cr dan O pada penampang permukaan
Gambar Halaman
2.1. Aluminium ... 16
2.2. Korosi logam Fe dan berubah menjadi oksidanya ... 19
2.3. Lapisan oksida berpori ... 25
2.4. Lapisan oksida tidak berpori ... 26
2.5. Lapisan oksida tidak berpori ... 26
2.6. Kurva penambahan berat terhadap waktu pada hukum kinetika untuk oksidasi logam 28 2.7. Alat Uji SEM ... 33
2.8. Skema Alat Uji SEM ... 35
3.1. Ilustrasi sederhana pada proses dipping ... 41
3.2. Diagram alir penelitian ... 42
4.1. Penampang permukaan baja AISI 4130 yang dilapisi Al-celup panas pada temperatur 700 oC dengan variasi waktu pencelupan 3-16 detik ... 44
4.2. Penampang permukaan baja AISI 4130 yang dilapisi Al celup panas selama 12 detik pada temperatur 700 oC yang dietsa dengan nital 3%. ... 45
4.4. SEM pada permukaan baja Al coated yang dioksidasi selama 15 jam dan Fe oxide nodul tumbuh di atas lapisan intermetalik dan Al2O3 ... 50
4.5. (a) Plot weight gain terhadap waktu oksidasi (b) Plot parabolik weight gain terhadap akar kuadrat waktu oksidasi pada baja AISI 4130 yang dilapisi Al 51 4.6. SEM/EDS analisis komposisi (%) dilakukan dengan EDS line scanning
sepanjang ketebalan lapisan alumida spesimen Al-coated ... 53 4.7. SEM/SEI pada penampang permukaan baja yang dilapisi Al dioksidasi pada
temperatur 850 °C. (a−b) lapisan Fe2Al5 dengan pengendapan-(FeAl)Cr dan
lapisan tipis FeAl selama oksidasi 30 min sampai 1 jam. (c) lapisan FeAl mendominasi setelah 49 jam... 54 4.8. SEM penampang permukaan baja AISI 4130 Al coated dioksidasi selama 1 jam
dengan EDS X-ray mapping untuk elemen Fe, Al, O, Cr dan Mo ... 56 4.9. Pola difraksi hasil XRD pada permukaan baja AISI 4130 Al-coated yang
dioksidasi pada temperatur 850º C ... 57 4.10. SEM penampang permukaan baja AISI 4130 Al coated yang dioksidasi selama
1 jam ... 58 4.11. (a) SEM penampang permukaan baja Al coated dioksidasi 36 jam, dan (b) EDS
line scanning yang menunjukkan komposisi elemen Fe, Al, Cr, O dan Mo dalam lapisan aluminida ... 59 4.12. SEM topografi permukaan baja yang dialuminasi setelah dioksidasi pada
temperatur 850 oC (a) fasa Fe2Al5 yang mengandung kaya Cr mengendap dan
BAB I
PENDAHULUAN
1.1 Latar Belakang
Korosi merupakan hasil reaksi kimia logam dengan gas korosif [ Qiao dkk, 1998]. Karat logam umumnya adalah berupa oksida atau karbonat. Bahkan kebocoran pipa saluran gas sering terjadi tanpa bisa diidentifikasi secara dini karena tingginya konsentrasi gas yang mengandung senyawa-senyawa klorida dan sulfur [ Ravindra dkk, 2007, Dorota dkk, 2009]. Sehingga proses perancangan sistem perpipaan untuk komponen pipa saluran uap panas dari sumur-sumur produksi harus selalu memperhatikan ketahanan korosi dan kekuatan bahan yang akan digunakan [ Kalivodova dkk, 2005]. Hal ini perlu dilakukan agar diperoleh rancangan yang optimal baik dari segi operasionalnya maupun dari segi keamanannya. Sedangkan scaling merupakan fenomena dimana endapan kerak anorganik menumpuk pada sistem saluran perpipaan yang dapat menggangu transfer gas uap panas dan juga menimbulkan korosi [Iulian dkk, 2010]. Korosi dan endapan anorganik akan menimbulkan penyumbatan pada sistem saluran pipa yang akhirnya menurunkan laju aliran gas panas bumi dan produksi tenaga listrik.
3
lebih rendah daripada baja paduan yang tahan korosi atau titanium [Cedric, 2005]. Pada penelitian ini digunakan baja AISI 4130 yang merupakan baja paduan rendah molybdenum yang mengandung kromium 0,8-1,1% dan kandungan karbon 0,28-0,33%. Dimana baja ini diaplikasikan pada pipa-pipa gas. Dengan kadar karbon yang relatif rendah, maka paduan ini dapat dikeraskan dengan perlakuan panas. Penggunaan inhibitor anorganik, asam amino atau polimer yang tahan air meskipun mampu menurunkan endapan kerak CaCO3 [Martinod dkk, 2008], namun untuk
penggunaan waktu yang cukup lama cenderung meningkatkan laju korosi bila melebihi 100 ppm. Ini artinya bahwa penggunaan inhibitor anorganik dan organik hanya terbatas pada konsentrasi yang rendah dan aplikasi hanya pada temperatur rendah. Untuk mendapatkan peningkatan ketahanan korosi baja karbon pada temperatur tinggi dapat dilakukan dengan pelapisan celup panas (Hot Dipping).
Meskipun baja AISI 4130 mengandung Cr sekitar 0,8-1,1 wt%, selama baja tersebut teroksidasi pada temperatur tinggi, pembentukan lapisan pelindung Cr2O3 tidak stabil
karena pembentukan CrO3 yang menghasilkan kerusakan lapisan pelindung
Cr2O3[Perez dkk,2006]. Dalam penelitian ini akan digunakan proses pelapisan celup
panas aluminium, proses pelapisan ini lebih murah dan sangat efektif untuk komponen yang besar dan bentuknya yang komplek seperti pipa [Dah dkk, 2007, Chang dkk, 2006, Wang dkk, 2003]. Lapisan aluminium yang terbentuk pada permukaan baja karbon dapat menjadi lapisan pelindung baja selama aplikasi pada temperatur tinggi bahkan pada lingkungan yang mengandung konsentrasi uap panas yang tinggi mampu melindungi permukaan baja karbon dari korosi uap air [Wang dan Badaruddin, 2010].
Berdasarkan latar belakang di atas maka pada penelitian ini mengambil judul :
“Ketahanan Korosi Baja AISI 4130 Pada Temperatur 850oC Dengan Dilapisi
Aluminium Celup Panas”.
1.2 Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah
a. Meningkatkan ketahanan korosi baja paduan rendah pada temperatur 850o C. b. Mengetahui karakteristik ketebalan lapisan aluminium yang terbentuk setelah
5
1.3Batasan masalah
Berdasarkan latar belakang dan perumusan masalah diatas agar proses yang dilakukan bisa berjalan dengan sesuai maka peneliti membatasi masalah penelitiannya sebagai berikut:
a. Mencairkan alumunium pada temperatur 700o C.
b. Subtrate baja paduan rendah bahan yang akan diuji adalah baja AISI 4130 dengan dimensi panjang 20 mm, lebar 10 mm, dan tebal 2 mm.
c. Waktu proses hot dipping adalah 3, 5, 9, 12 dan 16 detik.
d. Korosi oksidasi dilakukan pada temperatur 850o C dengan variasi waktu oksidasi adalah ½ jam sampai 49 jam.
1.4 Sistematika Penulisan
Penulisan Tugas Akhir ini disusun menjadi lima Bab. Adapun sistematika penulisannya adalah sebagai berikut :
BAB I PENDAHULUAN
Pada bab ini menguraikan latar belakang penelitian tugas akhir, tujuan penelitian tugas akhir, batasan masalah dan sistematika penulisan.
BAB II TINJAUAN PUSTAKA
BAB III METODOLOGI PENELITIAN
Pada bab ini menjelaskan metode tentang langkah-langkah, Alat dan bahan yang dilakukan untuk mencapai hasil yang diharapkan dalam penelitian ini.
BAB IV HASIL DAN ANALISA
Pada bab ini menguraikan hasil dan membahas yang diperoleh dari penelitian yang telah dilakukan.
BAB V SIMPULAN DAN SARAN
Pada bab ini menyimpulkan dari hasil dan pembahasan sekaligus memberikan saran yang dapat menyempurnakan penelitian ini.
DAFTAR PUSTAKA
Berisikan literatur-literatur atau referensi yang diperoleh penulis untuk mendukung penyusunan laporan ini.
LAMPIRAN
BAB II
TINJAUAN PUSTAKA
2.1 Baja
Baja adalah logampaduan dengan besi sebagai unsur dasar dan karbon sebagai unsur paduan utamanya. Kandungan karbon dalam baja berkisar antara 0.2% hingga 2.1% berat sesuai grade-nya. Fungsi karbon dalam baja adalah sebagai unsur pengeras. Unsur paduan lain yang biasa ditambahkan selain karbon adalah mangan (manganese), krom (chromium), vanadium, dan nikel. Dengan memvariasikan kandungan karbon dan unsur paduan lainnya, berbagai jenis kualitas baja bisa didapatkan. Penambahan kandungan karbon pada baja dapat meningkatkan kekerasan (hardness) dan kekuatan tariknya (tensile strength), namun di sisi lain membuatnya menjadi getas (brittle) serta menurunkan keuletannya (ductility).
2.1.1 Klasifikasi Baja
Menurut ASM handbook vol.1:329 (1993), baja dapat diklasifikasikan berdasarkan komposisi kimianya seperti kadar karbon dan paduan yang digunakan. Adapun klasifikasi baja berdasarkan komposisi kimianya adalah sebagai berikut:
2.1.1.1Baja karbon
Baja karbon adalah paduan antara besi dan karbon dengan sedikit Si, Mn, P, S, dan Cu. Sifat baja karbon sangat tergantung pada kadar karbon, bila kadar karbon naik maka kekuatan dan kekerasan juga akan bertambah tinggi. Karena itu baja karbon dikelompokkan berdasarkan kadar karbonnya [Wiryosumarto, 2004].
a. Baja Karbon Rendah
Baja karbon rendah memiliki kandungan karbon dibawah 0,3%. Baja karbon rendah sering disebut dengan baja ringan (mild steel) atau baja perkakas. Jenis baja yang umum dan banyak digunakan adalah jenis cold roll steel dengan kandungan karbon 0,08% – 0,30% yang biasa digunakan untuk body kendaraan [Sack, 1997].
b. Baja Karbon Sedang
9
banyak digunakan untuk poros, rel kereta api, roda gigi, pegas, baut, komponen mesin yang membutuhkan kekuatan tinggi, dan lain-lain.
c. Baja Karbon Tinggi
Baja karbon tinggi memiliki kandungan karbon paling tinggi jika dibandingkan dengan baja karbon yang lain yakni 0,60% - 1,7% C dan memiliki tahan panas yang tinggi, kekerasan tinggi, namun keuletannya lebih rendah. Baja karbon tinggi mempunyai kuat tarik paling tinggi dan banyak digunakan untuk material tools. Salah satu aplikasi dari baja ini adalah dalam pembuatan kawat baja dan kabel baja.
2.1.1.2Baja paduan
Menurut [Amanto, 1999], baja paduan didefinisikan sebagai suatu baja yang dicampur dengan satu atau lebih unsur campuran seperti nikel, mangan, molybdenum, kromium, vanadium dan wolfram yang berguna untuk memperoleh sifat-sifat baja yang dikehendaki seperti sifat kekuatan, kekerasan dan keuletannya. Paduan dari beberapa unsur yang berbeda memberikan sifat khas dari baja. Misalnya baja yang dipadu dengan Ni dan Cr akan menghasilkan baja yang mempunyai sifat keras dan ulet. Berdasarkan kadar paduannya baja paduan dibagi menjadi tiga macam yaitu:
a. Baja Paduan Rendah (Low Alloy Steel)
paduan. Dengan penambahan unsur paduan, kekuatan dapat dinaikkan tanpa mengurangi keuletannya, kekuatan fatik, daya tahan terhadap korosi, aus dan panas. Aplikasinya banyak digunakan pada kapal, jembatan, roda kereta api, ketel uap, tangki gas, pipa gas dan sebagainya.
b. Baja Paduan Menengah (Medium Alloy Steel)
Baja paduan menengah merupakan baja paduan yang elemen paduannya 2,5%-10% wt misalnya unsur Cr, Mn, Ni, S, Si, P, dan lain-lain.
c. Baja Paduan Tinggi (High Alloy Steel)
Baja paduan tinggi merupakan baja paduan yang elemen paduannya lebih dari 10% wt misalnya unsur Cr, Mn, Ni, S, Si, P, dan lain-lain. Contohnya baja tahan karat, baja perkakas dan baja mangan. Aplikasinya digunakan pada bearing, bejana tekan, baja pegas, cutting tools, frog rel kereta api dan lain sebagainya.
Pada umumnya, baja paduan mempunyai sifat yang unggul dibandingkan dengan baja karbon biasa diantaranya [Amstead, 1993]:
1. Keuletan yang tinggi tanpa pengurangan kekuatan tarik
2. Tahan terhadap korosi dan keausan yang tergantung pada jenis paduannya 3. Tahan terhadap perubahan suhu, ini berarti bahwa sifat fisisnya tidak
banyak berubah
11
Pengaruh unsur-unsur paduan dalam baja adalah sebagai berikut: 1. Unsur karbon (C)
Karbon merupakan unsur terpenting yang dapat meningkatkan kekerasan dan kekuatan baja. Kandungan karbon di dalam baja sekitar 0,1%-1,7%, sedangkan unsur lainnya dibatasi sesuai dengan kegunaan baja. Unsur paduan yang bercampur di dalam lapisan baja adalah untuk membuat baja bereaksi terhadap pengerjaan panas dan menghasilkan sifat-sifat yang khusus. Karbon dalam baja dapat meningkatkan kekuatan dan kekerasan tetapi jika berlebihan akan menurunkan ketangguhan.
2. Unsur Mangan (Mn)
Semua baja mengandung mangan karena sangat dibutuhkan dalam proses pembuatan baja. Kandungan mangan kurang lebih 0,6% tidak mempengaruhi sifat baja, dengan kata lain mangan tidak memberikan pengaruh besar pada struktur baja dalam jumlah yang rendah. Penambahan unsur mangan dalam baja dapat menaikkan kuat tarik tanpa mengurangi atau sedikit mengurangi regangan, sehingga baja dengan penambahan mangan memiliki sifat kuat dan ulet.
3. Unsur Silikon (Si)
Silikon merupakan unsur paduan yang ada pada setiap baja dengan
tidak stabil, sehingga memisahkan dan membentuk grafit. Unsur silikon juga merupakan pembentuk ferit, tetapi bukan pembentuk karbida, silikon juga cenderung membentuk partikel oksida sehingga memperbanyak pengintian kristal dan mengurangi pertumbuhan akibatnya struktur butir semakin halus.
4. Unsur Nikel (Ni)
Nikel mempunyai pengaruh yang sama seperti mangan, yaitu memperbaiki kekuatan tarik dan menaikkan sifat ulet, tahan panas, jika pada baja paduan terdapat unsur nikel sekitar 25% maka baja dapat tahan terhadap korosi. Unsur nikel yang bertindak sebagai tahan karat (korosi) disebabkan nikel bertindak sebagai lapisan penghalang yang melindungi permukaan baja. 5. Unsur Kromium (Cr)
13
2.2 Baja AISI 4130
Dalam penelitian ini jenis material yang digunakan yaitu baja AISI 4130 yang merupakan baja paduan rendah molybdenum yang mengandung kromium dengan kandungan karbon 0,30%. Baja AISI 4130 mempunyai komposisi kimia (0,28-0,33)% C; (0,40-0,60)% Mn; 0,035% P; 0,04% S; (0,15-0,30)% Si; (0,80-1,10)% Cr; (0,15-0,25)% Mo.
2.3 Hot Dipping
Pelapisan hot dipping adalah pelapisan logam dengan cara mencelupkan pada sebuah material yang terlebih dahulu dilebur dari bentuk padat menjadi cair pada sebuah pot atau tangki, menggunakan energi dari gas pembakaran atau menggunakan energi alternatif seperti panas listrik. Titik lebur yang digunakan pada pelapisan material ini adalah biasanya beberapa ratus derajat celcius (tidak melebihi 10000C).
untuk logam-logam yang memiliki titik lebur rendah, misalnya; timah, seng dan aluminium.
Sebelum proses hot dipping benda harus dibersihkan atau disemprot, disikat dengan larutan berupa HCl dengan konsentrasi tertentu untuk membersihkan agar bebas dari minyak dan kotoran lainnya dan diakhiri dengan mencelupkan benda kerja ke dalam fluxes atau menyemprotkan fluxes ke benda yang akan dilapisi. Fluxes adalah cairan yang digunakan untuk lebih merekatkan pelapisan logam [Gambreel, 2009].
Bahan logam yang bisa digunakan untuk melapisi pada proses hot dipping adalah timah, seng, aluminium, timah hitam dan campuran lain. Sebelum dilapisi dalam proses hot dipping permukaan benda kerja harus bersih dari kotoran seperti lemak, oksida dan kotoran lain. Lapisan yang terbentuk relatif tipis. Dalam pelaksanaan proses ini haruslah dipenuhi persyaratan antara lain:
a. Permukaan benda kerja yang dilapisi harus bersih dan bebas dari kotoran. Oleh karena itu harus dibersihkan terlebih dahulu dengan larutan pembersih yang digunakan untuk hot dipping.
b. Logam yang akan dilapisi harus mempunyai titik lebur yang lebih tinggi dan untuk logam pelapis (timah, seng atau aluminum) mempunyai titik lebur yang lebih rendah.
15
2.4 Aluminium
Aluminium adalah putih keperakan dan logam yang sangat populer yang memiliki banyak kegunaan dan sifat yang berguna. Tidak ada logam lain memiliki banyak kegunaan seperti aluminium. Aluminium merupakan salah satu logam non ferrous yang sangat penting di dunia industri. Aluminium menjadi salah satu komponen yang banyak digunakan pada bidang konstruksi, aplikasi elektronika, kontainer, transportasi, badan pesawat, perabot rumah tangga serta peralatan mekanik. Aluminium memiliki massa jenis 2,7 gr.cm-3 dan memiliki titik lebur mencapai 660oC . Sifat-sifat yang dimiliki aluminium antara lain:
1. Ringan, tahan korosi dan tidak beracun sehingga banyak digunakan untuk alat rumah tangga seperti panci, kuali dan lain-lain.
2. Reflektif, dalam bentuk aluminium foil digunakan sebagai pembungkus makanan, pembungkus rokok dan lain-lain.
3. Daya hantar listrik dua kali lebih besar dari Cu, sehingga aluminium digunakan sebagai kabel listrik.
4. Paduan aluminium dengan logam lainnya menghasilkan logam yang kuat, seperti duralium (campuran Al, Cu dan Mg) untuk pembuatan badan pesawat.
5. Aluminium sebagai zat reduktor untuk oksida MnO2 dan Cr2O3.
bauksit yang merupakan satu-satunya sumber aluminium. Bentuk fisik aluminium dapat dilihat pada gambar 1.
Gambar 2.1. Aluminium
2.5 Hot Dipping Aluminium
Logam aluminium dipilih sebagai pelapis karena kemampuan aluminium membentuk lapisan keramik sangat tipis yaitu alumina (Al2O3) [Badaruddin,
17
penerapan pelapisan aluminium pada komponen seperti pipa, sangat sulit dilakukan. Metode yang paling murah dan sederhana dapat digunakan untuk melapisi pipa baik sisi dalam maupun luarnya adalah dengan metode celup panas. Disamping itu juga ketebalan lapisan aluminium pada substratnya dapat dikontrol melalui control parameter temperatur cair aluminium dan waktu pencelupan. Sehingga ketersediaan aluminium sebagai reservoir untuk produksi Al2O3 tetap
terjaga pada permukaan pipa baja.
Dalam pemanfaatan logam terutama alumunium untuk pelapisan, ada dua jenis pelapisan hot dipping aluminum, yaitu:
(a) Pelapisan Alumunium Type 1 (Pelapisan Al – Si)
Lapisan tipe ini adalah lapisan yang tipis yaitu dengan ketebalan menurut kelasnya. Untuk kelas 40 tebal lapisannya adalah 20 –25 m dan untuk kelas
25 biasanya untuk kepentingan tertentu yaitu tebal pelapisan 12 m. Silicon
yang dicampurkan pada pelapisan tipe 1 ini rata–rata adalah 5 – 11% untuk perintah mencegah pembentukan lapisan tebal antara logam besi– alumunium, dimana akan merusak pelekatan lapisan dan kemampuan untuk membentuk [Townsend, 1994].
(b) Pelapisan Alumunium Type 2 (Al Murni)
Lapisan ini adalah lapisan yang tebal dengan ketebalan pelapisan adalah 30 –
terhadap ketahanan korosi udara. Pada lingkungan perairan laut, pelapisan ini sangat baik ketahanannya terhadap korosi celah [Townsend, 1994].
2.6 Korosi
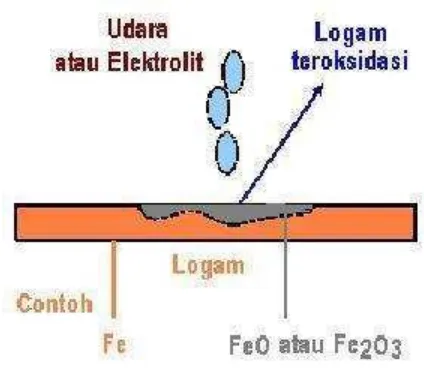
Korosi adalah kerusakan atau degradasi logam akibat reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya yang menghasilkan senyawa-senyawa yang tidak dikehendaki. Dalam bahasa sehari-hari korosi disebut perkaratan. Contoh korosi yang paling lazim adalah perkaratan besi. Pada peristiwa korosi, logam mengalami oksidasi, sedangkan oksigen (udara) mengalami reduksi. Karat logam umumnya adalah berupa oksida atau karbonat. Rumus kimia karat besi adalah Fe2O3.nH2O, suatu zat padat yang berwarna coklat-merah.
19
Gambar 2.2. Korosi logam Fe dan berubah menjadi oksidanya
Korosi dapat terjadi oleh air yang mengandung garam, karena logam akan bereaksi secara elektrokimia dalam larutan garam (elektrolit). Faktor yang mempengaruhi proses korosi meliputi potensial elektrodanya yang negative lebih mudah mengalami korosi. Demikian pula dengan logam yang potensial elektrodanya positif sukar mengalami korosi.
Seng amat mudah teroksidasi membentuk lapisan ZnO. Lapisan inilah yang akan melindungi besi dari oksidator.
2.6.1 Faktor-faktor yang mempengaruhi korosi
Secara umum faktor-faktor yang mempengaruhi korosi dibagi menjadi dua yaitu, faktor internal dan faktor eksternal. Faktor internal meliputi keragaman struktur, perlakuan panas, pendinginan dan perlakuan permukaan. Sedangkan yang termasuk faktor eksternal ialah fenomena korosi yang merupakan interaksi elektrokimia antara logam dengan lingkungannya. Adapun kondisi lingkungan yang mempengaruhi korosi logam yaitu:
a. Keberadaan gas terlarut
Adanya gas terlarut seperti CO2, O2 dan H2S merupakan beberapa gas yang
mempengaruhi laju korosi logam. Gas tersebut ikut berperan dalam transfer muatan di dalam larutan.
b. Temperatur
Temperatur berperan mempercepat seluruh proses yang terlibat selama korosi terjadi. Titik optimum dari temperatur yang menyebabkan korosi adalah sekitar rentang 328-353 K.
c. pH larutan
21
d. Padatan terlarut
Garam klorida, khususnya ion-ion klorida menyerang lapisan mild steel dan stainless steel. Ion-ion ini menyebabkan terjadinya pitting, crevice corrosion dan pecahnya paduan logam.
2.6.2 Klasifikasi korosi
Korosi diklasifikasikan melalui banyak cara. Ada metode yang membagi korosi menjadi korosi pada temperatur rendah dan temperatur tinggi. Metode lainnya memisahkan korosi menjadi kombinasi langsung (atau oksidasi) dan korosi elektrokimia [M.G. Fontana, 1986]. Klasifikassi yang lebih disukai adalah korosi basah (wet corrosion) dan korosi kering (dry corrosion). Korosi basah terjadi ketika adanya cairan, biasanya melibatkan larutan yang mengandung air atau elektrolit. Contoh yang paling umum adalah korosi pada baja yang disebabkan oleh air. Korosi kering terjadi ketika tidak adanya fasa cair atau ketika di atas titik embun lingkungan. Korosi kering paling sering dihubungkan dengan temperatur tinggi. Contohnya korosi baja pada tungku perapian gas.
2.6.3 Penyebab korosi temperatur tinggi
Adapun penyebab korosi temperatur tinggi yaitu: a. Oksidasi
jumlah oksigen di lingkungannya cukup (jumlah oksigen dalam lingkungan disebut oksigen potensial). Tetapi harus terkontrol dan oksidasinya terbentuk dari senyawa dari unsure-unsur yang menguntungkan.
b. Karburasi dan metal dusting
Terjadi dalam lingkungan yang mengandung CO, CH4 dan gas hidrokarbon
lainnya. Penguraian C ke permukaan logam mengakibatkan penggetasan dan degradasi sifat mekanik lainnya.
c. Nitridasi
Terjadi pada lingkungan yang mengandung ammonia, terutama pada potensial oksigen yang rendah. Penyerapan nitrogen yang berlebihan akan membentuk presipitat nitride di batas butir dan menyebabkan penggetasan.
d. Korosi oleh halogen
Senyawa halide akibat penyerapan halogen oleh logam, dapat bersifat mudah menguap atau mencair pada temperatur rendah. Kenyataan ini menyebabkan perusakan yang sangat parah.
e. Sulfidasi
Terjadi dalam lingkungan yang mengandung bahan bakar atau hasil pembakaran yang mengandung sulfur. Dengan oksigen membentuk SO2 dan
SO3 yang bersifat pengoksidasi yang kurang agresif dibandingkan H2S yang
23
f. Korosi deposit abu dan garam
Deposit dapat mengakibatkan turunnya aktifitas oksigen dan menaikkan aktifitas sulfur, sehingga merusak lapisan pasif dan mempersulit pembentukannya kembali. Deposit biasanya mengandung S, Cl, Zn, Pb dan K. g. Korosi karena logam cair
Terjadi pada proses yang mempergunakan logam cair, misalnya heat treatment dan refining process. Korosi terjadi dalam bentuk pelarutan logam dan oksidanya akan semakin hebat dengan adanya uap air dan oksigen.
2.7 Oksidasi
2.7.1 Pengertian oksidasi
Oksidasi adalah peristiwa yang biasa terjadi jika metal bersentuhan dengan oksigen. Dalam reaksi kimia di mana oksigen tertambahkan pada unsur lain disebut oksidasidan unsur yang menyebabkan terjadinya oksidasi disebut unsur pengoksidasi. Setiap reaksi di mana oksigen dilepaskan dari suatu senyawa merupakan reaksi reduksi dan unsur yang menyebabkan terjadinya reduksi disebut unsur pereduksi.
elektron dari materi yang bereaksi. Jika satu materi kehilangan elektron, materi ini disebut teroksidasi. Jika satu materi memperoleh elektron, materi ini disebut tereduksi.
Dalam reaksi redoks, satu reagen teroksidasi yang berarti menjadi reagen pereduksi dan reagen lawannya terreduksi yang berarti menjadi reagen pengoksidasi. Kecenderungan metal untuk bereaksi dengan oksigen didorong oleh penurunan energi bebas yang mengikuti pembentukan oksidanya. Lapisan oksida di permukaan metal bisa berpori (dalam kasus natrium, kalium, magnesium) bisa pula rapat tidak berpori (dalam kasus besi, tembaga, nikel).
2.7.2 Penebalan lapisan oksida
Pada umumnya lapisan oksida yang terjadi di permukaan metal cenderung menebal. Berikut ini beberapa mekanisme yang mungkin terjadi, antara lain : a. Jika lapisan oksida yang pertama terbentuk adalah berpori, maka molekul
25
Gambar 2.3. Lapisan oksida berpori.
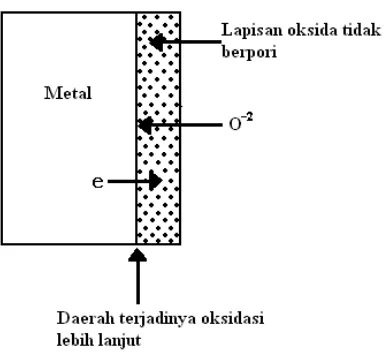
Gambar 2.4. Lapisan oksida tidak berpori
Jika lapisan oksida tidak berpori, ion oksigen dapat berdifusi menuju bidang batas metal-oksida dan bereaksi dengan metal dibidang batas metal-oksida. Elektron yang dibebaskan dari permukaan logam tetap bergerak ke arah bidang batas oksidaudara. Proses oksidasi berlanjut di perbatasan metal-oksida. Ion oksigen berdifusi menembus oksida, elektron dari metal ke permukaan oksida
[image:38.612.226.422.500.676.2]27
Mekanisme lain yang mungkin terjadi adalah gabungan antara b) dan c) di mana ion metal dan elektron bergerak ke arah luar sedang ion oksigen bergerak ke arah dalam. Reaksi oksidasi bias terjadi di dalam lapisan oksida. Terjadinya difusi ion, baik ion metal maupun ion oksigen, memerlukan koefisien difusi yang cukup tinggi. Sementara itu gerakan elektron menembus lapisan oksida memerlukan konduktivitas listrik oksida yang cukup tinggi pula. Oleh karena itu jika lapisan oksida memiliki konduktivitas listrik rendah, laju penambahan ketebalan lapisan juga rendah karena terlalu sedikitnya elektron yang bermigrasi dari metal menuju perbatasan oksida-udara yang diperlukan untuk pertukaran elektron dalam reaksi.
2.8 Oksidasi pada temperatur tinggi
Pada tingkat hukum parabola, laju oksidasi temperatur tinggi pada logam sering mengikuti hukum laju parabolik, yang memerlukan ketebalan oksida (x), propotional ke waktu ( t) yaitu,
x2 = kpt………(1) Di mana kp dikenal sebagai konstanta laju parabolik.
Penebalan lapisan oksida dapat pula didapat dari persamaan di bawah ini:
x = 2……….(2)
Dimanaμ ∆w = berat specimen setelah oksidasi (mg)
A0 = luas permukaan awal spesimen (mm2)
[image:40.612.149.445.373.629.2]
Gambar 2.6. Kurva penambahan berat terhadap waktu pada hukum kinetika untuk oksidasi logam.
29
2.9 Kinetika Oksidasi
Perubahan energi bebas menunjukkan kemungkinan produk reaksi stabil, tetapi tidak meramalkan laju pembentukan produk. Selama oksidasi, molekul oksigen pertama yang di absorpsi permukaan logam berdisosiasi menjadi komponen atom sebelum membentuk ikatan kimia dengan atom permukaan logam, proses ini disebut kemisorpsi. Setelah terbentuk beberapa lapisan adsorpsi, oksida bernukleasi secara epitaksial pada butir logam induk di lokasi yang diutamakan, seperti dislokasi dan atom pengotor. Setiap daerah nukleasi tumbuh, merasuk satu dengan lainnya sehingga terbentuk lapisan tipis oksida di seluruh permukaan. Oleh karena itu oksida biasanya terdiri dari agregat butir individu atau kristal dan menampakkan gejala seperti rekristalisasi, pertumbuhan butir, creep mencakup cacat kisi, mirip dengan yang terjadi pada logam.
Pertumbuhan lapisan oksida dapat diikuti dengan keseimbangan termal memiliki kepekaan hingga 10-7 g, dan pengurangan dilakukan di lingkungan pada temperatur yang dikendalikan dengan teliti. Teknik metalografi yang paling sering diterapkan adalah elipsometri, yang bergantung pada perubahan di bidang polarisasi berkas cahaya terpolarisasi yang terpantulkan oleh permukaan oksida, sudut rotasi bergantung tebal oksida. Selain itu juga digunakan interferometri, tetapi kini lebih sering dipakai replika dan lapisan tipis di mikroskop transmisi elektron dan mikroskopik scanning elektron. Laju penebalan oksidasi bergantung pada temperatur dan material.
Selama tahap awal pertumbuhan pada temperatur rendah, karena atom oksigen mendapatkan elektron dari atom permukaan logam, terbentuk medan listrik yang kuat pada lapisan tipis oksida, medan ini menarik atom logam melalui oksida. Pada rentang temperatur yang rendah ini (untuk Fe dibawah 200oC) ketebalan bertambah
secara logaritmik dengan waktu (x ∞ Ln t) dan laju oksidasi turun dengan
berkurangnya kekuatan medan.
31
sering sekali dialami lapisan oksida pelindung retak dan lepas. Pengelupasan berulang yang terjadi pada skala kecil menghalangi pertumbuhan parabolik yang lebih luas dan oksidasi memiliki laju linier bahkan lebih cepat. Tegangan dalam lapisan oksida berkaitan dengan rasio pilling-bedworth (P-B), yaitu rasio volume molekuler oksida terhadap volume atomik logam yang membentuk oksida. Apabila rasio lebih kecil dari satu seperti untuk Mg, Na, K oksida yang terentuk mungkin tidak memberikan perlindungan yang memadai terhadap oksidasi selanjutnya, sejak tahap awal dan dengan kondisi seperti ini yang lazim dijumpai pada logam-logam alkali, diikuti
hubungan oksidasi linear (x ∞ t). Namun, apabila rasio P-S jauh lebih besar dari satu, seperti pada logam transisi, oksida terlalu tebal dan pengelupasan cenderung terjadi.
Pada temperatur tinggi, lapisan bertambah sesuai hukum laju parabolik (x2∞ t). cacat titik berdifusi melalui oksida karena terdapat gradient konsentrasi yang konstan. Cacat ditiadakan pada salah satu antar muka dan terjadi pembentukan lokasi kisi yang baru. Khususnya seng oksida bertambah tebal karena difusi Intertisi seng yang terbentuk di antar muka logam oksida melalui oksida menuju antar muka oksida logam dan disini menghilang karena reaksi:
2Zni++ + 4e + O2 2ZnO
Konsentrasi intertisi seng pada antar muka logam/oksida dipertahankan oleh reaksi:
Zn(logam) Znj++ + 2e
wajar untuk mengasumsi bahwa konsentrasi kedua spesies yang bermigrasi adalah konstan pada kedua permukaan oksida, yaitu permukaan oksida/gas dan oksida logam, konsentrasi dikendalikan oleh kesetimbangan termodinamika setempat, jadi
melintasi oksida terdapat perbedaan konsentrasi konstan ∆c dan laju transportasi melalui satuan luas D∆c/x, dimana D adalah koefisien difusi dan ∆W adalah tebal
lapisan. Maka laju pertumbuhan:
Dx/dt = D∆c/x……….(3) Dan penebalan lapisan bertambah secara parabolik sesuai hubungan
∆W2 = kpt………(4)
∆W = W1-W0………..(5)
Dimana : kp = konstanta parabolik
W0 = berat awal spesimen
W1 = berat akhir spesimen
33
Pada temperatur rendah dan untuk lapisan oksida yang tipis, berlaku hukum logaritmik. Apabila tebal kerak bertambah mengikuti hukum parabolik, resultan tegangan yang terjadi pada antar muka bertambah dan akhirnya lapisan oksida mengalami kegagalan perpatahan sejajar dengan antar muka atau mengalami perpatahan geser atau pematahan tarik melalui lapisan. Di daerah ini laju oksidasi meningkat sehingga terjadi peningkatan yang kemudian berkurang lagi akibat perpatahan lokal di kerak oksida. Laju oksidasi yang bersifat parabolik berubah menjadi rata dan laju oksidasi mengikuti hukum liniear. Perubahan seperti ini disebut paralinear dan biasanya dijumpai pada oksidasi titanium setelah oksida mencapai ketebalan kritis[M. Daud Pinem, 2005]
2.10 SEM (scanning electron microscopy)
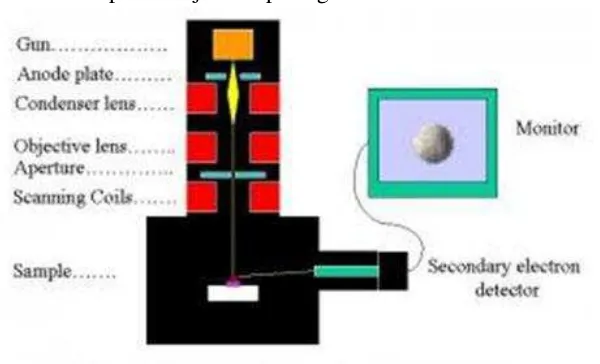
[image:45.612.254.388.467.628.2]Peralatan SEM ini dapat ditunjukkan seperti pada gambar di bawah ini :
Gambar 2.7. Alat uji SEM
SEM merupakan alat yang digunakan untuk mengkarakterisasi nanomaterial. Beberapa hal yang dikarakterisasi yaitu permukaan material tersebut. Jadi, setelah material diamati dengan SEM ini maka akan diperoleh bagaimana bentuk permukaan material tersebut. Pada SEM, permukaan material ditembaki dengan berkas elektron berenergi tinggi. Elektron berenergi tinggi ini memiliki panjang gelombang yang sangat pendek yang bersesuaian dengan panjang gelombang de Broglie. Proses ini mengakibatkan adanya elektron yang dipantulkan atau dihasilkannya elektron sekunder. Elektron yang dipantulkan diterima oleh detektor. Lalu hasil yang diterima diolah oleh program dalam komputer. Ada beberapa syarat pada material yang dikarakterisasi dengan SEM ini. Seperti yang dijelaskan sebelumnya bahwa detektor mendeteksi elektron yang dipantulkan atau electron sekunder yang dihasilkan oleh material, maka sifat ini dimiliki oleh material yang berjenis logam. Jika material yang bersifat isolator dikarakterisasi dengan SEM, maka hasilnya akan kabur dan mungkin akan hitam.
35
[image:47.612.155.455.97.279.2]Skema dari SEM dapat ditunjukkan pada gambar berikut :
Gambar 2.8. Skema alat uji SEM
Pengkarakterisasian dengan SEM ini tidak boleh terlalu lama. Karena berkas elektron energi tinggi yang digunakan akan menyebabkan atom-atom material menjadi terlepas sehingga material akan menjadi rusak.
2.11 XRD (X-ray Difraction)
Spektroskopi difraksi sinar-X (X-ray difraction/XRD) merupakan salah satu metoda karakterisasi material yang paling tua dan paling sering digunakan hingga sekarang. Teknik ini digunakan untuk mengidentifikasi fasa kristalin dalam material dengan cara menentukan parameter struktur kisi serta untuk mendapatkan ukuran partikel. XRD terdiri dari slit dan film serta monokromator.
hamburan (2θ). Hamburan sinar-x berasal dari atom-atom yang membentuk bidang kisi kristal dari cuplikan yang diamati.
Difraksi sinar-X terjadi pada hamburan elastis foton-foton sinar-X oleh atom dalam sebuah kisi periodik. Hamburan monokromatis sinar-X dalam fasa tersebut memberikan interferensi yang konstruktif. Dasar dari penggunaan difraksi sinar-X untuk mempelajari kisi kristal adalah berdasarkan persamaan Braggμ n. = 2.d.sinθ ; n
= 1,2,... Dengan adalah panjang gelombang sinar-X yang digunakan, d adalah jarak
antara dua bidang kisi, θ adalah sudut antara sinar datang dengan bidang normal, dan
n adalah bilangan bulat yang disebut sebagai orde pembiasan.
BAB III
METODOLOGI PENELITIAN
3.1Tempat Penelitian
Penelitian ini dilakukan di beberapa tempat sebagai berikut:
1. Proses pembuatan spesimen dan proses oksidasi dilakukan di laboraturium Material Teknik, Jurusan Teknik Mesin Universitas Lampung.
2. Proses pengujian OM dilakukan di Institut Teknologi Bandung (ITB), Bandung.
3. Proses pengujian SEM / EDS dilakukan di Balai Besar Keramik (LIPI) Serpong, Tangerang.
4. Proses pengujian XRD dilakukan di Universitas Islam Negeri (UIN) Syarif Hidayatullah Ciputat, Tangerang.
3.2Alat dan Bahan
Adapun bahan yang digunakan pada penelitian ini adalah: 1. Baja AISI 4130
Adapun alat yang digunakan dalam penelitian ini adalah: 1. Tungku (Furnace)
Digunakan untuk proses hot dip aluminium dan proses oksidasi. 2. Mesin Gerinda
Digunakan untuk memotong dan menghaluskan spesimen uji.. 3. Mistar dan Jangka Sorong
Digunakan untuk membantu dalam pengukuran spesimen uji. 4. Mesin Bor
Digunakan untuk melubangi spesimen uji. 5. Kawat Stainless
Digunakan untuk menggantung spesimen uji.
3.3Prosedur Penelitian
Adapun prosedur kerja pada penelitian ini yaitu: 1. Persiapan Spesimen Uji
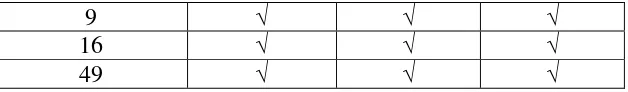
[image:50.595.152.472.663.750.2]Pada penelitian ini dilakukan dalam dua bagian, dengan uraian sebagai berikut: Bagian pertama pada pencelupan 16 detik dengan variasi waktu oksidasi ½ jam sampai 49 jam. Bagian kedua dengan variasi waktu celup 3 detik, 5 detik, 9 detik, 12 detik dan 16 detik.
Tabel 3.1. Jumlah spesimen yang digunakan pada bagian pertama untuk masing-masing pengujian.
Pengujian (jam)
X-RD SEM/EDS OM
1/2 √ √ √
1 √ √ √
39
9 √ √ √
16 √ √ √
[image:51.595.157.471.84.130.2]49 √ √ √
Tabel 3.2. Jumlah spesimen yang digunakan pada bagian kedua untuk masing-masing pengujian.
Pengujian (detik)
SEM/EDS OM
3 √ √
5 √ √
9 √ √
12 √ √
16 √ √
2. Pemotongan Spesimen Uji
Pemotongan spesimen uji ini dilakukan dengan menggunakan gergaji besi. Dengan ukuran spesimen 20 mm x 10 mm x 2 mm. Spesimen dilubangi dengan mesin bor diameter 1 mm untuk digantung dengan kawat stainless steel.
3. Cleaning
Yang dimaksud dengan cleaning yaitu pembersihan permukaan logam yang bertujuan untuk menghilangkan kotoran dan membentuk struktur permukaan spesimen yang baik. Dalam hal ini ada beberapa proses yang dilakukan antara lain:
a. Proses Polishing
Pencucian lemak dengan menggunakan etanol dimaksudkan agar benda kerja bebas dari lemak atau minyak yang dapat mengganggu daya rekat hasil pelapisan.
c. Proses Pembilasan
Proses pembilasan dengan menggunakan air yang berfungsi untuk menghilangkan sisa-sisa etanol yang masih ada pada permukaan benda kerja.
4. Pickling
Proses pickling adalah proses pembersihan material setelah proses cleaning dengan menggunakan bahan kimia yang mengandung asam.
Dalam hal ini ada beberapa proses yang dilakukan antara lain :
- Pencucian dengan 5 % NaOH dan 15% H3PO4.
Proses pencucian dilakukan pada permukaan benda kerja yang masih mengandung lemak atau minyak. Merendam benda kerja kedalam larutan NaOH+H3PO4+air
dengan perbandingan 1 : 1 : 1 (dalam volume).
5. Fluxing
41
6. Dipping
[image:53.595.118.503.303.526.2]Proses dipping adalah proses akhir yang dilaksanakan dengan mencelupkan baja kedalam Al cair. Pada penelitian ini dilakukan dalam dua bagian yaitu pada bagian pertama pada pencelupan 16 detik dengan variasi waktu oksidasi 1/2 jam, saampai 49 jam. Pada bagian kedua Bagian kedua dengan variasi waktu celup 3 detik, 5 detik, 9 detik, 12 detik dan 16 detik.
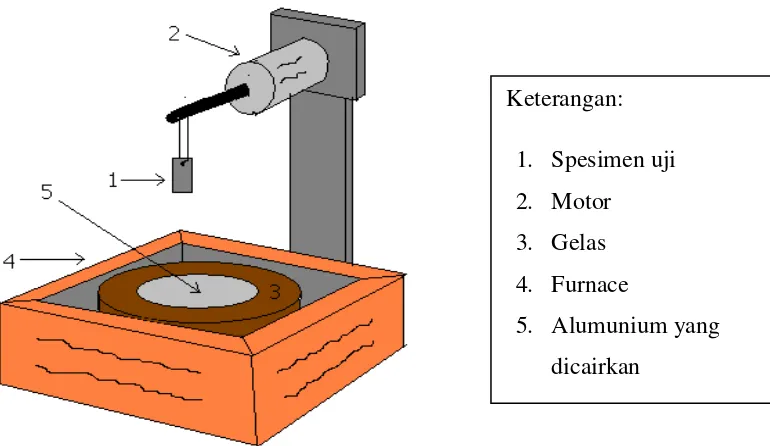
Gambar 3.1. Ilustrasi sederhana pada proses dipping
7. Proses pendinginan (cooling)
Proses ini adalah proses pendinginan material yang telah melalui proses dipping dengan cara mencelupkan ke dalam air agar lapisan logam yang melapisi segera mendingin.
Keterangan: 1. Spesimen uji 2. Motor 3. Gelas 4. Furnace
3.4Diagram Alir
Gambar 3.2. Diagram alir penelitian Mulai
Persiapan bahan baja paduan rendah
Proses hot dipping
Pengujian oksidasi
SEM/EDS
Simpulan dan Saran Analisa data dan pembahasan
Selesai
OM X-RD
Analisa Sampel Studi literatur dan
survey
BAB V
SIMPULAN DAN SARAN
5.1. SIMPULAN
Beberapa simpulan yang dapat diambil dari hasil penelitian ini adalah:
1. Ketebalan lapisan Al dan lapisan Fe-Al meningkat seiring dengan lamanya waktu pencelupan pada proses hot dip aluminium.
2. Laju kinetika oksidasi baja AISI 4130 yang dilapisi Al yaitu sekitar 6.74 × 10-12 mg2 cm-4 s-1 pada range waktu 7-210 menit, sedangkan pada range waktu 340-527 menit mengalami penurunan laju kinetika oksidasi sebesar satu order. Hal ini dikarenakan pembentukan lapisan protektif Al2O3 yang
berperan dalam mengontrol laju difusi anion oksigen ke dalam lapisan FeAl.
3. Lapisan alumina yang terbentuk pada permukaan baja AISI 4130 dapat meningkatkan ketahanan oksidasi pada temperatur 850 °C melalui pembentukan lapisan protektif α−Al2O3.
5.2. SARAN
Perlu dilakukan penelitian untuk baja AISI 4130 Al- coated yang dioksidasi dalam lingkungan yang mengandung NaCl dan Na2SO4 pada temperatur dan
DAFTAR PUSTAKA
Amanto, H. dan Daryanto, 1999. Ilmu Bahan. Jakarta, Bumi Aksara
Amstead, B.H., 1993. Teknologi Mekanik. Jakarta, Erlangga
Andi E.P., Allan T., Salazar N., Julmar S., Haun S., dan Toralde, 2010. Corrosion control in geothermal aerated fluids drilling projects in Asia Pasific, Proceeding World Geothermal Congress 2010, Bali, Indonesia.
ASM International, 1993. ASM handbook vol.1:329
Badaruddin M., 2010. Effect of water vapour on the high temperature oxidation of low carbon steel and hot-dip aluminized steel, Ph.D thesis, National Taiwan University of Science and Technology, Taiwan.
Bye GC, Simpkin GT. Influence of Cr and Fe on formation of Al2O3 from -Al2O3. J. Am Ceram Soc 1974;57:367 4.
Cedric N. H., 2005. Factors Affecting Cost Geothermal Power Development, the Geothermal Energy Association for the U.S. Department of Energy.
Davis, Troxell, dan Hauck. 1998. The Testing of Engineering Materials. Edisi 4. Penerbit Mc Graw Hill. New York.
Dorota Bankiewicz, Patrik Yrjas, and Mikko Hupa, 2009. High temperature corrosion of superheater tube materials exposed to zinc salts, Energy & Fuels, Vol. 23, pp. 3469-3474.
Erlindo C. Angcoy, Jr., Archibald L. Abarquez, Romeo P. Andrino, Garry F. Canete, Melvin D. Liedo, Cristine H. Siega and Ruperto R. villa, Jr., 2010. Mechanisms of Erosion-Corrosion in Well 311D, South Sambaloran, Leyte Geothermal Production Field, Proceedings World Geothermal Congress 2010, Bali, Indonesia.
Fontana, M.G., 1986. Corrosion Engineering, 3rd edition. McGraw-Hill Book Company, New York.
Gambrell, J.W. 1992. Surface Engineering ASM Handbook volume 5. ASM International.
http://www.unm.edu/~cmem/nano/facilities/pics/SEM-5200.png. Diakses pada 14 Juni 2012.
Iulian S., Oana S., Ludovic G., Mioara S. and Georgeta G., 2010. Control of corrosion and scaling in selected geothermal wells from Romania, Proceedings World Geothermal Congress 2010, Bali, Indonesia.
Martinod A., Euvrard M., Foissy A., Neville A., 2008. Progessing Understanding of chemical inhabitation of mineral scale by green inhibitors, Desalination, Vol. 220, pp. 345-352.
Perez F.J., Hierro M.P., Trilleros J.A., Carpintero M.C., Sanchez L., and Bolivar F.J., 2006. Aluminium and aluminium/silicon coating and ferritic steels by CVD-FBR technology, Materials Chemistry and Physics, Vol. 97, pp. 50-58.
Pinem, M. Daud. 2005. Korosi dan Rekayasa Permukaan. Politeknik Negeri Medan, Medan. Diakses pada 7 Februari 2012.
Qiao, L, Yang Liang Huang, 1998. Stress Corrosion Cracking of AISI 321 Stainless Steel In Acidic Chloride Solution. J. Material Science, Vol. 25, pp. 47-51.
Quadakkers WJ, Naumenko D, Wessel E, Kochubey V, Singheiser L. Growth rates of alumina scales on Fe Cr Al alloys.Oxid Met 2004;61:17 20.
Ravindra, K., Tewari, V.K., Prakash, S., 2007. Studies on hot corrosion of the2.25 Cr-1Mo boiler tube steel and its weldments in the molten salt Na2SO4 -60 pct V2O5 environment, Metallurgical and Materials Transaction A, Vol. 28, pp. 24-27.
Sack, Raymond J. 1997. I”Welding: Principles and Prantices”. Mc Graw Hill. USA
Suharno, 2007. Potensi energi listrik pada prospek panas bumi Ile Angin-Ile Padung, Nusa Tenggara Timur. Prosiding seminar hasil Program Pengembangan Diri Bidang MIPA.
Wang, C.J., Badaruddin M., 2010. The dependence of high temperature resistance of aluminized steel exposed to water-vapour oxidation, Surface Coating Technology. Vol. 205, pp. 1200-1205.
Wiryosumarto, H dan Okumura, T. 2004. Teknologi Pengelasan Logam. Cetakan 9. Penerbit Pradnya Paramita. Jakarta.
Furnace dari batu tahan api (fire brick)
Proses Oksidasi Temperatur Tinggi
Komponen dalam control panel box
Proses penimbangan/weighing spesimen