Ekstraksi dan Karakterisasi Pektin Dari Limbah Kulit Pisang Uli
(Musa paradisiaca
L. AAB)
SKRIPSI
Syukron Maulana
NIM: 108102000068
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
Ekstraksi dan Karakterisasi Pektin Dari Limbah Kulit Pisang Uli
(Musa paradisiaca
L. AAB)
SKRIPSI
Diajukan untuk memenuhi syarat gelar Sarjana Farmasi (S.Far)
Syukron Maulana
NIM: 108102000068
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
v (Musa paradisiaca L. AAB)
Indonesia merupakan negara penghasil pisang terbesar se Asia. Salah satu jenis pisang yang menjadi makanan favorit diantaranya ialah pisang uli, dan merupakan salah satu jenis pisang yang banyak dikonsumsi masyarakat indonesia. pemanfaatannya sebagai bahan makanan olahan maupun langsung menghasilkan limbah kulit pisang yang melimpah. Kulit pisang selain digunakan untuk pakan ternak, dapat juga diambil kandungan pektin yang ada di dalamnya. Penelitian ini bertujuan untuk mengetahui karakteristik pektin yang dihasilkan dari limbah kulit pisang uli.Proses ekstraksi dilakukan menggunakan HCl untuk kemudian dilakukan perendaman menggunakan etanol 96%. Adapun variable waktu ekstraksi yang digunakan adalah 70 dan 80 menit. Parameter yang dianalisa adalah bobot pektin, kadar air, kadar abu, berat ekivalen, kadar metoksil, kadar galakturonat dan derajat esterifikasi.Hasil penelitian menunjukkan bahwa hasil yang paling optimum didapat dari variabel waktu ekstraksi 80 menit dengan rincian; bobot pektin 2,45 gram; kadar air 9,58%; kadar abu 0,38%; berat ekivalen 3.642,191; kadar metoksil 3,20%; kadar galakturonat 72,95% serta derajat esterifikasi 24, 96%
vi peel (Musa paradisiaca L. AAB)
Indonesia is the largest banana producer in Asia. One type of banana which favorite food is Uli, and one of many types of bananas ore consumed by indonesia people. It’s used as a food ingredient or directly processed. It’s usage could produce abundant waste banana peel. Banana peel just used for animal feed, may also be taken pectin content in it. This study aims to determinate the characteristic of pectin produced from Uli banana peel .The extraction process is done using HCl for later immersion using 96% ethanol. As for variable extraction time used was 70 and 80 minutes. The parameters analyzed were weight pectin, moisture content, ash content, equivalent weight, methoxyl content, galakturonat levels and the degree of esterification.The result showed that the most optimum result obtained from the variable extraction time of 80 minutes with the details; weight of 2,45 grams pectin; 9,58% moisture content; 0,38% of ash content; equivalent weight of 3.642,191; 3,20% metoksil level; 72,95% galakturonat levels and 24, 96% the degree of esterification
vii
kehadirat Allah SWT atas segala nikmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Shalawat serta salam senantiasa tercurahkan kepada junjungan Nabi Besar Muhammad SAW yang telah membawa cahaya petunjuk dan menjadi suri tauladan bagi umat manusia, semoga kelak kita semua mendapat syafaat beliau.Amin ya robbal’alamin
Skripsi dengan judul “Ekstraksi dan karakterisasi pektin dari kulit pisang uli (Musa paradisiaca L. AAB)” ini disusun dalam rangka memenuhi salah satu syarat menempuh ujian akhir untuk memperoleh gelar sarjana farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Penulis menyadari begitu banyak bantuan dari berbagai pihak yang telah meluangkan waktunya, mendidik serta membimbing sejak masa perkuliahan sampai pada proses penelitian dan penyusunan skripsi ini. Pada kesempatan ini, penulis ingin menyampaikan penghargaan setinggi-tingginya dan rasa terima kasih yang sebesar-besarnya kepada :
1. Bapak Dr. Arif Sumantri, S.KM., M.Kes., selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. Bapak Yardi, Ph.D, Apt. selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta
3. Bapak Supandi M.Si, Apt. selaku Dosen Pembimbing Pertama yang telah menyediakan waktu, tenaga, dan pikiran dalam menuntun penulis dalam penyusunan skripsi ini.
4. Ibu Lina Elfita M.Si, Apt. selaku Dosen Pembimbing Kedua yang telah sabar dalam memberikan arahan kepada penulis dalam menyelesaikan skripsi ini.
5. Segenap Dosen Farmasi UIN yang telah memberikan ilmu, pengalaman serta wawasannya kepada penulis selama menempuh pendidikan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
viii
8. Orangtua, kakak, adik dan keluarga besar yang selalu memberi dukungan, semangat dan doa kepada penulis.
9. Rekan seperjuangan Teguh Priyanto, Muhamad Luqmanul Hakim, Adam Dzulfaqih Amry yang telah bersama dalam suka dan duka mengejar kelulusan. Sahabat-sahabat Jidin Abdullah, Muhammad Farhan, Ahmad Ziaul Fitrahuddin, Ludi Mauliana, Ali Aridhi, Muhamad Khairul Anwar dll, yang telah memberikan dukungan dan dorongan sehingga saya bersemangat dan bisa menyelesaikan tugas akhir ini.
10. Teman-teman seangkatan Farmasi 2008 yang telah menempuh pendidikan bersama selama empat tahun, Semoga semangat dan kesuksesan bersama-sama dengan kita semua.
11. Semua pihak yang tak bisa disebutkan satu persatu yang telah membantu kelancaran pembuatan skripsi, Saya ucapkan terimakasih.
Saya menyadari bahwa dalam makalah skripsi ini masih terdapat banyak
kekurangan. Oleh karena itu, saya mengharapkan kritik dan saran yang
membangun sehingga dapat menyempurnakan skripsi ini dan melaksanakan
perbaikan di masa yang akan datang. Semoga tulisan ini dapat bermanfaat bagi
para pembaca dan bagi dunia pendidikan dan ilmu pengetahuan.
Ciputat, 13 Juli 2015
xi
BAB III METODOLOGI PENELITIAN ...24
3.1 waktu dan Tempat Penelitian...24
BAB IV HASIL DAN PEMBAHASAN ... ...29
4.1 Bahan Baku...29
4.1.1 Penentuan Bahan Baku... 29
4.1.2 Determinasi Tanaman Bahan Baku ...29
4.1.3 Persiapan Bahan Baku ...30
4.2 Produksi Pektin ...31
4.3 Identifikasi Kualitatif Pektin...34
4.4 Karakterisasi Pektin Hasil Ekstraksi ...35
xii
xiii
Tabel 2.1. Berbagai Jenis Pisang Berdasarkan Genom...4
Tabel 2.2. Kandungan Buah Pisang ...5
Tabel 2.3. Kandungan Asam Amino Kulit Pisang...9
Tabel 2.4. Komposisi Pektin pada Berbagai Sayuran dan Buah... 15
Tabel 2.5. Standar Mutu Pektin ...17
Tabel 2.6. Spesifikasi Pektin Berdsarkan Farmakope V...18
Tabel 4.1. Komposisi Nutrien Kulit Pisang ...30
Tabel 4.2. Pemerian Pektin Hasil Ekstraksi ...34
xiv
Gambar 2.2. Stuktur Pektin (Faridaet al.,2012) ...13
Gambar 4.1 Diagram Bobot Pektin...36
Gambar 4.2 Diagram Kadar Air Pektin ...37
Gambar 4.3 Diagram Kadar Abu Pektin ...38
Gambar 4.4 Diagram Berat Ekivalen Pektin ...39
Gambar 4.5 Diagram Kadar Metoksil Pektin ...41
Gambar 4.6 Diagram Kadar Galakturonat Pektin ...42
xv
Lampiran 2. Alur Kerja Penelitian ... 53
Lampiran 3. Dokumentasi Proses Ekstraksi Pektin ... 54
Lampiran 4. Gambar Alat yang Digunakan ... 55
Lampiran 5. Perhitungan Pembakuan Larutan Titran NaOH ... 56
Lampiran 6. Contoh Perhitungan Kadar Air Pektin . . . 5 7 Lampiran 8. Contoh Perhitungan Kadar Abu Pektin ... 58
Lampiran 9. Contoh Perhitungan Berat Ekivalen... 59
Lampiran 10. Contoh Perhitungan Kadar Metoksil ... 60
Lampiran 11. Contoh Perhitungan mEq NaOH ... 61
Lampiran 12. Contoh Perhitungan Kadar Galakturonat ... 62
Lampiran 13. Contoh Perhitungan Derajat Esterifikasi ... 63
Lampiran 14. Bobot Pektin Hasil Ekstraksi ... 64
Lampiran 15. Kadar Air Pektin...65
Lampiran 16. Kadar Abu Pektin ... 66
Lampiran 17. Penentuan Berat Ekivalen Pektin ... 67
Lampiran 18. Penentuan Kadar Metoksil Pektin ... 68
1
1. 1 Latar Belakang Masalah
Pisang (Musa sp) merupakan tanaman yang berasal dari Asia Tenggara dan memberikan kontribusi yang sangat penting pada industri buah di Asia khususnya di Asia Tenggara. Di Indonesia pisang merupakan buah yang sangat penting dan menduduki ranking pertama baik dalam luas, volume produksi (Subijanto, 1990) serta memiliki peluang ekspor yang terbuka lebar mengingat jenis pisang Indonesia cukup digemari dan tidak kalah penting dengan pisang luar negeri (Rukmana, 1989). Pada tahun 2010, produksi pisang di Indonesia mencapai 5,8 juta ton atau sekitar 30% dari produksi buah nasional (Kuntarsih, 2012).
Pemanfaatan buah pisang selain dikonsumsi langsung sebagai buah, juga dapat dimanfaatkan sebagai keripik pisang, selai kripik, pembuatan tepung dan dibuat berbagai olahan bahan makanan yang lezat seperti pisang goreng, kue pisang, agar-agar pisang dan lain sebagainya, dan salah satu dari pisang tersebut ialah Pisang Uli.
Pisang Uli merupakan salah satu jenis pisang raja yang sangat cocok diolah menjadi berbagai sajian menu karena mampu mempertahankan rasa manis ketika telah diolah menjadi berbagai macam sajian. Para penjual pisang goreng pun mayoritas menggunakan piang jenis ini dikarenakan harganya yang terjangkau, mudah didapat serta banyak disukai oleh masyarakat karena rasanya yang enak.
Penanganan limbah kulit pisang secara profesional hingga saat ini membutuhkan biaya yang tidak sedikit sehingga perlu dicarikan jalan keluarnya. Limbah kulit pisang memiliki prospek yang amat baik sebagai sumber bahan baku pembuatan pektin jika diolah dengan menggunakan teknologi yang relatif sederhana.
Pektin sendiri merupakan bahan pangan fungsional bernilai tinggi yang berguna secara luas dalam pembentukan gel dan bahan-bahan penstabil pada sari buah, bahan pembuat jeli, selai dan marmalade (Willat, 2006). Pektin secara komersial umumnya diperoleh dengan cara ekstraksi menggunakan larutan asam dari bagian albedo kulit jeruk atau ampas apel dengan cara pemurnian dan isolasi yang berbeda-beda (Herbstreith and Fox, 2005).
Hingga tahun 2011, seluruh pektin yang digunakan pada industri-industri Indonesia merupakan barang impor. Jumlah impor pektin cukup besar, yaitu lebih besar dari 100 ton pertahun dan harganya sangatlah mahal, membuat biaya impor pektin berdampak terhadap pengurangan devisa negara yang besar pula (Sofia, 2012).
Dalam usaha mengurangi impor pektin, dikaji beberapa kemungkinan untuk mencari sumber bahan baku pektin yang diduga memiliki potensi untuk dikembangkan, dan salah satunya menggunakan limbah kulit Pisang Uli, mengingat kulit Pisang Uli belum pernah diteliti mengenai kandungan pektin di dalamnya
1.2 Rumusan Masalah
Ditinjau dari latar belakang masalah diatas, maka dapat ditentukan
rumusan masalah berupa:
1. Apakah kulit Pisang Uli dapat dimanfaatkan sebagai bahan baku
pembuatan pektin dengan cara ekstraksi menggunakan HCl
2. Bagaimanakah karakteristik pektin yang dihasilkan dan apakah kualitas
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan data karakteristik pektin yang dihasilkan dari ekstraksi limbah kulit Pisang Uli menggunakan asam klorida dengan variasi waktu ekstraksi
1.4 Manfaat Penelitian
4
2.1. Pisang
2.1.1. Deskripsi Tanaman Pisang
Tanaman pisang tergolong famili Musaceae yang termasuk kedalam genus Musa dengan 2 spesies liar yaitu Musa acuminata Colla dan Musa Balbisiana Colla (Simmonds, 1996). Persilangan keduanya menghasilkan keturunan yang memiliki tingkat ploidi yang beragam. Pisang budidaya yang diturunkan secara murni dari spesies Musa acuminata diberi simbol AA, yang triploid diberi simbol AAA dan tetraploid AAAA. Adapun hasil persilangan
Musa acuminata dan balbisiana yang triploid diberi simbol AAB atau ABB. Pisang Musa acuminata (AA) enak dimakan, sedangkan pisang Musa balbisiana (BB) tidak enak dimakan dan selalu berbiji (Simmonds & Shepherd, 1995)
Tabel 2.1. Berbagai Jenis Pisang Berdasarkan Genom (Valmayor et,al, 1991)
Spesies, Genom Nama Lokal
Musa acuminata
(pisang meja dan olahan )
(cavendish )
(non cavendish) Pisang Ambon Kuning Pisang Susu (non plantain) Pisang Uli
Musa x paradisiaca
Manfaat buah pisang bagi kesehatan cukup potensial, karena pisang termasuk ke dalam buah yang mengandung gizi lengkap. Menurut ilmuan dari Universitas John Hopkins di Amerika Serikat bahwasannya potasium yang terkandung dalam buah pisang sangat membantu dalam proses pemindahan garam dalam tubuh, sehingga dapat cepat menurunkan tekanan dalam darah (Mulyati, 2005)
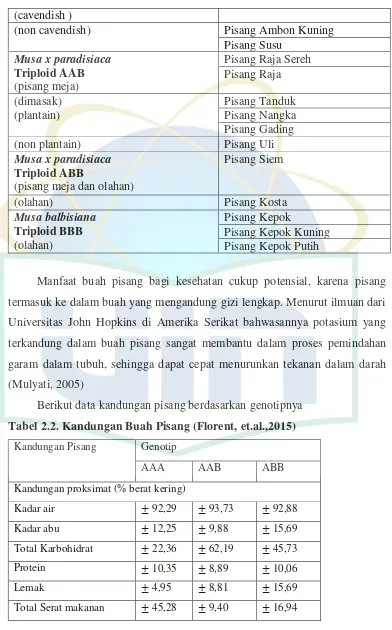
Berikut data kandungan pisang berdasarkan genotipnya Tabel 2.2. Kandungan Buah Pisang (Florent, et.al.,2015)
Kandungan Pisang Genotip
AAA AAB ABB
Kandungan proksimat (% berat kering)
Komposisi makromineral (mg/100g) dataran tinggi dengan ketinggian tidak lebih dari 1.600 m di atas permukaan laut. Suhu optimum untuk pertumbuhan tanaman pisang adalah 27 , dan suhu maksimumnya 38 , dan dengan keasaman tanah (pH) sekitar 4,5-7,5. Curah hujan 2000-2500 mm/tahun atau paling tidak 100 mm/bulan. Apabila suatu daerah mempunyai bulan kering berturut-turut melebihi 3 bulan maka tanaman pisang memerlukan tambahan pengairan agar dapat tumbuh dan berproduksi dengan baik (Badan Penelitian dan Pengembangan Pertanian, 2008).
kompak, tampak seperti batang. Batang semu tanaman pisang bersifat lunak dan banyak mengandung air (Cahyono, 2009)
Akar pohon pisang tumbuh pada umbi batang, berupa akar serabut dan tidak memiliki akar tunggang (Cahyono, 2009). Akar pisang tumbuh menyebar 4-5 m ke arah lateral (menyamping) dan 75-150 cm ke arah pusat bumi tergantung kepada varietasnya (Verheij & Coronel, 1992).
Tunas pisang berbentuk silinder pseudostem dengan pelepah daun yang bertumpuk dan melingkari satu dengan lainnya sehingga menghasilkan gulungan yang keras berdiameter 20-50 cm. Daun yang baru tumbuh mulai dari bagian tengah kumpulan dahan terus menjalar ke atas melewati bagian tengah dari pseudostem dengan helaian daun yang melingkar tebal (Verheij & Coronel, 1992).
Daun pisang yang telah membuka berbentuk seperti bujur mata pisau dengan panjang sekitar 150-400 cm dan lebar 70-100 cm dengan daun yang menempel pada dahannya berbentuk rapih dan urat-uratnya tersusun sejajar (Verheij & Coronel, 1992). Daun pisang memiliki lapisan lilin pada permukaan bagian bawahnya serta tidak memiliki tulang daun pada bagian pinggirnya sehingga daun pisang mudah sekali robek bila terhempas angin (Cahyono, 2009)
Bunga tanaman pisang berbentuk bulat lonjong dengan bagian ujung runcing. Bunga tanaman pisang yang baru muncul, biasa disebut jantung pisang. Bunga tanaman pisang terdiri atas tangkai bunga, daun penumpu bunga atau pelindung bunga (seludang bunga) dan mahkota bunga. Seludang bunga berwarna merah tua, tersusun secara spiral, berlapis lilin dengan ukuran panjang 10-25 cm. Seludang bunga akan rontok setelah bunga mekar. Mahkota bunga berwarna putih dan tersusun melintang sebanyak dua baris. Bunga tanaman pisang berkelamin satu dengan benang sari berjumlah lima buah. Bakal buah berbentuk persegi (Cahyono, 2009)
2.1.2. Klasifikasi Pisang Uli (Verheij, 1992) Kingdom :Plantae
Divisi : Magnoliophyta Kelas : Liliopsida Ordo : Zingiberales Famili :Musaceae Genus : Musa
Spesies : Musa x pradisiaca L. AAB
2.1.3. Karakteristik Pisang Uli
Karakteristik morfologi Pisang Uli diantaranya adalah tinggi pohon mencapai 2 – 2,5 m dengan warna hijau pucat atau kemerah-merahan, panjang daun sekitar 180-200 cm berwarna hijau dengan tangkai daun kadang berwarna merah muda, panjang tandan buah mencapai 1,5-1,7 m, merunduk dan berbulu halus; jantung berbentuk bulat telur, kelopak luar berwarna ungu dan sebelah dalam berwarna merah (Rukmana, 1999).
Gambar 2.1. Pisang Uli (Kuntarsih, 2012)
2.1.4. Kandungan Kimia Kulit Pisang
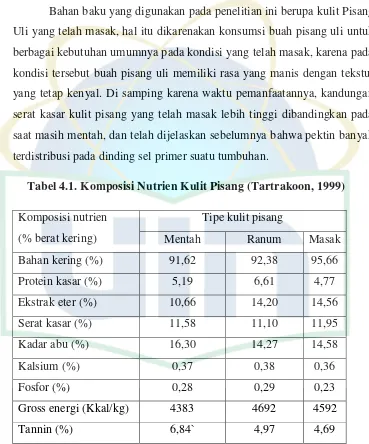
Pada umumnya semua jenis kulit pisang mengandung air, karbohidrat, lemak, protein, kalsium, fosfor, besi, vitamin B dan vitamin C (Munajim, 1984). Selain itu, kulit pisang juga mengandung senyawa bioaktif seperti flavonoid, katekolamin dan dopamin yang berfungsi sebagai antioksidan (Kanazawa, K. & Sakakibara H., 2000). Kulit pisang merupakan sumber mineral yang bagus, khususnya potasium (Anhwage, 2008) dan memiliki kandungan serat sekitar 30% (Happi Emaga et al.,2011). Secara rinci kulit pisang didalamnya terdapat kandungan protein sebesar 10,09%; 18,01% serat kasar; 5,17% lemak; 55, 59% bahan kering; kalsium 0,36%,; fosfor 0,10% dan energi sebesar 3727 kkal/kg (Adlin, 2008) serta mengandung gula berupa glukosa 14,6% dan sukrosa 56% (Goewert & Nicholas, 1980).
Selain kandungan diatas, kulit pisang pun memiliki kandungan asam amino, diantaranya seperti yang tertera pada tabel berikut
Tabel 2.3. Kandungan Asam Amino Kulit Pisang Asam amino * Tipe kulit pisang
Asam glutamat (%) 0,382 0,539 0,454
2.2. Pektin
2.2.1. Senyawa Pektin
Kata pektin berasal dari bahasa latin “pectos” yang berarti pengental atau yang membuat sesuatu menjadik keras/padat. Pektin ditemukan oleh Vauquelin dalam jus buah sekitar 200 tahun yang lalu. Pada tahun 1790, pektin belum diberi nama. Nama pektin pertama kali digunakan pada tahun 1824, yaitu ketika Braconnot melanjutkan penelitian yang dirintis oleh Vauquelin. Braconnot menyebut substansi pembentuk gel tersebut sebagai asam pektat (Herbstreith and Fox, 2005)
Pektin adalah polisakarida kompleks bersifat asam yang terdapat dalam jumlah yang bervariasi, terdistribusi secara luas dalam jaringan tanaman, umumnya terdapat di dalam dinding sel primer dan khususnya di sela-sela antar selulosa dan hemiselulosa. Pada dasarnya semua tanaman yang berfotosintesis tanpa terkecuali mengandung pektin namun dalam jumlah yang berbeda bergantung kepada jenis tanaman dan tingkat kematangannya (McCready, 1965). Pektin dalam sel tumbuhan berperan dalam pertumbuhan, perkembangan, morfogenesis, pertahanan, adhesi sel, pembentuk struktur dinding sel, agen pengenal, pengembang sel, dinding penyerap, perkembangan tabung serbuk sari, pengikat ion, dan perkembangan buah (O’Neill et al.,1990. Willats et al.,2001). Pektin juga berperan dalam memberikan kekuatan dan kelenturan pada jaringan tumbuhan ketika berinteraksi dengan komponen dinding sel yang lain (Carpita and Gibeaut, 1993). Fungsi lain dari Pektin ialah berfungsi sebagai bahan perekat antara dinding sel yang satu dengan yang lainnya (Hasbullah, 2001). Pada dinding sel tanaman, pektin berikatan dengan ion kalsium sehingga memiliki fungsi untuk memperkuat dinding sel (Wang, et. al, 2002)
seperti halnya asam-asam lain dan terdapat dalam jaringan tanaman sebagai kalsium atau magnesium pektat. Asam pektinat yang disebut juga dengan pektin, dalam molekulnya terdapat ester metil pada beberapa gugus karboksil sepanjang rantai polimer dari galakturonat. Bila pektinat mengandung metil ester yang cukup, yaitu sekitar 50% dari seluruh karboksil, maka disebut dengan pektin. Pektin juga dapat membentuk garam yang disebut dengan garam pektinat, dan dalam bentuk garam inilah pektin tersebut berfungsi dalam pembuatan jeli dengan gula dan asam (Winarno, 2004).
Protopektin merupakan istilah untuk senyawa-senyawa pektin yang tidak larut, yang banyak terdapat pada jaringan tanaman yang muda. Bila jaringan-jaringan tanaman ini dipanaskan dalam air yang juga mengandung asam, protopektin dapat berubah menjadi pektin yang mudah terdispersi dalam air (Winarno, 2004).
Asam pektat tersusun dari beberapa elemen struktural, dan yang paling penting diantaranya ialah Homogalakturonan (HG) dan Rhamnogalakturonat tipe I (RG-I) yang sering digambarkan dengan bagian yang halus dan berambut secara berturut-turut. Wilayah HG berisikan ikatan 1 4 dari residu -D-GalA yang dapat termetilasi secara parsial pada gugus C-6 (Pilnik dan Voragen, 1970) dan mungkin sebagian asetil terasterifikasi pada gugus O2 dan O3 (Rombouts dan Thibault, 1986).
Derajat metilasi (DM) dan derajat asetilasi (DAc) didefinisikan sebagai jumlah mol dari metanol atau asam asetat per 100 mol GalA. Derajat metilasi dari pektin alam biasanya berkisar antara 70-80, sedangkan derajat asetilasi biasanya lebih rendah yaitu sekitar 35 untuk gula bit (Rombouts dan Thibault, 1986).
2.2.2. Struktur Kimia Pektin
primer C6 yang memiliki gugus karboksilat (Hart.,et al, 2003) seperti yang
terlihat pada gambar
Gambar 2.2. Stuktur pektin (Farida et al.,2012)
Asam galakturonat memiliki gugus karboksil yang dapat saling berikatan dengan ion atau sehingga berkas-berkas polimer berlekatan satu sama lain. Ini menyebabkan rasa lengket pada kulit (Anonim, 2010)
Pektin berisikan ratusan sampai ribuan unit sakarida yang berada dalam ikatan seperti konfigurasi, hal ini didasarkan kepada bobot molekul yang berkisar antara 50.000 sampai 150.000 dalton. Gula netral juga terdapat dalam untaian pektin ini. Rhamnosa merupakan komponen terkecil dalam untaian inti dan dapat menjadikan rantai untaian pektin yang kusut menjadi lurus, dan gula netral yang lain seperti arabinosa, galaktosa, xylosa juga terdapat pada sisi rantainya (Oakenful, 1991).
Molekul pektin tidaklah lurus, melainkan bergulung dengan ikatan hidrogennya lebih sedikit ketimbang ikatan hidrogen dalam polimer lurus seperti selulosa (Deman, 1989). Sterling (1963) menunjukan bahwa hal ini mungkin disebabkan oleh konformasi rantai, posisi polar gugus hidroksi C2 dan C3, tidak ada tarik menarik antara gugus hidroksil ini dengan gugus metil dan muatan yang ditimbulkan oleh gugus karboksil yang terdisosiasi.
2.2.3. Sifat Pektin
membentuk cairan kental, opalesen, larutan koloidal mudah dituang dan bersifat asam terhadap lakmus, praktis tidak larut dalam etanol atau pelarut lain.
Dalam SNI disebutkan bahwa pektin merupakan zat berbentuk serbuk kasar hingga halus yang berwana putih kekuningan, tidak berbau, dan memiliki rasa seperti lendir. Gliksman (1969) menyebutkan pektin kering yang telah dimurnikan berupa kristal yang berwarna putih dengan kelarutan yang berbeda-beda sesuai dengan kandungan metoksilnya. Pektin yang memiliki kadar metoksil tinggi dapat larut dalam air dingin, sedangkan pektin dengan kadar metoksil rendah larut dalam alkali dan asam oksalat. Pektin tidak dapat larut dalam aseton dan alkohol (Kirk dan Othmer, 1952)
Menurut Towle dan Christensen (1973) kelarutan pektin dalam air ditentukan oleh jumlah gugus metoksil, distribusinya, dan bobot molekulnya. Secara umum, kelarutan akan meningkat dengan menurunnya bobot molekul dan meningkatnya gugus metil ester. Namun pH, suhu, jenis pektin, garam dan adanya zat organik seperti gula juga mempengaruhi kelarutan pektin.
Sifat penting pektin adalah kemampuannya membentuk gel. Pektin metoksil tinggi membentuk gel dengan gula dan asam, yaitu dengan konsentrasi gula 58-75 dan pH 2,8-3,5. Pembentukan gel terjadi melalui ikatan hidrogen diantara gugus karboksil bebas dan diantara gugus hidroksil. Pektin bermetoksil rendah tidak mampu membentuk gel dengan asam dan gula, tetapi dapat membentuk gel dengan adanya ion-ion kalsium (Caplin, 2004)
2.2.4. Sumber Pektin
kadar pektin kering sekitar 9% (Mollea et al.,2008). Kandungan pektin dari beberapa sayuran dan buah-buahan dapat dilihat pada tabel berikut:
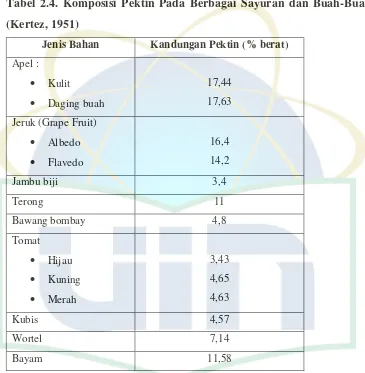
Tabel 2.4. Komposisi Pektin Pada Berbagai Sayuran dan Buah-Buahan (Kertez, 1951)
Jenis Bahan Kandungan Pektin (% berat)
Apel :
Pektin merupakan pangan fungsional bernilai tinggi yang berguna secara luas dalam pembentukan gel dan bahan penstabil pada sari buah, bahan pembuat jelly, selai dan marmalade (Willat et al,.2006). Konsentrasi pektin berpengaruh terhadap pembentukan gel dengan tingkat kekenyalan dan kekuatan tertentu (Chang and Myamoto, 1992)
efek positif bagi kesehatan seperti menurunkan kadar kolesterol dan kadar gula darah, menurunkan kanker (Jackson., et al, 2007) dan merangsang respon imun (Inngjerdingen,. et al, 2007). Pektin juga digunakan pada produksi beberapa produk tertentu seperti film biodigradasi, busa, plastisizer dan penghantar obat.
Pada usus halus, pektin dan polisakarida pembentuk gel lainnya dapat meningkatkan viskositas makanan dalam saluran pencernaan sehingga mempengaruhi proses pencernaan dan penyerapan (Judd & Truswell 1985, dalam Arjmandi et al. 1992). Pektin termasuk jenis serat pangan yang larut air dan mudah difermentasi oleh mikroflora usus besar (Gallaher, 2000)
Dalam hal menurunkan kadar kolesterol, telah dilaporkan bahwa pektin dapat menurunkan koleterol darah dengan baik (Sriamonsark, 2001). Mengkonsumsi sekurangnya 6g/hari dapat menurunkan kadar kolesterol secara signifikan (Ginter et al.,1979). Mietinnen dan Tarplia (1977) melaporkan terjadi pengurangan kolesterol dalam serum sebanyak 13% setelah 2 minggu pengobatan menggunakan pektin.
Pektin juga berperan sebagai agen profilaktik yang dapat melawan racun dari toksik kation, dan telah menunjukkan efektivitasnya dalam menghilangkan timah dan merkuri dari saluran gastrointestinal serta organ pernapasan (Kohn, 1982).
2.2.6. Ekstraksi Pektin
Protopekin tidak dapat larut dalam air karena berada dalam bentuk garam-kalsium-magnesium pektinat. Proses pelarutan protopektin menjadi pektin terjadi karena adanya penggantian ion kalsium dan magnesium oleh ion hidrogen ataupun dikarenakan putusnya ikatan antara pektin dengan selulosa. Semakin tinggi konsentrasi ion hidrogen, maka semakin tinggi pula kemampuan menggantikan ion kalsium dan magnesium, dengan kata lain kemampuan untuk memutuskan ikatan pektin dengan selulosa akan semakin tinggi pula sehingga pektin yang larut akan bertambah (Meyer,1978)
Kisaran tingkat keasaman (pH) pada ekstraksi pektin adalah 1,2-3,0. Jika pH terlalu rendah, maka protopektin tidak dapat berubah menjadi pektin secara optimal. Demikian juga apabila pH terlalu tinggi maka pektin akan berubah menjadi asam pektat sehingga tidak dapat membentuk gel (Manalo, et.al, 1985).
Menurut Towle dan Christensen (1973) kelarutan pektin dalam air ditentukan oleh jumlah gugus metoksil, distribusinya dan bobot molekulnya. Secara umum kelarutan akan meningkat dengan menurunnya bobot molekul dan meningkatnya gugus metil ester
2.3. KarekterisasiPektin
Berikut ini adalah standar mutu pektin berdasarkan standar mutu
InternatonalPectinAssociation (2002) dan Codex (1996)
Tabel 2.5. Standar Mutu Pektin
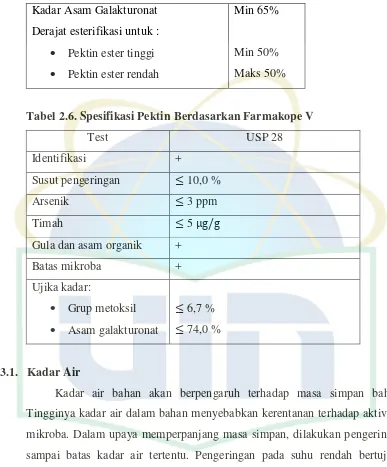
Kadar Asam Galakturonat
Tabel 2.6. Spesifikasi Pektin Berdasarkan FarmakopeV
Test USP 28 Tingginya kadar air dalam bahan menyebabkan kerentanan terhadap aktivitas mikroba. Dalam upaya memperpanjang masa simpan, dilakukan pengeringan sampai batas kadar air tertentu. Pengeringan pada suhu rendah bertujuan untuk meminimalisir terjadinya degradasi pektin (Hariyati, 2006)
2.3.2. Kadar Abu
Prinsip penetapan kadar abu adalah bahan dipanaskan pada tempratur dimana senyawa organik dan turunannya terdestruksi dan menguap, sehingga yang tertinggal hanya unsur mineral dan unsur anoranik (DepKes, 2000) 2.3.3. Berat Ekivalen
Berat ekivalen merupakan ukuran terhadap kandungan gugus asam galakturonat bebas (tidak teresterifikasi) dalam rantai molekul paktin. Asam pektat murni merupakan zat pektat yang seluruhnya tersusun atas atas asam poligalakturonat yang terbebas dari gugus metil ester atau tidak mengalami esterifikasi. Semakin rendah kadar pektin akan menyebabkan berat ekivalen semakin rendah (Ranggana, 2000)
2.3.4. Kadar Metoksil
Kadar metoksil didefinisikan sebagai jumlah mol etanol yang terdapat di dalam 100 mol asam galakturonat. Kadar metoksli pektin memiliki peranan penting dalam menentukan sifat fungsional larutan pektin dan dapat mempengaruhi struktur dan tekstur dari gel pektin (Constenla et al, 2003). Berdasarkan kandungan metoksilnya, pektin dapat dibagi menjadi dua golongan, yaitu pektin berkadar metoksil tinggi (HMP), dan pektin berkadar metoksil rendah (LMP). Pektin bermetoksil tinggi memiliki kandungan metoksil minimal 7%, sedangkan pektin bermetoksil rendah memiliki kandungan pektin maksimal 7% (Guichard et.al., 1991)
2.3.5. Kadar Galakturonat
2.3.6. Derajat Esterifikasi
Derajat esterifikasi didefinisikan sebagai presentase kelompok karboksil yang teresterifikasi. Pektin dengan derajat esterifikasi di atas 50% dinamakan pektin tinggi metoksil, sedangkan derajat esterifikasi di bawah 50% dinamakan pektin rendah metoksil (Siamornsak, 2003).
Menurut Whistler dan Daniel (1985), derajat esterifikasi merupakan
persentase jumlah residu asam D-galakturonat yang gugus karboksilnya
teresterifikasi dengan etanol. Nilai derajat esterifikasi pektin diperoleh dari
nilai kadar metoksil dan kadar asam galakturonat. Persentase dari kelompok
karboksil teresterifikasi oleh methanol dinamakan derajat esterifikasi
(Fennema, 1996) dalam Hariyati ,2006).
2.4. Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi
senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan
pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan
massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi
baku yang telah ditetapkan. (Depkes RI, 2000).
Dalam buku Farmakope Indonesia Edisi V, disebutkan bahwa ekstrak
adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif
dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk
yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah
ditetapkan.
2.4.1. Faktor yang mempengaruhi mutu ekstrak
1. Faktor biologi
Mutu ekstrak dipengaruhi dari bahan asal (tumbuhan obat), dipandang secara
khusus dari segi biologi yaitu identitas jenis, lokasi tumbuhan asal, periode
2. Faktor kimia
Mutu ekstrak dipengaruhi dari bahan asal (tumbuhan obat), dipandang
secara khusus dari kandungan kimia, yaitu :
a. Faktor internal, seperti jenis senyawa aktif dalam bahan, komposisi
kualitatif senyawa aktif, kadar total rata-rata senyawa aktif.
b. Faktor eksternal, seperti metode ekstraksi perbandingan ukuran alat
ekstraksi, pelarut yang digunakan dalam ekstraksi, kandungan logam berat,
ukuran kekerasan, dan kekeringan bahan (Depkes RI, 2000).
2.4.2. Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair.
Kelarutan dan stabilitas senyawa pada simplisia terhadap pemanasan, udara,
cahaya, logam berat dan derajat keasaman dipengaruhi olah struktur kimia
yang berbeda-beda. (Depkes RI, 2000)
Simplisia yang lunak seperti rimpang, akar dan daun mudah diserap
oleh pelarut, sehingga pada proses ekstraksi tidak perlu diserbuk sampai
halus. Sedangkan simplisia yang keras seperti biji, kulit kayu, dan kulit akar
susah diserap oleh pelarut, karena itu perlu diserbuk sampai halus. Selain sifat
fisik dan senyawa aktif dari simplisia, senyawa-senyawa yang terdapat dalam
simplisia seperti protein, karbohidrat, lemak dan gula juga harus diperhatikan
(Depkes RI, 2000).
2.4.3. Metode Ekstraksi
Dengan menggunakan metode penyarian atau pelarut dalam ekstraksi
dapat dibedakan macam-macam cara ekstraksi diantaranya:
a. Cara Dingin 1. Maserasi
Maserasi ialah proses pengekstrakan simplisia dengan
menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan
dengan prinsip metode pencapaian konsentrasi pada keseimbangan.
Maserasi kinetik berarti dilakukan pengadukan yang kontinyu
(terus-menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut
setelah dilakukan penyaringan maserat pertama, dan seterusnya. Cara ini
dapat menarik zat-zat berkhasiat yang tahan pemanasan maupun yang
tidak tahan pemanasan. (Depkes RI, 2000)
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna (exhaustive extraction) yang umumnya dilakukan pada
temperatur ruangan. Proses ini terdiri dari tahapan pengembangan bahan,
tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak), terus menerus sampai diperoleh
ekstrak (perkolat) yang jumlahnya 1- 5 kali bahan. Ekstraksi ini
membutuhkan pelarut yang lebih banyak. (Depkes RI, 2000)
b. Cara Panas 1. Refluks
Refluks merupakan ekstraksi dengan pelarut pada temperatur titik
didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif
konstan dengan adanya pendingin balik. Umumnya dilakukan
pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat
termasuk proses ekstraksi sempurna. (Depkes RI, 2000)
2. Soxhletasi
Soxhletasi ialah ekstraksi dengan menggunakan pelarut yang selalu
baru yang umumnya dilakukan dengan alat khusus sehingga terjadi
ekstraksi kontinyu dengan jumlah pelarut relatif konstan dengan adanya
3. Digesti
Digesti merupakan maserasi kinetik (dengan pengadukan kontinyu)
pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu
secara umum dilakukan pada temperatur 40-50oC. (Depkes RI, 2000)
4. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas
air mendidih, temperature terukur 96o C-98o C selama waktu tertentu
(15-20 menit). Infus pada umumnya digunakan untuk menarik atau
mengekstraksi zat aktif yang larut dalam air dari bahan-bahan nabati.
Hasil dari ekstrak ini akan menghasilkan zat aktif yang tidak stabil dan
mudah tercemar oleh kuman dan kapang, sehingga ekstrak yang diperoleh
24
BAB III
METODOLOGI PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian II dan Laboratorium Kimia Obat FKIK UIN Syarif Hidayatullah Jakarta. Penelitian ini dilakukan pada bulan Mei sampai dengan bulan Juli 2015.
3.2. Bahan Uji
3.2.1. Penyediaan Bahan Uji
Bahan yang akan dilakukan pengekstraksian berupa kulit pisang Uli yang telah masak yang didapatkan dari penjual pisang goreng di sekitar kampus UIN Syarif Hidayatullah Jakarta
3.2.2. Determinasi Bahan Uji
Bahan kulit pisang Uli yang akan diekstraksi terlebih dahulu dilakukan pengidentifikasian di Laboratorium Botani, Puslit Biologi LIPI Cibinong.
3.3. Alat dan Bahan 3.3.1. Alat
Peralatan penelitian yang digunakan antara lain oven, blender, alat-alat gelas (erlenmeyer, gelas beker, gelas ukur, pipet tetes, buret dll), motor pengaduk, stirrer, tabung pendingin balik, pH indikator universal, cawan penguap, cawan krus, labu gelas, termometer, hot plate, termokontrol, neraca analitik, statif dan klem serta corong buchner.
3.3.2.Bahan
Kulit pisang uli matang, etanol 96%, Asam Klorida (HCl), Aquadest, natrium klorida (NaCl), natrium hidroksida (NaOH), indikator
3.4. Prosedur Kerja
a. Persiapan bahan
Kulit pisang dilakukan pensortiran dari kulit pisang yang busuk atau
rusak, selanjutnya dilakukan pembersihan dengan menggunakan tissue basah
pada bagaian kulit luar agar kulit pisang yang akan digunakan dapat terbebas
dari kotoran-kotoran yang menempel. Setelah kulit pisang tersebut bersih, lalu
dilakukan pengeringan dengan cara dijemur dengan menggunakan panas
matahari selama 2 hari (16 jam), untuk kemudian dikeringkan lebih lanjut
menggunakan oven selama 5 jam dengan suhu 70 guna menghilangkan
kandungan air yang masih tersisa. Setelah kulit pisang tersebut kering, untuk
selanjutnya dilakukan penghalusan dengan cara diblender dan diayak dengan
ukuran Mesh 100 (Hanum et.,al, 2012 dengan modifikasi).
b. Ekstraksi Kulit Pisang
Sebanyak 30 g bubuk kulit pisang yang telah dihasilkan dimasukkan
kedalam labu gelas lalu ditambahkan larutan HCl sebanyak 1000 ml dengan
pH 1,5. Hasil yang diperoleh disebut dengan bubur masam. Bubur masam
kemudian dipanaskan dengan menyalakan pemanas listrik dengan setingan
suhu 90 . Penghitungan waktu ekstraksi dari saat tercapainya kondisi operasi
sesuai variabel percobaan yaitu 70 dan 80 menit. Setelah dipanaskan, bubur
masam tersebut disaring dengan menggunakan corong buchner yang telah dilapisi dengan kapas dan dihubungkan dengan vakum guna memisahkan
filtratnya. Filtrat yang didapatkan disebut dengan filtrat petin (Beri Satria dan
Yusuf Ahda, 2008 dengan modifikasi).
c. Pengendapan pektin
Larutan etanol 96% diasamkan dengan menambahkan 2 ml HCl pekat
per satu liter etanol, larutan ini disebut dengan alkohol asam. Filtrat pektin
ditambahkan dengan alkohol asam lalu diaduk hingga rata. Perbandingan
filtrat pekat dengan alkohol asam adalah 1 : 1,5. Setelah itu filtrat didiamkan
kertas saring. Hasil yang diperoleh disebut dengan pektin masam (Akmaludin
dan Kurniawan, 2009).
d. Pencucian pektin masam
Pektin masam ditambahkan dengan etanol 96% sambil diaduk untuk
kemudian dilakukan penyaringan dengan menggunakan kertas saring. Hal ini
dilakukan beberapa kali sampai etanol bekas pencucian berwarna jernih dan
tidak bereaksi dengan asam, adapun tanda dari tidak lagi bereaksi dengan
asam adalah ketika air bekas pencucian pektin berwarna berwarna merah bila
ditetesi dengan phenolftalein (Akmaludin dan Kurniawan, 2009).
e. Pengeringan
Pektin yang sudah dilakukan pencucian tersebut selanjutnya dikeringkan
dalam oven pada suhu 30-40 selama 6-10 jam. Hasil yang diperoleh disebut
dengan pektin kering (Akhmaludin dan Kurniawan, 2009)
3.5. Analisa Kadar
3.5.1. Penimbangan bobot pektin
Bobot pektin adalah banyaknya pektin yang dihasilkan dari
ekstraksi kulit pisang uli pada masing-masing variasi waktu
3.5.2. Penentuan kadar air
Sebanyak 0,3 g sampel pektin dikeringkan di dalam oven pada suhu
100 selama 4 jam. Selanjutnya sampel didinginkan dalam desikator lalu
ditimbang sampai diperoleh bobot yang tepat
% Kadar air =
100%
Dimana : Wa = bobot sebelum dikeringkan (gram)
Wb = bobot setelah dikeringkan (gram)
(Pardede, et.al., 2013)
3.5.3. Penentuan kadar abu
Cawan krus dikeringkan di dalam tanur pada suhu 600 , kemudian
0,3 g pektin ditimbang dalam cawan porselin yang telah diketahui
bobotnya untuk selanjutnya dimasukkan ke dalam tanur pada suhu 600
selama 4 jam. Residu kemudian didinginkan dalam desikator lalu
ditimbang untuk mengetahui berat konstan
Kadar abu (%) =
Keterangan :
W = bobot sampel awal
W1 = bobot wadah + sampel setelah pemanasan (gram)
W2 = bobot wadah kosong (gram)
(Ranggana, 1997 dalam Hariyati, 2006)
3.5.4. Penentuan berat ekivalen
Nilai berat ekivalen digunakan untuk perhitungan kadar asam
anhidrouronat dan derajat esterifikasi. Berat ekivalen ditentukan dengan
menimbang 0,5 g pektin yang diperoleh lalu dimasukkan ke dalam
erlenmeyer 250 ml dan dilembabkan dengan 5 ml etanol. Sebanyak 1 g
NaCl ditambahkan ke dalamnya guna mempertajam titik akhir titrasi. Air
suling bebas CO2 sebanyak 100 ml dan 6 tetes indikator phenolptalein
ditambahkan. Campuran tersebut kemudian diaduk cepat guna memastikan
bahwa semua substansi pektin telah terlarut dan tidak ada gumpalan yang
menempel pada dinding erlenmeyer. Titrasi dilakukan secara perlahan
(untuk menghindari kemungkinan terjadinya deesterifikasi) dengan titran
standar 0,1 N NaOH sampai warna campuran berubah menjadi merah
muda (pH) dan tetap bertahan selama kurang lebih 30 detik. Larutan
tersebut kemudian dinetralkan guna penentuan kadar metoksil
Berat ekivalen =
(Ranggana, 1997 dalam Hariyati, 2006)
3.5.5. Analisa Kadar Metoksil
Penentuan kadar metoksil dilakukan dengan penambahan 25 ml 0,5N
lalu didiamkan selama 30 menit pada suhu kamar dalam erlenmeyer
tertutup. Sebanyak 25 ml HCl 0,25N dan phenolptalein ditambahkan
kedalamnya kemudian dilakukan titrasi hingga larutan berubah menjadi
merah muda
Kadar metoksil (%) =
Dimana angka 31 menunjukkan berat molekul (BM) dari metoksil
(Ranggana, 1997 dalam Hariyati, 2006)
3.5.6. Analisa Kadar Galakturonat
Kadar galakturonat dihitung dari miliekivalen NaOH yang diperoleh
dari penentuan BE (berat ekivalen) dan kandungan metoksil.
Galakturonat (%) =
Dimana angka 176 merupakan berat terendah ekivalen dari asam pektat
(Ismail et,al 2012)
3.5.7. Penentuan derajat esterifikasi
Derajat esterifikasi (DE) dari pektin dapat dihitung dengan:
DE (%) =
29
4.1 Bahan Baku
4.1.1 Penentuan Bahan Baku
Bahan baku yang digunakan untuk penelitian ini berupa kulit
pisang Uli hasil limbah dari pembuatan pisang goreng. Pisang Uli
merupakan jenis pisang yang banyak digunakan untuk makanan olahan
seperti pisang goreng, molen serta produk makanan lain yang umumnya
akan menghasilkan limbah berupa kulit pisang yang pada saat ini hanya di
buang begitu saja. Pisang Uli juga dapat dimakan secara langsung
dikarenakan rasanya manis, hanya saja tekstur dari buahnya kenyal dan
terasa agak sepat, tetapi rasa sepat tersebut akan berangsur menghilang
seiring dengan semakin matangnya buah. Dari pemanfaatan yang besar
itulah produksi makanan olahan pisang banyak menghasilkan limbah kulit
pisang.
Menurut Cahyono (2009), pektin terdistribusi secara luas dalam
jaringan tanaman dan umumnya terdapat pada dinding sel. Pisang Uli
memliki kulit buah yang agak tebal meskipun tidak setebal kulit pisang
kepok, sehingga masih memliki kemungkinan terdapat pektin pada kulit
Pisang Uli tersebut. Pemilihan bahan baku kulit Pisang Uli didasarkan
pada tingginya konsumsi Pisang Uli baik itu secara konsumsi langsung
maupun sebagai olahan, sehingga menghasilkan limbah kulit pisang
dalam jumlah besar. Dan oleh karena pektin juga terdapat pada kulit
pisang, maka pemanfaatan limbah kulit pisang diharapkan mampu
menekan biaya produksi pektin di indonesia.
4.1.2 Determinasi Tanaman Bahan Baku
Determinasi bahan baku dilakukan guna memastikan keabsahan
dari bahan yang akan digunakan dari segi identitas tanaman. Adapun
Penelitian Biologi LIPI (Lembaga Ilmu Pengetahuan Indonesia) Cibinong,
Bogor. Adapun hasil determinasi menunjukan bahwa bahan baku yang
digunakan adalah dari jenis tanaman Pisang Uli dari Famili Musaceae.
4.1.3 Persiapan Bahan Baku
Bahan baku yang digunakan pada penelitian ini berupa kulit Pisang
Uli yang telah masak, hal itu dikarenakan konsumsi buah pisang uli untuk
berbagai kebutuhan umumnya pada kondisi yang telah masak, karena pada
kondisi tersebut buah pisang uli memiliki rasa yang manis dengan tekstur
yang tetap kenyal. Di samping karena waktu pemanfaatannya, kandungan
serat kasar kulit pisang yang telah masak lebih tinggi dibandingkan pada
saat masih mentah, dan telah dijelaskan sebelumnya bahwa pektin banyak
terdistribusi pada dinding sel primer suatu tumbuhan.
Tabel 4.1.Komposisi Nutrien Kulit Pisang (Tartrakoon, 1999)
Komposisi nutrien
atau karbohidrat analog yang resisten terhadap pencernaan dan absorpsi
pada usus halus dengan fermentasi lengkap atau parsial pada usus besar
polisakarida, yaitu sellulosa, pektin dan hemisellulosa (Piliang dan
Djojosoebagjo, 2002)
Adapun bahan baku diambil dari pasar Ciputat Tangerang Selatan.
Kulit pisang terlebih dahulu di bersihkan dari ujung pisang yang masih
terdapat sisa-sisa buah pisang untuk selanjutnya kulit pisang dibersihkan
dengan cara digosok permukaan luar kulitnya menggunakan tissue basah
hingga terbebas dari kotoran yang menempel, untuk selanjutnya kulit
pisang dikeringkan dengan cara dijemur di terik matahari selama 2 hari
(dari jam 10.00 – 15.00 WIB) kemudian dilakukan pengovenan dengan
suhu 70 selama 5 jam.
Kulit pisang yang telah kering kemudian dihaluskan dengan
menggunakan blender kemudian di ayak menggunakan ayakan berukuran
100 Mesh, adapun tanda dari kulit pisang yang telah kering adalah mudah
dipatahkan.
4.2 Produksi Pektin
Produksi pektin dilakukan melalui proses ekstraksi kulit Pisang Uli
menggunakan asam klorida dengan normalitas 0,031 dan dengan variasi
waktu ekstraksi 70 dan 80 menit. Suhu yang digunakan untuk ekstraksi
sekitar 90 . Ekstraksi pektin dilakukan dengan menggunakan metode
konvensional yaitu pemanasan secara langsung. Srivastava dan Malviya
(2011) menyatakan bahwa ada dua metode ektraksi pektin yang biasa
dilakukan, yaitu pemanasan secara langsung dan pemanasan dengan
menggunakan microwave.
Hanum et.al. (2012) mengungkapkan bahwa ekstraksi pektin dapat
dilakukan dengan hidrolisis asam, yaitu dengan menggunakan pelarut HCl
guna merombak protopektin yang tidak larut dalam air menjadi pektin
yang mudah larut dalam air. Penggunaan pelarut HCl didasarkan pada
pernyataan Kertesz (1951) bahwa selain asam organik, ekstraksi pektin
memiliki kecendrungan untuk menggunakan asam mineral yang mudah
Dalam proses ekstraksi pektin ini digunakan bahan baku kering.
Sebanyak 30 gram bahan baku kering dimasukkan ke dalam erlenmeyer
2000 mL, lalu ditambahkan pelarut HCl dengan pH 1,5 sebanyak 1000
mL. Pada ujung leher erlenmeyer disumbat menggunakan gulungan kapas
yang pada bagian tengahnya di pasang termometer guna memastikan suhu
yang digunakan stabil. Proses ekstraksi dilakukan dengan pemanasan di
atas hot plate pada suhu 90 dengan varian waktu 70 dan 80 menit. Pada
saat proses ektraksi dilakukan pengadukan menggunakan magnetic stirrer
dengan kecepatan 10 (600 rpm). Menurut Prina, et.al.(2007), pengadukan
dalam ekstraksi penting dilakukan karena dapat meningkatkan
perpindahan solut dari permukaan partikel ke dalam cairan pelarut dan
mencegah pengendapan padatan serta memperluas kontak partikel dengan
pelarutnya.
Setelah proses ektraksi selesai, campuran terlebih dahulu
didinginkan untuk kemudian dilanjutkan proses penyaringan guna
memisahkan filtrat dari residunya menggunakan kertas saring.
Setelah proses penyaringan selesai, filtrat yang diperoleh
dipindahkan ke dalam wadah kaca lain, lalu dilakukan perendaman filtrat
menggunakan etanol 96%, hal tersebut dimaksudkan agar tejadi pemisahan
larutan ekstak dari rafinat. Etanol yang ditambahkan dalam larutan pektin
akan bersifat sebagai pendehidroksi sehingga keseimbangan antara pektin
dengan air akan terganggu dan pektin akan mengendap (Prasetyowati,et.al,
2009)
Berdasarkan Rouse (1977) di dalam Astuti (2007), penggumpalan
atau koagulasi pektin terjadi karena gangguan terhadap kestabilan dispersi
koloidalnya. Pektin merupakan koloidal hidrofilik yang bermuatan negatif
(dari gugus karboksil bebas yang terionisasi) dan tidak memiliki titik
isoelektrik. Seperti koloid hidrofilik pada umumnya, pektin distabilkan
oleh selapis air melalui ikatan elektrostatik anatara muatan negatif molekul
pektin dengan muatan positif molekul air. Penambahan zat pendehidrasi
dehidrasi dapat mengganggu kesetimbangan pektin dengan air, sehingga
paktin akan menggumpal.
Etanol dipilih karena tidak terlalu berbahaya bagi pernapasan serta
agar tidak terjadi kontaminasi pada saat pencucian pektin, mengingat
pencucian pektin dilakukan menggunakan etanol.Penambahan etanol ke
dalam filtrat hasil ekstraksi dilakukan secara perlahan sambil diaduk
sehingga terbentuk endapan untuk kemudian didiamkan semalaman (17
jam) agar proses pengendapan berlangsung sempurna. Setelah perendaman
satu malam, endapan tersebut dicuci beberapa kali menggunakan alkohol
guna membersihkan sisa-sisa asam pada pektin. Pencucian menggunakan
alkohol dipilih karena menghasilkan warna pektin yang lebih bersih dan
putih dibandingkan dengan pencucian tanpa alkohol (Susilowati, 2013).
Penentuan bebas asam dilakukan dengan memeriksa larutan bekas
pencucian pektin menggunakan pH indikator universal. Adapun hasil dari
beberapa kali pencucian menyatakan bahwa tingkat keasaman pada pektin
menunjukkan angka 6, hal itu disebabkan pH dari etanol yang digunakan
ber pH 6.
Setelah pencucian pektin, tahap selanjutnya ialah pengeringan
pektin. Pektin yang dihasilkan untuk selanjutnya dikeringkan
menggunakan oven selama kurang lebih 8 jam dengan suhu pengeringan
rendah yakni 40 , hal itu dimaksudkan agar tidak terjadi degradasi pektin
selama masa pengeringan. Pektin yang telah kering selanjutnya dihaluskan
menjadi serbuk dengan cara digerus mengunakan lumpang. Hal itu
dikarenakan pektin yang dihasilkan setelah pengovenan berbentuk seperti
karamel yang mengeras dan tidak saling terpisah satu dengan lainnya.
Setelah pektin terbentuk serbuk, tahap selanjutnya dilakukan penimbangan
bobot serta karaketrisasi untuk menentukan kualitas dari pektin yang
dihasilkan.
4.3 Identifikasi Kualitatif Pektin
Pemerian pektin hasil ekstraksi pada penelitian ini cenderung tidak
terdapat perbedaan yang signifikan antara pektin dengan waktu ekstraksi
70 menit dan waktu ekstraksi 80 menit. Seluruh pektin hasil dari ekstraksi
berwarna cokelat dengan tekstur mirip seperti gula putih.
Tabel 4.2. Pemerian Pektin Hasil Ekstraksi
No Kondisi ekstraksi Pemerian
1 Sampel ekstraksi 70 menit
2 Sampel ekstraksi 80 menit
Berdasarkan Farmakope Indonesia edisi V (2014), pemerian pektin
berupa serbuk kasar atau halus, berwarna putih kekuningan, hampir tidak
berbau dan mempunyai rasa musilago. Menurut Food Chemical Codex
(1996), pemerian pektin berupa serbuk kasar hingga halus; berwarna putih
kekuningan, kelabu atau kecokelatan.
Pektin kering yang diperoleh pada penelitian ini berwarna
kecoklatan, hal ini dapat dimungkinkan adanya pengaruh oksidasi pada
bahan baku pada saat penyimpanan. Hal tersebut dimungkinkan karena
terdapat jeda waktu antara proses penyerbukan kulit pisang dengan proses
ekstraksi, sehingga paparan udara bebas pada saat penyimpanan
menyebabkan serbuk kulit pisang menjadi kehitaman, mengingat wadah
Apabila merujuk kepada Farmakope Indonesia V, maka hasil yang
diperoleh dari penelitian ini belum sesuai dengan standar mutu pektin, tapi
apabila dibandingkan dengan standar yang mutu yang tertera dalam Food Chemical Codex (1996), maka hasil pektin yang didapatkan masih masuk kedalam kriteria standar mutu pektin.
Setelah didapatkannya serbuk pektin, maka tahap selanjutnya adalah
melakukan identifikasi pektin. Identifikasi dilakukan guna memastikan
secara kualitatif bahwasannya serbuk yang diperoleh merupakan pektin.
Identifikasi pektin ini dilakukan sesuai dengan prosedur yang tertera dalam
Farmakope Indonesia edisi 5 tahun 2014.
4.4 Karakterisasi Pektin Hasil Ekstraksi
Tabel 4.3. Karakterisasi Pektin Hasil Ekstraksi
No Karakterisasi Waktu Ekstraksi Standar menurut
Food Chemical Codex 70 menit 80 menit
1 Bobot pektin (gram) 2,05 2,45
2 Kadar air (%) 9,97 9,58 Maks 12%
3 Kadar abu (%) 0,36 0,38 Maks 1,0%
4 Berat ekivalen 5.260,942 3.642,191 600-800 mg
5 Kadar metoksil (%) 3,07 3,20 2,5-7,12%
6 Kadar galakturonat (%) 69,95 72,95 Min 65%
4.4.1 Bobot Pektin
Gambar 4.1 Diagram bobot pektin
Bobot pektin adalah banyaknya pektin yang dihasilkan dari ekstraksi
kulit pisang Uli pada masing-masing variable waktu ekstraksi. Bobot
pektin hasil ekstraksi dengan waktu 70 menit sebesar 2,0528 gram; dan
waktu 80 menit sebesar 2,4511 gram, keduanya menggunakan suhu
ekstraksi 95 . Dari data yang didapatkan menunjukkan bahwa ekstraki
pektin dengan waktu 80 menit menghasilkan lebih banyak pektin
dibandingkan dengan waktu ekstraksi 70 menit.
Menurut Nainggolan dalam Hanum (2012) menyatakan bahwa
prinsip ekstraksi pektin merupakan perombakan protopektin yang tidak
larut dalam air menjadi pektin yang dapat larut dalam air. Ekstraksi pektin
ini dapat dilakukan dengan cara hidrolisis asam atau enzimatis. Pelarut
HCl merupakan asam yang berperan sebagai katalis guna mempercepat
reaksi hidrolisis protopektin menjadi pektin. Menurut percobaan yang
dilakukan oleh Yusuf Ahda (2008), waktu ektraksi optimum pada kulit
pisang yaitu pada rentang 1,5 hingga 2 jam untuk jenis solvent HCl.
Apabila proses ekstraksi melebihi waktu operasi maksimumnya,
maka hasil pektin yang didapat mengalami penurunan dikarenakan pektin
yang terbentuk mengalami hidrolisa lebih lanjut menjadi asam pektat. Dan 2,0528
2,4511
Bobot pektin (gram)
Diagram Bobot Pektin
Waktu Ekstraksi 70 menit
bila waktu ekstraksi terus ditambah maka pektin akan mengalami
kejenuhan yang tetap serta mengakibatkan rusaknya pektin yang terbentuk.
4.4.2 Kadar Air
Gambar 4.2 Diagram kadar air pektin
Kadar air pada bahan berpengaruh terhadap masa simpan
bahan.Tingginya kadar air dalam bahan dapat menyebabkan kerentanan
terhadap aktivitas mikroba (budiyanto dan Yulianingsih, 2008). Dalam
upaya memperpanjang masa simpan bahan, dilakukan pengeringan sampai
batas kadar air tertentu. Produk dengan kadar air rendah relatif lebih stabil
dalam penyimpanan jangka panjang dibanding dengan produk berkadar air
tinggi (Pardede, et al, 2013).
Pada penelitian ini, pengeringan dilakukan dalam oven pengering
dengan suhu 40 selama 8 jam (hanum, et. Al., 2012). Kadar air pektin
tertinggi diperoleh dari ekstraksi varian waktu 70 menit dibandingkan
dengan pektin dengan waktu ekstraksi 80 menit. Syarat kadar air
maksimum untuk pektin kering menurut IPPA (International Pectin Producer Association) adalah tidak lebih dari 12%, dengan demikian kadar air hasil penelitian ini masih termasuk dalam pektin yang memenuhi syarat
menurut IPPA. Menurut Utami (2014), tingginya kadar air pektin yang
dihasilkan dapat dipengaruhi oleh derajat pengeringan pektin yang tidak
maksimal sehingga air yang dikandung bahan tidak teruapkan secara
4.4.3 Kadar Abu
Gambar 4.3 Diagram kadar abu pektin
Abu merupakan bahan anorganik yang diperoleh dari residu atau sisa
pembakaran bahan organik. Kandungan mineral suatu bahan dapat
diketahui dari kadar abu yang dimiliki oleh suatu bahan yang juga
berpengaruh pada tingkat kemurnian pektin, (Budiyanto dan
Yulianingsih). Semakin tinggi tingkat kemurnian pektin, maka kadar abu
dalam pektin akan semakin rendah, begitupun sebaliknya, bila kadar abu
pada pektin semakin tinggi, maka tingkat kemurnian pektin semakin
rendah. Kadar abu dalam tepung pektin dipengaruhi oleh adanya residu
bahan anorganik yang terkandung dalam bahan baku, metode ekstraksi
serta isolasi pektin (Kalapathy dan Proctor, 2001) .
Hasil analisa kadar abu menunjukkan bahwa kadar abu pektin
tertinggi diperoleh pada pektin dengan waktu ekstraksi 80 menit, yaitu
sekitar 0,3894 %. Batas maksimum kadar abu pektin dalam IPPA (2013)
adalah tidak lebih dari 10%, dengan demikian kadar abu hasil penelitian
ini masih dalam batas yang diperbolehkan IPPA
Menurut Mayer (1985) dalam Hanum et.al. (2012), dalam buah-buahan dan sayuran, protopektin terdapat dalam bentuk
kalsium-magnesium pektat. Perlakuan dengan asam mengakibatkan terhidrolisisnya
pektin dari ikatan kalsium dan magnesiumnya. Peningkatan reaksi
dalam larutan ekstrak. Dengan demikian, semakin banyak mineral berupa kalsium dan magnesium akan semakin banyak kadar abu pektin
tersebut.
Kadar abu dalam pektin semakin meningkat dengan meningkatnya
konsentrasi asam, suhu, dan waktu ekstraksi. Hal ini disebabkan oleh
kemampuan asam untuk melarutkan mineral alami dari bahan yang
diekstrak yang semakin meningkat dengan meningkatnya konsentrasi
asam, suhu, dan waktu ekstraksi. Mineral yang terlarut akan ikut
mengendap bercampur dengan pektin pada saat pengendapan
dengan alkohol (Kalapathy dan Proctor, 2001). Hasil pengukuran kadar
abu pada penelitian ini sesuai dengan pernyataan di atas, di mana waktu
ekstraksi paling tinggi menghasilkan kadar abu yang tinggi pula.
4.4.4 Berat Ekivalen
Gambar 4.4 Diagram berat ekivalen pektin
Berat ekivalen merupakan kandungan gugus asam galakturonat
bebas yang tidak terseterifikasi dalam rantai molekul pektin. Harga berat
ekivalen ditentukan berdasarkan reaksi penyabunan gugus karboksil
oleh NaOH dimana berat ekivalen akan berbanding terbalik dengan
banyaknya volume NaOH yang digunakan untuk bereaksi dengan gugus
karboksil (HUI dalam Prasetyowati, 2009). Asam pektat murni 5.260,94
3.642,19
Berat ekivalen
Diagram Berat Ekivalen
merupakan zat pektat yang seluruhnya tersusun dari asam poligalakturonat
yang bebas dari gugus metil ester atau tidak mengalami esterifikasi.
Semakin rendah kadar pektin menyebabkan berat ekivalen semakin rendah
(Ranganna, 1977 dalam Hanum, 2012).
Berat ekivalen tertinggi pada penelitian ini dihasilkan pada pektin
dengan waktu ekstraksi 70 menit, yaitu sebesar 5.260,942, sedangkan pada
ekstraksi dengan waktu 80 menit sebesar 3.642,19, berat ekivalen menurun
siring meningkatnya waktu ekstraksi. Berdasarkan penelitian yang
dilakukan oleh Hesti Meilina (2003) menyatakan bahwasannya semakin
meningkatnya waktu ekstraksi maka berat ekivalen semakin menurun, hal
tersebut dikarenakan pektin akan mengalami depolimerisasi menjadi asam
pektat sehingga gugus asam galakturonat yang tidak teresterifikasi menjadi
lebih banyak jumlahnya.
Berat ekivalen pektin berdasarkan standar IPPA (2003) yakni
berkisar antara 600-800. Pada penelitian ini pektin yang dihasilkan
memiliki berat ekivalen yang tidak memenuhi standar yang ada.
Bobot molekul pektin tergantung pada jenis tanaman, kualitas bahan
baku, metode ekstraksi, dan perlakuan pada proses ekstraksi.
Kemungkinan besar hal yang mempengaruhi nilai berat ekivalen adalah
sifat pektin hasil ekstraksi itu sendiri, serta proses titrasi yang dilakukan
4.4.5 Kadar Metoksil
Gambar 4.5 Diagram kadar metoksil pektin
Kadar metoksil menyatakan banyaknya gugus metil teresterifikasi
pada ekstraksi kulit pisang Uli. Kadar metoksil berpengaruh terhadap
kemampuan pembentukan gel yang baik. Semakin besar kandungan
metoksil, maka kemampuan pembentukan gel akan semakin besar
(Dudung Muhidin dalam Prasetyowati, 2009). Pektin dapat disebut
bermetoksil tinggi bila memiliki nilai kadar metoksil sama dengan atau
lebih dari 7%, sedangkan bila kadar metoksil di bawah 7% dapat dikatakan
pektin tersebut bermetoksil rendah.
Pada penelitian ini kadar metoksil tertinggi diperoleh dari pektin
dengan waktu ekstraksi 80 menit, yaitu sekitar 3,2%, sedangkan pada
ekstraksi dengan waktu 70 menit, kadar metoksil sebesar 3,07%, tidak
terdapat perbedaan yang signifikan, hal tersebut dikarenakan perbedaan
waktu ekstraksi yang tidak terlalu jauh. Dalam Food Chemical Codex
(1996), pektin bermetoksil rendah berkisar antara 2,5-7,2%, sehingga
pektin yang dihasilkan pada penelitian ini tergolong ke dalam pektin
bermetoksil rendah.
Berdasarkan penelitian yang dilakukan oleh Kaban, et.al.,(2012)
dan Tarigan et.al., (2012), bahwasannya kadar metoksil meningkat seiring
dengan kenaikan suhu dan waktu ekstraksi, hal ini disebabkan karena
4.4.6 Kadar Galakturonat
Gambar 4.6 Diagram kadar galakturonat pektin
Kadar galakturonat serta muatan molekul pektin berperan penting
dalam penentuan sifat fungsional larutan pektin dan mempengaruhi
struktur dan tekstur dari gel pektin yang terbentuk (Constenla dan Lozano,
2006). Semakin tinggi nilai kadar galakturonatnya, maka mutu pektin juga
semakin tinggi.
Kadar galakturonat tertinggi yang dihasilkan pada penelitian ini
adalah pada waktu ekstraksi 80 menit, yaitu sekitar 72,95%, sedangkan
pada ekstraksi dengan waktu 70 menit menghasilkan kadar galakturonat
sekitar 69,95%. Kadar galakturonat meningkat seiring dengan
bertambahnya waktu ekstraksi. Menurut IPPA (2003), kadar galakturonat
minimum yang diizinkan adalah minimal 65%. Dengan demikian kadar
galakturonat pektin hasil penelitian ini masih memenuhi persyaratan mutu
pektin yang telah ditetapkan
Kadar galakturonat pektin dapat dipengaruhi oleh sumber bahan
baku, pelarut, dan metode ekstraksi yang digunakan (Fitria, 2013).
Menurut Nelson, et. al., (1977) dan Towle (1973) di dalam Fitriani (2003), selain asam galakturonat, pektin juga mengandung
senyawa-senyawa lain yaitu gula netral seperti D-galaktosa, arabinosa, dan
L-ramnosa, dan jenis gula lainnya. Senyawa-senyawa non uronat tersebut
mempengaruhi komposisi senyawa pektin. Metode ekstraksi yang
digunakan juga dapat mempengaruhi komposisi senyawa pektin yang
berpengaruh terhadap kadar galakturonat. Beberapa senyawa non uronat
dapat dihilangkan melalui pelarutan kembali pektin dalam air dan
penggumpalan, tetapi tidak dapat menghilangkan semua senyawa uronat
(Fitria, 2013).
4.4.7 Derajat Esterifikasi
Gambar 4.7 Diagram derajat esterifikasi pektin
Derajat esterifikasi merupakan persentase jumlah residu asam
D-galakturonat yang gugus karboksilnya teresterifikasi dengan etanol
(Whistler dan Daniel, 1985 di dalam Budiyanto dan Yulianingsih, 2008).
Nilai derajat esterifikasi pektin diperoleh dari nilai kadar metoksil dan
kadar galakturonat (Fennema, 1996).
Nilai derajat esterifikasi tertinggi pada penelitian ini diperoleh pada
pektin dengan waktu ekstraksi 70 menit, yakni sekitar 24,97%, sedangkan
untuk waktu ekstraksi 80 menit senilai 24,96%. Menurut standar pektin
dalam food chemical codex (1996), pektin bermetoksil tinggi memiliki
kadar metoksil di atas 50%, sedangkan pektin bermetosil rendah memiliki
kadar di bawah 50%.
Hasil penelitian ini sesuai dengan penelitian yang telah dilakukan
menurun seiring dengan meningkatnya suhu dan waktu ekstraksi, hanya
saja dikarenakan perbedaan waktu yang tidak terlalu tinggi maka hasil dari
derajat esterifikasi juga tidak terdapat perbedaan yang signifikan.
Tingginya suhu dan lamanya waktu ekstraksi dapat menyebabkan
degradasi gugus metil ester pada pektin menjadi asam karboksilat oleh
adanya asam (Kertez, 1951 dalam hariyati, 2006). Asam dalam ekstraksi
pektin akan menghidrolisis ikatan hidrogen. Ikatan gugus metil ester dari
pektin cenderung terhidrolisis menghasilkan asam galakturonat. Apabila
ekstraksi dilakukan terlalu lama maka pektin akan berubah menjadi asam
pektat yang dimana asam galaktuonatnya bebas dari gugus metil ester.
Jumlah gugus metil ester menunjukkan jumlah gugus karboksil tidak
teresterifikasi (Budiyanto dan Yulianingsih, 2008 dalam Vita Fitria, 2013).
Menurut Awashti (2011), nilai derajat esterifikasi untuk pektin tinggi
metoksil memiliki rentang nilai derajat esterifikasi sebesar 60-70% dan
untuk pektin rendah metoksil memiliki rentang 20-40%. Pektin yang
dihasilkan pada penelitian ini termasuk ke dalam pektin dengan kadar
metoksil rendah karena tidak termasuk kedalam rentang derajat esterifikasi