KARAKTERISASI PEKTIN HASIL EKSTRAKSI DARI
LIMBAH KULIT PISANG KEPOK
(
Musa balbisiana
ABB)
SKRIPSI
VITA FITRIA
NIM. 109102000069
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
KARAKTERISASI PEKTIN HASIL EKSTRAKSI DARI
LIMBAH KULIT PISANG KEPOK
(
Musa balbisiana
ABB)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
VITA FITRIA
NIM. 109102000069
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
Nama : Vita Fitria Program Studi : Farmasi
Judul : Karakterisasi Pektin Hasil Ekstraksi dari Limbah Kulit Pisang Kepok (Musa balbisiana ABB)
Pektin merupakan polimer dari asam D-galakturonat yang dihubungkan oleh ikatan α-1,4 glikosidik. Senyawa pektin banyak digunakan dalam industri farmasi, makanan dan minuman. Penelitian ini bertujuan untuk mengetahui karakteristik pektin hasil ekstraksi dari limbah kulit pisang kepok menggunakan pelarut asam laktat dengan variasi pH keasaman dan suhu ekstraksi. Penelitian ini dilakukan dengan metode ekstraksi menggunakan pelarut asam laktat kemudian ditambahkan aseton ke dalam filtrat untuk mengendapkan pektin dan proses terakhir dilakukan pengeringan untuk mendapatkan pektin kering. Variasi keasaman pelarut adalah pH 1, 1,5 dan 2, suhu ekstraksi 80℃ dan 90℃ serta lama ekstraksi 80 menit. Pektin yang dihasilkan ditentukan karakteristiknya meliputi rendemen, kadar air, kadar abu, berat ekivalen, kadar metoksil, kadar galakturonat dan derajat esterifikasi.
Hasil penelitian menunjukkan bahwa rendemen pektin (5,02%-10,78%), rendemen tertinggi didapat pada pH 1,5 dan suhu 90℃. Kadar air berkisar antara 10,54%-11,96%, kadar air terendah didapat pada pH 2 dan suhu 80℃. Kadar abu berkisar antara 4,25%-8,05%, kadar abu terendah didapat pada pH 1,5 dan suhu 90℃. Berat ekivalen berkisar antara 4094,4-9534,71, berat ekivalen tertinggi didapat pada ekstraksi pH 2. Pektin termasuk dalam pektin metoksil rendah, dengan kadar metoksil antara 1,01%-2,70%. Kadar asam galakturonat berkisar antara 32,74%-78,60%. Derajat esterifikasi berkisar antara 17,13%-20,78%. Spektroskopi FTIR digunakan untuk membandingkan spektrum dari pektin sampel, komersial dan standard dan hasilnya menunjukkan kemiripan masing-masing serapan gugus fungsi.
Name : Vita Fitria Program Study : Pharmacy
Title : Characterization of Pectin Extracted from Banana Peels (Musa balbisiana ABB)
Pectin are polymer of D-galacturonic acids connected by α-1,4 glucosidic. Pectin are widely used in pharmaceutical, food dan beverage industries. This reaserch was aimed to investigate the characteristics of pectin extracted from banana peels (Musa balbisiana ABB) using lactic acid solvent with pH variation of acidity and temperature of extraction. The research used an extraction method by using lactic acid solvent in additional to acetone to form the sediment of pectin and the last step was drying in order to get dry pectin. Variation of solvent acidity was pH 1; 1,5 and 2, extraction temperature of 80℃, 90℃ and extraction time of 80 minute. Pectin determined characteristics include yield, water content, ash content, equivalent weight, methoxyl content, galacturonic acid content and degrees of esterification.
The results showed that the pectin yield (5.02%-10.78%), the highest yield obtained at pH 1.5 and temperature of 90℃. Water content ranged from 10.54%-11.96%, the lowest water content obtained at pH 2 and temperature of 80 ℃. Ash content ranged from 4.25%-8.05%, the lowest ash content obtained at pH 1.5 and temperature of 90℃. Equivalent weight ranged from 4094.47-9534.71, the highest equivalent weight obtained at pH 2. Pectin was included in the low methoxyl pectin, with a methoxyl content between 1.01%-2.70%. Galacturonic acid content ranged from 32.74%-78.60%. Degree of esterification ranged from 17.13%-20.78%. FTIR Spectroscopy was used to compare the spectrum of the sample, commercial and standard pectin and the result showed the similarity of each absorption functional groups.
Segala puji penulis panjatkan hanya kepada Allah SWT yang telah
melimpahkan rahmat kasih sayang, kenikmatan, dan kemudahan yang begitu
besar. Shalawat dan salam semoga selalu tercurahkan kepada junjungan baginda
Nabi Muhammad SAW yang membawa petunjuk dan suri tauladan bagi umat
manusia, semoga kelak kita semua mendapat syafaat beliau.
Skripsi dengan judul: “Karakterisasi Pektin Hasil Ekstraksi dari Limbah
Kulit Pisang Kepok (Musa balbisianaABB)” ini disusun untuk memenuhi salah
satu syarat memperoleh gelar Sarjana Farmasi di Program studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
Penulis menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai
pihak, sangatlah sulit untuk menyelesaikan skripsi ini. Oleh karena itu, dalam
kesempatan kali ini penulis ingin mengucapkan terima kasih yang
sebesar-besarnya pada pihak yang membantu dan memberikan bimbingan dalam
penyusunan skripsi ini. Ucapan terima kasih dan penghargaan, penulis sampaikan
kepada:
1. Bapak Sukardi dan Ibu Saniyem, kedua orang tua tercinta yang tiada
henti-hentinya mendoakan di setiap waktunya, memberikan kasih sayang,
motivasi, semangat dan nasihat, tanpa Bapak dan Ibu penulis tidaklah
memiliki arti apa-apa. Adik tersayang Ade Rifky Amalia yang selalu
memberikan dukungan, semangat dan keceriaan, serta untuk kelurga
besar yang tak pernah lupa memberikan doa dan semangat.
2. Pemerintah Provinsi Sumatera Selatan dan Diknas Sumatera Selatan serta
jajaran pengurus program Santri Jadi Dokter, selaku pemberi beasiswa
sehingga penulis dapat menempuh pendidikan di Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta.
3. Ibu Ofa Suzanti Betha M.Si, Apt, selaku dosen pembimbing 1 dan Bapak
4. Prof. DR (hc). Dr. M.K. Tadjudin, Sp. And, selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta.
5. Bapak Drs. Umar Mansur M.Sc., Apt, selaku kepala prodi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta.
6. Bapak dan ibu staff pengajar dan karyawan yang telah memberikan
bantuan dan bimbingan kepada penulis selama menempuh pendidikan di
Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam Negeri Syarif Hidayatullah Jakarta.
7. Rekan-rekan Santri Jadi Dokter (SJD-Sumsel), teman-teman Farmasi
2009 yang selalu memberikan dukungan, semangat perjuangan serta
pengalaman kebersamaan yang tak ternilai. Untuk Tika, Kiki, Rani,
Nurul, Maharani, dkk terima kasih atas segala semangat, dukungan,
keceriaan dan kebersamaan yang tak terlupakan, sukses untuk kita
semua. Serta semua pihak yang tidak dapat disebutkan satu persatu.
Penulis menyadari sepenuhnya bahwa skripsi ini masih banyak kekurangan
dan jauh dari kesempurnaan. Oleh sebab itu dengan segala kerendahan hati
penulis sangat mengharapkan kritik dan saran demi kesempurnaan skripsi ini
Akhir kata, penulis berharap Allah SWT berkenan membalas segala
kebaikan semua pihak yang telah membantu penulis dalam menyelesaikan skripsi
ini. Semoga skripsi ini dapat bermanfaat dan dapat memberi sumbangan
pengetahuan khususnya di Program Studi Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta dan bagi pembaca
pada umumnya yang mempergunakannya terutama untuk proses kemajuan
pendidikan.
Jakarta, 12 September 2013
DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
2.1.1 Pengertian, Sumber dan Struktur Pektin ... 5
2.1.2 Jenis Pektin ... 7
2.2.6 Derajat Esterifikasi ... 16
2.2.7 Kekuatan Gel ... 17
2.2.8 Bilangan Asetil ... 17
2.3Pisang Kepok (Musa balbisiana) ... 18
2.3.1Uraian Umum Pisang ... 18
2.3.2Klasifikasi Pisang Kepok (Musa balbisiana) ... 19
2.3.3Kandungan Kimia Kulit Pisang ... 20
2.4Asam Laktat ... 21
BAB 3 METODE PENELITIAN ... 24
3.5.2Karakterisasi Pektin Hasil Ekstraksi ... 27
3.5.3Perbandingan Spektrum FTIR ... 29
BAB 4 HASIL DAN PEMBAHASAN ... 30
4.1Bahan Baku ... 30
4.1.1 Penentuan Bahan Baku ... 30
4.1.2Determinasi Tanaman Bahan Baku ... 30
4.1.3Persiapan Bahan Baku... 31
4.2Ekstraksi Pektin ... 32
4.3Pemerian Pektin Hasil Ekstraksi ... 34
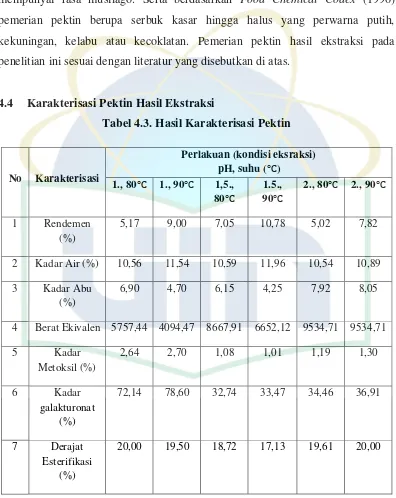
4.4Karakterisasi Pektin Hasil Ekstraksi... 36
4.4.1Rendemen ... 37
4.4.7Derajat Esterifikasi ... 48
4.5Perbandingan Spektrum FTIR ... 49
BAB 5 KESIMPULAN DAN SARAN ... 53
5.1Kesimpulan ... 53
5.2Saran ... 53
DAFTAR GAMBAR
Halaman
Gambar 2.1. Struktur Dinding Sel Tanaman ... 5
Gambar 2.2. Struktur Pektin ... 7
Gambar 2.3. Molekul Pektin dengan Kadar Metoksil Tinggi ... 8
Gambar 2.4. Molekul Pektin dengan Kadar Metoksil Rendah ... 8
Gambar 2.5. Pisang Kepok ... 20
Gambar 3.1. Alur Penelitian ... 24
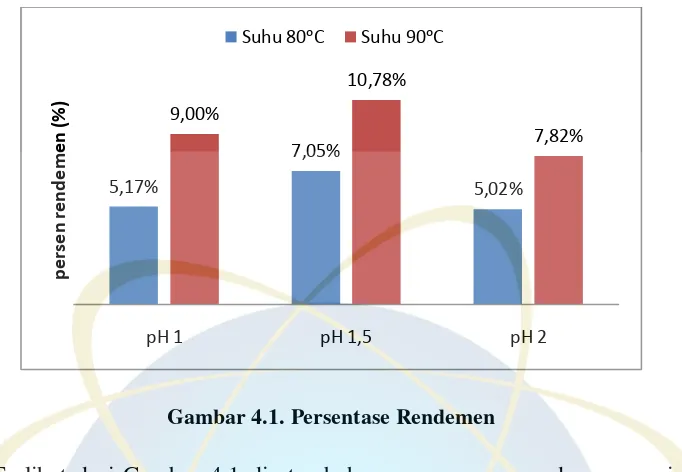
Gambar 4.1. Persentase Rendemen ... 38
Gambar 4.2. Kadar Air ... 40
Gambar 4.3. Kadar Abu ... 41
Gambar 4.4. Berat Ekivalen ... 43
Gambar 4.5. Kadar Metoksil ... 45
Gambar 4.6. Kadar Asam Galakturonat ... 47
Gambar 4.7. Derajat Esterifikasi ... 49
DAFTAR TABEL
Halaman
Tabel 2.1. Standar Mutu Pektin ... 14
Tabel 2.2. Spesifikasi Pektin Berdasarkan Farmakope ... 14
Tabel 4.1. Bahan Baku ... 31
Tabel 4.2. Pemerian Pektin Hasil Ekstraksi ... 34
Tabel 4.3. Hasil Karakterisasi Pektin ... 36
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Determinasi Tumbuhan ... 59
Lampiran 2. Hasil Pemeriksaan Kadar Air Serbuk Kulit Pisang ... 60
Lampiran 3. Karakterisasi Pektin Hasil Ekstraksi ... 61
Lampiran 4. Hasil Spektrum FTIR ... 70
1.1 Latar Belakang
Komoditas pisang di Indonesia menduduki tempat pertama di antara jenis
buah-buahan lainnya, baik dari segi luas pertanamannya maupun dari segi
produksinya. Pada tahun 2010, produksi pisang di Indonesia mencapai 5,8 juta
ton atau sekitar 30% dari produksi buah nasional (Kuntarsih, 2012).
Sentra produksi pisang di Indonesia adalah, NAD (Pidie, Aceh Besar),
Sumatera Utara (Deli Serdang, Serdang Begadai), Sumatera Barat (Pasaman
Barat), Lampung (Lampung Selatan, Lampung Timur, Lampung Barat), Jawa
Barat (Cianjur, Bogor, Sukabumi, Tasikmalaya, Sumedang, Ciamis, Garut), Jawa
Tengah (Kendal, Purbalingga, Banyumas, Cilacap), Jawa Timur (Lumajang,
Malang), NTT (Ngada, Nagageo, Ende, Sikka), Kalimantan Selatan (Tapin,
Banjar), Kalimantan Timur (Kutai Timur, Kutai Kertanegara) (Departemen
Pertanian, 2012).
Buah pisang sangat digemari untuk dikonsumsi baik secara langsung sebagai
buah segar ataupun sebagai produk olahan. Saat ini kulit pisang digunakan untuk
pakan ternak atau hanya dibuang sebagai limbah rumahan atau industri.
Pemanfaatan kulit pisang tersebut kurang optimal, padahal kulit pisang
mengandung komponen yang bermanfaat bagi manusia.
Menurut hasil penelitian dari Balai Penelitian dan Pengembangan Industri,
tanaman pisang mengandung berbagai macam senyawa seperti air, gula
pereduksi, sukrosa, pati, protein kasar, pektin, lemak kasar, serat kasar, dan abu.
Senyawa pektin cukup besar terkandung di dalam kulit pisang (Satria dan Ahda,
2009).
Pektin adalah substansi alami yang terdapat pada sebagian besar tanaman
pangan. Selain sebagai elemen struktural pada pertumbuhan jaringan dan
komponen utama dari lamela tengah pada tanaman, pektin juga berperan sebagai
glikosidik α(1-4). Sebagian gugus karboksil pada polimer pektin mengalami
esterifikasi dengan metil (metilasi) menjadi gugus metoksil (Akhmalludin dan
Kurniawan 2009).
Pektin dapat dimanfaatkan dalam beberapa bidang industri, misalnya pada
industri pangan dan industri farmasi. Dalam industri pangan, pektin berperan
sebagai bahan pokok pembuatan jeli, selai, dan marmalade (Herbstreith dan Fox,
2005). Pektin dalam industri farmasi sebagai agen pembentuk gel, pengental,
penstabil dan pengemulsi (Commite on Food Chemical Codex, 1996). Pektin juga
dapat digunakan sebagai bahan terapi diare, sembelit, dan obesitas (Rowe, et al.,
2006).
Hingga tahun 2012, pektin yang digunakan di industri-industri Indonesia
merupakan barang impor. Data terakhir pada Januari sampai November 2012
jumlah impor substansi pektin, yaitu 2.276.742 kg dengan nilai sebesar US $
2.132.966 (Badan Pusat Statistik, 2012).
Pektin komersial biasanya diperoleh dari kulit buah sitrus atau apel, namun
dengan berkembangnya penelitian, pektin juga dapat diperoleh dari pengolahan
kulit pisang kepok, kulit pisang raja, buah naga, kulit coklat, limbah pengolahan
jeruk, cincau hijau, ampas nanas serta kulit durian. Baker (1997) menyebutkan
pektin juga dapat diperoleh dari lemon, aprikot, beri-berian, anggur, labu-abuan
dan semangka. Sebagian besar pektin diproduksi dengan mengekstraksi bahan
baku dengan larutan asam mineral panas (May, 1990) dan dapat pula
menggunakan asam organik (Kertesz, 1951).
Karakteristik pektin yang baik berdasarkan IPPA (2002) dan Food Chemical
Codex (1996) adalah memiliki kadar air maksimum 12%, kadar abu maksimum
10%, berat ekivalen 600-800 mg, kandungan metoksil tinggi jika >7,12%,
bermetoksil rendah jika 2,5-7,12%, kadar asam galakturonat minimal 35%, derajat
esterifikasi untuk pektin ester tinggi minimal 50% dan derajat esterifikasi untuk
pektin ester rendah maksimum 50%. Menurut Budiyanto dan Yulianingsih (2008)
perlakuan suhu, waktu ekstraksi pektin dan interaksi keduanya berpengaruh nyata
terhadap karakteristik pektin yang dihasilkan. Kondisi ekstraksi pektin
berpengaruh terhadap karakteristik pektin dan sifat fisik pektin tergantung dari
Hasil penelitian yang dilakukan oleh Tarigan, et al., (2012) menunjukkan
bahwa karakteristik pektin terbaik hasil ekstraksi dari kulit pisang kepok
menggunakan asam klorida (HCl) diperoleh pada temperatur 90℃, pH 1,5 selama
80 menit dengan perolehan rendemen tertinggi, kadar air 11,88%, kadar abu
0,98%, dan kadar metoksil 3,72%. Ekstraksi kulit papaya dengan pelarut asam
asetat (CH3COOH) oleh Sofiana, et al., (2012), pada temperatur 80℃ selama 2
jam menghasilkan karakteristik pektin terbaik dengan rendemen 3,26%, kadar
metoksil 4,65% dan kadar galakturonat 64,02%.
Penggunaan asam organik seperti asam laktat dalam ekstraksi pektin sangat
jarang dipublikasikan, sehingga peneliti sangat tertarik untuk mengetahui karakter
pektin yang dihasilkan. Pengkarakterisasian pektin hasil ekstraksi tersebut
diharapkan dapat memberikan informasi dan menjadi suatu peluang dalam
mengembangkan sumber pektin baru dengan memanfaatkan kulit pisang kepok
sebagai bahan bakunya yang selama ini hanya menjadi limbah.
1.2 Rumusan Masalah
Ditinjau dari latar belakang di atas maka dapat dirumuskan masalah dalam
penelitian ini adalah:
1. Belum diketahuinya karakteristik pektin hasil ekstraksi dari limbah kulit
pisang kepok menggunakan pelarut asam laktat dengan variasi pH dan suhu
ekstraksi.
2. Bagaimanakah karakteristik pektin yang dihasilkan dan apakah karateristik
tersebut sesuai dalam standar mutu yang telah ditetapkan.
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan data karakteristik pektin yang
dihasilkan dari ekstraksi limbah kulit pisang kepok menggunakan asam laktat
1.4 Manfaat Hasil Penelitian
Hasil penelitian ini diharapkan mampu memberikan informasi karakteristik
pektin hasil ekstraksi dari limbah kulit pisang kepok menggunakan asam laktat
2.1 Pektin
2.1.1 Pengertian, Sumber dan Struktur Pektin
Berdasarkan Herbstreith dan Fox (2005) kata pektin berasal dari bahasa
Latin “pectos” yang berarti pengental atau yang membuat sesuatu menjadi keras atau padat. Pektin ditemukan oleh Vauquelin dalam jus buah sekitar 200 tahun
yang lalu. Pada tahun 1790, pektin belum diberi nama. Nama pektin pertama kali
digunakan pada tahun 1824, yaitu ketika Braconnot melanjutkan penelitian yang
dirintis oleh Vauquelin. Braconnot menyebut substansi pembentuk gel tersebut
sebagai asam pektat.
Menurut Hasbullah (2001) yang dijelaskan dalam Tarigan, et al., (2012)
pektin merupakan polisakarida kompleks yang bersifat asam yang terdapat dalam
jumlah bervariasi, terdistribusi secara luas dalam jaringan tanaman. Umumnya
pektin terdapat di dalam dinding sel primer. Khususnya di sela-sela antara
selulosa dan hemiselulosa. Pektin juga berfungsi sebagai bahan perekat antara
dinding sel yang satu dengan yang lainnya. Substansi pektin tersusun dari asam
poligalakturonat, dimana gugus karboksil dari unit asam poligalakturonat dapat
teresterifikasi sebagian dengan metanol.
Sumber: IPPA (2002)
Senyawa pektin adalah asam pektat, asam pektinat dan protopektin menurut
(Winarno, 1989 dan Klavons, 1995 dalam Tarigan, et al., 2012).
1. Asam Pektat
Asam pektat adalah senyawa asam galakturonat yang bersifat koloid dan
pada dasarnya bebas dari kandungan metil ester.
2. Asam Pektinat
Asam pektinat adalah asam poligalakturonat yang bersifat koloid dan
mengandung sejumlah metil ester. Pektin merupakan asam pektinat dengan
kandungan metil ester dan derajat netralisasi yang berbeda-beda.
3. Protopektin
Protopektin adalah substansi pektat yang tidak larut dalam air, terdapat
dalam tanaman, jika dipisahkan secara hidrolisis akan menghasilkan asam
pektinat.
Winarno (2002) mengemukakan komposisi kandungan protopektin, pektin,
dan asam pektat dalam buah sangat bervariasi dan tergantung pada derajat
kematangan buah. Pada umumnya protopektin yang bersifat tidak larut dalam air
dan lebih banyak terdapat pada buah-buahan yang belum matang. Dwidjoseputro
(1983) menjelaskan bahwa di dalam buah-buahan yang masih muda, sel-sel yang
satu dengan sel-sel yang lain masih dipersatukan dengan kuat oleh protopektin
tersebut. Akan tetapi jika buah menjadi dewasa, maka sebagian dari protopektin
mengalami penguraian menjadi pektin karena pertolongan enzim protopektinase.
Hal ini mengakibatkan terlepasnya sel-sel satu dari yang lain, sehingga buah
menjadi lunak. Selanjutnya enzim pektinase meneruskan pengubahan pektin
menjadi asam-pektat, hal mana menyebabkan buah menjadi matang.
Adapun Rowe, et al., (2006) menjelaskan bahwa pektin merupakan molekul
dengan bobot molekul tinggi, kunstituen dalam tanaman yang menyerupai
karbohidrat, terutama terdiri dari unit rantai asam galakturonat terikat dengan
ikatan 1,4-α-glukosida, dengan berat molekul 30.000-100.000. Pektin merupakan
kompleks polisakarida yang terutama terdiri dari residu asam D-galakturonat yang
teresterifikasi dalam rantai α-(1-4). Gugus asam sepanjang rantai sebagian besar teresterifikasi membentuk kelompok metoksil. Kadar metoksil pektin bervariasi
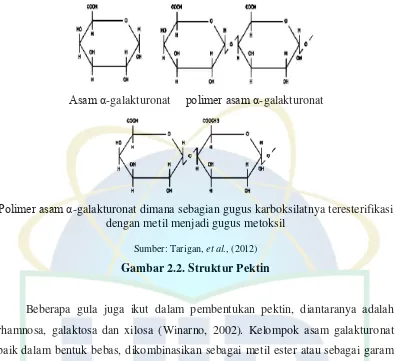
Asam α-galakturonat polimer asam α-galakturonat
Polimer asam α-galakturonat dimana sebagian gugus karboksilatnya teresterifikasi dengan metil menjadi gugus metoksil
Sumber: Tarigan, et al., (2012)
Gambar 2.2. Struktur Pektin
Beberapa gula juga ikut dalam pembentukan pektin, diantaranya adalah
rhamnosa, galaktosa dan xilosa (Winarno, 2002). Kelompok asam galakturonat
baik dalam bentuk bebas, dikombinasikan sebagai metil ester atau sebagai garam
natrium, kalium, kalsium atau amonium dan dalam beberapa kelompok pektin
amida (IPPA, 2002).
2.1.2 Jenis Pektin
Berdasarkan derajat esterifikasi (DE) pektin dibedakan menjadi dua
golongan, yaitu pektin dengan kadar metoksi tinggi (HM) dan pektin dengan
kadar metoksi rendah (LM). Nilai DE untuk pektin komersial dengan derajat
metoksi tinggi biasanya berkisar dari 60-75% dan untuk pektin dengan derajat
metoksi rendah berkisar dari 20-40%. Untuk pektin dengan kadar metoksi tinggi
memerlukan jumlah minimum padatan terlarut dan pH dalam kisaran yang sempit
sekitar 3,0 untuk membentuk gel. Pektin dengan kadar metoksi tinggi bersifat
termal reversibel dan secara umum larut terhadap air panas serta seringkali
mengandung zat terdispersi seperti dekstrosa untuk mencegah penggumpalan.
Pektin dengan kadar metoksi rendah menghasilkan pembentukan gel yang
adanya sejumlah kalsium atau kation divalent lainnya untuk pembentukan gel
(Sriamornsak, 2003). Pengaruh terbesar pada sifat pektin adalah derajat
esterifikasi (DE) yang misalnya menentukan tingkat reaktivitas dengan kalsium
dan kation lainnya (International Pectin Producers Association, 2002).
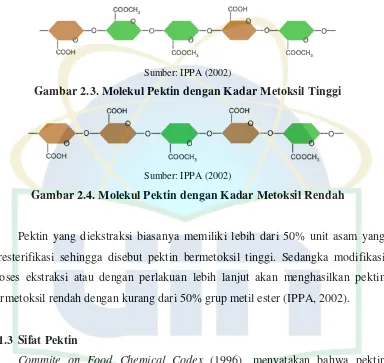
Sumber: IPPA (2002)
Gambar 2.3. Molekul Pektin dengan Kadar Metoksil Tinggi
Sumber: IPPA (2002)
Gambar 2.4. Molekul Pektin dengan Kadar Metoksil Rendah
Pektin yang diekstraksi biasanya memiliki lebih dari 50% unit asam yang
teresterifikasi sehingga disebut pektin bermetoksil tinggi. Sedangka modifikasi
proses ekstraksi atau dengan perlakuan lebih lanjut akan menghasilkan pektin
bermetoksil rendah dengan kurang dari 50% grup metil ester (IPPA, 2002).
2.1.3 Sifat Pektin
Commite on Food Chemical Codex (1996), menyatakan bahwa pektin
sebagian besar tersusun atas metil ester dari asam poligalakturonat dan sodium,
potasium, kalsium dan garam ammonium. Pektin merupakan zat berbentuk serbuk
kasar hingga halus yang berwarna putih, kekuningan, kelabu atau kecoklatan dan
banyak terdapat pada buah-buahan dan sayuran matang.
Berdasarkan Farmakope Indonesia Edisi IV (1995) pektin berupa serbuk
kasar atau halus, berwarna putih kekuningan, hampir tidak berbau dan mempunyai
rasa musilago. Pektin hampir larut sempurna dalam 20 bagian air, membentuk
cairan kental, opalesen, larutan koloidal mudah dituang dan bersifat asam
terhadap lakmus, praktis tidak larut dalam etanol atau pelarut organik lain. Pektin
gliserin, atau dengan sirup simplek atau jika permukaan dicampur dengan 3
bagian atau lebih sukrosa.
Menurut May (1990), pektin merupakan asam poligalakturonat yang
bermuatan negatif. Pektin bereaksi dengan makromolekul bermuatan positif.
Pembentukan gel dapat terjadi dengan cepat pada pH rendah, tetapi reaksi ini
dapat dihambat dengan penambahan garam.
Gliksman (1969) di dalam Hariyati (2006) memaparkan pembentukan gel
pektin metoksil tinggi terjadi melalui ikatan hidrogen diantara gugus karboksil
bebas dan antara gugus hidroksil. Pada pektin metoksil rendah, kemampuan
membentuk gel dengan gula dan asam hilang. Sebaliknya pektin ini mampu
membentuk gel dengan adanya ion kalsium.
Rouse (1977) serta Chang dan Miyamoto (1992) menjelaskan faktor-faktor
yang mempengaruhi pembentukan gel dengan tingkat kekenyalan dan kekuatan
tertentu meliputi pH, konsentrasi pektin, suhu, ion kalsium, dan gula (Hariyati,
2006). Kekentalan larutan pektin mempunyai kisaran yang cukup lebar tergantung
pada konsentrasi pektin, garam, dan ukuran rantai asam poligalakturonat.
Meskipun pektin umumnya terkandung di sebagian besar jaringan tanaman,
namun sumber yang dapat digunakan untuk pembuatan pektin komersial sangat
terbatas. Hal demikian dikarenakan kemampuan pektin untuk membentuk gel
tergantung pada ukuran molekul dan derajat esterifikasi (DE). Pektin dari sumber
yang berbeda tidak memiliki kemampuan membentuk gel yang sama karena
adanya variasi dalam parameter ini (Sriamornsak, 2003).
2.1.4 Kegunaan Pektin
Pektin adalah produk alami yang dapat ditemukan dalam dinding sel dari
semua tanaman tingkat tinggi. Umumnya digunakan sebagai agen pembentuk gel,
penebal dan penstabil. Saat ini pektin merupakan komponen yang tak terpisahkan
dari berbagai macam produk baik dalam industri makanan, dimana ia digunakan
dalam produksi selai, gula-gula, pasta, dan produk susu. Pektin juga dapat
dimanfaatkan dalam industri non-pangan, seperti dalam kosmetik dan farmasi.
Beberapa tahun terakhir manfaat pektin semakin penting dan dibutuhkan oleh
Pektin merupakan salah satu tipe serat pangan yang bersifat larut dalam air,
karena merupakan serat yang berbentuk gel, pektin dapat memperbaiki otot
pencernaan dan mendorong sisa makanan pada saluran pembuangan. Pektin juga
dikenal sebagai antikolesterol karena dapat mengikat asam empedu yang
merupakan hasil akhir metabolism kolesterol. Makin banyak asam empedu yang
berikatan dengan pektin dan terbuang ke luar tubuh, makin banyak kolesterol
yang dimetabolisme sehingga pada akhirnya kolesterol menurun jumlahnya.
Selain itu, pektin juga dapat menyerap kelebihan air dalam usus, memperlunak
feses, serta mengikat dan menghilangkan racun dari usus (Ide, 2009).
Pektin dengan sendirinya atau dengan sifat pembentuk gelnya dimanfaatkan
dalam industri farmasi, kesehatan dan pengobatan. Pektin telah digunakan secara
potensial sebagai karier atau pembawa untuk pengiriman obat ke saluran
pencernaan, seperti matriks tablet, gel beads dan film-coated. Pektin merupakan
senyawa menarik bagi keperluan dalam bidang farmasi, misalnya sebagai
pembawa berbagai obat untuk aplikasi pelepasan terkontrol. Banyak teknik telah
digunakan untuk memproduksi pektin berbasis sistem pengiriman, terutama
ionotropik gelasi dan gel coating. Dengan teknik sederhana dan dengan profil
toksisitas yang sangat aman, membuat pektin sebagai eksipien menarik dan
menjanjikan dalam bidang industri farmasi untuk aplikasi sekarang maupun masa
depan (Sriamornsak, 2003). Dalam usus besar, mikroorganisme mendegradasi
pektin dan membebaskan rantai pendek asam lemak yang memiliki pengaruh
positif pada kesehatan atau dikenal sebagai efek prebiotik (Srivastava dan
Malviya, 2011).
Srivastava dan Malviya (2011) menjelaskan pektin dapat digunakan sebagai
polimer mukoadhesiv, agen pembentuk gel, pengental, pengikat air dan stabilator.
Dalam bidang kedokteran dan farmasi, pektin digunakan untuk mengatasi
konstipasi dan diare, sebagai salah satu bahan utama yang digunakan dalam
Kaopektat, bersama dengan kaolinit. pektin juga digunakan dalam pelega
tenggorokan sebagai demulcent, sebagai sumber diet serat, sebagai komponen
propilaktit alami untuk melawan keracunan kation toksik, dalam formulasi
Sriamornsak (2003) menjelaskan dalam jurnalnya bahwa di bidang farmasi
pektin digunakan sebagai pembawa obat ke saluran pencernaan, seperti matriks
tablet dan sediaan salut tipis. Selain itu dijabarkan pula beberapa menfaat dari
pektin, diantaranya adalah mengkonsumsi setidaknya 6 gram per hari pektin
memiliki pengaruh yang signifikan terhadap pengurangan kolesterol, namun jika
kurang dari 6 gram per hari pektin tidak efektif. Pektin bertindak sebagai zat
penangkal alami terhadap keracunan dari kation beracun. Telah terbuksti efektif
dalam mengatasi keracunan timah dan merkuri pada saluran pencernaan dan organ
pernafasan. Ketika disuntikkan secara inravena, pektin menimbulkan efek
mempersingkat waktu koagulasi darah yang diambil, sehingga berguna dalam
pengendalian perdarahan. Pektin dan kombinasi dari pektin dengan koloid lain
yang telah digunakan efektif untuk mengobati diare, terutama pada bayi dan
anak-anak. Dalam kondisi in-vitro tertentu pektin mungkin memiliki efek antimikroba
terhadap Escherichia coli. Pektin dapat mengurangi laju pencernaan oleh
immobilisasi komponen makanan dalam usus, menyebabkan penyerapan makanan
menjadi lebih sedikit. Ketebalan lapisan pektin mempengaruhi penyerapan karena
mengurangi kontak antara enzim usus dan makanan sehingga mengurangi
ketersediaan sari makanan. Adanya kapasitas waterbinding yang besar, pektin
memberikan rasa kenyang sehingga mengurangi konsumsi makanan. Hasil
percobaan menunjukkan perpanjangan waktu paruh pengosongan lambung 23-50
menit dengan makanan yang diperkaya dengan pektin. Sifat-sifat pektin
dimanfaatkan dalam pengobatan penyakit yang berhubungan dengan gangguan
makan yang berlebihan. Pektin hidrogel telah digunakan dalam formulasi tablet
sebagai agen pengikat dan telah digunakan dalam formulasi tablet lepas
terkontrol.
2.1.5 Ekstraksi Pektin
Ekstraksi pektin merupakan proses pengeluaran pektin dari sel pada
jaringan tanaman. Ekstraksi pektin dengan larutan asam dilakukan dengan cara
memanaskan bahan dalam larutan asam encer yang berfungsi untuk
menghidrolisis protopektin menjadi pektin. Ekstraksi ini dapat dilakukan dengan
ekstraksi, semakin singkat waktu yang dibutuhkan untuk mendapatkan hasil
yang maksimum. Tatapi dalam hal ini faktor keasaman yang digunakan tidak
bisa diabaikan. Kisaran pH yang dirokemendasikan 1,5 – 3,0 tetapi pH kisaran
pada pH 2,6 – 2,8 lebih sering dipakai (Kirk dan Othmer, 1958 di dalam
Akmalludin dan Kurniawan 2009).
Beberapa jenis asam dapat digunakan dalam ekstraksi pektin, diantaranya
adalah asam tartrat, asam malat, asam sitrat, asam laktat, asam asetat, asam fosfat
tetapi ada kecenderungan untuk menggunakan asam mineral yang murah seperti
asam sulfat, asam klorida, dan asam nitrat (Kertesz, 1951 di dalam Hariyati,
2006).
Menurut Sriamornsak (2003) pektin komersial diekstraksi dengan
memperlakukan bahan baku dengan asam mineral encer panas pada pH sekitar 2.
Lama waktu ekstraksi bervariasi tergantung dengan bahan baku, jenis pektin yang
diinginkan dan tergantung oleh suatu produsen tertentu. Ekstrak pektin panas
dipisahkan dari residu padat semaksimal mungkin.
Berdasarkan May (2000) pektin kebanyakan diproduksi dengan
mengekstraksi bahan baku dengan larutan asam mineral panas. Setiap produsen
pektin telah mengembangkan kondisi yang sesuai dengan jenis bahan baku yang
diolah di pabrik mereka, namun tujuannya adalah selalu untuk menghasilkan
bubur yang mengandung residu padat yang dapat dengan mudah dipisahkan oleh
teknologi yang dipilih, dan fase cair (filtrat) yang mengandung pektin konsentrasi
tinggi dan berat molekul tinggi, tanpa menghasilkan viskositas yang berlebihan.
Menghilangkan kotoran pada ekstrak cair dilakukan sebelum dilanjutkan untuk
mengisolasi pektin padat. Pada prinsipnya, pektin murni dapat diisolasi dengan
berbagai cara. Metode yang paling umum digunakan adalah dengan mencampur
ekstrak pekat dengan pelarut organik yang melarutkan pektin, tapi memungkinkan
banyak kotoran tetap dalam larutan. Standar makanan internasional mengizinkan
penggunaan metanol, etanol, atau isopropanol sebagai pelarut organik. Dalam
proses ini, ekstrak pektin dapat diperoleh dengan konsentrasi sekitar 2%, dan
dicampur dengan alkohol yang cukup untuk membentuk endapan yang
selanjutnya dapat dilakukan pemisahan dengan penyaringan atau sentrifugasi.
beberapa kali dengan air dan alkohol untuk menghilangkan garam dan kotoran
lainnya. Menurut Ranganna (1977) pengumpulan pektin dapat dilakukan dengan
menggunakan alkohol 95% yang mengandung 2 mL asam klorida setiap satu liter
alkohol. Biasanya untuk pengendapan secara komersial digunakan alkohol dan
garam metal seperti alumunium hidroksida, kalium sulfat atau alumunium sulfat.
Penggunaan asam dalam ekstraksi pektin adalah untuk menghidrolisis
protopektin menjadi pektin yang larut dalam air ataupun membebaskan pektin dari
ikatan dengan senyawa lain, misalnya selulosa (Kaban, et al., 2012). Disini asam
dengan ion H+ berfungsi selain memecahkan ikatan protopektin dengan
senyawa-senyawa dalam dinding sel tanaman juga menyatukan satu molekul pektin yang
lain sehingga terbentuk sebuah jaringan yang dapat memerangkap air (Nurhikmat,
2003).
Berdasarkan Rouse (1977) di dalam Astuti (2007) penggumpalan atau
koagulasi pektin terjadi karena gangguan terhadap kestabilan dispersi koloidalnya.
Pektin adalah termasuk koloidal hidrofilik yang bermuatan negatif (dari gugus
karboksil bebas yang terionisasi) dan tidak mempunyai titik isoelektrik. Seperti
koloid hidrofilik umumnya, pektin distabilkan terutama oleh hidrasi partikelnya
daripada oleh muatannya. Pektin distabilkan oleh selapis air melalui ikatan
elektrostatik antara muatan negatif molekul pektin dan muatan positif molekul air.
Penambahan zat pendehidrasi seperti alkohol dapat mengurangi stabilitas disperse
pektin karena efek dehidrasi mengganggu keseimbangan pektin-air, sehingga
2.2 Karakteristik Pektin
Berikut adalah standar mutu pektin dan spesifikasi pektin, berdasarkan
standar mutu International Pectin Producers Association (2002), Food Chemical
Codex (1996) dan Hanbook of Pharmaceutical Excipiens (2006).
Tabel 2.1. Standar Mutu Pektin
Tabel 2.2 Spesifikasi Pektin Berdasarkan Farmakope
Pektin komersial harus memenuhi syarat mutu International Pectin
Producers Association (IPPA) dan Food Chemical Codex serta spesifikasi dalam
Farmakope di atas. Karakteristik pektin tergantung dari kondisi ekstraksi pektin,
dan sifat fisik pektin tergantung dari karakteristik kimia pektin. Pektin hasil
ekstraksi terbaik biasanya diperbandingkan dengan pektin komersial. Hal ini
dilakukan karena jika diaplikasikan pada industri kebutuhan energi untuk
peningkatan suhu dan lama ekstraksi akan meningkatkan biaya produksi. Apabila
perlakuan suhu terendah dan waktu paling cepat dapat memberi hasil yang masih
diperbolehkan oleh International Pectin Producers Association, Food Chemical
Codex dan Farmakope maka hal ini akan sangat menguntungkan jika
diaplikasikan (Fitriani, 2003).
2.2.1 Kadar Air
Pengukuran kandungan air yang berada di dalam bahan (Departemen
Kesehatan, 2000). Kadar air suatu bahan berpengaruh terhadap masa simpan.
Kadar air yang tinggi menyebabkan kerentanan terhadap aktivitas mikroba
(Budiyanto dan Yulianingsih, 2008).
2.2.2 Kadar Abu
Abu merupakan residu atau sisa pembakaran bahan organik yang berupa
bahan anorganik. Kadar abu berpengaruh pada tingkat kemurnian pektin. Semakin
tinggi tingkat kemurnian pektin, kadar abu dalam pektin semakin rendah
(Budiyanto dan Yulianingsih, 2008).
Prinsip penetapan kadar abu adalah bahan dipanaskan pada temperatur
dimana senyawa organik dan turunannya terdestruksi dan menguap, sehingga
tinggal unsur mineral dan anorganik (Departemen Kesehatan, 2000).
2.2.3 Berat Ekivalen
Berat ekivalen merupakan ukuran terhadap kandungan gugus asam
galakturonat bebas (tidak teresterifikasi) dalam rantai molekul pektin. Asam
pektat murni merupakan zat pektat yang seluruhnya tersusun dari asam
esterifikasi. Semakin rendah kadar pektin akan menyebabkan berat ekivalen
semakin rendah (Ranganna, 1977).
2.2.4 Kadar Metoksil
Constenla dan Lozano (2003) mendefinisikan kadar metoksil sebagai
jumlah mol etanol yang terdapat di dalam 100 mol asam galakturonat. Kadar
metoksil pektin memiliki peranan penting dalam menentukan sifat fungsional
larutan pektin dan dapat mempengaruhi struktur dan tekstur dari gel pektin.
Berdasarkan kandungan metoksilnya, pektin dapat dibagi menjadi dua
golongan yaitu pektin berkadar metoksil tinggi (HMP), dan pektin berkadar
metoksil rendah (LMP). Pektin bermetoksil tinggi mempunyai kandungan
metoksil minimal 7%, sedangkan pektin bermetoksil rendah mempunyai
kandungan pektin maksimal 7%) (Guichard, 1991 di dalamHariyati, 2006).
2.2.5 Kadar Asam Galakturonat
Perhitungan kandungan asam galakturonat sangat penting untuk mengetahui
kemurnian pektin. Kadar galakturonat dan muatan molekul pektin memiliki
peranan penting dalam menentukan sifat fungsional larutan pektin. Kadar
galakturonat dapat mempengaruhi struktur dan tekstur dari gel pektin (Sofiana, et
al., 2012).
2.2.6 Derajat Esterifikasi (DE)
Derajat esterifikasi didefinisikan sebagai persentase grup karboksil yeng
teresterifikasi. Pektin dengan derajat esterifikasi di atas 50% dinamakan pektin
tinggi metoksi dan derajat esterifikasi di bawah 50% dinamakan pektin rendah
metoksi (Siamornsak, 2003).
Derajat esterifikasi merupakan persentase jumlah residu asam
D-galakturonat yang gugus karboksilnya teresterifikasi dengan etanol. Semakin
tinggi suhu dan lama proses ekstraksi dapat menyebabkan degradasi gugus metil
ester pada pektin menjadi asam karboksil oleh adanya asam. Ikatan glikosidik
gugus metil ester dari pektin cenderung terhidrolisis menghasilkan asam
asam pektat yang asam galakturonatnya bebas dari gugus metil ester. Jumlah
gugus metil ester menunjukkan jumlah gugus karboksil yang tidak teresterifikasi
atau derajat esterifikasi (Budiyanto dan Yulianingsih, 2008).
2.2.7 Kekuatan Gel
Konsentrasi pektin berpengaruh terhadap pembentukan gel dengan tingkat
kekenyalan dan kekuatan tertentu (Budiyanto dan Yulianingsih, 2008). Grade dari
pektin merupakan indikasi penting yang menggambarkan mutu pektin. Grade
pektin didefinisikan sebagai jumlah gula yang dibutuhkan oleh satu bagian pektin
untuk membentuk gel yang diinginkan pada kondisi yang sesuai. Pektin yang
mempunyai grade pektin 100 berarti dapat membentuk gel yang baik dengan 100
gram gula. Penentuan grade pektin biasanya menggunakan metode International
Food Technologist (IFT) yaitu dengan membuat gel dengan konsentrasi gula 65%
pada pH 2,2 - pH 2,4. Gel kemudian disimpan selama 18-24 jam dan kemudian
diuji dengan alat Ridgelimeter (Meilina dan Silah, 2003).
2.2.8 Bilangan Asetil
Pektin gula bit mengandung gugus asetil, dimungkinkan juga dalam pektin
lain mengandung gugus asetil ini. Jika gugus asetil hadir dalam pektin maka akan
menghambat pembentukan jelly. Analisis adanya gugus asetil menggunakan
prosedur saponifikasi alkali sederhana diikuti dengan titrasi kembali namun
2.3 Pisang Kepok (Musa balbisiana)
2.3.1 Uraian Umum Pisang
Pisang adalah tanaman herba yang berasal dari kawasan Asia Tenggara
(termasuk Indonesia). Tanaman buah ini kemudian menyebar luas ke kawasan
Afrika (Madagaskar), Amerika Selatan dan Amerika Tengah. Penyebaran
tanaman ini selanjutnya hampir merata ke seluruh dunia, yakni meliputi daerah
tropik dan subtropik, dimulai dari Asia Tenggara ke timur melalui Lautan Teduh
sampai ke Hawai. Selain itu tanaman pisang menyebar ke barat melalui Samudera
Atlantik, Kepulauan Kenari sampai Benua Amerika (Suyanti dan Supriyadi,
2008).
Produksi pisang dunia dalam 120 negara diperkirakan mencapai 68 juta
setiap tahunnya. Negara-negara Asia Tenggara penghasil pisang yang terkenal
diantaranya adalah Filipina, Thailand, Malaysia dan Indonesia. Indonesia, Filipina
dan Thailand merupakan negara penghasil pisang nomor satu di kawasan Asia
Tenggara (Verheij dan Coronel, 1992).
Pisang merupakan tumbuhan basah yang besar, biasanya mempunyai batang
semu yang tersusun dari pelepah-pelepah daun. Tangkai daun jelas beralur pada
sisi atasnya, helaian daun lebar, bangun jorong memanjang, dengan ibu tulang
yang nyata dan tulang-tulang cabang yang menyirip dan kecil-kecil. Bunga dalam
suatu bunga majemuk dengan daun-daun pelindung yang besar dan berwarna
merah. Masing-masing bunga mempunyai tenda bunga yang menyerupai mahkota
atau jelas mempunyai kelopak dan mahkota yang biasanya berlekatan, zigomorf.
Benang sari 6 yang 5 fertil yang satu staminoidal. Bakal buah tenggelam, beruang
3 dengan 1 bakal biji dalam tiap ruang. Tangkai putik berbelah 3-6. Buahnya buah
buni atau buah kendaga. Biji mempunyai salut, endosperm dan juga perisperm
(Tjitrosoepomo, 1994).
Pemanfaatan pisang telah meluas di kalangan masyarakat, baik dari mulai
daun, batang, bunga, buah hingga kulitnya. Buah pisang memiliki kandungan
kalium yang tinggi, tingginya kandungan kalium dalam pisang membantu
mengatasi stress yang memacu gangguan sulit tidur dengan cara menurunkan
tekanan darah dan menyingkirkan rintangan berupa penyumbatan dalam
berfikir dan menghindari kepikunan atau mudah lupa (Suyanti dan Supriyadi,
2008). Kulit buah pisang selain untuk pakan ternak juga dapat dijadikan sebagai
bahan campuran krim antinyamuk. Kulit buah pisang juga dapat diekstrak untuk
dibuat pektin. Bagian dalam kulit pisang matang yang dikerok dan dihancurkan
dapat dimanfaatkan sebagai bahan baku pembuatan nata pisang. Sementara
tepung kulit pisang yang dicampur dengan ampas tahu dapat digunakan sebagai
pakan ayam buras untuk meningkatkan pertumbuhannya. Manfaat lainnya dapat
dijadikan sebagai pembunuh larva serangga, yakni dengan menambahkan sedikit
urea dan pemberian bakteri. Berdasarkan hasil temuan dari Taiwan diketahui
bahwa kulit pisang yang mengandung vitamin B6 dan serotonin dapat diekstrak
dan dimanfaatkan untuk kesehatan mata (Suyanti dan Supriyadi, 2008).
2.3.2 Klasifikasi Pisang Kepok (Musa balbisiana)
Berikut adalah klasifikasi dari pisang kepok berdasarkan Herbarium
Bogoriense:
Jenis : Musa balbisiana (grup ABB)
Suku : Musaceae
Sehingga taksonomi dari Musa balbisiana berdasarkan United States
Department of Agriculture (USDA) adalah:
Kerajaan : Plantae
Subkerajaan : Tracheobionta
Superdivisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Liliopsida
Subkelas : Zingiberidae
Ordo : Zingiberales
Famili : Musaceae
Genus : Musa L.
Sumber: Koleksi Pribadi
Gambar 2.5. Pisang Kepok
Pisang kepok (Musa balbisiana) merupakan jenis triploid diberi simbol
ABB (Nasir, 2003). Hibridisasi beragam Musa balbisiana menghasilkan
keturunan hibrida yang sebagian besar steril terutama genom AB (dessert
bananas), AAB (plantains) dan ABB (cooking bananas) (OECD, 2010).
Musa balbisiana tersebar dari India termasuk Kepulauan Andam hingga
Myanmar utara (Burma), Thailand dan Indocina ke Cina Selatan dan Filipina.
Musa balbisiana merupakan salah satu spesiea yang berasal dari Indocina (OECD,
2010).
Menurut Cahyono (2009) pisang kepok memiliki banyak jenis, namun yang
terkenal adalah pisang kepok kuning dan kepok putih. Daging buah pisang kepok
kuning berwarna putih sedangkan kepok putih berwarna putih. Daging buahnya
bertekstur agak keras. Pisang kepok kuning memiliki rasa yang lebih manis dan
enak dibandingkan kepok putih. Buah pisang kepok tidak beraroma harum. Kulit
buah pisang kepok sangat tebal, pada buah yang sudah masak berwarna hijau
kekuningan. Dalam satu tandan bisa terdapat hingga 16 sisir dan pada setiap
sisirnya terdapat hingga 20 pisang, berat setiap tandannya sekitar 14-22 kg. buah
pisang kepok cocok untuk disantap dalam bentuk olahan.
2.3.3 Kandungan Kimia Kulit Pisang
Kulit pisang merupakan sumber yang kaya pati (3%), protein kasar (6-9%),
lemak kasar (3,8-11%), serat makanan total (43,2-49,7%), dan asam lemak ganda
tak jenuh (PUFA), terutama asam linoleat dan α-linolenat, pektin, asam amino esensial (leusin, valin, fenilalanin dan treonin) dan mikronutrien (K, P, Ca, Mg).
(10-21%), selulosa (7,6-9,6%), hemiselulosa (6,4-9,4%) dan asam galaktouronat.
Pektin yang diekstrak dari kulit pisang juga mengandung glukosa, galaktosa,
arabinosa, rhamnosa, dan xilosa. Mikronutrien (Fe dan Zn) ditemukan dalam
konsentrasi tinggi pada kulit dibandingkan pada pulp. Sehingga, kulit bisa
menjadi bahan pakan yang baik untuk ternak dan unggas. Kulit pisang juga dapat
digunakan dalam minuman anggur, produksi etanol, sebagai substrat untuk
produksi biogas dan sebagai bahan dasar untuk ekstraksi pektin. Abu kulit pisang
dapat digunakan sebagai pupuk untuk tanaman pisang dan sebagai sumber alkali
untuk produksi sabun. Ekstrak etanol kulit Musa sapientum dapat digunakan
penghambat korosi untuk baja ringan. kulit pisang juga dapat digunakan di pabrik
pengolahan air limbah (Mohapatra, et al., 2010).
2.4 Asam Laktat
Berdasarkan Rowe, et al., (2006) asam laktat (C3H6O3) memiliki sinonim
2-hydroxypropanoic acid; a-hydroxypropionic acid; DL-lactic acid; Lexalt L; milk
acid; Patlac LA; Purac 88 PH; racemic lactic acid. Berfungsi sebagai agen
pengasam. Asam laktat dibuat dari fermentasi karbohidrat, seperti glukosa,
sukrosa laktosa dengan Bacillus asam laktat atau mikroorganisme terkait lainnya.
- Titik didih: 122℃ pada 2 kPa (15mmHg)
- Konstanta disosiasi: pKa = 4,14 pada 22,5℃
- Kelarutan: larut dengan etanol (95%), eter dan air, praktis tidak larut
dalam kloroform.
- Stabilitas: Asam laktat bersifat higroskopis dan akan membentuk
produk kondensasi seperti asam polilaktat pada saat kontak dengan air.
Kesetimbangan antara asam polilaktat dan asam laktat tergantung pada
konsentrasi dan temperatur. Pada suhu tinggi asam laktat akan
membentuk laktida, yang mudah dihidrolisis kembali ke asam laktat.
Asam laktat harus disimpan dalam wadah tertutup baik dalam tempat
dingin dan kering.
- Inkompatibilitas: Kompatibel dengan oksidator, iodida, dan albumin.
Asam laktat termasuk dalam golongan asam organik (Dashek dan Micales,
1997). Asam laktat dapat digunakan untuk ekstraksi pektin menurut seperti halnya
jenis asam lain yakni asam tartarat, asam malat, asam sitrat, asam asetat dan asam
fosforat (Canteri-Schemin, et al., 2005)
2.5 Spektroskopi FTIR (Fourier Transform Infra Red)
Spektroskopi adalah studi mengenai interaksi antara energi cahaya dan
materi. Warna-warna yang nampak dan fakta bahwa orang bisa melihat adalah
akibat-akibat absorpsi energi oleh senyawa organik maupun anorganik, yang
merupakan perhatian primer bagi ahli kimia organik ialah fakta bahwa panjang
gelombang pada suatu senyawa organik menyerap energi cahaya, bergantung pada
struktur senyawa itu. Oleh karena itu teknik-teknik spektroskopi dapat digunakan
untuk menentukan struktur senyawa yang tidak diketahui dan untuk mempelajari
karakteristik ikatan dari senyawa yang diketahui (Fessenden dan Fessenden,
1986).
Analisa spektroskopi inframerah mencakup beberapa metode yang
berdasarkan atas absorbsi atau refleksi dari radiasi elektromagnetik (Rousessac
dan Rousessac, 2000). Spektrum inframerah berada di antara daerah sinar tampak
dan daerah microwave. Daerah spektrum yang paling baik digunakan untuk
berbagai keperluan praktis dalam kimia organik adalah antara 4000-400 cm-1.
Rentang bilangan gelombang inframerah dibagi dalam tiga daerah, inframerah
jauh (200-10 cm-1), inframerah tengah (4000-200 cm-1) dan inframerah dekat
(12500-4000 cm-1) (Watson, 2009).
Dua jenis instrumen yang biasa digunakan untuk memperoleh spektrum
inframerah yaitu instrumen dispersi, yang menggunakan suatu monokromator
untuk memilih masing-masing bilangan gelombang secara berurutan untuk
memantau intensitasnya setelah radiasi telah melewati sampel, dan instrumen
transformasi Fourier, yang menggunakan suatu interferometer. Instrumen
tranformasi Fourier menghasilkan sumber radiasi dengan masing-masing bilangan
gelombang dapat dipantau dalam ± 1 detik pulsa radiasi tanpa memerlukan
dispersi. Dalam suatu instrumen inframerah transformasi Fourier (Fourier
suatu interferometer. Interferometer menggunakan cermin bergerak untuk
memindahkan bagian radiasi yang dihasilkan oleh satu sumber, sehingga
menghasilkan suatu interferogram yang dapat diubah dengan menggunakan suatu
persamaan yang disebut „Transformasi Fourier‟ untuk mengekstraksi spektrum
dari suatu seri frekuensi yang bertumpang tindih (Watson, 2009).
Spektroskopi FTIR memiliki banyak keunggulan dibanding spektroskopi
inframerah diantaranya yaitu lebih cepat karena pengukuran dilakukan secara
serentak (simultan), serta mekanik optik lebih sederhana dengan sedikit
komponen yang bergerak (Suseno dan Firdausi, 2008).
Jika sinar inframerah dilewatkan melalui sampel senyawa organik, maka
terdapat sejumlah frekuensi yang diserap dan ada yang diteruskan atau
ditransmisikan tanpa diserap. Serapan cahaya oleh molekul tergantung pada
struktur pada struktur elektronik dari molekul tersebut. Molekul yang menyerap
energi tersebut terjadi perubahan energi vibrasi dan perubahan tingkat energi
rotasi. Pada suhu kamar, molekul senyawa organik dalam keadaan diam, setiap
ikatan mempunyai frekuensi yang karakteristik untuk terjadinya vibrasi ulur
(stretching vibrations) dan vibrasi tekuk (bending vibrations) dimana sinar
3.1 Alur Penelitian
Gambar 3.1. Alur Penelitian
Kulit pisang kepok Pengeringan dalam oven
Dihaluskan menjadi serbuk
Ekstraksi menggunakan asam laktat dengan variasi pH dan suhu ekstraksi selama 80 Penyaringan
3.2 Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian I, Laboratorium
Penelitian II, Laboratorium Kimia Obat, Laboratorium Farmakognosi dan
Fitokimia, dan Laboratorium Kimia Analisa Pangan dan Obat, Program Studi
Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah
Jakarta dan dilaksanakan pada bulan April sampai Agustus 2013.
3.3 Bahan Uji
3.3.1 Penyediaan Bahan Baku
Bahan baku yang digunakan berupa kulit pisang kepok yang masih mentah.
Bahan uji didapatkan dari limbah pengolahan kripik pisang kepok yang ada di
daerah Lampung. Pengambilan bahan baku pada pagi hari tanggal 14 Februari
2013.
3.3.2 Determinasi Bahan Baku
Bahan baku berupa kulit pisang kepok yang dilakukan identifikasi terlebih
dahulu di Laboratorium Herbarium Bogoriense Pusat Penelitian Biologi LIPI,
Bogor, Jawa Barat.
3.4 Alat dan Bahan
3.4.1 Alat
Peralatan yang digunakan dalam penelitian ini antara lain alat-alat gelas
seperti, erlenmeyer (Schott Duran), gelas beker (Schott Duran), gelas ukur, pipet
tetes, pipet volume, batang pengaduk, botol timbang, buret, labu Buchner dll.
Adapun alat-alat lain diantaranya adalah corong Buchner, hot plate, oven,
blender, tanur, krustang, krus porselain, cawan porselain, desikator, kertas saring,
statif dan klem, termometer, pH meter, pH indikator universal, magnetic stirrer,
neraca analitik, dan Jasco FTIR-6100.
3.4.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah asam laktat,
aquades, asam klorida (HCl), natrium hidroksida (NaOH), natrium klorida (NaCl),
aseton teknis, indikator phenolptalein (PP), indikator fenol merah, pektin murni
3.5 Prosedur Kerja
3.5.1 Produksi Pektin
a. Persiapan Bahan Uji
Kulit pisang yang didapatkan dari limbah pengolahan kripik pisang kepok
disortir (dipisahkan antara kulit pisang yang bagus dengan yang busuk). Kulit
pisang kepok yang berwarna hijau atau kekuningan yang dipilih. Bagian pucuk
dan tangkai kulit pisang tidak diambil. Kemudian dilakukan pencucian dengan
menggunakan air mengalir agar kulit pisang dapat bersih dari kotoran-kotoran
yang menempel. Setelah kulit pisang tersebut bersih, dilakukan pemotongan
kecil-kecil dan dilakukan pengeringan dengan cara diangin-anginkan yang selanjutnya
dikeringkan dalam oven suhu 50℃. Setelah didapatkan kulit pisang kering,
selanjutnya dilakukan penghalusan dengan cara diblender dan diayak dengan
ayakan mesh 100 (ukuran partikel 105 mikrometer) sehingga didapatkan serbuk
kering kulit pisang kepok yang kemudian diukur kadar airnya, kadar air
seharusnya tidak lebih dari 10% (Tarigan, et al., 2012).
b. Ekstraksi Pektin
Serbuk kulit pisang kepok yang dihasilkan dimasukkan ke dalam
erlenmeyer sebanyak 60,0 gram, kemudian ditambahkan larutan asam laktat
sebanyak 2000 mL dengan variasi pH 1, 1,5 dan 2. Pembuatan larutan asam laktat
dengan variasi pH dilakukan dengan cara melarutkan asam laktat dalam aquadest
dan pH larutan diukur menggunakan pH meter. Campuran 60,0 gram serbuk kulit
pisang kepok dan larutan asam laktat tersebut dipanaskan di atas pemanas listrik
dengan pengaturan suhu 80℃ dan 90℃ untuk masing-masing pH disertai
pengadukan menggunakan magnetic stirrer. Penghitungan waktu ekstraksi dari
saat tercapainya kondisi operasi percobaan yaitu 80 menit. Setelah dipanaskan,
campuran tersebut disaring menggunakan kertas saring dengan bantuan penyaring
vakum guna memisahkan ampas dan filtratnya. Filtrat yang didapatkan disebut
dengan filtrat pektin (Akhmalludin dan Kurniawan, 2009; Satria dan Ahda, 2009;
Tarigan, et al., 2012).
c. Pengendapan Pektin
Pengendapan pektin dilakukan dengan penambahan aseton dalam filtrat
pektin tersebut didiamkan selama 10-14 jam. Endapan pektin yang terbentuk
kemudian dipisahkan dari larutannya menggunakan kertas saring dengan bantuan
penyaring vakum (Akhmalludin dan Kurniawan 2009).
d. Pencucian Pektin
Endapan pektin yang terbentuk ditambahkan dengan aseton sambil diaduk
untuk kemudian dilakukan penyaringan dengan menggunakan penyaring vakum.
Hal ini dilakukan beberapa kali sampai pektin tidak lagi meninggalkan residu
asam. Adapun pektin yang sudah tidak lagi meninggalkan residu asam adalah
pektin yang tidak berwarna merah bila ditambahkan dengan indikator
phenolphtalein (PP) (Akhmalludin dan Kurniawan, 2009).
e. Pengeringan Pektin
Pektin basah hasil pengendapan yang telah bebas dari residu asam kemudian
dikeringkan dalam oven pada suhu 40℃ selama 8 jam. Hasil yang diperoleh
disebut dengan pektin kering (Tarigan, et al., 2012).
3.5.2 Karakterisasi Pektin Hasil Ekstraksi
1. Perhitungan Persen Rendemen
Persen rendemen adalah perbandingan gram pektin yang dihasilkan
dengan gram bahan baku kering.
Rendemen (%) = bobot total pektin yang diperoleh
bobot bahan baku kering x 100%
2. Penentuan Kadar Air
Sebanyak 0,300 gram sampel pektin dikeringkan di dalam oven pada
suhu 100oC selama 4 jam menggunakan botol timbang yang telah diketahui
bobot kosongnya. Selanjutnya didinginkan dalam desikator dan ditimbang
sampai diperoleh bobot yang tetap.
Kadar Air (%) = Wa−Wb
W x 100% (Pardede, et al., 2013)
Dimana: Wa = bobot sebelum dikeringkan
3. Penentuan Kadar Abu (Ranganna, 1977)
Krus porselain dikeringkan di dalam tanur pada suhu 600oC kemudian
didinginkan di dalam desikator dan ditimbang sebagai bobot wadah.
Selanjutnya sebanyak 0,500 gram pektin ditimbang dan di masukkan dalam
krus silikat yang telah diketahui bobotnya kemudian di masukkan dalam
tanur dengan suhu 600℃ selama 4 jam. Residu didinginkan dalam desikator
dan ditimbang sampai diperoleh bobot tetap.
Kadar Abu (%) = = W 1−W 2
W x 100%
Dimana: W = bobot sampel awal (g)
W1 = bobot wadah + sampel setelah pemanasan (g)
W2 = bobot wadah kosong (g)
4. Penentuan Berat Ekivalen (Ranganna, 1977)
Nilai berat ekivalen digunakan untuk perhitungan kadar asam
galakturonat dan derajat esterifikasi. Berat ekivalen ditentukan dengan
menimbang 0,25 gram pektin dimasukkan dalam Erlenmeyer 250 mL dan
dilembabkan dengan 1,0 mL alkohol. Air suling bebas O2 sebanyak 50,0 mL
dan 6 tetes indikator fenol merah ditambahkan. Campuran tersebut
kemudian diaduk dengan cepat untuk memastikan bahwa semua substansi
pektin telah terlarut dan tidak ada gumpalan yang menempel pada sisi
Erlenmeyer. Titrasi dilakukan perlahan-lahan dengan titran standar NaOH
0,1 N sampai warna campuran berubah menjadi merah muda (pH 7,5) dan
tetap bertahan selama setidaknya 30 detik. Larutan tersebut dinetralkan yang
kemudian digunakan untuk penentuan kadar metoksil.
Berat Ekivalen = bobot pektin (mg ) ml NaOH x N NaOH
5. Kadar Metoksil (Ranganna, 1977)
Penentuan kadar metoksil dilakukan dengan menambahkan 25,0 mL
NaOH 0,25 N ke dalam larutan netral dari penentuan BE kemudian dikocok
dengan benar dan didiamkan selama 30 menit pada suhu kamar dalam
merah kemudian dititrasi dengan titran NaOH 0,1 N hingga larutan berubah
menjadi merah muda.
Kadar Metoksil (%) = ml NaOH x 31 x N NaOH x 100 bobot sampel mg
Dimana 31 adalah berat molekul (BM) dari metoksil
6. Kadar Galakturonat (Ismail, et al., 2012)
Kadar galakturonat dihitung dari miliekivalen NaOH yang diperoleh
dari penentuan BE (berat ekivalen) dan kandungan metoksil.
% Galakturonat = (meq dari NaOH untuk asam bebas + meq dari NaOH untuk metoksil ) x 176 x 100 bobot sampel (mg )
Dimana 176 adalah berat ekivalen terendah asam pektat
7. Derajat Esterifikasi (Schultz, 1965 dalam Hariyati, 2006)
Derajat esterifikasi (DE) dari pektin dapat dihitung dengan:
DE (%) = kadar metoksil x 176 x 100 kadar galakturonat x 31
3.6 Perbandingan Spektrum FTIR
Spektrum FTIR digunakan untuk memperoleh informasi serapan gugus
fungsional. Data FTIR diperoleh dengan menggunakan Jasco FTIR-6100 dengan
rentang panjang gelombang dari 4000 cm-1 sampai 400 cm-1 (Ismail, et al., 2012).
Perbandingan antara sebuk KBr dan masing-masing sampel pektin adalah
100:1 mg. Setelah didapatkan spektrum masing-masing sampel pektin, ketiganya
(pektin hasil ekstraksi, komersial dan standard) dibandingkan tiap serapan gugus
4.1 Bahan Baku
4.1.1 Penentuan Bahan Baku
Bahan baku yang digunakan dalam penelitian ini adalah limbah kulit pisang
kepok yang diperoleh dari pengolahan kripik pisang di daerah Lampung. Kulit
pisang merupakan bagian dari buah pisang yang umumnya dibuang sebagai
sampah. Limbah kulit pisang kepok dipilih sebagai bahan baku karena pisang
kepok lebih sering digunakan sebagai makanan olahan sehingga menghasilkan
limbah kulit yang cukup banyak. Pemilihan bahan baku berupa limbah kulit
pisang didasarkan pada pemanfaatan limbah yang tidak digunakan menjadi suatu
bahan baku produksi pektin. Cahyono (2009) mengungkapkan bahwa kulit buah
pisang kepok sangat tebal. Sedangkan pektin terdistribusi secara luas dalam
jaringan tanaman dan umumnya terdapat dalam dinding sel, sehingga pemilihan
kulit pisang kepok untuk produksi pektin diharapkan mampu menghasilkan pektin
yang melimpah pula. Menurut Mohapatra, et al., (2010) kandungan pektin dalam
kulit pisang berkisar antara 10-21%. Limbah kulit pisang diperoleh dengan tidak
mengeluarkan biaya karena limbah biasanya dibuang begitu saja. Keuntungan dari
pemanfaatan limbah tersebut adalah menjadikan biaya produksi pektin dapat lebih
ekonomis dan diharapkan tidak mengurangi kualitas pektin yang dihasilkan.
4.1.2 Determinasi Tanaman Bahan Baku
Determinasi tanaman bahan baku dilakukan di Herbarium Bogoriense Pusat
Penelitian Biologi LIPI, Bogor, Jawa Barat. Hasil determinasi menunjukkan
bahwa tanaman bahan baku yang digunakan adalah benar tanaman pisang kepok
(Musa balbisiana ABB) famili Musaceae. Hasil determinasi dapat dilihat pada
4.1.3 Persiapan Bahan Baku
Bahan baku limbah kulit pisang yang digunakan adalah kulit pisang yang
masih mentah berwarna hijau atau kekuningan. Kebanyakan limbah kulit pisang
dari pengolahan kripik pisang menggunakan buah pisang yang masih mentah.
Limbah kulit pisang dipisahkan dari tangkai dan ujungnya kemudian dibersihkan
dengan dicuci menggunakan air mengalir, dipotong kecil-kecil dan dikeringkan
dengan diangin-anginkan dan selanjutnya dikeringkan lebih lanjut menggunakan
oven pada suhu 50℃ selama kurang lebih 3 hari hingga kulit pisang benar-benar
kering dengan kadar air kurang dari 10%. Kulit pisang yang telah kering
selanjutnya dihaluskan hingga berbentuk serbuk dan diayak dengan ayakan mesh
100 (ukuran partikel 105 mikrometer). Pemotongan dan pembelahan bahan-bahan
yang akan diekstraksi membantu pengontakan antara padatan dengan pelarut
karena pecahnya sel-sel yang mengandung solut (Perina, et al., 2007). Serbuk
kulit pisang yang dihasilkan ditentukan kadar airnya. Penentuan kadar air serbuk
kulit pisang menggunakan prinsip gravimetri. Kadar air serbuk kulit pisang adalah
8,39% kadar ini tidak lebih dari yang ditetapkan yakni tidak lebih dari 10%
(Tarigan, et al., 2012). Pemeriksaan kadar air dilakukan di BPPT LABTIAP
Serpong, Banten.
Tabel 4.1. Bahan Baku
Bahan Baku Hasil
Bobot kulit pisang kepok awal 5 kg
Bobot serbuk kulit pisang kepok setelah pengeringan 511 gram
Kadar air serbuk kulit pisang 8,39%
Kulit pisang kepok yang belum dipisahkan dari ujung dan tangkainya serta
belum dibersihkan dari pengotornya seperti tanah yang melekat adalah sebanyak 5
kilogram. Setelah dilakukan pembersihan, pengeringan dan penghalusan
menghasilkan serbuk kulit pisang sebanyak 511 gram. Dengan demikian,
dibutuhkan banyak bahan baku limbah kulit pisang yang diperlukan untuk
menghasilkan serbuk kulit pisang yang banyak pula. Sebab dengan 5 kg limbah
kulit pisang segar hanya menghasilkan serbuk kering kulit pisang sebanyak 511
sehingga setelah pengeringan menghasilkan sedikit serbuk kulit pisang. Begitu
pula dengan banyaknya bagian yang tidak diambil dari kulit pisang tersebut
seperti tangkai dan ujung kulit pisang.
4.2 Ekstraksi Pektin
Pektin diekstraksi dengan menggunakan pelarut asam laktat dengan variasi
pH 1, 1,5 dan 2, variasi suhu ekstraksi 80℃ dan 90℃ dengan waktu ekstraksi
tetap yakni 80 menit. Waktu ekstraksi ditetapkan berdasarkan hasil penelitian
yang dilakukan oleh Tarigan, et al., (2012) yang menyatakan bahwa waktu
optimum rendemen tertinggi yang diperoleh dari hasil ekstraksi kulit pisang kepok
menggunakan pelarut asam klorida adalah selama waktu 80 menit. Sehingga
waktu optimum tersebut yang digunakan dalam penelitian ini. Ekstraksi pektin
disini dilakukan dengan metode konvensional yakni secara pemanasan langsung,
menurut Srivastava dan Malviya (2011) ada dua metode ekstraksi pektin yang
biasa dilakukan yaitu pemanasan langsung dan pemanasan menggunakan
microwave.
Pelarut yang digunakan dalam ekstraksi pektin disini adalah menggunakan
pelarut asam organik berupa larutan asam laktat dengan variasi pH. Larutan asam
laktat digunakan untuk merombak protopektin yang tidak larut menjadi pektin
yang dapat larut. Berdasarkan Tarigan, et al., (2012) ekstraksi pektin dilakukan
dengan hidrolisis asam atau enzimatis. Ekstraksi pektin pada penelitian ini
dilakukan dengan hidrolisis asam, asam yang berperan adalah larutan asam laktat.
Penggunaan asam laktat dalam ekstraksi pektin sesuai dengan yang dikemukakan
oleh Fellow (2002) dalam Perina, et al., (2007) bahwa asam lain selain HCl (asam
klorida), H2SO4 (asam sulfat) dan CH3COOH (asam asetat) yang dapat digunakan
adalah asam sitrat, asam laktat dan asam tartrat.
Bahan baku berupa serbuk kering kulit pisang kepok berukuran 105
mikrometer, berdasarkan Fellow (2002) di dalam Perina, et al., (2007)
menjelaskan bahwa semakin kecil ukuran partikel berarti semakin luas permukaan
yang kontak antara padatan dan pelarut serta semakin pendek jarak difusi solut
sehingga kecepatan ekstraksi lebih besar. Sebanyak 60,0 gram serbuk kering kulit