UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH VARIASI PERLAKUAN BAHAN BAKU
DAN KONSENTRASI ASAM TERHADAP
EKSTRAKSI DAN KARAKTERISTIK PEKTIN DARI
LIMBAH KULIT PISANG KEPOK KUNING
(
Musa balbisiana
BBB)
SKRIPSI
QADRINA SUFY
1111102000030
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH VARIASI PERLAKUAN BAHAN BAKU
DAN KONSENTRASI ASAM TERHADAP
EKSTRAKSI DAN KARAKTERISTIK PEKTIN DARI
LIMBAH KULIT PISANG KEPOK KUNING
(
Musa balbisiana
BBB)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
QADRINA SUFY
1111102000030
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ABSTRAK
Nama : Qadrina Sufy Program Studi : Farmasi
Judul : Pengaruh Variasi Perlakuan Bahan Baku dan Konsentrasi Asam Terhadap Ekstraksi dan Karakteristik Pektin dari Limbah Kulit Pisang Kepok Kuning (Musa balbisiana BBB)
Pektin merupakan polimer alam dari kelompok polisakarida yang terdapat dalam jaringan tanaman, tersusun atas unit asam D-galakturonat yang dihubungkan oleh ikatan glikosidik α(1-4). Pektin telah digunakan selama bertahun-tahun dalam industri farmasi, makanan, dan minuman. Penelitian ini bertujuan untuk mengetahui pengaruh variasi perlakuan bahan baku dan konsentrasi asam terhadap
karakteristik pektin hasil ekstraksi dari limbah kulit pisang kepok kuning
(Musa balbisiana BBB). Penelitian dilakukan dengan metode ekstraksi
menggunakan pelarut HCl, lalu dilakukan pengendapan pektin dengan menambahkan aseton ke dalam filtrat hasil ekstraksi, kemudian endapan dicuci dengan etanol 96%, dan dikeringkan dalam oven suhu 400C untuk mendapatkan pektin kering. Variabel tetap dalam penelitian ini adalah suhu ekstraksi 900C selama 80 menit. Sedangkan variabel berubahnya adalah perlakuan bahan baku, yaitu bahan segar dan kering serta konsentrasi HCl 0,025 N; 0,05 N; dan 0,075 N. Karakteristik yang dianalisa adalah jumlah pektin yang dihasilkan, kadar air, kadar abu, berat ekivalen, kadar metoksil, kadar galakturonat, derajat esterifikasi, dan viskositas larutan pektin. Hasil penelitian menunjukkan bahwa kondisi optimum untuk menghasilkan pektin terbanyak dari masing-masing perlakuan bahan baku yaitu 10,3610 gram untuk bahan segar dan 8,0290 gram untuk bahan kering, diperoleh dengan ekstraksi menggunakan pelarut HCl 0,075 N, dengan karakteristik berturut-turut : kadar air 9,3165% dan 10,3501%; kadar abu 1,3592% dan 2,4770%; berat ekivalen 4752,7974 dan 4874,1837; kadar metoksil 3,8166% dan 3,7524%; kadar galakturonat 101,1200% dan 99,6591%; derajat esterifikasi 21,4284% dan 21,3770%; dan viskositas larutan pektin 1% 15,00 cPs dan 15,50 cPs.
ABSTRACT
Name : Qadrina Sufy Program Study : Pharmacy
Title : Effect of Variations in The Raw Materials Treatment and Acid Concentration to The Extraction and Characteristics of Pectin from Yellow Banana Peel Waste (Musa balbisiana
BBB)
Pectin is a natural polymer of polysaccharides present in plant tissue, composed of D-galacturonic acid units linked by glycosidic bond α(1-4). It has been used successfully for many years in the food and beverage industry. This research was aimed to investigate the effect of variations in the raw materials treatment and acid concentration on the characteristics of pectin extracted from yellow banana peel waste (Musa balbisiana BBB). The research used an extraction method by using HCl solvent, pectin was precipitated by adding acetone into the filtrate extracted, then the precipitate was washed with ethanol 96%, and dried in oven at 400C to obtain a dry pectin. The fix variables which were used in this research were extraction temperature of 900C during 80 minute. Extraction process by carried out by the raw materials treatment which were fresh and dried, and the HCl solvent concentration of 0,025 N; 0,05 N; and 0,075 N. Characteristics analyzed were yield of pectin, moisture content, ash content, equivalent weight, methoxyl content, galacturonic content, degree of esterification, and viscosity of pectin solution. The results showed that the optimum conditions to produce most of pectin from each raw material treatment i.e. 10,3610 gram of fresh material and 8,0290 gram of dry material, obtained by HCl 0,075 N with the characteristics respectively : 9,3165% and 10,3501% of moisture content, 1,3592% and 2,4770% of ash content, 4752,7974 and 4874,1837 of equivalent weight, 3,8166% and 3,7524% of methoxyl content; 101,1200% and 99,6591% of galacturonic content, 21,4284% and 21,3770% of degree of esterification, and 15,00 cPs and 15,50 cPs of viscosity of 1% pectin solution.
KATA PENGANTAR
Alhamdulillahirabbil’aalamiin, segala puji dan syukur selalu terpanjatkan atas kehadirat Allah SWT atas segala nikmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Shalawat serta salam senantiasa tercurahkan kepada junjungan Nabi Besar Muhammad SAW yang telah membawa cahaya petunjuk dan menjadi suri tauladan bagi umat manusia, semoga kelak kita semua mendapat syafaat beliau. Aamiin yaa rabbal’aalamiin.
Skripsi dengan judul, “Pengaruh Variasi Perlakuan Bahan Baku dan
Konsentrasi Asam Terhadap Ekstraksi dan Karakteristik Pektin dari Limbah Kulit Pisang Kepok Kuning (Musa balbisiana BBB)” ini disusun dalam rangka
memenuhi salah satu syarat menempuh ujian akhir untuk memperoleh gelar
Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Penulis menyadari begitu banyak bantuan dari berbagai pihak yang telah meluangkan waktunya, mendidik, dan membimbing dari masa perkuliahan sampai pada proses penelitian dan penyusunan skripsi ini. Pada kesempatan ini, penulis ingin menyampaikan penghargaan setinggi-tingginya dan rasa terima kasih yang sebesar-besarnya kepada :
1. Bapak Dr. Arif Sumantri, S. KM., M. Kes., selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. Bapak Yardi, M. Si., Ph. D., Apt., selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Ibu Eka Putri, M. Si., Apt. dan Bapak Supandi, M. Si., Apt., sebagai Pembimbing I dan Pembimbing II yang dengan sabar senantiasa meluangkan waktu dan pikirannya untuk membimbing, mendidik, memberikan saran, dan dukungan kepada penulis hingga skripsi ini selesai.
5. Ayahanda Husni El Fuad dan Ibunda Nurhidayati, kedua orang tercinta yang senantiasa mendoakan tiada pernah terputus, selalu memberikan cinta dan kasih sayang, semangat, dan dukungan baik moril maupun materiil yang tak akan pernah mampu penulis membalas itu semua. Semoga Allah selalu memberikan limpahan rezeki, keberkahan, dan keselamatan bagi Ayahanda dan Ibunda tercinta baik di dunia maupun di akhirat. Aamiin.
6. Adikku tersayang Muhammad Maksum yang selalu memberikan dukungan, semangat, dan keceriaan dalam hidup penulis, serta untuk keluarga besar yang senantiasa memberikan doa dan semangat kepada penulis.
7. Teman-teman seperjuangan Farmasi angkatan 2011 yang telah menjadi keluarga kedua bagi penulis, yang selalu memberikan warna baru dalam hidup penulis. Terima kasih atas kebersamaan kita selama ini yang begitu indah, semoga silaturrahim kita dapat tetap selalu terjaga.
8. Kak Lisna, Kak Tiwi, Kak Eris, Kak Liken, Mba Rani, dan Kak Rahmadi yang telah banyak membantu penulis selama penelitian di laboratorium. 9. Serta semua pihak yang tidak dapat disebutkan satu persatu, yang turut
membantu penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa dalam penulisan skripsi ini masih terdapat banyak kelemahan dan kekurangan serta jauh dari kesempurnaan, namun penulis berharap semoga hasil penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan pada umumnya dan ilmu farmasi pada khususnya. Dengan segala kerendahan hati, penulis sangat mengharapkan saran dan kritik membangun agar skripsi ini lebih sempurna.
Akhir kata, penulis berharap semoga Allah SWT mencatat dan memberikan balasan yang berlipat ganda atas segala kebaikan semua pihak yang telah membantu dalam menyelesaikan skripsi ini.
Jakarta, 12 Juni 2015
DAFTAR ISI
3.2.1 Alat ... 25
3.2.2 Bahan ... 25
3.3 Prosedur Penelitian ... 26
3.3.1 Persiapan Bahan Baku ... 26
3.3.2 Produksi Pektin ... 27
3.4 Identifikasi Kualitatif Pektin ... 28
3.5 Karakteristik Pektin ... 28
3.6 Perbandingan Spektrum FTIR ... 31
3.7 Perbandingan Pektin Hasil Penelitian terhadap Pektin Komersial ... 31
BAB 4 HASIL DAN PEMBAHASAN ... 32
4.1 Penentuan Bahan Baku ... 32
4.2 Determinasi Tanaman Bahan Baku ... 32
4.3 Persiapan Bahan Baku ... 33
4.4 Produksi Pektin ... 34
4.5 Identifikasi Kualitatif Pektin ... 37
4.6 Karakteristik Pektin Hasil Ekstraksi ... 40
4.7 Perbandingan Spektrum FTIR ... 51
4.8 Perbandingan Pektin Hasil Penelitian terhadap Pektin Komersial ... 54
BAB 5 KESIMPULAN DAN SARAN ... 57
5.1 Kesimpulan ... 57
5.2 Saran ... 57
DAFTAR PUSTAKA ... 58
DAFTAR TABEL
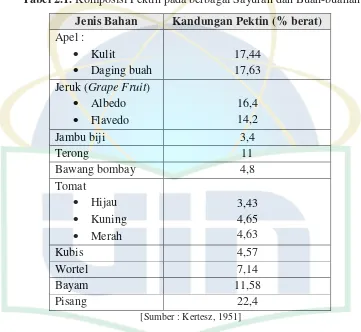
Tabel 2.1 Komposisi Pektin pada berbagai Sayuran dan Buah-buahan ... 12
Tabel 2.2 Spesifikasi Standar Mutu Pektin ... 19
Tabel 2.3 Spesifikasi Pektin Berdasarkan Farmakope ... 19
Tabel 4.1 Bahan Baku ... 34
Tabel 4.2 Pemerian Pektin Hasil Ekstraksi ... 37
Tabel 4.3 Identifikasi Pektin Hasil Ekstraksi ... 38
Tabel 4.4 Karakteristik Pektin Hasil Ekstraksi ... 40
Tabel 4.5 Data Spektrum FTIR Pektin Komersial dan Hasil Ekstraksi ... 52
DAFTAR GAMBAR
Gambar 2.1 Pisang Kepok ... 6
Gambar 2.2 Struktur Dinding Sel Tanaman ... 8
Gambar 2.3 Rumus Molekul Pektin ... 9
Gambar 2.4 Struktur Kimia α-Galakturonat ... 9
Gambar 2.5 Struktur Kimia Asam Poligalakturonat ... 10
Gambar 2.6 Molekul Pektin Bermetoksil Tinggi ... 11
Gambar 2.7 Molekul Pektin Bermetoksil Rendah ... 11
Gambar 2.8 Molekul Pektin yang Teramidasi ... 11
Gambar 2.9 Skema Perubahan Protopektin menjadi Pektin dan Asam Pektat ... 16
Gambar 4.1 Jumlah pektin kulit pisang kepok hasil ekstraksi ... 41
Gambar 4.2 Kadar air pektin kulit pisang kepok hasil ekstraksi ... 43
Gambar 4.3 Kadar abu pektin kulit pisang kepok hasil ekstraksi ... 44
Gambar 4.4 Berat ekivalen pektin kulit pisang kepok hasil ekstraksi ... 45
Gambar 4.5 Kadar metoksil pektin kulit pisang kepok hasil ekstraksi ... 47
Gambar 4.6 Kadar galakturonat pektin kulit pisang kepok hasil ekstraksi .. 48
Gambar 4.7 Derajat esterifikasi pektin kulit pisang kepok hasil ekstraksi ... 49
Gambar 4.8 Reaksi Deesterifikasi Pektin ... 50
Gambar 4.9 Viskositas larutan pektin kulit pisang kepok hasil ekstraksi .... 51
Gambar 4.10 Struktur Pektin ... 53
DAFTAR LAMPIRAN
Lampiran 1. Hasil Determinasi Tanaman ... 66
Lampiran 2. Hasil Pemeriksaan Kadar Air Serbuk Kulit Pisang Kepok (Musa balbisiana BBB) ... 67
Lampiran 3. Alur Kerja Penelitian ... 68
Lampiran 4. Diagram Alir Persiapan Bahan Baku Segar ... 69
Lampiran 5. Diagram Alir Persiapan Bahan Baku Kering ... 70
Lampiran 6. Jumlah Pektin Hasil Ekstraksi ... 71
Lampiran 7. Kadar Air Pektin ... 71
Lampiran 8. Kadar Abu Pektin ... 72
Lampiran 9. Pembakuan Larutan Titran NaOH 0,1027 N ... 73
Lampiran 10. Berat Ekivalen Pektin ... 74
Lampiran 11. Kadar Metoksil Pektin ... 75
Lampiran 12. Kadar Galakturonat Pektin ... 76
Lampiran 13. Derajat Esterifikasi Pektin ... 77
Lampiran 14. Viskositas Larutan Pektin ... 77
Lampiran 15. Contoh Perhitungan Kadar Air Pektin Hasil Ekstraksi ... 78
Lampiran 16. Contoh Perhitungan Kadar Abu Pektin Hasil Ekstraksi ... 78
Lampiran 17. Contoh Perhitungan Berat Ekivalen Pektin Hasil Ekstraksi ... 78
Lampiran 18. Contoh Perhitungan Kadar Metoksil Pektin Hasil Ekstraksi .... 79
Lampiran 19. Contoh Perhitungan mEk ... 79
Lampiran 20. Contoh Perhitungan Kadar Galakturonat Pektin Hasil Ekstraksi ... 81
Lampiran 21. Contoh Perhitungan Derajat Esterifikasi Pektin Hasil Ekstraksi ... 82
Lampiran 22. Hasil Spektrum FTIR Pektin Komersial dan Hasil Ekstraksi ... 83
Lampiran 23. Sertifikat Analisis Pektin Carigill® ... 87
Lampiran 24. Sertifikat Analisis Pektin Danisco® ... 88
Lampiran 25. Dokumentasi Proses Ekstraksi Pektin ... 89
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Polimer alam merupakan polisakarida yang penting secara farmasetik dengan berbagai aplikasi seperti agen pengental, pengikat, penghancur, pensuspensi, pengemulsi, penstabil, dan pembentuk gel. Polimer alam lebih disukai daripada sintetik karena tidak toksik, biaya rendah, bersifat emolien, dan tidak mengiritasi (Malviya, et. al., 2011).
Pektin termasuk kelompok polisakarida yang terdapat di antara dinding sel sekunder tanaman termasuk xilem dan serat sel yang merupakan konstituen penting dalam pertumbuhan awal dan proses pematangan buah, di mana komponen utamanya terdiri dari unit asam D-galakturonat yang terikat dengan ikatan glikosidik α(1-4) (Bansal, et. al., 2014).
Di berbagai negara, pektin telah dikenal dan diizinkan penggunaannya sebagai bahan dasar dalam berbagai industri, baik pangan maupun non pangan, seperti industri farmasi dan kosmetik, karena kemampuannya dalam mengubah sifat fungsional produk seperti kekentalan, emulsi, dan gel (Nurviani, 2014).
Hingga tahun 2012, seluruh pektin yang digunakan di industri-industri Indonesia merupakan barang impor dengan data terakhir pada Januari sampai November 2012 mencapai 2.276.742 kg yang bernilai sebesar US $ 2.132.966. Biaya impor pektin yang sangat mahal akan berdampak terhadap penggunaan devisa Negara (Badan Pusat Statistik, 2012).
Pemanfaatan buah pisang untuk berbagai jenis makanan akan menghasilkan limbah kulit pisang yang merupakan limbah organik yang masih mengandung karbohidrat dan nutrisi lain. Volume limbah yang besar dan terbuang merupakan pemborosan sumber daya karena limbah ini dapat dimanfaatkan sebagai sumber pektin yang dapat diproduksi dengan teknik ekstraksi menggunakan asam mineral panas atau asam organik (May, 1990; Baker, 1994; Sofia, 2008).
Hasil penelitian Hanum, et. al. (2012), pektin dengan karakteristik terbaik hasil ekstraksi dari kulit pisang kepok kering menggunakan pelarut air yang diasamkan dengan HCl diperoleh pada pH 1,5 dan suhu 900C
selama 80 menit dengan perolehan rendemen tertinggi sebesar 5,21 gram, kadar air 11,88%, kadar abu 0,98%, dan kadar metoksil 3,72%.
Berdasarkan uraian di atas, kulit pisang diketahui berpotensi sebagai sumber pektin, maka dalam penelitian ini dilakukan pengembangan ekstraksi pektin dengan memanfaatkan limbah kulit pisang kepok kuning
(Musa balbisiana BBB), dengan melihat pengaruh dari variasi perlakuan
bahan baku segar dan kering yang diekstraksi menggunakan pelarut HCl dengan berbagai konsentrasi terhadap karakteristik pektin yang dihasilkan. Pelarut HCl dipilih karena tergolong asam mineral yang cenderung murah dan mudah didapatkan serta pada pH rendah dapat menghasilkan rendemen pektin yang lebih tinggi dibandingkan asam organik (Kertesz, 1951; Rouse dan Crandal, 1978).
1.2 Rumusan Masalah
Berdasarkan pustaka, ekstraksi pektin dari kulit pisang kepok menggunakan pelarut HCl sudah diteliti. Akan tetapi, belum diketahuinya karakteristik pektin hasil ekstraksi dengan memanfaatkan limbah kulit pisang kepok kuning (Musa balbisiana BBB) yang dipengaruhi variasi perlakuan bahan baku dan konsentrasi pelarut HCl.
1.3 Tujuan Penelitian
BBB) dan mengetahui pengaruh variasi perlakuan bahan baku dan konsentrasi pelarut HCl terhadap karakteristik pektin yang dihasilkan.
1.4 Manfaat Penelitian
2.1 Tanaman Pisang 2.1.1 Uraian Umum Pisang
Pisang adalah tanaman herba yang berasal dari kawasan Asia Tenggara (termasuk Indonesia). Tanaman buah ini kemudian menyebar luas ke kawasan Afrika (Madagaskar), Amerika Selatan, dan Amerika Tengah. Penyebaran tanaman ini selanjutnya hampir merata ke seluruh dunia, yakni meliputi daerah tropik dan subtropik, dimulai dari Asia Tenggara ke timur melalui Lautan Teduh sampai ke Hawai. Selain itu tanaman pisang menyebar ke barat melalui Samudera Atlantik, Kepulauan Kenari sampai Benua Amerika (Suyanti dan Supriyadi, 2008).
Pisang adalah buah terbesar kedua setelah jeruk yang tumbuh di daerah tropis yang paling banyak ditanam dan dihasilkan, serta telah dibudidayakan di lebih dari 130 negara, kontribusinya mencapai 16% dari produksi buah total dunia (Mohapatra, et. al., 2010). Indonesia, Filipina, dan Thailand merupakan negara penghasil pisang nomor satu di kawasan Asia Tenggara (Verheij dan Coronel, 1992).
Pemanfaatan pisang telah meluas di kalangan masyarakat, baik dari mulai daun, batang, bunga, buah hingga kulitnya. Pisang sangat bergizi dan mudah dicerna daripada buah-buahan lainnya, waktu penghancuran atau digesti dari buah pisang kurang dari 105 menit dibandingkan apel, yaitu 210 menit. Pisang memiliki karakteristik yang khas pada aroma, bentuk, dan mudah dikupas serta dimakan. Selain itu, buah pisang juga rendah sodium dan kaya akan kalsium dan kalium, sehingga dapat membantu mengatasi stress yang memacu gangguan sulit tidur dengan cara menurunkan tekanan darah dan melancarkan aliran darah yang tersumbat dalam pembuluh darah (Apriadji, 2007; Mohapatra, et. al., 2010). Berdasarkan penelitian dari Taiwan diketahui bahwa kulit pisang mengandung vitamin B6 dan serotonin yang dapat diekstrak dan dimanfaatkan untuk kesehatan mata (Suyanti dan Supriyadi, 2008).
Kulit pisang juga dapat digunakan untuk membuat minuman anggur, produksi etanol, sebagai substrat untuk produksi biogas, sebagai bahan dasar untuk produksi pektin, dan pengolahan air limbah di pabrik. Abu kulit pisang dapat digunakan sebagai pupuk untuk tanaman pisang dan sebagai sumber alkali untuk produksi sabun, ekstrak etanol kulit pisang
(Musa sapientum) dapat digunakan penghambat korosi untuk baja ringan.
(Mohapatra, et. al., 2010).
2.1.2 Kandungan Kimia Kulit Pisang
sehingga kulitnya bisa menjadi bahan pakan yang baik untuk ternak dan unggas (Mohapatra, et al., 2010).
Menurut hasil penelitian dari Balai Penelitian dan Pengembangan Industri, tanaman pisang mengandung berbagai macam senyawa seperti air, gula pereduksi, sukrosa, pati, protein kasar, pektin, protopektin, lemak kasar, serat kasar, dan abu. Sedangkan di dalam kulitnya mengandung senyawa pektin yang cukup besar, dapat diekstraksi dengan cara sederhana, biaya yang tidak mahal, dan dapat diterapkan dalam skala kecil (Satria dan Ahda, 2009).
2.1.3 Pisang Kepok (Musa balbisiana)
Berdasarkan Herbarium Bandungense Sekolah Ilmu dan Teknologi Hayati Institut Teknologi Bandung (2015), klasifikasi dari pisang kepok
(Musa balbisiana) sebagai berikut :
Kingdom : Plantae
Divisi : Magnoliophyta
Kelas : Liliopsida
Ordo : Zingiberales
Famili : Musaceae
Genus : Musa
Spesies : Musa balbisiana
Gambar 2.1. Pisang Kepok
Berikut ini merupakan klasifikasi dari pisang kepok berdasarkan Herbarium Bogoriense (2014) :
Jenis : Musa balbisiana BBB
Famili : Musaceae
Pisang kepok (Musa balbisiana) tersebar dari India termasuk Kepulauan Andam hingga Myanmar utara (Burma), Thailand, dan Indocina ke China Selatan dan Filipina. Musa balbisiana merupakan salah satu spesies yang berasal dari Indocina (OECD, 2010).
Di Indonesia, pisang kepok memiliki banyak jenis, namun yang terkenal adalah pisang kepok kuning dengan daging buahnya berwarna kuning dan pisang kepok putih dengan daging buahnya berwarna putih. Pisang kepok kuning memiliki rasa yang lebih manis dan enak dibandingkan kepok putih. Pisang kepok memiliki daging buah yang bertekstur agak keras dengan buahnya tidak beraroma harum, kulit buahnya sangat tebal, dan pada buah yang sudah masak berwarna hijau kekuningan. Dalam satu tandan bisa terdapat hingga 16 sisir dan pada setiap sisirnya terdapat hingga 20 pisang, berat setiap tandannya sekitar 14-22 kg. Buah pisang kepok cocok untuk disantap dalam bentuk olahan (Cahyono, 2009).
2.2 Pektin
2.2.1 Pengertian dan Sumber Pektin
Umumnya pektin terdapat di dalam dinding sel primer, khususnya di sela-sela antara selulosa dan hemiselulosa, yang berfungsi sebagai bahan perekat antara dinding sel yang satu dengan yang lainnya (Hasbullah, 2001). Pektin yang dimanfaatkan untuk makanan merupakan suatu polimer dengan sedikitnya mengandung 65% unit asam galakturonat (IPPA, 2003).
Gambar 2.2. Struktur Dinding Sel Tanaman
[Sumber : IPPA, 2003]
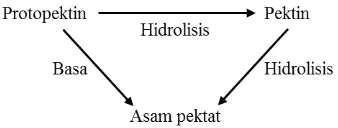
Komposisi kandungan protopektin, pektin, dan asam pektat di dalam buah sangat bervariasi tergantung pada derajat kematangan buah, di mana umumnya protopektin yang tidak larut lebih banyak terdapat pada buah-buahan yang belum matang (Winarno dan Aman, 2002). Pada buah-buahan yang masih muda, sel-sel yang satu dengan yang lainnya masih dipersatukan dengan kuat oleh protopektin, tetapi jika buah semakin tua, maka sebagian dari protopektin mengalami penguraian menjadi pektin karena adanya enzim protopektinase sehingga mengakibatkan terlepasnya sel-sel satu dari yang lain, sehingga buah menjadi lunak. Selanjutnya enzim pektinase meneruskan pengubahan pektin menjadi asam pektat, di mana menyebabkan buah menjadi matang (Dwidjoseputro, 1983). Beberapa gula juga ikut dalam pembentukan pektin, di antaranya adalah rhamnosa, galaktosa, dan xilosa (Winarno dan Aman, 2002).
2.2.2 Struktur, Komposisi Kimia, dan Jenis Pektin
Schneider dan Bock pada tahun 1937 membentuk formula tersebut (Herbstreith dan Fox, 2005).
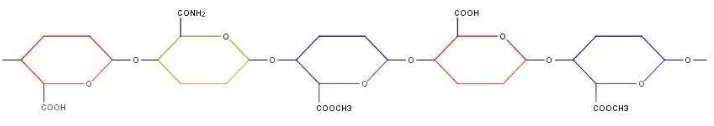
Gambar 2.3. Rumus Molekul Pektin
[Sumber : Koleksi Pribadi]
Senyawa pektin adalah asam pektat, asam pektinat, dan protopektin yaitu sebagai berikut :
1. Asam Pektat
Asam pektat adalah senyawa asam galakturonat yang bersifat koloid dan pada dasarnya bebas dari kandungan metil ester (Winarno dan Aman, 2002).
2. Asam Pektinat
Asam pektinat adalah asam poligalakturonat yang bersifat koloid dan mengandung sejumlah metil ester. Pektin merupakan asam pektinat dengan kandungan metil ester dan derajat netralisasi yang berbeda-beda (Winarno dan Aman, 2002).
3. Protopektin
Protopektin adalah substansi pektat yang tidak larut dalam air, terdapat dalam tanaman, jika dipisahkan secara hidrolisis akan menghasilkan asam pektinat (Klavons, et. al., 1995).
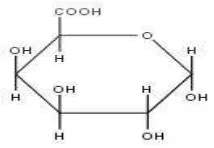
Gambar 2.4. Struktur Kimia Asam α-Galakturonat
Pektin terdiri dari monomer asam galakturonat yang berbentuk suatu rantai molekul panjang, di mana setiap rantai utamanya diselingi oleh kelompok rhamnosa dengan rantai cabang menyusun gula netral (arabinosa, galaktosa). Dalam suatu molekul pektin terdapat 300-1000 cincin yang merupakan suatu molekul dari asam galakturonat yang dihubungkan dengan suatu rantai linier (Hoejgaard, 2004 dalam Hanum, et.al., 2012). Kelompok karboksil (kelompok asam) dari asam galakturonat dapat diesterifikasi atau diamidasi (IPPA, 2003).
Selain asam D-galakturonat sebagai komponen utama, pektin juga memiliki D-galaktosa, L-arabinosa, dan L-rhamnosa dalam jumlah yang bervariasi. Komposisi kimia pektin sangat bervariasi tergantung pada sumber dan kondisi yang dipakai dalam isolasinya (Willats, et. al., 2006).
Gambar 2.5. Struktur Kimia Asam Poligalakturonat
[Sumber : Koleksi Pribadi]
Berdasarkan kandungan metoksil dan derajat esterifikasi (DE), pektin dibedakan menjadi dua golongan, yaitu pektin bermetoksil tinggi
(High Methoxyl Pectin) dengan kandungan metoksil minimal 7% dan
derajat esterifikasi lebih dari 50%, dan pektin bermetoksil rendah
(Low Methoxyl Pectin) dengan kandungan metoksil maksimal 7% dan
(Sriamornsak, 2003; Hui, 2006). Pengaruh terbesar pada sifat pektin adalah derajat esterifikasi yang akan menentukan tingkat reaktivitas dengan kalsium dan kation lainnya (IPPA, 2003).
Pektin yang diekstraksi biasanya memiliki lebih dari 50% unit asam yang teresterifikasi sehingga disebut pektin bermetoksil tinggi. Sedangkan modifikasi proses ekstraksi atau dengan perlakuan lebih lanjut akan menghasilkan pektin bermetoksil rendah dengan kurang dari 50% grup metil ester (IPPA, 2003).
Gambar 2.6. Molekul Pektin Bermetoksil Tinggi
[Sumber : Koleksi Pribadi]
Gambar 2.7. Molekul Pektin Bermetoksil Rendah
[Sumber : Koleksi Pribadi]
Beberapa pektin dalam proses produksinya dapat diekstraksi dengan menggunakan ammonia untuk menghasilkan pektin yang teramidasi dan memiliki beberapa keunggulan tertentu dalam beberapa aplikasinya (IPPA, 2003).
Gambar 2.8. Molekul Pektin yang Teramidasi
2.2.3 Sifat-sifat Pektin
Pektin banyak dijumpai pada buah-buahan dan sayur-sayuran serta dalam jumlah kecil ditemukan pada serealia (Kertesz, 1951). Kandungan pektin dari beberapa sayuran dan buah-buahan dapat dilihat pada tabel berikut :
Tabel 2.1. Komposisi Pektin pada berbagai Sayuran dan Buah-buahan
Jenis Bahan Kandungan Pektin (% berat)
Apel :
Pektin berupa serbuk kasar atau halus, berwarna putih kekuningan, hampir tidak berbau, dan mempunyai rasa musilago, hampir larut sempurna dalam 20 bagian air, membentuk cairan kental, opalesen, larutan koloidal yang mudah dituang dan bersifat asam, praktis tidak larut dalam etanol atau pelarut organik lainnya, larut dalam air lebih cepat jika permukaannya dibasahi dengan etanol, dengan gliserin, atau dengan sirup simpleks, atau jika permukaannya dicampur dengan tiga bagian atau lebih sukrosa (Farmakope Indonesia Edisi V, 2014).
buah-buahan dan sayuran matang (Food Chemicals Codex, 2004) dengan sifat-sfat fisikanya seperti kelarutan, viskositas, dan kemampuan membentuk gel tergantung dari karakteristik kimia pektin itu sendiri, seperti kadar metoksil, derajat esterifikasi, dan berat molekul (Prasetyowati, 2009). Pektin merupakan asam poligalakturonat yang bermuatan negatif, bereaksi dengan makromolekul bermuatan positif, di mana pembentukan gel dapat terjadi dengan cepat pada pH rendah, tetapi reaksi ini dapat dihambat dengan penambahan garam (May, 1990). Faktor-faktor yang mempengaruhi pembentukan gel dengan tingkat kekenyalan dan kekuatan tertentu meliputi suhu, pH, konsentrasi pektin, gula, dan keberadaan ion seperti Ca2+.
Kekentalan larutan pektin mempunyai kisaran yang cukup lebar tergantung pada konsentrasi pektin, garam, dan ukuran rantai asam poligalakturonat (Chang dan Miyamoto, 1992; Rolin, 1993).
Pembentukan gel pektin bermetoksil tinggi terjadi melalui ikatan hidrogen di antara gugus karboksil bebas dan gugus hidroksil, yang dipengaruhi oleh konsentrasi pektin, persentase gula, dan pH, di mana semakin besar konsentrasi pektin, semakin keras gel yang terbentuk. Konsentrasi pektin kurang dari 1% telah menghasilkan kekerasan yang cukup baik. Gula yang ditambahkan tidak boleh lebih dari 65% agar dapat mencegah terbentuknya kristal-kristal di permukaan gel (Rolin, 1993; Sundar Raj, et. al., 2012). Berbeda halnya dengan pektin bermetoksil rendah yang mana kemampuan membentuk gelnya akan hilang dengan adanya gula dan asam, tetapi mampu membentuk gel dengan adanya sejumlah ion kalsium atau kation divalen lainnya yang dapat bereaksi dengan gugus-gugus karboksil dari dua molekul asam pektat dan membetuk suatu jembatan, sehingga tidak diperlukan gula dan viskositas gel yang terbentuk kurang kental (Rolin, 1993; Guichard, et. al., 1991).
membentuk gel yang tidak sama karena adanya variasi dalam karakteristiknya (Sriamornsak, 2003). Rouse (1977) di dalam Hariyati (2006) mengungkapkan bahwa degradasi dan dekomposisi pektin dapat disebabkan oleh adanya reaksi oksidasi yang dipengaruhi suhu, pH, dan konsentrasi agen pengoksidasi.
2.2.4 Produksi Pektin
a. Ekstraksi Pektin
Ekstraksi pektin dari buah-buahan didasarkan pada sifat pektin yang dapat larut dalam air, sedangkan sebagian besar polisakarida lain, seperti selulosa dan hemiselulosa yang bersama-sama pektin menyusun dinding sel tanaman, bersifat tidak larut air (Prasetyowati, 2009).
Faktor-faktor yang berpengaruh dalam ekstraksi pektin antara lain sebagai berikut :
1) Derajat keasaman larutan ekstraksi (pH)
Kandungan ion hidrogen berpengaruh karena dapat mensubstitusi kalsium dan magnesium dari molekul protopektin sehingga menyebabkan protopektin terhidrolisis menghasilkan pektin yang larut dalam air (Prasetyowati, 2009).
2) Waktu kontak antara bahan baku dengan pelarut
Waktu kontak atau lama ekstraksi berpengaruh terhadap banyaknya ion hidrogen yang berhasil mensubstitusi kalsium dan magnesium dari protopektin sehingga akan menentukan jumlah pektin yang dapat terlarut dalam air (Prasetyowati, 2009).
3) Ukuran partikel yang diekstraksi
Ukuran partikel akan berpengaruh terhadap luas permukaan sentuhan antara solvent dan solute sehingga akan mempengaruhi jumlah pektin yang terlarut dalam air (Prasetyowati, 2009).
4) Suhu ekstraksi
5) Rasio pelarut dan bahan ekstraksi
Rasio antara pelarut dan bahan ekstraksi berpengaruh terhadap jumlah pektin karena umumnya pelarut memiliki keterbatasan untuk mengikat molekul-molekul pektin (Prasetyowati, 2009).
6) Jenis pelarut
Keberhasilan proses ekstraksi juga dipengaruhi oleh pemilihan pelarut yang tepat dengan kriteria seperti selektivitas, kelarutan, kemampuan tidak saling bercampur, reaktivitas, titik didih, dan kriteria-kriteria pendukung lainnya, seperti murah, tersedia dalam jumlah besar, tidak beracun, tidak dapat terbakar, tidak eksplosif bila bercampur dengan udara, tidak korosif, memiliki viskositas yang rendah, serta stabil secara kimia dan termis (Prasetyowati, 2009). 7) Jenis bahan yang diekstraksi
Jika bahan yang diekstraksi memiliki struktur yang lunak maka ekstraksi dapat berlangsung lebih cepat dan banyak molekul yang akan terlarut, tetapi jika bahan yang diekstraksi memiliki struktur yang keras maka diperlukan perlakuan khusus agar bahan tersebut mudah diekstraksi (Prasetyowati, 2009).
Gambar 2.9. Skema Perubahan Protopektin menjadi Pektin dan Asam Pektat [Sumber : Koleksi pribadi]
Pada umumnya ekstraksi pektin dilakukan dengan ekstraksi asam yang menggunakan beberapa jenis asam seperti asam tartrat, asam malat, asam sitrat, asam laktat, asam asetat, asam fosfat tetapi terdapat kecenderungan untuk menggunakan asam mineral yang murah seperti asam sulfat, asam klorida, dan asam nitrat (Kertesz, 1951). Beberapa artikel saat ini, menyarankan untuk menggunakan asam klorida (Kalapathy dan Proctor, 2001; Hwang, et. al., 1998; Dinu, 2001) dan asam nitrat (Pagán, et. al., 2001).
Ekstraksi menggunakan asam mineral menghasilkan rendemen yang lebih tinggi dibandingkan dengan asam organik. Asam mineral pada pH rendah lebih baik daripada pH tinggi untuk menghasilkan pektin (Rouse dan Crandal, 1978). Peranan asam dalam ekstraksi pektin adalah untuk memisahkan ion polivalen, memutus ikatan antara asam pektinat dengan selulosa, menghidrolisa protopektin menjadi molekul yang lebih kecil, dan menghidrolisa gugus metil ester pektin (Kertesz, 1951).
Suhu ekstraksi yang tinggi dapat meningkatkan rendemen pektin, di mana akan membantu difusi pelarut ke dalam jaringan tanaman dan dapat meningkatkan aktivitas pelarut dalam menghidrolisis pektin yang umumnya terdapat di dalam sel primer tanaman, khususnya pada lamella tengah (Towle dan Christensen, 1973). Suhu ekstraksi yang terlalu tinggi akan menghasilkan pektin yang tidak jernih sehingga gel yang diperoleh akan keruh dan kekuatan gel berkurang (Kertesz, 1951).
yang lebih mudah larut. Ekstraksi pektin dari sayur-sayuran dan buah-buahan dilakukan pada kisaran pH 1,5-3,0 dengan suhu pemanasan 60-1000C selama 30-90 menit (Towle dan Christensen,
1973). Waktu ekstraksi yang terlalu lama akan mengakibatkan terjadinya hidrolisis pektin menjadi asam galakturonat. Pada kondisi asam, ikatan glikosidik gugus metil ester dari pektin cenderung terhidrolisis menghasilkan asam galakturonat (Smit dan Bryant, 1986). b. Pengendapan Pektin
Proses pengendapan pektin merupakan suatu proses pemisahan pektin dari larutannya. Pektin adalah koloid hidrofilik yang bermuatan negatif (dari gugus karboksil bebas yang terionisasi) dan tidak mempunyai titik isoelektrik seperti kebanyakan kolod hidrofilik, lebih utama distabilkan oleh hidrasi partikelnya daripada oleh muatannya, sehingga dengan penambahan alkohol dapat mendehidrasi pektin sehingga mengganggu stabilitas larutan koloidalnya sehingga pektin akan terkoagulasi (Rouse, 1977 dalam Hariyati, 2006). Menurut Prasetyowati (2009), pengendapan pektin dilakukan dengan penambahan alkohol yang bersifat sebagai pendehidroksi dengan bobot molekul yang rendah, sehingga akan bercampur sempurna dengan air melalui ikatan hidrogen dan akan mengurangi jumlah ion atau molekul air yang mengelilingi pektin, sehingga keseimbangan antara pektin dengan air akan terganggu dan pektin akan mengendap.
c. Pencucian Pektin
Koh, et. al. (2014) melakukan pencucian pektin dengan etanol 70% sebanyak dua kali dilanjutkan dengan etanol 95% hingga filtrat bekas pencucian tidak berwarna. Maulidiyah, et. al. (2014) melakukan pencucian pektin dengan menambahkan etanol 96% sambil diaduk yang dilakukan beberapa kali hingga pektin tidak bereaksi dengan asam. Susilowati, et. al. (2013) juga melakukan pencucian pektin menggunakan alkohol hingga pH netral dan menghasilkan pektin dengan warna yang lebih bersih dan putih.
d. Pengeringan Pektin
Tahap akhir dari produksi pektin adalah pengeringan endapan pektin, di mana dianjurkan dilakukan pada tekanan yang rendah agar pektin tidak terdegradasi. Hanum, et. al. (2012) melakukan pengeringan pektin dalam oven pada suhu 400C selama 8 jam. Azad, et. al. (2014) menggunakan cabinet drier untuk mengeringkan pektin dengan suhu 400C selama 24 jam. Koubala, et. al. (2008) mengeringkan pektin dengan vacuum-drying pada suhu 500C selama satu malam.
2.2.5 Karakterisasi Pektin
Pektin komersial harus memenuhi syarat mutu International Pectin
Producers Association (IPPA) dan Food Chemicals Codex serta spesifikasi
seperti dalam farmakope. Karakteristik pektin tergantung dari kondisi ekstraksi pektin, di mana hasil ekstraksi terbaik biasanya diperbandingkan dengan pektin komersial. Hal ini dilakukan karena jika diaplikasikan pada industri, kebutuhan energi untuk peningkatan suhu dan lama ekstraksi akan meningkatkan biaya produksi. Apabila perlakuan suhu terendah dan waktu paling cepat dapat memberikan hasil yang masih dapat diperbolehkan oleh IPPA, Food Chemicals Codex, dan Farmakope, maka hal ini akan sangat menguntungkan jika diaplikasikan (Fitriani, 2003).
Tabel 2.2. Spesifikasi Standar Mutu Pektin
Karakteristik Nilai
Kadar air (maksimum) 12%
Kadar abu (maksimum) 10%
Berat ekivalen 600 – 800
Kandungan metoksil :
Pektin bermetoksil tinggi
Pektin bermetoksil rendah
> 7,12% 2,5 – 7,12% Kandungan asam galakturonat (minimum) 65% Derajat esterifikasi untuk
Pektin ester tinggi (minimum)
Pektin ester rendah (maksimal)
50% 50%
Tabel 2.3. Spesifikasi Pektin Berdasarkan Farmakope
Tes USP 28
Identifikasi +
Susut pengeringan < 10,0%
Arsenik < 3 ppm menentukan daya tahan suatu produk, terkait dengan aktivitas mikroorganisme selama penyimpanan dan berpengaruh terhadap masa simpan. Produk dengan kadar air rendah relatif lebih stabil dalam penyimpanan jangka panjang daripada produk dengan kadar air tinggi yang rentan terhadap aktivitas mikroba (Pardede, et. al., 2013). Kadar air ditentukan dengan pengukuran kandungan air yang berada di dalam produk (Departemen Kesehatan, 2000).
b. Kadar Abu
kemurnian pektin. Semakin tinggi tingkat kemurnian pektin, maka kadar abu akan semakin rendah (Budiyanto dan Yulianingsih, 2008).
Prinsip penetapan kadar abu adalah bahan dipanaskan pada temperatur di mana senyawa organik dan turunannya terdestruksi dan menguap, sehingga yang tertinggal hanya unsur mineral dan anorganik (Departemen Kesehatan, 2000).
c. Berat Ekivalen
Ranganna (1977) di dalam Hariyati (2006) menjelaskan bahwa berat ekivalen adalah kandungan gugus asam galakturonat bebas yang tidak teresterifikasi dalam rantai molekul pektin. Asam pektat murni merupakan zat pektat yang seluruhnya tersusun dari asam poligalakturonat yang bebas dari gugus metil ester atau tidak mengalami esterifikasi. Semakin rendah kadar pektin akan menyebabkan berat ekivalen semakin rendah.
d. Kadar Metoksil
Kadar metoksil merupakan jumlah mol etanol yang terdapat di dalam 100 mol asam galakturonat yang memiliki peranan penting dalam menentukan sifat fungsional larutan pektin dan dapat mempengaruhi struktur dan tekstur dari gel pektin (Constenla dan Lozano, 2003).
e. Kadar Galakturonat
Perhitungan kandungan galakturonat sangat penting untuk mengetahui kemurnian pektin. Kadar galakturonat dan muatan molekul pektin memiliki peranan penting dalam menentukan sifat fungsional larutan pektin dan dapat mempengaruhi struktur serta tekstur dari gel pektin (Sofiana, et. al., 2012).
f. Derajat Esterifikasi (DE)
terlalu lama, pektin akan berubah menjadi asam pektat yang asam galakturonatnya bebas dari gugus metil ester. Jumlah gugus metil ester menunjukkan jumlah gugus karboksil yang tidak teresterifikasi atau derajat esterifikasi (Budiyanto dan Yulianingsih, 2008).
g. Kekuatan Gel
Konsentrasi pektin berpengaruh terhadap pembentukan gel dengan tingkat kekenyalan dan kekuatan tertentu (Budiyanto dan Yulianingsih, 2008). Grade pektin didefinisikan sebagai jumlah gula yang dibutuhkan oleh satu bagian pektin untuk membentuk gel yang diinginkan pada kondisi yang sesuai, di mana menjadi indikasi penting yang menggambarkan mutu pektin. Pektin yang mempunyai grade 100 dapat membentuk gel yang baik dengan 100 gram gula. Penentuan grade pektin biasanya menggunakan metode International Food Technologist (IFT),
yaitu dengan membuat gel dengan konsentrasi gula 65% pada pH 2,2 - 2,4 yang disimpan selama 18-24 jam dan kemudian diuji dengan
alat Ridgelimeter (Meilina dan Silah, 2013).
2.2.6 Aplikasi Pektin
Pektin adalah produk alami yang dapat ditemukan dalam dinding sel dari semua tanaman tingkat tinggi, umumnya digunakan sebagai agen pembentuk gel, pengental, dan penstabil. Saat ini pektin merupakan komponen yang tidak terpisahkan dari berbagai macam produk baik dalam industri makanan, seperti untuk produksi selai, gula-gula, pasta, dan produk susu. Pektin juga dapat dimanfaatkan dalam industri non-pangan, seperti dalam farmasi dan kosmetik. Beberapa tahun terakhir manfaat pektin semakin penting dan dibutuhkan oleh konsumen (IPPA, 2003).
Selain itu, pektin juga berperan sebagai bahan pokok pembuatan jelly, jam,
dan marmalades (Herbstreith dan Fox, 2005).
Pektin dengan sendirinya atau dengan sifat pembentuk gelnya memiliki potensi yang baik dalam bidang farmasi. Pektin digunakan untuk mengatasi konstipasi, sebagai salah satu bahan utama yang digunakan dalam kaopektat bersama dengan kaolinit, pelega tenggorokan (demulcent), sumber serat, dan komponen propilaktit alami untuk melawan keracunan kation toksik (Malviya, 2011). Pektin melalui pembuluh darah dapat memperpendek waktu koagulasi darah yang berguna untuk mengendalikan pendarahan. Pada industri farmasi, pektin digunakan sebagai polimer mukoadhesif, gelling agent, pengental, pengikat air, stabilator, emulsifier
bagi preparat cair dan sirup, obat diare pada bayi dan anak-anak, obat penawar racun logam, dan bahan penyusut kecepatan absorpsi berbagai macam obat. Selain itu, pektin juga berfungsi sebagai bahan kombinasi untuk memperpanjang kerja hormon dan antibiotik, bahan pelapis perban (pembalut luka) untuk menyerap kotoran dan jaringan rusak, serta bahan injeksi untuk mencegah pendarahan (Towle dan Christensen, 1973, 2006; Malviya, 2011).
Pektin merupakan salah satu tipe serat pangan yang bersifat larut dalam air karena merupakan serat yang berbentuk gel, dapat memperbaiki otot pencernaan, dan mendorong sisa makanan pada saluran pembuangan. Dalam usus besar, mikroorganisme mendegradasi pektin dan membebaskan rantai pendek asam lemak yang memiliki pengaruh positif pada kesehatan atau dikenal sebagai efek prebiotik. Pektin juga dikenal sebagai antikolesterol karena dapat mengikat asam empedu yang merupakan hasil akhir metabolisme kolesterol. Semakin banyak asam empedu yang berikatan dengan pektin dan terbuang ke luar tubuh, semakin banyak kolesterol yang
dimetabolisme sehingga menurunkan jumlah kolesterol tubuh. Selain itu, pektin juga dapat menyerap kelebihan air dalam usus,
Pektin merupakan senyawa yang menarik dalam bidang farmasi karena berpotensi sebagai carrier atau pembawa obat dalam formulasi pelepasan terkontrol dan dalam penargetan situs spesifik misalnya untuk penghantaran obat ke saluran pencernaan seperti matriks tablet, gel beads,
dan film coated. Banyak teknik yang telah digunakan untuk memproduksi
pektin berbasis sistem penghantaran, terutama ionotropik gelasi atau gel
coating. Dengan teknik sederhana dan dengan profil toksisitas yang sangat
aman, membuat pektin sebagai eksipien menarik dan menjanjikan dalam industri farmasi untuk aplikasi masa kini dan masa mendatang (Sriamornsak, 2003; Malviya, 2011).
2.3 Asam Klorida
Asam Klorida (HCl) memiliki sinonim acidum hydrochloridum concentratum; chlorohydric acid; concentrated hydrochloric acid; E507.
Asam klorida berfungsi sebagai acidifying agent atau agen pengasam berupa
larutan jernih, tidak berwarna, yang berasap dengan bau yang menyengat,
memiliki titik didih sebesar 1100C pada pemanasan konstan dari 20,24% b/b
HCl, dapat bercampur dengan air, larut dalam dietil eter, etanol 95%, dan
metanol (Rowe, et. al., 2009).
Asam klorida sebaiknya disimpan dalam wadah yang tertutup dengan
baik, dalam wadah gelas atau wadah inert lainnya pada temperatur di bawah
300C dan harus terhindar dari senyawa alkali, logam, dan sianida karena
dapat bereaksi dengan senyawa tersebut dengan menimbulkan sejumlah panas (Rowe, et. al., 2009).
2.4 Spektroskopi FTIR (Fourier Transform Infra Red)
dibagi dalam tiga daerah, inframerah jauh (200-10 cm-1), inframerah tengah (4000-200 cm-1) dan inframerah dekat (12500-4000 cm-1) (Watson, 2009).
Dua jenis instrumen yang biasa digunakan untuk memperoleh spektrum inframerah yaitu instrumen dispersi dengan menggunakan suatu monokromator untuk memilih masing-masing bilangan gelombang secara berurutan untuk memantau intensitasnya setelah radiasi telah melewati sampel, dan instrumen transformasi Fourier dengan menggunakan suatu interferometer yang menghasilkan sumber radiasi dengan masing-masing bilangan gelombang dapat dipantau dalam + 1 detik pulsa radiasi tanpa memerlukan dispersi. Dalam suatu instrumen inframerah transformasi Fourier (Fourier Transform Infrared, FTIR), prinsipnya adalah monokromator digantikan oleh suatu interferometer yang menggunakan cermin bergerak untuk memindahkan bagian radiasi yang dihasilkan oleh satu sumber, sehingga menghasilkan suatu interferogram yang dapat diubah dengan menggunakan suatu persamaan yang disebut “Transformasi
Fourier‟ untuk mengekstraksi spektrum dari suatu seri frekuensi yang
bertumpang tindih (Watson, 2009).
Spektroskopi FTIR memiliki banyak keunggulan dibanding spektroskopi inframerah diantaranya yaitu lebih cepat karena pengukuran dilakukan secara serentak (simultan), serta mekanik optik lebih sederhana dengan sedikit komponen yang bergerak (Suseno dan Firdausi, 2008).
3.1 Tempat dan Waktu Penelitian
Penelitian dilaksanakan di laboratorium Penelitian 1, laboratorium Penelitian 2, dan laboratorium Kimia Obat, Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta. Waktu penelitian dimulai pada bulan November 2014 hingga April 2015.
3.2 Alat dan Bahan 3.2.1 Alat
Peralatan yang digunakan dalam penelitian ini antara lain alat-alat gelas seperti erlenmeyer (Schott Duran), gelas beaker (Schott Duran), gelas ukur (Schott Duran), labu ukur, tabung reaksi, pipet tetes, pipet volumetrik, batang pengaduk, kaca arloji, labu Buchner, corong, botol timbang, dan buret. Adapun alat-alat lain di antaranya timbangan analitik, mikropipet, spatula, corong Buchner, hot plate stirrer, magnetic stirrer, grinder, oven, tanur, krustang, krus porselen dan tutup, bulp, cawan porselen, desikator, statif dan klem, termometer, pH meter (HORBA), pH indikator universal, Spektroskopi IRPrestige-21 Shimadzu, dan viskotester HAAKE 6R.
3.2.2 Bahan
Bahan baku tumbuhan yang digunakan dalam penelitian ini adalah kulit pisang kepok kuning (Musa balbisiana BBB) dari buah yang masih mentah, diperoleh dari limbah pengolahan kripik pisang kepok yang ada di daerah Ciputat di mana pisangnya disuplai dari Cilawu, Garut, yang terlebih dahulu dideterminasi di Laboratorium Herbarium Bogoriense, Pusat Penelitian Biologi LIPI (Lembaga Ilmu Pengetahuan Indonesia), Bogor, Jawa Barat.
NaCl, aseton teknis, etanol 96%, etanol absolut, asam oksalat 0,1027 N, pektin Cargill®, pektin Danisco®, indikator phenolptalein (PP), indikator metil merah, dan serbuk KBr.
3.3 Prosedur Penelitian 3.3.1 Persiapan Bahan Baku
Bahan baku limbah kulit pisang kepok kuning (Musa balbisiana BBB) disortasi basah terlebih dahulu (dipisahkan antara kulit pisang yang bagus dengan yang busuk), dipilih kulitnya yang berwarna hijau atau kekuningan, bagian pucuk dan tangkai kulit pisang tidak diambil. Kemudian dicuci dengan menggunakan air mengalir untuk membersihkan kulit pisang dari kotoran-kotoran yang menempel. Setelah bersih, dilakukan perajangan kecil-kecil dan selanjutnya bahan baku disiapkan dengan perlakuan yang berbeda, yaitu bahan segar dan kering.
a. Pembuatan bubur kulit pisang (bahan segar)
Bahan baku kulit pisang kepok segar yang telah dirajang, diambil sebanyak 300 gram, lalu dihancurkan menggunakan blender dengan penambahan aquadest sebanyak 150 mL (perbandingan 2 : 1) sampai kulit pisang tersebut dapat diblender hingga menjadi bubur kulit pisang (Ekasari, 2013; Utami, 2014; dengan modifikasi).
b. Pembuatan serbuk kulit pisang (bahan kering)
Bahan baku kulit pisang kepok segar yang telah dirajang diambil sebanyak 5 kg dan dikeringkan dengan cara dikering anginkan di bawah sinar matahari, kemudian dikeringkan menggunakan blower pada suhu 500C selama 5 hari. Kulit pisang yang telah kering
3.3.2 Produksi Pektin
1. Ekstraksi Pektin
Bahan segar ditimbang sebanyak 300 gram dan bahan kering 42 gram, masing-masing dimasukkan ke dalam erlenmeyer 2000 mL dan ditambahkan pelarut HCl sejumlah volume tertentu, bahan segar dengan perbandingan (b/v) 1 : 2 (300 gram dalam 600 mL) dan bahan kering 1 : 20 (42 gram dalam 840 mL) dengan variasi konsentrasi pelarut HCl yaitu 0,025 N; 0,05 N; dan 0,075 N. Masing-masing campuran tersebut dipanaskan di atas hot plate stirrer dengan pengaturan suhu 900C disertai pengadukan konstan menggunakan
magnetic stirrer selama 80 menit. Penghitungan waktu ekstraksi
dimulai saat tercapainya kondisi operasi percobaan. Setelah dipanaskan, selanjutnya dilakukan penyaringan filtrat hasil ekstraksi menggunakan kertas saring dengan bantuan vacuum Buchner untuk memisahkan filtrat dari residunya, dan filtrat didinginkan pada suhu ruang. Filtrat yang didapatkan disebut dengan filtrat pektin (Hanum et. al., 2012; Utami, 2014 dengan modifikasi).
2. Pengendapan Pektin
Filtrat hasil ekstraksi yang telah dingin diendapkan menggunakan aseton dengan perbandingan tiap 1 liter filtrat ditambahkan dengan 1,5 liter aseton, kemudian didiamkan selama satu malam (18 jam). Endapan pektin yang terbentuk dipisahkan dari filtratnya menggunakan kertas saring dengan bantuan vacuum Buchner (Fitria, 2013).
3. Pencucian Pektin
Endapan pektin yang terbentuk dicuci dengan etanol 96% sambil dilakukan pengadukan. Pemisahan endapan pektin dengan etanol 96% bekas pencucian dilakukan menggunakan kertas saring dengan bantuan
vacuum Buchner. Hal ini dilakukan beberapa kali hingga pektin bebas
etanol 96% yang ditambahkan dengan beberapa tetes larutan perak nitrat (AgNO3) (Hariyati, 2006; Fitria, 2013).
4. Pengeringan pektin
Pektin basah hasil pengendapan yang telah dicuci dan bebas aseton, asam, dan klorida selanjutnya dikeringkan dalam oven pada suhu 400C selama kurang lebih 8 jam. Hasil yang diperoleh disebut
dengan pektin kering (Hanum, et. al., 2012).
3.4 Identifikasi Kualitatif Pektin
a. Larutan pektin 1% (1 gram dalam 100 mL), diambil 5 mL, lalu ditambahkan etanol P dengan volume yang sama, akan terbentuk endapan bening seperti gelatin (perbedaan dari kebanyakan gom). b. 5 mL larutan pektin 1% ditambahkan 1 mL NaOH 2 N, dibiarkan pada
suhu ruang selama 15 menit, akan terbentuk gel atau semigel (perbedaan dari tragakan).
c. Gel yang diperoleh dari pengujian B diasamkan dengan HCl 3 N, lalu dikocok, akan terbentuk endapan seperti gelatin, tidak berwarna, yang menjadi putih dan bergumpal bila dididihkan (asam pektat).
(Farmakope Indonesia Edisi V, 2014 dengan modifikasi)
3.5 Karakteristik Pektin a. Jumlah Pektin
Jumlah pektin adalah banyaknya pektin dalam gram yang dihasilkan dari ekstraksi kulit pisang kepok kuning (Musa balbisiana
BBB) pada masing-masing perlakuan, yaitu menggunakan bahan segar dan kering yang diekstraksi dengan pelarut HCl pada berbagai konsentrasi (0,025 N; 0,05 N; dan 0,075 N).
b. Penentuan Kadar Air
Botol timbang dipanaskan dalam oven pada suhu 1050C selama
1050C selama 3 jam. Setelah itu didinginkan dalam desikator selama 30 menit, lalu ditimbang dan dicatat bobotnya. Pemanasan diulangi kembali dan ditimbang hingga diperoleh bobot yang konstan. Perhitungan kadar air dilakukan dengan menggunakan rumus :
Keterangan :
Wa = Bobot sebelum dikeringkan (gram)
Wb = Bobot akhir setelah dikeringkan (gram)
(SNI 01-2891-1992)
c. Penentuan Kadar Abu
Krus porselen dikeringkan di dalam tanur pada suhu 5500C kemudian didinginkan di dalam desikator dan ditimbang sebagai bobot wadah. Selanjutnya sebanyak 0,300 gram sampel pektin ditimbang dan dimasukkan dalam krus porselen yang telah diketahui bobotnya, lalu dimasukkan dalam tanur pada suhu 5500C sampai pengabuan sempurna.
Residu didinginkan dalam desikator dan ditimbang sampai diperoleh bobot tetap. Perhitungan kadar abu dilakukan dengan menggunakan rumus :
Keterangan :
W = Bobot sampel awal (gram)
W1 = Bobot wadah + sampel setelah pemanasan (gram)
W2 = Bobot wadah kosong (gram)
(SNI 01-2891-1992)
d. Penentuan Berat Ekivalen
NaCl serta ditambahkan 6 tetes indikator phenoftalein sebagai indikator. Campuran tersebut kemudian diaduk dengan cepat untuk memastikan bahwa semua substansi pektin telah terlarut dan tidak ada gumpalan yang menempel pada sisi erlenmeyer. Titrasi dilakukan perlahan-lahan dengan titran standar NaOH 0,1027 N sampai warna campuran berubah menjadi merah muda dan tetap bertahan selama setidaknya 30 detik.
(Owen, et. al., 1952 dalam Nazaruddin, et. al., 2013)
e. Kadar Metoksil
Penentuan kadar metoksil dilakukan dengan menambahkan 25,0 mL NaOH 0,25 N ke dalam larutan netral dari penentuan BE kemudian dikocok dengan benar dan didiamkan selama 30 menit pada suhu kamar dalam erlenmeyer tertutup. Selanjutnya ditambahkan 25,0 mL HCl 0,25 N dan 6 tetes indikator phenoftalein kemudian dititrasi dengan titran NaOH 0,1027 N hingga larutan berubah menjadi merah muda.
Keterangan :
Nilai 31 didapatkan dari bobot molekul metoksil yang berupa CH3O.
(Owen, et. al., 1952 dalam Nazaruddin, et. al., 2013)
f. Kadar Galakturonat
Kadar galakturonat dihitung dari mEk (miliekivalen) NaOH yang diperoleh dari penentuan BE dan kandungan metoksil.
Keterangan :
* = Diperoleh dari mEk NaOH untuk asam bebas pada penentuan BE ** = Diperoleh dari mEk NaOH pada penentuan metoksil
g. Derajat Esterifikasi
Derajat esterifikasi dihitung dari kadar metoksil dan kadar galakturonat yang telah diperoleh.
(Owen, et. al., 1952 dalam Nazaruddin, et. al., 2013)
h. Viskositas Larutan Pektin
Pengujian viskositas dilakukan menggunakan viskotester HAAKE 6R terhadap setiap larutan pektin 1% dari masing-masing kondisi ekstraksi menggunakan spindel R2 dengan kecepatan putar 60 rpm pada suhu ruang. Nilai viskositas dalam satuan centipoises (cPs) (Goycoolea dan Adriana, 2003).
3.6 Perbandingan Spektrum FTIR
Perbandingan spektrum FTIR pektin hasil ekstraksi dengan pektin standar dilakukan dengan menggunakan Spektroskopi IRPrestige-21 Shimadzu pada daerah 400-4000 cm-1 dengan resolusi 2 cm-1 dan 16 scan.
Sampel uji dibuat dengan mencampurkan 20 mg serbuk pektin dengan 100 mg KBr untuk membuat pellet. Setelah didapatkan spektrum masing-masing, selanjutnya dibandingkan tiap serapan gugus fungsionalnya antara pektin hasil ekstraksi dengan pektin komersial yang dibeli dari Cargill® dan Danisco® yang digunakan sebagai standar (Gopi, et. al., 2014 dengan modifikasi).
3.7 Perbandingan Pektin Hasil Penelitian terhadap Pektin Komersial
4.1 Penentuan Bahan Baku
Bahan baku yang digunakan dalam penelitian ini berupa limbah kulit pisang kepok kuning yang diperoleh dari pengolahan kripik pisang di daerah Ciputat di mana buah pisangnya disuplai dari Cilawu, Garut. Buah pisang kepok sering dimanfaatkan untuk diolah menjadi berbagai jenis makanan seperti kripik pisang, sehingga akan menyisakan kulit pisang yang kurang pemanfaatannya dan umumnya dibuang sebagai limbah. Pemilihan limbah kulit pisang kepok ini adalah untuk memanfaatkan limbah terbuang yang sudah tidak digunakan menjadi suatu bahan baku produksi pektin yang bernilai ekonomis.
Cahyono (2009) mengungkapkan bahwa pektin terdistribusi secara luas dalam jaringan tanaman dan umumnya terdapat pada dinding sel. Pisang kepok memiliki kulit buah yang cukup tebal dengan kandungan pektin di dalamnya berkisar 10-21% (Mohapatra, et. al., 2010). Pemilihan bahan baku kulit pisang kepok memiliki kelebihan yaitu diperoleh dengan tidak mengeluarkan biaya karena berupa limbah organik yang dibuang begitu saja, sehingga dapat menekan biaya produksi pektin, dan diharapkan dapat menghasilkan pektin dalam jumlah besar dan ekonomis tanpa mengurangi kualitas pektin yang dihasilkan.
4.2 Determinasi Tanaman Bahan Baku
4.3 Persiapan Bahan Baku
Bahan baku yang digunakan berupa limbah kulit pisang kepok kuning yang masih mentah yang mana kulitnya keras, bergetah, dan berwarna hijau atau kekuningan. Bahan baku diambil dari pengolahan kripik pisang yang umumnya menggunakan buah pisang yang masih mentah. Pemilihan kulit pisang dari buah yang masih mentah berdasarkan pendapat Sambeganarko (2008), di mana protopektin banyak terdapat pada buah mentah dengan sifat tidak larut air yang dapat dihidrolisis menggunakan asam atau secara enzimatis untuk menghasilkan pektin yang mudah larut dalam air (Hanum, et. al., 2012). Dalam penelitian ini bahan baku disiapkan dalam dua perlakuan yang berbeda yaitu bahan segar dan bahan kering. Hal pertama yang dilakukan adalah melakukan sortasi basah terhadap limbah kulit pisang kepok yang diperoleh dengan dipisahkan dari tangkai dan ujungnya kemudian dibersihkan dengan dicuci menggunakan air mengalir hingga terbebas dari kotoran yang menempel dan dirajang kecil-kecil.
Bahan segar disiapkan dengan cara menghancurkan kulit pisang kepok segar menggunakan blender dengan penambahan aquadest (2 : 1 b/v)
sehingga terbentuk bubur kulit pisang. Sedangkan bahan kering disiapkan dari 5 kg kulit pisang kepok segar yang telah disortasi basah, dicuci, dirajang, lalu dikering-anginkan selama satu malam yang selanjutnya dikeringkan menggunakan blower pada suhu 500C selama 5 hari yang dilakukan di BALITTRO (Balai Penelitian Tanaman Obat dan Aromatik), Cimanggu, Bogor. Kulit pisang kepok yang telah kering selanjutnya dihaluskan menjadi serbuk menggunakan grinder dan diayak dengan ayakan
Setelah pengeringan dan penghalusan, dari 5 kg kulit pisang kepok segar menghasilkan 691 gram serbuk kulit pisang kepok kering. Serbuk kulit pisang kepok yang dihasilkan tergolong sedikit dikarenakan kandungan air yang cukup tinggi dalam limbah kulit pisang segar, sehingga untuk menghasilkan serbuk kulit pisang kepok yang banyak diperlukan bahan baku limbah kulit pisang yang banyak pula.
Tabel 4.1. Bahan Baku
No. Bahan Baku Hasil
1 Bobot kulit pisang kepok awal untuk dikeringkan 5 kg 2 Bobot serbuk kulit pisang kepok setelah pengeringan 691 gram
3 Kadar air serbuk kulit pisang kepok 8,90%
4 Kadar air kulit pisang kepok segar 85,3868%
Selanjutnya dilakukan penentuan kadar air terhadap kedua bahan baku (bahan segar dan kering) tersebut guna mengetahui kadar air awal dari bahan baku yang digunakan sebelum dilakukan ekstraksi pektin, karena kandungan air yang terkandung dapat mempengaruhi proses ekstraksi. Penentuan kadar air awal bahan baku dilakukan dengan menggunakan prinsip gravimetri. Hasil yang diperoleh menunjukkan kadar air awal bahan segar (kulit pisang kepok segar) sebesar 85,3868% dan bahan kering (serbuk kulit pisang kepok) sebesar 8,90%. Kadar air untuk bahan kering adalah 8,90% di mana kadar air ini tidak lebih dari yang diperbolehkan untuk bahan kering yaitu kurang dari 10% (Hanum et. al., 2012). Pemeriksaan kadar air untuk bahan segar dilakukan di laboratorium Kimia Obat, Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta sedangkan untuk bahan kering dilakukan di BALITTRO (Balai Penelitian Tanaman Obat dan Aromatik), Cimanggu, Bogor.
4.4 Produksi Pektin
selama 80 menit. Waktu dan suhu ekstraksi dalam penelitian ini ditetapkan berdasarkan hasil penelitian yang dilakukan oleh Hanum et. al. (2012) yang menyatakan bahwa rendemen tertinggi yang diperoleh dari hasil ekstraksi kulit pisang kepok menggunakan pelarut asam klorida adalah pada suhu 900C selama 80 menit. Ekstraksi pektin dilakukan menggunakan metode
konvensional yakni secara pemanasan langsung. Srivastava dan Malviya (2011) menyatakan bahwa ada dua metode ekstraksi pektin yang biasa dilakukan, yaitu pemanasan langsung dan pemanasan menggunakan
microwave.
Hanum, et. al. (2012) mengungkapkan bahwa ekstraksi pektin dapat dilakukan dengan hidrolisis asam atau secara enzimatis. Pada penelitian ini, ekstraksi pektin dilakukan dengan hidrolisis asam yaitu menggunakan pelarut HCl dengan variasi konsentrasi yang digunakan untuk merombak protopektin yang tidak larut menjadi pektin yang mudah larut. Penggunaan pelarut HCl di dasarkan pada pernyataan Kertesz (1951) bahwa selain asam organik, ekstraksi pektin memiliki kecenderungan untuk menggunakan asam mineral yang murah seperti asam klorida, asam sulfat, dan asam nitrat. Beberapa artikel saat ini menyarankan untuk ekstraksi menggunakan asam klorida (Kalapathy dan Proctor, 2001; Dinu, 2001; Hwang, et. al., 1998)
Dalam proses ekstraksi pektin digunakan bahan baku dengan dua perlakuan yang berbeda yaitu bahan segar dan kering. Sebanyak 300 gram bahan segar dan 42 gram bahan kering masing-masing dimasukkan ke dalam erlenmeyer 2000 mL, lalu ditambahkan larutan HCl 600 mL (1 : 2 ) untuk bahan segar dan 840 mL (1 : 20) untuk bahan kering. Selanjutnya ke dalam erlenmeyer tersebut dimasukkan magnetic stirrer dan pada leher erlenmeyer ditutup dengan sumbat kapas. Proses ekstraksi dilakukan dengan pemanasan di atas hot plate pada suhu 900C selama 80 menit yang selalu
dan memperluas kontak partikel dengan pelarutnya. Setelah proses ekstraksi selesai, campuran didinginkan terlebih dahulu yang selanjutnya dilakukan proses penyaringan untuk memisahkan antara filtrat dengan residunya menggunakan kertas saring dengan bantuan vacuum Buchner sehingga proses penyaringan dapat berjalan lebih cepat.
Setelah disaring, filtrat yang diperoleh dipindahkan ke dalam wadah kaca lain, lalu dilakukan pengendapan pektin dengan penambahan aseton. Aseton dipilih sebagai agen pengendap dikarenakan aseton lebih disukai karena kemampuannya membentuk endapan yang tegar sehingga mudah dipisahkan dari asetonnya dibandingkan dengan etanol yang menghasilkan pektin yang kurang murni karena tidak hanya mengendapkan pektin tetapi juga senyawa lain seperti dekstrin dan hemiselulosa (Akhmalludin dan Kurniawan, 2009). Penambahan aseton ke dalam filtrat hasil ekstraksi dilakukan secara perlahan sambil diaduk sehingga terbentuk endapan, yang kemudian didiamkan selama satu malam (18 jam) agar proses pengendapan berlangsung sempurna. Setelah 18 jam, endapan tersebut disaring untuk memisahkan endapan dari filtratnya, kemudian endapan dicuci beberapa kali menggunakan etanol 96% hingga bebas dari residu aseton, asam, dan klorida. Pencucian dengan etanol 96% dipilih karena dapat menghasilkan warna pektin yang jauh lebih bersih dan putih dibandingkan dengan pencucian tanpa alkohol (Susilowati, 2013). Pektin yang telah bebas asam adalah pektin yang berwarna kuning saat ditetesi dengan indikator metil merah dan memberikan warna netral pada pH indikator universal ketika dicelupkan ke dalam larutan bekas pencucian, adapun pektin yang telah bebas klorida yaitu apabila tidak terbentuk endapan putih (AgCl) pada larutan bekas pencucian pektin yang ditambahkan dengan beberapa tetes larutan perak nitrat (AgNO3) (Hariyati, 2006; Fitria, 2013)
Setelah pencucian pektin, selanjutnya dilakukan penekanan terhadap endapan pektin dalam kertas saring sehingga endapan tidak terlalu basah dengan etanol 96%, lalu pektin dikeringkan dalam oven selama kurang lebih 8 jam dengan suhu pengeringan rendah, yaitu 400C untuk memperkecil
dihaluskan menjadi serbuk dengan digerus menggunakan lumpang dan alu, lalu dihitung bobotnya dan dilakukan karakterisasi untuk menentukan kualitas dari pektin yang dihasilkan, meliputi penentuan kadar air, kadar abu, berat ekivalen, kadar metoksil, kadar galakturonat, dan derajat esterifikasi. Hasil karakterisasi tersebut dibandingkan dengan standar yang telah ditetapkan dalam literatur seperti Farmakope Indonesia Edisi V (2014), Food Chemicals Codec (2004), dan IPPA (2003).
4.5 Identifikasi Kualitatif Pektin
Pemerian pektin hasil ekstraksi pada penelitian ini cenderung sama pada tiap kondisi ekstraksi yang dipengaruhi perlakuan bahan baku dan konsentrasi HCl. Seluruh pektin hasil ekstraksi memberikan warna putih kecuali pada kondisi ekstraksi dari bahan kering dengan konsentrasi HCl 0,025 N yang menghasilkan pemerian yang berwarna putih kekuningan.
Tabel 4.2. Pemerian Pektin Hasil Ekstraksi
No. Kondisi ekstraksi Pemerian
Berdasarkan Farmakope Indonesia Edisi V (2014), pemerian pektin berupa serbuk kasar atau halus, berwarna putih kekuningan, hampir tidak berbau, dan mempunyai rasa musilago. Menurut Food Chemicals Codex
(2004) pemerian pektin berupa serbuk kasar hingga halus, berwarna putih, kekuningan, kelabu, atau kecokelatan. Pektin hasil ekstraksi pada penelitian ini memberikan pemerian yang sesuai dengan literatur yang telah disebutkan di atas.
Tabel 4.3. Identifikasi Pektin Hasil Ekstraksi
No. Kondisi tidak berwarna, menjadi putih dan
bergumpal bila didihkan
Terbentuk gel Terbentuk endapan seperti gelatin, tidak berwarna, menjadi putih dan
3 Bahan segar; HCl 0,075 N
Terbentuk endapan bening,
seperti gelatin
Terbentuk gel Terbentuk endapan seperti gelatin, tidak berwarna, menjadi putih dan
bergumpal bila didihkan tidak berwarna, menjadi putih dan
bergumpal bila didihkan tidak berwarna, menjadi putih dan
bergumpal bila didihkan
Terbentuk gel Terbentuk endapan seperti gelatin, tidak berwarna, menjadi putih dan
bergumpal bila didihkan
Identifikasi pektin dilakukan untuk memastikan secara kualitatif bahwa serbuk yang diperoleh dari hasil ekstraksi adalah benar pektin. Identifikasi pektin dilakukan sesuai dengan prosedur yang tertera dalam Farmakope Indonesia Edisi V tahun 2014 dengan sedikit modifikasi.