PERBANDINGAN DAYA ADSORPSI PEKTIN DARI LIMBAH
KULIT PISANG KEPOK KUNING (
MUSA BALBISIANA
BBB),
PEKTIN KOMERSIL DAN AEROSIL TERHADAP MINYAK
ATSIRI HERBA KEMANGI (
OCIMUM AMERICANUM
L.)
SKRIPSI
GALIH AUDHA RAHMAN
1112102000003
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
PERBANDINGAN DAYA ADSORPSI PEKTIN DARI
LIMBAH KULIT PISANG KEPOK KUNING (
MUSA
BALBISIANA
BBB), PEKTIN KOMERSIL DAN
AEROSIL TERHADAP MINYAK ATSIRI HERBA
KEMANGI (
OCIMUM AMERICANUM
L.)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh Sarjana Farmasi
GALIH AUDHA RAHMAN
1112102000003
PROGRAM STUDI FARMASI
iii
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar
Nama : Galih Audha Rahman NIM : 1112102000003 Tanda Tangan :
Program studi : Farmasi
Judul Penelitian : Perbandingan Daya Adsorpsi Pektin dari Limbah Kulit Pisang Kepok Kuning (Musa balbisiana BBB), Pektin Komersil dan Aerosil terhadap Minyak Atsiri Herba Kemangi (Ocimum americanum L.)
Pisang merupakan tanaman yang berbuah sepanjang tahun tanpa mengenal musim dan produksi buahnya di Indonesia menduduki peringkat pertama hasil pertanian hortikultura yaitu mencapai 6.279.290 ton pada tahun 2013. Kulit pisang mengandung senyawa pektin yang cukup besar. Penelitian ini bertujuan untuk mengetahui kemampuan adsorpsi pektin yang diekstraksi dari limbah kulit pisang kepok kuning (Musa balbisiana BBB) terhadap minyak atsiri herba kemangi (Ocimum americanum L.) dan dibandingkan dengan pektin komersil dan aerosil. Ekstraksi pektin dari simplisia kulit pisang dilakukan dengan menggunakan pelarut HCl 0,075 N pada suhu 90oC selama 80 menit. Setelah proses ekstraksi, dilakukan karakterisasi pektin. Karakterisasi pektin yang dilakukan meliputi pemerian pektin, uji kualitatif, rendemen, kadar air, berat ekivalen, kadar metoksil, dan distribusi ukuran partikel. kemudian dilakukan uji daya adsorpsi kemangi yang diawali dengan pencampuran adsorben dengan minyak atsiri kemudian disimpan dalam desikator pada suhu 25-27oC dengan Rh 70-72 selama 34 hari. Pengujian dilakukan dengan metode pengukuran area under curve (AUC) menggunakan GC-MS dan uji gravimetri. Hasil karakterisasi kualitatif dan pemerian pektin sudah sesuai dengan standar, rendemen pektin 13,81%, kadar air 8,30%, kadar metoksil rendah yaitu 6,81%, dan distribusi ukuran partikel rata-rata serbuk pektin, pektin komersil dan aerosil secara berturut-turut yaitu 26,43 µm, 27,49 µm, dan 12,61 µm. Hasil uji daya adsorpsi dengan metode pengukuran AUC dari pektin hasil ekstraksi, pektin komersil, dan aerosil setelah penyimpanan selama 34 hari berturut-turut mengalami kehilangan minyak atsiri sebanyak 45,42%, 76,90%, 27,97%. Hasil berdasarkan uji gravimetri dari pektin hasil ekstraksi, pektin komersil, dan aerosil setelah 31 hari berturut-turut mengalami kehilangan minyak atsiri sebanyak 37,25%, 45,08% dan 10,02%. Kesimpulannya daya adsorpsi aerosil lebih baik dibandingkan dengan pektin, namun daya adsorpsi pektin hasil ekstraksi lebih baik dibandingkan pektin komersil.
vii Program study : Pharmacy
Title of research : Comparison of Adsorption Ability Pectin from Waste of Pisang Kepok Kuning (Musa balbisiana BBB), Pectin Commercial and Aerosil Against Essential Oil from Herba Kemangi (Ocimum americanum L.)
Banana is a plant whose fruit throughout the year regardless of the season and his production in Indonesia was ranked first horticultural crops which reached 6.27929 million tons in 2013. The banana peel contains pectin compounds are quite large. This study aims to determine the ability of adsorption of pectin extracted from waste peel of Pisang kepok (Musa balbisiana BBB) against herbal essential oil of Kemangi (Ocimum americanum L.) and compared with commercial pectin and aerosil. The extraction of pectin from banana peels simplisia done using 0.075 N HCl solvent at a temperature of 90 ° C for 80 minutes. After extraction, characterization pectin. Characterization of pectin made include pemerian pectin, qualitative test, yield, moisture content, equivalent weight, methoxyl content, and particle size distribution, then tested the adsorption capacity of essential oil begins with mixing the adsorbent with the essential oil, then stored in a desiccator at a temperature of 25-27oC with Rh 70-72 for 34 days. Tests conducted by the method of measurement area under curve (AUC) using GC-MS and gravimetric test. The results of the qualitative characterization and pemerian pectin is in conformity with the standards, pectin yield of 13.81%, 8.30% water content, low methoxyl content is 6.81%, and the particle size distribution of the average powder pectin, commercial pectin and aerosil respectively -turut is 26.43 μm, 27.49 μm and 12.61 μm. The test results adsorption capacity with AUC measurement method of extraction pectin, commercial pectin, and aerosil after storage for 34 consecutive days experienced a loss of essential oils as much as 45.42%, 76.90%, 27.97%. Results based on test gravimetric extraction of pectin, commercial pectin, and aerosil after 31 consecutive days experienced a loss of essential oils as much as 37.25%, 45.08% and 10.02%. In conclusion aerosil better adsorption capacity than the pectin, but the adsorption capacity of the extracted pectin better than commercial pectin.
Puji syukur senantiasa penulis panjatkan atas kehadirat Tuhan Yang Maha Esa, Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya, sehingga saya dapat menyelesaikan penulisan skripsi ini. Penulisan skripsi ini dilakukan dalam rangka menyelesaikan tugas akhir sebagai salah satu syarat memperoleh gelar Sarjana Farmasi di Fakultas Kedokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah Jakarta.
Saya menyadari sangat banyak bantuan, dukungan, dan bimbingan dari berbagai pihak yang selalu diberikan kepada penulis sejak masa perkuliahan hingga masa pengerjaan dan penulisan skripsi ini. Pada kesempatan ini, penulis ingin menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Ibu Eka Putri, M.Si., Apt, selaku pembimbing pertama serta Ibu Yuni Anggraeni M.Farm., Apt. selaku pembimbing kedua yang telah membantu, membimbing dan memberikan ilmu kepada saya, serta meluangkan waktu, tenaga dan pikiran dari awal penelitian sampai pada penyusunan skripsi ini selesai.
2. Bapak Dr. H. Arief Sumantri, SKM., M.Kes, selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah Jakarta
3. Ibu Nurmeilis M.Si., Apt. selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam (UIN) Syarif Hidayatullah Jakarta
4. Seluruh dosen yang telah memberikan ilmu dan pengetahuan sehingga penulis dapat menyelesaikan studi di Jurusan Farmasi Fakultas Keokteran dan Ilmu Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah Jakarta. 5. Seluruh laboran Laboratorium Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan Universitas Negeri (UIN) Syarif Hidayatullah Jakarta yang telah membantu dalam hal penggunaan alat dan bahan selama penelitian.
ix
7. Teman seperjuangan “Pektin Mania” Agung dan Dwi yang telah banyak membantu penulis saat memproduksi pektin.
8. Teman-teman “Kontrakan Ceria” Adia, Benny, Boy, Brendi, Fadil, Ghilman, Gunawan, Irham, Ivan, Okin, Santo, Thantowi, dan Agung yang senantiasa menghibur serta memberikan masukan, dan semangat bagi penulis dalam menyelesaikan skripsi ini.
9. Teman-teman Farmasi angkatan 2012 yang telah berjuang bersama-sama selama perkuliahan hingga menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini masih belum sempurna. Oleh karena itu, kritik dan saran yang membangun sangat penulis harapkan. Penulis berharap semoga hasil dari penelitian ini dapat bermanfaat baik bagi kalangan akademis dan dunia ilmu pengetahuan, khususnya bagi mahasiswa farmasi serta bagi masyarakat pada umumnya
Akhir kata, penulis berharap semoga Allah SWT mencatat dan memberikan balasan yang berlipat ganda atas segala kebaikan semua pihak yang telah membantu dalam nmenyelesaikan skripsi ini.
Ciputat, Juli 2016
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini :
Nama : Galih Audha Rahman NIM : 1112102000003 Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
PERBANDINGAN DAYA ADSORPSI PEKTIN DARI LIMBAH KULIT PISANG KEPOK KUNING (Musa balbisiana BBB), PEKTIN KOMERSIL
DAN AEROSIL TERHADAP MINYAK ATSIRI HERBA KEMANGI (Ocimum americanum L.)
untuk dipublikasi atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya
Dibuat di : Ciputat Pada Tanggal : 29 Juli 2016
Yang menyatakan,
xi
halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
3.3.2 Karakterisasi Pektin Hasil Ekstraksi ... 22
3.3.3 Minyak Atsiri Kemangi ... 24
3.3.4 Uji Daya Adsorpsi Minyak Atsiri Kemangi ... 25
BAB 4 HASIL DAN PEMBAHASAN ... 28
4.1 Produksi Pektin ... 28
4.2 Karakterisasi Pektin Hasil Ekstraksi ... 29
4.2.1 Pemerian Pektin ... 29
4.2.2 Identifikasi Kualitatif Pektin ... 30
4.2.3 Sifat Fisikokimia Pektin Hasil Ekstraksi ... 31
4.3 Parameter Minyak Atsiri Kemangi ... 34
4.3.1 Organoleptik ... 34
4.3.2 Analisis Komponen Kimia dalam Minyak Atsiri Kemangi .... 35
4.4 Uji Daya Adsorpsi ... 37
4.4.1 Pengujian dengan Instrumen GC-MS ... 37
4.4.2 Pengujian dengan Metode Gravimetri ... 38
BAB 5 PENUTUP ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
xiii
Halaman
Tabel 2.1 Komposisi Pektin pada Beberapa Sayuran dan Buah-buahan ... 10
Tabel 4.1 Identifikasi Pektin Hasil Isolasi ... 30
Tabel 4.2 Sifat Fisikokimia Pektin Hasil Ekstraksi ... 31
Tabel 4.3 Organoleptik Minyak Atsiri Kemangi ... 34
Tabel 4.4 Hasil Analisis GCMS Komponen Kimia Minyak Atsiri ... 36
Tabel 4.5 Hasil AUC dari GC-MS dan % penurunan AUC ... 37
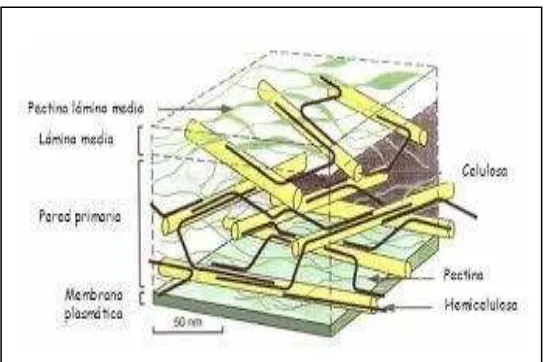
Gambar 2.1 Struktur Dinding Sel Tanaman yang Mengandung Pektin ... 6
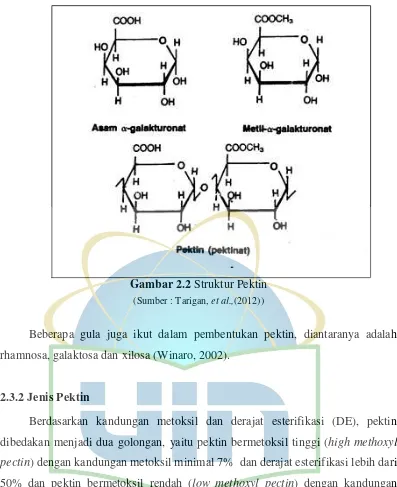
Gambar 2.2 Struktur Pektin ... 8
Gambar 2.3 Molekul Pektin Bermetoksil Tinggi ... 9
Gambar 2.4 Molekul Pektin Bermetoksil Rendah ... 9
Gambar 2.5 Proses Adsorp dan Desorp ... 18
Gambar 4.1 Pemerian Pektin Hasil Isolasi ... 29
Gambar 4.2 Diagram Distribusi Ukuran Partikel Serbuk Adsorben ... 33
Gambar 4.3 Minyak Atsiri Kemangi ... 34
Gambar 4.4 Hasil Kromatogram Minyak Atsiri Kemangi ... 35
xv
Lampiran 1. Alur Ekstraksi Pektin ... 46
Lampiran 2. Pengendapan Pektin ... 46
Lampiran 3. Pencucian dan Pengendapan Pektin ... 47
Lampiran 4. Cara perhitungan Rendemen ... 47
Lampiran 5. Cara perhitungan Kadar air pektin ... 47
Lampiran 6. Pembuatan Larutan NaOH 0,1 N sebanyak 1 L ... 48
Lampiran 7. Pembuatan Larutan NaOH 0,25 N sebanyak 100 mL ... 48
Lampiran 8. Pembuatan HCL 0,25 N sebanyak 100 mL ... 58
Lampiran 9. Cara perhitungan Berat Ekivalen ... 48
Lampiran 10. Cara perhitungan Kadar Metoksil ... 49
Lampiran 11. Distribusi Ukuran Partikel Serbuk Adsorben ... 49
Lampiran 12. Contoh Cara Perhitungan Penurunan Kadar AUC ... 50
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Adsorpsi merupakan proses penyerapan oleh suatu padatan tertentu terhadap zat tertentu yang terjadi pada permukaan padatan tersebut karena adanya gaya tarik atom atau molekul pada permukaan zat padat tanpa meresap ke dalamnya. Bila suatu gas atau uap bersentuhan dengan permukaan padatan, maka gas atau uap tadi akan teradsorpsi pada permukaan padatan tersebut. Permukaan padatan disebut sebagai adsorben, sedangkan gas atau uap disebut sebagai adsorbat. (Bird,T., 1993). Adsorben bisa digunakan untuk memisahkan atau menyerap molekul yang akan digunakan dalam proses formulasi sediaan farmasi.
Salah satu contoh pemanfaatan adsorben saat formulasi sediaan farmasi yaitu seperti penelitian yang dilakukan oleh Alfrida (2013) yang membuat tablethisap minyak atsiri kemangi (Ocimum americanum L.), peneliti menggunakan aerosil sebagai adsorben untuk mengadsorpsi minyak atsiri agar minyak atsiri yang berbentuk cair dapat berubah menjadi serbuk minyak atsiri dan dalam penelitian tersebut peneliti menggunakan metode cetak langsung untuk menghindari proses pemanasan yang terjadi pada metode granulasi basah maupun granulasi kering saat proses pembuatan tablet.
Buku Handbook of Pharmaceutical Excipients, 5th edition menjelaskan contoh-contoh adsorben yang dapat dimanfaatkan dalam pembuatan sediaan farmasi. Berikut ini merupakan beberapa contoh adsorben yang disebutkan dalam
Handbook of pharmaceutical Excipients, 5th edition antara lain aluminum oxide, aerosil, bentonite, pektin, cellulose, magnesium aluminum silicate. Adsorben yang aman untuk pembuatan sediaan oral hanya pektin dan aerosil.
UIN Syarif Hidayatullah Jakarta
cairan dalam serbuk, karena aerosil memiliki kemampuan adsorpsi yang besar yang dapat mengurangi kadar air hingga 40% sehingga sering dimanfaatkan untuk bahan cair atau kental dalam formulasi sediaan tablet, maupun tablet kunyah.
Pektin merupakan suatu komponen serat yang terdapat pada lapisan lamella tengah dan dinding sel primer pada tanaman (Bacon, 1978). Indonesia memiliki potensi yang cukup besar dalam proses produksi pektin. Hal ini bisa terjadi karena Indonesia memiliki banyak tumbuh-tumbuhan yang bisa menjadi sumber pektin. Pektin komersial biasanya diperoleh dari kulit buah jeruk atau apel, namun dengan berkembangnya penelitian-penelitian, pektin juga dapat diperoleh dari limbah jeruk pontianak (Citrus nobilis var microcarpa) (Hariyati, 2006), ampas nanas (Ananas comosus Merr) (Dwi, et al., 2008), kulit pisang raja (Musa
Minyak atsiri merupakan salah satu jenis minyak nabati yang multimanfaat. Bahan baku minyak ini diperoleh dari berbagai bagian tanaman seperti daun, bunga, buah, biji, kulit biji, batang, akar atau rimpang. Salah satu ciri utama minyak atsiri yaitu mudah menguap dan beraroma khas (Rusli, M.S., 2010). Karena minyak atsiri bersifat mudah menguap maka sulit untuk diformulasikan untuk pembuatan sediaan tablet. Minyak atsiri harus dibuat dalam bentuk serbuk sebelum diformulasikan menjadi sediaan tablet. Salah satu cara untuk mendapatkan serbuk minyak atsiri adalah dengan penambahan adsorben. Pemilihan adsorben yang baik sangat penting untuk mendapatkan serbuk minyak atsiri.
6.279.290 ton pada tahun 2013 (Badan Pusat Statistik, 2014) dan pektin komersil yang berasal dari kulit apel. Dalam penelitian ini akan membandingkan kemampuan adsorpsi pektin yang diisolasi dari kulit pisang kepok kuning (Musa balbisiana BBB), pektin komersil dan aerosil.
1.2 Rumusan Masalah
Bagaimana kemampuan pektin yang diisolasi dari limbah kulit pisang kepok kuning (Musa balbisiana BBB) sebagai adsorben minyak atsiri kemangi dibandingkan dengan pektin komersial dan aerosil?
1.3 Tujuan Penelitian
Menguji kemampuan adsorpsi pektin yang diisolasi dari limbah kulit pisang kepok kuning (Musa balbisiana BBB) dan dibandingkan dengan kemampuan adsorpsi aerosil dan pektin komersial terhadap minyak atsiri kemangi.
1.4 Manfaat Penelitian
UIN Syarif Hidayatullah Jakarta
BAB 2
TINJAUAN PUSTAKA
2.1 Pisang Kepok (Musa balbisiana)
Berdasarkan Herbarium Bandungense Sekolah Ilmu dan Teknologi Hayati Institut Teknologi Bandung (2015), klasifikasi dari pisang kepok (Musa balbisiana) sebagai berikut :
Kingdom : Plantae
Divisi : Magnoliophyta Kelas : Liliopsida Ordo : Zingiberales Famili : Musaceae Genus : Musa
Spesies : Musa balbisiana
Berikut ini merupakan klasifikasi dari pisang kepok berdasarkan Herbarium Bogoriense (2014) :
Jenis : Musa balbisiana BBB Famili : Musaceae
Di Indonesia, pisang kepok memiliki banyak jenis, namun yang terkenal adalah pisang kepok kuning dengan daging buah berwarna kuning dan pisang kepok putih dengan daging buah berarna putih. Pisang kepok memiliki daging buah yang bertekstur agak keras dengan buahnya yang tidak beraroma harum, kulit buahnya sangat tebal, dan pada buah yang sudah masak berwarna hijau kekuningan. Dalam satu tandan bisa terdapat hingga 16 sisir dan pada setiap sisirnya terdapat hingga 20 pisang, berat setiap tandannya sekitar 14-22 Kg (Cahyono, 2009).
2.2 Kandungan Kulit Pisang
Kulit pisang merupakan sumber kaya pati (3%), protein kasar (6-9%), lemak kasar (3,8-11%), serat makanan total (43,2-49,7%) dan asam lemak tak jenuh, terutama asam linoleat dan α-linoleat, asam amino essensial (leusin, valin, fenilalanin, dan treonin), dan mikronutrien (K,P,Ca,Mg, Fe dan Zn), selain itu juga merupakan sumber yang baik dari lignin (6-12%), pektin (10-21%) pektin dari kulit pisang ini mengandung glukosa, galaktosa, arabinosa, rhamnosa dan xilosa, selulosa (7,6-9,6%), dan hemiselulosa (6,4-9,4%) (Mohapatra, et. al.,2010).
Menurut hasil penelitian dari Balai Penelitian dan Pengembangan Industri, tanaman pisang mengandung berbagai macam senyawa seperti air, gula pereduksi, sukrosa, pati, protein kasar, pektin, protopektin, lemak kasar, serat kasar, dan abu. Sedangkan di dalam kulit pisang mengandung senyawa pektin yang cukup besar, dapat diekstraksi dengan cara sederhana, biaya yang tidak mahal, dan dapat diterapkan dalam skala kecil (Satria dan Ahda, 2009).
2.3 Pektin
2.3.1 Pengertian Pektin, Sumber dan Struktur Pektin
Senyawa kimia pektin pertama kali ditemukan oleh Vauguelin pada tahun 1790. Bracconot pertama kali memberikan istilah pektin, yang berasal dari bahasa Yunani Pektas yang berarti mengental atau menjadi padat.
UIN Syarif Hidayatullah Jakarta
Gambar 2.1 Struktur Dinding Sel Tanaman yang Mengandung Pektin (Sumber : International Pectin Producers Association (IPPA) (2002))
Pektin komersial biasanya diperoleh dari kulit buah jeruk atau apel, namun dengan berkembangnya penelitian-penelitian, pektin juga dapat diperoleh dari pengolahan kulit pisang kepok, kulit pisang raja, buah naga, kulit coklat, limbah pengolahan jeruk, cincau hijau, ampas nanas serta kulit durian (Vita, 2013). Baker (1997) juga menyebutkan pektin dapat diperoleh dari lemon, aprikot, beri-berian, anggur, labu-labuan dan semangka. Sebagian besar pektin diproduksi dengan cara mengekstraksi bahan dengan larutan asam mineral panas (May,1990) dan dapat pula menggunakan asam organik (Kertesz,1951).
Berikut ini yang tergolong senyawa pektin adalah asam pektat, asam pektinat dan protopektin (Winario,1998 dan Klavons,1995 dalam Tarigan, et al.,
2012).
1. Asam Pektat
Asam pektat adalah senyawa asam galakturonat yang bersifat koloid dan pada dasarnya bebas dari kandungan metil ester.
2. Asam Pektinat
3. Protopektin
Protopektin adalah substansi pektat yang tidak larut air, terdapat dalam tanaman, jika dipisahkan secara hidrolisis akan menghasilkan asam pektinat. Komposisi kandungan protopektin, pektin dan asam pektat di dalam buah sangat bervariasi tergantung pada derajat kematangan buah, pada umumnya protopektin lebih banyak terdapat pada buah-buahan yang belum matang (Winarno dan Aman, 2002; Qadrina, 2015). Pada buah-buahan yang masih muda, sel-sel yang satu dengan sel yang lainnya masih dipersatukan dengan kuat oleh protopektin, tetapi jika buah semakin tua, maka sebagian dari protopektin mengalami penguraian menjadi pektin karena adanya enzim protopektinase sehingga mengakibatkan terlepasnya sel-sel satu dengan yang lainnya, sehingga buah menjadi lebih lunak. Selanjutnya enzim pektinase meneruskan pengubahan pektin menjadi asam pektat, sehingga menyebabkan buah menjadi matang (Dwidjoseputro, 1983).
Rowe, et al., (2006) menjelaskan bahwa pektin merupakan molekul dengan bobot molekul yang tinggi yaitu sekitar 30.000-100.000, pektin merupakan konstituen dalam tanaman yang menyerupai karbohidrat, terutama terdiri dari unit rantai asam galakturonat yang terikat dengan ikatan 1,4-α-glukosida. Pektin termasuk polisakarida yang terdapat di antara dinding sel sekunder pada tanaman termasuk xilem dan serat sel yang merupakan konstituen penting dalam pertumbuhan awal dan pada proses pematangan buah, dimana komponen utama pektin yaitu terdiri dari unit asam D-galakturonat yang terikat dengan ikatan glikosidik α(1-4) (Bansal, et al., 2014).
UIN Syarif Hidayatullah Jakarta
Gambar 2.2 Struktur Pektin (Sumber : Tarigan, et al.,(2012))
Beberapa gula juga ikut dalam pembentukan pektin, diantaranya adalah rhamnosa, galaktosa dan xilosa (Winaro, 2002).
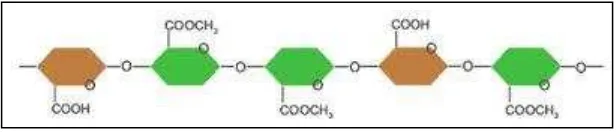
2.3.2 Jenis Pektin
Berdasarkan kandungan metoksil dan derajat esterifikasi (DE), pektin dibedakan menjadi dua golongan, yaitu pektin bermetoksil tinggi (high methoxyl pectin) dengan kandungan metoksil minimal 7% dan derajat esterifikasi lebih dari 50% dan pektin bermetoksil rendah (low methoxyl pectin) dengan kandungan metoksil maksimal 7 dan derajat esterifikasi berkisar kurang dari 50% (Guichard,
et al., 1991; Hui, 2006; Qadrina, 2015).
Gambar 2.3 Molekul Pektin Bermetoksil Tinggi
(Gambar direkayasa ulang dari sumber : International Pectin Producers Association (IPPA) (2002))
Gambar 2.4 Molekul Pektin Bermetoksil Rendah
(Gambar direkayasa ulang dari sumber: International Pectin Producers Association (IPPA) (2002) yang telah dimodifikasi)
Pektin yang diekstraksi biasanya memiliki lebih dari 50% unit asam yang teresterifikasi sehingga disebut pektin bermetoksil tinggi. Sedangkan modifikasi proses ekstraksi atau dengan perlakuan lebih lanjut akan menghasilkan pektin bermetoksil rendah yaitu kurang dari 50% grup metil ester (IPPA, 2002).
2.3.3 Sifat Pektin
Berdasarkan Farmakope Indonesia Edisi V (2014) pektin berupa serbuk kasar atau halus, berwarna putih kekuningan, hampir tidak berbau dan mempunyai rasa musilago. Pektin hampir larut sempurna dalam 20 bagian air, membentuk cairan kental, opalesen, larutan koloidal mudah dituang dan bersifat asam terhadap lakmus, praktis tidak larut dalam etanol atau pelarut organik lain. Pektin larut lebih cepat bila permukaan dibasahi dengan etanol, dengan gliserin, atau dengan sirup simplek atau jika permukaan dicampur dengan 3 bagian atau lebih sukrosa.
UIN Syarif Hidayatullah Jakarta
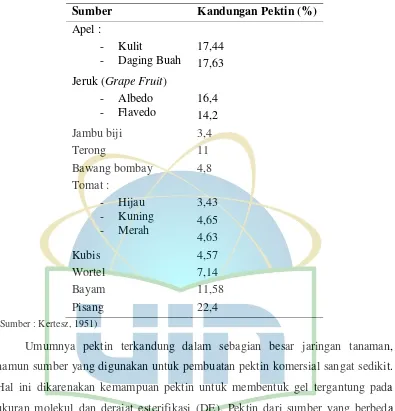
Kandungan pektin dari beberapa sayuran dan buah-buahan dapat dilihat pada tabel berikut ini :
Tabel 2.1 Komposisi Pektin pada Beberapa Sayuran dan Buah-buahan
Sumber Kandungan Pektin (%)
Apel :
Umumnya pektin terkandung dalam sebagian besar jaringan tanaman, namun sumber yang digunakan untuk pembuatan pektin komersial sangat sedikit. Hal ini dikarenakan kemampuan pektin untuk membentuk gel tergantung pada ukuran molekul dan derajat esterifikasi (DE). Pektin dari sumber yang berbeda tidak memiliki kemampuan membentuk gel yang sama karena adanya variasi pada parameter ini (Sriamornsak, 2003).
2.3.4 Kegunaan Pektin
Pektin adalah produk alami yang dapat ditemukan dalam dinding sel dari tanaman tingkat tinggi. Umumnya digunakan sebagai agen pembentuk gel, penebal dan penstabil. Saat ini pektin merupakan komponen yang tidak terpisahkan dari berbagai macam produk baik dalam industri makanan maupun dalam industri non pangan seperti dalam kosmetik dan farmasi. Beberapa tahun terakhir manfaat pektin semakin penting dan dibutuhkan oleh konsumen (IPPA, 2002).
Dalam industri karet, pektin bisa digunakan sebagai bahan pengental lateks. Pektin juga dapat memperbaiki warna, konsistensi, kekentalan dan stabilitas produk karet yang dihasilkan (Towle & Christensen, 1973). Pektin berkadar metoksil tinggi digunakan untuk pembuatan selai dan jeli dari buah-buahan, serta digunakan dalam pembuatan saus salad, puding, gel buah-buahan dalam es krim, selai dan jeli. Pektin bermetoksil rendah efektif digunakan dalam pembentukan gel saus buah-buahan karena stabilitasnya yang tinggi pada proses pembekuan,
thawing, dan pemanasan, serta digunakan sebagai penyalut dalam banyak produk pangan (Glicksman, 1969).
Di bidang farmasi pektin dikenal sebagai bahan yang bersifat potensiator dan memperpanjang pengaruh antibiotik, hormon-hormon dan obat-obatan sulfat dan analgesik-analgesik. Pektin juga digunakan sebagai emulsifier bagi preparat cair dan sirup, obat diare pada anak-anak, obat penawar racun logam, bahan penurun daya racun dan meningkatkan daya larut obat sulfa, memperpanjang kerja hormon dan antibiotika, bahan pelapis perban (pembalut luka) guna menyerap kotoran dan jaringan yang rusak serta bahan kosmetik, oral atau injeksi untuk mencegah pendarahan (Yohenta, 2008).
2.3.5 Produksi Pektin
a. Ekstraksi Pektin
UIN Syarif Hidayatullah Jakarta
menghidrolisis protopektin menjadi pektin. Ekstraksi ini dapat dilakukan dengan asam mineral seperti asam klorida atau asam sulfat. Semakin tinggi suhu ekstraksi maka semakin singkat waktu yang dibutuhkan untuk mendapatkan hasil yang maksimum. Selain suhu faktor keasaman juga merupakan hal yang sangat penting. pH yang direkomendasikan dalam proses ekstraksi adalah sekitar 1,5 - 3,0 namun pH yang sering digunakan yaitu sekitar 2,6 - 2,8 (Krik dan Othmer, 1958).
Ekstraksi dengan asam mineral menghasilkan rendemen yang lebih tinggi dibandingkan dengan asam organik. Asam mineral pada pH rendah lebih baik daripada pH tinggi untuk menghasilkan pektin (Rouse dan Crandal, 1978). Suhu ekstraksi yang tinggi dapat meningkatkan rendemen pektin, karena pada suhu tinggi terjadi peningkatan difusi pelarut pada jaringan tanaman dan dapat meningkatkan aktivitas pelarut dalam menghidrolisis pektin yang umumnya terdapat di dalam sel primer tanaman, khususnya pada lamella tengah (Towle dan Christensen, 1973). Namun bila suhu ekstraksi terlalu tinggi akan menghasilkan pektin yang tidak jernih sehingga gel yang diperoleh akan keruh dan kekuatan gel berkurang (Kertesz, 1951).
Pektin dalam jaringan tumbuhan banyak dalam bentuk protopektin yang tidak larut dalam air, dengan adanya asam, kondisi larutan pH rendah akan menghidrolisis protopektin menjadi pektin yang lebih mudah larut dalm air.
May (2000) menjelaskan bahwa umumnya pektin diproduksi dengan mengekstrak bahan baku dengan larutan asam mineral panas. Setiap produsen pektin telah mengembangkan kondisi yang sesuai dengan jenis bahan baku yang diolah oleh pabrik mereka, namun tujuannya yaitu untuk menghasilkan bubur yang mengandung residu padat yang dapat dengan mudah dipisahkan, dan fase cairnya (filtrat) yang mengandung pektin dengan konsentrasi tinggi tidak memiliki viskositas yang terlalu tinggi. Menghilangkan kotoran pada ekstrak cair harus dilakukan sebelum dilanjutkan untuk mengisolasi pektin padat.
b. Pengendapan Pektin
Proses pengendapan pektin bisa dilakukan dengan beberapa cara yaitu: 1. Penambahan alkohol
Penambahan alkohol yang bersifat sebagai penghidroksi dengan bobot molekul rendah akan bercampur sempurna dengan air melalui ikatan hidrogen dan akan mengurangi jumlah ion atau molekul air yang mengelilingi pektin, sehingga keseimbangan antara pektin dan air akan terganggu dan pektin akan mengendap.
2. Pengendapan dengan aseton
Pengendapan dengan aseton lebih disukai karena dapat membentuk endapan yang mudah dipisahkan dari asetonnya, sedangkan bila pengendapan dengan etanol akan menghasilkan pektin yang kurang murni karena tidak hanya menghasilkan pektin namun juga senyawa lain seperti dekstrin dan hemiselulosa (Akhmalludin dan Kurniawan, 2009).
c. Pencucian Pektin
Susilowati, et al., (2013) melakukan pencucian pektin dengan menggunakan alkohol hingga pH filtrat netral dan menghasilkan pektin dengan warna yang lebih bersih dan putih.
d. Pengeringan Pektin
UIN Syarif Hidayatullah Jakarta
2.4 Tanaman Kemangi
2.4.1 Klasifikasi Ilmiah Tanaman Kemangi (US Departement of Agriculture)
Tanaman kemangi secara taksonomi mempunyai klasifikasi ilmiah sebagai berikut :
Kingdom : Plantae
Subkingdom : Tracheobionta Superdivisi : Spermatophyta Divisa : Magnoliophyta Kelas : Magnoliopsida Subkelas : Asteridae
Ordo : Lamiales
Famili : Lamiaceae Genus : Ocimum L.
Spesies : Ocimum canum Sims.
2.4.2 Nama Lain Tanaman Kemangi (Siemonsma dan Piluek, 1994)
1. Sinonim : Ocinum africanum Lour, Ocinumamericanum L, Ocinum brachiatum Blume.
2. Nama Asing : selaseh, kemangi, ruku-ruku (Malaysia); american basil, hoary basil, lemon basil, wildbasil (Inggris); suraung (Sunda), selasih putih, kemangi (Indonesia); maengklak (Thailand); rau h[us]ng (Vietnam).
2.4.3 Morfologi Tanaman Kemangi
Kemangi merupakan tanaman tegak, bercabang banyak, tanaman semusim, herbal aromatik yang tingginya dapat mencapai 0,3-1 m. Batang dan cabangnya berbentuk segi empat, berwarna hijau kekuningan dan terdapat bulu pada batang terutama pada batang muda (Siemonsma dan Pileuk, 1994).
berbentuk bulat panjang dengan ukuran panjang daun mencapai 5 cm dan lebar mencapai 2,5 cm (Hadipoentyanti dan Wahyuni, 2008).
Bunga kemangi merupakan bunga majemuk yang panjangnya dapat mencapai 15 cm, tersusun berhadapan silang dengan 6 bunga membentuk lingkaran (karangan semu) yang masing-masing terpisah dengan jarak mencapai 3 cm, berbentuk sederhana bercabang. Ibu tangkai bunga dan porosnya berbentuk segi empat. Panjang daun pelindung pada bunga adalah 2 - 3 mm, sangat bengkok pada bagian atas. Kelopak bunga berbelah dua dengan panjang 2 - 2,5 cm dan berbulu putih pada bagian luarnya serta berwarna putih. Mahkota bunga berbentuk tabung berbibir dua dengan ukuran 4 mm dan berwarna putih. Terdapat 4 benang sari yang berbentuk ramping dengan 2 benang sari lebih panjang. Putik dengan 4 bakal biji dan 4 bakal buah serta 2 kepala putik (Siemonsma dan Piluek, 1994).
2.4.4 Kandungan Kimia Tanaman Kemangi
Kandungan kimia pada Ocinum americanum L. antara lain : minyak atsiri, karbohidrat, fitosterol, alkaloid, senyawa fenolik, tanin, lignin, pati, saponin, flavonoid, terpenoid dan antrakuinon (Dhale et al., 2010; Sarma dan Babu, 2011). Sedangkan kandungan utama minyak atsiri pada Ocinum americanum L. adalah
champor, limonene, methyl cinnamate dan linalool (Hadipoeyanti dan wahyuni, 2008).
2.4.5 Isolasi Minyak Atsiri Kemangi
UIN Syarif Hidayatullah Jakarta
mendidih, namun dilewati uap air sehingga senyawa kandungan menguap ikut terdestilasi (Depkes RI. 2000).
Penyulingan dengan uap air dibuat dengan cara bahan diletakkan di atas rak atau saringan berlubang, ketel suling diisi air sampai permukaan air berada tidak jauh di bawah saringan, air dipanaskan dengan berbagai cara yaitu dengan uap jenuh basah dan bertekanan rendah. Ciri khas metode ini adalah uap selalu dalam keadaan basah, jenuh dan tidak terlalu panas. Bahan tanaman hanya berhubungan dengan uap, tidak dengan air panas (Guenther, 1987).
Cara destilasi dengan air dan uap ini baik untuk simplisia basah atau kering yang rusak pada pendidihan. Untuk simplisia kering harus dimaserasi lebih dahulu, sedangkan untuk simplisia segar yang baru dipetik tidak perlu dimaserasi. Cara destilasi ini sudah banyak dilakukan sebagai industri rumah, karena peralatan mudah didapat dan hasil yang diperoleh cukup baik (Depkes RI. 1985).
2.4.6 Manfaat Minyak Atsiri Kemangi
Kegunaan minyak atsiri bagi tanamannya sendiri berguna untuk menarik serangga yang membantu proses penyerbukan, sebagai cadangan makanan, untuk mencegah kerusakan tanaman oleh serangga atau hewan lain dan mempengaruhi proses transpirasi. Dalam industri minyak atsiri sering digunakan untuk zat tambahan dalam sediaan kosmetik, obat, makanan, rokok dan sebagainya. Selain itu minyak atsiri dari daun kemangi banyak digunakan sebagai obat anti kuman dan kapang (Dzulkarnain dkk., 1996).
2.5 Adsorpsi
Adapun syarat – syarat adsorben yang baik antara lain: 1. Mempunyai daya serap yang tinggi
2. Berupa zat padat yang mempunyai luas permukaan yang besar 3. Tidak boleh larut dalam zat yang akan diadsorpsi
4.Tidak boleh mengadakan reaksi kimia dengan campuran yang akan dimurnikan 6. Tidak beracun
7. Tidak meninggalkan residu berupa gas yang berbau 8. Mudah didapat dan harganya murah
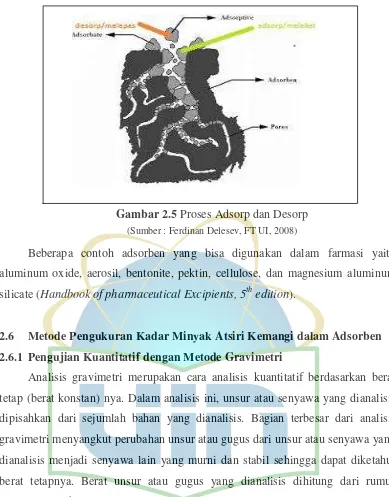
Proses adsorpsi dapat berlangsung jika suatu permukaan padatan dan molekul-molekul gas atau cair, dikontakkan dengan molekul-molekul tersebut, sehingga terjadi gaya kohesif termasuk gaya hidrostatik dan gaya ikatan hidrogen yang bekerja di antara molekul seluruh material. Gaya-gaya yang tidak seimbang pada batas fasa tersebut menyebabkan perubahan-perubahan konsentrasi molekul pada interface solid/fluida.
Menurut Metcalf and Eddy (1979), proses adsorpsi terjadi dalam tiga tahap mekanisme yaitu :
1. Pergerakan molekul-molekul adsorbat menuju permukaan adsorben. 2. Penyebaran molekul-molekul adsorbat ke dalam rongga-rongga
adsorben.
3. Penarikan molekul-molekul adsorbat oleh permukaan aktif membentuk ikatan, biasanya berlangsung secara cepat.
UIN Syarif Hidayatullah Jakarta
Gambar 2.5 Proses Adsorp dan Desorp (Sumber : Ferdinan Delesev, FT UI, 2008)
Beberapa contoh adsorben yang bisa digunakan dalam farmasi yaitu aluminum oxide, aerosil, bentonite, pektin, cellulose, dan magnesium aluminum silicate (Handbook of pharmaceutical Excipients, 5th edition).
2.6 Metode Pengukuran Kadar Minyak Atsiri Kemangi dalam Adsorben
2.6.1 Pengujian Kuantitatif dengan Metode Gravimetri
Analisis gravimetri merupakan cara analisis kuantitatif berdasarkan berat tetap (berat konstan) nya. Dalam analisis ini, unsur atau senyawa yang dianalisis dipisahkan dari sejumlah bahan yang dianalisis. Bagian terbesar dari analisis gravimetri menyangkut perubahan unsur atau gugus dari unsur atau senyawa yang dianalisis menjadi senyawa lain yang murni dan stabil sehingga dapat diketahui berat tetapnya. Berat unsur atau gugus yang dianalisis dihitung dari rumus senyawa serta berat atom penyusunnya.
Pemisahan unsur murni yang terdapat dalam senyawa berlangsung melalui beberapa tahap atau metode, antara lain :
1. Pengendapan 2. Penguapan
3. Pengendapan melalui listrik 4. Serta cara-cara fisis lainnya.
konsentrasi atau menghitung volumenya. Gravimetri merupakan penetapan kuantitas atau jumlah sampel melalui perhitungan berat zat. Sehingga dalam gravimetri produk halus selalu dalam bentuk padatan.
Analisis gravimetri adalah proses isolasi dan pengukuran berat suatu unsur atau senyawa tertentu. Bagian terbesar dari penentuan senyawa gravimetri meliputi transformasi unsur atau radikal senyawa murni stabil yang dapat segera diubah menjadi bentuk yang dapat ditimbang dengan teliti. Berat unsur dapat dihitung berdasarkan rumus senyawa dan berat atom unsur – unsur atau senyawa yang dikandung dilakukan dengan berbagai cara, seperti : metode pengendapan; metode penguapan; metode elektroanalisis; atau berbagai macam cara lainya. Pada prakteknya 2 metode pertama adalah yang terpenting, metode gravimetri memakan waktu yang cukup lama, adanya pengotor pada konstituen dapat diuji dan bila perlu faktor – faktor pengoreksi dapat digunakan (Khopkar,1999).
Persyaratan berikut haruslah dipenuhi agar metode gravimetri itu berhasil:
1. Proses pemisahan hendaknya cukup sempurna sehingga kualitas analit yang tak terendapkan secara analitis tak dapat dideteksi (biasanya 0,1 mg atau kurang dalam menetapkan penyusun utama dari suatu makro). 2. Zat yang ditimbang hendaknya mempunyai susunan yang pasti dan
hendaknya murni, atau hampir sangat murni. Bila tidak, akan diperoleh hasil yang galat (Underwood, A. L. 1989).
2.6.2 Uji Kuantitatif dengan Instrument GC-MS
UIN Syarif Hidayatullah Jakarta
BAB 3
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian dilaksanakan di laboratorium penelitian 1, laboratorium penelitian 2, laboratorium steril, laboratorium kimia obat, laboratorium sediaan padat, Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta. Penelitian dimulai dari bulan Septemberber 2015 sampai Juni 2016.
3.2 Alat dan Bahan
3.2.1 Alat
Peralatan yang digunakan dalam penelitian ini yaitu erlenmeyer (Schott Duran), gelas beaker (Schott Duran), gelas ukur (Schott Duran), labu ukur, toples, pipet tetes, batang pengaduk, kaca arloji, vakum, labu buchner, corong, botol timbang, buret, lumpang dan alu, termometer, pinset, pH indicator universal, desikator, higrometer (HTC-1), timbangan analitik, mikropipet, spatula, batang pengaduk, hot plate stirrer (Cimarec), pengaduk magnetik, oven (Memmert), krus porselen dan tutup, lemari pendingin (Samsung), instrument GC-MS (Agilent Technologies).
3.2.2 Bahan Penelitian
Bahan-bahan yang digunakan antara lain yaitu minyak atsiri kemangi (Ocimum americanum L.) yang sudah tersedia di lab PDR 1 dan telah dideterminasi di Herbarium Bogoriense LIPI, Cibinong, Bogor; stok bahan serbuk simplisia kulit pisang kepok kuning (Musa balbisiana BBB) yang sudah tersedia di lab PDR 1 dan telah dideterminasi di Laboratorium Herbarium Bogoriense, Pusat Penelitian Biologi LIPI (Lembaga Ilmu Pengetahuan Indonesia), Bogor, Jawa Barat.
Bahan kimia yang digunakan dalam penelitian ini antara lain aquadest, HCl (0,075 N, 0,25 N dan 3 N), NaOH (0,1 N, 0,25 N dan 2 N), NaCl, aseton teknis,
larutan NaNO2, etanol 96%, etanol 70%, asam oksalat 0,1 N, pektin Danisco®,
aerosil, indikator phenolptalein, dan serbuk KBr.
3.3 Prosedur Pengerjaan
3.3.1 Produksi Pektin
a. Ekstraksi Pektin
Serbuk kulit pisang ditimbang sebanyak 42 gram, kemudian dicampurkan HCl 0,075 N simplisia sebanyak 840 mL (perbandingan simplisia dengan HCl 1:20) dan dipanaskan di atas hot plate stirrer dengan pengaturan suhu 80o-100oC disertai pengadukan yang konstan dengan magnetic stirrer selama 80 menit. Penghitungan waktu ekstraksi dimulai saat tercapainya suhu 80 oC pada bahan percobaan. Setelah dipanaskan, selanjutnya dilakukan penyaringan filtrat menggunakan kertas saring dengan bantuan vacuum Buchner untuk memisahkan filtrat dari residunya, dan filtrat didinginkan pada suhu ruang. Filtrat yang didapatkan disebut filtrat pektin (Hanum et al., 2012, dalam Qadrina 2015).
b. Pengendapan Pektin
Filtrat hasil ekstraksi yang telah dingin diendapkan menggunakan aseton dengan perbandingan tiap 1 liter filtrat ditambahkan dengan 1,5 liter aseton, kemudian didiamkan selama 18 jam agar pengendapannya terjadi secara sempurna. Endapan pektin yang terbentuk dipisahkan dari filtratnya menggunakan kertas saring dengan bantuan vacuum Buchner (Fitria, 2013).
c. Pencucian Pektin
UIN Syarif Hidayatullah Jakarta
putih (AgCl) pada larutan bekas pencucian pektin dengan etanol 96% yang ditambahkan dengan beberapa tetes perak nitrat (AgNO3) (Fitria, 2013).
d. Pengeringan Pektin
Pektin basah hasil pencucian yang telah bebas aseton, asam, dan klorida selanjutnya dikeringkan pada suhu ruangan selama 16 jam. Hasil yang diperoleh disebut dengan pektin kering (Hanum, et al.,2012).
3.3.2 Karakterisasi Pektin Hasil Ekstraksi
a. Pemerian Pektin
Pemerian pektin dilihat dari fisik pektin hasil ekstraksi yang meliputi bentuk, warna dan bau. Dalam buku farmakope Edisi V (2014) menyebutkan bahwa pemerian pektin berupa serbuk kasar atau halus, berwarna putih kekuningan, hampir tidak berbau, dan memiliki rasa musilago. Selain itu, dalam
Food Chemicals Codex (2004) menjelaskan pemerian pektin yaitu berupa serbuk kasar hingga halus, berwarna putih, kekuningan, kelabu, atau kecoklatan.
b. Identifikasi Kualitatif Pektin
Identifikasi pektin secara kualitatif dilakukan dengan cara :
1. Larutan pektin 1% (1 gram dalam 100 mL), diambil 5 mL, lalu ditambahkan etanol P dengan volume yang sama, akan terbentuk endapan bening seperti gelatin (perbedaan dengan kebanyakan gom).
2. 5 mL larutan pektin 1% ditambahkan 1 mL NaOH 2 N, dibiarkan pada suhu ruang selama 15 menit, akan terbentuk gel atau semi-gel (perbedaan dengan tragakan).
3. Gel yang diperoleh dari pengujian di atas diasamkan dengan HCl 3 N, lalu dikocok, akan terbentuk endapan seperti gelatin, tidak berwarna, yang menjadi putih dan bergumpal bila dididihkan (asam pektat).
c. Penghitungan Persen Rendemen
Persen rendemen adalah perbandingan antara bobot pektin yang dihasilkan dengan bobot bahan baku simplisia yang digunakan.
Rendemen (%)
X100%
(Owen, et al., (1952))
d. Penentuan Kadar Air
Sebanyak 0,300 gram sampel dikeringkan dalam oven pada suhu 105oC selama 4 jam menggunakan botol timbang yang telah diketahui bobot kosongnya. Selanjutnya didinginkan dalam desikator dan ditimbang sampai diperoleh bobot yang tetap.
Kadar air Dimana : W = Bobot isi sampel awal
Wa = Bobot sebelum dikeringkan
Wb = Bobot akhir setelah dikeringkan (Owen, et al., (1952))
e. Penentuan Berat Ekivalen (BE)
Berat ekivalen ditentukan dengan menimbang 0,5 gram pektin yang dimasukkan dalam erlenmeyer 250 mL dan dilembabkan dengan dengan 2,0 mL etanol absolut kemudian ditambahakan 100,0 mL air suling bebas CO2 yang berisi
1,0 gram NaCl serta ditambahkan 6 tetes indikator phenoftalein sebagai indikator. Campuran tersebut kemudian diaduk dengan cepat untuk memastikan bahwa semua substansi pektin telah larut dan tidak ada yang menempel pada dinding erlenmeyer. Titrasi dilakukan perlahan-lahan dengan titran standar NaOH 0,1 N sampai warna campuran berubah menjadi merah muda dan warna tetap selama minimal 30 detik.
UIN Syarif Hidayatullah Jakarta
f. Kadar Metoksil
Penentuan kadar metoksil dilakukan dengan menambahkan 25 mL NaOH 0,25 N ke dalam larutan netral dari penentuan BE kemudian dikocok dengan kuat dan benar dan didiamkan selama 30 menit pada suhu kamar dan tertutup. Selanjutnya ditambahkan 25 mL HCl 0,25 N dan 6 tetes indikator phenolphthalein kemudian dititrasi dengan titran NaOH 0,1 N hingga larutan berubah warna menjadi merah muda.
Kadar metoksil
Keterangan :
Nilai 31 didapatkan dari bobot molekul metoksil yang berupa OCH3. (Owen, et al.,2013).
g. Distribusi Ukuran Partikel Serbuk Pektin
Distribusi ukuran partikel serbuk pektin diukur menggunakan mikroskop optik. Sejumlah serbuk pektin diletakkan di kaca objek dan dilihat di bawah mikroskop dengan perbesaran 10 kali.
3.3.3 Minyak Atsiri Kemangi
1. Identitas
Memberikan identitas tanaman dan informasi senyawa spesifik dari kandungan minyak atsiri.
2. Organoleptik
3.3.4 Uji Daya Adsorpsi Minyak Atsiri Kemangi
Berikut ini merupakan alur pengerjaan penyiapan sampel.
Desikator ditempatkan pada kondisi suhu 25-27,5oC dan kelembaban Rh 70-72 selama 31 hari dan sampel dilakukan pengecekan kuantitatif dengan metode gravimetri secara bertahap yang dilakukan pada hari ke-0, hari ke-7, hari ke-13, hari ke-15, hari ke-25, hari ke-31.
Disiapkan 24 vial untuk menempatkan minyak atsiri dan adsorbennya.
UIN Syarif Hidayatullah Jakarta
1. Pengujian dengan instrument GC-MS
Kondisi GC-MS yang diguakan yaitu GC-MS (Shimdzu QP-5000), kolom DB-10 (25 m, diameter 0,25 mm), gas pembawanya adalah helium dengan kecepatan aliran gas 3 mL/menit dan tekanan kolom 70 kpa. Suhu kolom diprogram dari 50oC sampai 250oC dengan 2 tahap kenaikan. Pada tahap awal suhu kolom dibuat konstan 50oC selama 5 menit, lalu dinaikkan sampai 80oC dengan kecepatan kenaikan 2oC/menit. Pada 80oC suhu dipertahankan selama 1 menit dan selanjutnya dinaikkan menjadi 250oC dengan kecepatan kenaikan 4oC/menit. Kondisi pada suhu 250oC ini dipertahankan selama 4,5 menit. Suhu injektor selama analisis berlangsung diprogram konstan pada suhu 225oC, sedangkan suhu detektor (Elektron Impact) konstan pada suhu 270oC dengan energi 1,25 kv. Proses ini memakan waktu 68 menit. Spektrum massa masing-masing puncak hasil Kromatogram GC-MS selanjutnya dicocokkan dengan spektrum massa autentik yang ada pada bank NIST (National Institute of Standard Technology) library (Sulianti, Sri Budi, 2008; dalam Alfrida 2013).
Pengujian dengan instrument GC-MS ini dilakukan pada hari ke-0 dan pada hari ke-34. Pengujian dengan instrument GC-MS dilakukan dengan cara membandingkan area under curve (AUC) yang didapatkan setelah mengekstraksi minyak atsiri dalam bahan adsorben di hari ke-0 dengan AUC yang didapatkan dari ekstraksi minyak atsiri dalam bahan adsorben di hari ke-34.
2. Pengujian dengan metode gravimetri
Pengujian ke-dua yaitu metode gravimetri, pengujian dilakukan dengan pengovenan sampel pada suhu 105oC hingga mendapatkan bobot tetapnya.
Dimana : W = Bobot isi awal
Wa = Bobot isi + wadah sebelum dioven
Wb = Bobot + wadah setelah dioven
Setelah didapatkan % kadar air + kadar minyak atsiri pada adsorben sampel dan % kadar air pada adsorben blanko, kadar minyak atsiri dalam sampel dapat dihitung dengan cara :
Kadar minyak atsiri pada adsorben =
UIN Syarif Hidayatullah Jakarta
BAB 4
HASIL DAN PEMBAHASAN
4.1 Produksi Pektin
Bahan baku yang digunakan dalam pembuatan pektin adalah simplisia kulit pisang kepok kuning yang telah tersedia di lab PDR 1. Simplisia tersebut berasal dari kulit pisang kepok kuning yang belum matang. Pada umumnya protopektin lebih banyak terdapat pada buah-buahan yang belum matang (Winarno dan Aman, 2002). Protopektin bersifat tidak larut air yang bila dihidrolisis menggunakan asam atau secara enzimatik akan menghasilkan pektin yang sifatnya dapat larut air (Hanum, et al., 2012).
Produksi pektin dilakukan melalui proses ekstraksi menggunakan pelarut HCl 0,075 N pada suhu 90oC selama 80 menit. Suhu dan waktu dalam proses ekstraksi ini ditetapkan berdasarkan hasil penelitian sebelumnya (Suffy. Q, 2015) yang menyatakan bahwa rendemen tertinggi yang diperoleh dari ekstraksi simplisia kulit pisang kepok dengan menggunakan pelarut HCl adalah pada suhu 90oC selama 80 menit. Ekstraksi pektin dilakukan menggunakan metode pemanasan langsung.
Hanun et al. (2012) mengungkapkan bahwa ekstraksi pektin dapat dilakukan dengan hidrolisis asam atau secara enzimatis. Pada penelitian ini, ekstraksi pektin dilakukan dengan hidrolisis asam yaitu dengan HCl dengan konsentrasi 0,075N. Penentuan konsentrasi HCl pada penelitian ini ditetapkan berdasarkan hasil penelitian sebelumnya (Suffy. Q, 2015) yang menyatakan bahwa pektin hasil ekstraksi dari limbah kulit pisang kepok kuning paling optimum dan yang paling sesuai dengan karakteristik pektin dalam Farmakope Indonesia Edisi V (2014) dan sesuai dengan standar mutu International Pectin Producers Association (IPPA) (2013) adalah pektin yang diekstraksi menggunakan HCl dengan konsentrasi 0,075N.
Pada proses ekstraksi pektin, simplisia kulit pisang kepok kuning yang digunakan adalah sebanyak 42 gram kemudian dimasukkan ke dalam erlenmeyer 2000 ml setelah itu ditambahkan HCl 0,075 N sebanyak 840 mL (1:20).
Selanjutnya ke dalam erlenmeyer tersebut dimasukkan pengaduk magnet lalu pada leher erlenmeyer ditutup dengan aluminium foil.
4.2 Karakterisasi Pektin Hasil Ekstraksi
4.2.1 Pemerian Pektin
Pemerian pektin dari simplisia kulit pisang ini berupa serbuk kasar, berwarna kecoklatan, tidak berbau dan mempunyai rasa musilago. Hasil tersebut sesuai dengan pemerian pektin yang dijelaskan dalam buku Farmakope Edisi V (2014) yaitu pemerian pektin berupa serbuk kasar atau halus, berwarna putih kekuningan, hampir tidak berbau, dan mempunyai rasa musilago dan dalam Food Chemicals Codex (2004) yang menjelaskan pemerian pektin yaitu berupa serbuk putih kasar hingga halus, berwarna putih, kekuningan, kelabu, atau kecoklatan.
Berikut ini merupakan gambar pektin yang dihasilkan dari proses isolasi kulit pisang kepok kuning.
UIN Syarif Hidayatullah Jakarta
4.2.2 Identifikasi Kualitatif Pektin
Berikut ini merupakan tabel hasil identifikasi kualitatif pektin dari limbah kulit pisang kepok kuning.
Tabel 4.1 Identifikasi Pektin Hasil Isolasi
4.2.3 Sifat Fisikokimia Pektin Hasil Ekstraksi
Berikut ini merupakan tabel yang menggambarkan sifat fisikokimia pektin hasil ekstraksi.
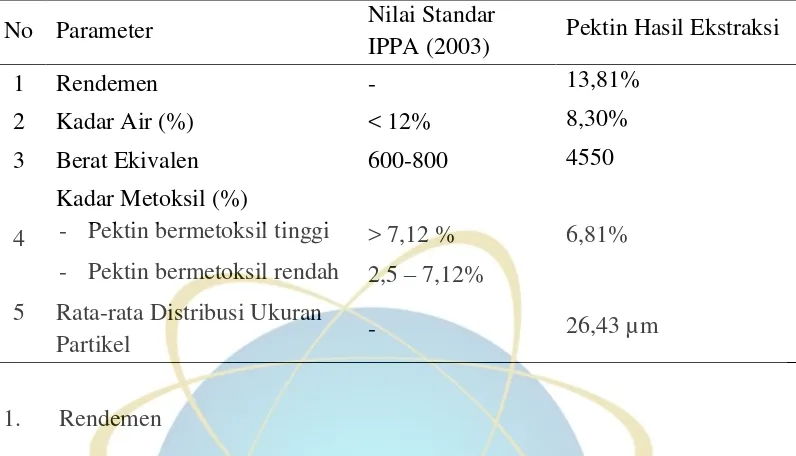
Tabel 4.2 Sifat Fisiko Kimia Pektin Hasil Ekstraksi
No Parameter Nilai Standar
IPPA (2003) Pektin Hasil Ekstraksi
1 Rendemen - 13,81%
Rendemen adalah perbandingan hasil minyak atsiri dengan bagian tanaman yang diolah yang dinyatakan dalam persen (Haris, 1994). Persen rendemen dari hasil ekstraksi pektin dari simplisia limbah kulit pisang kepok kuning adalah 13,81%.
Persen rendemen dihitung untuk memperkirakan jumlah simplisia kulit pisang yang dibutuhkan untuk menghasilkan pektin dalam jumlah tertentu yang dibutuhkan untuk suatu kebutuhan seperti dalam memformulasi suatu sediaan.
2. Kadar Air (%)
Kadar air merupakan salah satu parameter penting yang menentukan daya tahan produk selama penyimpanan dan terkait dengan aktivitas mikroorganisme selama penyimpanan. Produk yang memiliki kadar air tinggi lebih mudah rusak karena mudah menjadi media yang kondusif bagi pertumbuhan mikroorganisme, sedangkan produk dengan kadar air rendah relatif lebih stabil dalam penyimpanan jangka panjang daripada produk dengan kadar air yang tinggi (Pardede, et al.,
UIN Syarif Hidayatullah Jakarta
Hasil uji kadar air Pektin hasil ekstraksi adalah 8,30%. Dengan demikian kadar air pektin hasil ekstraksi sudah sesuai dengan syarat yang ditetapkan oleh IPPA.
3. Berat Ekivalen
Berat ekivalen merupakan kandungan gugus asam galakturonat bebas yang tidak teresterifikasi dalam rantai molekul pektin. Asam pektat murni merupakan zat pektat yang seluruhnya tersusun dari asam poligalakturonat yang bebas dari gugus metil ester atau tidak mengalami esterifikasi. Semakin rendah kadar pektin menyebabkan berat ekivalen semakin rendah (Ranganna, 1977).
Berat ekivalen pektin hasil ekstraksi adalah 4550, sedangkan berat ekivalen berdasarkan standar IPPA (2003) berkisar antara 600-800. Sehingga pada penelitian ini pektin hasil ekstraksi memiliki berat ekivalen yang tidak memenuhi standar IPPA (2003). Hasil ini sesuai dengan penelitian yang sebelumnya dikerjakan (Utami, 2014; Suffy, 2015), peneliti sebelumnya juga menghasilkan pektin hasil ekstraksi dari kulit pisang kepok yang memiliki berat ekivalen lebih tinggi dari standar IPPA (2013), yaitu berkisar antara 4090,47 – 9534,71 dan 4725,7974 – 8119,1172. Kemungkinan besar yang mempengaruhi nilai berat ekivalen adalah sifat pektin hasil ekstraksi itu sendiri, serta proses titrasi yang dilakukan (Fitria, 2013). Hasil titrasi untuk perhitungan berat ekivalen akan mempengaruhi perhitungan kadar metoksil.
4. Kadar Metoksil
Kadar metoksil didefinisikan sebagai jumlah metoksil yang terdapat di dalam pektin yang dapat menentukan sifat fungsional larutan pektin dan mempengaruhi struktur serta tekstur dari gel pektin yang terbentuk. Pektin disebut bermetoksil tinggi jika kadar metoksil sama dengan atau lebih dari 7% dan disebut bermetoksil rendah jika kadar metoksil kurang dari 7% (Goycoolea dan Adriana, 2003).
0
Pektin bermetoksil rendah dapat menghasilkan pembentukan gel yang tidak bergantung pada kadar gula dan tidak sensitif terhadap pH serta memerlukan adanya sejumlah kalsium atau kation divalen lainnya untuk pembentukan gel (Sriamonsak, 2003; Hui, 2006).
5. Distribusi Ukuran Partikel Masing-masing Serbuk Adsorben
Distribusi ukuran partikel merupakan evaluasi fisik pada serbuk pektin yang ditujukan untuk mengetahui diameter rata-rata partikel. Metode yang digunakan adalah metode mikroskopis dengan mikroskop optik pada perbesaran 10 kali.
Ukuran partikel dari serbuk pektin hasil ekstraksi, pektin komersil, dan aerosil akan mempengaruhi kemampuannya sebagai adsorben karena molekul-molekul yang dapat diadsorpsi merupakan molekul-molekul-molekul-molekul yang diameternya lebih kecil atau sama dengan diameter pori adsorben. Selain itu, jumlah molekul adsorbat akan meningkat dengan bertambahnya luas permukaan dari bahan adsorben (Suryawan, 2004; Arfan, 2006).
UIN Syarif Hidayatullah Jakarta
Profil distribusi ukuran partikel menunjukkan ukuran partikel dari masing-masing serbuk adsorben dimulai dari yang terkecil hingga yang terbesar secara berturut-turut adalah aerosil, pektin hasil ekstraksi, dan pektin komersil dengan ukuran rata-rata aerosil adalah 12,61 µm, pektin hasil ekstraksi adalah 26,43 µm, dan pektin komersil 27,49 µm.
4.3 Parameter Minyak Atsiri Kemangi
4.3.1 Organoleptik
Hasil pengamatan organolpetik yang dilakukan adalah sebagai berikut : Tabel 4.3 Organoleptik Minyak Atsiri Kemangi
Bentuk Cairan Warna Kuning muda
Bau Khas aromatik
Rasa Kelat
Gambar 4.3 Minyak Atsiri Kemangi (Sumber : koleksi pribadi)
4.3.2 Analisis Komponen Kimia Minyak Atsiri Kemangi
UIN Syarif Hidayatullah Jakarta
Tabel 4.4 Hasil Analisis GCMS Komponen Kimia Minyak Atsiri
NO Waktu Retensi
Area
(%) Komponen Quality
1 23,333 1,862 Linalool 92
2 24,098 27,855 ß-Citral 97
3 25,740 37,698 Citral 99
4 29,769 0,162 Citronellal 91
5 30,070 2,677 Cis-Geraniol 90
6 35,033 1,411 Trans Nerol 93
7 36,778 6,961 Caryophyllene 97
8 37,562 1,166 Trans-α-Bergamotene 90
Hasil analisis kimia minyak atsiri kemangi dengan GC-MS menunjukkan terdapat 8 komponen senyawa di dalamnya. Senyawa yang paling dominan di antaranya citral (37,698%) dan ß-Citral (27,855%). Hasil tersebut sesuai dengan hasil yang didapatkan pada penelitian sebelumnya (Nurhadi.G, 2015) yang menjelaskan citral (45,505%) dan ß-Citral (32,879%) merupakan komponen utama dari Ocimum americanum L., Sehingga minyak atsiri yang digunakan dalam penelitian ini masih sesuai dengan minyak atsiri yang digunakan pada penelitian sebelumnya (Nurhadi.G, 2015).
4.4 Uji Daya Adsorpsi Pektin
4.4.1 Pengujian dengan Instrument GC-MS
Pengujian dengan instrument GC-MS ini dilakukan pada hari ke-0 dan di hari ke-34. Hal ini dilakukan untuk melihat penurunan Area Under Curve (AUC) kandungan minyak atsiri dalam bahan adsorben selama masa penyimpanan.
Adsorben yang mengandung minyak atsiri diekstrak dengan menggunakan n-hexane sebanyak 100 kali dari bobot minyak atsiri yang sebelumnya ditimbang untuk bahan adsorben tersebut (Fattah, M., 2015).
Berikut ini merupakan tabel hasil pengukuran AUC yang didapatkan dari instrumen GC-MS pada masing-masing bahan adsorben pada hari ke-0 dan hari ke-34.
Tabel 4.5 Hasil AUC dari GC-MS dan % penurunan AUC
No. Adsorben Hasil pengukuran AUC Penurunan
AUC (%) Hari ke-0 Hari ke-34
1 Aerosil 518443038 373416274 27,97%
2 Pektin komersial 450963952 104136715 76,90%
3 Pektin hasil ekstraksi 471618618 257393003 45,42%
UIN Syarif Hidayatullah Jakarta
4.4.2 Pengujian dengan Metode Gravimetri.
Berikut ini merupakan hasil pengujian gravimetri yang dilakukan selama 31 hari dengan pengujian bertahap pada hari ke-0, hari ke-7, hari ke-13, hari ke-19, hari ke-25, hari ke-31.
Tabel 4.6 Penurunan Kadar Minyak Atsiri Selama 31 Hari
No. Adsorben Jumlah kadar minyak atsiri yang hilang pada hari ke-
0 7 13 19 25 31
Gambar 4.5 Kurva Penurunan Kadar Minyak Atsiri Selama Penyimpanan
31 hari
Tabel dan kurva tersebut menggambarkan kemampuan masing-masing adsorben dalam mempertahankan minyak atsiri. Bila hasil tersebut diubah dalam bentuk persen (%), maka penurunan kadar minyak atsiri setelah 31 hari pada pektin hasil ekstraksi, pektin komersil dan aerosil secara berturut-turut yaitu 37,25%, 45,08% dan 10,02%.
Hasil tersebut menunjukkan daya adsorpsi pektin hasil ekstraksi lebih baik dibandingkan dengan pektin komersil, tetapi bila dibandingkan dengan aerosil, daya adsorpsi pektin masih di bawah daya adsorpsi aerosil.
Semua hasil uji daya adsorpsi baik uji pengukuran AUC menggunakan GC-MS maupun uji gravimetri yang telah dikerjakan menunjukan pola hasil yang sama yaitu daya adsorpsi pektin hasil ekstraksi lebih baik dibandingkan dengan
pektin komersil, tetapi bila dibandingkan dengan aerosil, daya adsorpsi pektin masih di bawah daya adsorpsi aerosil.
UIN Syarif Hidayatullah Jakarta
BAB 5
PENUTUP
5.1 Kesimpulan
Uji daya adsorpsi dilakukan dengan 2 metode. Hasil uji GC-MS menunjukkan penurunan AUC pada aerosil selama masa penyimpanan 34 hari adalah 27,97%, penurunan AUC pada pektin komersil selama masa penimpanan 34 hari adalah 76,90%, sedangkan penurunan AUC pada pektin hasil isolasi selama masa penimpanan 34 hari adalah 45,42%. pada uji gravimetri setelah penyimpanan 31 hari, aerosil kehilangan bobot minyak atsiri sebanyak 10,02%, pada pektin komersil kehilangan bobot minyak atsiri sebanyak 45,08%, dan pada pektin hasi ekstraksi kehilangan bobot minyak atsiri sebanyak 37,25%. Hasil tersebut menunjukkan bahwa kemampuan adsorpsi pektin hasil ekstraksi lebih baik dibandingkan dengan pektin komersil, tetapi bila dibandingkan dengan aerosil, daya adsorpsi pektin masih dibawah daya adsorpsi aerosil.
5.2 Saran
Pektin tidak cocok digunakan sebagai adsorben minyak atsiri. Perlu dilakukan penelitian lebih lanjut dengan menggunakan adsorbat lain selain minyak atsiri.
DAFTAR PUSTAKA
Artha, L., J, Rona., Nurminah, Mimi. 2014. Pengaruh ekstraksi terhadap mutu pektin dari kulit durian. Jurnal Ilmiah, Universitas Sumatra Utara. Medan. Armstrong, N.A., 2009. Sucrose in Rowe C. R., Sheskey, P. J., and Owen, S. C.
Handbook of Pharmaceutical Exipients 5th Edition. Pharmaceutical Press. London.
Badan Penelitian dan Pengembangan Kesehatan. 2013.Riset Kesehatan Dasar. Kementrian Kesehatan Republik Indonesia. Jakarta.
Badan Pusat Statistik. 2011. Buletin Statistik Perdagangan Luar Negeri Impor September 2011. Badan Pusat Statistik. Jakarta.
Badan Pusat Statistik. 2012. Buletin Statistik Perdagangan Luar Negeri Impor November 2012. Badan Pusat Statistik. Jakarta.
Badan Pusat Statistik. 2013. Buletin Statistik Perdagangan Luar Negeri Impor November 2013. Badan Pusat Statistik. Jakarta.
Badan Pusat Statistik. 2014. Buletin Statistik Perdagangan Luar Negeri Impor November 2014. Badan Pusat Statistik. Jakarta.
Badan Pusat Statistik. 2015. Buletin Statistik Perdagangan Luar Negeri Impor November 2015. Badan Pusat Statistik. Jakarta.
Baker, Robert A. 1997. Reassessment of Some Fruit and Vegetable Pectin Levels. Journal of Food Science, Vol. 62, No. 2 : 225-229.
Bansal, Jharna, Rishbha Malviya, Tanya Malaviya, Vinit Bhadwaj, dan Pramod Kumar Sharma. 2014. Evaluation of Banana Peel Pectin as Excipient in Solid Oral Dosage Form. Global Journal of Pharmacology, 8 (2) : 275 – 278. ISSN 1992-0075.
Cawson, R. A. and Spector R. G., 1987, Clinical Pharmacology In Dentistry, 4th ed, 89, Churchill Livingstone, Edinburgh.
Erika, Cut. 2013. “The Extraction of Pectin from Cocoa (Theobroma cacao L.)“.
Universitas Syiah Kuala. Banda Aceh.
UIN Syarif Hidayatullah Jakarta
Fattah, Mohammad. 2015. Uji aktivitas antibiofilm In Vitro minyak atsiri herba kemangi terhadap bakteri Escherichia coli, Pseudomonas aeruginosa, dan
Staphylococcus aureus. Skripsi, UIN Syarif Hidayatullah. Jakarta
Fitria, Vita. 2013. Karakterisasi pektin hasil ekstraksi dari limbah kulit pisang kepok (Musa Balbisiana ABB.). Skripsi, UIN Syarif Hidayatullah. Jakarta. Fuki, Tri Yuliarto, Khasanah dan Anandito. 2012. The Influence of The Raw
Materials Size and The Distillation Methods To The Quality of Cinnamon Bark Essential Oil. Universitas Sebelas Maret. Semarang.
Genaro, R. A., 1990, Rhemington’s Pharmaceutikal Science, 18th Ed., 207, Mack Printing Company, Easton.
Greenspan, Lewis. 1977. Humidity Fixed Points of binary Saturated Aqueous Solutions. Journal of Research. Washington, D. C.
Guenther, E. 1987. The Essential Oils. Terjemahan. Ketaren, R.S. (1987). Minyak Atsiri. Jilid I. Penerbit Universitas Indonesia. Jakarta.
H. Yamada,. Kiyohara, H. and Matsumoto, T, Recent Studies on Possible Funct ion of Bioact ive Pektins and Pectic Polysaccharides from Medica, 2003. Hanum, Farida, Martha Angelina Tarigan, dan Irza Menka Deviliany Kaban.
2012. Ekstraksi Pektin dari Kulit Buah Pisang Raja (Musa sapientum). Jurnal Teknik Kimia, Universitas Sumatera Utara, Vol.1, No. 2:21-26. Hanum, Farida, Martha Angelina Tarigan, dan Irza Menka Deviliany Kaban.
2012. Ekstraksi Pektin dari Kulit Buah Pisang Raja (Musa sapientum). Jurnal Teknik Kimia, Universitas Sumatera Utara, Vol.1, No. 2:49-53. Hariyati, Muliyah Nur. 2006. Ekstraksi dan karakterisasi pektin dari limbah
proses pengolahan jeruk pontianak (Citrus nobilis var microcarpa). Institut Pertanian Bogor. Bogor.
Heriawan, Rusman. 2010. Buletin Statistik Perdagangan Luar Negeri Impor November 2010. Badan Pusat Statistik. Jakarta.
IPPA (International Pectins Producers Association). What is pectin. www.ippa.info/history_of_pectin.htm (diakses tanggal 7 Januari 2016 pukul 16.08 WIB).
Effect of variety and acid washing method on extraction yield and quality of sunflower head pectin, J. Food Chemistry 83: 43– 47, 1992.
K. Sirotek,, L. Slovakova, J. Kopecny and M. Marounek, Fermentation of pectin and glucose, and activity of pectindegrading enzymes in the rabbit caecal bacterium Bacteroides caccae, Letters in Applied Microbiology 38: 327 332, 2004.
M. H. Canteri-Schemin,., H.R. Fertonani, N. Waszczyaskyj and G. Wosiacki, Extraction of Pektin from Apple. Brazilian Archives of Biology and Technology,Vol. 48 n.2: pp. 259–266, 2005.
Martin, alfred. James. and Arthur. 1990. Farmasi Fisik: Dasar-Dasar Kimia Fisik Dalam Ilmu Farmasetik Edisi 1. Ui Press. Depok
Martin, alfred. James. and Arthur. 1993. Farmasi Fisik: Dasar-Dasar Kimia Fisik Dalam Ilmu Farmasetik Edisi 2. Ui Press. Depok
Martono, Budi., dkk. 2004. Plasma nutfah insektisida nabati. balai penelitian tanaman rempah dan obat perkembangan teknologi.TRO VOL. XVI, No. 1, hal 52.
Maryati., dkk. 2007. Uji aktivitas antibakteri minyak atsiri daun kemangi (Ocimum basilicum) terhadap Staphylococcus aureus dan Eschericia coli. Jurnal Penelitian Sains dan Teknologi,Vol. 8, No. 1 : 30-38
Nurhadi, Galih. 2015. Pengaruh Konsentrasi Tween 80 Terhadap Stabilitas Fisik Obat Kumur Minyak Atsiri Herba Kemangi (Ocimum americanum L.).
Skripsi, UIN Syarif Hidayatullah. Jakarta.
Puspitasari, D., Datti, N., Edahwati, L. 2008. Ekstraksi Pektin dari Ampas Nanas.
Makalah Seminar Nasional Soebardjo Brotohardjono. Surabaya. Pitojo, Setijo. 1996. Kemangi dan Selasih. Ungaran : TrubusAgriwidya.
Power, J. M. And Sakaguchi, R. I., 2006. Craig’s Restorative Dental Material. 12th ed., 164-167, C.V. Mosby Co., Toronto.
Reddy, K Indra. 1996. Ocular Therapeutics and Drug Delivery. Technomic Publishing Company. Pennsylvania, USA.