UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH VARIASI KONSENTRASI ASAM DAN
WAKTU HIDROLISIS TERHADAP PRODUKSI
BIOETANOL
KUNING
FAKULTAS KEDOKTERAN
UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH VARIASI KONSENTRASI ASAM DAN
WAKTU HIDROLISIS TERHADAP PRODUKSI
BIOETANOL DARI LIMBAH KULIT PISANG KEPOK
KUNING (Musa balbisiana BBB)
SKRIPSI
VINA FAUZIAH NIM. 1111102000100
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
JAKARTA JUNI 2015
UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH VARIASI KONSENTRASI ASAM DAN
WAKTU HIDROLISIS TERHADAP PRODUKSI
DARI LIMBAH KULIT PISANG KEPOK
PENGARUH VARIASI KONSENTRASI ASAM DAN
WAKTU HIDROLISIS TERHADAP PRODUKSI
BIOETANOL DARI LIMBAH KULIT PISANG KEPOK
KUNING (
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
ii
PENGARUH VARIASI KONSENTRASI ASAM DAN
WAKTU HIDROLISIS TERHADAP PRODUKSI
BIOETANOL DARI LIMBAH KULIT PISANG KEPOK
KUNING (Musa balbisiana BBB)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana
VINA FAUZIAH NIM. 1111102000100
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
JAKARTA JUNI 2015
PENGARUH VARIASI KONSENTRASI ASAM DAN
WAKTU HIDROLISIS TERHADAP PRODUKSI
BIOETANOL DARI LIMBAH KULIT PISANG KEPOK
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
vi UIN Syarif Hidayatullah Jakarta Judul : Pengaruh Variasi Konsentrasi Asam dan Waktu Hidrolisis terhadap
Produksi Bioetanol dari Limbah Kulit Pisang Kepok Kuning (Musa balbisiana BBB)
Kulit pisang mengandung pati dan serat yang dapat dijadikan sebagai substrat potensial pada fermentasi etanol. Pati dan serat harus dipecah menjadi gula sederhana melalui proses hidrolisis sehingga dapat dikonversi oleh Saccharomyces cereviceae menjadi etanol. Penelitian ini bertujuan untuk melihat pengaruh variasi konsentrasi asam dan waktu hidrolisis terhadap produksi bioetanol dari limbah kulit pisang kepok kuning (Musa balbisiana BBB). Penelitian ini menggunakan dua parameter yang berbeda yaitu waktu hidrolisis dan konsentrasi asam sulfat. Waktu hidrolisis yang digunakan adalah 120 menit, 150 menit, dan 180 menit. Sedangkan konsentrasi asam yang digunakan adalah 0,2 N, 0,5 N dan 0,8 N. Kadar gula pereduksi terbanyak selanjutnya dilakukan fermentasi dan destilasi guna memisahkan etanol. Hasil penelitian menunjukkan dari 50 g sampel tepung limbah kulit pisang kepok yang digunakan, kadar gula pereduksi terbanyak dihasilkan pada sampel dengan konsentrasi asam sulfat 0,8 N dihidrolisis selama 180 menit sebesar 12,7183272 µg/mL. Kadar etanol tertinggi dihasilkan pada waktu fermentasi ke 96 jam sebesar 12%. Dan Kadar etanol tertinggi didapatkan setelah destilasi ke tiga dengan menggunakan suhu 600C sebesar 90% sebanyak 6 mL.
vii UIN Syarif Hidayatullah Jakarta ABSTRACT
Title : Effect Of Acid Concentration Variation and Hydrolysis Time Toward Bioethanol Production from Waste of Peel Kepok Yellow Banana (Musa balbisiana BBB)
Banana peel contains starch and fiber which can be as a potential substrate in ethanol fermentation. Starch and fiber have to be broken down into simple sugars through hydrolysis that can be converted into ethanol by Saccharomyces cereviceae. This study aims to look at the effects of various concentrations of acid and hydrolysis time on the production of bioethanol from waste of peel kepok yellow banana (Musa balbisiana BBB). This study uses two different parameters, they are hydrolysis time and concentration of sulfuric acid. Hydrolysis times that used are 120 minutes, 150 minutes, and 180 minutes. While the concentrations of acid that used are 0.2 N, 0.5 N and 0.8 N. The highest levels of reducing sugars that will be fermented and distillation further. The results showed from 50 g waste flour of kepok banana peel was used, the highest levels of reducing sugars produced in the samples using sulfuric acid concentration of 0.8 N hydrolyzed for 180 minutes at 12.7183272 mg/mL. The highest levels of ethanol produced in the fermentation time to 96 hours is 12%. And the highest levels of ethanol obtained after the third distillation by used the temperature of 600C is 90% with total volume 6 mL.
viii UIN Syarif Hidayatullah Jakarta
Esa Allah SWT yang telah melimpahkan berbagai macam nikmat, karunia serta kasih sayang-Nya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Shalawat serta salam tak lupa pula kami haturkan kepada pemimpin seluruh umat dan rahmat bagi semesta alam baginda Nabi Besar Muhammad SAW, beserta keluarga, sahabat dan para pengikutnya hingga hari akhir nanti, semoga kita senantiasa mendapatkan syafaat dari beliau.
Skripsi dengan judul “Pengaruh Variasi Konsentrasi Asam dan Waktu Hidrolisis terhadap Produksi Bioetanol dari Limbah Kulit Pisang Kepok Kuning (Musa balbisiana BBB)” ini disusun untuk memenuhi salah satu syarat menempuh ujian akhir guna mendapatkan gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Dalam proses penelitian dan penyusunan skripsi ini, penulis menyadari adanya beberapa pihak yang memberikan kontribusi kepada penulis. Oleh karena itu penulis mengucapkan rasa terima kasih yang sebesar-besarnya, khususnya kepada :
1. Dr. H. Arif Sumantri, SKM, M.Kes selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
2. Yardi, M.Si., Ph.D., Apt selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3. Eka Putri, M. Si., Apt sebagai Pembimbing I dan Supandi, M. Si., Apt sebagai Pembimbing II yang telah meluangkan waktu, pikiran dan tenaganya serta memberikan ilmu terbaik yang dimiliki sehingga menutupi banyak keterbatasan penulis.
ix UIN Syarif Hidayatullah Jakarta
5. Ayahanda Nana Supriatna S.Pd sebagai pemimpin dalam keluarga yang selalu memberikan semangat dan menjadi panutan penulis dalam meraih cita-cita dan Ibunda Uum Umamah S.Pd tercinta yang selalu memberikan kasih sayang, perhatian, dukungan, do’a dan nasihat tak terhingga yang tak akan pernah mampu penulis membalasnya. Saudara penulis, Ahmad Yudi Satibi, Abdul Fariz Azizi, Renna Khairunnisa, dan Nurul Khamalia Shofi yang selalu memberikan semangat dan dorongan untuk kesuksesan penulis.
6. Sahabat-sahabat tercinta satu tim penelitian pisang kepok, Qadrina Sufy dan Faradhila Nur saraswati yang telah membantu dan bekerja sama dalam melakukan penilitan ini.
7. Sahabat-sahabat penulis Puspita, Lela Laelatu, Vernanda, Tia Monica, Khairunnisa, Ageng Hasna F, Miyadah Samiyah, Hestiawati, serta teman-teman farmasi angkatan 2011 yang telah menjadi keluarga kedua penulis selama menjadi mahasiswa di program studi farmasi ini.
8. Laboran yang telah membantu keseharian penulis selama penelitian di laboraturium FKIK UIN Syarifhidayatullah, mba Rani, Kak Tiwi, Kak Lisna, Kak Eris dan Kak Rahmadi serta semua pihak yang telah membantu penulis yang belum bisa disebutkan satu per satu.
Penulis sadar bahwa dalam penulisan skripsi ini masih banyak kelemahan dan kekurangan, kritik dan saran pembaca diharapkan penulis untuk memperbaiki kemampuan penulis.
Jakarta, 12 Juni 2015
DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
LEMBAR ORIGINALITAS ... iii
LEMBAR PERSETUJUAN SKRIPSI ... iv
LEMBAR PENGESAHAN SKRIPSI ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
xii UIN Syarif Hidayatullah Jakarta
3.3.3.1. Pengaruh Variasi Waktu Hidrolisis dan Konsentrasi Asam ... 29
4.2 Karakterisasi Tepung Kulit Pisang Kepok ... 34
4.3 Hidrolisis Tepung Kulit Pisang Kepok ... 36
4.4 Perhitungan Gula Pereduksi Metode Nelson Somogyi ... 40
4.5 Fermentasi Bioetanol ... 42
4.6 Analisis Kadar Bioetanol Metode Berat Jenis... 45
BAB 5 KESIMPULAN DAN SARAN ... 47
4.1 Kesimpulan ... 47
4.2 Saran ... 47
DAFTAR PUSTAKA ... 49
DAFTAR TABEL
Tabel 2.1. Komposisi Tiap 100 g Kulit Pisang Kepok. ... 9
Tabel 2.2. Sifat Fisika Etanol. ... 13
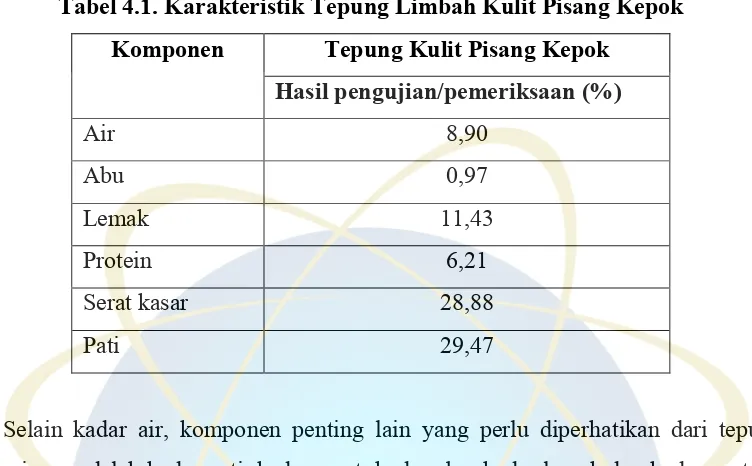
Tabel 4.1. Karakteristik Tepung Limbah Kulit Pisang Kepok ... 35
Tabel 4.2. Kadar Gula Pereduksi Hasil dari Hidrolisi Asam. ... 40
Tabel 4.3. Pengaruh Lamanya Fermentasi Terhadap Perubahan pH. ... 44
DAFTAR LAMPIRAN
Lampiran 1. Hasil Determinasi Tanaman Kulit Pisang Kepok ... 55
Lampiran 2. Hasil Analisis Proksimat ... 56
Lampiran 3. Kadar Air Tepung Kulit Pisang Kepok ... 57
Lampiran 4. Kurva Standar Gula Pereduksi Metode Nelson Somogyi ... 58
Lampiran 5. Kadar Etanol Selama Fermentasi Metode Berat Jenis ... 59
Lampiran 6. Perhitungan Rendemen ... 59
Lampiran 7. Perhitungan Kadar Abu ... 59
Lampiran 8. Perhitungan NPK dan Ragi ... 60
Lampiran 9. Pembuatan Pereaksi Nelson Somogyi ... 60
Lampiran 10. Hasil GC-MS Standar Etanol ... 61
Lampiran 11. Hasil Analisis GC-MS Sampel Bioetanol ... 63
Lampiran 12. Hasil MS Sampel Bioetanol ... 65
Lampiran 13. Hasil MS Standar Etanol ... 66
Lampiran 14. COA Glukosa ... 67
Lampiran 15. Kerangka Penelitian... 68
1.1.Latar Belakang
Etanol merupakan cairan hasil proses fermentasi gula dari sumber karbohidrat (pati) menggunakan bantuan mikroorganisme, salah satunya adalah Saccharomyces cereviceae (Dewati, 2008). Menurut Schlegel, (1994) dalam Martiningsih, (2007) kebutuhan etanol semakin bertambah dengan semakin banyaknya pabrik-pabrik farmasi dan sekolah farmasi maupun kimia di Indonesia yang menggunakan etanol. Berbagai jenis produk dapat dihasilkan dari etanol terutama yang erat kaitannya dengan industri kimia, baik untuk keperluan medis maupun industri kosmetik.
Bahan-bahan yang mengandung monosakarida (C6H12O6) sebagai glukosa langsung dapat difermentasi menjadi etanol. Akan tetapi disakarida, pati ataupun karbohidrat kompleks harus dihidrolisis terlebih dahulu menjadi komponen sederhana yaitu monosakarida. Oleh karena itu, agar tahap proses fermentasi dapat berjalan secara optimal, bahan tersebut harus mengalami perlakuan pendahuluan sebelum masuk ke dalam proses fermentasi (Sari Ketut, 2009).
2
Limbah hayati merupakan salah satu sumber yang paling potensial penggunaannya dalam produksi etanol dari sekian banyak sumber alternatif yang memungkinkan, terutama bagi industri kimia. Alasan utama penggunaan limbah hayati terutama berasal dari tumbuhan berkaitan dengan senyawa dasar pembentuk makhluk hidup yang juga merupakan persenyawaan hidrokarbon yang membentuk struktur molekul etanol. Disamping itu karena berasal dari persenyawaan hayati, diharapkan mampu memberikan dampak positif bagi lingkungan serta perkembangan industri produsen etanol karena penggunaan limbah sebagai bahan baku akan menurunkan biaya produksi. (Nugroho, 2004)
Limbah kulit pisang merupakan salah satu sumber karbohidrat atau gula yang berpotensi dalam menghasilkan bioetanol. Kulit pisang mengandung karbohidrat dengan komposisi cukup besar, yaitu sekitar 18,50%. Selain itu juga, Amsal (2005) menyebutkan bahwa tingginya hasil etanol pada kulit pisang kepok dibandingkan dengan kulit Cavendish dan kulit pisang nangka disebabkan kandungan karbohidrat pada kulit pisang kepok yang lebih tinggi dibandingkan dengan kedua pisang tersebut. Kulit pisang Cavendish menghasilkan kadar etanol sebesar 0,37%, kulit pisang nangka sebesar 0,20% sedangkan kulit pisang kepok sebesar 0,45%. Dari hasil penelitian ini, kulit pisang kepok yang berpotensi besar dalam menghasilkan bioetanol terbanyak diantara kulit pisang yang lainnya.
hidrolisis yang lainnya terhadap kadar bioetanol. Sehingga dilakukanlah penelitian ini yang bertujuan untuk melihat pengaruh variasi konsentrasi asam dan waktu hidrolisis terhadap kadar bioetanol yang dihasilkan dari limbah kulit pisang kepok kuning (Musa balbisiana BBB).
1.2.Rumusan Masalah
Berdasarkan latar belakang tersebut, perlu adanya laporan penelitian mengenai pengaruh konsentrasi asam dan waktu hidrolisis terhadap produksi bioetanol untuk mendapatkan kondisi hidrolisis paling tepat dalam menghasilkan bioetanol dengan kadar dan volume yang tinggi dari tepung limbah kulit pisang kepok kuning (Musa balbisiana BBB).
1.3. Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui pengaruh variasi konsentrasi asam dan waktu hidrolisis terhadap jumlah bioetanol yang dihasilkan, sehingga didapatkanlah kondisi hidrolisis paling tepat dalam menghasilkan jumlah bioetanol terbanyak.
1.4.Manfaat Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1. Tanaman Pisang
Pisang merupakan tanaman asli daerah Asia Tenggara termasuk Indonesia yang memiliki nama latin Musa paradisiaca. Nama ini diberikan sejak sebelum masehi, diambil dari nama dokter kaisar Romawi Octavianus Augustus (63 SM-14 M) yang bernama Antonius Musa (Munadjim,1988 dalam Dewati 2008). Tanaman pisang ini oleh masyarakat dapat dimanfaatkan mulai dari bunga, buah, daun, batang sampai bonggol pun dapat dimanfaatkan untuk dibuat sayur. Pisang merupakan tanaman hortikultura yang penting karena potensi produksinya yang cukup besar dan produksi pisang berlangsung tanpa mengenal musim (Dewati, 2008).
Sejak lama pisang sudah dikenal sebagai buah yang lezat dan berkhasiat bagi kesehatan, karena pisang mengandung gizi sangat baik, antara lain menyediakan energi cukup tinggi dibanding dengan buah-buahan lain. Walaupun demikian, pemanfaatan pisang masih terbatas. Selain dapat dimakan langsung sebagai buah segar, pisang juga dapat diolah dalam keadaan mentah maupun matang. Pisang mentah dapat diolah menjadi gaplek, tepung dan keripik, sedangkan pisang matang dapat diolah menjadi anggur, sari buah, pisang goreng, pisang rebus, kolak, getuk dan lain sebagainya (Dewati, 2008).
2.1.1. Manfaat
Tanaman pisang merupakan tanaman yang serba guna, mulai dari akar sampai daun dapat digunakan (Munadjim, 1998 dalam Dewati 2008).
a. Umbi batang (Bonggol)
Pati yang terkandung dalam umbi batang pisang dapat dipergunakan sebagai sumber karbohidrat bahkan bisa dikeringkan untuk menjadi abu. Dimana abu dari umbi ini mengandung soda yang dapat digunakan sebagai bahan pembuatan sabun dan pupuk.
b. Batang pohon
Dapat digunakan sebagai makanan ternak di musim kekurangan air dan secara sederhana dapat dipergunakan sebagai bahan baku pembuatan pupuk kompos yang bernilai humusnya sangat tinggi.
c. Daun pisang
Daun yang segar dapat digunakan sebagai makanan ternak dimusim kering dan dimanfaatkan oleh masyarakat sebagai pembungkus makanan secara tradisional.
d. Bunga pisang
Bunga pisang yang masih segar (jantung pisang) bisa dijadikan makanan sebagai sayur.
e. Buah pisang
Selain enak dimakan secara langsung, bisa dijadikan selai pisang yang daya awetnya tinggi dan dapat menghasilkan uang yang lebih serta juga bisa dibuat tepung pisang dari buah yang tua yang belum masak.
f. Kulit buah pisang
6
2.1.2. Pisang Kepok
Pisang adalah tanaman herba yang berasal dari kawasan Asia Tenggara (termasuk Indonesia). Tanaman buah ini kemudian menyebar luas ke kawasan Afrika (Madagaskar), Amerika Selatan dan Amerika Tengah. Penyebaran tanaman ini selanjutnya hampir merata ke seluruh dunia, yakni meliputi daerah tropik dan subtropik, dimulai dari Asia Tenggara ke timur melalui Lautan Teduh sampai ke Hawai. Selain itu tanaman pisang menyebar ke Barat melalui Samudera Atlantik, Kepulauan Kenari sampai Benua Amerika (Suyanti dan Supriyadi, 2008).
Produksi pisang dunia dalam 120 negara diperkirakan mencapai 68 juta setiap tahunnya. Negara-negara Asia Tenggara penghasil pisang yang terkenal diantaranya adalah Filipina, Thailand, Malaysia dan Indonesia. Indonesia, Filipina dan Thailand merupakan negara penghasil pisang nomor satu di kawasan Asia Tenggara (Verheij dan Coronel, 1992 dalam Fitri 2013).
Pisang merupakan tumbuhan basah yang besar, biasanya mempunyai batang semu yang tersusun dari pelepah-pelepah daun. Tangkai daun jelas beralur pada sisi atasnya, helaian daun lebar, bangun jorong memanjang, dengan ibu tulang yang nyata dan tulang-tulang cabang yang menyirip dan kecil-kecil. Bunga dalam suatu bunga majemuk dengan daun-daun pelindung yang besar dan berwarna merah. Masing-masing bunga mempunyai tenda bunga yang menyerupai mahkota atau jelas mempunyai kelopak dan mahkota yang biasanya berlekatan, zigomorf. Benang sari 6 yang 5 fertil yang satu staminoidal. Bakal buah tenggelam, beruang 3 dengan 1 bakal biji dalam tiap ruang. Tangkai putik berbelah 3-6. Biji mempunyai salut, endosperm dan juga perisperm (Tjitrosoepomo, 1994).
sebagai bahan campuran krim antinyamuk. Kulit buah pisang juga dapat diekstrak untuk dibuat pektin. Bagian dalam kulit pisang matang yang dikerok dan dihancurkan dapat dimanfaatkan sebagai bahan baku pembuatan nata pisang. Sementara tepung kulit pisang yang dicampur dengan ampas tahu dapat digunakan sebagai pakan ayam buras untuk meningkatkan pertumbuhannya. Manfaat lainnya dapat dijadikan sebagai pembunuh larva serangga, yakni dengan menambahkan sedikit urea dan pemberian bakteri. Berdasarkan hasil temuan dari Taiwan diketahui bahwa kulit pisang yang mengandung vitamin B6 dan serotonin dapat diekstrak dan dimanfaatkan untuk kesehatan mata (Suyanti dan Supriyadi, 2008).
Sumber : Koleksi Pribadi
Gambar 2.1. Pisang Kepok Dan Kulit Pisang Kepok Kuning
2.1.3 Klasifikasi Pisang Kepok (Musa balbisiana)
Berikut adalah klasifikasi dari pisang kepok berdasarkan Herbarium Bogoriense: Jenis : Musa balbisiana (grup BBB)
8
Sehingga taksonomi dari Musa balbisiana berdasarkan United States Department of Agriculture (USDA) adalah:
Kerajaan : Plantae
Subkerajaan : Tracheobionta
Superdivisi : Spermatophyta
Musa balbisiana tersebar dari India termasuk Kepulauan Andam hingga Myanmar utara (Burma), Thailand dan Indocina ke Cina Selatan dan Filipina. Musa balbisiana merupakan salah satu spesies yang berasal dari Indocina (OECD, 2010).
Menurut Cahyono (2009) pisang kepok memiliki banyak jenis, namun yang terkenal adalah pisang kepok kuning dan kepok putih. Daging buah pisang kepok kuning berwarna kuning sedangkan kepok putih berwarna putih. Daging buahnya bertekstur agak keras. Pisang kepok kuning memiliki rasa yang lebih manis dan enak dibandingkan kepok putih. Buah pisang kepok tidak beraroma harum. Kulit buah pisang kepok sangat tebal, pada buah yang sudah masak berwarna hijau kekuningan. Dalam satu tandan bisa terdapat hingga 16 sisir dan pada setiap sisirnya terdapat hingga 20 pisang, berat setiap tandannya sekitar 14-22 kg. Buah pisang kepok cocok untuk disantap dalam bentuk olahan makanan.
2.1.4. Kandungan Kimia Kulit Pisang
(leusin, valin, fenilalanin dan treonin) dan mikronutrien (K, P, Ca, Mg). Kulit pisang juga merupakan sumber yang baik dari lignin (6-12%), pektin (10-21%), selulosa (7,6-9,6%), hemiselulosa (6,4-9,4%) dan asam galakturonat. Pektin yang diekstrak dari kulit pisang juga mengandung glukosa, galaktosa, arabinosa, rhamnosa, dan xilosa. Mikronutrien (Fe dan Zn) ditemukan dalam konsentrasi tinggi pada kulit dibandingkan pada pulp. Sehingga, kulit bisa menjadi bahan pakan yang baik untuk ternak dan unggas. Kulit pisang juga dapat digunakan dalam minuman anggur, produksi etanol, sebagai substrat untuk produksi biogas dan sebagai bahan dasar untuk ekstraksi pektin. Abu kulit pisang dapat digunakan sebagai pupuk untuk tanaman pisang dan sebagai sumber alkali untuk produksi sabun (Mohapatra, et al., 2010).
Tabel 2.1 Data komposisi tiap 100 gr kulit pisang kepok
Komponen Gram
Polisakarida non selulosa dapat larut 4.29 Polisakarida non selulosa tak dapat larut 0.61
Lignin 1.23
Fiber (serat) 6.75
Sumber : Kundarto, 2004
2.2. Bioetanol
dan oligosakarida dapat dilakukan dengan dua cara yaitu hidrolisis asam dan hidrolisis enzim. Proses hidrolisis asam dapat menggunakan be
yang sudah banyak diteliti, antara lain HCl, H
secara enzimatik terdiri dari dua tahap yaitu liquifikasi de
sakarifikasi menggunakan aminoglikosidase. Reaksi yang terjadi pada proses produksi etanol secara sederhana dibagi menjadi dua tahap yaitu (1) pemecahan komponen polisakarida menjadi komponen monosakarida (pemecahan sempurna) dan komponen oligosakarida yang dapat dilak
kimiawi. Proses pemecahan tahap pertama ditunjukkan pada persamaan reaksi 1. H2O + (C
(2) pengubahan komponen monomer glukosa mejadi etanol yang dilakukan dengan bantuan agen mikroba.
paling efektif adalah jenis khamir spesies
glukosa menjadi senyawa etanol ditunjukkan pada persamaan reaksi 2 (Wirahadikusumah 1985).
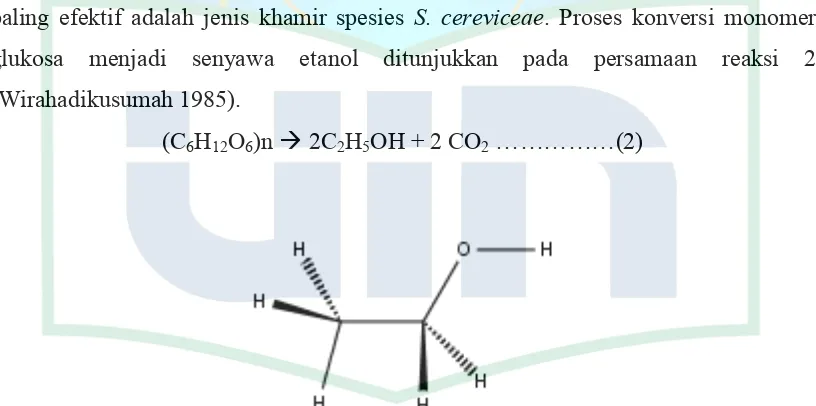
(C6H12
Gambar 2.2. Rumus Bangun Bioetanol
Purwadi (2006), membagi kualitas alko 1. Alkohol Teknis (96,5%)
Digunakan terutama untuk kepentingan industri sebagai bahan pelarut organik, bahan baku maupun bahan antara produksi berbagai senyawa organik lainnya. dan oligosakarida dapat dilakukan dengan dua cara yaitu hidrolisis asam dan hidrolisis enzim. Proses hidrolisis asam dapat menggunakan beberapa jenis asam yang sudah banyak diteliti, antara lain HCl, H2SO4, dan HNO3. Proses hidrolisis pati
secara enzimatik terdiri dari dua tahap yaitu liquifikasi dengan α
menggunakan aminoglikosidase. Reaksi yang terjadi pada proses produksi etanol secara sederhana dibagi menjadi dua tahap yaitu (1) pemecahan komponen polisakarida menjadi komponen monosakarida (pemecahan sempurna) dan komponen oligosakarida yang dapat dilakukan secara enzimatis maupun secara kimiawi. Proses pemecahan tahap pertama ditunjukkan pada persamaan reaksi 1.
O + (C6H10O5)n n C6H12O6 + n H2O ….. (1)
(2) pengubahan komponen monomer glukosa mejadi etanol yang dilakukan dengan Mikroba pengubah monomer glukosa menjadi etanol yang paling efektif adalah jenis khamir spesies S. cereviceae. Proses konversi monomer glukosa menjadi senyawa etanol ditunjukkan pada persamaan reaksi 2
1985).
12O6)n 2C2H5OH + 2 CO2 ………(2)
Sumber : Koleksi Pribadi
Gambar 2.2. Rumus Bangun Bioetanol
Purwadi (2006), membagi kualitas alkohol dengan beberapa tingkatan : Alkohol Teknis (96,5%)
Digunakan terutama untuk kepentingan industri sebagai bahan pelarut organik, bahan baku maupun bahan antara produksi berbagai senyawa organik lainnya.
10
dan oligosakarida dapat dilakukan dengan dua cara yaitu hidrolisis asam dan berapa jenis asam . Proses hidrolisis pati ngan α–amilase dan menggunakan aminoglikosidase. Reaksi yang terjadi pada proses produksi etanol secara sederhana dibagi menjadi dua tahap yaitu (1) pemecahan komponen polisakarida menjadi komponen monosakarida (pemecahan sempurna) dan ukan secara enzimatis maupun secara kimiawi. Proses pemecahan tahap pertama ditunjukkan pada persamaan reaksi 1.
(2) pengubahan komponen monomer glukosa mejadi etanol yang dilakukan dengan pengubah monomer glukosa menjadi etanol yang . Proses konversi monomer glukosa menjadi senyawa etanol ditunjukkan pada persamaan reaksi 2
hol dengan beberapa tingkatan :
2. Alkohol Murni (96,0 – 96,5%)
Digunakan terutama untuk kepentingan farmasi dan konsumsi misal untuk minuman keras.
3. Alkohol Absolut ( 99,7 – 99,8%)
Digunakan dalam pembuatan sejumlah besar obat-obatan dan juga sebagai bahan antara dalam pembuatan senyawa-senyawa lain skala laboratorium. Alkohol jenis ini disebut Fuel Grade Ethanol (F.G.E) atau anhydrous ethanol yaitu etanol yang bebas air atau hanya mengandung air minimal.
Bioetanol bersifat multi-guna karena dicampur dengan bensin pada komposisi berapapun memberikan dampak yang positif. Berikut kelebihan-kelebihan bioetanol dibandingkan bensin:
a) Bioetanol aman digunakan sebagai bahan bakar, titik nyala etanol tiga kali lebih tinggi dibandingkan bensin.
b) Emisi hidrokarbon lebih sedikit.
Kekurangan-kekurangan bioetanol dibandingkan bensin:
a) Pada mesin dingin lebih sulit melakukan starter bila menggunakan bioetanol. b) Bioetanol bereaksi dengan logam seperti magnesium dan aluminium.
Produksi bioetanol (alkohol) dengan bahan baku tanaman yang mengandung pati atau karbohidrat, dilakukan melalui proses konversi karbohidrat menjadi gula (glukosa) larut air. Sebagai alternatif digunakan campuran bioetanol dengan bensin. Sebelum dicampur, bioetanol harus dimurnikan hingga 100%. Campuran ini dikenal dengan sebutan gasohol (Skadrongautama, 2009).
12
Bahan berselulosa misalnya kayu, jerami, batang pisang, bagas dan lain-lain (Susmiati, 2010).
Secara biokimia, proses pembentukan etanol didahului dengan proses glikolisis yaitu proses perubahan satu molekul glukosa menjadi dua molekul piruvat. Proses glikolisis secara garis besar dibagi menjadi dua bagian :
1. Proses pemakaian energi. Di dalam tahap persiapan ini, glukosa mengalami proses fosforilasi dan pemecahan menjadi dua molekul triosa yaitu gliseraldehid-3-fosfat. Proses ini mengkonsumsi 2 ATP.
2. Proses pembentukan energi. Dua molekul gliseraldehid-3-fosfat akan dikonversi menjadi piruvat yang disertai dengan pembentukan 4 ATP.
Respirasi terhenti dalam keadaan tanpa oksigen karena proses pengangkutan elektron yang dirangkaikan dengan fosforilasi bersifat oksidasi melalui rantai pernafasan yang menggunakan molekul oksigen sebagai penerima elektron terakhir tidak berjalan. Akibatnya jalan metabolisme lingkar asam trikarboksilat (daur krebs) akan terhenti pula sehingga piruvat tidak lagi masuk ke dalam daur krebs melainkan dialihkan pemakaiannya yaitu diubah menjadi etanol (Wirahadikusumah, 1985).
Sumber : Wirahadikusumah, 1985
Khamir memproduksi etanol dan CO2 melalui dua reaksi yang berurutan.
1. Proses dekarboksilasi piruvat menjadi asetaldehid dan CO2 dengan katalis
piruvat dekarboksilase (enzim ini tidak ada di binatang). Proses dekaboksilasi merupakan reaksi yang tidak reversibel membutuhkan ion Mg2+ dan koenzim tiamin pirofosfat. Reaksi berlangsung melalui beberapa senyawa antara yang terikat secara kovalen pada koenzim.
2. Reduksi asetaldehid menjadi etanol oleh NADH dengan dikatalisis oleh alkohol dehidrogenase, dengan demikian pembentukan NAD+ akan digunakan
di dalam proses reaksi GADPH glikolisis (Voet et al, 2006).
Tabel 2.2. Sifat Fisika Etanol
Parameter Komposisi Dapat larut dalam air dan eter Memiliki bau yang khas
Sumber : Perry (1999)
Etanol memiliki berat jenis sebesar 0,7937 g/ml (15oC) dan titik didih sebesar
78,32oC pada tekanan 760 mmHg. Etanol larut dalam air dan eter dan mempunyai
panas pembakaran 328 Kkal dan fermentasi etanol membutuhkan waktu 30-72 jam (Paturau, 1981 dalam Juara, 2011). Prescott dan Dunn (1981) menyatakan bahwa waktu fermentasi etanol yang dibutuhkan adalah 3 hingga 7 hari. Frazier dan Westhoff (1978) menambahkan suhu optimum fermentasi adalah 25-30oC dengan
14
2.3. Hidrolisis Asam
Hidrolisis asam dapat dipergunakan untuk memecah komponen polisakarida menjadi monomer-monomernya. Proses hidrolisis yang sempurna akan memecah selulosa dan pati menjadi glukosa, sedangkan hemiselulosa akan terpecah menjadi pentosa dan heksosa. Asam sulfat (H2SO4) merupakan asam yang dapat digunakan
sebagai katalis asam selain asam klorida (HCl). Hidrolisis asam dikelompokkan menjadi dua yaitu hidrolisis asam pekat dengan konsentrasi tinggi dan hidrolisis asam encer dengan konsentrasi rendah (Taherzadeh & Karimi 2007).
Keuntungan hidrolisis menggunakan asam konsentrasi tinggi antara lain proses hidrolisis dapat dilakukan pada suhu yang rendah dan hasil gula yang didapatkan tinggi. Namun penggunaan asam konsentrasi tinggi mempunyai kelemahan antara lain jumlah asam yang digunakan sangat banyak, potensi korosi pada peralatan produksi terutama alat yang terbuat dari besi, penggunaan energi yang tinggi untuk proses daur ulang asam dan waktu reaksi yang lama yaitu berkisar antara dua hingga enam jam. Hidrolisis menggunakan asam dengan konsentrasi rendah mempunyai keuntungan antara lain jumlah asam yang digunakan sedikit dan waktu tinggal yang sebentar. Namun kerugian dalam penggunaan asam encer dengan konsentrasi rendah antara lain membutuhkan suhu tinggi dalam proses operasinya, gula yang didapatkan sedikit, potensi korosi pada peralatan produksi terutama alat yang terbuat dari besi dan pembentukan produk samping yang tidak diharapkan (Taherzadeh & Karimi 2007).
Hidrolisis asam dengan konsentrasi rendah dilakukan dalam dua tahap yaitu tahap pertama yang melibatkan asam encer untuk menghidrolisis gula dari golongan pentosa yang umumnya terdapat dalam fraksi hemiselulosa. Tahap ini biasanya menggunakan H2SO4 1% pada suhu 80oC-120oC selama 30-240 menit. Tahap kedua
menggunakan asam dengan konsentrasi yang lebih tinggi untuk menghidrolisis gula yang berasal golongan heksosa seperti selulosa biasanya dilakukan dengan konsentrasi asam 5-20% H2SO4 dengan suhu 180oC. Proses hidrolisis bertahap ini
Penentuan konsentrasi asam tergantung pada ukuran, bentuk dan kadar air pada partikel lignoselulosa. Asam sulfat biasanya digunakan pada bahan terlarut dengan konsentrasi tidak melebihi 10% berat (H2SO4 umum digunakan tidak lebih
dari 5%). Penggunaan katalis asam encer selalu terjadi penambahan air yang banyak pada bahan lignoselulosa dan hal itu membutuhkan energi panas yang lebih banyak selama proses pemanasan (Patent Cooperation Treaty, 1998).
Proses hidrolisis menggunakan konsentrasi asam encer, selain dapat menguraikan glukosa juga menghasilkan hasil samping yang dapat menghambat proses fermentasi. Hasil samping yang dapat menghambat proses fermentasi antara lain furfural, 5-hidroksimetilfurfural (HMF), asam lefulenat, asam asetat, asam format, asam uronat dan lain-lainnya (Taherzadeh & Karimi 2007).
Hidrolisis asam pada bahan lignoselulosa, hemiselulosa merupakan komponen yang paling mudah terhidrolisis oleh asam yang akan terdegradasi menjadi xilosa, manosa, asam asetat, galaktosa arabinosa dan sejumlah kecil rhamnosa, asam glukuronat, asam metil glukronat dan asam galakturonat (Morohoshi 1991; Sjӧstrӧm 1993). Selulosa akan terdegradasi menjadi glukosa. Xilosa akan terdegradasi menjadi furfural dan 5-hidroksimetilfurfural (HMF) pada kondisi suhu dan tekanan tinggi. Komponen fenol terbentuk dari lignin yang terpecah sebagian dan juga selama proses degradasi karbohidrat (Palmqvist & Hahn Hӓgerdal, 2000). Lignin merupakan komponen komplek yang tersusun oleh phenylpropane yang terikat di dalam struktur tiga dimensi. Ikatan kimia terjadi di antara lignin dan hemiselulosa bahkan terkadang juga dengan selulosa. Lignin sangat tahan terhadap reaksi kimia dan enzimatik (Taherzadeh 1999; Palmqvist & Hahn-Hӓgerdal 2000).
2.4. Karbohidrat
16
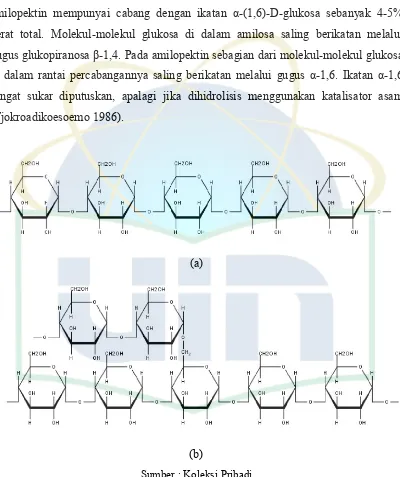
Pati terdiri dari dua fraksi yaitu fraksi amilosa dan amilopektin. Fraksi amilosa mempunyai struktur lurus dengan ikatan α-(1,4)-D-glukosa, sedangkan amilopektin mempunyai cabang dengan ikatan α-(1,6)-D-glukosa sebanyak 4-5% berat total. Molekul-molekul glukosa di dalam amilosa saling berikatan melalui gugus glukopiranosa β-1,4. Pada amilopektin sebagian dari molekul-molekul glukosa di dalam rantai percabangannya saling berikatan melalui gugus α-1,6. Ikatan α-1,6 sangat sukar diputuskan, apalagi jika dihidrolisis menggunakan katalisator asam (Tjokroadikoesoemo 1986).
(a)
(b)
Sumber : Koleksi Pribadi
Gambar 2.4. (a) Struktur Amilosa dan (b) Satruktur Amilopektin
dapat dicerna oleh manusia dan tidak larut dalam air. Selulosa pada tumbuhan terdapat di dalam dinding sel pelindung tanaman, terutama pada tangkai, batang, dahan, dan semua bagian berkayu dari jaringan tumbuhan. Komponen ini terdiri dari unit monomer D-glukosa yang terikat melaui ikatan β-1, 4-D-glukopiranosa. Struktur kimia selulosa berupa polisakarida linear yang tersusun dari pengulangan unit β-1, 4-D-glukopiranosa dan berasosiasi dengan hemiselulosa (Hayn et al. 1993.).
Selulosa dapat larut dalam asam pekat seperti H2SO4 72%. Asam tersebut
akan menghidrolisis selulosa menjadi glukosa. Peningkatan temperatur dan tekanan akan meningkatkan laju hidrolisis. Hidrolisis selulosa dapat dihambat oleh lignin dan hemiselulosa (Sjostrom 1994).
Hemiselulosa termasuk dalam kelompok polisakarida heterogen yang dibentuk melalui biosintetis yang berbeda dari selulosa. Berbeda dengan selulosa yang merupakan homopolisakarida. Hemiselulosa relatif mudah dihidrolisis dengan asam menjadi komponen-komponen monomernya yang terdiri dari glukosa, D-manosa, D-galaktosa, D-xilosa, dan sejumlah kecil L-ramnosa disamping menjadi asam D-glukuronat, asam 4-0-metil-glukuronat dan asam D-galakturonat (Sastrohamidjojo dan Prawirohatmodjo 1995)
Hemiselulosa merupakan polisakarida dengan bobot molekul lebih kecil dibandingkan selulosa. Molekul hemiselulosa lebih mudah menyerap air, bersifat plastis dan mempunyai permukaan kontak antar molekul lebih luas dibandingkan dengan selulosa (Judoamidjojo et al.1989). Ikatan di dalam rantai hemiselulosa banyak bercabang karena gugus β-glukosida di dalam molekul yang satu berikatan dengan gugus hidroksil C2, C3 dan C4 dari molekul yang lain. Berbeda dengan selulosa, hemiselulosa berbentuk amorf (Tjokroadikoesoemo 1986).
2.5. Fermentasi
18
mikroorganisme untuk bahan pangan. Oleh Louis Pasteur, fermentasi didefinisikan sebagai proses penguraian gula pada buah anggur menjadi gelembung-gelembung udara (CO2) oleh khamir yang terdapat pada cairan ekstrak buah anggur tersebut.
Fermentasi etanol yang juga biasa disebut fermentasi alkohol, adalah proses biologi dimana gula seperti glukosa, fruktosa, dan sukrosa dirubah menjadi energi selular dan menghasilkan etanol dan karbondioksida sebagai metabolit samping. Persamaan reaksi kimia pada fermentasi alkohol :
C6H12O6 2 C2H5OH + 2CO2 + 2 ATP (ΔG : 118 kJ per mol) atau
Gula Alkhol + Karbon Dioksida + Energi (ATP)
Fermentasi yang dilakukan dalam penelitian kali ini menggunakan
Saccharomyces cereviceae sebagai mikroorganisme yang berperan dalam mengubah 1 mol glukosa menjadi 2 mol etanol. Pada proses ini, Saccharomyces cereviceae akan memetabolisme glukosa membentuk asam piruvat melalui tahapan reaksi jalur Embden-Meyerhof-Parnas, sedangkan asam piruvat yang dihasilkan akan didekarboksilasi menjadi asetaldehida yang kemudian mengalami dehidrogenasi menjadi etanol (Roukas, 1996).
Prosesnya dimulai ketika satu molekul glukosa dipecah menjadi piruvat melalui proses glikolisis (jalur Embden-Meyerhof-Parnas) (Stryer, 1975).
C6H12O6 2CH3COCOO- + 2H+
Reaksi ini mengubah dua molekul NAD+ menjadi NADH dan menghasilkan 2 ATP serta 2 molekul air. Piruvat lalu diubah menjadi asetaldehid dan karbondioksida oleh enzim piruvat dekarboksilase dan menghasilkan tiamin difosfat sebagai kofaktor (Stryer, 1975).
CH3COCOO- + H+ CH3CHO + CO2
Setelah itu, asetaldehid direduksi oleh NADH yang dihasilkan dari glikolisis menjadi etanol.
CH3CHO + NADH C2H5OH + NAD+
diperoleh alkohol dengan kadar 10%, mikroba akan mengalami lisis karena pengaruh dari alkohol tersebut.
Proses fermentasi dapat digolongkan berdasarkan cara operasinya, yaitu sebagai berikut:
A. Proses Fermentasi Cair (Roukas, 1996)
Submerged fermentation adalah yang melibatkan air sebagai fase kontinyu dari sistem pertumbuhan sel bersangkutan atau substrat, baik sumber karbon maupun mineral terlarut atau tersuspensi sebagai partikel-partikel dalam fase cair.
Fermentasi cair dengan teknik tradisional tidak dilakukan pengadukan, berbeda dengan tenik fermentasi cair modern melibatkan fermentor yang dilengkapi dengan : pengadukan (agar medium tetap homogen), aerasi, pengaturan suhu (pendinginan dan pemanasan) dan pengaturan pH.
Fermentasi ini dapat dibagi menjadi 3 macam :
1) Batch process, yaitu fermentasi dengan cara memasukkan media dan inokulum secara bersamaan ke dalam bioreaktor dan pengambilan produk dilakukan pada akhir fermentasi. Pada sistem batch, bahan media dan inokulum dalam waktu yang hampir bersamaan dimasukkan ke dalam bioreaktor. Pada saat proses berlangsung, akan terjadi perubahan kondisi dalam bioreaktor (nutrient akan berkurang sedangkan produk serta limbah bertambah), hingga pada suatu keadaan tertentu (sesuai keadaan yang diinginkan). Untuk proses fermentasi yang baru, maka bioreaktor harus dikosongkan.
2) Feed batch process, yaitu fermentasi dengan cara memasukkan sebagian sumber nutrisi ke dalam bioreaktor dengan volume tertentu hingga diperoleh produk yang mendekati maksimal, akan tetapi konsentrasi sumber nutrisi dibuat konstan.
20
B. Fermentasi Padat (Solid State fermentation)
Fermentasi media padat merupakan proses fermentasi yang berlangsung dalam substrat tidak larut, namun mengandung air yang cukup sekalipun tidak mengalir bebas. Solid state fermentation mempunyai kandungan nutrisi per volume jauh lebih pekat sehingga hasil per volume dapat lebih besar.
Keuntungan fermentasi dengan cara ini adalah : 1. Medium yang digunakan relatif sederhana
2. Ruang yang diperlukan untuk peralatan fermentasi relatif kecil, karena air yang digunakan sedikit
3. Inokulum dapat disisapkan secara sederhana
4. Kondisi medium tempat pertumbuhan mikroba mendekati kondisi habitat alaminya
5. Aerasi dihasilkan dengan mudah karena ada ruang di antara setiap partikel substratnya
6. Produk yang dihasilkan dapat dipanen dengan mudah
Menurut Budiyanto (2003) dalam Rusdianto, untuk mendapatkan hasil fermentasi yang optimum perlu diperlihatkan hal-hal berikut:
1 Kadar gula yang terlalu tinggi akan menghambat aktivitas khamir. Konsentrasi gula yang optimum untuk menghasilkan kadar etanol yang optimum adalah 14-18 %.
2 Suhu yang baik untuk fermentasi adalah dibawah 300C. semakin rendah suhu fermentasi, maka semakin tinggi kadar etanol yang dihasilkannya. Hal ini dikarenakan pada suhu rendah CO2 lebih sedikit yang dihasilkan.
2.6. Saccharomyces sereviceae
Saccharomyces sereviceae di Indonesia lebih dikenal dengan nama jamur ragi. Jamur ini merupakan jamur yang sangat dibutuhkan untuk membuat roti dan bir sejak zaman kuno. Ini adalah mikroorganisme yang berperan di belakang fermentasi. Mikroorganisme ini berasal dari golongan khamir yang mampu memfermentasi glukosa, maka dimanfaatkan untuk memproduksi bioetanol (Rusdianto, 2010).
2.6.1. Taksonomi Saccharomyces sereviceae
Saccharomyces cereviceae merupakan suatu khamir sel tunggal (unicellular) yang berukuran 5-10 μm, berbentuk bulat, silindris, atau oval. S. cereviceae
digunakan untuk produksi etanol pada kondisi anaerob. Klasifikasi S. cereviceae adalah sebagai berikut (Rusdianto, 2010) :
Kingdom : Fungi
Spesies : Saccharomyces cereviceae
2.6.2. Morfologi Saccharomyces sereviceae
Saccharomyces sereviceae merupakan khamir atau fungi uniseluler golongan eukariot. Mikroorganisme ini berbentuk bulat atau oval dengan diameter 5-20 mikrometer dan berultifikasi membentuk bud yang setelah dewasa akan pecah menjadi sel induk (Haetami dkk, 2008). Strukturnya mempunyai dinding polisakarida tebal yang menutup protoplasma. Ciri umum Saccharomyces sereviceae yaitu tidak mempunyai hifa dan tubuh buah.
22
khamir dipengaruhi oleh keadaan lingkungan serta jumlah nutrisi yang tersedia bagi pertumbuhan sel (Mandels, 1970).
2.6.3. Fisiologi Saccharomyces sereviceae
Semua galur dari S. cereviceae dapat tumbuh secara aerobik di dalam media glukosa, maltosa dan trehalosa namun tidak dapat hidup di dalam laktosa dan selobiosa. Kemampuan untuk hidup dan menggunakan berbagai jenis gula akan berbeda-beda yang dipengaruhi oleh kondisi aerobik atau anaerobik, beberapa galur tidak dapat tumbuh secara anaerobik di media sukrosa dan trehalosa. Semua galur dari S. cereviceae dapat menggunakan amonia dan urea sebagai sumber nitrogen tetapi tidak dapat menggunakan nitrat karena ketidakmampuannya untuk mereduksi menjadi ion amoniak. Khamir selain membutuhkan unsur nitrogen juga memerlukan unsur fosfor dan unsur logam seperti magnesium, besi, kalsium dan seng untuk pertumbuhannya .
Untuk dapat bertahan hidup, S. cereviceae membutuhkan nutrien yang diperoleh dari medium perkembangbiakkannya seperti (NH4)2SO4,
MgSO4.7H2O, KCl, CaCl2, P3(PO4)5, ekstrak ragi, air, dan glukosa. S.
cereviceae merupakan mikroorganisme yang dapat dikultivasi pada kondisi aerobik dan anaerobik, produk yang dihasilkan pada kedua kondisi tersebut berbeda. S. cereviceae pada kondisi aerobik akan menghasilkan individu baru, sedangkan pada kondisi anaerobik dihasilkan produk utama yang dapat berupa etanol dimana hasilnya tergantung pada konsentrasi awal biomassa. Konsentrasi gula yang baik untuk fermentasi menggunakan khamir adalah diantara 10-18% dengan pH bahan 4-5 dan waktu yang digunakan biasanya 30-72 jam (Rusdianto, 2010).
2.7. Kromatografi Gas
fase gerak. Sebagai fase diam dapat digunakan zat cair atau zat padat sedangkan fase geraknya dapat berupa gas atau zat cair (Hendayana dkk, 2000). Contoh sampel diinjeksikan ke dalam kromatografi gas yang dilengkapi dengan kolom gelas non polar metil silikon. Gas pembawa helium kemudian mengangkut uap bahan tersebut menerobos kolom sehingga komponen-komponenya terpisah oleh proses kromatografik. Komponen yang terbawa kemudian akan terdeteksi oleh detektor nyala pengion dan sinyal detektor diolah oleh suatu sistem akuisisi data elektronik. Komponen-komponen pada cairan terdeteksi dengan waktu retensinya sedangkan konsentrasi setiap komponen diketahui melalui luas puncak kromatogram (Prihandana dkk, 2007).
2.8. Spektrofotometri UV-Vis
Spektrofotometri UV-Vis adalah alat yang digunakan untuk mengukur serapan yang dihasilkan dari interaksi kimia antara radiasi elektromagnetik dengan molekul atau atom dari suatu zat kimia pada daerah ultraviolet (200-400 nm) dan sinar tampak (400-800 nm).
Spektrofotometer yang sesuai untuk pengukuran di daerah spektrum ultraviolet dan cahaya tampak terdiri dari suatu sistem optik dengan kemampuan menghasilkan cahaya monokromatik dalam jangkauan 200 nm hingga 800 nm dan suatu alat yang sesuai untuk menetapkan serapan. Kedua sel yang digunakan untuk larutan yang diperiksa dan larutan pembanding harus mempunyai karakteristik spektrum yang sama. Bila digunakan instrumen bekas ganda dengan perekam, sel yang berisi pelarut ditempatkan pada jalur berkas pembanding.
Jika tidak dinyatakan lain, serapan diukur pada panjang gelombang yang ditetapkan dengan menggunakan kuvet yang panjangnya 1 cm pada suhu 19oC hingga
20oC. Jika hal tersebut tidak sesuai untuk instrumen tertentu, panjang kuvet dapat
24
sebagai pembanding. Dalam hal tertentu, pengukuran dilakukan terhadap suatu campuran pereaksi sebagai pembanding.
BAB 3
METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian akan dilaksanakan di Badan Penelitian Tanaman Obat dan Aromatik (BALITRO), Laboratorium Penelitian 1, Laboratorium Steril, Laboratorium Penelitian 2 dan Laboratorium Farmakognosi dan Fitokimia Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta. Waktu penelitian dimulai pada bulan November 2014 sampai dengan April 2015.
3.2. Alat dan Bahan 3.2.1. Alat
Alat yang digunakan dalam penelitian ini antara lain: grinder, timbangan analitik (AND GX-200), labu erlenmeyer (Scott Duran), beacker glass (Scott Duran), gelas ukur (Scott Duran), corong (Scott Duran), tabung reaksi (Scott Duran), spatula, batang pengaduk, pipet tetes, seperangkat alat destilasi, cawan porselen, spatel, pH-meter digital (HORBA), inkubator, soxlet, centrifuge (Eppendorf Centrifuge 5417 R), oven, autoklaf (Ogawa Seiki), pisau, Hotplate-Magnetik Stirrer (Wiggen Hauser), spektroskopi Uv-Vis (Hitachi U-2910), dan GC-MS (Agilent Technologies 7890A).
3.2.2. Bahan
Sampel tumbuhan yang digunakan dalam penelitian ini adalah limbah kulit pisang kepok kuning (Musa balbisiana L) yang diperoleh dari pengolah pisang yang berada di daerah Ciputat dimana pisang tersebut disuplai dari Cilawu, Garut. Selanjutnya, sampel dideterminasi di Herbarium Bogoriense, LIPI, Cibinong, Bogor.
Mikroorganisme yang digunakan untuk fermentasi etanol adalah
Saccharomyces cereviceae dalam bentuk dry baker yeast komersial. Bahan yang
26
Somogiy, H2SO4, etanol (pa), Metanol, HCl, selenium, CuSO4.5H2O, Na2SO4,
CH3COOH dan etanol 70%.
3.3. Prosedur Kerja
3.3.1. Penyiapan Sampel
Limbah kulit pisang kepok yang diperoleh dari pengolah pisang di daerah Ciputat yang disuplai dari Cilawu, Garut, diambil dalam keadaan segar pada bulan November 2014. Sampel disortasi basah, selanjutnya dicuci dan dipotong menjadi bagian yang lebih kecil untuk menghindari pembusukan dan mempercepat pengeringan. Selanjutnya sampel dikeringkan dengan menggunakan blower suhu 500C yang dilakukan di BALITRO, Bogor. Pengeringan dilakukan sampai kadar air
nya 8,90%. Sampel dihaluskan dan dihitung rendemennya.
Rendemen =Bobot total sampel basah x 100%Bobot total tepung
3.3.2. Karakteristik Tepung Kulit Pisang Kepok 3.3.2.1. Kadar Air (SNI 01-2891-1992)
Panaskan botol timbang pada oven pada suhu 1050C selama 1 jam.
Dinginkan di dalam desikator selama ½ jam. Timbang dan catat bobotnya. Timbang sampel sebanyak 1 g pada botol timbang tertutup yang telah diketahui bobot konstannya. Panaskan dalam oven pada suhu 1050C selama 3 jam.
Kemudian didinginkan di dalam desikator selama ½ jam. Timbang botol timbang yang berisi sampel tersebut. Ulangi pemanasan dan penimbangan hingga diperoleh bobot konstan. Perhitungan kadar air dilakukan dengan menggunakan rumus :
3.3.2.2. Kadar Abu (SNI 01-2891-1992)
Timbang dengan seksama 2 g sampel ke dalam cawan porselen yang telah diketahui bobotnya. Arangkan di atas nyala pembakar, lalu diabukan di dalam tanur listrik pada suhu maksimum 5500C sampai pengabuan sempurna.
Dinginkan di dalam desikator lalu timbang sampai bobot tetap. Perhitungan kadar abu dilakukan dengan menggunakan rumus :
Kadar Abu (%) = Berat sampel (g) x 100%Berat abu (g)
3.3.2.3. Kadar Lemak (SNI 01-2891-1992)
Timbang dengan seksama 1 g sampel, masukkan ke dalam selongsong kertas yang dilapisi kapas. Sumbat selongsong kertas yang berisi sampel tersebut dengan kapas. Keringkan di dalam oven pada suhu 800C selama 1
jam, kemudian masukkan ke dalam alat soxlet yang dihubungkan dengan labu lemak yang telah dikeringkan dan diketahui bobotnya (timbang labu sebelum dipakai). Ekstraksi dengan heksan selama 6 jam. Suling heksan dan keringkan ekstrak lemak di dalam oven pada suhu 1050C. Dinginkan di dalam desikator
dan timbang. Ulangi hingga tercapai berat konstan.
Kadar Lemak (%b/b) =Bobot sampel x 100% Bobot lemak
3.3.2.4. Kadar Protein (SNI 01-2891-1992)
Timbang dengan seksama 0,51 g sampel, masukkan ke dalam labu kjeldahl 100 mL. Tambahkan 2 g campuran selenium (selenium 4 g + CuSO4.
5H2O 3 g + Na2SO4 190 g) dan 25 mL H2SO4 pekat. Panaskan di atas
28
indikator fenolftalein. Suling selama 10 menit. Tambahkan 10 mL asam borat 2%yang telah dicampur indikator BCG-MR (campuran bromcresol green dan
methyl red) di dalam penampungan. Larutan sampel dititrasi dengan HCl 0,01
N hingga berwarna merah muda. Kerjakan penetapan blanko. Penetapan kadar N dan kadar protein dilakukan dengan persamaan berikut:
Kadar Protein = (V1 − V2)x N HCl x 0,014 x k x fpW x 100%
Keterangan :
W = Bobot cuplikan
V1 = Volume HCl 0,01 N yang digunakan untuk penitaran sampel V2 = Volume HCl yang dipergunakan untuk penitaran blanko N = Normalitas larutan HCl
Fk = Faktor konversi protein Fp = Faktor pengenceran
3.3.2.5. Kadar Serat Kasar (SNI 01-2891-1992)
Sampel sebanyak 4 g dimasukan ke dalam erlenmeyer 500 mL kemudian ditambahkan 100 mL H2SO4 1,25% dan dididihkan selama 30
menit. Ditambahkan lagi 50 mL NaOH 1,25 N dan dididihkan selama 30 menit. Dalam keadaan panas disaring dengan corong buchner yang berisi kertas saring tak berabu Whatman No.41 setelah diketahui bobot keringnya. Cuci endapan yang terdapat pada kertas saring berturut-turut dengan air panas, H2SO4 1,25% dan etanol 96%. Kemudian dikeringkan di dalam oven bersuhu
105oC sampai bobotnya konstan. Kertas saring didinginkan dalam desikator
dan ditimbang.
3.3.2.6. Analisa Kadar Pati (SNI 01-2891-1992)
Timbang dengan seksama 5 gr sampel ke dalam erlenmeyer 500 mL. Tambahkan 200 mL larutan HCl 3% didihkan selama 3 jam. Dinginkan dan netralkan dengan NaOH 30% dan tambahkan sedikit CH3COOH 3% agar
suasana sedikit asam. Pindahkan isinya ke dalam labu ukur 500 mL dan impitkan hingga tanda batas dan disaring. Pipet 10 mL hasil saringan ke dalam erlenmeyer 500 mL, tambahkan 25 mL larutan Luff (dengan pipet) dan beberapa butir batu didih serta 15 mL air suling. Panaskan campuran tersebut dengan nyala yang tetap. Usahakan agar larutan dapat mendidih dalam waktu 3 menit. Didihkan terus selama 10 menit dihitung dari saat mulai mendidih. Kemudian dinginkan dalam bak yang berisi es. Setelah dingin tambahkan 15 mL larutan KI 20%, dan 25 mL H2SO4 25% perlahan-lahan. Titer secepatnya
dengan larutan tiosulfat 0,1 N (gunakan larutan indikator amilum 0,5%). Kerjakan juga blanko.
Kadar karbohidrat sebagai pati =Mg gula x Ntio 10000,1 x fpx 100% x 0,9
Ws = Bobot cuplikan (mg)
Mg gula = Glukosa yang terkandung untuk mL tio yang dipergunakan (mg) Fp = Faktor pengenceran
3.3.3. Hidrolisi Asam
3.3.3.1. Pengaruh Variasi Waktu Hidrolisis Dan Konsentrasi Asam
Metode hidrolisis yang digunakan merupakan hasil modifikasi metode hidrolisis yang dipergunakan oleh Retno dan Nuri (2011). Sebanyak 50 g tepung kulit pisang yang telah halus dilarutkan menggunakan H2SO4 dengan
variasi konsentrasi 0,2 N, 0,5 N, dan 0,8 N (1:10 b/v) dan diautoklaf pada suhu 1000C dengan variasi lama hidrolisis yaitu 120 menit, 150 menit, dan
30
N. Kadar gula pereduksi diukur dengan menggunakan metode Nelson
Somogiy.
3.3.3.2. Perhitungan Gula Pereduksi Dengan Metode Nelson Somogiy
Larutan standar dibuat dengan menimbang 100 mg glukosa yang dilarutkan dalam 100 mL akuades (1000 ppm). Dari larutan glukosa standar tersebut dilakukan pengenceran sehingga diperoleh larutan glukosa dengan konsentrasi 4, 8, 12, 16, dan 20 ppm. Sebanyak 5 tabung reaksi disiapkan dan masing-masing diisi dengan 1 mL larutan glukosa standar tersebut dan disiapkan 1 tabung yang berisi aquadest sebagai blanko. Masing-masing tabung ditambahkan 1 mL pereaksi Nelson dan dipanaskan semua tabung pada penangas air mendidih selama 20 menit. Semua tabung diambil dan didinginkan dalam beaker glass yang berisi air. Tabung yang telah dingin, ditambahkan 1 mL pereaksi arsenmolibdat dan digojog sampai endapan Cu2O yang ada larut kembali. Setelah semua endapan
Cu2O larut sempurna, tambahkan 7 mL aquadest digojog hingga homogen.
Masing-masing larutan diukur absorbansinya pada panjang gelombang 746 nm. Kurva standar yang dibuat menunjukkan hubungan antara absorbansi dan konsentrasi glukosa (Nasrullah, 2009).
Penentuan gula pereduksi pada sampel dilakukan dengan mengambil 1 mL sampel yang telah diencerkan ke dalam tabung reaksi. Kemudian sampel tersebut ditambahkan 1 mL pereaksi Nelson dan selanjutnya diperlakukan seperti pada penyiapan kurva standar di atas. Jumlah gula pereduksi dapat ditentukan berdasarkan nilai absorbansi larutan sampel dan kurva standar larutan glukosa (Sudarmaadji dkk, 1997).
3.3.4. Fermentasi Bioetanol
3.3.4.1. Persiapan Media Fermentasi
penyaringan dan sentrifugasi. Proses penyaringan dilakukan menggunakan kertas saring yang berfungsi untuk memisahkan ampas yang berukuran besar. Larutan hasil penyaringan kemudian diadjust pH dengan NaOH 0,1 N dan 1 N hingga mencapai pH 4,1. Kemudian dilanjutkan dengan proses sentrifugasi untuk mengurangi jumlah padatan terlarut dan kelebihan garam yang terbentuk dari proses netralisasi. Proses sentrifugasi dilakukan pada kecepatan 2.500 rpm selama 5 menit sehingga dihasilkan dua produk yaitu endapan dan filtrat. Filtrat digunakan sebagai media fermentasi etanol sedangkan endapan tidak digunakan (Rusdianto, 2010).
3.3.4.2. Fermentasi Bioetanol
Fermentasi dilakukan dengan menambahkan Saccharomyces
cereviceae dalam bentuk dry baker yeast komersial (ragi roti) dan sumber
nutrisi berupa pupuk NPK. Jumlah NPK yang ditambahkan sebanyak 0,06% total gula pereduksi dan ragi roti sebanyak 0,23% total gula pereduksi (Rusdianto, 2010). Sampel kemudian diletakkan pada inkubator pengaduk pada suhu 25oC dan diaduk pada 180 rpm dilakukan dengan variasi waktu 1,2,3,4,5 hari (Daniel et al, 2012). Hasil fermentasi yang didapatkan, kemudian dilanjutkan dengan proses destilasi.
Cairan hasil fermentasi kemudian dilakukan destilasi bertingkat menggunakan suhu 800C, 700C, dan 600C untuk memisahkan produk utama yang berupa etanol dan cairan sisa destilasi sebagai produk samping akhir proses destilasi. Parameter yang diamati pada akhir fermentasi antara lain analisis kadar bioetanol, rendemen bioetanol dan struktur bioetanol dengan menggunakan GC-MS.
3.3.5. Analisis Bioetanol
3.3.5.1. Analisis Kadar Bioetanol Metode Berat Jenis
32
aquadest, didinginkan pada suhu 150C dan ditimbang. Lakukan hal yang
sama pada sampel dengan mengganti aquadest dengan cairan hasil destilasi (Mardoni dan Tjandrawati, 2005).
Perhitungan berat jenis bioetanol :
(Berat piknometer kosong + Sampel) – Berat Piknometer Kosong (Berat piknometer kosong + aquades) – Berat Piknometer Kosong
Berat jenis yang terukur dikonversikan pada tabel konversi berat jenis etanol pada suhu 150C.
3.3.5.2. Rendemen Bioetanol (% v/b)
Rendemen bioetanol dihitung menggunakan persamaan sebagai berikut :
Rendemen Bioetanol =Berat kulit pisang kering (g) x100%Volume bioetanol (mL)
3.3.5.3. Analisis Struktur Bioetanol
Setelah dilakukan pemurnian, selanjutnya analisis struktur dilakukan dengan menggunakan GC-MS. Kolom yang digunakan adalah HP-5MS (30 m x 0,25 mm ID x 0,25 µM). Suhu awal 380C selama 5 menit. Suhu kedua
600C/menit. Suhu akhir 2000C/menit. Rasio split 10 : 1 dan larutan sampel
4.1. Penyiapan Sampel
Determinasi dari suatu tanaman bertujuan untuk mengetahui kebenaran identitas tanaman tersebut. Dengan demikian kesalahan dalam pengumpulan bahan yang akan diteliti dapat dihindari (Shiddiq, 2011). Dari hasil determinasi yang dilakukan di Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong, Bogor, tanaman yang diteliti merupakan kulit pisang kepok jenis Musa balbisiana BBB (Lampiran 1).
Kulit pisang yang digunakan untuk pembuatan bioetanol ini merupakan limbah yang diambil dari pengolah kripik pisang. Kulit pisang kepok yang dipilih tidak terlalu matang, karena diperkirakan kulit pisang yang matang mengandung pati yang lebih sedikit. Berdasarkan hasil penelitian Kundarto (2004), kriteria kulit pisang kepok yang paling baik dijadikan sebagai sumber pembuatan bioetanol adalah kulit pisang kepok kuning yang masih setengah matang. Bagian dalam kulit pisangnya masih tebal. Sehingga diperkirakan kandungan patinya masih tinggi.
Kulit pisang kepok yang telah terkumpul dibersihkan dari kotoran yang melekat dengan menggunakan air mengalir dan kemudian dirajang kecil-kecil. Pengeringan
yang dilakukan dengan menggunakan blower suhu 500C yang berlangsung selama 5
34
(a) (b)
Sumber : Koleksi pribadi
Gambar 4.1. (a) Limbah kulit pisang segar. (b) Tepung limbah kulit pisang
4.2. Karakterisasi Tepung Limbah Kulit Pisang Kepok Kuning
Karakterisasi tepung limbah kulit pisang kepok ini bertujuan untuk melihat karakteristik proksimat tepung limbah kulit pisang kepok kuning yang diambil dari daerah Cilawu, Garut meliputi nilai kandungan nutrisinya serta melihat korelasinya terhadap bioetanol yang dihasilkan. Ada 6 komponen yang perlu dikarakterisasi, diantaranya kadar air, kadar abu, kadar lemak, kadar protein, kadar serat kasar dan kadar pati.
Tabel 4.1. Karakteristik Tepung Limbah Kulit Pisang Kepok Komponen Tepung Kulit Pisang Kepok
36
Kadar abu, lemak dan protein digunakan untuk menilai kandungan nutrisi dari kulit pisang kepok. Kadar abu dalam bahan menggambarkan kandungan
mineral-mineral anorganik sisa pembakaran bahan organik pada suhu 5500C (Apriyantono et
al. 1988 dalam Maulidya 2011). Kadar abu total dalam tepung kulit pisang kepok sebanyak 0,97%. Nilai ini lebih rendah dari kadar abu kulit pisang kepok yang dilakukan oleh Dewati (2008) yaitu sekitar 1,03%.
Selain itu, kadar lemak dan protein berturut-turut sebanyak 11,47% dan 6,21%. Kadar lemak dan protein berpengaruh terhadap karakteristik gelatinasi dan kekentalan bahan. Adanya lemak pada bahan berpati dapat mengganggu proses gelatinasi karena lemak dapat membentuk kompleks dengan amilosa sehingga menghambat keluarnya amilosa dari granula pati. Sedangkan protein dapat menyebabkan kekentalan pati menurun (Mohamed dan Duarteb, 2003 dalam Juara 2011). Leach (1965) dalam Richana dan Sunarti (2004) menyatakan bahwa protein dan pati akan membentuk kompleks dengan permukaan granula dan menyebabkan viskositas pati menurun, dan berakibat pada rendahnya kekuatan gel.
Bila kita bandingkan dengan hasil yang didapatkan oleh Kundarto (2011), kadar lemak diperoleh pada penelitian ini jauh lebih besar dibandingkan dengan hasil Kundarto yaitu sebesar 1,84%. Hal ini menunjukkan proses gelatinasi yang terjadi akan lebih buruk karena kadar lemak yang jauh lebih tinggi pada sampel kulit tepung pisang kepok kuning. Sedangkan kadar protein yang didapatkan lebih rendah dari hasil Kundarto yaitu sebesar 7,36%.
4.3. Hidrolisis Tepung Limbah Kulit Pisang Kepok dengan Asam Sulfat
Proses hidrolisis yang dilakukan adalah hidrolisis asam menggunakan asam
sulfat (H2SO4). Hidrolisis asam dilakukan untuk menggantikan proses hidrolisis
gula-gula sederhana yang diperoleh akan meningkat dibandingkan menggunakan enzim (Susmiati, 2010).
Hidrolisis menggunakan asam merupakan salah satu teknik yang sederhana dilakukan untuk mengubah polisakarida menjadi bentuk monosakarida. Asam sulfat merupakan asam yang sering digunakan sebagai katalis kimia meskipun asam yang lain juga bisa digunakan seperti asam klorida (HCl). Asam bekerja dengan cara acak dalam proses konversi dan gula yang dihasilkan sebagian besar gula pereduksi. Pemilihan asam sulfat pada proses hidrolisis ini atas dasar bahwa asam sulfat dapat memberikan hasil yang lebih tinggi dibandingkan dengan asam klorida pada konsentrasi dan waktu hidrolisis yang sama. Sebagaimana yang dinyatakan oleh Sari dalam Susmiati (2010), bahwa asam sulfat menghasilkam total gula sedikit lebih tinggi dibandingkan dengan asam klorida pada konsentrasi, waktu dan suhu yang sama karena sifat HCl lebih kuat dengan reaktivitas yang lebih tinggi.
Pada proses hidrolisis, ketika larutan tepung dipanaskan pada suhu tinggi terjadi proses pengembangan granula pati, hemiselulosa dan selulosa. Proses pemanasan menyebabkan granula pati mengembang dengan cepat dan menyerap air sebanyak-banyaknya, oleh karena itu daya serap air pada bahan yang tinggi akan mempermudah pemutusan ikatan hidrogen pada pati. Pada proses hidrolisis pati dengan asam terjadi proses konversi oleh katalis asam pada ikatan α-1,4 dan α-1,6 glikosida. Proton yang bertindak sebagai katalisator asam berinteraksi cepat dengan oksigen glikosida (O-glikosida) yang menghubungkan dua unit gula, diikuti dengan pemecahan yang lambat dari ikatan C-O (Oktavianus dkk, 2013). Proses hidrolisis pada mulanya terjadi pada bagian amorf dari granula pati. Granula pati yang terhidrolisis dengan asam akan mengalami kerusakan pada bagian tengah yaitu bagian hilus, dimana daerah tersebut terjadi keretakan dan berlubang sehingga granula tersebut akan pecah (Susmiati, 2010).
38
terbaik yang didapatkan pada proses hidrolisis. Perubahan warna yang terjadi dari coklat menjadi merah tua menandakan bahwa sampel telah mengalami hidrolisis. Perubahan warna merah yang merata pun menandakan bahwa hidrolisis yang dilakukan telah sempurna. Menurut Rusdianto (2010), hasil hidrolisis yang sempurna dapat dilihat jika warna merah tua pada hidrolisat merata pada seluruh larutan.
Dari ketiga konsentrasi yang digunakan, ada perbedaan warna merah yang terjadi setelah dilakukan proses hidrolisis. Pada sampel yang menggunakan konsentarsi asam 0,2 N menghasilkan perubahan warna menjadi coklat kemerahan. Artinya, warna merah yang terjadi sedikit keruh. Pada sampel yang menggunakan konsentrasi asam sulfat 0,5 N, warna merah yang terbentuk lebih jelas dan tidak begitu keruh. Sedangkan pada sampel yang menggunakan konsentrasi asam sulfat 0,8 N warna merah yang terbentuk tidak keruh dan lebih encer. Bisa disimpulkan bahwa semakin tinggi konsentrasi asam sulfat yang digunakan, maka semakin rendah tingkat kekeruhan yang terbentuk dan semakin terlihat jelas warna merah yang dihasilkannya. Menurut Tjokroadikoesoemo (1986), kejernihan dan kualitas warna dalam hidrolisat pati dipengaruhi oleh kandungan ISSP (Insoluble Starch Particles) dalam pati. ISSP adalah partikel-partikel pati yang tersusun atas sebagian besar amilosa yang saling bergandengan membentuk rantai lurus (linear). Bahan ini dapat dihidrolisis dengan memakai katalisator asam pada suhu tinggi, meskipun hasil hidrolisis masih tetap mengandung sejumlah kecil sisa ISSP. Pada proses tersebut proses konversi atau pemecahan polisakarida menjadi gula-gula sederhana belum sempurna, sehingga masih banyak partikel-partikel besar yang mengendap pada larutannya. Pada kondisi ini juga diduga asam sulfat hanya mampu memecah polisakarida kompleks menjadi polisakarida sederhana dan cukup sedikit monosakarida yang dihasilkan (Susmiati, 2010).
Semakin tinggi konsentrasi larutan asam, semakin banyak ion H+ yang mengikat
hidrolisis yang cukup lama dibutuhkan untuk memberi kesempatan terjadinya reaksi tersebut sehingga akan semakin banyak monosakarida yang dihasilkan.
Sampel Sebelum hidrolisis Setelah hidrolisis 0,2 N H2SO4
0,5 N H2SO4
0,8 N H2SO4
Sumber : Koleksi Pribadi
40
4.4. Perhitungan Gula Pereduksi dengan Metode Nelson Somogyi
Kadar gula pereduksi dapat dihitung dengan menggunakan beberapa metode dan
salah satunya adalah metode Nelson Somogyi. Prinsip kerja dari metode ini adalah
dengan cara tereduksinya kuprioksida menjadi kuprooksida oleh gula reduksi, kuprooksida yang terbentuk direaksikan dengan arsenmolibdat sehingga terbentuk molibdenum yang berwarna biru, intensitasnya diukur dengan menggunakan spektrofotometer Uv-Vis (CMFRI, 1981).
Gula reduksi menunjukkan jumlah komponen gula yang ujung rantainya mengandung gugus aldehida atau keton bebas. Semua monosakarida (glukosa, fruktosa, galaktosa) dan disakarida (laktosa, maltosa), kecuali sukrosa dan pati (polisakarida), termasuk sebagai gula pereduksi. Besarnya kadar gula pereduksi menunjukkan hidrolisat berpotensi besar menghasilkan etanol yang tinggi dalam proses fermentasi, sebab gula pereduksi yang terukur dimanfaatkan oleh S. cereviceae dalam proses metabolisme menghasilkan etanol, terlepas dari ada atau tidaknya inhibitor. (Osho 2005; Moneke et al 2005).
Tabel 4.2. Kadar Gula Pereduksi Hasil dari Hidolisis Asam Sampel
(50 g tepung kulit pisang)
Grafik 4.1. Kadar Gula Pereduksi Hasil dari Hidolisis Asam
Hasil analisis dari ke 9 sampel yang telah dihidrolisis dan diuji kadar gula
pereduksinya dengan menggunakan metode Nelson Somogyi serta diukur
absorbansinya, didapatkan bahwa dari 50 g tepung limbah kulit pisang dengan
kondisi hidrolisis menggunakan asam sulfat 0,8 N selama 180 menit pada suhu 1000C
42
4.5. Fermentasi Bioetanol
Sebelum dilakukan fermentasi, sampel harus dikondisikan terlebih dahulu sesuai dengan kondisi tumbuh mikroba. Hidrolisat yang telah disaring, memiliki tingkat keasaman yang sangat tinggi, yaitu sebesar 0,907. Untuk menyesuaikan dengan kondisi media fermentasi, hidrolisat harus diadjust pH dengan NaOH hingga pH 4,1.
Hal ini disebabkan karena khamir S. cereviceae dapat tumbuh di kisaran pH 4-5
(Frazier dan Westhoff, 1978).
Fermentasi merupakan proses konversi glukosa menjadi etanol dalam kondisi anaerob dengan agensia perubah berupa khamir. Khamir akan merubah glukosa dan fruktosa menjadi asam piruvat melalui tahapan reaksi pada jalur Embden-Meyerof-Parnas yang kemudian akan dilanjutkan dengan proses dekarboksilasi asam piruvat menjadi asetaldehida. Asetaldehida kemudian mengalami proses dehidrogenasi menjadi senyawa etanol. Jenis khamir yang sering digunakan dalam proses
fermentasi adalah S. cereviceae karena jenis ini mempunyai beberapa keunggulan
antara lain mampu berproduksi tinggi, toleran dengan konsentrasi etanol yang cukup tinggi (12-18%), tahan terhadap kadar gula yang tinggi dan tetap aktif melakukan
fermentasi pada suhu 4-320C (Gaur, 2006).
Setelah pengkondisian media fermentasi selesai dilakukan, maka langsung dilakukan tahap fermentasi. Selama proses fermentasi, media disimpan di dalam
incubator shaker dengan suhu 250C. Selain pH, suhu juga mempengaruhi proses