KARAKTERISASI REPRODUKSI MUNCAK,
Muntiacus muntjak muntjak
JANTAN: KAJIAN ANATOMI,
PROFIL METABOLIT TESTOSTERON, DAN SPERMATOGENESIS
SELAMA PERIODE PERTUMBUHAN RANGGAH
SRI WAHYUNI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Karakterisasi Reproduksi Muncak, Muntiacus muntjak muntjak Jantan: Kajian Anatomi, Profil Metabolit Testosteron, dan Spermatogenesis selama Periode Pertumbuhan Ranggah adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Mei 2012
ABSTRACT
SRI WAHYUNI. Reproductive Characterization of Male Muntjak, Muntiacus muntjak muntjak: Study of Anatomy, Testosterone Metabolite Profile, and Spermatogenesis during Antler Growth Periods. Under direction of TUTY L. YUSUF, SRIHADI AGUNGPRIYONO, and MUHAMMAD AGIL.
Muntjaks (Muntiacus muntjak muntjak) are belonging to Cervidae which distributed in Java Island and Southern part of Sumatera. Muntjaks have been protected by Indonesian Government since 1999. In order to support breeding program of the species and to avoid from extinction, several activities in this study were conducted. Therefore, the objective of this study was to investigate the reproductive capacity of male muntjaks in captivity. Anatomical procedure and histological preparation of reproductive organ (testis, ductus epididymidis, accessory sex glands, and penis) from an adult male muntjak (♂#1) in hard antler period was carried out to collect data of their morphology and histology structure. Immunoreactive testosterone (iT) level of fecal samples was measured by the enzymeimmunoassay method using testosterone assay (Möstl) from two adult male muntjaks with individual code as ♂#2 and ♂#3. Furthermore, core needle biopsy and electroejaculation methods were applied for obtained testicular tissues and semen for study spermatogenesis. The entire samples were collected in hard antler (RK), casting (C), and velvet antler (RV) periods with different sampling frequency. The result showed that in general, the anatomy of reproductive organ in male muntjak was somewhat similar with other small ruminant included Cervids (ram and goat, rusa deer, pampas deer, and reeves muntjak). As dominant male, ♂#2 had sturdier and bigger hard antlers (RK1 and RK2) compare to ♂#3. The duration of antler cycle of ♂#2 was also longer (459 days) than ♂#3 (381 days) in the first antler cycle. Duration of second antler cycle of ♂#3 was longer (20.65%) than in previous cycle (485 days) Based on the hormonal data, iT level of ♂#2 was different among RK, C, and RV periods where iT level during RK 1 period was higher than C (p = 0.003) and RV (p = 0.02). In
addition, iT level during RK 2 was also significantly higher than those C (p = 0.009) and RV (p = 0.06). In the first antler cycle, the pattern of T secretion
in ♂#3 was slightly different if compared to the ♂#2. ♂#3 showed iT level was significantly lower in RK1 than RK2 (p = 0.0003), RK3 (p= 0.0034), C1 (p = 0.05), and C2 (p = 0.0001). However, the pattern of testosterone secretion was changed when ♂#3 in RK2 at the second of antler cycle coincided with increase of ♂#3’s age and death of ♂#2. Interestingly, iT level still detected during C and RV periods in both of muntjaks and showed a positive correlation with spermatogenesis which was proven by presence of spermatozoa in semen with significant concentration during those periods. The highest sperm concentration, however, was found in RK, and slightly decreased in C and RV. These findings provide that the specific pattern of testosterone metabolite profile that exhibited by ♂#2 and ♂#3 had closed correlation with their age, body size, antler size, and antler cycles length. In conclusion, testosterone that synthesized during an antler cycle plays a central role in continuing reproductive activities in male muntjaks. Therefore, muntjaks could provide reproductive function throughout the year of reproductive aseasonality which is similar to the reeves and formosan muntjaks.
RINGKASAN
SRI WAHYUNI. Karakterisasi Reproduksi Muncak, Muntiacus muntjak muntjak Jantan: Kajian Anatomi, Profil Metabolit Testosteron, dan Spermatogenesis selama Periode Pertumbuhan Ranggah. Dibimbing oleh TUTY L. YUSUF, SRIHADI AGUNGPRIYONO, dan MUHAMMAD AGIL.
Muncak (Muntiacus muntjak muntjak) termasuk ke dalam famili Cervidae yang tersebar di Pulau Jawa dan Pulau Sumatera bagian selatan. Sejak tahun 1999, muncak ditetapkan sebagai satwa yang dilindungi di Indonesia. Perburuan liar dan eksploitasi habitat muncak dan satwa lainnya di alam menjadi penyebab utama penurunan populasi muncak. Sampai saat ini belum ada data pasti mengenai populasi muncak di habitat asli maupun di area konservasi. Kekhawatiran akan punahnya muncak di Indonesia menjadi alasan kuat dilakukannya penelitian ini. Selain itu karakteristik reproduksi muncak Indonesia sejauh ini belum dilaporkan, sehingga upaya pengembangbiakan muncak di penangkaran tidak dapat berjalan dengan baik. Pada penelitian ini digunakan tiga ekor muncak jantan dewasa sesuai dengan Surat Keputusan Menteri Kehutanan Republik Indonesia nomor SK. 23/Menhut-II/2011. Muncak diperoleh dari hasil tangkapan masyarakat di Kabupaten Cilacap, Jawa Tengah.
Regulasi hormonal terhadap pertumbuhan ranggah berkaitan erat dengan aktivitas reproduksi selama satu siklus ranggah, meliputi: periode ranggah keras (RK), lepas ranggah atau casting (C), dan ranggah velvet (RV). Sejauh mana keterkaitan antara pertumbuhan ranggah dengan aktivitas steroidogenesis dan spermatogenesis untuk menghasilkan spermatozoa selama satu siklus ranggah pada muncak dapat diketahui dari penelitian ini. Oleh karena itu, tujuan dari penelitian ini adalah untuk mengetahui dan mempelajari karakteristik reproduksi muncak jantan selama periode pertumbuhan ranggah yang pada akhirnya dapat menjelaskan gambaran fertilitas muncak dan pola reproduksinya. Ada empat kegiatan penelitian yang dilakukan dengan metode spesifik, yaitu: 1) anatomi dan histologi organ reproduksi muncak jantan, 2) karakteristik pertumbuhan ranggah muncak, 3) profil metabolit testosteron selama periode pertumbuhan ranggah, dan 4) spermatogenesis dan kualitas semen muncak selama periode pertumbuhan ranggah. Hasil pengamatan selanjutnya dibahas pada bagian akhir dari penelitian ini. Data yang diperoleh dapat digunakan sebagai bahan pertimbangan dalam manajemen pemeliharaan dan pengembangbiakan muncak di penangkaran.
timor, namun lebih besar dibandingkan organ reproduksi kancil. Struktur histologi organ reproduksi muncak juga mirip dengan domba, tetapi perbandingan dengan rusa timor, pampas deer, dan spesies rusa, spesies dan subspesies muncak lainnya tidak dapat dilakukan, karena gambaran histologi seluruh organ reproduksi kecuali testis dan duktus epididimidis belum dilaporkan pada Cervidae tersebut. Data anatomi dan histologi organ reproduksi muncak jantan tersebut dapat digunakan untuk mengetahui fungsi fisiologi masing-masing organ dalam aktivitas reproduksi. Gambaran histologi testis pada periode ranggah keras dapat digunakan untuk menentukan tahapan epitel tubuli seminiferi dan durasinya selama spermatogenesis berlangsung. Selain itu, ukuran panjang penis muncak dapat digunakan untuk memprediksi ukuran panjang saluran reproduksi muncak betina yang penting diketahui untuk aplikasi teknik inseminasi buatan.
Informasi mengenai karakteristik pertumbuhan ranggah muncak diperoleh dari dua ekor muncak jantan dewasa yang diberi kode ♂#2 dan ♂#3. Pengamatan dilakukan terhadap morfologi dan morfometri pertumbuhan RV dan RK post casting, serta durasi setiap periode ranggah. Pengamatan dilakukan selama mendekati satu siklus ranggah pada ♂#2, dan dua siklus ranggah pada ♂#3. Pada kegiatan ini juga diamati kaitan antara periode pertumbuhan ranggah dengan pemunculan perilaku spesifik, yaitu perilaku reproduksi dan agresif. Pertumbuhan RV dimulai setelah casting dengan urutan pertumbuhan ranggah velvet utama (RVU) dan diikuti ranggah velvet cabang (RVC). Kedua muncak mengalami urutan pertumbuhan RVU dan RVC yang sama, namun morfometrinya berbeda. Morfologi dan morfometri RK1 dan RK2 post casting pada ♂#2 berukuran lebih besar dan sudah memiliki cabang rangah dibandingkan RK1 dan RK2 pada ♂#3. Durasi masing-masing periode ranggah ♂#2 juga lebih panjang dibandingkan ♂#3 pada siklus ranggah pertama. Memasuki siklus ranggah kedua, terjadi perubahan morfologi dan peningkatan morfometri RK pada ♂#3. Hasil menunjukkan bahwa periode RK merupakan periode terpanjang dibandingkan periode C dan RV, dengan total durasi satu siklus ranggah muncak ♂#2 lebih lama (459 hari) dibandingkan ♂#3 pada siklus rangah pertama, yaitu 319 hari. Peningkatan umur dan ukuran tubuh ♂#3 berimplikasi terhadap perubahan morfologi dan peningkatan morfometri dan durasi satu siklus ranggah (489 hari). Oleh karena itu prediksi umur ♂#2 di awal penelitian adalah 5 tahun, sedangkan ♂#3 berumur 3 tahun. Prediksi umur ♂#2 dan ♂#3 tersebut diperlukan untuk mengetahui seberapa besar pengaruh status sosial, seperti peringkat dominasi dan pengaruh stimulo-social dari muncak betina fertil terhadap profil metabolit testosteron, aktivitas spermatogenesis, dan kualitas spermatozoa pada ♂#2 dan ♂#3, selama periode pertumbuhan ranggah. Perilaku reproduksi dan perilaku agresif ditemukan saat kedua muncak berada pada periode RK, dan jarang ditemukan pada periode C dan RV.
(p = 0.0001), dan RK2 (p = 0.0003), namun tidak berbeda dengan RV1 dan RV2. Pada saat ♂#3 memasuki siklus ranggah kedua, pola sekresi testosteron mulai menyerupai pola sekresi testosteron ♂#2, walaupun secara statistik tidak berbeda. Perubahan pola sekresi tersebut terjadi bersamaan dengan meningkatnya umur ♂#3 dan kematian ♂#2 pada saat ♂#3 berada pada awal periode RK2 dari siklus ranggah kedua. Pada periode awal pertumbuhan RV, konsentrasi iT relatif rendah dibandingkan pada periode RK. Pola ini dibuktikan dengan adanya korelasi negatif (pearson correlation, r = -0.785) antara laju pertumbuhan RV dengan konsentrasi iT pada ♂#2 dan secara statistik berbeda (p = 0.021), dan periode RV2 dari siklus ranggah kedua pada ♂#3 (pearson correlation, r = -0.574), namun secara statistik tidak berbeda (p = 0.311). Hasil lain memperlihatkan bahwa testosteron masih terdeteksi dalam konsentrasi yang lebih rendah walaupun muncak berada pada periode C dan RV. Hal ini mengindikasikan bahwa testosteron tetap diperlukan untuk kelangsungan aktivitas spermatogenesis selama satu siklus ranggah, meskipun aktivitas tersebut sedikit menurun dibandingkan saat muncak berada pada periode RK.
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
KARAKTERISASI REPRODUKSI MUNCAK,
Muntiacus muntjak muntjak
JANTAN: KAJIAN ANATOMI,
PROFIL METABOLIT TESTOSTERON, DAN SPERMATOGENESIS
SELAMA PERIODE PERTUMBUHAN RANGGAH
SRI WAHYUNI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr. Drh. Amrozi
Dr. Drh. Chairun Nisa’, M.Si, PAVet
Penguji pada Ujian Terbuka : Dr. Ir. Novianto Bambang Wawandono, M.Si.
Judul Disertasi : Karakterisasi Reproduksi Muncak, Muntiacus muntjak muntjak Jantan: Kajian Anatomi, Profil Metabolit Testosteron, dan Spermatogenesis selama Periode Pertumbuhan Ranggah.
Nama : Sri Wahyuni
NIM : B362080011
Disetujui
Komisi Pembimbing
Prof. Dr.Drh. Tuty L. Yusuf, M.S. Ketua
Drh. Srihadi Agungpriyono, Ph.D, PAVet (K). Dr. Drh. Muhammad Agil, M.Sc. Agr.
Anggota Anggota
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Biologi Reproduksi
Prof. Dr. Drh. M. Agus Setiadi Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Disertasi yang berjudul Karakterisasi Reproduksi Muncak, Muntiacus muntjak muntjak Jantan: Kajian Anatomi, Metabolit Testosteron, dan Spermatogenesis selama Periode Pertumbuhan Ranggah, diajukan untuk memperoleh gelar doktor pada Sekolah Pascasarjana Institut Pertanian Bogor.
Terima kasih dan penghargaan yang tulus penulis sampaikan kepada Ibu Prof. Dr. Drh. Tuty L. Yusuf, M.S., Bapak Drh. Srihadi Agungpriyono, Ph.D, PAVet (K), dan Bapak Dr. Drh. Muhammad Agil, M.Sc. Agr., selaku Ketua dan Anggota Komisi Pembimbing atas bimbingan, arahan, dan saran yang diberikan selama penulis menjalani penelitian menempuh pendidikan doktor pada Program Studi Biologi Reproduksi, Sekolah Pascasarjana Institut Pertanian Bogor.
Ucapan terima kasih juga penulis sampaikan kepada:
1. Rektor Universitas Syiah Kuala dan Dekan Fakultas Kedokteran Hewan Universitas Syiah Kuala, Banda Aceh atas izin yang diberikan kepada penulis untuk melanjutkan studi doktor di PS BRP, SPs IPB.
2. Rektor Institut Pertanian Bogor dan Dekan Sekolah Pascasarjana (SPs IPB) yang telah menerima penulis sebagai mahasiswa di SPs IPB angkatan 2008.
3. Direktorat Jenderal Pendidikan Tinggi (DIKTI), Kementerian Pendidikan Nasional atas pemberian dana BPPS, beasiswa Sandwich-like 2010, dan Hibah Penelitian Disertasi Doktor tahun 2011.
4. Pemerintah Provinsi Aceh atas bantuan beasiswa yang diberikan selama penulis menempuh pendidikan.
5. Kementerian Kehutanan Republik Indonesia dan instansi terkait: Balai Konservasi Sumber Daya Alam (BKSDA) Jawa Tengah dan BKSDA Jawa Barat atas proses perizinan penggunaan muncak pada penelitian ini. 6. Pusat Penelitian Biologi LIPI atas rekomendasi yang diberikan terkait
penggunaan muncak penelitian.
7. Ibu Dr. Drh. Chairun Nisa’, M.Si, PAVet dan Bapak Dr. Drh. Amrozi, selaku penguji luar komisi pada ujian tertutup.
8. Bapak Dr. Ir. Novianto Bambang Wawandono, M.Si. dan Bapak Dr. Drh. Bambang Purwantara, M.Sc. selaku penguji luar komisi pada
ujian terbuka.
9. Bapak Prof. Dr. Drh. M. Agus Setiadi selaku Ketua PS BRP, SPs IPB beserta seluruh staf pendidik dan kependidikan atas bimbingan dan bantuan yang diberikan selama menjalankan studi di PS BRP.
10. Bapak Dr. Drh. Amrozi selaku Kepala Unit Rehabilitasi Reproduksi (URR) FKH IPB beserta staf atas izin penggunaan fasilitas kandang dan laboratorium serta bantuan teknis selama penelitian berlangsung.
fasilitas untuk penelitian dan bimbingan selama penulis meneliti di Laboratorium Anatomi FKH IPB.
12. Prof. J. Keith Hodges dan Dr. Michael Heistermann dari Reproductive Biology Unit, German Primate Center, Goettingen, Germany beserta staf (Petra Kiesl dan Andrea Heistermann) atas bimbingan pada kegiatan analisis hormon muncak dalam Program Sandwich-like 2010.
13. Drh. I Ketut Mudite Adnyane, M.Si, Ph.D, PAVet., Ir. Asri Pudjirahaju, M.Si, dan Gholib, S.Pt, M.Si, atas segala bantuan yang diberikan selama penelitian.
14. Rumah Sakit Hewan IPB atas bantuan teknis saat proses pengambilan sampel penelitian.
15. Teman-teman PS. BRP angkatan 2008: Ir. Ekayanti M. Kaiin, M. Si., Ir. Tatan Kostaman, MP, dan Harry Murti, S.Si atas persahabatan yang baik, dukungan dan bantuan selama menjalankan studi di BRP.
16. Juliper Silalahi, SKH., Lidya M.Manik, SKH., Rissar Siringo Ringo, SKH, Danang Dwi Cahyadi, SKH., Drh. Dedi R.S, Bondan Achmadi, SE., Drh. Wahono Esthi Prasetyaningtyas, M.Si, PAVet., Drh. Kusdiantoro Mohammad, M.Si, PAVet., Forum Mahasiswa Pascasarjana Biologi Reproduksi (Forum Wacana BRP), Madia, Rudi, serta seluruh pihak yang tidak dapat disebutkan satu per satu, atas segala bantuan yang diberikan.
Akhirnya ucapan terima kasih dan penghargaan yang tulus disampaikan kepada suami tercinta Said Ashim, SE dan ananda tersayang Said Muhammad Muafi, serta ayahanda dr. H. Anwar Jakfar, M.S. dan ibunda Hj. Trimurti Chaidir, kakanda Sri Wartini dan Sri Maryam, serta adinda Sri Haryani, Rahmat Hidayat, dan Firman Hidayat, keluarga besar Walid (alm) H. Said Ismail dan Ummi Hj. Syarifah Nurbasty atas segala dukungan dan doa yang dipanjatkan. Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2012
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 19 November 1969 dari Ayahanda dr. H. Anwar Jakfar, M.S dan Ibunda Hj. Trimurti Chaidir sebagai anak ketiga dari enam bersaudara. Penulis menikah dengan Said Ashim, SE pada tahun 1996 dan dikarunai seorang putra, Said Muhammad Muafi. Saat ini penulis merupakan staf pengajar pada Fakultas Kedokteran Hewan Universitas Syiah Kuala, Banda Aceh.
Pendidikan dokter hewan diselesaikan pada tahun 1994 dari Fakultas Kedokteran Hewan Universitas Syiah Kuala, Banda Aceh. Pada tahun 2005 penulis memulai pendidikan magister (S2) di Sekolah Pascasarjana Institut Pertanian Bogor dan lulus pada tahun 2008. Pada tahun dan di perguruan tinggi yang sama, penulis melanjutkan pendidikan program doktor (S3) pada Program Studi Biologi Reproduksi (BRP).
DAFTAR ISI
Halaman
DAFTAR TABEL ………. xv
DAFTAR GAMBAR ……… xvi
DAFTAR LAMPIRAN ………. xvii
DAFTAR SINGKATAN ……… xviii
PENDAHULUAN ………. 1
Latar Belakang ……… 1
Perumusan Masalah ……….. 4
Tujuan Penelitian ………. 4
Manfaat Penelitian ……….. 5
Kerangka Pemikiran ……… 5
TINJAUAN PUSTAKA ……… 9
Muncak dan Status Konservasinya ………. 9
Morfologi dan karakteristik Reproduksi Muncak Jantan……… 10
Pertumbuhan dan Siklus Ranggah ……….. 13
Biosintesis dan Metabolisme Androgen ……….. 15
Metode Pengukuran Kadar Metabolit Steroid ……… 17
Anatomi Organ Reproduksi Jantan ……….. 19
Spermatogenesis dan Tahapan Epitel Tubuli Seminiferi Testis……….. 21
Morfologi dan Kualitas Semen ……….. 24
Peluang Pemanfaatan Ejakulat Muncak ………. 25
ANATOMI DAN HISTOLOGI ORGAN REPRODUKSI MUNCAK JANTAN PADA PERIODE RANGGAH KERAS ………. 29 Abstrak ………. 29
Abstract ………... 29
Pendahuluan ……… 30
Bahan dan Metode ………. 32
Hasil dan Pembahasan ………. 37
Simpulan ……….. 67
Daftar Pustaka ……… 67
KARAKTERISTIK PERTUMBUHAN RANGGAH MUNCAK……….. 73
Abstrak ………. 73
Abstract ……… 73
Pendahuluan ……… 74
Bahan dan Metode ………. 76
Hasil dan Pembahasan ……….. 81
Simpulan ……….. 97
PROFIL METABOLIT TESTOSTERON MUNCAK JANTAN SELAMA
PERIODE PERTUMBUHAN RANGGAH ……… 101
Abstrak ………. 101
Abstract ……….. 101
Pendahuluan ……….. 102
Bahan dan Metode ……… 104
Hasil dan Pembahasan ………. 110
Simpulan ………. 122
Daftar Pustaka ……… 122
SPERMATOGENESIS DAN KUALITAS SEMEN MUNCAK SELAMA PERIODE PERTUMBUHAN RANGGAH………. 127 Abstrak ……… 127
Abstract ……….. 127
Pendahuluan ……….. 128
Bahan dan Metode ………. 130
Hasil dan Pembahasan ……… 137
Simpulan ………. 161
Daftar Pustaka ……… 161
PEMBAHASAN UMUM ……….. 167
SIMPULAN DAN SARAN UMUM ………. 175
DAFTAR PUSTAKA ………... 176
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
1 Bagan alir kerangka penelitian ……… 7 2 Muncak (Muntiacus muntjak muntjak, Zimmermann 1780) jantan …… 9 3 Lokasi penyebaran muncak di Indonesia ………. 10 4 Morfologi tulang kepala muncak jantan (Muntiacus sp) ………. 11 5 Regulasi hormonal pertumbuhan ranggah Cervidae ………. 14 6 Regulasi steroidogenesis androgen ……….. 16
7 Anatomi testis ……… 21
DAFTAR LAMPIRAN
Halaman
1 Prosedur pewarnaan hematoksilin-eosin (HE) ………. 187
2 Prosedur pewarnaan periodic acid Schiff (PAS) ………. 188
3 Preparasi spermatozoa untuk SEM ……… 189
4 Prosedur pewarnaan William ……….. 190
DAFTAR SINGKATAN
Singkatan Kata 5α-DHT 5α-dehidrotestosteron
17β-HSD 17β-hidroksisteroid dehidrogenase
♂#1 Muncak jantan nomor 1
♂#2 Muncak jantan nomor 2
♂#3 Muncak jantan nomor 3
ABP Androgen binding protein
ACTH Adrenocorticothropic hormone
C Casting
C1 Casting 1
C2 Casting 2
CNB Core needle biopsy
D Diplotene
DHEA Dehidroepiandrosteron DHT Dehidrotestosteron
DRKC Diameter ranggah keras cabang
DRKU Diameter ranggah keras utama
DRVC Diameter ranggah velvet cabang
DRVU Diameter ranggah velvet utama
E Elongated spermatid
EIA Enzymeimmunoassay
GnRH Gonadothropin releasing hormone
HE Hematoksilin-eosin HPG Hipotalamus-hipofise-gonad
IB Inseminasi buatan
iT Testosteron imunoreaktif
L Leptotene
LC Least concern
LH Luteinizing hormone
P Pachytene
PAS Periodic acid Schiff
PC Principle cells
Pl Preleptotene
PRKC Panjang ranggah keras cabang
PRKU Panjang ranggah keras utama
PRVC Panjang ranggah velvet cabang
PRVU Panjang ranggah velvet utama
R Round spermatid
RIA Radioimmunoassay
RK Ranggah keras
RK1 Ranggah keras 1
RK2 Ranggah keras 2
RKC Ranggah keras cabang
RKU Ranggah keras utama
RV Ranggah velvet
RV1 Ranggah velvet 1
RV2 Ranggah velvet 2
RVC Ranggah velvet cabang
RVU Ranggah velvet utama
SEM Scanning electron microscope
SHBG Steroid hormone-binding globulin
Ss Spermatosit sekunder
Sz Spermatozoa
VNO Vomeronasal organ
Z Zygotene
PENDAHULUAN UMUM
Latar Belakang
Pengetahuan dan informasi mengenai biologi reproduksi suatu spesies satwa khususnya satwa liar sangat diperlukan untuk mensukseskan program konservasi satwa tersebut. Biologi reproduksi satwa liar bersifat spesifik spesies, dengan variasi kompleks yang meliputi struktur anatomi dan fungsi organ reproduksi, profil hormon reproduksi, siklus estrus pada betina, fisiologi gamet serta deposisi semen pada organ reproduksi betina. Data biologi reproduksi tersebut sangat penting untuk mendukung program pemeliharaan, pengembangbiakan maupun penerapan teknologi reproduksi seperti inseminasi buatan, embrio transfer, fertilisasi in vitro, bank plasma nutfah (genome resource bank), mikromanipulasi gamet, semen sexing dan transfer inti sel somatis pada satwa liar (Comizolli et al. 2000; Andrabi dan Maxwell 2007). Selain itu informasi dasar mengenai biologi reproduksi satwa liar, juga bermanfaat sebagai bahan pertimbangan dalam penentuan kebijakan dan strategi pengelolaan satwa liar di penangkaran. Keberhasilan dari strategi tersebut akan menjamin dan meningkatkan populasi satwa yang dilindungi dan terancam punah.
2
Cervidae jantan dicirikan dengan keberadaan ranggah (Bubenik 2006). Pada beberapa spesies rusa, pertumbuhan ranggah berkorelasi erat dengan aktivitas organ reproduksinya, seperti sintesis testosteron, spermatogenesis untuk menghasilkan spermatozoa dan aktivitas kelenjar asesoris kelamin dalam menghasilkan plasma semen. Hal tersebut telah dilaporkan pada rusa timor jantan, yang memperlihatkan adanya keterkaitan antara aktivitas reproduksi dengan pertumbuhan ranggahnya (Handarini et al. 2004; Handarini dan Nalley 2008). Demikian pula pada spesies rusa lainnya seperti axis deer
(Axis axis) (Loudon dan Curlewis 1988), pampas deer (Ozotoceros bezoarticus
bezoarticus) (Pereira et al. 2005) dan red deer (Cervus elaphus) (Bartos et al. 2009). Namun demikian, pola reproduksi seperti yang ditemukan
pada beberapa spesies rusa tersebut sedikit berbeda pada formosan muntjak.
Walaupun pertumbuhan ranggah berkorelasi erat dengan konsentrasi testosteron, namun aktivitas reproduksi formosan muntjak tetap berjalan sepanjang tahun (Pei et al. 2009) yang ditandai dengan ditemukannya spermatozoa motil pada berbagai stadia ranggah (Liu et al. 2004). Pola reproduksi muncak yang tersebar di Indonesia hingga saat ini belum dilaporkan, apakah terdapat kemiripan dengan pola reproduksi formosan muntjak atau menyerupai pola reproduksi rusa yang hidup di berbagai negara termasuk Indonesia.
Sejauh ini informasi mengenai pola reproduksi genus Muntiacus masih terbatas pada spesies reeves muntjak (Muntiacus reevesi) (Chapman dan Harris
1991) yang diintroduksi ke Inggris, dan sub spesies formosan muntjak
(M. reevesi micrurus) yang berasal dari Taiwan (Pei et al. 2009). Di sisi lain, penelitian pada beberapa spesies rusa famili Cervidae di Indonesia telah dilakukan, diantaranya tentang karakteristik ranggah rusa timor (Cervus timorensis) (Semiadi 1997) dan pertumbuhan ranggah pada rusa bawean (Axis kuhlii) (Semiadi et al. 2003). Selain itu aplikasi teknik inseminasi buatan (IB) juga telah dilakukan pada rusa timor, rusa sambar (Cervus unicolor) dan rusa bawean (Dradjat 2002).
3
Pengamatan terhadap ketiga aspek reproduksi tersebut terlebih dahulu diawali dengan pengamatan terhadap anatomi dan histologi organ reproduksi muncak jantan yang hingga saat ini datanya belum tersedia.
Pada penelitian ini, penentuan karakteristik dan pola reproduksi muncak jantan berdasarkan profil metabolit testosteron terkait aktivitas steroidogenesis selama periode pertumbuhan ranggah, dilakukan dengan teknik non invasif menggunakan metode enzymeimmunoassay (EIA). Melalui teknik dan metode tersebut, aktivitas steroidogenesis selama periode pertumbuhan ranggah dapat dideteksi berdasarkan konsentrasi testosteron imunoreaktif (iT). Teknik non invasif telah dikenal luas sebagai teknik yang praktis, murah, dan cocok digunakan pada berbagai spesies satwa liar, baik yang berada di habitat ex situ
maupun in situ (Mauget et al. 2007). Aplikasi metode EIA pada badak sumatera
(Dicerorhinus sumatrensis) (Heistermann et al. 1998; Agil 2007) telah memberikan hasil dengan tingkat validitas yang baik. Pada muncak, teknik analisis tersebut baru dilakukan pada formosan muntjak dengan metode
radioimmunoassay (RIA) (Pei et al. 2009). Analisis dengan metode EIA sejauh ini belum dilakukan, sehingga metode EIA sangat sesuai diaplikasikan pada penelitian ini.
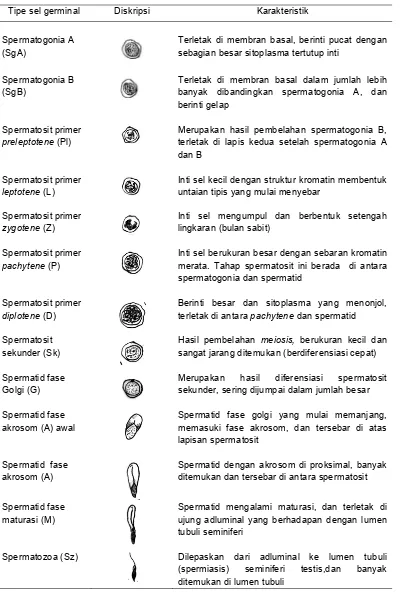
Karakteristik dan pola reproduksi muncak jantan selama periode pertumbuhan ranggah dapat pula diketahui dari aktivitas spermatogenesis pada tubuli seminiferi testis muncak. Kemungkinan adanya perbedaan aktivitas spermatogenesis selama periode ranggah keras, casting, dan ranggah velvet, dapat diketahui berdasarkan proses diferensiasi spermatid untuk menghasilkan spermatozoa pada ketiga periode pertumbuhan ranggah tersebut. Diferensiasi spermatid dapat dideteksi menggunakan metode pewarnaan periodic acid Schiff
(PAS).
4
Perumusan Masalah
Informasi berupa data lengkap yang berhubungan dengan karakteristik reproduksi pada muncak jantan belum dilaporkan, yaitu:
1. Anatomi dan histologi organ reproduksi.
2. Pertumbuhan ranggah, durasi siklus ranggah dan perilaku spesifik selama periode ranggah.
3. Profil hormon reproduksi selama periode pertumbuhan ranggah.
4. Aktivitas reproduksi selama periode pertumbuhan ranggah yang dikaitkan dengan spermatogenesis dan kualitas semen.
5. Pola reproduksi selama periode pertumbuhan ranggah.
Tujuan Penelitian
Secara umum, penelitian ini bertujuan untuk mendukung program konservasi muncak melalui penyediaan data yang berhubungan dengan aspek reproduksi, baik yang dilakukan dengan perkawinan alami maupun penerapan teknologi reproduksi. Adapun tujuan khusus dari penelitian ini adalah mempelajari karakteristik reproduksi muncak jantan selama periode pertumbuhan ranggah dengan cara menganalisis dan menggali informasi mengenai:
1. Anatomi dan histologi organ reproduksi.
2. Pertumbuhan ranggah dan durasi siklus ranggah, serta perilaku spesifik selam periode pertumbuhan ranggah.
3. Profil metabolit testosteron dan korelasinya dengan pertumbuhan ranggah.
4. Spermatogenesis dan kualitas semen.
Manfaat Penelitian
Seluruh data yang diperoleh dari penelitian ini diharapkan dapat:
1. Memberikan informasi mengenai karakteristik reproduksi muncak jantan yang dapat digunakan sebagai bahan rekomendasi pada program pengembangbiakan muncak di penangkaran.
2. Sebagai data dasar untuk aplikasi teknologi reproduksi pada muncak. 3. Mendukung program konservasi plasma nutfah melalui preservasi semen
5
4. Mendukung program budidaya muncak yang dapat digunakan sebagai satwa harapan penghasil protein alternatif asal hewan.
Kerangka Pemikiran
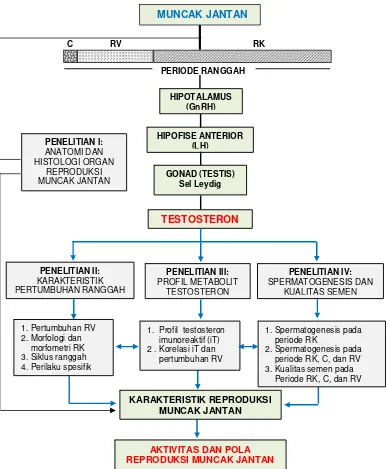
Ranggah merupakan karakteristik reproduksi sekunder yang dimiliki oleh sebagian besar Cervidae jantan, termasuk muncak. Pertumbuhan ranggah bersifat tahunan yang disebut dengan siklus pertumbuhan ranggah. Satu siklus pertumbuhan ranggah terbagi atas periode ranggah keras (RK), tanpa ranggah atau casting (C), dan ranggah lunak atau ranggah velvet (RV). Tumbuh kembangnya ranggah, berada dibawah kontrol poros hipotalamus-hipofise-gonad yang melibatkan GnRH dari hipotalamus, LH dari hipofise anterior dan testosteron dari gonad (testis). Tingginya konsentrasi LH yang terjadi pada periode ranggah keras (RK) akan menstimulasi sel-sel Leydig testis untuk mensintesis testosteron dalam konsentrasi tinggi. Testosteron diperlukan untuk membantu spermatogenesis (efek parakrin) khususnya pada proses spermiogenesis. Tingginya konsentrasi testosteron selama periode RK akan meningkatkan aktivitas spermatogenesis yang dapat diketahui dari konsentrasi spermatozoa, meningkatkan perilaku agresif dan tingginya libido. Pada akhir periode RK dan saat memasuki periode C, konsentrasi testosteron menurun drastis. Kondisi ini terjadi karena testosteron dalam konsentrasi tinggi di sirkulasi darah memberikan umpan balik negatif ke hipotalamus dan hipofise, sehingga sekresi GnRH dan LH menurun. Akibatnya konsentrasi testosteron juga menurun dan berefek pada penurunan aktivitas reproduksi. Setelah periode C, muncak memasuki periode RV yang ditandai dengan masih rendahnya testosteron akibat belum optimalnya rangsangan LH pada sel Leydig testis. Akhir periode RV (shedding) merupakan awal periode RK baru dengan konsentrasi testosteron yang tinggi dan muncak memasuki periode aktif reproduksi.
6
1. Anatomi dan histologi organ reproduksi muncak jantan. 2. Karakteristik pertumbuhan ranggah muncak jantan.
3. Profil metabolit testosteron muncak jantan selama periode pertumbuhan ranggah.
4. Spermatogenesis dan kualitas semen muncak selama periode pertumbuhan ranggah.
7
Gambar 1 Bagan alir kerangka pemikiran. GnRH: gonadotrophin releasing hormone, LH: luteinizing hormone, C: casting (lepas ranggah), RV: ranggah velvet,
RK: ranggah keras.
TESTOSTERON PERIODE RANGGAH
C RV RK
MUNCAK JANTAN
HIPOTALAMUS (GnRH)
HIPOFISE ANTERIOR (LH)
PENELITIAN III: PROFIL METABOLIT
TESTOSTERON
PENELITIAN IV: SPERMATOGENESIS DAN
KUALITAS SEMEN PENELITIAN II:
KARAKTERISTIK PERTUMBUHAN RANGGAH
1. Pertumbuhan RV 2. Morfologi dan morfometri RK 3. Siklus ranggah 4. Perilaku spesifik
KARAKTERISTIK REPRODUKSI MUNCAK JANTAN
PENELITIAN I: ANATOMI DAN HISTOLOGI ORGAN
REPRODUKSI MUNCAK JANTAN
1. Spermatogenesis pada periode RK
2. Spermatogenesis pada periode RK, C, dan RV 3. Kualitas semen pada
Periode RK, C, dan RV 1. Profil testosteron
imunoreaktif (iT) 2 . Korelasi iT dan pertumbuhan RV
AKTIVITAS DAN POLA REPRODUKSI MUNCAK JANTAN
10
Muncak (M. m. muntjak) dan sub spesies muncak lainnya yang tersebar di Indonesia merupakan satwa yang dilindungi di Indonesia, seperti yang tercantum di dalam Daftar Lampiran Peraturan Pemerintah Republik Indonesia Nomor 7 tahun 1999, sejak tanggal 27 Januari 1999 (PHKA 2004). Namun demikian, satwa ini belum tercantum di dalam Daftar Appendix CITES (Convention on International Trade in Endangered Species of Fauna and Flora). Berdasarkan data International Union for Conservation of Nature and Natural Resources (IUCN), terdapat satu spesies muncak dengan status vulnerable di dunia, yaitu Muntiacus crinifrons (Black Muntjak) yang berasal dari China (Wemmer 1998). Sedangkan spesies muncak lainnya termasuk bahan penelitian ini (M. m. muntjak) masih memiliki status least concern (IUCN 2011). Populasi muncak di habitat asli diduga semakin menurun, seperti yang terjadi pada populasi spesies satwa liar Indonesia lainnya. Penyebab utama dari penurunan populasi muncak di Indonesia adalah hilangnya habitat satwa seiring dengan alih fungsi hutan sebagai lahan pertanian, dan maraknya perburuan liar.
Gambar 3 Lokasi penyebaran muncakdi Indonesia yang meliputi Pulau Sumatera, Pulau Jawa, Pulau Kalimantan, Pulau Bali dan Lombok (Sumber: IUCN 2011).
Morfologi dan Karakteristik Reproduksi Muncak Jantan
11
dibandingkan dengan M. crinifrons, yaitu dengan rataan panjang tubuh 1043 mm, tinggi bahu 611 mm, panjang kepala 209 mm dengan ukuran fossa lacrimalis lebih kecil dari pada fossa orbitalis (Ma et al. 1986).
Ranggah merupakan organ asesoris reproduksi sekunder yang tumbuh apabila seekor rusa jantan telah mencapai pubertas (Wallace dan Birtles 1985). Selain sebagai simbol keindahan, ranggah juga digunakan sebagai organ pertahanan saat terjadi perkelahian dengan jantan lainnya (Price et al. 2005). Dari seluruh Cervidae jantan di dunia, hanya ada beberapa spesies yang tidak memiliki ranggah, yaitu chinese water deer (Hydropotes inermis), rusa musk (Moschus chrysogaster) dan mouse deer (Moschiola mimenoides). Selain pada rusa jantan, ranggah juga ditemukan pada rusa betina, yaitu pada rheindeer (Rangifer tarandus), namun ukuran ranggahnya lebih kecil dibandingkan rheindeer jantan (Rajaram 2004). Muncak yang tergolong Cervidae memiliki bentuk ranggah yang berbeda dengan ranggah Cervidae lainnya, yaitu berukuran pendek dengan ujung tanduk cenderung melengkung ke dalam pada muncak berumur tua dan memiliki pedikel (dasar ranggah) yang panjang (Gambar 4). Panjang ranggah pada beberapa spesies muncak bervariasi, yaitu 29-47 mm pada M. reevesi, 38-47 mm pada M. rooseveltorum, 36-49 mm pada M. feae, 48-55 mm pada M. crinifrons dan 48-84 mm pada M. Muntjak (Ma et al. 1986).
12
Ciri khas muncak jantan lainnya adalah sepasang gigi taring atas yang tumbuh dari os maxillaris dengan ukuran sekitar 2 cm yang tetap terlihat saat mulutnya tertutup. Pada saat melakukan aktivitas reproduksi, taring lebih berperan sebagai alat pertahanan saat terjadi kompetisi dengan jantan lainnya dari pada ranggah (Chapman 1997). Selain itu, muncak memiliki vokalisasi spesifik berupa suara gongongan sebagai panggilan atau peringatan kepada muncak lainnya agar menghindar dari predator. Namun vokalisasi tersebut tidak digunakan pada saat aktivitas reproduksi dan untuk penentuan teritorialnya (Oli dan Jacobson 1995).
Perilaku reproduksi M. muntjak secara umum mirip dengan Cervidae lainnya, yaitu poligami pada jantan dan poliestrus pada betina. Aktivitas organ reproduksi jantan dan betina berlangsung setelah muncak berumur di atas satu tahun. Siklus estrus muncak betina berkisar antara 14-21 hari dengan durasi estrus selama dua hari. Sedangkan periode gestasi berlangsung selama 210 hari dengan jumlah anak 1-2 ekor per kelahiran (Jackson 2002) dengan jarak per kelahiran sekitar tujuh bulan (Barrette 2008). Aktivitas reproduksi formosan muntjak (Muntiacus reeves micrurus) menunjukkan pola yang tidak berhubungan dengan periode pertumbuhan ranggah dan konsentrasi testosteron. Walaupun diketahui testosteron dibutuhkan dalam konsentrasi tinggi untuk pertumbuhan ranggah, namun pada saat konsentrasi testosteron rendah, spermatogenesis tetap berlangsung (Pei et al. 2009). Hal ini dibuktikan dengan ditemukannya spermatozoa selama satu siklus ranggah (Liu et al. 2004).
13
capreolus), perkawinan lebih sering terjadi pada musim panas antara bulan Mei sampai Agustus (Sempere 1990; Blottner et al. 1996).
Pertumbuhan dan Siklus Ranggah
Ranggah merupakan satu-satunya organ pada mamalia yang mengalami perpanjangan dan mampu beregenerasi secara berulang. Setiap tahun ranggah lepas dan tumbuh kembali dari blastema dan selanjutnya bercabang. Ranggah terdiri atas kulit, syaraf, buluh darah, jaringan fibrosa, tulang rawan (kartilago) dan tulang keras. Struktur ranggah tersebut berbeda dengan tanduk pada ruminansia lain seperti kerbau dan kambing. Tanduk ruminansia merupakan jaringan yang mengalami keratinisasi yang tumbuh dibawah kontrol sel-sel mesenkim pada lapisan basal tanduk. Pada beberapa spesies rusa, ranggah dapat tumbuh sekitar 2 cm per hari, sehingga ranggah disebut sebagai organ yang mengalami pertumbuhan tercepat dibandingkan organ lainnya (Price dan Allen 2004; Price et al. 2005). Regenerasi ranggah bersifat tahunan dan terjadi secara berulang disepanjang hidup Cervidae jantan. Fenomena tersebut dipengaruhi oleh keberadaan testosteron dengan
konsentrasi berbeda sesuai dengan tahapan regenerasi ranggah (Suttie et al. 1992). Pada roe deer (Capreolus capreolus), pertumbuhan ranggah
berlangsung setelah bulan Januari di saat periode pencahayaan dan konsentrasi testosteron mulai meningkat. Namun pada sebagian besar Cervidae lainnya, proses tersebut terjadi pada musim panas (Sempere dan Boissin 1981).
15
Tahap ini merupakan tahap akhir yang ditandai dengan berlanjutnya proses osifikasi kondrogenik hingga terbentuk ranggah. Onset formasi ranggah ditandai dengan munculnya selaput tipis (velvet skin) yang menutupi bagian ujung distal pedicle.
Biosintesis dan Metabolisme Androgen
Pada hewan jantan terdapat tiga jenis hormon steroid yang berperan penting dalam sistem reproduksi, yaitu testosteron, dihidrotestosteron dan estradiol. Dari ketiga jenis hormon steroid tersebut, testosteron memiliki peran dominan. Sekitar 95% testosteron disintesis dan disekresikan oleh sel-sel Leydig tubuli semeniferi testis, sedangkan sebagian kecil lainnya disekresikan oleh kelenjar adrenal. Selain testosteron, sel-sel Leydig testis juga mensekresikan androgen lainnya, yaitu dehidrostestosteron (DHT), dehidroepiandrosteron (DHEA) dan androstenedion yang kurang memiliki efek androgen dibandingkan testosteron. Sel-sel Leydig juga menghasilkan beberapa hormon steroid lainnya dalam jumlah kecil, seperti estradiol, estron, pregnenolon, 17α -hidroksipregnenolon dan 17α-hidroksiprogesteron (Braunstein 1997).
Pada vertebrata, biosintesis hormon steroid seperti testosteron dan metabolitnya berasal dari kolesterol sebagai prekursor hormon (Koolman dan Röhm 2001). Biosintesis testosteron oleh sel-sel Leydig dapat berlangsung akibat stimulus luteinizing hormone (LH) yang dihasilkan oleh sel-sel LH di hipofise anterior. Hormon ini bekerja secara sinergis dengan follicle stimulating hormone (FSH) dan prolaktin. Peran prolaktin pada proses sintesis testosteron adalah dengan meningkatkan jumlah dan afinitas reseptor LH di membran sel Leydig. Adanya interaksi antara LH dan reseptornya akan mengaktifkan sistem adenilat siklase, termasuk aktivasi protein kinase dan sintesis RNA (Pineda 2003), sehingga terjadi peningkatan sintesis pregnenolon dengan jumlah rantai karbon 21 (C21) dari kolesterol (C27) oleh mitokondria sel-sel Leydig. Hasil akhir dari proses tersebut adalah testosteron (C19) (Koolman dan Röhm 2001; Pineda 2003).
17
Testosteron yang memasuki sirkulasi darah terikat pada albumin serum dan steroid hormone-binding globulin (SHBG). Senyawa ini merupakan suatu glikosilasi protein dimer yang terutama diekspresikan di hati dan selanjutnya memasuki sel secara difusi. Testosteron dapat dikonversikan menjadi 5α-DHT oleh dua tipe isoenzim mikrosomal, yaitu 5α-reduktase-1 dan 5α-reduktase-2.
Enzim 5α-reduktase-2 akan mengkonversi testosteron menjadi 5α-DHT pada organ genital. Enzim ini dikode oleh gen SRD5A2 yang terdapat di kromosom 2 (2p23) dan hanya diekspresikan oleh jaringan genital yang bergantung pada androgen. Selain itu, testosteron juga dapat diaromatisasi menjadi estradiol-17β oleh enzim aromatase sitokrom P450 (P450arom) di jaringan perifer. Walaupun estradiol-17β merupakan hormon steroid utama pada betina, namun pada jantan hormon ini diperlukan dalam konsentrasi kecil pada proses spermatogenesis, libido, dan beberapa fungsi reproduksi lainnya (Meaden dan Chedrese 2009).
Menurut Hodges dan Heistermann (2003); Heisterman (2010), hormon steroid yang beredar di sirkulasi darah akan mengalami perubahan metabolik di hati atau ginjal sebelum dieliminasi oleh tubuh. Perubahan yang terjadi secara alami bervariasi di antara spesies hewan, baik dari jenis metabolit maupun jalur ekskresinya. Informasi yang diperoleh dari variasi tersebut, pada tahap berikutnya akan bermanfaat untuk memilih teknik pengukuran metabolit hormon steroid dan interpretasi hasil yang akurat. Metabolisme hormon steroid seperti androgen secara mayoritas berlangsung di hati, namun beberapa aktivitas katabolik juga berlangsung di ginjal. Metabolit steroid yang dihasilkan akan diekskresikan oleh ginjal melalui urin, sedangkan sistem empedu mengekskresikan metabolit melalui feses (Amaral et al. 2009).
Hormon androgen yang beredar di sirkulasi darah akan dikonversikan oleh hati menjadi beberapa metabolit androgen, seperti androsteron dan etiokolanolon. Metabolit androgen tersebut selanjutnya akan terkonjugasi dengan glukoronik dan asam sulfat sebelum diekskresikan melalui urin sebagai 17-ketosteroid (sekitar 20-30%), sedangkan sisanya merupakan hasil metabolisme steroid kelenjar adrenal (Meaden dan Chedrese 2009).
Metode Pengukuran Konsentrasi Metabolit Steroid
18
ternak, namun teknik tersebut sedikit berisiko bila dilakukan pada satwa liar, karena harus melewati prosedur imobilisasi dengan bahan kimia dan restrain fisik (Hamasaki et al. 2001). Oleh karena itu perlu dilakukan teknik pemeriksaan lainnya yaitu dengan teknik non invasif. Teknik ini sangat sesuai bila diaplikasikan pada satwa liar untuk tujuan penelitian jangka panjang (longitudinal study), baik di lingkungan in situ maupun ex situ. Dengan pendekatan non invasif, hewan terhindar dari stres akibat proses restrain yang biasa dilakukan pada teknik invasif. Teknik non invasif dapat diaplikasikan untuk menganalisis metabolit hormon yang terdapat pada feses dan urin (Mateo dan Cavigelli 2005; Washburn et al. 2004). Poole et al. (1984), menggunakan teknik tersebut untuk menentukan konsentrasi testosteron dari sampel feses dan urin gajah liar afrika (Loxodonta africana), Hamasaki et al. (2001) pada sika deer (Cervus nippon), Morato et al. (2004) pada jaguar (Panthera onca), dan Mauget et al. (2007) pada chinese water deer (Hydropotes inermis)
Pada tahap berikutnya penelitian mengenai teknik ini terus berkembang, terutama yang berhubungan dengan improvisasi metode analisis, transportasi dan purifikasi sampel (Ziegler dan Wittwer 2005). Proses validasi monitoring non invasif terhadap variasi metabolit androgen yang terdapat di dalam ekstrak feses juga telah dilakukan pada beberapa spesies satwa liar, seperti spotted hyena (Crocuta crocuta) (Dloniak et al. 2004) dan Gajah Afrika (Loxodonta africana) (Ganswindt et al. 2005). Pada satwa betina aplikasi teknik ini telah dilaporkan untuk menentukan siklus ovariumnya, seperti pada badak putih (Ceratotherium simum simum) (Patton et al. 1999; Schwarzenberger et al. 1998), schimitar horned-oryx (Oryx dammah) (Morrow dan Monfort 1998) dan okapi (Okapia jhonstoni) (Kusuda et al. 2007).
19
sampling feses di lapangan adalah menyimpan sampel menggunakan alkohol sebagai bahan preservatif hingga tahap analisis dilakukan. Namun metode ini memiliki kelemahan, yaitu dapat menyebabkan terjadinya perubahan struktur
steroid hormon akibat terbatasnya udara pada saat transportasi (Khan et al. 2002). Untuk itu, telah dilakukan beberapa metode penyimpanan
yang dapat mempertahahankan kondisi sampel yang dikoleksi, seperti pembekuan sampel (freezing samples), dan pengeringan sampel (drying samples). Proses pengeringan (lyophilization) sampel feses merupakan tahapan penting untuk mengawetkan metabolit hormon steroid agar dapat disimpan dalam waktu lama, sehingga konsentrasi metabolit steroid yang akan diperiksa tidak berubah secara signifikan (Hunt dan Wasser 2003). Tahap berikutnya adalah ekstraksi sampel di yang dilanjutkan dengan tahap analisis laboratorium. Sampel feses yang telah diekstraksi dapat dianalisis secara langsung dengan teknik enzymeimmunoassay menggunakan antibodi spesifik terhadap hormon yang akan dideteksi (Ziegler dan Wittwer 2005).
Pengukuran hormon dan metabolit hormon biasanya dilakukan dengan prosedur imunologi menggunakan antibodi hormon atau antibodi grup spesifik hormon. Ada dua metode immunoassay yang tersedia, yaitu radioimmunoassay (RIA) dan enzyme immunoassay (EIA). Metode RIA dilakukan dengan melabel hormon dengan marker radioaktif tertentu, sedangkan EIA menggunakan preparasi enzim atau enzim yang dilabel dengan biotin. Metode EIA lebih dipilih karena tidak menimbulkan efek radioaktif seperti RIA. Selain itu biaya asai lebih murah dibandingkan dengan RIA (Hodges dan Heistermann 2003). Aplikasi metode EIA terhadap metabolit androgen feses dari spesies rusa telah dilaporkan pada pampas deer (Ozotoceros bezoarticus bezoarticus) (Pereira et al. 2005), dan red brocket buck (Mazama americana) (Versiani et al. 2009). Meode tersebut telah terbukti sebagai metode yang tepat
dan praktis untuk mengetahui status reproduksi pada kedua spesies rusa tersebut.
Anatomi Organ Reproduksi Jantan
20
menuju uretra (Colville dan Bassert 2002). Selain itu terdapat pula kelenjar asesoris kelamin yang terdiri atas: glandula vesikularis, glandula prostata dan glandula bulbouretralis (Tabel 1). Kelenjar asesoris kelamin tersebut berperan sebagai organ yang menghasilkan bahan pembentuk plasma semen (Haron et al. 1999). Uretra adalah saluran reproduksi jantan yang berjalan di sepanjang penis dan berfungsi untuk menyalurkan urin dan semen. Sedangkan penis merupakan organ kopulasi jantan yang menyalurkan semen ke dalam organ reproduksi betina saat terjadi ejakulasi (Senger 2005).
Tabel 1 Kelenjar asesoris kelamin pada beberapa spesies hewan.
Spesies Glandula Vesikularis Glandula Prostata Glandula Bulbourethralis
Sapi + + +
Anjing - + -
Kuda + + +
Kucing - + +
Llamas - + +
Domba + + +
Babi + + +
(Sumber: Pineda 2003).
23
Setelah melalui tahapan berikutnya, jaringan testis difiksasi dengan glutaraldehid buffer 4% dan dibuat sediaan histologi untuk selanjutnya diwarnai dengan pewarna toluidine blue. Durasi spermatogenesis pada berbagai spesies hewan bervariasi, pada sapi berlangsung selama 54 hari, babi 39 hari, domba 47 hari dan manusia 74 hari (Juneja dan Koide 2000).
Androgen adalah hormon steroid jantan yang berperan penting dalam proses spermatogenesis. Target androgen pada jaringan testis adalah sel Leydig dan sel Sertoli. Testosteron merupakan androgen utama yang disintesis oleh sel Leydig testis. Hormon ini memiliki efek parakrin pada sel Sertoli, yaitu sebagai salah satu komponen penting pada saat spermatogenesis. Sedangkan pada sel Leydig, testosteron memiliki efek otokrin yang berfungsi untuk menginisiasi diferensiasi dan fungsi sel Leydig pada masa pubertas (Shan et al 1997). Aktivitas androgen pada jaringan testis seperti pada sel Leydig dan sel Sertoli dapat diketahui melalui deteksi terhadap reseptor yang terdapat pada sel-sel tersebut. Aksi androgen dimediasi oleh reseptor intraselular yang berperan sebagai faktor transkripsi akibat adanya ikatan antara ligan dengan reseptor tersebut (Madjig et al. 1995).
Beberapa peneltian tentang lokalisasi reseptor androgen telah dilaporkan, seperti pada tikus (Bremner et al. 1994), yang menyatakan bahwa reseptor androgen pada setiap tahapan spermatogenesis menunjukkan ekspresi berbeda. Pada sel Sertoli testis tikus, ekspresi reseptor androgen dapat dideteksi pada tahap II-VII dengan level tertinggi pada tahap VII dari siklus tubuli seminiferi. Selain itu, reseptor androgen ditemukan juga pada jaringan testis lainnya seperti sel myoid peritubular, arteriol dan sel Leydig, namun tidak ditemukan pada sel-sel germinal. Ekspersi reseptor androgen pada jaringan sel-selain sel-sel Sertoli, tidak berhubungan dengan tahapan spermatogenesis yang berlangsung pada tubuli seminiferi yang berdekatan dengan jaringan tersebut.
24
Morfologi dan Kualitas Semen
Kualitas semen merupakan salah satu parameter yang dapat menentukan status reproduksi pada Cervidae jantan. Pada red deer (Cervus elaphus), kualitas semen menunjukkan perbedaan pada setiap periode reproduksinya, yaitu pada periode pre-mating, mating dan post-mating. Kualitas semen yang terbaik ditemukan pada saat periode musim kawin (mating), yang berlangsung dari akhir September sampai akhir Oktober. Kondisi tersebut ditandai dengan tingginya libido rusa jantan untuk mengawini betina (Gizejewski 2004). Selanjutnya dijelaskan oleh Monfort et al. (1995) bahwa musim juga berpengaruh pada kualitas semen eld’s deer (Cervus eldi thamin). Volume semen tertinggi pada rusa tersebut ditemukan pada musim dingin yaitu: 3.49 ± 0.36 ml, musim panas: 2.95 ± 0.42 ml dan musim gugur 2.11 ± 0.61 ml.
Sedangkan volume terendah ditemukan pada musim semi 0.69 ± 0.03 ml.
Spermatozoa merupakan sel berbentuk panjang dan motil, berperan sebagai agen pengantar genom haploid jantan menuju oosit betina. Spermatozoa terbagi atas kepala yang mengandung inti (nukleus) dan ekor (flagellum) yang memiliki bagian leher (connecting piece), badan ekor (mid-piece), ekor utama (principle piece) dan ujung ekor (end-piece) (Gambar 9) (Manandhar dan Sutovsky 2007). Secara umum, kepala spermatozoa berbentuk oval dengan struktur kromatin padat dan berinti tipis serta dilapisi oleh tudung akrosom di bagian anterior dan selubung post akrosom di bagian posterior (Barth dan Oko 1989). Struktur kromatin pada inti spermatozoa lebih padat 6–10 kali lipat dibandingkan struktur kromatin pada tahap metafase kromosom saat pembelehan sel somatis (Manandhar dan Sutovsky 2007). Sedangkan akrosom merupakan struktur pelindung dengan lapisan ganda, terletak di antara plasma membran dan bagian anterior kepala spermatozoa, berfungsi sebagai pelindung inti selama tahap akhir formasi spermatozoa. Selain itu akrosom mengandung akrosin, enzim hialuronidase dan enzim-enzim hidrolitik lainnya yang berperan dalam proses fertilisasi (Garner dan Hafez 2000).
26
meningkatkan populasi dan mutu genetik ternak. Menurut Pesch dan Hoffmann (2007), teknik IB menggunakan ejakulat hasil kriopreservasi telah dilakukan pada program budidaya sapi sejak 60 tahun yang lalu, dan bertujuan untuk mencegah penularan agen infeksi organ genital yang dapat terjadi pada perkawinan alami. Namun, menurut Rizal (2005), teknik ini belum banyak dilakukan pada ternak ruminansia kecil karena terdapat beberapa kendala teknis, seperti sulitnya deposisi semen pada saluran reproduksi betina saat pelaksanaan IB, ukuran serviks yang kecil serta tidak memungkinkan dilakukannya palpasi rektal seperti pada ternak besar. Dengan demikian diperlukan upaya untuk meningkatkan kualitas ejakulat dan saat yang tepat untuk pelaksanaan IB.
Menurut Morrow et al. (2009), aplikasi IB untuk tujuan manajemen genetik pada Cervidae dan sapi non domestik (antelop) mengalami beberapa kendala, seperti; 1) terbatasnya informasi tentang karakterisitik reproduksi yang bersifat spesifik spesies, 2) sulitnya untuk mengurangi stres akibat handling yang dilakukan, 3) kegagalan kebuntingan, dan 4) tantangan terhadap regulasi impor semen. Teknik IB pada spesies non domestik tersebut telah diuji coba pada beberapa peternakan rusa dan antelop dengan mengadaptasi protokol IB pada sapi.
Sejauh ini penerapan teknik IB pada Cervidae sudah dilakukan pada red deer (C. elaphus) dengan metode IB intrauterin dengan tindakan laparoskopi (High dan Bowen 1991; Asher et al. 2000), pada white-tailed deer (Odocoileus virginianus) dengan IB intraservikal dan intrauterin (Jacobson et al. 1989) dan pada rheindeer (Rangifer tarandus) secara intraservikal dan intravaginal (Asher et al. 2000). Namun teknik IB dengan berbagai metode tersebut belum pernah dilakukan pada muncak.
27
ANATOMI DAN HISTOLOGI ORGAN REPRODUKSI
MUNCAK JANTAN
Abstrak
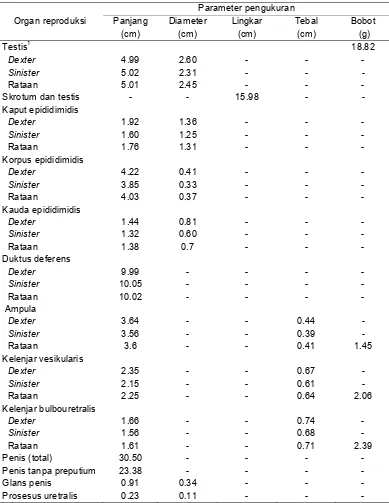
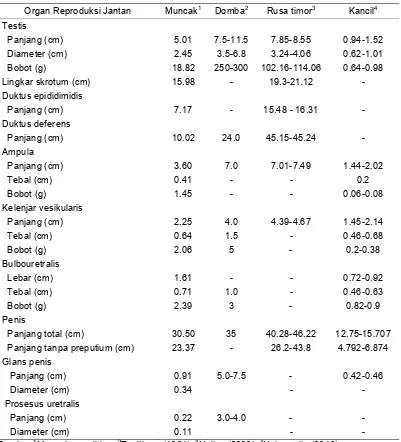
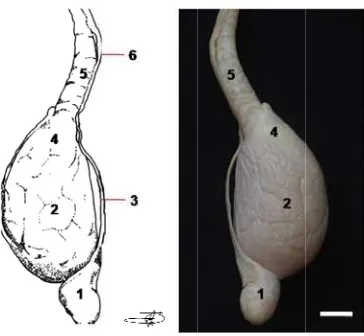
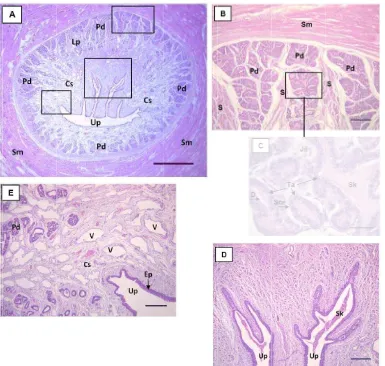
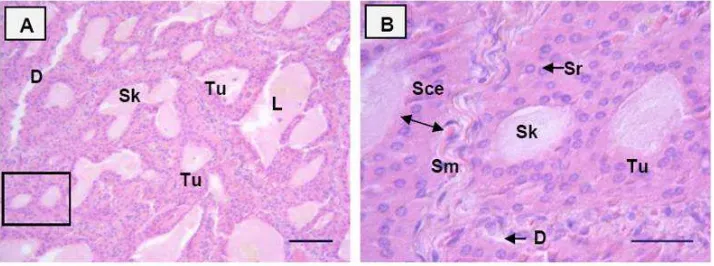
Informasi dasar mengenai aspek anatomi dan histologi organ reproduksi muncak (Muntiacus muntjak muntjak) hingga saat ini belum pernah dilaporkan. Data morfologi, morfometri, struktur histologi, dan histomorfometri organ reproduksi muncak yang diperoleh pada penelitian ini dapat menjelaskan fungsi setiap organ pada saat berlangsungnya aktivitas reproduksi selama periode pertumbuhan ranggah. Oleh karena itu, penelitian ini bertujuan untuk menggali informasi mengenai karakteristik anatomi dan histologi organ reproduksi muncak jantan pada periode ranggah keras. Seekor muncak jantan dewasa yang diberi kode ♂#1, berumur 4-5 tahun dengan bobot badan 19 kg terlebih dahulu di-exanguinasi untuk memperoleh organ reproduksi yang meliputi testis, duktus epididimidis, duktus deferens, kelenjar asesoris kelamin, dan penis yang diamati secara makroskopis dan mikroskopis. Hasil pengamatan menunjukkan bahwa organ reproduksi muncak jantan memiliki sepasang testis yang relatif kecil dengan lingkar testis berikut skrotum 15.98 cm, dan bobot 18.82 g. Karakteristik lainnya adalah kelenjar prostat tidak teramati secara makroskopis, kelenjar bulbouretralis berukuran besar, serta penis berukuran relatif panjang membentuk fleksura sigmoidea dan glans penis berukuran kecil dengan bagian dorsal yang cembung. Panjang penis tanpa preputium adalah 23.37 cm, sedangkan panjang prosesus uretralisnya hanya 0.22 cm. Secara histologi, struktur pars diseminata prostat ditemukan disekeliling uretra pars pelvina. Tebal lapis epitel kaput, korpus dan kauda epididimidis berturut-turut adalah 62.21 ± 4.21 µm, 49.53 ± 3.01 µm, dan 16.30 ± 2.27 µm. Perbedaan ketebalan lapis epitel tersebut berhubungan dengan fungsi penyerapan, pematangan dan penyimpanan spermatozoa. Tipe kelenjar tubuloalveolar ditemukan pada ampula, kelenjar vesikularis dan pars diseminata prostat, sedangkan tipe kelenjar tubular ditemukan pada kelenjar bulbouretralis. Dapat disimpulkan bahwa secara umum morfologi organ reproduksi muncak jantan mirip dengan ruminansia kecil lainnya seperti kambing dan domba, serta rusa timor dan pampas deer pada periode ranggah keras, namun morfometrinya berbeda.
Kata kunci: anatomi dan histologi, organ reproduksi jantan, muncak
Abstract
30
and microscopically. The result showed that muntjak had small testis with scrotal circumference and it weight were 15.98 cm and 18.82 g Other characteristics were unappeared of prostate gland macroscopically, conspicuous of bulbourethral gland, and long penis with sigmoid flexure and small gland penis with convex shape in it dorsal region. The length of penis included of urethral processus were 23.37 cm and 0.22 cm. Histologicaly, pars disseminate prostate gland was observed around of urethra pelvina. Aditionally, the thickness of epithelial lining of caput, corpus, and cauda epididymidis were 62.21 ± 4.21 µm, 49.53 ± 3.01 µm, and 16.30 ± 2.27 µm respectivelly. The differentiation of epithelial thickness correlated to their function in fluid absorption, maturation and sperm storage. In addition tubuloalveolar glands were found in the ampullae, vesicular gland, and also in pars disseminate prostate gland, whereas tubular glands were found in bulbourthral gland. In conclusion, the morphology of reproductive organs of adult male muntjak in hard antler period are somewhat similar to the other small ruminants, e.g. goat and ram, and also other cervids, e.g. timor deer and pampas deer during hard antler period but it differed in morphometry.
Keywords: anatomy and histology, male reproductive organs, muntjak
Pendahuluan
Organ reproduksi jantan mamalia terdiri atas testis, duktus epididimidis, duktus deferens, kelenjar asesoris kelamin: ampula, kelenjar vesikularis, prostat dan bulbouretralis, serta penis. Testis memiliki fungsi gametogenesis dan steroidogenesis. Fungsi gametogenesis dikenal dengan spermatogenesis, bertujuan untuk menghasilkan spermatozoa, sedangkan fungsi steroidogenesis bertujuan untuk mensintesis hormon steroid jantan yaitu testosteron (Weinbauer et al. 2010). Spermatozoa yang berada di lumen tubuli seminiferi testis ditransfer oleh rete testis ke duktus eferen, dan selanjutnya memasuki kaput, korpus dan kauda epididimidis. Ketiga bagian duktus epididimidis memiliki fungsi spesifik dalam proses pematangan dan penyimpanan spermatozoa sebelum disalurkan melalui duktus deferens menuju ampula dan uretra (Wrobel dan Bregmann 2006). Sebelum diejakulasikan melewati uretra, spermatozoa terlebih dahulu bergabung dengan plasma semen yang dihasilkan oleh kelenjar asesoris. Sebagai organ kopulasi, penis berfungsi sebagai organ untuk menyalurkan semen ke saluran reproduksi betina (Senger 2005).
31
umumnya, penis ruminansia termasuk Cervidae bertipe fibroelastik dengan fleksura sigmoidea di bagian korpus penis. Namun pada mamalia lainnya seperti kuda, memiliki penis bertipe muskulo-kavernosus. Variasi morfologi organ reproduksi jantan secara makroskopis tersebut tentu saja diikuti dengan adanya variasi secara mikroskopis.
Cervidae jantan dengan pola reproduksi musiman (seasonal), memperlihatkan perubahan morfologi dan morfometri pada organ reproduksinya, baik secara makroskopis maupun mikroskopis. Perubahan tersebut dipengaruhi oleh faktor lingkungan seperti intensitas pencahayaan (photoperiod) dan ketersediaan pakan di alam. Akibatnya pada periode tertentu, aktivitas reproduksi Cervidae berhenti secara temporer bersamaan dengan turunnya konsentrasi testosteron di sirkulasi darah. Kondisi tersebut berkorelasi erat dengan morfometri dan morfofungsi organ reproduksinya, seperti yang dilaporkan pada red deer, Cervus elaphus (Lincoln 1985); fallow deer, Dama dama (Asher and Peterson 1991); roe deer, Capreolus capreolus (Sempere
1990), korean water deer, Hydropotes inermis argyropus (Shon dan Kimura 2012). Namun demikian, seberapa besar pengaruh lingkungan terhadap perubahan morfometri dan morfofungsi organ reproduksi pada muncak jantan belum dilaporkan.
32
Bahan dan Metode
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Riset Anatomi, Bagian Anatomi, Histologi dan Embriologi, Departemen Anatomi, Fisiologi dan Farmakologi Fakultas Kedokteran Hewan Institut Pertanian Bogor. Penelitian ini dimulai dari bulan Januari sampai Desember 2009.
Hewan Penelitian
Pada penelitian ini digunakan seekor muncak jantan dewasa normal dengan kode ♂#1 dan telah memiliki ranggah keras, berumur antara 4-5 tahun dengan berat badan 19 kg. Muncak tersebut secara klinis dinyatakan sehat dan telah memperlihatkan aktivitas reproduksi. Muncak diperoleh dari Kabupaten Cilacap, Jawa Tengah, dengan ijin tangkap berdasarkan Surat Keputusan Menteri Kehutanan Republik Indonesia Nomor: SK. 23/Menhut-II/2011.
Bahan dan Alat
Bahan yang digunakan meliputi: anastetikum xylazin HCl 2% (Seton®) dan ketamin HCl 10% (Ketamil®), NaCl fisiologis, paraformaldehid 4%, alkohol dengan konsentrasi bertingkat (70, 80, 90, 95% dan absolut), silol, parafin, akuades, pewarna hematoksilin-eosin (HE) dan bahan perekat Entelan®
.
Sedangkan alat-alat yang digunakan adalah: spuit ukuran 5 ml, scalpel, kateter, arteri klem, pinset, gunting, wadah penyimpan jaringan, tissue cassette, micro calliper digital (mm), pita ukur (cm), cawan petri, gelas objek dan penutup,
inkubator 37OC, inkubator parafin, blok kayu, bunsen, mikrotom, penangas air, hot plate, termometer, mikroskop (Olympus CH30, Japan) dan kamera digital
(Sony Cyber-shot DSC-W30 dan Canon Power Shot A540).
Metode Penelitian
Orientasi eksternal testis dan epididimis yang masih terbungkus skrotum diamati sebelum muncak di-exanguinasi. Pengamatan dilakukan saat muncak berada pada posisi berdiri sehingga testis dan skrotum terlihat jelas dan selanjutnya didokumentasikan. Hasil pemotretan dibandingkan dengan orientasi testis dan epididimis pada beberapa ruminansia dan mamalia lainnya.
33
ketamin HCl dengan dosis masing-masing 1 mg/kg berat badan. Prosedur
exanguinasi dilakukan dengan cara mengeluarkan darah dari arteri Carotis communis dan diperfusi dengan mengalirkan larutan paraformaldehid 4% melalui
arteri yang sama. Pengambilan organ reproduksi jantan dilakukan secara laparotomi medianus di daerah inguinal.
Morfologi dan morfometri organ reproduksi muncak
Organ reproduksi muncak jantan yang digunakan pada tahap ini merupakan organ yang telah difiksasi dengan larutan paraformaldehid 4%. Parameter pengamatan terhadap morfologi dan morfometri secara makroskopis, meliputi ukuran panjang, lebar, dan berat setiap bagian organ reproduksi, yaitu testis berikut duktus epididimidis, duktus deferens, kelenjar asesoris kelamin, dan penis. Organ reproduksi dipreparir untuk memisahkan testis dan duktus epididimidis dari skrotum, hingga seluruh bagian duktus deferens, ampula, kelenjar asesoris kelamin (kelenjar vesikularis, kelenjar bulbouretralis), dan penis dipisahkan dari tubuh. Selanjutnya dilakukan pengukuran organ reproduksi muncak jantan yang meliputi panjang, lebar dan ketebalan. Penimbangan organ reproduksi dilakukan setelah masing-masing bagian organ reproduksi dipisahkan, sehingga diperoleh testis berikut duktus epididimidis, duktus deferens, kelenjar asesoris kelamin (ampula, kelenjar vesikularis dan kelenjar bulbouretralis) dan penis. Prosedur pengukuran organ reproduksi diuraikan sebagai berikut:
Skrotum
Lingkar skrotum berikut testis diukur dengan cara melingkarkan pita ukur pada lingkaran terbesar dari skrotum.
Testis
Pengukuran dilakukan setelah testis dipisahkan dari skrotum. Panjang testis diukur dengan cara menempatkan pita ukur dari ekstremitas kapitata ke ekstremitas kaudata. Diameter testis diukur pada bagian terbesar dari testis, yaitu dari margo epididimalis ke margo liber testis. Bobot testis beserta epididimidis ditimbang dengan meletakkan testis dexter et sinister beserta epididimis dalam cawan petri yang telah diletakkan di atas timbangan digital bersatuan gram (g).
Duktus epididimidis
34
pada bagian proksimal ekstremitas kapitata (awal kaput) hingga bagian menyempit yang berbatasan dengan korpus epididimidis; panjang korpus diukur dari bagian distal kaput epididimidis hingga bagian distal ekstremitas kaudata, sedangkan panjang kauda diukur dari distal ekstremitas kaudata sampai ujung distal kauda epididimidis. Lebar kaput, korpus, dan kauda epididimidis juga diukur pada masing-masing bagian terlebar menggunakan mikrokaliper.
Kelenjar asesoris kelamin
Panjang ampula dexter et sinister diukur mulai dari pembesaran duktus deferens hingga bagian kaudal yang berbatasan dengan kelenjar vesikularis. Panjang kelenjar vesikularis dexter et sinister diukur dari bagian kauda ampula sampai ujung kranial kelenjar vesikularis. Kelenjar bulbouretralis diukur dari kranial ke kaudal kelenjar tersebut yang berada di proksimal muskulus bulbospongiosus. Pengukuran bobot sepasang ampula, kelenjar vesikularis, dan kelenjar bulbouretralis ditimbang dengan menempatkan masing-masing kelenjar di atas cawan petri yang diletakkan di atas timbangan digital.
Penis
Pengukuran panjang total penis dimulai dari radiks penis hingga ke ujung bebas penis. Pengukuran panjang juga dilakukan pada bagian-bagian penis seperti glans penis dan prosesus uretralis. Diameter penis diukur pada bagian yang terbesar dari penis. Pengukuran diameter juga dilakukan pada glans penis dan prosesus uretralis.
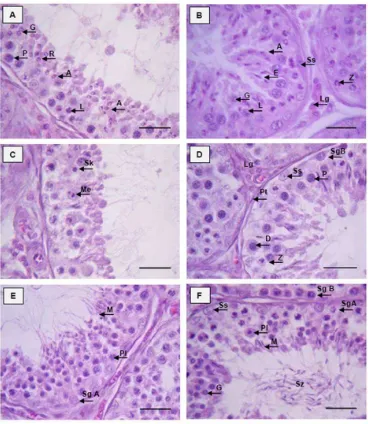
Histologi organ reproduksi muncak
Pengamatan struktur histologi organ reproduksi muncak dilakukan secara mikroskopis terhadap jaringan testis, kelenjar asesoris kelamin dan penis. Jaringan testis dan duktus epididimidis yang masih menempel dengan testis dipotong menjadi beberapa bagian kecil berukuran 0.5 cm2. Untuk kelenjar asesoris, sampel yang diambil mengikuti besar kecilnya organ tersebut yang disayat secara transversal. Sampel penis diambil pada bagian korpus penis. Untuk mengetahui posisi kelenjar prostat diambil jaringan pada bagian uretra pars pelvina antara ujung kaudal testis dan kranial kelenjar bulbouretralis. Proses pembuatan preparat histologi (Kiernan 1990) meliputi tahapan sebagai berikut:
• fiksasi jaringan dengan larutan paraformaldehid 4%
35
• dehidrasi jaringan dalam larutan alkohol konsentrasi bertingkat (70%, 80%, 90%, 95% dan absolut) dan clearing atau penjernihan dalam larutan silol dengan tiga kali ulangan
• infiltrasi di dalam parafin cair dengan tiga kali ulangan, dilanjutkan dengan penanaman jaringan (embedding) dalam parafin
• pembuatan blok parafin, sectioning dan pewarnaan dengan pewarna HE.
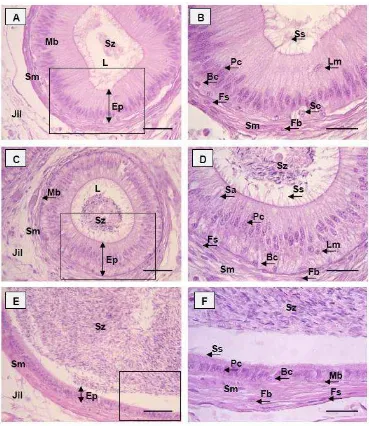
Pengamatan mikroskopis meliputi struktur histologi umum jaringan testis dan duktus epididimidis bagian kaput, korpus dan kauda epididimidis; duktus deferens; kelenjar asesoris kelamin: ampula, kelenjar vesikularis; bagian uretra pars pelvina untuk mengetahui posisi pars diseminata prostat, dan kelenjar bulbouretralis; serta organ kopulatoris (penis). Pengukuran dilakukan untuk mendapatkan data histomorfometri testis dan duktus epididimidis. Parameter histomorfometri testis meliputi: lebar tubuli seminiferi dan lumen, serta ketebalan lapisan sel epitel germinal (diukur dari membran basal sampai adluminal tubuli seminiferi testis). Parameter pengukuran duktus epididimis meliputi: lebar duktus dan lumen, serta ketebalan lapisan epitel tanpa stereosilia pada kaput, korpus dan kauda epididimidis (Arrighi et al. 2010).
Pengamatan dan pengukuran histomorfometri tubuli seminiferi dan ketiga bagian duktus epididimis dilakukan terhadap potongan transversal dari 30 tubuli seminiferi testis, dan dari 10 duktus epididimidis pada masing-masing bagian (kaput, korpus dan kauda). Pengamatan dan pengukuran menggunakan mikroskop cahaya serta skala mikrometer dengan perbesaran lensa objektif 10 kali. Seluruh parameter diukur menggunakan program Image J (Mc Master Biophotonic Facility).
Analisis Data
36
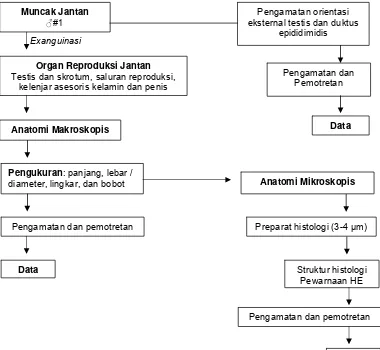
Gambar 10 Bagan alir disain penelitian I: anatomi dan histologi organ reproduksi muncak jantan.
Muncak Jantan ♂#1 Exanguinasi
Anatomi Makroskopis
Anatomi Mikroskopis
Pengamatan orientasi eksternal testis dan duktus
epididimidis
Organ Reproduksi Jantan
Testis dan skrotum, saluran reproduksi, kelenjar asesoris kelamin dan penis
Pengukuran: panjang, lebar / diameter, lingkar, dan bobot
Struktur histologi Pewarnaan HE
Data
Pengamatan dan Pemotretan
Pengamatan dan pemotretan
Data
Preparat histologi (3-4 µm)
Pengamatan dan pemotretan