PEMURNIAN DAN PENCIRIAN PROTEASE DARI ISOLAT
BAKTERI W-1 YANG DIHASILKAN OLEH TAUCO HITAM
WIWIT KUMALA DEWI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
WIWIT KUMALA DEWI. Pemurnian dan Pencirian Protease dari Isolat Bakteri W-1 yang Dihasilkan oleh Tauco Hitam. Dibimbing oleh IRMA H SUPARTO dan YANTI.
Enzim protease dari isolat bakteri W-1 yang diisolasi dari tauco hitam memiliki aktivitas fibrinolitik. Penelitian ini bertujuan memurnikan dan mencirikan protease dari isolat bakteri yang diisolasi dari tauco hitam yang merupakan salah satu makanan fermentasi tradisional Indonesia.
ABSTRACT
WIWIT KUMALA DEWI.Purification and Characterization of Protease Produced from Bacteria W-1 Isolated from Black Tauco. Under the direction of IRMA H SUPARTO and YANTI.
Protease which was produced by bacteria W-1 isolated from black tauco an Indonesian traditional fermented food, showed fibrinolytic activity. Therefore, the purpose of this research was to study the purification and characterization of protease produced by bacteria W-1 isolated from black tauco.
PEMURNIAN DAN PENCIRIAN PROTEASE DARI ISOLAT
BAKTERI W-1 YANG DIHASILKAN OLEH TAUCO HITAM
WIWIT KUMALA DEWI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul :
Pemurnian dan Pencirian Protease dari Isolat Bakteri W-1 yang
Dihasilkan oleh Tauco Hitam
Nama : Wiwit Kumala Dewi
NIM : G01400049
Menyetujui:
Pembimbing I, Pembimbing II,
dr Irma H Suparto, M.S. Yanti, M.Si.
NIP 131606776 NIP 120041094
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, M. S.
NIP 131473999
RIWAYAT HIDUP
Penulis dilahirkan di Duri-Riau pada tanggal 26 Februari 1982 dari ayah Ali Suar dan ibu Zamnidar. Penulis merupakan putri keempat dari enam bersaudara.
Tahun 2000 penulis lulus dari SMU Negeri 1 Mandau dan pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis diterima di Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah melaksanakan praktik lapangan di Laboratorium Biosistematika dan Genetika, Bidang Mikrobiologi Pusat Penelitian Biologi LIPI, Bogor pada tahun 2004.
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan karya ilmiah ini. Penelitian dilaksanakan dari bulan Juni sampai dengan Desember 2005 dengan judul Pemurnian dan Pencirian Protease dari Isolat Bakteri W-1 yang Dihasilkan oleh Tauco Hitam. Penelitian dilakukan di Laboratorium Biokimia dan Teknologi Enzim, Fakultas Teknobiologi, Universitas Katolik Atma Jaya, Jakarta.
Terima kasih penulis ucapkan kepada dr Irma H Suparto, M.S dan Yanti, M.Si selaku pembimbing yang telah memberikan waktu, bimbingan, saran, dan pengarahan kepada penulis dalam menyelesaikan karya ilmiah ini. Ungkapan terima kasih juga penulis sampaikan untuk keluarga tercinta Papa, Mama, kakak-kakakku, adikku (Budi dan Elin), dan keponakanku (Imam, Alif, Abin, dan Caca), yang telah memberikan kasih sayang serta doanya dalam membantu penulis menyelesaikan tugas ini. Ucapan terimakasih kepada Muhamad Arief Setiawan atas dukungan dan doanya. Penelitian ini juga tidak lepas dari bantuan beberapa pihak, oleh karena itu penghargaan penulis sampaikan kepada Mas Yudi, Mas Bambang, Mas Ridwan (Laboratorium Biokimia dan Teknologi Enzim Atma Jaya), Santi, dan Dian selaku rekan-rekan seperjuangan dalam pelaksanaan penelitian ini. Terima kasih penulis ucapkan kepada Cicih, Iduy, dan Zendy atas diskusi dan masukan-masukan yang sangat berharga, teman-teman angkatan 37 (khususnya C-8) dan 38 atas kebersamaannya, dan mas Hery atas bantuannya selama ini. Serta semua pihak yang tidak dapat penulis sebutkan satu persatu.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Februari 2006
DAFTAR ISI
Halaman
DAFTAR TABEL... x
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN... xi
PENDAHULUAN TINJAUAN PUSTAKA Tauco ... .1
Protease fibrinolitik... 2
Pemurnian enzim ... 3
SDS-PAGE dan zimografi ... 4
Kromatografi penukar ion ... 4
BAHAN DAN METODE Alat dan bahan ... 5
Metode penelitian... 5
HASIL DAN PEMBAHASAN Penapisan isolat yang berasal dari sampel tauco hitam ... 8
Produksi dan ekstraksi enzim ... 8
Hasil Pemurnian enzim... 8
Hasil Presipitasi ... 8
Hasil Dialisis... 8
Hasil Kromatografi penukar ... 9
Hasil karakterisasi enzim ... 9
SIMPULAN DAN SARAN Simpulan ... 14
Saran ... 14
DAFTAR PUSTAKA ... 14
LAMPIRAN...16
DAFTAR TABEL
Halaman
1
Sumber-sumber enzim fibrinolitik dan penciriannya ... 32 Komposisi gel pemisah dan gel penahan untuk SDS-PAGE dan zimografi... 7
3 Hasil pemurnian enzim protease dari isolat bakteri W-1... 9
4 Ciri biokimiawi enzim protease dari isolat bakteri W-1 ... 13
DAFTAR GAMBAR Halaman 1 Tauco hitam ... 2
2 Pertumbuhan isolat W-1 pada 37ºC ... 7
3 Pengaruh konsentrasi amonium sulfat terhadap terhadap kadar protein pada supernatan ekstrak enzim kasar ... 8
4 Fraksinasi protease dari isolat bakteri W-1 dengan kolom penukar anion DEAE-Sepharose... 9
5 Pengaruh suhu terhadap aktivitas ekstrak enzim kasar, dialisat, dan eluat ... 10
6 Pengaruh suhu terhadap aktivitas residual ekstrak enzim kasar, dialisat, dan eluat .. 10
7 Pengaruh pH terhadap aktivitas ekstrak enzim kasar, dialisat, dan eluat ... 10
8 Pengaruh inhibitor terhadap aktivitas residual ekstrak enzim kasar dan dialisat ... 11
9 Pengaruh ion logam terhadap aktivitas residual ekstrak enzim kasar dan dialisat ... 12
10 Analisis SDS-PAGE 15% ekstrak enzim kasar, eluat, dan standar ... 12
DAFTAR LAMPIRAN
Halaman
1 Prosedur pembuatan pereaksi kimia ... 17
2 Diagram alir penelitian ... 18
3 Diagram produksi ekstrak kasar ... 19
4 Contoh perhitungan aktivitas enzim (U/ml) dan aktivitas enzim spesifik ... 20
5 Pembuatan kurva standar Bradford ... 21
6 Data pengaruh suhu, pH, waktu, inhibitor, dan ion logam terhadap aktivitas protease dari ekstrak kasar tauco hitam ... 22
7 Data pengaruh suhu, pH, waktu, inhibitor, dan ion logam terhadap aktivitas protease dari dialisat tauco hitam... 23
8 Data pengaruh suhu, pH, waktu, inhibitor, dan ion logam terhadap aktivitas protease dari eluat hitam ... 24
PENDAHULUAN
Penelitian ilmiah terhadap makanan hasil fermentasi di Indonesia seperti tempe, tahu, tauco, dadih, brem, oncom, yoghurt, dan tape sudah dimulai pada akhir abad ke-19. Salah satu makanan hasil fermentasi tradisional Indonesia yang diteliti dan dikembangkan adalah tauco yang merupakan produk kedelai berbentuk pasta, ada yang berwarna kuning dan ada yang berwarna hitam, rasanya agak asin, dibuat dengan cara fermentasi menggunakan kapang Aspergillus oryzae
(Wood 1985). Makanan fermentasi ini kaya akan kandungan vitamin B2, vitamin C, dan asam folat (Sarwono 2004).
Pada dasarnya proses fermentasi bertujuan memperbanyak jumlah mikrob dan meningkatkan metabolisme mikrob tersebut di dalam substrat. Jenis mikrob disesuaikan dengan produk akhir yang diinginkan. Makanan hasil fermentasi biasanya mempunyai nilai gizi yang lebih tinggi daripada bahan asalnya. Hal ini disebabkan karena mikrob bersifat katabolitik dan dapat mensintesis beberapa vitamin yang kompleks seperti riboflavin, vitamin B12, dan provitamin A (Winarno et al. 1980).
Penelitian di Korea menunjukkan bahwa produk-produk fermentasi seperti kecap dan tauco mengandung beberapa jenis peptida yang berfungsi menekan sel tumor, sebagai anti-hipertensi dan anti-trombotik. Selain itu produk fermentasi tidak hanya digunakan sebagai bahan makanan tetapi lebih sebagai pangan fungsional yang mempunyai nilai kesehatan yang sangat tinggi.
Baru-baru ini penelitian dilakukan dengan mengisolasi enzim fibrinolitik dari ekstrak alami untuk memperoleh enzim fibrinolitik dengan spesifitas yang tinggi dan harga yang murah. Penelitian ini berhasil memurnikan dan mencirikan isozim fibrinolitik dari cacing tanah Lumbricus rubellus Indonesia. Di samping lumbrokinase, beberapa enzim fibrinolitik dilaporkan telah diisolasi dari isolat Bacillus sp. yang berasal dari makanan fermentasi tradisional beberapa negara diantaranya adalah Jepang (natto) (Seo dan Lee 2004), Korea (chungkok-jang)(Kim et al. 1996), dan Thailand (thua-nao) (Chantawannakul et al. 2002).
Penelitian yang dilakukan adalah memurnikan dan mencirikan enzim fibrinolitik dari isolat potensial yang diisolasi
dari tauco hitam yang merupakan salah satu pangan fermentasi tradisional Indonesia. Isolat tersebut merupakan koleksi Laboratorium Biokimia dan Teknologi Enzim, Fakultas Teknobiologi, Universitas Katolik Atma Jaya, Jakarta. Indonesia kaya akan makanan fermentasi tradisional yang merupakan hasil dari proses bioteknologi sederhana yang sudah dimulai sejak beribu tahun yang lalu. Diduga, makanan fermentasi tersebut mengandung bakteri penghasil enzim fibrinolitik potensial yang dapat menjaga kesehatan terutama melindungi sistem fibrinolitik di dalam tubuh dan mencegah penyakit antitrombosis sejak dini.
Penelitian ini bertujuan memurnikan dan mencirikan protease dari isolat bakteri yang diperoleh dari tauco hitam yang merupakan salah satu makanan fermentasi tradisional Indonesia. Penelitian dilaksanakan di Laboratorium Biokimia dan Teknologi Enzim, Fakultas Teknobiologi, Universitas Katolik Atma Jaya, Jakarta, yang berlangsung selama 6 bulan, yaitu dari Juni 2005 sampai dengan Desember 2005
.
TINJAUAN PUSTAKA
Tauco
Tauco adalah penyedap masakan yang dihasilkan melalui proses fermentasi yang melibatkan kapang, khamir, dan bakteri. Selain mempunyai nilai gizi yang tinggi, tauco juga mempunyai aroma yang khas. Tauco banyak dikenal oleh masyarakat Indonesia terutama di daerah Jawa Barat dan Jawa Timur. Pusat produksi tauco adalah di kota Cianjur. Menurut Shurtleff dan Aoyagi (1976), tauco telah diproduksi di beberapa negara dengan nama miso di Jepang, chiang di Cina, jang di Korea, tauco di Indonesia dan Thailand, serta taosi di Filipina.
Tauco hitam berasal dari biji kedelai yang berwarna hitam (Gambar 1). Tauco mempunyai aroma yang lebih baik dengan terbentuknya asam, alkohol, dan ester. Tauco berfungsi sebagai penyedap masakan karena bau dan rasanya yang khas dan dapat disimpan lama karena kadar garamnya yang cukup tinggi.
pembuatannya melalui dua tahap fermentasi, yaitu fermentasi kapang (mold fermentation) dan fermentasi dalam larutan garam (brine fermentation). Pada fermentasi pertama digunakan kapang Aspergillus oryzae, Rhizopus oligosporus atau Rhizopus oryzae. Nisbah campuran kapang tersebut adalah 1:1:1, kemudian dicampurkan dengan tepung beras ketan yang sudah disangrai. Pada fermentasi tahap kedua digunakan larutan garam 22.8%.
Secara tradisional, kedua tahap fermentasi tersebut dilakukan secara spontan (kapang yang tumbuh pada bahan berasal dari udara sekitarnya atau berasal dari sisa-sisa spora kapang yang tertinggal pada wadah bekas fermentasi sebelumnya). Tahapan pembuatan tauco adalah perendaman, pencucian, pengukusan, penirisan, dan perendaman dalam larutan garam. Pada pembuatan tauco sering ditambahkan tepung, baik tepung beras, tepung ketan, maupun tapioka untuk menambah kekurangan karbohidrat. Mutu tauco ditentukan oleh beberapa faktor seperti bahan yang digunakan, proses penyimpanan dan pengerjaannya, jenis mikroorganisme yang berperan, konsentrasi garam yang digunakan, lama fermentasi, dan kondisi lingkungan selama proses fermentasi (Soetoyo 1988).
Gambar 1 Tauco hitam.
Protease Fibrinolitik
Enzim fibrinolitik merupakan kelompok protease yang dapat mendegradasi benang-benang fibrin. Benang-benang-benang fibrin adalah jaringan yang mengelilingi sel-sel darah
merah, hal ini yang disebut penggumpalan darah. Enzim fibrinolitik akan mendegradasi gumpalan-gumpalan yang ada pada saluran darah sehingga aliran darah menjadi normal kembali. Di dalam tubuh, enzim fibrinolitik atau plasmin diproduksi oleh sel endotel dalam saluran pankreas. Seiring dengan pertambahan usia dan pola konsumsi pangan yang tidak seimbang, maka produksi plasmin alami oleh tubuh semakin berkurang sehingga kerja sistem fibrinolitik di dalam tubuh akan terganggu. Bila hal ini berlangsung terus menerus secara berkala maka akan memicu timbulnya penyakit trombosis yang akhirnya mengarah pada berbagai penyakit degeneratif seperti stroke, hipertensi, dan diabetes. Umumnya sumber enzim fibrinolitik berasal dari manusia (plasmin dan urokinase), hewan (lumbrokinase dan desmoteplase), tanaman (natokinase), dan mikroorganisme/bakteri (streptokinase dan stapilokinase).
Penyakit trombosis menyebabkan penggumpalan darah di otak (cerebral stroke) maupun di jantung (myocardial infarction), dapat mengakibatkan cacat (disability) bahkan kematian. Serat fibrinogen adalah komponen protein utama di dalam darah beku (gumpalan darah). Gumpalan darah ini bisa dihancurkan oleh enzim fibrinolitik (Nurachman 2001). Pada manusia, reaksi penguraian serat-serat fibrin terjadi melalui kerja enzim plasmin. Plasmin terdapat di dalam aliran darah dalam bentuk tidak aktif/zimogen (plasminogen). Kegagalan mendegradasi gumpalan darah ditemukan pada penyakit trombosis. Penggunaan enzim-enzim trombolitik dalam medis adalah metode efektif yang dipakai dalam terapi penyakit trombosis. Berbagai macam obat anti-trombosis yang telah beredar saat ini, tetapi harganya sangat mahal dan kemampuannya terbatas (mudah hancur dan dapat menimbulkan pendarahan). Oleh karena itu, dikembangkan penemuan baru obat anti-beku darah yang dinilai memiliki keefektifan lebih baik dan efek samping lebih rendah yang berasal dari keragaman isolasi mikroorganisme.
Tabel 1 Sumber-sumber enzim fibrinolitik dan penciriannya
Pemurnian Enzim
Enzim merupakan unit fungsional dari metabolisme sel. Enzim sebagai suatu kelompok protein yang berperan sangat penting dalam aktivitas biologis. Enzim berfungsi sebagai katalisator dalam sel dan sifatnya sangat khas. Enzim akan terdenaturasi oleh panas, dan mengendap oleh etanol atau garam-garam organik berkonsentrasi tinggi seperti amonium sulfat, tidak dapat melewati membran semipermeabel atau membran selektif (tidak terdialisis). Menurut Suhartono (1989) faktor-faktor yang mempengaruhi aktivitas enzim adalah konsentrasi enzim, substrat, produk, adanya senyawa inhibitor dan aktivator, pH, suhu, kekuatan ion dan jenis pelarut yang terdapat pada lingkungan. Oleh karena itu, penentuan sifat-sifat dari enzim yang dihasilkan perlu dilakukan, misalnya penentuan suhu optimum, pH optimum, pengaruh senyawa kimia dan ion logam, stabilitas enzim pada pH dan suhu optimum enzim tersebut.
Pemurnian enzim adalah salah satu cara untuk memisahkan protein enzim dari protein jenis lain dan kontaminan. Secara umum, pemurnian enzim dibagi dalam tiga tahap, yaitu ekstraksi, pemekatan, dan fraksinasi. Menurut Scopes (1987) tujuan pemurnian enzim salah satunya adalah untuk mengidentifikasi fungsi dan struktur protein. Enzim yang murni dari senyawa pengotor dapat digunakan untuk keperluan medis, farmasi, dan penelitian biokimia karena spesifitasnya yang tinggi (Lehninger 1993).
Tahap awal dalam pemurnian protein atau enzim ekstraseluler adalah tahap isolasi yang bertujuan memisahkan biomassa sel serta senyawa pengotor yang berasal dari media pertumbuhan. Pemisahan dilakukan dengan sentrifugasi dengan kecepatan tertentu. Enzim yang diisolasi akan tertinggal dalam filtrat (supernatan) dan endapan yang terbentuk adalah zat-zat pengotor yang tidak diinginkan (Scopes 1987).
Pemekatan enzim dilakukan untuk memisahkan konsentrat protein dari komponen biomolekul lainnya (karbohidrat, lipid, dan asam nukleat). Berbagai metode pemekatan enzim yang lazim digunakan adalah presipitasi dengan garam, pelarut organik, polimer, dialisis, dan ultrafiltrasi (Scopes 1989).
Presipitasi dengan garam (amonium sulfat, sodium sulfat) lebih disukai daripada presipitasi dengan pelarut organik (aseton dan etanol), dengan alasan pelarut organik cenderung mendenaturasi protein pada suhu agak tinggi, relatif mahal, dan mudah terbakar. Selain itu, presipitasi dengan pelarut organik sangat dipengaruhi oleh konsentrasi pelarut organik, konsentrasi protein, kekuatan ionik, pH, dan suhu (Suhartono 1989).
Garam amonium sulfat dipilih karena kelarutannya tinggi, murah, tidak toksik, dan tidak mempengaruhi struktur protein, sedangkan presipitasi dengan polimer (polietilena glikol) sama halnya dengan presipitasi menggunakan pelarut organik. Hanya saja polietilena glikol lebih mudah ditangani daripada pelarut organik karena
Referensi Sumber Ciri
Chantawannakul et al.
2002
Bacillus subtilis Strain 38 yang diisolasi dari Thua nao, makanan tradisional Thailand hasil fermentasi kedelai
Suhu dan pH optimumnya adalah
47°C dan 6.5.
Seo dan Lee. 2004 Bacillus firmus NA-1 yang
diisolasi dari Natto, makanan tradisional Jepang yang merupakan hasil fermentasi
Suhu dan pH optimumlnya adalah
40ºC dan 7.
Yanti et al. 2003 Cacing tanah lokal Lumbricus
rubellus
Terdiri atas enam isozim fibrinolitik dengan bobot molekul 22, 24, 26, 30, 36, dan 38 kD menggunakan analisis SDS-PAGE.
Kim et al. 1996 Bacillus sp Strain CK 11-4 yang diisolasi dari Chungkok-jang, makanan tradisional Korea hasil fermentasi kedelai.
Suhu dan pH optimumnya adalah
70ºC dan 10.5. Bobot molekul
tidak mudah terbakar, tidak toksik, tidak bermuatan, dan murah.
Sisa garam dari proses presipitasi enzim dihilangkan dengan dialisis menggunakan kantong selofan. Dengan demikian, konsentrat enzim bebas garam dapat dimurnikan lebih lanjut melalui fraksinasi enzim.
Fraksinasi dilakukan untuk memisahkan enzim dari protein non enzim lainnya. Metode fraksinasi yang umum dilakukan adalah kromatografi kolom dan elektroforesis.
SDS-PAGE dan Zimografi
Elektroforesis adalah teknik pemisahan fraksi-fraksi zat berdasarkan pergerakan partikel bermuatan atau ion-ion makromolekul di bawah pengaruh medan listrik, karena adanya perbedaan ukuran, bentuk, muatan atau sifat kimia molekul. Metode elektroforesis digunakan untuk analisis dan pemisahan asam amino, protein, dan asam nukleat (DNA/RNA). Beberapa jenis elektroforesis yang dikenal antara lain elektroforesis kertas, elektroforesis selulosa asetat atau selulosa nitrat dan elektroforesis gel. Elektroforesis gel sering digunakan untuk analisis dan pemisahan protein dan asam nukleat, sedangkan jenis elektroforesis lainnya bermanfaat dalam pemisahan molekul yang lebih kecil (Scopes 1987).
Bentuk elektroforesis gel dapat berupa kolom atau lempengan. Beberapa jenis gel dapat dimanfaatkan, yaitu gel pati, gel agarosa, dan gel poliakrilamida. Gel poliakrilamida merupakan polimer yang disusun oleh akrilamida dan N, N’-metilena-bis-akrilamida yang berpolimerisasi dengan bantuan katalisator TEMED dan senyawa radikal bebas seperti amonium sulfat.
Prinsip analisis SDS-PAGE adalah pemisahan protein berdasarkan ukuran molekul. Pada SDS-PAGE, semua ikatan disulfida yang ada pada protein direduksi oleh
β-merkaptoetanol. Senyawa SDS yang ditambahkan berfungsi memutuskan ikatan diantara sub unit penyusun protein dan membuat keseluruhan protein diselimuti muatan negatif, sehingga pergerakan protein hanya dipengaruhi oleh ukurannya.
Data pemurnian enzim yang diperoleh melalui elektroforesis tidak selalu menunjukkan daya katalitik enzim yang sebenarnya karena adanya kontaminan, isoenzim atau enzim lain dari kelas yang sama. Kekurangan ini dapat diatasi dengan meneliti aktivitas enzim sesudah elektroforesis gel. Zimografi merupakan cara
menganalisis aktivitas proteolitik yang sederhana, sensitif, dapat dikuantisasi, dan fungsional.
Zimografi adalah salah satu teknik elektroforesis yang digunakan untuk mengidentifikasi aktivitas proteolitik enzim yang dipisahkan dalam gel poliakrilamida dengan kondisi tidak tereduksi dan terdenaturasi, direnaturasi dengan triton X-100 dan diinkubasi dalam sistem bufer yang sesuai untuk aktivitas enzim. Gel kemudian diwarnai dengan pewarna Coomassie blue dan adanya aktivitas enzim ditunjukkan oleh daerah bening (clear zone) di mana substrat telah didegradasi.
Kromatografi Kolom
Kromatografi adalah suatu metode pemisahan yang dapat digunakan untuk memisahkan suatu komponen dari komponen lainnya atau memisahkan suatu komponen dari sekumpulan komponen lainnya. Kromatografi merupakan teknik yang efektif dan dapat digunakan untuk memisahkan komponen yang sulit dipisahkan dengan metode lain.
Metode yang umum digunakan untuk pemurnian enzim adalah kromatografi kolom. Pemilihan kromatografi kolom bergantung pada sifat protein enzim yang ingin dipisahkan. Ada empat jenis kromatografi yang dapat dikategorikan ke dalam kromatografi kolom, yaitu kromatografi adsorpsi, kromatografi partisi, kromatografi pertukaran ion, dan kromatografi filtrasi gel. Kromatografi penukar ion menggunakan resin penukar ion sebagai fase diam. Mekanisme pemisahan didasarkan pada keseimbangan penukar ion (Christian 2003). Kromatografi penukar ion sering digunakan pada tahap akhir kemurnian. Karena resolusinya yang tinggi dan waktu pemisahan yang relatif singkat maka IEC (ion exchange chromatography/kromatografi penukar ion) dianggap paling baik untuk melakukan beberapa analisis. Analisis kemurnian menggunakan IEC didasarkan pada fakta bahwa protein memiliki muatan positif dan negatif yang tergantung dari pH lingkungannya (Roe 1999).
lebih dahulu dibandingkan dengan biomolekul yang memiliki muatan ion lebih besar. Semakin besar muatan ion maka diperlukan larutan garam NaCl dengan konsentrasi semakin besar pula. Oleh karena itu, pada umumnya elusi dilakukan secara linear gradient.
Ada dua tipe kolom penukar ion yaitu kolom penukar kation (CIEC) dan kolom penukar anion (AIEC). Pemilihan kolom penukar ion biasanya didasarkan pada nilai pI (titik isolistrik) dan stabilitas pH dari molekul protein yang akan ditukarkan. Jika pH di atas nilai pI, molekul akan memiliki muatan negatif maka digunakan kolom penukar anion. Kolom penukar kation digunakan untuk pemisahan protein yang bermuatan positif, biasanya yang memiliki pH di bawah nilai pI, dan banyak digunakan untuk memisahkan protein serum.
METODE PENELITIAN
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah isolat bakteri yang diisolasi dari tauco hitam yang merupakan koleksi Laboratorium Biokimia dan Teknologi Enzim, Fakultas Teknobiologi, Universitas Katolik Atma Jaya, Jakarta. Media penapisan untuk memperoleh tiga jenis isolat penghasil enzim protease tersebut adalah media Skim Milk Agar (SMA). Media yang digunakan untuk perbanyakan mikrob adalah Luria Bertani Broth (LB). Komposisi media secara lengkap terdapat pada Lampiran 1.
Bahan-bahan kimia yang digunakan adalah kasein Hammersten (Merck), pereaksi Bradford, standar L-tirosina (Merck), bovine serum albumin (BSA) Fraktion V (Merck), amonium sulfat teknis, bufer universal pH 7,
trichloro acetic acid (TCA), pereaksi Folin Ciocalteau, garam NaCl step wise, bufer Tris-HCl pH 7.5, etilena diamin tetra-asetat (EDTA), gliserol 50% (v/v), polietilena glikol (PEG), inhibitor fenil metil sulfonil fluorida (PMSF), N-p-tosil-L-lisin klorometilketon (TLCK), soybean trypsin inhibitor (STI), dimetil sulfoksida (DMSO) pereaksi elektroforesis (akrilamida, bis-akrilamida, amonium persulfat 10% (b/v),
N,N,N’,N’-tetraetilmetilenadiamina (TEMED),
bromphenol blue, Coomassie Brilliant Blue R-250, tris, dan sodium dodesil sulfat (SDS), triton X-100 2.5 % (v/v), bufer sampel, standar marker low molecular weight (LMW),
dan matriks Sepharose- dietil aminoetil (DEAE) fast flow.
Alat-alat yang digunakan adalah spektrofotometer UV/VIS Optima, sentrifugasi mikro berpendingin Beckmann, inkubator, shaker, lemari es, perangkat elektroforesis Bio Rad, perangkat kromatografi kolom Amersham Biosience, pH meter Orion, neraca analitik Fisher, pengaduk magnetik dan vortex, tabung eppendorf, pipet mikro Bio Rad dan tip, aluminium foil, jarum ose, pembakar spiritus, rak tabung, oven, dan alat-alat kaca lainnya.
Metode Penelitian
Penapisan isolat yang berasal dari sampel tauco hitam
Terhadap ke-3 isolat yang diberi kode, yaitu W1, W2, dan W3 masing-masing sebanyak satu ose dipindahkan ke dalam media Skim milk agar dan diinkubasi pada suhu 37ºC selama 24 jam untuk disegarkan. Koloni yang memiliki suatu lingkaran bening (halo proteolitik) di sekeliling koloni digunakan sebagai sumber produksi enzim.
Produksi dan ekstraksi enzim
Koloni yang memiliki halo proteolitik dipindahkan ke media produksi, yaitu media LB. Kemudian disimpan dalam inkubator bergoyang pada suhu 37ºC dan kecepatan perputaran 150 rpm selama dua hari. Pada hari ke-3 dilakukan sentrifugasi dengan kecepatan 7500 rpm selama 15 menit pada suhu 4ºC. Supernatan yang diperoleh berupa ekstrak enzim. Diagram alir penelitian secara lengkap terdapat pada Lampiran 2 dan 3.
Analisis aktivitas protease
Aktivitas protease diukur secara kuantitatif dengan modifikasi metode Bergmeyer (1983) dengan menggunakan substrat kasein Hammarsten 2% (b/v). Terdapat tiga perlakuan analisis yang dilakukan, yaitu blanko, standar, dan sampel. Larutan enzim ditambahkan ke dalam tabung eppendorf yang berisi 250 μl 50 mM bufer fosfat dengan variasi pH 4, 5, 6, 7, 8, 10, dan 12. Perlakuan pada blanko dan standar, enzim digantikan dengan akuades dan tirosina 5 mM.
penambahan 500 μl TCA 0.1 M. Pada blanko dan standar ditambahkan 50 μl larutan enzim, sedangkan pada sampel ditambahkan 50 μl akuades, kemudian larutan diinkubasi kembali pada suhu 37ºC selama 10 menit, dilanjutkan dengan sentrifugasi pada kecepatan 10000 rpm dan suhu 4ºC selama 10 menit.
Supernatan sebanyak 375 μl ditambahkan ke dalam tabung berisi 1.25 ml Na2CO3 0.4 M dan 250 μl pereaksi Folin Ciocalteau, lalu diinkubasi kembali pada suhu 37ºC selama 20 menit. Absorbans larutan diukur pada panjang gelombang 578 nm. Contoh perhitungan aktivitas enzim terdapat pada Lampiran 4.
Pengukuran konsentrasi protein (Bradford 1976)
Kadar protein ditentukan dengan metode Bradford (1976). Sebanyak 100μl larutan enzim ditambahkan ke dalam tabung yang berisi 1 ml akuades dan 1 ml pereaksi Bradford. Perlakuan pada blanko, larutan enzim diganti dengan akuades. Selanjutnya larutan tersebut dihomogenkan dan didiamkan selama 20 menit pada suhu ruang. Absorbans larutan diukur pada panjang gelombang 595 nm.
Standar protein yang digunakan adalah BSA. Pada kurva standar protein, larutan enzim digantikan dengan BSA dengan kisaran konsentrasi 0 sampai 250 μg/ml. Konsentrasi protein larutan enzim ditentukan berdasarkan persamaan garis linear hubungan antara konsentrasi standar protein dan absorbans.
Pemurnian Enzim
Presipitasi. Ekstrak enzim kasar diendapkan dengan amonium sulfat. Untuk menentukan konsentrasi garam yang optimal, dilakukan pengujian aktivitas enzim hasil pengendapan oleh garam mulai dari 30 sampai 80% (b/v). Penambahan dilakukan sedikit demi sedikit pada suhu 0 sampai 4ºC sambil diaduk dengan pengaduk magnetik hingga larut. Endapan enzim dipisahkan dengan sentrifugasi berpendingin 4000 rpm selama 10 menit. Pelet disuspensikan dalam 50 mM bufer universal pH 7 dan didialisis dalam 50 mM bufer universal pH 7 dengan menggunakan kantung dialisis (cut-off 10 kD).
Dialisis. Untuk keperluan dialisis, potongan kantung dialisis dipanaskan selama 10 menit (dua kali). Salah satu ujung kantung diikat dan enzim hasil presipitasi dimasukkan. Kantung kemudian dimasukkan ke dalam
larutan bufer universal pH 7 bervolume 100 kali volume filtrat. Sambil diagitasi perlahan, dialisis dilakukan dalam ruang dingin dengan pergantian larutan bufer setiap 2 jam selama 2 kali. Setelah dialisis, untuk lebih memekatkan, kantung diletakkan di atas serbuk polietilena glikol selama beberapa menit.
Kromatografi Penukar Ion. Sistem kromatografi disiapkan yaitu pompa peristaltik, fraction collector, dan kolom weak anion exchangerDEAESepharose Fast Flow.
Syringe atau tabung pemompa diisi dengan
start buffer yaitu bufer Tris-Cl pH 7. 50 mM sampai pH di dalam kolom menunjukkan pH 7. Adaptor dinyalakan sehingga kolom terhubung dengan syringe. Udara harus dihindari agar tidak masuk ke dalam kolom. Kolom dicuci dengan 10 ml bufer Tris-HCl pada laju alir 3.0 ml/menit. Bufer elusi yaitu 5 ml NaCl 1 M dialirkan ke dalam kolom. Keseimbangan akhir dicapai dengan mengalirkan 10 ml bufer Tris-HCl pH 7.5.
Fraction collector diatur berdasarkan jumlah tetes dengan volume fraksi 1 ml dan laju alir 3.0 ml/menit. Sebanyak 1 ml dialisat diinjeksikan ke dalam kolom. Kolom dicuci dengan 5 ml bufer Tris-HCl pH 7.5 kemudian dielusi dengan ml NaCl 0.5 M dan 1 M diikuti dengan 5 ml bufer Tris-Cl pH 7.5. Eluat yang dihasilkan diuji kadar protein dan aktivitas enzim. Fraksi dengan kadar protein dan aktivitas enzim yang tinggi dipilih untuk diuji selanjutnya.
Pencirian enzim
Presipitat dan eluat (hasil fraksinasi) dicirikan sebagai berikut :
Penentuan pH optimum aktivitas enzim.
Bufer universal dan substrat kasein untuk reaksi diatur pada nilai pH 4, 5, 6, 7, 8, 10, dan 12. Pengujian aktivitas dilakukan pada suhu yang konstan (37ºC). Aktivitas tertinggi menunjukkan pH optimum enzim.
Penentuan suhu optimum aktivitas enzim. Enzim direaksikan pada pH optimumnya dengan variasi suhu yang diujikan adalah 27ºC, 37ºC, 50ºC, 55ºC, 60ºC, 65ºC, dan 80ºC. Aktivitas tertinggi menunjukkan suhu optimum enzim.
satu jam pada suhu ruang, lalu aktivitas residunya dianalisis secara kuantitatif.
Pengaruh ion logam. Pengaruh aktivitas protease terhadap penambahan ion logam dilakukan dengan konsentrasi akhir 5 mM selama 1 jam pada suhu ruang, lalu diuji aktivitas residunya secara kuantitatif. Logam yang digunakan, yaitu KCl, NaCl, CuCl2, MgCl2, dan MnCl2.
Analisis SDS-PAGE dan Zimografi
Elektroforesis gel poliakrilamida yang dikombinasikan dengan suatu detergen sodium dodesil sulfat digunakan untuk memisahkan dan meneliti jumlah dan ukuran (bobot molekul) rantai protein dan rantai subunit protein. Sementara zimografi merupakan salah satu teknik elektroforesis yang bertujuan mendeteksi aktivitas enzim proteolitik secara langsung.
Tahapan kerja yang dilakukan dalam analisis SDS-PAGE dan zimografi meliputi penyiapan gel pemisah dan penahan, penyiapan sampel dan loading, kondisi
running, pewarnaan gel, dan pelunturan warna.
Penyiapan gel pemisah dan penahan.
Tabel 2 Komposisi gel pemisah dan gel penahan untuk SDS-PAGE dan zimografi
Pereaksi Gel pemisah 15% (ml)
Preparasi sampel dan loading. Khusus SDS-PAGE, 20 µl sampel ditambahkan dengan 5 µl bufer sampel yang mengandung 2-merkaptoetanol, lalu dipanaskan pada suhu 100ºC selam 3-5 menit. Sementara pada zimografi sampel dilarutkan dalam bufer sampel yang tidak mengandung 2-merkaptoetanol dan tidak memerlukan
perlakuan pemanasan. Tiap sampel diloading ke dalam sumur gel dengan kisaran volume 10-20 µl, sedangkan volume standar LMW yang digunakan sebanyak 5 µl.
Kondisi running, pewarnaan, dan pelunturan warna. Gel dijalankan pada tegangan 100 V selama 1.5 jam dalam bufer elektroforesis. Pada SDS-PAGE, setelah elektroforesis, gel langsung diwarnai dengan menggunakan larutan pewarna (Coomassie Brilliant Blue R-250) selama 15 menit. Pelunturan warna pada gel dilakukan dengan larutan peluntur berulang kali sampai diperoleh pita protein biru dengan latar gel bening. Sementara pada zimografi, setelah elektroforesis, gel didenaturasi terlebih dahulu dalam larutan Triton-X 2.5% (v/v) sambil digoyang selama satu jam. Kemudian gel didigesti dalam 50 mM bufer universal pH 7 dan suhu 50ºC (kondisi suhu dan pH optimum enzim) selama 30 menit. Gel diwarnai dengan larutan pewarna selama 15 menit. Pelunturan warna gel dilakukan dengan larutan peluntur berulangkali sampai diperoleh pita enzim proteolitik putih dengan latar gel biru.
HASIL DAN PEMBAHASAN
Penapisan isolat yang berasal dari sampel tauco hitam
0
Kejenuhan amonium sulfat (% )
K
Gambar 2 Pertumbuhan isolat W1 pada suhu 37ºC.
Pemurnian enzim
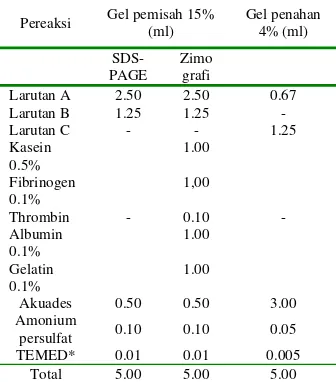
Presipitasi ekstrak enzim dengan garam amonium sulfat diuji pada berbagai konsentrasi kejenuhan amonium sulfat 30-80% (b/v) (Gambar 3). Konsentrasi yang dipilih adalah yang memberikan kadar protein terendah pada supernatan, dengan asumsi protein telah terendapkan secara maksimal pada pelet. Protein yang telah diendapkan ini biasanya tidak terdenaturasi dan aktivitasnya diperoleh kembali dengan melarutkan endapannya dalam bufer untuk menjaga aktivitas dan stabilitas enzim. Hasil presipitasi disebut presipitat.
Gambar 3 Pengaruh konsentrasi amonium sulfat terhadap kadar protein pada supernatan ekstrak enzim kasar.
Menurut Boyer (1986), terdapat beberapa parameter penting yang dapat dihitung berdasarkan data aktivitas dan total protein enzim. Parameter tersebut adalah aktivitas spesifik, total aktivitas, dan persentase yield.
Aktivitas spesifik adalah besarnya aktivitas enzim per miligram protein. Pengukuran konsentrasi protein dilakukan berdasarkan metode Bradford (1976). Kurva standar diperoleh dari regresi linier berbagai konsentrasi BSA (Lampiran 5). Ekstrak enzim kasar yang diperoleh memiliki kadar protein sebesar 0.242 mg/ml. Total aktivitas adalah besarnya aktivitas spesifik dikalikan total kandungan protein. Derajat pemurnian yang menunjukkan tingkat efisiensi pemurnian merupakan perbandingan aktivitas spesifik hasil pemurnian dengan aktivitas spesifik ekstrak kasar. Sedangkan persentase yield
adalah perbandingan total aktivitas tahap
tertentu dengan aktivitas tahap sebelumnya. Data aktivitas secara lengkap terdapat pada Lampiran 6, 7, dan 8.
Ekstrak kasar enzim (crude enzyme) memiliki nilai aktivitas sebesar 0.081 U/ml atau aktivitas spesifik sebesar 0.338 U/mg. Fraksi presipitat memberikan kontribusi sedikit terhadap kemurnian enzim. Hal ini dapat dilihat setelah melalui pengendapan oleh 70% (b/v) amonium sulfat, aktivitas meningkat menjadi 0.088 U/ml dengan aktivitas spesifik 0.488 U/mg atau 1.44 kali lebih murni terhadap ekstrak kasar.
Kemurnian enzim yang lebih tinggi dapat diperoleh melalui proses dialisis untuk menghilangkan molekul garam dan ion pengganggu lainnya yang mempengaruhi kestabilan enzim. Proses dialisis mampu memisahkan molekul–molekul kecil berukuran <10 kD seperti ion logam, inhibitor, peptida kecil dan lainnya dan menahan molekul besar yang berukuran >10 kD.
Dialisis dilakukan terhadap ekstrak enzim hasil presipitasi dengan garam amonium sulfat. Pemanasan kantong dialisis nitroselulosa asetat (cut-off 10 kD) sebelum digunakan bertujuan menghilangkan protein yang mungkin menempel pada kantong. Setelah enzim dimasukkan ke dalam kantong dialisis dan direndam dalam larutan bufer, akan terjadi proses difusi dan osmosis. Karena konsentrasi garam di dalam kantong lebih tinggi dari sekelilingnya pada awal dialisis, larutan bufer akan masuk ke dalam kantong menggantikan garam yang keluar sehingga terjadi keseimbangan. Tahapan ini dilakukan beberapa kali dengan menggantikan larutan bufer tiap 2 jam karena semua garam dan ion pengganggu tidak dapat dihilangkan hanya dengan sekali dialisis (Scopes 1989). Selanjutnya hasil dialisis disebut fraksi dialisat.
Fraksi dialisat memberikan nilai aktivitas sebesar 0.124 mg/ml atau 1.117 U/mg atau 3.30 lebih murni terhadap ekstrak kasar. Terjadinya pengenceran oleh larutan bufer yang menggantikan garam di dalam kantong dialisis menyebabkan konsentrasi protein menjadi menurun.
Kromatografi penukar anion
Dialisat diinjeksikan ke dalam kolom penukar anion DEAE-Sepharose fast flow
0
matriks ini berlaku sebagai penukar anion yang akan mengikat protein-protein bermuatan negatif berdasarkan densitas muatannya selama fraksinasi. Protein akan
dilepas dengan penambahan bufer elusi yang berfungsi sebagai fase gerak
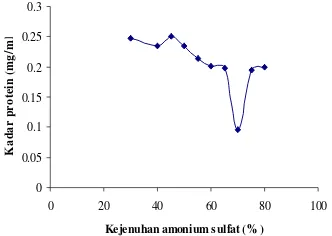
ialah Tris-HCl pH 7.5. Satu fraksi enzim muncul setelah dielusi oleh NaCl step wise 0.5 M dan 1 M. Dalam hal ini fraksi 7 merupakan fraksi aktif (Gambar 4). Hal ini dapat dilihat dari peningkatan nilai aktivitas menjadi 0.293 U/ml (3.860 U/mg) atau 11.42 kali lebih murni dibanding ekstrak kasar. Secara lengkap data aktivitas enzim dari setiap tahapan dapat dilihat pada Tabel 3.
Gambar 4 Fraksinasi protease dari isolat bakteri W-1 dengan kolom penukar anion DEAE-Sepharose Fast Flow
pada kondisi analisis: bufer elusi 50 mM Tris-HCl pH 7.5 NaCl 0.50 M dan 1 M, laju alir 3.0/menit, dan volume elusi 1.0 ml/tabung.
Pencirian enzim
Pencirian enzim protease diuji secara kuantitatif dengan metode Bergmeyer (1983) yang meliputi pengaruh suhu, pH, inhibitor, ion logam serta SDS-PAGE untuk
menentukan bobot molekul dari pita protein enzim dan secara kualitatif digunakan analisis zimografi.
Penentuan suhu optimum
Variasi suhu yang digunakan untuk penentuan suhu optimum enzim protease adalah pada kisaran 27ºC sampai 80ºC. Untuk mengurangi kemungkinan gangguan sisa peptida yang terbentuk selama degradasi substrat protein (kasein) maka setelah reaksi enzimatik ditambahkan senyawa pengendap protein atau peptida, yaitu TCA. Endapan yang terbentuk dipisahkan dengan sentrifugasi. Pada umumnya semakin tinggi suhu maka laju reaksi kimia akan semakin cepat.
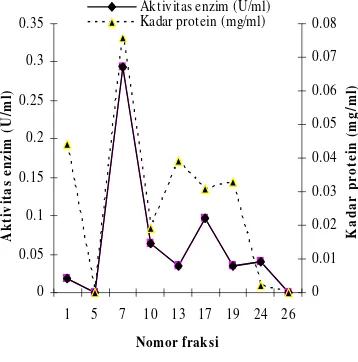
Penentuan suhu optimum enzim protease dilakukan terhadap ekstrak enzim kasar, dialisat, dan fraksi eluat (C, D, dan E). Seperti terlihat pada Gambar 5, ketiga fraksi ini sama-sama mencapai aktivitas maksimal pada suhu 50ºC ketika diuji dengan bufer universal pH 7.0 selama 10 menit. Fraksi eluat memiliki aktivitas enzim paling tinggi (0.293 U/ml ), diikuti oleh dialisat (0.085 U/ml), dan ekstrak enzim kasar (0.082 U/ml). Pada suhu di bawah 50ºC aktivitas enzim ini meningkat karena terjadi peningkatan energi kinetik yang mempercepat gerak vibrasi, translasi serta rotasi enzim dan substrat sehingga memperbesar peluang keduanya untuk saling berinteraksi (Suhartono 1989). Pada suhu 80ºC (diatas suhu optimum) , enzim ini akan kehilangan aktivitasnya sampai dengan 80%, dapat dilihat dari nilai aktivitas residual (perbandingan nilai aktivitas tertentu terhadap aktivitas tertinggi) yang hanya tersisa 20%, baik pada ekstrak enzim kasar, dialisat, maupun eluat (Gambar 6). Hal ini disebabkan enzim adalah molekul Tabel 3 Hasil pemurnian enzim protease dari isolat tauco hitam
0
protein yang dapat terdenaturasi pada suhu tinggi. Peningkatan suhu hingga batas tertentu menyebabkan semakin meningkatnya aktivitas katalitik enzim dan semakin bertambahnya proses kerusakan enzim (Palmer 1991).
Uji fibrinolitik enzim protease dari B. Firmus NA-1 yang diisolasi dari Natto, makanan fermentasi tradisional Jepang (Seo dan Lee 2004) dan dari Bacillus sp Strain CK 11-4 yang diisolasi dari Chungkok-jang, makanan tradisional Korea (Kim et al. 1996), telah dilaporkan relatif stabil pada suhu 40ºC. Enzim protease yang diisolasi dari Bacillus subtilis strain 38 dilaporkan memiliki suhu optimum pada 47ºC (Chantawannakul et al. 2002). Protease ini tidak stabil dan aktivitasnya menurun dengan cepat pada suhu 60ºC.
Penentuan pH optimum
pH sangat berpengaruh terhadap aktivitas enzim, karena sifat ionik gugus karboksil dan gugus amino mudah dipengaruhi oleh pH. Hal ini akan menyebabkan daerah katalitik dan konformasi enzim berubah.
Penentuan pH optimum enzim protease dilakukan terhadap ekstrak enzim kasar, dialisat, dan fraksi eluat. Dalam penelitian ini digunakan bufer universal pada kisaran pH 4 sampai 12 untuk mengurangi kondisi ketidaksamaan yang mungkin timbul jika menggunakan bufer yang berbeda-beda sesuai pH, dengan demikian diharapkan enzim berada pada lingkungan yang sama.
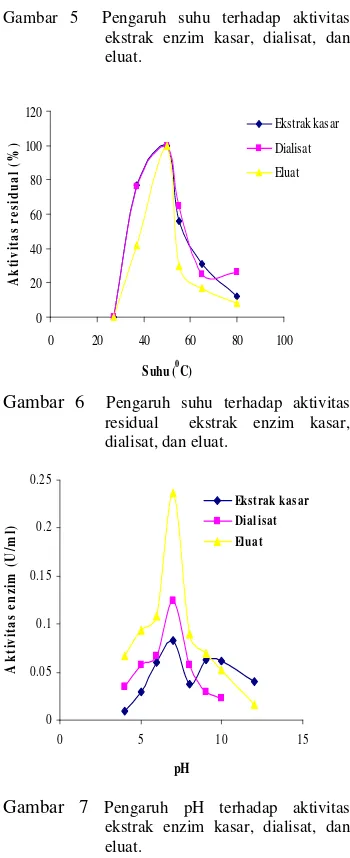
Pada suhu 50ºC aktivitas optimum ekstrak enzim kasar, dialisat, dan fraksi eluat dicapai pada pH 7 (Gambar 7). Nilai aktivitas tertinggi terdapat pada fraksi eluat (0.236 U/ml ), diikuti oleh dialisat (0.124 U/ml), dan ekstrak enzim kasar (0.083 U/ml). Sebagai perbandingan, enzim fibrinolitik yang berasal dari miselia Armillaria mellea mempunyai pH optimum pada 6.0 (Kim et al. 2005).
Gambar 5 Pengaruh suhu terhadap aktivitas ekstrak enzim kasar, dialisat, dan eluat.
Gambar 6 Pengaruh suhu terhadap aktivitas residual ekstrak enzim kasar, dialisat, dan eluat.
Gambar 7 Pengaruh pH terhadap aktivitas ekstrak enzim kasar, dialisat, dan eluat.
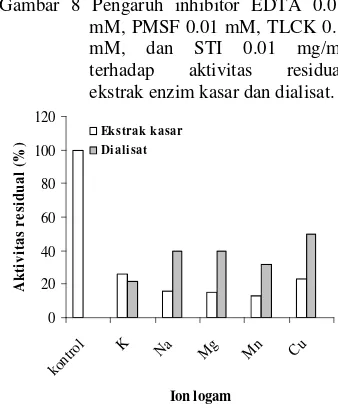
Pengaruh inhibitor
Enzim sangat peka terhadap senyawa yang diikatnya. Apabila aktivitas enzim menjadi terhambat karena senyawa atau gugus senyawa tersebut maka senyawa ini disebut inhibitor. Pada Gambar 8 dapat dilihat bahwa senyawa PMSF yang merupakan inhibitor protease serin dapat menghambat aktivitas ekstrak enzim kasar dan dialisat sampai dengan 100%. Sebagai perbandingan, protease alkali dari bakteri
Alcaligenes faecalis jugadihambat kuat oleh PMSF (Thangam dan Rajkumar 2002)
.
0
Kontrol TLCK STI PMSF EDTA
Inhibitor
tradisional Korea, dihambat kuat oleh PMSF. Adanya reaksi antara gugus-gugus hidroksi dari residu serin pada sisi aktif enzim protease dengan senyawa PMSF menyebabkan enzim mengalami inaktivasi. Konsentrasi PMSF yang digunakan adalah 5 mM yang dilarutkan dalam DMSO yang tidak merusak struktur enzim.
Aktivitas enzim protease juga dihambat spesifik oleh TLCK (0.1 mg/ml), ditandai dengan nilai residu yang tersisa hanya 8% (ekstrak kasar) dan 6% (dialisat) dibandingkan dengan kontrol. Penambahan inhibitor ini mampu menurunkan aktivitas enzim protease >90% dengan nilai aktivitas 0.010 U/ml (ekstrak kasar) dan 0.007 U/ml (dialisat). Berdasarkan hasil yang diperoleh maka protease yang berasal dari isolat tauco hitam digolongkan ke dalam kelompok protease serin karena enzim ini sensitif terhadap inhibitor TLCK (Suhartono 1989). STI (0.1 mg/ml) yang merupakan inhibitor protease tripsin dapat memberi pengaruh inhibisi yang lebih kecil dibanding PMSF dan TLCK dengan nilai aktivitas ekstrak kasar adalah 0.068 U/ml (aktivitas residual 54 %), dialisat dengan nilai aktivitas 0.083 U/ml (aktivitas residual 66%). Park et al. 1998 telah mempublikasikan bahwa SBTI, TLCK, dan PMSF merupakan protease serin.
Senyawa EDTA merupakan pengkelat yang dapat menstabilkan enzim. Penambahan EDTA 0.01 mM tidak mempengaruhi aktivitas ekstrak enzim kasar dan dialisat karena aktivitas residual masih cukup besar yaitu 97% (ekstrak kasar) dan 90% (dialisat). Cara kerja senyawa EDTA adalah dengan mengikat logam berat pengganggu dan mencegah interaksi antara asam atau golongan –S-H (Schwimmer 1981 dalam
Yanti 2003). Senyawa EDTA mampu mengkelat ion logam baik yang dibutuhkan maupun yang tidak dibutuhkan oleh enzim. Bila suatu ion logam dikelat oleh EDTA maka akan terjadi perubahan konformasi sehingga berpengaruh terhadap aktivitas enzim. Enzim fibrinolitik dari Bacillus sp Strain CK 11-4 yang diisolasi dari Chungkok-jang, makanan tradisional Korea dilaporkan tidak dihambat kuat oleh EDTA (Kim et al. 1996).
Pengaruh ion logam
Pengaruh logam dilakukan untuk mengetahui peningkatan atau penurunan aktivitas protease dari isolat tauco hitam
dengan penambahan logam. Logam yang digunakan ialah Na, K, Mg, Mn, dan Cu. Hasil pengukuran menunjukkan bahwa penambahan logam-logam tersebut dapat menurunkan aktivitas enzim sampai dengan 85%. Penambahan Na+ menurunkan aktivitas protease pada ekstrak kasar dan dialisat. Hal ini dapat dilihat dari aktivitas residual yang hanya tersisa 16% dangan nilai aktivitas 0.032 U/ml (ekstrak kasar) dan 40% dengan nilai aktivitas 0.051 U/ml (dialisat). Penambahan K+ juga menurunkan aktivitas protease pada ekstrak kasar sampai dengan 74% dengan aktivitas 0.050 U/ml dan dialisat sampai dengan 78% dengan aktivitas 0.028 U/ml.
Penambahan Mg2+ menyisakan aktivitas sebesar 15% dengan unit 0.030 U/ml (ekstrak kasar) dan 40% dengan unit 0.050 U/ml (dialisat). Peningkatan aktivitas protease oleh penambahan ion logam Mg2+ dilaporkan terjadi pada protease bakteri lainnya. Thangam dan Rajkumar (2002) melaporkan bahwa ion Mg2+ merupakan aktivator protease alkali dari bakteri Alcaligenes faecalis. Ion logam Mn2+ menghambat aktivitas enzim protease sampai dengan 87% dengan nilai aktivitas 0.026 U/ml (ekstrak kasar) dan 68% dengan nilai aktivitas 0.040 U/ml (dialisat). Penambahan Cu2+ juga menurunkan aktivitas protease pada ekstrak kasar sampai dengan 77% dengan aktivitas 0.045 U/ml dan dialisat sampai dengan 50% dengan aktivitas 0.063 U/ml.
Dari hasil yang diperoleh diketahui bahwa ion logam Na+, K+, Mg2+, Mn2+, dan Cu2+ bersifat menghambat aktivitas protease dari isolat bakteri tauco hitam. Selama bekerja dengan enzim protease ini, logam-logam tersebut di atas harus dihindari karena dapat menurunkan aktivitas enzim. Enzim protease yang berasal dari micelia Armillaria mellea
dilaporkan oleh Kim et. al (2005) dihambat oleh Cu2+ dan Co2+.
66
Gambar 8 Pengaruh inhibitor EDTA 0.01 mM, PMSF 0.01 mM, TLCK 0.1 mM, dan STI 0.01 mg/ml terhadap aktivitas residual ekstrak enzim kasar dan dialisat.
Gambar 9 Pengaruh ion logam terhadap aktivitas residual ekstrak enzim kasar dan dialisat (5 mM).
Penentuan bobot molekul enzim
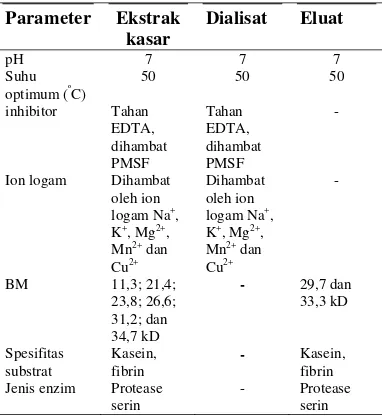
Teknik SDS-PAGE digunakan untuk estimasi bobot molekul enzim. Pengikatan SDS oleh protein akan menyebabkan muatan intrinsik rantai polipeptida tertutupi sehingga muatan total per unit menjadi konstan. Hal inilah yang menyebabkan pemisahan molekul protein bisa berdasarkan berat molekul. Berdasarkan hasil uji SDS-PAGE 15% terhadap ekstrak kasar protease, menunjukkan jumlah pita protein sebanyak enam pita dengan kisaran berat molekul 11-35 kD dan eluat dengan dua pita protein dengan kisaran bobot molekul 30-34 kD. Bobot molekul masing-masing enzim adalah 11.3; 21.4; 23.8; 26.6; 31.2; dan 34.7 kD untuk ekstrak enzim kasar. Sedangkan untuk fraksi eluat bobot molekulnya adalah 29.7 dan 33.3 kD (Gambar 10). Standar yang digunakan adalah LMW yang mempunyai bobot molekul pada 6.6 sampai 66 kD.
Gel poliakrilamida diperoleh dengan cara polimerisasi akrilamida dengan adanya sejumlah cross-linking agent metilena bis-akrilamida dan amonium persulfat sebagai inisiator. Radikal bebas yang terbentuk dari pelarutan amonium persulfat dalam air akan bereksi dengan akrilamida membentuk akrilamida aktif yang bereaksi satu sama lain membentuk polimer. SDS akan mendenaturasi dan menyelimuti protein enzim sehingga bermuatan negatif dan akan
bergerak menuju elektroda positif. Air akan mengeluarkan sisa SDS sekaligus membilas permukaan gel pemisah dari sisa akrilamida yang tidak terpolimerisasi.
Sebelum pengisian ke dalam sumur gel, standar harus dipanaskan pada 100ºC selama 5 menit agar protein terpecah menjadi sub unitnya kemudian dilarutkan di dalam bufer yang mengandung gliserol sebagai pemberat dan β-merkaptoetanol sebagai pemutus ikatan disulfida protein.
Pewarnaan dilakukan dengan merendam gel dalam larutan Coomassie Brilliant Blue. Selain praktis, larutan pewarna ini memiliki sensitivitas tinggi yaitu dapat mewarnai protein dengan konsentrasi 0.5 μg/cm2. Kelebihan warna dihilangkan dengan merendam gel di dalam larutan peluntur sampai diperoleh pita berwarna biru dengan latar gel putih. Bobot molekul protein dapat diperoleh dengan membandingkan dengan pita-pita protein standar (Lampiran 9). Sebagai perbandingan, enzim fibrinolitik yang diisolasi dari micelia Armillaria mellea
memiliki bobot molekul 21 kD setelah dilakukan pemurnian dengan kromatografi penukar ion dan dilanjutkan dengan kolom filtrasi gel (Kim et. al 2005).
(kD) LMW C E
Gambar 10 Analisis SDS PAGE 15%, Ekstrak enzim kasar (C), Fraksi eluat (E), dan standar LMW.
Zimografi
menggunakan bufer universal 50 mM pH 7 pada suhu 50ºC. Pada tahap ini substrat akan didegradasi oleh enzim yang ada pada sampel. Pewarnaan dan pelunturan gel dilakukan untuk memperoleh meunculnya pita-pita bening yang menunjukkan protein enzim (kasein, fibrin, albumin, dan gelatin) yang bereaksi dengan substrat dan latar belakang gel biru yang menunjukkan semua protein substrat yang terdapat pada enzim.
Uji ini dilakukan secara kualitatif karena hanya dilihat dari ada atau tidaknya pita yang dihasilkan dari degradasi kasein dan fibrinogen (tanpa menghitung bobot molekul). Teknik zimogram berfungsi untuk identifikasi dan klasifikasi jenis enzim dalam menunjang proses pemurnian dan karakterisasi enzim. Oleh karena itu enzim yang digunakan harus murni.
Analisis zimografi menunjukkan bahwa substrat kasein menghasilkan intensitas warna pita sangat terang dibandingkan dengan substrat fibrinogen. Sedangkan pada substrat albumin dan gelatin tidak terlihat adanya pita berwarna putih (Gambar 11). Protease memiliki spesifitas substrat lebih tinggi terhadap kasein daripada fibrinogen (Yanti 2003), ditandai dengan intensitas warna pita yang dihasilkan. Substrat kasein memberikan pita yang lebih terang dibanding substrat fibrinogen. Hal ini juga dibuktikan dengan uji spesifitas substrat. Substrat kasein memberikan aktivitas sebesar 0.281 U/ml dan substrat fibrinogen hanya memberikan aktivitas sebesar 0.098 U/ml, sedangkan substrat albumin dan gelatin menyebabkan aktivitas enzim menjadi nol.
Gambar 11 Analisis zimografi 15% pada fraksi eluat dengan substrat kasein (A), substrat fibrinogen (B), substrat albumin (C), dan substrat gelatin (D).
Secara keseluruhan ciri biokimiawi protease dari isolat bakteri W-1 ditampilkan pada Tabel 4.
Tabel 4 Ciri biokimiawi protease dari isolat bakteri W-1
SIMPULAN DAN SARAN Simpulan
Pencirian enzim protease dari isolat bakteri W-1 yang dihasilkan oleh tauco hitam memiliki aktivitas maksimal pada suhu 50ºC, pH 7 dengan waktu inkubasi 10 menit. Enzim ini merupakan protease serin karena dihambat spesifik oleh inhibitor PMSF. Ion-ion logam seperti Na+, K+, Mg2+, Mn2+, dan Cu2+ dapat menurunkan aktivitas enzim tersebut. Enzim berhasil dimurnikan dengan kromatografi penukar anion DEAE-Sepharose fast flow
pada laju alir 3.0 ml/menit, hal ini terbukti dengan meningkatnya aktivitas enzim sampai dengan 11.42 kali lipat dibanding dengan ekstrak enzim kasar.
Enzim protease ini mempunyai aktivitas kaseinolitik dan fibrinolitik. Ekstrak kasar protease menunjukkan jumlah pita protein sebanyak enam pita dengan kisaran berat molekul 11-35 kD dan eluat dengan dua pita protein dengan kisaran bobot molekul 30-34 kD. Bobot molekul enzim adalah 11.3; 21.4; 23.8; 26.6; 31.2; dan 34.7 kD untuk ekstrak enzim kasar. Sedangkan untuk fraksi eluat bobot molekulnya adalah 29.7 dan 33.3 kD.
Parameter Ekstrak kasar
Dialisat Eluat
pH 7 7 7
Ion logam Dihambat oleh ion Jenis enzim Protease
serin
- Protease
Saran
Sebaiknya dilakukan penelitian lebih lanjut dengan melakukan identifikasi bakteri yang dihasilkan dan tahap pemurnian dilanjutkan dengan kolom filtrasi gel.
DAFTAR PUSTAKA
Baziad A. Mempersiapkan Menopause. Artikel. Kompas. http:// www.google.com [14 Juli 2005].
Bergmeyer HU, Grassl MM. 1983. Method of Enzymatic Analysis. Ed ke-2. Weinheim: Verlag Chemie.
Bradford MM. 1976. A Rapid and Sensitive Method for Quantitation Microgram Quantities of Protein Utilizing the Principle of Protein dye- binding. Anal Biochem 72: 234-254.
Chantawannakul P et al. 2002. Characterization of proteases of
Bacillus subtilis strain 38 isolated from traditionally fermented soybean in Northern Thailand. App Sci 28: 241-245.
Christian GD. 2003. Analitycal Chemistry. Ed ke-2. Washington: Washington University.
Kim WK et al. 1996. Purification and characterization of a fibrinolytic enzyme produce from Bacillus sp. Strain CK 11-4 Screened from chungkook-jang. Environ microbial 62 : 2482-2488.
Kim SJ et al. 2005. Purification and characterization of fibrinolytic enzyme from cultured mycelia of Armillaria mellea.App Sci 252: 520-714.
Lehninger A. 1993. Dasar-Dasar Biokimia. Jilid 1. Thenawidjaja M, penerjemah; Jakarta: Erlangga. Terjemahan dari:
Principles of Biochemistry.
Nurachman Z. 2001. Obat stroke dan jantung akibat trombosis dari cacing tanah. Seminar on-air Bioteknologi untuk Indonesia Abad 21. Jakarta: Sinergy forum-PPI Tokyo Institute of Technology [1-14 Februari 2001].
Palmer T. 1991. Understanding Enzymes. England: Ellis Horwood Limited .
Park SG et al. 1998. Rapid purification and biochemical characteristics of lumbrokinase 111 from earthworm for us as a fibrinolityc agent. Biotechnol Lett 20: 169-172.
Roe S. 1999. Protein Purification Techniques. Ed ke-2. Oxford: Technology plc.
Rose AH. 1982. Fermented Food. England: Academic Press.
Sarwono B. 2004. Membuat Tempe dan Oncom. Jakarta: Penebar Swadaya.
Scopes RK. 1987. Protein Purification Principles and Practice. Ed Ke-2. New York: Springer-Verlag.
Scopes RK. 1989. Protein Purification. USA: R.R. Donnelley and Sons.
Seo JH, Lee SP. 2004. Production of fibrinolytic enzyme from soybean grits fermented by Bacillus firmus NA-1. Inc
12: 442-449.
Shurleff W, Aoyagi. 1976. The Book of Miso. USA: Autum Press.
Soetoyo HS. 1988. Modifikasi pembuatan tauco dengan sistem fermentasi terkontrol [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor: IPB PAU Bioteknologi.
Suhartono MT. 1992. Protease. Bogor: IPB PAU Bioteknologi.
Thangam EB , Rajkumar GS. 2002. Purification and characterization of alkaline protease from Alcaligenes faecalis. App. Biochem 35: 144-154.
Tucker GA, Woods LF. 1995. Enzyme in Food Processing. Ed ke-2. Nottingham: University of Nottingham.
Winarno F, Fardiaz S, Fardiaz D. 1980.
Pengantar Teknologi Pangan. Jakarta: Gramedia.
Winarno FG. 1983. Enzim Pangan. Jakarta: Gramedia.
Wood BJ. 1985. Microbiology of Fermented Foods. Scotland: Academic Press.
Yanti. 2003. Pemurnian dan karakterisasi protease cacing tanah Lumbricus rubellus yang bersifat fibrinolitik [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Yanti et al. 2003. Karakterisasi protease dari ekstrak cacing tanah Lumbricus rubellus. International symposim on Biomedicines: Biodiversity on Traditional on Biomedicines for Human Health and Welfare. Bogor: Pusat Studi Biofarmaka IPB [18-19 September 2003].
Lampiran 1 Prosedur pembuatan pereaksi kimia
Pereaksi untuk Analisis Akvitas Enzim dan Kadar Protein • Kasein 2% (b/v)
Sebanyak 2 gram kasein Hammarsten dilarutkan dalam bufer universal (ditambahkan
sedikit-sedikit) sambil diaduk dan dipanaskan (50-60oC) supaya mudah larut, lalu ditera
hingga volume total 100 ml.
• Tirosin 5mM
Sebanyak 0.091 gram tirosin dilarutkan dalam akuades (ditambahkan sedikit-sedikit)
sambil diaduk, lalu ditera hingga volume total 100ml.
• TCA 0.1M
Sebanyak 1.634 gram TCA dilarutkan dalam akuades (tambahkan sedikit-sedikit) sambil
distirer, lalu di tera hingga volume total 100ml.
• Na2CO3 0.4M
Sebanyak 4.2404 gram Na2CO3 dilarutkan dalam 100 ml akuades, lalu diaduk dengan
pengaduk magnetik hingga larut.
• Pereaksi Folin-Ciocalteau
Sebanyak 25 ml pereaksi Folin-Ciocalteau diencerkan dengan akuadest hingga volume 50
ml dan diaduk dengan pengaduk magnetik hingga homogen.
• Pereaksi Bradford
Stok larutan Bradford dibuat dengan cara melarutkan 0.1 gram Coomasssie Brilliant Blue
R-250 dalam 50 ml etanol 95% (v/v) dan 100 ml asam fosfat 85% (v/v), lalu ditera
dengan akuades hingga volume 200 ml. Larutan kerja Bradford dibuat dengan cara
mengencerkan 5 ml larutan stok Bradford dengan akuades sehingga volume 50 ml.
Pereaksi untuk analisis SDS-PAGE dan Zimografi
• Larutan A ( 30% (b/v) akrilamida dan 0.8% (b/v) bis-akrilamida)
Sebanyak 14.6 gram akrilamida dan 0.4 gram bis-akrilamida dilarutkan dalam 50 ml
akuadest dan diaduk dengan pengaduk magnetic hingga larut homogen.
• Larutan B (bufer gel pemisah dan tris-HCl 2 M pH 8.8)
Sebanyak 75 ml larutan tris-HCl 2 M pH 8.8 dan 4 ml larutan SDS 10% (b/v)
ditambahkan dengan akuades hingga volume total 100ml.
• Larutan C (bufer gel penahan dan tris-HCl 1M pH 6.8)
Sebanyak 6.8 tris-HCl 1M pH 6.8 dan 4 ml larutan SDS 10% (b/v) ditambahkan dengan
akuades hingga volume total 100ml.
• Amonium persulfat 10% (b/v)
• Bufer elektroforesis
Sebanyak 1.803 gram tris, 8.648 gram glisin, dan 0.6 gram SDS dilarutkan dalam 600 ml
akuades, lalu ditera hingga pH 8.3 dengan HCl 1M.
• Bufer sampel
Komposisi bufer sampel untuk SDS-PAGE terdiri dari 0.3 ml tris-HCl 1M pH 6.8, 2.5 ml
gliserol 50% (v/v), 1.0 ml SDS 10% (b/v), 0.25 ml 2-merkaptoetanol, 0.5 ml bromfenol
blue 1% (b/v), dan 0.45 ml akuades dengan volume total 5.0 ml. Sementara komposisi
bufer sampel untuk zimografi terdiri dari 0.5 gram SDS, 1ml gliserol 50 % (v/v), 1 ml
bromfenol biru, 0.625 ml tris-HCl 1 M pH 6.8, dan 2.375 ml akuades dengan volume
total 5.0 ml.
• Larutan pewarna
Sebanyak 0.5 gram Coomasssie Brilliant Blue R-250 dilarutkan dalam campuran 225 ml
metanol, 50 ml asam asetat glasial, dan 225 akudes dengan volume total 500 ml.
• Larutan peluntur
Komposisi larutan terdiri dari 50 ml metanol, 50 ml asam asetat glasial, dan 400 ml
akuades dengan volume total 500 ml.
• Triton X-100 2.5 % (v/v)
Sebanyak 2.5 ml larutan Triton X-100 dilarutkan dalam akuades hingga volume total
500ml.
Larutan berbagai bufer
Larutan kerja bufer dibuat dengan cara mengencerkan 25 ml larutan stok bufer 0.2 M
dengan akuades hingga volume total 100 ml. Bufer yang digunakan dalam penelitian ini adalah
bufer universal (pH 4 sampai 10), glisin-HCl (pH 8.3), dan bufer tris-HCl pH 6.8 dan 8.8.
Komposisi media pertumbuhan dan media produksi
Media Luria Bertani Broth (LB 10%), pH 7
Yeast ekstrak 0.05 g
Tripton 0.1 g
NaCl 0.05 g
Akuades 100 ml
Media Skim Milk Agar (SMA), pH 7
Agar 4.5 g
Susu skim milk 100 ml
Bufer universal
Larutan A : Asam sitrat (6.008 g) + KH2PO4 (3.895 g) + H3PO3(1.769 g) + asam dietilbarbiturat (5.266 g) dilarutkan ke dalam 1 liter akuades
Larutan B : 0.2 N NaOH
100 ml larutan A + X ml larutan B
Kandungan Standar LMW • BSA 66 (kD)
• ovalbumin (45 kD),
• Gliseraldehid-3-fosfat Dehidrogenase (36 kD),
• Karbonat Anhidrase (29 kD),
• Tripsinogen (24 kD),
• Soybean Trypsin Inhibitor (20 kD),
• α-Laktalbumin (14.2 kD),
• dan apronitin 6.5 kD.
X (ml) pH
Lampiran 2 Diagram alir penelitian
Produksi ekstrak kasar
Presipitasi amonium sulfat (kejenuhan 30-80%) Analisis aktivitas protease dan
kadar protein
SDS-PAGE dan Zimografi Karakterisasi enzim
pH, suhu, waktu, ion logam,
dan inhibitor Dialisis dan pemekatan dengan kantung dialisis (cut-off 10 kD
)
Isolat tauco hitam
Lampiran 3 Diagram alir produksi ekstrak kasar
Isolat tauco hitam
Media produksi
Inkubasi 48 jam, 150 rpm, 37ºC (inkubator bergoyang
)
Sentrifugasi 7500 rpm, 15 menit
Lampiran 4 Contoh perhitungan aktivitas enzim (U/ml) dan aktivitas enzim spesifik Perhitungan aktivitas enzim (U/ml)
Aktivitas protease (U/ml) = Asampel-Ablanko x Fp Astandar-Ablanko t
Keterangan :
Asp = Absorbans sampel Astd = Absorbans standar Ablk = Absorbans blanko Fp = Faktor pengenceran t = waktu hidrolisis
Contoh perhitungan pada suhu 50ºC selama 10 menit (ekstrak protease kasar) Aktivitas protease (U/ml) = 0.652-0.460 x 6
1.869-0.460 10 = 0.082 U/ml
Perhitungan kadar protein
Persamaan dari kurva standar :
y = 4.3703x + 0.0265 x = [ BSA] mg/ml y= Absorbansi (mg/ml)
contoh perhitungan kadar protein ekstrak protease kasar dengan nilai absorbansi 1.085 nm
y = 4.3703x + 0.0265 1.085 = 4.3703x + 0.0265 1.085 - 0.0265= 4.3703x
X= 0.242 mg/ml [Protein] (mg/ml) = 0.242 mg/ml
Perhitungan aktivitas spesifik enzim (U/mg)
aktivitas enzim spesifik (U/mg) = aktivitas enzim (U/ml) [Protein] (mg/ml)
Contoh perhitungan pada suhu 50ºC selama 10 menit (ekstrak protease kasar) aktivitas enzim spesifik (U/mg) = aktivitas enzim (U/ml)
[Protein] (mg/ml) = 0.082
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7
0 0.05 0.1 0.15 0.2
Konsentrasi (mg/ml)
Ab
so
r
b
a
n
s
Lampiran 5 Pembuatan kurva standar Bradford Kurva standar Bradford
[BSA] μg/ml Absorbans
Lampiran 6 Data pengaruh suhu, pH, waktu, inhibitor, dan ion logam terhadap aktivitas protease dari ekstrak kasar tauco hitam
Pengaruh suhu
Suhu (ºC) Asampel (nm) Ablanko (nm) Astandar (nm) Aktivitas enzim
Pengaruh waktu
Waktu Asampel (nm) Ablanko (nm)
Astandar (nm) Aktivitas enzim (U/ml)
Inhibitor Asampel (nm) Ablanko (nm)
Astandar (nm) Aktivitas enzim (U/ml)
Pengaruh ion logam
Inhibitor Asampel (nm) Ablanko (nm)
Lampiran 7 Data pengaruh suhu, pH, waktu, inhibitor, dan ion logam terhadap aktivitas protease dari dialisat tauco hitam
Pengaruh suhu
Suhu (ºC) Asampel (nm) Ablanko (nm) Astandar (nm) Aktivitas enzim
Pengaruh waktu
Waktu Asampel (nm) Ablanko (nm)
Astandar (nm) Aktivitas enzim (U/ml)
Inhibitor Asampel (nm) Ablanko (nm)
Astandar (nm) Aktivitas enzim (U/ml)
Pengaruh ion logam
Inhibitor Asampel (nm) Ablanko (nm)
Lampiran 8 Data pengaruh suhu, pH, waktu, inhibitor, dan ion logam terhadap aktivitas protease dari eluat tauco hitam
Pengaruh suhu
Suhu (ºC) Asampel (nm) Ablanko (nm) Astandar (nm) Aktivitas enzim (U/ml)
Aktivitas relatif (%) 27
37 50 55 65 80
0.245 0.620 0.462 0.695 0.486 0.434
0.257 0.343 0.248 0.510 0.420 0.401
0.480 1.702 0.686 1.800 1.195 1.295
0 0.122 0.293 0.086 0.051 0.022
0 42 100
30 17 8
Pengaruh pH
pH Asampel (nm) Ablanko (nm) Astandar (nm) Aktivitas enzim (U/ml)
Aktivitas relatif (%) 4 0.649 0.580 1.200 0.067 28 5 0.897 0.700 1.861 0.094 40 6 0.915 0.725 1.778 0.108 46 7 0.701 0.552 0.930 0.236 100 8 0.815 0.762 1.121 0.089 38 9 0.911 0.770 1.775 0.069 29 10 0.912 0.810 1.990 0.052 22 12 0.677 0.590 1.900 0.016 11
Pengaruh waktu
Waktu Asampel (nm) Ablanko (nm)
Astandar (nm) Aktivitas enzim (U/ml)
Aktivitas relatif (%)
y = -1.2773x + 2.0279
R2 = 0.9699
0 0.2 0.4 0.6 0.8 1
0 0.5 1 1.5 2
Rf (cm)
Log BM
Lampiran 9 Pembuatan kurva standar SDS-PAGE 15%
Pita Rf (cm) BM (kDa) Log BM
1 0.2000 66 1.8195
2 0.2727 45 1.6532
3 0.3273 36 1.5563
4 0.4364 29 1.4624
5 0.4909 24 1.3802
6 0.6182 20 1.3010