PRODUKSI H2O2 PADA KEDELAI KULTIVAR SLAMET
Oleh :
Mohammad Bahrelfi Belafiff
G34101054
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Subunit α terhadap Cekaman Al melalui Identifikasi Produksi H2O2 pada Kedelai Kultivar
Slamet. Dibimbing oleh UTUT WIDYASTUTI SUHARSONO dan DIAH RATNADEWI. Peranan protein heterotrimerik G subunit α pada cekaman Al3+ diteliti dengan menggunakan kultur suspensi sel kedelai kultivar Slamet. Kalus yang sesuai untuk inisiasi kultur suspensi sel berhasil diinduksi secara in vitro pada media MS minimal dengan vitamin Gamborg B5 dan 1 ppm 2,4-D serta 0.1 ppm Kinetin. Kalus kemudian dipindahkan ke media cair MS minimal dengan 2 g/L Bacto Tryptone, 3 ppm 2,4-D dan 0.1 ppm Kinetin. Kultur suspensi sel didapatkan setelah 3-4 minggu inkubasi dalam gelap. Sel yang diperoleh dari kultur suspensi sel digunakan untuk percobaan.
Pada cekaman pH rendah (pH 4.0) dan Al3+ (1.2 mM) didapati represi produksi H2O2 mulai
dari jam ke-1 sampai jam ke-6 pada kedua perlakuan. Pemberian Mastoparan (30 µM) tidak menunjukkan perbedaan tingkat produksi H2O2 antara kontrol dengan kedua perlakuan pada jam
ke-1 dan ke-3 setelah pemberian cekaman. Mastoparan menginduksi produksi H2O2 pada kedua
perlakuan setelah lewat 3 jam sejak pemberian cekaman, dimana tingkat produksi H2O2 pada
kultur suspensi sel kedelai lebih tinggi pada perlakuan pH rendah dibandingkan Al3+. Tingkat kematian sel pada jam ke 6 lebih tinggi pada pemberian Mastoparan dibandingkan kontrol, dengan tingkat kematian pada pH rendah lebih tinggi dibanding Al3+. Hasil menunjukkan bahwa protein heterotrimerik G tidak terlibat dalam transduksi sinyal Aluminium pada 3 jam pertama setelah perlakuan dengan Al3+. Represi produksi H2O2 pada awal cekaman diperlukan untuk mencegah
kematian sel. Produksi H2O2 meningkat setelah 3 jam perlakuan Aluminium (Al 3+
) dengan mastoparan.
ABSTRACT
MOHAMMAD BAHRELFI BELAFIFF. The Involvement of Heterotrimeric G Protein α Subunit in Aluminum Toxicity of Soybean cv. Slamet Through the Identification of H2O2.
Supervised by UTUT WIDYASTUTI SUHARSONO and DIAH RATNADEWI.
The role of Heterotrimeric G protein α subunit in Al3+ toxicity was investigated using soybean cultivar Slamet cell suspension culture. Suitable callus for initiation of cell suspension culture was obtained in vitro using soybean seedlings hypocotyl on MS basal salt with Gamborg’s B5 vitamins supplemented with 1 ppm of 2,4-D, and 0.1 ppm Kinetin. Callus was then transferred to liquid medium of MS basal salt supplemented with 2 g/L of Bacto Tryptone, 3 ppm 2,4-D and 0.1 ppm Kinetin. Cell suspension culture was generated after 3-4 weeks incubation in dark. Cells obtained from cell suspension culture were used in the experiment.
Repression of H2O2 production rate was observed on both pH 4.0 and pH 4.0+Al3+ (1.2
mM) treatments started from the 1st to the 6th hour. Mastoparan (30 µM) application showed no significant difference of H2O2 production rate between control and both pH 4.0 and pH 4.0+Al
3+
treatment from the 1st to the 3rd hour after treatment. Mastoparan induced H2O2 production after
the 3rd hour, where it was strongly enhanced in cells treated with pH 4.0 compared only with pH 4.0+Al3+. The rate of cell death on the 6th hour was higher with Mastoparan compared to control of both treatment, with rate of cell death was higher on pH 4.0 compared to pH 4.0+Al3+. The results indicated that heterotrimeric G protein was not involved on the signal transduction of Aluminium on the first 3 hour after treatment with Al3+. Repression of H2O2 production at the early hour of
stress seems necessary to prevent cell death. H2O2 production was increased after 3 hour of
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut pertanian Bogor
Oleh :
Mohammad Bahrelfi Belafiff
G34101054
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama
: Mohammad Bahrelfi Belafiff
NRP
: G34101054
Menyetujui:
Pembimbing I,
Pembimbing II,
Dr. Ir. Utut Widyastuti S, M.Si.
Dr. Diah Ratnadewi
NIP
131851279
NIP
130937090
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131473999
diselesaikan. Penelitian ini dibiayai oleh Proyek Hibah Bersaing XII Direktorat Jenderal Pendidikan tinggi (DIKTI) dengan judul Analisis Gen Penyandi Protein Heterotrimerik G Subunit α yang Terlibat dalam Sistem Toleransi Tanaman Kedelai terhadap Cekaman Aluminium atas nama Dr. Ir. Utut Widyastuti Suharsono.
Terima kasih penulis ucapkan kepada Dr. Ir. Utut Widyastuti Suharsono, M.Si dan Dr. Diah Ratnadewi sebagai pembimbing atas segala bimbingan, waktu, sarana dan nasihat yang telah diberikan. Terima kasih kepada Kepala Pusat Penelitian Sumberdaya Hayati dan Bioteknologi beserta seluruh staf dan karyawan atas sarana, prasarana, dan bantuannya selama penulis melakukan penelitian di Laboratorium Biologi Molekuler dan Seluler Tanaman (BMST) dan Laboratorium Biorin (Biotechnology Research Indonesia-the Netherland). Terimakasih kepada Dr. Anja Meryandini atas saran yang telah diberikan sehingga tulisan ini menjadi lebih baik. Terima kasih juga disampaikan kepada Bapak Abdul Mulya, Mbak Pepi Elvavina, Mbak Nia, Mbak Sara dan Bapak Asep atas nasihat, bantuan, dan kerjasamanya.
Ungkapan terima kasih penulis juga disampaikan kepada kedua orang tua penulis, dan kedua adik penulis atas perhatian, doa dan kasih sayangnya. Terima kasih juga penulis haturkan kepada teman-teman Biologi 38 Lulu, Fitri, Nana, Lucky, Cynthia LM, Irwandi, Hijrah, Henry, Made, Deri, Ritma, Rika, Vina, Pi’i, teman-teman di As-Syabab, Angga, Trio, Bekti, Isnan, Rizki, Erwin, Rully F, dan rekan-rekan seperjuangan di Laboratorium BMST dan Biorin yaitu Akhmad Amirullah, Lestari Budi Utami, Popi Septiani, Evy Ammay R, Hakiim Bashaar, Lulut D.S., T. Dian Fauziah, Syahnada Jaya, Prasna ITP 39, Rika ITP 40, Kak Ade, Mas Firdaus, Mbak Wiwid, Mbak Agust, Mbak Zendi, Mas Huda, Mbak Kiki, Mbak Muti, Mbak Nana, Mbak Didi, Pak Muzuni, Pak Hadi, Mbak Ratna, Bu Srilis dan Bu Hanum atas segala bantuan, nasihat, persahabatan serta diskusi malam yang hangat.
Semoga karya ilmiah ini bermanfaat bagi agama, bangsa dan negaraku.
Bogor, Mei 2007
Nurul Hidayati. Penulis merupakan anak pertama dari tiga bersaudara.
Tahun 2001 penulis lulus dari SMU Negeri 98 Jakarta dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam Institut pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
DAFTAR GAMBAR... DAFTAR LAMPIRAN... PENDAHULUAN
Latar belakang... Tujuan Penelitian... Waktu dan Tempat Penelitian... BAHAN DAN METODE
Sterilisasi Eksplan... Induksi Kalus... Inisiasi dan Pemeliharaan Kultur Suspensi Sel Kedelai... Perlakuan Cekaman berbagai nilai pH dan Al3+... Perlakuan Cekaman Al3+ dengan Aktivator Protein G... Deteksi dan Kuantifikasi H2O2 pada Kultur Suspensi Sel...
Pengukuran Jumlah Sel Mati... HASIL DAN PEMBAHASAN
Hasil... Induksi Kalus... Inisiasi dan Pemeliharaan Kultur Suspensi Sel Kedelai... Deteksi dan Kuantifikasi H2O2 pada Kultur Suspensi Sel...
Pengukuran Jumlah Sel Mati... Pembahasan...
Induksi Kalus... Inisiasi dan Pemeliharaan Kultur Suspensi Sel Kedelai... Deteksi dan Kuantifikasi H2O2 pada Kultur Suspensi Sel...
Pengukuran Jumlah Sel Mati...
SIMPULAN... SARAN... DAFTAR PUSTAKA ... LAMPIRAN...
vii vii
1 2 2
2 2 2 2 3 3 3
1 2
3 4 5 6
7 8
Bobot kalus pada perlakuan berbagai ZPT... Kalus yang terbentuk pada media (a) MS+1 ppm D dan (b) MS+1 ppm 2,4-D+0.1 ppm Kinetin... Kurva tumbuh kultur suspensi sel kedelai cv. Slamet... Produksi H2O2 pada berbagai pH media tanpa agitasi...
Produksi H2O2 pada berbagai pH media dengan perlakuan agitasi selama 16 jam....
Produksi H2O2 pada media kontrol (a) dan mastoparan 30 µM (b) dengan
perlakuan agitasi selama 16 jam... Sel yang telah diwarnai dengan 0,04 % Evans blue, (A) sel hidup, (B) sel mati... Tingkat kematian sel pada perlakuan kontrol (a) dan mastoparan (b)...
4
4 4 5 5
6 6 6
DAFTAR LAMPIRAN
Halaman 1
2 3
Komposisi media yang digunakan... Komposisi buffer Xylenol Orange... Kurva standar H2O2...
Protein G merupakan salah satu komponen yang berperan dalam transduksi sinyal pada makhluk hidup. GTP-binding regulatory protein atau protein G termasuk dalam famili protein pengikat guanosin trifosfat (GTP). Protein G sendiri terbagi menjadi 2 jenis yaitu protein heterotrimerik G, yang terletak di membran plasma, dan protein G kecil (small G protein ) yang terletak di sitoplasma. Beragam jenis transduksi sinyal pada mamalia telah diketahui melibatkan protein G khususnya protein heterotrimerik G (Ma 1994).
Protein heterotrimerik G terbagi menjadi 3 subunit, yaitu subunit α, dan . Protein ini aktif ketika mengikat dan menghidrolisis GTP yang diikatnya. Saat aktif protein ini akan meneruskan sinyal yang diterima reseptor ekstraseluler kepada efektor intraseluler pada sisi membran sel bagian dalam. Setelah GTP yang terikat dihidrolisis menjadi GDP, protein ini kembali ke konformasi semula dan menjadi tidak aktif (Krauss 2001). Protein heterotrimerik G, khususnya subunit α, telah diketahui terlibat dalam transduksi sinyal cekaman biotik, hormon dan lain sebagainya (Assman 2002)
Kedelai (Glycine max) merupakan salah satu produk pertanian dengan tingkat permintaan yang tinggi di dunia. Kandungan gizi yang tinggi, karena mengandung beberapa asam amino esensial, serta beragam kegunaan lain selain untuk dikonsumsi mengakibatkan melonjaknya permintaan akan kedelai. Beragam usaha telah dilakukan untuk meningkatkan produksi kedelai dunia, mulai dari cara intensifikasi dengan menggunakan teknik pertanian yang lebih baik, sampai dengan ekstensifikasi lahan oleh negara-negara pengeskpor kedelai terbesar dunia seperti Brazil dan Amerika (USDA 2007).
Produksi kedelai Indonesia belum mampu memenuhi kebutuhan dalam negeri sehingga masih perlu mendatangkan dari luar. Produksi kedelai Indonesia pada tahun 2006 baru mencapai 783 554ton per tahun (BPS 2006), sedangkan kebutuhan dalam negeri mencapai kurang lebih 2 juta ton, sehingga pada tahun 2006 Indonesia mengimpor kedelai sebesar kurang lebih 1 370 000 metrik ton (USDA 2007).
Oleh karena itu perlu diupayakan peningkatan produksi kedelai di Indonesia untuk menutupi kekurangan tersebut. Hal ini dapat dilakukan baik melalui intensifikasi
Di seluruh dunia, tanah dengan pH cukup rendah banyak dijumpai di daerah tropis. Kondisi tanah masam ini dijumpai pada kurang lebih 40% lahan yang dapat ditanami di seluruh dunia (Gardner 1998). Indonesia sebagai negara agraris memiliki 18,2 juta hektar lahan dengan tingkat pH rendah (Mashuda 2006) yang potensial untuk dikembangkan sebagai lahan pertanian, khususnya untuk kedelai.
Tantangan yang menghadang untuk ekstensifikasi adalah kondisi pH tanah yang rendah, yang akan meningkatkan kelarutan ion-ion logam di tanah. Tingginya kandungan ion-ion logam tertentu dalam tanah dapat bersifat toksik bagi tanaman. Salah satu ion tersebut adalah Aluminium (Al) dalam bentuk ion Al3+. Beberapa penelitian telah menun-jukkan bahwa pada tanah dengan kondisi masam, ion Al3+ yang terakumulasi meru-pakan faktor penyebab utama yang membatasi tingkat keberhasilan panen (Kochian 1995), karena ion Al3+ menghambat pertumbuhan akar, yang akan berakibat terhadap pertum-buhan tanaman (Gardner 1998).
Salah satu solusi terhadap permasalahan tersebut adalah penggunaan kultivar unggul yang tahan terhadap Al3+ tinggi. Usaha untuk menghasilkan kultivar unggul tersebut dapat dicapai dengan teknik pemuliaan konven-sional ataupun melalui perakitan genetik tanaman. Namun usaha untuk merakit tana-man yang memiliki sifat ketahanan terhadap Al3+ sebelumnya harus didahului oleh studi mengenai mekanisme pertahanan serta gen-gen yang terlibat dalam ketahanan terhadap Al3+. Oleh karena itu, usaha untuk memahami mekanisme yang terlibat dalam peristiwa toksisitas Al pada tanaman, khususnya pada kedelai merupakan langkah penting.
Cote dan Crain (1993) menunjukkan adanya penghambatan dari Al3+ terhadap pemecahan fosfoinositol menjadi IP3,
sehingga mempengaruhi regulasi kanal Ca2+ dan mengakibatkan perubahan kandungan Ca2+ intraseluler, yang berpengaruh terhadap fungsi seluler sel tumbuhan. Legendre et al. (1993) menegaskan bahwa aktivitas protein heterotrimerik Gα meningkatkan kandungan IP3 intraseluler, dan mendorong peningkatan
produksi H2O2 pada kultur sel kedelai. Hal ini
menunjukkan bahwa IP3 berperan dalam
regulasi produksi H2O2 (Legendre et al.
heterotrimerik G. Jika transduksi sinyal cekaman Al3+ pada tumbuhan melibatkan protein heterotrimerik G, maka produksi H2O2
pada sel tumbuhan dapat dijadikan indikator untuk melihat keterlibatan protein hetero-trimerik G dalam cekaman aluminium. Tujuan penelitian.
Tujuan penelitian ini adalah untuk menganalisis keterlibatan protein hetero-trimerik G subunit α pada mekanisme tole-ransi dari kultivar kedelai toleran asam (Slamet) terhadap cekaman Al3+ melalui identifikasi produksi H2O2.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan April 2005 sampai dengan Desember 2006, bertempat di Laboratorium Biologi Seluler dan Molekuler Tanaman dan Laboratorium Biorin (Biotechnology Research Indonesia-The Netherland), Pusat Penelitian Sumber-daya Hayati dan Bioteknologi (PPSHB) IPB, Jalan Kamper, Kampus IPB Darmaga.
BAHAN DAN METODE
Sterilisasi Eksplan
Biji kedelai Slamet dipilih yang berkulit mulus dan tidak cacat. Biji dicuci dengan air dan Tween-80 (0.5%) (v/v) dengan agitasi kuat, dan dibilas dengan air dua kali. Biji kemudian disterilisasi dengan alkohol 70% (v/v) selama 30 detik, setelah itu dibilas dengan akuades steril. Biji disterilisasi ulang dengan larutan Natrium Hipoklorit komersial 20% (v/v) (NaClO 5,25%) yang diberi Tween -80 (0.5%) (v/v), selama 15 menit dengan agitasi kuat, dilanjutkan pembilasan dengan akuades steril sebanyak tiga kali.
Induksi Kalus
Biji yang telah steril ditanam pada botol kultur berisi larutan mineral MS dan vitamin B5 (Liu et al. 1997) (Lampiran 1) dengan tambahan ZPT (Zat Pengatur Tumbuh) 2,4-D (2,4-Dichlorophenoxyacetic acid) dan Kinetin (6-Furfurylaminopurin) serta agar 8 g/L. ZPT diberikan dengan kombinasi sebagai berikut (Da Silva et al. 2003):
1. Medium MS 0 (Kontrol) 2. Medium MS+ 1 ppm 2,4-D
3. Medium MS+ 1 ppm 2,4-D+ 0.1 ppm Kinetin
4. Medium MS+ 0.1 ppm Kinetin. Di dalam tiap botol kultur ditanam 5 biji, ditumbuhkan pada suhu 24°C dengan
pencahayaan kontinyu dan intensitas cahaya ± 1 000 lux. Eksplan diamati pertumbuhannya selama 3 minggu hingga terbentuk kalus. Perlakuan diulang sebanyak sepuluh kali. Inisiasi dan Pemeliharaan Kultur Suspensi Sel Kedelai
Kultur berisi kalus dalam media peme-liharaan MS organik minimal dengan 2 g/L Bacto Tryptone (Becton, Dickinson & Co.) serta 3 ppm 2,4-D dan 0.1 ppm kinetin (pH 5.8) (Legendre et al. 1992) (Lampiran 1), kemudian diinkubasi pada inkubator ber-goyang resiprokal (bolak-balik) Certomat WR dengan kecepatan 70 rpm selama 3-4 minggu secara kontinyu, dalam keadaan gelap. Setelah 3-4 minggu sebanyak 20 sampai 30 mL suspensi sel dipindahkan ke dalam media cair baru dengan komposisi yang sama dan diinkubasi pada inkubator goyangan berputar Bench Top Shaker 4622 pada kecepatan 70 rpm secara kontinyu dengan intensitas cahaya 15 lux.
Kultur suspensi sel dipelihara selama penelitian, dengan subkultur ke media dengan komposisi yang sama setiap 7 hari sekali. Konsentrasi sel diukur setiap 2 hari sekali dengan metode PCV (Packed Cell Volume) yaitu dengan cara sebanyak 10 mL suspensi sel diendapkan dengan sentrifugasi Jouan BR4i (Jouan) pada kecepatan 200xg selama 5 menit pada suhu 15 ºC. Persentase PCV dihitung dengan rumus :
%
100
×
=
sampel
total
volume
mL
n
terendapka
yang
sel
mL
PCV
Kultur suspensi sel yang telah mencapai konsentrasi sel 10% PCV digunakan untuk penelitian dengan perlakuan cekaman pH dan Al3+.
Perlakuan Cekaman Berbagai Nilai pH dan Al3+
pada setiap cawan petri dan diinkubasi selama 16 jam pada suhu 25 °C dalam gelap. Setelah itu, media pada tiap cawan petri diganti dengan media perlakuan sebanyak 2 mL.
Perlakuan berupa cekaman pH yaitu pH 5.8 (pH media pemeliharaan), pH 6.0, pH 4.0 dan pH 4.0+ 1,2 mM Al3+. Cekaman Al3+
diberikan dalam bentuk AlCl3. Tepat sebelum
dilakukan penggantian media dengan media perlakuan, diambil sebanyak 100 µL media sebagai data jam ke 0. Selanjutnya penga-matan produksi H2O2 dilakukan pada jam ke
1, 3 dan 6 setelah penggantian media dengan media perlakuan. Pemberian cekaman Al3+ dengan konsentrasi 1,2 mM mengacu pada metode Anwar (1999) dan Mashuda (2006), yang menunjukkan bahwa antara perlakuan cekaman Al3+ pada konsentrasi 1,2 mM dan 1,6 mM tidak berbeda nyata.
Agitasi telah diketahui mampu meningkatkan produksi H2O2 pada kultur
suspensi sel kedelai (Legendre et al. 1993a). Oleh karena itu induksi H2O2 diberikan secara
endogen dengan praperlakuan agitasi selama 16 jam. Setelah inkubasi, dilakukan pengu-kuran dengan tahapan seperti disebutkan di atas. Tiap perlakuan diulang sebanyak tiga kali.
Perlakuan Cekaman Al3+ dengan Aktivator Protein G
Mastoparan merupakan aktivator spesifik protein heterotrimerik G subunit α. Pemberian mastoparan hanya dilakukan pada perlakuan cekaman pH 4.0 dan pH 4.0+1.2 mM Al3+. Konsentrasi Mastoparan-7 (Sigma-Aldrich) yang digunakan sebesar 30 µM. Sebagai kontrol adalah media perlakuan cekaman pH 4.0 dan pH 4.0+1.2 mM Al3+ tanpa penam-bahan mastoparan. Pada jam ke 0, 1, 3 dan 6 dilakukan pengukuran H2O2 dan jumlah sel
mati diukur pada jam ke 0 dan jam ke 6. Tiap perlakuan diulang sebanyak dua kali.
Deteksi dan Kuantifikasi H2O2 pada Kultur
Suspensi Sel.
Deteksi dan kuantifikasi terhadap kandungan H2O2 dilakukan menurut He et al.
(2000) dan Suharsono et al. (2002b). Sebanyak 100 µL cairan medium diambil pada jam ke 0, 1, 3, dan 6 pada tiap perlakuan. Cairan medium kemudian direaksikan dengan 1 mL larutan penyangga Xylenol Orange (Dojindo) (Lampiran 2) dan diinkubasi pada suhu ruang selama 2 jam. Sampel kemudian disentrifugasi pada 10 000 rpm selama 10 menit untuk mengendapkan sel-sel yang terbawa pada pengambilan sampel.
Absor-bansi diukur dengan spektrofotometer Cecil CE 2020 (Cecil Instrument Limited) pada λ 560 nm dengan menggunakan H2O2 sebagai
standar.
Pengukuran Jumlah Sel Mati
Pengukuran terhadap jumlah sel yang mati dilakukan menurut Suharsono (2002a). Sebanyak 200 µL suspensi sel dari tiap perlakuan diambil pada jam ke 0 sebelum penggantian media dan jam ke 6 setelah per-lakuan. Suspensi sel diendapkan dengan sentrifugasi pada kecepatan 2 500 rpm selama 5 menit. Supernatan kemudian dibuang dan endapan sel diberi 1 mL larutan Evans blue (Sigma-Aldrich) 0.04% (b/v) dalam air dan diinkubasi selama 10 menit pada suhu ruang.
Sel kemudian diendapkan pada kecepatan 2 500 rpm selama 5 menit, supernatan di-buang dan endapan sel dibilas dengan 1 mL larutan 100 µM CaCl2 (pH 5.6). Pembilasan
dilakukan sebanyak 5-6 kali untuk meng-hilangkan kelebihan zat pewarna Evans blue. Kemudian sel dicuci dengan 1 mL larutan 1% SDS (b/v) dalam metanol 50% (v/v) dan di-inkubasi selama 2 jam untuk mengeluarkan zat warna Evans blue dari dalam sel yang mati. Absorbansi dari zat pewarna Evans blue yang dilepaskan dari sel yang mati kemudian diukur dengan spektrofotometer pada λ 595 nm.
HASIL DAN PEMBAHASAN
Hasil
Induksi Kalus
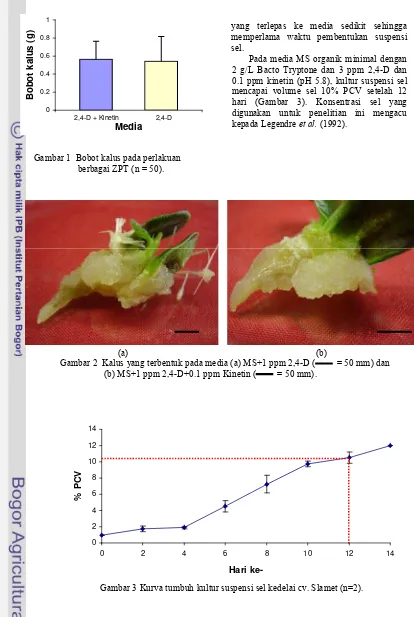
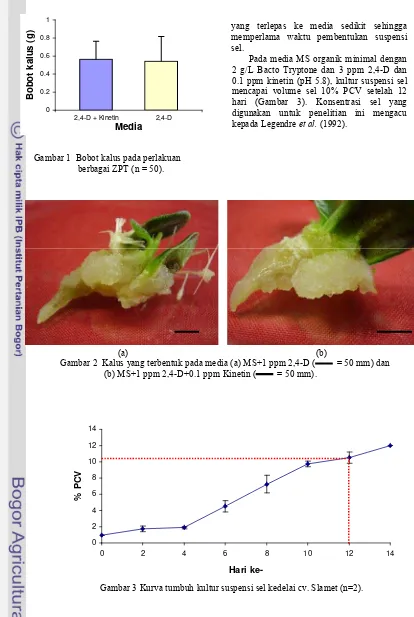
Induksi terhadap kalus tidak dijumpai pada media kontrol (MS) dan media MS+0.1 ppm kinetin. Media perlakuan MS+1 ppm 2,4-D+0.1 ppm kinetin dengan MS+1 ppm 2,4-D tidak menunjukkan perbedaan nyata dalam bobot kalus (Gambar 1).
Kalus yang terbentuk pada media dengan kombinasi MS+1 ppm 2,4-D+0.1 ppm kinetin memberikan kalus yang lebih remah (friable) jika dibandingkan dengan media MS+1 ppm 2,4-D (Gambar 2).
Inisiasi dan Pemeliharaan Kultur Suspensi Sel Kedelai
0 0.2 0.4 0.6 0.8 1
Media
B
obot
k
a
lus
(
g)
2,4-D + Kinetin 2,4-D
Gambar 1 Bobot kalus pada perlakuan berbagai ZPT (n = 50).
yang terlepas ke media sedikit sehingga memperlama waktu pembentukan suspensi sel.
Pada media MS organik minimal dengan 2 g/L Bacto Tryptone dan 3 ppm 2,4-D dan 0.1 ppm kinetin (pH 5.8), kultur suspensi sel mencapai volume sel 10% PCV setelah 12 hari (Gambar 3). Konsentrasi sel yang digunakan untuk penelitian ini mengacu kepada Legendre et al. (1992).
(a) (b)
Gambar 2 Kalus yang terbentuk pada media (a) MS+1 ppm 2,4-D ( = 50 mm) dan (b) MS+1 ppm 2,4-D+0.1 ppm Kinetin ( = 50 mm).
0 2 4 6 8 10 12 14
0 2 4 6 8 10 12 14
Hari
ke-% P
C
V
Deteksi dan Kuantifikasi H2O2 pada Kultur
Suspensi Sel
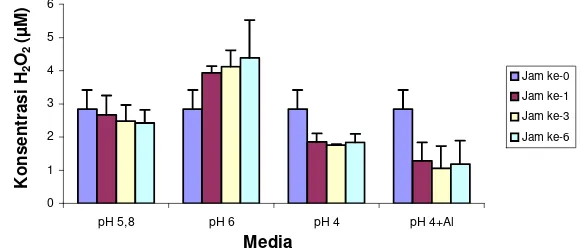
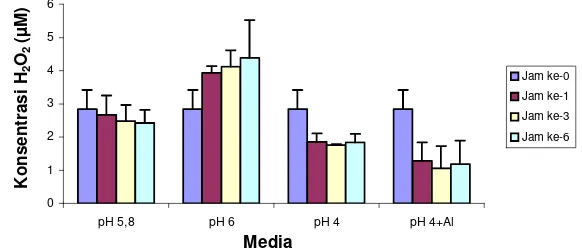
Pengukuran dilakukan pertama kali dengan kondisi praperlakuan inkubasi 16 jam tanpa agitasi dalam gelap, pada semua perlakuan pH media, yaitu pH 5.8 (pH media pemeliharaan), pH 6, pH 4 dan pH 4+ Al3+ 1.2 mM untuk melihat respon sel.
Pada media dengan pH 5.8, yang merupakan pH untuk media pemeliharaan kultur sel, tidak teramati perubahan drastis pada produksi H2O2 dari jam ke jam setelah
penggantian media. Media dengan pH 6 menyebabkan fluktuasi terhadap produksi
H2O2 dimana tingkat produksinya menurun
dari jam ke 1 hingga jam ke 3, kemudian meningkat sampai jam ke 6. Pada media dengan pH 4 dan pH 4+Al3+ secara umum terlihat memiliki kemiripan pola tingkat produksi H2O2, dimana terjadi penurunan
produksi H2O2 pada jam ke 1 setelah
peng-gantian media dengan media perlakuan. Pola tersebut diikuti dengan kenaikan tingkat produksi H2O2 pada jam ke 3 dan ke 6.
Tingkat produksi H2O2 pada perlakuan media
ber-pH 4 lebih tinggi dibandingkan dengan perlakuan pH 4+Al3+ (Gambar 4).
0 1 2 3 4 5 6
pH 5,8 pH 6 pH 4 pH 4+Al Media
K
o
n
sen
trasi H
2
O2
(µ
M)
Jam ke-0
Jam ke-1
Jam ke-3
Jam ke-6
Gambar 4 Produksi H2O2 pada berbagai pH media tanpa agitasi (n=3).
0 1 2 3 4 5 6
pH 5,8 pH 6 pH 4 pH 4+Al
Media
K
o
n
sen
trasi H
2
O2
(µ
M)
Jam ke-0
Jam ke-1
Jam ke-3
Jam ke-6
Gambar 5 Produksi H2O2 pada berbagai pH media dengan perlakuan agitasi selama 16 jam
(n=3).
Pengamatan kemudian dilakukan pada kultur suspensi sel yang diberi praperlakuan agitasi selama 16 jam guna memberikan induksi H2O2 endogen pada sel kedelai.
Pada perlakuan inkubasi dengan praper-lakuan agitasi selama 16 jam, produksi H2O2
pada pH 5.8 cenderung konstan dari jam ke jam, dan pada pH 6 menunjukkan kecen-derungan kenaikan, maka hal sebaliknya justru teramati pada perlakuan pH 4 dan pH 4+Al3+. Pada kedua perlakuan tersebut, ter-amati adanya penurunan tingkat produksi H2O2 dari jam ke 1, untuk kemudian konstan
hingga jam ke 6. Tetapi tingkat produksi H2O2
pada perlakuan pH 4+Al3+ lebih rendah dibandingkan dengan pH 4 (Gambar 5). Perlakuan pH 4 dan pH 4+Al3+ pada inkubasi dengan praperlakuan agitasi maupun tidak terlihat cenderung menekan produksi H2O2,
dan produksi H2O2 pada pH 4+Al 3+
lebih rendah dari pH 4.
Oleh karena itu untuk melihat keter-libatan protein heterotrimerik Gα dalam regu-lasi produksi H2O2 karena cekaman Al
3+
dila-kukan pada media dengan pH 4 dan pH 4+Al3+ dengan agitasi selama 16 jam.
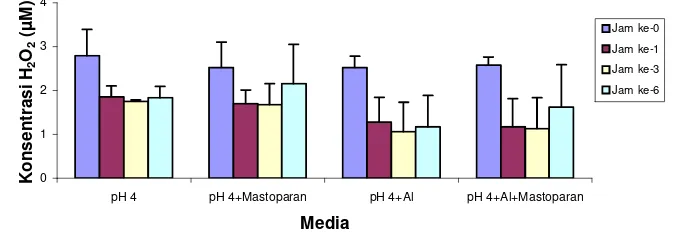
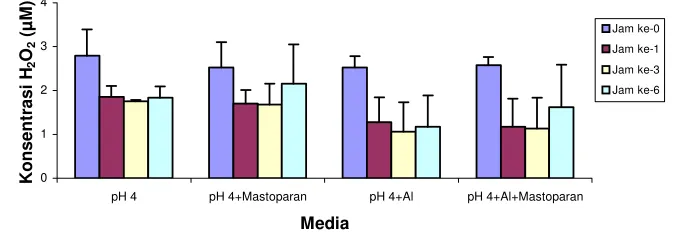
Dengan pemberian mastoparan, didapati adanya kesamaan pola produksi H2O2 antara
perlakuan pH 4 dan pH 4+Al3+, juga terlihat bahwa pemberian mastoparan tidak mengubah pola produksi H2O2 pada perlakuan pH 4 dan
pH 4+Al3+ pada jam ke 1 dan ke 3, dimana
tingkat produksi H2O2 relatif sama dengan
kontrol (tanpa mastoparan). Pada jam ke enam baru dijumpai adanya lonjakan produksi H2O2,
yang berbeda dengan yang teramati pada kontrol (Gambar 6).
0 1 2 3 4
pH 4 pH 4+Mastoparan pH 4+Al pH 4+Al+Mastoparan
Media
K
onsentrasi H
2
O2
(µ
M)
Jam ke-0
Jam ke-1
Jam ke-3
Jam ke-6
Gambar 6 Produksi H2O2 pada media kontrol dan mastoparan 30 µM dengan perlakuan agitasi
selama 16 jam (n=2). Pengukuran Jumlah Sel Mati
Pewarnaan Evans blue adalah pewarnaan selektif guna mengidentifikasi sel yang telah mati. Sel yang mati akan berwarna biru, sedangkan sel yang hidup akan bewarna jernih (Gambar 7). Pengukuran terhadap jumlah sel yang mati dilakukan pada awal perlakuan (jam ke 0) dan setelah jam ke 6. Pada kontrol terlihat tidak terjadi peningkatan kematian sel yang signifikan, meskipun setelah 6 jam perlakuan tingkat kematian pada media pH 4+Al3+ lebih tinggi dibandingkan dengan media pH 4 (Gambar 8). Tetapi perlakuan pemberian 30 µM mastoparan menyebabkan peningkatan kematian sel yang signifikan pada jam ke 6 dibandingkan dengan kontrol (tanpa mastoparan). Namun tingkat kematian
sel pada media pH 4 lebih tinggi dibandingkan dengan media pH 4+Al3+ (Gambar 8).
Gambar 7 Sel yang telah diwarnai dengan 0,04 % Evans blue, (A) sel hidup, (B) sel mati
( = 50 µm).
0 0,1 0,2 0,3 0,4 0,5
pH 4 pH 4+Mastoparan pH 4+Al pH 4+Al+Mastoparan
Media
Intensitas kematian sel (A
bsorbansi = 595 nm)
Jam ke-0
Jam ke-6
Gambar 8 Tingkat kematian sel pada perlakuan kontrol dan mastoparan (n=2).
Pembahasan Induksi Kalus
Pada penelitian ini kombinasi media MS dengan ZPT 1 ppm 2,4-D+0.1 ppm kinetin pada media inisiasi kalus mendapatkan kalus yang tidak hanya tumbuh cepat namun memi-liki karakteristik yang sesuai untuk kultur sel suspensi, yaitu kalus yang lebih remah ( friab-le) dibandingkan dengan perlakuan hanya de-ngan 1 ppm 2,4-D. Pemberian kombinasi ki-netin (kelompok sitokinin) dan 2,4-D (ke-lompok auksin) mampu meningkatkan pem-bentukan kalus.
Hal ini sesuai dengan Moore (1979) yang menyatakan bahwa kombinasi yang sesuai antara kedua ZPT tersebut dibutuhkan guna mendapatkan kalus yang remah. Bhojwani & Razdan (1996) menyatakan bahwa diferen-siasi akar dan tajuk lebih dipengaruhi oleh interaksi kuantitatif antara auksin dan sito-kinin, sehingga jika rasio antara kedua ZPT tersebut condong lebih tinggi ke salah satu zat akan memicu induksi akar atau tajuk. Namun jika rasio antar keduanya seimbang, maka yang terinduksi adalah kalus dengan sifat yang remah.
Auksin merupakan kelompok hormon yang menginduksi pembelahan dan peman-jangan sel, sedangkan sitokinin berperan da-lam merangsang pembelahan sel (Moore 1979). Interaksi diantara keduanya pada rasio yang sesuai menyebabkan pembelahan sel yang ekstensif. Efek pelemahan dinding sel oleh auksin, akan mempermudah dalam proses sitokinesis serta sintesis dinding sel. Karena dinding sel selalu dalam keadaan lemah, diduga hal inilah yang menimbulkan struktur kalus yang remah.
Kalus yang remah (friable) lebih sesuai untuk digunakan dalam pembuatan kultur suspensi sel (Bhojwani & Razdan 1996) dika-renakan sel-sel pada kalus tersebut tersusun longgar sehingga dengan agitasi rendah pada medium cair akan menyebabkan sel-sel ter-sebut terlepas satu sama lain dan membentuk agregat-agregat (mikrokoloni) sel yang lebih kecil. Dengan agitasi yang kontinyu diha-rapkan ukuran agregat tersebut akan menjadi lebih kecil sehingga membentuk suspensi sel yang lebih homogen.
Inisiasi dan Pemeliharaan Kultur Suspensi Sel Kedelai
Kultur suspensi sel dipelihara pada me-dium cair dengan konsentrasi 2,4-D yang le-bih tinggi, sebesar 3 ppm, dibandingkan dengan media induksi kalus. Peningkatan kon-sentrasi auksin ini semakin memperbesar rasio auksin/sitokinin, dan pada kultur suspensi sel menginduksi pembelahan sel yang cepat.
Auksin diketahui mampu menginduksi pem-belahan dan pemanjangan sel, ditambah dengan adanya sitokinin pada media semakin memperkuat induksi terhadap pembelahan sel yang cepat
Selain itu, penambahan sumber asam amino kompleks pada media (Bhojwani & Razdan 1996), telah diketahui mampu meng-induksi dispersi sel-sel pada kultur suspensi sel. Sumber asam amino kompleks yang digu-nakan adalah Bacto Tryptone. Faktor lain yang turut berperan adalah perlakuan agitasi dengan kecepatan yang sesuai, sehingga me-mungkinkan dispersi sel untuk mencapai kul-tur suspensi sel yang berukuran cukup halus.
Dari kurva tumbuh kultur suspensi sel kedelai yang dibuat, terlihat bahwa konsen-trasi sel yang dibutuhkan untuk penelitian ini, mengacu pada Legendre et al. (1992), tercapai pada hari ke 12 setelah subkultur (Gambar 3) Deteksi dan Kuantifikasi H2O2 pada Kultur
Suspensi Sel
Pengukuran produksi H2O2 pada kultur
setelah praperlakuan 16 jam inkubasi tanpa agitasi (Gambar 4) dan dengan praperlakuan agitasi selama 16 jam (Gambar 5) menun-jukkan adanya perubahan drastis pada tingkat produksi H2O2 dari perlakuan media ber-pH 6,
pH 4 dan pH 4+Al3+, lebih disebabkan oleh perubahan nilai pH media, bukan dikarenakan tindakan subkultur. Hal ini ditunjukkan oleh tingkat produksi H2O2 pada medium ber-pH
5.8 pada kedua praperlakuan yang cenderung konstan dari jam ke jam (Gambar 4 dan 5).
Perubahan tingkat produksi H2O2 pada
praperlakuan tanpa agitasi dan dengan pra-perlakuan agitasi selama 16 jam pada pH 6 tampak bertolak belakang. Pada praperlakuan tanpa agitasi pola produksi H2O2 menurun
drastis dari jam ke 0 hingga jam ke 1, untuk seterusnya sama hingga jam ke 3, dan disusul kenaikan pada jam ke 6 (Gambar 4), sedang-kan dengan praperlakuan agitasi, pola pro-duksi yang dijumpai adalah kenaikan mulai dari jam ke 0 hingga jam ke 6 (Gambar 5). Hal lain yang teramati selain perbedaan pola produksi H2O2 adalah tingkat konsentrasi pada
jam ke 0 pada praperlakuan agitasi lebih ting-gi dibandingkan dengan praperlakuan tanpa agitasi (Gambar 4 dan 5).
Namun bila kita membandingkan pola produksi H2O2 antara praperlakuan tanpa
agi-tasi (Gambar 4) dan dengan agiagi-tasi (Gambar 5) hanya pada perlakuan pH 4 dan pH 4+Al3+, terlihat bahwa pola produksi H2O2 antara
mulai dari jam ke 1 dan konstan sampai jam ke 6, dengan tingkat produksi pada perlakuan pH 4 lebih tinggi dibandingkan tingkat pro-duksi pada perlakuan pH 4+Al3+ (Gambar 5). Perbedaan yang mencolok adalah bahwa agitasi menyebabkan tingkat produksi H2O2
lebih tinggi pada tiap jam perlakuan diban-dingkan tanpa agitasi.
Agitasi merupakan salah satu faktor yang turut memicu produksi H2O2 pada kultur
suspensi sel (Legendre et al. 1993a). Praper-lakuan sel dengan agitasi selama 16 jam akan meningkatkan konsentrasi H2O2 pada media
pada jam ke 0 sebagaimana terlihat pada Gambar 5.
Tingginya konsentrasi H2O2 di media
akibat praperlakuan agitasi menginduksi sel dan menyebabkan perubahan tingkat produksi H2O2 oleh sel. Pada perlakuan media ber-pH
6, kenaikan nilai pH media dari pH 5.8, meng-akibatkan sel meningkatkan produksi H2O2
mulai dari jam ke 1 hingga jam ke 6. Pada media ber-pH 4, penurunan nilai pH media menyebabkan penurunan tingkat produksi H2O2 mulai dari jam ke 1 hingga jam ke 6.
Pada media pH 4+ Al3+, sel mendapat ceka-man tidak hanya penurunan nilai pH, namun juga keberadaan Al3+ pada media. Sel yang diberi perlakuan tersebut meresponnya dengan menekan tingkat produksi H2O2 sehingga
lebih rendah dibandingkan dengan perlakuan pH 4 (Gambar 5).
Menurut Jones & Kochian (1995) H2O2
merupakan senyawa yang mampu meng-induksi peningkatan kerja enzim Fosfolipase C (PLC). PLC sendiri merupakan protein yang berperan dalam transduksi sinyal dengan me-mecah fosfolipid menjadi DAG (Diasilgli-serol) dan IP3 (Inositol 1,4,5-trifosfat).
Menu-rut Legendre et al. (1993b), IP3 berperan
da-lam peningkatan produksi H2O2 pada kultur
suspensi sel kedelai.
Salah satu efek toksisitas Al3+ yang telah dipelajari adalah efek penghambatannya ter-hadap Fosfolipase C (PLC) (Jones & Kochian 1995). Penghambatan tersebut tetap teramati bahkan bila PLC diinduksi dengan H2O2. Pada
percobaan ini, induksi H2O2 diberikan secara
endogen melalui praperlakuan agitasi. Diduga bahwa melalui penghambatan Al3+ terhadap aktivitas PLC ini, perlakuan pH 4 dan pH 4+Al3+ menurunkan tingkat produksi H2O2.
Pada perlakuan pH 6 hal yang sebaliknya justru terjadi, dimana PLC yang terinduksi oleh keberadaan H2O2 semakin meningkatkan
produksi H2O2.
Langkah selanjutnya yang harus dila-kukan adalah pengukuran terhadap aktivitas
PLC dan kandungan IP3 intraseluler untuk
melihat apakah benar penurunan atau kenaik-an produksi H2O2 pada perlakuan tersebut
disebabkan oleh penurunan atau peningkatan aktivitas PLC dan konsentrasi IP3.
Perlakuan dengan penambahan mastopa-ran, suatu aktivator spesifik untuk protein heterotrimerik G subunit α (Pingret et al. 1998), tidak menimbulkan perbedaan yang nyata antara perlakuan pH 4 tanpa mastoparan (kontrol) dengan perlakuan pH 4+mastoparan pada jam ke 1 dan jam ke 3 setelah perlakuan. Namun pada jam ke 6 teramati adanya kenaik-an produksi H2O2 pada perlakuan dengan
mastoparan (Gambar 6) dibandingkan dengan kontrol. Hal yang sama juga teramati bila kita membandingkan antara perlakuan pH 4+Al3+ tanpa mastoparan (kontrol) dengan perlakuan pH 4+Al3++mastoparan, dimana teramati adanya kenaikan produksi pada jam ke 6 setelah perlakuan (Gambar 6).
Protein heterotrimerik Gα bertindak se-bagai saklar dalam proses transduksi sinyal. Pada keadaan inaktif, protein G tersusun dari 3 subunit yaitu α, , dan , dengan subunit α mengikat GDP. Ketika teraktivasi oleh ligan yang terikat pada reseptor, protein G akan ter-disosiasi menjadi 2 bagian, yaitu subunit α yang akan melepaskan GDP dan mengikat GTP, dan subunit . Subunit α akan ber-asosiasi dengan efektor untuk meneruskan sinyal yang diterima, dalam prosesnya meng-hidrolisis GTP menjadi GDP, dan kembali bergabung dengan subunit . Mastoparan akan menginduksi protein G subunit α untuk melepaskan GDP dan mengikat GTP, serta mencegah subunit α untuk bergabung kembali dengan subunit (Higashijima et al. 1990). Hal ini mengakibatkan protein G yang telah menerima sinyal selalu berada dalam keadaan aktif, demikian pula dengan efektor yang ber-asosiasi dengan subunit α, mengakibatkan respon terhadap sinyal terus menerus berlang-sung.
Pola represi produksi H2O2 pada 3 jam
pertama setelah pemberian cekaman diduga tidak melibatkan protein Gα, ditunjukkan dengan tidak terlihatnya perubahan terhadap pola produksi pada perlakuan yang diberi mastoparan dengan kontrol (Gambar 6). Pola yang teramati pada 3 jam pertama setelah cekaman juga tidak berbeda dengan pola yang teramati pada pengukuran awal dengan pra-perlakuan agitasi (Gambar 5) pada jam penga-matan yang sama. Kenaikan produksi H2O2
4+Al3+. Hal ini mengindikasikan bahwa protein Gα terlibat dalam transduksi sinyal dari kedua cekaman tersebut mulai jam ke 6 setelah perlakuan.
Mashuda (2006) dan Suharsono & Suharsono (2006) telah melakukan pengamat-an terhadap pola ekspresi gen protein Gα pada kedelai yang mendapat cekaman pH 4 dan pH 4+1.6 mM Al3+ dengan interval waktu pengamatan 0, 8, 24, 48, dan 72 jam setelah perlakuan. Pola ekspresi gen protein Gα yang teramati pada perlakuan pH 4 menunjukkan tingkat ekspresi gen tertinggi pada jam ke 8, dan cenderung menurun setelahnya hingga jam ke 72. Pola ekspresi pada perlakuan pH 4+1.6 mM Al3+ juga menunjukkan tingkat ekspresi gen tertinggi pada jam ke 8, untuk kemudian stabil sampai dengan jam ke 48, dan menurun hingga jam ke 72 (Mashuda 2006). Tingkat ekspresi gen Gα lebih tinggi pada perlakuan pH 4+Al3+ dibandingkan dengan tingkat ekspresi pada perlakuan pH 4.
Namun pada penelitian tersebut tidak dilakukan pengamatan terhadap ekspresi gen Gα antara jam ke 0 sampai jam ke 8. Sesuai dengan hasil penelitian ini, timbul dugaan bahwa ekspresi gen Gα pada cekaman pH 4 dan pH 4+Al3+ mulai meningkat setelah 3 jam sejak pemberian cekaman, ditunjukkan dengan adanya kenaikan produksi H2O2 pada
jam ke 6.
Hal ini didukung dengan hasil penga-matan terhadap tingkat produksi H2O2 pada
perlakuan pH 4 dan pH 4+Al3+ dengan penambahan mastoparan yang dilakukan pada 0, 1, 3, 6, dan 8 jam setelah perlakuan (data tidak dipublikasikan). Pola produksi pada jam ke 0 hingga jam ke 6 tidak berbeda dengan pola yang teramati pada gambar 6 untuk perla-kuan pH 4 dan pH 4+Al3+. Namun pada jam ke 8 dijumpai kenaikan produksi H2O2 yang
sangat besar pada kontrol pH 4+Al3+,
sedang-kan pada kontrol pH 4 tingkat produksinya sama dengan jam ke 6. Penambahan mastopa-ran meningkatkan produksi H2O2 pada jam ke
8 pada perlakuan pH 4, namun dengan tingkat produksi H2O2 lebih rendah dibandingkan
tingkat produksi H2O2 pada perlakuan pH
4+Al3+.
Pengukuran terhadap tingkat produksi H2O2 pada perlakuan cekaman pH 4 dan pH
4+ Al3+ yang diberi penghambat protein Gα akan sangat menunjang dalam meneliti peranan protein heterotrimerik Gα dalam proses transduksi sinyal dari cekaman pH rendah dan Al3+.
Sebagaimana kita ketahui membran plas-ma tidak permeabel terhadap
senyawa-senyawa polar dan ion, namun permeabel ter-hadap senyawa-senyawa non polar. Karena Al3+ adalah ion maka Al3+ tidak dapat menem-bus membran dengan mudah. Oleh karena itu sinyal keberadaan Al3+ hanya dapat diterima oleh reseptor yang berada di membran. Secara umum terdapat tiga jenis reseptor yang terle-tak di membran. Reseptor ini berperan dalam transduksi sinyal terhadap ligan yang tidak mampu menembus fosfolipid. Ketiga reseptor tersebut antara lain reseptor terkait protein G, reseptor terkait enzim, dan reseptor terkait kanal ion (Trewavas 2000).
Jika dugaan bahwa transduksi sinyal pada awal cekaman, yaitu 3 jam pertama tidak melibatkan protein Gα benar, maka transduksi sinyal cekaman pH rendah (pH 4) dan cekaman Al3+ (pH 4+Al3+) mungkin melalui salah satu diantara kedua reseptor selain protein G, sebagaimana disebutkan di atas.
Kawano et al. (2004) mendapati bahwa cekaman Al3+ dengan konsentrasi yang tinggi menyebabkan penghambatan terhadap kanal ion Ca2+, sedangkan pada konsentrasi Al3+
yang rendah dijumpai adanya peningkatan aktivitas kanal ion Ca2+. Kanal ion Ca2+ ber-fungsi untuk melewatkan ion Ca2+ dari luar membran plasma ke sitosol atau dari tempat penyimpanan Ca2+ intraseluler ke sitosol. Peningkatan konsentrasi ion Ca2+ di sitosol dapat menyebabkan kenaikan produksi ROS (Reactive Oxygen Species), salah satunya adalah H2O2, dan peningkatan konsentrasi
H2O2 dapat menyebabkan peningkatan
kon-sentrasi ion Ca2+ di sitosol (Mahalingam & Fedoroff 2003). Hal yang sebaliknya terjadi bila terjadi penurunan drastis konsentrasi Ca2+ di sitosol akan menyebabkan penurunan ting-kat produksi H2O2 pada sel.
Karena konsentrasi Al3+ yang digunakan dalam percobaan ini cukup tinggi, mencapai 1.2 mM, diduga bahwa transduksi sinyal untuk cekaman Al3+ mungkin melibatkan suatu reseptor terkait kanal ion Ca2+. Reseptor terkait kanal ion Ca2+ ini pada kondisi pH rendah dan atau keberadaan Al3+ akan
meng-hambat aliran ion Ca2+, mengakibatkan penu-runan konsentrasi Ca2+ pada sitosol, dan ber-ujung pada penurunan tingkat produksi H2O2,
sebagaimana yang teramati pada 3 jam per-tama setelah perlakuan.
Pengukuran Jumlah Sel Mati
sel yang tidak terlalu signifikan setelah 6 jam cekaman. Ini menunjukkan bahwa keberadaan Al3+ pada media menjadi penyebab peningkat-an kematipeningkat-an sel lebih besar setelah 6 jam (Gambar 8).
Jika dibandingkan dengan kontrol pH 4 dan pH 4+Al3+ (Gambar 8) terlihat bahwa penambahan mastoparan memacu peningkatan kematian sel setelah 6 jam (Gambar 8). Pemberian mastoparan menyebabkan terjadi-nya peningkatan produksi H2O2 6 jam setelah
cekaman, sehingga diduga bahwa peningkatan inilah yang memicu kematian sel setelah 6 jam perlakuan. Namun tingkat kematian sel pada cekaman Al3+ lebih rendah dibandingkan
dengan pH 4 (Gambar 8), seiring dengan tingkat produksi H2O2 yang lebih rendah pada
cekamanAl3+ (Gambar 6).
Respon awal sel terhadap cekaman pH rendah dan Al3+ berupa represi produksi H2O2.
Diduga ini merupakan mekanisme awal perta-hanan terhadap cekaman pH rendah dan Al3+ guna mencegah tingkat kematian sel yang tinggi akibat efek sitotoksik dari H2O2.
Peningkatan produksi H2O2 secara drastis
yang dimediasi oleh protein Gα baru terlihat setelah jam ke 3 setelah cekaman (Gambar 6), dikenal dengan sebutan semburan oksidatif (oxidative burst).
SIMPULAN
Protein heterotrimerik Gα tidak terlibat dalam transduksi sinyal cekaman Al3+ pada 3 jam pertama setelah perlakuan. Protein hete-rotrimerik Gα terlibat dalam transduksi sinyal cekaman Al3+ setelah lewat 3 jam sejak
pem-berian cekaman dengan meningkatkan pro-duksi H2O2. Transduksi sinyal terhadap
ceka-man pada 3 jam pertama setelah cekaceka-man melibatkan jalur transduksi lain selain jalur transduksi yang dimediasi oleh protein hete-rotrimerik Gα. Represi produksi H2O2 pada
awal cekaman diperlukan untuk mencegah kematian sel.
SARAN
Perlu dilakukan pengukuran aktivitas Fospolipase C (PLC) dan kandungan IP3
intra-seluler pada kultivar kedelai yang toleran dan peka terhadap cekaman Aluminium yang mendapat cekaman Al3+ untuk lebih mema-hami peranan enzim Fospolipase C dalam proses transduksi sinyal cekaman Al3+.
Pengamatan terhadap pola produksi H2O2 dengan pemberian penghambat protein
heterotrimerik Gα pada kedelai kultivar Slamet, serta pengamatan pola produksi H2O2
pada kultivar kedelai yang peka terhadap Al3+
perlu dilakukan guna mengamati lebih lanjut peranan protein heterotrimerik Gα terhadap cekaman Al3+.
Analisis ekspresi gen Gα dan gen-gen lain terkait cekaman pada awal cekaman juga perlu dilakukan pada interval waktu di bawah 8 jam untuk lebih memahami mekanisme molekuler yang mendasari sifat ketahanan terhadap Al3+ pada kultivar kedelai yang toleran dan peka terhadap Al3+.
DAFTAR PUSTAKA
Anwar S. 1999. Pengklonan gen-gen yang diinduksi oleh cekaman aluminium pada kedelai [Glycine max (L.) Merryl] [disertasi]. Bogor: Sekolah Pasca sarjana, Institut Pertanian Bogor. Assman SM. 2002. Heterotrimeric and
uncon-ventional GTP binding protein in plant cell signalling. Plant Cell Supl:S355-S373.
[BPS] Badan Pusat Statistik. 2006. Harvested area, yield rate and production of soy-bean by province, 2006. Jakarta : BPS. Bhojwani SS, Razdan MK. 1996. Plant Tissue
Culture: Theory and Practice, a Revi-sed Edition. Amsterdam : Elsevier. Cote GG, Crain RC. 1993. Biochemistry of
phosphoinisitides. Annu Rev Plant Physiol Mol Biol 44:333-356.
Da Silva ALC, Caruso CS, Moreira RDA, Horta ACG. 2003. In vitro induction of callus from cotyledon and hypocotyls explant of Glycine wightii (Wight & Arn.) Verdc. Ciênc Agrotec 27:1277-1284.
Gardner RC. 1998. Manipulation of Alumi-num tolerance by gene transfer [review]. Hayati 5:29-33.
Gotor C, Lam E, Cejudo FJ, Romero LC. 1996. Isolation and analysis of the soybean SGA2 gene (cDNA), encoding a new member of the plant G-protein family of signal transducers. Plant Mol Biol 32:1227-1234.
He Z, Wang ZY, Li J, Zhu Q, Lamb C, Ronald P, Chory J. 2000. Perception of brassinosteroids by the extracellular domain of the receptor kinase BR1. Science 288:2360-2363.
mastopa-ran, related amphiphilic peptides and hydrophobic amines: mechanism and structural determinants of activity. J Biol Chem 265:14176-14186.
Jones DL, Kochian LV. 1995. Aluminum inhibition of the lnositol 1,4,5-Tris-phosphate signal transduction pathway in wheat roots: a role in aIuminum toxicity ? Plant Cell 7:1913-1922 Kawano T, Kadono T, Fumoto K, Lapeyrie F,
Kuse M, Isobe M, Furuichi T, Muto S. 2004. Aluminum as a specific inhibitor of plant TPC1 Ca2+ channels. Biochem Biophys Res Comm 324:40-45.
Kochian LV. 1995. Cellular mechanism of aluminum toxicity and resistance in plants. Annu Rev Plant Physiol Mol Biol 46:237-260.
Krauss G. 2001. Biochemistry of Signal Transduction and Regulation. Wienheim:Wiley-VCH.
Legendre L, Heinstein PF, Low PS. 1992. Evidence for participation of GTP-binding proteins in elicitation of the rapid oxidative burst in cultured soybean cells. J Biol Chem 267:20140-20147.
Legendre L, Rueter S, Heinstein PF, Low PS. 1993a. Characterization of the oligo-galacturonide-induced oxidative burst in cultured soybean (Glycine max) cells. Plant Physiol 102:233-240. Legendre L, Yueh YG, Crain R, Haddock N,
Heinstein PF, Low PS. 1993b. Phospo-lipase C activation during elicitation of the oxidative burst in cultured plant cells. J Biol Chem 268:24559-24563. Liu ZH, Wang WC, Yan SY. 1997. Effect of
hormone treatment on callus formation and endogenous indoleacetic acid and polyamine contents of soybean hypo-cotyls cultivated in vitro. Bot Bull Acad Sin 38:171-176.
Ma H. 1994. GTP-binding proteins in plants: New member of and old family. Plant Mol Biol 26:1611-1636.
Mahalingam R, Fedoroff N. 2003. Stress response, cell death and signalling: the many faces of reactive oxygen species [review]. Physiol Plant 119:56-68.
Mashuda. 2006. Ekspresi gen Gα dan GST pada kedelai kultivar slamet yang mendapat cekaman Aluminium [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Moore TC. 1979. Biochemistry and Physio-logy of Plant Hormones. New York: Springer-Verlag.
Neer EJ. 1995. Heterotrimeric G protein: Organizers of transmembrane signals [review]. Cell 80:249-257.
Pingret JL, Journet EP, Barker DG. 1998. Rhizobium Nod factor signaling: Evi-dence for a G protein-mediated trans-duction mechanism. Plant Cell 10:659-671.
Suharsono U. 2002a. Role of heterotrimeric G protein in defense response of rice [disertasi]. Nara: Graduate School of Bioscience, Nara Institute of Science and Technology, Japan.
Suharsono U, Fujisawa Y, Kawasaki T, Iwasaki Y, Satoh H, Shimamoto K . 2002b. The heterotrimeric G protein α subunit acts upstream of the small GTPase Rac in disease resistance of rice. Proc Natl Acad Sci USA 99:13307-13312.
Suharsono UW, Suharsono. 2006. Analisis gen penyandi protein heterotrimerik G subunit α yang terlibat dalam sistem toleransi tanaman kedelai terhadap cekaman Aluminium. Laporan akhir Hibah Bersaing XII. Institut Pertanian Bogor.
Trewavas A. 2000. Signal Perception and Transduction. Di dalam: Buchanan B, Gruissem W, Jones R, editor. Bio-chemistry and Molecular Biology of Plants. New Jersey: John Wiley & Sons. hlm 930-987.
Lampiran 1 Komposisi media yang digunakan
Konsentrasi
(miligram/L)
Bahan
MS + vitamin B5 MS + Bacto-tryptoneTM
Hara makro NH4NO3 1 650 1 650
CaCl2.2H2O 332.2 332.2
MgSO4.7H2O 180.7 180.7
KNO3 1 900 1 900
KH2PO4 170 170
Hara mikro H3BO3 6.2 6.2
Na2MoO4 0.25 0.25
CoCl2.2H2O 0.025 0.025
KI 0.83 0.83
ZnSO4.7H2O 8.6 8.6
MnSO4.4H2O 22 22
CuSO4.5H2O 0.025 0.025
Na2EDTA 37.26 37.26
FeSO4.7H20 27.8 27.8
Bahan organik Tiamin HCl 10 0.4
Asam Nikotinat 1 --
Piridoksin 1 --
Myo Inositol 100 100
Bacto-tryptone™ -- 2 000
ZPT 2,4-D -- 3
Lampiran 2 Komposisi larutan penyangga
Xylenol Orange
FeSO4
(NH4)2SO4
H2SO4
Sorbitol
Xylenol Orange
0.25 mM
0.25 mM
25 mM
10 mM
125 µM
Lampiran 3 Kurva standar H2O2
0 0,1 0,2 0,3
0 2 4 6 8 10 12
Konsentrasi H2O2 (µM)
A
b
s
o
rb
an
si
(
5
60 n
m
)
y = 0.0237x-0.002 R2 = 0.99743951
PRODUKSI H2O2 PADA KEDELAI KULTIVAR SLAMET
Oleh :
Mohammad Bahrelfi Belafiff
G34101054
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Subunit terhadap Cekaman Al melalui Identifikasi Produksi H2O2 pada Kedelai Kultivar Slamet. Dibimbing oleh UTUT WIDYASTUTI SUHARSONO dan DIAH RATNADEWI.
Peranan protein heterotrimerik G subunit Į pada cekaman Al3+ diteliti dengan menggunakan kultur suspensi sel kedelai kultivar Slamet. Kalus yang sesuai untuk inisiasi kultur suspensi sel berhasil diinduksi secara in vitro pada media MS minimal dengan vitamin Gamborg B5 dan 1 ppm 2,4-D serta 0.1 ppm Kinetin. Kalus kemudian dipindahkan ke media cair MS minimal dengan 2 g/L Bacto Tryptone, 3 ppm 2,4-D dan 0.1 ppm Kinetin. Kultur suspensi sel didapatkan setelah 3-4 minggu inkubasi dalam gelap. Sel yang diperoleh dari kultur suspensi sel digunakan untuk percobaan.
Pada cekaman pH rendah (pH 4.0) dan Al3+ (1.2 mM) didapati represi produksi H2O2 mulai dari jam ke-1 sampai jam ke-6 pada kedua perlakuan. Pemberian Mastoparan (30 μM) tidak menunjukkan perbedaan tingkat produksi H2O2antara kontrol dengan kedua perlakuan pada jam ke-1 dan ke-3 setelah pemberian cekaman. Mastoparan menginduksi produksi H2O2 pada kedua perlakuan setelah lewat 3 jam sejak pemberian cekaman, dimana tingkat produksi H2O2 pada kultur suspensi sel kedelai lebih tinggi pada perlakuan pH rendah dibandingkan Al3+. Tingkat kematian sel pada jam ke 6 lebih tinggi pada pemberian Mastoparan dibandingkan kontrol, dengan tingkat kematian pada pH rendah lebih tinggi dibanding Al3+. Hasil menunjukkan bahwa protein heterotrimerik G tidak terlibat dalam transduksi sinyal Aluminium pada 3 jam pertama setelah perlakuan dengan Al3+. Represi produksi H2O2pada awal cekaman diperlukan untuk mencegah kematian sel. Produksi H2O2 meningkat setelah 3 jam perlakuan Aluminium (Al
3+
) dengan mastoparan.
ABSTRACT
MOHAMMAD BAHRELFI BELAFIFF. The Involvement of Heterotrimeric G Protein Į Subunit in Aluminum Toxicity of Soybean cv. Slamet Through the Identification of H2O2. Supervised by UTUT WIDYASTUTI SUHARSONO and DIAH RATNADEWI.
The role of Heterotrimeric G protein Į subunit in Al3+ toxicity was investigated using soybean cultivar Slamet cell suspension culture. Suitable callus for initiation of cell suspension culture was obtained in vitro using soybean seedlings hypocotyl on MS basal salt with Gamborg’s B5 vitamins supplemented with 1 ppm of 2,4-D, and 0.1 ppm Kinetin. Callus was then transferred to liquid medium of MS basal salt supplemented with 2 g/L of Bacto Tryptone, 3 ppm 2,4-D and 0.1 ppm Kinetin. Cell suspension culture was generated after 3-4 weeks incubation in dark. Cells obtained from cell suspension culture were used in the experiment.
Repression of H2O2 production rate was observed on both pH 4.0 and pH 4.0+Al3+ (1.2 mM) treatments started from the 1st to the 6th hour. Mastoparan (30 μM) application showed no significant difference of H2O2 production rate between control and both pH 4.0 and pH 4.0+Al
Protein G merupakan salah satu komponen yang berperan dalam transduksi sinyal pada makhluk hidup. GTP-binding regulatory protein atau protein G termasuk dalam famili protein pengikat guanosin trifosfat (GTP). Protein G sendiri terbagi menjadi 2 jenis yaitu protein heterotrimerik G, yang terletak di membran plasma, dan protein G kecil (small G protein ) yang terletak di sitoplasma. Beragam jenis transduksi sinyal pada mamalia telah diketahui melibatkan protein G khususnya protein heterotrimerik G (Ma 1994).
Protein heterotrimerik G terbagi menjadi 3 subunit, yaitu subunit α, dan . Protein ini aktif ketika mengikat dan menghidrolisis GTP yang diikatnya. Saat aktif protein ini akan meneruskan sinyal yang diterima reseptor ekstraseluler kepada efektor intraseluler pada sisi membran sel bagian dalam. Setelah GTP yang terikat dihidrolisis menjadi GDP, protein ini kembali ke konformasi semula dan menjadi tidak aktif (Krauss 2001). Protein heterotrimerik G, khususnya subunit α, telah diketahui terlibat dalam transduksi sinyal cekaman biotik, hormon dan lain sebagainya (Assman 2002)
Kedelai (Glycine max) merupakan salah satu produk pertanian dengan tingkat permintaan yang tinggi di dunia. Kandungan gizi yang tinggi, karena mengandung beberapa asam amino esensial, serta beragam kegunaan lain selain untuk dikonsumsi mengakibatkan melonjaknya permintaan akan kedelai. Beragam usaha telah dilakukan untuk meningkatkan produksi kedelai dunia, mulai dari cara intensifikasi dengan menggunakan teknik pertanian yang lebih baik, sampai dengan ekstensifikasi lahan oleh negara-negara pengeskpor kedelai terbesar dunia seperti Brazil dan Amerika (USDA 2007).
Produksi kedelai Indonesia belum mampu memenuhi kebutuhan dalam negeri sehingga masih perlu mendatangkan dari luar. Produksi kedelai Indonesia pada tahun 2006 baru mencapai 783 554ton per tahun (BPS 2006), sedangkan kebutuhan dalam negeri mencapai kurang lebih 2 juta ton, sehingga pada tahun 2006 Indonesia mengimpor kedelai sebesar kurang lebih 1 370 000 metrik ton (USDA 2007).
Oleh karena itu perlu diupayakan peningkatan produksi kedelai di Indonesia untuk menutupi kekurangan tersebut. Hal ini dapat dilakukan baik melalui intensifikasi
Di seluruh dunia, tanah dengan pH cukup rendah banyak dijumpai di daerah tropis. Kondisi tanah masam ini dijumpai pada kurang lebih 40% lahan yang dapat ditanami di seluruh dunia (Gardner 1998). Indonesia sebagai negara agraris memiliki 18,2 juta hektar lahan dengan tingkat pH rendah (Mashuda 2006) yang potensial untuk dikembangkan sebagai lahan pertanian, khususnya untuk kedelai.
Tantangan yang menghadang untuk ekstensifikasi adalah kondisi pH tanah yang rendah, yang akan meningkatkan kelarutan ion-ion logam di tanah. Tingginya kandungan ion-ion logam tertentu dalam tanah dapat bersifat toksik bagi tanaman. Salah satu ion tersebut adalah Aluminium (Al) dalam bentuk ion Al3+. Beberapa penelitian telah menun-jukkan bahwa pada tanah dengan kondisi masam, ion Al3+ yang terakumulasi meru-pakan faktor penyebab utama yang membatasi tingkat keberhasilan panen (Kochian 1995), karena ion Al3+ menghambat pertumbuhan akar, yang akan berakibat terhadap pertum-buhan tanaman (Gardner 1998).
Salah satu solusi terhadap permasalahan tersebut adalah penggunaan kultivar unggul yang tahan terhadap Al3+ tinggi. Usaha untuk menghasilkan kultivar unggul tersebut dapat dicapai dengan teknik pemuliaan konven-sional ataupun melalui perakitan genetik tanaman. Namun usaha untuk merakit tana-man yang memiliki sifat ketahanan terhadap Al3+ sebelumnya harus didahului oleh studi mengenai mekanisme pertahanan serta gen-gen yang terlibat dalam ketahanan terhadap Al3+. Oleh karena itu, usaha untuk memahami mekanisme yang terlibat dalam peristiwa toksisitas Al pada tanaman, khususnya pada kedelai merupakan langkah penting.
Cote dan Crain (1993) menunjukkan adanya penghambatan dari Al3+ terhadap pemecahan fosfoinositol menjadi IP3,
sehingga mempengaruhi regulasi kanal Ca2+ dan mengakibatkan perubahan kandungan Ca2+ intraseluler, yang berpengaruh terhadap fungsi seluler sel tumbuhan. Legendre et al. (1993) menegaskan bahwa aktivitas protein heterotrimerik Gα meningkatkan kandungan IP3 intraseluler, dan mendorong peningkatan
produksi H2O2 pada kultur sel kedelai. Hal ini
menunjukkan bahwa IP3 berperan dalam
regulasi produksi H2O2 (Legendre et al.
heterotrimerik G. Jika transduksi sinyal cekaman Al3+ pada tumbuhan melibatkan protein heterotrimerik G, maka produksi H2O2
pada sel tumbuhan dapat dijadikan indikator untuk melihat keterlibatan protein hetero-trimerik G dalam cekaman aluminium. Tujuan penelitian.
Tujuan penelitian ini adalah untuk menganalisis keterlibatan protein hetero-trimerik G subunit α pada mekanisme tole-ransi dari kultivar kedelai toleran asam (Slamet) terhadap cekaman Al3+ melalui identifikasi produksi H2O2.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan April 2005 sampai dengan Desember 2006, bertempat di Laboratorium Biologi Seluler dan Molekuler Tanaman dan Laboratorium Biorin (Biotechnology Research Indonesia-The Netherland), Pusat Penelitian Sumber-daya Hayati dan Bioteknologi (PPSHB) IPB, Jalan Kamper, Kampus IPB Darmaga.
BAHAN DAN METODE
Sterilisasi Eksplan
Biji kedelai Slamet dipilih yang berkulit mulus dan tidak cacat. Biji dicuci dengan air dan Tween-80 (0.5%) (v/v) dengan agitasi kuat, dan dibilas dengan air dua kali. Biji kemudian disterilisasi dengan alkohol 70% (v/v) selama 30 detik, setelah itu dibilas dengan akuades steril. Biji disterilisasi ulang dengan larutan Natrium Hipoklorit komersial 20% (v/v) (NaClO 5,25%) yang diberi Tween -80 (0.5%) (v/v), selama 15 menit dengan agitasi kuat, dilanjutkan pembilasan dengan akuades steril sebanyak tiga kali.
Induksi Kalus
Biji yang telah steril ditanam pada botol kultur berisi larutan mineral MS dan vitamin B5 (Liu et al. 1997) (Lampiran 1) dengan tambahan ZPT (Zat Pengatur Tumbuh) 2,4-D (2,4-Dichlorophenoxyacetic acid) dan Kinetin (6-Furfurylaminopurin) serta agar 8 g/L. ZPT diberikan dengan kombinasi sebagai berikut (Da Silva et al. 2003):
1. Medium MS 0 (Kontrol) 2. Medium MS+ 1 ppm 2,4-D
3. Medium MS+ 1 ppm 2,4-D+ 0.1 ppm Kinetin
4. Medium MS+ 0.1 ppm Kinetin. Di dalam tiap botol kultur ditanam 5 biji, ditumbuhkan pada suhu 24°C dengan
pencahayaan kontinyu dan intensitas cahaya ± 1 000 lux. Eksplan diamati pertumbuhannya selama 3 minggu hingga terbentuk kalus. Perlakuan diulang sebanyak sepuluh kali. Inisiasi dan Pemeliharaan Kultur Suspensi Sel Kedelai
Kultur berisi kalus dalam media peme-liharaan MS organik minimal dengan 2 g/L Bacto Tryptone (Becton, Dickinson & Co.) serta 3 ppm 2,4-D dan 0.1 ppm kinetin (pH 5.8) (Legendre et al. 1992) (Lampiran 1), kemudian diinkubasi pada inkubator ber-goyang resiprokal (bolak-balik) Certomat WR dengan kecepatan 70 rpm selama 3-4 minggu secara kontinyu, dalam keadaan gelap. Setelah 3-4 minggu sebanyak 20 sampai 30 mL suspensi sel dipindahkan ke dalam media cair baru dengan komposisi yang sama dan diinkubasi pada inkubator goyangan berputar Bench Top Shaker 4622 pada kecepatan 70 rpm secara kontinyu dengan intensitas cahaya 15 lux.
Kultur suspensi sel dipelihara selama penelitian, dengan subkultur ke media dengan komposisi yang sama setiap 7 hari sekali. Konsentrasi sel diukur setiap 2 hari sekali dengan metode PCV (Packed Cell Volume) yaitu dengan cara sebanyak 10 mL suspensi sel diendapkan dengan sentrifugasi Jouan BR4i (Jouan) pada kecepatan 200xg selama 5 menit pada suhu 15 ºC. Persentase PCV dihitung dengan rumus :
%
100
×
=
sampel
total
volume
mL
n
terendapka
yang
sel
mL
PCV
Kultur suspensi sel yang telah mencapai konsentrasi sel 10% PCV digunakan untuk penelitian dengan perlakuan cekaman pH dan Al3+.
Perlakuan Cekaman Berbagai Nilai pH dan Al3+
heterotrimerik G. Jika transduksi sinyal cekaman Al3+ pada tumbuhan melibatkan protein heterotrimerik G, maka produksi H2O2
pada sel tumbuhan dapat dijadikan indikator untuk melihat keterlibatan protein hetero-trimerik G dalam cekaman aluminium. Tujuan penelitian.
Tujuan penelitian ini adalah untuk menganalisis keterlibatan protein hetero-trimerik G subunit α pada mekanisme tole-ransi dari kultivar kedelai toleran asam (Slamet) terhadap cekaman Al3+ melalui identifikasi produksi H2O2.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan April 2005 sampai dengan Desember 2006, bertempat di Laboratorium Biologi Seluler dan Molekuler Tanaman dan Laboratorium Biorin (Biotechnology Research Indonesia-The Netherland), Pusat Penelitian Sumber-daya Hayati dan Bioteknologi (PPSHB) IPB, Jalan Kamper, Kampus IPB Darmaga.
BAHAN DAN METODE
Sterilisasi Eksplan
Biji kedelai Slamet dipilih yang berkulit mulus dan tidak cacat. Biji dicuci dengan air dan Tween-80 (0.5%) (v/v) dengan agitasi kuat, dan dibilas dengan air dua kali. Biji kemudian disterilisasi dengan alkohol 70% (v/v) selama 30 detik, setelah itu dibilas dengan akuades steril. Biji disterilisasi ulang dengan larutan Natrium Hipoklorit komersial 20% (v/v) (NaClO 5,25%) yang diberi Tween -80 (0.5%) (v/v), selama 15 menit dengan agitasi kuat, dilanjutkan pembilasan dengan akuades steril sebanyak tiga kali.
Induksi Kalus
Biji yang telah steril ditanam pada botol kultur berisi larutan mineral MS dan vitamin B5 (Liu et al. 1997) (Lampiran 1) dengan tambahan ZPT (Zat Pengatur Tumbuh) 2,4-D (2,4-Dichlorophenoxyacetic acid) dan Kinetin (6-Furfurylaminopurin) serta agar 8 g/L. ZPT diberikan dengan kombinasi sebagai berikut (Da Silva et al. 2003):
1. Medium MS 0 (Kontrol) 2. Medium MS+ 1 ppm 2,4-D
3. Medium MS+ 1 ppm 2,4-D+ 0.1 ppm Kinetin
4. Medium MS+ 0.1 ppm Kinetin. Di dalam tiap botol kultur ditanam 5 biji, ditumbuhkan pada suhu 24°C dengan
pencahayaan kontinyu dan intensitas cahaya ± 1 000 lux. Eksplan diamati pertumbuhannya selama 3 minggu hingga terbentuk kalus. Perlakuan diulang sebanyak sepuluh kali. Inisiasi dan Pemeliharaan Kultur Suspensi Sel Kedelai
Kultur berisi kalus dalam media peme-liharaan MS organik minimal dengan 2 g/L Bacto Tryptone (Becton, Dickinson & Co.) serta 3 ppm 2,4-D dan 0.1 ppm kinetin (pH 5.8) (Legendre et al. 1992) (Lampiran 1), kemudian diinkubasi pada inkubator ber-goyang resiprokal (bolak-balik) Certomat WR dengan kecepatan 70 rpm selama 3-4 minggu secara kontinyu, dalam keadaan gelap. Setelah 3-4 minggu sebanyak 20 sampai 30 mL suspensi sel dipindahkan ke dalam media cair baru dengan komposisi yang sama dan diinkubasi pada inkubator goyangan berputar Bench Top Shaker 4622 pada kecepatan 70 rpm secara kontinyu dengan intensitas cahaya 15 lux.
Kultur suspensi sel dipelihara selama penelitian, dengan subkultur ke media dengan komposisi yang sama setiap 7 hari sekali. Konsentrasi sel diukur setiap 2 hari sekali dengan metode PCV (Packed Cell Volume) yaitu dengan cara sebanyak 10 mL suspensi sel diendapkan dengan sentrifugasi Jouan BR4i (Jouan) pada kecepatan 200xg selama 5 menit pada suhu 15 ºC. Persentase PCV dihitung dengan rumus :
%
100
×
=
sampel
total
volume
mL
n
terendapka
yang
sel
mL
PCV
Kultur suspensi sel yang telah mencapai konsentrasi sel 10% PCV digunakan untuk penelitian dengan perlakuan cekaman pH dan Al3+.
Perlakuan Cekaman Berbagai Nilai pH dan Al3+
pada setiap cawan petri dan diinkubasi selama 16 jam pada suhu 25 °C dalam gelap. Setelah itu, media pada tiap cawan petri diganti dengan media perlakuan sebanyak 2 mL.
Perlakuan berupa cekaman pH yaitu pH 5.8 (pH media pemeliharaan), pH 6.0, pH 4.0 dan pH 4.0+ 1,2 mM Al3+. Cekaman Al3+
diberikan dalam bentuk AlCl3. Tepat sebelum
dilakukan penggantian media dengan media perlakuan, diambil sebanyak 100 µL media sebagai data jam ke 0. Selanjutnya penga-matan produksi H2O2 dilakukan pada jam ke
1, 3 dan 6 setelah penggantian media dengan media perlakuan. Pemberian cekaman Al3+ dengan konsentrasi 1,2 mM mengacu pada metode Anwar (1999) dan Mashuda (2006), yang menunjukkan bahwa antara perlakuan cekaman Al3+ pada konsentrasi 1,2 mM dan 1,6 mM tidak berbeda nyata.
Agitasi telah diketahui mampu meningkatkan produksi H2O2 pada kultur
suspensi sel kedelai (Legendre et al. 1993a). Oleh karena itu induksi H2O2 diberikan secara
endogen dengan praperlakuan agitasi selama 16 jam. Setelah inkubasi, dilakukan pengu-kuran dengan tahapan seperti disebutkan di atas. Tiap perlakuan diulang sebanyak tiga kali.
Perlakuan Cekaman Al3+ dengan Aktivator Protein G
Mastoparan merupakan aktivator spesifik protein heterotrimerik G subunit α. Pemberian mastoparan hanya dilakukan pada perlakuan cekaman pH 4.0 dan pH 4.0+1.2 mM Al3+. Konsentrasi Mastoparan-7 (Sigma-Aldrich) yang digunakan sebesar 30 µM. Sebagai kontrol adalah media perlakuan cekaman pH 4.0 dan pH 4.0+1.2 mM Al3+ tanpa penam-bahan mastoparan. Pada jam ke 0, 1, 3 dan 6 dilakukan pengukuran H2O2 dan jumlah sel
mati diukur pada jam ke 0 dan jam ke 6. Tiap perlakuan diulang sebanyak dua kali.
Deteksi dan Kuantifikasi H2O2 pada Kultur
Suspensi Sel.
Deteksi dan kuantifikasi terhadap kandungan H2O2 dilakukan menurut He et al.
(2000) dan Suharsono et al. (2002b). Sebanyak 100 µL cairan medium diambil pada jam ke 0, 1, 3, dan 6 pada tiap perlakuan. Cairan medium kemudian direaksikan dengan 1 mL larutan penyangga Xylenol Orange (Dojindo) (Lampiran 2) dan diinkubasi pada suhu ruang selama 2 jam. Sampel kemudian disentrifugasi pada 10 000 rpm selama 10 menit untuk mengendapkan sel-sel yang terbawa pada pengambilan sampel.
Absor-bansi diukur dengan spektrofotometer Cecil CE 2020 (Cecil Instrument Limited) pada λ 560 nm dengan menggunakan H2O2 sebagai
standar.
Pengukuran Jumlah Sel Mati
Pengukuran terhadap jumlah sel yang mati dilakukan menurut Suharsono (2002a). Sebanyak 200 µL suspensi sel dari tiap perlakuan diambil pada jam ke 0 sebelum penggantian media dan jam ke 6 setelah per-lakuan. Suspensi sel diendapkan dengan sentrifugasi pada kecepatan 2 500 rpm selama 5 menit. Supernatan kemudian dibuang dan endapan sel diberi 1 mL larutan Evans blue (Sigma-Aldrich) 0.04% (b/v) dalam air dan diinkubasi selama 10 menit pada suhu ruang.
Sel kemudian diendapkan pada kecepatan 2 500 rpm selama 5 menit, supernatan di-buang dan endapan sel dibilas dengan 1 mL larutan 100 µM CaCl2 (pH 5.6). Pembilasan
dilakukan sebanyak 5-6 kali untuk meng-hilangkan kelebihan zat pewarna Evans blue. Kemudian sel dicuci dengan 1 mL larutan 1% SDS (b/v) dalam metanol 50% (v/v) dan di-inkubasi selama 2 jam untuk mengeluarkan zat warna Evans blue dari dalam sel yang mati. Absorbansi dari zat pewarna Evans blue yang dilepaskan dari sel yang mati kemudian diukur dengan spektrofotometer pada λ 595 nm.
HASIL DAN PEMBAHASAN
Hasil
Induksi Kalus
Induksi terhadap kalus tidak dijumpai pada media kontrol (MS) dan media MS+0.1 ppm kinetin. Media perlakuan MS+1 ppm 2,4-D+0.1 ppm kinetin dengan MS+1 ppm 2,4-D tidak menunjukkan perbedaan nyata dalam bobot kalus (Gambar 1).
Kalus yang terbentuk pada media dengan kombinasi MS+1 ppm 2,4-D+0.1 ppm kinetin memberikan kalus yang lebih remah (friable) jika dibandingkan dengan media MS+1 ppm 2,4-D (Gambar 2).
Inisiasi dan Pemeliharaan Kultur Suspensi Sel Kedelai
pada setiap cawan petri dan diinkubasi selama 16 jam pada suhu 25 °C dalam gelap. Setelah itu, media pada tiap cawan petri diganti dengan media perlakuan sebanyak 2 mL.
Perlakuan berupa cekaman pH yaitu pH 5.8 (pH media pemeliharaan), pH 6.0, pH 4.0 dan pH 4.0+ 1,2 mM Al3+. Cekaman Al3+
diberikan dalam bentuk AlCl3. Tepat sebelum
dilakukan penggantian media dengan media perlakuan, diambil sebanyak 100 µL media sebagai data jam ke 0. Selanjutnya penga-matan produksi H2O2 dilakukan pada jam ke
1, 3 dan 6 setelah penggantian media dengan media perlakuan. Pemberian cekaman Al3+ dengan konsentrasi 1,2 mM mengacu pada metode Anwar (1999) dan Mashuda (2006), yang menunjukkan bahwa antara perlakuan cekaman Al3+ pada konsentrasi 1,2 mM dan 1,6 mM tidak berbeda nyata.
Agitasi telah diketahui mampu meningkatkan produksi H2O2 pada kultur
suspensi sel kedelai (Legendre et al. 1993a). Oleh karena itu induksi H2O2 diberikan secara
endogen dengan praperlakuan agitasi selama 16 jam. Setelah inkubasi, dilakukan pengu-kuran dengan tahapan seperti disebutkan di atas. Tiap perlakuan diulang sebanyak tiga kali.
Perlakuan Cekaman Al3+ dengan Aktivator Protein G
Mastoparan merupakan aktivator spesifik protein heterotrimerik G subunit α. Pemberian mastoparan hanya dilakukan pada perlakuan cekaman pH 4.0 dan pH 4.0+1.2 mM Al3+. Konsentrasi Mastoparan-7 (Sigma-Aldrich) yang digunakan sebesar 30 µM. Sebagai kontrol adalah media perlakuan cekaman pH 4.0 dan pH 4.0+1.2 mM Al3+ tanpa penam-bahan mastoparan. Pada jam ke 0, 1, 3 dan 6 dilakukan pengukuran H2O2 dan jumlah sel
mati diukur pada jam ke 0 dan jam ke 6. Tiap perlakuan diulang sebanyak dua kali.
Deteksi dan Kuantifikasi H2O2 pada Kultur
Suspensi Sel.
Deteksi dan kuantifikasi terhadap kandungan H2O2 dilakukan menurut He et al.
(2000) dan Suharsono et al. (2002b). Sebanyak 100 µL cairan medium diambil pada jam ke 0, 1, 3, dan 6 pada tiap perlakuan. Cairan medium kemudian direaksikan dengan 1 mL larutan penyangga Xylenol Orange (Dojindo) (Lampiran 2) dan diinkubasi pada suhu ruang selama 2 jam. Sampel kemudian disentrifugasi pada 10 000 rpm selama 10 menit untuk mengendapkan sel-sel yang terbawa pada pengambilan sampel.
Absor-bansi diukur dengan spektrofotometer Cecil CE 2020 (Cecil Instrument Limited) pada λ 560 nm dengan menggunakan H2O2 sebagai
standar.
Pengukuran Jumlah Sel Mati
Pengukuran terhadap jumlah sel yang mati dilakukan menurut Suharsono (2002a). Sebanyak 200 µL suspensi sel dari tiap perlakuan diambil pada jam ke 0 sebelum penggantian media dan jam ke 6 setelah per-lakuan. Suspensi sel diendapkan dengan sentrifugasi pada kecepatan 2 500 rpm selama 5 menit. Supernatan kemudian dibuang dan endapan sel diberi 1 mL larutan Evans blue (Sigma-Aldrich) 0.04% (b/v) dalam air dan diinkubasi selama 10 menit pada suhu ruang.
Sel kemudian diendapkan pada kecepatan 2 500 rpm selama 5 menit, supernatan di-buang dan endapan sel dibilas dengan 1 mL larutan 100 µM CaCl2 (pH 5.6). Pembilasan
dilakukan sebanyak 5-6 kali untuk meng-hilangkan kelebihan zat pewarna Evans blue. Kemudian sel dicuci dengan 1 mL larutan 1% SDS (b/v) dalam metanol 50% (v/v) dan di-inkubasi selama 2 jam untuk mengeluarkan zat warna Evans blue dari dalam sel yang mati. Absorbansi dari zat pewarna Evans blue yang dilepaskan dari sel yang mati kemudian diukur dengan spektrofotometer pada λ 595 nm.
HASIL DAN PEMBAHASAN
Hasil
Induksi Kalus
Induksi terhadap kalus tidak dijumpai pada media kontrol (MS) dan media MS+0.1 ppm kinetin. Media perlakuan MS+1 ppm 2,4-D+0.1 ppm kinetin dengan MS+1 ppm 2,4-D tidak menunjukkan perbedaan nyata dalam bobot kalus (Gambar 1).
Kalus yang terbentuk pada media dengan kombinasi MS+1 ppm 2,4-D+0.1 ppm kinetin memberikan kalus yang lebih remah (friable) jika dibandingkan dengan media MS+1 ppm 2,4-D (Gambar 2).
Inisiasi dan Pemeliharaan Kultur Suspensi Sel Kedelai
0 0.2 0.4 0.6 0.8 1
Media
B
obot
k
a
lus
(
g)
2,4-D + Kinetin 2,4-D
Gambar 1 Bobot kalus pada perlakuan berbagai ZPT (n = 50).
yang terlepas ke media sedikit sehingga memperlama waktu pembentukan suspensi sel.
Pada media MS organik minimal dengan 2 g/L Bacto Tryptone dan 3 ppm 2,4-D dan 0.1 ppm kinetin (pH 5.8), kultur suspensi sel mencapai volume sel 10% PCV setelah 12 hari (Gambar 3). Konsentrasi sel yang digunakan untuk penelitian ini mengacu kepada Leg