ROSEIGA RETNO ANGGARANI
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN
FAKULTAS TEKNOLOGI PERTANIANINSTITUT PERTANIAN BOGOR BOGOR
2014
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pembuatan Label Cerdas Pendeteksi Salmonella typhimurium adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
ABSTRAK
ROSEIGA RETNO ANGGARANI. Pembuatan Label Cerdas Pendeteksi Salmonella typhimurium. Dibimbing oleh ENDANG WARSIKI
Label cerdas berfungsi sebagai pemberi informasi kualitas dan pengawasan jaminan keamanan produk suatu pangan. Penelitian ini bertujuan membuat label dengan bahan pewarna indikator. Bahan utama label yaitu agar bubuk 2%, tepung tapioka 0.5%, dan gliserol 1%. Penelitian pendahuluan diawali dengan mencari bahan indikator warna pendeteksi S. typhimurium. Indikator dipilih berdasarkan berbagai media selektif dan komposisi bahan biokimiawi. Bahan utama dan media selektif Xylose Lysine Deoxychoalate agar (XLD agar) menghasilkan label yang sensitif terhadap pertumbuhan S. typhimurium.
Label dapat mempresentasikan perubahan warna dari cokelat transparan ke warna merah muda yang dapat diamati dengan mata. Uji sensitivitas pertumbuhan S. typhimurium terbaik adalah label dalam sachet yang diletakkan pada permukaan bawah tutup cawan petri. Hasil penelitian menunjukkan label memiliki tingkat sensitivitas tinggi. Label dapat mendeteksi S. typhimurium dari jumlah sel terkecil sebesar 2.2 x 100 CFU / mL (sampel A) sampai jumlah sel terbanyak sebesar 2.2 x 1015 CFU / mL (sampel B) pada jam ke – 24. Uji identifikasi perubahan warna menggunakan alat kolorimeter dengan mengolah data L*, a*, dan b*. Perubahan warna ditunjukkan oleh perubahan nilai ΔH* pada dua sampel di lima titik yang berbeda. Peningkatan perubahan warna terjadi sampai jam ke – 72 untuk sampel A dan jam ke – 48 untuk sampel B.
6
ABSTRACT
ROSEIGA RETNO ANGGARANI. Making a Smart Label As Detector Salmonella typhimurium. Supervised by ENDANG WARSIKI
Smart label serves as a providing of information and monitoring the quality of food product. This research was aimed to produce a label with indicator dye. The main label ingredients was 2 % agar powder, 0.5 % tapioca flour, and 1% glycerol. Preliminary research was began to find color indicator materials for Salmonella typhimirium. The indicator was consisted of various media selection and biochemical composition. The indicator of Xylose Lysine Deoxychoalate agar (XLD agar) have produced label which sensitive to S. typhimurium growth.
Label could present transparent color changing from brown to pink that can be observed by eyes. The best sensitivity testing of S. typhimurium growth was label in a sachet form which was placed on the bottom surface of the petri dish lid. The results showed that the label had a high sensitivity level. Label could detect S. typhimurium from the smallest amount of cells at about 2.2 x 100 CFU /
mL (sample A) up to the highest amount of cell at about 2.2 x 1015 CFU / mL
(sample B)in 24 hours. Test identification discoloration used a colorimeter have resulted data of L*, a*, and b*. Color change was indicated by changing in the value of ΔH* on two samples at five different points. Improved color change occurred up to 72 hours for sample A and 48 hours for sample B.
ROSEIGA RETNO ANGGARANI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
Pada
Departemen Teknologi Industri Pertanian
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
Judul Skripsi : Pembuatan Label Cerdas Pendeteksi Salmonella typhimurium Nama : Roseiga Retno Anggarani
NIM : F34100100
Disetujui oleh
Dr. Endang Warsiki, S.TP, M.Si Dosen Pembimbing
Diketahui oleh
Prof. Dr. Ir. Nastiti Siswi Indrasti Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia – NYA sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2014 sampai Juli 2014 ini ialah kemasan cerdas, dengan judul Pembuatan Label Cerdas Pendeteksi Salmonella typhimurium.
Terima kasih penulis ucapkan kepada Dr. Endang Warsiki, S.TP, M.Si selaku Dosen pembimbing, Ir. Liesbetini Haditjaroko, MS dan Dr. Ir. Moh. Yani, M.Eng selaku Dosen penguji ujian skripsi. Di samping itu, penghargaan penulis sampaikan kepada Alm. Bapak Sugito dan Ibu Ida Setiawati sebagai orang tua yang selalu mendoakan putranya, Maulana Angga Bahaduri dan Sulthan Dzaky Dzulfikar sebagai adik penulis, Nurul Latifah, Suci Enggar Afrianty, Dheanti Arista, Umi Maharani, Handayani Dwirianti, Riris Oktaviasari, Hanisa Pratiwi, dan Aloysius Boris yang selalu membantu, mendukung, dan memberikan semangat kepada penulis, rekan – rekan P3, dan rekan – rekan TIN 47. Semoga karya ilmiah ini bermanfaat.
Bogor, September 2014
DAFTAR ISI
Penentuan Jumlah Sel S. typhimurium 9
Pemilihan Bahan Media Indikator dan Uji Sensitivitas Label Cerdas 11
Pemilihan Bahan Media Indikator 11
Uji Sensitivitas 13
Performa Label dengan Penambahan PVA Terhadap Suhu Pengeringan 13 Pengaruh Konsentrasi XLD Terhadap Perubahan Visualisasi Warna Label 14
Uji Sensitivitas Label Cerdas Berbentuk Sachet 15
Perhitungan Jumlah Sel S. typimurium pada Label dan Media Pertumbuhan 17
Pengukuran Perubahan Warna Label Cerdas 18
HASIL DAN PEMBAHASAN 21
Penentuan Jumlah Sel S. typhimurium dalam 100 mL Larutan BHI 21 Pemilihan Bahan Media Indikator dan Uji Sensitivitas Label Cerdas 21 Performa Label Dengan Penambahan PVA Terhadap Suhu Pengeringan 25 Pengaruh Konsentrasi XLD Terhadap Perubahan Visualisasi Warna Label 27
Sensitivitas Label Cerdas dalam Bentuk Sachet 29
Jumlah Sel S. typhimurium pada Label Cerdas dan Media Pertumbuhan 34
14
Nilai L* 36
Nilai a* 37
Nilai b* 38
Perubahan nilai ΔH* 38
SIMPULAN DAN SARAN 39
SIMPULAN 39
SARAN 40
DAFTAR PUSTAKA 40
LAMPIRAN 43
RIWAYAT HIDUP 49
DAFTAR TABEL
1 Perbedaan kemasan cerdas dan kemasan aktif 3
2 Karakteristik pertumbuhan Salmonella sp. 4
3 Syarat mutu mikrobiologi daging sapi 6
4 Hasil uji sensitivitas label cerdas pada berbagai media selektif 22 5 Hasil uji sensitivitas label cerdas dengan indikator phenol red 23 6 Hasil uji sensitivitas label cerdas dengan indikator tetrathionate 24 7 Hasil uji sensitivitas label cerdas dengan suhu pengeringan 37oC
berdasarkan konsentrasi PVA 26
8 Hasil uji sensitivitas label cerdas dengan suhu pengeringan 50oC
berdasarkan konsentrasi PVA 27
9 Hasil perubahan visualisasi warna terhadap berbagai konsentrasi XLD 28 10 Hasil uji sensitivitas bentuk sachet label cerdas dalam botol 30 11 Hasil uji sensitivitas bentuk sachet label cerdas di dalam cawan petri
yang ditutupi dengan plastik wrap 32
12 Hasil uji sensitivitas metode label cerdas dalam sachet di dalam cawan petri yang tidak ditutupi dengan plastik wrap 33
DAFTAR GAMBAR
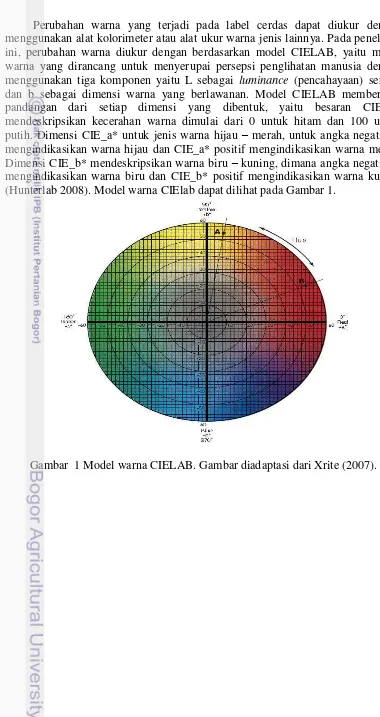
1 Model warna CIELAB. Gambar diadaptasi dari Xrite (2007). 8 2 Diagram alir perhitungan jumlah sel Salmonella typhimurium 10 3 Diagram alir pembuatan label cerdas dengan menggunakan media selektif 12 4 Diagram alir pembuatan label cerdas dengan menggunakan bahan komposisi
biokimiawi 12
5 Langkah uji sensitivitas label cerdas terhadap pertumbuhan
Salmonella typhimurium 13
6 Diagram alir pembuatan label cerdas dengan suhu pengeringan 37oC
dan 50oC 14
7 Diagram alir pembuatan label cerdas dalam sachet 15 8 Ilustrasi pengujian sensitivitas di dalam botol 16 9 Ilustrasi pengujian sensitivitas di dalam cawan petri 17 10 Diagram alir uji perhitungan S. typhimurium dengan metode agar tuang 18
11 Posisi titik pengukuran warna label cerdas 18
12 Perubahan warna label cerdas dari cokelat transparan ke warna merah muda 25
13 Jumlah sel S. typhimurium pada sampel A 34
14 Jumlah pertumbuhan sel S. typhimurium pada sampel B 35
15 Grafik nilai L* 37
16 Grafik nilai a* 37
17 Grafik nilai b* 38
18 Grafik nilai ΔH* 39
DAFTAR LAMPIRAN
1 Komposisi media selektif 44
2 Jumlah sel pada sampel A 44
3 Jumlah sel pada sampel B 45
4 Nilai perubahan warna label cerdas sampel A 45
5 Lanjutan Nilai perubahan warna label cerdas sampel A 46
6 Nilai perubahan warna label cerdas sampel B 47
PENDAHULUAN
Latar Belakang
Bahan pangan sangat rentan terhadap penurunan kualitas yang dapat terjadi selama penyimpanan, distribusi, dan transportasi. Penurunan kualitas produk pangan yang tidak diketahui secara pasti dapat berbahaya jika dikonsumsi. Untuk mengetahui penurunan kualitas suatu produk pangan, maka dibutuhkan alat pendeteksi yang dapat membantu konsumen untuk mengetahui tingkat penurunan kualitas produk pangan yang akan dibeli.
Pendeteksian dapat dilakukan berdasarkan indikator luar dan indikator dalam. Contoh indikator luar yaitu indikator waktu, indikator suhu, dan indikator pertumbuhan mikroba, sedangkan contoh indikator dalam adalah indikator oksigen, indikator karbon dioksida, indikator patogen, dan indikator pertumbuhan mikroba (Ahvenainen 2003). Salah satu alat pendeteksi yang dibutuhkan adalah pendeteksi kerusakan pangan yang disebabkan oleh bakteri.
ToxinGuardTM (Ontario, Kanada) mengembangkan indikator biosensor yang memiliki sistem diagnostik visual. Indikator tersebut dicetak pada plastik polietilen yang mampu mendeteksi bakteri patogen, seperti Salmonella sp, Campylobacter sp, Escherichia coli O517 dan Listeria sp (Bodenhammer et al. 2004). Beberapa penelitian kemasan cerdas berbentuk label telah banyak dilakukan. Warsiki et al. (2013) telah meneliti label indikator untuk mendeteksi kerusakan buah potong karena perubahan pH dan juga kemasan antimikroba yang mampu menghambat mikroba pembusuk pangan (Warsiki et al. 2009; Warsiki et al. 2010). Selain itu, Nofrida et al. (2013) memanfaatkan daun erpa sebagai indikator warna untuk produk rentan suhu dan cahaya.
Label cerdas indikator warna dapat diaplikasikan sebagai pendeteksi kerusakan produk, salah satunya bahan pangan yang disebabkan oleh bakteri patogen seperti Salmonella sp. Pada umumnya bakteri patogen ditemukan pada produk karkas hewan seperti di kulit antara kaki dan dada, seperti Salmonella enterica (Humphrey 2006). Nógrády et al. (2008) menyatakan bahwa cemaran S. infaritis di rumah potong unggas di Hungaria berasal dari air yang telah tercemar Salmonella sp., pencemaran silang selama pencabutan bulu, pendinginan, penanganan selama pemotongan (cutting), dan pengemasan (packaging).
Salmonella sp memiliki potensi untuk tumbuh pada produk makanan yang kering, makanan yang tidak dikemas dengan proses yang baik, makanan yang mentah, unggas dan daging, telur, buah – buahan serta sayuran mentah seperti selada, tauge, tomat, dan kentang (Dina 2013). Kontaminasi Salmonella pada daging dapat ditandai dengan adanya gas H2S akibat reaksi fermentasi atau digesti anaerobik. Salmonella termasuk dalam bakteri Gram negatif, bersifat fakultatif anaerob, berbentuk batang bergerak dan tidak menghasilkan spora.
2
pelapisan pada daging dan disimpan pada suhu ruang. Hasil pengamatan menunjukan bahwa terjadi perpindahan zat warna dari bahan label ke daging segar. Bahan label yang bermigrasi ke daging yaitu pewarna eosin Y dan pewarna methylene blue pada agar Eosin Methylene Blue (EMB). Hal ini disebabkan zat warna ini mudah larut dalam air (Merck 2013).
Berdasarkan hasil penelitian tersebut, pada pembuatan label cerdas pendeteksi Salmonella digunakan campuran bahan film yang dapat meningkatkan sifat mekanis dan menurunkan tingkat permeabilitas air yaitu Polivinil Alkohol (PVA). PVA merupakan polimer sintetik yang mudah terurai secara biologi (biodegradable), berbentuk bubuk halus, berwarna putih kekuningan, tidak berbau, dan memiliki densitas 1.3 g/cm3 (pada 20oC) dan pH 3.5 – 7.0 (Simanjutak 2008). Selain itu pemilihan bahan indikator sangat penting sehingga dihasilkan label dengan sensitivitas tinggi.
Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut:
Pemilihan label cerdas indikator S. typhimurium dari berbagai Media selektif dan bahan biokimiawi
Mempelajari respon sensitivitas label cerdas terhadap pertumbuhan S. typhimurium.
Mengetahui jumlah sel S. typhimurium pada media pertumbuhan dan label cerdas selama penyimpanan.
Menghitung perubahan warna label cerdas menggunakan kolorimeter
Ruang Lingkup Penelitian
TINJAUAN PUSTAKA
Kemasan Cerdas
Kemasan cerdas adalah kemasan yang didisain sebagai pemberi informasi melalui perubahan warna, mengenai kualitas dari sifat makanan selama di dalam kemasan (Brody et al. 2001). Menurut Lestari (2013), kemasan cerdas adalah kemasan yang dapat mengawasi dan memberikan informasi tentang kualitas produk terkemas. Prinsip kerja dari kemasan cerdas yaitu memberikan jaminan integritas, keamanan, dan kualitas produk yang digunakan melalui indikator seperti suhu, waktu, pewarna gas, penginderaan, dan indikator pertumbuhan mikroba, sehingga dapat memberi komunikasi kepada konsumen akhir mengenai kualitas produk. Contoh dari kemasan cerdas adalah Magic Ink yaitu memberikan indikasi perubahan warna jika ada perubahan suhu yang tidak diinginkan. Perubahan warna pada kemasan cerdas menjadi parameter pemberi informasi mengenai kualitas suatu bahan pangan.
Terdapat perbedaan antara kemasan cerdas dan kemasan aktif seperti yang ditunjukkan pada Tabel 1. Berdasarkan tabel tersebut dapat dilihat bahwa kemasan aktif merupakan pelindung dari suatu produk yang fokus terdapat zat aditif tertentu yang membuat kemasan tersebut aktif dan dapat melakukan beberapa peran untuk melindungi suatu produk seperti pengawetan makanan, penghalang kelembaban, dan penyerap komponen yang tidak diinginkan dari makanan.
Tabel 1 Perbedaan kemasan cerdas dan kemasan aktif
Kemasan Cerdas Kemasan Aktif
Indikator waktu dan temperatur Anti mikroba Indikator / sensor keberadaan bakteri pembusuk Ethylene scavenger
Indikator kejut fisik Pemanas / pendingin
Sensor kebocoran Penyerapan kelembaban
Indikator penyebab alergi Penyerap / pelepas bau dan rasa
Sensor pertumbuhan mikroba Oxygen scavenger
4
Salmonella sp.
Genus Salmonella sp. merupakan anggota famili Enterobacteriaceae, yaitu basili gram negatif, fakultatif anaerobik, berbentuk batang, tidak berspora, memiliki flagela peritrikus, memiliki panjang ± 2 – 4 µm dan bergaris tengah antara ± 0.5 – 0.8 µm, tumbuh pada suhu antara 5 – 45 ̊ C, dengan suhu optimum 35 – 37 ̊ C. Salmonella sp. mampu tumbuh pada pH rendah dan umumnya sensitif pada kadar garam yang meningkat. Salmonella sp. membentuk rantai filamen yang panjang jika dibiakkan atau ditumbuhkan pada suhu ekstrim 4 – 8oC atau 44oC, serta pada pH 4.4 atau 9.4. Semua jenis Salmonella sp. bersifat patogen, serta dapat menyerang makrofag, sel – sel dendrit, dan epitel. Pada umumnya isolat Salmonella menghasilkan H2S, akan tetapi Salmonella typhimurium hanya menghasilkan sedikit H2S dan tidak membentuk gas pada fermentasi glukosa (Bhunia 2008). Karakteristik pertumbuhan Salmonella dapat dilihat pada Tabel 2.
Tabel 2 Karakteristik pertumbuhan Salmonella sp.
Parameter Minimum Optimum Maksimum
Suhu ( ̊C) (*)
Bakteri lain yang termasuk dalam famili Enterobacteriaceae ini ialah Escherichia, Edwardsiella, Shigella, Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Yersinia, dan Erwinia. Pertumbuhan bakteri dipengaruhi oleh metabolisme energi, salah satunya berupa oksidasi dan fermentasi. Salmonella sp merupakan bakteri fakultatif anaerobik, yaitu suatu kondisi bakteri yang dapat hidup secara aerob (ada oksigen) dan anaerob (tidak ada oksigen). Pada kondisi aerob, bakteri akan mengoksidasi asam amino, sebaliknya saat tidak ada oksigen atau pada kondisi anaerob bakteri tersebut akan bersifat fermentatif yang memecah gula menjadi asam organik (Fardiaz 1992).
Salmonella (food – borne disease), contohnya S. typhimurium. Penyakit ini dapat menyebabkan demam tifus yang biasanya menular dari hewan ke manusia melalui makanan asal hewan yang terkontaminasi. (Agricultural Research Service 2002; Fardiaz dan Jenie 1989).
Penyakit demam tifus memiliki gejala pada masa inkubasi 5 – 14 hari dengan rata – rata 7 – 8 hari dalam tubuh. Masa inkubasi tersebut akan cepat berlangsung jika dosis S. typhimurium yang tertelan semakin tinggi. Oleh karena masa inkubasi S. typhimurium yang cepat pada tubuh dan tingkat bahaya bakteri patogen, maka syarat yang diperbolehkan Salmonella sp. pada pangan contohnya daging sebesar negatif per 25 gram (Badan Standarisasi Nasional 2008).
Berdasarkan standarisasi nasional tersebut, peran label cerdas sangat dibutuhkan sebagai alat pengawas dan pemberi informasi mengenai keberadaan bakteri Salmonella sp. Label cerdas tersebut diaplikasikan ke dalam kemasan, sehingga dapat membantu konsumen dalam mengetahui keamanan pangan. Label cerdas akan mempresentasikan perubahan warna, ketika bahan pangan mengalami kontaminasi bakteri patogen Salmonella sp.
Salmonella sp pada Daging
Kontaminasi Salmonella sp. umumnya terjadi pada produk pangan seperti daging sapi, daging ayam dan daging unggas. Kontaminasi sering terjadi pada produk olahan daging seperti pada karkas daging unggas dan jenis pengolahan daging lainnya. Faktor – faktor yang dapat mempengaruhi kontaminasi bakteri pada produk daging adalah jumlah dan jenis organisme bakteri patogen selama pengolahan, waktu dan suhu penyimpanan, jenis jaringan kulit dan otot, pH, jenis pengemasan, dan keberadaan CO2 (Bhunia 2008).
Berdasarkan sifat pertumbuhannya pada makanan, Salmonella sp. termasuk dalam bakteri patogen yang pertumbuhannya dirangsang oleh makanan tempat tumbuhnya, sehingga jumlahnya cepat dan bertambah banyak (Fardiaz 1989). Salmonella sp lebih mudah menyebar ke pangan yang telah terkontaminasi, kemudian dikonsumsi mentah atau belum matang.
6
Tabel 3 Syarat mutu mikrobiologi daging sapi
Jenis Uji Satuan Persyaratan
Total plate count cfu/g Maksimum 1 × 106
Coliform cfu/g Maksimum 1 × 102
Staphylococcus aureus cfu/g Maksimum 1 × 102 Salmonella sp per 25 gram Negatif
Esherichia coli cfu/g Maksimum 1 × 101 Sumber : Badan Standarisasi Nasional (2008)
Bahan Indikator
Media Selektif
Media selektif (selective medium) adalah media yang ditambah zat kimia tertentu yang bersifat selektif untuk mencegah pertumbuhan mikroba lain sehingga dapat mengisolasi mikroba tertentu. Media ini selain mengandung nutrisi juga ditambah suatu zat pengahambat, sehingga media tersebut dapat menekan pertumbuhan mikroba lain dan merangsang pertumbuhan mikroba yang diinginkan. Zat penghambat seperti kristal violet dapat mencegah pertumbuhan bakteri gram positif tanpa mempengaruhi pertumbuhan bakteri gram negatif. (Baird et al. 1995).
Terdapat beberapa media selektif khusus Salmonella sp yaitu Xylose Lysine Deoxycholate (XLD), Hektoen Enteric Agar (HEA), Salmonella Shigella Agar (SSA), dan Bismuth Sulphite Agar (BSA). Komposisi bahan dari media selektif terdapat pada Lampiran 1. Salah satu komposisi bahan pH indikator seperti phenol red, akan memberikan warna kuning – orange ketika suasana asam (nilai pH < 7) dan warna merah muda (fuchsia) – merah ketika tercipta suasana basa (nilai pH > 7). Mikroorganisme yang dapat memfermentasikan karbohidrat akan menciptakan suasana asam dan membuat warna kuning pada media. Mikroorganisme yang tidak dapat memfermentasikan karbohidrat, dapat mendekarboksilasi pepton dan lisin, sehingga akan menciptakan suasana basa. Pada kondisi basa, phenol red akan menghasilkan warna merah muda (fuchsia) – merah pada media pada suasana basa (Anonim 2014).
Jenis karbohidrat xilosa, digunakan bakteri S. typhimurium untuk melakukan fermentasi dan menciptakan suasana asam. Bakteri Shigella tidak dapat memfermentasikan xilosa sehingga tetap menghasilkan warna merah. Setelah memfermentasikan xilosa, selanjutnya S. typhimurium mendekarboksilasi lisin yang termasuk dalam jenis asam amino dan meningkatkan pH menjadi basa. Suasana basa tersebut akan mengubah pada indikator pH phenol red warna label cerdas menjadi warna merah muda (Himedia 2011a).
yaitu E.coli. Hasil dari fermentasi tersebut akan menghasilkan suasana asam dan mencegah kembalinya reversi pH akibat oleh dekarboksilasi.
Salmonella sp memproduksi hidrogen sulfida (H2S) hasil dari metbolisme Na2S2O3, lalu bereaksi dengan besi (ferric amonium citrate (FAC)) pada medium dan membentuk endapan hitam besi sulfida (black center). Akan tetapi, bakteri S. typhimurium hanya sedikit membentuk H2S, sehingga sulit di deteksi keberadaan H2S pada label cerdas. Media XLD memiliki kandungan bahan sodium deoxycholate yang berfungsi sebagai bahan penghambat pertumbuhan bakteri gram positif, sehingga label cerdas dapat khusus mendeteksi bakteri gram negatif. Bahan – bahan tersebut menjadikan XLD agar sebagai media yang lebih selektif dan sensitif dibandingkan media lainnya seperti SSA, HEA, dan BSA (Himedia 2011)a.
Komposisi Medium Bahan Biokimiawi
Bahan – bahan biokimiawi yang digunakan sebagai bahan indikator warna ialah Brain Heart Infussion (BHI), phenol red, glukosa, tetrathionate, Na2S2O3, dan Ferric Amonium Citrate (FAC). BHI merupakan medium diperkaya yang bergizi untuk pertumbuhan mikroba. Medium diperkaya tersebut mengandung pepton, proteosa, dan infus (otak sapi dan jantung sapi) yang berfungsi sebagai sumber karbon, nitrogen, asam amino, vitamin, dan faktor pertumbuhan (Atlas 2010). Kandungan bahan tersebut membuat BHI menjadi media diperkaya yang baik untuk pertumbuhan mikroba, sehingga digunakan sebagai salah satu bahan penyusun indikator agar lebih cepat mendeteksi bakteri Salmonella typhimurium.
Karbohidrat jenis glukosa digunakan oleh bakteri S. typhimurium sebagai sumber energi nutrien organik melalui proses fermentasi. Terdapat dua jenis fermentasi pada metabolisme pertumbuhan Salmonella sp.yaitu fermentasi aerob dan anaerob. Pada ferementasi aerob melalui jalur Embden – Meyerhoff – Parnas (EMP), glukosa dipecah atau dikatabolisme menjadi asam piruvat, NADH2, dan Adenosine trihosphate (ATP). Pada fermentasi anaerob, glukosa akan dimetabolisme dan menghasilkan asam – asam organik, alkohol, CO2, H2, dan energi (Fardiaz 1992).
Tetrathionate digunakan untuk mengisolasi dan memperbanyak kultur murni Salmonella sp. Kandungan pepton proteasa pada tetrathionate berfungsi sebagai nutrien yang digunakan untuk metabolisme pertumbuhan bakteri (Himedia 2011)b. Tetrathionate mengandung komponen garam empedu yang berfungsi sebagai bahan penghambat bakteri gram – positif dan mikroorganisme lain, sehingga Enterobacteriaceae seperti bakteri S. typhimurium akan tetap tumbuh.
8
Uji Warna
Perubahan warna yang terjadi pada label cerdas dapat diukur dengan menggunakan alat kolorimeter atau alat ukur warna jenis lainnya. Pada penelitian ini, perubahan warna diukur dengan berdasarkan model CIELAB, yaitu model warna yang dirancang untuk menyerupai persepsi penglihatan manusia dengan menggunakan tiga komponen yaitu L sebagai luminance (pencahayaan) serta a dan b sebagai dimensi warna yang berlawanan. Model CIELAB memberikan pandangan dari setiap dimensi yang dibentuk, yaitu besaran CIE_L* mendeskripsikan kecerahan warna dimulai dari 0 untuk hitam dan 100 untuk putih. Dimensi CIE_a* untuk jenis warna hijau – merah, untuk angka negatif a* mengindikasikan warna hijau dan CIE_a* positif mengindikasikan warna merah. Dimensi CIE_b* mendeskripsikan warna biru – kuning, dimana angka negatif b* mengindikasikan warna biru dan CIE_b* positif mengindikasikan warna kuning (Hunterlab 2008). Model warna CIElab dapat dilihat pada Gambar 1.
METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Dasar Ilmu Terapan (DIT), Laboratorium Teknologi Pengemasan, Distribusi, dan Transportasi, Laboratorium Minyak Atsiri Departemen Teknologi Industri Pertanian, dan di Laboratorium Mikrobiologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dimulai bulan Februari sampai Juli 2014.
Bahan
Bahan yang digunakan yaitu agar bubuk, tepung tapioka, gliserol, Xylose Lysine Deoxycholate (XLD), Polyvinile Alcohol (PVA), Tetrathionat, Salmonella Shigella Agar (SSA), Tryptic Soy Agar (TSA), Bismuth Salt Agar (BSA), Hecton Enteric agar (HEA), Brain Heart Infussion (BHI), NaCl fisiologis, aquades, biakan Escherichia coli, dan biakan Salmonella typhimurium.
Alat
Peralatan yang digunakan adalah cawan petri, gelas piala, magnetic stirer, autoklaf, oven (pengering), inkubator, kompor, hot stirer, batang penyebar, termometer, neraca analitik, pipet volumetrik, sudip alumunium, tabung Scotch, tabung reaksi, dan alat pengukur warna colortec – PCM colorimeter.
Prosedur
Penentuan Jumlah Sel S. typhimurium
Jumlah sel S. typhimurium yang diketahui bertujuan untuk melihat tingkat sensitivitas label cerdas dalam mendeteksi bakteri S. typhimurium. Perhitungan jumlah sel menggunakan metode hitungan cawan atau Total Plate Count (TPC). Sebanyak 1 ose biakan sel S. typhimurium diinokulasikan ke media diperkaya BHI cair 100 mL, lalu diinkubasi pada suhu 37oC selama 24 jam. 1 mL S. typhimurium dari larutan BHI cair 100 mL diencerkan ke dalam 9 mL NaCl fisiologis sampai tingkat pengenceran 10-12.
10
Pengenceran dari media kultur BHI bertujuan agar jumlah sel yang dipupuk ke dalam media di cawan petri dapat dihitung yaitu, jumlah sel antara 30 sampai 300 (Fardiaz 1992).
Menurut Rahayu dan Nurwitri (2012), perhitungan bakteri dengan metode Total Plate Count (TPC) dapat dilakukan berdasarkan ketentuan sebagai berikut:
N =
�1+ 0.1 �2 . ∑ c = Jumlah seluruh sel yang dihitung pada cawan n1 = Jumlah cawan dari pengenceran pertama n2 = Jumlah cawan dari pengenceran kedua
d = Faktor pengenceran pada pengenceran pertama
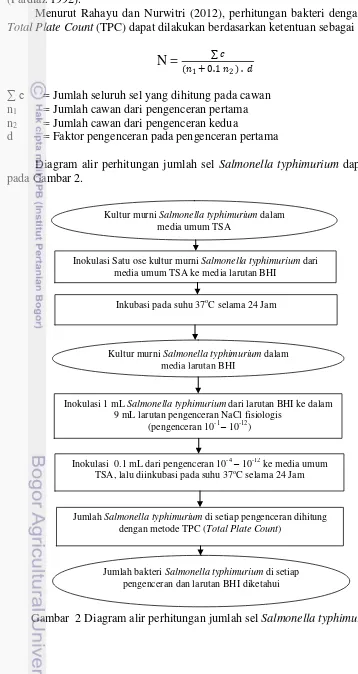
Diagram alir perhitungan jumlah sel Salmonella typhimurium dapat dilihat pada Gambar 2.
Gambar 2 Diagram alir perhitungan jumlah sel Salmonella typhimurium
Kultur murni Salmonella typhimurium dalam
media umum TSA
Inokulasi Satu ose kultur murni Salmonella typhimurium dari
media umum TSA ke media larutan BHI
Inkubasi pada suhu 37oC selama 24 Jam
Inokulasi 1 mL Salmonella typhimurium dari larutan BHI ke dalam
9 mL larutan pengenceran NaCl fisiologis (pengenceran 10-1 – 10-12)
Kultur murni Salmonella typhimurium dalam
media larutan BHI
Jumlah Salmonella typhimurium di setiap pengenceran dihitung
dengan metode TPC (Total Plate Count)
Jumlah bakteri Salmonella typhimurium di setiap
pengenceran dan larutan BHI diketahui
Inokulasi 0.1 mL dari pengenceran 10-4– 10-12 ke media umum
Pemilihan Bahan Media Indikator dan Uji Sensitivitas Label Cerdas Pemilihan Bahan Media Indikator
Terdapat dua metode penentuan bahan pewarna indikator yaitu pemilihan antara media selektif dan komposisi medium bahan biokimiawi. Media indikator tersebut dihomogenkan dengan aquades 150 mL dan bahan utama, yaitu agar bubuk 2%, tepung tapioka 0.5%, dan gliserol 1 %. Pemilihan indikator warna menggunakan media selektif bakteri S. typhimurium yaitu media Xylosa Lysine Deoxycholate agar (XLD agar), Hektoen Enteric Agar (HEA), Salmonella Shigela Agar (SSA), dan Bismuth Salt Agar (BSA). Komposisi bahan pada setiap media selektif dapat dilihat pada Lampiran 1. Penggunaan awal konsentrasi media selektif mengacu pada penelitian Lestari (2013) yaitu sebesar 1%.
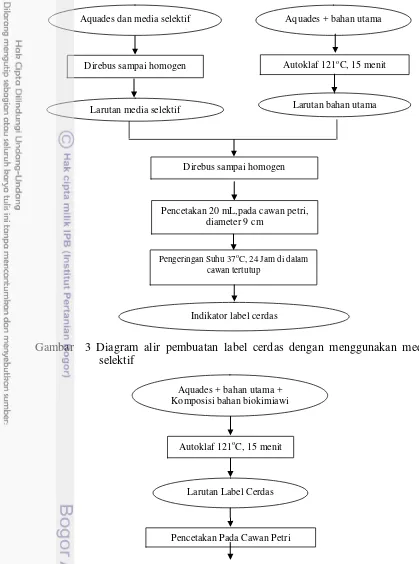
Gambar 3 memperlihatkan diagram alir pembuatan label cerdas dengan menggunakan media selektif. Menurut Atlas (2010), media selektif Salmonella sp seperti XLD, SSA, HEA, dan BSA akan mengalami kerusakan komponen ketika dipanaskan pada suhu lebih 100oC. Oleh karena itu, cara menghomogenkan bubuk media selektif dan aquades dengan cara direbus sampai menghasilkan larutan media selektif. Untuk bahan utama dan aquades dihomogenkan melalui alat autoklaf dengan pada suhu 121oC selama 15 menit. Larutan media selektif dan larutan bahan utama dicampur dan dihomogenkan kembali dengan cara direbus untuk menghasilkan larutan label cerdas. Larutan tersebut dicetak pada cawan petri dengan volume 20 mL dan dikeringkan dengan suhu 37oC selama 24 jam.
Metode pemilihan indikator warna kedua yaitu dengan membuat formulasi dari bahan utama dan bahan komposisi biokimiawi yang dibutuhkan bagi S. typhimurium untuk mensintesis bahan – bahan selnya. Bahan biokimiawi yang digunakan adalah phenol red 0.02%, media diperkaya BHI 3.7%, glukosa 1%, media pengayaan selektif tetrathionate 7.7%, Na2S2O3 0.85%, dan Ferric Amonium Citrate (FAC) 0.15%. Bahan tersebut dihomogenkan dengan bahan utama, sehingga menghasilkan label cerdas yang dapat mendeteksi bakteri basili gram negatif, fakultatif anaerobik yang bersifat patogen. Konsentrasi bahan tersebut berpacu dalam pengunaan pembuatan media umum (Atlas 2010).
Terdapat dua bagian pembuatan label cerdas dari bahan utama dan bahan komposisi biokimiawi yaitu menggunakan indikator phenol red dan menggunakan indikator tetrathionate. Formluasi label cerdas dengan indikator phenol red yaitu pertama bahan utama dan phenol red. Kedua bahan utama, phenol red, media BHI, dan glukosa. Adapun untuk formulasi label cerdas dengan indikator tetrathionate yaitu pertama bahan utama, phenol red, BHI, tetrathionate, glukosa, Na2SsO3, dan FAC. Kedua bahan utama, phenol red, glukosa, tetrathionate, Na2S2O3, dan FAC.
12
Gambar 3 Diagram alir pembuatan label cerdas dengan menggunakan media selektif
Gambar 4 Diagram alir pembuatan label cerdas dengan menggunakan bahan komposisi biokimiawi
Aquades + bahan utama + Komposisi bahan biokimiawi
Autoklaf 121oC, 15 menit
Larutan Label Cerdas
Pencetakan Pada Cawan Petri
Label cerdas pendeteksi
Salmonella
Pengeringan Suhu 37oC, 24 Jam
Larutan media selektif Aquades dan media selektif
Direbus sampai homogen
Aquades + bahan utama
Autoklaf 121oC, 15 menit
Larutan bahan utama
Direbus sampai homogen
Pencetakan 20 mL,pada cawan petri, diameter 9 cm
Pengeringan Suhu 37oC, 24 Jam di dalam cawan tertutup
Uji Sensitivitas
Label cerdas yang telah dicetak dalam cawan petri diuji sensitivitasnya terhadap pertumbuhan Salmonella typhimurium dengan cara memipetkan jumlah sel S. typhimurium. Positif pertumbuhan Salmonella typhimurium pada label cerdas ditandai dengan perubahan warna menjadi merah muda sampai kuning. Metode uji sensitivitas label cerdas terhadap pertumbuhan Salmonella typhimurium diadaptasi dari penelitian Lestari (2013), seperti yang ditunjukkan pada Gambar 5.
Uji sensitivitas label cerdas dilakukan dengan cara memipetkan kultur S. typhimurium sebanyak 0.1 mL larutan BHI ke dalam label cerdas yang telah dicetak di dalam cawan petri. Selanjutnya kultur tersebut disebarkan di atas permukaan label cerdas menggunakan batang penyebar. Inkubasi bahan pengujian sensitivitas dilakukan pada suhu optimum pertumbuhan S. typhimurium 37oC selama 24 jam.
Gambar 5 Langkah uji sensitivitas label cerdas terhadap pertumbuhan Salmonella typhimurium
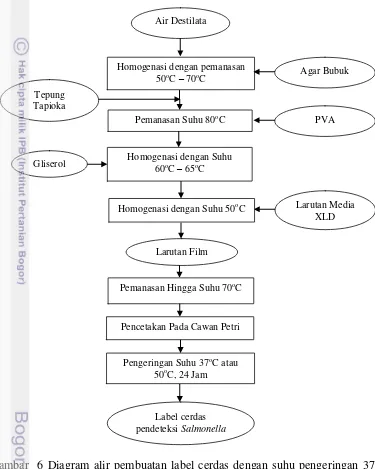
Performa Label dengan Penambahan PVA Terhadap Suhu Pengeringan Penambahan berbagai konsentrasi PVA bertujuan untuk mengetahui komposisi bahan yang sesuai untuk label. Komposisi yang sesuai tersebut diharapkan dapat menahan uap air, sehingga label tidak larut ketika kontak dengan produk. Penelitian tahap ini, diawali dengan pembuatan label cerdas yang dicetak pada cawan petri dan dikeringkan pada suhu 37oC dan dan 50oC. Penentuan formulasi label cerdas bergantung pada jenis label cerdas dan sensitivitas pertumbuhan S. typhimurium. Diagram alir pembuatan label cerdas dengan suhu pengeringan pada suhu 37oC dan 50oC seperti ditunjukkan pada Gambar 6.
Air destilata dipanaskan sampai suhu 50oC – 70oC kemudian agar bubuk dimasukkan secara perlahan dan ditunggu sampai homogen. Tepung tapioka dimasukkan ketika suhu belum mencapai 80oC. Setelah semua bahan homogen, kemudian dimasukkan PVA ketika suhu 80oC. Suhu tersebut bertujuan untuk menghomogenkan PVA dengan bahan lainnya. Setelah homogen, larutan
14
didinginkan pada suhu 60 – 65oC lalu dimasukkan gliserol. Dinginkan kembali larutan sampai suhu 50oC dan masukkan larutan media selektif XLD. Selanjutnya larutan label cerdas dihomgenkan pada suhu 70oC agar tidak cepat membeku. Cetak larutan pada cawan petri dengan volume 20 mL dan keringkan sesuai suhu perlakuan yaitu 37oC dan 50oC.
Gambar 6 Diagram alir pembuatan label cerdas dengan suhu pengeringan 37oC dan 50oC
Pengaruh Konsentrasi XLD Terhadap Perubahan Visualisasi Warna Label Penelitian tahap ini bertujuan untuk mendapatkan konsentrasi terbaik XLD berdasarkan perubahan visualisasi warna pertumbuhan bakteri gram negatif famili Enterobacteriaceae, S. typhimurium. Formulasi standar label cerdas mengacu kepada penelitian Warsiski et al. (2010) dalam pembuatan film yaitu tepung
Larutan Film
Pemanasan Hingga Suhu 70oC
Label cerdas
pendeteksi Salmonella
Pengeringan Suhu 37oC atau
50oC, 24 Jam
Pencetakan Pada Cawan Petri Air Destilata
Homogenasi dengan pemanasan
50oC – 70oC Agar Bubuk
Tepung Tapioka
Pemanasan Suhu 80oC PVA
Gliserol
Larutan Media XLD
Homogenasi dengan Suhu 50oC
tapioka 0.5 % dan gliserol 1 %. Konsentrasi agar bubuk mengacu pada penelitian Lestari (2013) sebesar 2 %. Label cerdas dengan 4 konsentrasi media selektif XLD yaitu 0.5 %, 1 %, 1.5 %, 2 % dilakukan uji sensitivitas terhadap pertumbuhan bakteri Salmonella typhimurium.
Uji Sensitivitas Label Cerdas Berbentuk Sachet
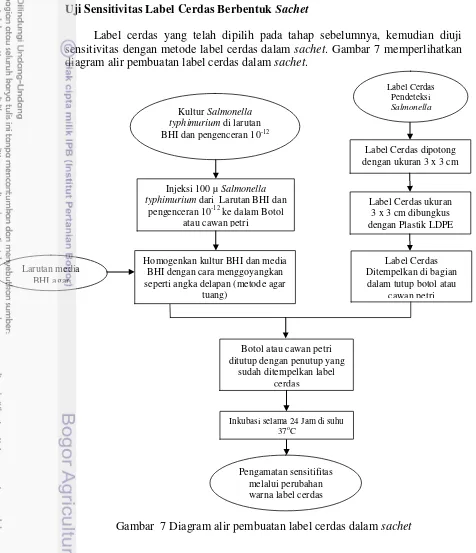
Label cerdas yang telah dipilih pada tahap sebelumnya, kemudian diuji sensitivitas dengan metode label cerdas dalam sachet. Gambar 7 memperlihatkan diagram alir pembuatan label cerdas dalam sachet.
Gambar 7 Diagram alir pembuatan label cerdas dalam sachet
Pengamatan sensitifitas
Inkubasi selama 24 Jam di suhu 37oC
Injeksi 100 µ Salmonella
typhimurium dari Larutan BHI dan
pengenceran 10-12 ke dalam Botol
16
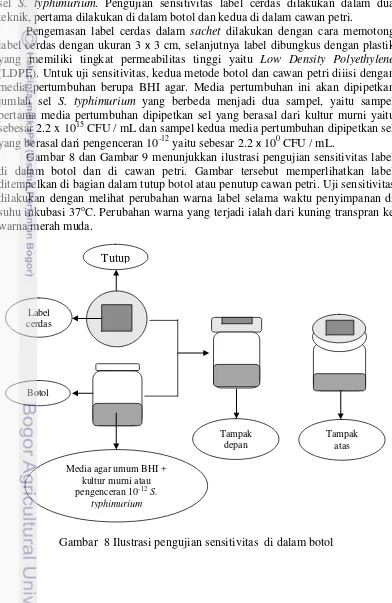
Kemasan sachet dibuat dari plastik Low Density Polyethylene (LDPE) yang memiliki permeabilitas tinggi. Label yang telah dipotong dengan ukuran 3 x 3 cm dibungkus dengan plastik LDPE, sehingga berbentuk sachet. Kemasan sachet bertujuan untuk mengurangi migrasi antara label cerdas dan produk. Pada tahap keempat ini akan dipilih formulasi terbaik label cerdas dalam sachet dan mengetahui tingkat sensitivitas indikator label cerdas dalam mendeteksi jumlah sel S. typhimurium. Pengujian sensitivitas label cerdas dilakukan dalam dua teknik, pertama dilakukan di dalam botol dan kedua di dalam cawan petri.
Pengemasan label cerdas dalam sachet dilakukan dengan cara memotong label cerdas dengan ukuran 3 x 3 cm, selanjutnya label dibungkus dengan plastik yang memiliki tingkat permeabilitas tinggi yaitu Low Density Polyethylene (LDPE). Untuk uji sensitivitas, kedua metode botol dan cawan petri diiisi dengan media pertumbuhan berupa BHI agar. Media pertumbuhan ini akan dipipetkan jumlah sel S. typhimurium yang berbeda menjadi dua sampel, yaitu sampel pertama media pertumbuhan dipipetkan sel yang berasal dari kultur murni yaitu sebesar 2.2 x 1015 CFU / mL dan sampel kedua media pertumbuhan dipipetkan sel yang berasal dari pengenceran 10-12 yaitu sebesar 2.2 x 100 CFU / mL.
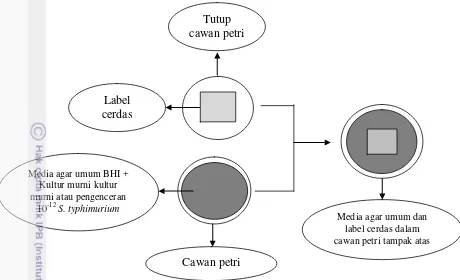
Gambar 8 dan Gambar 9 menunjukkan ilustrasi pengujian sensitivitas label di dalam botol dan di cawan petri. Gambar tersebut memperlihatkan label ditempelkan di bagian dalam tutup botol atau penutup cawan petri. Uji sensitivitas dilakukan dengan melihat perubahan warna label selama waktu penyimpanan di suhu inkubasi 37oC. Perubahan warna yang terjadi ialah dari kuning transpran ke warna merah muda.
Gambar 9 Ilustrasi pengujian sensitivitas di dalam cawan petri
Perhitungan Jumlah Sel S. typimurium pada Label dan Media Pertumbuhan Perhitungan jumlah sel S. typhimurium dilakukan dengan menggunakan Total Plate Count (TPC). Sel bulat hitam dihitung manual untuk melihat pertumbuhan sel selama 96 jam atau 4 hari. Gambar 10 menunjukkan metode cawan tuang dengan perhitungan jumlah S. typhimurium menggunakan Total Plate Count (TPC). Metode cawan tuang merupakan metode perhitungan yang pengenceran dan medianya telah disiapkan terlebih dahulu. Label cerdas dan
media pertumbuhan terlebih dahulu dihancurkan menjadi suspensi S. typhimurium, kemudian dimasukkan ke larutan pengenceran NaCl fisiologis.
Sebanyak 0.1 mL pengenceran dipipetkan ke dalam cawan petri lalu tuangkan media selektif Salmonella Shigella Agar (SSA) ke dalam cawan petri, lalu dihomogenkan dengan cara digoyangkan seperti membentuk angka delapan. Perhitungan bakteri dengan metode TPC dilakukan seperti metode pada sub bab perhitungan jumlah sel S. typhimurium.
Tutup cawan petri
Label cerdas
Media agar umum BHI + Kultur murni kultur murni atau pengenceran
10-12
S. typhimurium
Cawan petri
18
Gambar 10 Diagram alir uji perhitungan S. typhimurium dengan metode agar tuang
Pengukuran Perubahan Warna Label Cerdas
Pengukuran perubahan warna label cerdas dilakukan dengan menggunakan alat kolorimeter di lima titik berbeda yaitu kanan atas, kanan bawah, tengah, kiri atas, dan kiri bawah seperti yang ditunjukkan pada gambar 11. Dari data tersebut dicari nilai L*, a*, b*, dan ΔH*. Hasil dari pengolahan data kemudian dirata – ratakan.
Gambar 11 Posisi titik pengukuran warna label cerdas. Titik kanan atas ( ), titik kanan bawah ( ), titik tengah ( ), titik kiri atas ( ), dan titik kiri bawah ( ).
Suspensi
S.typhimurium Pengenceran
Pemipetan 0.1 mL ke cawan petri Penuangan SSA
Inkubasi 24-48 jam suhu 37°C Perhitungan sel
Prinsip alat kolorimeter yaitu menangkap warna yang sesuai dengan persepsi penglihatan manusia. Alat tersebut akan menghasilkan nilai Lab dan dibandingkan dengan beberapa warna. Warna label cerdas diperoleh dengan cara mengolah data warna berupa perhitungan rata – rata nilai L*, a*, b* ΔL*, Δa*, Δb*, ΔE*, ΔC*, dan ΔH*. Perubahan warna label cerdas mempengaruhi nilai Lab* yang dihasilkan. Berdasarkan Xrite (2007), perubahan nilai Lab* dapat ditulis sebagai berikut:
1. Perubahan nilai L* (ΔL)
Nilai L* digunakan untuk menilai perubahan terang atau gelap suatu sampel. Nilai L* positif mengindikasikan sampel lebih terang dari sebelumnya dan nilai L* negatif mengindikasikan sampel lebih gelap dari sebelumnya.
ΔL* = L*0 – L* Dimana :
ΔL* = Perubahan nilai L* selama waktu tertentu L*0 = Nilai L* untuk sampel pada kondisi awal L* = Nilai L* untuk sampel selama waktu tertentu 2. Perubahan nilai a* (Δa)
Nilai a* memberikan parameter warna suatu sampel merah – hijau. Nilai a* positif menandakan sampel lebih merah dari sebelumnya dan nilai a* negatif menandakan sampel lebih hijau dari sebelumnya.
Δa* = a*0 – a * Dimana :
Δa* = Perubahan nilai a* selama waktu tertentu a*0 = Nilai a* untuk sampel pada kondisi awal a* = Nilai a* untuk sampel selama waktu tertentu 3. Perubahan nilai b* (Δb)
Parameter nilai b digunakan untuk memberikan nilai kuning – biru. Nilai b* positif menandakan sampel lebih kuning dari sebelumnya dan nilai b* negatif menandakan sampel lebih biru dari sebelumnya.
Δb* = b*0 – b* Dimana :
20
4. Total perubahan nilai Lab* (ΔE*)
Parameter ΔE digunakan untuk melihat tingkat perubahan nilai L*, a*, dan b* selama perubahan warna label cerdas. Semakin besar nilai ΔE* maka semakin besar pula perubahan atau perbedaan nilai L*, a*, dan b* yang terjadi. Selanjutnya jika nilai ΔE semakin kecil, maka perubahan atau perbedaan nilai L*, a*, dan b* juga semakin kecil.
ΔE* = (ΔL2+ Δa2+ Δb2)1/2 Dimana :
ΔE* = Perubahan nilai Lab* selama waktu tertentu ΔL* = Perubahan nilai L* selama waktu tertentu Δa* = Perubahan nilai a* selama waktu tertentu Δb* = Perubahan nilai b* selama waktu tertentu 5. Total perubahan tingkat saturasi warna (C* dan ΔC*)
Parameter C* digunakan untuk menilai tingkat saturasi warna yang dihasilkan. Semakin tinggi nilai C*, maka semakin tinggi saturasi warna yang
C* = Nilai saturasi sampel selama waktu tertentu a* = Nilai a* untuk sampel selama waktu tertentu b* = Nilai b* untuk sampel selama waktu tertentu ΔC* = Perubahan nilai C* selama waktu tertentu C*0 = Nilai saturasi sampel pada kondisi awal 6. Perubahan warna / hue (ΔH*)
Parameter ΔH digunakan untuk melihat perubahan warna yang terjadi pada label cerdas. Semakin besar nilai ΔH* maka semaikn besar perubahan warna. Begitu pula sebaliknya, semakin kecil nilai ΔH* maka semakin kecil pula perubahan warna yang terjadi.
ΔH* = (ΔE2–ΔL2–ΔC2)1/2 Dimana :
HASIL DAN PEMBAHASAN
Penentuan Jumlah Sel S. typhimurium dalam 100 mL Larutan BHI
Tingkat sensitivitas label cerdas dapat diketahui dari kemampuan dan waktu yang dibutuhkan label dalam mendeteksi jumlah awal sel bakteri yang ada. Jumlah awal sel berasal dari banyaknya sel bakteri yang dipipetkan ke media uji sensitivitas. Berdasarkan hasil pengamatan, jumlah sel yang dapat dihitung terdapat pada pengenceran 10-12.
Hasil perhitungan menunjukkan bahwa dalam satu ose kultur murni terdapat jumlah sel Salmonella typhimurium sebesar 2.2 x 1015 CFU / mL, sehingga dapat diketahui jumlah sel S. typhimurium pada pengenceran tingkat 10-12 adalah 2.2 x 100 CFU / mL. Jumlah bakteri Salmonella typhimurium dari kultur murni dan pengenceran 10-12 tersebut dipipetkan ke label cerdas dan media pertumbuhan pada saat uji sensitivitas label cerdas. Hal ini bertujuan untuk melihat kemampuan sensitivitas label cerdas dalam mendeteksi jumlah bakteri yang ada.
Pemilihan Bahan Media Indikator dan Uji Sensitivitas Label Cerdas
Pembuatan label cerdas pendeteksi Salmonella berdasarkan pada penelitian Warsiki et al. (2010) dan Lestari (2013). Berdasarkan penelitian tersebut diperoleh bahan utama pembuatan label cerdas yaitu agar bubuk 2 %, tepung tapioka 0.5 %, dan Gliserol 1 %. Agar bubuk berfungsi sebagai bahan viskositas atau pengental dan menyatukan setiap bahan. Tepung tapioka merupakan bahan pembuat film yang mempunyai struktur mekanis yang cukup baik, tetapi kurang baik sebagai penghambat uap air (Nugroho et al 2013). Gliserol merupakan cairan tidak berwarna, tidak berbau, dan merupakan cairan kental yang memiliki rasa manis, sedangkan peran gliserol ialah sebagai plasticizer dan konsentrasinya meningkatkan fleksibilitas film (Pagliaro et al 2008).
22
HEA tidak memperlihatkan perubahan warna secara jelas pada saat mendeteksi S. typhimurium.
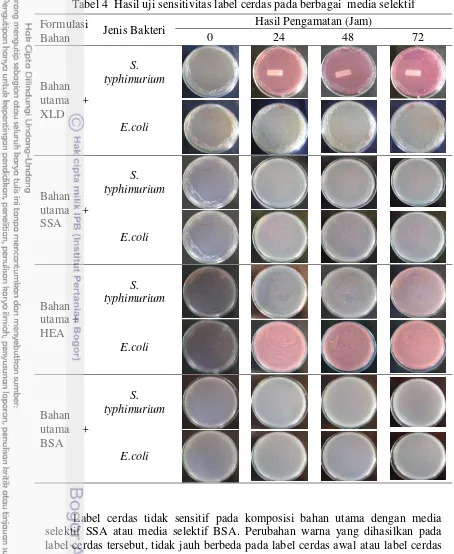
Berdasarkan hasil pengamatan, bahan utama dan media selektif XLD menghasilkan presentasi perubahan warna terbaik untuk mendeteksi bakteri S. typhimurium. Perubahan warna yang dihasilkan lebih terlihat jelas secara visual dan durabilitas perubahan warna lebih tahan lama. Sebaliknya pada bahan utama dan media selektif lainnya kurang terlihat jelas perubahan warna yang terjadi.
Metode kedua yaitu, membuat label pendeteksi S. typhimurium dari komposisi medium bahan biokimiawi yang dibutuhkan sebagai sumber energi bakteri S. typhimurium. Terdapat dua bahan utama komposisi medium yaitu phenol red dan Tetrathionate. Tabel 5 menunjukkan hasil uji sensitivitas label cerdas dengan bahan utama phenol red.
Tabel 5 Hasil uji sensitivitas label cerdas dengan indikator phenol red Bahan Jenis Bakteri Hasil Pengamatan (Jam)
0 24 48 72
Uji sensitivitas dari bahan utama dan phenol red menghasilkan perubahan warna dari kuning ke merah. Tidak terdapat perbedaan perubahan warna label cerdas dalam mendeteksi bakteri S. typhimurium dan E.coli. Hal ini disebabkan karena kedua bakteri tersebut menghasilkan suasana pH pada skala yang sama yaitu sebesar 6.8 – 8.4 yang dapat dideteksi oleh indikator pH phenol red.
Formulasi kedua dibuat dengan bahan utama, indikator phenol red, BHI, dan glukosa. Hasil uji sensitivitas menghasilkan perubahan warna dari merah ke kuning dalam mendeteksi S. typhimurium dan E. coli. Warna merah dari label cerdas berasal dari kondisi basa yang ditimbulkan oleh BHI. Kondisi basa tersebut ditangkap oleh sistem indikator phenol red dan membuat warna label cerdas menjadi merah. Nilai pH media BHI sebesar 7.2 – 7.6 dengan masa inkubasi optimum pada suhu 37oC dan waktu 24 – 48 jam.
24
secara langsung pada jam ke – 24. Faktor yang mempengaruhi tingkat sensitivitas label cerdas tersebut, disebabkan adanya media diperkaya BHI yang berfungsi sebagai sumber gizi dan energi bagi bakteri.
Formulasi label cerdas yang terbuat dari bahan indikator phenol red, merupakan formulasi label cerdas yang terlalu umum untuk dapat mendeteksi bakteri gram negatif Enterobacteriaceae. Label cerdas dari formulasi tersebut kurang selektif jika dibandingkan dengan label cerdas dengan media selektif XLD. Hal ini disebabkan media selektif memiliki bahan inhibitor (penghambat) pada media berupa Sodium deoxycholate untuk Enterobacteriaceae, sehingga bakteri gram positif lainnya dapat dihambat pertumbuhannya. Selektifitas suatu media bergantung pada jenis komponen penghambat yang digunakan. Komponen penghambat yang dapat digunakan oleh Enterobacteriaceae untuk mencegah mikroorganisme lain tumbuh adalah bile salts, brilliant green, dan sodium laurye sulphate (Baird et al. 1995).
Formulasi selanjutnya berasal dari indikator tetrathionate yang merupakan media pengayaan selektif khusus bakteri Salmonella sp. dengan menggunakan teknik mebran filter. Tabel 6 menunjukkan hasil uji sensitivitas label cerdas dengan indikator tetrathionate.
Tabel 6 Hasil uji sensitivitas label cerdas dengan indikator tetrathionate
Bahan Jenis Bakteri Pengamatan (Jam)
typhimurium dibandingkan dengan bakteri E.coli. Label cerdas tersebut juga menghasilkan warna hitam, yang berasal dari reaksi antara FAC dan H2S. Perubahan warna tersebut dihasilkan dari suasana asam hasil fermentasi glukosa.
Label yang dihasilkan pada formulasi kedua, menghasilkan perubahan warna yang tidak jauh berbeda dengan warna awal label cerdas. Seperti halnya formulasi pertama, untuk formulasi kedua menggunakan bahan yang sama akan tetapi tidak menggunakan komponen BHI. Oleh karena itu, tingkat sensitivitas pada label cerdas formulasi kedua lebih rendah dibandingkan dengan label cerdas pada formulasi pertama. Label cerdas yang menggunakan komponen tetrathionate menghasilkan sifat fisik yang tidak padat, sehingga sulit dijadikan bahan penyusun label cerdas. Perubahan warna dari uji sensitivitas label cerdas hanya dapat dilihat dari satu sisi, sehingga kurang dapat diaplikasikan menjadi label cerdas.
S. typhimurium tumbuh dan menghasilkan uji sensitivitas perubahan warna terbaik pada bahan utama + media selektif XLD. Pertumbuhan S. typhimurium ditunjukkan dengan berubahnya warna label cerdas dari cokelat transparan ke warna merah muda seperti yang ditunjukkan pada Gambar 12. Di samping itu media selektif XLD memiliki kandungan sodium deoxycholate sebagai bahan inhibitor bakteri gram positif, sehingga label cerdas lebih mudah mendeteksi bakteri gram negatif dan menghambat bakteri gram positif lainnya untuk dideteksi.
Gambar 12 Perubahan warna label cerdas dari cokelat transparan ke warna merah muda
Performa Label Dengan Penambahan PVA Terhadap Suhu Pengeringan
26
Hasil uji sensitivitas label cerdas pada suhu pengeringan 37oC, menunjukkan bahwa, label cerdas tanpa PVA dan label cerdas dan konsentrasi PVA 0.5 % memiliki durabilitas yang paling stabil dalam perubahan warna. Semakin tinggi konsentrasi PVA maka stabilitas perubahan warna akan semakin berkurang. Label cerdas dengan konsentrasi PVA 1%, 1.5%, dan 2% mengalami perubahan warna kembali menjadi kuning pada jam ke – 48 . Hal tersebut disebabkan oleh reaksi PVA yang menghambat S. typhimurium dalam mendekarbokilasi lisin, sehingga label cerdas mengalami penurunan nilai pH menjadi asam. Suasana asam tersebut kemudian dipresentasikan oleh sistem indikator phenol red menjadi warna kuning.
Tabel 7 Hasil uji sensitivitas label cerdas dengan suhu pengeringan 37oC berdasarkan konsentrasi PVA
Konsentrasi PVA (%)
Pengamatan (Jam)
0 24 48 0 (Tanpa
PVA)
0.5
1
1.5
2
Pada penelitian tahap ini, fungsi PVA pada label cerdas tidak memiliki pengaruh untuk menurunkan tingkat permebilitas dan membuat label cerdas tahan terhadap air. Hal ini disebabkan kondisi label cerdas bersifat basah yang pada umumnya nilai Aw minimal sebesar 0.94. Oleh karena itu pada tahap ini formulasi label cerdas yang positif mendeteksi S. typhimurium dan memiliki stabilitas warna terbaik adalah bahan utama + media selektif XLD.
yang kering, tipis, dan elastis seperti film. Pada metode tersebut pertumbuhan S. typhimurium tidak terlihat pada label cerdas. Hal ini disebabkan, salah satu
faktor pertumbuhan dari S. typhimurium yaitu adanya nilai aktivitas air minimal 0.94 dan maksimum > 0.99 (Bell dan Kyriakides 2002).
Hasil pengamatan menunjukkan bahwa bakteri S. typhimurium positif tumbuh pada label cerdas dengan suhu pengeringan 37oC. Label cerdas diduga memiliki nilai Aw sekitar 0.94 – 0.99 . Penelitian ini menghasilkan pemilihan formulasi label cerdas terbaik dalam mendeteksi S. typhimurium, yaitu bahan utama + media XLD. Di samping itu, penentuan formulasi dan konsentrasi PVA dipilih berdasarkan stabilitas perubahan warna yang terjadi.
Tabel 8 Hasil uji sensitivitas label cerdas dengan suhu pengeringan 50oC berdasarkan konsentrasi PVA Konsentrasi
PVA (%)
Pengamatan (Jam)
0 24 48 0 (Tanpa
PVA)
0.5
1
1.5
2
Pengaruh Konsentrasi XLD Terhadap Perubahan Visualisasi Warna Label
28
bakteri S. typhimurium. Hal ini dapat dilihat dari perubahan warna yang dapat dibedakan dari jam ke-0 sampai jam ke – 72. Untuk label cerdas dengan konsentrasi XLD 1 % dan 1.5 % memiliki warna awal pada jam ke-0 cokelat transparan dan berubah secara perlahan menjadi warna merah muda pada jam ke-24, 48, dan 72. Perbedaan hasil perubahan warna, pada kedua konsentrasi media XLD terlihat pada jam ke-24. Pada konsentrasi XLD 1 % perubahan warna ke merah muda cukup terlihat jelas, sedangkan label cerdas dengan konsentrsai XLD 1.5 % memiliki perubahan warna yang lebih terlihat jelas. Hal ini dapat terjadi karena komposisi komponen media selektif pada konsentrasi 1.5 % lebih banyak, sehingga lebih sensitif dalam mendeteksi S. typhimurium dan perubahan warna.
Tabel 9 Hasil perubahan visualisasi warna terhadap berbagai konsentrasi XLD
Konsentrasi
XLD (%) Keterangan
Pengamatan (Jam)
0 24 48 72
0.5
Kontrol
S.
typhimurium
1
Kontrol
S.
typhimurium
1.5
Kontrol
S.
typhimurium
2
Kontrol
S.
Label cerdas dengan konsentrasi XLD sebesar 0.5 % dan 2 % memiliki perubahan warna yang tidak terlalu terlihat dengan jelas. Pada konsentrasi XLD 0.5 %, perubahan warna yang terjadi tidak jauh berbeda dengan kontrol, sedangkan label cerdas dengan konsentrasi XLD 2 % memperlihatkan perubahan warna yang hampir sama, sehingga perbedaan warna tidak terlalu terlihat secara visual.
Sensitivitas Label Cerdas dalam Bentuk Sachet
Pemilihan label cerdas yang dipilih berdasarkan penelitian tahap sebelumnya, adalah bahan utama konsentrasi XLD 1 % dan bahan utama + konsentrasi XLD 1.5 %. Sifat fisik yang dihasilkan oleh label cerdas tersebut adalah basah seperti agar, padat, dan agak mudah patah. Berdasarkan sifat fisik label yaitu basah atau menmiliki nilai Aw yang cukup tinggi membuat tingkat kelarutan atau peluruhan warna label cerdas ke produk semakin tinggi. Untuk mencegah pewarna label cerdas luruh, maka digunakan metode pengemasan label cerdas dalam bentuk sachet.
Bahan pengemas yang digunakan sebagai sachet label cerdas adalah plastik Low Density Polyethylene (LDPE) yang memiliki tingkat permeabilitas tinggi, yaitu kemampuan suatu bahan dalam melewatkan partikel atau gas pada kondisi tertentu. Menurut Joseph (1984), tingkat permeabilitas dan transmisi uap air untuk plastik LDPE sebesar 550 cc/hari untuk O2 dan 2900 cc/hari untuk CO2. Tingkat permeabilitas yang tinggi tersebut dapat membuat bakteri S. typhimurium menembus permukaan plastik, sehingga label cerdas dapat mendeteksi bakteri S. typhimurium.
Label cerdas dalam sachet dilakukan dengan cara memotong label cerdas yang telah dicetak di cawan petri dengan ukuran 3 x 3 cm, kemudian dikemas dengan plastik LDPE. Pengujian sensitivitas label cerdas dilakukan pada dua perlakuan. Pertama label cerdas dalam sachet ditempatkan di bagian atas dalam tutup botol dan kedua diletakkan di bagian atas dalam cawan petri. Masing – masing botol dan cawan petri diisi dengan media umum BHI agar dan 0.1 mL kultur murni bakteri S. typhimurium, kemudian label cerdas diamati perubahan warna sebagai respon positif.
Pengujian sensitiftas label cerdas pada metode ini juga dilakukan untuk
mengetahui tingkat sensitivitas label cerdas dalam mendeteksi bakteri S. typhimurium berdasarkan jumlah sel. Pada penelitian sebelumnya, diketahui
30
Tabel 10 Hasil uji sensitivitas bentuk sachet label cerdas dalam botol
Bahan ∑
Perubahan warna label cerdas dengan mengunakan metode botol dan bahan media selektif 1 % memiliki tingkat sensitifitas dalam mendeteksi bakteri S. typhimurium. Label cerdas dengan media selektif XLD 1 % berubah warna ketika mendeteksi jumlah sel awal S. typhimurium 2.2 x 100 CFU / mL pada jam ke – 72. Adapun untuk jumlah awal sel S. typhimurium 2.2 x 1015 CFU / mL dapat berubah warna pada jam ke – 24 sampai akhir pengamatan jam ke – 72. Pada label cerdas dengan media selektif 1 % lebih mudah dapat mendeteksi jumlah sel S. typhimurium dalam jumlah yang banyak dibandingkan dengan mendeteksi bakteri S. typhimurium pada jumlah sedikit.
Berikutnya untuk label cerdas dengan media selektif 1.5 % sensitif untuk mendeteksi S. typhimurium pada jumlah sel awal sebesar 2.2 x 100 CFU / 0.1 mL dan 2.2 x 1015 CFU / mL pada jam ke – 48 sampai jam ke – 72. Walau demikian label cerdas yang dipipetkan jumlah sel sebesar 2.2 x 1015 CFU / mL mengalami perlambatan perubahan warna menjadi merah pada jam ke – 48.
Menurut Himedia (2011a), bakteri S. typhimurium di media XLD terlebih dahulu memfermentasikan xilosa sehingga menghasilkan suasana asam dengan pH yang rendah. Suasana asam tersebut dideteksi oleh pH indikator phenol red,
S. typhimurium mendekarboksilasi lisin yang termasuk dalam jenis asam amino dan meningkatkan pH menjadi basa. Suasana basa tersebut mengubah indikator pH phenol red warna label cerdas menjadi warna merah muda (fuschia).
Menurut Fardiaz (1992), salah satu faktor yang mempengaruhi fase pertumbuhan bakteri adalah jumlah sel awal yang dipipetkan. Jumlah sel awal yang lebih banyak akan lebih cepat memfermentasikan karbohidrat dari pada jumlah awal sel yang lebih sedikit. Pada label cerdas yang dipipetkan jumlah sel terbanyak yaitu 2.2 x 1015 CFU / mL lebih cepat memfermentasikan xilosa yang dapat dilihat melalui perubahan warna yang lebih kuning sampai jam ke – 24.
Warna kuning tersebut mengindikasikan bahwa label cerdas memiliki pH yang sangat rendah. S. typhimurium tidak dapat hidup pada kondisi pH di bawah 3.8, sehingga akan membuat bakteri S. typhimurium mengalami fase kematian, yaitu berkurangnya jumlah bakteri S. typhimurium yang masih hidup. Jumlah bakteri yang semakin kurang tersebut akan berdampak pada metabolisme bakteri, salah satunya yaitu kemampuan S. typhimurium untuk mendekarboksilasikan asam amino yang menjadi lebih lambat. Oleh karena iu perubahan warna pada label cerdas dengan media XLD 1.5 % yang dipipetkan jumlah sel awal sebesar 2.2 x 1015 CFU / mL lebih lambat perubahan warna menjadi merah muda pada jam ke – 48 dibandingkan label cerdas yang dipipetkan jumlah sel sebesar 2.2 x 100 CFU / mL.
Uji sensitivitas label cerdas dalam bentuk sachet di cawan petri menggunakan dua teknik yaitu cawan petri yang ditutupi dengan plastik wrap pada celah antar tutup dan wadah cawan petri dan cawan petri yang tidak ditutupi dengan plastik wrap. Tujuan metode tersebut adalah untuk menciptakan suasana fakultatif anaerobik bakteri S. typhimurium. Oksigen akan sulit untuk masuk ke dalam cawan petri yang ditutupi dengan plastik wrap, sedangkan pada cawan petri yang tidak ditutupi dengan plastik wrap akan mempermudah oksigen untuk masuk. Hasil uji sensitivitas metode label cerdas dalam sachet di dalam cawan petri yang ditutupi dengan plastik wrap dapat dilihat pada Tabel 11.
32
Label cerdas metode sachet dengan konsentrasi XLD 1 % dan 1.5 % tidak memiliki perbedaan dalam mendeteksi bakteri S. thypimurium dan perubahan warna. Kelebihan dari label cerdas dengan konsentrasi XLD 1 % ialah warna awal yang dihasilkan oleh label cerdas lebih transparan, sehingga lebih mudah terlihat perubahan warna secara visual. Selain itu, penggunaan material label cerdas dengan konsentrasi 1 % lebih hemat karena penggunaanya yang lebih sedikit. Penggunaan metode uji sensitivitas label cerdas di cawan petri yang tidak ditutupi dengan plastik wrap, menghasilkan perubahan warna yang cepat dan terlihat perbedaan warna yang jelas pada jam ke – 18.
Tabel 12 Hasil uji sensitivitas metode label cerdas dalam sachet di dalam cawan petri yang tidak ditutupi dengan plastik wrap
Bahan ∑ dipipetkan sel yang 0 18 Pengamatan (Jam) 24 48 72
Bahan utama + XLD 1 %
Kontrol
2.2 x 100 CFU / mL
2.2 x 1015
CFU / mL
Bahan utama + XLD 1.5 %
Kontrol
2.2 x 100 CFU / mL
2.2 x 1015
CFU / mL
34
Jumlah Sel S. typhimurium pada Label Cerdas dan Media Pertumbuhan
Perhitungan jumlah sel S. typhimurium di media pertumbuhan dan label cerdas dilakukan selama 96 Jam atau 4 hari untuk melihat durabilitas perubahan warna label cerdas. Sampel yang digunakan adalah label cerdas yang memiliki konsentrasi media selektif XLD sebesar 1 % dengan metode cawan petri yang tidak ditutupi plastik wrap. Waktu pengamatan dilakukan berdasarkan stabilitas perubahan warna pada uji sensitivitas label cerdas di cawan petri yang tidak ditutpi dengan plastik wrap.
Terdapat dua sampel pada pengujian yaitu, sampel A yang dipipetkan bakteri S. typhimurium sebesar 2.22 x 100 CFU / mL dan Sampel B yang dipipetkan bakteri S. typhimurium sebesar 2.2 x 1015 CFU / mL. Untuk mengetahui jumlah bakteri dilakukan uji Total Plate Count (TPC) berdasarkan berat sampel yaitu 20 g untuk media pertumbuhan dan 2 g untuk label cerdas. Hasil pengolahan data disajikan dalam bentuk per gram. Jumlah pertumbuhan sel S. typhimurium pada sampel A ditunjukkan pada Gambar 13.
Gambar 13 Jumlah sel S. typhimurium pada sampel A. Media pertumbuhan, Label cerdas.
Hasil analisis jumlah sel S. typhimurium di label cerdas sampel A selama pengamatan 96 jam memperlihatkan pada jam ke – 0 sampai jam ke – 6 jumlah sel di media pertumbuhan berturut – turut sebesar log 1.1 (12.63 CFU / g) dan log 1.81 (65 CFU / g), sedangkan di label cerdas tidak terdapat jumlah sel. Label peningkatan yang eksponensial yaitu sebesar log 12.27 (1.87 x 1012 CFU / g) dan
pada label cerdas jumlah sel sebesar log 3.83 (6.75 x 103 CFU / g). Perubahan warna terus terjadi pada jam ke – 96 dengan jumlah sel di media pertumbuhan sebesar log 10.36 (2.3 x 1010 CFU / g), sedangkan pada label cerdas jumlah sel sebesar log 4.05 (1.13 x 105 CFU / g). Gambar 14 menunjukkan jumlah pertumbuhan sel S. typhimurium pada sampel B.
Gambar 14 Jumlah pertumbuhan sel S. typhimurium pada sampel B. Media pertumbuhan, Label cerdas.
Seperti halnya sampel A, sampel B memiliki perubahan warna label cerdas yang baru terjadi pada jam ke – 24 sampai jam ke – 96. Walau demikian pada stasioner jumlah sel di media pertumbuhan sebesar log 6.92 (6.92 x 106 CFU / g), sedangkan pada label cerdas jumlah sel berturut – turut sebesar log 6.05 (1.13 x 106 CFU / g) dan log 4.22 (1.65 x 104 CFU / g). Perubahan warna masih terjadi pada jam ke – 96, dimana media pertumbuhan mengalami penururnan dengan jumlah sel sebesar log 5.26 (3.6 x 106 CFU / g) dan label cerdas sebesar log 3.89 (7.75 x 103 CFU / g). Data jumlah pertumbuhan sel S. typhimurium di label cerdas di sampel A dan sampel B dapat dilihat pada Lampiran 2 dan Lampiran 3.
Perubahan Warna Label Cerdas
Pada penelitian uji warna, label cerdas yang digunakan sama seperti yang digunakan untuk menghitung jumlah sel S. typhimurium. Terdapat dua sampel label cerdas yang berbeda yaitu label cerdas sampel A yang dipipetkan bakteri S.
36
typhimurium sebesar 2.22 x 100 CFU / mL dan Sampel B yang dipipetkan bakteri S,typhimurium sebesar 2.22 x 1015 CFU / mL. Perubahan warna akan dilihat berdasarkan perubahan terang atau gelap (ΔL*), parameter warna merah – hijau (Δa*), parameter warna kuning – biru (Δb*), dan perubahan warna (ΔH*). Penilaian uji warna tersebut dilakukan di lima titik sampel yaitu kanan atas, kanan bawah, tengah, kiri atas, dan kiri bawah. Selanjutnya hasil data dirata – rata kan dari pengambil di lima titik sampel. Sampel label cerdas yang diuji perubahan warna dapat dilihat pada Tabel 13. Data nilai perubahan warna label cerdas sampel A dapat dilihat pada Lampiran 4 dan Lampiran 5, sedangkan data nilai perubahan warna label cerdas sampel B dapat dilihat pada Lampiran 6 dan Lampiran 7.
Tabel 13 Sampel label cerdas untuk uji warna
Sampel Waktu Pengamatan (Jam)
0 6 24 48 72 96
A
B
Nilai L*
Gambar 15 Grafik nilai L*. Sampel A, sampel B.
Nilai a*
38
Nilai b*
Grafik pengolahan data perubahan rata – rata nilai b* untuk label cerdas selama waktu pengematan dapat dilihat pada Gambar 17.
Gambar 17 Grafik nilai b*. Sampel A, sampel B.
Nilai b* parameter untuk melihat suatu warna bahan kuning – biru. Peningkatan nilai b* mengartikan bahwa warna label cerdas lebih kuning dari sebelumnya, sedangkan penurunan nilai b* mengindikasikan bahwa warna label lebih biru dari sebelumnya. Berdasarkan grafik pada Gambar 17 dapat dilihat bahwa warna label cerdas sampel A lebih kuning dari sebelumnya karena terjadi peningkatan nilai b* sampai jam ke – 48. Selanjutnya pada jam ke – 72 dan jam ke – 96 terjadi penurunan nilai b* yang mengartikan bahwa warna sampel berubah menjadi lebih biru dari sebelumnya. Di samping itu untuk sampel B memperlihatkan penurunan nilai b* sampai jam ke – 72, dengan kata lain warna label cerdas lebih biru dari sebelumnya, sedangkan pada jam ke – 96 terjadi peningkatan nilai b* yang mengindkasiakn warna label berubah menjadi kuning dari sebelumnya.
Perubahan nilai ΔH*
Perubahan warna label cerdas dapat ditunjukkan melalui nilai ΔH*. Gambar 18 menunjukkan grafik perubahan rata – rata nilai ΔH* label cerdas selama waktu pengamatan. Peningkatan nilai ΔH* menunjukkan semakin besar pula perubahan warna. Begitu pula sebaliknya, semakin kecil nilai ΔH* maka semakin kecil pula perubahan warna yang terjadi.