PERBANDINGAN METODE SNI DENGAN METODE Salmonella
Latex Test UNTUK MEMANTAU PENCEMARAN Salmonella spp.
PADA KOTAK PENGANGKUTAN Day Old Chick (DOC)
TATIT DIAH NAWANG RETNO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Perbandingan Metode SNI
dengan Metode Salmonella Latex Test untuk Memantau Pencemaran Salmonella
spp. pada Kotak Pengangkutan Day Old Chick (DOC), adalah karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2009
Tatit Diah Nawang Retno
ABSTRACT
TATIT DIAH NAWANG RETNO. Comparison between SNI and Salmonella
Latex Text Method to Monitor Contamination of Salmonella spp. in Day Old
Chick (DOC) Boxes. Under direction of EKO SUGENG PRIBADI and TITIEK SUNARTATIE.
Fifty DOC boxes, which were supplied by five breeding company, was examined to Salmonella contamination. SNI and Salmonella latex test method were used for the research. The result indicated four boxes were positive which examined by SNI method and five boxes were positive which examined by
Salmonella latex testmethod.
With confidence level of 95% Salmonella latex test has sensitivity of 100% and specificity of 97.8% and the value of kappa statistic was 0.878 or excellent value.
Salmonella latex test are containing flagella antibody. This method need
time 24-hours faster and cheaper than SNI method. Salmonella latex test can be
used as an alternative screening test of Salmonella contamination in clinical or animal product samples. Unfortunately, this method is able to detect
flagella-Salmonella only.
Key word : Salmonella contamination, DOC transportation boxes, SNI method,
RINGKASAN
TATIT DIAH NAWANG RETNO. Perbandingan Metode SNI dengan Metode
Salmonella Latex Test untuk Memantau Pencemaran Salmonella spp. pada Kotak
Pengangkutan Day Old Chick (DOC). Dibimbing oleh EKO SUGENG PRIBADI
dan TITIEK SUNARTATIE.
Salmonella spp. adalah bakteri patogen utama penyebab demam typhoid dan penyakit pullorum pada unggas. Kecenderungan yang berkembang saat ini kasus salmonellosis banyak menyerang reptilia dan anak ayam umur sehari yang diperjualbelikan secara bebas. Jumlah kasus yang dilaporkan masih sedikit dibandingkan kejadian nyata di lapangan. Salah satu persyaratan untuk
melalulintaskan DOC di wilayah Republik Indonesia adalah, bebas avian
salmonellosis dengan menunjukkan bukti hasil laboratorium. Sebagai instansi yang berada pada garda depan, Badan Karantina Pertanian dituntut untuk melakukan pelayanan kepada pengguna jasa secara cepat dan profesional. Mengacu dari hal tersebut di atas, maka penelitian ini bertujuan untuk membandingkan metode baku yang digunakan, dalam hal ini metode SNI dan
metode uji cepat yaitu Salmonella latex test untuk memantau pencemaran
Salmonella spp. pada kotak pengangkutan DOC.
Metode yang digunakan dalam memantau pencemaran Salmonella spp. pada
kotak pengangkutan DOC adalah, yang pertama dengan menggunakan uji
kualitatif yang sesuai dengan SNI yang mengacu pada Bacteriological Analytical
Manual, Food and Drug Administration, AOAC International yang terdiri dari beberapa tahapan yaitu pra-pengayaan, pengayaan, isolasi dan identifikasi serta uji serologik. Metode yang kedua, menggunakan uji cepat yaitu Salmonella latex test sebagai uji presumtif Salmonella spp., dengan prinsip aglutinasi terhadap
antibodi yang terkandung di dalam Salmonella khususnya antibodi terhadap
antigen flagella. Sejumlah besar antigen flagella Salmonella digunakan untuk menghasilkan antisera polyvalent dalam kelinci. Antibodi yang telah dipurifikasi
digunakan untuk memberikan efek peka terhadap partikel latex.
Sebanyak 50 contoh kotak pengangkutan DOC diambil dari 5 perusahaan pembibitan ayam yang berbeda untuk diuji menggunakan dua metode pengujian. Metode pengujian pertama adalah Metode SNI dan metode pengujian kedua
menggunakan Salmonella latex test, untuk mengetahui adanya cemaran
Salmonella spp. pada kotak pengangkutan DOC. Dari hasil pengujian dengan
metode SNI menunjukkan 4 kotak tercemar Salmonella spp. atau sekitar 8% dari
total jumlah contoh. Dari hasil pengamatan terhadap koloni dan uji untuk isolasi dan identifikasi serta uji serologik didapatkan spesies S. Entertidis dari contoh yang diduga Salmonella.
Dari hasil pengujian menggunakan Salmonella latex test menunjukkan
5 kotak atau sekitar 10% tercemar Salmonella spp.. Dengan tingkat kepercayaan
95% hasil pengujian Salmonella latex test diperoleh kepekaan 100% dan
kekhususan 97,8%. Kepekaan adalah proporsi kotak pengangkutan DOC yang
tercemar Salmonella spp. yang memberikan hasil uji positif, sedangkan
kekhususan adalah proporsi kotak pengangkutan DOC yang tidak tercemar
Salmonella spp. yang memberikan hasil uji negatif. Nilai prediktif positif atau
yang bereaksi positif dengan metode Salmonella latex test sebesar 80% dan nilai prediktif negatif atau proporsi kotak pengangkutan DOC yang tidak tercemar
Salmonella spp. diantara contoh yang memberikan reaksi negatif dengan
menggunakan metode Salmonella latex test sebesar 100%.
Dengan adanya perbedaan hasil antara metode SNI dan Salmonella latex test
maka dianalisis dengan menggunakan analisis statistik kappa untuk menguji kesesuaian dua pengujian. Metode baku memberikan prevalensi yang nampak
sebesar 0,08, sedangkan dengan metode Salmonella latex test memberikan
prevalensi sebesar 0,1. Kedua metode tersebut sama-sama memberikan reaksi positif terhadap 8% dari keseluruhan contoh yang diperiksa. Data ini memberikan indikasi pengujian yaitu proporsi positif yang lebih besar daripada yang lain dan arahan untuk menghitung kesesuaian diantara kedua metode yang digunakan. Nilai kappa yang diperoleh sebesar 0,878 yang berarti bagus sekali atau
kesesuaian antara pengujian dengan metode SNI dan Salmonella latex test
menunjukkan nilai bagus sekali.
Metode Salmonella latex test juga memiliki keuntungan dan kerugian.
Keuntungan penggunaan metode ini adalah menyingkat waktu 24 jam lebih cepat serta memerlukan biaya yang lebih hemat dibandingkan metode SNI. Kerugian
Salmonella latex test adalah hanya spesies Salmonella yang berflagella yang dapat terlacak oleh alat uji ini.
Dengan adanya cemaran S. Enteritidis pada kotak pengangkut DOC,
menjadikan kotak pengangkut sebagai sumber penularan bagi orang-orang yang bersentuhan langsung dengan kotak pengangkut DOC tersebut. Misalnya pekerja kandang, penjual DOC dan anak-anak yang membeli DOC yang diperjualbelikan secara bebas, tenaga kesehatan hewan ataupun petugas di laboratorium yang menangani pemeriksaan cemaran mikroba.
Tindakan yang dapat dilakukan untuk mencegah terjadinya penularan salmonellosis, yang berasal dari kotak pengangkutan DOC adalah dengan cara membakar kotak tersebut setelah DOC dibongkar di tempat tujuan dan mengkampanyekan anjuran cuci tangan setelah menangani atau memegang hewan piara terutama DOC. Pencegahan terhadap pentingnya menjaga higienitas diri dilakukan pada semua kelompok umur baik anak-anak maupun orang dewasa. Pencegahan dilakukan terutama bagi mereka yang rentan terpapar oleh cemaran
Salmonella khususnya bagi petugas karantina. Tindakan pencegahan seperti tersebut di atas harus dilakukan untuk memutus mata rantai penularan salmonellosis dan demi terwujudnya wilayah Negara Republik Indonesia yang bebas penyakit hewan menular.
Salmonella latex test lebih efektif dan efisien dibandingan dengan metode SNI. Salmonella latex test dapat digunakan sebagai uji tapis, baik pada contoh klinis maupun produk peternakan untuk hasil yang cepat dan akurat. Hasil pengujian cepat dan akurat sangat diperlukan terutama bagi instansi seperti karantina sebagai garda terdepan dalam lalulintas hewan dan produk hewan
Kata kunci : cemaran Salmonella, kotak pengangkutan DOC, metode SNI,
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah;
b. dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PERBANDINGAN METODE SNI DENGAN METODE
Salmonella Latex Test UNTUK MEMANTAU PENCEMARAN
Salmonella spp. PADA KOTAK PENGANGKUTAN Day Old
Chick (DOC)
TATIT DIAH NAWANG RETNO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Perbandingan Metode SNI dengan Metode Salmonella Latex
Test untuk Memantau Pencemaran Salmonella spp. pada
Kotak Pengangkutan Day Old Chick (DOC)
Nama : Tatit Diah Nawang Retno
NIM : B251064114
Disetujui Komisi Pembimbing
Dr. drh. Eko Sugeng Pribadi, M.S. drh. Titiek Sunartatie, M.S.
Ketua Anggota
Diketahui
Ketua Program Studi Kesehatan Masyarakat Veteriner
Dekan Sekolah Pascasarjana
Dr. drh. Denny Widaya Lukman, M.Si. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Tanggal Ujian : 15 Januari 2009 Tanggal Lulus :
PRAKATA
Puji Syukur pada Tuhan Yang Maha Kasih penulis panjatkan yang telah mengkaruniakan berkat anugerah dan kesempatan kepada penulis sehingga dapat menyelesaikan tesis ini. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2008 ialah Perbandingan Metode SNI dengan Metode
Salmonella Latex Test untuk Memantau Pencemaran Salmonella spp. pada Kotak
Pengangkutan Day Old Chick (DOC).
Pada kesempatan ini, penulis menyampaikan terima kasih kepada Dr. drh. Eko Sugeng Pribadi, M.S. selaku Ketua Komisi Pembimbing dan drh. Titiek Sunartatie, M.S. selaku Anggota Komisi Pembimbing yang telah memberikan arahan dalam penulisan tesis ini, Dr. Drh. Denny Widaya Lukman, M.Si. selaku Ketua Program Studi Kesehatan Masyarakat Veteriner, serta seluruh staf pengajar pada Program Studi Kesehatan Masyarakat Veteriner yang telah membimbing, mengarahkan, membantu dan memberikan saran-saran kepada penulis.
Penulis juga menyampaikan penghargaan setinggi-tingginya kepada Badan Karantina Pertanian yang telah memberikan beasiswa serta ijin belajar sehingga penulis dapat menempuh pendidikan magister pada Program Studi Kesehatan Masyarakat Veteriner Institut Pertanian Bogor, serta khususnya kepada Ir. Syukur Iwantoro, M.S, MBA. yang memacu, mendorong dan memberi cambuk semangat bagi penulis dalam menyelesaikan seluruh tugas dan kewajiban untuk meraih gelar Magister Sains.
Kepada Drh. Bambang Erman, penghargaan dan terima kasih penulis sampaikan atas ijin yang diberikan kepada penulis demi lancarnya penyelesaian tugas-tugas akhir serta arahan dan masukannya kepada penulis.
Selain itu penulis juga mengucapkan terimakasih kepada suami dan anak-anak tercinta, drh. Sintong HMT Hutasoit, M.Si., Keyra Beatrice Maduma Putri Hutasoit dan Kevin Leondra Sahatma Raja Putra Hutasoit, Papa dan Mama di Yogyakarta, Bapak (Alm) dan Mama di Siborongborong serta keluarga besar R. Soewito dan keluarga besar Hutasoit atas perhatian, pengertian dan kasihnya selama ini.
Ucapan terimakasih juga diberikan kepada Bpk. Agus Haryanto yang telah memberikan waktu, tenaga dan kesabarannya pada penulis dalam menyelesaikan tesis ini serta Ibu Esih dan Bapak Ismet, staf laboratorium Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, IPB atas bantuan dan arahannya selama ini.
Ungkapan terima kasih disampaikan juga kepada Kepala Pusat Karantina Hewan, Balai Besar Karantina Pertanian Soekarno-Hatta, teman-teman Program Khusus S2 Karantina, rekan-rekan di bidang Karantina Hewan Ekspor dan Antar Area atas perhatian, dukungan dan kerjasamanya selama ini.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Yogyakarta pada tanggal 2 Januari 1976 sebagai putri pertama dari 3 bersaudara pasangan dr. Purnomo Subagyo, M.Sc. dan Widiarti Rumendah. Penulis menyelesaikan pendidikan dasar di Sekolah Dasar Negeri Ungaran II Yogyakarta tahun 1988, pendidikan Sekolah Menengah Pertama Negeri 5 Yogyakarta tahun 1991 dan pendidikan Sekolah Menengah Atas Negeri 8 Yogyakarta tahun 1994.
Pada tahun 1994 penulis menempuh pendidikan di Fakultas Kedokteran Hewan Universitas Gadjah Mada Yogyakarta dan menyandang gelar Dokter Hewan pada tahun 2000.
Penulis menikah dengan drh. Sintong HMT Hutasoit, M.Si. pada tanggal 28 Oktober 2000 di Yogyakarta dan dikaruniai dua orang anak, putri dan putra, yang pertama Keyra Beatrice Maduma Putri Hutasoit dan yang kedua Kevin Leondra Sahatma Raja Putra Hutasoit.
DAFTAR ISI
Diagnosis Salmonella……….. 4 6 8 11 15 Uji Cepat terhadap Cemaran Salmonella……….. 15MATERI DAN METODE……… 16
Waktu dan Tempat……… 16
Alat dan Bahan………. 16
Metode Pengujian……… 17
Pengujian Salmonella spp. dengan Metode SNI……….. Pengujian Salmonella spp. dengan Salmonella Latex Test……… Rancangan Penelitian……… 17 24 24 Analisis Data………. 25
HASIL DAN PEMBAHASAN………. 26
Hasil Pengujian Salmonella spp. dengan Metode SNI………….
Hasil Pengujian Salmonella spp. dengan Metode Salmonella
Latex Test………... 26
28
Evaluasi Cemaran Salmonella spp. dengan Metode SNI dan
Salmonella Latex Test……… 28
Pencemaran S. Enteritidis pada Kotak Pengangkutan DOC 31
KESIMPULAN DAN SARAN………. Kesimpulan……….. Saran………
33 33 33
DAFTAR TABEL
Halaman
1 Observasi studi veteriner terhadap salmonellosis dengan hipotesis
faktor risiko berdasarkan spesies………. 10
2 Diagnosis salmonellosis……….. 13
3 Serotipe Salmonella beserta gejala klinisnya……….. 14
4 Hasil uji Salmonella spp. pada TSIA dan LIA ………... 18
5 Reaksi biokimiawi Salmonella……….... 23
6 Gambaran koloni dari media HEA dan uji biokimiawi contoh yang diduga positif Salmonella……… 27 7 Hasil uji Salmonella dengan metode SNI dan Salmonella latex test... 28
8 Proporsi populasi yang diklasifikasi-silangkan berdasarkan hasil uji
DAFTAR GAMBAR
Halaman
1 Penularan salmonellosis (kecuali S. Typhi dan Paratyphoid)…………. 6
2 Koloni Salmonella pada media HEA dari 6 contoh yang diduga
positif... 27 3
4
Hasil uji khas Salmonella pada media TSIA dan LIA………...
Gambaran aglutinasi pada contoh positif Salmonella spp. dengan
metode Salmonella latex test………
PENDAHULUAN
Latar Belakang
Salmonella spp. merupakan mikroorganisme yang dikenal sebagai major food borne pathogen pada manusia dan menyebar di seluruh dunia. Di Amerika
Serikat dilaporkan setidaknya terdapat 800.000 sampai 4 juta infeksi Salmonella
setiap tahunnya dan sekitar 500 dari kasus tersebut bersifat fatal (Ahmed et al. 2005).
Kecenderungan yang berkembang saat ini kasus salmonellosis tidak hanya sebatas pada keracunan makanan tetapi sudah dapat diisolasi dari reptilia dan
unggas umur sehari (day old chick, DOC) yang diperjualbelikan untuk mainan
anak-anak. Tingkat kejadian ditemukannya Salmonella dalam kasus ini dapat
mencapai 76.000-140.000 kasus per tahunnya (Warwick et al. 2001).
Secara resmi kejadianluar biasayang disebabkan oleh Salmonella di
Indonesia belum banyak dilaporkan. Kasus salmonellosis di Indonesia
diperkirakan sebanyak 60.000 hingga 1.300.000 kasus dengan sedikitnya 20.000
kematian per tahun (Suwandono et al. 2005). Di negara-negara maju seperti
Amerika Serikat telah banyak dilaporkan adanya kejadian luar biasa
salmonellosis. Namun persentase jumlah yang dilaporkan masih terlalu kecil dibandingkan dengan wabah yang sebenarnya terjadi.
Salmonella tidak hanya menyerang hewan ternak tetapi juga menyerang hewan piaraan dan dapat diisolasi dari bahan autopsi yang terdiri dari organ, darah dan feses (PAHO 2003).
Avian salmonellosis telah ada di berbagai peternakan dengan tingkatan yang
berbeda. Pada umumnya penyakit tradisional misalnya fowl typhoid dan pullorum
telah dapat dikendalikan dengan baik meskipun penyakit ini masih tetap banyak di beberapa negara di Amerika Selatan dan Amerika Tengah, Eropa Timur, Asia,
Afrika. Bagaimanapun juga infeksi paratyphoid salmonellosis masih merupakan
peternakan pembibitan. Kuman Salmonella dapat ditemukan pada pengumpulan contoh dari peternakan asal atau dari kotak pengangkutan unggas/burung.
Peneguhan adanya pencemaran Salmonella dapat diambil dari contoh lingkungan
tanpa menyebabkan unggas mengalami cekaman (Zancan et al. 2000).
Permasalahan
Semua produk pertanian khususnya hewan dan produk hewan yang dilalulintaskan dari dan ke dalam wilayah Negara Republik Indonesia maupun antar pulau harus memenuhi beberapa persyaratan yang terkait dengan tugas pokok dan fungsi karantina, yaitu mencegah masuk dan tersebarnya hama dan penyakit hewan karantina. Salah satu persyaratan yang dibutuhkan untuk
pengangkutan antar area khususnya pemasukan day old chicks (DOC) adalah
dilengkapi Surat Keterangan Kesehatan yang didalamnya memuat pernyataan tentang persyaratan yang mengharuskan bahwa dari peternakan asal dalam waktu
6 bulan harus bebas Salmonella yang dibuktikan dengan uji laboratorium dan
tidak ada bukti gejala klinis avian salmonellosis.
Penentuan adanya pencemaran Salmonella perlu dibuktikan dengan uji
laboratorium. Metode pengujian Salmonella untuk sampel yang berasal dari
lingkungan dalam hal ini adalah kotak pengangkutan DOC adalah metode yang diambil dari SNI. Metode lain yang telah ada di Badan Karantina Pertanian untuk
menguji adanya cemaran Salmonella adalah metode cepat menggunakan
Tujuan Penelitian
Penelitian ini bertujuan untuk membandingkan metode SNI dengan Salmonella
latex test untuk memantau pencemaran Salmonella spp. pada kotak pengangkutan DOC.
Manfaat Penelitian
Penelitian ini diharapkan memberi manfaat berupa pembuktian penggunaan uji
yang efektif dan efisien dalam melacak adanya pencemaran Salmonella spp.
khususnya pada kotak pengangkutan DOC, sehingga dapat digunakan sebagai uji baku melacak Salmonella spp. pada instansi karantina.
Hipotesis Penelitian
Hipotesis yang diajukan pada penelitian ini adalah:
H0 : metode Salmonella latex test kurang efektif dan efisien untuk
memantau pencemaran Salmonella spp. pada kotak pengangkutan
DOC dibandingkan metode SNI.
H1 : metode Salmonella latex test lebih efektif dan efisien untuk memantau
pencemaran Salmonella spp. pada kotak pengangkutan DOC
dibandingkan metode SNI.
TINJAUAN PUSTAKA
Salmonella spp. merupakan bakteri berbentuk batang langsing, tidak membentuk spora, bersifat Gram negatif, aerobik atau fakultatif aerobik serta katalase positif dan oksidase negatif. Sifat katalase positif bakteri Salmonella artinya bakteri ini memiliki enzim katalase untuk memecah peroksidase menjadi H2O dan O2. Sifat oksidase negatif Salmonella adalah bakteri ini tidak memiliki enzim superoksida dismutase yang dapat mengubah H2 menjadi peroksida. Bakteri ini kadang-kadang memproduksi asam dan gas dari fermentasi glukosa atau laktosa. Sifat yang lain adalah mereduksi nitrat menjadi nitrit, tumbuh cepat pada berbagai macam media, hidup pada pH 4-9 dan beberapa pada pH 3,7, dapat tumbuh pada kisaran suhu 5-45 0C dengan suhu optimum 35-37 0C, bertahan pada suhu terendah 5,3 0C untuk S. Heidelberg dan 6,2 0C untuk S. Typhimurium. Bakteri ini menghasilkan koloni yang dapat terlihat dengan jelas pada suhu 37 0C selama 24 jam dan tidak dapat bertahan hidup pada konsentrasi garam di atas 9%, serta memiliki nilai aw optimal yaitu 0,96-0,999. Salmonella pertama kali diisolasi oleh Salmon dan
Smith pada tahun 1885 dari seekor babi yang terinfeksi hog cholera, selanjutnya
spesies Salmonella tersebut dinamakan S. Cholera-suis (PAHO 2003).
Kaufmann dan White (1966) dalam Quinn et al. (2002) membedakan Salmonella
berdasarkan sifat antigennya. Salmonella dan jenis Enterobacteriaceae
mempunyai beberapa jenis antigen yaitu O (somatik), H (flagella), K dan Vi (Kapsul). Antigen O mengandung glikosamin. Antigen H merupakan protein yang disebut flagellin dan bersifat tidak tahan panas. Antigen K terdapat pada
permukaan luar bakteri, terdiri dari polisakarida dan tidak tahan panas. Antigen Vi
terdapat pada beberapa galur Salmonella misalnya S. Typhi yang mempengaruhi
daya virulensi.
Genus Salmonella terbagi menjadi dua spesies besar yang pertama adalah S.
enterica dan yang kedua adalah S. bongori. S enterica terdiri dari lebih 2.400 serotipe. S.enterica var. typhimurium sekarang ini dikenal dengan nama
S. Typhimurium dan S. enterica var. enteritidis yang dikenal dengan nama S.
Enteritidis(Gray dan Fedorka-Cray 2002).
Menurut PAHO (2003) nama spesies yang diterima oleh the International
Committee on Systematic Bacteriology adalah sebagai berikut: S. Typhi, S.
lagi menjadi 2.000 serotipe tergantung kepada antigen somatik dan flagella yang dimiliki. Serotipe paratifoid dari S. Typhi dan S. Enteritidis, Paratyphi A dan
Paratyphi C merupakan spesies Salmonella yang khas pada manusia. Serotipe
Paratyphi B dijumpai pada sapi, babi, anjing dan unggas. S. Cholera-suis dan beberapa serotipe S. Enteritidis seperti Gallinarum,Pullorum, Abortus equi dan Dublin teradaptasi pada hewan dan dapat ditularkan juga ke manusia. Sebagian besar serotipe dari S. Enteritidis merupakan bakteri dari berbagai jenis hewan, vertebrata dan invertebrata. S. Arizonae mempunyai kurang lebih 300 serotipe. Terdapat lebih dari 2.500 serotipe Salmonella yang tersebar di seluruh dunia, diantara serotipe tersebut yang menyerang unggas adalah S. Pullorum dan S.
Gallinarum.
Serotipe Salmonella mempunyai induk semang khas. S. Thypi dan S. Paratyphi menyerang manusia dan menimbulkan tanda-tanda gangguan pencernaan serta dema tifus dan paratifus. S. Dublin menyerang ternak sapi, S. Abortus equi
menyerang kuda, S. Typhimurium terutama menyerang itik dan rodensia,
sedangkan S. Pullorum dan S. Gallinarum menyerang ayam (Anonimus 2004). S.
Gallinarum dan S. Pullorum merupakan agen penyebab fowl thypoid atau penyakit
pullorum yang ditandai dengan diare berwarna kehijauan. Juga, dapat
menyebabkan penyakit kronis saluran genitalis yang dapat menurunkan produksi telur dengan tingkat kematian sampai 100% (Proux et al. 2002).
S. Enteritidis dikenal sebagai patogen yang penting, baik pada unggas maupun
manusia. Kasus keracunan makanan pada manusia berkaitan erat dengan
meningkatnya jumlah ayam dan telur ayam yang tercemar oleh serotipe S.
Enteritidis (Thorns et al. 1996). Bakteri ini bertahan hidup pada waktu yang lama dalam lingkungan (Hopper dan Mawer 1988).
Habitat alami kuman Salmonella adalah saluran pencernaan walaupun dapat
ditemukan juga di organ lain seperti kelenjar limfe, limpa, hati, empedu, jantung, paru-paru, urat daging, sumsum tulang dan periosteum. Hewan dan unggas yang
menderita salmonellosis dapat menjadi pembawa (carrier) yang menetap
Penularan Salmonella
Penularan Salmonella pada manusia terjadi karena menelan organisme yang
ada di dalam makanan yang berasal dari hewan yang terinfeksi atau makanan yang tercemar oleh kotoran hewan atau kotoran orang yang terinfeksi. Penularan juga terjadi dari bahan-bahan makanan seperti telur, produk telur yang tidak dimasak dengan baik, air yang tercemar, daging dan produk daging, unggas dan produk unggas. Salmonellosis juga dapat ditularkan melalui hewan piara seperti kura-kura, iguana, anak ayam atau obat-obatan berbahan dasar hewan yang tidak disucihamakan (Anonimus 2005).
hewan carier & sakit hewan rentan
Gambar 1 Penularan salmonellosis ( kecuali S.Typhi dan Paratyphoid )
Salmonella memperbanyak diri dalam saluran pencernaan hewan yang terinfeksi maupun hewan pembawa selanjutnya akan dikeluarkan melalui feses. Feses yang tercemar akan mencemari makanan dan lingkungan dan akan
termakan oleh hewan yang rentan terhadap Salmonella. Manusia terinfeksi
Salmonella karena memakan bahan pangan asal hewan, air dan sayuran yang tercemar. Penularan Salmonella dari manusia ke manusia lainnya melalui rute fekal-oral (PAHO 2003).
Pencemaran makanan dan lingkungan
Rute fekal-oral
feses termakan
Memakan makanan asal hewan
Jalur utama penularan S. Enteritidis secara vertikal melalui telur dan secara horizontal melalui rute fekal oral (Hopper dan Mawer 1988).
Penularan parathypoid salmonella secara oral pertama kali karena adanya
kolonisasi di dalam saluran pencernaan, dan selalu berakhir pada perlekatan yang menetap dalam feses. Invasi ke dalam saluran pencernaan memicu perbanyakan
Salmonella dalam sistem makrofag pada organ hati dan limpa dan menyebar ke seluruh jaringan. Bakterimia dapat terjadi setelah melalui tahap-tahap tersebut dan berakhir kepada kematian (Thiagarajan et al. 1994)
PAHO (2003) menyatakan S. Typhi dan S. Paratyphoid merupakan serotipe
yang dominan pada manusia, dan hewan berperan sebagai sumber penularan
Salmonella. Makanan yang sering menyebabkan infeksi Salmonella pada manusia pada umumnya berasal dari unggas, babi, sapi, telur, susu dan hasil olahannya. Makanan yang berasal dari sayuran yang tercemar oleh produk-produk hewan, kotoran manusia, pengolahan komersil juga merupakan sumber cemaran
Salmonella. S. Typhi dan beberapa Salmonella lainnya juga dapat mencemari air yang digunakan sebagai sumber air bersih.
Di Amerika Serikat pernah dilaporkan adanya kematian 2 orang anak kecil karena salmonellosis dari reptil yang menjadi hewan piara. Sementara kejadian kasus salmonellosis karena reptil seperti kura-kura mencapai 280.000 kasus per tahunnya (Warwick et al. 2001).
Berdasarkan penelitian yang dilakukan oleh Nakamura di Jepang pada tahun 1986 menunjukkan bahwa 10% dari total produk hewan yang diproduksi tercemar oleh Salmonella dan dari seluruh persentase tersebut mayoritas oleh spesies S. Enteritidis, sedangkan penelitian yang dilakukan di Amerika Serikat
menunjukkan bahwa produk hewan yang tercemar oleh Salmonella sebanyak 24%
(Nakamura et al. 1994).
Selama tahun 2006, Departemen Kesehatan Amerika Serikat melaporkan adanya
tiga kasus wabah infeksi Salmonella pada orang yang pernah kontak dengan anak
ayam, anak itik, anak angsa dan anak kalkun yang dijual di toko pertanian (Bidol
Di Indonesia telah dilakukan pemantauan dan surveilans terhadap kasus salmonellosis. Data dari Rumah Sakit yang menangani penyakit infeksius di Jakarta melaporkan bahwa kasus demam tifoid terus meningkat, dari 11,4% menjadi 18,9% selama tahun 1983-1990. Pada periode tahun 1991-1996 penyakit meningkat dari 22% sampai 36,5%. Kejadian demam tifoid yang dilaporkan oleh Pusat Kesehatan dan Rumah Sakit di Jakarta menyebutkan bahwa penyakit terus meningkat dari 92% menjadi 125% per 100.000 penduduk per tahun selama tahun 1994-1996 (Sujudi 1998). Angka kematian (mortalitas) penyakit menurun dari 3,4% pada tahun 1981 menjadi 0,6% pada tahun 1996. Menurunnya angka kematian dipengaruhi oleh adanya perbaikan fasilitas kesehatan (Arjoso dan Simanjuntak 1998).
Salmonellosis pada Anak Ayam
Umur merupakan salah satu faktor penting ketika terpapar Salmonella.
Milner dan Shaffer (1990) dalam Bailey et al. (1994) mengamati bahwa dosis dan
jumlah hari mempengaruhi dosis kolonisasi pada anak ayam ketika ditantang
secara oral dengan 10 serotipe Salmonella. Anak ayam umur sehari dapat
terinfeksi Salmonella kurang dari lima sel dan infeksi lanjutan bersifat tidak terpola dan setelah itu dapat mencapai dosis tertinggi (Bailey et al. 1994).
Tingkat infeksi dalam saluran pencernaan dibuktikan oleh perlekatan fekal
berkorelasi dengan usia unggas dan dosis inokulum. Rute paparan Salmonella
juga memegang peranan penting dalam kolonisasi. Pada suatu penelitian yang dilakukan oleh Cox (1992) dalam Corrier et al. (1997) disebutkan suatu hipotesis bahwa rendahnya pH dari saluran pencernaan bagian atas memberikan peranan
yang besar pada peningkatan Salmonella pada anak ayam melalui rute oral.
Pergerakan dan lokalisasi Salmonella ketika pertama kali pada anak ayam belum
dapat dijelaskan secara pasti. Salmmonella mungkin bertranslokasi ke organ
lainnya. Salmonella dapat ditemukan pada hati ayam setelah diinokulasi secara
terinfeksi menunjukkan gejala depresi, lemah dan diare (Wray et al. 1996). Tingkat kematian sangat tinggi pada anak ayam umur di bawah satu minggu. Ayam dewasa yang terinfeksi menunjukkan pertumbuhan yang lamban serta adanya lesi fokal, perikarditis dan septikemia (Lister 1988). Bakteri ini bertahan
hidup untuk waktu yang lama dalam lingkungan (Hopper dan Mawer 1988). S.
Enteritidis ditemukan pada unggas dan masuk ke dalam peternakan karena adanya populasi rodensia di peternakan ayam. S. Enteritidis dapat menginfeksi ayam tanpa menimbulkan gejala-gejala penyakit khususnya pada ayam petelur (Cogan dan Humphrey 2003).
S. Enteritidis dikenal sebagai patogen yang penting, baik pada unggas maupun manusia. Kasus keracunan makanan pada manusia berkaitan erat dengan meningkatnya jumlah ayam yang tercemar oleh serotipe S. Enteritidis (Thorns et
al. 1996). Terdapat tiga macam serotipe yang berkaitan dengan food-borne
disease yang terjadi di negara-negara Eropa, Amerika dan Inggris. Wabah salmonellosis tersebut disebabkan oleh S. Enteritidis phage tipe 4, 8 dan 23. Dari beberapa tipe tersebut, tipe phage 4 merupakan serotipe yang paling patogen terhadap ayam (Dhillon et al. 1999). Di Indonesia S. Enteritidis tipe phage 4 awalnya ditemukan dari anak ayam umur sehari (DOC) yang berasal dari
peternakan pembibitan parent stock maupun grand parent stock (Poernomo
2000).
Salmonella secara cepat dapat menembus dinding dan membran telur tetas. Kondisi selama masa inkubasi dapat yang padanya meningkatkan proliferasi sel bakteri ke dalam usus. Setiap orang, binatang, arthropoda, tumbuh-tumbuhan, tanah atau barang-barang, atau kombinasi dari keduanya, yang padanya Salmonella dapat hidup dengan baik, merupakan sumber utama bagi jalur
penularan Salmonella ke dalam telur tetas. Reservoir dapat bertahan dalam
kondisi yang optimal dan hanya dapat disingkirkan setelah telur-telur tersebut difumigasi (Cox et al. 1991). Salmonella yang telah berproliferasi ke dalam membran telur akan tertelan oleh embrio dan bertahan di dalam tubuh embrio sampai masa penetasan. Anak ayam yang telah ditetaskan dan terinfeksi
ayam yang baru menetas sangat berbahaya karena anak ayam tersebut belum
memiliki mikroflora saluran pencernaan yang matang dan Salmonella akan
berkolonisasi secara cepat di dalam saluran pencernaan anak ayam tersebut (Blankenship et al. 1993).
Ternak ayam yang tidak memperlihatkan gejala klinis dan mati, atau ayam sembuh dari infeksi, dapat menjadi pembawa menahun yang sewaktu-waktu dapat mengeluarkan bakteri S. Enteritidis melalui fesesnya (Gast 1997).
Penularan salmonellosis pada hewan tergantung dari beberapa faktor risiko. Faktor-faktor risiko tersebut diantaranya dapat dilihat pada Tabel 1 dibawah ini.
Tabel 1 Observasi studi veteriner terhadap salmonellosis dengan hipotesis faktor risiko berdasarkan spesies
Species Penyakit HipotesaFaktorResiko Referensi
Kuda Infeksi
Salmonella spp.
Ras, jenis kelamin, penampilan, keluhan, tindakan darurat, status pra operasi, prosedur pemberian (mis. anestesi, antibiotik)
Hird et. al (1984-1986)
Sapi Salmonellosis Tata laksana, faktor produksi dan lingkungan. Rekam medis adanya retensi plasenta
Bendixen, et.al (1986a) Vandegraaff (1980) Rowlands et.al. (1986)
Un ggas Salmonellosis Daerah geografi, tipe ventilasi, ukuran kawanan ternak, tipe peternakan, tata laksana dan higienitas sumber pakan
Graat et.al. (1990)
Sumber : Thrusfield (1995)
Menurut Graat et al. (1990) dalam Thrusfield (1995) terdapat beberapa faktor risiko yang mempengaruhi kejadian salmonellosis pada hewan. Daerah geografis, tipe ventilasi peternakan, ukuran atau jumlah hewan dalam suatu peternakan, tipe peternakan serta tatalaksana dan higienitas sumber pakan
merupakan faktor-faktor yang mempengaruhi infeksi Salmonella pada unggas.
Salmonellosis pada Manusia
Salmonella mungkin terdapat dalam jumlah yang tinggi pada makanan yang dimakan manusia, walaupun tidak selalu menimbulkan perubahan dalam hal warna, bau maupun rasa dari makanan tersebut. Pada umumnya, semakin tinggi
jumlah Salmonella dalam suatu makanan, semakin besar dan cepat timbulnya
timbul juga dipengaruhi oleh sifat virulensi dan invasi bakteri, jumlah bakteri yang termakan, daya tahan tubuh inang yang dipengaruhi oleh umur dan kesehatan penderita (Supardi dan Sukamto 1999).
Vought dan Tatini (1998) mengemukakan bahwa wabah salmonellosis di Inggris telah terjadi pada orang dewasa akibat memakan es krim yang tercemar
S. Enteritidis sebanyak ≥107colony forming unit (CFU). Pada orang dewasa yang
memakan makanan tercemar bakteri tersebut sebanyak 105-106 CFU dilaporkan
tidak menunjukkan gejala klinis penyakit. Namun, beberapa penelitian
menyatakan bahwa sejumlah kecil S. Enteritidis dalam makanan (≤105 CFU) telah dapat menyebabkan infeksi. Hal ini dapat terjadi karena produk makanan tersebut
mengandung banyak lemak dan atau gula yang dapat melindungi Salmonella dari
lambung yang bersifat asam sehingga bakteri tersebut dapat mencapai usus halus dan menimbulkan gejala penyakit.
Investigasi Centers for Disease Control (CDC) pada tahun 2006 dalam
penelitian yang dilakukan selama 5 tahun terakhir melaporkan rata-rata kejadian salmonellosis mencapai 86 kasus per tahun. Isolat yang paling banyak ditemukan dalam kasus tersebut adalah Typhimurium. Kejadian wabah salmonellosis dilaporkan terdapat 171 kasus di 19 negara yang dilaporkan sejak 1 September 2006. Median usia penderita salmonellosis adalah 36 tahun, dan 59% diantaranya adalah wanita. Sebanyak 73 penderita mengalami diare dan 14 (19%) dirawat di rumah sakit. Namun, tidak ada laporan mengenai kematian yang dilaporkan dari kejadian-kejadian sakit tersebut (Anonimus 2006).
Salmonellosis menimbulkan gejala klinis seperti demam, sakit kepala, mual, muntah, sakit perut dan diare (Anonimus 2002).
Menurut Jawets et al. (2001) gejala salmonellosis dibedakan menjadi
fokal pada paru-paru, tulang dan meninges. Kasus enterokolitis merupakan manisfestasi infeksi Salmonella yang banyak terjadi dengan gejala klinis berbentuk mual, sakit kepala, muntah, diare. Deman terjadi dalam 2-3 hari, terdapat luka radang pada usus besar dan usus kecil dan kadang-kadang disertai bakterimia dengan tingkat kejadian 2-4%.
Salmonella menyebabkan tiga tipe penyakit utama pada manusia. Namun, tipe yang paling sering adalah tipe campuran, yaitu demam enterik, septikemia
dan enterokolitis. S. Typhi menyebabkan demam enterik. Pada tipe enterik,
Salmonella mencapai usus kecil kemudian masuk ke getah bening dan ke aliran darah. Oleh sel darah bakteri dibawa ke seluruh organ sasaran, termasuk usus.
Salmonella meningkat di dalam jaringan getah bening usus dan dikeluarkan melalui tinja. Sesudah masa inkubasi 10-14 hari, muncul gejala-gejala, seperti demam, rasa tidak enak badan, sakit kepala, konstipasi, bradycardia dan myalgia. Diagnosis dilakukan dengan mengambil contoh dari pembiakan darah dan
pembiakan feses. Pada pembiakan darah, positif Salmonella pada waktu 1-2
minggu sakit, sedangkan pada pembiakan feses positif Salmonella setelah dua
minggu sakit. S. Cholerasuis menyebabkan tipe septikemia. Gejala klinis yang
nampak adalah demam dengan suhu yang meningkat secara tiba-tiba. S.
Enteritidis dan S. Typhimurium menyebabkan tipe enterokolitis. Gejala klinis yang menyertai tipe ini adalah demam tingkat rendah dan berlangsung selama 2-5 hari, mual dan muntah pada awal terjadinya diare. Pada pemeriksaan pembiakan feses, ditemukan Salmonella terutama setelah onset penyakit (Jawets et al. 2001).
Tabel 2 dibawah ini menjelaskan diagnosis salmonellosis pada manusia.
Tabel 2 Diagnosis salmonellosis
Demam enterik Septikemia Enterokolitis
Periode inkubasi
7-20 hari Beragam 8-48 jam
Munculnya gejala klinis
Demam Berangsur-angsur
Beberapa minggu Beragam 2-5 hari
Simtom
Sering positif Positif secara
cepat setelah onset Sumber : Jawets et al. (2001)
Sementara Supardi dan Sukamto (1999) menjelaskan beragamnya gejala-gejala infeksi yang timbul setelah tertelannya sel-sel Salmonella. Hal ini tergantung dari daya virulensi, invasi dari serotipe dan galur bakteri tersebut, jumlah sel yang tertelan dan daya tahan tubuh yang dipengaruhi oleh umur dan
kesehatan penderita. Kebanyakan Salmonella menyebabkan demam enterik yang
disertai dengan diare, tetapi beberapa serotipe seperti S. Typhi, S Paratyphi A, B
dan C, serta S. Cholerasuis sering menimbulkan bakteremia. Gejala infeksi, waktu
inkubasi dan tanda-tanda yang ditimbulkan oleh masing-masing serotipe
Salmonella dapat dilihat pada Tabel 3.
Tabel 3 Serotipe Salmonella beserta gejala klinisnya
Gejala Serotipe/Galur Waktu inkubasi & Gejala
Gastroenteritis S. cholerasuis
Enteritidis,
Typhimurium,
Heidelberg,
Derby
Java
infantis
7-28 hari, rata-rata 14 hari Septikemia, malaise, demam profus, mual, muntah, sakit perut, limpa membesar, diare, kadang-kadang bercak merah, lebih ringan dan lebih singkat (1-3 minggu)
Sumber: Supardi dan Sukamto (1999)
Beberapa kebijakan pemerintah terhadap pengamanan pangan asal ternak atau hewan meliputi pengawasan dan pembinaan keamanan terhadap daging, susu
dan telur serta unggas. Kewajiban untuk mendapatkan sertifikat bebas Salmonella
merupakan salah satu upaya pencegahan penularan infeksi Salmonella. Sertifikat
bebas Salmonella merupakan sertifikasi kelayakan dari cara produksi DOC di
suatu usaha pembibitan unggas. Pemerintah juga perlu memeriksa pabrik-pabrik makanan ternak, rumah potong unggas atau tempat pemotongan daging,
importir/eksportir/penyalur. Peternakan ayam petelur juga harus bebas dari
Salmonella sehingga jika akan memasukkan hewan baru sebagai pengganti, hewan tersebut harus benar-benar berasal dari peternakan yang bebas salmonellosis (Dharmojono 2001, Moerad 2003).
Diagnosis Salmonella
dapat dilakukan dengan uji serologik, yaitu dengan uji aglutinasi untuk
mengelompokkan Salmonella dengan antigen O: A, B, C, D dan E. (Jawets et al.
2001).
Uji Cepat terhadap Cemaran Salmonella
Selain menggunakan metode pembiakan dan serologik, pengujian untuk menduga
adanya cemaran Salmonella dalam contoh klinis maupun contoh produk hewan
dapat menggunakan uji cepat. Beberapa uji cepat yang ada untuk menduga
cemaran Salmonella diantaranya adalah: Salmonella latex test yang menggunakan
antigen dan antibodi flagellauntuk reaksi aglutinasi (Zancan et al. 2000); enzim
substrat 4-methyllumbelliferyl-caprylate (MUCAP) yang didasarkan pada deteksi
caprylate esterase; serta medium agar baru yang menggunakan karakteristik novel
fenotipe yaitu Rambach Agar (Manafi dan Sommer 1992). Uji cepat lainnya untuk
menduga cemaran Salmonella adalah Widal tes yaitu tes aglutinasi pengenceran
dalam tabung dan the MicroScreen latex slide agglutination (Jawes et al. 2001).
Salmonellalatex test adalah suatu uji serologik dengan berdasarkan reaksi aglutinasi untuk mengidentifikasi isolat yang diduga Salmonella spp. Prinsip dari uji ini adalah menghasilkan antisera polyvalent terhadap antigen flagella
Salmonella dengan menggunakan hewan kelinci. Antibodi yang telah dipurifikasi
digunakan untuk memberikan efek peka terhadap partikel latex. Satu loopful
materi diambil, dicampurkan dengan satu tetes reagen latex test. Jika terjadi aglutinasi, berarti Salmonella ada pada material tersebut (Anonimus 2007).
MATERI DAN METODE
Penelitian ini dilakukan dari bulan September-Oktober 2008. Tempat penelitian dilakukan di Bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah cawan petri, tabung reaksi, pipet ukuran 1 ml, 2 ml, 5 ml, 10 ml; botol media, gunting, pinset,
jarum inokulasi (ose), stomacher, pembakar Bunsen, pH meter, timbangan,
magnetic stirrer, pengocok tabung (vortex), inkubator, penangas air,
autoklaf, lemari sucihama (clean bench), lemari pendingin (refrigerator),
freezer.
Bahan yang digunakan dalam penelitian ini adalah lactose broth (LB, Oxoid,
England);selenite cystine broth (SCB, Oxoid, England);tetrathionate broth (TTB, Oxoid, England);rappaport vassiliadis (RV, Oxoid, England);xylose lysine deoxycholate agar (XLDA, Oxoid, England); hektoen enteric agar (HEA, Oxoid, England);bismuth sulfite agar (BSA, Oxoid, England),triplesugar iron agar (TSIA, Oxoid, England);lysine iron agar (LIA, Oxoid, England); brain
heart infusion broth (BHIB, Oxoid, England); lysine decarboxylase broth (LDB, Oxoid, England);kalium cyanida broth (KCNB, Oxoid, England);methyl red-voges-proskauer (MR-VP,Oxoid, England);tryticase soy tryptose broth (TSTB, Oxoid, England);sulphide indol motility (SIM, Oxoid, England);reagen kovac (Oxoid, England);urea broth (Oxoid, England);malonate broth (Oxoid, England);phenol red (Oxoid, England );phenol red sucrose broth (Oxoid, England); dulcitol broth (Oxoid, England); phenol red lactose broth (Oxoid, England);simmon’s citrate agar (SCA, Oxoid, England); kristal keratin;larutan
bromcresol purple dye 0,2%; larutan physiological saline 0,85%; PBS pH 7,4,
larutan formalinized physiological saline; Salmonella polyvalent somatic (O)
Metode Pengujian
Ada dua macam metode pengujian yang digunakan dalam penelitian ini, yaitu uji
kualitatif sesuai dengan Metode SNI yang diacu dari Isolation and Enumeration
dalam Bacteriological Analytical Manual, Food and Drug Administration. AOAC
International (BAM 2001); dan yang kedua adalah Salmonella latex test.
Pengujian Salmonella spp. dengan Metode SNI
Metode pengujian yang digunakan dalam penelitian ini adalah uji kualitatif diambil dari Metode Standar Nasional Indonesia yang mengacu pada
Bacteriological Analytical Manual, Food and Drug Administration, AOAC International (BAM 2001). Setiap proses pengujian selalu disertai dengan kontrol positif dan negatif.
Pra-pengayaan
Kotak pengangkutan DOC dengan luas 10 x 10 cm2 di-swab menggunakan
swab sucihama yang sebelumnya telah dibasahi dengan PBS pH 7,4. Swab-swab
tersebut dipindahkan ke dalam Erlenmeyer atau wadah sucihama yang berisi
lactose broth. Kemudian diinkubasikan pada suhu 35 0C selama 24 jam ± 2 jam.
Pengayaan
Biakan pra-pengayaan diaduk secara perlahan kemudian diambil, dipindahkan masing-masing 1 ml ke dalam 10 ml media TTB, dan 0,1 ml ke
dalam 10 ml media RV. Untuk contoh dengan dugaan cemaran Salmonella spp.
tinggi (high microbial load), maka media RV diinkubasikan pada suhu 42 0C ±
0,2 0C selama 24 jam ± 2 jam, sedangkan untuk media TTB diinkubasi pada suhu
43 0C ± 0,2 0C selama 24 jam ± 2 jam. Untuk contoh dengan dugaan cemaran
Salmonella spp. rendah (low microbial load), maka media RV diinkubasikan pada
suhu 42 0C ± 0,2 0C selama 24 jam ± 2 jam, sedangkan untuk media TTB
diinkubasi pada suhu 35 0C ± 2 0C selama 24 jam ± 2 jam.
Sebanyak dua atau lebih biakan bakteri diambil dengan jarum öse dari masing-masing media pengayaan yang telah diinkubasikan, dan diinokulasikan pada media HE, XLD dan BSA. Selanjutnya media-media tersebut diinkubasi pada
suhu 35 0C selama 24 jam ± 2 jam. Bila masa inkubasi telah tercapai dan koloni
yang tumbuh di Media BSA belum jelas, maka inkubasi dilanjutkan lagi selama
24 jam ± 2 jam. Pengamatan dilakukan terhadap koloni Salmonella pada media
HE, yakni koloni yang terlihat berwarna hijau kebiruan dengan atau tanpa titik hitam (H2S). Pada media XLD pengamatan diarahkan kepada koloni yang terlihat merah muda dengan atau tanpa titik mengkilat atau terlihat hampir seluruh koloni hitam. Pada media BSA pengamatan diarahkan kepada koloni yang terlihat keabu-abuan atau kehitaman, kadang metalik, media di sekitar koloni berwarna coklat dan semakin lama waktu inkubasi akan berubah menjadi hitam.
Tahap selanjutnya adalah mengambil koloni yang diduga Salmonella dari
ketiga media tersebut dan diinokulasikan ke media TSIA dan LIA. Inokulasi dilakukan dengan cara menusukkan jarum inokulasi ke dasar media agar dan selanjutnya digores pada bagian miring agar. Kedua media diinkubasi pada suhu
35 0C selama 24 jam ± 2 jam. Setelah masa inkubasi tercapai, dilakukan
pengamatan terhadap koloni yang mengarah kepada koloni Salmonella dengan
menggunakan hasil reaksi seperti yang tercantum pada Tabel 4.
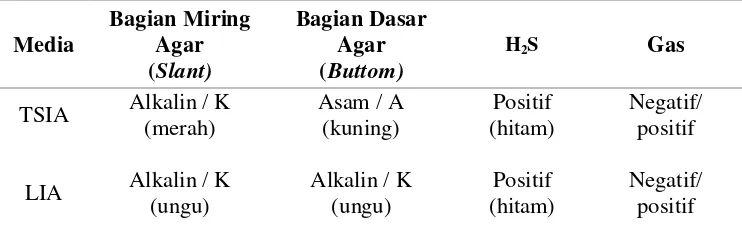
Tabel 4 Hasil uji Samonella spp. pada TSIA dan LIA
Koloni yang positif Salmonella dari TSIA diinokulasikan dengan öse
merah. Hasil uji negatif ditandai dengan tidak adanya perubahan warna. Hasil uji khas Salmonella adalah negatif uji urease.
- Uji Indole
Koloni dari media TSIA yang menunjukkan reaksi positif Salmonella,
diinokulasikan pada SIM dan diinkubasi pada suhu 35 0C selama 24 ± 2 jam.
Sebanyak 0,2-0,3 ml Reagen Kovacs ditambahkan ke atas permukaan media
setelah masa inkubasi tercapai. Hasil uji positif ditandai dengan adanya cincin merah di permukaan media. Hasil uji negatif ditandai dengan terbentuknya cincin kuning. Hasil uji khas Salmonella adalah negatif uji
Indole.
- Uji Voges-Proskauer (VP)
Biakan dari media TSIA yang menunjukkan reaksi positif Salmonella,
diambil dengan öse lalu diinokulasi ke tabung yang berisi 10 ml media
MR-VP dan diinkubasi pada suhu 35 0C selama 48 ± 2 jam. Sebanyak lima
mililiter MR-VP dipindahkan ke tabung reaksi dan larutan α-naphthol
sebanyak 0,6 ml dan 0,2 ml KOH 40% ditambahkan ke dalamnya setelah masa inkubasi tercapai. Tabung digoyang sampai tercampur merata dan didiamkan. Untuk mempercepat reaksi ditambahkan kristal kreatin. Hasil dibaca setelah empat jam. Hasil uji positif apabila warna larutan berubah menjadi berwarna merah jambu sampai merah delima. Umumnya
Salmonella memberikan hasil negatif untuk uji VP (tidak terjadi perubahan warna pada media).
- Uji Merah Metil (Methyl Red, MR)
negatif ditandai dengan terjadinya warna kuning pada media. Umumnya
Salmonella memberikan hasil positif untuk uji MR.
- Uji Sitrat
Koloni dari TSIA yang menunjukkan reaksi positif Salmonella,
diinokulasikan ke dalam SCA dengan öse. Kemudian diinkubasi pada suhu
35 0C selama 96 jam ± 2 jam. Hasil uji positif ditandai adanya pertumbuhan koloni yang diikuti perubahan warna dari hijau menjadi biru.Hasil uji negatif ditandai dengan tidak adanya pertumbuhan koloni atau tumbuh
sangat sedikit dan tidak terjadi perubahan warna.Umumnya Salmonella
memberikan hasil positif pada uji sitrat.
- Uji Lysine Decarboxylase Broth (LDB)
Sebanyak satu öse koloni dari TSIA yang menunjukkan reaksi positif
Salmonella, diambil dan diinokulasikan k edalam LDB. Kemudian
diinkubasi pada suhu 35 0C selama 48 ± 2 jam dan diamati setiap 24 jam.
Salmonella memberikan reaksi positif yang ditandai dengan terbentuknya warna ungu pada seluruh media dan hasil reaksi negatif memberikan warna kuning. Jika hasil reaksi meragukan (bukan ungu atau bukan kuning), maka
ke dalam media ditambahkan beberapa tetes 0,2 % bromcresol purple dye
dan diamati perubahan warnanya.
- Uji Potasium Sianida (KCN)
Sebanyak satu öse biakan dari TSIA yang menunjukkan reaksi positif
Salmonella, diinokulasikan ke media TB dan diinkubasi pada suhu 35 0C
selama 24 ± 2 jam. Sebanyak satu öse koloni dari TB diambil dan
diinokulasikan ke dalam KCNB. Inkubasi pada suhu 35 0C selama 48 ± 2
jam. Hasil uji positif ditunjukkan dengan adanya pertumbuhan koloni yang ditandai dengan terjadinya kekeruhan. Hasil uji negatif ditunjukkan dengan
tidak adanya pertumbuhan pada media. Umumnya Salmonella memberikan
hasil negatif untuk uji KCN.
a) Phenol Red Dulcitol Broth atau Purple Broth Base dengan 0,5%
Dulcitol
Koloni dari TSIA yang menunjukkan reaksi positif Salmonella,
diambil dan inokulasikan pada médium dulcitol broth. Kemudian
diinkubasi pada suhu 35 0C dan diamati setiap 24 jam selama 48 jam ± 2
jam.Reaksi positif oleh Salmonella ditandai dengan pembentukan gas
dalam tabung Durham dan warna kuning (pH asam) pada media.Reaksi
negatif oleh Salmonella ditandai dengan tidak terbentuknya gas pada
tabung Durham dan pada media terbentuk warna merah (pH basa) untuk
indikator phenol red atau ungu untuk indikator bromcresol purple.
b) Uji Malonate Broth
Sebanyak satu öse dari TB dipindahkan ke dalam malonate broth.
Kemudian diinkubasi pada suhu 35 0C dan diamati setiap 24 jam selama
48 jam ± 2 jam. Hasil uji positif ditunjukkan dengan adanya perubahan
warna menjadi biru. Reaksi negatif Salmonella yang ditandai dengan
adanya warna hijau atau tidak ada perubahan warna.
c) Uji Phenol Red Lactose Broth
Koloni dari TSIA yang menunjukkan reaksi positif Salmonella,
diinokulasikan ke dalam phenol red lactose broth. Kemudian diinkubasi
pada suhu 35 0C dan diamati setiap 24 jam selama 48 jam ± 2 jam. Hasil
reaksi positif ditandai dengan dihasilkannya asam (warna kuning) dengan atau tanpa gas.Hasil reaksi negatif Salmonella ditandai dengan tidak ada perubahan warna dan pembentukan gas.
d) Uji Phenol Red Sucrose Broth
Koloni dari TSIA yang menunjukkan reaksi positif Salmonella,
diinokulasikan ke dalam phenol red sucrose broth. Kemudian diinkubasi
pada suhu 35 0C selama 48 jam ± 2 jam dan diamati setiap 24 jam. Hasil
Salmonella ditandai dengan tidak ada perubahan warna dan pembentukan gas.
Uji Serologik
- Uji Polyvalent Somatik (O)
Sebanyak satu öse koloni dari TSIA atau LIA yang menunjukkan
reaksi positif Salmonella, diletakkan pada gelas obyek dan ditetesi satu tetes larutan garam fisiologis (NaCl 0,85%) sucihama dan diratakan
dengan biakan Salmonella spp.. Sebanyak satu tetes antiserum Salmonella
polyvalent somatic (O) diberikan di samping suspensi koloni. Suspensi koloni dicampur ke antiserum sampai tercampur sempurna. Gelas objek dimiringkan ke kiri dan ke kanan dengan latar belakang gelap sambil
diamati adanya reaksi aglutinasi. Kontrol negatif dibuatdengan
mencampur hanya larutan garam fisiologis dan antiserum.
- Uji Polyvalent Flagelar (H)
Koloni dari TSIA yang memberikan hasil uji urease negatif
diinokulasikan ke dalam BHIB dan diinkubasi pada suhu 35 0C selama 4-6
jam atau ke dalam TSTB dan inkubasi pada suhu 35 0C selama 24 ± 2 jam.
Sebanyak 2,5 ml larutan garam fisiologis berformalin (formalinized
physiological saline) ditambahkan ke dalam lima mililiter dari salah satu
biakan di atas. Sebanyak 0,5 ml larutan antisera Salmonella Polyvalent
flagellar (H) diambil dengan menggunakan pipet dan dimasukkan ke dalam tabung serologik ukuran 10 x 75 mm. Kemudian ditambahkan 0,5 ml antigen yang akan di uji. Larutan garam fisiologis kontrol disiapkan dengan mencampurkan 0,5 ml larutan garam fisiologis berformalin dengan
0,5 ml antigen berformalin (formalinized antigen). Kemudian diinkubasi
kedua campuran tersebut dalam penangas air pada suhu 48-50 0C.
Interpretasi Hasil Salmonella spp.
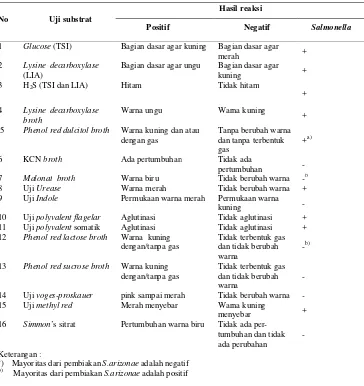
Interpretasi hasil uji biokimiawi Salmonella spp. terpapar pada Tabel 5.
Tabel 5 Reaksi biokimiawi Salmonella
No Uji substrat
Hasil reaksi
Positif Negatif Salmonella
1 Glucose (TSI) Bagian dasar agar kuning Bagian dasar agar
merah +
2 Lysine decarboxylase
(LIA)
Bagian dasar agar ungu Bagian dasar agar
kuning +
3 H2S (TSI dan LIA) Hitam Tidak hitam
+
4 Lysine decarboxylase broth
Warna ungu Warna kuning
+
5 Phenol red dulcitol broth Warna kuning dan atau dengan gas
10 Uji polyvalent flagelar Aglutinasi Tidak aglutinasi + 11 Uji polyvalent somatik Aglutinasi Tidak aglutinasi + 12 Phenol red lactosebroth Warna kuning
dengan/tanpa gas
Tidak terbentuk gas dan tidak berubah warna
-b)
13 Phenol red sucrosebroth Warna kuning dengan/tanpa gas
Tidak terbentuk gas dan tidak berubah warna
-14 Uji voges-proskauer pink sampai merah Tidak berubah warna - 15 Uji methyl red Merah menyebar Warna kuning
menyebar +
16 Simmon’s sitrat Pertumbuhan warna biru Tidak ada per-tumbuhan dan tidak ada perubahan
-
Keterangan :
a
) Mayoritas dari pembiakan S.arizonae adalah negatif
b)
Mayoritas dari pembiakan S.arizonae adalah positif
Sumber : BAM (2001)
Pengujian Salmonella spp. dengan Salmonella Latex Test
Contoh dibiakkan melalui teknik pra-pengayaan dan pengayaan sebelum
Salmonella spp. dari media Blood Agar diambil dan dilarutkan dalam larutan
NaCl fisiologis 0,85% di kartu reaksi. Kemudian reagen latex diteteskan
disamping suspensi tersebut. Kedua larutan dicampurkan dan kartu uji digoyang-goyang dengan gerakan melingkar selama dua menit. Dilakukan pengamatan ada-tidaknya reaksi aglutinasi
Reaksi dinyatakan positif jika terjadi aglutinasi dalam waktu dua menit dan tidak
terjadi aglutinasi dalam waktu dua menit pada kontrol latex (Anonimus 2007).
Rancangan Penelitian
Contoh yang diperiksa adalah kotak pengangkutan DOC yang
dilalulintaskan melalui Bandara Internasional Soekarno-Hatta. Pengambilan
contoh dilakukan dengan metode acak berkelompok (cluster random sampling).
Jumlah contoh diambil secara proporsional sebanyak 50 kotak yang berasal dari lima perusahaan pembibitan yang berbeda dan 50 kotak yang dicemari
S. Enteritidis sebagai kontrol positif. Dari kelima perusahaan pembibitan tersebut diambil masing-masing 10 contoh. Contoh diambil dari dinding bagian dalam dan
bagian bawah kotak pengangkutan DOC pada luasan 10 x 10 cm2 menggunaan
gauze swab yang telah dibasahi phosphat buffer saline (PBS) pH 7,4. Kapas
tersebut kemudian dimasukkan ke sebuah tabung Erlenmeyer berisi 100 ml
lactose broth dan diinkubasi selama 24 jam pada suhu 42 0C (Wray dan Davies 1994).
Terhadap kotak-kotak yang menunjukkan hasil positif adanya cemaran
Salmonella spp., selanjutnya dilakukan pemeriksaan identifikasi Salmonella spp.
dan keragaman spesies Salmonella yang ada.
Analisis Data
Data yang diperoleh akan dianalisis secaradeskriptif, yaitu mengumpulkan,
HASIL DAN PEMBAHASAN
Hasil Pengujian Salmonella spp. dengan Metode SNI
Tahapan pengujian Salmonella menggunakan metode SNI diawali dengan proses pra-pengayaan, pengayaan, dilanjutkan isolasi pada media selektif
pembeda, yaitu HEA, XLD dan BSA. Koloni yang diduga Salmonella pada media
HEA akan berwarna hijau kebiruan dengan atau tanpa titik hitam karena terbentuknya H2S. Koloni terlihat merah muda pada media XLD dengan atau tanpa titik mengkilat atau terlihat hampir seluruh koloni hitam Koloni terlihat keabu-abuan atau kehitaman pada media BSA. Kadangkala koloni berwarna metalik dengan media di sekitar koloni berwarna coklat dan berubah hitam
dengan bertambahnya waktu inkubasi (Merck 2004). Koloni Salmonella spp.
pada media HEA dapat dilihat pada Gambar 2. Keenam contoh yang diduga positif Salmonella dilanjutkan ke uji-uji biokimiawi. Hasil identifikasi dari uji-uji
biokimia mengarah kepada S. Enteritidis(Cowan 1981).
Menurut Quinn et al. (2002) Salmonella bersifat non motil pada suhu 30 0C,
tidak memfermentasi laktosa, tidak menghasilkan indole (tidak terbentuk cincin
warna merah pada uji indole), menggunakan glukosa untuk memproduksi asam
(uji methyl red positif, ditandai dengan warna merah menyebar), tidak
memetabolisme glukosa untuk menghasilkan asetoin dan 2,3-butanadiol (uji
voges-proskauer negatif, ditandai dengan tidak adanya perubahan warna),
menggunakan sitrat sebagai satu-satunya sumber karbon (ditandai dengan adanya
pertumbuhan koloni Salmonella dan media berwarna biru pada uji sitrat),
menghasilkan H2S, menghasilkan lysine decarboxylase (ditandai dengan
perubahan warna ungu pada uji lysine decarboxylase) dan tidak memetabolisme
urea (tidak adanya perubahan warna atau warna tetap kuning pada uji urease).
Terhadap enam contoh yang diduga Salmonella spp., dilanjutkan pengujian
serologik di Balai Besar Penelitian Veteriner untuk mengetahui spesies
Salmonella. Hasil yang didapatkan dari enam contoh tersebut, hanya empat
contoh yang positif S. Enteritidis. Sedangkan dua contoh yang diuji menunjukkan
hasil bukan Salmonella spp.
Tabel 6 Gambaran koloni dari media HEA dan uji biokimiawi contoh yang diduga positif Salmonella
No
Perusaha-an
1 A5
Gambar 2 Koloni Salmonella pada media HEA dari 6 contoh yang diduga positif
Media TSIA Media LIA
Gambar 3 Hasil uji khas Salmonella pada media TSIA dan LIA
Hasil Pengujian Salmonella spp. dengan Metode Salmonella Latex Test
Pengujian 50 contoh kotak pengangkutan DOC terhadap adanya cemaran
Salmonella spp. menggunakan metode Salmonella latex test menunjukkan hasil
hanya lima contoh sampel positif Salmonella spp.(10%). Contoh yang bereaksi
positif dengan Salmonella latex test ditandai dengan adanya reaksi aglutinasi pada kartu reaksi seperti pada Gambar 4.
terjadi aglutinasi tidak terjadi aglutinasi
Gambar 4 Gambaran aglutinasi pada contoh positif Salmonella spp. dengan
metode Salmonella latex test
Proses aglutinasi pada Salmonella latex test disebabkan oleh reaksi antibodi terhadap antigen flagella Salmonella. Salmonella latex test merupakan salah satu
uji cepat Salmonella yang lebih menyingkat waktu dibandingkan dengan metode
baku pengujian Salmonella. Menurut Anonimus (2007) metode ini dapat
mendeteksi spesies Salmonella diantaranya S. Typhimurium, S. Enteritidis, S.
Virchow, S. Newport, S. Infantis, S. Anatum, dan berbagai subspesies Salmonella
lainnya yang masuk dalam serotipe B, C1, C2, C3, D1 and E1.
Evaluasi Pengujian Cemaran Salmonella spp. dengan Metode SNI dan
Salmonella Latex Test
Perbedaan hasil uji Metode SNI dan Salmonella Latex Test terpapar pada
Tabel 7 di bawah ini.
Untuk membandingkan antara metode SNI dan Salmonella latex test
Tabel 8 Proporsi populasi yang diklasifikasi-silangkan berdasarkan hasil uji dengan metode yang berbeda
Metode Metode SNI Jumlah
Positif Negatif
Kepekaan dan kekhususan Salmonella latex test mencapai 100% dan 97,8%
dengan tingkat kepercayaan 95%. Kepekaan adalah proporsi kotak pengangkutan
DOC yang tercemar Salmonella spp. yang memberikan hasil uji positif,
sedangkan kekhususan adalah proporsi kotak pengangkutan DOC yang tidak
tercemar Salmonella spp. yang memberikan hasil uji negatif. Dengan
menggunakan data Tabel 8 Salmonella latex test memberikan nilai pendugaan
(prediktif) positif sebesar 80% dan nilai prediktif negatif sebesar 100%. Nilai prediktif positif adalah proporsi kotak pengangkutan DOC yang yang tercemar
Salmonella spp. diantara contoh yang bereaksi positif dengan metode Salmonella latex test, sedangkan nilai prediktif negatif adalah proporsi kotak pengangkutan
DOC yang tidak tercemar Salmonella spp. diantara contoh yang memberikan
reaksi negatif dengan menggunakan metode Salmonella latex test. Nilai prediksi
pengujian telah digunakan sebagai cara untuk memilih pengujian yang dilakukan, namun nilai prediksi tidak hanya dipengaruhi oleh kepekaan dan kekhususannya, tetapi dipengaruhi juga oleh prevalensi yang sebenarnya. Prevalensi sebenarnya biasanya sulit diketahui, maka tidak dapat secara langsung dianggap bahwa suatu pengujian yang memiliki nilai prediksi tertinggi selalu paling peka dan khas.
Untuk menentukan kesesuaian antara pengujian baku dan pengujian baru dilakukan analisis statitstik kappa (Thrusfield 2005). Metode SNI memberikan
prevalensi yang nampak sebesar 0,08, sedangkan dengan Salmonella latex test
pengujian yang memberikan proporsi positif yang lebih besar daripada yang lain dan arahan untuk menghitung kesesuaian diantara kedua metode yang digunakan. Dari Tabel 8 diperoleh nilai kappa sebesar 0,878. Berdasarkan Budiharta dan Suardana (2007) nilai kappa ≥0,7-1,0 dinilai bagus sekali, 0,5≤kappa<0,7 dinilai bagus, 0,4≤kappa<0,5 dinilai cukup dan <0,4 dinilai jelek. Dari hasil analisis
pengujian dengan metode SNI dan Salmonella latex test diperoleh kesesuaian
bagus sekali. Maka metode Salmonella latex test dapat digunakan sebagai uji tapis
untuk mengetahui adanya cemaran Salmonella spp. baik dari contoh klinis
maupun dari contoh produk-produk pertanian.
Ada beberapa keuntungan dan kerugian terhadap penggunaan metode
Salmonella latex test. Keuntungan yang diperoleh dengan metode tersebut adalah: dapat menyingkat waktu kurang lebih 24 jam dibandingkan dengan metode SNI
yang memakan waktu lebih lama untuk mengetahui adanya cemaran Salmonella
dalam kotak pengangkutan DOC. Studi yang dilakukan oleh Metzler dan
Nachamkin (1988) menjelaskan bahwa penggunaan metode Salmonella latex test
dapat menyingkat waktu kurang lebih 21 jam per 100 contoh karena tidak
dilakukan uji biokimiawi untuk menduga adanya cemaran Salmonella.
Keuntungan lain dari penggunaan metode Salmonella latex test yaitu adanya
pengurangan media yang digunakan dalam uji biokimiawi, menyingkat prosedur yang digunakan untuk membiakkan bakteri dari feses, membaca dan
menginterpretasikan hasil biakan pada lempengan agar dan uji tapis terhadap cemaran Salmonella spp. (Hinrichs et al. 1985). Salmonella latex test terbukti cukup efisien dilihat dari segi pembiayaan. Untuk memeriksa 50 contoh yang diuji menggunakan Salmonella latex test membutuhkan biaya kurang lebih Rp 1.750.000,-. Dengan metode SNI menghabiskan biaya sekitar Rp 3.750.000,-
Jadi dengan menggunakan metode Salmonella latex test dapat menghemat biaya
sekitar Rp 2.000.000,- per 50 contoh. Dalam penelitiannya dengan menggunakan
Selain beberapa keuntungan tersebut penggunaan metode Salmonella latex
test efektif digunakan untuk uji dugaan adanya cemaran Salmonella pada
produk-produk peternakan, khususnya pangan asal hewan. Juga, dengan teknik ini dapat
dibedakan antara Salmonella dengan spesies lainnya. Dari beberapa pertimbangan
tersebut, terlihat bahwa metode ini dapat dipergunakan untuk uji penapisan pada instansi-instansi yang membutuhkan hasil uji yang cepat, tepat dan akurat, seperti halnya karantina.
Kerugian menggunakan Salmonella latex test adalah tidak semua spesies
Salmonella dapat terlacak dengan uji tersebut. Hal ini dikarenakan antigen yang
digunakan adalah antigen flagella yang khusus terdapat pada spesies Salmonella
yang motil, seperti S. Enteritidis, S. Pomona, S. Hadar, S. Heidelberg, S. Infantis, S. Agona, S. Typhimurium, S. Newport, S. Javadan S. Virchow(Anonimus 2007).
Pencemaran S. Enteritidis pada Kotak Pengangkutan DOC
Dengan adanya cemaran S. Enteritidis pada kotak pengangkutan DOC
menjadikan kotak pengangkutan sebagai sumber penularan bagi orang-orang yang bersentuhan langsung dengan kotak pengangkutan DOC tersebut, misalnya pekerja kandang, penjual DOC dan anak-anak yang membeli DOC yang diperjualbelikan secara bebas.
Tindakan yang dapat dilakukan untuk mencegah terjadinya penularan salmonellosis yang berasal dari kotak pengangkutan DOC adalah dengan cara membakar kotak tersebut setelah DOC dibongkar di tempat tujuan dan
mengkampanyekan anjuran cuci tangan setelah menangani atau memegang hewan piara terutama DOC.
CDC melaporkan adanya tiga kejadian wabah salmonellosis pada anak-anak di Amerika Serikat yang terinfeksi dari anak ayam yang dibeli di toko peternakan
selama tahun 2006 (Bidol et al. 2007). Wabah tersebut menjelaskan bahwa