INDUKSI EMBRIOGENESIS SOMATIK SENGON
(Falcataria moluccana) DENGAN PERLAKUAN
THIDIAZURON, PROLIN, DAN CAHAYA
ARI SUNANDAR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Induksi Embriogenesis Somatik Sengon (Falcataria moluccana) dengan Perlakuan Thidiazuron, Prolin, dan Cahaya adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
RINGKASAN
Ari Sunandar. Induksi Embriogenesis Somatik Sengon (Falcataria moluccana) dengan Perlakuan Thidiazuron, Prolin, dan Cahaya. Dibimbing oleh ENCE DARMO JAYA SUPENA dan DORLY.
Sengon (Falcataria moluccana) merupakan tanaman legum berkayu yang cepat pertumbuhannya. Kayu sengon dimanfaatkan mulai sebagai kayu bakar hingga bahan pulp kertas. Tingginya nilai ekonomi kayu sengon dan meningkatnya penanaman sengon ternyata tidak ditunjang oleh ketersediaan bibit sengon yang memadai. Bibit sengon selama ini dihasilkan melalui perkecambahan biji, namun metode ini kurang efektif karena rendahnya perkecambahan biji, tanaman tidak homogen, dan sangat tergantung pada musim. Salah satu alternatif untuk perbanyakan tanaman sengon adalah menggunakan teknik in vitro melalui induksi embriogenesis somatik. Induksi embriogenesis somatik pada sengon telah dilakukan namun hanya mendapatkan kalus embriogenik. Induksi embriogenesis somatik pada tanaman legum lain telah berhasil menghasilkan tanaman menggunakan perlakuan thidiazuron, prolin, dan cahaya.
Sumber eksplan yang digunakan pada penelitian ini adalah daun urutan ke dua atau ke tiga dari bibit in vitro sengon. Metode rancangan acak lengkap faktorial digunakan untuk mempelajari pengaruh thidiazuron dan cahaya terhadap induksi embriogenesis somatik sengon, sedangkan untuk mempelajari pengaruh prolin terhadap induksi embriogenesis somatik sengon menggunakan metode rancangan acak lengkap. Jumlah embrio somatik yang terbentuk untuk setiap perlakuan diamati setiap dua minggu. Metode parafin digunakan untuk mempelajari histologi embriogenesis somatik sengon.
Eksplan daun sengon akan tumbuh menjadi kalus kompak pada setiap perlakuan thidiazuron dan cahaya. Kalus kompak kemudian berkembang menjadi kalus embriogenik dan mengalami embriogenesis yang ditandai terbentuknya fase globular, fase hati, dan fase kotiledon pada perlakuan thidiazuron 1 mg/l dan perlakuan tujuh hari gelap kemudian dipindah ke terang di media MS yang diperkaya dengan prolin 1.2 g/l.
Thidiazuron dan cahaya tidak hanya mempengaruhi induksi embriogenesis somatik tetapi juga mempengaruhi waktu perkembangan embrio somatik pada sengon. Fase globular, hati, dan kotiledon masing-masing terbentuk pada 2, 4, dan 7 mst pada perlakuan thidiazuron 1 mg/l dalam media MS yang diperkaya prolin 1.2 g/l dan perlakuan tujuh hari gelap kemudian dipindah ke terang namun tidak dapat berkembang menjadi planlet. Pada perlakuan terang kontinyu atau gelap kontinyu pada perlakuan thidiazuron 1 mg/l, fase globular dapat terbentuk pada 2 mst tetapi menyebabkan tertundanya pembentukan fase hati yaitu masing-masing pada 13 dan 17 mst. Fase globular tidak terbentuk pada perlakuan gelap kontinyu jika konsentrasi thidiazuron ditingkatkan menjadi 2 atau 3 mg/l.
Studi histologi melalui sayatan membujur pada fase globular dan fase kotiledon menunjukkan embrio somatik memasuki embriogenesis somatik sekunder. Akibat adanya embriogenesis somatik sekunder ini, menyebabkan fase kotiledon yang didapatkan pada penelitian ini tidak dapat berkembang menjadi planlet. Keberhasilan induksi embriogenesis somatik pada sengon akan memberikan peluang menyediakan bibit secara masal dan merupakan titik awal untuk pemuliaan tanaman sengon melalui transformasi genetik untuk meningkatkan kualitas bibit sengon.
SUMMARY
Ari Sunandar. Induction of Somatic Embryogenesis in Sengon (Falcataria moluccana) Through Thidiazuron, Proline, and Light Treatments. Supervised by ENCE DARMO JAYA SUPENA and DORLY.
Sengon (Falcataria moluccana) is a fast growing leguminous woody plant. The wood of sengon is useful for fuelwood until a source of material for making paper pulp. The high economic value of wood make it desirable, but the limited availability of seedling sometimes prohibit its wide dissemination. The seedling of sengon is produced through seed germination. However, this method is not effective because of the low germination of seed, low homogenity of plant, and it is influenced by season. The alternative method for sengon propagation is through the induction of somatic embryogenesis in vitro. Induction of somatic embryogenesis in sengon had been carried out by some previous researcher, but the results only obtained embryogenic calli. On the other hand, induction of somatic embryogenesis in other legum plants had been conducted and successfully obtained a planlet through thidiazuron, proline, and light treatments.
The second and the third leaflets from in vitro sengon seedling were used as the source of explant. Factorial complete randomized design was used to analyse the influence of thidiazuron and light treatments in induction of somatic embryogenesis and complete randomized design was used to analyse the influence of proline on somatic embryogenesis. The number of somatic embryo formed for all treatments were observed every two weeks. Paraffin method was used to histological analysis of somatic embryogenesis.
Leaflet explants of sengon grew and become compact calli in all thidiazuron and light treatments. Compact callus started to form embryogenic callus and later turned into somatic embryogenesis which characterized by the formation of globular, heart, and cotyledon stages in 1 mg/l thidiazuron and seven days of dark followed by light treatment in MS medium supplemented by 1.2 g/l proline.
Thidiazuron and light treatments not only had an effect on the induction of somatic embryo, but they also influenced the developmental timeline development of somatic embryogenesis in sengon. Globular, heart, and cotyledon stages were formed in 2, 4, and 7 weeks post-treatment respectively with 1 mg/l thidiazuron and seven days of dark followed by light treatments in MS medium supplemented by 1.2 g/l proline but the cotyledon stage did not growth to be planlet. In light continuous and dark continuous treatments, globular stage was formed in 2 weeks treatment but cause delayed of heart stage i.e. 13 and 17 weeks post-treatment with 1 mg/l thidiazuron post-treatment. Globular stage did not formed in dark continuous treatment, if concentrations of thidiazuron were incresed to 2 or 3 mg/l.
Proline concentration also influenced induction of somatic embryogenesis. Increasing proline concentration from 0.6 to 1.8 g/l led to a 3-fold increasing the production of somatic embryos. Combination of 1 mg/l thidiazuron, and 1.8 g/l proline in MS medium with seven days of dark followed by light treatments were the optimal treatments for induction of somatic embryogenesis of sengon.
embryogenesis caused cotyledon stages in this research could not develop into planlet. Successful induction of somatic embryogenesis in sengon would provide the chance to large-scale supply of seedlings, and would represent a useful starting point for plant breeding of sengon via genetic transformation to improve the quality of sengon seedling.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
INDUKSI EMBRIOGENESIS SOMATIK SENGON
(Falcataria moluccana) DENGAN PERLAKUAN
THIDIAZURON, PROLIN, DAN CAHAYA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Induksi Embriogenesis Somatik Sengon (Falcataria moluccana) dengan Perlakuan Thidiazuron, Prolin, dan Cahaya
Nama : Ari Sunandar NIM : G353110031
Disetujui oleh Komisi Pembimbing
Dr Ir Ence Darmo Jaya Supena, MSi Ketua
Dr Ir Dorly, MSi Anggota
Diketahui oleh
Ketua Program Studi Biologi Tumbuhan
Dr Ir Miftahudin, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah azza wa jalla atas segala karunia-Nya sehingga pelaksanaan penelitian dan penulisan karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2014 sampai Januari 2015 ini ialah embriogenesis somatik sengon, dengan judul Induksi Embriogenesis Somatik Sengon (Falcataria moluccana) dengan Perlakuan Thidiazuron, Prolin, dan Cahaya.
Terima kasih penulis ucapkan kepada Dr Ence Darmo Jaya Supena, M.Si dan Dr Dorly, M.Si selaku pembimbing. Penulis juga mengucapkan terima kasih kepada Dr Hamim, M.Si selaku penguji pada ujian tesis, serta rekan-rekan mahasiswa di program studi Biologi Tumbuhan. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, isteri, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 2
Biologi Sengon 2
Kultur Jaringan Sengon 3
Embriogenesis Somatik 4
3 METODE 5
Waktu dan Tempat Penelitian 5
Bahan 5
Perkecambahan Benih 5
Induksi Embriogenesis Somatik 6
Pengamatan Histologi Embrio Somatik Sengon 6
Rancangan Percobaan dan Analisis Data 7
4 HASIL DAN PEMBAHASAN 7
Pengaruh Thidiazuron dan Cahaya Terhadap Embriogenesis Somatik 7 Pengaruh Cahaya Terhadap Kecepatan Induksi Embrio Somatik 9 Pengaruh Prolin Terhadap Jumlah Embrio Somatik 9
Histologi Embrio Somatik 10
Pembahasan 11
5 SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 13
LAMPIRAN 18
DAFTAR TABEL
1 Pengaruh konsentrasi thidiazuron dan cahaya terhadap rata-rata
jumlah embrio somatik pada umur 17 mst 9
DAFTAR GAMBAR
1 Perbedaan warna kalus kompak pada perlakuan cahaya 8 2 Induksi embriogenesis somatik sengon pada media MS dengan
penambahan thidiazuron 1 mg/l dan prolin 1.2 g/l dengan perlakuan tujuh hari di tempat gelap kemudian dipindahkan ke
tempat terang 8
3 Skematik waktu perkembangan embriogenesis somatik sengon
pada media MS yang diperkaya prolin 1.2 g/l 10
4 Pengaruh konsentrasi prolin terhadap rata-rata jumlah embrio
somatik umur empat mst 10
5 Histologi embrio somatik abnormal sengon yang mengalami
embriogenesis sekunder 11
DAFTAR LAMPIRAN
1
1
PENDAHULUAN
Latar Belakang
Sengon (Falcataria moluccana (Miquel) Barneby & Grimes) adalah tanaman berkayu yang sangat cepat pertumbuhannya. Kayu sengon termasuk kelas kuat dan awet IV-V, sehingga kayu sengon sangat beragam penggunaannya, mulai dari sebagai kayu bakar, furniture, bahan alat musik hingga sumber utama pulp kertas (Soerianegara & Lemmens 1994). Pemanfaatan kayu sengon yang beragam menjadikan kayu sengon memiliki nilai ekonomi yang tinggi sehingga banyak dibudidayakan oleh masyarakat.
Tingginya nilai ekonomi kayu dan meningkatnya budidaya sengon ternyata tidak ditunjang dengan ketersediaan jumlah bibit yang cukup karena rendahnya daya perkecambahan benih dan bibit yang seragam dan berkualitas. Bibit sengon yang tahan terhadap penyakit karat tumor (gall rust) adalah salah satu kriteria bibit sengon berkualitas (Setiadi et al. 2014). Upaya peningkatan keberhasilan perkecambahan dilakukan dengan merendam benih dalam air mendidih selama 1-3 menit atau direndam dalam asam sulfat pekat selama 10 menit (Soerianegara & Lemmens 1994). Cara lain yang dapat digunakan untuk meningkatkan ketersediaan bibit yaitu melalui perbanyakan dengan teknik kultur in vitro.
Multiplikasi tunas sengon in vitro telah berhasil dilakukan menggunakan media MS dengan penambahan benzyladenin (BA) 2 mg/l atau BA 0.49 mg/l yang dikombinasikan dengan air kelapa 15% (v/v) (Sinha & Mallick 1993). Regenerasi tanaman melalui organogenesis sengon telah dilakukan oleh Ghosh et al. (2010) menggunakan eksplan daun pada media MS dengan penambahan BA 4 mg/l, asam indol 3-butirat (IBA) 0.05 mg/l, dan air kelapa (10% v/v). Teknik kultur in vitro yang dikembangkan ini telah mampu meningkatkan induksi pucuk dan akar pada tunas serta persentase tanaman yang dihasilkan dapat hidup pada percobaan lapangan mencapai 66%.
Teknik perbanyakan tanaman secara in vitro lainnya yang berpotensi diterapkan pada sengon adalah kultur embriogenesis somatik. Embriogenesis somatik adalah diferensiasi sel somatik menjadi embrio somatik sehingga tanaman yang dihasilkan berasal dari embrio akan memiliki akar dan tunas (Von Arnold et al. 2002). Embrio somatik dapat dimanfaatkan untuk memproduksi benih sintetik yang perbanyakannya dilakukan menggunakan bioreaktor. Teknik embriogenesis somatik dapat juga dimanfaatkan untuk seleksi pada tingkat sel, meregenerasikan hibrid sel somatik, produksi tanaman poliploid, pelestarian plasma nutfah, menghasilkan tanaman bebas virus, dan transformasi genetik (Vicient & Martinez 1998).
2
thidiazuron 2 mg/l (Sumiasri et al. 2006), dan eksplan aksis embrio sengon yang dikulturkan pada media MS dengan penambahan IAA 0.25 mg/l dan thidiazuron 0.1 mg/l (Hartati 2011).
Embriogenesis somatik sampai menghasilkan tanaman telah berhasil dilakukan pada beberapa tanaman legum lain dengan menambahkan thidiazuron pada media kultur. Regenerasi tanaman melalui embriogenesis somatik tersebut dapat menggunakan thidiazuron secara tunggal seperti pada tanaman Lens culinaris (Chhabra et al. 2008) dan Cajanus cajan (Aboshama 2011), ataupun menggunakan thidiazuron yang dikombinasikan dengan ZPT lain seperti pada regenerasi kotiledon Vigna umbellata (Saini & Chopra 2012).Regenerasi tanaman legum melalui embriogenesis somatik juga telah berhasil dilakukan dengan mengunakan prolin yang dikombinasikan dengan beberapa ZPT seperti pada Acacia arabica, Acacia catechu, Hardwickia binata, dan Dalbergia sissoo (Das 2011). Keberhasilan regenerasi tanaman melalui embriogenesis somatik juga dilaporkan dipengaruhi oleh cahaya, misalnya perlakuan gelap selama sembilan hari diperlukan pada awal induksi embriogenesis somatik Tetrapleura tetraptera (Opabode et al. 2011).
Thidiazuron, prolin, dan cahaya telah diketahui memiliki peran pada keberhasilan induksi dan regenerasi melalui embriogenesis somatik pada beberapa tanaman legum lain. Ketiga kombinasi perlakuan ini belum dicobakan dan memiliki potensi untuk induksi embriogenesis somatik pada tanaman sengon.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh konsentrasi thidiazuron, konsentrasi prolin, dan perlakuan cahaya pada induksi embriogenesis somatik sengon.
Manfaat Penelitian
Keberhasilan induksi embriogenesis somatik pada sengon akan memberikan informasi metode regenerasi tanaman untuk penyediaan bibit tanaman secara masal dan seragam dalam waktu yang relatif singkat, serta akan dapat membantu proses pemuliaan tanaman sengon.
2
TINJAUAN PUSTAKA
Biologi Sengon
3
Paraserianthes, Serianthes, dan Parachidendron. Sengon termasuk ke dalam genus Paraserianthes (Nielsen et al. 1983). Barneby & Grimes mengajukan taksa baru yaitu Falcataria moluccana (Barneby & Grimes 1996). Nama daerah untuk F. moluccana yang umum dikenal masyarakat adalah jeungjing (Jawa Barat), sengon laut (Jawa), puah (Brunei), batai (Malaysia), kayu machis (Serawak), white albizia (Papua Nugini), dan moluccan sau atau falcata (Filipina) (Soerianegara & Lemmens 1994).
Sengon merupakan tanaman asli dari Maluku, Papua Nugini, dan kepulauan Solomon. Sengon ditemukan pada ketinggian 2300 m dpl, pada hutan hujan tropis sekunder dan ditepian sungai berlumpur (Nielsen et al. 1983). Di Maluku, tegakan sengon alam dapat ditemukan di Pulau Taliabu, Mangolle, Sasan, Obi, Bacan, Halmahera, Seram dan Buru. Di Papua, sengon alam ditemukan di Sorong, Manokwari, Kebar, Biak, Serui, Nabire dan Wamena. Selain itu, sengon juga ditanam di Pulau Jawa (Martawijaya et al. 1989).
Tanaman sengon dapat mencapai tinggi 25.5 meter dengan diameter batang 17 cm hanya dalam enam tahun. Tanaman sengon tidak bercabang hingga ketinggian 20 m dan memiliki tajuk berbentuk perisai. Batang sengon tidak berbanir dengan bentuk bulat memanjang agak lurus (Soerianegara & Lemmens 1994).
Daun sengon merupakan tipe daun majemuk bertingkat dua. Panjang daun dari pulvinus hingga daun terujung dapat mencapai 40 cm. Pinna dapat berjumlah 4-7, 8-10 atau 11-12. Setiap pinna dapat terdiri dari 8, 15, atau 25 anak daun. Daun sengon berbentuk oblong cenderung sedikit lancip seperti sabit. Bunga sengon bertipe hermaprodit dengan warna seperti putih, krim, kuning pucat, atau hijau terang. Buah sengon berbentuk polong memiliki panjang 12 cm dan lebar
4
eksplan daun pada media MS dengan penambahan BA 2.25 mg/l dan 2,4-D 2.21 mg/l (Chujo et al. 2010).
Embriogenesis Somatik
Embriogenesis somatik adalah proses diferensiasi sel somatik menjadi embrio somatik (Von Arnold et al. 2002). Sel somatik memerlukan kondisi yang tepat untuk dapat berdiferensiasi menjadi sel embriogenik dan mengalami serangkaian perubahan morfologis dan fisiologis sehingga menjadi embrio somatik (Komamine et al. 2005). Tahap perubahan morfologi yang dialami sel dalam proses embriogenesis yaitu: fase globular, fase hati, fase torpedo, dan fase kotiledon (Nakamura et al. 1992). Induksi embriogenesis somatik dapat dilakukan melalui dua cara yaitu: embriogenesis somatik secara langsung dan embriogenesis somatik secara tidak langsung. Embriogenesis somatik secara langsung ketika embrio somatik terbentuk tanpa didahului dengan terbentuknya kalus, sedangkan embriogenesis somatik secara tidak langsung adalah terbentuknya embrio somatik yang didahului dengan terbentuknya kalus (George 1993).
Keberhasilan induksi embriogenesis somatik sangat tergantung pada beberapa faktor yaitu eksplan, zat pengatur tumbuh, cahaya, dan asam amino. Pemilihan eksplan merupakan salah satu faktor penentu keberhasilan induksi embriogenesis somatik. Pada legum, embrio zigotik muda dan kotiledon merupakan jenis eksplan yang paling responsif untuk induksi embriogenesis somatik (Ahmed et al. 1996). Keberadaan zat pengatur tumbuh seperti auksin dan sitokinin sangat mempengaruhi induksi embriogenesis. Penggunaan 2,4-D pada legum menginduksi embriogenesis somatik dan mampu menghasilkan embrio somatik dalam jumlah besar, namun secara morfologi abnormal dan gagal menjadi tanaman (Chengalrayan et al. 1994). Pemberian 2,4-D yang dikombinasikan degan BA dalam konsentrasi tinggi mampu meningkatkan embriogenesis somatik pada Medicago suffruticosa (Li & Demarly 1996). Penggunaan thidiazuron mampu menginduksi embriogenesis somatik secara langsung pada kacang tanah (Saxena et al. 1992). Thidiazuron memiliki dua fungsi pada induksi embriogenesis somatik yaitu berperan sebagai sitokinin yang mendorong pembelahan dan diferensiasi sel (Aboshama 2011) dan menginduksi auksin endogen (Murthy et al. 1995).
Cahaya merupakan salah satu penentu keberhasilan induksi embriogenesis somatik selain eksplan dan zat pengatur tumbuh. Cahaya dan 2,4-D berperan sebagai sinyal yang mengaktifkan protein G, nukleosida difosfat kinase, dan protein arrestin sehingga menginduksi proliferasi dan diferensiasi sel pada embriogenesis somatik Triticum aestivum (Nato et al. 2000). Asam amino seperti prolin dilaporkan berperan dalam induksi embriogenesis somatik Medicago sativa (Shetty & McKersie 1993). Prolin dapat meningkatkan produksi embrio somatik melalui keterlibatan prolin pada beberapa jalur transduksi sinyal sel (Phang 1985), sebagai tempat penyimpanan nitrogen, pengatur osmotikum, dan sumber NADP+ yang diperlukan untuk pertumbuhan embrio (Ghanti et al. 2009)..
5
sebagai gene bank. Pada tahapan lebih awal, kalus embriogenik merupakan obyek yang potensial untuk dimanfaatkan dalam rekayasa genetika tanaman melalui teknik transformasi genetik (Von Arnold et al. 2002). Seleksi sel dan regenerasi tanaman melalui embriogenesis somatik telah digunakan untuk menghasilkan tanaman tebu yang resisten terhadap virus (Oropeza & de Gracia 1996) dan kopi yang resisten terhadap phytotoxins (Nyange et al. 1995). Embriogenesis somatik juga dapat digunakan untuk meregenerasikan hibrid sel somatik, seperti pada Arachis intragenic hybrids (Feng et al. 1996) dan Citrus intragenic hybrids (Grosser et al. 1996). Embriogenesis somatik juga dapat diaplikasikan untuk menghasilkan tanaman triploid pada Acacia nilotica (Grag et al. 1996), produksi tanaman anggur bebas virus (Goussard & Wiid 1992), produksi kafein dan teobromine dari kakao (Paiva & Janick 1983), dan produksi benih sintetik yang telah diinokulasikan ektomikoriza (Vicient & Martinez 1998).
3
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juni hingga Desember 2014 di Laboratorium Biologi Molekuler dan Seluler Tanaman, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB dan Laboratorium Mikroteknik Departemen Biologi FMIPA IPB.
Bahan
Bahan tanaman yang digunakan adalah benih sengon (F. moluccana) lokal dari Usaha Dagang (UD) Tanjung Harapan, Sumedang, Jawa Barat, hasil panen pada bulan Juni 2012. Bahan kimia yang digunakan diantaranya adalah thidiazuron, prolin, dan Media dasar MS (Murashige & Skoog 1962).
Perkecambahan Benih
6
jam pada temperatur 25±2 oC selama empat minggu untuk menyediakan daun sebagai sumber eksplan.
Induksi Embriogenesis Somatik
Tahap awal untuk induksi embriogenesis somatik sengon yaitu menginduksi terbentuknya kalus kompak. Daun sengon hasil perkecambahan in vitro berumur 4 minggu setelah tanam (mst) yang digunakan sebagai eksplan adalah set daun majemuk urutan kedua dan ketiga dari pucuk yang berwarna hijau tua. Eksplan daun dibelah secara membujur kemudian ditanam pada media MS dengan penambahan thidiazuron sesuai perlakuan (1, 2, atau 3 mg/l) (Chhabra et al. 2008) dan diinkubasi sesuai perlakuan cahaya (terang kontinyu, tujuh hari di tempat gelap kemudian dipindahkan ke tempat terang, atau gelap kontinyu). Untuk perlakuan terang kontinyu menggunakan fotoperiode 16/8 jam pada temperatur 25±2oC. Cara perlakuan tujuh hari di tempat gelap kemudian dipindahkan ke tempat terang adalah eksplan disimpan di tempat gelap pada temperatur 25±2oC selama tujuh hari kemudian dipindahkan ke tempat terang dengan fotoperiode 16/8 jam pada temperatur 25±2oC. Sedangkan untuk perlakuan gelap, eksplan disimpan di tempat gelap pada temperatur 25±2oC.
Kalus kompak yang terbentuk pada saat 4 minggu setelah tanam (mst) pada setiap perlakuan thidiazuron dan cahaya digunakan untuk penelitian induksi embriogenesis somatik yang terdiri dari dua tahapan yaitu:
(1) Tahap pertama untuk mempelajari pengaruh konsentrasi thidiazuron dan cahaya pada induksi embriogenesis somatik sengon. Kalus kompak disubkultur ke media MS yang diperkaya prolin 1.2 g/l dan ditambahkan thidiazuron sesuai perlakuan (Murch 1999) kemudian diinkubasi sesuai perlakuan cahaya. Konsentrasi thidiazuron dan perlakuan cahaya terbaik pada induksi embriogenesis somatik tahap pertama digunakan sebagai acuan pada tahap penelitian kedua.
(2) Tahap kedua untuk mempelajari pengaruh prolin terhadap induksi embriogenesis somatik sengon. Kalus kompak disubkultur pada media MS dengan konsentrasi thidiazuron dan perlakuan cahaya terbaik berdasarkan hasil penelitian tahap pertama yang ditambahkan prolin pada medianya dengan beberapa konsentrasi sebagai perlakuan(0.6, 1.2, dan 1.8 g/l).
Kultur diinkubasi pada fotoperiode 16/8 jam pada temperatur 25±2oC untuk setiap rangkaian percobaan. Perubahan morfologi kalus dan jumlah embrio somatik yang terbentuk diamati setiap dua minggu untuk setiap tahapan percobaan.
Pengamatan Histologi Embrio Somatik Sengon
7
sayatan diwarnai dengan safranin 2% dan anilin blue 1%, kemudian diamati menggunakan mikroskop cahaya.
Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang digunakan untuk mempelajari pengaruh thidiazuron, prolin, dan cahaya terhadap induksi embriogenesis somatik sengon menggunakan dua rancangan percobaan yang terdiri dari:
(1) Tahap pertama penelitian menggunakan rancangan acak lengkap faktorial dengan dua faktor. Faktor pertama adalah konsentrasi thidiazuron yang memiliki tiga taraf yaitu 1, 2, dan 3 mg/l. Faktor kedua adalah perlakuan cahaya yang memiliki tiga taraf yaitu terang kontinyu, tujuh hari gelap kemudian ke terang, dan gelap kontinyu.
(2) Tahap kedua penelitian menggunakan rancangan acak lengkap dengan menggunakan konsentrasi prolin 0.6, 1.2, dan 1.8 g/l.
Setiap perlakuan untuk setiap rangkaian percobaan menggunakan lima botol kultur yang masing-masing ditanam lima kalus kompak, dan digunakan empat ulangan, sehingga dibutuhkan total 100 kalus kompak untuk setiap perlakuan.
Analisis pengaruh konsentrasi thidiazuron dan perlakuan cahaya terhadap jumlah embrio somatik dan pengaruh konsentrasi prolin terhadap jumlah embrio somatik menggunakan analysis of variance (ANOVA). Perlakuan yang berbeda nyata kemudian diuji lanjut menggunakan Duncan’s multiple range test (DMRT) menggunakan SPSS v.16 pada tingkat kepercayan 95%.
4
HASIL DAN PEMBAHASAN
HASIL
Pengaruh Thidiazuron dan Cahaya Terhadap Embriogenesis Somatik
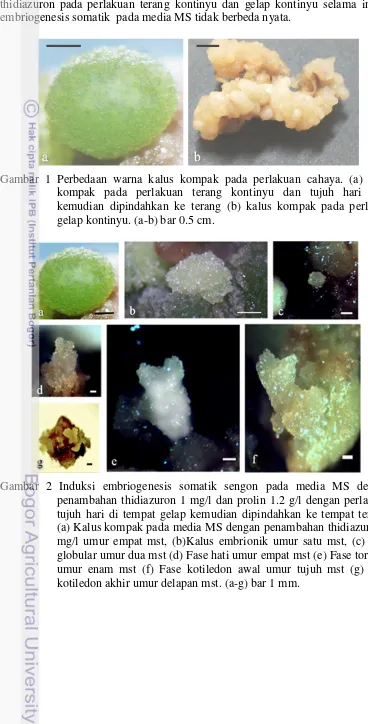
Proses induksi embriogenesis somatik sengon pada penelitian ini diawali dengan pembentukan kalus kompak. Kalus kompak dapat dihasilkan pada semua perlakuan konsentrasi thidiazuron dan perlakuan cahaya. Kalus kompak yang berasal dari perlakuan terang kontinyu dan tujuh hari gelap kemudian dipindah ke terang semuanya berwarna hijau, sedangkan kalus kompak yang berasal dari perlakuan gelap kontinyu berwarna coklat kekuningan (Gambar 1). Kalus kompak pada perlakuan thidiazuron 1 mg/l dan perlakuan tujuh hari gelap kemudian dipindah ke terang pada media MS yang diperkaya prolin 1.2 g/l, berkembang menjadi kalus embriogenik, kemudian mengalami embriogenesis yang ditandai terbentuknya fase globular, hati, torpedo dan kotiledon namun kotiledon tidak dapat berkembang menjadi planlet (Gambar 2).
8
Rata-rata jumlah embrio somatik yang dihasilkan dari penambahan 2 atau 3 mg/l thidiazuron pada perlakuan terang kontinyu dan gelap kontinyu selama induksi embriogenesis somatik pada media MS tidak berbeda nyata.
Gambar 1 Perbedaan warna kalus kompak pada perlakuan cahaya. (a) Kalus kompak pada perlakuan terang kontinyu dan tujuh hari gelap kemudian dipindahkan ke terang (b) kalus kompak pada perlakuan gelap kontinyu. (a-b) bar 0.5 cm.
9
Tabel 1 Pengaruh konsentrasi thidiazuron dan cahaya terhadap rata-rata jumlah embrio somatik pada umur 17 mst
Pengaruh Cahaya Terhadap Kecepatan Induksi Embriogenesis Somatik
Perlakuan cahaya dan konsentrasi thidiazuron tidak hanya mempengaruhi jumlah embrio somatik tetapi juga mempengaruhi kecepatan induksi embriogenesis somatik pada sengon. Fase globular terbentuk pada dua mst dan fase hati terbentuk pada empat mst untuk perlakuan perlakuan tujuh hari gelap dengan thidiazuron 1 mg/l dan konsentrasi prolin 1.2 g/l. Fase kotiledon hanya terbentuk pada konsentrasi thidiazuron 1 mg/l dengan penambahan prolin 1.2 g/l pada tujuh mst pada perlakuan tujuh hari gelap, namun tidak dapat berkembang menjadi planlet (Gambar 1). Fase globular dan hati masing-masing terbentuk pada dua mst dan 13 mst untuk perlakuan terang kontinyu dengan konsentrasi thidiazuron 1 mg/l namun tidak mengalami perkembangan lebih lanjut. Untuk perlakuan gelap kontinyu, fase globular terbentuk pada dua mst namun fase hati baru terbentuk pada 17 mst dan hanya terbentuk pada konsentrasi thidiazuron 1 mg/l serta tidak mengalami perkembangan lebih lanjut (Gambar 3).
Fase globular dan hati masing-masing terbentuk pada dua mst dan 13 mst, namun fase hati tidak mengalami perkembangan lebih lanjut pada perlakuan terang kontinyu dengan konsentrasi thidiazuron 2 atau 3 mg/l pada media MS yang diperkaya prolin 1.2 g/l. Fase globular, hati, dan torpedo masing-masing terbentuk pada dua mst dan 4 mst, namun fase torpedo tidak mengalami perkembangan lebih lanjut pada perlakuan tujuh hari gelap dengan konsentrasi thidiazuron 2 atau 3 mg/l dan prolin 1.2 g/l. embrio somatik tidak terbentuk pada perlakuan gelap kontinyu dengan konsentrasi thidiazuron 2 dan 3 mg/l dan prolin 1.2 g/l (Gambar 3).
Pengaruh Prolin Terhadap Jumlah Embrio Somatik
10
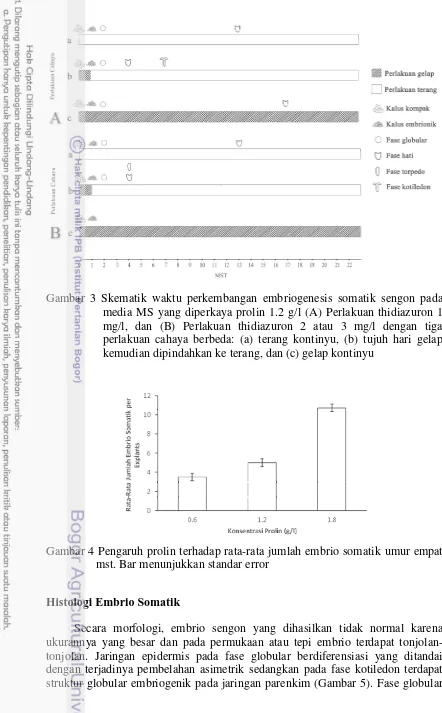
Gambar 3 Skematik waktu perkembangan embriogenesis somatik sengon pada media MS yang diperkaya prolin 1.2 g/l (A) Perlakuan thidiazuron 1 mg/l, dan (B) Perlakuan thidiazuron 2 atau 3 mg/l dengan tiga perlakuan cahaya berbeda: (a) terang kontinyu, (b) tujuh hari gelap kemudian dipindahkan ke terang, dan (c) gelap kontinyu
Gambar 4 Pengaruh prolin terhadap rata-rata jumlah embrio somatik umur empat mst. Bar menunjukkan standar error
Histologi Embrio Somatik
11
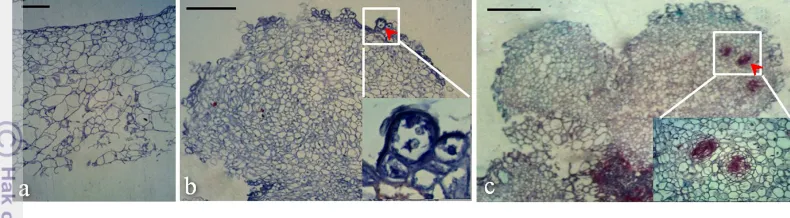
yang mengalami embriogenesis sekunder tidak mengalami perkembangan lebih lanjut, begitu juga fase kotiledon yang mengalami embriogenesis sekunder tidak berkembang menjadi tanaman.
Gambar 5 Histologi embrio somatik abnormal sengon yang mengalami embriogenesis sekunder: (a) Kalus kompak, (b) Pembelahan asimetrik pada fase globular umur dua mst (tanda panah), (c) Struktur globular embriogenik pada fase kotiledon umur enam mst (tanda panah). Bar 100 µm.
Pembahasan
Pada penelitian perlakuan thidiazuron mampu menginduksi embriogenesis somatik tidak langsung pada eksplan daun sengon. Konsentrasi thidiazuron 1 mg/l dalam media MS yang diperkaya prolin 1.2 g/l merupakan konsentrasi terbaik untuk menginduksi embriogenesis somatik pada sengon (Tabel 1, Gambar 2). Konsentrasi thidiazuron 1 mg/l juga merupakan konsentrasi optimal untuk menginduksi embriogenesis somatik pada Lens culinaris (Chhabra et al. 2008).
Pada umumnya legum, embriogenesis somatik merupakan respon yang diakibatkan oleh auksin dalam konsentrasi tinggi (Lakshmanan & Taji 2000) atau oleh rasio 4:1 antara auksin-sitokinin (Van Staden et al. 2008). Peran thidiazuron diduga dapat menggantikan auksin atau auksin-sitokinin yang dibutuhkan untuk menginduksi embriogenesis somatik melalui keterlibatan thidiazuron dalam menginduksi zat pengatur tumbuh endogen khususnya auksin dan sitokinin (Murthy et al. 1995). Sitokinin mendorong pembelahan dan diferensiasi sel, dan auksin memainkan peran penting untuk menginduksi kemampuan embriogenik (Aboshama 2011).
12
(Hutchinson et al. 2000). Perlakuan gelap kontinyu menyebabkan peningkatan sintesis etilen (Sasaki 2002) yang akan menghambat embriogenesis somatik pada Dalbergia sissoo (Sahu et al. 2014).
Perlakuan thidiazuron dan cahaya masing-masing memberikan pengaruh yang signifikan pada induksi embriogenesis somatik sengon (Tabel 1, Gambar 2), namun tidak ada pengaruh interaksi pada kedua perlakuan tersebut. Hal ini kemungkinan disebabkan oleh cahaya dan thidiazuron memiliki peran yang berbeda pada induksi embriogenesis somatik sengon. Cahaya dan 2.4 D berperan sebagai sinyal bagi protein G, nukleosida difosfat kinase, dan protein arrestin sehingga menginduksi proliferasi dan diferensiasi sel pada embriogenesis somatik Triticum aestivum (Nato et al. 2000). Thidiazuron memiliki dua fungsi pada induksi embriogenesis somatik yaitu berperan sebagai sitokinin yang mendorong pembelahan dan diferensiasi sel (Aboshama 2011) dan menginduksi auksin endogen (Murthy et al. 1995). Auksin akan mengaktifkan PIN1 yang mengatur polaritas auksin (Su et al. 2009) dan polaritas auksin sangat penting untuk perkembangan embrio somatik (Minocha & Minocha 1995).
Selain thidiazuron dan perlakuan tujuh hari gelap pada awal induksi embriogenesis somatik, prolin juga berperan dalam induksi embriogenesis somatik sengon. Penambahan prolin dari 0.6 hingga 1.8 g/l pada media kultur meningkatkan tiga kali lipat jumlah embrio somatik yang terbentuk (Gambar 4). Peran prolin pada embriogenesis somatik adalah sebagai tempat penyimpanan nitrogen, pengatur osmotikum, dan sumber NADP+ yang diperlukan untuk pertumbuhan embrio (Ghanti et al. 2009). Konsentrasi prolin yang digunakan untuk menginduksi embriogenesis somatik pada sengon dalam penelitian ini tiga kali lipat lebih tinggi dari pada untuk Dalbergia sissoo, Acacia catechu, Acacia arabica, dan Hardwickia binata yang hanya menggunakan konsentrasi prolin 0.6 g/l (Das 2011).
Sel tumbuhan merespon berbagai keadaan lingkungan dan sinyal seluler seperti homon dan cahaya, yang berperan mengontrol pembelahan sel, elongasi, polaritas dan diferensiasi (Dodeman et al. 1997). Embrio somatik abnormal pada sengon (Gambar 5) kemungkinan merupakan respon terhadap tingginya konsentrasi auksin endogen yang disebabkan oleh penggunaan thidiazuron secara kontinyu pada media induksi embriogenesis somatik sengon. Konsentrasi auksin endogen yang tinggi kemungkinan menginduksi pembelahan asimetris pada epidermis fase globular sengon, seperti halnya pembelahan asimetrik pada sel embrionik wortel yang diinduksi auksin (Komamine et al. 1992). Konsentrasi auksin endogen yang tinggi juga kemungkinan menginduksi terbentuknya struktur globular embriogenik pada jaringan parenkim fase kotiledon sengon, seperti halnya terbentuknya struktur globular embriogenik pada Alyssum borzaeanum yang diakibatkan oleh auksin (IAA, IBA, dan 2,4-D) dengan konsentrasi 1-2.5 mg/l (P unescu 2008).
13
Strategi yang dapat digunakan untuk mengatasi masalah embrio abnormal adalah memberikan maturation treatments dan zat pengatur tumbuh tanaman yang lebih lemah aktivitasnya dari thidiazuron. Sebagai contoh, Aboshama (2011) menggunakan maturation treatments pada media MS yang diperkaya glutamin 500 mg/l, casein hidrolisat 200 mg/l, dan ABA 0.1 mg/l selama empat minggu. Embrio somatik kemudian dipindahkan ke media setengah MS yang ditambahkan BA dan arang aktif.
5
SIMPULAN DAN SARAN
Simpulan
Induksi embriogenesis somatik sengon secara tidak langsung yang berasal dari eksplan daun dipengaruhi oleh konsentrasi thidiazuron, konsentrasi prolin, dan cahaya. Konsentrasi thidiazuron 1 mg/l, prolin 1.8 g/l pada media MS, dan perlakuan inkubasi kultur tujuh hari di tempat gelap kemudian dipindah ke cahaya berhasil menginduksi embriogenesis somatik pada sengon. Namun embrio somatik yang dihasilkan tidak normal dan tidak berkembang menjadi tanaman, yang ditandai dengan ukuran masing-masing fase embriogenesis yang membesar dan studi histologi menunjukkan bahwa embrio somatik memasuki embriogenesis somatik sekunder.
Saran
Perlu dilakukan uji lanjut untuk melihat pengaruh durasi gelap-terang dan mengembangkan metode untuk memelihara embrio tetap pada jalur embriogenesis somatik primer. Selain itu, perlu dikembangkan metode untuk perkecambahan embrio somatik fase kotiledon sengon agar didapatkan planlet.
DAFTAR PUSTAKA
Aboshama HMS. 2011. Somatic embryogenesis proliferation, maturation and germination in Cajanus cajan. World J Agric Sci 7:86-95.
Abrahamsson M, Valladares S, Larsson E, Clapham D, Von Arnold S. 2012. Patterning during somatic embryogenesis in Scots pine in relation to polar auxin transport and programmed cell death. Plant Cell Tiss Org Cult 109:391-400.
Ahmed R, Gupta SD, De DN. 1996. Somatic embryogenesis and plant regeneration from leaf derived callus of winged bean (Psophocarpus tetragonolobus L.). Plant Cell Rep 15:531–535.
Barneby RC, Grimes JW. 1996. Silk tree, guanacastel, monkey’s earring. Memoirs of the New York Botanical Garden 74: 245-255.
14
Chhabra G, Chaudhary D, Varma M, Sainger M, Jaiwal PK. 2008. TDZ-induced direct shoot organogenesis and somatic embryogenesis on cotyledonary node explants of lentil (Lens culinaris Medik.). Physiol Mol Biol Plants 14:347-353.
Chujo M, Eizawa J, Yokota S, Ishiguri F, Lizuka K, Priadi D, Sumiarsi N, Yoshizawa N. 2010. Micropropagation and protoplast culture in Paraserianthes falcataria. Wood Res J 1:108-114.
Damanik RI. 1999. Pengembangan metode regenerasi embrio somatik dan proliferasi tunas secara in vitro pada tanaman sengon (Parserianthes falcataria (L) Nielsen). [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Das P. 2011. Somatic embryogenesis in four tree legumes. Biotechnol Res Int 2011:1-8.
Dodeman VL, Ducreux G, Kreis M. 1997. Zigotic embryogenesis versus somatic embryogenesis. J Exp Bot 48:1493-1509.
Feng Q, Stalker HT, Pattee HE. 1996. Plant recovery of self and interspecific hybrids of Arachis by in vitro culture of peg tips. Crop Sci36:1660-1666. Fosberg FR. 1956. Revision of Albizia sect. Pachysperma
(Leguminosae-Mimosoiseae). Reinwardtia 7:71-90.
Garg L, Bhandari NN, Rani V, Bhojwani SS. 1996. Somatic embryogenesis and regeneration of triploid plants in endosperm cultures of Acacia nilotica. Plant Cell Rep15:855-858.
George EF. 1993. Plant Propagation by Tissue Culture part 1. England (UK): Exegetics Ltd.
Ghanti SK, Sujata KG, Rao S, Udayakumar M, Kishor PBK. 2009. Role of enzymes and identification of stage specific proteins in developing somatic embryos of chickpea (Cicer arietinum L.). In Vitro Cell Dev Biol Plant 45:667-672.
Ghosh N, Smith DW, Das AB, Chatterjee A. 2010. Rapid in vitro regeneration and clonal propagation of the fastest growing leguminous tree Albizia falcataria (L.) Fosberg using leaflet explant. Plant Tiss Cult Biotech 20:63-72.
Goldsmith MEM. 1982. A saturable site responsible for polar transport of indole-3-acetic acid in sections of maize coleoptiles. Planta 155:68-75.
Goussard PG, Wiid J. 1992. The elimination of fanleaf virus from grapevines using in vitro somatic embryogenesis combined with heat therapy. S Afr J Enol Vitic 13:81-83.
Grosser JW, Gmitter FG, Tusa N, Reforgiato-Recupero G, Cucinotta P. 1996. Further evidence of a cybridization requirement for plant regeneration from Citrus leaf protoplasts following somatic fusion. Plant Cell Rep15:672-676. Hartati NS. 2011. Modifikasi kandungan lignin kayu sengon (Paraserianthes falcataria (L) Nielsen) melalui rekayasa gen 4-caoumarate coa ligase (4CL). [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Hutchinson MJ, Senaratna T, Sahi SV, Saxena PK. 2000. Light mediates endogenous plant growth substances in thidiazuron-induced somatic embryogenesis in geranium hypocotyl cultures. J Plant Biochem Biotech 9:1-6.
15
Komamine A, Matsumoto M, Tsukahara M, Fujiwara A, Kawahara R, Ito M, Smith J, Nomura K, Fujimura T. 1992. Mechanisms of somatic embryogenesis in cell cultures: physiology, biochemistry and molecular biology. In Vitro Cell Dev Biol Plant 28: 11-14.
Komamine A, Murata N, Nomura K. 2005. Mechanisms of somatic embryogenesis in carrot suspension cultures morphology, physiology, biochemistry, and molecular biology. In vitro Cell Dev Biol Plant 41:6–10.
Lakshmanan P, Taji A. 2000. Somatic embryogenesis in leguminous plants. Plant
Biol 2: 136-148.
Li X, Demarly Y. 1996. Somatic embryogenesis and plant regeneration in Medicago suffruticosa. Plant Cell Tiss Org Cult 44:79–81.
Martawijaya A, Kartasujana I, Mandang YI, Prawira SA, Kadir K. 1989. Atlas Kayu Indonesia Jilid II. Bogor (ID): Pusat Penelitian dan Pengembangan Hasil Hutan.
Minocha SC, Minocha R. 1995. Role of polyamines in somatic embryogenesis. Di dalam: Bajaj YPS (Eds.) Somatic Embryogenesis and Shyntetic Seed I. Berlin: Springer, hlm 53-70.
Murashige T, Skoog F.1962. A revised medium for rapid growth and biossays with tobacco tissue cultures. Physiol Plant 15:473-497.
Murch SJ, Victor JMR, Krishnaraj S, Saxena PK. 1999. The role of proline in thidiazuron-induced somatic embryogenesis of peanut. In Vitro Cell Dev Biol Plant 35:102-105.
Murthy BNS, Murch SJ, Saxena PK. 1995. Thidiazuron-induced somatic embryogenesis in intact seedlings of peanut (Arachis hypogaea): endogenous growth regulator levels and significance of cotyledons. Physiol Plant 94: 268-276.
Nakamura T, Taniguchi T, Maeda E. 1992. Studies on somatic embryogenesis of coffee by scanning electron microscope. Jpn J Crop Sci 61:476–486.
Nato A, Fresneau C, Moursalimova N, De Buyser J, Lavergne A, Henry Y. 2000. Expression of auxin and light-regulated arrestin-like proteins, G proteins and nucleoside diphosphate kinase during induction and development of wheat somatic embryos. Plant Physiol Biochem 38: 483−490.
Nielsen I, Guinet PH, Barreta-Kuipers T. 1983. Studies in the Malesian, Australian and Pacific Ingece (Leguminosce-Mimosoidecu): the genera Archidendropsis, Wallaceodendron, Paraserianthes, Pararchidendron and Serianthes (part I). Bull Mus nat Hist Nat ser 4 vol 5 sect B Adansonia 4: 335-360.
Nyange NE, Williamson B, Mcnicol RJ, Lyon GD, Hackett CA. 1995. In vitro selection of Coffea arabica callus for resistance to partially purified phytotoxic culture filtrates from Colletotrichum kahawae. Ann Appl Biol 127:425-439.
Opabode JT, Akinyemiju OA, Ayeni OO. 2011. Plant regeneration via somatic embryogenesis from immature leaves in Tetrapleura tetraptera (Schum & Thonn.) Taub. Arch Biol Sci 63: 1135-1145.
16
Paiva M, Janick J. 1983. In vivo and in vitro production of alkaloids in Theobroma cacao L. Acta Hort131:249-273.
P unescu A. 2008. Histological investigation of the secondary somatic embryogenesis of Alyssum borzaeanum (Brassicaceae). Phytol Balcan 14:111-117.
Phang JM. 1985. The regulatory functions of proline and pyrroline-5-carboxylic acid. Curr Top Cell Regul 25:92–132.
Ramesar-Fortner NS, Yeung EC. 2001. Tri-iodobenzoic acid affects shoot apical meristem formation and function in zygotic embryos of Brassica napus cv. Topas. Can J Bot 79:265-273.
Sahu J, Khan S, Sahu RK, Roy A. 2014. Micropropagation of Dalbergia sissoo Roxb. through tissue culture technique. Pak J Biol Sci 17:597-600.
Saini R, Chopra AR. 2012. In vitro plant regeneration via somatic embryogenesis in rice-bean Vigna umbellata (Thunb.) Ohwi and Ohashi : an underutilized and recalcitrant grain legume. J Environ Res Develop 6:452-457.
Sasaki H. 2002. Brassinolide promotes an adventitious shoot regeneration from cauliflower hypocotyl segment. Plant Cell Tiss Org Cult 71: 111-116. Saxena PK, Malik KA, Gill R. 1992. Induction by thidiazuron of somatic
embryogenesis in intact seedlings of peanut. Planta 187:421-424.
Setiadi D, Susanto M, Baskorowati L. 2014. Ketahanan serangan penyakit karat tumor pada uji keturunaan sengon (Falcataria moluccana) di Bondowoso, Jawa Timur. Jurnal Pemuliaan Tanaman Hutan 8:1-13.
Shetty K, McKersie BD. 1993. Proline, thioproline and potassium mediated stimulation of somatic embryogenesis in alfalfa (Medicago sativa L.). Plant Sci 88:185–193.
Sinha RK, Mallick R. 1993. Regeneration and multiplication of shoot in Albizia falcataria. Plant Cell Tiss Org Cult 32:259-261.
Soerianegara I, Lemmens RHMJ. 1994. Timber Trees: Major Commercial Timbers. Bogor (ID): Plant Resources of South-East Asia, PROSEA.
Su YH, Zhao XY, Liu YB, Zhang CL, O’Neill SD, Zhang XS. 2009. Auxin-induced WUS expression is essential for embryonic stem cell renewal during somatic embryogenesis in Arabidopsis. Plant J 59:448-460.
Sukarutiningsih, Saito Y, Ide Y. 2002. In vitro planlet regeneration of Parasetainthes falcataria (L) Nielsen. Bull Tokyo Univ For 107:21-28. Sumiasri N, Priadi D, Yokota S, Yoshizawa N. 2006. Tissue culture of fast
growing tropical trees in Indonesia: Mangium (Acacia mangium Wild) and Sengon (Paraserianthes falcataria (L) Nielsen). Di dalam: Imamura Y, Umezawa T, Hata T (Eds.) Sustainable Development and Utilization of Tropical Forest Resources. Kyoto (JP): Research Institute for Sustainable Humanosphere, Kyoto University, hlm 123-130.
Terzi M, Loschiavo F. 1990. Somatic embryogenesis. Di dalam: Bhojwani SS (Ed.) Plant Tissue Culture: Applications and Limitations. Amsterdam (NL): Elsevier, hlm 54-66.
17
Van Staden J, Zazimalova E, George EF (2008). Plant growth regulators II: Cytokinins, their analogues and antagonist. Di Dalam: George EF, Hall M, De Klerk GJ (Eds) Plant Propagation by Tissue Culture 3rd Edition. Vol. 1. Dordrecht (NL): Springer, hlm 205-226.
Von Arnold S, Sabala I, Bozhkov P, Dyachok J, Filonova L. 2002. Developmental pathways of somatic embryogenesis. Plant Cell Tiss Org Cult 69:233–249. Vicient CM, Martinez FX. 1998. The potential uses of somatic embryogenesis in
agroforestry are not limited to synthetic seed technology. Rev Bras Fisiol Veg 10:1-12.
18
Lampiran 1. Larutan Johansen dan Larutan Giford Larutan seri Johansen I-VI (Johansen 1940)
Komposisi larutan
Larutan Johansen (%)
I II III IV V VI VII
Air 50 30 15
Etanol 95% 40 50 50 45
Etanol 100% 25
TBA 10 20 35 55 75 100 50
Minyak paraffin 50
Komposisi larutan Giford
Nama bahan Volume (ml)
Asam asetat glasial 20
Etanol 60% 80
Gliserin 5
19
RIWAYAT HIDUP
Penulis dilahirkan di Sintang, Kalimantan Barat pada tanggal 23 Agustus 1985 dari pasangan Bapak Abdul Syukur Sanal dan Ibu Nana Rusina. Penulis merupakan anak kedua dari tiga orang bersaudara.