OPTIMASI MEDIA PRODUKSI SENYAWA AKTIF Penicillium lagena SEBAGAI ANTIFUNGI PATOGEN Phellinus lamaoensis DENGAN
MENGGUNAKAN RESPONSE SURFACE METHODOLOGY
SITI NABILAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Optimasi Media Produksi Senyawa Aktif Penicillium lagena sebagai Antifungi Patogen Phellinus lamaoensis dengan Menggunakan Response Surface Methodology adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SITI NABILAH. Optimasi Media Produksi Senyawa Aktif Penicillium lagena sebagai Antifungi Patogen Phellinus lamaoensis dengan Menggunakan Response Surface Methodology. Dibimbing oleh KHASWAR SYAMSU dan ROFIQ SUNARYANTO.
Phellinus lamaoensis (Murr.) Hein merupakan cendawan patogen yang dapat menyebabkan penyakit akar cokelat pada tanaman kakao, teh, karet, dan kopi. Fungi endofit Penicillium lagena yang diisolasi dari tanaman obat bandotan (Ageratum conyzoides Linn.) diketahui mampu menghambat pertumbuhan patogen P. lamaoensis. Senyawa aktif P. lagena yang dapat menghambat pertumbuhan P. lamaoensis merupakan senyawa hasil metabolit sekunder.
Kultivasi kultur batch dilakukan menggunakan labu erlenmeyer kocok pada suhu 25°C agitasi 220 rpm selama 120 jam dengan volume kerja 25 mL. Setiap media kultivasi diinokulasi dengan 10% inokulum dari kultur seed. Pemisahan senyawa aktif P. lagena dari media dilakukan dengan sentrifugasi pada suhu 4°C, 5870 g selama 15 menit. Supernatan diekstrak dengan etil asetat. Kultivasi dilakukan untuk memperoleh sumber karbon, sumber nitrogen, dan konsentrasi mineral terbaik. Optimasi ketiga komponen media tersebut dilakukan dengan response surface methodology (RSM). Optimasi terhadap faktor yang signifikan diprediksi dengan model ordo dua melalui rancangan statistika central composite design (CCD). Untuk memperoleh komposisi media yang optimal, sebanyak 34 percobaan telah dilakukan.
Laktosa, yeast extract, dan mineral adalah komponen media yang menunjukkan pengaruh yang nyata terhadap produksi senyawa aktif P. lagena. Produksi persentase relatif luas area senyawa aktif P. lagena tertinggi diprediksi oleh model kuadratik sebesar 69.233% dengan komposisi media 44.77 g L-1 laktosa, 13.02 g L-1 yeast extract, dan 15.95 mL L-1 larutan mineral. Hasil verifikasi persentase relatif senyawa aktif P. lagena di laboratorium sebesar 58.365%. Hasil verifikasi lebih rendah 15.7% dibandingkan prediksinya. Pemilihan jenis dan konsentrasi optimal sumber karbon, nitrogen, dan mineral meningkatkan produksi senyawa aktif P. lagena sembilan kali lipat dibandingkan sebelum optimasi (6.473%).
SUMMARY
SITI NABILAH. Optimization of Penicillium lagena medium cultivation to produce antifungal pathogen of Phellinus lamaoensis using response surface methodology. Supervised by KHASWAR SYAMSU and ROFIQ SUNARYANTO.
Phellinus lamaoensis (Murr.) Hein is fungal pathogen that can cause brown root rot disease in cocoa, tea, rubber, and coffee plants. Endophytic fungi, Penicillium lagena, isolated from bandotan (Ageratum conyzoides Linn.), medicinal plant, is able to inhibit the growth of pathogenic, P. lamaoensis. Active compounds of P. lagena that inhibites growth of P. lamaoensis are secondary metabolite.
Batch cultivation was carried out at 25°C agitation 220 rpm for 120 hours in 25 mL. Each flask was inoculated with 10% (v/v) inoculum from seed culture. To harvest, culture was centrifuged at 4°C 5870 g for 15 min. Supernatan was extracted with ethyl acetate. Cultivation was done to get the best source of carbon, nitrogen, and mineral concentration. Composition optimization of these three medium components was done by response surface methodology (RSM). The optimal response region of the significant factor was predicted by using a second order polynomial model with statistical design, central composite design (CCD). To find optimum medium, 34 experiments were done.
Lactose, yeast extract, and mineral solution were media components which showed significant effect toward production of P. lagena active compound. Higest production of P. lagena active compound by quadratic model was predicted to be 69.233% with medium composition 44.77 g L-1 lactose, 13.02 g L-1 yeast extract, and 15.95 mL L-1 mineral solution. Verification in laboratory resulted 58.365%, which was 15.7% lower than its prediction. Selection of the optimal type and concentration source of carbon, nitrogen, and mineral solution increase production of P. lagena active compound 9 fold compared to unoptimized media (6.473%).
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
OPTIMASI MEDIA PRODUKSI SENYAWA AKTIF Penicillium lagena SEBAGAI ANTIFUNGI PATOGEN Phellinus lamaoensis DENGAN
MENGGUNAKAN RESPONSE SURFACE METHODOLOGY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2014 ini ialah biofungisida, dengan judul Optimasi Media Produksi Senyawa Aktif Penicillium lagena sebagai Antifungi Patogen Phellinus lamaoensis dengan Menggunakan Response Surface Methodology.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Khaswar Syamsu, MSc St dan Bapak Dr Rofiq Sunaryanto, MSi selaku pembimbing atas saran dan bimbingannya dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Ucapan terima kasih disampaikan kepada Bapak Prof Dr Ir Suharsono, DEA sebagai ketua program studi Bioteknologi atas persetujuan pelaksanaan penelitian ini. Ucapan terima kasih disampaikan kepada Dr Nisa Rachmania Mubarik, MSi atas saran dan masukan yang diberikan pada ujian karya ilmiah. Terima kasih penulis sampaikan kepada Balai Pengkajian Bioteknologi Badan Pengkajian dan Penerapan Teknologi (Biotek-BPPT) Laboratorium Mikrobiologi Serpong. Ungkapan terima kasih juga penulis sampaikan kepada Abi, Ummi, serta seluruh keluarga atas segala doa dan kasih sayangnya. Terima kasih juga kepada Bapak Rudiyono, Eni, Nadia, Iqbal, Sela, Nabila, Husnun, Evi, dan Isna atas bantuan, kerjasama, dan semangat yang diberikan selama penelitian. Terima kasih juga kepada rekan-rekan Bioteknologi 2013 atas semangat dan kebersamaannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 4
Penicillium lagena 4
Phellinus lamaoensis 4
Mikroorganisme Endofit 5
Metabolit Sekunder 5
Optimasi Kultivasi 6
3 METODE 7
Waktu dan Tempat 7
Bahan 7
Alat 8
Prosedur 8
4 HASIL DAN PEMBAHASAN 12
Morfologi Penicillium lagena 12
Kurva Pertumbuhan Penicillium lagena pada Media F1 13 Kultivasi, Ekstraksi, dan Uji aktivitas Senyawa Aktif P. lagena dengan
Media F15 14
Pemilihan Sumber Karbon Terbaik 16
Pemilihan Sumber Nitrogen Terbaik 19
Pemilihan Konsentrasi Mineral Terbaik 21
Optimasi Media dengan Response Surface Methodology 23
Formulasi Medium dan Validasi Model 27
Liquid Chromatography-Mass Spectrometry (LC-MS) 28
5 SIMPULAN DAN SARAN 29
Simpulan 29
Saran 30
DAFTAR PUSTAKA 30
LAMPIRAN 34
DAFTAR TABEL
1 Rancangan percobaan central composite design (CCD) 11 2 Faktor dan level yang digunakan pada central composite design 24 3 Analisis varian dan Lack of Fit Test terhadap permukaan respon
model kuadratik 25
DAFTAR GAMBAR
1 Central composite design untuk tiga variabel dengan dua level 6
2 Morfologi Penicillium lagena 13
3 Kurva pertumbuhan Penicillium lagena pada media F1 13 4 Waktu retensi dan serapan gelombang maksimum senyawa aktif P.
lagena yang diproduksi menggunakan media F15 15 5 Uji aktivitas senyawa aktif P. lagena yang diproduksi dengan media
F15 15
6 Persentase relatif luas area senyawa antifungi respon beberapa
sumber karbon 16
7 Diameter zona bening respon beberapa sumber karbon 17 8 Lintasan metabolisme laktosa, glukosa, galaktosa, dan maltosa
sampai terbentuk asam piruvat 18
9 Persentase relatif luas area senyawa antifungi respon beberapa
sumber nitrogen 20
10 Diameter zona bening respon beberapa sumber nitrogen 20 11 Persentase relatif luas area senyawa antifungi respon terhadap
konsentrasi larutan mineral 22
12 Diameter zona bening respon terhadap konsentrasi larutan mineral 23 13 Hubungan antara laktosa dan yeast extract dalam bentuk permukaan
respon dan kontur plot 26
14 Hubungan antara laktosa dan mineral dalam bentuk permukaan
respon dan kontur plot 26
15 Hubungan antara yeast extract dan mineral dalam bentuk permukaan
respon dan kontur plot 27
16 Hasil liquid cromatography senyawa aktif P. lagena 28 17 Spektrum analit senyawa aktif P. lagena pada menit ke 3.85 29
DAFTAR LAMPIRAN
1 Penentuan gula total dan bobot bahan dari masing-masing sumber karbon yang digunakan untuk optimasi medium fermentasi 34 2 Penentuan nitrogen total dan bobot bahan dari masing-masing sumber
4 Analisis ragam dan uji lanjut perbandingan berganda Duncan
perlakuan sumber karbon 37
5 Analisis ragam dan uji lanjut perbandingan berganda Duncan
perlakuan sumber nitrogen 39
6 Analisis ragam dan uji lanjut perbandingan berganda Duncan
perlakuan mineral 41
7 Waktu retensi dan serapan gelombang maksimum dari pemilihan
sumber karbon 43
8 Waktu retensi dan serapan gelombang maksimum dari pemilihan
sumber nitrogen 44
9 Waktu retensi dan serapan gelombang maksimum dari pemilihan
konsentrasi mineral 45
10 Data hasil analisa respon pada optimasi media kultivasi menggunakan
central composite design 46
11 Uji statistika data hasil optimasi dengan persentase relatif luas area
senyawa antifungi P.lagena sebagai respon 47
12 Uji statistika data hasil optimasi dengan diameter zona bening sebagai
respon 48
13 Hasil verifikasi media optimal 49
14 Bobot molekul dan rumus kimia bobot molekul senyawa aktif
1
PENDAHULUAN
Latar Belakang
Phellinus lamaoensis (Murr.) Hein sinonimnya Fomes noxius Corner atau Fomes lamaoensis Murr. adalah patogen yang dapat menyebabkan penyakit akar cokelat pada tanaman kakao, teh, karet, dan kopi (Semangun 2000). Patogen P. lamaoensis menyerang kakao di beberapa negara, yaitu Indonesia, Ghana, Nigeria, Sri Lanka, Malaysia, Papua New Guinea, dan Samoa (Wood dan Lass 1989). Serangan penyakit akar cokelat mampu menurunkan 50 persen populasi kakao dalam perkebunan (PPKKI 2010). Gejala yang ditimbulkan, yaitu daun menguning, layu, dan gugur kemudian diikuti dengan kematian tanaman. Gejala penyakit akar timbul hingga ke permukaan tanah disebabkan akar membusuk sehingga tidak dapat mentransfer air dan nutrisi dari tanah (Brooks 2002). Pemeriksaan terhadap leher akar dan perakaran tanaman harus dilakukan untuk megetahui keberadaan patogen dengan tepat. Pada permukaan akar tanaman yang terinfeksi, terdapat miselium berwarna cokelat berlendir yang mengikat erat pada tanah dan sulit untuk lepas walaupun sudah dicuci (PPKKI 2010). Penyebaran penyakitnya lambat, yaitu melalui kontak langsung antara akar sehat dengan akar yang sakit. Pohon yang terinfeksi akan mati setelah enam bulan infeksi (Wood dan Lass 1989).
Tanaman yang terserang penyakit akar cokelat menunjukkan gejala sakit ketika sudah terserang parah. Penyebaran penyakit yang lambat dan infeksi patogen yang tidak diketahui sejak awal menyebabkan penanggulangan penyakit akar cokelat terlambat. Tanaman yang sudah mati akibat penyakit akar cokelat dibongkar dan dibakar, kemudian lubang bekas tanamannya diberi 600 gram belerang dan lahan ini dapat digunakan kembali satu tahun kemudian (PPKKI 2010). Gas SO2 atau SO3 dari belerang dapat bereaksi dengan uap air di udara membentuk H2SO3 atau H2SO4 yang dapat menyebabkan hujan asam (Triharso 1994). Hujan asam menyebabkan kerusakan hutan dan mengikis lapisan tanah yang subur. Pengendalian penyakit menggunakan bahan kimia kurang efektif dan dapat berpengaruh negatif bagi lingkungan dan kesehatan manusia (Mejía et al. 2008).
2
antimikrob karena mengandung senyawa flavonoid, steroid, p-hidrokuinon, dan tanin (Sugara 2011).
Tanaman obat mengalami kelangkaan disebabkan oleh daya regenerasi yang lambat terutama jenis tumbuhan tahunan dan peningkatan jumlah populasi manusia yang berdampak pada kerusakan lingkungan dan penurunan keanekaragaman hayati (Wilson 1988). Keberadaan tanaman obat yang semakin langka menjadi kendala untuk isolasi P. lagena. Oleh karena itu, perlu dilakukan kultivasi P. lagena di laboratorium untuk menghasilkan senyawa aktif yang mampu mematikan patogen P. lamaoensis secara efisien. Selain itu, perlu dilakukan optimasi media pertumbuhan P. lagena untuk memaksimalkan senyawa aktif yang dihasilkan.
Metode konvensional rekayasa media untuk optimasi kultivasi dilakukan dengan mengubah satu parameter sedangkan parameter lainnya tetap (Liu dan Tzeng 1998). Metode ini dapat menyebabkan salah interpretasi terhadap hasil terutama ketika pengaruh interaksi antara faktor yang berbeda diabaikan. Optimasi media produksi senyawa aktif fungi endofit dapat dilakukan dengan central composite design (CCD) (Prabandari 2011). Optimasi produksi metabolit dengan menggunakan metode statistika dapat meminimalkan jumlah eksperimen yang dilakukan sehingga mampu menghemat biaya, waktu, dan tenaga. CCD merupakan rancangan percobaan yang terdiri atas 2n faktorial dengan dua level (tertinggi dan terendah) dan beberapa titik (starting point dan center point) yang memungkinkan adanya pengaruh interaksi antar faktor yang dicoba. Gambaran kondisi optimal yang diperoleh dibangun dengan response surface methodology (RSM). RSM adalah teknik gabungan antara matematika dan statistika untuk membentuk model empiris yang dapat mengkombinasi semua faktor yang terlibat dalam kultivasi (Montgomery 2001).
Perumusan Masalah
Phellinus lamaoensis merupakan patogen yang dapat menyebabkan penyakit akar cokelat pada tanaman perkebunan. Pengendalian penyakit akar cokelat menggunakan bahan kimia berpengaruh negatif terhadap lingkungan dan kesehatan manusia. Pengendalian penyakit akar cokelat dapat dilakukan dengan pengendalian hayati. Penicillium lagena menghasilkan senyawa aktif yang dapat menghambat pertumbuhan P. lamaoensis. Produksi senyawa aktif P. lagena bergantung pada ketersediaan sumber nutrisi dan mineral pada proses kultivasi. Penelitian mengenai optimasi produksi senyawa aktif P. lagena sebagai agen biofungisida dengan response surface methodology belum dilakukan. Senyawa aktif P. lagena diduga jenisnya dengan liquid chomatography-mass spectrometer (LC-MS).
Tujuan Penelitian Penelitian ini bertujuan untuk:
3 2. Mendapatkan sumber nitrogen terbaik yang menghasilkan senyawa aktif P.
lagena sebagai antifungi patogen P. lamaoensis dengan kadar tertinggi. 3. Menguji pengaruh mineral terhadap produksi senyawa aktif P. lagena sebagai
antifungi patogen P. lamaoensis.
4. Mendapatkan komposisi media kultivasi optimal untuk produksi senyawa aktif P. lagena sebagai antifungi patogen P. lamaoensis dengan metode response surface methodology.
5. Mendapatkan informasi berat molekul dan struktur kimia senyawa antifungi yang dihasilkan P. lagena
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai senyawa aktif P. lagena dan kondisi optimum media kultivasi senyawa aktif P. lagena. Manfaat penelitian ini bagi masyarakat antara lain memperkaya khasanah iptek dan kelak dapat diaplikasikan sebagai pengendali biologi bagi patogen P. lamaoensis yang menyebabkan penyakit akar cokelat pada beberapa tanaman perkebunan, sehingga pengendalian penyakit akar cokelat menggunakan bahan kimia dapat dihindari.
Ruang Lingkup Penelitian
Ruang lingkup penelitian seleksi dan optimalisasi media fermentasi untuk produksi senyawa aktif Penicillium lagena adalah sebagai berikut:
1. Pemuliaan dan peremajaan isolat Penicillium lagena dan Phellinus lamaoensis.
2. Identifikasi makromorfologi dan mikromorfologi P. lagena.
3. Kultivasi perbanyakan sel P. lagena dengan kultur kocok dalam erlenmeyer 500 mL dengan volume kerja 50 mL pada pH 5.8, suhu 28°C, pengocokan 220 rpm selama 48 jam.
4. Kultivasi produksi senyawa aktif P. lagena dengan kultur kocok dalam erlenmeyer 250 mL dengan volume kerja 25 mL pada pH 5.9, suhu 25°C, pengocokan 220 rpm selama 120 jam.
5. Ekstraksi senyawa aktif dari kaldu kultivasi dengan pelarut organik.
6. Analisis parameter produksi yang meliputi konsentrasi senyawa aktif P. lagena yang dilihat dari luas area hasil HPLC dan diameter zona bening dalam uji antagonis dengan patogen P. lamaoensis.
4
2
TINJAUAN PUSTAKA
Penicillium lagena
Menurut McLean et al. (2005) Penicillium lagena merupakan salah satu jenis cendawan yang umum terdapat pada hutan berkayu. Penicillium lagena ditemukan juga pada sedimen Ocean Pacifik kedalaman 10500 m di Mariana Trench (Takami et al. 2007) dan tanaman obat-abatan (Kaswati 2013).
Klasifikasi (Stolk dan Samson 1983) Divisi : Fungi
Subdivisi : Ascomycota Kelas : Eurotiomycetes Suku : Trichocomaceae Genus : Penicillium
Spesies : Penicillium lagena
Phellinus lamaoensis
Phellinus lamaoensis (Murr.) Hein sinonimnya Fomes noxius Corner atau Fomes lamaoensis Murr. adalah patogen yang dapat menyebabkan penyakit akar cokelat pada tanaman kakao, teh, karet, dan kopi (Semangun 2000). Gejala-gejala tanaman terserang penyakit akar cokelat, yaitu pertumbuhan tanaman lambat, daun menguning dan layu, batang dieback, dan tanaman mati. Gejala-gejala ini dapat terjadi cepat atau lambat tergantung jumlah akar yang diinfeksi. Gejala yang timbul dipermukaan tanah karena akar membusuk dan tidak dapat mentransfer air dan nutrisi dari tanah (Brooks 2002).
Phellinus lamaoensis termasuk kelas basidiomycetes. P. lamaoensis parasit fakultatif yang mengambil nutrisi dari jaringan tanaman yang mati atau akan mati. Miselium dari patogen tanaman tropika ini tumbuh baik pada suhu 25-30°C serta tidak dapat tumbuh pada suhu di bawah 4°C dan di atas 40°C. Perkembangan koloni P. lamaoensis di laboratorium memiliki perkembangan yang khusus, yaitu berwarna cokelat atau putih (Brooks 2002).
5 Mikroorganisme Endofit
Endofit adalah mikroorganisme (umumnya cendawan dan bakteri) yang berada hampir disemua jaringan tanaman namun tidak menyebabkan kerugian atau menginfeksi tanaman. Endofit berkoloni pada jaringan internal tanaman di bawah lapisan sel epidermal dan tinggal di bagian interseluler dengan mempenetrasi sel hidup. Endofit dapat menjadi parasit ketika inangnya stress. Cendawan endofit banyak tergolong ascomycetes dan cendawan anamorf (Selim et al. 2012).
Di dunia, terdapat sekitar 300.000 spesies tanaman dan setiap tanaman merupakan inang untuk satu atau lebih endofit dan beberapa endofit mengkoloni inang yang khusus. Kebanyakan endofit menghasilkan bioaktif yang dibutuhkan untuk interaksi dengan tanaman inang atau sebagai sumber yang potensial untuk aplikasi dalam bidang kesehatan, pertanian, dan industri (Selim et al. 2012). Mikroorganisme endofit menghasilkan senyawa aktif dengan berbagai macam fungsi. Endofit Hypocrea spp. yang diisolasi dari Dillenia indica Linn. sebagai antimikroba patogen Staphylococcus aureus dan Fusarium oxysporum (Gogoi et al. 2008), endofit Tubercularia sp. galur TF5 yang diisolasi dari Taxus mairei sebagai antikanker (Wang et al. 2000), fungi endofit yang diisolasi dari Mezzetia parviflora Becc. sebagai antioksidan (Mufidah et al. 2013), fungi endofit yang diisolasi dari Acacia sp. sebagai antibakteri dan antifungi (Tran et al. 2010). Deskripsi tentang populasi endofit masih sedikit diketahui, hal ini memberi kesempatan untuk menemukan galur dan produk baru dari mikroorganisme endofit yang mengkolonisasi tanaman pada relung dan ekosistem yang berbeda.
Metabolit Sekunder
Makhluk hidup menghasilkan senyawa yang dihasilkan dari metabolit primer dan metabolit sekunder. Metabolit primer dihasilkan melalui metabolisme primer, seperti respirasi, glikolisis, dan siklus asam sitrat. Metabolisme primer yang terjadi pada seluruh makhluk hidup di dalam selnya hampir semua memiliki kemiripan baik proses, produk yang terbentuk, dan fungsi biologisnya (Seigler 1998). Menurut Mardad et al. (2013), metabolisme primer bakteri pendegradasi fosfat (inorganic-phosphate solubilizing bacteria (PSB)) yang diisolasi dari pertambangan Moroccan menghasilkan asam glutamat, asetat, suksinat,
oksaloasetat, piruvat, malat, fumarat, dan α-ketoglutarat.
Metabolit sekunder dihasilkan oleh makhluk hidup melalui turunan jalur metabolit primer yang tidak secara langsung terlibat dalam pertumbuhan dan perkembangan. Senyawa metabolit sekunder tidak disintesis pada fase pertumbuhan yang cepat (trophophase), namun disintesis pada tahap produksi setelahnya (idiophase). Sintesis metabolit sekunder dimulai ketika salah satu sumber nutrien (karbon, nitrogen, atau fosfat) habis. Antibiotik β-laktam, yaitu penisilin, sefalosporin, dan sefamisin dihasilkan dari turunan jalur sintesis asam amino (González et al. 2003).
6
Misal, biosintesis alkaloid pada fungi genus Claviceps dimulai setelah pembentukan dua enzim, yaitu DMAT (tryptophan dimethylallytransferase) sintetase dan chanoclavine siklikase pada tahap awal fase stasioner. Sintesisnya dipengaruhi oleh enzim DMAT sintetase dengan subsrat L-tryptophan ditambahkan pada awal fase pertumbuhan sebagai prekursor (Seigler 1998).
Metabolit sekunder yang dihasilkan oleh makhluk hidup sangat beragam jenis, fungsi, dan aplikasinya. Metabolit sekunder memiliki aktivitas biologi yang dapat diaplikasikan dalam bidang industri, pertanian, dan farmasi. Taxol sebagai antikanker (Wang et al. 2000), mechercharmycins A sebagai antitumor (Kanoh et al. 2005), penisilin sebagai antibiotik dan oocydin sebagai antifungi (Selim et al. 2012), lovastatin sebagai antikolesterol (Alarcón dan Águila 2005), dan spirofungin dan reveromycin sebagai antifitopatogen (Sari 2011).
Optimasi Kultivasi
Pembentukan produk metabolit sekunder dipengaruhi oleh beberapa faktor, seperti komponen media, temperatur, pH, dan induser. Namun, tidak semua faktor memiliki pengaruh yang signifikan terhadap proses produksi. Komponen subsrat pada kultur buatan in vitro sangat berpengaruh terhadap produksi metabolit sekunder (Seigler 1998). Formulasi media dilakukan untuk mendapat sistem pertumbuhan terbaik, memaksimalkan produk, dan meminimalkan biaya dan teknologi. Metode konvensional rekayasa media untuk optimasi kultivasi dilakukan dengan mengubah satu parameter sedangkan parameter lainnya tetap (Liu dan Tzeng 1998). Optimasi dengan satu variabel dapat menyebabkan salah interpretasi terhadap hasil terutama ketika pengaruh interaksi antara faktor yang berbeda diabaikan.
Response surface methodology (RSM) adalah teknik gabungan antara matematika dan statistika untuk membentuk model empiris. RSM dalam optimasi kultivasi dapat mengkombinasi semua faktor yang terlibat dalam kultivasi. RSM dapat dilakukan dengan central composite design (CCD), Box-Behnken design dan face-centered central composite design (Montgomery 2001).
Model berordo dua (persamaan 1) dapat dibangun secara efektif dengan central composite design (CCD). CCD adalah model ordo satu (2N) ditambahkan dengan titik pusat dan axial untuk menduga parameter pada model ordo dua. CCD dapat didesain menggunakan 2N faktorial, 2N titik axial, dan 1 titik pusat (Gambar 1). Model ordo dua merupakan model yang umum digunakan dalam RSM khususnya ketika bagian yang menjadi perhatian terbatas (Unal et al. 1998).
7 y = b0 + Σ bi xi + Σ bii xi2 + ΣΣ bij xi xj ... (persamaan 1)
xi = variabel yang berpengaruh terhadap respon y b0, bi, bij = koefisien regresi
Central composite design sangat efisien untuk mendesain model ordo dua yang tepat dalam suatu penelitian. Dua parameter yang harus ditetapkan dalam
CCD, yaitu jarak α antara titik pusat dengan titik axial dan jumlah ulangan titik
pusat. Nilai α ditentukan dengan rumus α = (nf)1/4, dimana nf adalah jumlah percobaan dalam faktorial. Design respon permukaan dengan model ordo dua harus bersifat rotatable, yaitu prediksi varian responnya sama pada semua titik x yang memiliki jarak yang sama dari titik pusat. Jumlah ulangan pada titik pusat untuk menduga error percobaan dan untuk mengecek kesesuaian model (Montgomery 2001).
Central composite design dapat dirancang menggunakan 3N faktorial percobaan untuk menyusun model ordo dua (persamaan 1). Desain ini akan menjadi sulit ketika faktor yang diuji berjumlah lima, sehingga membutuhkan 243 percobaan (Unal et al. 1998). CCD tiga variabel dengan dua level telah dilakukan untuk optimasi media produksi asam 8-hydroxy 9,12-octadecadienoic dari kapang endofit Curvularia lunata BioMCC FE-00283 (Prabandari 2011).
3
METODE
Waktu dan Tempat
Penelitian dilakukan mulai September 2014 – September 2015 di Balai Pengkajian Bioteknologi Badan Pengkajian dan Penerapan Teknologi (Biotek-BPPT) Laboratorium Mikrobiologi Serpong, Tangerang Selatan.
Bahan
8
Alat
Peralatan yang digunakan ialah oven, autoklaf, alumunium foil, pH meter, bulb, neraca analitik, erlenmeyer, tabung reaksi, laminar, stirrer, parafilm, oven, shaker, penangas air, rotary vaccum evaporator, tabung sentrifus 50 mL, tabung sentrifus 15 mL, tabung rotavapor, spatula, parafilm, pipa kapiler, kolom, spektrometer, CAmag UV cabinet II, HPLC analitik (Waters 2695), dan Liquid chromatography–mass spectrometry (LC-MS (XEVO - G2QTOF (Waters))).
Prosedur
Pembuatan Media PDA (Potato Dextrose Agar)
Sebanyak 15.6 gram potatoes dextrose agar ditambahkan akuades hingga volumenya mencapai 400 mL pH 5.6 dalam erlenmeyer. Media disterilisasi selama 15 menit pada suhu 121ºC.
Pembuatan Media F1 (Kode Instansi)
Komposisi media F1, yaitu 10 g L-1 tepung beras, 10 g L-1 glukosa, 20 g L-1 soybean meal, 1 g L-1 KH2PO4, dan 0.5 g L-1 MgSO4.7H2O. pH diukur hingga 5.8. Sebanyak 50 mL larutan media dimasukkan ke dalam erlenmeyer 500 mL yang berisi glass bead, kemudian disterilisasi pada suhu 121ºC selama 15 menit.
Pembuatan Media F15 (Kode Instansi)
Komposisi media F15, yaitu 30 g L-1 glukosa, 20 mL L-1 gliserol, 10 g L-1 dekstrin, 10 g L-1 malt extract, 10 g L-1 yeast extract, 1 g L-1 tripton, 1 g L-1 KH2PO4, dan 1 g L-1 NH4NO3. pH diukur hingga 5.9. Sebanyak 25 mL larutan media dimasukkan ke dalam erlenmeyer 250 mL, kemudian disterilisasi selama 15 menit pada suhu 121ºC, dan didinginkan pada suhu ruang selama 1 hari.
Regenerasi Penicillium lagena
Penicillium lagena yang berada dalam vial (didiamkan pada suhu ruang) dipindahkan ke media PDA dan diinkubasi pada suhu 28ºC selama 5-7 hari.
Regenerasi Phellinus lamaoensis
Phellinus lamaoensis yang merupakan fitopatogen tanaman kakao diregenerasi pada media PDA dan diinkubasi pada suhu 28ºC selama 5-7 hari.
Pengamatan Morfologi Penicillium lagena
9 disebar ke media PDA dalam cawan petri. Koloni tunggal diamati bentuk, permukaan, tekstur, warna, dan diameter sebagai ciri makromorfologi. Pengamatan mikromorfologi dilakukan dengan cara, media agar berdiameter ± 5 mm diletakkan di atas kaca preparat. Media agar diinokulasi P. lagena dengan cara menusukkannya dengan tusuk gigi steril kemudian ditutup dengan kaca penutup. Dua hari kemudian diamati di bawah mikroskop.
Kultivasi Kultur Seed
Kultur seed dilakukan pada 50 mL media F1 di dalam erlenmeyer 500 mL. P. lagena yang tumbuh pada media PDA miring, ditambahkan 6 mL NaCl fisiologis. Media F1 diinokulasi sebanyak 2% P. lagena yang telah diregenerasi. Jumlah sel yang diinokulasi sekitar 103-104 sel mL-1. Kultur seed diinkubasi dalam orbital shaker incubator pada suhu 28ºC, 220 rpm selama 48 jam.
Penentuan Kurva Pertumbuhan Penicillium lagena pada Kultur Seed (Sunaryanto 2011)
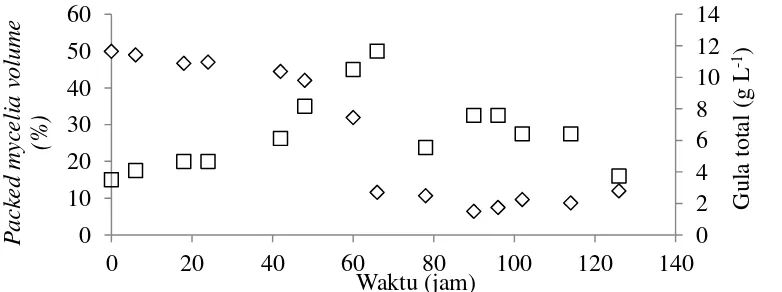
Sampel dari media F1 diambil sebanyak 10 mL dan disentrifuse dengan kecepatan 1470 g selama 20 menit. Pelet diukur volumenya sebagai packed mycelia volume serta ditentukan persentasenya sedangkan supernatan untuk penentuan kadar gula total. Pada setiap interval waktu enam jam, sampel mikroorganisme diukur absorbansinya pada panjang gelombang 550 nm untuk penentuan kadar gula total. Kurva pertumbuhan diperoleh dengan memplotkan hubungan antara waktu dengan kadar biomassa dan gula total.
Perhitungan Gula Total dengan Metode DNS (Miller 1959)
Sebanyak 0.5 gram sampel ditambahkan 1 mL HCl 4N dan dipanaskan selama 20 menit. Setelah dingin, larutan ditambahkan 2 mL NaOH 2N. Sampel diencerkan sesuai dengan perkiraan konsentrasi gula pereduksi yang terdapat di dalam sampel. Sebanyak 1 mL larutan ditambahkan dengan 3 mL DNS dan dipanaskan selama 5 menit. Absorbansi dibaca panjang gelombang 550 nm.
Kultivasi Kultur Produksi
Kultur produksi dilakukan pada 25 mL media F15 di dalam erlenmeyer 250 mL. Media diinokulasi dengan 10% cendawan yang ditumbuhkan pada media F1. Jumlah sel yang diinokulasi sekitar 104-105 sel mL-1. Kultur produksi diinkubasi dalam orbital shaker incubator pada suhu 25ºC, 220 rpm selama 120 jam.
Ekstraksi Senyawa Aktif
10
Supernatan yang diperoleh diekstrak menggunakan etil asetat. Media kultivasi yang telah digunakan ditambah dengan pelarut etil asetat dengan rasio 1:1 (v/v). Campuran media dan pelarut dikocok selama 30 menit. Fase etil asetat dikeringkan menggunakan centrifugal concentrator. Berat ekstrak ekstraseluler ini selanjutnya dihitung menggunakan neraca analitik.
Uji Aktivitas Penicillium lagena terhadap Phellinus lamaoensis
Phellinus lamaoensis yang tumbuh pada media PDA miring, ditambah 6 mL NaCl fisiologis dan diinokulasi ke media PDA sebanyak 5% dari volume media PDA. Jumlah sel yang diinokulasi tersebut sekitar 103-104 sel mL-1. Kemudian media dan inokulum dihomogenkan dan dituang ke cawan petri. Ekstrak kering pada proses ekstraksi dengan pelarut etil asetat dibuat konsentrasinya menjadi 5000 ppm dalam metanol 98.9%. Kontrol negatif dengan metanol 98.9% dan kontrol positif dengan nistatin 1000 ppm. Kertas cakram ditetesi 20 µL larutan ekstrak, metanol, dan nistatin. Kertas cakram dipindahkan ke media PDA yang telah disiapkan sebelumnya dan diinkubasi pada suhu 28ºC. Pertumbuhan cendawan diamati setiap hari dengan memperhatikan zona bening yang terbentuk. Zona bening menunjukkan adanya senyawa bioaktif (antifungi) yang dihasilkan oleh mikroorganisme sebagai bentuk pertahanan terhadap cendawan patogen.
Kromatografi Cair Kinerja Tinggi (KCKT)/High Performance Liquid Chromatography (HPLC) (Adlani 2009)
Kemurnian dari ekstrak metabolit dianalisis menggunakan KCKT analitik.
Sistem KCKT yang digunakan adalah “HPLC Water 2695” dengan kolom fase
balik (reversed phase) Symmetry C18 (5 μm; 4,6 x 250 mm) volume injeksi 10
μL injek-1, detektor Photo Dioda Array (PDA) Uv-vis pada panjang gelombang 210 nm. Sampel dielusi secara gradien menggunakan asetonitril 5% sampai 100% selama 35 menit. Fase gerak yang digunakan adalah asetronitril 100% dan TFA 0.1%. Puncak yang diduga sebagai senyawa aktif ditampung dan dipekatkan. Luas area yang terbentuk dihitung sebagai konsentrasi senyawa aktif P. lagena.
Pemilihan Sumber Karbon dan Sumber Nitrogen
11 masing-masing media diekstrak kemudian diuji dengan HPLC serta uji aktivitas dengan mengukur diameter zona bening.
Pemilihan Konsentrasi Larutan Mineral Terbaik
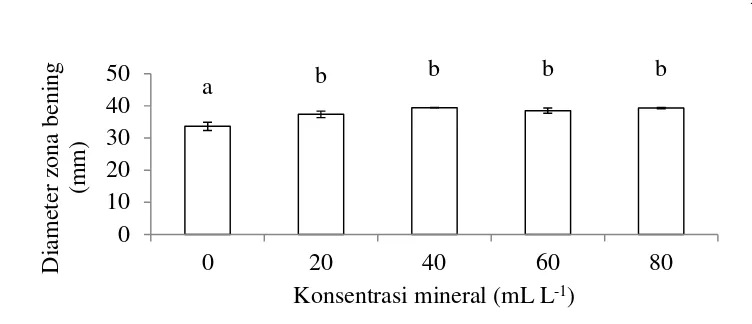
Menurut Ghatora et al. (2006) larutan mineral untuk media kultivasi Penicillium lagena terdiri dari (% b v-1) 0.2 (NH4)2S04, 0.5 KCl, 0.1 CaCl2, 0.5 MgSO4, 0.01 ZnSO4, dan 0.005 CuSO4. Larutan mineral ditambahkan ke media kultivasi Penicillium lagena masing-masing 0, 20, 40, 60, dan 80 mL. Media diinokulasi dengan 10% cendawan yang ditumbuhkan pada media F1. Kultivasi Penicillium lagena dilakukan dengan menggunakan kultur kocok pada erlenmeyer 250 mL volume kerja 25 mL pada suhu 25ºC, 220 rpm selama 120 jam. Penambahan larutan mineral yang menghasilkan senyawa aktif dengan konsentrasi tertinggi dan diameter zona bening tertinggi pada uji aktivitas digunakan untuk optimasi media.
Optimasi Komposisi Media Kultivasi untuk Produksi Senyawa Aktif Penicillium lagena
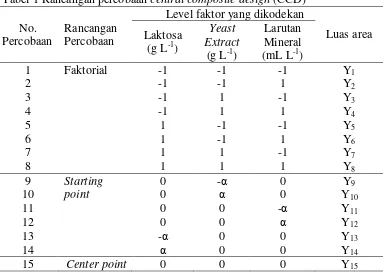
Rancangan optimasi media menggunakan rancangan central composite design (CCD). Rancangan yang digunakan mengandung tiga taraf faktor, yaitu rancangan faktorial 23, starting point (titik awal), dan center point (titik tengah) yang dikodekan untuk tiap faktor (Tabel 1). -1 adalah batas bawah, 0 adalah titik tengah, 1 adalah batas atas, dan α adalah starting point. Kultivasi Penicillium lagena dilakukan dengan menggunakan kultur kocok pada erlenmeyer 250 mL volume kerja 25 mL pada suhu 25ºC, 220 rpm selama 120 jam.
12
Analisis Data
Konsentrasi senyawa aktif P. lagena dari media dengan sumber karbon, nitrogen, dan larutan mineral terpilih dianalisa dengan analisis ragam untuk melihat perbedaan respon antar peubah. Data optimasi media diolah menggunakan perangkat lunak Design Expert versi 7 untuk mendapatkan model matematika sebagai berikut :
Y = b0 + b1X1i + b2 X2i + b3 X3i + b11X12 + b22X22 + b33X32 + b12X1X2 + b13X1X3 + b23X2X3
Keterangan : b0, bi, bij = koefisien regresi Y = konsentrasi senyawa aktif
X1 = konsentrasi sumber karbon (g L-1) X2 = konsentrsi sumber nitrogen (g L-1) X3 = konsentrasi larutan mineral (mL L-1)
Model yang diperoleh diujikan kembali di laboratorium sebanyak lima ulangan untuk pengujian kesesuaian model.
Analisis Ekstrak Aktif dengan Liquid Chromatography-Mass Spectrometer (LC-MS)
Bobot dan rumus molekul senyawa aktif ditentukan dengan spektrum LC-MS (ESI positif ion). Ekstrak P. lagena dibuat konsentrasinya menjadi 100 ppm dalam larutan metanol 98.9%. Sebanyak 5 µL larutan diinjeksikan ke dalam LC-MS. Kolom yang digunakan TOF MS ES+. Laju alir fase gerak 0.3 mL menit-1. Eluen yang digunakan H2O + 0.1% asam format dan asetonitril dengan detektor ESI-MS positive ion mode.
4
HASIL DAN PEMBAHASAN
Morfologi Penicillium lagena
Koloni Penicillium lagena berwarna putih, massa berkatun, bulat dengan diameter 9 – 20 mm, bagian tengah lebih tebal dibandingkan bagian pinggir dan pinggiran bercabang (Gambar 2a). Dinding konidiofor halus dan tipis, konidiofor ada yang bercabang dan tidak bercabang, berdiri sendiri atau berkelompok dalam kluster, dan terdapat konidium pada bagian ujung (Gambar 2b). Menurut Refai et al. (2015), makromorfologi Penicillium sp. bervariasi baik tingkat pertumbuhan, tekstur, dan warna. Diameter Penicillium sp. mulai dari 5 mm sampai 45 mm, dapat tumbuh pada suhu 21 – 37 ºC. Variasi tekstur Penicillium sp., yaitu beludru, massa berkatun, dan kasar atau bergranular. Warna koloni putih, abu-abu, jingga, kuning, kuning kecoklatan, dan merak kecoklatan. Secara mikromorfologi, Penicillium sp. mempunyai konidiofor, phialides, metulae, dan konidium. Akan tetapi pada Gambar 2b antara phialides dan metulae tidak dapat dibedakan.
13
Kurva Pertumbuhan Penicillium lagena pada Media F1
Kurva pertumbuhan pada media F1 digunakan untuk mengetahui waktu yang tepat untuk transfer inokulum dari kultur seed ke kultur kultivasi, yaitu mendekati akhir fase logaritmik. Fase penyesuaian atau fase lag terjadi selama kurang lebih 30 jam. Pada fase lag, belum terjadi penambahan jumlah sel akan tetapi berat sel mungkin sudah bertambah (Crueger dan Crueger 1984). Fase pertumbuhan atau logaritmik terjadi pada rentang waktu jam ke-30 sampai jam ke-66. Pada fase ini terjadi pertumbuhan sel yang cepat dengan konsumsi gula yang cukup banyak. Kemudian pertumbuhannya menurun dan mengalami kematian (Gambar 3). Berdasarkan kurva pertumbuhan P. lagena pada media F1, maka waktu pemindahan inokulum dari kultur seed ke kultur kultivasi dapat dilakukan antara jam ke-48 sampai ke-60. Mikroorganisme yang membentuk senyawa metabolit sekunder mengalami dua fase yaitu trophophase dan idiophase. Pada trophophase, mikroorganisme membentuk senyawa metabolit primer sedangkan idiophase adalah fase setelahnya saat mikroorganisme membentuk senyawa metabolit sekunder (Waites et al. 2001).
Konidiofor Konidium
Gambar 2 Morfologi Penicillium lagena. Makromorfologi (a); mikromorfologi (b)
14
Biosintesis metabolit sekunder tidak berhubungan dengan pertumbuhan sel. Ketika produk metabolit sekunder menjadi produk target dalam fermentasi, maka media awal didesain untuk pertumbuhan sel kemudian diperlukan optimasi kondisi (media) untuk produksi metabolit sekunder (Waites et al. 2001). Senyawa aktif yang dihasilkan oleh P. lagena merupakan senyawa metabolit sekunder. Oleh karena itu, kultur seed digunakan untuk perbanyakan sel dan selanjutnya dilakukan optimasi kondisi untuk menghasilkan senyawa aktif P. lagena. Media F1 yang digunakan mengandung soybean meal. Media soybean meal digunakan untuk perbanyakan sel dalam kultur cair Penicillium sp. oleh Vargas et al. (2008) dan Tan et al. (2004).
Kultivasi, Ekstraksi, dan Uji aktivitas Senyawa Aktif P. lagena dengan Media F15
Fermentasi adalah proses untuk menghasilkan produk melalui kultur massa mikroorganisme. Dalam fermentasi, mikroorganisme membutuhkan air, karbon, nitrogen, mineral, dan oksigen apabila prosesnya aerob (Stanbury et al. 2003). Media F15 mengandung sumber karbon dari glukosa, gliserol, dan dekstrin sumber nitrogen dari malt extract, yeast extract, tripton, dan NH4NO3 serta mineral dari KH2PO4.
Ekstraksi adalah pemisahan senyawa-senyawa kimia dari cairan campuran dengan pelarut cair yang dapat melarutkan senyawa yang diinginkan (Stanbury et al. 2003). Ekstraksi senyawa aktif P. lagena menggunakan pelarut etil asestat. Etil asetat merupakan golongan ester dan bersifat semipolar (Smallwood 1996). Sifat pelarut merepresentasikan sifat senyawa antifungi yang diperoleh. Ekstrak yang diperoleh diuji dengan HPLC dan LC-MS serta diuji aktivitasnya.
15
Gambar 5 Uji aktivitas. Senyawa aktif P. lagena yang diproduksi dengan media F15 (a), kontrol negatif dengan metanol 98.9% (b), dan kontrol positif dengan 1000 ppm nistatin (c)
Uji aktivitas ekstrak senyawa aktif P. lagena dilakukan dengan metode difusi agar. Senyawa aktif P. lagena dengan konsentrasi 5000 ppm diuji terhadap patogen P. lamaoensis yang diinokulasi ke dalam media agar sebanyak 103-104 sel mL-1. Kontrol negatif menggunakan pelarut metanol 98.9% sedangkan kontrol positif menggunakan 1000 ppm nistatin. Uji aktivitas dengan senyawa aktif P. lagena menghasilkan zona bening di sekitar cakram dengan diameter 27.45 mm. Pada kontrol negatif tidak terbentuk zona bening sedangkan pada kontrol positif terbentuk zona bening dengan diameter 13.87 mm (Gambar 5).
a b c
Zona bening yang terbentuk di sekitar kertas cakram menunjukkan bahwa ekstrak yang diuji mampu menghambat pertumbuhan patogen uji. Kontrol negatif untuk membuktikan bahwa zona bening yang terbentuk bukan disebabkan oleh pelarut metanol. Nistatin merupakan senyawa kimia yang berfungsi sebagai antifungi. Senyawa aktif P. lagena mampu mematikan fungi patogen uji seperti aktivitas kontrol positif nistatin.
27.45 mm 13.87 mm
16
Prinsip dari metode difusi agar adalah mendifusikan secara bebas senyawa uji yang diketahui konsentrasinya ke seluruh media agar yang telah dicampur dengan mikroorganisme uji. Pada saat difusi, senyawa uji bisa menjadi tidak aktif atau hilang karena berinteraksi dengan komponen padat dalam media, beragregasi atau mekanisme lain yang menyebabkan senyawa uji menjadi tidak aktif (Bonev et al. 2008). Zona bening yang terbentuk tergantung pada konsentrasi inokulum, laju pertumbuhan mikroorganisme uji, konsentrasi senyawa uji, temperatur, pH, dan kondisi agar (Finn 1959).
Pemilihan Sumber Karbon Terbaik
Media kultivasi harus mengandung nutrisi yang dibutuhkan oleh mikroorganisme. Nutrisi dalam media harus diformulasi untuk meningkatkan sintesis produk yang diinginkan, biomassa sel, atau metabolit spesifik. Formulasi media tergantung pada skala kultivasi. Pada skala laboratorium, diperlukan senyawa yang murni (pure chemical) untuk menentukan komposisi media yang terbaik (Waites et al. 2001).
Sumber karbon berfungsi untuk biosintesis dan sumber energi bagi mikroorganisme. Metabolisme sumber karbon dapat mempengaruhi pembentukan biomassa serta produk metabolit primer atau sekunder. Penyediaan sumber karbon dalam konsentrasi yang cukup diperlukan untuk membentuk produk yang diinginkan (Stanbury et al. 2003). Penelitian ini menggunakan sumber karbon dari senyawa murni, yaitu laktosa, galaktosa, maltosa, dan glukosa.
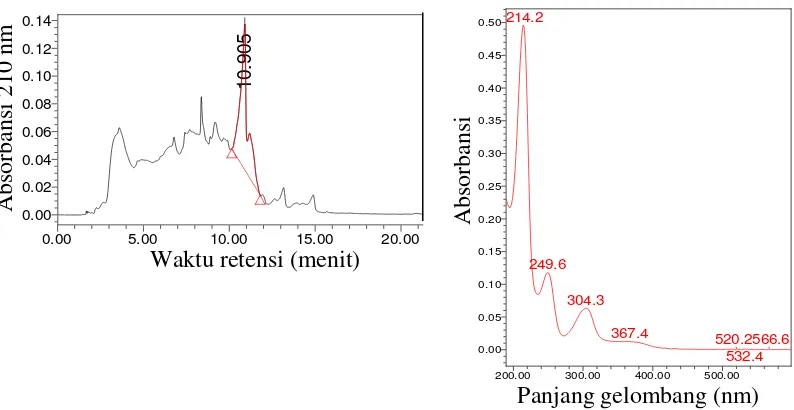
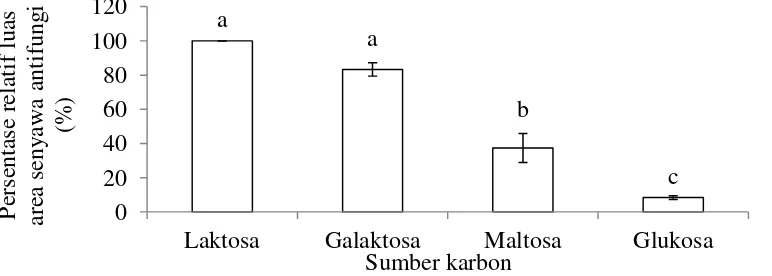
Sumber karbon dalam media kultivasi P. lagena yang menghasilkan senyawa antifungi memberikan respon yang berbeda nyata. Hasil HPLC menunjukkan laktosa memiliki persentase relatif luas area senyawa antifungi terbesar dibandingkan galaktosa, maltosa, dan glukosa. Hasil uji lanjut dengan uji perbandingan berganda Duncan pada taraf nyata 0.05 menunjukkan bahwa persentase relatif luas area senyawa antifungi antara laktosa, maltosa dan glukosa berbeda nyata sedangkan antara laktosa dan galaktosa tidak berbeda nyata (Gambar 6, Lampiran 4). Puncak senyawa aktif P. lagena dengan media laktosa dan galaktosa terbentuk pada menit ke 11.09 dengan serapan gelombang maksimum sebesar 202 – 304. Sedangkan dengan media maltosa dan glukosa terbentuk pada menit ke 10.99 dengan serapan gelombang maksimum sebesar 214
– 593 (Lampiran 7).
17
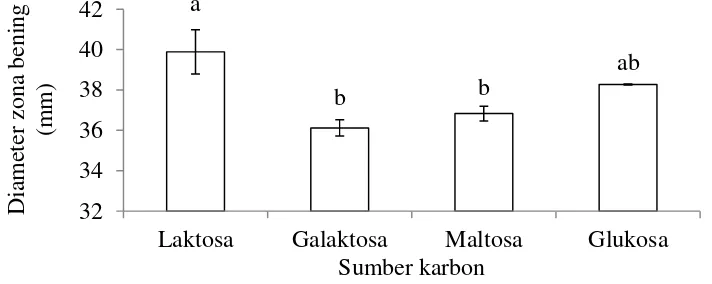
Terhadap hasil ekstraksi dilakukan uji antagonis dengan mikroorganisme uji Phellinus lamaoensis. Zona bening yang terbentuk menunjukkan besarnya hambatan pertumbuhan P. lamaoensis oleh senyawa antifungi yang dihasilkan P. lagena. Sumber karbon yang berbeda menghasilkan diameter zona bening yang berbeda nyata. Laktosa menghasilkan diameter zona bening terbesar dan diikuti dengan glukosa, maltosa, dan galaktosa. Hasil uji lanjut dengan uji perbandingan berganda Duncan pada taraf nyata 0.05 menunjukkan bahwa diameter zona bening berbeda nyata antara laktosa dengan galaktosa dan maltosa namun tidak berbeda nyata dengan glukosa. Antara glukosa, maltosa, dan galaktosa juga menunjukkan hasil yang tidak berbeda nyata (Gambar 7, Lampiran 4). Berdasarkan hasil luas area dan diameter zona bening, maka sumber karbon terbaik adalah laktosa.
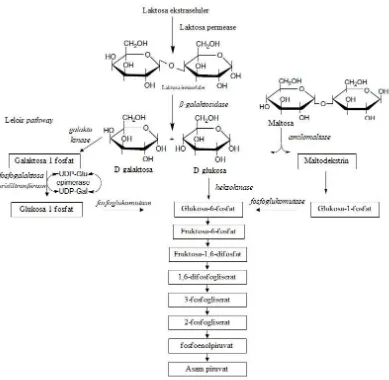
Laktosa adalah disakarida yang secara bioteknologi merupakan sumber karbon yang penting untuk fermentasi mikroorganisme. Laktosa disintesis pada organel golgi dalam kelenjar susu. Fungi dapat menghidrolisis laktosa secara
ekstraseluler dan intraseluler. Laktosa dihidrolisis oleh β-galaktosidase menjadi
galaktosa dan glukosa (Seiboth et al. 2007).
Glukosa adalah monosakarida yang dikatabolisme dalam siklus glikolisis menjadi dua molekul piruvat. Glukosa digunakan oleh sel sebagai sumber energi dan metabolit intermediat untuk pathway selanjutnya. Galaktosa berbeda dengan glukosa pada atom C nomor 4. Galaktosa diubah melalui pathway Leloir menjadi
glukosa. β-D-galaktosa diubah oleh enzim mutarotase menjadi α-D-galaktosa.
Galaktokinase memfosforilasi α-D-galaktosa menjadi galaktosa-1-fosfat.
Galaktosa diubah oleh kelompok glukosa dari glukosa menjadi UDP-galaktosa dan melepaskan glukosa-1-fosfat. Glukosa-1-fosfat diubah menjadi glukosa-6-fosfat dan kemudian masuk ke dalam siklus glikolisis (Sellick et al. 2008). Maltosa adalah disakarida glukosa. Amilomaltase menghidrolisis maltosa menjadi D-glukosa dan maltodekstrin. Maltodekstrin fosforilase mengubah maltodekstrin menjadi glukosa-1-fosfat. Fosfoglukomutase mengisomerisasi glukosa-1-fosfat menjadi glukosa-6-fosfat dan kemudian masuk ke dalam siklus glikolisis (Moat et al. 2002, Gambar 8).
18
Gambar 8 Lintasan metabolisme laktosa, glukosa, galaktosa, dan maltosa sampai terbentuk asam piruvat (Moat et al. 2002)
Metabolit sekunder dihasilkan oleh makhluk hidup melalui turunan jalur metabolit primer. Metabolit sekunder tidak secara langsung terlibat dalam pertumbuhan dan perkembangan mikroorganisme. Senyawa metabolit sekunder tidak disintesis pada fase pertumbuhan (trophophase), namun disintesis pada fase produksi (idiophase). Sintesis metabolit sekunder dimulai ketika salah satu sumber nutrien (karbon, nitrogen, atau fosfat) habis. Pembentukan produk metabolit sekunder dilakukan setelah pembentukan enzim tertentu sehingga substrat sangat berpengaruh terhadap produksi metabolit sekunder terutama kultur buatan secara in vitro (Seigler 1998).
19 Pemilihan sumber karbon laktosa, glukosa, galaktosa, dan maltosa didasarkan pada perbedaan lintasan metabolismenya. Media kultivasi dengan menggunakan laktosa, galaktosa, dan maltosa dapat menghasilkan senyawa aktif P. lagena dengan konsentrasi lebih tinggi dibandingkan glukosa. Hal ini salah satunya dapat disebabkan laktosa, galaktosa, dan maltosa tidak dapat digunakan secara langsung untuk metabolisme primer akan tetapi harus diubah terlebih dahulu. Sedangkan glukosa dapat dikatabolisme secara langsung untuk metabolisme primer.
Pembentukan senyawa antifungi oleh P. lagena diduga diinduksi oleh galaktosa. Hal ini ditunjukkan dengan tingginya konsentrasi senyawa antifungi ketika dikultivasi dengan media yang mengandung laktosa dan galaktosa. Media yang mengandung laktosa menghasilkan senyawa antifungi paling tinggi karena glukosa yang dipecah dari laktosa dapat digunakan untuk pertumbuhan mikroorganisme sedangkan galaktosa untuk menginduksi pembentukan senyawa antifungi. Oleh karena itu, laktosa dipilih sebagai sumber karbon dengan konsentrasi 44.81 g L-1 sebagai level 0 untuk penelitian tahap selanjutnya. Menurut Seiboth et al. (2007), laktosa dapat menginduksi enzim selulolitik yang dapat menghasilkan selulase dan protein rekombinan pada Hypocrea jecorina (Trichoderma reesei). Sedangkan menurut Gallo dan Katz (1972) glukosa dapat menekan enzim phenoxazinone synthase yang dapat menghasilkan antibiotik aktinomisin pada Streptomysec sp. namun galaktosa tidak menekan enzim phenoxazinone synthase dalam produksi antibiotik aktinomisin.
Pemilihan Sumber Nitrogen Terbaik
Mikroorganisme dapat mensintesis berbagai macam metabolit untuk pertumbuhan, perkembangan, dan pertahanan. Metabolit-metabolit ini berpengaruh terhadap tingkat pertumbuhan dan biomassa (Aharonowitz 1980). Sumber nutrisi termasuk nitrogen dalam media harus diformulasi untuk meningkatkan sintesis produk yang diinginkan, biomassa sel, atau metabolit spesifik (Waites et al. 2001).
20
Yeast extract Malt extract Tripton NH4NO3
P
Yeast extract Malt extract Tripton NH4NO3
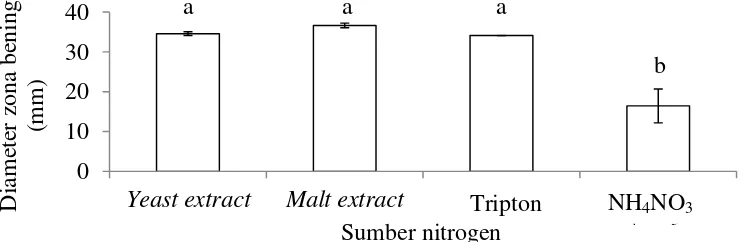
Dia senyawa antifungi memberikan respon yang berbeda nyata. Hasil HPLC menunjukkan yeast extract memiliki persentase relatif luas area antifungi terbesar dibandingkan malt extract, tripton, dan NH4NO3. Hasil uji lanjut dengan uji perbandingan berganda Duncan pada taraf nyata 0.05 menunjukkan bahwa persentase relatif luas area antifungi berbeda nyata antara yeast extract dengan tripton dan NH4NO3 namun tidak berbeda nyata dengan malt extract. Malt extract dan tripton juga memiliki nilai persentase relatif senyawa antifungi yang tidak berbeda nyata (Gambar 9, Lampiran 5). Puncak senyawa aktif P. lagena terbentuk sekitar menit ke 11 dengan serapan gelombang maksimum sebesar 202 – 530 (Lampiran 8).
Sumber nitrogen juga menghasilkan respon zona bening yang berbeda nyata. Malt extract menghasilkan diameter zona bening terbesar dan diikuti dengan yeast extract, tripton, dan NH4NO3. Hasil uji lanjut dengan uji perbandingan berganda Duncan pada taraf nyata 0.05 menunjukkan bahwa diameter zona bening tidak berbeda nyata antara malt extract, yeast extract, dan tripton namun berbeda nyata dengan NH4NO3 (Gambar 10, Lampiran 5). Yeast extract dipilih sebagai sumber nitrogen terbaik karena luas area senyawa antifungi yang dihasilkannya paling besar walaupun diameter zona bening yang dihasilkan lebih kecil dibandingkan malt extract.
Gambar 9 Persentase relatif luas area senyawa antifungi respon beberapa sumber nitrogen. Garis vertikal di atas tiap balok data menunjukkan standar eror dan huruf-huruf di atas balok data menunjukkan pembandingan nilai tengah antar sumber nitrogen berdasarkan uji perbandingan berganda Duncan pada taraf nyata 0.05
Gambar 10 Diameter zona bening respon beberapa sumber nitrogen. Garis vertikal di atas tiap balok data menunjukkan standar eror dan huruf-huruf di atas balok data menunjukkan pembandingan nilai tengah antar sumber nitrogen berdasarkan uji perbandingan berganda Duncan pada taraf nyata 0.05
Tripton NH4NO3
21 Yeast extract adalah substrat yang sangat baik untuk banyak mikroorganisme dalam proses fermentasi karena mengandung asam amino dan peptida, vitamin larut air, dan karbohidrat. Malt extract adalah substrat yang sangat baik untuk fungi, yeast, dan aktinomicetes. Malt extract kering mengandung 90-92% karbohidrat, protein, peptida, asam amino, purin, pirimidin, dan vitamin (Crueger dan Crueger 1984). Tripton merupakan produk hidrolisis dari kasein yang mengandung asam amino. Sedangkan NH4NO3 mengandung amonium dan nitrat.
Nitrogen dapat meregulasi biosintesis antibiotik dengan dua cara, yaitu asam amino sebagai prekursor menyatu secara utuh untuk membentuk antibiotik atau atom nitrogen dari metabolit primer ditransfer oleh reaksi antibiotik yang spesifik sebagai produk intermediat yang spesifik untuk membentuk antibiotik (Aharonowitz 1980). Keterlibatan sumber nitrogen dalam pembentukan senyawa aktif P. lagena diduga dengan cara asam amino dari sumber nitrogen terlibat secara langsung dalam biosintesis senyawa aktif. Hal ini ditunjukkan dengan produksi senyawa aktif P. lagena lebih tinggi dengan menggunakan nitrogen organik (mengandung asam amino) dibandingkan nitrogen inorganik. Namun yeast extract menjadi sumber nitrogen yang dipilih untuk produksi senyawa aktif P. lagena karena kandungan nitrogen total dalam yeast extract lebih tinggi dibandingkan malt extract sehingga untuk memenuhi nitrogen dalam medium, bobot yeast extract yang diperlukan lebih sedikit (12.16 g L-1)dibandingkan malt extract (149.19 g L-1) (Lampiran 2). Selain itu, gram malt extract yang terlalu tinggi dapat meningkatkan viskositas media. Viskositas dapat mempengaruhi agitasi, aerasi, dan pembentukan busa pada proses kultivasi (Waites et al. 2001). Nitrogen organik mampu menghasilkan antibiotik yang lebih banyak dibandingkan nitrogen inorganik (Aharonowitz 1980). Menurut Drew dan Demain (1977), sumber nitrogen yang dapat dikatabolisme secara langsung dapat menekan atau menghambat aktivitas enzim yang terlibat dalam biosintesis metabolit sekunder.
Pemilihan Konsentrasi Mineral Terbaik
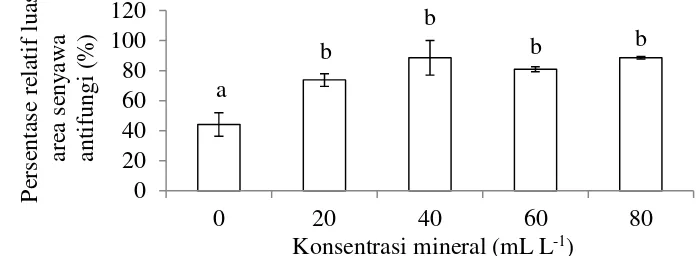
22
Gambar 11 Persentase relatif luas area senyawa antifungi respon terhadap konsentrasi larutan mineral. Garis vertikal di atas tiap balok data menunjukkan standar eror dan huruf-huruf di atas balok data menunjukkan pembandingan nilai tengah antar konsentrasi larutan mineral berdasarkan uji perbandingan berganda Duncan pada taraf nyata 0.05
Konsentrasi mineral (mL L-1)
digunakan berdasarkan Ghatora et al. (2006), yaitu terdiri atas (% b v-1) 0.2 (NH4)2SO4, 0.5 KCl, 0.1 CaCl2, 0.5 MgSO4, 0.01 ZnSO4, dan 0.005 CuSO4.
Konsentrasi mineral dalam media kultivasi P. lagena yang menghasilkan senyawa antifungi memberikan respon yang berbeda nyata. Hasil HPLC menunjukkan media kultivasi tanpa larutan mineral memiliki persentase relatif luas area senyawa antifungi yang lebih rendah dibandingkan media kultivasi yang ditambahkan dengan larutan mineral. Hasil uji lanjut dengan uji perbandingan berganda Duncan pada taraf nyata 0.05 menunjukkan bahwa persentase relatif luas area senyawa antifungi berbeda nyata antara media kultivasi tanpa larutan mineral dengan yang menggunakan larutan mineral. Namun konsentrasi larutan mineral antara 20, 40, 60, dan 80 mL L-1 tidak berbeda nyata (Gambar 11, Lampiran 6). Puncak senyawa aktif P. lagena terbentuk sekitar menit ke 11 dengan serapan gelombang maksimum sebesar 201 – 304 (Lampiran 9).
23
Konsentrasi mineral (mL L-1)
Mineral yang perlu ditambahkan ke dalam media kultivasi, yaitu magnesium, fosfor, potasium, sulfur, kalsium, dan klorida. Mineral lainnya seperti cobalt, copper, besi, mangan, molibdenum, dan zinc biasanya diperoleh dari sumber bahan lain (tidak murni) yang digunakan dalam media kultivasi (Stanbury et al. 2003). Dalam media kultivasi, mineral dibutuhkan dalam konsentrasi yang sangat rendah. Konsentrasi fosfat ≤ 100 mg L-1, sulfur 20-30 mg L-1, kalsium, besi, potasium, dan magnesium 10-20 mg L-1, sedangkan zinc dan tembaga ≤ 0.1-1 mg L-1 (Waites et al. 2001). Konsentrasi-konsentrasi mineral yang digunakan dalam penelitian ini sebagian besar sesuai dengan teori konsentrasi yang disebutkan oleh Waites et al. (2001).
Mineral yang ditambahkan dalam media kultivasi senyawa aktif P. lagena, yaitu amonium sulfat, kalium klorida, kalsium klorida, magnesium sulfat, zinc sulfat, dan tembaga sulfat. Fosfor pada media kultivasi senyawa aktif P. lagena diperoleh melalui ion fosfat inorganik. Fosfor dalam media kultivasi ada dalam bentuk gula fosfat, yaitu nukleotida (Vogel dan Todaro 1996), berfungsi sebagai buffer pH, sintesis asam nukleat, intermediat dalam metabolisme karbohidrat, dan senyawa yang terlibat dalam transduksi energi (ATP dan NADPH) (Waites et al. 2001). Sulfur pada penelitian ini disuplai dari amonium sulfat, magnesium sulfat, zinc sulfat, dan tembaga sulfat. Sulfur berfungsi untuk sintesis asam amino yang mengandung sulfur, yaitu sistin, sistein, dan metionin serta untuk sintesis beberapa vitamin. Molekul Mg2+, Zn2+, dan Cu2+ berikatan secara kompleks dengan enzim sebagai koenzim untuk mengkatalisis beberapa reaksi. Selain itu, zinc mempengaruhi produksi antibiotik (Vogel dan Todaro 1996). Magnesium berfungsi untuk stabilitas ribosom serta memelihara dinding sel dan integritas membran (Waites et al. 2001).
Optimasi Media dengan Response Surface Methodology
24
jumlah yang maksimal. Konsentrasi elemen-elemen kultivasi di bawah konsentrasi optimal menyebabkan senyawa metabolit yang dihasilkan tidak maksimal, sebaliknya konsentrasi elemen-elemen kultivasi di atas konsentrasi optimal dapat menyebabkan penekanan atau penghambatan terhadap enzim yang terlibat dalam sintesis senyawa metabolit yang diinginkan (Drew dan Demain 1977). Optimasi media dapat dilakukan dengan response surface methodology. Pada penelitian ini, komposis media kultivasi yang terpilih, yaitu laktosa sebagai sumber karbon, yeast extract sebagai sumber nitrogen, dan mineral menurut Ghatora et al. (2006) dengan konsentrasi ditampilkan pada Tabel 2.
Tabel 2 Faktor dan level yang digunakan pada central composite design
Faktor Level
-1.68 -1 0 1 1.68
Laktosa (g L-1) 25.99 33.61 44.81 56.01 63.63 Yeast extract (g L-1) 3.76 7.16 12.16 17.16 20.56 Larutan mineral (mL L-1) 0 4.05 10 15.95 20
Rancangan percobaan CCD terdiri atas faktorial, starting point, dan center point. Faktorial berjumlah delapan unit percobaan dengan dua kali ulangan. Starting point berjumlah enam unit percobaan dengan dua kali ulangan, sedangkan center point berjumlah satu unit percobaan dengan enam kali ulangan. Sehingga total unit percobaan menjadi 34. Luas area senyawa antifungi yang dikonversi menjadi persentase relatif luas area senyawa antifungi dan diameter zona bening sebagai respon pada 34 unit percobaan dapat dilihat pada Lampiran 10.
Uji statistika hasil optimasi dengan persentase relatif luas area senyawa antifungi sebagai respon ditampilkan pada Lampiran 11. Hasil analisis varian beberapa model menunjukkan bahwa model kuadratik vs 2FI secara nyata (nilai p = 0.0002) dapat menjelaskan data yang diperoleh. Selanjutnya, uji ketidakcocokan model (lack of fit) menunjukkan bahwa model kuadratik secara nyata menunjukkan nilai lack of fit yang tidak signifikan (nilai p = 0.1846) dan merupakan model yang disarankan. Model kuadratik memiliki nilai adjusted R-squared paling besar di antara yang lain, yaitu 0.5025. Nilai adjusted R-squared ini menunjukkan bahwa ketiga variabel berpengaruh terhadap keragaman respon sebesar 50.25% sedangkan sisanya dipengaruhi oleh variabel lain yang tidak diteliti. Nilai PRESS (prediction error sum of squares) untuk model kuadratik paling rendah, hal ini menunjukkan bahwa model kuadratik adalah model yang paling baik dibandingkan yang lain (Montgomery 2011).
25 digunakan untuk optimasi komposisi media produksi senyawa aktif antifungi dari P. lagena. Residual 4139.5966 24 172.4832
Lack of Fit 1276.0813 5 255.2163 1.6934 0.1846
tidak signifikan Pure Error 2863.5153 19 150.7113
Cor Total 11441.0295 33
Model kuadratik yang dapat menjelaskan data yang diperoleh adalah:
Y = 72.6459 – 2.1532 X1 + 1.4704 X2 + 4.1495 X3 + 2.5949 X1X2 + 5.2990 X1X3 + 6.9158 X2X3 – 13.3402 X12– 10.4027 X22– 8.6880 X32
Y adalah luas area senyawa antifungi, X1 adalah konsentrasi laktosa (g L-1), X2 adalah konsentrasi yeast extract (g L-1), dan X3 adalah konsentrasi larutan mineral (mL L-1). Persamaan di atas menunjukkan bahwa laktosa, yeast extract, dan larutan mineral mempunyai pengaruh terhadap senyawa antifungi yang dihasilkan P. lagena dalam media kultivasi. Laktosa, yeast extract, dan larutan mineral berpengaruh secara kuadratik. Hal ini menunjukkan bahwa laktosa, yeast extract, dan larutan mineral mempunyai hubungan langsung dengan senyawa antifungi yang disintesis P. lagena. Tanda negatif (-) pada koefisien kuadratik (X12, X22, dan X32) menunjukkan bahwa grafik respon yang diperoleh adalah maksimum atau grafik parabola terbuka ke bawah (Montgomery 2011).
26
lagena. Interaksi antara laktosa dengan yeast extract tidak berpengaruh terhadap produksi senyawa aktif P. lagena (p = 0.4371).
a b
Hubungan antara laktosa dan mineral dalam bentuk permukaan respon dan kontur plot disajikan pada Gambar 14. Kenaikan konsentrasi laktosa dan larutan mineral berpengaruh terhadap produksi senyawa aktif P. lagena. Konsentrasi laktosa di atas 44.81 g L-1 level (0) dan konsentrasi larutan mineral di atas 10 mL L-1 level (0) menyebabkan penurunan produksi senyawa aktif P. lagena. Interaksi antara yeast extract dengan mineral tidak berpengaruh terhadap produksi senyawa aktif P. lagena (p = 0.1196).
a b
Hubungan antara yeast extract dan mineral dalam bentuk permukaan respon dan kontur plot disajikan pada Gambar 15. Kenaikan konsentrasi yeast extract dan mineral berpengaruh terhadap produksi senyawa aktif P. lagena. Konsentrasi yeast extract di atas 12.16 g L-1 level (0) dan konsentrasi larutan mineral di atas 10 mL L-1 level (0) menyebabkan penurunan produksi senyawa aktif P. lagena. Interaksi antara yeast extract dengan mineral berpengaruh terhadap produksi senyawa aktif P. lagena (p = 0.0458).
Gambar 13 Hubungan antara laktosa dan yeast extract dalam bentuk permukaan respon (a) dan kontur plot (b)
27
a b
Peningkatan konsentrasi laktosa, yeast extract, dan larutan mineral di atas level (0) mampu menurunkan senyawa aktif P. lagena yang dihasilkan karena konsentrasi substrat yang tinggi menyebabkan tekanan osmotik tinggi. Tekanan osmotik yang tinggi dapat menyebabkan stress lingkungan sehingga mempengaruhi fisiologi P. lagena. (Waites et al. 2001; Parrondo et al. 2009). Peningkatan konsentrasi substrat mampu menurunkan laju pertumbuhan spesifik sehingga produk yang dihasilkan lebih rendah (Parrondo et al. 2009).
Uji statistika hasil optimasi dengan zona bening sebagai respon ditampilkan pada Lampiran 12. Hasil analisis varian beberapa model menunjukkan bahwa model linier vs mean secara nyata (nilai p = 0.0029) dapat menjelaskan data yang diperoleh. Selanjutnya, uji ketidakcocokan model (lack of fit) menunjukkan bahwa model linier secara nyata menunjukkan nilai lack of fit yang tidak signifikan (nilai p = 0.4719) dan merupakan model yang disarankan. Model ordo satu untuk mendeskripsikan permukaan yang miring atau tidak. Model ini tidak cocok untuk analisis daerah optimal. Hal ini terjadi karena hasil analisis zona bening berada pada kisaran yang tidak terlalu jauh (29.62 - 41.65 mm) (Bradley 2007). Hasil zona bening ini sebagai pembanding, apabila luas area yang dihasilkan lebih besar, maka zona bening yang terbentuk juga lebih besar. Zona bening menunjukkan bahwa senyawa aktif P. lagena dapat menghambat pertumbuhan patogen uji P. lamaoensis.
Formulasi Medium dan Validasi Model
Optimasi menggunakan perangkat lunak Design Expert versi 7 dilakukan untuk mendapatkan komposisi media yang dapat menghasilkan senyawa aktif P. lagena dengan konsentrasi tertinggi. Maksimum konsentrasi senyawa aktif P. lagena diprediksi sebesar 69.233% dengan komposisi media 44.77 g L-1 laktosa, 13.02 g L-1 yeast extract, dan 15.95 mL L-1 larutan mineral. Komposisi media hasil optimasi diverifikasi ulang sebanyak lima kali ulangan. Verifikasi komposisi media optimal menghasilkan senyawa aktif P. lagena sebesar 58.365% (Lampiran 13). Hasil ini 15.7% lebih rendah dibandingkan prediksi. Namun hasil optimasi Gambar 15 Hubungan antara yeast extract dan mineral dalam bentuk permukaan
28
Gambar 16 Hasil liquid cromatography senyawa aktif P. lagena
meningkatkan produksi senyawa aktif P. lagena sembilan kali lipat dibandingkan produksi senyawa aktif P. lagena dengan media F15 (6.473%).
Liquid Chromatography-Mass Spectrometry (LC-MS)
Metode LC-MS dapat digunakan untuk mendeteksi protein, peptida, karbohidrat, DNA, obat, dan metabolit. LC-MS dapat menguji senyawa yang bersifat polar, ionik, tidak stabil pada suhu panas, dan senyawa yang tidak menguap. LC-MS secara selektif dapat mendeteksi senyawa dalam kompleks matriks (tidak murni) dan dapat mendeteksi karakteristik massa dari senyawa tersebut (Kang 2012). Analit dan fase gerak dialirkan ke kolom kromatografi dengan laju tinggi. Analit yang bersifat lebih polar bergerak lebih cepat (Ardrey 2003). Berdasarkan hasil LC, senyawa aktif P. lagena paling dominan pada waktu retensi 3.85 menit (Gambar 16).
Analit dengan eluen yang telah dipisahkan pada kolom kromatografi kemudian masuk ke kapiler menjadi droplet dengan muatan positif kemudian masuk ke counter electrode dan dianalisis dengan spektrometer massa (Ardrey 2003). Spektrum massa analit menit ke 3.85 diperlihatkan pada Gambar 17.
Waktu retensi (menit)
Tr
ansmi
tan (
%
29
Mass(m/z)
Molekul ion yang terdeteksi pada MS adalah analit yang ditambahi dengan satu ion hidrogen sehingga bobot molekul senyawa aktif yang terdeteksi adalah 206.1134 gram mol-1 dengan rumus molekul C11H14N2O2 (Lampiran 14). Hasil rumus molekul tersebut diidentifikasi dengan situs chemspider dan menghasilkan 100 kemungkinan struktur kimia dengan sebagian besar menunjukkan hasil berupa senyawa piperidin. Ferheen et al. (2005) mengisolasi dua senyawa piperidin baru dari Haloxylon salicornicum yang diberi nama haloxylines A dan haloxylines B yang mempunyai aktifitas antifungi. Sugara (2011) melakukan karakterisasi senyawa aktif antibakteri dari daun tanaman bandotan (Ageratum conyzoides L.) dan memperoleh dugaan senyawa kumarin, 2 senyawa kromen (prekosen II dan 7-metoksi-2,2-dimetil-6-vinil-2H-kromen), 2 senyawa turunan asam palmitat (asam heksadekanoat dan asam 9,12-oktadekanoat), senyawa triterpen (neopitadien) dan seyawa metil-5,11,14,17-eikosatetraenoat. Senyawa-senyawa yang terkandung dalam bandotan ini berbeda dengan Senyawa-senyawa yang dihasilkan oleh P. lagena sebagai fungi endofit yang diisolasi dari bandotan. Sementara penelitian mengenai senyawa metabolit sekunder yang dihasilkan oleh P. lagena belum banyak dilakukan.
5
SIMPULAN DAN SARAN
Simpulan
Isolat Penicillium lagena menghasilkan senyawa aktif yang mampu menghambat pertumbuhan patogen Phellinus lamaoensis. Senyawa aktif yang dihasilkan oleh P. lagena diduga adalah piperidin dengan bobot molekul 206.1134 gram mol-1 dan rumus molekul C11H14N2O2. Kultivasi P.lagena untuk produksi senyawa aktif dilakukan dalam kultur terendam. Komponen media kultivasi yang secara nyata mampu meningkatkan produksi senyawa aktif P. lagena adalah laktosa sebagai sumber karbon, yeast extract sebagai sumber nitrogen, dan mineral.
Tr
ansmitan
(
%
)