EKSTRAKSI DAN UJI PENGARUH WAKTU EKUILIBRASI
TERHADAP JERAPAN FOSFAT PADA FRAKSI NANO DAN
LIAT DARI TUF VOLKAN GUNUNG SALAK, BOGOR
DEVI MAYASARI A14070038
PROGRAM STUDI MANAJEMEN SUMBERDAYA LAHAN DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN
FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR
RINGKASAN
DEVI MAYASARI. Ekstraksi dan Uji Pengaruh Waktu Ekuilibrasi terhadap Jerapan Fosfat pada Fraksi Nano dan Liat dari Tuf Volkan Gunung Salak, Bogor (Dibimbing oleh UNTUNG SUDADI dan HERMANU WIDJAJA).
Pemanfaatan material nano alami (nanoclay) sebagai flokulan dalam pengolahan air terkontaminasi P dilaporkan lebih efektif, murah dan ramah lingkungan daripada bahan kimia sintetik (Yuan dan Wu, 2007). Indonesia kaya tanah berbahan induk tuf volkan yang banyak mengandung material nano alami (diameter [Φ] <100 nm), yaitu alofan dan imogolit yang memiliki sifat muatan bergantung-pH (Sugiarti et al., 2010). Tuf volkan di Pulau Jawa dari arah timur ke barat berubah dari tipe basa (calc-alkaline basaltic ash) ke masam (andesitic-tuffaceous ash) (Tan, 1964; van Ranst et al., 2004), sehingga fraksi nanonya juga berubah ke dominan bermuatan positif. Dari 12 sampel tuf volkan di Pulau Jawa, fraksi nano bermuatan positif terbanyak dapat diekstraksi dari tuf volkan G. Salak, Bogor (Sherlie, 2010; Nursyirwan, 2010; Setiawan, 2010). Salah satu faktor penentu jerapan P adalah waktu ekuilibrasi. Dalam pengolahan air terkontaminasi P dipilih flokulan dengan waktu ekuilibrasi tercepat dan jerapan maksimum P tertinggi. Penelitian ini bertujuan menguji pengaruh waktu ekuilibrasi terhadap jerapan maksimum P pada fraksi nano dan liat yang diekstraksi dari tuf volkan G. Salak, Bogor.
Penelitian ini dilakukan di Lab. Kimia dan Kesuburan Tanah, DITSL, IPB pada Februari-Juli 2011. Ekstraksi fraksi nano dan liat dilakukan dengan metode Henmi dan Wada (1976) sbb: dispersi tuf volkan (Φ <2 mm) dalam silinder 1-L pada pH-4.00 [HCl] dan diultrasonic [15 mnt], sedimentasi [20 jam], pemisahan 10 cm larutan teratas, flokulasi [NaCl], redispersi flokulat [aquadest], pemisahan dengan sentrifugasi 9 kali [3500 rpm; 15 mnt] fraksi nano (tidak mengendap, Φ <0.2 µm) dari liat (mengendap, Φ <2 µm), reflokulasi, pencucian kelebihan NaCl [membran dialisis], pelarutan [500 cc aquadest] dan uji gravimetrik penetapan kadar fraksi nano dan liat. Analisis jerapan isotermal P dilakukan dengan menambahkan 5 cc deret larutan 0, 5, 10, 20, 40, 80, 160 dan 240 mg P/L dalam 1 mM CaCl2 ke tabung reaksi berisi 10 cc suspensi dengan waktu ekuilibrasi 24, 72
dan 144 jam (setiap hari suspensi diagitasi 3x10 dtk menggunakan magnetic stirrer pada jam 08 dan 16). Kadar P-kesetimbangan diukur dengan metode Murphy dan Riley (1962) menggunakan UV-Vis spektrofotometer [λ 660 nm].
Dari setiap 1.00 g tuf volkan G. Salak dapat diekstraksi 2.71 mg fraksi nano dan 3.88 mg fraksi liat bermuatan positif. Jerapan P pada kedua fraksi tersebut meningkat dengan bertambahnya waktu ekuilibrasi. Nilai b (jerapan maksimum P) dengan waktu ekuilibrasi 24, 72 dan 144 jam pada fraksi nano [14.51, 25.13 dan 32.79 mg/g] lebih tinggi daripada fraksi liat [4.60, 20.37 dan 25.13 mg/g]. Nilai b fraksi nano G. Salak [32.79 mg/g; 144 jam] berturut-turut sekitar dua dan delapan kali lebih tinggi daripada nanoclay China [16.23 mg/g; 24 jam; Yuan dan Wu (2007)] dan imogolit New Zealand [3.75 mg/g;16 jam; Parfitt dan Henmi (1980)].
SUMMARY
DEVI MAYASARI. Equilibration-time effects on phosphate adsorption by nano and clay fractions extracted from volcanic tuff of Mount Salak, Bogor (Under supervision of UNTUNG SUDADI and HERMANU WIDJAJA).
The use of natural nano material as a flocculant in the process of P-contaminated water purification was reported to be more effective, cheaper and environmentally friendly than synthetic chemicals (Yuan and Wu, 2007). Indonesia is rich in soils derived from volcanic tuff parent material containing natural nano materials (diameter [Φ] <100 nm), i.e. allophane and imogolith that pose pH-dependent charge properties (Sugiarti et al., 2010). Volcanic tuff in Java island from east to west direction change gradually from basaltic (calc-alkaline basaltic ash) to andesitic type (andesitic-tuffaceous ash) (Tan, 1964; van Ranst et al., 2004), so their nano fractions also change to those with dominant positive charge. From 12 volcanic tuff samples collected from Java island, the highest amount of positively-charged nano fraction could be extracted from that of M. Salak (Sherlie, 2010; Nursyirwan, 2010; Setiawan, 2010). One of the determining P-adsorption factors is equilibration-time. In the treatment of P-contaminated water, flocculant with fastest equilibration-time and highest P-adsorption is prefered. This study was aimed at to test the effects of equilibration-time on P-adsorption by nano and clay fractions extractedfrom volcanic tuff of M. Salak.
This study was conducted at Lab. Soil Chemistry and Soil Fertility, Dep. Soil Science and Land Resource, IPB on February-July 2011. The nano and clay fractions were extracted according to Henmi and Wada (1976) procedure: volcanic tuff dispersion (Φ <2 mm) in a 1-L cylinder at pH-4.00 [HCl], ultrasonic [15 min], sedimentation [20 h], separation of the top 10 cm solution, flocculation [NaCl], flocculate redispersion [aquadest], 9 times separation by centrifugation [3500 rpm; 15 min] of nano fraction (which not settled, Φ <0.2 µm) from the clay (which settled, Φ <2 µm), reflocculation, washing the excess of NaCl [membrane dialysis], dilution [500 cc aquadest] and gravimetrically determination of the amount of the nano and clay fractions. The isothermal P-adsorption analisys was done by adding solutions containing 0, 5, 10, 20, 40, 80, 160 and 240 mg P/L in 1 mM CaCl2 into test tubes containing 10 cc of the suspension with equilibration
time of 24, 72 and 144 hours (suspension was agitated 3x10 sec using magnetic stirrer at 08h and 16h, everyday).The equilibrium P content was determined with Murphy and Riley (1962) procedure using UV-Vis spectrophotometer [λ 660 nm].
From 1 g volcanic tuff of M. Salak, Bogor, it could be extracted 2.71 mg positively-charged nano and 3.88 mg clay fractions. The P-adsorption by both fractions increased with the increasing equilibration-time. The b values (maximum P-adsorption) after 24, 72 and 144 hours equilibration of the nano fraction [14.51, 25.13 and 32.79 mg/g] were higher than those of the clay ones [4.60, 20.37 and 25.13 mg/g]. The b value of the nano fraction of M. Salak [32.79 mg/g; 144 h] was around two and eight times higher than those respectively of China nanoclay [16.23 mg/g; 24 h; Yuan and Wu (2007)] and New Zealand imogolith [3.75 mg/g;16 h; Parfitt and Henmi (1980)].
EKSTRAKSI DAN UJI PENGARUH WAKTU EKUILIBRASI
TERHADAP JERAPAN FOSFAT PADA FRAKSI NANO DAN
LIAT DARI TUF VOLKAN GUNUNG SALAK, BOGOR
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Pertanian pada Fakultas Pertanian, Institut Pertanian Bogor
oleh
DEVI MAYASARI A14070038
PROGRAM STUDI MANAJEMEN SUMBERDAYA LAHAN DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN
FAKULTAS PERTANIAN INSTITUT PERTANIAN BOGOR
Judul Penelitian : Ekstraksi dan Uji Pengaruh Waktu Ekuilibrasi terhadap Jerapan Fosfat pada Fraksi Nano dan Liat dari Tuf Volkan Gunung Salak, Bogor
Nama : Devi Mayasari
NIM : A14070038
Menyetujui,
Dosen Pembimbing I Dosen Pembimbing II
Dr. Ir. Untung Sudadi, M.Sc. Ir. Hermanu Widjaja, M.Agr.Sc. NIP. 19621020 198903 1 001 NIP. 19640830 199003 1 003
Mengetahui,
Ketua Departemen Ilmu Tanah dan Sumberdaya Lahan
Dr. Ir. Syaiful Anwar, M.Sc. NIP. 19621113 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada 10 Agustus 1989. Penulis adalah anak pertama dari dua bersaudara pasangan Bapak Bambang Eddy dan Ibu Farida.
Penulis menempuh pendidikan di TK Purbo Utomo pada tahun 1993-1995, kemudian melanjutkan pendidikan di SD Negeri Kayuringin Jaya III pada tahun 1995-2001 dan SMP Negeri 3 Bekasi pada tahun 2001-2004. Pada tahun 2004 penulis diterima di SMA Negeri 3 Bekasi. Setelah lulus SMA pada tahun 2007, penulis diterima di Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur USMI.
Selama menempuh pendidikan di IPB, penulis aktif sebagai asisten
praktikum untuk mata kuliah Kimia Tanah, Fisika Tanah, Morfologi dan Klasifikasi Tanah, dan Pengantar Ilmu Tanah di Departemen Ilmu Tanah dan
KATA PENGANTAR
Alhamdulillahirobbil alamin. Segala puji dan syukur penulis panjatkan kehadirat Allah SWT, atas rahmat dan hidayah-Nya sehingga penulis bisa menyelesaikan skripsi ini.
Skripsi berjudul “Ekstraksi dan Uji Pengaruh Waktu Ekuilibrasi terhadap Jerapan Fosfat pada Fraksi Nano dan Liat dari Tuf Volkan Gunung Salak, Bogor” ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor.
Pada kesempatan ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Dr. Ir. Untung Sudadi, M.Sc., Pembimbing Akademik dan Pembimbing Skripsi I atas teladan, bimbingan, ide, kritik, saran, kesabaran, motivasi, dan ilmu yang diajarkan kepada penulis selama menempuh pendidikan. 2. Ir. Hermanu Widjaja, M.Agr.Sc., Pembimbing Skripsi II atas bimbingan,
kritik, saran, dan ilmu yang diajarkan kepada penulis selama menempuh pendidikan.
3. Dr. Ir. Enni Dwi Wahjunie, M.Si., sebagai Penguji atas kritik dan sarannya.
4. Ayah dan Ibu atas kasih sayang, kesabaran, motivasi dan do’a yang tak pernah putus.
5. Rekan-rekan MSL ’44, Melin, Melda, Deuis, Ridho, Vindy, Feky, Ayas dan teman-teman seperjuangan lainnya untuk kebersamaan dan dukungan. 6. Staf tata usaha dan laboratorium yang senantiasa mambantu penulis dalam
menyelesaikan penelitian.
7. Semua pihak yang telah membantu dalam penelitian dan penulisan skripsi ini yang tidak bisa disebutkan satu per satu.
Akhir kata semoga skipsi ini bermanfaat bagi penulis dan juga bagi yang membacanya.
Bogor, Desember 2011
DAFTAR ISI
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
TINJAUAN PUSTAKA ... 3
Fosfat sebagai Hara Tanaman dan Kontaminan Perairan... 3
Pemanfaatan Mineral Liat sebagai Nanomaterial Penjerap Fosfat Perairan ... 3
Mineral Liat ... 4
Asal Muatan Negatif pada Mineral Liat ... 5
Asal Muatan Positif pada Mineral Liat ... 5
Alofan dan Imogolit ... 6
Andisol ... 9
Tuf Volkan ... 10
Gunung Salak ... 11
Teknologi dan Material Nano ... 12
Metode Ekstraksi ... 13
Metode Jerapan Fosfat ... 13
BAHAN DAN METODE ... 15
Lingkup Penelitian ... 15
Waktu dan Tempat Penelitian ... 15
Bahan dan Alat ... 15
Preparasi Sampel dan Ekstraksi Fraksi Nano dan Liat ... 15
Percobaan Jerapan Fosfat... 15
Metode Penelitian ... 15
Bagan Alir Ekstraksi Fraksi Nano dan Fraksi Liat ... 15
Preparasi Sampel Tuf Volkan ... 16
Ekstraksi dan Pemisahan Fraksi Nano dan Fraksi Liat... 16
Dialisis dan Suspensi Fraksi Nano dan Fraksi Liat ... 18
HASIL DAN PEMBAHASAN ... 20
Deskripsi Lokasi Sampling Tuf Volkan ... 20
Ekstraksi berdasarkan Metode Gravimetrik ... 20
Karakterisasi Jerapan Fosfat dari Fraksi Nano dan Fraksi Liat TV-3 ... 21
KESIMPULAN DAN SARAN ... 25
Kesimpulan ... 25
Saran ... 25
DAFTAR PUSTAKA ... 26
DAFTAR TABEL
Nomor Halaman
Teks
1. Hasil Penetapan Kadar Fraksi Nano dan Liat dalam 10 cc Suspensi 21
2. Nilai Jerapan Maksimum dan Energi Ikatan 22
Lampiran
1. Hasil Analisis Data Jerapan P pada Fraksi Nano dari Sampel Tuf Volkan
TV-3 (24 jam) 31
2. Hasil Analisis Data Jerapan P pada Fraksi Liat dari Sampel Tuf Volkan
TV-3 (24 jam) 31
3. Hasil Analisis Data Jerapan P pada Fraksi Nano dari Sampel Tuf Volkan
TV-3 (72 jam) 32
4. Hasil Analisis Data Jerapan P pada Fraksi Liat dari Sampel Tuf Volkan
TV-3 (72 jam) 32
5. Hasil Analisis Data Jerapan P pada Fraksi Nano dari Sampel Tuf Volkan
TV-3 (144 jam) 33
6. Hasil Analisis Data Jerapan P pada Fraksi Liat dari Sampel Tuf Volkan
DAFTAR GAMBAR
Nomor Halaman
Teks
1.
Bagan Alir Tahapan Ekstraksi Fraksi Nano dan Liat 162. Preparasi Sampel Tuf Volkan 16
3. Ekstraksi Fraksi Nano dan Fraksi Liat 17
4. Hasil Sentrifugasi Pemisahan Fraksi Nano dan Fraksi Liat 17
5. Proses Membran Dialisis 18
6. Bagan Alir Uji Pengaruh Waktu Ekuilibrasi terhadap Jerapan Fosfat 19 7. Jerapan Isotermal Fosfat pada Fraksi Nano dan Fraksi Liat yang Diekstraksi
dari Tuf Volkan TV-3 G. Salak dalam 1 mM CaCl2 23
8. Pengaruh Waktu Ekuilibrasi terhadap Jerapan P pada Konsentrasi Larutan P
yang Ditambahkan 5 ppm [a] dan 240 ppm [b] 23
9. Perubahan Kepekatan Warna Biru Larutan yang Menunjukkan Peningkatan Jerapan P oleh Fraksi Nano [a] dan Liat [b] dengan Penambahan Waktu
Ekuilibrasi 72 ke 144 jam 24
Lampiran
1. Titik Lokasi Pengambilam Sampel Tuf Volkan 29
PENDAHULUAN
Latar Belakang
Peran fosfat dalam budidaya pertanian telah banyak dipelajari dalam kimia tanah. Namun, keberadaan fosfat dalam perairan juga dapat menimbulkan permasalahan terhadap kualitas air, misalnya menyebabkan terjadinya eutrofikasi (Dewi dan Masduqi, 2003).
Kebutuhan akan air bersih dan meningkatnya kesadaran akan efek samping pencemaran air terhadap kesehatan manusia mendorong pengembangan teknologi serta bahan yang efektif dan terjangkau untuk remediasi pencemaran air. Dalam proses penjernihan air tercemar fosfat, penyebab eutrofikasi, pemanfaatan
material nano alami sebagai flokulan dilaporkan lebih efektif, murah, dan ramah lingkungan daripada bahan kimia sintetik (Yuan dan Wu, 2007). Aplikasi Alofan
pada proses pengolahan air tercemar anion fluorida juga telah dilakukan oleh Kaufhold et al. (2009).
Jerapan P dipengaruhi oleh tipe adsorbent dan ukuran partikelnya yang menentukan karakteristik muatan permukaan serta luas permukaan spesifik dan kapasitas jerapannya. Pada penelitian sebelumnya, Sherlie (2010) menunjukkan bahwa jerapan fosfat pada fraksi nano bermuatan positif yang diekstraksi dari tuf volkan TV-3 G. Salak, Bogor lebih tinggi daripada pada fraksi liatnya. Hal ini karena ukuran partikel fraksi nano lebih kecil sehingga memiliki luas permukaan dan kapasistas jerapan terhadap anion fosfat yang lebih tinggi daripada fraksi liat. Selain luas permukaan spesifik, waktu ekuilibrasi untuk mencapai reaksi kesetimbangan juga mempengaruhi jerapan fosfat (Nair et al., 1984). Berdasarkan hal tersebut, penelitian lanjutan ini dilakukan untuk menguji pengaruh waktu ekuilibrasi terhadap jerapan fosfat pada fraksi nano dan liat yang diekstraksi dari sampel tuf volkan TV-3 G. Salak, Bogor, Jawa Barat.
Tujuan
TINJAUAN PUSTAKA
Fosfat sebagai Hara Tanaman dan Kontaminan Perairan
Fosfat memiliki peran besar dalam kimia tanah dan telah banyak dipelajari. Para ahli kimia menemukan fakta bahwa pemupukan fosfat sangat diperlukan untuk meningkatkan produktivitas pertanian. Akan tetapi kehadiran fosfat dalam air dapat menimbulkan permasalahan terhadap kualitas air, misalnya terjadi eutrofikasi (Dewi dan Masduqi, 2003).
Eutrofikasi merupakan salah satu masalah lingkungan hidup yang mengakibatkan kerusakan ekosistem perairan khususnya di air tawar. Hal tersebut disebabkan oleh fosfat (PO3-) sebagai limbah rumah tangga seperti detergen,
limbah peternakan, limbah industri, dan limbah pertanian. Permintaan air bersih dan meningkatnya kesadaran akan efek samping pencemaran pada kesehatan manusia dan ekosistem mendorong pengembangan teknologi dan bahan yang efektif dan terjangkau untuk pengendalian pencemaran dan pengolahan air (Yuan dan Wu, 2007).
Pemanfaatan Mineral Liat sebagai Nanomaterial Penjerap Fosfat Perairan Karena ketersediaannya yang melimpah di dalam tanah dan sedimen, liat telah lama digunakan sebagai flokulan dan adsorbent partikel tersuspensi dan senyawa beracun dalam air. Penggunaan liat dan mineral liat (secara alami atau setelah dimodifikasi kimia permukaannya) untuk pengolahan air telah banyak diselidiki selama tiga dekade terakhir. Contoh aplikasi tersebut adalah dalam remediasi air tercemar minyak, konstruksi lapisan liat (clay-liners), pencegahan pelindihan leachates organik dari situs pembuangan sampah, inaktivasi logam berat serta pemulihan limbah kaya nitrogen.
dengan luas permukaan spesifik (eksternal dan internal) mencapai beberapa ratus m2/g, mineral liat allophane dapat dimanfaatkan untuk memflokulasi fosfat dari larutan serta meremediasi perairan eutrofik. Allophane tidak terdispersi dalam air, sehingga dapat dipulihkan setelah digunakan (Yuan dan Wu, 2007).
Penerapan allophane pada penanganan air yang tercemar oleh ion fluorida telah dilakukan oleh Kaufhold et al. (2009). Hasil eksperimen tersebut menunjukkan bahwa allophane memiliki prospek lebih baik untuk diterapkan sebagai penjerap ion fluorida dibandingkan dengan zeolit alam (clinoptilolite), goethite ataupun viscogel (R). Bila dibandingkan dengan material komersial penjerap fluorida seperti Fluorolith, daya serap allophane sedikit lebih rendah. Namun demikian, kemudahan mendapatkan allophane dari lingkungan tanah memungkinkan allophane memiliki nilai lebih dibandingkan Fluorolith.
Mineral Liat
Mineral liat merupakan mineral yang berukuran kurang dari 2µ. Mineral liat hanya dapat dilihat dengan bantuan mikroskop elektron. Sifat mineral liat ditentukan dari: (1) susunan kimia pembentuknya yang tetap dan tertentu, terutama berkaitan dengan penempatan internal atom-atomnya, (2) sifat fisika-kimia dengan batasan waktu tertentu, dan (3) kecenderungan membentuk geometris tertentu (Madjid, 2009).
Mineral liat adalah lapisan silikat yang biasanya terbentuk sebagai produk
liat menyerupai mika dalam komposisi kimia, kecuali mereka memiliki ukuran sangat halus. Seperti mika, mineral liat berbentuk seperti serpihan dengan tepi tidak teratur dan satu sisi halus (Al-Ani dan Sarapää, 2008).
Asal Muatan Negatif pada Mineral Liat
Liat tanah biasanya membawa muatan elektronegatif, yang menimbulkan reaksi pertukaran kation. Dua sumber utama untuk asal muatan negatif ialah: 1. Substitusi isomorfik, yaitu penggantian kation dalam struktur kristal oleh
kation lain yang mempunyai ukuran yang sama tetapi muatan (valensi) yang berbeda. Subtitusi isomorfik merupakan sumber utama muatan negatif dalam liat tipe 2:1. Kation yang menggantikan mempunyai muatan yang lebih rendah daripada yang digantikan, misalnya Mg2+ atau Fe2+ menggantikan Al3+ dalam Al-oktahedra, atau Al3+ menggantikan Si4+ dalam Si-tetrahedra sehingga terjadi kelebihan muatan negatif pada liat. Muatan negatif yang dihasilkan dianggap sebagai muatan permanen, karena tidak berubah dengan berubahnya pH. Kemudahan terjadinya substitusi isomorfik tergantung pada ukuran dan valensi ion-ion yang terlibat. Proses ini hanya terjadi antara ion-ion berukuran sebanding. Perbedaan dalam dimensi ion-ion yang saling berganti dilaporkan tidak lebih dari 15%, dan valensi ion-ion yang saling berganti seharusnya tidak berbeda lebih dari satu satuan (Paton, 1978).
2. Disosiasi H+ dari gugus OH yang terdapat pada tepi atau ujung kristal juga dapat menimbulkan muatan negatif. Pada pH tinggi, hidrogen dari hidroksil terurai sedikit dan permukaan liat menjadi bermuatan negatif yang berasal dari ion oksigen. Muatan negatif ini disebut muatan berubah-ubah atau muatan tergantung pH. Besaran dari muatan berubah-ubah ini beragam tergantung pH dan tipe koloid. Jenis muatan ini sangat penting pada liat tipe 1:1, liat oksida besi dan aluminium, dan koloid organik (Tan, 1998).
Asal Muatan Positif pada Mineral Liat
proton. Proses ini, yang hanya penting pada media sangat masam, menghasilkan muatan positif. Ion-ion H+ dan OH-, yang menyebabkan timbulnya muatan permukaan, juga bertanggung jawab atas potensial permukaan listrik. Oleh karena itu, mereka disebut ion-ion penentu potensial.
Muatan positif memungkinkan terjadinya reaksi pertukaran anion dan sangat penting dalam retensi fosfat. Muatan tersebut diperkirakan berasal dari protonasi atau penambahan ion H+ ke gugus hidroksil. Mekanisme ini tergantung pada pH dan valensi dari ion logam. Biasanya proses ini hanya berarti pada liat oksida Al dan Fe, tetapi hal ini kurang penting pada oksida Si (Tan, 1991).
Alofan dan Imogolit
Allophane dan imogolite sudah ditemukan lebih dari 40 tahun yang lalu, yaitu pada tahun 60-an. Namun, penelitian mendalam mengenai keduanya masih jarang dilakukan. Hal ini dikarenakan beberapa faktor, seperti struktur kimianya yang masih sulit dianalisis menggunakan difraksi sinar-X (XRD) dan metode sintesisnya yang hanya bisa dilakukan pada konsentrasi rendah. Analisis XRD pada sampel nano-ball allophone akan memberikan suatu difraktogram yang hampir tanpa atau tidak ada puncak. Sementara para ahli mineralogi liat dan kristalografi selalu menyatakan bahwa mineral liat memiliki suatu keteraturan dalam struktur kristalnya sehingga dapat dideteksi menggunakan XRD yang ditandai oleh adanya puncak-puncak pada difraktogramnya. Oleh karena itu, nano-ball allophane sebelum ini selalu didefinisikan oleh para ahli mineralogi liat dan kristalografi sebagai mineral yang tidak memiliki keteraturan atom dalam penyusunan struktur kristalnya atau dikenal sebagai mineral amorf.
fungsional aktif. Adanya alofan memberikan sifat-sifat unik pada Andisol. Hal ini karena alofan mempunyai muatan bervariasi yang besar, bersifat amfoter, dengan kapasitas tukar kation (KTK) sekitar 10-40 cmol.kg-1 pada pH 7.0, kapasitas tukar anion (KTA) 5-30 cmol.kg-1 pada pH 4.0, struktur acak dan terbuka, serta dapat mengikat fosfat (Tan, 1992; van Ranst, 1995; Wada, 1989). Akibat kuatnya fiksasi fosfat oleh mineral ini, maka ketersediaan fosfat yang mudah larut akan berkurang.
Saat ini morfologi dan struktur kimia alofan yang ditemukan dalam tanah yang berkembang dari abu volkan atau batu apung telah ditemukan (Henmi, 1980; Henmi dan Wada, 1976; Shimizu et al., 1988). Abidin (2003 dalam Sugiarti et al., 2010) membuktikan bahwa alofan adalah suatu mineral liat yang memiliki struktur kimia dan bukan mineral amorf dengan didapatkannya suatu keteraturan polyhedral untuk membuat struktur kimia yang bulat. Dengan ditemukannya keteraturan tersebut, struktur alofan dapat disusun menjadi berbagai macam diameter sebagai isomorfiknya.
Wada (1977) melaporkan bahwa alofan adalah nama kelompok untuk hydrous alluminosilicate dengan komposisi yang ditandai dengan rasio molar Si/Al 1:2 atau 1:1, serta mempunyai struktur mineral yang acak dan terbuka/berpori. Antara lembar tetrahedral dan oktahedral terdapat banyak daerah kosong sehingga molekul air dapat dengan mudah keluar masuk, dan anion seperti fosfat dan nitrat dapat terjerap. Alofan mempunyai luas permukaan spesifik yang
mencapai 1100 m2.g-1. Luas permukaan yang besar ini mengakibatkan sistem koloid tanah menjadi sangat reaktif sehingga pertukaran kation, anion, jerapan air, dan fiksasi menjadi lebih tinggi (Tan, 1992).
Struktur kimia alofan dicirikan oleh “short-range order” dan dominasi Si-O-Al (van Olpen, 1971; Wada, 1977). Komposisi kimia dari alofan bervariasi dengan rasio Si/Al sekitar 0.5 sampai 1. Alofan dengan rasio Si/Al 0.5 memiliki struktur dasar yang terdiri atas lembar gibsit [Al(OH)3] dengan SiO4 tetrahedral,
dan mempunyai morfologi berongga untuk tempat SiO4 tetrahedra dalam bola.
Alofan dengan rasio Si/Al lebih dari 0.5 memiliki kondensasi SiO4 yang terikat
lemah pada struktur (Hanudin, 2009). Alofan yang mempunyai rasio molar Al/Si 2.0 telah diidentifikasi pada Andisol di Selandia Baru dan Jepang serta tanah Podzol di Skotlandia (Parfitt dan Henmi, 1980).
Henmi Research Group dari Ehime University Japan telah lama melakukan penelitian tentang nano-ball allophane dan nano-ball imogolite yang sebagian besar menggunakan material yang diambil dari tanah. Berdasarkan data informasi spectra NMR untuk Si dan Al, gambar TEM dan reaksi serapan air, kation dan anion, Henmi menyimpulkan bahwa allophane memiliki dasar struktur kimia yang sama dengan nano-ball imogolite dan terdapat suatu keteraturan poyhedra pada strukturnya sehingga membentuk suatu bulatan. Allophane memiliki beragam ratio mol Si/Al dengan kisaran nilai antara 0.6 sampai dengan 1.2. Hal ini disebabkan oleh faktor curah hujan dan suhu yang mempengaruhi laju pelarutan silikon dari suatu proses pelapukan batuan dasar di lingkungan pembentukannya. Namun demikian, Henmi menyatakan bahwa pada dasarnya allophane memiliki struktur dasar yang sama dengan imogolite. Yang membedakan adalah asesoris silika yang terikat pada bagian lubang allophane
(Henmi dan Wada, 1976).
asumsi bahwa ion logam alkali dan alkali tanah lebih terkonsentrasi di bagian dalam batu apung daripada di bagian luar, pembentukan imogolit lebih mudah di bagian luar batu apung dan pembentukan alofan lebih mudah di bagian dalam batu apung. Penambahan ion logam alkali dan alkali tanah menghambat pembentukan imogolit dan memfasilitasi pembentukan alofan. Ion-ion logam mempengaruhi disosiasi dari kelompok silanol asam orthosilik. Disosiasi atau non-disosiasi asam orthosilik menyebabkan perbedaan formasi imogolit dan alofan (Abidin, Matsue, dan Henmi, 2009).
Berdasarkan hasil kajian eksperimental, nano-ball allophane memiliki sifat permukaan yang khas yaitu muatan yang bervariasi (variable charge) berdasarkan nilai pH kondisinya. Hal ini dikarenakan pada struktur allophane terdapat gugus silanol dan gugus aluminol (Elsheik et al., 2008). Pada pH tinggi (6-10), nano-ball allophane memiliki muatan negatif yang berasal dari deprotonisasi gugus silanol sehingga kation dan logam berat mudah terikat, sedangkan pada pH rendah (4-6), nano-ball allophane memiliki muatan positif dari protonasi pada gugus aluminol sehingga anion dan ligan mudah terikat. Abidin et al. (2008) menunjukkan sifat permukaan nano-ball allophane dengan simulasi perhitungan kimia yang menunjukkan adanya perpindahan atom H pada struktur kimianya. Simulasi pada pH netral menunjukkan atom H yang terikat pada gugus silanol dan gugus aluminol dari nano-ball allophane mudah mengalami perpindahan antar kedua gugus tersebut. Ketika kondisi
kesetimbangan ini diganggu dengan mengubah nilai pH sistem, maka atom H yang terikat pada gugus silanol atau gugus aluminol menjadi tidak stabil dan
mudah terdeprotonasi atau terprotonisasi.
Andisol
Nama Ando, yang biasanya dikaitkan dengan tanah abu vulkanik, diperkenalkan pada tahun 1974 oleh para ahli tanah Amerika Serikat untuk tanah-tanah di Jepang yang terbentuk dari abu vulkanik dan memiliki horizon permukaan gelap (Simonson, 1979 dalam Leamy et al., 1980). Istilah Ando diambil dari bahasa Jepang, Anshokudo, dimana an berarti gelap, shoku berarti berwarna, dan do berarti tanah (Leamy et al., 1980).
Andisol memiliki bobot isi yang rendah, kandungan bahan organik, kapasitas menahan air, porositas, dan kapasitas fiksasi fosfat yang tinggi, mengalami dehidrasi tak balik saat dikeringkan (Tan, 1998), afinitas yang tinggi terhadap bahan organik, dan muatannya bersifat bergantung pH. Andisol dicirikan oleh adanya salah satu dari horizon vitrik atau horizon andik. Horison andik banyak mengandung alofan (dan mineral serupa) atau kompleks Al-humus, sedangkan horison vitrik banyak mengandung gelas volkan (FAO, 2008).
Tuf Volkan
Gunung api yang sedang meletus melontarkan bahan hamburan dari dalam bumi ke permukaan. Dengan demikian endapan yang dihasilkan selalu bertekstur klastika. Apabila bahan hamburan itu dihasilkan oleh letusan non-magmatik maka endapannya disebut endapan hidroklastika. Bahan hamburan yang langsung berasal dari magma (primary magnetic materials) disebut piroklas (Fischer dan Schmincke, 1984); onggokan piroklas disebut endapan piroklastika (pyroclastic deposits) dan setelah mengalami litifikasi menjadi batuan piroklastika (pyroclastic rocks). Istilah pyroclast berasal dari kata pyro (bahasa Yunani) yang berarti api dan clast yang berarti bahan hamburan, butiran, fragmen, kepingan atau pecahan. Oleh sebab itu piroklas adalah fragmen pijar atau butiran yang mengeluarkan api (berpendar/membara) pada saat dilontarkan dari dalam bumi ke permukaan melalui kawah gunung api. Terbentuknya api tersebut dikarenakan magma yang mempunyai temperatur tinggi (900-1200oC) tiba-tiba dilontarkan ke permukaan bumi dimana temperatur rata-ratanya kurang dari 35oC.
mm, dan bom volkanik atau blok volkanik yang berukuran diameter ≥64 mm. Abu volkanik apabila sudah membatu menjadi tuf (Bronto, 2001).
Penyebaran bahan abu volkan ditentukan oleh ukuran butirnya. Tuf volkan hasil erupsi dari berbagai gunung api menunjukkan sifat yang beragam. Di Indonesia, abu volkan ditemukan berupa riolitik, dasitik, andesitik, basaltik dan ultra-basaltik. Di Jawa Barat, Gunung Salak menghasilkan lahar basalto-andesitik.
Gunung Salak
Menurut Tan (1964), bahan induk tanah-tanah di Pulau Jawa dari arah Timur ke Barat berubah dari tipe basa ke masam. Lebih lanjut, Whitford (1975 dalam van Ranst et al., 2004) juga menyatakan bahwa bahan induk tanah di Pulau Jawa berevolusi menjadi bertipe semakin masam dari arah timur ke barat. Secara lebih spesifik, hasil penelitian van Ranst et al. (2004) menunjukkan bahwa bahan induk tanah-tanah yang berkembang dari abu volkan di Jawa Timur bersifat basa (calc-alkaline basaltic ash), sedangkan ke arah barat bersifat lebih masam, yaitu tipe basalt-andesitic ash (Jawa Tengah) dan andesitic-tuffaceous ash (Jawa Barat). Hal ini menunjukkan bahwa kondisi iklim (suhu dan curah hujan) dan lingkungan pencucian yang semakin hebat ke arah Jawa Barat lebih mendukung pembentukan dan perkembangan mineral-mineral aluminosilikat sebagai hasil dari proses pelapukan bahan induk abu volkan. Di antara mineral liat yang terbentuk tersebut adalah Alofan dan Imogolit (Abidin, 2003 dalam Sugiarti et al., 2010).
Mineral fraksi pasir pada tuf volkan di sekitar Bogor mengandung mineral-mineral magnetit, kuarsa keruh, konkresi besi, hidrargilit, benda hancuran lain berupa lapukan, plagioklas intermedier (andesin), gelas volkan dan hiperstein, sedangkan pada fraksi beratnya dijumpai mineral magnetit, amfibol hijau, augit dan hiperstein (Kholik, 1984). Susunan mineral fraksi pasir ini menunjukkan bahwa tuf volkan tersebut bersusunan andesitik.
Teknologi dan Material Nano
Pertama kali konsep nanoteknologi diperkenalkan oleh Richard Feynman pada sebuah pidato ilmiah yang diselenggarakan oleh American Physical Society di Caltech (California Institute of Technology), 29 Desember 1959, dengan judul “There’s Plenty of Room at the Bottom”. Richard Feynman adalah seorang ahli fisika dan pada tahun 1965 memenangkan hadiah Nobel dalam bidang fisika. Istilah nanoteknologi pertama kali diresmikan oleh Profesor Norio Taniguchi dari Tokyo Science University tahun 1974 dalam makalahnya yang berjudul “On the Basic Concept of ‘Nano-Technology’”.
Pada tahun 1980an definisi Nanoteknologi dieksplorasi lebih jauh lagi oleh Dr. Eric Drexler melalui bukunya yang berjudul “Engines of Creation: The coming Era of Nanotechnology”. Teknologi-Nano adalah pembuatan dan penggunaan materi atau devais pada (divice) ukuran sangat kecil. Materi atau devais ini berada pada ranah 1 hingga 100 nanometer (nm). Satu nm sama dengan satu per-milyar meter (0.000000001 m), yang berarti 50.000 lebih kecil dari ukuran rambut manusia. Saintis menyebut ukuran pada ranah 1 hingga 100 nm ini sebagai skala nano (nanoscale), dan material yang berada pada ranah ini disebut sebagai kristal-nano (nanocrystals) atau material-nano (nanomaterials). Skala nano terbilang unik karena tidak ada struktur padat yang dapat diperkecil. Hal unik lainnya adalah bahwa mekanisme dunia biologis dan fisis berlangsung pada skala 0.1 hingga 100 nm. Pada dimensi ini material menunjukkan sifat fisis yang
berbeda, sehingga saintis berharap akan menemukan efek yang baru pada skala nano dan memberi terobosan bagi teknologi.
Metode Ekstraksi
Untuk memisahkan fraksi nano dan liat dari sampel tuf volkan dilakukan ekstraksi. Henmi dan Wada (1976) melakukan ekstraksi sampel dengan menggunakan H2O2 untuk menghilangkan bahan organik, kemudian didispersikan
pada pH 4 (HCl) atau pH 10 (NaOH) dengan perlakukan gelombang sonik (20 kHz). Pertama, liat (<2 µm) dikumpulkan dengan cara sedimentasi, diikuti dengan flokulasi menggunakan NaCl. Aliquot dari suspensi liat ini dicuci dengan dialysis dalam aquadest (Parfitt et al., 1977 dalam Parfitt dan Henmi, 1980) sampai liat terdispersi kembali, kemudian liat halus (<0.2 µm) dan liat kasar (0.2 hingga 2 µm) dikumpulkan dengan cara sentrifugasi. Suspensi liat ini selanjutnya digunakan untuk analisis baik dalam bentuk sebagai suspensi atau setelah dikering-bekukan. Ghoneim et al. (2007) juga memakai metode yang sama tetapi pada pemisahan fraksi dilakukan menggunakan ultrasonik pada frekuensi 28 kHz. Calabi et al. (2010) melakukan ekstraksi dengan menggunakan 5 g liat disuspensikan dalam 100 ml 1 M NaCl dan kemudian didispersikan menggunakan 214 J ultrasonik. Suspensi liat selanjutnya disentrifugasi pada 3000 rpm selama 40 menit. Pelet yang terbentuk dikumpulkan dan dicuci sembilan kali dengan 50 ml aquadest (supernatan ini adalah suspensi liat-nano). Sebelum setiap kali pencucian, suspensi liat-nano diaduk selama 40 menit. Suspensi liat-nano selanjutnya didialisis (dengan ukuran membran 1000 kDa) dalam aquadest sampai mencapai nilai konduktivitas 0.8-0.5 NS, dan terakhir divakum secara lyofilik.
Metode Jerapan Fosfat
Penetapan jerapan fosfat dilakukan dengan menggunakan metode isothermal Langmuir. Contoh tanah ditimbang 3 g dan dimasukkan ke dalam tabung plastik, kemudian diekuilibrasi selama 6 hari dalam 30 ml 0.011 M CaCl2
yang mengandung sederet konsentrasi Ca(H2PO4)2. Dua tetes toluene
Parfitt dan Henmi (1980) menentukan jerapan fosfat dengan mengekuilibrasikan sebagian suspensi yang mengandung 10-25 mg sampel dengan sejumlah Ca(H2PO4)2 yang diperlukan dan ditambah 20 cc larutan CaCl2
dan aquadest sehingga terbentuk larutan dengan kadar 0.01 M P terhadap CaCl2.
Tabung dikocok selama 16 jam, disentrifugasi, dan P dalam larutan supernatan diukur secara colorimetry.
Yuan dan Wu (2007) menentukan jerapan P secara duplo menggunakan metode batch equilibrium. Singkatnya, 30 ml larutan yang mengandung 200-700 mg P/L (dibuat dari KH2PO4) dan 1 mM CaCl2 sebagai background elektrolit
ditambahkan ke serangkaian tabung sentrifusi berisi 0.0500 g liat-nano alofan. Tabung-tabung yang telah ditutup rapat tersebut dikocok selama 24 jam pada 20
o
C dan kemudian disentrifugasi selama 12 menit pada 5000 rpm. Kadar P dalam larutan supernatan diukur secara colorimetry menggunakan instrumen Lachart. Fosfor yang terjerap dihitung dari perbedaan antara jumlah P awal yang ditambahkan ke liat-nano alofan dan yang terukur pada kondisi kesetimbangan.
Pada penelitian Sherlie dan Nursyirwan (2010), jerapan fosfat ditentukan menggunakan metode isothermal Langmuir. Pada 10 ml sampel suspensi yang ditambahkan 1 ml 1 mM CaCl2 dan mengandung sederet konsentrasi P
BAHAN DAN METODE
Lingkup Penelitian
Penelitian ini terdiri atas ekstraksi fraksi nano bermuatan positif dari bahan tuf volkan serta karakterisasi jerapannya terhadap fosfat. Pemilihan tuf volkan dan bukannya tanah andisol sebagai bahan dasar penelitian didasarkan pada pertimbangan untuk meminimalkan gangguan bahan organik dalam proses ekstraksi sehingga tidak diperlukan perlakuan oksidasi menggunakan H2O2.
Waktu dan Tempat Penelitian
Penelitian dimulai dari bulan Februari sampai dengan Juli 2011 dan dilakukan di Laboratorium Bagian Kimia dan Kesuburan Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Preparasi Sampel dan Ekstraksi Fraksi Nano dan Liat
Bahan yang digunakan meliputi sampel tuf volkan TV-3 dari G. Salak,
Bogor. aquadest, HCl dan NaCl teknis serta pH-paper. Alat yang digunakan meliputi mortar, ayakan 2 mm, neraca analitik, tabung reaksi, magnetic stirrer,
peralatan gelas, botol plastik, ultrasonic, sifon plastik, tabung/silinder 1-L, sentrifuse, dan membran dialisis.
Percobaan Jerapan Fosfat
Bahan yang digunakan meliputi suspensi fraksi nano dan fraksi liat terekstrak, larutan P (KH2PO4), ((NH4)6Mo7O24.4H2O, K(SbO)C4H4O6.0,5H2O,
H2SO4, asam askorbat (vitamin C), CaCl2, aquadest dan kertas saring. Alat yang
digunakan meliputi peralatan gelas, neraca analitik, magnetic stirrer dan UV-Vis spectrophotometer.
Metode Penelitian
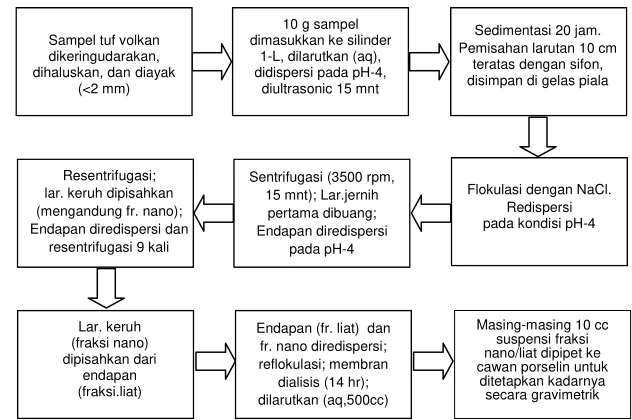
Bagan Alir Ekstraksi Fraksi Nano dan Fraksi Liat
Gambar 1. Bagan alir tahapan ekstraksi fraksi nano dan liat
Preparasi Sampel Tuf Volkan
Tahapan preparasi sampel tuf volkan untuk diekstraksi fraksi nano dan fraksi liatnya disajikan pada Gambar 2.
[a] [b] [c]
Gambar 2. Preparasi sampel tuf volkan
Sampel dikeringudarakan selama 1 minggu (Gambar 2 [a]), agregat tanah dipecahkan menggunakan mortar secara perlahan-lahan (Gambar 2[b]), dan diayak (<2 mm) (Gambar 2 [c]).
Ekstraksi dan Pemisahan Fraksi Nano dan Fraksi Liat
Tahapan ekstraksi fraksi nano dan fraksi liat dari sampel tuf volkan, yaitu
TV-3 yang terdispersi pada pH-4, disajikan pada Gambar 3 dan 4. Sebanyak 10 g sampel TV-3 dimasukkan ke dalam tabung silinder 1-L dan dilarukan dengan
1000 cc aquadest (Gambar 3 [a]), kemudian dikondisikan pH-nya ke pH-4 dengan penambahan 4 cc HCl 33% yang diencerkan 50x dan disedimentasikan
Resentrifugasi; Pemisahan larutan 10 cm
teratas dengan sifon, disimpan di gelas piala
selama 20 jam. Selanjutnya, 10 cm larutan teratas yang mengandung fraksi nano dan fraksi liat diambil dengan menggunakan sifon (Gambar 3 [b]). Tahapan ini dilakukan beberapa kali hingga diperoleh larutan terdispersi 10 cm teratas dalam jumlah yang cukup. Kemudian larutan diflokulasikan kembali menggunakan 200 cc 1 N NaCl dan larutan jernih di atasnya dibuang (Gambar 3 [c]).
[a] [b] [c]
Gambar 3. Ekstraksi fraksi nano dan fraksi liat
[a] [b] [c] [d]
Gambar 4. Hasil sentrifugasi pemisahan fraksi nano dan fraksi liat
Hasil flokulasi dibagi menjadi 4 bagian, dimasukkan ke tabung polietilen, disamakan volumenya dengan menambahkan aquadest dan dikondisikan kembali pH-nya ke pH-4 (Gambar 4 [a]). Setelah itu larutan disentrifugasi pada 3500 rpm selama 15 menit. Hasil sentrifugasi pertama, yang jernih dan mengandung
Dialisis dan Suspensi Fraksi Nano dan Fraksi Liat
Pada Gambar 5 disajikan proses membrane dialysis dan pelarutan fraksi nano dan fraksi liat untuk selanjutnya digunakan dalam percobaan jerapan fosfat.
[a] [b] [c]
Gambar 5. Proses membrane dialysis dan pelarutan
Baik fraksi nano maupun fraksi liat masing-masing ditampung ke dalam gelas piala (Gambar 5 [a]) dan dimasukkan ke dalam membran untuk didialisis dengan cara direndam dalam aquadest selama 2 minggu (Gambar 5 [b]) untuk menghilangkan kelebihan NaCl. Setelah 2 minggu, sampel fraksi nano dan fraksi liat masing-masing dikeluarkan dari membran dan dilarutkan dengan aquadest dalam labu takar 500 ml hingga tanda tera (Gambar 5 [c]) untuk selanjutnya ditetapkan kadar (bobot per satuan volume) secara gravimetrik.
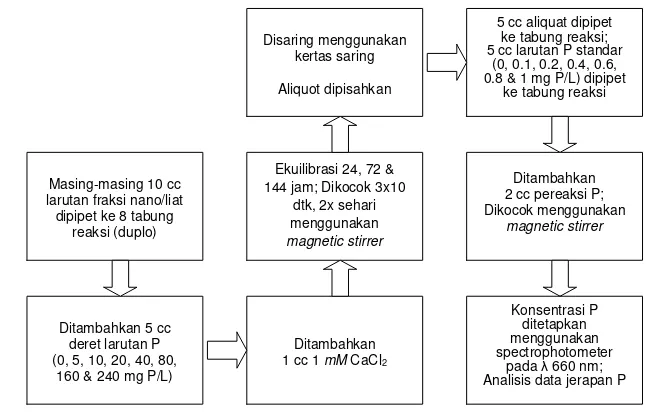
Uji Pengaruh Waktu Ekuilibrasi terhadap Jerapan Fosfat
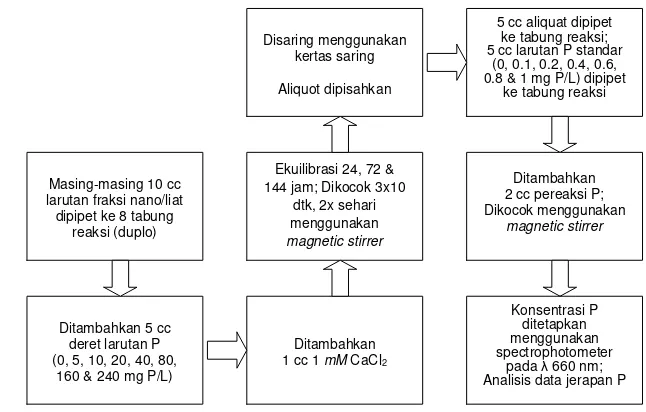
Percobaan jerapan fosfat dilakukan menurut metode isotermal Langmuir. Konsentrasi deret larutan P yang ditambahkan meliputi 0, 5, 10, 20, 40, 80, 160, 240 mg P/L yang dibuat dari larutan baku 500 ppm P (2.1936 g KH2PO4/100 cc).
Konsentrasi P dalam keseimbangan diukur secara kolorimetri menggunakan pereaksi pewarna P menurut metode Murphy dan Riley (1962). Pereaksi pewarna P dibuat sebanyak 100 ml yang terdiri atas 35 ml H2SO4, 15 ml (NH4)6Mo7O24.
4H2O, 5 ml K(SbO)C4H4O6.0,5H2O dan 30 ml asam askorbat (vitamin C).
Gambar 6. Bagan alir uji pengaruh waktu ekuilibrasi terhadap jerapan Fosfat
Masing-masing 10 cc larutan fraksi nano/liat dipipet ke 8 tabung
reaksi (duplo)
Ditambahkan 5 cc deret larutan P (0, 5, 10, 20, 40, 80,
160 & 240 mg P/L)
Ditambahkan 1 cc 1 mM CaCl2 Ekuilibrasi 24, 72 & 144 jam; Dikocok 3x10
dtk, 2x sehari menggunakan magnetic stirrer Disaring menggunakan
kertas saring
Aliquot dipisahkan
5 cc aliquat dipipet ke tabung reaksi; 5 cc larutan P standar
(0, 0.1, 0.2, 0.4, 0.6, 0.8 & 1 mg P/L) dipipet
ke tabung reaksi
Ditambahkan 2 cc pereaksi P; Dikocok menggunakan
magnetic stirrer
Konsentrasi P ditetapkan menggunakan spectrophotometer
HASIL DAN PEMBAHASAN
Deskripsi Lokasi Sampling Tuf Volkan
Lokasi sampling tuf volkan TV-3 G. Salak berada di desa Sukajadi, Bogor, Jawa
Barat dengan koordinat geografis 6o39’28” LS dan 106o43’52,2” BT, altitude 670 m dpl,
formasi geologi Qvsb (quarter volcanic salak brecci; batuan gunung api G. Salak), terdiri
atas lahar, breksi tufaan dan lapili, bersusunan andesit basal, umumnya sangat lapuk. Peta
lokasi sampling disajikan pada Lampiran 1. Foto profil TV-3 G. Salak disajikan pada
Lampiran 2.
Menurut Tan (1964), bahan induk tanah-tanah di lokasi yang disampling dari arah Timur ke Barat berubah dari tipe basa ke masam. Lebih lanjut, Whitford (1975 dalam van Ranst et al., 2004) juga menyatakan bahwa bahan induk tanah di Pulau Jawa berevolusi menjadi bertipe semakin masam dari arah Timur ke Barat. Secara lebih spesifik, hasil penelitian van Ranst et al. (2004) menunjukkan bahwa bahan induk tanah-tanah yang berkembang dari abu volkan di Jawa Timur bersifat basa (calc-alkaline basaltic ash), sedangkan ke arah Barat bersifat lebih masam, yaitu tipe basalt-andesitic ash (Jawa Tengah) dan andesitic-tuffaceous ash (Jawa Barat). Hal ini menunjukkan bahwa kondisi iklim (suhu dan curah hujan) dan lingkungan pencucian yang semakin hebat ke arah Jawa Barat lebih mendukung pembentukan dan perkembangan mineral-mineral aluminosilikat sebagai hasil dari proses pelapukan bahan induk volkan. Di antara mineral liat yang terbentuk tersebut adalah Alofan dan Imogolit yang kini telah diketahui bersifat kristalin dan memiliki ukuran pada tingkat nano (<5 nm) (Abidin, 2003 dalam Sugiarti et al., 2010). Dengan demikian, dari sampel tuf volkan yang diambil di Bogor, Jawa Barat diharapkan diperoleh fraksi nano yang lebih banyak dengan tingkat kristalisasi yang lebih sempurna daripada dari sampel yang diambil di Jawa Tengah.
Ekstraksi berdasarkan Metode Gravimetrik
Bahan induk tuf volkan TV-3 bersusunan tufa andesitik (van Ranst et al.
dapat diekstraksi fraksi nano sejumlah 2.7082 mg/g tuf volkan dan fraksi liat sejumlah 3.8769 mg/g tuf volkan.
Tabel 1. Hasil penetapan kadar fraksi nano dan liat dalam 10 cc suspensi
Ulangan
Tuf Volkan Fraksi Liat Fraksi Nano
KA
Karakterisasi Jerapan Fosfat dari Fraksi Nano dan Fraksi Liat TV-3
Pengukuran P dilakukan dengan metode Murphy dan Riley (1962) dan
konsentrasi P dalam keseimbangan diukur dengan UV-Vis spektrofotometer pada λ 660 nm. Jerapan P diperoleh dari selisih antara jumlah P yang ditambahkan dan P di dalam larutan kesetimbangan (nilai P yang terukur). Untuk menghitung jerapan P digunakan persamaan isotermal Langmuir sebagai berikut :
x/m= kbC
(1+kC)
dimana :
C = konsentrasi P kesetimbangan
x/m = jumlah P yang dijerap per satuan berat fraksi liat atau nano k = konstanta (energi ikatan)
b = jerapan P maksimum
Jerapan maksimum (nilai b) menunjukkan kemampuan maksimum adsorbent untuk menjerap P yang ditambahkan. Energi ikatan (nilai k) adalah kemampuan adsorbent untuk menjerap P yang ditambahkan, sehingga mudah tidaknya P terjerap dapat diduga. Semakin tinggi nilai k, energi yang dibutuhkan untuk menjerap P semakin tinggi (Kasno, 2002).
Tabel 2. Nilai Jerapan Maksimum dan Energi Ikatan
Sampel Waktu Ekulibrasi
Fraksi Nano Fraksi Liat
k b k b
TV-3
24 jam 0.7883 14.5138 1.0827 4.5998
72 jam 0.1912 25.1256 0.4140 20.3666
144 jam 0.4499 32.7869 0.3658 25.1256
Nanoclay 24 jam 0.4980 16.2338 Yuan & Wu (2007)
Imogolit 16 jam 0.2352 3.7523 Parfitt & Henmi (1980)
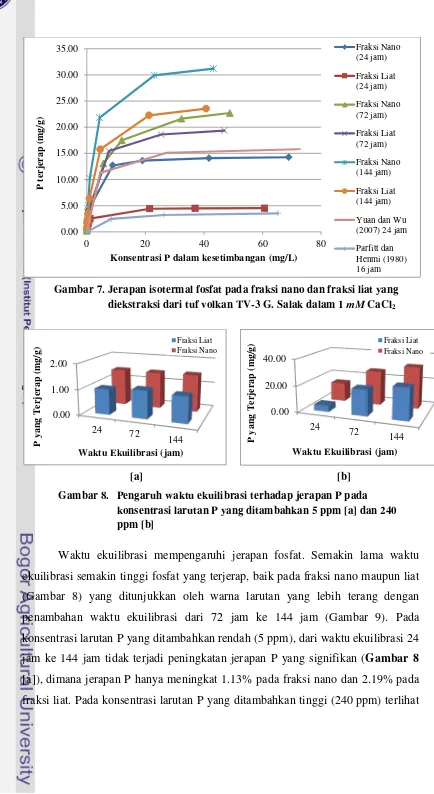
Dari Tabel 2 dapat dilihat bahwa nilai jerapan maksimum P pada fraksi nano dan liat yang diekstraksi dari tuf volkan TV-3 G. Salak, Bogor meningkat dengan semakin lamanya waktu ekuilibrasi. Jika dibandingkan dengan literatur, jerapan maksimum P pada nanoclay China dengan waktu ekuilibrasi 24 jam (Yuan dan Wu, 2007) dan Imogolit New Zealand dengan waktu ekuilibrasi 16 jam (Parfitt dan Henmi, 1980) lebih rendah dibandingkan dengan pada fraksi nano
yang diekstraksi dari tuf volkan TV-3 G. Salak, Bogor dengan waktu ekuilibrasi 72 dan 144 jam.
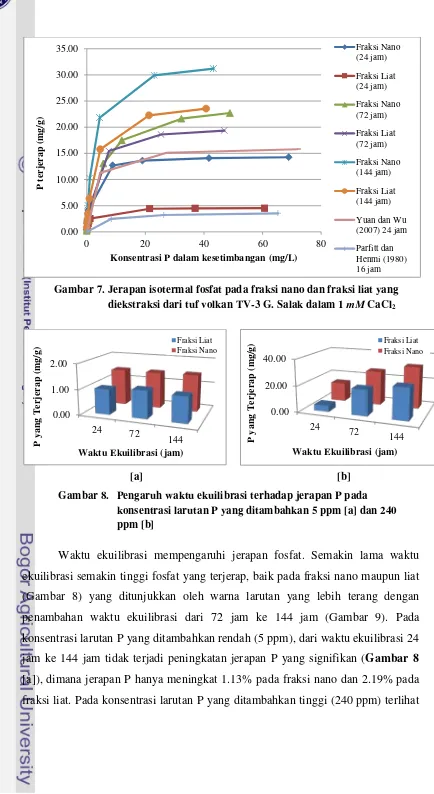
Hasil percobaan menunjukkan bahwa pada konsentrasi keseimbangan yang sama (C, sumbu X Gambar 7), jerapan fosfat (PO4-3 ) per satuan berat yang
sama (x/m, sumbu Y Gambar 7) pada fraksi nano TV-3 lebih tinggi dibandingkan pada fraksi liat. Hal ini dipengaruhi oleh tingkat kristalisasi fraksi nano yang telah sempurna dan ukuran fraksi nano yang lebih halus sehingga memiliki kapasitas jerapan P yang lebih tinggi daripada fraksi liat. Bola-nano Alofan dan tabung-nano Imogolit masing-masing memiliki luas permukaan 1000-1200 dan 1100-1300 m2/g. Dibandingkan luas permukaan montmorilonit, nilai-nilai ini lebih besar 3-4 kali lipat. Perbedaan kapasitas jerapan fosfat tersebut meningkat dengan meningkatnya C.
0.00
Gambar 7. Jerapan isotermal fosfat pada fraksi nano dan fraksi liat yang diekstraksi dari tuf volkan TV-3 G. Salak dalam 1 mM CaCl2
[a] [b]
Gambar 8. Pengaruh waktu ekuilibrasi terhadap jerapan P pada konsentrasi larutan P yang ditambahkan 5 ppm [a] dan 240 ppm [b]
Waktu ekuilibrasi mempengaruhi jerapan fosfat. Semakin lama waktu ekuilibrasi semakin tinggi fosfat yang terjerap, baik pada fraksi nano maupun liat (Gambar 8) yang ditunjukkan oleh warna larutan yang lebih terang dengan penambahan waktu ekuilibrasi dari 72 jam ke 144 jam (Gambar 9). Pada konsentrasi larutan P yang ditambahkan rendah (5 ppm), dari waktu ekuilibrasi 24 jam ke 144 jam tidak terjadi peningkatan jerapan P yang signifikan (Gambar 8 [a]), dimana jerapan P hanya meningkat 1.13% pada fraksi nano dan 2.19% pada fraksi liat. Pada konsentrasi larutan P yang ditambahkan tinggi (240 ppm) terlihat
0.00
Konsentrasi P dalam kesetimbangan (mg/L)
72 jam
144 jam
bahwa semakin lama waktu ekuilibrasi maka peningkatan jerapan P semakin signifikan (Gambar 8 [b]), dimana jerapan P meningkat 54.58% pada fraksi nano dan 80.46% pada fraksi liat. Hal ini menunjukkan bahwa waktu ekuilibrasi yang semakin lama memungkinkan reaksi jerapan fosfat berlangsung lebih baik untuk mencapai kondisi keseimbangan. Secara lebih spesifik, penambahan waktu ekuilibrasi menyebabkan peningkatan jerapan P yang lebih tinggi tetapi dengan jumlah P terjerap yang lebih rendah pada fraksi liat dibandingkan pada fraksi nano. Hal ini dengan demikian juga menunjukkan bahwa kondisi reaksi kesetimbangan lebih cepat tercapai pada fraksi nano daripada fraksi liat. Hasil ini menunjukkan bahwa fraksi nano bermuatan positif yang diekstraksi dari tuf volkan TV-3 G. Salak prospektif untuk dimanfaatkan sebagai flokulan di bidang sanitasi lingkungan dalam proses pengolahan air (limbah) terkontaminasi P. Endapan yang terbentuk sebagai hasil proses flokulasi akan dapat dimanfaatkan sebagai pupuk P.
[a] [b]
Gambar 9. Perubahan kepekatan warna biru larutan yang menunjukkan peningkatan jerapan P oleh fraksi nano [a] dan liat [b] dengan penambahan waktu ekuilibrasi 72 ke 144 jam
Peningkatan waktu ekuilibrasi dari 24 ke 72 dan 144 jam, dengan diagitasi
3x10 detik menggunakan magnetic stirrer dua kali sehari pada pukul 08.00 dan 16.00, dapat meningkatkan jerapan P pada fraksi nano dan liat. Hal ini berkaitan
dengan peningkatan efektivitas reaksi penjerapan akibat meningkatnya peluang kontak antara fraksi nano atau liat TV-3 dengan ion fosfat. Dengan demikian diharapkan akan terjadi peningkatan jerapan P (PO43-) dengan semakin tingginya
KESIMPULAN DAN SARAN
Kesimpulan
1. Dari bahan tuf volkan TV-3 G. Salak, Bogor, Jawa Barat dapat diekstraksi fraksi nano dan fraksi liat bermuatan positif secara sederhana dengan prinsip dispersi dan flokulasi pada kondisi sistem masam (pH 4.00).
2. Dari 292.33 g BKM sampel tuf volkan TV-3 dapat diekstraksi 15.83 mg fraksi nano atau 2.71 mg fraksi nano/g bahan tuf volkan (0.27%) dan 22.67 mg fraksi liat atau 3.88 mg fraksi liat/g bahan tuf volkan (0.39%).
3. Fraksi nano TV-3 lebih efektif daripada fraksi liatnya dalam menjerap fosfat. 4. Penambahan waktu ekuilibrasi dari 24 ke 72 hingga 144 jam, dengan cara
diagitasi 3x10 detik menggunakan magnetic stirrer dua kali sehari pada pukul 08.00 dan 16.00, diikuti oleh peningkatan jumlah fosfat yang terjerap baik oleh fraksi nano maupun fraksi liat.
5. Fraksi nano bermuatan positif yang diekstraksi dari tuf volkan TV-3 G. Salak prospektif untuk dimanfaatkan sebagai flokulan dalam proses pengolahan air (limbah) terkontaminasi P.
Saran
Penelitian lebih lanjut yang dapat disarankan antara lain:
1. Melakukan percobaan jerapan P dengan waktu ekuilibrasi yang lebih singkat
tetapi dengan penambahan intensitas agitasi dengan cara pengocokan yang berbeda,
2. Melakukan percobaan jerapan P dengan menggunakan air (limbah) alami terkontaminasi P, dan
DAFTAR PUSTAKA
Abidin Z, Matsue N, Henmi T. 2005. Molecular orbital analysis on the dissolut-ion of nano-ball allophane under alkaline conditdissolut-ion. Clay Sci. 13:1-6.
Abidin Z, Matsue N, Henmi T. 2008. Structure of nano-ball allophane and its surface properties. Aluminium and Silicon in Soils and the Environtment. Clay Minerals Group, British Society of Soil Science. 3-5 September 2008, Aberdeen, Scotland. Abstract.
Abidin Z, Matsue N, Henmi T. 2009. Validity of the new method for imogolite synthesis and its genetic implication. pp. 331–341 In Y. Obayashi and Page (Eds.) Interdisciplinary Studies on Environmental Chemistry, Environmental Research in Asia.
Al-Ani T, Sarapää O. 2008. Clay and Clay Mineralogy. Geological Survey of Finland.
Bronto S. 2001. Volkanologi. Buku Teks Bahan Ajar untuk Mahasiswa Ilmu Kebumian Khususnya Geologi. Sekolah Tinggi Teknologi Nasional Yogyakarta. Yogyakarta.
Calabi M, Jara A, Bendall J, Welland M, Maria de la Luz Mora. 2010. Structural characterization of natural nanomaterials: potential use to increase the phosphorus mineralization. World Congress of Soil Science, Soil Solutions for a Changing World. 1-6 Agustus 2010, Brisbane, Australia. p. 31-35. Dewi DF, Masduqi A. 2003. Phosphate removal by crystallization in fluidized bed
reactor using silica sand. J. Purifikasi. 4:151-156.
Elsheikh MA, Abidin Z, Matsue N, Henmi T. 2008. Competitive adsorption of oxalate and phosphate on allophane at low concentration. Clay Sci. 13(6):213-222.
FAO. 2008. Lecture Notes on the Major Soils of the World. Set #3. Mineral Soils Conditioned by Parent Material. http://www.fao.org/DOCREP/003/ YI899E/y1899E/y1899e06.htm#TopOfPage. [9 September 2011].
Fox RL, Kamprath EJ. 1970. Phosphate sorption isotherms for evaluating the phosphate requirements of soils. Soil Sci. Soc. Amer. Proc. 34:902-907. Ghoneim A, Matsue N, Ebid A, Henmi T. 2007. Change in surface acidity of
nano-ball allophane upon Zinc adsorption and its mechanism. Res. J. Environ. Sci. 1(2):64-70.
Hanudin E. 2009. Morphology and chemical structure of allophane. J. Ilmu Tanah dan Lingkungan 9:68-71.
Henmi T, Wada K. 1976. Morphology and composition of allophane. Am. Mineralogist 61:379-390.
Madjid A. 2009. Dasar-Dasar Ilmu Tanah. Bahan Ajar Online Fakultas Pertanian Universitas Sriwijaya. http://dasar2ilmutanah.blogspot.com
Nursyirwan PK. 2010. Ekstraksi Fraksi Nano dari Tuf Volkan G. Talagabodas, Jawa Barat dan Karakterisasi Jerapannya terhadap Fosfat. Skripsi. Departemen Ilmu Tanah dan Sumberdaya Lahan. Fakultas Pertanian. Institut Pertanian Bogor. Bogor.
Parfitt LP, Henmi T. 1980. Structure of some allophanes from New Zealand. Clays and Clay Minerals 28:285-294.
Paton TR. 1978. The Formation of Soil Material. Allen & Unwin, Boston, Mass. Setiawan D. 2010. Ekstraksi Fraksi Nano dari Tuf Volkan G. Lawu, Jawa Tengah
dan Karakterisasi Jerapannya terhadap Amonium. Skripsi. Departemen Ilmu Tanah dan Sumberdaya Lahan. Fakultas Pertanian. Institut Pertanian Bogor. Bogor.
Sherlie OP. 2010. Ekstraksi Fraksi Nano dari Tuf Volkan G. Salak, Jawa Barat dan Karakterisasi Jerapannya terhadap Fosfat. Skripsi. Departemen Ilmu Tanah dan Sumberdaya Lahan. Fakultas Pertanian. Institut Pertanian Bogor. Bogor.
Sugiarti S, Abidin Z, Sudadi U, Henmi T. 2010. Formulasi dan fabrikasi nano-komposit Nano-Ball Allophane/TiO2 sebagai fotokatalis untuk penguraian
senyawa organik berbahaya. Laporan Hibah Kompetitif Penelitian untuk Publikasi Internasional. Kemdiknas.
Tan KH. 1964. The Andosols in Indonesia. Soil Sci. 99:375-378.
______. 1991. Dasar-Dasar Kimia Tanah. Penerjemah: Gunadi DH. Gadjah Mada Univ. Press, Yogyakarta.
______. 1992. Prinviple of Soil Chemistry 2nd edition. Marcell Dekker. New York. 352 p.
______. 1998. Andosol. Kapita Selekta. Program Studi Ilmu Tanah. Program Pasca Sarjana. Universitas Sumatera Utara. Medan.
Van Ranst E. 1995. Clay Mineralogy. Lecture Notes. ITC for Post Graduate Soil Scientist. University of Ghent. 287 p.
Van Ranst E, Utami SR, Vanderdeelen J, Shamshuddin J. 2004. Surface reactivity of Andisols on volcanic ash along the Sunda arc crossing Java Island, Indonesia. Geoderma 123:193-203.
Wada K. 1989. Allophane and Imogolit. Ch. 21, p.1051-1087. In : JB Dixon and SB Weed (ed), Minerals in Soil Environtments, 2nd Edition.
Lampiran 1. Titik Lokasi pengambilan sampel tuf volkan
Lampiran 2. Foto profil TV-3 Gunung Salak, Bogor
1)
Effendi AC, Kusnama, Hermanto B. 1998. Peta Geologi Lembar Bogor, Jawa Skala 1: 100.000. Ed. Kedua. Pusat Penelitian dan Pengembangan Geologi, Bandung.
Lokasi:
Sukajadi, Bogor, Jawa Barat
Altitude: 670 m dpl
Kedalaman: 200-250 cm
Koordinat Geografis: 6o39’28” LS
106o43’52,2” BT
Formasi Geologi:
Qvsb (Quarter volcanic salak brecci; Batuan gunung api G. Salak)
Lahar, breksi tufaan dan lapili, bersusunan andesit basal, umumnya sangat lapuk 1)
Lampiran 3. Hasil analisis data percobaan jerapan P pada fraksi nano dari sampel tuf volkan TV-3 (24 jam)
Lampiran 4. Hasil analisis data percobaan jerapan P pada fraksi liat dari sampel tuf volkan TV-3 (24 jam)
Lampiran 5. Hasil analisis data percobaan jerapan P pada fraksi nano dari sampel tuf volkan TV-3 (72 jam)
Lampiran 6. Hasil analisis data percobaan jerapan P pada fraksi liat dari sampel tuf volkan TV-3 (72 jam)
Lampiran 7. Hasil analisis data percobaan jerapan P pada fraksi nano dari sampel tuf volkan TV-3 (144 jam)
Lampiran 8. Hasil analisis data percobaan jerapan P pada fraksi liat dari sampel tuf volkan TV-3 (144 jam)
PENDAHULUAN
Latar Belakang
Peran fosfat dalam budidaya pertanian telah banyak dipelajari dalam kimia tanah. Namun, keberadaan fosfat dalam perairan juga dapat menimbulkan permasalahan terhadap kualitas air, misalnya menyebabkan terjadinya eutrofikasi (Dewi dan Masduqi, 2003).
Kebutuhan akan air bersih dan meningkatnya kesadaran akan efek samping pencemaran air terhadap kesehatan manusia mendorong pengembangan teknologi serta bahan yang efektif dan terjangkau untuk remediasi pencemaran air. Dalam proses penjernihan air tercemar fosfat, penyebab eutrofikasi, pemanfaatan
material nano alami sebagai flokulan dilaporkan lebih efektif, murah, dan ramah lingkungan daripada bahan kimia sintetik (Yuan dan Wu, 2007). Aplikasi Alofan
pada proses pengolahan air tercemar anion fluorida juga telah dilakukan oleh Kaufhold et al. (2009).
Jerapan P dipengaruhi oleh tipe adsorbent dan ukuran partikelnya yang menentukan karakteristik muatan permukaan serta luas permukaan spesifik dan kapasitas jerapannya. Pada penelitian sebelumnya, Sherlie (2010) menunjukkan bahwa jerapan fosfat pada fraksi nano bermuatan positif yang diekstraksi dari tuf volkan TV-3 G. Salak, Bogor lebih tinggi daripada pada fraksi liatnya. Hal ini karena ukuran partikel fraksi nano lebih kecil sehingga memiliki luas permukaan dan kapasistas jerapan terhadap anion fosfat yang lebih tinggi daripada fraksi liat. Selain luas permukaan spesifik, waktu ekuilibrasi untuk mencapai reaksi kesetimbangan juga mempengaruhi jerapan fosfat (Nair et al., 1984). Berdasarkan hal tersebut, penelitian lanjutan ini dilakukan untuk menguji pengaruh waktu ekuilibrasi terhadap jerapan fosfat pada fraksi nano dan liat yang diekstraksi dari sampel tuf volkan TV-3 G. Salak, Bogor, Jawa Barat.
Tujuan
TINJAUAN PUSTAKA
Fosfat sebagai Hara Tanaman dan Kontaminan Perairan
Fosfat memiliki peran besar dalam kimia tanah dan telah banyak dipelajari. Para ahli kimia menemukan fakta bahwa pemupukan fosfat sangat diperlukan untuk meningkatkan produktivitas pertanian. Akan tetapi kehadiran fosfat dalam air dapat menimbulkan permasalahan terhadap kualitas air, misalnya terjadi eutrofikasi (Dewi dan Masduqi, 2003).
Eutrofikasi merupakan salah satu masalah lingkungan hidup yang mengakibatkan kerusakan ekosistem perairan khususnya di air tawar. Hal tersebut disebabkan oleh fosfat (PO3-) sebagai limbah rumah tangga seperti detergen,
limbah peternakan, limbah industri, dan limbah pertanian. Permintaan air bersih dan meningkatnya kesadaran akan efek samping pencemaran pada kesehatan manusia dan ekosistem mendorong pengembangan teknologi dan bahan yang efektif dan terjangkau untuk pengendalian pencemaran dan pengolahan air (Yuan dan Wu, 2007).
Pemanfaatan Mineral Liat sebagai Nanomaterial Penjerap Fosfat Perairan Karena ketersediaannya yang melimpah di dalam tanah dan sedimen, liat telah lama digunakan sebagai flokulan dan adsorbent partikel tersuspensi dan senyawa beracun dalam air. Penggunaan liat dan mineral liat (secara alami atau setelah dimodifikasi kimia permukaannya) untuk pengolahan air telah banyak diselidiki selama tiga dekade terakhir. Contoh aplikasi tersebut adalah dalam remediasi air tercemar minyak, konstruksi lapisan liat (clay-liners), pencegahan pelindihan leachates organik dari situs pembuangan sampah, inaktivasi logam berat serta pemulihan limbah kaya nitrogen.
dengan luas permukaan spesifik (eksternal dan internal) mencapai beberapa ratus m2/g, mineral liat allophane dapat dimanfaatkan untuk memflokulasi fosfat dari larutan serta meremediasi perairan eutrofik. Allophane tidak terdispersi dalam air, sehingga dapat dipulihkan setelah digunakan (Yuan dan Wu, 2007).
Penerapan allophane pada penanganan air yang tercemar oleh ion fluorida telah dilakukan oleh Kaufhold et al. (2009). Hasil eksperimen tersebut menunjukkan bahwa allophane memiliki prospek lebih baik untuk diterapkan sebagai penjerap ion fluorida dibandingkan dengan zeolit alam (clinoptilolite), goethite ataupun viscogel (R). Bila dibandingkan dengan material komersial penjerap fluorida seperti Fluorolith, daya serap allophane sedikit lebih rendah. Namun demikian, kemudahan mendapatkan allophane dari lingkungan tanah memungkinkan allophane memiliki nilai lebih dibandingkan Fluorolith.
Mineral Liat
Mineral liat merupakan mineral yang berukuran kurang dari 2µ. Mineral liat hanya dapat dilihat dengan bantuan mikroskop elektron. Sifat mineral liat ditentukan dari: (1) susunan kimia pembentuknya yang tetap dan tertentu, terutama berkaitan dengan penempatan internal atom-atomnya, (2) sifat fisika-kimia dengan batasan waktu tertentu, dan (3) kecenderungan membentuk geometris tertentu (Madjid, 2009).
Mineral liat adalah lapisan silikat yang biasanya terbentuk sebagai produk
liat menyerupai mika dalam komposisi kimia, kecuali mereka memiliki ukuran sangat halus. Seperti mika, mineral liat berbentuk seperti serpihan dengan tepi tidak teratur dan satu sisi halus (Al-Ani dan Sarapää, 2008).
Asal Muatan Negatif pada Mineral Liat
Liat tanah biasanya membawa muatan elektronegatif, yang menimbulkan reaksi pertukaran kation. Dua sumber utama untuk asal muatan negatif ialah: 1. Substitusi isomorfik, yaitu penggantian kation dalam struktur kristal oleh
kation lain yang mempunyai ukuran yang sama tetapi muatan (valensi) yang berbeda. Subtitusi isomorfik merupakan sumber utama muatan negatif dalam liat tipe 2:1. Kation yang menggantikan mempunyai muatan yang lebih rendah daripada yang digantikan, misalnya Mg2+ atau Fe2+ menggantikan Al3+ dalam Al-oktahedra, atau Al3+ menggantikan Si4+ dalam Si-tetrahedra sehingga terjadi kelebihan muatan negatif pada liat. Muatan negatif yang dihasilkan dianggap sebagai muatan permanen, karena tidak berubah dengan berubahnya pH. Kemudahan terjadinya substitusi isomorfik tergantung pada ukuran dan valensi ion-ion yang terlibat. Proses ini hanya terjadi antara ion-ion berukuran sebanding. Perbedaan dalam dimensi ion-ion yang saling berganti dilaporkan tidak lebih dari 15%, dan valensi ion-ion yang saling berganti seharusnya tidak berbeda lebih dari satu satuan (Paton, 1978).
2. Disosiasi H+ dari gugus OH yang terdapat pada tepi atau ujung kristal juga dapat menimbulkan muatan negatif. Pada pH tinggi, hidrogen dari hidroksil terurai sedikit dan permukaan liat menjadi bermuatan negatif yang berasal dari ion oksigen. Muatan negatif ini disebut muatan berubah-ubah atau muatan tergantung pH. Besaran dari muatan berubah-ubah ini beragam tergantung pH dan tipe koloid. Jenis muatan ini sangat penting pada liat tipe 1:1, liat oksida besi dan aluminium, dan koloid organik (Tan, 1998).
Asal Muatan Positif pada Mineral Liat
proton. Proses ini, yang hanya penting pada media sangat masam, menghasilkan muatan positif. Ion-ion H+ dan OH-, yang menyebabkan timbulnya muatan permukaan, juga bertanggung jawab atas potensial permukaan listrik. Oleh karena itu, mereka disebut ion-ion penentu potensial.
Muatan positif memungkinkan terjadinya reaksi pertukaran anion dan sangat penting dalam retensi fosfat. Muatan tersebut diperkirakan berasal dari protonasi atau penambahan ion H+ ke gugus hidroksil. Mekanisme ini tergantung pada pH dan valensi dari ion logam. Biasanya proses ini hanya berarti pada liat oksida Al dan Fe, tetapi hal ini kurang penting pada oksida Si (Tan, 1991).
Alofan dan Imogolit
Allophane dan imogolite sudah ditemukan lebih dari 40 tahun yang lalu, yaitu pada tahun 60-an. Namun, penelitian mendalam mengenai keduanya masih jarang dilakukan. Hal ini dikarenakan beberapa faktor, seperti struktur kimianya yang masih sulit dianalisis menggunakan difraksi sinar-X (XRD) dan metode sintesisnya yang hanya bisa dilakukan pada konsentrasi rendah. Analisis XRD pada sampel nano-ball allophone akan memberikan suatu difraktogram yang hampir tanpa atau tidak ada puncak. Sementara para ahli mineralogi liat dan kristalografi selalu menyatakan bahwa mineral liat memiliki suatu keteraturan dalam struktur kristalnya sehingga dapat dideteksi menggunakan XRD yang ditandai oleh adanya puncak-puncak pada difraktogramnya. Oleh karena itu, nano-ball allophane sebelum ini selalu didefinisikan oleh para ahli mineralogi liat dan kristalografi sebagai mineral yang tidak memiliki keteraturan atom dalam penyusunan struktur kristalnya atau dikenal sebagai mineral amorf.
fungsional aktif. Adanya alofan memberikan sifat-sifat unik pada Andisol. Hal ini karena alofan mempunyai muatan bervariasi yang besar, bersifat amfoter, dengan kapasitas tukar kation (KTK) sekitar 10-40 cmol.kg-1 pada pH 7.0, kapasitas tukar anion (KTA) 5-30 cmol.kg-1 pada pH 4.0, struktur acak dan terbuka, serta dapat mengikat fosfat (Tan, 1992; van Ranst, 1995; Wada, 1989). Akibat kuatnya fiksasi fosfat oleh mineral ini, maka ketersediaan fosfat yang mudah larut akan berkurang.
Saat ini morfologi dan struktur kimia alofan yang ditemukan dalam tanah yang berkembang dari abu volkan atau batu apung telah ditemukan (Henmi, 1980; Henmi dan Wada, 1976; Shimizu et al., 1988). Abidin (2003 dalam Sugiarti et al., 2010) membuktikan bahwa alofan adalah suatu mineral liat yang memiliki struktur kimia dan bukan mineral amorf dengan didapatkannya suatu keteraturan polyhedral untuk membuat struktur kimia yang bulat. Dengan ditemukannya keteraturan tersebut, struktur alofan dapat disusun menjadi berbagai macam diameter sebagai isomorfiknya.
Wada (1977) melaporkan bahwa alofan adalah nama kelompok untuk hydrous alluminosilicate dengan komposisi yang ditandai dengan rasio molar Si/Al 1:2 atau 1:1, serta mempunyai struktur mineral yang acak dan terbuka/berpori. Antara lembar tetrahedral dan oktahedral terdapat banyak daerah kosong sehingga molekul air dapat dengan mudah keluar masuk, dan anion seperti fosfat dan nitrat dapat terjerap. Alofan mempunyai luas permukaan spesifik yang
mencapai 1100 m2.g-1. Luas permukaan yang besar ini mengakibatkan sistem koloid tanah menjadi sangat reaktif sehingga pertukaran kation, anion, jerapan air, dan fiksasi menjadi lebih tinggi (Tan, 1992).
Struktur kimia alofan dicirikan oleh “short-range order” dan dominasi Si-O-Al (van Olpen, 1971; Wada, 1977). Komposisi kimia dari alofan bervariasi dengan rasio Si/Al sekitar 0.5 sampai 1. Alofan dengan rasio Si/Al 0.5 memiliki struktur dasar yang terdiri atas lembar gibsit [Al(OH)3] dengan SiO4 tetrahedral,
dan mempunyai morfologi berongga untuk tempat SiO4 tetrahedra dalam bola.
Alofan dengan rasio Si/Al lebih dari 0.5 memiliki kondensasi SiO4 yang terikat
lemah pada struktur (Hanudin, 2009). Alofan yang mempunyai rasio molar Al/Si 2.0 telah diidentifikasi pada Andisol di Selandia Baru dan Jepang serta tanah Podzol di Skotlandia (Parfitt dan Henmi, 1980).
Henmi Research Group dari Ehime University Japan telah lama melakukan penelitian tentang nano-ball allophane dan nano-ball imogolite yang sebagian besar menggunakan material yang diambil dari tanah. Berdasarkan data informasi spectra NMR untuk Si dan Al, gambar TEM dan reaksi serapan air, kation dan anion, Henmi menyimpulkan bahwa allophane memiliki dasar struktur kimia yang sama dengan nano-ball imogolite dan terdapat suatu keteraturan poyhedra pada strukturnya sehingga membentuk suatu bulatan. Allophane memiliki beragam ratio mol Si/Al dengan kisaran nilai antara 0.6 sampai dengan 1.2. Hal ini disebabkan oleh faktor curah hujan dan suhu yang mempengaruhi laju pelarutan silikon dari suatu proses pelapukan batuan dasar di lingkungan pembentukannya. Namun demikian, Henmi menyatakan bahwa pada dasarnya allophane memiliki struktur dasar yang sama dengan imogolite. Yang membedakan adalah asesoris silika yang terikat pada bagian lubang allophane
(Henmi dan Wada, 1976).
asumsi bahwa ion logam alkali dan alkali tanah lebih terkonsentrasi di bagian dalam batu apung daripada di bagian luar, pembentukan imogolit lebih mudah di bagian luar batu apung dan pembentukan alofan lebih mudah di bagian dalam batu apung. Penambahan ion logam alkali dan alkali tanah menghambat pembentukan imogolit dan memfasilitasi pembentukan alofan. Ion-ion logam mempengaruhi disosiasi dari kelompok silanol asam orthosilik. Disosiasi atau non-disosiasi asam orthosilik menyebabkan perbedaan formasi imogolit dan alofan (Abidin, Matsue, dan Henmi, 2009).
Berdasarkan hasil kajian eksperimental, nano-ball allophane memiliki sifat permukaan yang khas yaitu muatan yang bervariasi (variable charge) berdasarkan nilai pH kondisinya. Hal ini dikarenakan pada struktur allophane terdapat gugus silanol dan gugus aluminol (Elsheik et al., 2008). Pada pH tinggi (6-10), nano-ball allophane memiliki muatan negatif yang berasal dari deprotonisasi gugus silanol sehingga kation dan logam berat mudah terikat, sedangkan pada pH rendah (4-6), nano-ball allophane memiliki muatan positif dari protonasi pada gugus aluminol sehingga anion dan ligan mudah terikat. Abidin et al. (2008) menunjukkan sifat permukaan nano-ball allophane dengan simulasi perhitungan kimia yang menunjukkan adanya perpindahan atom H pada struktur kimianya. Simulasi pada pH netral menunjukkan atom H yang terikat pada gugus silanol dan gugus aluminol dari nano-ball allophane mudah mengalami perpindahan antar kedua gugus tersebut. Ketika kondisi
kesetimbangan ini diganggu dengan mengubah nilai pH sistem, maka atom H yang terikat pada gugus silanol atau gugus aluminol menjadi tidak stabil dan
mudah terdeprotonasi atau terprotonisasi.
Andisol