PADA IKAN MAS (Cyprinus carpio)
ALFABETIAN HARJUNO CONDRO HADITOMO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis dengan judul Pemberian Probiotik pada Media Budidaya untuk Pengendalian Aeromonas hydrophila pada Ikan Mas (Cyprinus carpio) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2011
Aquaculture Media as Water Additive to control the Infection of Aeromonas hydrophila in Cyprinid (Cyprinus carpio). Under direction of WIDANARNI and ANGELA MARIANA LUSIASTUTI.
The use of probiotic on aquaculture media as water additive becomes one of the alternatives solution for fish farmers to control the infection of A. hydrophila in cyprinid culture. It was easier and more possible to implement for fish culture. The aimed of this research was to know the concentration of A. hydrophila in media aquaculture that can cause Motile Aeromonad Septicemia (MAS) of the cyprinids and to know the effect of probiotic B. firmus in controlling growth of A. hydrophila. This research comprised 4 treatments with 3 replications, namely: PAP treatment (A. hydrophila 102cfu/ml + B. firmus 106cfu/ml every 2 days for 2 week), PAS (A. hydrophila102cfu/ml + B. firmus106 cfu/ml and siphon every 2 days for 2 week), PC (A. hydrophila 102cfu/ml + B. firmus 108cfu/ml every 2 days for 2 week), and PK (no addition). Data were analyzed descriptively, using tables, graphs and figures. The results showed that the concentration of A. hydrophila on media aquaculture that can cause Motile Aeromonad Septicemia (MAS) of the cyprinids were around 107-108 cfu/ml, and might be worst when the cyprinids were stressfull. The best results of this research was PAP treatment (A. hydrophila102cfu/ml +B. firmus106cfu/ml every 2 days for 2 week) with survival rate 100%.
ALFABETIAN HARJUNO CONDRO HADITOMO. Pemberian Probiotik pada Media Budidaya untuk Pengendalian Aeromonas hydrophila pada Ikan Mas (Cyprinus carpio). Dibimbing oleh WIDANARNI dan ANGELA MARIANA LUSIASTUTI.
Pemberian probiotik pada media budidaya menjadi salah satu solusi alternatif bagi pembudidaya ikan dalam mengendalikan serangan A. hydrophila pada budidaya ikan mas (Cyprinus carpio). Dengan cara ini maka probiotik lebih mudah dan memungkinkan untuk diterapkan dalam budidaya perikanan. Penelitian ini bertujuan untuk mengetahui konsentrasi dari A. hydrophila di media budidaya yang dapat menyebabkan Motile Aeromonad Septicemia (MAS) pada ikan mas (Cyprinus carpio) serta pengaruh penambahan probiotik yang dapat menekan pertumbuhan A. hydrophiladi media budidaya.
Penelitian ini dilaksanakan di Balai Riset Perikanan Budidaya Air Tawar Bogor. Penelitian ini dilaksanakan dalam empat tahapan dengan berbagai perlakuan di setiap tahapannya. Hasil dari setiap tahapan menjadi dasar penentu keputusan pada penelitian tahap selanjutnya. Data utama penelitian ini berupa tingkat kelangsungan hidup, fase pertumbuhan bakteri, kepadatan bakteri pada media budidaya beserta data pendukung berupa kualitas air, gejala klinis, dan perubahan gambaran darah, akan dianalisa secara deskriptif dengan menggunakan tabel, grafik dan gambar.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
ALFABETIAN HARJUNO CONDRO HADITOMO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
MAYOR ILMU AKUAKULTUR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Alfabetian Harjuno Condro Haditomo
NIM : C151090051
Disetujui Komisi Pembimbing
Dr. Ir. Widanarni, M.Si
Ketua AnggotaDr. drh. Angela Mariana L, M.Si
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Akuakultur
Prof. Dr. Enang Harris, MS Dr.Ir. Dahrul Syah, M.Sc. Agr
sehingga karya ilmiah dengan judul “Pemberian Probiotik pada Media Budidaya untuk Pengendalian Aeromonas hydrophila pada Ikan Mas (Cyprinus carpio)” dapat diselesaikan dengan baik. Penulis mengucapkan terimakasih kepada:
1. Dr.Ir.Widanarni, M.Si dan Dr. drh. Angela Mariana Lusiastuti, M.Si atas waktu, tuntunan, kesabaran, kebijaksanaan, serta bimbingan dan arahan yang selalu diberikan hingga tesis ini dapat diselesaikan.
2. Dr.Ir. Sukenda, M.Sc selaku penguji luar komisi yang telah memberikan saran dan masukan untuk kesempurnaan tesis ini.
3. Prof.Dr.Ir. Enang Harris, MS sebagai Ketua Program Studi Ilmu Akuakultur yang telah banyak memberikan bantuan selama menempuh pendidikan di Institut Pertanian Bogor.
4. Seluruh jajaran pimpinan, peneliti, teknisi, administrasi dan rekan-rekan di Balai Riset Perikanan Budidaya Air Tawar Bogor atas segala bantuan dan fasilitas yang diberikan.
5. Kementrian Pendidikan Nasional yang telah memberikan Beasiswa selama mengikuti pendidikan S2.
6. Ayahanda Hari Supranoto dan Ibunda Sri Supiana, Bapak Mertua Dedy Tinardi (Alm) dan Ibu Mertua Hj. Dewi Puspahati yang telah memberikan cinta dan kasih sayang, doa serta semangat yang tak pernah henti kepada penulis. Adik-adik dan kakak-kakakku Destian Bimantoro, Krestian Tripratomo, Retno Palupi, Reny Purwandari serta seluruh keluarga besar yang selalu memberikan do`a, dukungan dan semangat.
7. Istri tercinta Rina Puspitasari, sumber inspirasi dan semangatku Diandra Azzahra Sari Haditomo atas kasih sayang, pengertian, dukungan, kesabaran, pengorbanan, dan doa yang diberikan
8. Teman-teman Akuakultur 2009 (Reza Samsudin, Rahman, Tanbiyaskur, Hary Krettiawan, Aras Syazili, Syafrizal Putra, Anwar Hasan, Eulis Marlina, Dian Febriani, Sefti Heza, Jenny Abidin, Iko Imelda Arisa, Muznah Toatubun, Dewi Puspaningsih, Riri Ezraneti, Mulyani, Novi Mayasari, Zuraida, Erna Thalib, Wahyuni Fanggitasik, Jacqueline Sahetapy, Jakomina Metungun, Mariana Beruatjaan, Ary Agus Twilasto, Romeos Kalvari).
9. Semua pihak yang tidak dapat disebut satu persatu yang telah memberikan segala doa dan bantuan baik moril maupun materil.
Penulis dilahirkan di Jakarta pada tanggal 08 September 1983, putra pertama dari tiga bersaudara pasangan Bapak Hari Supranoto dan Ibu Sri Supiana.
Tahun 2000 Penulis lulus dari SMU Negeri 2 Tegal. Pada tahun yang sama penulis melanjutkan pendidikan Strata Satu (S1) pada Program Studi Budidaya Perairan, Jurusan Perikanan, Fakultas Perikanan dan Ilmu Kelautan Universitas Diponegoro, Semarang dan berhasil lulus pada Tahun 2005.
Halaman
Pemilihan Ikan Uji dan Bakteri (Patogen dan Probiotik) ... 13
Analisa Data... 20
HASIL DAN PEMBAHASAN... 21
Penelitian Tahap I ... 21
Identifikasi bakteri patogen uji ... 21
Pertumbuhan A. hydrophila pada media broth... 22
Pertumbuhan A. hydrophila pada media budidaya ... 24
Penelitian Tahap II ... 25
Identifikasi probiotik uji ... 26
Pertumbuhan B. firmus pada media broth... 26
Pertumbuhan B. firmus pada media budidaya ... 27
Penelitian Tahap III... 30
Kelangsungan hidup... 30
Tingkat pertumbuhan A. hydrophilapada media budidaya ... 32
Pemanfaatan pakan... 33
Kadar hemoglobin... 35
Kadar hematokrit... 36
Total eritrosit... 36
Total leukosit... 38
Infeksi A. hydrophila terhadap histopatologi ginjal dan hati ikan ... 38
Penelitian Tahap IV... 40
Kualitas Media Budidaya... 43
SIMPULAN DAN SARAN ... 45
Simpulan ... 45
Saran... 45
DAFTAR PUSTAKA ... 46
Halaman 1 Identifikasi A. hydrophilahasil reisolasi dari ikan uji……….. 22
2 Kepadatan A. hydrophila setelah 24 jam pada media broth
(TSB)………. 23
3 Identifikasi probiotik B. firmus……….... 26
4 Kepadatan probiotik B. firmus setelah 24 jam pada media broth
(TSB) ... 26
5 Perbandingan kultur bersama probiotik B. firmus dengan A.
hydrophila……… 29
6 Waktu kematian ikan uji pada infeksi A. hydrophila melalui
media budidaya ……… 31
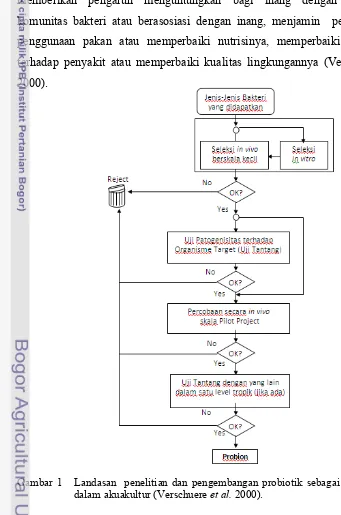
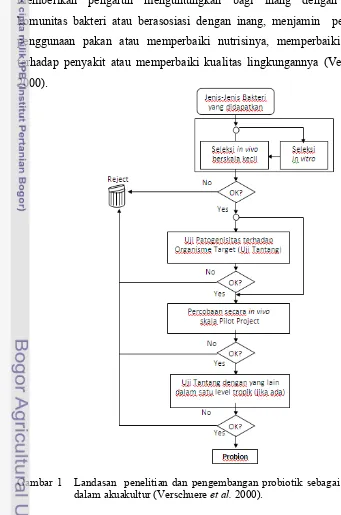
Halaman 1 Landasan penelitian dan pengembangan probiotik sebagai agen
biokontrol dalam akuakultur……… 5
2 A. hydrophilapada media agar ………. 21
3 Ikan sakit pada uji Postulat Koch………... 22
4 Kurva pertumbuhan A. hydrophila pada media broth pengamatan setiap 2 jam selama 24 jam ………. 23
5 Pertumbuhan A. hydrophila pada media budidaya ……….. 24
6 Kondisi DO media budidaya yang didalamnya ditambahkan A. hydrophila102cfu/ml di awal penelitian ……… 25
7 Kurva pertumbuhan B. firmus pada media broth setiap 2 jam selama 24 jam ……….. 27
8 Pertumbuhan probiotik B. firmuspada media budidaya ………... 28
9 Koloni A. hydrophila pada media budidaya probiotik B. firmus.. 28
10 Tingkat kelangsungan hidup ikan uji... 30
11 Kepadatan A. hydrophiladi media budidaya (Log 10cfu/ml)…….. 32
12 Kurva pemanfaatan pakan ikan uji ……….. 34
13 Kadar hemoglobin ikan uji selama penelitian………... 35
14 Kadar hematokrit ikan uji selama penelitian ………... 36
15 Total eritrosit ikan uji ……….. 37
16 Total Leukosit ikan uji ……… 38
17 Kondisi ginjal dan hati ikan uji ……….. 39
18 Tingkat kelangsungan hidup ikan uji setelah pemberian probiotik.. 41
19 a) Koloni A. hydrophila dan probiotik B. firmus yang tumbuh pada media agar TSA; b)Tidak ada koloni A. hydrophila yang
Halaman 1 Perubahan pola renang ikan mas penelitian tahap 3………...… 57
Latar Belakang
Salah satu kendala yang umum dihadapi dalam budidaya ikan adalah adanya serangan penyakit yang disebabkan oleh bakteri. Permasalahan ini meningkat seiring dengan semakin intensifnya suatu usaha budidaya perikanan. Intensifikasi suatu usaha budidaya ditandai dengan meningkatnya padat tebar dan pemberian pakan pada suatu usaha budidaya.
Hatmanti et al. (2009) menyatakan bahwa beberapa bakteri patogen yang sering menimbulkan permasalahan bagi pembudidaya ikan adalah Vibrio sp., Aeromonas sp., Pseudomonas sp., Streptococcus sp., Pasteurella sp., dan Mycobacterium sp. Penyakit bakterial yang sering menyerang berbagai jenis ikan pada berbagai tingkatan umur adalah Aeromonas hydrophila. Pada tahun 1980 pernah terjadi wabah yang disebabkan oleh A. hydrophila di daerah Jawa Barat dan sekitarnya, menimbulkan kerugian yang sangat besar bagi para pembudidaya berbagai spesies ikan air tawar.
Motile Aeromonad Septicemia (MAS) yang disebabkan oleh A. hydrophila merupakan permasalahan yang dihadapi oleh pembudidaya di seluruh dunia. A. hydrophila ini tidak hanya menyerang ikan mas saja, namun juga menyerang berbagai ikan air tawar lain. Tahun 2002, Dinas Peternakan dan Perikanan Kabupaten Bogor melaporkan jumlah total ikan mas yang mati akibat serangan bakteri yang diduga kuat A. hydrophila hingga mencapai 200 ton, di lain daerah yakni Pemerintah Daerah Kuningan menyebutkan adanya kematian 800 ton ikan mas siap jual. Kejadian tahun 2006, di Provinsi Sumatra Barat terjadi kematian hampir mencapai 47 ton ikan gurame karena serangan A. hydrophila, sedangkan di Kabupaten Bogor para petani sering mengeluhkan kematian ikan mas, lele, dan patin akibat serangan bakteri ini walau dalam jumlah sedikit (Hidayat 2006).
sebagai probiotik. Probiotik seringkali digunakan sebagai upaya pencegahan serangan bakteri patogen yang lebih aman dibandingkan dengan penggunaan antibiotik yang menimbulkan resistensi bakteri terhadap antibiotik tersebut. Aplikasi penggunaan probiotik dapat dilakukan dengan beberapa metode yaitu melalui pencampuran pakan dan perendaman atau pemberian probiotik pada media budidaya.
Rumusan Masalah
A. hydrophila merupakan bakteri patogen oportunistik yang bersifat fakultatif anaerob dan umum ada di setiap perairan (Burton & Lanza 1986; Palumbo et al. 1992; Inglis et al. 1993; Harikrishnan et al. 2005), oportunistik atau tidak menjadi berbahaya jika dalam kondisi budidaya yang baik, akan tetapi bila kondisi budidaya buruk, seperti adanya perubahan lingkungan yang menyebabkan tingkat stres ikan meningkat, akan dapat menyebabkan kematian masal (Harikrishnan et al. 2005), baik pada ukuran benih maupun induk dalam waktu yang relatif singkat sehingga mengakibatkan kerugian yang cukup besar. Namun demikian hingga saat ini belum diketahui secara pasti tingkat kepadatan A. hydrophila yang dapat memicu timbulnya serangan penyakit pada ikan mas pada media budidaya.
Manipulasi terhadap populasi mikroba yang berada di perairan guna pencegahan sebelum terjadinya serangan bakteri yang bersifat mematikan perlu dilakukan sebagaimana konsep probiotik sebagai biokontrol. Namun demikian penggunaan probiotik di dunia perikanan saat ini memakan biaya yang cukup tinggi karena harus digunakan secara rutin setiap hari atau beberapa hari sekali hingga waktu panen tiba. Sehingga diperlukan solusi yang lebih baik dan tepat di dalam pemakaian probiotik untuk dapat menekan biaya produksi dan meningkatkan keuntungan usaha budidaya perikanan.
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk mengetahui konsentrasi A. hydrophila di media budidaya yang dapat menyebabkan MAS pada ikan mas, serta pengaruh penambahan probiotik yang dapat menekan pertumbuhan A. hydrophila pada media budidaya.
Manfaat dari penelitian ini adalah dengan mengetahui tingkat konsentrasi A. hydrophila yang dapat menyebabkan MAS pada ikan mas, maka dapat dilakukan pencegahan terhadap kemungkinan terjadinya serangan yang mematikan dengan cara memberikan probiotik yang dapat menekan pertumbuhan A. hydrophiladi media lingkungan budidaya. Diharapkan hasil dari penelitian ini dapat mengatasi permasalahan yang ada pada budidaya ikan mas dengan lebih efektif dan efisien.
Hipotesis
Probiotik Akuakultur
Probiotik adalah bakteri hidup yang ditambahkan ke dalam pakan yang dapat memberikan keuntungan bagi inang dengan memperbaiki keseimbangan bakteri di dalam ususnya (Fuller 1992). Namun demikian, pengertian ini menjadi berkembang bagi hewan akuatik yang berarti sebagai bakteri hidup yang memberikan pengaruh menguntungkan bagi inang dengan memodifikasi komunitas bakteri atau berasosiasi dengan inang, menjamin perbaikan dalam penggunaan pakan atau memperbaiki nutrisinya, memperbaiki respon inang terhadap penyakit atau memperbaiki kualitas lingkungannya (Verschuere et al. 2000).
Bakteri probiotik memiliki mekanisme kerja yang dapat dibagi menjadi beberapa cara, yakni: produksi senyawa inhibitor; kompetisi terhadap senyawa kimia (Fe) atau sumber energi (nutrisi); kompetisi terhadap tempat pelekatan; peningkatan respon imun (kekebalan); perbaikan kualitas air; dan interaksi dengan fitoplankton.
didasarkan pada alasan ekologis yang berkaitan dengan habitat asli dari kandidat bakteri probiotik (misal: mikroorganisme flora yang terdapat di saluran pencernaan). Probiotik dari habitat aslinya memiliki peluang hidup dan tumbuh yang lebih besar dibandingkan kompetitor asing dari luar sistem, dan mereka menunjukkan pertumbuhan dalam jumlah sebagai buktinya (Riquelme et al. 1997; Jo¨born et al. 1997; Rengpipat et al. 2003).
Saat ini probiotik sudah menjadi bagian tak terpisahkan dalam budidaya perikanan untuk mendapatkan produksi yang tingi. Probiotik yang umum digunakan termasuk spesies dari Lactobacillus, Lactococcus, Leuconostoc, Enterococcus, Carnobacterium, Shewanella, Bacillus, Aeromonas, Vibrio, Enterobacter, Pseudomonas, Clostridium, dan Saccharomyces. Keterkaitan probiotik dalam nutrisi, ketahanan terhadap penyakit, dan berbagai keuntungan lainnya pada ikan sudah diyakini dan tidak diragukan lagi. Salah satu keuntungan yang paling umum diakibatkan oleh adanya probiotik adalah memodulasi sistem imun dengan menstimulasi imun non spesifik secara sistemik baik dalam kondisi in vitro maupun in vivo. Pemberian probiotik baik satu spesies ataupun multispesies mampu meningkatkan aktivitas pagositas, lisosim, komplemen, respiratory burst dengan baik pada ikan. Sama halnya dengan probiotik dapat meningkatkan sistem imun yang ditandai dengan meningkatnya jumlah sel-sel Igp dan acidophilic granulocytes. Berbagai faktor seperti sumber probiotik, dosis, lama pemberian akan memberikan efek yang sangat penting dalam aktivitas immunomodulatory dari probiotik (Nayak 2010).
Bacillus firmus
Bakteri ini merupakan bakteri nontoksik, tidak patogen, berperan sebagai anti infeksius, dan mengaktifasi makrofaga serta dapat merangsang limfosit B (Lomakova 2005). Secara taksonomi B. firmus dapat diklasifikasikan kedalam Filum Firmicutes, Kelas Bacilli, Ordo Bacillales, Famili Bacillaceae, Genus Bacillus, Spesies Bacillus firmus.
tumbuh pada suhu 30oC. Bakteri ini juga tersebar luas pada bermacam-macam
habitat, tidak bersifat patogen terhadap vertebrata ataupun invertebrata (Feliatra et al. 2004) oleh karenanya dapat digunakan sebagai probiotik.
Probiotik B. firmus mampu menghasilkan fitohormon dan termasuk dalam bakteri pelarut fosfat. Pelarutan fosfat secara biologis terjadi karena bakteri ini menghasilkan beberapa enzim seperti enzim fosfatase (Lynch 1983), dan enzim fitase (Alexander 1977). Sebagai probiotik, B. firmus juga mampu berfungsi sebagai immunostimulator yang dapat meningkatkan aktifitas fagosit dengan merangsang makrofaga (Prokesova et al. 1998).
Aeromonas hydrophila
Bakteri A. hydrophila umum ditemukan di perairan, seringkali berperan dalam infeksi sekunder pada jaringan luka (Angka 2001), bakteri ini secara normal terdapat di lingkungan perairan (Harikrishnan et al. 2005). Bakteri Aeromonas tersebar luas di lingkungan akuatik (Palumbo et al. 1992) dan menyebabkan hemoragi septikemia serta menimbulkan sindrom luka borok yang bersifat epizootik di banyak spesies perairan air tawar (Shao et al. 2004) dan spesies air laut (Lilley et al. 1997). Infeksi A. hydrophila memiliki rentang yang luas pada hewan akuatik maupun teresterial termasuk mamalia, dan menjadi agen penyebab penyakit yang umum menyerang ikan budidaya perairan hangat di seluruh dunia (Austin and Adams 1996; Thune et al. 1993; Yu et al. 2004). Di Asia Tenggara, A. hydrophila menyumbang kontribusi kerugian ekonomi yang sangat besar bagi industri perikanan (Llobrera and Gacutan, 1987; Thampuran et al. 1995). Di sisi lain, A. hydrophila ternyata tidak hanya menjadi agen penyebab penyakit ikan-ikan perairan hangat seperti Channel catfish, Ictalurus punctatus, Tilapia (Amin et al. 1985), Plecoglossus altivelis (Miyazaki and Jo 1985), tetapi juga pada ikan-ikan di perairan dingin dan juga hewan vertebrata tingkat tinggi lainnya (Janda and Abbott 1998). Jadi, sebagai patogen oportunistik A. hydrophila berasosiasi dengan berbagai kondisi klinis dengan rentang yang sangat luas, meliputi kondisi inang homeotermik dan poikilotermik.
buruk, penanganan yang kurang baik ataupun karena adanya patogen berbahaya lain yang terdapat di lingkungan tersebut (Leung et al. 1991). Sindermann (1988) diacu dalam Harikrishnan et al. (2005), menyatakan luka borok di permukaan kulit ikan yang disebabkan oleh A. hydrophilaadalah salah satu penanda biologis utama yang digunakan sebagai acuan dalam menentukan pencemaran pada lingkungan akuatik yang dapat menyebabkan tingkat stres yang tinggi bagi ikan yang hidup di dalamnya.
A. hydrophila yang masuk dalam family Vibrionaceae ini terdiri dari dua genera yang umum disebut sebagai Vibrio dan Aeromonas. Bakteri ini mampu bergerak motil dengan bantuan alat gerak berupa flagella (Botterelli and Ossiprandi 1999), dengan bentuknya batang halus pendek, berukuran 0.7-0.8 µm x 1.0-1.5µm (Kabata 1985) atau diameter 0.3-1.0µm dan panjang 1.0-3.5µm (Hayes 2000; Botterelli and Ossiprandi 1999), tidak berspora, biasanya tidak berkapsul, menyukai lingkungan yang bersuhu 15-30oC dan tumbuh dengan baik pada suhu optimum 28oC (Hayes 2000). Perairan umum A. hydrophila masih ditemukan pada suhu 4oC-32oC dan pertumbuhan mencapai tingkat tertinggi pada suhu 28oC (Burton and Lanza 1986).
acyltransferase), dan serin protease (Hayes 2000). Infeksi bakteri lain dapat menginduksi patogenitas bakteri A. hydrophila.
Menurut Hidayat (2006), terdapat dua mekanisme patogenisitas pada Aeromonas sp. yaitu: (1) Tissue adherence yang diperantarai oleh S-layers. S-layersmembantu adherence dan kolonisasi bakteri pada mukosa usus. Proses ini juga dibantu oleh struktur filamentous (fimbriae) atau membranous (adhesin) yang memiliki aktivitas hemaglutinasi, terutama ditemukan pada strain mesofilik (Botterelli and Ossiprandi 1999). (2) Toxic production; toksin Aeromonas dapat diklasifikasikan sebagai ekso dan endotoksin. Cytotoxins dan enterotoxins (termasuk dengan aktivitas haemolytic) merupakan yang paling penting dalam patogenisitas. Aeromonas sp. dapat juga menghasilkan substansi ekstraseluler lainnya, dengan faktor-faktor difusi yang penting, yaitu: protease, amylase, chitinase, lipase, nuclease (Botterelli and Ossiprandi 1999).
Gambaran Darah
Darah pada ikan berfungsi membawa ion-ion anorganik dan senyawa organik seperti hormon, vitamin, serta beberapa protein plasma. Protein plasma itu sendiri berperan dalam respon tubuh terhadap kekebalan suatu penyakit, penyangga dari perubahan pH darah dan pengatur tekanan osmotik (Bond 1979). Selain itu darah juga berfungsi dalam peredaran zat makanan hasil pencernaan dan oksigen ke sel-sel tubuh serta membawa hormon dan enzim menuju organ-organ yang membutuhkannya. Perubahan gambaran darah baik secara kualitatif maupun kuantitatif dapat menentukan kondisi ikan atau status kesehatannya (Wedemeyer et al. 1990). Beberapa parameter yang dapat memperlihatkan perubahan kondisi tubuh pada darah yaitu kadar hematokrit (Ht), hemoglobin (Hb), jumlah sel darah merah (eritrosit) dan jumlah sel darah putih (leukosit). Hematokrit
kehilangan nafsu makan karena sebab tertentu, maka kadar hematokrit akan menurun (Snieszko et al. 1974). Nilai kadar hematokrit tidak selalu tetap (Randall 1970), ikan memiliki kadar hematokrit berkisar antara 5-60% (Snieszko et al. 1960). Apabila berada di bawah 30% menunjukkan defisiensi eritrosit (Bond 1979), namun demikian kadar hematokrit normal dalam darah ikan mas adalah 27,1%.
Kadar hematokrit berguna untuk menentukan apakah ikan dalam kondisi normal atau anemia, karena nilainya berbeda-beda pada setiap status kesehatan ikan. Menurunnya kadar hematokrit dapat dijadikan petunjuk mengenai rendahnya kandungan protein pakan, defisiensi vitamin atau ikan mendapat infeksi, sedangkan meningkatnya kadar hematokrit menunjukkan ikan ada dalam keadaan stres (Wedemeyer & Yasutake 1977; Anderson & Siwicki 1993).
Hemoglobin
Lagler et al. (1977), hemoglobin berperan dalam proses pengangkutan oksigen dalam darah dan kadar hemoglobin dalam darah berkaitan erat dengan jumlah eritrosit. Kadar hemoglobin dalam darah ikan teleostei berkisar antara 37-70% dan 100% Hb setara dengan 14 gram dalam 100 ml darah, dalam keadaan sakit akut kadar Hb pada ikan akan turun hingga 27%. Kadar hemoglobin pada ikan mas dewasa adalah 8,61-10,86 (gram per 100 cc volume darah) (Angka 1990).
Kadar hemoglobin merupakan indikator anemia yang berkaitan dengan eritrosit yaitu kadar atau kandungan eritrosit matang atau dewasa dalam aliran darah. Rendahnya Hb menunjukkan ikan menderita anemia, namun tingginya kadar Hb berkaitan dengan kondisi ikan yang stres (Blaxhall 1972).
Eritrosit
eritrosit menunjukkan variasi yang dipertimbangkan berdasarkan spesies: umumnya ukuran sel memiliki sumbu yang lebih panjang yaitu 10-15 µm dan yang lebih pendek 8-12 µm dengan jumlah 1-3E+06 sel/mm3 (Takashima &
Hibiya 1995; Alifuddin 1996; Dana 1996).
Rendahnya jumlah eritrosit menunjukkan ikan mengalami anemia, kerusakan ginjal, sedangkan tingginya jumlah eritrosit menandakan ikan berada dalam kondisi stres (Wedemeyer & Yasutake 1977). Ellsaesser (1985), menyatakan bahwa pemeriksaan darah penting artinya untuk memastikan diagnosis suatu penyakit.
Leukosit
Waktu dan Tempat Penelitian
Penelitian ini dilakukan selama 5 bulan, mulai Januari–Juni 2011 di Laboratorium Patologi Ikan, Balai Riset Perikanan Budidaya Air Tawar, Bogor, Jawa Barat.
Pemilihan Ikan Uji dan Bakteri (Patogen dan Probiotik)
Ikan uji yang digunakan adalah ikan mas (Cyprinus carpio) dengan bobot 15 – 30 gram. Dalam penelitian ini padat tebar ikan uji pada setiap akuarium sebanyak 10 ekor/20 liter. Bakteri probiotik yang digunakan dalam penelitian ini adalah bakteri probiotik P23 yaitu Bacillus firmus yang telah diteliti oleh Balai Riset Perikanan Air Tawar, Bogor (Lusiastuti 2010) dan bakteri patogen A. hydrophila (Balai Riset Perikanan Air Tawar, Bogor). Sebelum digunakan ikan uji diaklimatisasi selama 1 minggu.
Bahan dan Media
Bahan yang digunakan terdiri atas media kultur bakteri yaitu: Trypticase Soy Agar (TSA), Trypticase Soy Broth (TSB), media selektif untuk Aeromonas sp. dan Pseudomonas sp. yaitu media agar GSP, serta media selektif untuk A. hydrophila yaitu media Rhimler Shotts (R-S medium). Selain itu digunakan pula aquades, salin (larutan fisiologi), alkohol 96%, dan 70%, korek api, tisu, kapas tutup tabung reaksi, minyak imersi, garam ikan, PK (kalium permanganat) dan bahan-bahan lain untuk karakterisasi bakteri baik patogen maupun probiotik, bahan untuk histopatologi dan lain-lain.
Prosedur Penelitian
Pasase dilakukan dengan penyiapan A. hydrophila yang dikultur pada media agar TSA dan kemudian diinkubasi selama 24 jam untuk kemudian dipindahkan ke media broth TSB. Selanjutnya suspensi sel tersebut siap untuk diinjeksikan ke ikan. Pada pasase ini 15 ekor ikan uji dimasukkan ke dalam dua akuarium untuk spesies bakteri patogen dan satu akuarium untuk kontrol (diinjeksi dengan larutan fisiologis). Selanjutnya ikan uji diamati sampai ikan tersebut menunjukkan gejala klinis atau sakit. Ikan yang sakit diambil untuk diisolasi bakterinya dengan cara digoreskan pada media GSP, RS, dan TSA. Goresan berasal dari luka, rongga perut dan organ ginjal. Koloni bakteri yang tumbuh diamati morfologi koloni, karakteristik biokimia (oksidase dan katalase) serta sifat Gram, untuk memastikan bakteri tersebut adalah spesies bakteri patogen yang diinfeksikan pada ikan. Proses pasase dilakukan dua kali untuk meningkatkan keganasan dari bakteri, selanjutnya bakteri dikultur pada media agar miring TSA untuk sediaan penelitian selanjutnya.
Penelitian Tahap I: Pertumbuhan A. hydrophila pada Media Budidaya
Penelitian ini diawali dengan melihat kurva tumbuh A. hydrophila pada media broth (TSB) selama 24 jam. Pengamatan dan penghitungan jumlah bakteri dilakukan setiap 2 jam dengan metode TPC (Total Plate Count) pada media agar TSA. Hal ini dilakukan untuk mengetahui tingkat pertumbuhan A. hydrophila pada media broth.
tanpa aerasi dan juga dilakukan penambahan pakan setiap harinya, perlakuan ini ditempatkan pada ruangan yang dingin dengan suhu air 24-25oC.
Wadah yang digunakan pada penelitian ini adalah bejana air dari kaca yang diisi dengan air media budidaya sebanyak 2 liter per wadah. Media budidaya yang digunakan berasal dari sumur artetis. Pada setiap perlakuan diasumsikan berisi 10 ekor ikan dengan bobot rata-rata 18 gram dengan volume air 20 liter/akuarium, dengan pemberian pakan 5% dari bobot total ikan yaitu 9 gram/hari. Berdasarkan asumsi tersebut maka pemberian pakan pada penelitian tahap ini adalah 0.18 gram/hari/wadah.
Penelitian dilaksanakan selama 14 hari, dengan pemeriksaan pertumbuhan bakteri dilakukan setiap hari menggunakan metode TPC. Setiap perlakuan dilakukan pengulangan 2 kali. Hasil dari penelitian tahap ini menjadi dasar pertimbangan pada penelitian tahap selanjutnya.
Penelitian Tahap II: Pertumbuhan B. firmus pada Media Budidaya
Penelitian ini diawali dengan melihat kurva tumbuh probiotik B. firmus pada media broth (TSB) selama 24 jam. Pengamatan dan penghitungan jumlah bakteri dilakukan setiap 2 jam dengan metode TPC pada media agar TSA. Hal ini dilakukan untuk mengetahui tingkat pertumbuhan probiotik B. firmus pada media broth.
Untuk mengetahui pertumbuhan probiotik B. firmus pada media budidaya maka dilakukan serangkaian perlakuan terhadap bakteri tersebut. Rancangan penelitian terhadap probiotik B. firmus adalah sebagai berikut: (KP) Kontrol – tanpa penambahan bakteri; (PP1) Media diberi probiotik B. firmus dengan kepadatan 102cfu/ml tanpa aerasi dan tanpa penambahan pakan; (PP2) Media diberi probiotik B. firmus dengan kepadatan 102cfu/ml dengan aerasi dan tanpa penambahan pakan; (PP3) Media diberi probiotikB. firmusdengan kepadatan 102 cfu/ml dengan aerasi dan diberikan penambahan pakan setiap harinya; (PP4) Media diberi probiotik B. firmusdengan kepadatan 102cfu/ml tanpa aerasi namun dengan penambahan pakan setiap harinya.
budidaya yang digunakan berasal dari sumur artetis. Pada setiap perlakuan diasumsikan berisi 10 ekor ikan dengan bobot rata-rata 18 gram dengan volume air 20 liter/akuarium, dengan pemberian pakan 5% dari bobot total ikan yaitu 9 gram/hari. Berdasarkan asumsi tersebut maka pemberian pakan pada penelitian tahap ini adalah 0.18 gram/hari/wadah dan dilakukan selama 4 hari.
Setelah diketahui hasil dari penelitian tahap ini, selanjutnya dilakukan pencarian konsentrasi terbaik dari probiotik B. firmus dengan A. hydrophilasecara in vitro dengan uji kultur bersama. Pada uji kultur bersama antara probiotik B. firmus dengan A. hydrophila ini dibandingkan hasil setiap ujinya dengan kontrol. Uji kultur bersama dilakukan pada perbandingan probiotik B. firmus : A. hydrophila =102 : 102cfu/ml hingga probiotik B. firmus : A. hydrophila =1012 : 102cfu/ml; dan kontrol hanya A. hydrophila102cfu/ml saja.
Setiap perlakuan dikultur pada media broth TSB selama 24 jam untuk selanjutnya diencerkan hingga kepadatan yang diinginkan lalu di kultur bersama pada media broth TSB kembali dan diinkubasi selama 24 jam. Selanjutnya seluruh perlakuan ditanam kedalam media agar RS dan diinkubasi selama 24 jam. Setelah diinkubasi selama 24 jam maka A. hydrophila yang tumbuh pada media RS dilihat dan dibandingkan dengan kontrol. Konsentrasi probiotik yang digunakan pada penelitian tahap IV adalah hasil terbaik dari uji kultur bersama yang telah dilakukan secara in vitro, hasil terbaik ditunjukkan dengan semakin sedikitnya A. hydrophila yang tumbuh pada media RS.
Penelitian Tahap III: Infeksi A. hydrophila pada Ikan Mas (Cyprinus carpio) melalui Media Budidaya
Penelitian tahap ketiga ini dilakukan sesuai dengan hasil dari penelitian tahap pertama yang berkaitan dengan pertumbuhan A. hydrophila pada media budidaya.
Perlakuan ini juga dianggap sebagai perlakuan kontrol. Setiap perlakuan dilakukan 3 kali pengulangan.
Setiap akuarium dimasukan ikan uji 10 ekor/ 20 liter air media budidaya dengan pemberian pakan sebanyak 5 % dari bobot total ikan uji per akuarium. Pemberian pakan dilakukan sedikit demi sedikit hingga ikan uji kenyang dan tidak merespon setiap pakan yang diberikan.
Hasil penelitian tahap ini akan dijadikan sebagai dasar tingkat patogenitas A. hydrophila.
Penelitian Tahap IV: Pemberian Probiotik B. firmus melalui Media Budidaya terhadap Infeksi A. hydrophila
Tahap keempat penelitian ini merupakan suatu penerapan dan aplikasi usaha pemecahan permasalahan yang terjadi dengan serangkaian penelitian yang telah dilakukan. Setelah mendapatkan dua hasil konsentrasi terbaik probiotik B. firmus dengan A. hydrophila secara in vitro pada penelitian kedua, selanjutnya diimplementasikan secara in vivo pada penelitian tahap IV yaitu pemberian probiotik B. firmuspada media budidaya terhadap infeksi A. hydrophila.
Pada tahap ini dilakukan perlakuan selama 14 hari yaitu: (PAP) Perlakuan penambahan A. hydrophila 102cfu/ml dan pemberian probiotik B. firmus 106 cfu/ml yang diberikan setiap 2 hari; (PC) Perlakuan penambahan A. hydrophila 102 cfu/ml dan pemberian probiotik B. firmus 108 cfu/ml yang diberikan setiap 2 hari; (PK) Perlakuan tanpa penambahan A. hydrophila dan tanpa penambahan probiotik B. firmus serta tanpa penyiponan; (PAS) Perlakuan penambahan A. hydrophila 102 cfu/ml dan pemberian probiotik B. firmus 106 cfu/ml namun dengan penyiponan setiap 2 hari sekali.
Pengukuran Parameter
Pengukuran parameter dalam penelitian ini meliputi fase pertumbuhan bakteri, tingkat kelangsungan hidup, gejala klinis, gambaran darah, histopatologi, dan pengukuran kualitas air.
Fase pertumbuhan bakteri
masuk fase penurunan. Hasil pengenceran dikultur pada media agar (TSA), diinkubasi selama 24 jam dan dihitung kepadatannya.
Kelangsungan hidup
Kelangsungan hidup/survival rate (SR), dihitung dengan metode menurut Effendi (1979).
Keterangan :
SR = Kelangsungan hidup (%)
Nt = Jumlah ikan yang hidup pada akhir pemeliharaan (ekor) No = Jumlah ikan pada awal pemeliharaan (ekor)
Gejala klinis
Parameter gejala klinis yang diamati meliputi perubahan tingkah laku ikan yang dapat dijadikan indikator kesehatan ikan, berupa respon reflek (renang, gerak renang ikan pada kolom air dan pernafasan ikan), patologi anatomi tubuh eksternal berupa kecerahan warna tubuh dan mata, kondisi kulit, geripis atau rusaknya sirip atau kelainan lainnya. Selain itu diamati respon makan ikan terhadap pakan yang diberikan selama penelitian dilaksanakan.
Gambaran darah Kadar hematokrit
Kadar Hematokrit (He) diukur menurut Anderson dan Siwicki (1993). Kadar He ditentukan dengan cara: sampel darah dimasukkan dalam tabung mikrohematokrit sampai kira-kira 3/4 bagian tabung, ujungnya disumbat dengan crytoseal sedalam 1 mm. Setelah itu disentrifus dengan sentrifus hematokrit selama 15 menit dengan kecepatan 5000 rpm selama 5 menit dan dilakukan pengukuran panjang darah yang mengendap (a) serta panjang total volume darah yang terdapat didalam tabung (b). Kadar He dinyatakan sebagai % volume padatan sel darah yang dihitung dengan cara; He = (a/b) x 100%.
Kadar hemoglobin
Pengukuran kadar hemoglobin (Hb) dilakukan dengan metode Sahli dengan sahlinometer (Wedemeyer dan Yasutake 1977). Kadar Hb diukur dengan cara mengkonversikan darah ke dalam bentuk asam hematin setelah darah ditambah dengan asam klorida. Prosedur perhitungan dilakukan dengan cara :
SR = x 100% No
darah dihisap dengan pipet sahli sampai skala 20 mm3 atau skala 0,2 ml, lalu ujung pipet dibersihkan dengan kertas tisu. Setelah itu darah dalam pipet dipindahkan dalam tabung Hb-meter yang telah diisi HCl 0,1 N sampai skala 10 (merah), diaduk dan dibiarkan selama 3 sampai 5 menit. Akuades ditambahkan sampai warna darah dan HCl tersebut seperti warna larutan standar yang ada dalam Hb meter tersebut. Kemudian skala dibaca dengan melihat permukaan cairan dan dicocokkan dengan skala tabung sahli yang dilihat pada skala berwarna kuning (gr %) yang berarti banyaknya hemoglobin dalam gram per 100 ml darah.
Total eritrosit
Jumlah eritrosit dihitung dengan metode Blaxhall dan Daisley (1973). Perhitungan eritrosit dilakukan dengan cara: sampel darah dihisap dengan pipet sampai skala 0.5, kemudian ditambahkan larutan Hayem’s sampai skala 101, digoyang atau diayunkan membentuk angka delapan selama 3 – 5 menit agar bercampur homogen. Tetesan pertama dibuang, tetesan berikutnya diteteskan ke dalam hemasitometer dan ditutup dengan kaca penutup, diamati di bawah mikroskop. Perhitungan dilakukan pada kotak kecil hemasitometer, Σ eritrosit = Σ sel eritrosit terhitung x 104sel/mm3.
Total leukosit
Jumlah leukosit dihitung dengan metode Blaxhall dan Daisley (1973) yaitu : sampel darah dihisap dengan pipet berskala sampai 0,5. Lalu ditambahkan larutan turk’s dihisap sampai skala 11 selanjutnya pipet digoyang membentuk angka delapan selama 5 menit agar bercampur homogen. Tetesan pertama dibuang, tetesan berikutnya dimasukkan ke dalam hemasitometer ditutup dengan kaca penutup, diamati dibawah mikroskop. Perhitungan dilakukan pada kotak kecil hemasitometer, Σ leukosit = Σ sel leukosit terhitung x 50 sel/mm3.
Histopatologi
dipotong dengan mikrotom rotary dengan ketebalan 3-5 µm dan diletakkan pada gelas objek. Setelah proses tersebut diatas tahap selanjutnya dilakukan proses pewarnaan dengan menggunakan hematoksilin–eosin. Selanjutnya preparat diamati di bawah mikroskop untuk mengamati perubahan jaringan yang mungkin terjadi. Histopatologi dilakukan dengan tujuan untuk mengetahui tingkat kerusakan organ akibat serangan bakteri patogen. Masing-masing perlakuan diambil satu ekor ikan uji sebagai sampel.
Analisa Data
HASIL DAN PEMBAHASAN
Data yang diperoleh selama penelitian adalah data utama dan data penunjang. Data utama meliputi tingkat kelangsungan hidup ikan uji, kurva pertumbuhan bakteri, kepadatan bakteri pada media budidaya beserta data pendukung berupa perubahan gambaran darah, gejala klinis, dan kualitas air.
Penelitian Tahap I : Pertumbuhan A. hydrophilapada Media Budidaya Identifikasi bakteri patogen uji
Pertumbuhan A. hydrophila pada media budidaya menjadi hal yang sangat penting untuk diketahui dan dikaji lebih mendalam mengingat masih minimnya pengetahuan mendasar mengenai hal ini. Untuk mengetahui hal ini maka dilakukan beberapa kegiatan diantaranya identifikasi bakteri patogen uji, pasase, dan kemudian diujikan pada rancangan penelitian yang telah disiapkan.
Pada media agar GSP, bakteri positif Aeromonas sp. jika bakteri yang tumbuh berwarna krem dan media agar berubah menjadi berwarna oranye, sedangkan pada media selektif RS bakteri positif jika tumbuh koloni berwarna kuning (Gambar 2).
Gambar 2 A. hydrophila pada media agar; a) media selektif GSP; b) media selektif RS
Hasil pengamatan morfologi koloni, karakteristik biokimia dan sifat Gram bakteri hasil reisolasi dari ikan uji yang diinfeksi dengan A. hydrophila disajikan pada Tabel 1.
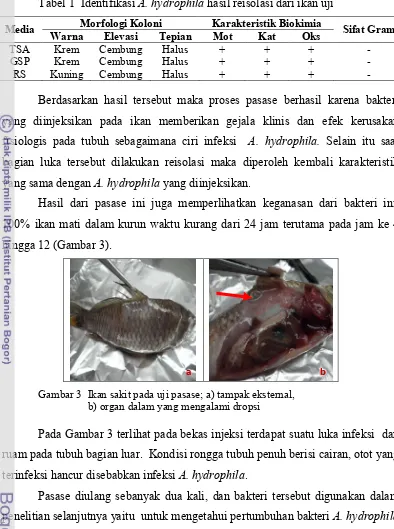
Tabel 1 Identifikasi A. hydrophila hasil reisolasi dari ikan uji
Media Warna Morfologi KoloniElevasi Tepian Karakteristik BiokimiaMot Kat Oks Sifat Gram
TSA Krem Cembung Halus + + +
-GSP Krem Cembung Halus + + +
-RS Kuning Cembung Halus + + +
-Berdasarkan hasil tersebut maka proses pasase berhasil karena bakteri yang diinjeksikan pada ikan memberikan gejala klinis dan efek kerusakan fisiologis pada tubuh sebagaimana ciri infeksi A. hydrophila. Selain itu saat bagian luka tersebut dilakukan reisolasi maka diperoleh kembali karakteristik yang sama dengan A. hydrophilayang diinjeksikan.
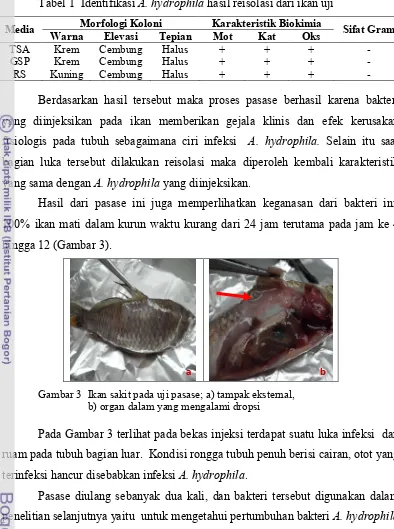
Hasil dari pasase ini juga memperlihatkan keganasan dari bakteri ini, 100% ikan mati dalam kurun waktu kurang dari 24 jam terutama pada jam ke 4 hingga 12 (Gambar 3).
Gambar 3 Ikan sakit pada uji pasase; a) tampak eksternal, b) organ dalam yang mengalami dropsi
Pada Gambar 3 terlihat pada bekas injeksi terdapat suatu luka infeksi dan ruam pada tubuh bagian luar. Kondisi rongga tubuh penuh berisi cairan, otot yang terinfeksi hancur disebabkan infeksi A. hydrophila.
Pasase diulang sebanyak dua kali, dan bakteri tersebut digunakan dalam penelitian selanjutnya yaitu untuk mengetahui pertumbuhan bakteri A. hydrophila pada media budidaya dengan berbagai kondisi, yakni dengan ada tidaknya aerasi, pakan, dan suhu. Hasil penelitian ini dijadikan acuan dalam penelitian tahap berikutnya.
Pertumbuhan A. hydrophilapada media broth
Pada tahap ini pertumbuhan A. hydrophila dilihat setelah 24 jam pada media brothTSB dengan hasil disajikan pada Tabel 2.
Tabel 2 KepadatanA. hydrophila setelah 24 jam pada media broth(TSB) Pengenceran Jumlah Koloni Kepadatan Rerata (cfu/mL)
10-10 TBUD
-1.77E+17
10-10 TBUD
-10-14 171 1.71E+17
10-14 183 1.83E+17
Gambaran pertumbuhan A. hydrophila pada media broth (TSB) dengan pengamatan setiap 2 jam selama 24 jam disajikan pada Gambar 4.
Gambar 4 Kurva pertumbuhan A. hydrophilapada media brothhasil pengamatan setiap 2 jam selama 24 jam; I = fase lamban, II = fase mulai, III = fase eksponensial, IV = fase statis dan kematian.
Berdasarkan kurva di atas memperlihatkan bahwa fase eksponensial A. hydrophila terjadi pada jam ke-16 hingga jam ke-22 dengan peningkatan jumlah mencapai puncaknya pada jam ke-22 dengan kepadatan bakteri mencapai 1.66E+19 cfu/mL. Widdel (2007) diacu dalam Winarti (2010) menyebutkan bahwa fase pertumbuhan bakteri dimulai dengan fase lamban (lag phase) yaitu suatu periode awal yang tampaknya tanpa pertumbuhan, diikuti dengan fase mulai (starting phase), kemudian pertumbuhan cepat yaitu fase eksponensial atau logaritma (exponential phase), selanjutnya mendatar yang disebut disebut fase statis (stationer phase) dan akhirnya diikuti oleh fase penurunan atau kematian (die-off phase).
Dengan diketahuinya kurva pertumbuhan dari A. hydrophila pada media brothTSB maka dapat dijadikan dasar pengetahuan terhadap tingkat pertumbuhan bakteri ini dan menjadi acuan pada penelitian tahap selanjutnya.
I
Pertumbuhan A. hydrophila pada media budidaya
Hasil penelitian tahap ini memperlihatkan kemampuan A. hydrophila untuk hidup, tumbuh dan bertahan pada rentang DO yang luas (0.13–7.82mg/L) sebagaimana disajikan pada Gambar 5.
Gambar 5 Pertumbuhan A. hydrophila pada media budidaya; (PA1) Perlakuan tanpa aerasi dan tanpa pakan; (PA2) Perlakuan dengan aerasi dan tanpa pakan; (PA3) Perlakuan dengan aerasi dan penambahan pakan; (PA4) Perlakuan tanpa aerasi dan penambahan pakan; (PA5) Perlakuan tanpa aerasi dan penambahan pakan (suhu air 24-25oC)
Pada kondisi DO terendah yaitu 0.13mg/L (Gambar 6) terlihat pada perlakuan PA5 (perlakuan tanpa aerasi dan penambahan pakan) terjadi pada hari kelima setelah pemberian A. hydrophila 102cfu/mL dengan kepadatan bakteri
meningkat menjadi 2.3E+10 cfu/mL. Sedangkan DO tertinggi terlihat pada perlakuan PA2 (perlakuan dengan aerasi dan tanpa penambahan pakan) yaitu 7.82mg/L pada hari pertama setelah pemberian A. hydrophila 102cfu/mL yaitu
dengan kepadatan bakteri 9.5E+01 cfu/mL.
Sebagaimana Burton and Lanza (1986), A. hydrophila merupakan bakteri yang umum ditemukan di perairan, dengan tingkat kepadatan yang berkorelasi dengan kandungan nutrien di suatu perairan tersebut. Bahan organik yang berasal dari sisa pakan ikan, dapat memicu peningkatan pertumbuhan A. hydrophila sehingga berpotensi menyebabkan penyakit pada ikan, terutama ikan yang dalam kondisi stres.
Gambar 6 Kondisi DO media budidaya yang ditambahkan A. hydrophila102cfu/mL di
awal penelitian; (PA1) Perlakuan tanpa aerasi dan tanpa pakan; (PA2) Perlakuan dengan aerasi dan tanpa pakan; (PA3) Perlakuan dengan aerasi dan penambahan pakan; (PA4) Perlakuan tanpa aerasi dan penambahan pakan; (PA5) Perlakuan tanpa aerasi dan penambahan pakan (suhu air 24-25oC); (KA) Perlakuan kontrol tanpa penambahan bakteri, tanpa aerasi dan
tanpa pakan
Kemampuan A. hydrophila untuk tumbuh pada rentang suhu dan kadar oksigen yang luas menyebabkan A. hydrophilaini menjadi salah satu bakteri yang paling sering ditemukan pada perairan dan menyebabkan sakit pada berbagai jenis ikan budidaya. Burton and Lanza (1986) dan Austin and Austin (2007) menyatakan bahwa A. hydrophilamampu hidup pada lingkungan bersuhu 4-37oC
dan pertumbuhan mencapai tingkat tertinggi pada suhu 28oC.
Berdasarkan hasil penelitian ini maka pada penelitian aplikasi dengan pemeliharaan ikan di tahap ketiga, digunakan perlakuan ketiga yaitu ikan dipelihara dengan pemberian pakan dan aerasi.
Penelitian Tahap II: Pertumbuhan B. firmus pada Media Budidaya
pertumbuhan A. hydrophilasecara in vitro. Selanjutnya dilakukan penelitian lebih mendalam untuk memanfaatkan probiotik B. firmus sehingga mendapatkan hasil optimal.
Identifikasi probiotik uji
Probiotik B. firmus yang digunakan dalam penelitian ini mampu membentuk zona hambat terhadap A. hydrophila dengan jarak 3 mm (Lusiastuti 2010). Hasil pengamatan terhadap bentuk, karakteristik biokimia dan sifat gram probiotik B. firmusdisajikan pada Tabel 3.
Tabel 3 Identifikasi probiotik B. firmus
Warna Bentuk Morfologi KoloniElevasi Tepian MotilKarakteristik BiokimiaKat Oks GramSifat
Putih Batang Cembung Halus + + - Biru (+)
Probiotik B. firmus memiliki ciri morfologi diantaranya adalah memiliki sifat Gram positif, motil oleh flagel peritrichous, memiliki endospora berbentuk oval, bundar atau silinder. Bakteri ini bersifat fakultatif aerob, tersebar luas pada bermacam-macam habitat tawar maupun laut (Feliatra et al. 2004), serta tidak bersifat patogen terhadap vertebrata ataupun invertebrata.
Pertumbuhan B. firmus pada media broth(TSB)
Prosedur yang dilakukan pada penanaman bakteri ini sama dengan penanaman A. hydrophila maupun bakteri lainnya. Kepadatan probiotik B. firmus setelah 24 jam pada media broth(TSB) disajikan pada Tabel 4.
Tabel 4 Kepadatan probiotik B. firmus setelah 24 jam pada media broth(TSB) Pengenceran Jumlah Koloni Kepadatan Rerata (cfu/mL)
10-8 TBUD
-5.53E+15
10-8 TBUD
-10-12 405 4.05E+15
10-12 700 7.00E+15
Gambar 7 Kurva pertumbuhan B. firmus pada media brothsetiap 2 jam selama 24 jam; I = fase lamban, II = fase mulai, III = fase eksponensial, IV = fase statis dan kematian.
Berdasarkan kurva di atas memperlihatkan bahwa fase eksponensial probiotik B. firmus terjadi pada jam ke-14 hingga jam ke-22 dengan peningkatan jumlah mencapai puncaknya pada jam ke-22 dengan kepadatan bakteri mencapai 1.20E+17 cfu/mL dan mulai menurun setelahnya. Pelczar & Chan (2005) menyatakan bahwa terjadi penambahan populasi yang teratur pada interval waktu tertentu selama masa inkubasi di mana semua bahan dan sel berada dalam keadaan seimbang sehingga menjadikannya fase pertumbuhan ideal bakteri. Pada fase kematian terjadi timbunan produk metabolisme yang beracun, kepadatan bakteri tinggi namun sumber nutrien dan substrat terbatas sehingga jumlah sel yang mati lebih cepat daripada terbentuknya sel-sel baru.
Pertumbuhan B. firmus pada media budidaya
Pertumbuhan probiotik B. firmus pada media budidaya yang diamati selama penelitian disajikan pada Gambar 8. Berbagai perlakuan yang dilakukan pada penelitian ini ditujukan untuk mengetahui gambaran pertumbuhan B. firmus pada media budidaya di berbagai kondisi lingkungan. Dari hasil penelitian ini maka dapat diketahui bahwa adanya oksigen dan penambahan pakan menyebabkan peningkatan pertumbuhan probiotik B. firmus. Probiotik B. firmus merupakan bakteri fakultatif aerob lebih menyukai kondisi lingkungan yang cukup oksigen sehingga pertumbuhannya menjadi lebih baik.
II
Gambar 8 Pertumbuhan probiotik B. firmus pada media budidaya; (PP1) Perlakuan tanpa aerasi dan tanpa pakan; (PP2) Perlakuan dengan aerasi dan tanpa pakan; (PP3) Perlakuan tanpa aerasi dan penambahan pakan; (PP4) Perlakuan dengan aerasi dan penambahan pakan.
Pada tahap ini terjadi penyesuaian rencana waktu pelaksanaan penelitian. Pada tahap ini rencananya dilaksanakan selama 14 hari seperti tahap pertama, namun dalam pelaksanaannya hal itu tidak memungkinkan untuk dilakukan. Penelitian ini dilaksanakan dalam empat hari karena ini adalah hari terakhir probiotik B. firmus dapat terbaca dalam penghitungan TPC. Hal ini disebabkan pertumbuhan probiotik B. firmus kalah cepat dengan pertumbuhan A. hydrophila yang secara alami ada pada media budidaya sehingga pada saat penghitungan bakteri dengan pengenceran tertinggi pada media agar TSA hanya terdapat koloni A. hydrophila dan tidak ada koloni probiotik B. firmus, sebagaimana disajikan pada Gambar 9.
Gambar 9 Koloni A. hydrophila pada media budidaya probiotik B. firmus. a) beberapa koloni probiotik B. firmus(pengenceran 10-12); b) tidak ada koloni probiotik B. firmussama sekali (pengenceran 10-14).
Pada tahap ini dilakukan uji kultur bersama (efikasi konsentrasi probiotik B. firmus terhadap A. hydrophila secara in vitro) pada media TSB dan ditanam pada media TSA dan RS agar. Uji kultur bersama dilakukan dengan membandingkan hasil kultur bersama dengan kontrol yaitu media yang hanya ditanam A. hydrophila 102cfu/mL saja (Tabel 5).
Tabel 5 Perbandingan kultur bersama probiotik B. firmusdengan A. hydrophila B. firmus (cfu/mL) A. hydrophila(cfu/mL) Hasil
102 102 +++++
Keterangan: +++++ = A. hydrophila tumbuh memenuhi seluruh cawan ++++ = A. hydrophila tumbuh sebagian besar cawan +++ = A. hydrophila tumbuh setengah bagian cawan ++ = A. hydrophila tumbuh seperempat bagian cawan + = A. hydrophila tumbuh sedikit pada cawan
Dari Tabel 5 dapat disimpulkan bahwa hasil terbaik dari probiotik B. firmus yang diuji tantang dengan A. hydrophila102 cfu/mL secara in vitro adalah
pada konsentrasi probiotik B. firmus 106 cfu/mL. Pada konsentrasi probiotik B.
firmus yang lebih tinggi, namun hasilnya kurang optimal diduga karena adanya persaingan nutrisi dan oksigen yang tinggi diantara sesama probiotik B. firmus sehingga menyebabkan keseimbangan bakteri pada media terganggu. Dugaan ini didasarkan pada pernyataan Fuller (1992) bahwa efektivitas probiotik diantaranya dipengaruhi oleh komposisi bakteri, dosis/konsentrasi yang digunakan, umur dan kualitas probiotik. Nikoskelainen et al. (2001) juga menyatakan bahwa penggunaan probiotik dalam konsentrasi tinggi ternyata tidak menjamin perlindungan yang lebih baik terhadap inang.
untuk selanjutnya ditambahkan pada media budidaya (in vivo) pada penelitian tahap IV.
Penelitian Tahap III: Infeksi A. hydrophila pada Ikan Uji Melalui Media Budidaya
Pada penelitian tahap ini mulai digunakan ikan dan diuji tantang dengan pemberian A. hydrophilapada masa pemeliharaannya.
Kelangsungan hidup
Tingkat kelangsungan hidup ikan setelah diuji tantang dengan A. hydrophila didapatkan bahwa kelangsungan hidup ikan uji tertinggi diperoleh pada perlakuan KS dengan rata-rata 80% sebagaimana tersaji pada Gambar 10.
Gambar 10 Tingkat kelangsungan hidup ikan uji. Kondisi ikan uji sebelum pemberian probiotik; (PA) Perlakuan penambahan A. hydrophila 102 cfu/mL; (PK)
Perlakuan tanpa penambahan A. hydrophila dan tanpa sipon; (KS) Perlakuan tanpa penambahan A. hydrophila namun dengan penyiponan setiap 3 hari sekali.
oportunistik dan dapat menyebabkan kematian tinggi pada ikan budidaya (Aoki 1999; Ghufran & Kordi 2004; Irianto 2005; Austin & Austin 2007). Kematian ikan disebabkan oleh sifat virulen bakteri yang disebabkan oleh endotoksin dan produk ekstraseluler atau eksotoksin (Angka 2005).
Metode perlakuan ini merupakan adaptasi dari kondisi alamiah di media budidaya, di mana bakteri masuk kedalam tubuh ikan dengan berbagai macam cara. Secara umum bakteri masuk dan menyebar kedalam tubuh ikan dapat melalui kulit, insang, dan saluran pencernaan (Alifuddin 1996). Waktu awal kematian ikan yang rata-rata terjadi pada hari ke tujuh cenderung lebih lambat dibandingkan dengan penelitian sejenis mengenai kerentanan ikan jelawat Leptobarbus hoevenii Blkr oleh Winarti (2010) yang melakukan beberapa pola infeksi A. hydrophila yaitu melalui perendaman, intra peritoneal (IP) dan intra muscular (IM) yang waktu awal kematiannya kurang dari satu hari. Hal ini dikarenakan pada penelitian Winarti (2010) konsentrasi perendaman (kepadatan bakteri) didasarkan pada dosis letal 50. Waktu kematian ikan uji pada tahap ini dapat dilihat pada Tabel 6.
Keterangan: (PA) Perlakuan penambahan A. hydrophila 102 cfu/mL; (PK) Perlakuan
tanpa penambahan A. hydrophila dan tanpa sipon; (KS) Perlakuan tanpa penambahan A. hydrophilanamun dengan penyiponan setiap 3 hari sekali D0…12 = Hari ke-0…ke-12; 1,2,3 = ulangan ke-1,2,3
perlakuan PK. Pada hari berikutnya ikan mengalami kematian dengan jumlah yang berbeda pada setiap perlakuan hingga akhir pengamatan. Kondisi jumlah bakteri yang semakin meningkat, tingkat kepadatan ikan yang tinggi, dan kondisi lingkungan yang memburuk semakin menambah tingkat stres pada ikan. Nafsu makan ikan semakin menurun memudahkan A. hydrophila menginfeksi ikan hingga akhirnya mengalami kematian.
Pada penelitian ini A. hydrophilatumbuh secara alami berdasarkan kondisi lingkungan sehingga dibutuhkan waktu bakteri untuk tumbuh di media budidaya dan masuk kedalam tubuh untuk kemudian juga tumbuh dan menginfeksi ke dalam tubuh secara alamiah. Selain itu, ikan memiliki pertahanan non spesifik yang ada tanpa perlu dirangsang terlebih dahulu yang siap menghadapi patogen yang akan masuk kedalam tubuh. Pertahanan tersebut meliputi pertahanan mekanik atau fisik seperti mukus, sisik dan kulit, lisosim, enzim bakteriolitik lain, serta mukopolisakarida yang menghalangi pergerakan bakteri kedalam tubuh (Anderson 1990).
Tingkat pertumbuhan A. hydrophilapada media budidaya
Tingkat pertumbuhan A. hydrophila pada media budidaya, disajikan Gambar 11.
Gambar 11 Kepadatan A. hydrophilapada media budidaya. (PA) Perlakuan penambahan
A. hydrophila 102 cfu/mL dan tanpa sipon; (PK) Perlakuan tanpa
Dari Gambar 11 terlihat pertumbuhan A. hydrophila pada media budidaya mencapai puncaknya pada hari ke-8 dengan kepadatan bakteri mencapai 5.00E+08 cfu/mL pada perlakuan PA dan mengakibatkan kematian ikan 4 ekor (Tabel 6). Pada perlakuan PK pertumbuhan A. hydrophila tertinggi juga terjadi pada hari ke-8 yaitu 1.65E+09 cfu/mL dan mengakibatkan 10 ekor ikan uji mati. Tingkat pertumbuhan A. hydrophila pada media budidaya (Lampiran 3) sejalan dengan terjadinya kematian ikan uji pada waktu tersebut. Dari hasil ini maka dapat diketahui bahwa konsentrasi A. hydrophila pada media budidaya yang dapat menyebabkan Motile Aeromonad Septicemia(MAS) pada ikan mas berkisar antara 107–108 cfu/mL.
Pada perlakuan KS terlihat bahwa pertumbuhan A. hydrophila bertahan pada kisaran kepadatan 105cfu/mL. Hal ini disebabkan adanya proses penyiponan media budidaya yang dilakukan setiap tiga hari. Cara ini juga dapat digunakan sebagai pencegahan terhadap serangan A. hydrophila. Penyiponan berfungsi sebagai cara untuk mencegah A. hydrophila mencapai jumlah populasi tertentu yang dapat menyebabkan sakit pada ikan (quorum). Quorum sensing ini merupakan suatu bahasa yang digunakan untuk berkomunikasi antara sesama bakteri dalam bentuk sinyal molekul yang digunakan untuk mengkoordinasikan aktivitas yang bersifat terbatas pada golongan bakteri tertentu untuk mengekspresikan protein, selain itu untuk bermigrasi ke lingkungan yang lebih baik. Bakteri A. hydrophila dapat mengekspresikan secara bersamaan sinyal molekul bernama C4HSL untuk memproduksi protein AhyI/AhyR (Teresa et al.
2000).
Pemanfaatan pakan
Gambar 12 Kurva pemanfaatan pakan ikan uji; a) tren pemanfaatan pakan ikan uji pada perlakuan (PA); b) tren pemanfaatan pakan ikan uji pada perlakuan (PK); c) tren pemanfaatan pakan ikan uji pada perlakuan (KS). (PA) Perlakuan penambahan A. hydrophila 102 cfu/mL dan tanpa sipon; (PK) Perlakuan
tanpa penambahan A. hydrophila dan tanpa sipon; (KS) Perlakuan tanpa penambahan A. hydrophiladan penyiponan setiap 3 hari sekali.
Dari Gambar 12 dapat dilihat gejala klinis dari ikan yang mengalami infeksi A. hydrophila ditandai dengan menurunnya nafsu makan ikan yang rata-rata dimulai pada hari ke empat, yang menandakan bahwa infeksi A. hydrophila mulai terjadi. Penurunan nafsu makan ini dapat juga disebabkan karena menurunnya kadar Hb akibat infeksi A. hydrophila (Gambar 13). Menurut Hardi (2011) rendahnya kadar Hb menyebabkan laju metabolisme menurun dan energi yang dihasilkan menjadi rendah, hal ini membuat ikan menjadi lemah dan tidak memiliki nafsu makan serta terlihat berdiam diri di dasar atau berenang lemah. Lebih lanjut Kabata (1985) menyatakan bahwa nafsu makan berkurang dan tingkah laku abnormal merupakan salah satu tanda ikan terinfeksi A. hydrophila.
Hasil analisa dari tingkat pertumbuhan A. hydrophila pada media budidaya, kelangsungan hidup ikan uji, dan waktu kematian ikan uji serta didukung oleh data pemberian pakan dan gambaran darah diperoleh bahwa kondisi kritis ikan uji akibat pertumbuhan A. hydrophila terjadi mulai hari ke-4 hingga ke-7 dengan kepadatan bakteri berkisar antara 105-108cfu/mL. Jika dilihat
dari gejala klinis tingkah laku, pola renang dan respon terhadap pakan dari ikan uji terlihat terjadi perubahan pola renang seperti berenang di permukaan, berkumpul di sudut akuarium, berenang lemah, menyendiri, dengan respon terhadap pemberian pakan yang mulai menurun. Pada pemeriksaan darah, hati dan ginjal ikan yang sakit menunjukkan positif terinfeksi A. hydrophila, dan hasil TPC pada darah diperoleh koloni bakteri dengan kepadatan yang bervariasi antara
b
102-106 cfu/mL. Pemeriksaan pada ikan yang terlihat sehat tidak ditemukan
adanya A. hydrophila.
Kadar hemoglobin
Hemoglobin berfungsi dalam transportasi oksigen dan karbondioksida serta mencegah keasaman darah yang terlalu tinggi (Angka 2005), juga berperan penting dalam osmolaritas eritrosit (Dellman and Brown 1989). Hemoglobin ikan mas normal adalah 7.77 ± 1.58 (5.8-9.8 g%) (Mones 2008) dan 8,3+1,78 (6,4-10,8 g%)(Vonti 2008). Pada penelitian ini didapatkan ikan uji sebelum diberikan perlakuan infeksi A. hydrophila adalah 6.5-7%. Kondisi hemoglobin ikan uji selama pengamatan disajikan pada Gambar 13. Ketidakstabilan kadar Hb sebagaimana terlihat dari Gambar 13 disebabkan toksik hemolisin yang dihasilkan oleh A. hydrophila. Toksin ini yang menyebabkan osmolaritas plasma darah lebih rendah sehingga menyebabkan lisis, hal inilah yang diduga menjadi salah satu faktor virulensi pada A. hydrophila.
Gambar 13 Kadar hemoglobin ikan uji selama penelitian; (PA) Perlakuan penambahan
A. hydrophila 102 cfu/mL; (PK) Perlakuan tanpa penambahan A. hydrophila dan tanpa sipon; (KS) Perlakuan tanpa penambahan A. hydrophilanamun dengan penyiponan setiap 3 hari sekali.
Kadar hematokrit
Hematokrit merupakan perbandingan fraksi seluler terhadap total volume darah setelah dipisahkan melalui sentrifugasi (perbandingan antara plasma dan sel darah). Nilai kadar hematokrit ikan mas normal adalah 27 ± 4.87 (19-34%) (Mones 2008) dan 29,30±4,68 (21-34%) (Vonti 2008). Sedangkan pada penelitian ini didapatkan kadar hematokrit ikan uji sebelum dilakukan perlakuan adalah 16-17%. Berdasarkan Gambar 14 kadar hematokrit mengalami kenaikan mencapai 50% terjadi pada hari ke tujuh perlakuan PA dan 58% terjadi pada hari ke-10 perlakuan PK. Kadar hematokrit mengalami penurunan yang cukup tajam hingga hari terakhir pengamatan yang mencapai 38% pada perlakuan PA dan 44% pada perlakuan PK. Tinggi rendahnya penurunan nilai kadar hematokrit tergantung pada berapa banyaknya kejadian pendarahan pada tubuh ikan tersebut. Hasil pengukuran hematokrit ikan uji disajikan pada Gambar 14.
Gambar 14 Kadar hematokrit ikan uji selama penelitian; (PA) Perlakuan penambahan A. hydrophila 102 cfu/mL; (PK) Perlakuan tanpa penambahan A. hydrophila
dan tanpa sipon; (KS) Perlakuan tanpa penambahan A. hydrophila namun dengan penyiponan setiap 3 hari sekali.
Sinyal bahaya serta usaha tubuh ikan untuk melawan infeksi A. hydrophila ditunjukkan dengan peningkatan nilai kadar hematokrit yang terjadi pada penelitian ini. Sedangkan penurunan nilai hematokrit menandakan adanya pendarahan dalam tubuh ikan.
Total eritrosit
mengandung asam karbonat dalam jumlah besar yang berfungsi mengkatalis reaksi antara karbondioksida dan air sehingga darah dapat mengedarkan karbondioksida dari jaringan menuju insang (Fujaya 2004). Nilai total eritrosit ikan uji sebelum dilakukan perlakuan adalah 1.06E+06 sel/mm3. Pada sampling
hari ke-3 menurun hingga 6.40E+05 sel/mm3pada perlakuan PA dan 7.60E+05
sel/mm3 pada perlakuan PK (Gambar 15). Nilai eritrosit yang menurun
menandakan terjadinya infeksi oleh A. hydrophilamelalui media budidaya. Secara alamiah pada ikan yang terinfeksi patogen akan ditemukan jumlah leukosit yang lebih banyak dari kondisi normal, karena salah satu antisipasi tubuh untuk mencegah perkembangan bakteri dalam tubuh dengan mengirimkan darah lebih banyak ke daerah infeksi. Perlakuan yang mengalami serangan A. hydrophila yaitu perlakuan PA dan PK mengalami tren fluktuasi yang sama. Total eritrosit ikan uji disajikan pada Gambar 15.
Gambar 15 Total eritrosit ikan uji; (PA) Perlakuan penambahan A. hydrophila 102
cfu/mL; (PK) Perlakuan tanpa penambahan A. hydrophiladan tanpa sipon; (KS) Perlakuan tanpa penambahan A. hydrophila namun dengan penyiponan setiap 3 hari sekali.
Total leukosit
Nilai total leukosit ikan uji selama penelitian disajikan pada Gambar 16.
Gambar 16 Total Leukosit ikan uji; (PA) Perlakuan penambahan A. hydrophila 102
cfu/mL; (PK) Perlakuan tanpa penambahan A. hydrophiladan tanpa sipon; (KS) Perlakuan tanpa penambahan A. hydrophilanamun dengan penyiponan setiap 3 hari sekali.
Berdasarkan Gambar 16 terlihat bahwa pada perlakuan PA dan PK total leukosit mengalami kenaikan hingga 1.62E+05 dan 1.51E+05 sel/mm3. Kemudian menurun hingga akhir pengamatan hari ke-14 sebesar 5.82E+04 dan 5.19E+04 sel/mm3. Meningkatnya total leukosit di awal merupakan tanda adanya fase awal infeksi, stres, ataupun leukemia (Anderson & Siwicki 1993). Pada hari ke tujuh, total leukosit semakin menurun tajam menandakan bahwa leukosit tidak mampu mengatasi infeksiA. hydrohiladalam darah.
Infeksi A. hydrophila terhadap histopatologi ginjal dan hati ikan yang sakit Ginjal umumnya terletak antara columna vertebralis dan gelembung renang. Ginjal mempunyai peran sebagai organ ekskresi yang menyaring bahan limbah yang tidak bermanfaat dari darah.
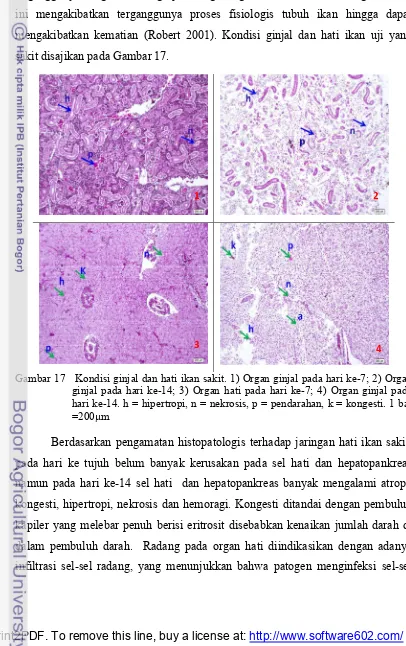
menyebabkan terjadinya peradangan glomerulus yang ditandai dengan reaksi radang pada glomerulus dengan infiltrasi leukosit dan proliferasi sel. Bila terjadi infeksi, maka akan terjadi mekanisme perlawanan dari leukosit. Infeksi ini selanjutnya mempengaruhi metabolisme dan proses enzimatis yang menyebabkan terganggunya fungsi normal ginjal sebagai organ ekskresi dan osmoregulasi, hal ini mengakibatkan terganggunya proses fisiologis tubuh ikan hingga dapat mengakibatkan kematian (Robert 2001). Kondisi ginjal dan hati ikan uji yang sakit disajikan pada Gambar 17.
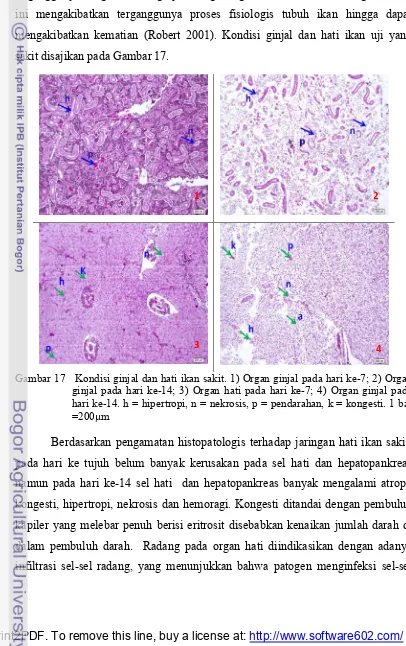
Gambar 17 Kondisi ginjal dan hati ikan sakit. 1) Organ ginjal pada hari ke-7; 2) Organ ginjal pada hari ke-14; 3) Organ hati pada hari ke-7; 4) Organ ginjal pada hari ke-14. h = hipertropi, n = nekrosis, p = pendarahan, k = kongesti. 1 bar =200µm
Berdasarkan pengamatan histopatologis terhadap jaringan hati ikan sakit, pada hari ke tujuh belum banyak kerusakan pada sel hati dan hepatopankreas namun pada hari ke-14 sel hati dan hepatopankreas banyak mengalami atropi, kongesti, hipertropi, nekrosis dan hemoragi. Kongesti ditandai dengan pembuluh kapiler yang melebar penuh berisi eritrosit disebabkan kenaikan jumlah darah di dalam pembuluh darah. Radang pada organ hati diindikasikan dengan adanya infiltrasi sel-sel radang, yang menunjukkan bahwa patogen menginfeksi sel-sel
1 2