PENGGUNAAN MARKA MOLEKULER MHC I DALAM
SELEKSI IKAN LELE (Clarias sp.) TAHAN
Aeromonas hydrophila
AZIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul “Penggunaan Marka Molekuler MHC I Dalam Seleksi Ikan Lele (Clarias sp.) Tahan Aeromonas hydrophila” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
AZIS. Penggunaan Marka Molekuler MHC I Dalam Seleksi Ikan Lele (Clarias
sp.) Tahan INFEKSI Aeromonas hydrophila. Dibimbing oleh ALIMUDDIN, SUKENDA dan MUHAMMAD ZAIRIN JUNIOR
Permintaan ikan lele (Clarias sp.) tinggi sehingga mendorong berbagai kalangan untuk terus meningkatkan produksi budidaya ikan lele. Salah satu ancaman kegagalan budidaya ikan lele adalah serangan motile aeromonad septicemia (MAS) yang disebabkan oleh bakteri Aeromonas hydrophila. Penyakit MAS dapat menyebabkan kematian tinggi pada ikan lele. Berbagai pendekatan dapat dilakukan untuk menanggulangi penyakit MAS, salah satunya adalah budidaya ikan lele secara genetik tahan infeksi A. hydrophila. Aplikasi metode seleksi dengan bantuan marka molekuler (marker assisted selection) diduga dapat mempercepat produksi ikan lele tahan penyakit MAS. Tujuan penelitian ini adalah: 1) Menemukan kandidat marka molekuler pembeda ikan yang hidup dan mati pascainfeksi dengan A. hydrophila; 2) Memproduksi keturunan F1 ikan lele dan menganalisis pewarisan marka DNA ikan tahan infeksi A. hydrophila, dan 3) Mengevaluasi performa ikan lele pembawa gen MHC I yang diinfeksi bakteri A. hydrophila.
Pada penelitian pertama, sebanyak 200 ekor ikan lele sangkuriang dengan bobot 60±5 g diuji tantang dengan menyuntikkan bakteri A. hydrophila dengan konsentrasi 105 cfu/ekor. Hasil uji tantang menunjukkan kelangsungan hidup ikan lele sebesar 54% (14 ekor ikan tanpa luka, dan 94 ekor ikan luka dan kemudian sembuh). Analisis PCR dengan primer spesifik MHC I digunakan untuk membedakan ikan yang hidup dan mati pascatantang. Tujuh pasang primer didesain berdasarkan sekuen gen MHC I ikan Clarias gariepinus yang terdapat di Bank Gen. DNA diekstraksi dari jaringan sirip ekor ikan hidup dan yang mati, kemudian dijadikan cetakan dalam amplifikasi PCR. Hasil PCR menggunakan salah satu set primer (ClMHAh-01) menunjukkan adanya pita DNA spesifik berukuran sekitar 300, 500 dan 930 bp pada ikan yang hidup pascatantang. Produk PCR disekuensing untuk konfirmasi dan menguji tingkat homologi sekuen MHC I ikan lele sangkuriang dengan database. Hasil analisis sekuen menggunakan basic local alignment search tools menunjukkan bahwa produk PCR tersebut memiliki kesamaan 69-88% dengan MHC I ikan C. gariepinus. Dengan demikian, fragmen MHC I tersebut dapat menjadi marka molekuler ikan lele tahan infeksi A. hydrophila.
menghasilkan 25% F1 membawa marka MHC I. Hal ini mengindikasikan bahwa marka MHC I dan daya tahan terhadap infeksi bakteri patogen A. hidrophyla
dapat diwariskan ke keturunan F1.
Selanjutnya, hasil uji tantang dengan A. hydrophila 105 cfu/ekor, memperlihatkan bahwa kelangsungan hidup ikan F1 dari induk ikan R dan L (76.8-87.0%) adalah sekitar 2.21 kali lebih tinggi daripada ikan kontrol. Persentase keturunan dari induk ikan R dan L dengan kategori “resisten” berkisar 64.0-77.2%, dan kategori “luka-sembuh” berkisar λ.2-18.8%, sedangkan pada ikan kontrol adalah 4.0% “resisten” dan 33.2% “luka-sembuh”. Gambaran darah dan titer antibodi sejalan dengan daya tahan ikan F1 dari induk R dan L yang tinggi terhadap infeksi A. hydrophila. Dengan demikian daya tahan terhadap infeksi A. hydrophila dapat diwariskan ke F1. Pemeliharaan ikan selama 95 hari di akuarium menunjukkan bahwa pertumbuhan bobot tidak berbeda nyata pada semua persilangan. Dengan kelangsungan hidup yang lebih tinggi, maka ikan lele yang mempunyai marka MHC I berpotensi memiliki produktivitas budidaya yang lebih tinggi.
SUMMARY
AZIS. The Use ofMHC IMolecularMarkerin The Selectionof Catfish(Clarias
sp.) Resistance toAeromonas hydrophila Infection. Supervised by ALIMUDDIN, SUKENDA and MUHAMMAD ZAIRIN JUNIOR
High demand of catfish (Clarias sp.) in the market encourages the people to continuously increase the production. One of the threats to fail the harvest is motile aeromonad septicemia (MAS) disease caused by Aeromonas hydrophila
infection. MAS could cause high mortality in catfish. Several approaches can be applied to overcome MAS disease ; one is farming of catfish that genetically resists to A. hydrophila infection. Application of molecular marker assisted selection could accelerate the process to obtain disease-resistant fish broodstock. The aims of this study were to: 1) obtain a major histocompatibility complex (MHC) I marker in the marker based selection to generate A. hydrophila-resistant sangkuriang catfish; 2) evaluate the inheritance of MHC I marker in F1 generation, and 3) Determine the growth and resistance of the F1 against A. hydrophila
infection.
In the first experiment, a total of 200 sangkuriang catfish (average body weight: 60±5 g) were challenged by intramuscular injecting 0.1 mL/fish with A. hydrophila at a dose of 105 cfu/fish. The results showed the viability of fish was 54% (14 fish survived without injure, and 94 fish recovered from injured). PCR analysis with specific primers for MHC I was used to distinguish the survived and dead fish after challenge test. Seven set primers were designed based on database gene sequences of MHC I of Clarias gariepinus. Genomic DNA was extracted from caudal fin tissue of living and the dead fish, and then used as template in PCR amplification. The PCR results using a set of primer (ClMHAh-01) showed specific DNA bands of approximately 300, 500 and 930 bp in the survived fish. PCR product was then sequenced to confirm and analyze homology of MHC I sequence of sangkuriang catfish and the database. The results of sequence analysis using the basic local alignment search tools showed that the nucleotide sequence of those PCR products had similarity of 69-88% with MHC I of C. gariepinus. As conclusion, MHC I could be used as a molecular marker of A. hydrophila
resistance catfish.
64.0-77.2%, and the L category was 9.2-18.8%, while R and L categories offspring from control were 4.0% and 33.2%, respectively. Blood profiles and antibody titer were in line with high resistance of F1 offspring from R and L broods against A. hydrophila infection. Thus, the resistance to A. hydrophila infection can be passed on to F1. Furthermore, rearing of fish for 95 days in aquarium showed that body weight growth was not different in all crosses. With high survival rate, catfish having MHC I marker is potentially to posses high farming productivity.
As conclusion, the results of study indicated that A. hydrophila-resistance catfish can be produced by MHC I marker based selection. Further research is needed to evaluate the performance of F1 catfish farming, and the stability of marker inheritance to next generations.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
1
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
Pada
Program Studi Ilmu Akuakultur
PENGGUNAAN MARKA MOLEKULER MHC I DALAM
SELEKSI IKAN LELE (Clarias sp.) TAHAN
Aeromonas hydrophila
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr. Sri Nuryati SPi MSi Prof. Dr. Ketut Sugama MSc
Judul Disertasi : Penggunaan Marka Molekuler MHC I Dalam Seleksi Ikan Lele (Clarias sp.) Tahan Aeromonas hydrophila
Nama : Azis
NIM : C161110041
Disetujui Komisi Pembimbing
Dr. Alimuddin, S.Pi, M.Sc Ketua
Dr. Ir. Sukenda, M.Sc Prof. Dr. Ir. Muhammad Zairin Junior, M.Sc
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Akuakultur
Dr. Ir. Widanarni, M.Si Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Penulis memanjatkan puji dan syukur ke hadirat Allah SWT atas segala karunia dan rahmat-Nya sehingga penulisan disertasi dengan judul μ “Penggunaan Marka Molekuler MHC I Dalam Seleksi Ikan Lele (Clarias Sp.) Tahan
Aeromonas hydrophila” dapat diselesaikan. Disertasi ini disusun sebagai salah
satu syarat untuk memperoleh gelar Doktor di Program Studi Ilmu Akuakultur, Sekolah Pascasarjana Institut Pertanian Bogor.
Penulis menyadari bahwa proses penyelesaian penelitian dan penulisan disertasi ini tidak akan dapat berjalan lancar tanpa dukungan banyak pihak, sehingga pada kesempatan ini penulis mengucapkan terima kasih kepada komisi pembimbing dan Prof. Komar Sumantadinata (Alm), atas waktu dan bimbingannya mulai dari persiapan penelitian, penelitian hingga penulisan disertasi.
Terima kasih disampaikan kepada Direktorat Jenderal Pendidikan Tinggi, Kementrian Pendidikan Nasional Indonesia atas penyediaan beasiswa BPPS Doktoral sehingga penulis dapat memperdalam ilmu di Institut Pertanian Bogor. Terima kasih juga kepada Rektor Universitas Borneo Tarakan dan Dekan Universitas Fakultas Perikanan dan Ilmu Kelautan Universitas Borneo Tarakan atas izin studi Doktoral di IPB. Terima kasih kepada Dekan Pascasarjana IPB dan Ketua Program Studi Akuakultur beserta stafnya atas pelayanan administrasi maupun teknis selama penulis menempuh pendidikan Doktoral di PS Ilmu Akuakultur Fakultas Perikanan dan Ilmu Kelautan IPB.
Ucapan yang sama kepada Ir. H. Sarifin MSi selaku Kepala Balai Besar Perikanan Budidaya Air Tawar Sukabumi dan segenap penanggung jawab Laboratorium dan stafnya atas bantuan fasilitas laboratorium dan bantuan teknis pada saat penelitian berlangsung.
Terima kasih dan penghargaan yang setinggi-tingginya kepada Ayahanda Abd. Razak Hamzah (Alm), Ibunda Hasna, Mertua H. Ma’ing (Alm) dan Hj. Rosmiati serta saudara-saudaraku dan adik ipar. Terima kasih banyak buat Istri tersayang Nur Ayu yang telah setia mendampingi dan memberi dorongan semangat pada penulis selama studi di IPB, juga terima kasih kepada anak-anakku tersayang Nurul Ghina Zahra Azis, Alya salsabilah Azis dan Muhammad Zafran Al-Ghazali Azis yang menjadi sumber semangat bagi penulis. Saudaraku sekaligus teman diskusi yang menyenangkan Adi Sucipto dan keluarga. Terima kasih kepada sahabat-sahabatku Ade Sunarma, Ayi Santika, Dian Hardiantho, Arief Eko Prasetiyo, Dwi Hany Yanti, Nur Lathifa, Dedy Heriwibowo dan Angga serta rekan-rekan S3 Prodi Akuakultur angkatan 2011.
Sebagian dari isi disertasi ini telah di publikasikan pada Jurnal Riset Akuakultur volume 10 (2) tahun 2015 dengan judul “Identifikasi kandidat marka MHC I pada ikan lele (Clarias sp.) tahan infeksi Aeromonas hydrophila” dan
menjadi sumber rujukan bagi kalangan peneliti dan akademisi untuk pengembangan dan perbaikan riset ini.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR x
PENDAHULUAN 1
Latar Belakang 1
Tujuan dan Manfaat Penelitian 2
Kerangka Penelitian 3
Hipotesis Penelitian 4
Kebaharuan Penelitian 4
TINJAUAN PUSTAKA 5
Ikan Lele Sangkuriang (Clarias sp) 5
Bakteri Aeromonas hydrophila 5
Mekanisme Respons Imun 6
Major Histocompatibility Complex (MHC) 8
Seleksi Berbasis Marka Molekuler (SBMM) 9
IDENTIFIKASI KANDIDAT MARKA MHC I PADA IKAN LELE (Clarias sp.) TAHAN INFEKSI Aeromonas hydrophila
Abstrak 11
Abstract 12
Pendahuluan 13
Metodologi Penelitian 14
Hasil 19
Pembahasan 24
Simpulan 26
PEWARISAN MARKA MOLEKULER MHC I DAN PERFORMA IKAN LELE (Clarias sp.) KETURUNAN PERTAMA TAHAN INFEKSI BAKTERI Aeromonas hydrophila
Abstrak 27
Abstract 28
Pendahuluan 29
Metodologi Penelitian 30
Hasil 32
Pembahasan 33
PERFORMA IKAN LELE (Clarias sp.) KETURUNAN PERTAMA PEMBAWA GEN MHC I YANG DIUJI TANTANG BAKTERI Aeromonas hydrophila
Abstrak 35
Abstract 36
Pendahuluan 37
Metodologi Penelitian 39
Hasil 42
Pembahasan 47
Simpulan 48
PEMBAHASAN UMUM SIMPULAN UMUM SARAN
49 51 51
DAFTAR PUSTAKA 52
LAMPIRAN 59
DAFTAR TABEL
1 Pengujian Gram dan uji biokimia bakteri Aeromonas hydrophila pascatantang sesuai prosedur standar SNI (2009) No. 7303:2009
15
2 Rataan bobot, panjang, laju pertumbuhan spesifik (SGR), laju
DAFTAR GAMBAR
1 Bagan alir produksi ikan lele tahan infeksi Aeromonas hydrophila. R=sangat tahan (sehat dan tidak terluka) ; LS=tahan (luka dan
sembuh) ; F0=tetua ; F1=turunan pertama 3
2 Mekanisme respons imun MHC I dan MHC II terhadap antigen 9 3 Bagan alir penentuan LD50 dan uji tantang dengan bakteri
Aeromonas hydrophila 16
4 Mortalitas (%) ikan lele setelah diinfeksi bakteri Aeromonas
hydrophila menggunakan dosis berbeda 19
5 Produk amplifikasi PCR dalam deteksi marka molekuler dengan target gen major histocompatibility complex (MHC I) pada ikan lele (Clariassp.) strain sangkuriang. β-aktin digunakan untuk kontrol loading DNA. M= Marka ukuran fragmen DNA (KAPA Biosystem) ; LS1-5 = ikan luka dan sembuh; M1-5= ikan yang mati; R1-5= ikan resisten, dan N= produk PCR tanpa cetakan DNA (kontrol negatif). Angka di sebelah kiri adalah ukuran fragmen
marka DNA 20
6 Penyejajaran nukleotida produk PCR pada pita DNA berukuran sekitar 500 bp dengan 930 bp yang spesifik terdapat pada ikan lele sangkuriang (Clarias sp.) bertahan hidup dalam
uji tantang dengan bakteri Aeromonas hydrophila 20
7 Penyejajaran nukleotida produk PCR pada pita DNA berukuran sekitar 300 bp dengan 500 bp yang spesifik terdapat pada ikan lele sangkuriang (Clarias sp.) bertahan hidup dalam
uji tantang dengan bakteri Aeromonas hydrophila 21
8 Analisis BLAST sekuen nukleotida produk PCR pita DNA berukuran sekitar 300 bp (A), 500 bp (B) dan 930 bp (C) dari ikan lele sangkuriang (Clarias sp.) bertahan hidup dalam uji tantang bakteri Aeromonas hydrophila. Description adalah deskripsi alel MHC I C. Gariepinus; Max. score adalah nilai maksimum; total score adalah nilai total ; identity
adalah nilai kemiripan 22
9 Kadar eritrosit dan leukosit ikan lele sangkuriang sebelum (0)
(0) hingga hari keenam uji tantang dengan bakteri A. hydrophila 23 11 Elektroforegram produk PCR ikan lele F1 menggunakan primer
ClMHAh-01 terkait marka MHC I (MHC I), dan β-aktin sebagai kontrol internal loadingDNA (β-aktin). M= marka ukuran fragmen DNA, RR= perkawinan antara ikan betina resistan (R) dan jantan resistan (R), LL= perkawinan antara ikan betina luka-sembuh (L) dan jantan luka-sembuh (L), N= kontrol negatif dengan templat SDW. RR1= pasangan induk RR nomor 1
32 12 Elektroforegram produk PCR ikan lele F1 menggunakan primer
ClMHAh-01 terkait marka MHC I (MHC I), dan β-aktin sebagai kontrol internal loadingDNA (β-aktin). M= marka ukuran fragmen DNA, RL= perkawinan antara ikan betina resistan (R) dan jantan resistan (R), LR= perkawinan antara ikan betina luka-sembuh (L) dan jantan resistan (R), N= kontrol negatif dengan templat SDW.
RL1= pasangan induk RL nomor 1. 33
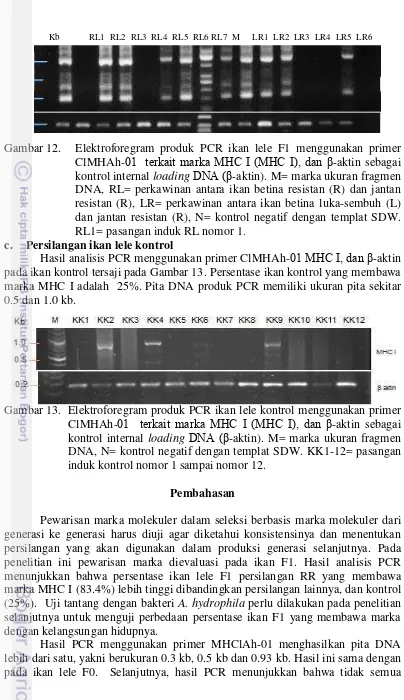
13 Elektroforegram produk PCR ikan lele kontrol menggunakan primer ClMHAh-01 terkait marka MHC I (MHC I), dan β-aktin sebagai kontrol internal loadingDNA (β-aktin). M= marka ukuran fragmen DNA, N= kontrol negatif dengan templat SDW. KK1-12=
pasangan induk kontrol nomor 1 sampai nomor 12 33
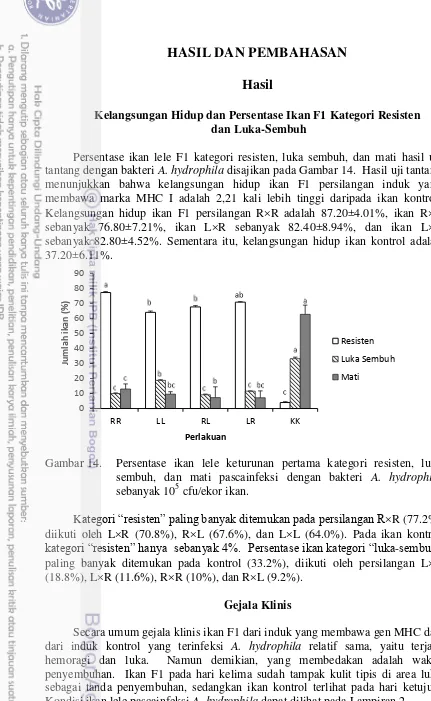
14 Persentase ikan lele keturunan pertama kategori resisten, luka- sembuh, dan mati pascatantang dengan bakteri Aeromonas
hydrophila 105 cfu/ekor ikan 42
15 Jumlah leukosit ikan lele Clarias sp. pascatantang Aeromonas hydrophila. Huruf berbeda di atas bar pada hari yang sama
menunjukkan nilai berbeda nyata berdasarkan uji Anova (p<0.05) 43 16 Kadar eritrosit ikan lele pascatantang Aeromonas hydrophila.
Huruf berbeda di atas bar pada hari yang sama menunjukkan
nilai berbeda nyata berdasarkan uji Anova (p<0.05) 44 17 Kadar hemoglobin ikan lele pascatantang Aeromonas hydrophila.
huruf berbeda di atas bar pada hari yang sama menunjukkan
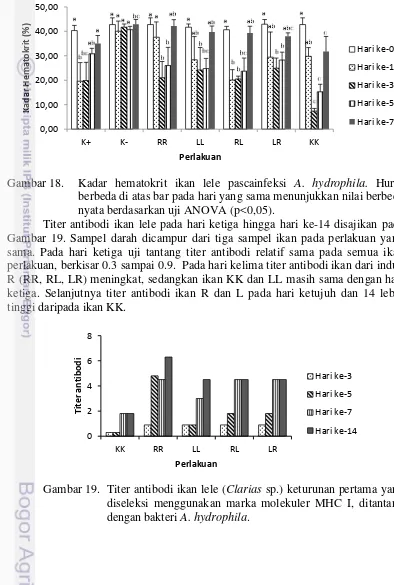
nilai berbeda nyata berdasarkan uji Anova (p<0,05) 44 18 Kadar hematokrit ikan lele pascatantang Aeromonas hydrophila.
Huruf berbeda di atas bar pada hari yang sama menunjukkan
nilai berbeda nyata berdasarkan uji Anova (p<0,05) 45 19 Titer antibodi ikan lele (Clarias sp.) keturunan pertama yang
diseleksi menggunakan marka molekuler MHC I, ditantang
PENDAHULUAN
Latar Belakang
Penyakit motile aeromonad septicemia (MAS) yang disebabkan oleh bakteri Aeromonas hydrophila merupakan salah satu permasalahan yang dihadapi oleh pembudidaya ikan di seluruh dunia. A. hydrophila adalah bakteri Gram negatif berbentuk batang yang terdistribusi secara luas di lingkungan perairan (Massa et al. 2001; Gonzalez et al. 2002). Bakteri ini dapat hidup di air tawar, dan juga dapat hidup di perairan payau dan laut (Gonzalez et al. 2002 ; Kingombe et al. 1999) dan mempunyai toleransi suhu yang lebar (Chopra et al. 1996). Ikan dari golongan siluridae, ictaluridae, clariidae, serta cyprinidae adalah ikan yang rentan terhadap serangan penyakit MAS (Miyazaki dan Jo, 1985; Rahman et al. 1997; Plumb 1999).
Penyakit yang disebabkan oleh infeksi A. hydrophila mulai dikenal di Indonesia sekitar tahun 1980 (Triyanto 1990). Menurut Hidayat (2006), pada tahun 2002, Dinas Peternakan dan Perikanan Kabupaten Bogor melaporkan sekitar 200 ton ikan mas mati akibat serangan bakteri yang diduga kuat A. hydrophila. Lebih lanjut dilaporkan bahwa, pada tahun 2006 di Provinsi Sumatera Barat terjadi kematian hampir mencapai 47 ton ikan gurami (Osphronemus goramy) karena serangan A. hydrophila, sedangkan pembudidaya di Kabupaten Bogor sering mengalami kerugian akibat kematian ikan mas, ikan lele, dan ikan patin akibat serangan bakteri ini walau dalam jumlah relatif sedikit. Yin et al. (2010) juga menambahkan bahwa infeksi bakteri A. hydrophila
dapat menyebabkan kematian ikan budidaya hingga 80%.
Penyakit ini dapat menyebar dengan cepat dan menimbulkan kematian ikan yang tinggi, menyerang ikan-ikan budidaya dan dalam waktu singkat menyebar ke daerah lain (Lukistyowati dan Kurniasih, 2011). Adanya wabah tersebut telah menciptakan kesadaran akan besarnya risiko dan biaya penanggulangannya, terutama dalam industri akuakultur. Namun demikian, secara umum di negara berkembang termasuk Indonesia, ada kecenderungan untuk meremehkan dampak infeksi oleh A. hydrophila dan belum ada laporan secara berkala tentang wabah penyakit MAS yang menyerang industri akuakultur dan dampaknya secara finansial.
relatif lama; ikan mas tahan penyakit dropsy diperoleh pada generasi ke-9 atau sekitar 11.5 tahun (Kirpichnikov 1999). Ikan salmon Atlantik tahan infeksi virus dan bakteri melalui uji tantang dengan penyakit ISA (infectious salmon anaemia) dan IPN (infectious pancreatic necrosis), membutuhkan waktu selama 7-8 generasi atau sekitar 28-32 tahun (Gjerde et al. 2010).
Pendekatan lain yang dapat dilakukan untuk menghemat waktu adalah seleksi dengan bantuan marka molekuler (marker assisted selection). Marka molekuler dapat digunakan pada beberapa aplikasi, di antaranya: identifikasi hibrid dan strain, variasi genetik dan evaluasi keanekaragaman genetik, pemetaan
quantitative trait loci (QTL) dan seleksi genom (Liu and Cordes 2004 ; Goddard
and Hayes, 2009). Pada penelitian ini, pemuliaan ikan lele dilakukan melalui pendekatan seleksi berbasis marka molekuler (SBMM). Metode ini telah berhasil digunakan untuk membuat ikan mas tahan infeksi KHV menggunakan marka Cyca-DAB1*05 (Alimuddin et al. 2011), ekspresi gen major histocompatibility complex I (MHC I) pada ikan rainbow trout (Oncorhynchus mykiss) dan salmon Atlantik (Salmo salar) (Aoyagi et al. 2002; Grimholt et al. 2002); MHC II (Glamann, 1995; Langefors et al. 2000); MHC IIα dan IIβ pada ikan salmon Atlantik (Stet et al. 2002)
Kemajuan bioteknologi dan teknologi informasi dilatarbelakangi oleh ledakan data (data explosion) sebagai hasil yang dicapai dari kemajuan bioteknologi. Contohnya adalah pertumbuhan pesat database DNA pada Bank Gen. Bank Gen adalah database utama dalam biologi molekuler, yang dikelola oleh NCBI (National Center for Biotechnology Information) di Amerika Serikat. Database tersebut sangat berguna dalam pencarian kandidat marka molekuler untuk metode SBMM.
Penyusunan kandidat primer MHC I pada penelitian tahap pertama, dilakukan dengan mengambil sekuens MHC dari 20 alel ikan lele yang tersedia dalam bank gen, sedangkan software Genetyx ver.7 digunakan untuk alignment
dan desain primer. Selanjutnya kandidat primer ini digunakan sebagai marka untuk melacak ikan lele yang tahan infeksi A. hydrophila. Selanjutnya, kandidat ikan lele tahan infeksi A. hyhdrophila dipilih berdasarkan keberadaan pita DNA spesifik produk PCR. Konfirmasi pewarisan marka dan daya tahan ikan F1 dilakukan pada penelitian tahap II dan III. Persilangan antar induk F0 yang membawa marka MHC I tersebut untuk menghasilkan keturunan pertama (F1). Pada penelitian tahap III ikan lele F1 diuji tantang dengan bakteri A. hydrophila,
untuk menguji daya tahannya terhadap infeksi bakteri patogen tersebut.
Tujuan dan Manfaat Penelitian
Tujuan utama penelitian ini adalah memproduksi ikan lele (Clarias sp.) tahan infeksi A. hydrophila, sedangkan tujuan khususnya adalah:
1. Menemukan kandidat marka molekuler pembeda ikan yang hidup dan mati pascainfeksi dengan A. hydrophila.
2. Memproduksi keturunan F1 ikan lele dan menganalisis pewarisan marka DNA ikan tahan infeksi A. hydrophila.
3. Mengevaluasi performa ikan lele pembawa gen MHC I yang diinfeksi bakteri
Ikan lele keturunan pertama (F1) hasil penelitian dapat menjadi bahan yang sangat penting dalam program seleksi lanjut dan produksi massal benih ikan lele tahan serangan penyakit MAS. Selanjutnya, ikan lele tahan penyakit tersebut dapat berperan penting dalam upaya peningkatan produksi budidaya ikan lele. Selain itu, metode yang dikembangkan dalam penelitian ini dapat berguna sebagai model untuk memilih spesies ikan lainnya yang tahan terhadap infeksi penyakit.
Kerangka Penelitian
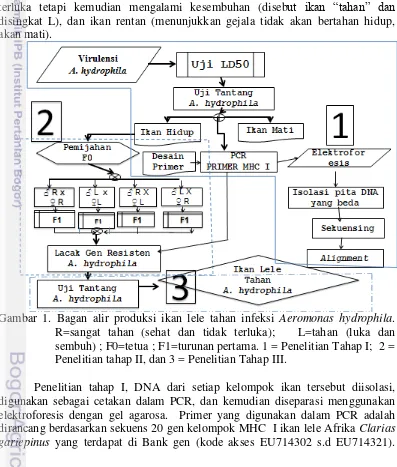
Alur penelitian ini adalah seperti ditunjukkan pada Gambar 1. Penelitian tahap pertama dimulai dengan meningkatakan tingkat virulensi bakteri A. hydrophila, kemudian dilanjutkan dengan uji LD50. Ikan lele kandidat tahan
infeksi A. hydrophila diperoleh melalui uji tantang. Hasil uji tantang menghasilkan tiga kelompok ikan, yaitu ikan yang terlihat sehat dan tidak terluka (resisten, dan selanjutnya disebut “sangat tahan” dan disingkat R), ikan lele terluka tetapi kemudian mengalami kesembuhan (disebut ikan “tahan” dan disingkat L), dan ikan rentan (menunjukkan gejala tidak akan bertahan hidup, akan mati).
Gambar 1. Bagan alir produksi ikan lele tahan infeksi Aeromonas hydrophila. R=sangat tahan (sehat dan tidak terluka); L=tahan (luka dan sembuh) ; F0=tetua ; F1=turunan pertama. 1 = Penelitian Tahap I; 2 = Penelitian tahap II, dan 3 = Penelitian Tahap III.
Selanjutnya, bila DNA hasil amplifikasi PCR yang spesifik pada ikan resisten adalah lebih dari 2 pita DNA, maka semua pita DNA tersebut disekuensing. Hasil sekuensing digunakan selanjutnya untuk mendesain primer pembeda ikan yang membawa dan tidak membawa marka MHC I. Penelitian tahap kedua, Primer yang telah dirancang digunakan dalam identifikasi keturunan pertama ikan lele hasil persilangan antar ikan yang membawa dan tidak membawa marka MHC I untuk mengevalusi pola segregasi marka. Selanjutnya pada penelitian tahap ketiga, sebagian dari ikan keturunan pertama yang membawa dan tidak membawa marka diuji tantang untuk rekonfirmasi keterkaitan antara marka dengan daya tahan ikan lele terhadap infeksi A. hydrophila.
Pengukuran bobot tubuh ikan lele selama pendederan di akuarium dilakukan setiap 30 hari untuk mengevaluasi pertumbuhannya. Selain itu, pada akhir penelitian dilakukan pengukuran bobot tubuh ikan yang membawa dan tidak membawa marka.
Hipotesis Penelitian
1. Marka MHC I pada ikan lele yang tahan terhadap infeksi bakteri A. hydrophila mampu dilacak keberadaannya melalui uji PCR dengan bantuan primer yang didesain berdasarkan sekuen MHC ikan lele afrika
2. Marka MHC I pada ikan lele dapat diwariskan pada keturunan berikutnya (F1).
3. Ikan lele yang membawa marka MHC I tahan terhadap infeksi Aeromonas hydrophila.
Kebaharuan Penelitian
Kebaharuan (novelty) penelitian ini adalah:
1. Marka molekuler berupa primer yang dapat membedakan antara ikan lele tahan dengan rentan infeksi A. hydrophila.
2. Produksi ikan lele tahan infeksi A. hydrophila hasil seleksi berbasis marka molekuler (SBMM).
TINJAUAN PUSTAKA
Ikan Lele Sangkuriang (Clarias sp.)
Ikan lele sangkuriang (Clarias sp.) merupakan jenis ikan air tawar yang banyak dibudidayakan secara intensif di Indonesia. Lele sangkuriang diperoleh melalui cara silang balik atau backcross breeding antara induk lele dumbo betina generasi kedua (F2) dengan induk lele dumbo jantan generasi keenam (F6). Induk betina F2 merupakan koleksi yang ada di BBPBAT Sukabumi dari keturunan kedua lele dumbo yang dibawa ke Indonesia tahun 1985. Induk jantan F6 merupakan induk yang telah ada di BBPBAT Sukabumi. Induk betina F2 dipilih yang bobotnya 0,7-1 kg dan memiliki panjang 25-30 cm, sedangkan induk jantan F6 dipilih yang berbobot 0,5-0,75 kg dengan panjang 30-35 cm. Lele jantan hasil perkawinan F2 dan F6 (F2-6) itu kemudian diseleksi dan dikawinkan kembali dengan induknya yaitu F2 (Sunarma et al. 2005).
Ikan lele sangkuriang dirilis pada tahun 2004 sebagai benih sebar dengan SK Menteri Kelautan dan Perikanan Nomor KEP. 26/MEN/2004. Ikan lele sangkuriang mempunyai sifat unggul dibandingkan lele lokal (Clarias batrachus). Ikan ini dapat tumbuh lebih cepat dan ukurannya lebih besar serta mudah dibudidayakan secara intensif dibandingkan Clarias batrachus. Di alam ataupun lingkungan budidaya, lele sangkuriang dapat memanfaatkan plankton, cacing, insekta, udang-udang kecil dan moluska sebagai makanannya. Lele sangkuriang dapat dipijahkan sepanjang tahun, fekunditas telur yang tinggi, dapat hidup pada kondisi air yang marjinal dan efisiensi terhadap pakan yang tinggi.
Bakteri Aeromonas hydrophila
Bakteri A. hydrophila merupakan bakteri berbentuk batang, Gram negatif, motil/bergerak dengan flagella polar, yang pada umumnya terdapat pada perairan dengan bahan organik yang tinggi dan sebagai agen penyebab motile aeromonad septicemia/MAS (Harikrisnan et al. 2003). Bakteri Gram negatif adalah organisme yang tidak dapat menahan zat pewarna setelah dicuci dengan alkohol 95% (Massa et al. 2001; Gonzalez et al. 2002). Dinding sel bakteri Gram negatif mengandung lebih sedikit peptidoglikan tetapi di luar lapisan peptidoglikan ada struktur membran kedua yang tersusun dari protein, fosfolipida, dan lipopolisakarida (Yogananth et al. 2009).
mempengaruhi pertumbuhan A. hydrophila. Bakteri ini mampu tumbuh dengan baik pada suhu optimum yaitu 37 oC, tetapi tidak mampu tumbuh pada suhu 4 oC dan 41 oC. Tumbuh baik pada pH 9, tetapi pada pH 5 pertumbuhannya terhambat. Kepadatan A. hydrophila tinggi ditemukan dalam lingkungan selama pertengahan musim panas ketika sedimen klorofil dan suhu air optimum (Jayavignesh et al.
2011).
A. hydrophila termasuk ke dalam kelompok bakteri patogen dengan virulensi yang tinggi. Tingkat virulensi bakteri tersebut ditentukan oleh kemampuan bakteri menghasilkan enzim dan toksin tertentu yang berperan dalam proses invasi dan infeksi (Chopra et al. 2000). A. hydrophila menghasilkan berbagai toksin ekstraseluler, salah satunya aerolysin yang diduga merupakan faktor virulen (Jayavignesh et al. 2011). Kitinase, lesitinase, dan hemolisin yang dihasilkan oleh A. hydrophila merupakan faktor-faktor vilrulensi yang bekerja dengan cara mendegradasi jaringan dan menimbulkan luka serta pendarahan pada ikan inang (Del Coral et al. 1990). Faktor virulensi oleh bakteri diakibatkan oleh hemolisin, protease dan enterotoksin (Vazquez-Juarez et al. 2003). Hemolisin merupakan enzim yang mampu melisiskan sel-sel darah merah dan membebaskan hemoglobinnya. Protease adalah enzim proteolitik yang merupakan biokatalisator untuk reaksi pemecahan protein menjadi oligopeptida atau asam-asam amino, selain itu Protease dinamakan juga peptidase, karena memecah ikatan peptida pada rantai polipeptida untuk melawan pertahanan tubuh inang saat infeksi dan mengambil persediaan nutrien inang untuk berkembangbiak (Angka 2005). Enterotoksin merupakan suatu toksin ekstraseluler bakteri yang khususnya menyerang saluran gastrointestinal. Lechitinase adalah enzim yang menghancurkan berbagai sel jaringan dan terutama aktif melisiskan sel-sel darah merah, sedangkan leucocidin adalah enzim yang dapat membunuh sel-sel darah putih (Chopra et al. 2000).
Ikan lele yang terserang penyakit MAS dapat menunjukkan gejala, antara lain kematian mendadak, kurangnya nafsu makan, gerakan berenang yang tidak normal (berputar-putar di atas permukaan air), insang pucat, pembengkakan tubuh atau luka-luka pada tubuh ikan dan pemborokan pada mata. Menurut Angka (2005), penyakit MAS menimbulkan kerusakan multifocal berupa nekrose sel dari jaringan epidermis sampai dermis, degenerasi sel dan infiltrasi sel radang.
Mekanisme Respons Imun
Ikan termasuk organisme primitif yang memiliki sistem imun yang sederhana dan berbeda dengan mamalia umumnya. Respons imun pada ikan terdiri atas respons seluler dan respons humoral (Anderson, 1974; Rijkers, 1982). Berbagai bahan dalam sirkulasi berperan dalam pertahanan humoral, bahan-bahan tersebut antara lain berupa antibodi, komplemen, interferon dan C-reactive protein (CRP). Serum normal dapat membunuh dan menghancurkan beberapa bakteri Gram negatif. Hal tersebut disebabkan oleh kerja sama antara antibodi dan komplemen, keduanya ditemukan dalam serum normal (Anderson 1974).
optimal sehingga kurang efisien menahan infeksi patogen sehingga rentan penyakit (Anderson, 1974). Mekanisme kekebalan non-spesifik merupakan kekebalan alamiah (innate immunity) pertahanan inang yang responsnya tidak tergantung kontak antigen tertentu. Sementara itu, respons kekebalan spesifik tergantung kontak inang dengan antigen tertentu sebelumnya (adaptive immunity). Fungsi sistem kekebalan non-spesifik juga terlibat dalam sistem kekebalan spesifik (Roitt, 1994). Sistem pertahanan non-spesifik merupakan pertahanan terdepan menghadapi patogen karena memberikan respons langsung terhadap antigen. Sistem kekebalan non-spesifik merupakan sistem pertahanan fisik, yang terdiri dari sisik, kulit, dan mukus. Sisik dan kulit berfungsi sebagai pelindung ikan dari luka, selain itu juga berperan penting sebagai pengendali osmolaritas tubuh. Sisik dan kulit yang rusak akan mempermudah kerja patogen untuk menginfeksi inang. Mukus bertugas untuk menghambat perkembangan kolonisasi mikroorganisme pada insang, kulit, dan mukosa. (Iwama dan Nakanishi 1996). Sistem kekebalan spesifik merupakan sistem pertahanan yang melibatkan reaksi antigen-antibodi. Umumnya baru dapat berfungsi dengan baik apabila sudah terpapar oleh patogen. Pada saat terpapar, pathogen akan mengaktifkan limfosit-T untuk menghancurkan patogen. Selain itu, limfosit-T juga akan merangsang limfosit-B untuk memproduksi antibodi spesifik (Baratawidjaja 2002). Sistem kekebalan spesifik ikan terdiri atas : sistem reticulo endothelial, limfosit, plasmosit, dan fraksi serum protein tertentu. Sistem reticulo endothelial ikan terdiri dari bagian depan ginjal, timus, limpa dan hati (pada awal perkembangan), jaringan menyerupai limfoid pada usus ikan, sel limfosit, limfosit-B dan limfosit-T. Aktivitas sel-T pada ikan berperan dalam sistem kekebalan seluler/imun perantara sel (cell mediated immunity), sedangkan sel-B berperan dalam produksi Ig melalui rangsangan antigen tertentu pada limpa dan hati (Anderson, 1974).
Antibodi merupakan suatu senyawa protein yang terbentuk sebagai respons pertahanan terhadap masuknya benda asing ke dalam tubuh yang dapat bereaksi dengan antigen khusus (Roitt 1994). Komplemen terdiri dari sejumlah besar protein yang bila diaktifkan akan memberikan proteksi terhadap infeksi dan berperan dalam respons inflamasi. Antibodi dan komplemen dapat menghancurkan membran lapisan lipopolisakarida (LPS) dinding sel. Diduga komplemen mempunyai sifat esterase yang berperan pada lisis tersebut. Begitu lapisan LPS melemah, lisozim, mukopeptida dalam serum dapat masuk menembus membran bakteri dan menghancurkan lapisan mukopeptida.
permukaan bakteri yang memudahkan makrofag untuk mengenal (opsonisasi) dan memakannya (Baratawidjaja 2002).
Major Histocompatibility Complex (MHC)
Major histocompatibility complex (MHC) merupakan genom terbesar yang dapat ditemukan pada vertebrata yang mengkode molekul MHC yang berperan penting dalam sistem kekebalan tubuh (Zhou et al. 2013). Molekul MHC terlibat dalam interaksi antara benda asing dengan sistem pertahanan tubuh ikan (Gambar 2). Berdasarkan fungsi dan susunan kimianya, gen MHC dibagi menjadi dua, yaitu MHC class I dan MHC class II (Pang et al. 2013). MHC I merupakan molekul yang terlibat dalam presentasi antigen peptida pada permukaan sel yang dikenali oleh reseptor sel T sitotoksik (TCR) dari limfosit T CD8+ (Germain 1994).
Molekul MHC I merupakan rantai besar α transmembran heterodimer (45 kDa) yang berasosiasi non-kovalen dengan rantai pendek (12 kDa) β2 -mikroglobulin (Rakus 2008).
Masing-masing rantai besar disandikan oleh gen polimorfik yang berisi peptida leader, tiga domain ekstraseluler (α1, α2, α3) dan transmembran serta sitoplasma (Cuesta et al. 2007). MHC I berperan penting dalam sistem utama kekebalan tubuh (Zhou et al. 2013).
Gen MHC merupakan kandidat gen untuk ketahanan terhadap penyakit karena gen MHC memiliki elemen penting dalam penyesuaian sistem imun (Rakus 2008).
MHC telah digunakan dalam seleksi ikan mas (Alimuddin et al. 2011).
Menurut Poonsawat
et al. (2009), ikan nila yang memiliki gen MHC I dengan alel Orni*a dan Orni*j menunjukkan tingkat ketahanan yang tinggi terhadap S. agalactiae.
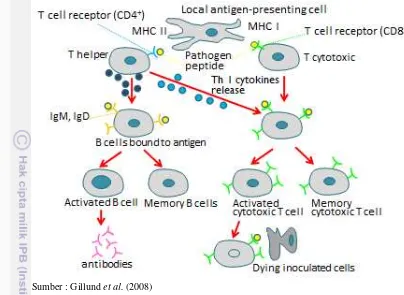
Respons imun dimulai bila sebagian besar antigen telah ditangkap dan diproses serta dipresentasikan oleh sel antigen precenting cell (APC) (Roitt 1994). Oleh karena itu, sel T hanya mengenal imunogen yang terikat pada protein MHC pada permukaan sel lain. Ada 2 kelas MHC (Kjoglum 2006), yaitu:
1. Protein MHC kelas I. MHC I diekspresikan oleh semua tipe sel somatik dan digunakan untuk presentasi antigen kepada CD8 dari sel T yang sebagian besar adalah sel sitotoksik. Sebagian besar sel mempresentasikan antigen ke sel T sitotoksik (sel Tc) serta merupakan target/sasaran dari sel Tc tersebut.
Sumber : Gillund et al. (2008)
Gambar 2. Mekanisme respons imun MHC I dan MHC II terhadap antigen Antigen ditangkap dan ditampilkan oleh antigen presenting cell (APC) yang terdiri atas sel B, makrofag, dan sel dendritik. Melalui APC, MHC I mempresentasikan antigen yang dapat dikenali oleh sel T reseptor (CD8+) yang berfungsi menghancurkan antigen maupun sel yang terinfeksi, selanjutnya tersimpan pada memori sel Tc. Sedangkan presentasi antigen melalui MHC II dapat dikenali oleh sel Th (CD4+) yang akan menstimulasi reaksi inflamatori atau respon antibodi untuk memperkuat kemampuannya berikatan dengan sel Tc dalam menghancurkan antigen, dan selanjutnya tersimpan pada memori sel B.
Seleksi Berbasis Marka Molekuler (SBMM)
Perkembangan ilmu pengetahuan yang sangat pesat dewasa ini, memungkinkan saling menunjangnya perkembangan berbagai disiplin ilmu pengetahuan. Beberapa kemajuan tersebut antara lain adalah perkembangan ilmu biologi molekuler yang memungkinkan diperolehnya suatu marka (penanda) gen yang mengendalikan karakter suatu individu. Penggunaan metode SBMM didasarkan pada gagasan bahwa terdapat gen yang memegang peranan utama dan menjadi sasaran atau target secara spesifik dalam seleksi (Wu et al. 2010).
penyakit dengan meningkatkan kapasitas kekebalan tubuh ikan menggunakan metode SBMM untuk menghasilkan ikan yang resisten terhadap penyakit. Menurut Kashi et al. (1990), jenis marka ada dua, yaitu :
1. Marka dominan (dominant marker) dapat menandai adanya lokus target, tetapi tidak bisa membedakan antara homozigot dan heterozigot.
2. Marka ko-dominan (co-dominant marker) dapat menandai adanya lokus target homozigot atau lokus target heterozigot.
Seiring dengan semakin berkembangnya teknologi yang berbasis marka DNA, maka saat ini telah ditemukan tiga tipe marka DNA dengan segala kelebihan dan kekurangan masing-masing. Ketiga tipe marka DNA (Rakus et al. 2008) tersebut adalah: (1) Marka yang berdasarkan pada hibridisasi DNA seperti
restriction fragment length polymorphism (RFLP). Metode ini telah digunakan oleh Nilson dan Strom (2002), untuk mendeteksi dan mengidentifikasi bakteri patogen pada ikan rainbow trout (Oncorhynchus mykiss) dan salmon (Salmo salar) di jaringan ginjal menggunakan gen 16S rRNA ; (2) Marka yang berdasarkan pada reaksi rantai polimerase (polymerase chain reaction, PCR) dengan menggunakan sekuen-sekuen nukleotida sebagai primer, seperti randomly amplified polymorphic DNA (RAPD). Metode RAPD telah digunakan oleh Nur-Nazifah et al. (2011) untuk mendeteksi keragaman genetik Streptococcus agalactiae dari lima lokasi pengambilan sampel. Hasil penelitian menunjukkan bahwa variasi genetik dari lokasi yang berbeda relatif tinggi dan metode amplified fragment length polymorphism (AFLP), telah digunakan oleh Benediktsdottir et al.
(2000) untuk mendeteksi tingkat virulensi bakteri Vibrio viscosus dan Vibrio wodanis dari spesies bakteri psychrotropic yang telah ditemukan sebagai penyebab penyakit “winter ulcer”, yang menyerang ikan salmon Atlantik di Norwegia, Islandia dan Skotlandia. (3) Marka yang berdasarkan pada PCR dengan menggunakan primer yang menggabungkan sekuen komplementer spesifik dalam DNA sasaran, seperti sequence tagged sites (STS), sequence characterized amplified region SCARs), simple sequence repets (SSRs) atau mikrosatelit, dan
single nucleotide polymorphism (SNPs). Menurut Karp et al. (1996) pada dasarnya teknik molekuler dikategorikan menjadi tiga kelompok yaitu metode non- PCR, aplikasi PCR dengan arbitrary atau semi arbitrary primer dan aplikasi PCR primer yang dirancang untuk sekuen khusus.
Penggunaan seleksi berbasis marka molekuler untuk mengidentifikasi karakter tertentu pada ikan telah dilakukan diantaranya : identifikasi ikan tilapia yang tahan terhadap suhu rendah dan adaptasi salinitas berbeda (Agresti et al.
2000 ; Cnaani et al. 2003), dalam penelitian ini disimpulkan bahwa sebagian besar ikan tilapia mampu bertahan hidup dan bereproduksi tidak hanya pada daerah beriklim tropis ; pengaruh alel terhadap hormon pertumbuhan (GH) telah ditemukan pada ikan brown trout (Gross and Nilsson 1995) dan chinook salmon
(Parks et al. 1995). Seleksi berbasis marka molekuler terhadap resistensi penyakit, sebagian besar telah ditemukan, diantaranya : infeksi hematopoetic necrosis virus
pada ikan hasil persilangan antara cutthroat dengan rainbow trout (Palti et al.
IDENTIFIKASI KANDIDAT MARKA MHC I PADA IKAN LELE (Clarias sp.) TAHAN INFEKSI Aeromonas hydrophila *)
Abstrak
Penyakit motile aeromonad septicemia disebabkan oleh bakteri Aeromonas hydrophila dapat menyebabkan kematian tinggi pada ikan lele (Clarias sp.). Penelitian ini dilakukan untuk mendapatkan kandidat marka MHC I dalam seleksi berbasis marka molekuler untuk menghasilkan ikan lele varietas sangkuriang tahan infeksi bakteri A. hydrophila. Sebanyak 200 ekor ikan lele dengan bobot 60±5 g diuji tantang dengan menyuntikkan bakteri A. hydrophila dengan konsentrasi 106 cfu/mL sebanyak 0,1 mL/ekor ikan. Hasil uji tantang menunjukkan kelangsungan hidup ikan lele sebesar 54% (14 ekor ikan tanpa luka, dan 94 ekor ikan luka dan kemudian sembuh). Tujuh pasang primer didesain berdasarkan sekuen gen major histocompatibility complex (MHC) I ikan Clarias gariepinus yang terdapat di Bank Gen. DNA diekstraksi dari jaringan sirip ekor ikan hidup dan yang mati, kemudian dijadikan cetakan dalam amplifikasi PCR. Hasil PCR menggunakan salah satu set primer menunjukkan adanya pita DNA spesifik berukuran sekitar 300, 500 dan 930 bp pada ikan yang hidup pascainfeksi. Hasil analisis sekuen menggunakan basic local alignment search tools (BLAST) menunjukkan bahwa produk PCR tersebut memiliki kesamaan 69-88% dengan gen MHC I ikan C. gariepinus. Dengan demikian, fragmen MHC I tersebut dapat menjadi marka molekuler ikan lele tahan infeksi A. hydrophila.
Kata kunci: ikan lele, marka molekuler, Aeromonas hydrophila, MHC I
IDENTIFICATION OF MHC I MARKER CANDIDATE IN
CATFISH
(Clarias sp.) RESISTANCE TO Aeromonas hydrophila
INFECTION
Abstract
Motile aeromonad septicemia disease caused by the bacterium Aeromonas hydrophila infection could cause high mortality in catfish (Clarias sp.). This study was conducted to obtain a MHC I marker candidate for molecular marker based selection to generate A. hydrophila resistance of sangkuriang catfish. A total of 200 fish with body weight 60 ± 5 g were challenged by intraperitoneally injecting with A. hydrophila at a dose of 106 cfu/mL. Challenge test results showed the viability of fish was 54% (14 fish survived without injury, and 94 fish recovered from injury). Seven set primers were designed based on database gene sequences of major histocompatibility complex (MHC) I of Clarias gariepinus. Genomic DNA was extracted from caudal fin tissue of living and the dead fish, and then used as template in PCR amplification. The PCR results using a set of primer showed specific DNA bands of approximately 300, 500 and 930 bp in the survived fish. The results of sequence analysis using the basic local alignment search tool showed that the nucleotide sequence of those PCR products had similarity of 69-88% with MHC I genes of C. gariepinus. As conclusion, MHC I could be used as a molecular marker of A. hydrophila resistance catfish.
PENDAHULUAN
Latar Belakang
Penyakit yang biasa menyerang ikan lele adalah motile aeromonad septicemia (MAS) yang disebabkan oleh infeksi bakteri Aeromonas hydrophila
(Li et al. 2013). Infeksi A. hydrophila dapat menyebabkan kematian ikan dalam jumlah besar (Angka et al. 2004). Saat ini telah dikembangkan vaksin untuk A. hydrophilayang dikenal dengan nama vaksin “Aero” dalam bentuk vaksin inaktif. Kelemahan vaksin tradisional, terutama vaksin yang dilemahkan adalah berisiko infeksi karena bakteri atau virus yang telah dilemahkan berpotensi menjadi patogen, biaya relatif mahal khususnya untuk ikan air tawar dan perlu dilakukan vaksinasi ulang (Mulia et al. 2004). Penggunaan benih ikan lele tahan infeksi A. hydrophila secara genetik merupakan alternatif solusi. Namun demikian, hingga saat ini belum ada varietas ikan lele tahan bakteri patogen tersebut.
Ikan tahan infeksi penyakit dapat dihasilkan melalui aplikasi seleksi secara konvensional seperti yang telah dilakukan dalam pembuatan ikan mas Krasnodar (Cyprinus carpio) resisten dropsy (Kirpichnikov et al. 1993). Namun demikian, waktu yang dibutuhkan relatif lama; ikan mas tahan penyakit dropsy diperoleh pada generasi 9 (Kirpichnikov, 1999). Pendekatan lain yang dapat dilakukan untuk menghemat waktu adalah seleksi dengan bantuan marka molekuler (marker assisted selection, MAS) (Xu et al. 2011). Metode ini telah berhasil digunakan untuk membuat ikan mas tahan infeksi virus KHV (Alimuddin et al. 2011). Marka molekuler yang digunakan adalah Cyca-DAB1*05 yang terkait sistem imun, dan termasuk kelompok gen major histocompatibility complex class II (MHC II). MHC II berperan dalam aktivasi sel-sel fagosit untuk memproduksi antibodi dan mengaktivasi sistem imun yang terlibat dalam eliminasi parasit dan bakteri, dan menetralkan virus (Rakus, 2008). Kelompok MHC lain yang terlibat dalam sistem imun adalah MHC I.
hidup dan mati pascainfeksi. Pita DNA produk PCR yang berbeda antara ikan yang hidup dan mati pascainfeksi merupakan marka molekuler. Dengan pendekatan yang sama dengan Alimuddin et al. (2011), penelitian ini dilakukan untuk mendapatkan marka molekuler berupa primer yang dapat membedakan antara ikan lele tahan dan rentan infeksi A. hydrophila. Primer yang dihasilkan dapat digunakan dalam seleksi berbasis marka molekuler (SBMM) untuk menghasilkan ikan lele tahan infeksi A. hydrophila.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk menemukan kandidat marka molekuler pembeda ikan yang hidup dan mati pascainfeksi dengan A. hydrophila.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Oktober 2011 – April 2012. Uji tantang dan pemeliharaan ikan lele dilakukan di Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi, sedangkan analisis DNA dilakukan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan (BDP), Fakultas Perikanan dan Ilmu Kelautan (FPIK) IPB.
Penyiapan Isolat A. hydrophila
Isolat bakteri A. hydrophila dengan kode AHL 110306-3 diperoleh dari Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor. Peningkatan virulensi A. hydrophila, dilakukan dengan menyuntikkan A. hydrophila 105 cfu/ekor pada tiga ekor ikan lele secara intramuskuler, dan proses penyuntikan dilakukan tiap 3 hari sebanyak tiga kali ulangan. Proses peningkatan virulensi A. hydrophila dapat dilihat pada Lampiran 1.
Setelah 24 jam pascainfeksi, organ hati, limpa dan ginjal diambil dari ikan yang terserang A. hydrophila yang ditandai dengan adanya dropsy, kemudian digerus untuk menghasilkan suspensi bakteri. Selanjutnya, dengan menggunakan jarum Ose, bakteri diambil dan dibiakkan pada media selektif Rimler Shott, diinkubasi pada suhu 28 °C selama 24 jam. Bakteri A. hydrophila dipindahkan ke media tryptic soy agar (TSA) miring, diinkubasi selama 24 jam pada suhu 28 °C. Sebelum digunakan, bakteri A. hydrophila dikultur menggunakan media tryptic soy broth (TSB) selama 24 jam pada suhu 28 °C. Bakteri dipanen menggunakan sentrifugasi selama 15 menit dengan kecepatan 3000 rpm, dan disuspensi dengan
tumbuh diamati untuk memastikan bakteri tersebut adalah A. hydrophila (Tabel 1), mengikuti prosedur standar SNI 7303 : 2009.
Tabel 1. Pengujian Gram dan uji biokimia bakteri Aeromonas hydrophila
pascainfeksi sesuai prosedur standar SNI (2009) No. 7303:2009
Isolat
Morfologi koloni dan sel Uji biokimia W arna Ele vasi G ram Mo tilitas O /F Ok sidase R S Isolat Awal K rem ce
mbung - + F + +
A K
rem
ce
mbung - + F + +
B K
rem
ce
mbung - + F + +
C K
rem
ce
mbung - + F + +
Keterangan : A – C = ulangan isolat ; O/F = oksidatif fermentatif ; RS = Rimler shott
Dari hasil identifikasi bakteri yang dilakukan dengan pewarnaan Gram, morfologi bakteri terlihat lebih jelas yaitu batang pendek, soliter, kadang terlihat berantai pendek, berwarna kemerahan yang menunjukkan bahwa bakteri yang diidentifikasi termasuk bakteri Gram negatif. Pada uji KOH 3% didapatkan hasil positif (terbentuk lendir), hal ini menunjukkan bahwa bakteri yang diidentifikasi merupakan bakteri Gram negatif. Pada media RS koloni berbentuk bulat berwarna kekuningan/krem. Untuk uji peneguhan spesies dilakukan uji biokimiawi yang menghasilkan antara lain oksidasi positif dan fermentatif. Dari hasil Identifikasi bakteri yang dilakukan, menunjukkan bahwa bakteri yang diidentifikasi sesuai dengan parameter atau sifat-sifat dari bakteri A. hydrophila. Oleh karena itu dapat disimpulkan bahwa bakteri yang digunakan pada penelitian ini adalah bakteri A. hydrophila.
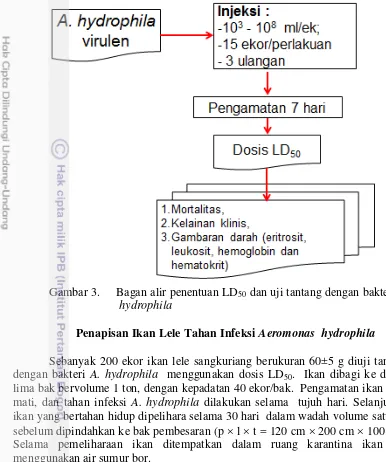
Penentuan LD50
Nilai LD50 digunakan dalam uji tantang. Penentuan LD50 (Gambar 3)
dilakukan dengan menyuntik ikan lele sangkuriang (berukuran 60±5 g) dengan bakteri A. hydrophila sebanyak 0,1 mL/ekor secara intramuskuler dengan konsentrasi bakteri berbeda, yaitu 103-107 cfu/ekor ikan.
Sebanyak 45 ekor ikan lele digunakan untuk masing-masing perlakuan, dan setiap perlakuan diulang 3 kali. Uji tantang dilakukan selama 7 hari, kematian ikan dicatat setiap hari dan LD50 dihitung pada akhir percobaan menggunakan
Gambar 3. Bagan alir penentuan LD50 dan uji tantang dengan bakteri A.
hydrophila
Penapisan Ikan Lele Tahan Infeksi Aeromonas hydrophila
Sebanyak 200 ekor ikan lele sangkuriang berukuran 60±5 g diuji tantang dengan bakteri A. hydrophila menggunakan dosis LD50. Ikan dibagi ke dalam
lima bak bervolume 1 ton, dengan kepadatan 40 ekor/bak. Pengamatan ikan yang mati, dan tahan infeksi A. hydrophila dilakukan selama tujuh hari. Selanjutnya ikan yang bertahan hidup dipelihara selama 30 hari dalam wadah volume satu ton sebelum dipindahkan ke bak pembesaran (p l t = 120 cm 200 cm 100 cm). Selama pemeliharaan ikan ditempatkan dalam ruang karantina ikan dan menggunakan air sumur bor.
DNA genom diekstraksi dari sirip ikan yang hidup dan ikan yang paling cepat mati pascainfeksi. Ekstraksi DNA dilakukan menggunakan kit isolasi DNA (Puregene, Minneapolis, USA) mengikuti prosedur dalam manual. DNA dilarutkan dengan sterile distillated water (SDW), kemudian disimpan dalam lemari beku -20 ˚C hingga akan digunakan untuk proses PCR.
Desain Primer
[image:34.595.72.458.90.552.2]Brachydanio rerio: L04805 (Ono et al. 1992). Penyejajaran sekuen dilakukan menggunakan program GENETYX versi 7.0, dengan tujuan untuk memperoleh kandidat primer forward dan reverse spesifik.
Identifikasi Ikan Lele Pembawa dan Analisis Sekuen Gen MHC
PCR dilakukan dengan volume akhir reaksi 25 L, yang terdiri atas 10x bufer Tag DNA polymerase 2.50 L, dNTPs 2 L, primer reverse dan forward
masing-masing 2.00 L, Tag DNA polymerase 0.25 L, SDW 17.25 L, dan
sampel DNA sebanyak 1 L. Program amplifikasi PCR yang digunakan adalah pengkondisian awal pada suhu 94 °C selama 5 menit; 35 siklus PCR dengan denaturasi pada suhu 94 °C selama 30 detik, annealing pada suhu 55 °C selama 30 detik, dan ekstensi pada suhu 72 °C selama 1 menit; dan ekstensi akhir pada suhu 72 °C selama 7 menit. Sebagai kontrol internal loading DNA digunakan primer β-aktin (Alimuddin et al. 2008). Setelah mesin menjadi dingin (sekitar 4 °C), tabung mikro dikeluarkan dari mesin PCR. Elekroforesis dilakukan dengan menggunakan gel agarosa 2% (w/v), pada tegangan 70 volt selama 90 menit. DNA divisualisasi dengan menggunakan gel red (Biotum Inc. California, USA) dan disinari cahaya ultraviolet.
Produk PCR kemudian disekuensing di Laboratorium 1st Base Sequencing INT-Singapura menggunakan mesin ABI PRISM 3730 XL (Genetic Analyzer Develop by Applied Biosystem, USA). Hasil sekuensing dianalisis menggunakan BLAST untuk memperoleh kemiripan sekuen yang ada di Bank Gen.
Analisis Hematologi
Data pendukung pengamatan tingkat virulensi pada masing-masing perlakuan adalah berupa gambaran darah ikan lele pascainfeksi dengan bakteri A. hydrophila. Gambaran darah yang diamati adalah total eritrosit, total leukosit, kadar hemoglobin, dan kadar hematokrit. Jumlah eritrosit, dan total leukosit dihitung menggunakan metode Blaxhall dan Daisley (1973). Kadar hemoglobin diukur menggunakan metode Sahli (Wedenmeyer dan Yasutake 1977). Kadar hematokrit diukur menggunakan metode Anderson dan Siwicki (1995).
Pengambilan Darah
Pengambilan darah dilakukan setiap hari selama pemeliharan setelah uji tantang dengan A. hydrophila. Sebelum pengambilan darah, ikan terlebih dahulu dibius dengan minyak cengkeh House Brand (PD. Eltra Raya Perkasa, Tangerang) dosis 0,04 mg/L. Pada saat pengambilan darah, ikan diletakkan dengan kepala di sebelah kiri. Jarum suntik yang sebelumnya sudah dibilas dengan natrium sitrat 3% (sebagai antikoagulan) diarahkan ke bagian vena kaudalis. Darah dihisap sampai batas yang diinginkan. Alat suntik dicabut, kemudian darah ditempatkan ke dalam eppendorf yang telah dibilas dengan natrium sitrat. Selanjutnya dilakukan pengamatan total eritrosit, total leukosit, kadar hemoglobin dan kadar hematokrit.
Sampel darah dihisap dengan pipet sampai skala 0.5, kemudian ditambahkan larutan Hayem’s sampai skala 101, digoyang atau diayunkan membentuk angka delapan selama 3-5 menit agar bercampur homogen. Tetesan pertama dibuang, tetesan berikutnya diteteskan ke dalam hemasitometer dan ditutup dengan kaca penutup, diamati di bawah mikroskop. Perhitungan dilakukan pada kotak kecil hemasitometer, kemudian jumlah eritrosit dihitung menggunakan rumus:
Σ eritrosit = Σ sel eritrosit terhitung 104 sel/mm3
Total Leukosit
Jumlah leukosit dihitung dengan metode Blaxhall dan Daisley (1973). Sampel darah dihisap dengan pipet berskala sampai 0.5. Lalu ditambahkan larutan Turk’s dihisap sampai skala 11 selanjutnya pipet digoyang membentuk angka delapan selama 5 menit agar bercampur homogen. Tetesan pertama dibuang, tetesan berikutnya dimasukkan ke dalam hemasitometer ditutup dengan kaca penutup, diamati di bawah mikroskop. Perhitungan dilakukan pada kotak kecil hemasitometer, kemudian jumlah leukosit dihitung menggunakan rumus:
Σ leukosit = Σ sel leukosit terhitung 50 sel/mm3
Kadar Hemoglobin
Pengukuran konsentrasi hemoglobin darah dilakukan dengan menggunakan metode Sahli. Metode ini mengkonversikan hemoglobin darah dalam bentuk asam hematin. Tabung Sahli diisi dengan HCl 0.1 N sampai batas tera terbawah. Sampel darah dihisap menggunakan pipet hemoglobin sampai tanda 20 mm3. Darah tersebut kemudian dimasukkan ke dalam tabung Sahli. Perubahan yang muncul adalah terbentuknya asam hematin yang berwarna coklat atau coklat hitam. Dengan menggunakan pipet penetes, akuades diteteskan sambil dikocok hati-hati. Penambahan akuades ini dilakukan sedikit demi sedikit hingga warnanya sama dengan warna standar. Pembacaan kadar hemoglobin dilakukan dengan melihat meniskus bawah cairan pada tabung Sahli. Satuan hemoglobin dinyatakan dalam gram%.
Kadar Hematokrit
Sampel darah dimasukkan dalam tabung mikrohematokrit sampai kira-kira 3/4 bagian tabung, ujungnya disumbat dengan crytoseal sedalam 1 mm. Setelah itu, sentrifugasi dilakukan selama 5 menit dengan kecepatan 5000 rpm, kemudian dilakukan pengukuran panjang darah yang mengendap (a) serta panjang total volume darah yang terdapat di dalam tabung (b). Kadar hematokrit (He) dinyatakan sebagai % volume padatan sel darah yang dihitung dengan cara:
HASIL DAN PEMBAHASAN
Hasil
Penentuan LD50
Hasil uji LD50 bakteri A. hydrophila pada ikan lele sangkuriang tersaji
pada Gambar 3. Hasil pengamatan menunjukkan bahwa jumlah dan waktu mortalitas ikan yang terpapar berbeda-beda. Mortalitas tertinggi terjadi pada konsentrasi bakteri 107 cfu/ekor ikan (92.6±4,3%), kemudian berturut-turut pada konsentrasi bakteri 106 cfu/ekor ikan (68.9%±3,3%), 104 cfu/ekor ikan (52.6±3,9%), 103 cfu/ikan(23,7±1,9%), dan 103 cfu/ikan (6,7±1,0%). Dari hasil perhitungan menggunakan metode Muench (1938), diperoleh LD50 bakteri A. hydrophila sebesar 105,9 cfu/mL dibulatkan menjadi 106 cfu/mL. Dengan demikian konsentrasi bakteri A. hydrophila yang digunakan dalam penelitian selanjutnya adalah sebesar 106 cfu/mL (105 cfu/ekor ikan).
Penapisan Ikan Lele Tahan Infeksi A. hydrophila
Mortalitas ikan lele sangkuriang pascainfeksi (Gambar 4), pada setiap bak adalah relatif sama (42,5-60,0%) dengan rerata kelangsungan hidup adalah 50%. Secara total, dari 200 ekor ikan yang diujitantang, diperoleh 108 ekor ikan yang hidup. Mortalitas tertinggi terjadi pada hari ke-3 dan 4 uji tantang. Pada hari ke-6 ikan yang terinfeksi mulai menunjukkan gejala luka yang berangsur-angsur sembuh, dan kematian ikan mulai berkurang. Selain itu, berdasarkan pengamatan secara visual pada ikan yang hidup hingga akhir pengamatan, diperoleh sebanyak 14 ekor ikan termasuk kategori sangat tahan (R, tidak ada luka), dan 94 ekor ikan kategori tahan (L, luka kemudian sembuh).
Gambar 4. Mortalitas (%) ikan lele pascainfeksi bakteri A. hydrophila menggunakan dosis berbeda.
0 10 20 30 40 50 60 70 80 90 100
1 2 3 4 5 6 7
0
M
β
Analisis Marka Molekuler
Di antara tujuh set primer yang diuji untuk mendeteksi marka MHC I, diperoleh satu set primer yang menghasilkan produk PCR spesifik bagi ikan yang hidup pascainfeksi bakteri A. hydrophila (Gambar 5). Ikan lele kategori tahan (L1-L5) dan sangat tahan (R1-R5) memiliki pita DNA spesifik berukuran sekitar 300 bp, 500 bp dan 930 bp. Ikan lele yang mati (M1-M5) dan PCR tanpa DNA (N) tidak menunjukkan produk PCR pada ukuran DNA tersebut. Sementara itu, PCR menggunakan β-aktin sebagai kontrol internal menghasilkan pita DNA dengan ukuran sama untuk semua sampel, yakni sekitar 200 bp.
Gambar 5. Produk amplifikasi PCR dalam deteksi marka molekuler dengan target gen major histocompatibility complex (MHC I) pada ikan lele (Clarias
sp.) strain sangkuriang (atas). β-aktin digunakan untuk kontrol
loading DNA (bawah). M= Marka ukuran fragmen DNA (KAPA
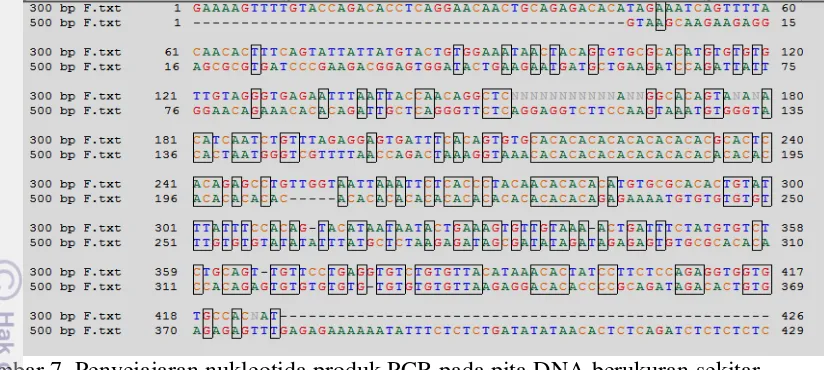
Biosystem); L1-5 = ikan luka dan sembuh; M1-5= ikan yang mati; R1-5= ikan resisten, dan N= produk PCR tanpa cetakan DNA (kontrol negatif). Angka di sebelah kiri adalah ukuran fragmen marka DNA. Hasil penyejajaran (alignment) nukleotida produk PCR pada posisi pita sekitar 500 dan 930 bp menunjukkan banyak kemiripan sekuen antara keduanya, khususnya pada sekuen sekitar 350 bp (Gambar 6). Sementara itu, kemiripan nukleotida produk PCR berukuran sekitar 300 bp dengan 500 bp adalah relatif rendah (Gambar 7). Demikian juga antara produk PCR ukuran sekitar 300 bp dengan 930 bp, kemiripannya relatif rendah (hasil tidak ditampilkan).
Gambar 6. Penyejajaran nukleotida produk PCR pada pita DNA berukuran sekitar 500 bp dengan 930 bp yang spesifik terdapat pada ikan lele sangkuriang (Clarias sp.) bertahan hidup dalam uji tantang dengan bakteri A. hydrophila.
Gambar 7. Penyejajaran nukleotida produk PCR pada pita DNA berukuran sekitar 300 bp dengan 500 bp yang spesifik terdapat pada ikan lele sangkuriang (Clarias sp.) bertahan hidup dalam uji tantang dengan bakteri A. hydrophila.
Gambar 8. Analisis BLAST sekuen nukleotida produk PCR pita DNA berukuran sekitar 300 bp (A), 500 bp (B) dan 930 bp (C) dari ikan lele sangkuriang (Clarias sp.) bertahan hidup dalam uji tantang bakteri A. hydrophila. Description adalah deskripsi alel MHC I C. Gariepinus;
Max. score adalah nilai maksimum; total score adalah nilai total;
identity adalah nilai kemiripan.
Gambaran Darah
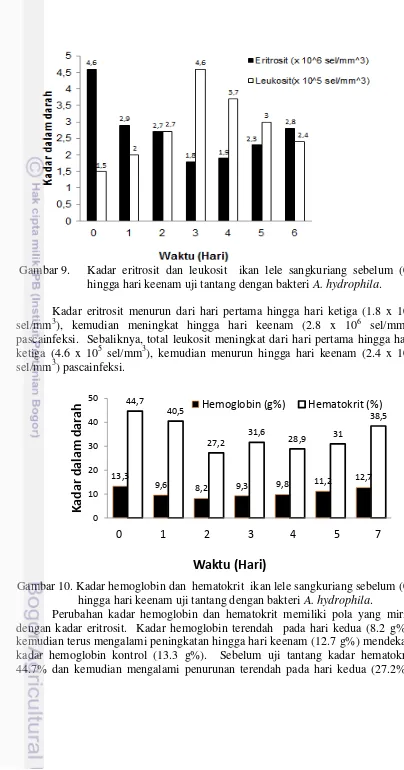
Hasil pengukuran kadar eritrosit dan leukosit ikan lele sangkuriang pascainfeksi A. hydrophila disajikan pada Gambar 9. Sedangkan kadar hemoglobin dan hematokrit ikan lele sangkuriang pascainfeksi A. hydrophila
Gambar 9. Kadar eritrosit dan leukosit ikan lele sangkuriang sebelum (0) hingga hari keenam uji tantang dengan bakteri A. hydrophila. Kadar eritrosit menurun dari hari pertama hingga hari ketiga (1.8 x 106 sel/mm3), kemudian meningkat hingga hari keenam (2.8 x 106 sel/mm3) pascainfeksi. Sebaliknya, total leukosit meningkat dari hari pertama hingga hari ketiga (4.6 x 105 sel/mm3), kemudian menurun hingga hari keenam (2.4 x 105 sel/mm3) pascainfeksi.
Gambar 10. Kadar hemoglobin dan hematokrit ikan lele sangkuriang sebelum (0) hingga hari keenam uji tantang dengan bakteri A. hydrophila.
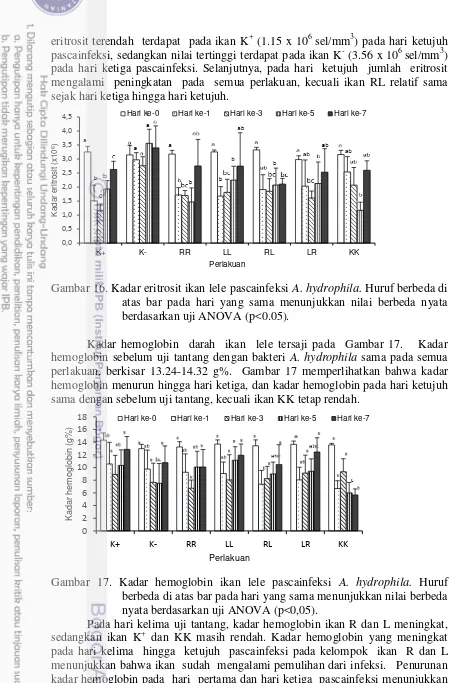
Perubahan kadar hemoglobin dan hematokrit memiliki pola yang mirip dengan kadar eritrosit. Kadar hemoglobin terendah pada hari kedua (8.2 g%), kemudian terus mengalami peningkatan hingga hari keenam (12.7 g%) mendekati kadar hemoglobin kontrol (13.3 g%). Sebelum uji tantang kadar hematokrit 44.7% dan kemudian mengalami penurunan terendah pada hari kedua (27.2%),
13,3
9,6 8,2 9,3 9,8 11,2 12,7
44,7
40,5
27,2
31,6
28,9 31
38,5
0 10 20 30 40 50
K
ad
ar
da
la
m
da
rah
Waktu (Hari)
Hemoglobin (g%) Hematokrit (%)
kemudian terjadi peningkatan kadar hematokrit hingga hari keenam (38.5%) pascainfeksi.
Pembahasan
Desain primer dalam penelitian ini berdasarkan sekuen 20 alel ikan lele Afrikayang ada di bank gen (Wachirachaikarn et al. 2009). Salah satu dari tujuh primer yang dibuat dapat mendeteksi ikan yang membawa gen MHC I pada ikan lele sangkuriang yang hidup pascainfeksi dengan bakteri A. hydrophila (Gambar 4). Namun demikian, produk PCR belum menunjukkan pita DNA tunggal, terdapat tiga pita DNA cukup jelas, yakni sekitar 300 bp, 500 bp, dan 930 bp. Dengan demikian dapat diyakini bahwa ikan R dan L memiliki gen MHC I terkait daya tahan terhadap A. hydrophila. Keyakinan ini diperkuat dengan hasil analisis BLAST yang menunjukkan bahwa produk PCR ikan lele sangkuriang memiliki kemiripan tinggi dengan MHC I alel 09 dan 17 ikan lele Afrika. Dengan demikian, gen MHC I dapat dijadikan sebagai marka bagi ikan lele sangkuriang yang tahan infeksi A. hydrophila. Selanjutnya, pita DNA produk PCR masih banyak, oleh sebab itu diperlukan penelitian lebih lanjut untuk memastikan alel dan sekuen nukleotidanya secara total, serta untuk mendesain primer spesifik dengan produk pita DNA tunggal, berdasarkan hasil penyejajaran nukleotida produk PCR pada pita antara 930 dan 500 bp .
Hingga saat ini, ikan air tawar termasuk ikan lele sangkuriang, belum ada induk ikan bebas patogen. Oleh karena itu, pewarisan sifat dan uji daya tahan ikan lele terhadap infeksi A. hydrophila perlu dilakukan pada generasi berikutnya. Pada ikan mas, telah ditemukan primer Cyca-DAB1*05 untuk mendeteksi ikan mas yang tahan terhadap penyakit koi herpesvirus (KHV) dan A. hydrophila, dan telah diuji hingga generasi kedua. Hasil PCR diperoleh bahwa ikan mas F0 yang tahan KHV dan A. hydrophila sebesar 50%, sedangkan pada F1 sebanyak 83% ikan mas tahan KHV dan A hydrophila. Ikan F2 hidup 100% bila diuji tantang dengan KHV, sedangkan dengan A. hydrophila kelangsungan hidupnya 74,4% (Kepmen KKP, 2015). Pada ikan nila telah ditemukan MHC Iα tahan
Streptococcus agalactiae dan berhasil mengidentifikasi sebanyak 15 alel dari enam strain ikan nila (Poonsawat et al. 2009). Ikan nila tahan S. agalactiae juga sedang dikembangkan di BBPBAT Sukabumi. Dengan cara yang sama pada ikan mas, besar kemungkinan dapat dicapai hasil yang sama pada ikan lele. Selanjutnya, hasil riset ini juga memberi peluang besar untuk menghasilkan ikan lele sangkuriang tahan infeksi A. hydrophila secara massal.
sehingga memungkinkan adanya tingkatan yang berbeda-beda (Schaperclaus, 1992). Pada penelitian ini, kondisi ikan yang resisten tidak menunjukkan gejala
dropsy, hal ini sangat berbeda pada ikan grup L dimana terjadi pembengkakan pada hari pertama pascainfeksi akibat reaksi virulen dari bakteri A. hydrophila. Selanjutnya pada hari kedua pascainfeksi terjadi ulser di sekitar area penyuntikan. Luka borok pada ikan yang mati tampak semakin lebar pada hari ketiga dan keempat disertai kematian ikan yang tinggi. Untuk ikan grup L terlihat bahwa area luka pada hari keempat tidak bertambah lebar dan hari keenam mulai menunjukkan gejala sembuh dengan adanya semacam lapisan tipis di area luka.
Peningkatan sistem imun pada ikan berkorelasi positif terhadap peningkatan jumlah leukosit darah ikan pascainfeksi dengan bakteri A. hydrophila. Dalam penelitian ini, sebelum ikan terinfeksi A. hydrophila jumlah leukosit dalam darah 1,5x 105 sel/mm3, dan meningkat secara signifikan pada hari ketiga pascainfeksi (4,6x105 sel/ mm3). Hal ini mengindikasikan bahwa apabila ada antigen masuk ke dalam tubuh, maka leukosit akan memberikan respons dengan meningkatkan jumlahnya sebagai bentuk pertahanan tubuh. Pendapat ini dipertegas oleh Baratawidjaja (2002) yang menyatakan bahwa respons imun akan meningkat dengan cara mengaktifkan leukosit. Penelitian yang dilakukan oleh Bastiawan et al. (2001) menjelaskan bahwa ikan lele dumbo sehat mempunyai kadar leukosit darah 20-150 (x103 sel/mm3), kadar eritrosit 3,18 x 106 sel/mm3 , nilai hematokrit 30,8 – 45,5 % dan nilai hemoglobin sebesar 12 – 14 Hb/100ml.
Masuknya bakteri dalam tubuh mengaktifkan respons imun dengan memproduksi polimorfonuklear leukosit, seperti melano-makrofag, monosit, dan neutrofil yang berperan sebagai pagositik sel. Kehadiran leukosit tersebut menyebabkan bakteri mengeluarkan toksin hemolisin yang mengakibatkan terjadinya ulcer dan hemoragik pada permukaan tubuh ikan (Cipriano, 2001). Ulser ditemukan pada hari kedua sampai hari keempat pascainfeksi A. hydrophila,
terutama di sekitar tempat injeksi. Hasil penelitian Li