PEMBUATAN ISOLAT ALERGEN
DIAN PURBASARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Karakterisasi Protein Ikan Tongkol (Auxis thazard), Kerang Hijau (Perna viridis) dan Udang Jerbung (Penaeus merguiensis) untuk Pembuatan Isolat Alergen adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor Maret 2012
Mackerel Fish (Auxis thazard), Green Mussel (Perna viridis) and White Shrimp (Penaeus merguensis) for Production of Isolate Allergen. Under direction of FRANSISKA RUNGKAT- ZAKARIA and DAHRUL SYAH.
Seafoods including fish, crustaceans and shellfish play an important role in human nutrition. However, it is also recognised as an important cause of food allergies, especially in coastal countries, including Indonesia. Treatments of these diseases still rely on avoiding the sources of the alergens, however it can also cause malnutrition which is also dangerous to health. To determine the specific food protein causing allergic reactions, cutie test was performed using isolate food protein. Until the present time, Indonesia still imports kits containing isolate proteins for food allergy diagnosis, therefore effort to locally produce the kit will reduce health cost for patients with allergic diseases. The objective of this study was to produce seafoods protein extract that is potential to be used as isolate of allergens for food allergy diagnosis. Two extract sarcoplasmic and myofibril protein were obtained from fish, shrimp and mussel by extraction in phosphate buffer with diference ionic strength Protein profile were then detected by means of sodium dodecyl polyacrylamide gel electrophoresis (SDS-PAGE). IgE binding pattern was analyzed by using ELISA and immunoblotting using sera from 20 respondents with histories of food allergy. The result of the study showed that samples of seafood extract protein consist of several protein with various molecular weight in the range about 14 to 143 kDa. The component were identified as tropomyosin (34-38 kDa), parvalbumin (~12 kDa), myosin light chain (~17.5 kDa) and arginin kinase (40 kDa) which are major allergens in seafoods. Further analysis with ELISA showed that the seafood protein extracts contained several IgE-binding proteins. Immunoblot of three extract samples from seafoods showed that components identified as allergens to each allergic subject have different molecular weight. The results demonstrated that crude extract could be directly used as isolate allergen for diagnostic test allergy (skin prick test) without isolating the major allergen components.
thazard), Kerang Hijau (Perna viridis) dan Udang Jerbung (Penaeus merguiensis) untuk Pembuatan Isolat Alergen. Dibimbing oleh FRANSISKA RUNGKAT- ZAKARIA dan DAHRUL SYAH.
Alergi pangan merupakan reaksi antibodi imunoglobulin E (IgE) terhadap protein dalam bahan pangan yang disebut alergen. Diantara pangan penyebab alergi, makanan laut dikenal sebagai penyebab penting alergi pangan. Sampai saat ini cara terbaik untuk mengatasi alergi pangan adalah dengan menghindari makanan yang dicurigai menimbulkan alergi yang dapat merugikan kesehatan dan mengurangi cita rasa suatu jenis pangan. Oleh karena itu diperlukan suatu diagnosis alergi untuk memastikan jenis pangan penyebab alergi, salah satunya yaitu dengan uji tusuk kulit (skin prick test). Uji ini menggunakan isolat alergen yang saat ini masih berasal dari impor. Oleh karena itu penelitian ini bertujuan untuk menghasilkan ekstrak protein dari ikan tongkol, kerang hijau dan udang jerbung yang berpotensi sebagai isolat alergen untuk uji diagnosis alergi.
Penelitian ini dilakukan dalam beberapa tahap, pertama yaitu isolasi protein sampel, dalam bentuk ekstrak protein sarkoplasma dan miofibril. Tahap selanjutnya yaitu karakterisasi ekstrak protein dengan SDS-PAGE dan penentuan alergenisitas masing-masing ekstrak dengan metode ELISA dan immunoblotting menggunakan 20 serum subyek penderita alergi.
Hasil analisis kadar protein dengan metode Bradford menunjukkan bahwa kadar protein sarkoplasma sampel udang, ikan tongkol dan kerang hijau berturut-turut adalah 1.154 mg/ml, 1.269 mg/ml dan 0.691 mg/ml. Sedangkan kadar protein adalah 0.627 mg/ml, 0.878 mg/ml dan 0.176 mg/ml. Berdasarkan hasil elektroforesis SDS-PAGE tiga ekstrak protein sampel diketahui bahwa komponen penyusunnya memiliki berat molekul berkisar dari 14 – 143 kDa, yang diidentifikasi beberapa komponen seperti tropomiosin (34-38 kDa), parvalbumin (~12 kDa), myosin light chain (~17.5 kDa) dan arginin kinase (40 kDa) yang merupakan alergen utama pada ikan, kerang dan udang.
Uji alergenisitas dengan metode ELISA ekstrak protein dari ketiga sampel terhadap 20 serum subyek menunjukkan hasil yang sesuai dengan sejarah medis alergi tiap-tiap subyek. Kemampuan ekstrak protein baik fraksi sarkoplasma dan miofibril dari ketiga sampel untuk mendeteksi IgE spesifik pada serum penderita alergi makanan laut menunjukkan bahwa ekstrak ini berpotensi untuk digunakan sebagai isolat alergen dalam diagnosis alergi, seperti uji tusuk atau SPT (skin prick test).
Berdasarkan immunoblotting ekstrak protein ikan tongkol, kerang hijau dan udang jerbung memperlihatkan adanya fraksi protein yang bersifat alergenik terhadap 5 serum subyek alergi (A, B, H, L dan P). Fraksi protein yang menyebabkan alergi pada tiap-tiap individu berbeda-beda. Sehingga untuk tujuan diagnosis ekstrak dapat digunakan langsung tanpa harus mengisolasi komponen alergennya.
© Hak Cipta milik Institut Pertanian Bogor, Tahun 2012 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
PEMBUATAN ISOLAT ALERGEN
DIAN PURBASARI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Mayor Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Kerang Hijau (Perna viridis) dan Udang Jerbung (Penaeus merguiensis) untuk Pembuatan Isolat Alergen.
Nama : Dian Purbasari
NRP : F251090051
Disetujui Komisi Pembimbing
Prof.Dr.Ir. Fransiska Rungkat-Zakaria, M.Sc Ketua
Dr.Ir. Dahrul Syah, M.Sc. Agr Anggota
Diketahui
Ketua Program Studi Ilmu Pangan
Dr.Ir.Ratih Dewanti, M.Sc
Dekan Sekolah Pasca Sarjana
Dr.Ir. Dahrul Syah, M.Sc. Agr
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala kerunia yang diberikan sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2011 ini ialah tentang protein alergen dengan judul Isolasi dan Karakterisasi Protein Ikan Tongkol (Auxis thazard), Kerang Hijau (Perna viridis) dan Udang Jerbung (Penaeus merguiensis) untuk Pembuatan Isolat Alergen.
Terima kasih penulis ucapkan kepada :
1. Prof.Dr.Ir. Fransiska R Zakaria, M.Sc dan Dr.Ir. Dahrul Syah, M.Sc. Agr sebagai dosen pembimbing atas bimbingan dan bantuan dana selama pelaksanaan penelitian.
2. Dra. Suliantari, M.Sc selaku dosen penguji luar komisi atas masukan dan arahan untuk perbaikan tulisan ini.
3. Drh. Didik Tulus Subekti, M.Kes yang telah banyak memberikan banyak masukan, arahan dan bimbingan selama pengerjaan uji ELISA di BALITVET Bogor.
4. Orangtuaku tercinta Bapak Agus Irianto, SH.MPd dan Ibu Nanik Sugiyarti, SPd, kedua adikku (Galuh dan Pupi) serta keluarga besar Banyuwangi (Pakdhe Nyoto, Budhe Ria, Mba Eka) atas kasih sayang, dukungan yang tak terhingga.
5. Teman-teman seperjuangan IPN 2009 (Rizki, Ria, Hermawan, Nandi, Dede, Fenny, Ilul, Riyanti, Bu Wida, Rangga, Tina, Wanny, Bu Indah), teman-teman IPN 2010 (Pak.Hendra, Zahra, Meli, Gadis, Yati, Nita, Sadex dan Pak Salim), anggota wisma queen castle (Dwi Andini, Ratna, Thea, Ilah, Nurisma, Rina, Yeni, Nana), serta staf LPP Mangrove (mba Yanti, Ayu, Mas Ali, a’Udi, Bu Eni, Pak Khumaedi, Gilang dan Roni) atas kebersamaan selama ini.
6. Keluarga besar : Program Mayor Ilmu Pangan Fateta IPB, SEAFAST Centre IPB, Laboratorium Biokimia Departemen Ilmu dan Teknologi Pangan Fateta IPB, Laboratorium Parasitologi BALITVET Bogor.
Bogor, Maret 2012
Penulis dilahirkan di Banyuwangi tanggal 15 Agustus 1985 dari ayah Agus Irianto, SH.MPd dan ibu Nanik Sugiyarti, SPd. Penulis merupakan putri pertama dari tiga bersaudara.
xvii
DAFTAR TABEL ... xix DAFTAR GAMBAR ... xxi DAFTAR LAMPIRAN ... xxiii 1. PENDAHULUAN ...
1.1. Latar Belakang ... 1.2. Perumusan Masalah ... 1.3. Tujuan Penelitian ... 1.4. Manfaat Penelitian ... 1.5. Hipotesis ... 2. TINJAUAN PUSTAKA ...
2.1. Alergi ... 2.1.1. Alergi Pangan... 2.1.2. Alergen dalam makanan ... 2.1.3. Deteksi Alergi ... 2.2. Makanan Laut Penyebab Alergi ... 2.2.1. Ikan Tongkol ... 2.2.2. Kerang Hijau ... 2.2.3. Udang Jerbung ... 2.3. SDS PAGE (Sodium Dodecyl Sulfate-Polyacrilamide Gel
Electrophoresis)... 2.4. ELISA (Enzyme Linked Immunosorbent Assay) ... 2.5. Imunoblotting ...
5 3.3. Metode Penelitian ... 3.3.1. Analisis Kadar Protein Metode Kjeldahl (AOAC 1995)... 3.3.2. Isolasi Protein Sampel (Hashimoto et al. 1979) ... 3.3.3. Analisis Kadar Protein Metode Bradford (Bradford 1976) 3.3.4. Penentuan Karakteristik Ekstrak Protein dengan
xviii
3.3.6.1. Penentuan IgE Total Serum Subyek Alergi (kualitatif) ………... 3.3.6.2. Penentuan Sifat Alergenisitas Ekstrak
Protein... 3.3.7. Immunoblotting (Towbin et al. 1979)...
27
28 28 4. HASIL DAN PEMBAHASAN ...
4.1. Ekstrak Protein Sarkoplasma dan Miofibril ... 4.2. Karakteristik Ekstrak Protein dengan Elektroforesis SDS-PAGE ..
4.2.1. Ikan Tongkol ... 4.2.2. Kerang Hijau ... 4.2.3. Udang Jerbung ... 4.3. Alergenisitas Ekstrak Protein dengan Metode ELISA ...
4.3.1. IgE Total Serum Subyek Alergi ... 4.3.2. Alergenisitas Ekstrak Protein Sarkoplasma dan Miofibril ....
4.3.2.1. Ikan Tongkol ... 4.3.2.2. Kerang Hijau ... 4.3.2.3. Udang Jerbung ... 4.4. Profil Protein Alergenik Ekstrak Protein Sarkoplasma dan Miofibril dengan Metode Imunoblotting ………...
31
xix
Tabel 1. Klasifikasi makanan laut penyebab alergi ... 10 Tabel 2. Jumlah total protein sampel awal dan protein terekstrak ... 32 Tabel 3. Nilai mobilitas relatif (Rf), logaritma berat molekul (Log BM)
dan berat molekul protein standar ... 35 Tabel 4. Perbandingan hasil uji ELISA dengan sejarah medis alergi
xxi
Gambar 1. Empat tipe reaksi alergi (Kuby 2007) ... 5 Gambar 2. Mekanisme umum reaksi hipersensitif tipe I (Kuby 2007)... 7 Gambar 3. Diagram alir penelitian ... 21 Gambar 4. Ekstraksi Protein Sarkoplasma dan Miofibril (Hashimoto et al. 1979) ………. 23 Gambar 5. Pola elektroforesis fraksi protein. M: low-molecular-weight
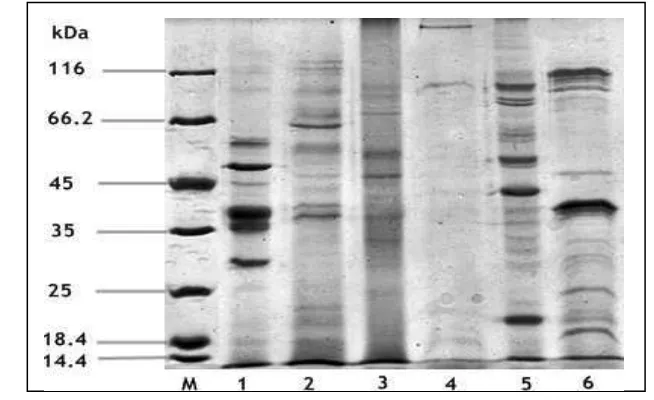
protein marker, 1: sarkoplasma tongkol, 2: miofibril tongkol, 3: sarkoplasma kerang hijau, 4: miofibril kerang hijau; 5: sarkoplasma udang jerbung, 6: miofibril udang jerbung ... 35
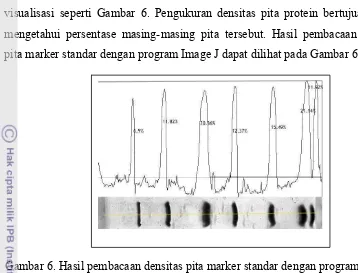
Gambar 6. Hasil pembacaan densitas pita marker standar dengan program Image J ... 37 Gambar 7. Hasil pembacaan densitas pita protein ikan tongkol dengan
program Image J: (a).fraksi sarkoplasma; (b). fraksi miofibril.. 38
Gambar 8. Hasil pembacaan densitas pita protein kerang hijau dengan program Image J: (a).fraksi sarkoplasma; (b). fraksi miofibril.. 39
Gambar 9. Hasil pembacaan densitas pita protein udang jerbung dengan program Image J:(a).fraksi sarkoplasma; (b). fraksi miofibril... 41
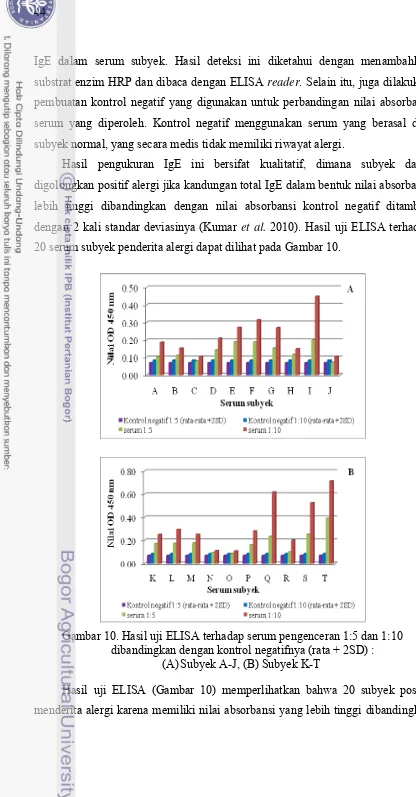
Gambar 10. Hasil uji ELISA terhadap serum pengenceran 1:5 dan 1:10 dibandingkan dengan kontrol negatifnya (rata + 2SD) : (A) Subyek A-J, (B) Subyek K-T...
44
Gambar 11. Hasil uji ELISA protein ikan tongkol terhadap 20 serum subyek(A-T) (A)fraksi sarkoplasma; (B)fraksi miofibril ... 49
Gambar 12. Hasil uji ELISA protein kerang hijau terhadap 20 serum subyek (A-T) (A)fraksi sarkoplasma; (B)fraksi miofibril…….. 51
Gambar 13. Hasil uji ELISA protein udang jerbung terhadap 20 serum subyek (A-T) (A)fraksi sarkoplasma; (B)fraksi miofibril…….. 52
xxiii
Lampiran 1. Larutan-larutan untuk ekstraksi protein sarkoplasma dan miofibril ... 69
Lampiran 2. Larutan-larutan untuk SDS PAGE ... 70 Lampiran 3. Rumus/Formula pembuatan larutan-larutan untuk ELISA 71 Lampiran 4. Rumus/Formula pembuatan larutan-larutan untuk
imunoblotting ... 72 Lampiran 5. Kurva protein standar (BSA) pada penetapan kadar
protein ekstrak sampel (udang jerbung, ikan tongkol dan kerang hijau) ... 73
Lampiran 6. Hasil perhitungan rendemen ekstrak dan analisis total protein dalam daging udang jerbung, ikan tongkol dan kerang hijau ... 74
Alergi pangan merupakan reaksi yang merugikan dari makanan yang didasarkan pada mekanisme imonologi (Houben dan Penninks 1996). Dalam beberapa tahun terakhir, angka kejadian alergi pangan terus meningkat tajam baik di dalam negeri maupun luar negeri. World Allergy Organization (WAO) menyebutkan 22% penduduk dunia menderita alergi dan terus meningkat setiap tahun (Candra et al. 2011). Jumlah kasus alergi pangan paling banyak pada bayi dan anak-anak yaitu berkisar antara 6-8% dan pada orang dewasa sekitar 1-2% (Sampson 2005). Kasus alergi pangan di Indonesia menunjukkan jumlah yang belum pasti namun selalu meningkat tiap tahunnya (Noverina 2008).
Timbulnya alergi pangan disebabkan adanya senyawa penyebab alergi atau lebih dikenal dengan alergen. Alergen pangan berupa protein yang tidak rusak pada saat proses pemasakan dan saat berada di keasaman lambung. Secara struktural protein makanan (alergen) tidak sama dengan struktur protein tubuh manusia sehingga dideteksi oleh sistem imun tubuh sebagai protein asing. Akibatnya alergen dapat masuk ke dalam tubuh melalui peredaran darah mencapai organ yang menjadi tergetnya sehingga menginduksi respon imun dan menimbulkan reaksi alergi. Gejala reaksi alergi dapat terlihat sebagai timbulnya gangguan kulit berupa bercak-bercak merah yang gatal pada permukaan kulit, gangguan saluran pencernaan berupa diare dan muntah, sesak nafas sampai syok anafilaksi yang fatal dan gangguan rongga mulut (Hamada et al. 2003).
Pada dasarnya semua makanan dapat menimbulkan reaksi alergi, yang membedakan hanya kadar protein di dalamnya dan kondisi tubuh seseorang dalam menerima pasokan protein tersebut. Umumnya makanan yang sering menimbulkan reaksi alergi adalah makanan yang mengandung protein tinggi yang sayangnya merupakan makanan sumber protein yang penting bagi kesehatan. Sekitar 90% reaksi alergi pangan disebabkan oleh kacang tanah, susu, telur ayam, kedelai, ikan, kerang dan gandum (FAAN 2010).
2
Namun, makanan laut juga merupakan salah satu jenis pangan penyebab terpenting timbulnya alergi, terutama di negara-negara yang mayoritas penduduknya bergantung pada sektor perikanan dan dimana ikan menjadi konsumsi andalannya (Samartin et al. 2001). Makanan laut ditemukan sebagai alergen pangan terpenting kedua setelah telur pada pasien penderita alergi (Lopata dan Potter 2000). Tiga jenis makanan laut yang dapat memicu alergi yaitu ikan, crustacea (kepiting, lobster, udang) dan moluska seperti kerang, tiram, remis dan cumi (FAAN 2010).
Hasil survei di Amerika Serikat menunjukkan bahwa 1,9% dari total penduduk memiliki alergi terhadap kelompok udang dan kerang-kerangan, dan sebanyak 0,4% dari total penduduk memiliki alergi terhadap ikan (Sicherer et al. 2004). Di Malaysia, ikan dan udang-udangan merupakan penyebab alergi pangan yang paling umum pada penderita alergi asma dan rhinitis (Shanaz et al. 2001).
Sampai saat ini upaya mengatasi alergi yang selama ini telah terbukti dan banyak dilakukan adalah dengan menghindari makanan yang diduga menimbulkan alergi (Sicherer dan Sampson 2009). Namun ternyata tindakan ini dapat merugikan kesehatan karena beresiko kekurangan gizi dan kurang variasi dalam menu makanan, selain itu juga dapat mengurangi kenikmatan cita rasa suatu jenis pangan. Oleh karena itu untuk memastikan jenis bahan pangan penyebab alergi diperlukan suatu diagnosis alergi. Diagnosis yang sering dilakukan adalah dengan uji kulit menggunakan isolat protein alergen pangan. Di Indonesia saat ini tempat untuk melakukan uji ini masih belum banyak ditemukan. Hal ini disebabkan karena isolat protein alergen yang saat ini digunakan oleh para dokter ahli alergologi di Indonesia masih berasal dari hasil impor sehingga biaya uji ini masih mahal (Candra et al. 2011).
1.2. Perumusan Masalah
Alergi yang timbul karena adanya reaksi penyimpangan (adverse reaction) yang melibatkan sistem imun dan komponen pangan berupa protein, disebut dengan alergi pangan. Terdapat lebih dari 160 jenis pangan yang dapat menyebabkan reaksi alergi. Salah satu penyebab utama alergi pangan adalah pangan yang berasal dari hasil laut yaitu ikan, kepiting, kerang, udang dan lobster.
Sampai saat ini belum ada obat khusus untuk mengatasi alergi pangan.
Tindakan pencegahan terbaik yaitu dengan menghindari sumber pangan
penyebabnya, namun hal ini juga dapat bersifat merugikan karena pembatasan
keragaman jenis pangan dapat berdampak pada kondisi kurang gizi protein dan
berkurangnya kenikmatan cita rasa suatu jenis pangan. Diagnosis alergi pangan
dibuat berdasarkan diagnosa klinis, yaitu anamnesa (mengetahui riwayat penyakit
penderita) dan pemeriksaan kejadian alergi yang terjadi. Pemeriksaan yang
dilakukan banyak dan beragam, baik dengan cara yang ilmiah hingga cara
alternatif, mulai yang dari yang sederhana hingga yang canggih. Diantaranya
adalah uji kulit alergi, yaitu suatu uji yang diterapkan secara subkutanus dengan menggunakan isolat protein alergen dari berbagai jenis pangan. Saat ini isolat protein alergen yang digunakan di Indonesia oleh para dokter ahli alergologi masih berasal dari hasil impor, sehingga diperlukan penyediaan protein isolat lokal.
1.3. Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk menghasilkan ekstrak protein dari makanan laut Indonesia yang berpotensi sebagai isolat alergen dan dapat digunakan untuk diagnosis alergi pangan.
Sedangkan tujuan khusus penelitian ini adalah :
1. Melakukan ekstraksi protein sarkoplasma dan miofibril ikan tongkol, kerang hijau dan udang jerbung
2. Mengkarakterisasi protein sarkoplasma dan miofibril ikan tongkol, kerang hijau dan udang jerbung dengan elektroforesis SDS PAGE
4
4. Menguji coba alergenisitas ekstrak protein sarkoplasma dan miofibril ikan tongkol, kerang hijau dan udang jerbung dengan menggunakan serum subyek penderita alergi pangan dengan teknik ELISA dan immunoblotting.
1.4. Manfaat Penelitian
Manfaat yang dapat diambil dari penelitian ini adalah :
1. Memberikan informasi tentang metode ekstraksi protein sarkoplasma dan miofibril dari makanan laut (ikan, udang dan kerang).
2. Memberikan informasi ilmiah tentang sifat alergenisitas 3 jenis bahan pangan yaitu ikan, udang dan kerang-kerangan.
3. Menghasilkan ekstrak protein produk laut yang berpotensi sebagai isolat alergen yang dapat diaplikasikan untuk diagnosis alergi terhadap makanan laut.
1.5. Hipotesis
1. Terdapat protein alergen dalam ekstrak protein fraksi sarkoplasma dan
miofibril ikan tongkol, kerang hijau dan udang jerbung.
2. Komponen yang terdapat dalam kedua fraksi ekstrak protein ikan tongkol,
kerang hijau dan udang jerbung dapat berikatan spesifik dengan IgE dari 20
serum subyek alergi.
3. Jenis komponen yang ada dalam masing-masing ekstrak protein yang dapat
menyebabkan alergi pada setiap orang berbeda-beda.
4. Ekstrak protein yang dihasilkan dapat digunakan sebagai isolat alergen dalam
2.
TINJAUAN PUSTAKA
2.1. Alergi
Istilah alergi dikemukakan pertama kali oleh von Pirquet pada tahun 1906.
Alergi dikenal sebagai reaksi hipersensitivitas dan dapat diartikan sebagai reaksi
imunologi terhadap antigen secara tidak wajar atau tidak tepat pada seseorang
yang sebelumnya pernah terpapar dengan antigen bersangkutan (Kresno 2001).
Secara garis besar, reaksi alergi dapat dibagi menjadi dua golongan yaitu
reaksi tipe cepat (immediate hypersensitivity) dan tipe lambat (delayed type hypersensitivity). Reaksi alergi tipe cepat dimediasi oleh sistem imun humoral (humoral-mediated) yang menunjukkan gejala secara cepat dalam hitungan menit atau jam setelah tubuh terpapar oleh antigen. Reaksi tipe lambat dimediasi oleh sel
(cell-mediated) dan gejala yang ditimbulkan muncul setelah beberapa hari terpapar oleh antigen. Berdasarkan mekanisme terjadinya reaksi, alergi terdiri atas
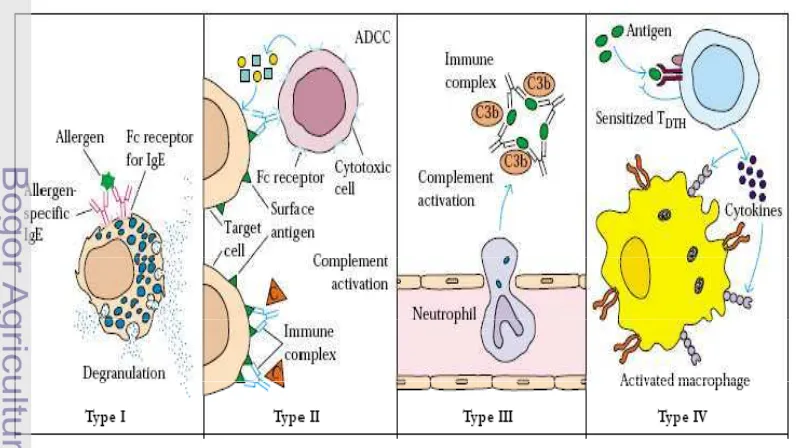
empat jenis yaitu tipe I (IgE-mediated hypersensitivity), tipe II ( Antibody-mediated cytotoxic hypersensitivity), tipe III (Immune complex-mediated hypersensitivity) dan tipe IV (Delayed-type hypersensitivity, DTH). Tipe I hingga III termasuk reaksi alergi tipe cepat, sedangkan tipe IV termasuk reaksi alergi tipe
lambat (Kuby 2007). Mekanisme umum terjadinya beberapa tipe alergi dapat
dilihat pada Gambar 1.
6
Reaksi alergi tipe I terjadi dengan cara alergen memicu sel limfosit B untuk
berubah menjadi sel plasma dan mengeluarkan IgE. IgE ini kemudian terikat
dengan reseptornya pada permukaan sel mastosit dan sel basofil darah. Hal ini
menyebabkan sel mastosit dan basofil mengalami degranulasi dan mengeluarkan
efektor. Reaksi alergi tipe II melibatkan antibodi untuk merusak sel asing.
Mekanisme seperti ini dijalankan dengan mengaktifkan sistem komplemen dan
membentuk lubang pada sel asing. Mekanisme ini juga dapat dijalankan dengan
melibatkan sel sitotoksik dan antiobdi untuk menghancurkan sel asing tersebut.
Pada reaksi alergi tipe III, kompleks imun yang dibentuk oleh antigen dengan
antibodi menjadikan sel fagosit mengenali kompleks imun ini dan menghancurkan
kompleks tersebut. Namun jika kompleks imun yang dibentuk sangat banyak, hal
ini dapat membahayakan jaringan tubuh. Reaksi alergi tipe IV berlangsung
dengan melibatkan pelepasan sitokin. Ketika sel T pembantu mengenali antigen,
sel ini akan mengeluarkan sitokin yang dapat menginduksi terjadinya reaksi
peradangan yang dikenal dengan reaksi alergi yang tertunda. Reaksi ini ditandai
dengan adanya sel penyebab radang seperti sel makrofag dalam jumlah besar
(Kuby 2007).
2.1.1. Alergi Pangan
Alergi yang sering timbul karena konsumsi bahan pangan disebut dengan
alergi pangan. Alergi pangan merupakan reaksi yang merugikan dari makanan
yang didasarkan pada mekanisme imonologi (Houben dan Penninks 1996).
Timbulnya reaksi alergi pangan disebabkan di dalam bahan pangan tersebut
terdapat senyawa penyebab alergi atau lebih dikenal dengan alergen. Alergen
dalam makanan dapat berupa protein, glikoprotein atau polipeptida dengan berat
molekul lebih dari 18.000 dalton, tahan panas dan tahan enzim proteolitik
(Hasyimi et al. 1992).
Reaksi alergi pangan merupakan reaksi hipersensitivitas yang diperantarai
oleh imunoglobulin E (IgE) dan termasuk dalam reaksi alergi tipe I (Adelman et al. 2002). Reaksi alergi tipe I diawali dengan tahap pengenalan, yaitu saat protein alergenik kontak dengan tubuh untuk pertama kalinya. Protein alergenik tersebut
kemudian difagosit dan dihancurkan oleh makrofag menjadi fragmen-fragmen
Antigen-Presenting Cell) melalui MHC II (Major Histocompatibility Complex II). Kemudian sel T helper 1 (Th 1) akan menempel pada kompleks MHC II-fragmen
peptida, sehingga sel Th 1 mensekresikan sitokin yang merangsang proliferasi dan
diferensiasi sel B menjadi sel plasma. Sel plasma inilah yang menghasilkan sel
memori dan IgE. IgE merupakan salah satu anggota imunoglobulin darah yang
berperan dalam reaksi alergi dan infeksi parasit. Molekul IgE yang dihasilkan ini
akan terikat pada reseptor spesifik Fc pada sel mastosit dan basofil pada darah.
Pada pemaparan yang kedua, alergen akan membentuk ikatan dengan IgE yang
menancap pada permukaan sel mastosit dan basofil. Setiap alergen harus dapat
mengikat dua atau lebih molekul IgE (cross linking). Ikatan tersebut menyebabkan terjadinya reaksi-reaksi biokimia, sehingga terjadi degranulasi dalam sel mastosit
dan basofil. Hasil degranulasi adalah terlepasnya mediator alergi yang
sebelumnya telah ada dalam sel seperti histamin, serotonin, kinin, prostaglandin
dan leukotrien. Histamin yang dilepaskan dapat memperlebar pembuluh darah
arteri dan pembuluh darah kapiler, meningkatkan permeabilitas pembuluh kapiler,
dan mempersempit aliran darah pada saluran pernafasan. Mekanisme umum
terjadinya reaksi hipersensitivitas tipe I dapat dilihat pada Gambar 2 (Kuby 2007).
8
Reaksi alergi terhadap susu, kacang-kacangan, ikan, kerang-kerangan,
gandum dan kedelai merupakan alergi pangan yang signifikan terjadi di Amerika
Serikat, namun sejumlah makanan lain juga dapat menyebabkan respon alergi
(Sicherer dan Sampson 2009). Reaksi hipersensitivitas yang timbul karena
konsumsi kerang-kerangan merupakan salah satu bentuk alergi pangan yang
serius. Di Amerika Serikat, lebih dari enam juta orang beresiko memiliki respon
hipersensitif setelah konsumsi kerang (Wild dan Lehrer 2005). Diantara
kerang-kerangan, kepiting diasumsikan menjadi penyebab utama reaksi hipersensitif di
China, terdapat lebih dari 600 jenis kepiting di China. Hasil survey terhadap
status alergi pangan pelajar China mengindikasikan bahwa sekitar 6% subyek
dalam kelompok usia 15-24 tahun menderita sedikitnya menderita alergi pangan,
dan alergenik pangan utamanya adalah makanan laut, termasuk kepiting (Lu et al. 2005).
2.1.2. Alergen dalam makanan
Istilah alergen secara sepesifik mengacu pada antigen nonparasit yang
mampu menstimulasi respon hipersensitivitas tipe I pada individu atopik.
Beberapa individu yang cinderung lebih mudah mengalami reaksi
hipersensitivitas tipe I jika terpapar oleh antigen atau alergen, disebut dengan
atopik. Respon abnormal IgE pada individu atopik sebagian karena genetik, yang
diturunkan dari keluarga (Kuby 2007).
Makanan tersusun dari karbohidrat, protein dan lemak. Alergen yang utama
dalam makanan merupakan protein, glikoprotein atau polipeptida dengan berat
molekul yang berkisar dari 10.000 dan 60.000 D, larut air, tahan panas dan tahan
enzim proteolitik (Adelman et al. 2002). Alergen pangan biasanya hanya sebagian kecil dari keseluruhan protein yang terdapat dalam makanan. Protein dari jenis
makanan seperti telur, susu sapi, kacang-kacangan, gandum, makanan laut (ikan,
kerang-kerangan, lobster dan udang) dan jenis makanan lain seperti kentang, apel,
kacang polong dapat menjadi penyebab terjadinya alergi atau reaksi hipersensitif
tipe I ( Kuby 2007).
Protein alergen pada tiap individu berbeda-beda. Perbedaan ini disebabkan
karena reaksi alergi merupakan interaksi antara protein dan sistem imun yang sulit
dimilikinya (Huby et al. 2000). Epitop merupakan bagian molekul alergen yang berikatan dengan antibodi IgE dan menentukan spesifitas reaksi protein alergen
dan antibodi IgE. Jumlah epitop pada satu molekul alergen berbeda dengan
jumlah epitop pada alergen yang lain (Kresno 2001).
Berbagai penelitian membuktikan bahwa suatu alergen sedikitnya harus
memiliki 2 epitop, yang masing-masing memiliki sekitar 15 residu asam amino.
Hal ini menunjukkan bahwa protein alergen minimal mengandung sekitar 30
residu asam amino (BM sekitar 3 kDa). Sebagai contoh, alergen kacang Ara h 1
dan Ara h 3 memiliki sedikitnya 23 dan 4 epitop, sedangkan alergen kedelai Gly
m Bd memiliki 16 epitop (Huby et al. 2000).
Suatu alergen yang mampu bereaksi dengan 50% IgE serum individu
penderita alergi disebut dengan alergen mayor. Alergen minor hanya dapat
bereaksi dengan 10% IgE serum atau bahkan tidak begitu kuat untuk
menyebabkan alergi. Contoh alergen mayor antara lain β-laktalbumin, kasein, α -laktalbumin susu dan antigen I, antigen II pada udang. Laktoferin,
laktoperoksidase, alkalifosfatase dan katalase susu merupakan jenis protein yang
tergolong sebagai alergen minor (Bush dan Hefle 1996).
Protein alergen pertama masuk ke dalam tubuh melalui intestinal. Dalam hal
ini, protein alergen memiliki ketahanan terhadap kondisi asam dalam lambung
serta enzim protease dalam saluran pencernaan seperti tripsin, kimotripsin dan
pepsin. Hal tersebut dikarenakan sebagian besar alergen mempunyai epitop
kontinyu yang dapat tahan terhadap panas dan sistem pencernaan seperti garam
empedu, asam dan enzim proteolitik. Namun demikian, jika saluran pencernaan
sesorang dalam kondisi sehat dan dapat mencerna makanan dengan sempurna,
alergen yang merupakan peptida ini tidak akan terserap oleh usus halus sehingga
tidak akan menyebabkan alergi walaupun secara genentik orang tersebut memiliki
riwayat alergi. Alergen dapat terserap jika pada dinding usus halus seseorang
terdapat lubang yang memungkinkan alergen masuk. Pembentukan lubang ini
dapat disebabkan oleh cacing, bakteri atau bahan kimia. Oleh karena itu, kelainan
genetik saja tidak cukup untuk menjelaskan terjadinya reaksi alergi. ada
kecinderungan bahwa faktor lingkungan juga mempunyai pengaruh penting dalam
10
2.1.3. Deteksi Alergi
Alergi tipe I umumnya dapat dideteksi dengan melalui uji tusuk kulit. Uji ini
dilakukan dengan menggunakan ekstrak alergen dan cairan kontrol diteteskan
pada permukaan volar lengan bawah. Bagian superfisial kulit ditusuk
menggunakan jarum khusus tanpa berdarah. Untuk setiap alergen harus digunakan
jarum yang berbeda untuk menghindari tercampurnya cairan uji. Dalam
melakukan uji tusuk kulit, sebagai kontrol positif dipakai histamin dan untuk
kontrol negatif dipakai bahan pelarut (Mygind et al. 1994). Tes dibaca setelah 15 menit, reaksi positif dinyatakan adanya kemerahan dan bentol pada kontrol positif
histamin dengan minimal diameter 3 mm lebih besar dibanding dengan kontrol
negatif. Keunggulan uji tusuk kulit adalah sederhana, pembacaan dapat dilakukan
dengan cepat, mempunyai sensitifitas dan spesifisitas yang tinggi serta dapat
menguji sejumlah besar alergen sekaligus (Rusznak & Davies 1998; Jarvis &
Burney 2004).
Uji lain yang dapat digunakan untuk diagnosa alergi adalah uji oral double blind challange. Uji ini dilakukan untuk memastikan makanan penyebab alergi pada pasien dalam keadaan puasa. Metode dilakukan dengan cara pemberian
makanan yang mengandung alergen dalam bentuk kapsul dengan dosis yang
dinaikkan secara bertahap, lalu ditunggu reaksinya dengan interval 15-30 menit.
Pengujian biasanya membutuhkan waktu 4-8 jam. Uji ini membutuhkan tenaga
ahli yang terampil dan berpengalaman (Groce 2007). Selain itu, juga masih
banyak uji yang dapat dilakukan untuk mengetahui penyebab alergi diantaranya
yaitu analisa total IgE, analisis IgE spesifik, uji degranulasi basofil dan mastosit,
uji pelepasan histamin dan uji permeabilitas intestinal.
2.2. Makanan Laut Penyebab Alergi
Di seluruh dunia, makanan laut berupa ikan, udang dan kerang-kerangan
memiliki peranan penting dalam zat gizi manusia. Namun, makanan laut juga
merupakan alergen yang kuat pada individu yang sensitif dan menyebabkan reaksi
alergi. Alergi pangan karena makanan laut paling mudah terdeteksi karena gejala
yang ditimbulkan relatif cepat. Biasanya kurang dari 8 jam keluhan alergi sudah
bisa dikenali. Jenis makanan laut yang sering mengakibatkan gangguan adalah
Ikan laut yang agak besar seperti salmon, tuna dan sebagainya relatif lebih ringan.
Klasifikasi makanan laut utama yang dapat menyebabkan reaksi alergi dapat
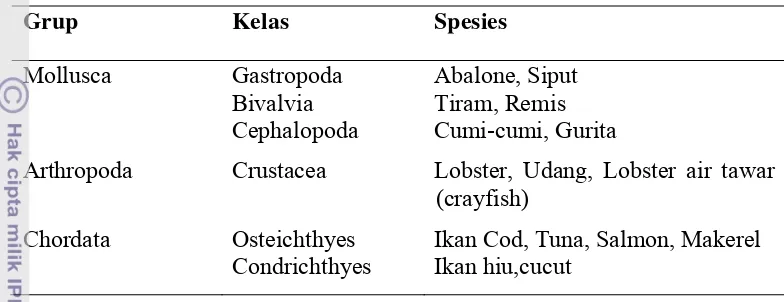
dilihat pada Tabel 1 dibawah (ALLSA 2008).
Tabel 1. Klasifikasi makanan laut penyebab alergi (ALLSA 2008)
Grup Kelas Spesies
Arthropoda Crustacea Lobster, Udang, Lobster air tawar (crayfish)
Chordata Osteichthyes Condrichthyes
Ikan Cod, Tuna, Salmon, Makerel Ikan hiu,cucut
Kelompok crustacea dan moluska merupakan janis pangan yang paling
sering menyebabkan reaksi hipersensitif yang diperantarai oleh antibodi IgE, yang
menimbulkan gejala alergi berupa urtikaria (gatal di kulit), angiodema, asma atau
kombinasi dari beberapa gejala tersebut (Motoyama et al. 2006).
Penelitian Clark et al. (2004) menunjukkan bahwa alergen ikan laut dapat mengakibatkan terjadinya 10% reaksi anafilaksis. Sifat alergi dari protein ikan
dipengaruhi oleh kondisi fisiologis lambung, terutama pada individu yang sensitif
terhadap jenis pangan ini (Untersmayr et al. 2005).
Protein ikan berdasarkan kelarutannya dibagi menjadi 3 jenis yaitu protein
sarkoplasma, protein miofibril dan protein stroma. Protein sarkoplasma berisi
beberapa jenis protein yang larut air dan dapat diekstrak dengan larutan garam
berkekuatan ion rendah. Protein miofibril merupakan protein yang dapat
diekstrak dengan larutan garam dengan kekuatan ion tinggi. Protein stroma
merupakan jenis protein yang tidak larut baik dalam larutan garam, asam maupun
basa. Protein miofibril merupakan bagian terbesar dari protein ikan yaitu sekitar
66-77% dari total protein ikan. Protein sarkoplasma terdapat dalam jumlah sekitar
10% dari total protein ikan, sedangkan protein stroma berkisar antara 3-5%.
Kandungan protein sarkoplasma dalam daging ikan bervariasi tergantung jenis
ikan. Pada umumnya ikan pelagik mempunyai kandungan sarkoplasma lebih besar
12
2.2.1. Ikan Tongkol
Ikan merupakan salah satu diantara delapan jenis pangan penyebab alergi
dan menempati urutan kedua terpenting setelah telur (Lopata dan Potter 2000).
Beberapa jenis ikan terutama ikan laut yang paling umum menyebabkan alergi
pangan diantaranya berasal dari famili Scombridae yaitu ikan tuna, tongkol,
cakalang, tenggiri, kembung. Selain itu juga ikan teri, ikan cod, kerapu, marlin,
salmon, sarden, hiu dan kakap (CFIA 2010).
Ikan tongkol merupakan salah satu famili Scombridae, bagian dari ikan
konsumsi penting di Indonesia. Dapat tumbuh sampai 1 meter dengan berat
maksimal 14 kg. merupakan ikan pelagis yang hidup di pantai sampai laut lepas
dengan kedalaman 200 meter (Kuncoro dan Wiharto 2009). Klasifikasi ikan
tongkol (Auxis thazard) adalah sebagai berikut (Saanin 1984) : Filum : Chordata
Subfilum : Vertebrata
Kelas : Teleostei
Subkelas : Actinopterygi
Ordo : Perciformes
Subordo : Scombroidea
Famili : Scombridae
Genus : Auxis
Spesies : Auxis thazard
Komposisi protein daging putih ikan mackerel yang juga merupakan famili
Scombridae terdiri dari 33-37% protein sarkoplasma, 59-61% protein miofibril
dan 1-2% protein stroma (Hashimoto et al. 1979). Hasil penelitian Benjakul et al. (2001) terhadap komposisi protein miofibril dari dua jenis ikan bigeye snapper
(Priacanthus tayenus dan Priacanthus macracanthus) memberikan hasil yang mirip, yaitu berkisar antara 44-45% dari total protein. Hasil elektroforesis fraksi
protein miofibril dari kedua jenis spesies memperlihatkan band protein yang
merupakan miosin rantai panjang, aktin, troponin, tropomiosin dan juga miosin
rantai panjang.
Hasil penelitian menunjukkan bahwa jenis alergen mayor pada ikan cod
protein sarkoplasma yang berikatan dengan kalsium dengan berat molekul sekitar
12 kDa (Elsayed dan Aas 1971 dalam Hamada et al. 2003). Selain itu juga diketahui adanya alergen minor pada beberapa jenis ikan lain melalui teknik
immunoblotting dan salah satunya telah dimurnikan dan diidentifikasi sebagai kolagen (Hamada et al. 2001).
2.2.2. Kerang Hijau
Kerang hijau merupakan salah satu jenis sumber daya laut yang memiliki
nilai ekonomis penting. Kerang ini tergolong dalam filum Mollusca. Daging segar
kerang hijau umumnya sangat lunak, berwarna putih atau oranye mengkilap dan
berair. Presentase daging kerang hijau lebih besar dibandingkan dengan jenis
kerang-kerangan lainnya, seperti kerang darah dan kerang bulu. Berikut ini
adalah klasifikasi kerang hijau (Perna viridis) berdasarkan NIMPIS (2002) : Filum : Mollusca
Kelas : Bivalvia
Sub kelas : Pteriomorphia
Ordo : Mytiloida
Famili : Mytilidae
Genus : Perna Spesies : Perna viridis
Beberapa alergen dari moluska adalah Tod p 1 dalam cumi-cumi, Hal m1 dalam abalone, Cra g 1 dalam tiram telah dikarakterisasi dengan menggunakan teknik biokimia. Leung et al. (1996) menyatakan bahwa suatu protein 38 kDa diidentifikasi sebagai tropomiosin yang juga ditemukan sebagai alergen pada
berbagai spesies moluska.
Tropomiosin ditetapkan sebagai penyebab alergi utama dan merupakan
alergen yang umum ditemukan pada penelitian alergen kerang. Tropomiosin dari
beberapa spesies telah diklon dan disekuen dan epitop mayor yang berikatan
dengan IgE telah diidentifikasi. Tropomiosin dikenal sebagai alergen yang
menyebabkan reaksi silang yang terdapat pada otot dan sel-sel lain dari kerang
tersebut (Leung et al. 1996).
Beberapa bivalvia terbukti memiliki minimal 2 bentuk tropomiosin, namun
14
M.galloprovincialis (Fujinoki 2006) yang memiliki identitas 100% asam amino daripada kerang biru (M.edulis) (Taylor 2008). Beberapa alergen selain tropomiosin telah ditemukan dalam spesies moluska lain namun belum
teridentifikasi secara rinci. Alergen ini diusulkan sebagai hemosianin, miosin
rantai panjang dan amilase (Taylor 2008). Adanya alergen selain tropomiosin
pada spesies moluska menunjukkan bahwa alergen lain juga mungkin ada dalam
kerang juga. Serum pasien yang mempunyai alergi terhadap udang bereaksi juga
dengan band kedua dari kerang hijau Asia (P.viridis) (Leung et al. 1996).
2.2.3. Udang Jerbung
Salah satu spesies dari famili Penaeidae yang bernilai ekonomis tinggi dan
tersebar luas hampir di seluruh Indonesia adalah udang jerbung (Penaeus merguiensis). Seperti hewan laut lainnya, dua komponen yang dominan pada udang adalah air dan protein. Protein udang juga terdiri dari protein sarkoplasma,
miofibril dan stroma (Suzuki 1981). Penelitian Sriket et al. (2007) terhadap dua jenis udang Penaeus monodon dan Penaeus vannamei menunjukkan bahwa komponen protein utama adalah miofibril yang terdiri dari aktindan myosin heavy chain (MHC). Perbedaan kandungan protein miofbril, sarkoplasma dan stroma dari jenis udang putih (P.vannamei) dan udang P.monodon disebabkan karena perbedaan sifat dan karakteristik dari kedua jenis spesies udang tersebut.
Udang jerbung memiliki klasifikasi sebagai berikut (Racek dan Dall 1965
dalam Naamin et al. 1992) : Filum : Arthropoda
Subfilum : Crustacea
Kelas : Malacostraca
Ordo : Decapoda
Famili : Penaeidae
Genus : Penaeus
Spesies : Penaeus merguiensis
Dari sejumlah pangan penyebab alergi, kelompok udang-udangan ditetapkan
menjadi salah satu penyebab utama terjadinya alergi pangan yang dikarenakan
yang ditetapkan oleh organisasi kesehatan dunia dan merupakan jenis pangan
yang banyak disukai karena rasa dan nilai gizinya yang tinggi (Yu et al. 2011). Telah banyak penelitian yang dilakukan untuk mengetahui jenis alergen
utama dari udang-udangan, seperti yang dikemukakan dalam penelitian
Motoyama et al. (2007), alergen utama pada kelompok udang adalah tropomiosin, yaitu suatu protein miofibril 35-38 kDa yang terdapat di dalam kontraksi otot.
Pengujian alergenisitas terhadap ekstrak protein udang putih (Penaeus merguensis) menunjukkan bahwa ekstrak protein baik fraksi sarkoplasma dan miofibril mampu menimbulkan terjadinya reaksi alergi pada subyek penderita
alergi (Ispurwanto 1998).
2.3. SDS PAGE (Sodium Dodecyl Sulfate-Polyacrilamide Gel Electrophoresis) Elektroforesis merupakan metode yang sering digunakan untuk memisahkan
fraksi-fraksi suatu zat berdasarkan muatannya dengan memanfaatkan medan
listrik. Migrasi fraksi-fraksi tersebut dipengaruhi oleh ukuran, bentuk, serta
muatan fraksi (Walsh 2001)
Proses pemisahan fraksi-fraksi protein umumnya menggunakan gel
poliakrilamida sebagai media elektroforesis atau sering disebut sebagai PAGE
(Polyacrilamide Gel Electrophoresis). Keunggulan penggunaan gel poliakrilamida pada proses elektroforesis adalah karena bersifat inert, tidak
bereaksi dengan sampel, tidak bermuatan, stabil pada kisaran pH yang luas, dan
transparan sehingga pengamatan terhadap pita-pita protein mudah dilakukan.
Selain itu, ukuran pori-pori gel poliakrilamida juga dapat diatur sesuai
dengan molekul yang akan dipisahkan. Semakin kecil ukuran molekul yang akan
dipisahkan, maka semakin tinggi konsentrasi poliakrilamida yang digunakan dan
sebaliknya. Umumnya protein dengan kisaran BM 24-205, 14-205 dan 14-66 kDa
berturut-turut baik dipisahkan oleh gel poliakrilamida 8%, 10% dan 12% (Bollag
dan Edelstein 1991).
SDS-PAGE merupakan modifikasi PAGE, yaitu proses elektroforesis yang
menggunakan sampel terdenaturasi serta mempunyai muatan negatif. Denaturasi
protein dapat dilakukan dengan pemberian β-merkaptoetanol sebagai denaturan yang memecah ikatan disulfida. Denaturasi protein juga dapat dilakukan melalui
16
menyebabkan polipeptida bermuatan negatif sehingga sampel akan tertarik
menuju elektroda positif. Polipeptida berukuran lebih kecil akan bermigrasi lebih
cepat dibandingkan polipeptida yang berukuran lebih besar (Walsh 2001).
Penggunaan teknik SDS-PAGE untuk identifikasi jenis protein alergen telah
banyak dilakukan. Sahabudin et al. (2011) melaporkan bahwa analisis ekstrak protein udang Penaeus monodon menghasilkan 23 band protein dengan berat molekul berkisar 15-200 kDa. Misnan et al. (2005) mengkarakterisasi ekstrak protein ikan tenggiri (Scomberomorus commerson) dengan elektroforesis SDS-PAGE dan menghasilkan 26 band protein dengan berat molekul 11-175 kDa.
Karakterisasi ekstrak protein udang putih (Penaeus merguensis) menunjukkan bahwa protein sarkoplasma terdiri dari 11 jenis protein (17-75 kDa) dan protein
miofibril terdiri dari 11 jenis protein dengan berat molekul berkisar 16-81 kDa.
2.4. ELISA(Enzyme Linked Immunosorbent Assay)
ELISA atau enzyme linked immunosorbent assay merupakan teknik immunoassay yang digunakan untuk mendeteksi atau mengkuantifikasi suatu senyawa dasar dalam reaksi imunologi (Kemeny 1991). Pada awalnya, ELISA
hanya digunakan dalam bidang imunologi untuk mendeteksi keberadaan antigen
maupun antibodi dalam suatu sampel seperti dalam pendeteksian antibodi IgM,
IgG dan IgA pada saat terjadi infeksi pada tubuh manusia khususnya. Namun
seiring dengan perkembangan ilmu pengetahuan, teknik ELISA juga digunakan
untuk bidang-bidang lainnya (Fossceco et al. 2007).
Penerapan teknik ELISA meliputi lima komponen dasar yaitu lempeng
padat, adsorbsi ke lempeng padat, penyangga dan larutan pencuci, konjugat enzim
dan substrat serta pembacaan hasil dari lempeng mikrotiter. Komponen yang
paling umum digunakan dalam ELISA adalah lempeng padat. Bahan yang
diperlukan untuk membuat lempeng padat berasal dari gelas atau plastik. Diantara
kedua bahan tersebut plastik lebih umum digunakan dibanding bahan yang terbuat
dari gelas. Pemakaian lempeng padat bertujuan untuk meletakkan antigen maupun
antibodi. Malcolm (1995) menerangkan bahwa antigen atau antibodi secara pasif
dapat menempel pada permukaan lempeng padat. Sementara komponen
penyangga (buffer) dan larutan pencuci merupakan komponen yang berpengaruh
Larutan pencuci biasanya mengandung deterjen yang ditujukan untuk
mengurangi reaksi-reaksi pengikatan non spesifik. Adapun konjugat enzim
merupakan komponen yang akan diikatkan pada antibodi indikator. Konjugat
enzim ini akan memecah substrat sehingga reaksi dapat dideteksi dengan melihat
perubahan warna yang terjadi. Komponen dasar yang terakhir adalah pembacaan
hasil ELISA, yang utamanya berkaitan dengan pemilihan panjang gelombang
yang sesuai. Panjang gelombang primer harus bertepatan dengan absorbansi
puncak (Burgess 1995).
Beberapa keunggulan teknik ELISA dibandingkan uji-uji imunologi yang
lain antara lain, ELISA mengukur lebih cepat, tidak menghasilkan limbah
radioaktif sehingga tidak membahayakan kesehatan, mudah diotomatisasi,
ekonomis dan cukup sensitif dengan reagen yang memiliki umur simpan panjang
serta dapat dibaca dengan spektrofotometer biasa (Kresno 2001).
Hamada et al. (2003) melakukan pengujian reaktivitas IgE serum subyek penderita alergi ikan dengan protein ikan Evynnis japonica menggunakan ELISA. Hasilnya menunjukkan bahwa protein parvalbumin (12 kDa) memiliki reaktivitas
paling kuat dengan IgE serum dibandingkan dengan protein lain. Menggunakan
teknik ELISA, Shriver et al. (2011) melaporkan bahwa perlakuan Pulsed Ultraviolet Light (PUV) menurunkan reaktivitas alergen mayor tropomiosin yang terdapat dalam ekstrak udang putih (Litopenaeus setiferus) dan dapat menurunkan kapasitas pengikatan terhadap IgE serum.
2.5. Immunoblotting
Suatu modifikasi dari prinsip imunoelektroforesis adalah teknik yang
disebut immunoblotting. Salah satu metode yang populer dari immunoblotting adalah western blotting. Western blotting biasanya digunakan untuk menentukan kadar relatif dari suatu protein dalam suatu campuran berbagai jenis protein atau
molekul lain. Metode ini menggabungkan selektivitas elektroforesis gel dengan
spesifitas immunoassay, sehingga setiap jenis protein dapat dideteksi dan dianalisis dengan menggunakan probe antibodi yang sesuai (Kresno 2001).
Proses pemindahan protein dari matriks gel ke suatu membran nitroselulosa dan
18
Dalam uji ini, protein-protein dalam campuran akan dipisahkan satu dengan
yang lain dengan cara elektroforesis gel, khususnya cara sodium dodecyl sulfate polyacrilamide gel electrophoresis (SDS-PAGE). Posisi akhir setiap jenis protein dalam gel poliakrilamida setelah elektroforesis dihentikan sesuai dengan berat
molekul masing-masing. Protein-protein yang telah dipisahkan satu dengan yang
lain itu kemudian dipindahkan dari gel ke suatu membran pendukung melalui
proses kapiler (blotting) sedimikian rupa sehingga membran tersebut mendapatkan replika dari susunan makromolekul seperti yang terdapat pada gel.
Posisi antigen yang dicari dapat diidentifikasi pada membran dengan
mereaksikannya dengan antibodi spesifik yang bertanda atau dilabel dengan
radioisotop atau enzim (Abbas et al. 2000).
Pita protein (misalnya, protein alergen) yang tercetak dalam membran
nitroselulosa dapat diidentifikasi dengan menginkubasi membran dalam serum
darah pasien yang positif alergi, sehingga protein tersebut akan berikatan spesifik
dengan IgE. Interaksi tersebut dapat terlihat setelah membran direaksikan dengan
substrat yang dapat berpendar, sedangkan bobot molekulnya diketahui dari
migrasinya pada gel SDS-PAGE (Rybicki et al. 1996).
Beberapa jenis alergen ikan berhasil diidentifikasi menggunakan teknik
imunoblotting diantaranya Gad c 1, yaitu protein parvalbumin12 kDa dari ikan
cod (Lopata dan Potter 2001), kolagen dengan berat molekul ~100 kDa (Hamada
Penelitian ini dilaksanakan dari bulan April – November 2011 di
laboratorium Biokimia Pangan Departemen Ilmu dan Teknologi Pangan IPB,
laboratorium Bioteknologi SEAFAST IPB dan Laboratorium Parasitologi Balai
Veteriner Bogor.
3.2. Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah ikan tongkol
(Auxis thazard), kerang hijau (Perna viridis) dan udang jerbung (Penaeus merguiensis) yang diperoleh segar dari pasar ikan Muara Angke, Jakarta Utara. Selain itu juga digunakan serum darah manusia dari 20 subyek penderita alergi
dan satu subyek normal yang tidak memiliki riwayat alergi.
Bahan-bahan kimia yang digunakan adalah bufer fosfat pH 7.5, KCl bufer
fosfat pH 7.5, aprotinin/inhibitor proteinase (Sigma), tris buffer pH 8.8 dan pH
6.8, amonium persulfat (APS), β-merkaptoethanol, TEMED, akrilamida, N,N’ bis akrilamida, SDS (Sodium Dodesil Sulfat), commasie brilliant blue G-200, commasie brilliant blue R-250, asam fosfat, glisin, etanol 95%, metanol, asam asetat glasial, bufer karbonat bikarbonat pH 9.6, Tween 20, BSA (Serum Albumin
Sapi) fraksi V (Sigma), susu bubuk skim, standar low molecular weight protein (LMW) yang mengandung 7 jenis protein standar (Fermentas®), antibodi sekunder
(ICL Lab) yaitu antibodi anti IgE manusia berlabel enzim HRP (Horse Radish Peroxidase), substrat DAB (3,3´-diaminobenzidine tetrahydrochloride), substrat TMB (3,3′,5,5′-Tetramethylbenzidine) dan bahan-bahan penunjang yang lain.
20
3.3. Metode Penelitian
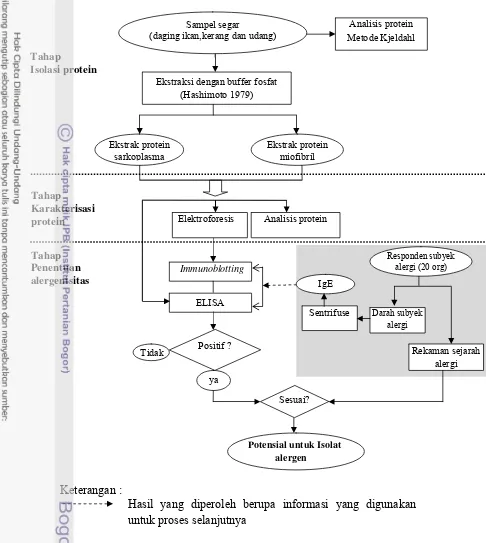
Secara umum, penelitian ini dibagi menjadi tiga tahap. Tahap pertama yaitu
isolasi protein sampel melalui ekstraksi protein sarkoplasma dan miofibril dari
sampel ikan tongkol, udang jerbung dan kerang hijau. Tahap kedua adalah
karakterisasi ekstrak protein sarkoplasma dan miofibril dengan SDS-PAGE dan
tahap ketiga dengan menguji alergenisitas protein sampel dengan menggunakan
serum subyek penderita alergi dengan teknik immunoblotting dan ELISA. Ringkasan alur penelitian dapat dilihat pada Gambar 3.
Sampel hasil laut segar (ikan tongkol, kerang hijau dan udang jerbung)
terlebih dahulu diuji kadar protein awalnya dengan metode Kjedahl. Selanjutnya
dilakukan tahapan isolasi protein sampel melalui ekstraksi daging ikan, udang dan
kerang dengan penambahan bufer fosfat dan dihomogenisasi dengan blender.
Ekstraksi dengan bufer fosfat dilakukan untuk pemisahan protein sarkoplasma dan
miofibril. Fraksi protein sarkoplasma dihasilkan dari proses ekstraksi dengan
kekuatan ion yang lebih rendah, yaitu bufer fosfat pada pH 7.5 dengan kekuatan
ion 0.05. Fraksi protein miofibril diperoleh melalui ekstraksi dengan bufer fosfat
pH 7.5 dan kekuatan ion 0.5. Kemudian dilakukan penentuan kadar protein
ekstrak sampel dengan metode Bradford dan dikrakterisasi dengan teknik
elektroforesis SDS-PAGE untuk mengetahui berat molekul protein yang
diekstrak. Gel hasil elektroforesis ini kemudian akan digunakan untuk pengujian
alergenisitas dengan teknik immunoblotting, dengan dipindahkan dalam suatu membran nitroselulosa.
Uji alergenisitas ekstrak protein (ikan tongkol, kerang hijau dan udang
jerbung) dilakukan dengan metode immunoblotting dan ELISA menggunakan serum subyek penderita alergi pangan. Penentuan subyek alergi melalui
wawancara langsung seputar alergi yang diderita subyek. Dari 20 subyek
penderita alergi pangan dan satu subyek normal, dilakukan pengambilan darah
sebanyak 20 ml dan dilakukan melalui koordinasi dengan klinik terdekat di daerah
Dramaga Bogor. Kemudian darah yang telah diperoleh dilakukan sentrifuse untuk
memisahkan serum dari plasma darah. Serum yang terpisah dikumpulkan dan
disimpan pada suhu beku -20°C. Serum ini digunakan sebagai sumber antibodi
Keterangan :
Hasil yang diperoleh berupa informasi yang digunakan untuk proses selanjutnya
Gambar 3. Diagram alir penelitian Sampel segar
(daging ikan,kerang dan udang)
Analisis protein Metode Kjeldahl
22
3.3.1. Analisis Kadar Protein Metode Kjeldahl (AOAC 1995)
Kadar protein awal sampel sebelum dilakukan ekstraksi ditentukan dengan
menggunakan metode Kjedahl. Sejumlah sampel (100-250 mg) ditimbang ke
dalam labu Kjedahl. Kemudian ditambahkan 1.9±0.1 g K2SO4, 40±10 mg HgO
dan 2±0.1 mL H2SO4. Sampel didihkan selama 1-1.5 jam dengan kenaikan suhu
secara bertahap sampai cairan menjadi jernih, lalu didinginkan. Sejumlah kecil
akuades diteteskan perlahan lewat dinding labu kemudian labu digoyang pelan
agar kristal yang terbentuk larut kembali. Isi labu kemudian dipindahkan ke dalam
alat destilasi dan labu dibilas 5-6 kali dengan 1-2 mL akuades. Lalu ditambahkan
8-10 mL larutan 60% NaOH- 5% Na2S2O3 ke dalam alat destilasi. Erlenmeyer
berisi 5 mL H3BO3 dan 2 tetes indikator metilen red-metilen blue diletakkan di
bawah kondensor dengan kondisi ujung kondesor terendam di bawah larutan
H3BO3. Destilasi dilakukan hingga diperoleh destilat sebanyak ± 15 mL. Destilat
yang diperoleh selanjutnya diencerkan hingga ± 50 mL dan dititrasi dengan HCl
terstandar sampai terjadi perubahan warna menjadi abu-abu keunguan.
Perhitungan kadar protein sesuai dengan persamaan dibawah berikut.
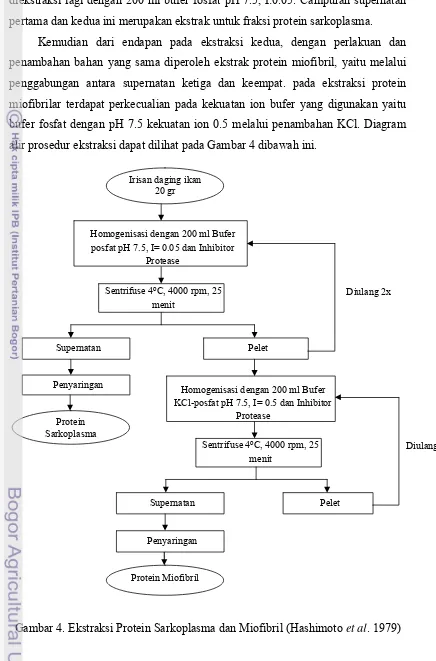
3.3.2. Isolasi Protein Sampel (Hashimoto et al. 1979)
Tahapan iolasi protein sampel dilakukan dengan ekstraksi fraksi
sarkoplasma dan miofibril dari ikan tongkol, kerang hijau dan udang jerbung
dilakukan berdasarkan metode Hashimoto et al. (1979).
Masing-masing sampel daging segar berupa ikan, kerang dan udang,
sebanyak 20 gram dipersiapkan bersama dengan penambahan 200 ml bufer fosfat
diekstraksi lagi dengan 200 ml bufer fosfat pH 7.5, I:0.05. Campuran supernatan
pertama dan kedua ini merupakan ekstrak untuk fraksi protein sarkoplasma.
Kemudian dari endapan pada ekstraksi kedua, dengan perlakuan dan
penambahan bahan yang sama diperoleh ekstrak protein miofibril, yaitu melalui
penggabungan antara supernatan ketiga dan keempat. pada ekstraksi protein
miofibrilar terdapat perkecualian pada kekuatan ion bufer yang digunakan yaitu
bufer fosfat dengan pH 7.5 kekuatan ion 0.5 melalui penambahan KCl. Diagram
alir prosedur ekstraksi dapat dilihat pada Gambar 4 dibawah ini.
Gambar 4. Ekstraksi Protein Sarkoplasma dan Miofibril (Hashimoto et al. 1979) Irisan daging ikan
20 gr
Sentrifuse 4ºC, 4000 rpm, 25 menit
Homogenisasi dengan 200 ml Bufer posfat pH 7.5, I= 0.05 dan Inhibitor
Protease
Pelet Supernatan
Diulang 2x
Homogenisasi dengan 200 ml Bufer KCl-posfat pH 7.5, I= 0.5 dan Inhibitor
Protease
Sentrifuse 4ºC, 4000 rpm, 25 menit
Supernatan Pelet
Penyaringan
Protein Sarkoplasma
Penyaringan
Protein Miofibril
24
3.3.3. Analisis Kadar Protein Metode Bradford (Bradford 1976)
Penentuan kadar protein ekstrak sarkoplasma dan miofibril dilakukan
dengan metode Bradford menggunakan serum albumin sapi (BSA) sebagai
standar. Sampel (filtrat ekstrak protein) direaksikan dengan pewarna coomasie briliant blue sebagai komponen utama pereaksi bradford.
Pereaksi Bradford dibuat dengan melarutkan 100 mg coomasie briliant blue G-200 ke dalam 50 ml etanol 95%. Kemudian ditambahkan 100 ml asam fosfat
85% (w/v) dan volume akhir larutan dibuat menjadi 1 liter, lalu disaring.
Standar dibuat dengan melarutkan 100 mg serum albumin sapi (BSA) ke
dalam 50 ml air destilata, kemudian diencerkan sampai volumenya mencapai 100
ml (konsentrasi 1 mg/ml). Dari konsentrasi 1 mg/ml, dibuat satu seri pengenceran
larutan standar.
Untuk penetapan protein diperlukan sebanyak 0,1 ml larutan standar dari
masing-masing seri konsentrasi, 0,1 ml sampel dan 0,1 ml air destilata sebagai
blanko. Ke dalam masing-masing larutan, ditambahkan 5 ml pereaksi bradford.
Setelah didiamkan selama 5 menit, larutan dibaca absorbansinya pada panjang
gelombang 595 nm. Konsentrasi protein ditentukan berdasarkan kurva standar
serum albumin sapi (BSA).
3.3.4. Penentuan Karakteristik Ekstrak Protein dengan Elektroforesis SDS-PAGE (Laemmli 1970)
Elektroforesis SDS-Polyacrylamide Gel Electrophoresis (SDS-PAGE)
dilakukan dengan metode Laemmli (1970), untuk menentukan berat molekul
protein ekstrak protein sampel. Analisis SDS-PAGE dilakukan menggunakan gel
akrilamid dengan konsentrasi separating gel 12% dan stacking gel 5%. Sampel yang dielektroforesis adalah ekstrak protein sarkoplasma dan miofibril hasil
ekstraksi dari sampel ikan tongkol, udang jerbung dan kerang hijau. Beberapa
tahapan utama yang harus dilakukan dalam melakukan elektroforesis SDS-PAGE
adalah 1) pembuatan separating gel, 2) pembuatan stacking gel, 3) persiapan sampel, 4) running gel, 5) pewarnaan gel, 6) destaining gel, dan 7) penentuan
berat molekul protein-protein yang terpisahkan. Pembuatan larutan stok dan
a. Pembuatan separating gel
Dua lempengan kaca (mini slab) yang akan digunakan sebagai cetakan gel dirangkai sesuai dengan petunjuk pemakaian. Sebanyak 4 ml larutan A dipipet
ke dalam gelas piala, kemuadian ditambakan 2.5 ml larutan B dan 3.5 ml
akua-biodestilat. Campuran kemuadian diaduk perlahan dengan
menggoyangkan gelas piala. Selanjutnya, sebanyak 50 µl APS 10% dan 5 µl
TEMED ditambahkan ke dalam campuran dan diaduk kembali dengan
perlahan. Campuran dimasukkan ke dalam lempengan kaca (mini slab) tanpa menimbulkan gelembung udara dengan menggunakan mikro pipet sampai
sekitar 1 cm dari atas lempengan. Bagian yang tidak diisi gel diberi akuades
untuk meratakan gel yang terbentuk. Gel kemudian dibiarkan mengalami
polimerisasi selama 30-60 menit.
b. Pembuatan stacking gel
Air dibuang dari atas separating gel dan dikeringkan dengan menggunakan tissue. Akua-biodestilat, larutan A dan larutan C masing-masing sebanyak
0.67 ml dan 1.0 ml dicampurkan ke dalam gelas piala dan diaduk perlahan
dengan cara menggoyangkan gelas piala. Selanjutnya, sebanyak 30 µl APS
10% dan 5 µl TEMED ditambahkan ke dalam campuran dan diaduk kembali
dengan perlahan. Campuran dimasukkan ke dalam mini slab, kemudian sisir
dimasukkan dengan cepat tanpa menimbulkan gelembung udara. Stacking gel dibiarkan mengalami polimerisasi selama 30-60 menit. Setelah gel
berpolimerisasi, sisir diangkat dari atas gel dengan perlahan dan slab
ditempatkan ke dalam wadah elektroforesis. Bufer elektroforesis dimasukkan
ke dalam wadah elektroforesis di bagian dalam dan luar agar gel terendam.
c. Preparasi dan injeksi sampel
Sebanyak 40 µl sampel dimasukkan tabung Eppendorf dan ditambahkan 10 µl
bufer sampel. Tabung kemudian dipanaskan selama 5 menit dalam air
mendidih 100°C. Sampel kemudian siap diinjeksikan ke dalam sumur
menggunakan mikropipet sebanyak 10 µl. Salah satu sumur diinjeksikan
26
d. Running SDS-PAGE
Katup elektroda dipasang dengan arus mengalir ke anoda. Sumber listrik
dinyalakan dan dijaga konstan pada 70 V. Running dilakukan selama 180
menit sampai migrasi dye tersisa sekitar 0.5 cm dari dasar. Setelah selesai,
aliran listrik dimatikan dan katup elektroda dilepaskan, lalu plat gel
dipindahkan dari elektroda.
e. Pewarnaan gel
Gel diangkat dari slab dan dipindahkan ke dalam wadah tertutup yang telah
berisi pewarna coomasie briliant blue (kurang lebih 20 ml). kemudian
didiamkan selama 20 menit.
f. Destaining gel
Gel diangkat dan dicuci menggunakan akuades beberapa kali. Larutan
penghilang warna ditambahkan (destaining solution) dan digoyangkan sekali hingga latar belakang pita protein menjadi terang. Selanjutnya, larutan
penghilang warna dibuang dan gel siap dianalisis.
g. Penentuan berat molekul protein yang terpisahkan
Berat molekul protein sampel dapat dihitung dari persamaan regresi antara
mobilitas relatif protein marker (penanda protein) dengan logaritma dari berat
molekul marker yang diketahui. Mobilitas relatif protein dihitung dengan
membandingkan jarak migrasi protein diukur dari garis awal separating gel
sampai ujung pita protein yang dibandingkan dengan jarak migrasi tracking dye. Mobilitas relatif tersebut dirumuskan sebagai persamaan berikut :
Rf = jarak migrasi protein jarak migrasi tracking dye
h. Analisis gel elektroforesis
Gel hasil elektroforesis SDS-PAGE tersebut di dokumentasikan dalam bentuk
gambar. Hasil dalam bentuk gambar ini kemudian dianalisis densitas pita
proteinnya dengan menggunakan perangkat lunak Image J. Program membaca
3.3.5. Serum Subyek Alergi
Serum dari 20 orang penderita alergi diperoleh melalui wawancara langsung
seputar alergi yang diderita subyek meliputi jenis, penyebab, gejala apabila
sedang terkena alergi. Subyek sasaran adalah penderita alergi makanan. Serum
satu orang subyek yang normal (tidak menderita alergi) digunakan sebagai kontrol
negatif. Pengambilan darah dilakukan melalui kooordinasi dengan klinik dengan
menggunakan jarum suntik steril (syringe/spuilt) 10 cc (ml).
Dari ke-21 subyek, 20 ml darah diambil untuk dipisahkan serum dari
plasmanya. Darah yang telah diperoleh segera diinkubasi pada suhu 37°C selama
30 menit, lalu disentrifuse selama 20 menit pada kecepatan 2500 rpm. Supernatan
yang didapat merupakan serum yang diduga banyak mengandung IgE.
3.3.6. ELISA (Ishikawa et al. 1997)
Enzyme-linked immunosorbent assay (ELISA) dilakukan dengan menggunakan lempeng polistiren dengan 96 sumur. Teknik ini dilakukan
berdasarkan metode yang pernah dilakukan Ishikawa et al. (1997) dengan beberapa modifikasi pada jenis substrat, larutan pemblok dan panjang gelombang
pembacaan sesuai dengan jenis subtrat yang digunakan. Konfigurasi ELISA yang
dipilih adalah ELISA tidak langsung yang melibatkan interaksi protein alergen
(antigen), antibodi primer (IgE serum subyek alergi), antibodi sekunder yaitu anti
IgE anti manusia berlabel enzim HRP (Horseradish Peroksidase) dan substrat TMB (3,3´-tetramethylbenzidine). Formula beberapa larutan untuk uji ELISA diantaranya seperti coating buffer, blocking buffer dan washing buffer (Lampiran 3).
3.3.6.1. Penentuan IgE Total Serum Subyek Alergi (kualitatif)
Sebanyak 100 µl serum subyek pada pengenceran 1:5 dan 1:10, dilapiskan
ke dalam lempeng mikrotiter. Inkubasi dilakukan selama semalam pada suhu
4°C, lalu sisa serum dalam lempeng dibuang dan dilakukan pencucian dengan
PBS Tween-20 0.05% 5 kali sebanyak 200 µl/well. Kemudian, sebanyak 200 µl
BSA 3% dalam PBS ditambahkan ke dalam lempeng mikrotiter dan diinkubasi
selama 1 jam pada suhu 37°C. Setelah dicuci sebanyak 5 kali dengan PBS
28
enzim HRP. Sebelumnya antibodi anti IgE manusia berlabel enzim HRP
diencerkan 1:6000 dalam PBS Tween-20 0.05% . Inkubasi dilakukan pada suhu
37°C selama 1 jam.
Setelah dicuci dengan PBS Tween-20 0.05% ditambahkan sebanyak 100 µl
substrat TMB dan dibiarkan 5 menit. Kemudian dihentikan reaksinya dengan
penambahan 25 µl H2SO4 2N. Hasil reaksi dapat dibaca dengan ELISA reader pada panjang gelombang 450 nm.
3.3.6.2. Penentuan Sifat Alergenisitas Ekstrak Protein
Sebanyak 100 µl ekstrak protein sarkoplasma dan miofibril sampel (ikan,
udang dan kerang) dilarutkan dalam coating buffer (konsentrasi 10 µg/100µl) dilapiskan pada dasar lempeng mikrotiter. Kemudian diinkubasi pada suhu 4°C
selama semalam, lalu dicuci dengan PBS Tween-20 0.05% (200 µl/well) sebanyak
5 kali. Selanjutnya dilakukan pemblokan dengan larutan BSA 3% dalam PBS
sebanyak 200 µl/sumur dan diinkubasi selama 1 jam suhu 37°C. Setelah itu dicuci
dengan PBS Tween-20 0.05% sebanyak 5 kali. Serum subyek yang telah
diencerkan (perbandingan 1:5 atau 1:10) dalam PBS Tween-20, dilapiskan pada
lempeng mikrotiter sebanyak 100 µl/sumur. Selanjutnya serum subyek diinkubasi
selama 1 jam pada suhu 37°C, lalu dicuci sebanyak 5 kali dengan PBS Tween-20
0.05%.
Penambahan antibodi anti IgE dilakukan setelah mengencerkan 1:6000
dalam PBS Tween-20 0.05%. Kemudian sebanyak 100 µl/sumur anti IgE manusia
berlabel enzim HRP ditambahkan dan diinkubasi selama 1 jam pada suhu 37°C.
Setelah inkubasi, dicuci dengan PBS Tween-20 0.05% sebanyak 5 kali, lalu
ditambahkan sebanyak 100 µl substrat TMB dan dibiarkan 5 menit. Kemudian
dihentikan reaksinya dengan penambahan 25 µl H2SO4 2N. Hasil reaksi dapat
dibaca dengan ELISA reader pada panjang gelombang 450 nm.
3.3.7. Immunoblotting (Towbin et al. 1979)
Gel hasil elektroforesis yang tidak diwarnai, ditransfer ke membran
nitroselulosa (0,45µm) dalam buffer transfer yang disusun dalam alat
Membran selulosa dipotong sesuai gel dan membran yang berisi marker
direndam dalam pewarna amido black (untuk mengetahui apakah gel sudah tertransfer ke membran). Selanjutnya, membran yang berisi sampel protein diblok
dengan susu skim 5%, diinkubasi selama 1 jam sambil digoyang, kemudian
membran dicuci dengan PBS Tween-20 0.05% selama 5 menit sebanyak 3 kali.
Selanjutnya dilakukan penambahan serum subyek alergi yang diencerkan
1:10 dalam PBS Tween-20 0.05% dan diinkubasi selama satu jam pada suhu
kamar sambil digoyang. Pencucian dilakukan lagi dengan PBS Tween-20 0.05%
selama 5 menit sebanyak 3 kali, lalu diberi antibodi IgE anti manusia yang
berlabel enzim HRP pengenceran 1:3000 dalam PBS Tween-20 0.05%. kemudian
diinkubasi selama 1 jam dengan shaker atau digoyang-goyang. Membran
kemudian dicuci kembali 3 kali menggunakan PBS Tween-20 0.05% selama 5
menit. Hasil deteksi kompleks protein alergen (ikan, udang dan kerang) dengan
4. HASIL DAN PEMBAHASAN
4.1. Ekstrak Protein Sarkoplasama dan Miofibril
Sampel ikan tongkol, kerang hijau dan udang jerbung sebelum diekstraksi
dianalisis kadar total proteinnya dengan metode Kjeldahl. Hasil analisis
menunjukkan bahwa kandungan protein ikan tongkol yaitu 16.44%, kerang hijau
14.03% dan udang jerbung sebesar 13.96%. Menurut Chaijan et al. (2004), sebagai unsur utama dalam otot ikan, protein terdapat sekitar 13.74 – 17.54%.
Kandungan protein awal biasanya berkisar 11-24%, tergantung dari jenis spesies,
nutrisi, dan siklus reproduksi hewan tersebut.
Selanjutnya ekstraksi protein sampel dilakukan menggunakan larutan bufer
dengan kekuatan ion yang berbeda. Proses ekstraksi ini bertujuan untuk
memperoleh fraksi protein sarkoplasma dan miofibril dari ketiga sampel tersebut.
Fraksi protein sarkoplasma dihasilkan dari proses ekstraksi menggunakan larutan
bufer dengan kekuatan ion yang lebih rendah yaitu bufer fosfat pH 7.5 dengan
kekuatan ion 0.05. Fraksi protein miofibril diperoleh melalui ekstraksi dengan
bufer pH 7.5 dan kekuatan ion 0.5. Peningkatan kekuatan ion dalam larutan bufer
fosfat dilakukan dengan penambahan senyawa KCl (Suzuki 1981).
Protein sarkoplasma dan miofibril merupakan protein utama di dalam
serabut otot ikan. Kedua jenis protein ini berbeda dalam hal kelarutannya. Protein
sarkoplasma dapat larut dalam air, sehingga untuk melakukan ekstraksi cukup
dengan kekuatan ion rendah. Protein miofibril merupakan protein yang tidak larut
dalam air, tetapi larut dalam larutan garam. Kontribusi muatan-muatan ion dalam
senyawa garam menyebabkan protein ini harus diekstraksi dengan kekuatan ion
yang lebih tinggi (Hashimoto et al. 1979).
Menurut Ahmed (2005) selain pH dan kekuatan ion bufer, adanya inhibitor
protease juga mempengaruhi proses ekstraksi protein. Inhibitor protease
digunakan untuk menjaga kestabilan ekstrak dengan menghambat kerja enzim
protease, karena itu dalam penelitian ini ditambahkan inhibitor protease berupa
aprotinin. Proteolisis merupakan masalah utama yang sering terjadi setelah proses
ekstraksi. Proteolisis menyebabkan protein terdegradasi menjadi protein-protein
dengan berat molekul rendah. Beberapa jenis protease terdapat pada sel daging