HUBUNGAN GANGGUAN HEMOSTASIS DENGAN
PENYAKIT GINJAL KRONIK
TESIS
Oleh
HENDRIK SARUMPAET
NIM: 087101015
DEPARTEMEN ILMU PENYAKIT DALAM
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
HUBUNGAN GANGGUAN HEMOSTASIS DENGAN
PENYAKIT GINJAL KRONIK
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Magister Ilmu Penyakit Dalam dan Spesialis Penyakit Dalam dalam Program Studi Ilmu
Penyakit Dalam pada Fakultas Kedokteran Universitas Sumatera Utara
Oleh
HENDRIK SARUMPAET
087101015
DEPARTEMEN ILMU PENYAKIT DALAM
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
HALAMAN PERNYATAAN ORISINALITAS
Tesis ini adalah karya penulis sendiri,
dan semua sumber baik yang dikutip maupun dirujuk telah penulis nyatakan dengan benar
Nama : Hendrik Sarumpaet NIM : 087101015
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini:
Nama : Hendrik Sarumpaet
NIM : 087101015
Program Studi : dokter spesialis Konsentrasi : Ilmu Penyakit Dalam Jenis Karya : Tesis
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-eksklusif (Non-exclusive Royalty Free Right ) atas tesis saya yang berjudul:
HUBUNGAN GANGGUAN HEMOSATSIS DENGAN
PENYAKIT GINJAL KRONIK
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalihmedia/formatkan, mengelola dalam bentuk database, merawat dan mempublikasikan tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemilik hak cipta.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Medan
Pada : DESEMBER 2014 Yang menyatakan
Telah diuji
Pada Tanggal : 24 Desember 2014
PANITIA PENGUJI TESIS
Ketua : Prof. dr. Gontar A. Siregar, SpPD,KGEH Anggota : Prof. dr. Haris Hasan, SpPD, SpJP(K)
ABSTRAK
Latar Belakang : Penyakit ginjal kronik (PGK) merupakan masalah kesehatan global yang terus meningkat, PGK biasanya terkait dengan kecenderungan terjadinya protrombik pada tahap awal dari PGK dan berkembang lebih lanjut pada stadium akhir penyakit ginjal, yang dapat menyebabkan perdarahan.Kelainan koagulasi berhubungan dengan penyakit ginjal yang terlihat pada PGK, gagal ginjal akut, sindrom nefritik, glomerulonefritis, neoplasma dan transplantasi ginjal. Fungsi trombosit yang abnormal juga terjadi karena akumulasi toksin metabolit. Hiperkoagulopati dengan kecenderungan untuk terjadinya trombosis juga dapat terjadi. Aktivitas fibrinolitik, anti-trombin III dan protein C menjadi berkurang dan terjadi peningkatan faktor V, VII, VIII dan X (nilai protrombin time (PT), Activated Partial Thromboplastin Time (aPTT) memanjang).
Metode : Penelitian potong lintang dengan cara consecutive sampling terhadap 30 orang pasien di ruang rawat inap dan poliklinik penyakit Dalam RSUP H.Adam Malik Medan, dibagi dalam tiga kelompok penelitian, yaitu kelompok PGK stadium III, PGK stadium IV, dan PGK stadium V selama bulan Juli – September 2014. Dilakukan pemeriksaan kadar trombosit, aPTT, PT, D-Dimer dan waktu pendarahan.
Hasil : Dijumpai korelasi positif yang kuat yang signifikan (r=0,071;p=0,02) antara PGK stadium V dengan kadar trombosit, antara PGK stadium III dengan kadar aPTT dijumpai korelasi positif yang kuat yang signifikan (r=0,68;p=0,03). Kesimpulan : Pada pasien PGK yang belum menjalani tindakan hemodialisis, ada hubungan korelasi positif yang kuat dengan gangguan hemostasis terutama pada aPTT, trombosit dan D-Dimer.
ABSTRACT
Background : Chronic kidney disease ( CKD ) is a global health problem that continues to increase , CKD is usually associated with the likelihood of protrombik in the early stages of CKD and evolve further in end-stage renal disease , which can cause bledding disorder. Coagulation abnormality associated with kidney disease seen in CKD , acute renal failure , nephritic syndrome , glomerulonephritis , neoplasms and renal transplantation . Abnormal platelet function also occur due to accumulation of toxins metabolites . Hiperkoagulopati with a tendency for thrombosis may also occur . Fibrinolytic activity , anti - thrombin III and protein C is reduced and an increase in factor V , VII , VIII and X ( value of prothrombin time ( PT ) , activated partial thromboplastin time ( aPTT ) lengthwise ) .
Methods : A cross-sectional study with consecutive sampling method on 30 patients in the inpatient unit and clinical disease in Adam Malik Hospital in Medan, were divided into three study groups , in groups of CKD stage III , stage IV CKD and CKD stage V during the month July to September 2014. The examination will be conducted platelet levels , aPTT , PT , D -dimer and bleeding time.
Results : Found a strong positive correlation was significant ( r = 0.071 ; p = 0.02 ) between CKD stage V with platelet levels , between CKD stage III with aPTT levels found a strong positive correlation was significant ( r = 0.68 ; p = 0.03 ) . Conclusion : In CKD patients who have not undergone hemodialysis action , there is a strong positive correlation with impaired hemostasis mainly on aPTT , platelet and D - dimer .
KATA PENGANTAR
Puji syukur yang tidak terhingga senantiasa penulis panjatkan ke hadirat Tuhan Yang Maha Esa yang telah memberikan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan tesis ini. Penulis sangat menyadari bahwa tanpa bantuan semua pihak, tesis ini tidak mungkin dapat penulis selesaikan. Oleh karena itu, perkenankanlah penulis mengucapkan terima kasih serta penghargaan yang setinggi-tingginya kepada semua pihak yang telah membantu dalam penyelesaian tesis ini, baik secara langsung maupun tidak langsung. Rasa hormat, penghargaan dan ucapan terima kasih sebesar-besarnya penulis sampaikan kepada:
1. (Alm) dr. Salli Roseffi Nasution, Sp.PD-KGH dan dr. Refli Hasan, Sp.PD, Sp.JP(K) selaku Ketua dan Sekretaris Departemen Ilmu Penyakit Dalam FK-USU/RSUP H. Adam Malik Medan yang telah memberikan kesempatan kepada penulis untuk mengikuti pendidikan serta senantiasa membimbing, memberikan dorongan dan kemudahan selama penulis menjalani pendidikan.
2. (Alm) dr. Zulhelmi Bustami, Sp.PD-KGHdan dr. Zainal Safri, Sp.PD, Sp.JP sebagai Ketua dan Sekretaris Program Studi Ilmu Penyakit Dalam yang telah dengan sungguh-sungguh membantu, membimbing, memberi dorongan dan membentuk penulis menjadi dokter Spesialis Penyakit Dalam yang berbudi luhur serta siap mengabdi dan berbakti pada nusa dan bangsa.
penulis selama mengadakan penelitian juga telah banyak meluangkan waktu dan dengan kesabaran membimbing penulis sampai selesainya tesis ini.
yang tidak dapat penulis sebutkan satu persatu, yang dengan kesabaran dan perhatian senantiasa membimbing penulis selama mengikuti pendidikan.
5. Direktur RSUP H. Adam Malik, RSUD dr. Pirngadi yang telah memberikan begitu banyak kemudahan dan izin dalam menggunakan fasilitas dan sarana Rumah Sakit kepada penulis dalam menjalani penelitian dan pendidikan. 6. Rektor Universitas Sumatera Utara, Dekan FK USU, Ketua TKP-PPDS FK USU, dan Ketua Program Studi Magister Kedokteran FK USU yang telah memberikan kesempatan kepada penulis untuk mengikuti Program Pendidikan Dokter Spesialis Ilmu Penyakit Dalam dan Magister Kedokteran Penyakit Dalam di Fakultas Kedokteran Universitas Sumatera Utara.
7. Kepada Pimpinan Laboratorium RSUP H. Adam Malik Medan beserta staf yang telah membantu dan memberikan kemudahan kepada penulis dalam hal pemeriksaan laboratorium hingga penelitian ini dapat selesai.
8. Teman-teman seangkatan dan seperjuangan yang telah memberikan dorongan semangat, dr. Arief Banu Pradipta, dr. Lisa Yulianti, dr. Dika Sinulingga, dr. Senior Tawarta. Terimakasih untuk kebersamaan kita dalam menjalani pendidikan selama ini.
9. Abang, kakak, dan adik-adik keluarga besar IKAAPDA dan peserta Program Pendidikan Dokter Spesialis Ilmu Penyakit Dalam FK USU yang telah banyak membantu penulis selama menjalani pendidikan ini.
10.Seluruh Perawat/Paramedis diberbagai tempat dimana penulis pernah bertugas selama pendidikan.
12. Syarifuddin Abdullah, Lely Husna Nasution, Amd, Deny Mahyudi, SKom, Erjan, Sriwanti, Tanti, Ita, Fitri, Julita Ramadayanti, Tika, Idriyanti, Ali dan seluruh pegawai administrasi Departemen Ilmu Penyakit Dalam FK-USU, yang telah banyak membantu memfasilitasi penulis dalam menyelesaikan pendidikan.
Rasa hormat dan terima kasih tidak terhingga penulis persembahkan kepada kedua orangtua yang sangat penulissayangi dan cintai, Ayahanda Prof dr Sorimuda Sarumpaet MPH dan Ibunda Ida br Marpaung, atas segala jerih payah, pengorbanan dan dengan kasih sayang yang tulus telah melahirkan, membesarkan, mendidik, mendoakan tiada henti, memberikan dukungan moril dan materil, serta mendorong penulis dalam berjuang menjalani hidup dan mencapai cita-cita. Tidak akan pernah bisa penulis membalas jasa-jasa ayahanda dan ibunda, semoga Tuhan selalu memberikan kesehatan, kebahagian, rahmat dan karunia-Nya kepada ayahanda dan ibunda.
Kepada istriku Febriani Frieska br Simorangkir, Amd yang telah membantu,mendoakan, memberi semangat, kritik, serta dorongan, ucapan terima kasih yang tak terhingga saya ucapkan untuk segalanya.
Kepada semua pihak, baik perorangan maupun instansi yang tidak mungkin penulis sebutkan satu persatu yang telah membantu dan berperan dalam menyelesaikan penelitian dan pendidikan saya ini, penulis ucapkan banyak terima kasih.
dukungan, bimbingan dan petunjuk yang telah diberikan kiranya mendapat balasan berlipat-ganda dari Tuhan Yang Maha Esa.
Medan, Desember 2014
DAFTAR ISI
Daftar Singkatan dan Tanda... xiii
Daftar Lampiran... xiv 1.5 Manfaat Penelitian... 4
2.1.4. Sistem Fibrinolisis... 13
2.2. Pemeriksaan Fungsi Hemostasis... 2.2.1. Pemeriksaan darah lengkap dan evaluasi hapusan darah tepi... 2.2.2. Pemeriksaan penyaring sistem koagulasi... 2.2.2.1. Waktu Protrombin (PT)... 2.2.2.2. aPTT (Activated Partial Thromboplastin Time ) 2.2.2.3. Waktu tombin (TT)... 2.2.3. Pemeriksaan faktor koagulasi khusus... 2.2.4. Waktu pendarahan... 2.3. Penyakit Ginjal Kronik (PGK)... 2.3.1. Defenisi... 2.3.2. Klasifikasi PGK... 2.3.3. Patofisiologi PGK... 2.4. Gangguan hemostasis pada PGK... 2.4.1. Meningkatnya resiko pendarahan...
2.6. Kerangka Konsep... 33
Bab 3. Metode Penelitian... ... 34
3.2 . Ruang lingkup penelitian... 3.3 Populasi dan Sampel ...
3.3.1. Populasi... 3.5. Variabel penelitian dan defenisi operasional...
3.5.1. Variabel penelitian... Bab 4. Hasil dan pembahasan...
4.1. Hasil penelitian... 4.1.2. Hubungan LFG dengan trombosit pada subjek PGK.. 4.1.3. Hubungan penanda koagulasi dengan subjek PGK...
DAFTAR TABEL
Tabel 1. Klasifikasi penyakit ginjal kronik atas dasar derajat penyakit 17 Tabel 2. Klasifikasi PGK atas dasar Diagnosis Etiologi 18
Tabel 3. Gangguan hemostasis pada PGK 21
Tabel 4. Gambaran klinis dari gangguan ginjal 22 Tabel 5. Aspek Pengukuran Variabel Penelitian 37
Tabel 6. Karateristik dasar penelitian 40
DAFTAR GAMBAR
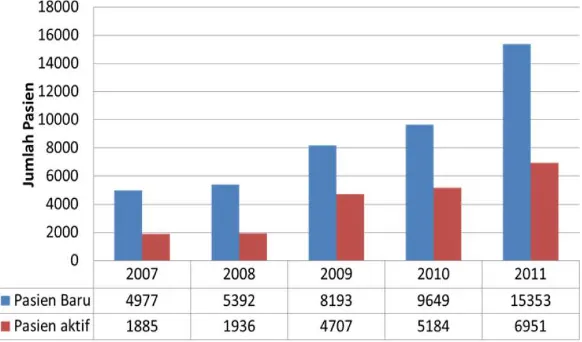
Gambar 1. Pasien baru dan pasien aktif di Indonesia 2007-2011 3
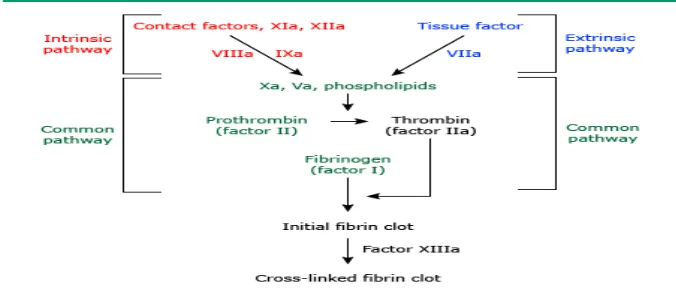
Gambar 2. Sistem koagulasi 11
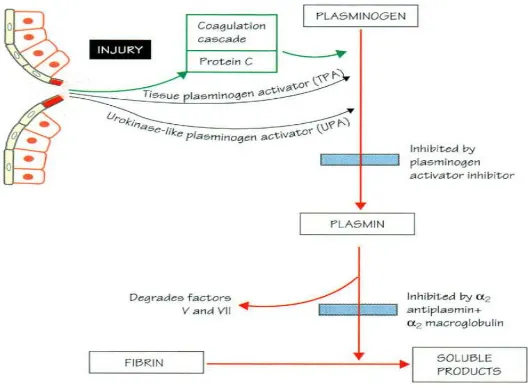
Gambar 3. Sistem fibrinolisis 13
Gambar 4. Faktor penyebab meningkatnya pendarahan pada gangguan
ginjal 25
Gambar 5. Faktor yang meningkatkan keadaan trombosis pada
gangguan ginjal 31
DAFTAR SINGKATAN
Singkatan Nama Pemakaian pertama kali
pada halaman
PGK Penyakit Ginjal Kronik 1
PT Protrombin time 2
aPTT Activated Partial Thromboplastin Time 2
AT Anti trombin 7
t-PA Tissue plasminogen activator 7
TF tissue factor 7
vWF von Willebrand factor 7
PDGF platelet derived growth factor 9
PDI protein disulfida isomerase 10
AT III Anti trombin III. 12
UPA urokinase like pasminogen activator 13
TT thrombin time 15
LFG laju filtrasi glomerolus. 17
TGF- transforming growth factor 19
PAI-1 plasminogen activator inhibitor 1. 21
DVT Deep Vein Thrombosis 22
PE Pulmonal Emboli 22
ACS acute coronary syndrome. 22
GP Glikoprotein. 23
NO nitro oxide 24
MPs Mikropartikel.. 28
EPC endothel progenitor cell 28
miRNAs microRNAs 30
DAFTAR LAMPIRAN
Nomor Judul Halaman
1 Persetujuan Komisi Etik Penelitian... 57
2 Master Tabel... 58
3 Analisa Statistik... 59
4 Lembar penjelasan kepada subjek... 72
5 Lemabar persetujuan penjelasan... 73
6 Kertas kerja profil peserta penelitian ... 74
ABSTRAK
Latar Belakang : Penyakit ginjal kronik (PGK) merupakan masalah kesehatan global yang terus meningkat, PGK biasanya terkait dengan kecenderungan terjadinya protrombik pada tahap awal dari PGK dan berkembang lebih lanjut pada stadium akhir penyakit ginjal, yang dapat menyebabkan perdarahan.Kelainan koagulasi berhubungan dengan penyakit ginjal yang terlihat pada PGK, gagal ginjal akut, sindrom nefritik, glomerulonefritis, neoplasma dan transplantasi ginjal. Fungsi trombosit yang abnormal juga terjadi karena akumulasi toksin metabolit. Hiperkoagulopati dengan kecenderungan untuk terjadinya trombosis juga dapat terjadi. Aktivitas fibrinolitik, anti-trombin III dan protein C menjadi berkurang dan terjadi peningkatan faktor V, VII, VIII dan X (nilai protrombin time (PT), Activated Partial Thromboplastin Time (aPTT) memanjang).
Metode : Penelitian potong lintang dengan cara consecutive sampling terhadap 30 orang pasien di ruang rawat inap dan poliklinik penyakit Dalam RSUP H.Adam Malik Medan, dibagi dalam tiga kelompok penelitian, yaitu kelompok PGK stadium III, PGK stadium IV, dan PGK stadium V selama bulan Juli – September 2014. Dilakukan pemeriksaan kadar trombosit, aPTT, PT, D-Dimer dan waktu pendarahan.
Hasil : Dijumpai korelasi positif yang kuat yang signifikan (r=0,071;p=0,02) antara PGK stadium V dengan kadar trombosit, antara PGK stadium III dengan kadar aPTT dijumpai korelasi positif yang kuat yang signifikan (r=0,68;p=0,03). Kesimpulan : Pada pasien PGK yang belum menjalani tindakan hemodialisis, ada hubungan korelasi positif yang kuat dengan gangguan hemostasis terutama pada aPTT, trombosit dan D-Dimer.
ABSTRACT
Background : Chronic kidney disease ( CKD ) is a global health problem that continues to increase , CKD is usually associated with the likelihood of protrombik in the early stages of CKD and evolve further in end-stage renal disease , which can cause bledding disorder. Coagulation abnormality associated with kidney disease seen in CKD , acute renal failure , nephritic syndrome , glomerulonephritis , neoplasms and renal transplantation . Abnormal platelet function also occur due to accumulation of toxins metabolites . Hiperkoagulopati with a tendency for thrombosis may also occur . Fibrinolytic activity , anti - thrombin III and protein C is reduced and an increase in factor V , VII , VIII and X ( value of prothrombin time ( PT ) , activated partial thromboplastin time ( aPTT ) lengthwise ) .
Methods : A cross-sectional study with consecutive sampling method on 30 patients in the inpatient unit and clinical disease in Adam Malik Hospital in Medan, were divided into three study groups , in groups of CKD stage III , stage IV CKD and CKD stage V during the month July to September 2014. The examination will be conducted platelet levels , aPTT , PT , D -dimer and bleeding time.
Results : Found a strong positive correlation was significant ( r = 0.071 ; p = 0.02 ) between CKD stage V with platelet levels , between CKD stage III with aPTT levels found a strong positive correlation was significant ( r = 0.68 ; p = 0.03 ) . Conclusion : In CKD patients who have not undergone hemodialysis action , there is a strong positive correlation with impaired hemostasis mainly on aPTT , platelet and D - dimer .
BAB I PENDAHULUAN
1.1. Latar Belakang
Hemostasis adalah proses yang mempertahankan integritas sistem peredaran darah setelah terjadi kerusakan vaskular. Dalam keadaan normal, dinding pembuluh darah yang cedera dengan cepat memulai serangkaian proses terkoordinasi yang dirancang untuk menutup kerusakan yang disebabkan oleh cedera. Peristiwa ini menyebabkan pembentukan gumpalan dan membutuhkan perekrutan dan aktivasi trombosit serta pembentukan trombin dan fibrin 1. Proses ini diatur oleh beberapa mekanisme, sehingga dapat mencegah peradangan dan kerusakan jaringan pembuluh darah 2. Gangguan dari fungsi trombosit atau kaskade koagulasi biasanya menyebabkan gangguan pendarahan, sedangkan hiperaktivitas trombosit dan kelainan pada mekanisme regulasi juga dapat menyebabkan pembentukan trombin yang berlebihan dan trombosis patologis.
menyebabkan pendarahan pada PGK termasuk asam guanidinosuksinik dan asam fenolat.
Trombositopenia, trombosis glomerulus dan trombus pada arteri kecil dan kapiler glomerulus merupakan kondisi umum pada penyakit ginjal. Trombosit terlibat langsung dalam patogenesis penyakit glomerulus, melalui berbagai mekanisme termasuk pelepasan molekul aktif dengan meningkatkan deposisi kompleks imun dan mengubah permeabilitas glomerular5. Disfungsi trombosit pada PGK dan gagal ginjal terminal terjadi karena kelainan trombosit intrinsik dan gangguan interaksi platelet pada pembuluh darah. Hal ini merupakan respon dari trombosit pada saat terjadinya cedera pada pembuluh darah dengan aktivasi dari trombosit, perekrutan, adhesi dan agregasi pada PGK.6
Kelainan koagulasi berhubungan dengan penyakit ginjal yang terlihat pada PGK, gagal ginjal akut, sindrom nefritik, glomerulonefritis, neoplasma dan transplantasi ginjal. Fungsi trombosit yang abnormal juga terjadi karena akumulasi toksin metabolit. Hiperkoagulopati dengan kecenderungan untuk terjadinya trombosis juga dapat terjadi. Aktivitas fibrinolitik, anti-trombin III dan protein C menjadi berkurang dan terjadi peningkatan faktor V, VII, VIII dan X (nilai protrombin time (PT), Activated Partial Thromboplastin Time (aPTT) memanjang).7
sebagai risiko untuk pendarahan perioperatif dan data menunjukkan keadaan hiperkoagulasi pada PGK.9
Subdanuddin dan kawan-kawan melaporkan bahwa ada peningkatan D-Dimer yang signifikan pada pasien PGK stadium 3 dan 4. Mereka juga mengatakan pasien dengan PGK stadium 3 dan 4 berhubungan dengan koagulasi yang abnormal dan gangguan pendarahan.10
Di Amerika Serikat, data tahun 1995-1999 menyatakan insiden PGK diperkirakan 100 kasus perjuta penduduk pertahun, dan angka ini meningkat sekitar 8% setiap tahunnya. Di Malaysia, dengan populasi 18 juta, diperkirakan terdapat 1.800 kasus baru gagal ginjal pertahunnya. Di negara-negara berkembang lainnya, insiden ini diperkirakan sekitar 40-60 kasus perjuta per tahun11. Data di Indonesia dijumpai adanya peningkatan jumlah pasien gagal ginjal yang melakukan tindakan hemodialisa dari 4.997 pasien baru pada tahun 2007 menjadi 15.353 pada tahun 2011. (Gambar 1.)
Penelitian ini ingin melihat bagaimana hubungan antara PGK dengan gangguan koagulasi pada pasien PGK yang belum dilakukan tindakan hemodialisa
1.2. Rumusan Masalah
Apakah ada hubungan PGK dengan gangguan hemostasis
1.3. Hipotesis Penelitian
Ada hubungan PGK dengan gangguan hemostasis
1.4. Tujuan penelitian 1.4.1 Tujuan umum
Terdapat adanya hubungan PGK dengan peningkatan gangguan hemostasis.
1.4.2. Tujuan khusus
1. Mendeskripsikan gangguan trombosit pada pasien PGK stadium III,IV dan V pre dialisis.
2. Mendeskripsikan hasil pemeriksaan koagulasi pada pasien PGK stadium III,IV dan V pre dialisis.
3. Membuktikan hubungan keparahan PGK dengan peningkatan gangguan hemostasis.
1. Memberi masukan perlu dilakukan pemeriksaan hemostasis pada pasien dengan PGK
2. Memberi masukan perlu dilakukan terapi penanganan gangguan hemostasis pada pasien dengan PGK
BAB II
TINJAUAN PUSTAKA
2.1. Hemostasis
Faal hemostasis adalah suatu fungsi tubuh yang bertujuan untuk mempertahankan keenceran darah sehingga darah tetap mengalir dalam pembuluh darah dan menutup kerusakan pada dinding pembuluh darah sehingga mengurangi kehilangan darah pada saat terjadinya kerusakan pembuluh darah. Faal hemostasis melibatkan sistem berikut:
1. Sistem vaskular. 2. Sistem trombosit 3. Sistem koagulasi 4. Sistem fibrinolisis
Untuk mendapatkan faal hemostasis yang baik maka keempat sistem tersebut harus bekerja sama dalam suatu proses yang berkeseimbangan dan saling mengontrol. Kelebihan atau kekurangan suatu komponen akan menyebabkan kelainan. Kelebihan fungsi hemostasis akan menyebabkan trombosis, sedangkan kekurangan faal hemostasis akan menyebabkan pendarahan.12 Faal hemostasis untuk dapat berjalan normal memerlukan 3 langkah yaitu :
1. Langkah I : hemostasis primer, yaitu pembentukan “primary platelet plug”
3. Langkah III : fibrinolisis yang menyebabkan lisis dan fibrin setelah dinding vaskuler mengalami reparasi sempurna sehingga pembuluh darah kembali paten
Faal hemostasis terdiri atas 2 komponen yaitu :
1. Faal koagulasi : yang berakhir dengan pembentukan fibrin stabil 2. Faal fibrinolisis : yang berakhir dengan pembentukan plasmin Faal koagulasi melibatkan 3 komponen, yaitu :
1. Komponen vaskuler 2. Komponen trombosit 3. Komponen koagulasi 2.1.1. Sistem Vaskular13
Pembuluh darah memiliki peran penting dalam menjaga hemostasis. Sel endotel menghasilkan :
1. Prostasiklin, yang menyebabkan vasodilatasi dan mencegah terjadinya agregasi dari trombosit
2. Anti trombin (AT) dan protein C activator (thrombomodulin), dimana keduanya mencegah terjadinya koagulasi
3. Tissue plasminogen activator (t-PA), yang berperan mengaktifkan fibrinolisis
yang memediasi adhesi platelet pada endotel dan membawa faktor pembekuan VII dalam plasma.
2.1.2. Sistem trombosit
Trombosit diaktifkan pada lokasi cedera vaskular untuk membentuk sebuah plug trombosit yang memberikan respon hemostatik awal untuk menghentikan pendarahan.14
Respon fungsional trombosit diaktifkan melibatkan empat proses yang berbeda:
2.1.2.1.Adhesi trombosit
Setelah aktivasi, trombosit mengalami perubahan bentuk yang signifikan, menghasilkan pseudopods yang membuat trombosit sangat gampang melekat. Adhesi trombosit terutama dimediasi oleh pengikatan platelet pada permukaan reseptor kompleks GP Ib /IX /V dengan vWF dalam matriks subendothelial.15 Defisiensi komponen dari kompleks GP Ib/IX/V atau vWF menyebabkan gangguan pendarahan kongenital seperti penyakit Bernard-Soulier dan penyakit von Willebrand.16
Selain itu, ada interaksi perekat lainnya yang berkontribusi terhadap adhesi platelet. Salah satu contoh adalah pengikatan reseptor platelet kolagen GPIA / IIa dengan kolagen fibril dalam matriks.17
2.1.2.2.Agregasi trombosit
ditemukan di banyak jenis sel yang berbeda. Kompleks GP IIb/IIIa (integrin alpha IIb beta 3) adalah reseptor yang paling banyak di permukaan platelet, dengan sekitar 80.000 kompleks per platelet. GP IIb/IIIa tidak mengikat fibrinogen, suatu divalen molekul simetris yang menjembatani yang menyebabkan trombosit diaktifkan, pada trombosit yang belum distimulasi. Namun, setelah trombosit distimulasi, GP IIb/IIIa mengalami perubahan afinitas dan dikonversi dari afinitas rendah ke afinitas tinggi dari reseptor fibrinogen, sebuah proses yang disebut sebagai sinyal "inside-out".
Selain memediasi agregasi platelet, bagian dari sitosol diaktifkan kompleks GP IIb /IIIa yang mengikat sitoskeleton platelet dan dapat memediasi trombosit menjadi menyebar dan membentuk retraksi bekuan, yang telah disebut sebagai sinyal "outside-in". Dengan demikian, kompleks GP IIb/IIIa mengintegrasikan interaksi reseptor-ligan yang terjadi pada bagian eksternal dari membran dengan peristiwa sitosol yang terjadi secara dua arah19; hal ini merupakan jalur akhir yang umum untuk agregasi platelet, terlepas dari modus stimulasi trombosit.
2.1.2.3.Sekresi trombosit
1. ADP dan serotonin merangsang dan merekrut tambahan trombosit.20 Platelet yang merilis serotonin biasanya menyebabkan vasodilatasi, Namun dapat menyebabkan vasokonstriksi pada endotelium yang rusak atau abnormal. Trombosit ADP yang aktif meningkatkan ekspresi permukaan antar molekul adhesi (ICAM) -1 pada sel endotel.21
2. Fibronektin dan trombospondin adalah protein adhesi yang dapat memperkuat dan menstabilkan agregat trombosit.
3. Fibrinogen dilepaskan dari butiran alpha trombosit, menyediakan sumber fibrinogen pada daerah endotel yang cedera selain itu fibirnogen juga dijumpai pada plasma.22
4. Tromboksan A2, merupakan metabolit prostaglandin yang menyebabkan vasokonstriksi dan agregasi platelet.
5. Faktor pertumbuhan, seperti PDGF, memiliki efek mitogenik yang kuat pada sel-sel otot polos. Pelepasan PDGF dari trombosit pada lokasi vaskular yang vaskular mungkin mempengaruhi perbaikan jaringan fisiologis dan pada tempat yang mengalami cedera berulang, dapat berkontribusi untuk terjadinya aterosklerosis dan oklusi koroner setelah angioplasti.
2.1.2.4.Aktifitas prokoagulan
Aktivitas platelet prokoagulan merupakan aspek penting dari aktivasi platelet dan melibatkan paparan fosfolipid prokoagulan, terutama phosphatidylserine, dan pembentukan berikutnya dari kompleks enzim dalam kaskade pembekuan pada permukaan platelet 24. Kompleks ini merupakan contoh penting dari keterkaitan erat antara aktivasi trombosit dan aktivasi kaskade pembekuan.
2.1.3. Sistem Koagulasi 12
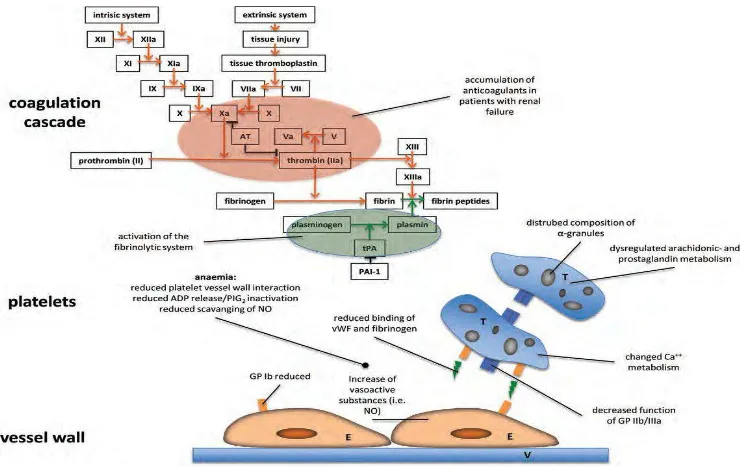
Faktor koagulasi atau faktor pembekuan darah adalah protein yang terdapat dalam plasma (darah) yang berfungsi dalam proses koagulasi. Jika terjadi aktivasi protein ini dalam keadaan tidak aktif (proenzim atau zymogen), protein aktif ini (enzim) akan mengaktifkan rangkaian aktivasi berikutnya secara beruntun, seperti sebuah tangga (kaskade) atau seperti air terjun (water fall).
Proses pembentukan fibrin jika digambarkan secara skematik mirip seperti fenomena air terjun (waterfall) atau seperti tangga (cascade). Artinya aktivasi faktor awal akan mengaktifkan faktor berikutnya disertai dengan proses amplifikasi sehingga molekul yang dihasilkan akan bertambah banyak. Gambaran kaskade koagulasi dapat dilihat pada gambar 2.
Proses pembekuan darah bertujuan untuk mengatasi vascular injury sehingga tidak terjadi pendarahan berlebihan, tetapi proses pembekuan darah ini harus dilokalisir hanya pada daerah injury, tidak boleh menyebar ke tempat lain karena akan membahayakan peredaran darah. Untuk itu, tubuh membuat mekanisme kontrol dimana endotil yang intak memegang peranan penting.
1. Adanya AT III (anti-thrombin III) yang terikat pada permukaan endotil dengan perantaraan heparan sulfat. AT III akan menginaktifkan thrombin dan faktor Xa.
2. Molekul trombomodulin pada permukaan endotil akan mengikat trombin. Kompleks trombin-trombomodulin akan mengaktifkan protein-C (dengan bantuan protein-S sebagai kofaktor) akan menginaktifkan faktor Va dan faktor VIIIa, dengan demikian pembentukan trombin akan berkurang.
2.1.4. Sistem Fibrinolisis13
Proses fibrinolitik bertujuan untuk membentuk plasmin yang berguna untuk menghancurkan bekuan fibrin yang berlebihan atau menghancurkan fibrin setelah proses reparasi dinding pembuluh darah selesai sehingga pembuluh darah tersebut kembali paten. Fibrinolosis merupakan proses dimana fibrin di degradasi oleh plasmin. Sirkulasi pro-enzim, plasminogen, diaktifkan oleh plasmin :
1. Pada saat terjadi perlukaan, oleh t-PA dan urokinase-like plasminogen activator (UPA) yang dilepaskan oleh sel yang rusak atau oleh sel yang aktif
2. Bahan eksogen seperti streptokinase, atau oleh t-PA atau UPA terapetik
Plasmin mengubah fibrin atau fibrinogen menjadi fibrin degradation product (FDPs) dan juga mendegradasi faktor V dan VII. Plasmin yang bebas di
nonaktifkan oleh plasma α2antiplasmin dan α2 makroglobulin
2.2. Pemeriksaan Fungsi Hemostais25
Sejumlah pemeriksaan sederhana dapat dilakukan untuk menilai fungsi trombosit, pembuluh darah, serta komponen koagulasi dalam hemostasis.
Pemeriksaan penyaring ini meliputi : pemeriksaan darah lengkap, evaluasi darah apus, waktu pendarahan, waktu protrombin (PT), aPTT, agregasi trombosit. 2.2.1. Pemeriksaan darah lengkap dan evaluasi hapusan darah tepi.
Trombositopenia merupakan penyebab tersering dari terjadinya pendarahan yang abnormal, oleh karena itu pada pasien yang diduga menderita kelainan darah, pertama kali harus dilakukan pemeriksaan hitung darah lengkap dan pemeriksaan hapusan darah tepi. Selain untuk memastikan adanya trombositopenia, dari pemeriksaan hapusan darah tepi dapat menyingkirkan kemungkinan lain seperti leukemia.
2.2.2. Pemeriksaan penyaring sistem koagulasi
Pemeriksaan meliputi penilaian jalur intrinsik dan ekstirnsik dari sistem koagulasi dan perubahan dari fibrinogen menjadi fibrin :
2.2.2.1.Waktu protormbin (PT)
PT digunakan untuk menilai jalur ekstrinsik pembekuan, yang terdiri dari faktor jaringan dan faktor VII, dan faktor koagulasi pada jalur umum (faktor II (protrombin), V, X, dan fibrinogen). Nilai normal 10-14 detik.
memiliki kepekaan yang sama (indeks sensitivitas internasional [ISI] berkisar 1,03-1,09). Keterbatasan metode ini adalah bahwa variabilitas pereaksi atau instrumen dapat mempengaruhi hasil.
2.2.2.2.aPTT
Digunakan untuk menilai integritas koagulasi jalur intrinsik (prekallikrein, tinggi kininogen berat molekul, faktor XII, XI, IX, VIII) dan jalur akhir yang umum (faktor II, V, X, dan fibrinogen), dan untuk memantau respon terapi pemakaian heparin.Nilai normal aPTT antara 30-40 detik.
2.2.2.3.Waktu trombin (thrombin time, TT)
Cukup sensitif untuk menilai defisiensi fibrinogen atau adanya hambatan terhadap trombin. TT digunakan untuk mengukur langkah terakhir dari jalur pembekuan, konversi fibrinogen menjadi fibrin27. Nilai normal antara 14-16 detik. 2.2.3. Pemeriksaan faktor koagulasi khusus
Termasuk disini adalah fibrinogen, faktor vW, dan faktor VII. Pemeriksaan bisa secara kuantitatif atau dengan cara membandingkan efek koreksi dari plasma yang mengandung kekurangan substrat tertentu yang mempunyai perpanjangan waktu pembekuan (PT, aPTT) dengan efek koreksi terhadap plasma normal, yang hasilnya dinyatakan dengan presentase aktivitas normal.
2.2.4. Waktu pendarahan
pendarahan biasanya normal. Pada keadaan normal, pendarahan akan berhenti dalam waktu 3-8 detik.
2.2.5. Pemeriksaan fungsi trombosit
Tes agregasi trombosit merupakan pemeriksaan yang mempunyai nilai penting. Tes ini mengukur penurunan penyerapan sinar pada plasma kaya trombosit sebagai agregat trombosit. Agregasi primer berasal dari rangsangan agen eksternal, sedangkan respon sekunder berasal dari agen yang dilepas dari dalam trombosit sendiri. Agen agregasi yang sering digunakan misalnya : ADP, kolagen, ristosetin, asam arakidonat dan adrenalin.
2.2.6. Pemeriksaan Fibrinolisis
Peningkatan aktivator plasminogen dalam sirkulasi dapat dideteksi dengan memendeknya euglobulin clot lysis time. Beberapa teknik imunologik digunakan untuk mendeteksi produk degradasi dari fibrin maupun fibrinogen (D-Dimer)
2.3. Penyakit Ginjal Kronik (PGK)11 2.3.1. Definisi
PGK adalah kelainan dari struktur ginjal atau fungsi, yang terjadi lebih dari 3 bulan dengan adanya gambaran :
1. Kelainan struktur histopatologi ginjal.
2. Petanda kerusakan ginjal meliputi kelainan komposisi darah dan urin, atau uji pencitraan ginjal.
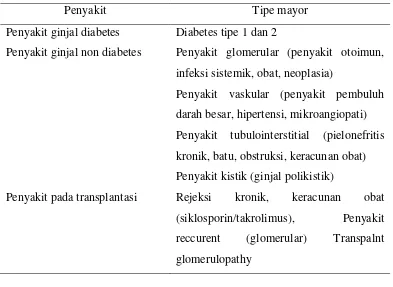
2.3.2. Klasifikasi PGK
Klasifikasi penyakit ginjal kronik didasarkan atas dua hal yaitu, atas dasar derajat penyakit dan atas dasar diagnosis etiologi. Klasifikasi atas dasar derajat penyakit, dibuat atas dasar LFG yang dihitung dengan mempergunakan rumus Kockroft-gault sebagai berikut :
* pada perempuan dikalikan 0.82
Tabel 1. Klasifikasi penyakit ginjal kronik atas dasar derajat penyakit
Stadium Penjelasan LFG
(ml/mt/1,73m2) 1 Kerusakan ginjal dengan LFG normal atau
meningkat
≥ 90
2 Kerusakan ginjal dengan LFG menurun ringan
60-80
3 Kerusakan ginjal dengan LFG menurun sedang
30-59
4 Kerusakan ginjal dengan LFG berat 15-29
Tabel 2. Klasifikasi PGK atas dasar Diagnosis Etiologi
Penyakit Tipe mayor
Penyakit ginjal diabetes Diabetes tipe 1 dan 2
Penyakit ginjal non diabetes Penyakit glomerular (penyakit otoimun, infeksi sistemik, obat, neoplasia)
Penyakit vaskular (penyakit pembuluh darah besar, hipertensi, mikroangiopati) Penyakit tubulointerstitial (pielonefritis kronik, batu, obstruksi, keracunan obat) Penyakit kistik (ginjal polikistik)
Penyakit pada transplantasi Rejeksi kronik, keracunan obat (siklosporin/takrolimus), Penyakit reccurent (glomerular) Transpalnt glomerulopathy
2.3.3. Patofisiologi PGK
Patofisiologi PGK pada awalnya tergantung pada penyakit yang mendasarinya, tapi dalam perkembangan selanjutnya proses yang terjadi kurang lebih sama.
peningkatan aktivitas aksis renin-angiotensin-aldosteron intrarenal, ikut memberikan kontribusi terhadap terjadinya hiperfiltrasi, sklerosis dan progressifitas tersebut.
Aktivasi jangka panjang aksis renin-angiotensin-aldosteron, sebagian diperantarai oleh growth factor seperti transforming growth factor β (TGF- ). Beberapa hal yang juga dianggap berperan terhadap terjadinya progresifitas PGK adalah albuminuria, hipertensi, hiperglikemia, dilipidemia. Terdapat variabilitas interindividual untuk terjadinya sklerosis dan fibrosis glomerulus dan maupun tubulointerstitial.
kalium. Pada LFG dibawah 15% akan terjadi gejala dan komplikasi yang lebih serius, dan pasien sudah memerlukan terapi pengganti ginjal (renal replacement therapy) antara lain dialisis atau trasplantasi ginjal. Pada keadaan ini pastilah dikatakan sampai pada stadium gagal ginjal.
2.4. Gangguan hemostasis pada PGK
Tabel 3. Gangguan hemostasis pada PGK Gangguan hemostasis pada PGK
1. Peningkatan dari tissue factor (TF) 2. Peningkatan dari faktor von Willebrand 3. Peningkatan faktor XIIa
4. Peningkatan faktor VIIa 5. Peningkatan aktivasi protein C 6. Peningkatan dari fibrinogen
7. Penurunan dari tissue plasminogen activator 8. Peningkatan dari plasminogen activator inhibitor 1
2.4.1. Meningkatnya resiko pendarahan
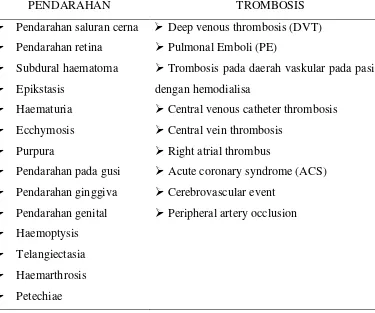
Tabel 4. Gambaran klinis dari gangguan ginjal
Deep venous thrombosis (DVT)
Pulmonal Emboli (PE)
Trombosis pada daerah vaskular pada pasien dengan hemodialisa
Central venous catheter thrombosis
Central vein thrombosis
Right atrial thrombus
Acute coronary syndrome (ACS)
Cerebrovascular event
Peripheral artery occlusion
2.4.1.1.Gangguan trombosit karena uremia
Telah terbukti bahwa fungsi trombosit terganggu pada pasien dengan gangguan ginjal yang berat30. Dimana kelainan fisiologi pada trombosit berkontribusi terhadap disfungsi platelet dengan masalah pendarahan pada pasien dengan gangguan ginjal yang disebabkan karena gangguan granule platelet α32.
Platelet α mengandung faktor trombosit 4, transforming growth factor- 1, platelet yang berasal dari faktor pertumbuhan, fibronektin, B thromboglobulin, vWF, fibrinogen, serotonin dan faktor koagulasi V dan XIII. Pada pasien uremik,
peningkatan kandungan kalsium dan terganggunya aliran kalsium, telah memiliki hubungan dengan terjadinya disfungsi trombosit dan pendarahan pada pasien uremik. Trombosit pada pasien uremik juga menunjukkan deregulasi asam arakidonat dan metabolisme prostaglandin dengan gangguan sintesis dan atau pelepasan tromboksan A2 yang mengakibatkan berkurangnya adhesi dan agregasi trombosit pada gangguan pendarahan32, yang dapat diperbaiki dengan dialisis , sehingga menunjukkan bahwa toksin uremik terkait dengan efek ini33. Selain itu, ultrafiltrasi uremik menghambat platelet-activating factor synthesis yang dapat menjelaskan mengapa aktivitas platelet menurun.34
Sirkulasi dari fragmen fibrinogen juga dapat mengganggu homeostasis karena mengikat dengan reseptor glikoprotein (GP) IIb / IIIa pada trombosit yang mengakibatkan adhesi dan potensi agregasi trombosit menurun.35
2.4.1.2.Interaksi antara trombosit dan dinding pembuluh darah
Pengikatan trombosit ke dinding pembuluh dimediasi oleh adhesi dari protein fibrinogen dan vWF dan reseptor GP Ib serta kompleks GP IIb / IIIa30. Penurunan dari jumlah GP Ib pada trombosit telah diamati pada pasien uremik, yang kemungkinan disebabkan oleh proteolisis tinggi dari GP Ib38. Gangguan pengikatan vWF dan fibrinogen untuk mengaktifkan trombosit pada pasien uremik dapat disebabkan dari fungsi kompleks GP IIb / IIIa yang menurun.39 Selain itu, kerusakan fungsional dalam interaksi vWF dengan trombosit dapat berhubungan dengan meningkatnya resiko pendarahan.40
Selain itu, zat vasoaktif seperti oksida nitrat (NO) juga menghambat agregasi platelet melalui pembentukan cGMP, atau prostasiklin, yang memodulasi tonus pembuluh darah, dapat juga berperan dalam gangguan hemostasis pada gagal ginjal. Kadar plasma dari prostasiklin, NO generasi trombosit dan konsentrasi metabolit NO meningkat dalam plasma pasien uremik, sehingga memberikan kontribusi untuk terganggunya hemostasis dengan risiko pendarahan yang meningkat41. Semua perubahan ini dapat berhubungan dengan faktor yang muncul dalam plasma uremik.
2.4.1.3.Anemia
Salah satu faktor penting dalam terjadinya gangguan pendarahan pada pasien uremik adalah anemia pada gangguan ginjal itu sendiri42. Pada pasien dengan gagal ginjal, anemia secara langsung mempengaruhi waktu pendarahan.43
dan inaktivasi PGI2, sehingga menstimulasi fungsi trombosit44. Selain itu, hemoglobin mengikat NO45. Dengan demikian, anemia mengurangi fungsi trombosit oleh karena berkurangnya interaksi dinding platelet dengan dinding pembuluh darah, mengurangi pelepasan ADP atau inaktivasi PGI2 serta mengurangi pengikatan NO.
Temuan ini didukung oleh pengamatan pada pasien uremik dimana aktivitas dari eritrosit atau erythropoietin mengurangi waktu pendarahan. Namun, hematokrit yang normal dikaitkan dengan peningkatan insiden infark miokard dan angka kematian yang lebih tinggi. Jadi sejauh ini, hematokrit optimal pada pasien dialisis perlu ditentukan untuk menghindari gangguan pendarahan di satu sisi dan peristiwa trombotik di sisi lain.46
2.4.2. Peningkatan resiko trombosis
Risiko tromboemboli vena meningkat pada pasien dengan gagal ginjal31. Angka kematian yang berhubungan dengan emboli paru (PE) adalah lebih besar pada pasien dengan gagal ginjal bila dibandingkan dengan tanpa penyakit ginjal47. Resiko terjadinya tromboemboli meningkat 2 kali lipat pada pasien dengan penyakit ginjal lanjut, sementara risiko yang lebih tinggi memiliki telah ditunjukkan pada pasien rawat inap dengan gangguan ginjal48. Resiko mulai meningkat ketika LFG <75 mL/min/1.73 m2. Selama tahap awal dari PGK, resiko trombosis tampaknya berhubungan dengan albuminuria.49
Klinis trombosis relevan pada pasien dengan gagal ginjal dapat muncul dengan trombosis vena dalam dengan atau tanpa PE, trombosis vaskular akses pada hemodialisis termasuk trombosis pemasangan arteriovenous serta trombosis AV fistula, sentral trombosis vena kateter dengan atau tanpa trombosis vena sentral, trombus atrium kanan. Selain itu, pembentukan trombus juga dapat terjadi pada arteri yang sering mengalami aterosklerosis, dan bisa dijumpai sebagai sindrom koroner akut, kejadian serebrovaskular atau oklusi arteri perifer (Tabel 3).47
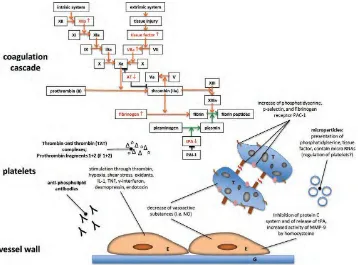
2.4.2.1.Kaskade koagulasi
menginduksi faktor transkripsi proinflamasi Nf-kB serta protease-activated receptor-152. Hal ini menunjukkan bahwa konsentrasi faktor koagulasi XIIa dan VIIA serta diaktifkannya kompleks protein C dan kompleks trombin-antitrombin yang meningkat pada pasien dengan gagal ginjal53. Sehingga menyebabkan aktivitas antitrombin berkurang.54
Sebuah sistem klinis penting yang mungkin terlibat dalam keadaan hiperkoagulasi pasien dengan gagal ginjal adalah kemungkinan dari sistem renin-angiotensin-aldosteron sebagai aktivasi telah dikaitkan dengan peningkatan tingkat fibrinogen plasma, D-dimer dan PAI-155. PAI-1 telah dikaitkan dengan penghambatan dari perubahan matriks ekstraseluler, stimulasi makrofag dan infiltrasi myofibroblast serta regulasi TGF- , sehingga menyebabkan fibrosis jaringan dengan progresifitas dari PGK56. Selain itu, PAI-1 menghambat aktivasi sistem fibrinolitik melalui penghambatan t-PA dan urokinase.
2.4.2.2.Trombosit
pembentukan oksigen radikal bebas oleh granulosit neutrofil yang menyebabkan pembentukan trombus pada pasien dengan gagal ginjal .57
2.4.2.3.Endothelium
Endotelium penting untuk hemostasis. Endotelium bertanggung jawab untuk sekresi faktor modulasi kaskade koagulasi seperti PAI - 1 dan vWF, berperan dalam pengaturan vaskular, mengatur stres oksidan dan respon inflamasi dan menghasilkan endotel mikropartikel (MPs)58. Selanjutnya, hal ini mempengaruhi hemostasis melalui proses proliferasi atau perbaikan yang juga termasuk sel-sel progenitor endotel ( EPC )59. Endotelium mungkin kehilangan sifat anti trombogeniknya jika dirangsang oleh trombin, hipoksia, oksidan, interleukin-1, tumor necrosis factor, -interferon, desmopressin asetat dan endotoksin58. Pada pasien dengan gagal ginjal stadium akhir, kerusakan sel endotel dapat menyebabkan gangguan koagulasi bersama dengan trombofilia.
Homosistein dapat memainkan peran sebagai mediator antara disfungsi ginjal dan kerusakan sel endotel . Hal ini dapat menghambat trombomodulin dependen mengaktifkan sistem protein C yang menghasilkan aktivasi trombin yang permanen dengan pembentukan selanjutnya adalah fibrin. Keadaan ini mengganggu pelepasan endothelial dari t - PA menjadi hipofibrinolisis. Hal ini juga dapat disebabkan oleh gangguan dari pelepasan t - PA dari endotelium dengan vasodilatasi endothelium dependen.
diketahui sebagai penanda aktivasi sel endotel. Namun, konsentrasi tinggi dari plasma fibrinogen, D-dimer, kompleks trombin-antitrombin, koagulasi faktor VII, vWF, trombomodulin dan PAI-1 semua dapat menunjukkan kerusakan sel endotel dan keadaan trombofilik pada pasien uremik.58
Aterosklerosis sendiri tampaknya dikaitkan dengan peningkatan risiko terjadinya trombosis vena pada pasien dengan gagal ginjal60. Alasan dari fenomena ini bisa tumpang tindih yang berhubungan dengan faktor risiko seperti obesitas, hipertensi, merokok, diabetes dan dislipidemia. Selain itu, pada pasien dengan gagal ginjal, trombosit dan sistem koagulasi dapat diaktifkan dalam pembuluh darah yang aterosklerotik yang berkontribusi terhadap pembentukan trombosis vena pada pembuluh darah yang berbeda. Dalam sebuah studi berbasis populasi baru-baru ini, 26% dari pasien dengan trombosis vena juga memiliki riwayat gejala aterosklerosis61. Menariknya, mikroalbuminuria juga terkait dengan terjadinya trombosis vena. Hal ini dapat dikaitkan dengan fakta bahwa mikroalbuminuria mencerminkan keparahan kerusakan endotel yang pada gilirannya dapat menyebabkan trombosis.62
2.4.2.4.Mikropartikel
2.5. Kerangka Teori
PGK
Koagulasi Endothel Mikro partikel
47
2.6. Kerangka konsep
PGK stadium
III,IV,V pre
dialisis
aPTT, PT, D-Dimer,
Waktu pendarahan,
trombosit
Resiko trombosis
Resiko pendarahan
48
BAB III
METODE PENELITIAN
3.1. Desain Penelitian
Cross sectional (Potong lintang) yaitu untuk menilai korelasi LFG dengan gangguan hemostasis pada pasien PGK.
3.2. Ruang Lingkup Penelitian 3.2.1. Lingkup wilayah
Wilayah penelitian adalah Sub Divisi Hematologi Onkologi Medik Departemen Ilmu Penyakit Dalam RSUP HAJI ADAM MALIK MEDAN.
3.2.2. Lingkup waktu
Penelitian dikerjakan pada bulan Juli 2014- September 2014 atau sampai sampel terpenuhi
3.2.3. Lingkup ilmu
Bidang ilmu yang diteliti meliputi Sub Divisi Hematologi Onkologi Medik yang bekerjasama dengan Sub Divisi Ginjal Hipertensi Departemen Ilmu Penyakit Dalam RSUP Haji Adam Malik Medan
3.3. Populasi dan Sampel 3.3.1. Populasi
49
Keseluruhan pasien tersebut dianggap homogen dalam mempengaruhi gangguan hemostasis pada penderita GGK.
3.3.2. Sampel penelitian
Besar sampel ditentukan dengan menggunakan rumus jumlah sampel untuk uji hipotesis beda untuk disain cross sectional, yaitu:
n = (
Zα)
2PQ
d
2n = besar sampel
P = Proporsi Penurunan LFG yang mulai telah dikeluhkan penderita GGK (30%)
Q = 1-P (70%)
d = presisi penelitian yaitu 10%
Zα = deviat baku alpha yaitu 1,96
Dari perhitungan diatas diperoleh jumlah sampel 80,6. Dengan demikian maka besar sampel untuk penderita PGK adalah 80,6/3 dan diperoleh 26,8. Dibulatkan menjadi 30 penderita PGK untuk masing-masing stadium III, IV dan V.
3.3.3. Teknik Pengambilan Sampel
Sampel diambil secara consecutive sampling yaitu pasien yang datang berobat ke Sub Bagian Ginjal Hipertensi Departemen Ilmu Penyakit Dalam dan yang dirawat di bangsal RSUP Haji Adam Malik Medan pada saat penelitian sampai memenuhi jumlah sampel minimal yang dibutuhkan. Sampel diperiksa di RSUP Haji Adam Malik Medan.
3.3.4. Kriteria Inklusi
50
1. Pasien usia lansia ( usia > 65 tahun) 2. Pasien PGK dengan dialisis
3. Gangguan fungsi hati 4. Pasien Sepsis
5. Gambaran klinis DIC 6. Gambaran klinis DVT
7. Sedang mengkonsumsi anti platelet
8. Sedang dalam pemakaian terapi anti koagulan 9. Ibu hamil
3.4. Kerangka Operasional
Pasien PGK stadium III, IV, V
predialisis
- APTT (activated partial thromboplastin time) - D-Dimer- Trombosit ANALISA STATISTIK
51
3.5. Variabel penelitian dan Defenisi Operasional 3.5.1. Variabel penelitian
3.5.2. Pengukuran Variabel
Mengukur variabel independen (LFG pasien PGK stadium III, IV dan V pre dialisis yang mempengaruhi) dan variabel dependen (gangguan hemostasis) sebagaimana tabel 5.
Tabel 5. Aspek Pengukuran Variabel Penelitian
53
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Penelitian ini dilakukan dari bulan Juli – September 2014 di ruang rawat inap dan poliklinik penyakit Dalam RSUP H.Adam Malik Medan dengan metode cross sectional, dan pengumpulan sampel dilakukan dengan cara consecutive sampling. Seluruh sampel yang disertakan dalam penelitian ini dibagi dalam tiga kelompok penelitian, yaitu kelompok PGK stadium III, PGK stadium IV, dan PGK stadium V.
4.1.1. Karakteristik Dasar
Berdasarkan karateristik dasar, pasien yang paling banyak adalah laki-laki dengan jumlah 17 orang (56,7%), dan rentang umur : 51-60 tahun, yaitu sebanyak 12,4%, dan etiologi PGK yang paling banyak adalah pada pasien DM tipe 2 sebanyak 47%, trombositosis, rasio PT dan aPTT yang memanjang dijumpai masing-masing 13,3%, 13,3% dan 23,3%, Dijumpai adanya peningkatan D-dimer pada pasien PGK sebanyak 46,7% . Sementara pemanjangan waktu pendarahan pada PGK dijumpai sebanyak 20% (Tabel 6).
54
4.1.2. Hubungan LFG dengan Trombosit pada subjek PGK
Untuk menilai korelasi antara LFG dan stadium PGK dengan trombosit dilakukan dengan uji korelasi spearman.
55
Tabel 7. Korelasi antara LFG dengan Trombosit
Variabel LFG
Trombosit r p
0,262 0,162
Uji Correlations Spearman's rho
Berdasarkan uji korelasi spearman, dijumpai korelasi positif kuat antara jumlah trombosit dengan PGK stadium IV dan V, dengan masing-masing nilai r = 0,429 dan r = 0,711. Sementara untuk PGK stadium III dijumpai korelasi negatif lemah (r = -0,365) yang berarti semakin tinggi nilai LFG maka semakin rendah nilai trombosit . Dari ketiga variabel stadium PGK, PGK stadium III memiliki korelasi yang signifikan dengan jumlah trombosit (p=0,02) (Tabel 8).
Tabel 8. Korelasi antara Stadium PGK dengan Trombosit
Variabel Stadium PGK
Trombosit
Stadium III Stadium IV Stadium V
r p r p r P
-0,365 0,3 0,429 0,216 0,711 0,021 4.1.3. Hubungan penanda koagulasi dengan subjek PGK.
56
Tabel 9. Korelasi antara LFG dengan penanda koagulasi
Variabel
LFG
r p
PT -0,27 0,15
aPTT 0,18 0,33
Waktu pendarahan 0,25 0,18
D-Dimer 0,28 0,13
Uji Correlations Spearman's rho
Dijumpai korelasi positif sedang yang signifikan antara nilai aPTT dengan PGK stadium III dengan r = 0,68; p 0,03, sementara untuk PGK stadium IV dijumpai korelasi negatif sedang dengan nilai aPTT (r = -0,59) dan korelasi positif sedang dengan D-Dimer (r= 0,57) akan tetapi kedua korelasi ini tidak memiliki hubungan yang signifikan (p=0,07;p=0.08). Sementara pada PGK stadium V dijumpai korelasi negatif lemah pada nilai PT dan aPTT dan korelasi positif lemah pada Waktu pendarah dan D-Dimer akan tetapi keempat variabel ini tidak memiliki korelasi yang signifikan (Tabel 10).
Tabel 10. Korelasi antara Stadium PGK dengan penanda koagulasi
Variabel
Stadium PGK
Stadium III Stadium IV Stadium V
r p r P r p
PT 0,078 0,83 -0,367 0,29 -0,05 0,88
aPTT 0,68 0,03 -0,59 0,07 -0,04 0,9
57
D-Dimer 0,23 0,52 0,57 0,08 0,02 0,94
Uji Correlations Spearman's rho
4.2. Pembahasan
Pada penelitian ini dilakukan penilaian terhadap kadar trombosit dan faktor koagulasi pada pasien-pasien PGK stadium III, IV dan V yang belum menjalani tindakan hemodialisa.
Pada penelitian ini tidak dijumpai korelasi yang signifikan (p >0,05) antara peningkatan nilai aPTT dengan LFG, akan tetapi bila dilakukan uji korelasi nilai aPTT berdasarkan stadium dari PGK, dijumpai adanya korelasi yang signifikan (p <0,05) antara peningkatan nilai aPTT dengan PGK stadium III. Hal ini serupa dengan studi yang dilakukan oleh subhan-ud-din dkk.10
Peningkatan aPTT pada PGK pre HD disebabkan oleh karena terjadinya disfungsi endotel yang akan menurunkan faktor koagulasi V, VIII, IX, X, XI, XIII, protrombin, fibrinogen, prekalikren, kininogen, dimana terjadi peningkatan aktifitas fibrinolisis dan penurunan kadar fibrinogen yang biasanya disebabkan karena adanya inhibitor dan defisiensi faktor koagulasi VIII, IX, XI, XII, protrombin, fibrinogen, prekalikren, serta kininogen.
Dijumpai adanya pemanjangan nilai PT pada PGK stadium III didapati 2 dari 10 sampel, pada PGK stadium IV 1 dari 10 sampel dan pada PGK stadium V 1 dari 10 sampel. Korelasi antara LFG dan pemanjangan nilai PT pada penelitian ini tidak signifikan, begitu juga bila di lakukan pemeriksaan berdasarkan stadium dari PGK, juga tidak dijumpai hasil yang signifikan.
58
pemanjangan nilai PT ≥ 11 detik lebih banyak apabila dibandingkan dengan PGK
tanpa DM tipe 2. Pemanjangan nilai PT pada penyakit ginjal kronik disebabkan oleh disfungsi endotel yang akan menurunkan faktor koagulasi V, VII, X, protrombin, fibrinogen sehingga menyebabkan peningkatan aktifitas fibrinolisis dan penurunan kadar fibirogen yang biasanya disebabkan karena adanya inhibitor dan defisiensi faktor koagulasi V, VII, XI.
Hasil pemeriksaan waktu pendarahan pada penelitian ini tidak memiliki korelasi yang signifikan (p>0,05) baik pada LFG maupun pada stadium dari PGK. Korelasi yang dijumpai pada penelitian ini bila dilihat berdasarkan hubungannya dengan LFG memiliki korelasi positif lemah. Sedangkan bila dilihat berdasarkan stadium dari PGK, pada PGK stadium III dan V ditemukan korelasi positif. Pada penelitian ini dijumpai hanya 2 pasien pada PGK stadium V yang waktu pendarahannya memanjang. Penelitian yang dilakukan oleh Subhan-ud-din dkk melaporkan tidak dijumpai adanya pemanjangan waktu pendarahan pada PGK stadium III dan IV, hanya 5 dari 50 pasien dengan PGK stadium IV yang waktu pendarahannya memanjang. Penelitian lain yang dilakukan oleh Prima astiawanti juga tidak menemukan perbedaan waktu pendarahan yang bermakna pada pasien PGK yang menderita DM dibandingkan dengan tanpa DM. Pada penelitian ini tidak dijumpai adanya pemanjangan dari waktu pendarahan.10
59
dilakukan oleh Reza Karami-Djurabi dkk menunjukkan adanya hubungan yang
signifikan antara peningkatan D-Dimer dengan 3 kategori penurunan dari LFG untuk gangguan ginjal moderat dibandingkan dengan gangguan ginjal ringan dan dengan fungsi ginjal normal.
Pada penelitian ini dijumpai 3 dari 10 pasien PGK stadium V yang diamati mengalami trombositopenia Pada penelitian ini dijumpai korelasi positif yang signifikan antara nilai LFG dengan trombosit pada PGK stadium V. Korelasi positif ini juga dijumpai pada PGK stadium IV dan juga bila dilihat dari hubungan LFG dengan trombosit, akan tetapi hasil ini tidak signifikan. Berdasarkan LFG secara umum tidak dijumpai adanya korelasi yang signifikan. Pada penelitian yang dilakukan oleh subhan-ud-din melaporkan hubungan yang signifikan pada keadaan trombositopenia pada PGK stadium III, dan stadium IV.10
60
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Pada pasien PGK yang belum menjalani tindakan hemodialisis, ada hubungan korelasi positif yang kuat dengan gangguan hemostasis terutama pada aPTT, trombosit dan D-Dimer.
5.2. Saran
61
DAFTAR PUSTAKA
1. Furie B, Furie BC. Mechanisms of thrombus formation. N Engl J Med
2008;359(9):938–949.
2. Lane DA, Philippou H, Huntington JA. Directing thrombin. Blood
2005;106(8):2605–2612.
3. Jalal DI, Chorchol M, Targher G. Disorder of homeostasis with chronic.
Kidney disease. Semin thromb Hemost. 2010; 36 (1) : 34-40.
4. Steiner RW, Coggin C, Carvalha AC, Bleeding time in uremia A useful test
to assess clinical bleeding AMJ Hematol 1979; 7: 107-17.
5. Boceardo P, Remuzzi G, Galbusera M, Platelet dysfunction in renal failure
semin thrombo Hemost. 2004; 30(5): 579-89.
6. KawD, Malhotra D. Platelet dysfunction and end stage renal disease. Semin
Dial 2006: 19(4): 317-22.
7. Mehta AB, Hoffbrand AV, Hematological aspect of systemic disease. In
Hoffbrand AV, Tuden H, eds. Postgraduate hematology. 5th ed. Oxford;
Blackwell, 2005; 971-72.
8. Hunt BJ, Grcaves M. Acquired venous thrombosis. In: Hoffbrand AV,
Tuden H, eds. Postgraduate Haematology 5th ed. Oxford: Blackwell, 2005.
901.
9. Kim SY, Lee SK. Son JS, Han YJ, Song HS. Preoperative assessment of
coagulation profiles using a thromboelastography in patients with chronic
62
10. Subdan-ud-Din, Shah A.R. Shahida. Heomostatic defects in chronic kidney
disease J.Med.Sci 2013; 21(3) : 149-152.
11. Ketut suwitra. Penyakit ginjal kronik. Buku ajar ilmu penyakit dalam.Jilid 1.
Edisi ke- 5. Jakarta: Balai penerbit FK UI; 2009.p1035-1040.
12. I Made Bakte. Hematologi klinik ringkas. Edisi-1. Jakarta :Penerbit EGC;
2006 p 233-254.
13. Mehta AB, Hoffbrand AV, Hematological aspect of systemic disease. In
Hoffbrand AV, Tuden H, eds. Haematology at a glance. 1st ed. Oxford;
Blackwell, 2000; 78-81.
14. Leung LK Lawrence MD, Overview of hemostasis. Uptodate (Online
journal), diunduh 7 Oktober 2013. Tersedia dari
http://www.uptodate.com/contents/overview-of-hemostasis.
15. Clemetson KJ. Platelet GPIb-V-IX complex. Thromb Haemost 1997; 78:266.
16. López JA, Andrews RK, Afshar-Kharghan V, Berndt MC. Bernard-Soulier syndrome. Blood 1998; 91:4397.
17. Sixma JJ, van Zanten GH, Huizinga EG, et al. Platelet adhesion to collagen: an update. Thromb Haemost 1997; 78:434.
18. Savage B, Shattil SJ, Ruggeri ZM. Modulation of platelet function through adhesion receptors. A dual role for glycoprotein IIb-IIIa (integrin alpha IIb beta 3) mediated by fibrinogen and glycoprotein Ib-von Willebrand factor. J Biol Chem 1992; 267:11300.
63
20. Kroll MH, Schafer AI. Biochemical mechanisms of platelet activation. Blood 1989; 74:1181.
21. Gawaz M, Neumann FJ, Dickfeld T, et al. Activated platelets induce monocyte chemotactic protein-1 secretion and surface expression of intercellular adhesion molecule-1 on endothelial cells. Circulation 1998; 98:1164.
22. Harrison P, Savidge GF, Cramer EM. The origin and physiological relevance of alpha-granule adhesive proteins. Br J Haematol 1990; 74:125.
23. Reinhardt C, von Brühl ML, Manukyan D, et al. Protein disulfide isomerase acts as an injury response signal that enhances fibrin generation via tissue factor activation. J Clin Invest 2008; 118:1110.
24. Kojima H, Newton-Nash D, Weiss HJ, et al. Production and
characterization of transformed B-lymphocytes expressing the membrane defect of Scott syndrome. J Clin Invest 1994; 94:2237.
25. Suharti C. Dasar-dasar hemostasis. Sudoyo Aru W, Setiyohadi Bambang,
dkk. Buku ajar penyakit dalam. Edisi 5. 2009; 1293-1300.
26. Frith D, Goslings JC, Gaarder C, et al. Definition and drivers of acute traumatic coagulopathy: clinical and experimental investigations. J Thromb Haemost 2010; 8:1919.
27. JIM RT. A study of the plasma thrombin time. J Lab Clin Med 1957; 50:45. 28. Malyszko J, Malyszko JS, Mysliwiec M, Buzcko W. Hemoostasi in chronic
64
29. Moal V, Brunet P, Dou L et al. Impaired expression of glycoproteins on resting and stimulated platelets in uraemic patients. Nephrol Dial Transplant 2003; 18: 1834–1841.
30. Kaufman JS, O‘Connor TZ, Zhang JH et al. Randomized controlled trial of clopidogrel plus aspirin to prevent hemodialysis access graft thrombosis. J Am Soc Nephrol 2003; 14: 2313–2321.
31. Parikh AM, Spencer FA, Lessard D et al. Venous thromboembolism in patients with reduced estimated GFR: a populationbased perspective. Am J Kidney Dis 2011; 58: 746–755.
32. Di Minno G, Martinez J, McKean ML et al. Platelet dysfunction in uremia. Multifaceted defect partially corrected by dialysis. Am J Med 1985; 79: 552–559.
33. Bloom A, Greaves M, Preston FE et al. Evidence against a platelet cyclooxygenase defect in uraemic subjects on chronic haemodialysis. Br J Haematol 1986; 62: 143–149.
34. Wratten ML, Tetta C, De Smet R et al. Uremic ultrafiltrate inhibits platelet-activating factor synthesis. Blood Purif 1999; 17: 134–141.
35. Thekkedath UR, Chirananthavat T, Leypoldt JK et al. Elevated fibrinogen fragment levels in uremic plasma inhibit platelet function and expression of glycoprotein IIb–IIIa. Am J Hematol 2006; 81: 915–926.
65
37. Brunini TM, Mendes-Ribeiro AC, Ellory JC et al. Platelet nitric oxide synthesis in uremia and malnutrition: a role for L-arginine supplementation in vascular protection? Cardiovasc Res 2007; 73: 359–367.
38. Mezzano D, Tagle R, Panes O et al. Hemostatic disorder of uremia: the platelet defect, main determinant of the prolonge bleeding time, is correlated with indices of activation of coagulation and fibrinolysis. Thromb Haemost 1996; 76: 312–321.
39. Benigni A, Boccardo P, Galbusera M et al. Reversible activation defect of the platelet glycoprotein IIb-IIIa complex in patients with uremia. Am J Kidney Dis 1993; 22: 668–676.
40. Mannucci PM, Remuzzi G, Pusineri F et al. Deamino-8-D-arginine vasopressin shortens the bleeding time in uremia. N Engl J Med 1983; 308: 8–12.
41. Kyrle PA, Stockenhuber F, Brenner B et al. Evidence for an increased generation of prostacyclin in the microvasculature and an impairment of the platelet alpha-granule release in chronic renal failure. Thromb Haemost 1988; 60: 205–208.
42. Galbusera M, Remuzzi G, Boccardo P. Treatment of bleeding in dialysis patients. Semin Dial 2009; 22: 279–286.
66
44. Gaarder A, Jonsen J, Laland S et al. Adenosine diphosphate in red cells as a factor in the adhesiveness of human blood platelets. Nature 1961; 192: 531– 532.
45. Martin W, Villani GM, Jothianandan D et al. Blockade of endothelium-dependent and glyceryl trinitrate-induced relaxation of rabbit aorta by certain ferrous hemoproteins. J Pharmacol Exp Ther 1985; 233: 679–685. 46. Vigano G, Benigni A, Mendogni D et al. Recombinant human
erythropoietin to correct uremic bleeding. Am J Kidney Dis 1991; 18: 44– 49.
47. Monreal M, Falga C, Valle R et al. Venous thromboembolism in patients with renal insufficiency: findings from the RIETE Registry. Am J Med 2006; 119: 1073–1079
48. Cook DJ, Crowther MA, Meade MO et al. Prevalence, incidence, and risk factors for venous thromboembolism in medicalsurgical intensive care unit patients. J Crit Care 2005; 20: 309–313.
49. Ocak G, Verduijn M, Vossen CY et al. Chronic kidney disease stages 1–3 increase the risk of venous thrombosis. J Thromb Haemost 2010; 8: 2428– 2435.
50. de la Serna G. Fibrinogen: a new major risk factor for cardiovascular disease. A review of the literature. J Fam Pract 1994; 39: 468–477.
67
52. Chu AJ. Tissue factor mediates inflammation. Arch Biochem Biophys 2005; 440: 123–132.
53. Matsuo T, Koide M, Kario K et al. Extrinsic coagulation factors and tissue factor pathway inhibitor in end-stage chronic renal failure. Haemostasis 1997; 27: 163–167.
54. Tomura S, Nakamura Y, Deguchi F et al. Coagulation and fibrinolysis in patients with chronic renal failure undergoing conservative treatment. Thromb Res 1991; 64: 81–90.
55. Tay KH, Lip GY. What ‗drives‘ the link between the renin -angiotensin-aldosterone system and the prothrombotic state in hypertension? Am J Hypertens 2008; 21: 1278–1279.
56. Huang Y, Noble NA. PAI-1 as a target in kidney disease. Curr Drug Targets 2007; 8: 1007–1015
57. Bonomini M, Dottori S, Amoroso L et al. Increased platelet phosphatidylserine exposure and caspase activation in chronic uremia. J Thromb Haemost 2004; 2: 1275–1281.
58. Molino D, De Lucia D, Gaspare De Santo N. Coagulation disorders in uremia. Semin Nephrol 2006; 26: 46–51.
59. Mohandas R, Segal MS. Endothelial progenitor cells and endothelial vesicles—what is the significance for patients with chronic kidney disease? Blood Purif 2010; 29: 158–162.
68
61. Piazza G, Goldhaber SZ, Lessard DM et al. Venous thromboembolism in patients with symptomatic atherosclerosis. Thromb Haemost 2011; 106: 1095–1102
62. Mahmoodi BK, Gansevoort RT, Veeger NJ et al. Microalbuminuria and risk of venous thromboembolism. JAMA 2009; 301: 1790–1797.
63. Camaioni C, Gustapane M, Cialdella P et al. Microparticles and microRNAs: new players in the complex field of coagulation. Intern Emerg Med 2011 Key NS. Analysis of tissue factor positive microparticles. Thromb Res 2010; 125: S42–S45.
64. Key NS. Analysis of tissue factor positive microparticles. Thromb Res 2010; 125: S42–S45.
65. Landry P, Plante I, Ouellet DL et al. Existence of a microRNA pathway in anucleate platelets. Nat Struct Mol Biol 2009; 16: 961–966.
69
70
Lampiran 2 : Master Tabel Penelitian
73
Trombosit Mean 243800,00 24496,887
95% Confidence Interval
for Mean
Lower Bound 193698,24
Upper Bound 293901,76
5% Trimmed Mean 235759,26
Median 200000,00
Variance 1,800E10
Std. Deviation 134174,976
Minimum 72000
74
Prothrombin Time (PT) Mean 16,400 1,1011
77
Explore Diagnosa
Descriptives
Diagnosa Statistic Std. Error