ABSTRAK
PENGARUH KONSENTRASI PIKLORAM DAN 2,4-D TERHADAP PROLIFERASI KALUS DAN REGENERASI TUNAS PADA KULTUR
IN VITRO TANAMAN TEBU (Saccharum officinarum L.) MT-72
Oleh
Agung Ari Brata
Proliferasi dan regenerasi tunas in vitro tanaman tebu (Saccharum officinarum L.)
berperan sangat penting dalam mendukung program pemuliaan tanaman tebu.
Penelitian ini bertujuan untuk mengetahui pengaruh
4-amino-3,5,6-trichloropicolinic acid (pikloram) dan 2,4-dichlorophenoxyacetic acid (2,4-D)
terhadap proliferasi kalus tanaman tebu dan respons pembentukan tunas in vitro
pada media penginduksi tunas. Eksplan yang digunakan adalah gulungan daun
muda (leaf roll). Induksi kalus primer dilakukan selama 8 minggu pada media
yang tersusun dari garam MS, 30 g/l sukrosa, 150 ml/l air kelapa, 100 mg/l
myo-inositol, 0.1 mg/l tiamin-HCl, 0.5 mg/l piridoksin-HCl, 0.5 mg/l asam nikotinat,
2 mg/l glisin, dan 3 mg/l 2,4-D. Kemudian kalus diperlakukan dengan beberapa
konsentrasi pikloram (1, 2, 3, 4, 5 mg/l), 2,4-D 3 mg/l dan kombinasi pikloram
dan 2,4-D (pikloram 2 mg/l + 2,4-D 1 mg/l dan pikloram 1 mg/l + 2,4-D 2 mg/l)
perlakuan 5 mg/l pikloram menghasilkan kalus dengan diameter, bobot kalus, dan
skor kalus embriogenik tertinggi. Hasil percobaan juga menunjukkan bahwa
kalus hasil proliferasi pada media yang mengandung pikloram 5 mg/l memberikan
respons pembentukan tunas tertinggi.
PENGARUH KONSENTRASI PIKLORAM DAN 2,4 D TERHADAP PROLIFERASI KALUS DAN REGENERASI TUNAS PADA KULTUR
IN VITRO TANAMAN TEBU (Saccharum officinarum L.) MT-72
Oleh
AGUNG ARI BRATA
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA PERTANIAN
Pada
Jurusan Agroteknologi
Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Kecamatan Sumberjaya, Kabupaten Lampung Barat pada tanggal
2 September 1992. Penulis adalah anak tunggal dari pasangan Drs. Abdul Malik dan
Dra. Juhaeti. Penulis menyelesaikan pendidikan di Sekolah Dasar Negeri 2 Sukapura
pada tahun 2004, Sekolah Menengah Pertama (SMP) Negeri 1 Sumberjata pada tahun
2007, dan Sekolah Menengah Atas (SMA) Negeri 1 Sumberjaya pada tahun 2010.
Kemudian pada tahun yang sama juga penulis melanjutkan studi di Jurusan
Agroteknologi, Fakultas Pertanian, Universitas Lampung.
Pada tahun 2013, penulis magang di laboratorium Ilmu Tanaman Universitas
Lampung. Penulis pernah menjadi asisten praktikum pada mata kuliah Dasar-Dasar
Budidaya Tanaman (S1). Kemudian pada bulan Juli 2013 penulis melaksanakan
kegiatan Praktik Umum di Balai Penelitian Tanaman Sayuran (BALITSA) dan pada
bulan Januarai 2014 penulis melaksanakan kegiatan Kuliah Kerja Nyata Universitas
Lampung (KKN) di Purbolinggo Kabupaten Lampung Timur. Pada bulan Juli 2014
penulis juga telah mengikuti kegiatan seminar dan rapat tahunan (SEMIRATA) PTN
seluruh bagian Barat sebagai peserta dan mempresentasikan hasil penelitian secara
Yaa ayyuhaalladzina aamanu ista’iinu biashabri waalshalaati innaallaaha ma’aalshabiriina. - Q.S. Al-Baqarah[153]
Musuh yang paling berbahaya di atas dunia adalah rasa takut dan bimbang dan teman yang paling setia hanyalah keberanian dan
keyakinan yang teguh. - Andrew Jackson
i SANWACANA
Segala puji hanyalah milik Allah SWT. Kepada-Nya kita memuja, meminta petunjuk,
memohon pertolongan, dan mengharapkan ampunan, sehingga penulis dapat
menyelesaikan skripsi dengan judul ‘Pengaruh Konsentrasi Pikloram dan 2,4 D Terhadap Proliferasi Kalus dan Regenerasi Tunas pada Kultur In Vitro Tanaman Tebu (Saccharum officinarum L.) MT-72’ adalah salah satu syarat untuk memperoleh gelar Sarjana Pertanian Universitas Lampung. Shalawat berserta salam tercurahkan
kepada baginda besar Nabi Muhammad SAW.
Dalam penulisan skripsi ini, Penulis telah banyak mendapat bimbingan, bantuan, serta
dukungan dari banyak pihak. Oleh karena itu, Penulis mengucapkan terima kasih
sebesar-besarnya kepada:
1. Bapak Dr. Ir. Dwi Hapsoro, M.Sc., selaku pembimbing pertama, pembimbing
akademik, dan dosen pengajar yang telah memberikan bimbingan, motivasi, saran,
nasehat, dan, pemikiran, yang diberikan selama penulis menyelesaikan pendidikan
Jurusan Agroteknologi Fakultas Pertanian.
2. Ibu Dr. Ir. Yusnita, M.Sc., selaku pembimbing kedua dan dosen pengajar, dan
Kepala Laboratorium Kultur Jaringan yang telah memberikan bimbingan, motivasi,
saran, nasehat, pemikiran, , dan fasilitas yang diberikan selama penulis
ii 3. Ibu Dr. Ir. Nyimas Sa’diyah, M.P., selaku penguji, dosen pengajar yang telah
memberikan saran, nasehat, motivasi, pemikiran, dan bimbingan yang diberikan
selama penulis menyelesaikan pendidikan.
4. Bapak Prof. Dr. Ir.Wan Abbas Zakaria, M.S., selaku Dekan Fakultas Pertanian
Universitas Lampung.
5. Bapak Dr. Ir. Kuswanta F. Hidayat, M.P., selaku Ketua Jurusan Agroteknologi.
6. Keluarga tersayang, Papah (Abdul Malik), Mamah (Juhaeti), dan seluruh keluarga
besar, atas seluruh doa, kasih sayang, cinta, dukungan, perjuangan, semangat,
motivasi, dan perhatian kepada penulis.
7. Sahabat-sahabat di Laboratorium Kultur Jaringan: Hayane Adeline Warganegara,
S.P., M.Si., Husna Fii Karisma Jannah, S.P., Linda Maylayuni, S.P.
8. Sahabat satu perjuangan Septiana Triyani telah bekerja keras dan bekerja sama
dengan baik selama ini.
9. Sahabat-sahabat tercinta: Novrik, Tibor Eka Saputra, Galih Dwi Cahyo, Bangun
Ferdian, Adawiyah Timur, Annisa Indra, Ade Yunike Larassati, Alawiyah, Sherly
Ardhani Pitaloka, Noviaz Adriani, Aulia Meydina, Dian Saputra, dan teman-teman
AGT 2010 yang tidak bisa disebutkan satu per satu atas dukungan, motivasi,
bantuan, perhatian dan kisah hingga saat ini.
10. Semua pihak yang telah banyak membantu yang tidak dapat penulis sebutkan satu
per satu baik secara langsung maupun tidak langsung dalam melaksanakan dan
iii Semoga Allah SWT menganugerahi rahmat atas semua bantuan yang telah mereka
berikan kepada penulis dan semoga hasil penelitian ini bermanfaat. Amin.
Bandar Lampung, Oktober 2014 Penulis,
iv DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
I. PENDAHULUAN ... 1
1.1 Latar Belakang dan Masalah ... 1
1.2 Tujuan Penelitian ... 7
1.3 Kerangka Pemeikiran ... 8
1.4 Hipotesis ... 9
II. TINJAUAN PUSTAKA ... 11
2.1 Deskripsi Tanaman Tebu ... 11
2.2 Perbanyakan Tanaman Tebu ... 13
2.3 Kultur Jaringan Tebu ... 14
2.4 Zat Pengatur Pertumbuhan (ZPT) ... 16
III. BAHAN DAN METODE ... 18
3.1 Tempat dan Waktu Penelitian ... 18
3.2 Metode Penelitian ... 18
3.2.1 Bahan Tanaman (Eksplan) ... 18
3.2.2 Persiapan Eksplan ... 19
3.2.3 Persiapan Media dan Alat ... 19
3.2.4 Sterilisasi dan Penanaman Eksplan ... 20
3.2.5 Induksi dan Proliferasi Kalus ... 21
3.2.6 Induksi Tunas ... 22
3.2.7 Analisis Statistika ... 22
v
IV. HASIL DAN PEMBAHASAN ... 26
4.1 Hasil Penelitian ... 26
4.1.1 Diameter dan Bobot Kalus Tebu ... 26
4.1.2 Skoring Kalus Embriogenik ... 28
4.1.3 Skoring Induksi Tunas ... 30
4.2 Pembahasan ... 32
4.2.1 Diameter dan Bobot Kalus Tebu ... 32
4.2.2 Kalus Embriogenik ... 33
4.2.3 Induksi Tunas ... 34
V. KESIMPULAN DAN SARAN ... 38
5.1 Kesimpulan ... 38
5.2 Saran ... 38
PUSTAKA ACUAN ... 39
DAFTAR TABEL
Tabel Halaman
1. Perlakuan yang dicobakan. ... 22
2. Pengaruh penambahan pikloram dan/atau 2,4 D terhadap
penambahan diameter kalus tebu umur 4 minggu. . ... 27
3. Pengaruh penambahan pikloram dan/atau 2,4 D terhadap
penambahan bobot kalus tebu umur 4 minggu. ... 28
4. Pengaruh konsentrasi pikloram dan/atau 2,4 D terhadap skor
dan persentase kalus embriogenik pada umur 8 minggu. ... 29
5. Skor induksi tunas dan persentase tunas yang terbentuk. ... 31
6. Formulasi Media Murashige & Skoog. ... 44
7. Data Pengamatan diameter kalus umur 4 minggu
setelah dikulturkan. ... 44
8. Analisis ragam untuk pengaruh pikloram dan/atau
2,4 D terhadap pertambahan diameter kalus. ... 45
9. Data pengamatan bobot kalus umur 4 minggu
setelah dikulturkan. ... 45
10. Analisis ragam untuk pengaruh pikloram dan/atau
2,4 D terhadap pertambahan bobot kalus. ... 46
11. Data skor kalus embriogenik. ... 46
12. Analisis ragam untuk pengaruh pikloram dan/atau
2,4 D terhadap skor kalus embriogenik. ... 47
13. Data skor pembentukan tunas. ... 47
[image:16.595.120.518.253.724.2]DAFTAR GAMBAR
Gambar Halaman
1. Penentuan skor pembentukan kalus embriogenik pada 8 MST. (a) skor 1, (b) skor 2,
(c) skor 3, (d) skor 4, (e) skor 5 ... 24
2. Penetuan skor induksi tunas 4 level. (a) skor 1,
(b) skor 2, (c) skor 3, (d) skor 3 ... 25
3. Pertumbuhan kalus tebu. (a) kalus primer yang dikulturkan ke dalam media perlakuan,
(b) kalus umur 2 minggu, (c) kalus umur 4 minggu ... 26
4. Pembentukan kalus embriogenik tebu yang dikulturkan in vitro pada berbagai media yang mengandung pikloram
dan 2,4-D pada 8 minggu setelah tanam ... 29
5. Penampilan tunas in vitro pada media induksi tunas 12 minggu setelah tanam dari kalus embriogenik
yang dihasilkan dari media proliferasi kalus yang mengandung
1
I. PENDAHULUAN
1.1 Latar Belakang dan Masalah
Masalah mengenai tebu yang hingga kini sering dihadapi adalah rendahnya
produktivitas tebu dan rendahnya tingkat rendemen gula. Rata-rata produktivitas
tebu yang ditanam di lahan sawah sekitar 95 ton/ha dan di lahan tegalan sekitar 75
ton/ha dengan rendemen gula sekitar 7,3—7,5% (Indrawanto et al., 2010).
Produktivitas dan rendemen ini masih di bawah potensi produktivitas dan
rendemen yang ada, yaitu di atas 100 ton/ha untuk pertanaman tebu di lahan
sawah dan sekitar 90 ton/ha untuk pertanaman tebu di lahan tegalan dengan
rendemen gula di atas 10%. Rendahnya produktivitas ini berakibat pula pada
rendahnya efisiensi pengolahan gula nasional, sedangkan kebutuhan gula di
Indonesia sebagai konsumsi langsung maupun industri terus meningkat sejalan
dengan meningkatnya jumlah penduduk (Indrawanto et al., 2010). Menurut
Ditjenbun (2013), pada tahun 2014 kebutuhan gula nasional akan mencapai 5,7
juta ton. Ditjenbun (2013) juga menyebutkan untuk memenuhi kebutuhan gula
tersebut diupayakan melalui program swasembada gula nasional dengan
2
Intensifikasi dilakukan dengan cara pengolahan tanah yang baik, pengairan/irigasi
yang teratur, penggunaan varietas unggul, pemupukan, pemberantasan hama dan
penyakit tanaman. Penggunaan varietas unggul merupakan salah satu cara untuk
meningkatkan produktivitas tanaman tebu. Karakteristik varietas unggul tebu
adalah yang memiliki hasil gula tinggi, rendemen gula tinggi, kualitas gilingan
tinggi, tahan hama dan penyakit, dan tahan rebah. Menurut P3GI (2012),
penggunaan varietas tebu unggul dapat meningkatkan produktivitas 21%–46%,
tapi produktivitas tebu dan produksi gula senantiasa dapat dioptimalkan, maka
varietas tebu unggul juga selalu diganti secara periodik dengan varietas yang baru.
Telah diketahui bahwa mendapatkan varietas ungggul tebu dilakukan dengan cara
pemuliaan tanaman untuk mendapatkan heterosis yang kuat dan stabil yang dapat
dilakukan dengan pemilihan kombinasi persilangan yang baik.
Saat ini pemuliaan tanaman tidak hanya dilakukan secara konvensional tapi juga
dapat dilakukan dengan cara biologi molekuler salah satu contohnya seperti
mutasi dan rekayasa genetik. Menurut Sisworo et al. (2010) teknik mutasi dalam
bidang pemuliaan tanaman dapat meningkatkan keragaman genetik tanaman
sehingga memungkinkan pemulia melakukan seleksi genotipe tanaman sesuai
dengan tujuan pemuliaan yang dikehendaki. Menginduksi mutasi dapat dilakukan
pada tanaman dengan perlakuan bahan mutagen tertentu terhadap organ
reproduksi tanaman seperti biji, stek batang, serbuk sari, akar/rhizome, kultur
jaringan dan sebagainya. Apabila proses mutasi alami terjadi sangat lambat, maka
percepatan, frekuensi dan spektrum mutasi tanaman dapat diinduksi dengan
perlakuan bahan mutagen tertentu. Umumnya bahan mutagen bersifat radioaktif
3
rakayasa genetik pada prinsipnya adalah memanipulasi susunan asam nukleat dari
DNA atau menyisipkan gen baru ke dalam struktur DNA organisme penerima.
Gen yang disisipkan pada organisme penerima dapat berasal dari organisme apa
saja misalnya, gen dari bakteri bisa disisipkan di kromosom tanaman, sebaliknya
gen tanaman dapat disisipkan pada kromosom bakteri. Penggabungan gen asing
ini bertujuan untuk mendapatkan tanaman dengan sifat-sifat yang diinginkan,
misalnya membuat tanaman yang tahan kekeringan, resisten terhadap organisme
pengganggu tanaman, serta kuantitas dan kualitas hasil yang lebih tinggi dari
tanaman alami. Menurut laporan Susiyanti et al. (2007) kalus tebu cv. PSJT
94-41 dapat ditransformasi dengan gen fitase melalui Agrobacterium tumefaciens GV
2260 (pBinPI-IIEC). Persentase kalus tebu transforman yang bertahan hidup
dalam media kanamisin mencapai 75%.
Dengan adanya pemuliaan tanaman tebu secara biologi molekuler yang telah
dipaparkan di atas maka, hal tersebut memberikan peran pada teknik regenerasi in
vitro atau biasa dikenal sebagai kultur jaringan yaitu sebagai fasilitator pada
rekayasa genetik dan mutasi tanaman tebu. Kultur jaringan adalah teknik
mengembangbiakkan bagian tanaman dalam kondisi aseptik di dalam tabung (in
vitro) yang berisi media buatan bernutrisi lengkap dan dalam kondisi terkontrol
untuk tujuan tertentu (Yusnita, 2003). Perbanyakan secara kultur jaringan
merupakan teknik yang memiliki keunggulan seperti, bebas virus dan memiliki
planlet yang true to type. Kultur jaringan tanaman menawarkan metodologi
terbaik pada budidaya tebu untuk mendapatkan kualitas dan bahan tanam pada
4
Perbanyakan tanaman tebu melalui kultur in vitro harus melalui tahap-tahap
regenerasi hingga tanaman tebu siap ditanam di lapang. Tahap-tahap tersebut
meliputi induksi kalus, proliferasi kalus, induksi tunas, induksi akar, hardening in
vitro, dan yang terakhir adalah aklimatisasi. Eksplan tanaman tebu membutuhkan
media tanam yang telah dikombinasikan dengan zat pengatur tumbuh yang
berbeda jenis maupun konsentrasi pada setiap tahapan regenerasinya. Contohnya
seperti menginduksi dan proliferasi kalus membutuhkan ZPT dari golongan
auksin. Menurut Pierik (1987) dalam kultur jaringan telah diketahui bahwa
auksin berfungsi sebagai penginduksi kalus, akar, pembelahan dan pemanjangan
sel. Kemudian dalam menginduksi tunas biasanya media tanam dikombinasikan
dengan ZPT dari golongan sitokinin. Sukmadjaja dan Mulyana (2011)
melaporkan bahwa regenerasi tunas tanaman tebu varietas PS 951 dapat dilakukan
dengan formulasi media MS + BAP 1 mg/l + kinetin 1 mg/l + NAA 0,5 mg/l +
GA3 0,5 mg/l.
Penelitian lainnya juga menyebutkan bahwa sebagian besar tunas tebu diproduksi
secara in vitro dengan mengkulturkan leaf roll tebu pada media MS + 3 mg/l
2,4-D selama 8 minggu untuk menginduksi pembentukan kalus kemudian induksi
kalus didapat dari media MS ditambah dengan 2,5 mg/l BA dikulturkan selama
8 minggu. Prosedur ini menghasilkan 100% respon pembentukan tunas dengan
36,4 tunas per kalus (Hapsoro et al., 2012). Setelah itu induksi akar dilakukan
dengan cara mengkulturkan eksplan pada media tanam yang telah berisi ZPT dari
golongan auksin salah satu contohnya adalah IBA. Khan dan Kathri (2006)
5
ketika planlet dipisahkan, daun dipangkas dan plantlet dikultur pada media
induksi akar yang mengdanung MS + 1 mg/l IBA + 6% sukrosa.
Pemuliaan tanaman secara biologi molekular baik mutasi maupun rekayasa
genetik membutuhkan sel-sel ataupun jaringan dari hasil kultur in vitro sebagai
target dan sel-sel atau jaringan tersebut harus diregenerasikan melalui kultur in
vitro untuk ditumbuhkan menjadi tanaman utuh. Seperti yang dilaporkan
Susiyanti et al. (2007) mengenai rekayasa genetik bahwa bahan-bahan yang
digunakan untuk transformasi gen fitase menggunakan Agrobacterium
tumefaciens antara lain pucuk tebu (cv. PSJT 94-41) yang dikulturkan menjadi
kalus embriogenik pada media MS + 3 mg/l 2,4-D selama 6 minggu. Koch et al.
(2010) melaporkan bahwa bahan yang digunakan dalam memutasi tanaman tebu
adalah kalus tanaman tebu yang diinduksi menggunakan formulasi media yaitu
MS + 2,4-D 3 mg/l. Kalus yang terbentuk kemudian disubkulturkan setiap
2 minggu untuk memacu proliferasi dan terjadinya keragaman somaklonal.
Proliferasi kalus adalah fase dimana kalus mengulang siklus pertumbuhan kalus
secara pesat tanpa hambatan. Pada tahap proliferasi inilah kalus tebu sangat
dibutuhkan untuk pemuliaan tanaman secara biologi molekular. Oleh karena itu
sangat penting untuk menentukan ZPT mana yang tepat untuk mendukung fase
ploriferasi agar lebih cepat dan menghasilkan kalus yang embriogenik.
Masalah dalam menggunakan ZPT adalah ketepatan dalam memilih jenis dan
konsentrasi ZPT itu sendiri. Oleh sebab itu hingga saat ini masih dilakukan
pengujian terhadap jenis dan konsentrasi ZPT yang tepat dalam menumbuhakan
6
dikarenakan jenis tanaman dan jaringan tanaman mempunyai respon tersendiri
terhadap pemberian zat pengatur tumbuh (Muchtar, 1996).
Dalam kultur jaringan tebu, ZPT yang biasa digunakan untuk menginduksi dan
proloferasi kalus adalah 2,4-Dichlorophenoxyacetic Acid (2,4-D) dengan
konsentrasi dalam media MS 3 mg/l. Seperti yang dilaporkan oleh Mayang et al.
(2011) bahwa penambahan 3 mg/l 2,4-D pada media MS menginduksi kalus
tanaman tebu dengan ukuran tertinggi. Kemudian Sisharmini et al. (2010), juga
menyebutkan bahwa media induksi kalus yang paling baik adalah media MS
dengan kombinasi hormon 4 mg/l 2,4-D + 2 mg/l pikloram (GIK-3) yang
menunjukkan frekuensi induksi kalus 100% pada tanaman gdanum, sedangkan
pikloram (4-amino-3,5,6-trichloropicolonic acid ) adalah jenis hormon sintetik
yang termasuk golongan auksin yang juga dapat digunakan untuk menginduksi
dan proliferasi kalus. Menurut penelitian Khan et al. (2008) induksi dan
proliferasi kalus tebu klon NIA-98, NIA-2004 dan BL4 terbaik didapat dari media
yang berisi 4 mg/l 2,4-D dan 4 mg/l pikloram. Untuk itu perlu dilakukan
pengujian konsentrasi yang tepat terhadap jenis ZPT pikloram dan
membdaningkannya dengan ZPT yang biasa digunakan yaitu 2,4-D dengan
7
1.2 Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut:
1. Mempelajari respon proliferasi kalus pada kultur tebu klon MT-72 terhadap
berbagai konsentrasi pikloram.
2. Mendapatkan konsentrasi pikloram terbaik untuk proliferasi kalus tanaman
tebu klon MT-72.
3. Membdaningkan proliferasi kalus tebu MT-72 yang dihasilkan oleh berbagai
konsentrasi pikloram dengan proliferasi kalus yang dihasilkan 2,4-D dengan
konsentrasi 3 mg/l
4. Mempelajari respon proliferasi kalus tanaman tebu klon MT-72 terhadap
kombinasi 2 mg/l pikloram dan 1 mg/l 2,4-D dan 1 mg/l pikloram dan 2 mg/l
2,4-D.
5. Mempelajari regenerasi kalus menjadi tunas dari kalus embriogenik yang
dihasilkan oleh berbagai konsentrasi pikloram dan kombinasinya dengan
8
1.3 Kerangka Pemikiran
Regenerasi tanaman dari kalus dimungkinkan dengan organogenesis atau
embriogenesis somatik (Mathur dan Koncz, 1998). Kalus merupakan kumpulan
sel yang tidak terorganisasi dan aktif membelah diri (meristematik) yang sering
terjadi karena pelukaan jaringan tanaman atau pengulturan berbagai jaringan
tanaman (Yusnita, 2003). Dalam kultur jaringan kalus merupakan salah satu
bentuk regenerasi yang dihasilkan dari penanaman eksplan ke dalam media.
Batasan yang serupa dinyatakan oleh George et al. (2008) bahwa kalus adalah
jaringan koheren (berhubungan) dan amorf (tidak memiliki bentuk yang jelas),
dibentuk ketika sel-sel tumbuhan berkembang biak dengan cara tidak teratur.
Kalus dapat diinisiasi in vitro dengan menempatkan potongan-potongan kecil dari
bagian tanaman (eksplan) ke dalam media pertumbuhan pendukung dalam kondisi
steril (George et al.,2008).
Pembentukan kalus yang diinisiasi in-vitro dilakukan dengan pengaplikasian
hormon seperti auksin. Aplikasi eksogen auksin dan sitokinin dapat menginduksi
dan memproliferasi kalus pada berbagai spesies tanaman. Zat pengatur
pertumbuhan dari golongan auksin yang biasa digunakan untuk menginduksi
kalus adalah 2,4-D, sedangkan dalam penelitian ini akan diuji konsentrasi
pikloram yang terbaik untuk proliferasi kalus tebu.
Pikloram baru-baru ini dilaporkan berhasil dalam kultur kalus Arecanut dan
produksi embrio somatik Arecanut. Produksi berlanjut dari embrio kalus yang
berasal dari eksplan awal menunjukkan potensi untuk perbanyakan kelapa (Karun
9
kalus dipaparkan oleh Khan et al. (2008) bahwa induksi dan proliferasi kalus tebu
NIA-98, NIA-2004 dan BL4 terbaik ditunjukkan pada media yang mengdanung 4
mg/l 2,4-D dan 4 mg/l pikloram. Oleh karena itu dibutuhkan pengujian lebih
lanjut mengenai konsentrasi pikloram yang terbaik serta kombinasi antara
pikloram dan 2,4-D terhadap proliferasi kalus tebu MT-72.
Sel-sel kalus dapat berdiferensiasi dengan penggunaan sitokinin. Selain
pembelahan sel, rasio antara auksin dan sitokinin menentukan diferensiasi kultur
jaringan tanaman baik akar ataupun tunas. Rasio antara auksin dan sitokinin yang
tinggi meningkatkan induksi akar dan rasio antara auksin dan sitokinin rendah
meningkatkan induksi tunas. Sitokinin juga berperan dalam induksi tunas lateral
dari dominasi apikal (Taiz dan Zeiger, 2010). Golongan sitokinin yang umum
digunakan adalah BA (6-benzyladenine) dan kinetin (Farid, 2003). Karim et al.
(2002) melaporkan bahwa jumlah tunas yang terbentuk per eksplan pada kultur
tebu yang diinduksi oleh BA lebih baik dibdaningakan dengan yang diinduksi
oleh Kinetin. Mayang et al. (2011) melaporkan bahwa konsentrasi BA yang
menghasilkan pertumbuhan dan perbanyakan terbaik tunas tebu dari kalus adalah
2,5 mg/l.
1.4 Hipotesis
Dari kerangka pemikiran yang telah dikemukakan, didapat hipotesis sebagai
berikut:
1. Peningkatan konsentrasi pikloram hingga 5 mg/l dalam media dapat
10
2. Respon proliferasi kalus tanaman tebu terhadap perlakuan pikloram tertinggi
akan lebih baik dibdaningkan terhadap konsentrasi 3 mg/l 2,4-D.
3. Kombinasi antara pikloram dan 2,4-D akan menghasilkan kalus tebu yang
11
II. TINJAUAN PUSTAKA
2.1 Deskripsi Tanaman Tebu
Tanaman tebu (Saccharum officinarum L.) tergolong dalam famili Graminae yaitu
rumput-rumputan. Saccharum officinarum merupakan spesies paling penting
dalam genus Saccharum sebab kandungan sukrosanya paling tinggi dan
kandungan seratnya paling rendah (Wijayanti, 2008).
Beberapa peneliti berkesimpulan bahwa tanaman tebu berasal dari India,
berdasarkan catatan-catatan kuno dari negeri tersebut. Bala tentara Alexander the
Great mencatat adanya tanaman di negeri itu ketika mencapai India pada tahun
325 SM (Tjokroadikoesoemo dan Baktir, 2005).
Klasifikasi ilmiah dari tanaman tebu adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermathophyta
Sub Divisi : Angiospermae
Kelas : Monocotyledone
Ordo : Glumiflorae
Famili : Graminae
Genus : Saccharum
12
Tanaman tebu mempunyai batang yang tinggi, tidak bercabang dan tumbuh tegak.
Tanaman yang tumbuh baik, tinggi batangnya dapat mencapai 3—5 meter atau
lebih. Pada batang terdapat lapisan lilin yang berwarna putih dan keabu-abuan.
Lapisan ini banyak terdapat sewaktu batang masih muda. Ruas-ruas batang
dibatasi oleh buku-buku yang merupakan tempat duduk daun. Pada ketiak daun
terdapat sebuah kuncup yang biasa disebut “mata tunas”. Bentuk ruas batang dan
warna batang tebu yang bervariasi merupakan salah satu ciri dalam pengenalan
varietas tebu (Wijayanti, 2008).
Tebu memilki daun tidak lengkap, karena hanya terdiri dari helai daun dan
pelepah daun saja. Daun berkedudukan pada pangkal buku. Panjang helaian daun
antara 1—2 meter, sedangakan lebar 4—7 cm, dan ujung daunnya meruncing
(Supriyadi, 1992). Pelepah tumbuh memanjang menutupi ruas. Pelepah juga
melekat pada batang dengan posisi duduk berselang seling pada buku dan
melindungi mata tunas (Miller dan Gilbert, 2006).
Pada tanah yang cocok akar tebu dapat tumbuh panjang mencapai 0,5—1,0 meter.
Tanaman tebu berakar serabut maka hanya pada ujung akar-akar muda terdapat
akar rambut yang berperan mengabsorpsi unsur-unsur hara (Wijayanti, 2008).
Tanaman tebu memiliki akar setek yang disebut juga akar bibit, tidak berumur
panjang, dan hanya berfungsi pada saat tanaman masih muda. Akar ini berasal
dari cincin akar dari setek batang, disebut akar primer (Miller dan Gilbert, 2006).
Kemudian pada tanaman tebu muda akan tumbuh akar tunas. Akar ini merupakan
pengganti akar bibit, berasal dari tunas, berumur panjang, dan tetap ada selama
13
2.2 Perbanyakan Tanaman Tebu
Penyediaan bibit unggul merupakan salah satu faktor pendukung keberhasilan
pengembangan tanaman tebu. Perbanyakan tanaman secara konvensional masih
dibatasi oleh kemampuan tanaman untuk menghasilkan bibit baru dalam jumlah
banyak, seragam dan dalam waktu singkat. Sampai saat ini tebu banyak
diproduksi dengan dua cara, yaitu dengan menggunakan biji dan stek. Usaha
perbanyakan tanaman tebu menggunakan stek atau biji memiliki kendala, yaitu
pada penggunaan biji untuk perbanyakan tanaman dalam jumlah banyak akan
mengurangi jumlah biji sedangkan teknik perbanyakan melalui stek menghasilkan
tanaman dengan jumlah terbatas, dan membutuhkan pohon induk yang banyak
(Rasullah et al., 2013).
Pengadaan bibit pada tanaman tebu khususnya yang akan dieksploitasi secara
besar-besaran dalam waktu yang cepat akan sulit dicapai melalui teknik
konvensional. Salah satu teknologi yang banyak dilaporkan dan telah terbukti
memberikan keberhasilan adalah melalui teknik kultur jaringan. Melalui kultur
jaringan tanaman tebu dapat diperbanyak dengan cepat setiap waktu sesuai
kebutuhan. Varietas baru yang telah dihasilkan para pemulia dapat segera
dikembangkan melalui kultur jaringan sehingga dapat digunakan oleh para petani,
dan pengguna lainnya. Perbanyakan tanaman melalui kultur jaringan khususnya
tanaman tebu telah banyak diterapkan di negara lainnya seperti Australia.
Keberhasilan perbanyakan tebu secara cepat, masal, seragam dan tidak mengubah
14
perbanyakan terutama masalah regenerasi yang sangat menentukan kecepatan
pengadaan bibit per satuan waktu, per satuan luas (Mariska dan Rahayu, 2011).
2.3 Kultur Jaringan Tebu
Saat ini perbanyakan in vitro dapat dilakukan dengan beberapa cara, yaitu kultur
setek satu buku, perbanyakan tunas samping, dan metode pembiakan dengan jalur
organogenesis dan embriogenesis somatik (Husein et al., 2006). Kultur jaringan
pada tanaman tebu pertama kali dilakukan pada tahun 1969 oleh Heinz dan Mee
yang berhasil meregenerasi kalus secara in vitro menjadi tanaman tebu.
Penelitian Sukmadjaja dan Mulyana (2011) menunjukkan bahwa regenerasi dan
pertumbuhan tanaman tebu secara in vitro dipengaruhi antara lain oleh jenis atau
varietas dan komposisi media tumbuh yang digunakan. Induksi kalus tanaman
tebu varietas Bulu Lawang dapat dilakukan dengan formulasi media MS + 2,4-D
2 mg/l + BAP 0,4 mg/l + CH 2000 mg/l dan varietas PS-951 dapat dilakukan
dengan formulasi media MS + 2.4-D 1 mg/l + BAP 0,4 mg/l. Regenerasi tunas
tanaman tebu varietas Bulu Lawang dapat dilakukan dengan formulasi media
Murashige dan Skoog (1962) tanpa penambahan zat pengatur tumbuh dan varietas
PS-951 dengan formulasi media MS + BAP 1 mg/l + kinetin 1 mg/l + NAA 0,5
mg/l + GA3 0,5 mg/l. Induksi perakaran tanaman tebu varietas Bulu Lawang dan
PS-951 dapat dilakukan dengan formulasi media MS + IBA 1 mg/l.
Khan dan Khatri (2006) melaporkan bahwa induksi kalus tebu, pertama kali
dimulai pada jaringan meristematik namun karena produksi fenol yang tinggi di
15
Sedangkan pada jaringan meristematik yang lebih muda tidak ada produksi fenol.
Eksplan meristematik menunjukkan potensi induksi kalus tertinggi dan secara
aktif tumbuh kompak berwarna putih. Kalus dipindahkan ke media MS yang
mengandung konsentrasi 2,4-D ( 0,5 mg/l) atau tanpa 2,4-D . Kalus yang
ditransfer pada media tanpa 2,4-D mulai berubah cokelat setelah 7 hari dari
subkultur, sedangkan kalus yang ditransfer pada medium yang mengandung
0,5 mg/l 2,4-D, menunjukkan struktur yang pro-embrioids setelah 14—19 hari.
Karakteristik atau ciri morfologi utama embrio somatik adalah ditunjukkannya
bipolaritas dan tidak adanya koneksi dengan jaringan vaskular (Reinert, 1977
dalam Khan dan Khatri, 2006). Karakteristik ini pada tebu dijelaskan oleh
Guiderdoni dan Demarly (1988) melalui analisis histologis embrio somatik yang
menunjukkan orientasi bipolar khas, scutellum, koleoptil dan tidak adanya
koneksi jaringan vaskular dengan jaringan yang berdekatan .
Setelah kalus terbentuk langkah selanjutnya dalam kultur jaringan tanaman tebu
adalah menginduksi tunas dari kalus tersebut. Hapsoro et al. (2012) melaporkan
bahwa sejumlah besar tunas tebu secara in vitro diproduksi dengan cara
mengkulturkan leaf roll tebu pada media MS + 2,4-D dengan konsentrasi 3 mg/l
selama 8 minggu untuk menginduksi pembentukan kalus dan mengkulturkan
kalus ke dalam media MS + 2,5 mg/l BA selama 8 minggu untuk pembentukan
tunas. Prosedur ini menghasilkan 100% respon pembentukan tunas dengan 36,4
tunas per clump kalus. Protokol pembentukan tunas ini terbukti efektif untuk
menginduksi multiplikasi tunas tebu di 11 genotipe lainnya, yang mengarah ke
16
2.4 Zat Pengatur Pertumbuhan (ZPT)
Zat pengatur pertumbuhan juga dikenal sebagai hormon tanaman adalah bahan
kimia yang digunakan untuk mengubah pertumbuhan bagian tanaman atau
tanaman. Hormon adalah zat alami yang diproduksi oleh tanaman, zat yang
mengontrol fungsi tanaman normal, seperti pertumbuhan akar, buah, dan proses
perkembangan lainnya (Fishel, 2006). Hartmann et al. (2002) mengemukakan
bahwa ZPT adalah senyawa organik bukan hara yang dalam jumlah sedikit dapat
memacu, menghambat, dan mengubah proses fisiologis tanaman. Awal
penemuan dan penggunaan zat pengatur tumbuh adalah dengan asetilena dan
etilen, yang meningkatkan produksi bunga pada tanaman nanas. Selanjutnya,
kegunaan zat pengatur tumbuh telah berkembang pesat menjadi komponen utama
produksi komoditas pertanian (Fishel, 2006). Salah satunya digunakan sebagai
komponen penting dalam kultur jaringan.
Ada lima kelompok ZPT yang dikenal yaitu: auksin, sitokinin, giberelin, etilen,
dan asam absisat. Auksin dan sitokinin sejauh ini adalah ZPT yang paling penting
untuk mengatur pertumbuhan dan morfogenesis dalam jaringan tanaman dan
kultur organ. Hormon sintetik telah ditemukan dengan aktivitas biologis yang
sama atau melebihi zat pertumbuhan alami (George et al.,2008). George et al.
(2008) juga menyebutkan bahwa auksin banyak digunakan dalam kultur jaringan
tanaman dan biasanya merupakan bagian tak terpisahkan dari komponen media.
Auksin digunakan terutama dalam kombinasi dengan sitokinin untuk mendorong
pertumbuhan kalus, suspensi sel atau organ, dan juga mengatur arah
17
ZPT dari golongan auksin yang biasa digunakan dan paling potensial dalam kultur
jaringan adalah 2,4-D (2,4-Dichlorophenoxyacetic Acid). Dilaporkan oleh
Naz et al. (2008) bahwa media dengan kombinasi 2,4-D lebih potensial untuk
inisiasi kalus tanaman tebu dibandingkan dengan kombinasi hormon lainnya.
Laporan yang serupa mengenai 2,4-D sebagai ZPT yang sangat potensial sebagai
penginduksi dan proliferasi kalus disebutkan dalam berbagai penelitian oleh Huan
et al. (2004), Behera dan Sahoo (2009),Gopitha et al. (2010), dan Yelnititis
(2012).
Selain 2,4-D, ZPT yang digunakan dalam menginduksi dan proliferasi kalus
adalah pikloram (4-amino-3,5,6-trichloropyridine-2-carboxylic acid). Hasil
penelitian Khan et al. (2008) menunjukkan bahwa induksi kalus dan proliferasi
tanaman tebu terbaik diamati pada media mengandung 4 mg/l 2,4-D dan 4 mg/l
pikloram, bahkan media yang mengandung pikloram 2 mg/l sudah menunjukkan
induksi kalus yang baik. Selain itu, penelitian Kaouther et al.(2011)
menunjukkan bahwa penambahan pikloram dapat mengekspresikan
embriogenesis somatik terhadap daun cerry yang dilakukan pelukaan. Penelitian
Kordestani dan Karami (2007) menunjukkan juga konsentrasi penambahan
pikloram terbaik dalam menginduksi embriogenesis somatik strawberry adalah 2
18
III. BAHAN DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Ilmu Tanaman dan lahan pertanaman
tebu, Fakultas Pertanian, Universitas Lampung, Bandar Lampung. Penelitian
dilaksanakan sejak November 2013 sampai dengan Maret 2014.
3.2 Metode Penelitian
3.2.1 Bahan Tanaman (Eksplan)
Bahan tanaman yang digunakan pada penelitian ini berupa eksplan tebu klon
MT-72. Klon MT-72 merupakan salah satu klon pemberian dari PT. Gunung
Madu Plantation (PT. GMP) yang kemudian dimanfaatkan sebagai eksplan pada
penelitian kultur jaringan tanaman tebu di Laboratorium Ilmu Tanaman,
Universitas Lampung. Klon MT-72 ini merupakan hasil pemuliaan tanaman yang
dilakukan oleh PT. GMP sebagai upaya mendapatkan klon yang unggul. Dari
beberapa klon yang ada dipilih klon MT-72 karena ketersediaan eksplan klon
MT-72 yang membentuk kalus cukup memadai untuk dilakukan penelitian
dibandingkan dengan klon-klon yang lain, oleh karena itu dalam penelitian ini
19
digunakan sebagai eksplan adalah bagian leaf roll. Leaf roll adalah gulungan
daun muda yang terletak pada ruas teratas batang tebu. Pengambilan leaf roll tebu
dilakukan dengan mengambil ujung tanaman (primordial daun) tebu yang
panjangnya sekitar 30 cm.
3.2.2 Persiapan Eksplan
Setelah leaf roll tebu berada di dalam laboratorium Ilmu Tanaman, selanjutnya
dilakukan persiapan eksplan. Beberapa lapisan daun yang sudah tua dibuang
sehingga terlihat batas antara batang muda dan daun muda. Eksplan dipotong dan
diseragamkan panjangnya sekitar 20 cm. Setelah itu, eksplan direndam dalam 2
liter air yang telah ditambahkan 2 g fungisida berbahan aktif mankozeb.
3.2.3 Persiapan Media dan Alat
Penelitian dilakukan dengan menggunakan media MS (Murashige dan Skoog,
1962) yang terdiri dari 2 macam media, yaitu media penginduksi kalus dan media
perlakuan. Media penginduksi kalus berisi bahan-bahan media MS dan 3 mg/l
2,4-D. Sedangkan komposisi media perlakuan pada penelitian ini adalah media
MS yang ditambahkan pikloram dan 2,4-D sesuai dengan konsentrasi perlakuan.
Sebelum membuat media, semua alat gelas dan non gelas yang akan dipergunakan
(gelas beaker ukuran 2 L, 1 L, dan 500 ml; gelas ukur ukuran 25 ml, 100 ml, 800
ml, dan 2000 ml; pipet tetes; labu ukur 500 ml dan 1000 ml; magnetic stearer;
pinset; spatula; dan panci enamail) dibilas dengan menggunakan aquades terlebih
20
menggunakan autoklaf selama 30 menit dengan suhu 121˚C dan tekanan 1,5
kg/cm2.
Setelah semua peralatan siap, dilarutkan garam-garam MS (Murashige dan Skoog,
1962), 50 mg/l asam sitrat, 150 mg/l asam askorbat, 3 mg/l 2,4-D, pikloram
(sesuai perlakuan), 150 ml/l air kelapa, 100 mg/l myo-inositol, serta 30 g/l sukrosa
ke dalam aquades hingga homogen. Kemudian, larutan tersebut ditera dengan
aquades menggunakan labu ukur 1 liter. Larutan media ditetapkan pH-nya
menjadi 5,8 dengan menggunakan pH meter. Penetapan pH dilakukan dengan
cara menambahkan larutan KOH 0,1 N untuk menaikkan pH dan larutan HCl
0,1 N untuk menurunkan pH. Setelah dilakukan penetapan pH, larutan media
dimasak dan ditambahkan 8 g/l agar-agar hingga mendidih. Sebanyak 20—25 ml
media dituangkan ke dalam botol kultur berukuran 250 ml, ditutup dengan
menggunakan plastik dan diikat dengan karet, botol kultur diberi label dengan
informasi komposisi media. Media disterilisasi menggunakan autoklaf selama 7
menit dengan suhu 121˚C dan tekanan 1,5 kg/cm2. Setelah sterilisasi selesai dan
tekanan autoklaf turun menjadi 0 atm, media dikeluarkan dan disimpan dalam
ruang kultur.
3.2.4 Sterilisasi dan Penanaman Eksplan
Sterilisasi eksplan tebu sebagaimana yang telah dijelaskan oleh Hapsoro, et al.
(2012). Eksplan dikeluarkan dari larutan fungisida berbahan aktif mankozeb,
kemudian dicelupkan ke dalam larutan deterjen. Eksplan dibilas di bawah air
mengalir sehingga fungisida dan kotoran tidak lagi menempel pada permukaan
21
dan dibawa ke dalam ruang tanam atau ruang transfer untuk dilakukan sterilisasi
eksplan yang lebih lanjut dan penanaman di media penginduksi kalus.
Sterilisasi eksplan di ruang tanam dilakukan dengan kondisi yang aseptik di dalam
laminar air flaw cabinet (LAFC). Strelirisasi eksplan pada tahap ini dilakukan
dengan menggunakan Bayclin yang mengandung 5,25% NaOCl (natrium
hipoklorit). Bayclin sebanyak 50% didapatkan dengan cara melarutkan 50 ml
bayclin dengan 50 ml air steril. Lima puluh persen larutan Bayclin dimasukkan
ke dalam botol Schott yang telah berisi eksplan dan ditambahkan surfaktan cair (4
tetes/100 ml), kemudian dikocok selama 30 menit. Setelah itu, eksplan dibilas
menggunakan air steril hingga tidak ada lagi busa yang menempel.
3.2.5 Induksi dan Proliferasi Kalus
Induksi kalus sebagaimana yang telah dilakukan oleh Hapsoro et al.(2012) yaitu
eksplan dikecilkan dan dipotong-potong dengan tebal leaf roll 1 cm, eksplan
tersebut dikulturkan ke dalam media penginduksi kalus yang terdiri dari garam
MS (Murashige dan Skoog, 1962), 30 g/l sukrosa, 150 ml/l air kelapa, 100 mg/l
myo-inositol, 0,1 mg/l tiamin-HCl, 0,5 mg/l pyridoxine-HCl, 0,5 mg/l asam
nikotinat, 2 mg/l glisin, dan 3 mg/l 2,4-D dan diinkubasi selama 30 hari di dalam
ruang gelap. Kemudian, dilakukan pemindahan eksplan yang sudah membentuk
kalus embriogenik ke dalam media MS yang ditambahkan perlakuan ZPT.
Eksplan kalus yang digunakan adalah kalus embriogenik yang dicirikan oleh sel
yang berukuran kecil, sitoplasma padat, inti besar, vakuola kecil-kecil dan
22
ukurannya yaitu berdiameter 0,8 cm. Umur kalus yang ditanam ke dalam media
perlakuan adalah 4 minggu di dalam media penginduksi kalus. Perlakuan yang
dicobakan pada penelitian ini berupa jenis dan konsentrasi ZPT yang disajikan
[image:39.595.112.418.236.389.2]pada Tabel 1.
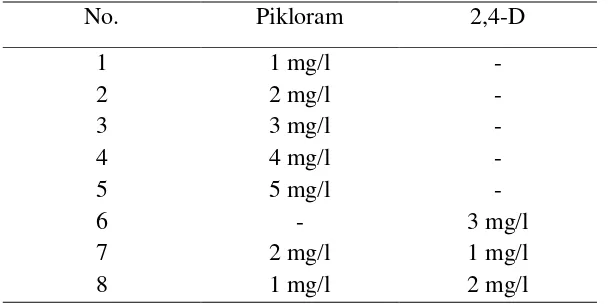
Tabel 1. Perlakuan yang dicobakan.
No. Pikloram 2,4-D
1 1 mg/l -
- - - - 3 mg/l 1 mg/l 2 mg/l
2 2 mg/l
3 3 mg/l
4 4 mg/l
5 6 7 8 5 mg/l - 2 mg/l 1 mg/l
3.2.6 Induksi Tunas
Induksi tunas dilakukan dengan cara memindahkan kalus-kalus sekunder hasil
proliferasi dari media perlakuan ke dalam media penginduksi tunas yang terdiri
dari garam MS (Murashige dan Skoog, 1962), 30 g/l sukrosa, 150 ml/l air kelapa,
100 mg/l myo-inositol, 0,1 mg/l tiamin-HCl, 0,5 mg/l pyridoxine-HCl, 0,5 mg/l
asam nikotinat, 2 mg/lg lisin, dan 2,5mg/l BA. Kemudian diinkubasi selama 3
bulan di dalam ruangan yang diperlengkapi lampu fourescent kurang lebih 1.000
lux dengan suhu ruangan 25o C ± 2o C.
3.2.7 Analisis Statistika
Perlakuan diterapkan pada satuan percobaan dalam rancangan teracak sempurna
23
(Murashige dan Skoog, 1962). Dari masing-masing perlakuan tersebut dilakukan
ulangan sebanyak tiga kali. Apabila asumsi terpenuhi, dilakukan analisis ragam.
Apabila nilai F-hitung lebih besar dari F-tabel dilakukan pemisahan nilai tengah
dengan uji beda nyata terkecil (BNT) dengan selang kepercayaan 95%.
3.2.8 Variabel Pengamatan
1. Diameter Kalus dan Bobot Kalus
Pengamatan eksplan diameter kalus (cm) dan bobot kalus (gram). Dilakukan pada
umur 4 minggu setelah tanam (MST) ke dalam media perlakuan. Diameter kalus
dapat diukur dengan cara meletakkan kalus pada cawan petri yang di bawahnya
telah diletakkan kertas millimeter blok. Kemudian pengamatan bobot kalus
diperoleh dengan cara clump kalus diletakkan pada cawan petri yang telah
diletakkan di atas timbangan analitik. Percobaan ini terdiri dari 3 ulangan tiap
ulangan terdiri dari satu clump kalus.
2. Skoring Kalus Embriogenik
Pengamatan dilakukan pada umur 8 minggu setelah tanam (MST) eksplan pada
media perlakuan. Pengamatan ini bertujuan untuk mengetahui kalus yang
embriogenik dengan cara skoring 5 level yaitu 1 (tidak ada), 2 (sedikit), 3
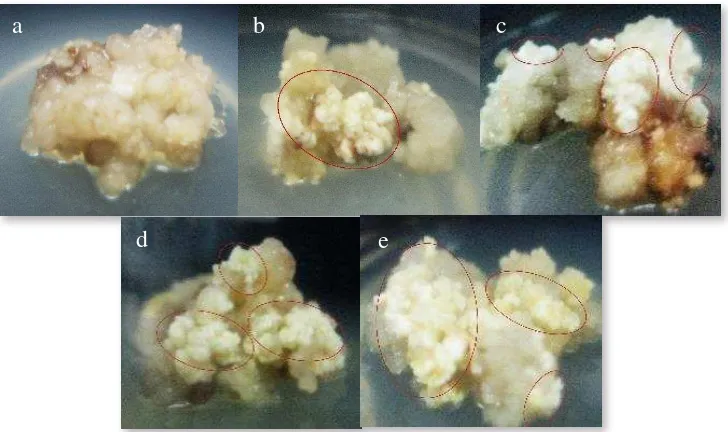
(sedang), 4 (banyak), dan 5 (sangat banyak) yang ditunjukkan pada Gambar 1.
Percobaan ini terdiri dari 3 ulangan setiap ulangan terdiri dari 2 botol kultur dan
24
Gambar1. Penentuan skor pembentukan kalus embriogenik pada 8 MST.
(a) skor 1 (tidak ada), (b) skor 2 (sedikit), (c) skor 3 (sedang), (d) skor 4 (banyak), (e) skor 5 (sangat banyak)
3. Skoring Induksi Tunas
Pengamatan selanjutnya adalah induksi tunas adventif dari kalus yang sudah
terbentuk. Tunas adalah bagian tumbuhan yang tumbuh dari bagian tanaman
tertentu seperti daun, akar ataupun kalus yang berada di atas permukaan
tanah/media. Tunas dapat terdiri dari batang dan daun muda. Dalam istilah
fisiologi tumbuhan, tunas juga berarti semua bagian tumbuhan yang bukan akar,
yaitu bagian tumbuhan yang cenderung memiliki geotropisme negatif (atau
heliotropisme positif). Untuk melakukan pengamatan tersebut kalus embriogenik
yang sudah terbentuk dikulturkan ke dalam media MS + BA 2,5 mg/l.
Pengkulturan kalus ke dalam media MS + BA 2,5 mg/l dilakukan setelah 8
minggu setelah tanam (MST). Adapun pengamatannya dilakukan dengan cara
melakukan skoring 4 level yaitu 1 (tidak ada tunas sama sekali), 2 (membentuk
calon tunas), 3 (membentuk tunas ukuran kecil), 4 (sudah membentuk tunas besar)
a
d
c b
25
yang ditunjukkan pada Gambar 2. Percobaan ini terdiri dari 3 ulangan setiap
[image:42.595.180.447.169.388.2]ulangan terdiri dari 4 botol kultur dan setiap botol terdiri dari satu clump kalus.
Gambar 2. Penetuan skor induksi tunas 4 level. (a) skor 1 (tidak ada tunas), (b) skor 2 (membentuk calon tunas), (c) skor 3 (membentuk tunas ukuran kecil), (d) skor 4 (membentuk tunas besar)
a
c
b
26
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian dapat ditarik kesimpulan sebagai berikut:
1. Pikloram 5 mg/l pada media proliferasi kalus efektif untuk merangsang
pertumbuhan kalus embriogenik tebu dengan persentase pembentukan kalus
embriogenik sebesar 92%, sama efektifnya dengan perlakkuan 2,4-D 3 mg/l
sebagai kontrol. Kombinasi pikloram dan 2,4-D kurang efektif untuk
merangsang pembentukan kalus embriogenik tebu dibandingkan pikloram
5 mg/l dan 2,4-D 3 mg/l.
2. Ketika dikulturkan pada media induksi tunas, kalus embriogenik yang dihasilkan
dari media proliferasi kalus yang mengandung pikloram 5 mg/l menghasilkan
tunas yang sama banyaknya dibandingkan kalus embriogenik yang dihasilkan
dari media proliferasi kalus yang mengandung 2,4-D 3 mg/l sebagai kontrol,
tetapi dengan persentase pembentukan tunas yang lebih tinggi yaitu 100%.
5.2 Saran
Keefektifan 2,4-D untuk regenerasi tanaman tebu telah ditunjukkan oleh Hapsoro et
al. (2012) dengan menggunakan 11 klon tebu. Oleh karena itu, perlu diketahui juga
39
DAFTAR PUSTAKA
Behera, K. K. and S. Sahoo. 2009. Rapid In vitro Micro propagation of
Sugarcane (Saccharum officinarum L. cv-Nayana) Through Callus Culture. Nature and Science. 7: 1545—0740.
Ditjenbun. 2013. Kebutuhan Gula Nasional Mencapai 5,700 Juta Ton Tahun 2014. Ditjenbun. Administrator (Ed). Deptan. 10 November 2013. http://ditjenbun.deptan.go.id/setditjenbun/berita-172-dirjenbun--kebutuhan-gula-nasional-mencapai-5700-juta-ton-tahun-2014.html.
Farid, M. 2003. Perbanyakan Tebu (Saccharum officinarum L.) Secara In Vitro pada Berbagai Konsentrasi IBA dan BAP. J. Sains & Teknologi. 3: 103— 109.
Fishel, F. M. 2006. Plant Growth Regulators. University of Florida. Florida.
Geijskes R. J., L. Wang, P. Lakshmanan, M.G. Mckeon, N. Berding, R.S. Swain, A.R.Elliott, C.P.L. Grof, J.A. Jackson, and G.R. Smith. 2003. Smartsett seedlings: tissue cultured seed plants for the Australian sugar industry. Proc. Aust. Soc. Sugar Cane Technol. 25: 13—17.
George, E.F., M.A. Hall, and G.J.D. Klerk. 2008. Plant Propagation by Tissue Culture 3rd Edition. Springer. Netherldans. 508 hlm.
Gopitha, K., A. L. Bhavani and J. Senthilmanickam. 2010. Effect of The Different Auxins and Cytokinins In Callus Induction, Shoot, Root Regeneration In Sugarcane. Biotechnology. 1: 0975—6299.
Guiderdoni, E. and Y. Demarly. 1988. Histology of somatic embryogenesis in cultured leaf segments of sugarcane plantlets. Plant Cell Tissue and Organ Culture. 14: 71—88.
40
Hartmann, H.T., D.E. Kester, F.T. Davies, and R.L. Geneve. 2002. Plant Propagation: Principles and Practices. Sixth Edition. Prentice-Hall, Englewood CLIFFS, New Jersey. 647 hlm.
Hofmann, N., R.L. Nelson, and S.S. Korban. 2004. Influence of media components and pH on somatic embryo induction in three genotypes of soybean. Plant Cell Tiss. 77: 157—163.
Huan, L. V. T., T. Takamura, and M. Tanaka. 2004. Callus Formation and Plant Regeneration From Callus Through Somatic Embryo Structures in
Cymbidium orchid. Plant Science. 166: 1443–1449.
Husein, S., R. Ibrahim, and A.L.P. Kiong. 2006. Somatic Embryogenesis: An Alternative Method for In Vitro Micropropagation. Iranian Journal of Biotechnology. 4: 156—161.
Indrawanto, C., Purwono, Siswanto, M. Syakir, dan W. Rumini. 2010. Budidaya dan Pasca Panen TEBU. ESKA Media. Jakarta. 44 hlm.
James, G. 2004. Sugarcane. Blackwell Publishing Company. Oxford OX4 2Dq, UK. 216 hlm.
Kaouther, B.M., E. Nadhra, C. Ahlem, A. Jemmali, and P. Druart. 2011. In Vitro Picloram-Induced Somatic Embryogenesis from Leaflets of Cherry (Prunus incisa Thunb.). Journal of Life Sciences. 5: 913—920.
Karim, M.Z., M.N. Amin, M.A. Hossain, S. Islam, F. Hossain, and R. Alam. 2002. Micropropagation of Two Sugarcane (Saccharum officinarum) Varieties from Callus Culture. Journal of Biological Sciences. 2(10): 682—685.
Karun, A., E. A.Siril, E. Radha, and V. A. Parthasarathy. 2004. Somatic Embryogenesis and Plantlet Regeneration from Leaf and Inflorescence Explants of Arecanut (Areca catechu L.). Current Science. 86: 1623— 1628.
Khan, I. A., M. U.Dahot, N. Seema, S. Bibi, and A. Khatri, 2008. Genetic Variability in Plantlets Derived from Callus Culture in Sugarcane. Pak. J. Bot. 40: 547—564.
Khan, I.A., and A. Khatri. 2006. Plant Regeneration Via Organogenesis or Somatic Embryogenesis in Sugarcane: Histological Studies. Pak. J. Bot. 38: 631—636.
41
Sugarcane Tolerant To Imidazolinone Herbicides. Proc. Int. Soc. Sugar Cane Technol. 27: 1—3.
Kordestani, G.K., and O. Karami. Picloram-Induced Somatic Embryogenesis in Leaves of Strawberry (Fragaria ananassa L.). Acta Biologica Cracoviensia. 50: 69—72.
Mariska, I. dan S. Rahayu. 2011. Pengadaan Bibit Tebu Melalui Kultur
Jaringan. Sinar Tani. Edisi 6-12 Juli 2011 No. 3413. Tahun XLI. Hal 15.
Mathur, J. and C. Koncz. 1998. Callus Culture and Regeneration. Methods in Molecular Biology. 82: 31—34.
Mayang R.B., D. Hapsoro dan Yusnita. 2011. Regenerasi In Vitro Tanaman Tebu (Saccharum Officinarum L.): Induksi dan Proliferasi Kalus, Serta Induksi Tunas. Jurnal Agrotropika. 16: 52—56.
Miller, J.D. and R.A. Gilbert. 2006. Sugarcane Botany: A Brief View.
Agronomy Department, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida. 6 hlm.
Muchtar, H.1996. Pengaruh Beberapa Jenis Sitokinin dan Auksin Terhadap Pembentukan Embrio Somatik Rotan Manau (Calamus manan Miquel). (Tesis). Program Pascasarjana, Institut Pertanian Bogor. Bogor.
Murashige T and F. Skoog. 1962. A Revised Medium For Rapid Growth and Bio-Assays With Tobacco Tissue Cultures. Physiol Plant. 15: 473—497.
Naz, S., A. Ali and A. Siddique. 2008. Somatic Embryogenesis and Plantlet Formation In Different Varieties Of Sugarcane (Sacchrum officinarum L.) Hsf-243 and Hsf-245. Sarhad J. Agric. 24: 4.
Nugrahani, P., Sukendah dan Makziah. 2011. Regenerasi Eksplan Melalui Organogenesis Dan Embriogenesis Somatik. Universitas Pembangunan Nasional. Jawa Timur.
P3GI. 2012. P3GI Sebagai Lembaga Riset Penghasil Varietas Tebu Unggul dan Penghasil Benih Tebu Bermutu Generasi Kedua (G2) Asal Kultur Jaringan.
http://www.sugarresearch.org/index.php/p3gi-sebagai-lembaga-riset-penghasil-varietas-tebu unggul-dan-penghasil-benih-tebu-bermutu-generasi-kedua-g2-asal-kultur-jaringan.html. (12 Juni 2014).
42
Raghavan, V. 1986. Embryogenesis In Angiosperm : A Developmental and Experimental Study. Cambridge Univ. Cambridge.
Rasullah, F. F. F., T. Nurhidayati, dan Nurmalasari. 2013. Respon Pertumbuhan Tunas Kultur Meristem Apikal Tanaman Tebu (Saccharum officinarum) Varietas NXI 1-3 secara in viro pada Media MS dengan Penambahan Arginin dan Glutamin. Jurnal Sains dan Seni Pomits. 2: 2337—3520.
Schmülling, T. 2004. Cytokinin. University of Berlin. Berlin.
Sisharmini, A., A. Apriana, dan Sustiprijatno. 2010. Induksi Kalus dan Regenerasi Beberapa Genotipe Gdanum (Triticum aestivum L.) secara In Vitro. Jurnal AgroBiogen 6: 57—64.
Sisworo, W.H., Wandowo, Ismachin, dan L.S. Elsje. 2010. Isotop dan Radiasi Untuk Kemajuan Usaha Dana. Badan Tenaga Nuklir Nasional. Indonesia.
Sukmadjaja, D. dan A. Mulyana. 2011. Regenerasi dan Pertumbuhan Beberapa Varietas Tebu (Saccharum officinarum L.) secara In Vitro. Jurnal
AgroBiogen. 7: 106—118.
Supriyadi, A., 1992. Rendemen Tebu. Kanisius. Yogyakarta. 72 hal.
Susiyanti, G.A., Wattimena, M. Surahman, A. Purwito dan D.A. Santosa. 2007. Transformasi Tanaman Tebu (cv. PSJT 94-41) dengan Gen Fitase Menggunakan Agrobacterium tumefaciens GV 2260 (pBinPI-IIEC). Bul. Agron. 35: 205—211.
Taiz, L. and E. Zeiger. 2010. Plant Physiology. Sinauer Associates. Boston. 782 hlm.
Tarigan, B. Y. dan J. N. Sinulingga, 2006. Laporan Praktek Kerja Lapangan di Pabrik Gula Sei Semayang PTPN II Sumatera Utara. (Laporan).
Universitas Sumatera Utara, Medan.
Tjokroadikoesoemo, P. S. dan A. S. Baktir, 2005. Ekstraksi Nira Tebu. (Skripsi). Yayasan Pembangunan Indonesia Sekolah Tinggi Teknologi Industri. Surabaya.
Wijayanti, W. A. 2008. Pengelolaan Tanaman Tebu (Saccharum Officinarum L.) di, Pabrik Gula Tjoekir Ptpn X, Jombang, Jawa Timur. (Skripsi). Institut Pertanian Bogor. Bogor.
Yelnititis. 2012. Pembentukan Kalus Remah dari Eksplan Daun Ramin. Jurnal Pemuliaan Tanaman Hutan. 6: 181—194.