MENGGUNAKAN FILM TiO
2ENDANG PALUPI
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ENDANG PALUPI. Degradasi Methylene Blue dengan Metode Fotokatalisis dan Fotoelektrokatalisis Menggunakan Film TiO2. Dibimbing oleh Akhiruddin Maddu, M.Si dan Drs. Moh. Indro, M.Sc.
Dengan metode squeegee printing, dapat dibuat lapisan semikonduktor TiO2 pada substrat
Indium TinOxide. Hasil karakterisasi XRD menunjukkan bahwa film yang dihasilkan adalah anatase dengan nilai parameter kisi kristal a = b = 3.7945 dan c = 9.579, serta ukuran kristal adalah 24.545 nm.
FILM TiO
2Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Departemen Fisika
Oleh:
ENDANG PALUPI
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul : Degradasi Methylene Blue dengan Metode Fotokatalisis dan Fotoelektrokatalisis Menggunakan Film TiO2
Nama : Endang Palupi NIM : G07400025
Menyetujui,
Pembimbing I
Akhiruddin Maddu, M.Si
Pembimbing II
Drs. Moh. Nur Indro, M.Sc NIP: 132 206 239 NIP: 130 367 084
Mengetahui,
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono NIP 131 473 999
Penulis lahir di Bogor pada tanggal 21 Agustus 1981 sebagai anak kedua dari empat bersaudara pasangan bapak Suprapto dan ibu Ikim.
i
KATA PENGANTAR
Bismillahirrahmanirrahiim
Alhamdulillahirabbil’alamiin, segala puji dan syukur hanya bagi Allah SWT, karena berkat serta rahmat-Nyalah penulis dapat menyelesaikan penulisan usulan penelitian ini dengan judul ”Degradasi Methylene Blue dengan Metode Fotokatalisis dan Fotoelektrokatalisis Menggunakan Film TiO2”. Sebagai seorang manusia biasa penulis menyadari masih banyak sekali terdapat
kekurangan dalam penulisan usulan penelitian ini. Oleh karena itu, saran dan kritik yang membangun sangat penulis harapkan sehingga diwaktu yang akan datang dapat digunakan untuk mendapatkan hasil yang lebih baik.
Penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Bapak Akhiruddin Maddu, M.Si dan Bapak Drs. Moh. Nur Indro, M.Sc., selaku
pembimbing yang telah memberikan bimbingan, masukan, motivasi dan diskusi-diskusi yang sangat membantu, serta untuk dosen penguji: Bapak Drs. Sidikrubadi Pramudito, Bapak Jajang Juansyah, S.Si, dan Bapak Faozan Ahmad S.Si.
2. Untuk Bapak, terima kasih banyak atas segala yang telah diberikan. Maaf Endang
belum sempat memberi apa pun sebagai balasannya. Mama yang tiada hentinya memberikan do’a.
3. Pỏpỏ, Ceot, Benkz, Adot, Wiwid, Ii Sam, Om Wisnu, Kakang, Ary, Dede Helen,
Keluarga besar Mama: Ii Alin, Ii Eli, dan Keluarga besar Bapak, terima kasih untuk kesabarannya nunggu Endang lulus.
4. Segenap staf pengajar dan tata usaha di Departemen Fisika yang telah sangat banyak membantu selama masa perkuliahan dan proses kelulusan, juga staf laboratorium Pak Yani, Pak Mus, Pak Toni, dan Pak Mul.
5. Staf laboratorium Kimia Analisis Departemen Kimia Institut Pertanian Bogor: Ibu
Nunung, dan Om Eman. Terima kasih atas bantuan dan kerjasamanya.
6. Anggota Schroedinger cat’z (Eenkz, Fati, Reiny, Cepy, Dhoni, Ichwansyah, Fuady,
Armand, Kun, Ewing, Gana, Iqin, Andre, Kun). Makasih atas semua dukungan moral, spiritual dan finansialnya. Kita telah melalui masa yang takkan terlupakan, baik suka maupun duka. Meskipun kita sudah tidak bersama lagi, tetapi persahabatan kita akan terus terjalin selamanya. Serta rekan-rekan Fisika angkatan 37 lainnya yang tidak sempat saya sebutkan.
7. Penghuni Ciwaluya 9: Nana, Mee-mee, Letta, Tata, Monik, Ka Kocha, Taya, Age,
Kaka, Abang Rifki, Ka Ucup, dan Dini: terima kasih atas ilmu, kesenangan, dan dukungannya.
8. Ka Ari Sudana, terima kasih atas masukan-masukannya, serta para senior dan yunior di Departemen Fisika.
Bogor, Oktober 2006
ii
KATA PENGANTAR ... i
DAFTAR ISI... ii
DAFTAR GAMBAR ... iii
DAFTAR TABEL... iii
DAFTAR LAMPIRAN ... iii
PENDAHULUAN... 1
Latar Belakang ... 1
Perumusan Masalah... 1
Tujuan Penelitian... 2
TINJAUAN PUSTAKA... 2
Semikonduktor ... 2
Titanium Dioksida ... 2
Proses Fotokatalisis ... 3
Proses Fotoelektrokatalisis ... 5
Methylene Blue ... 6
BAHAN DAN METODE ... 6
Tempat dan Waktu Penelitian... 6
Alat dan Bahan ... 6
Deposisi Film TiO2... 6
Karakterisasi XRD ... 6
Pembuatan Reaktor... 7
Pembuatan Kurva Standar Methylene Blue... 7
Evaluasi Fotolisis, Fotokatalisis dan Fotoelektrokatalisis ... 7
HASIL DAN PEMBAHASAN ... 7
Hasil XRD Film TiO2 dan Ukuran Partikel ... 7
Kurva Standar Methylene Blue ... 8
Pengaruh Konsentrasi Awal Methylene Blue... 9
Pengaruh pH Awal Methylene Blue ... 9
Evaluasi Aktivitas Fotolisis, Fotokatalisis dan Fotoelektrokatalisis... 10
Evaluasi Aktivitas Fotolisis... 10
Evaluasi Aktivitas Fotolisis dan Fotoelektrokatalisis... 10
Pengaruh Penambahan H2O2... 11
KESIMPULAN DAN SARAN ... 12
Kesimpulan... 12
Saran... 12
DAFTAR PUSTAKA ... 12
iii
DAFTAR GAMBAR
Halaman
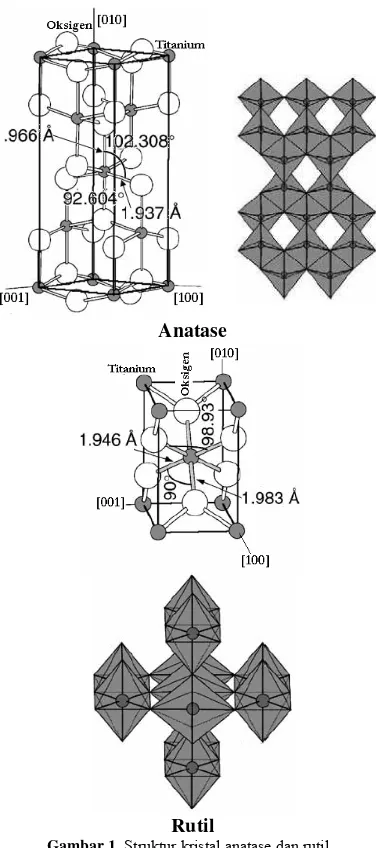
1. Struktur kristal anatase dan rutil ... 3
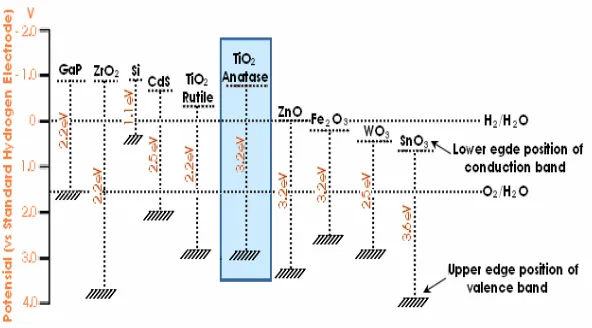
2. Energi gap, posisi pita valensi, konduksi, dan potensial reduksi dari berbagai semikonduktor ... 4
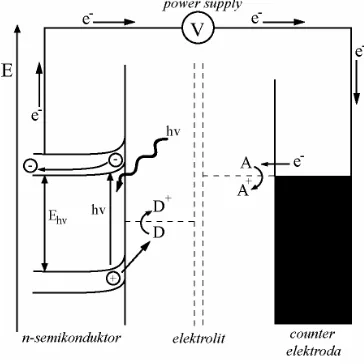
3. Skema proses fotokatalisis ... 4
4. Skema proses fotoelektrokatalisis ... 5
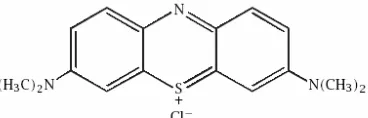
5. Struktur molekul kimia Methylene Blue... 6
6. Kristalografi TiO2... 8
7. Spektrum karakterisasi absorbansi Methylene Blue ... 9
8. Kurva standar MB... 9
9. Pengaruh konsentrasi awal terhadap degradasi fotokatalisis MB ... 9
10. Hubungan antara pH dan persen degradasi MB ... 10
11. Perbandingan proses degradasi MB ... 10
12. Hubungan linear antara ln (C/C0) dan lama perlakuan... 11
13. Grafik persentase penurunan konsentrasi MB... 11
14. Foto hasi degradasi fotolisis, fotokatalisis dan fotoelektrokatalisis ... 11
DAFTAR TABEL Halaman 1. Perbedaan struktur kristal anatase dan rutil...3
2. Mekanisme fotokatalisis dengan titanium dioksida ...5
3. Susunan puncak dan intensitas kristal TiO2 fase anatase ...8
4. Perbandingan parameter kisi kristal sampel pada lapisan TiO2 dan literatur ...8
5. Tetapan kelajuan degradasi Methylene Blue...12
DAFTAR LAMPIRAN Halaman 1. Skema reaktor degradasi ...15
2. Tabel Standar Struktur Tegragonal TiO2 pada XRD dengan λ = 1.54056 ...16
3. Penentuan parameter kisi dengan metode Cohen...17
4. Penentuan ukuran kristal dengan metode Cohen ...20
PENDAHULUAN
Latar Belakang
Pewarnaan merupakan faktor penting dalam industri fashion, garmen, peralatan,
kertas, dan percetakan. Dye, senyawa
pemberi warna pada suatu material, biasanya digunakan pada proses pewarnaan ini. Konsumsi dye per kapita mendekati 150 g per tahun, memenuhi konsumsi rata-rata industri tekstil sekitar 14.0 kg per tahun per penduduk. Tingginya kebutuhan akan industri tekstil di dunia, membuat industri ini semakin berkembang. Industri ini menggunakan
sekitar 700.000 ton dari 10.000 tipe dye
berbeda yang diproduksi tiap tahun. Selama penggunaannya, 185 ton dari dye ini terbuang ke lingkungan per tahunnya[1].
Diantara dye-dye reaktif yang ada,
methylene blue merupakan dye yang paling
banyak digunakan. Limbah berwarna yang dihasilkan oleh industri dye dan tekstil dapat menyebabkan kerusakan ekosistem aquatik karena tingginya konsentrasi senyawa
organik yang terkandung didalamnya[2.
Limbah tersebut mendapat perhatian paling besar karena penggunaannya yang menyebar, pengaruhnya yang kuat terhadap lingkungan, kemampuannya dalam membentuk produk aromatik yang beracun dan rendahnya kecepatan penguraian. Limbah ini terbuang selama proses pembuatan dan penggunaan[1]
Proses penghilangan zat warna limbah cair yang dihasilkan dari industri tekstil menjadi isu diskusi dan regulasi di seluruh dunia. Fotokatalisis berbasis semikonduktor menawarkan solusi terbaik untuk permasalahan tersebut. Komisi IUPAC mendefinisikan fotokatalisis sebagai suatu reaksi katalitik yang melibatkan absorbsi cahaya oleh katalis. Katalis adalah suatu substansi yang meningkatkan kecepatan
reaksi[3]. Fotokatalisis memanfaatkan
semikonduktor sebagai katalis yang diaktifkan dengan sinar ultraviolet (UV) untuk menguraikan senyawa organik menjadi mineral-mineralnya [4].
Proses fotokatalisis memiliki beberapa
keuntungan dibandingkan dengan proses oksidasi kimia tradisional atau proses biologi. Proses fotokatalisis tidak spesifik sehingga mampu mendegradasi tidak hanya satu macam senyawa kimia; sangat kuat, sehingga mampu mencapai mineralisasi yang sempurna berupa karbon dioksida dan air; bebas dari racun organik; dapat diterapkan pada medium cair maupun gas; dan memiliki
potensi untuk memanfaatkan sinar matahari sebagai pengganti sinar UV[5].
Semikonduktor yang paling banyak digunakan sebagai fotokatalis adalah titanium dioksida (TiO2). TiO2 telah dimanfaatkan
untuk pemurnian air, pemurnian udara, gas sensor dan fotovoltaik sel surya[6]. Ketika
TiO2 disinari cahaya dengan panjang
gelombang antara 100 – 400 nm, elektron (e-) akan tereksitasi dari pita valensi ke pita konduksi, meninggalkan hole (h+) pada pita valensi. Jika pasangan elektron-hole dapat dipisahkan satu sama lain dengan cepat tanpa terjadi rekombinasi, elektron dan hole ini akan bermigrasi ke permukaan semikonduktor. Hole bereaksi dengan H2O
atau OH− yang teradsorbsi pada permukaan semikonduktor dan menghasilkan radikal hidroksil ( OH•) yang dikenal sebagai spesies
oksidator yang sangat kuat, sedangkan elektron akan mengadsorbsi molekul O2 atau
H2O untuk membentuk radikal anion
superoksida (O2 -•
) yang merupakan spesies reduktor. Spesies-spesies oksidator dan reduktor ini akan menyerang kontaminan yang terlarut dalam sistem dan mendegradasinya menjadi senyawa yang tidak berbahaya[7].
Perumusan Masalah
Pemasalahan utama dari sistem fotokatalisis adalah ketika elektron tereksitasi ke pita konduksi, selain bereaksi dengan spesies lain yang teradsorbsi, 90% elektron ini akan segera berekombinasi
dengan hole dalam waktu nanosekon.
Rekombinasi ini akan menurunkan efektivitas fotokatalisis. Masalah rekombinasi ini dapat diatasi memberikan potensial bias positif melewati fotoanoda dan penambahan hidrogen peroksida. Pemberian bias ini akan menarik elektron menuju ke katoda, sehingga rekombinasi pasangan elektron-hole dalam katalis akan terminimalisasi. Dengan demikian pemberian tegangan akan meningkatkan kecepatan oksidasi senyawa organik. Proses ini dikenal dengan fotoelektrokatalisis. Penambahan hidrogen
peroksida, H2O2, dapat meningkatkan
2
Tujuan Penelitian
Penelitian ini bertujuan untuk
1. Membuat film TiO2 pada substrat ITO
(Indium Tinoxide) dengan metoda squeegee printing.
2. Menumbuhkan kristal TiO2 melalui
proses anneling pada temperatur 450 oC.
3. Membuat reaktor degradasi fotokatalisis
dan fotoelektrokatalisis dengan menggunakan TiO2 sebagai katalisnya.
4. Melihat pengaruh pH, penambahan
hidrogen peroksida dan pemberian potensial bias positif terhadap efektivitas fotokatalisis dalam mendegradasi methylene blue.
TINJAUAN PUSTAKA
Semikonduktor
Semikonduktor adalah material yang dicirikan dengan terisinya pita valensi dan kosongnya pita konduksi. Elektron tidak dapat berada pada daerah bandgap antara pita valensi dan pita konduksi. Berdasarkan pembawa muatannya, semikonduktor dapat diklasifikasikan dalam dua kelompok, yaitu semikonduktor intrinsik dan semikonduktor ekstrinsik. Semikonduktor intrinsik adalah semikonduktor yang belum disisipi atom lain. Ketersediaan pembawa muatan pada semikonduktor ini berasal dari persenyawaan unsur-unsur secara langsung. Semikonduktor ekstrinsik adalah semikonduktor yang partikel pembawa muatannya berasal dari unsur lain. Semikonduktor ekstrinsik diperoleh melalui rekayasa pemberian sejumlah impuritas atau injeksi partikel agar bahan mengalami perubahan nilai konduktivitas.
Berdasarkan jumlah mayoritas partikel pembawa muatan, semikonduktor dibedakan dalam dua jenis, yaitu semikonduktor tipe-p dan tipe-n. Semikonduktor tipe-p merupakan semikonduktor yang mengalami kekurangan elektron sehingga semikonduktor ini bermuatan positif dengan lubang/hole sebagai pembawa muatan mayoritas. Dilain pihak, semikonduktor tipe-n mengalami kelebihan elektron, menyebabkan semikonduktor ini bermuatan negatif dengan elektron sebagai pembawa muatan mayoritas[10].
Ketika disinari cahaya dengan panjang gelombang yang tepat, elektron pada pita valensi akan mengabsorbsi energi foton,
tereksitasi, dan berpindah ke pita konduksi. Hasil eksitasi elektron ini adalah terbentuknya hole (muatan positif) pada pita
valensi (h+VB) dan elektron pada pita
konduksi (e-CB). Pasangan elektron-hole ini
tidak stabil. Mereka dapat kembali ke tempat asalnya (berekombinasi) dengan melepaskan panas[8].
Secara termodinamik, level energi pita
konduksi (ECB) adalah ukuran kekuatan
reduksi elektron pada semikonduktor, sedangkan level energi pita valensi (EVB)
adalah ukuran daya oksidasi hole.
Semikonduktor yang berbeda memiliki level pita energi yang berbeda. Semakin tinggi potensial pita valensi, semakin tinggi daya oksidasi yang dimiliki oleh hole. Agar suatu semikonduktor mampu mendegradasi senyawa-senyawa organik yang berbeda, maka level energi valensinya harus terletak pada potensial yang relatif tinggi.
Semikonduktor dengan bandgap kecil
memiliki spektrum absorbsi yang cocok dengan spektrum emisi cahaya matahari. Dari sudut pandang pemanfaatan energi matahari, semikonduktor dengan celah pita yang kecil merupakan pilihan yang lebih baik. Tapi, semikonduktor yang memiliki bandgap kecil normalnya tidak memiliki potensial pita valensi yang tinggi[9].
Titanium Dioksida
TiO2 muncul dalam 3 bentuk polimorf
yang berbeda, yaitu rutil, anatase, dan brukit. Dua struktur kristal TiO2, rutil dan
anatase, paling umum digunakan dalam fotokatalisis. Struktur anatase dan rutil digambarkan dalam bentuk rantai oktahedra TiO6. Struktur kedua kristal dibedakan oleh
distorsi oktahedron dan pola susunan rantai
oktahedronnya (Gambar 1). Setiap ion Ti4+
dalam struktur kisi ini menyebabkan perbedaan massa jenis dan struktur pita elekektronik antara dua bentuk TiO2[11],
yaitu anatase memiliki daerah aktivasi yang lebih luas dibandingkan rutil sehingga kristal tersebut menjadi lebih reaktif terhadap cahaya dibandingkan rutil. Besar bandgap yang dimiliki pun menjadi berbeda, pada anatase besar rentang energinya adalah 3,2 eV sedangkan rutil 3,1 eV[13]. Perbedaan struktur kristal anatase dan rutil dirangkum pada Tabel 1.
Kristal rutil memiliki struktur yang lebih padat dibandingkan anatase, karenanya memiliki densitas dan indeks refraktif yang lebih tinggi (massa jenis anatase: 3,894 gr/cm3; rutil: 4,250 gr/cm3; indeks bias anatase dan rutil berturut-turut adalah 2,5688 dan 2,9467) [13].
Tabel 1. Perbedaan struktur kristal anatase dan rutil
energi gap (Eg), posisi pita konduksi dan pita valensi menentukan karakter fotokatalisis dalam hal kebutuhan energi foton yang diperlukan untuk mengaktifkannya dan berapa besar kekuatan oksidasi atau reduksinya setelah diaktifkan. Gambar 2. memperlihatkan besarnya energi celah, posisi pita valensi, pita konduksi beberapa semikondukor dan komparasinya dengan potensial redoks relatif terhadap standar elektroda hidrogen.
Pada Gambar 3, TiO2 anatase memiliki
energi celah sebesar 3,2 eV, dengan posisi tingkat energi pita konduksi memiliki potensial reduksi sebesar kira-kira -1,0 Volt (vs SHE) dan posisi tingkat energi pita valensi mempunyai potensial oksidasi kurang dari +3,0 Volt (vs SHE). Hal ini
mengindikasikan bahwa hole pada
permukaan TiO2 merupakan spesis oksidator
kuat, dan karenanya akan mengoksidasi spesies kimia lainnya yang mempunyai potensial redoks yang lebih kecil, termasuk molekul air dan/atau gugus hidroksil yang akan menghasilkan radikal hidroksil. Radikal
hidroksil pada pH = 1 mempunyai potensial sebesar 2,8 V, dan kebanyakan zat organik mempunyai potensial redoks yang lebih kecil dari potensial tersebut [13].
Anatase
Rutil
Gambar 1. Struktur kristal anatase dan rutil.
Proses Fotokatalisis
4
Gambar 2. Energi gap, posisi pita valensi, konduksi, dan potensial redoks dari berbagai semikonduktor.
Gambar 3. Skema proses fotokatalisis. Rekombinasi elektron-hole dapat terjadi pada permukaan semikonduktor (reaksi a) atau di bulk semikonduktor (reaksi b). Pada permukaan partikel, elektron fotogenerasi dapat mereduksi oksigen menjadi anion super-oksida (reaksi c) dan hole fotogenerasi
dapat mengoksidasi OH- atau air untuk membentuk radikal hidroksil (reaksi d).
Reaksi fotokatalisis (Gambar 3)
diawali ketika partikel TiO2 mengabsorbsi
foton dari cahaya, kemudian pasangan
elektron-hole akan terbentuk dalam
semikonduktor seperti diperlihatkan pada
reaksi 1 dalam Tabel 2. Elektron dan hole
pada permukaan semikonduktor masing-masing berperan sebagai reduktor dan oksidator. Pasangan elektron-hole ini akan (i) berekombinasi, yaitu kembali ke keadaan awal dan melepaskan energi foton terabsorbsi sebagai panas (reaksi 5 pada Tabel 2) atau (ii) bermigrasi ke permukaan dan bereaksi dengan senyawa teradsorbsi[8].
Ion hidroksida teradsorbsi dan molekul air membentuk radikal hidroksil melalui mekanisme oksidasi dengan cara mengikat hole, seperti diperlihatkan pada reaksi (6a) dan (6b), kemudian akan mengawali serangkaian reaksi redoks yang kompleks pada permukaan zat padat-cair[8].
Untuk meningkatkan oksidasi titanium dioksida, yang kemudian akan meningkatkan aktivitas fotokatalisis, harus ada akseptor
elektron irreversible. Akseptor elektron
irreversible merupakan senyawa yang mampu menjaga kesetimbangan muatan dalam sistem dengan cara mereduksi dan mencegah rekombinasi pasangan
elektron-hole. Oksigen dan hidrogen peroksida
merupakan akseptor elektron irreversible
yang sangat baik dan dapat dengan mudah ditambahkan ke dalam sistem fotokatalitik. Seperti yang diilustrasikan pada reaksi 8b dan 13 [14].
Radikal hidroksil dihasilkan pada permukaan titanium dioksida, radikal-radikal ini dapat teradsorbsi pada permukaan titanium dioksida atau berdifusi ke dalam larutan. Radikal hidroksil dapat mengoksidasi molekul kontaminan organik melalui empat langkah:
1. Kasus I (reaksi 9): radikal hidroksil tetap teradsorbsi pada atau dekat permukaan titanium dioksida dan akan mengikat molekul kontaminan teradsorbsi.
2. Kasus II (reaksi 10): radikal hidroksil
berdifusi ke dalam larutan dan mengikat molekul kontaminan teradsorbsi.
4. Kasus IV (reaksi 12): radikal hidroksil berdifusi ke dalam larutan dan mengikat kontaminan juga di dalam larutan. Ringkasan keseluruhan reaksi dapat dilihat pada Tabel 2.
Tabel 2.Mekanisme fotokatalisis dengan titanium dioksida [8]
Reaksi Radikal Lain
2 2( ) ( 2 2)
Pemberian potensial listrik melalui film katalis, untuk menghasilkan “fotoreaktor bias”, dapat meminimalisasi rekombinasi
elektron-hole. Reaktor seperti ini
menggunakan elektroda terpisah: sebuah elektroda kerja yang dilapisi dengan katalis
(sebagai fotoanoda) dan sebuah elektroda
counter (sebagai katoda). Pemberian potensial positif melewati fotoanoda akan
menarik elektron fotogenerasi ke katoda,
kemudian meminimalisasi rekombinasi
pasangan elektron-hole dalam katalis dan
meningkatkan kecepatan oksidasi senyawa organik [14].
Seperti yang diindikasikan pada
Gambar 4, pasangan elektron-hole dapat
dihasilkan dalam semikonduktor melalui absorbsi cahaya dengan energi lebih besar atau sama dengan celah pita energi semikonduktor. Ketika semikonduktor tipe-n dicelupkan pada larutan, maka tingkat energi ferminya berkurang dan menghasilkan
pembentukan medan listrik pada interface
antara semikonduktor dan larutan elektrolit
[13]
. Pasangan elektron-hole yang dihasilkan pada daerah medan listrik tersebut, daerah deplesi, akan terpisah dan tidak mengalami rekombinasi. Sebagai konsekuensinya, pada semikonduktor tipe-n, elektron fotogenerasi akan bergerak ke bulk semikonduktor, dimana elektron ini dapat ditransfer baik melalui kawat ke elektroda non-fotoaktif (seperti Pt) atau bergerak ke permukaan ke suatu titik dimana elektron akseptor dapat direduksi. Sementara itu, hole fotogenerasi, dibawah pengaruh medan listrik, akan bermigrasi ke permukaan semikonduktor dan mengoksidasi elektron donor yang cocok. Proses fotoelektrokatalisis ini diilustrasikan pada Gambar 4. Dari tinjauan termodinamik, agar elektron fotogenerasi di pita konduksi dapat mereduksi air, pita potensialnya, (ECB),
harus kurang dari E(H+/H2); juga agar hole
fotogenerasi pada pita valensi dapat mengoksidasi air, EVB, harus lebih besar dari
(O2/H2O) [4].
6
Methylene Blue
Methylene Blue yang memiliki rumus
kimia C16H18ClN3S, adalah senyawa
hidrokarbon aromatik yang beracun dan
merupakan dye kationik dengan daya
adsorpsi yang sangat kuat. Pada umumnya digunakan sebagai pewarna sutra, wool, tekstil, kertas, peralatan kantor dan kosmetik.
Senyawa ini berupa kristal berwarna hijau gelap. Ketika dilarutkan dalam air atau alkohol akan menghasilkan larutan berwarna biru. Memiliki berat molekul 319.86 gr/mol, dengan titik lebur di 105 oC dan daya larut
sebesar 4,36 x 104 mg/L. Strukturnya
diperlihatkan pada Gambar 5.
Gambar 5. Struktur molekul kimia Methylene Blue
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Kegiatan penelitian dilakukan di Laboratorium Fisika Material Jurusan Fisika dan Laboratorium Analisis Kimia Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Penelitian ini dilakukan sejak bulan Agustus 2005 sampai Agustus 2006 yang terdiri dari penelusuran literatur, kegiatan penelitian dan penulisan laporan.
Bahan dan Alat
Bahan-bahan yang digunakan dalam
penelitian ini adalah TiO2 Degussa P25,
Acetylaceton (Merck), Polyethyleneglycol 4000 (Merck), akuades, aseton, bubuk methylene blue (Certistain), NaOH, HCl, dan
H2O2. Sebagai substrat digunakan kaca
konduktif ITO (Indium TinOxide).
Peralatan yang digunakan diantaranya furnace (Vulcan), difraktometer sinar-X (Shimadzu tipe XD-610), lampu UV jenis
Black Light (UV-A) dengan panjang
gelombang maksimum sebesar 360 Å,
berdaya listrik 6 Watt (Ultra Violet Products. Inc), Thermo Spectronic 20D+, spektroskopi UV-Vis Genesys-10, ultrasonic cleaner (Cole-Parmer), pH-meter, reaktor
fotokatalisis, eletroda pencacah platina (Pt), catu daya, neraca analitik, pengaduk magnet, magnet, pipet hisap 5 ml, volumetrik 50 ml, tabung reaksi, scotch-tape, wadah sampel, gelas rod, dan alumunium foil.
Deposisi Film TiO2
Film TiO2 dibuat dengan metode
squeegee printing. Pasta titanium disiapkan
dengan mencampurkan 3 mg TiO2 bubuk, 3
ml akuades, 1 ml asetylaseton dan 4 gr Polyethyleneglycol (PEG). Campuran ini diaduk selama 1 jam hingga dihasilkan pasta yang mengental. Substrat ITO berukuran (4.5 x 3) cm, sebanyak 4 buah dibersihkan dengan sabun dan direndam dengan aseton dalam ultrasonic cleaner selama 30 menit, kemudian dikeringkan. Tepi-tepi substrat
dibingkai dengan scotch-tape, 0.5 cm dari
tiap tepi dengan sisi konduktif menghadap ke atas.
Deposisi dilakukan dengan meneteskan pasta titanium pada substrat ITO. Pasta diratakan dengan glass rod hingga seluruh substrat tertutup dengan titanium. Substrat yang telah dilapisi dipanaskan di atas piringan pemanas bersuhu 100 oC selama 10 menit hingga lapisan mengering dan scotch-tape dapat dilepas tanpa merusak tepi lapisan. Untuk menumbuhkan kristal anatase, film
dipanaskan hingga 450 oC dengan kenaikan
suhu 5 oC/menit dan di-hold 10 menit pada
suhu 100 oC dan 300 oC, sedangkan pada
suhu 450 oC di-hold selama 30 menit. Total waktu proses pemanasan adalah dua jam lima belas menit.
Karakterisasi XRD
Karakterisasi kristal TiO2 ditentukan
dengan difraksi sinar-X (XRD) menggunakan difraktometer sinar-X (Shimadzu model XD-610) yang terdapat di Laboratorium X-Ray, Pusat Penelitian dan Pengembangan Ilmu Pengetahuan dan Teknologi Batan (P3IB), Badan Tenaga Nuklir Nasional (BATAN), Kawasan PUSPITEK Serpong, Tangerang. Alat ini menggunakan sumber Cu dengan tegangan 30 kV, arus 30mA dan panjang
gelombang, λ = 1.54056 Å. Film discan
dengan rentang 2θ antara 20-70o. Hasil output karakterisasi XRD berupa kurva hubungan antara 2θ versus intensitas. Kurva ini kemudian dibandingkan dengan kurva XRD
dihitung menggunakan persamaan
Debye-panjang gelombang sinar-X yang digunakan; θB adalah sudut puncak; dan B adalah lebar
puncak pada setengah intensitas maksimum (FWHM).
Pembuatan Reaktor
Reaktor degradasi skala laboratorium yang dibuat adalah model reaktor takalir (Water Static Batch Reactor). Reaktor ini terdiri dari bejana dengan daya tampung 100 ml; film TiO2; elektroda pencacah, Pt;
pengaduk magnet; catu daya; lampu UV-A. Bejana dibuat menggunakan bahan aklirik
dengan dimensi (5 x 4 x 5) cm. Film TiO2
diletakkan pada salah satu sisi bejana, 1 cm dari dasar bejana. 0,5 cm di atasnya diletakkan elektroda pencacah platina (Pt). Lampu UV diletakkan 3 cm dari mulut bejana. Bagian atas bejana ditutup
menggunakan wrapping plastic dan
sisi-sisinya ditutup dengan alumunium foil. Keseluruhan reaktor ditutup dengan kotak kayu untuk menghindari pengaruh cahaya dari luar. Luas lapisan tipis adalah 10 cm2 dan luas elektroda pencacah adalah 0.5 cm2 (Lampiran 1)
Pembuatan Kurva Standar Methylene Blue
Kurva karakterisasi absorbansi Methylene Blue, MB, untuk beberapa variasi konsentrasi diperoleh menggunakan spektroskopi UV-Vis Genesys-10 pada panjang gelombang 524-669 nm, sedangkan kurva standar dibuat dengan menscan larutan MB, menggunakan Thermo Spectronic 20D+
pada panjang gelombang 500-700 Å. Untuk
selanjutnya spektroskopi yang digunakan untuk mengukur absorbansi larutan adalah Thermo Spectronic 20D+. Spektroskopi Genesys-10 digunakan hanya untuk melihat karakterisasi absorbansi MB.
Evaluasi Fotolisis, Fotokatalisis dan Fotoelektrokatalisis
Evaluasi dilakukan melalui beberapa variasi kondisi eksperimen, yaitu fotolisis (kondisi eksperimen dengan UV tanpa TiO2),
fotokatalisis (kondisi eksperimen dengan
TiO2 dan UV), dan fotoelektrokatalisis (UV,
TiO2 dan pemberian potensial bias eksternal).
Sebagai kontrol dilakukan eksperimen pada keadaan gelap (tanpa perlakuan apapun).
Larutan MB yang digunakan sebanyak 50 ml dengan konsentrasi awal 5 x 10-6 M. Lampu UV yang digunakan adalah lampu UV-A dengan panjang gelombang
maksimum 360 Å. TiO2 disinari dengan
lampu ini sepanjang arah normalnya. pH larutan diatur dengan menambahkan NaOH dan HCl. Pengaruh hidrogen peroksida terhadap degradasi MB dilihat dengan
menambahkan H2O2 30% sebanyak 0.1 ml.
Penambahan potensial bias sebesar +1.0 Volt, dimana platina yang digunakan sebagai elektroda counter dihubungkan ke kutub
negatif power supply sedangkan film TiO2
dihubungkan ke kutub positif. Konsentrasi MB setelah diberi perlakuan diukur dengan Thermo Spectronic 20D+. Petikan sampel diambil pada menit ke- 0, 30, 60, 90, 120, dan 150.
Degradasi MB dinyatakan dengan kecepatan reaksi kinetik:
dC
dt = laju degradasi Methylene Blue
(Molar/menit)
Co = konsentrasi awal Methylene Blue
(dalam Molar)
C = konsentrasi Methylene Blue setelah
waktu t (dalam Molar)
t = waktu (dalam menit)
k = tetapan kelajuan degradasi (dalam
menit-1)
HASIL DAN PEMBAHASAN
Hasil XRD Film TiO2 dan Ukuran Partikel
Pendeposisian TiO2 bubuk dengan
metode squeegee printing pada substrat ITO (Indium Tin Oxide) dengan binder PEG memperlihatkan hasil yang baik. Adanya
PEG sebagai binder meningkatkan gaya
adhesi partikel sehingga TiO2 menempel
8
Gambar 6.Kristalografi TiO2
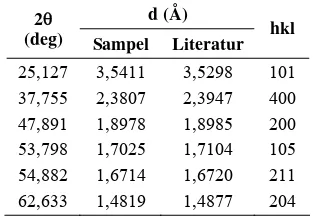
Tabel 3.. Susunan puncak dan intensitas kristal TiO2 fase anatase
d (Å) 2θ
(deg) Sampel Literatur hkl
25,127 3,5411 3,5298 101
Struktur film diperiksa menggunakan XRD. Gambar 6 memperlihatkan pola
difraksi film TiO2 yang dipanaskan hingga
450o. Pada pola tersebut tampak bahwa ada enam puncak yang konsisten dengan puncak untuk kristal anatase, sedangkan kristal rutil tidak terdeteksi pada pola difraksi. Hasil ini menunjukkan bahwa proses pemanasan yang
dilakukan hingga 450o cukup untuk
membentuk kristal anatase dan tidak berlebih sehingga terbentuk kristal rutil. Rangkuman puncak-puncak tersebut diperlihatkan pada Tabel 3. Perbandingan hasil XRD sampel dan literatur diberikan pada Lampiran 2.
Perbandingan parameter kisi sampel TiO2 dan standar diperlihatkan pada Tabel 4.
Dari data ini dapat dilihat bahwa nilai parameter a dan c sampel tidak jauh berbeda dengan nilai parameter dari literatur. Nilai ini
mengindikasikan bahwa film TiO2 yang
dibuat memiliki struktur tetragonal. Perhitungan parameter kisi diperlihatkan pada Lampiran 3.
Ukuran kristal mempengaruhi aktivitas
fotokatalisis. Film dengan ukuran kristal yang kecil (skala nanometer) dapat
meningkatkan aktivitas fotokatalis melalui
peningkatan generasi elektron dan hole.
Ukuran kristal dihitungdengan formula Scharrer. Perhitungannya dapat dilihat pada Lampiran 4. Dari hasil perhitungan keenam puncak pola XRD diperoleh bahwa partikel TiO2 sampel memiliki ukuran kristal sebesar
24.545 nm.
Tabel 4.. Perbandingan parameter kisi kristal sampel pada lapisan TiO2 dan literatur
Parameter Sampel Literatur
a (Å) 3,7945 3,797
c (Å) 9,518061 9,579
Kurva Standar Methylene Blue
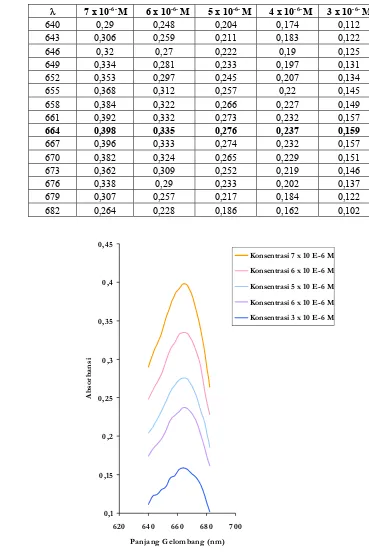
Hasil scan larutan MB (Gambar 7)
menggunakan spektroskopi UV-Vis Genesys-10 memperlihatkan kurva karakteristik absorbansi Methylene Blue dengan puncak maksimum berada pada panjang gelombang 664 nm. Nilai ini tidak terlalu berbeda dari literatur yaitu 666 nm. Dari hasil tersebut dapat dilihat bahwa spektrum absorbansi MB menurun dengan menurunnya konsentrasi larutan. Kurva standar Methylene Blue
(Gambar 8) diperoleh dengan menscan
0
500 550 600 650 700
Panjang Gelombang (nm)
Gambar 7. Spektrum karakterisasi absorbansi Methylene Blue untuk konsentrasi 1 x 10-4 M, 9 x 10-5 M, 8 x 10-5 M, 7 x 10-5 M dan 6 x 10-5 M menggunakan spektroskopi UV-Vis Genesys-10.
Gambar 8. Kurva standar Methylene Blue (menggunakan Spektronic 20-Milton Roy). .
Pengaruh Konsentrasi Awal MB
a
a; Konsentrasi 5 x 10E-6 M b; Konsentrasi 6 x 10E-6 M c; Konsentrasi 7 x 10E-6 M
Gambar 9. Pengaruh konsentrasi awal terhadap degradasi fotokatalisis MB.
Gambar 9. memperlihatkan profil degradasi fotokatalisis MB untuk konsentrasi awal 7 x 10-6 MB, 6 x 10-6 MB, dan 5 x 10-6
M. Grafik hubungan antara C/Co terhadap
lama perlakuan memperlihatkan adanya penurunan tetapan kelajuan degradasi dengan
meningkatnya konsentrasi awal MB. Nilai t
untuk ketiga konsentrasi awal tersebut adalah 0.0075, 0.0079, dan 0.0102 (menit-1) untuk konsentrasi 7 x 10-6 M, 6 x 10-6 M, dan 5 x 10-6 M (Gambar 10) .
Pada larutan dengan konsentrasi MB yang tinggi, jumlah molekul MB yang terkandung dalam larutan juga akan semakin tinggi. Molekul ini akan menghalangi foton
untuk mencapai TiO2, sehingga akan
menurunkan kecepatan degradasi. Fenomena sebaliknya teramati untuk larutan dengan konsentrasi MB yang rendah. Peluang foton
untuk mencapai TiO2 bertambah karena
molekul MB dalam larutan lebih sedikit. Selain itu, larutan dengan konsentrasi MB yang tinggi membutuhkan radikal hidroksil yang lebih banyak dalam proses degradasi. Karena luas permukaan katalis yang digunakan selama proses fotokatalisis
tetap, maka jumlah radikal OH• yang
dihasilkan oleh katalis juga akan konstan. Akibatnya akan terjadi kurangan pasokan radikal pada proses degradasi dengan konsentrasi awal yang tinggi, dan hanya akan menghasilkan tetapan kelajuan degradasi yang kecil.
Pengaruh pH Awal MB
Nilai pH merupakan parameter penting pada proses degradasi. pH larutan
mempengaruhi muatan permukaan TiO2,
kekuatan ionik, sifat dye dan mempengaruhi adsorbsi dye pada partikel TiO2. Nilai pH
dimana permukaan suatu oksida tidak bermuatan didefinisikan sebagai zero point charge (pHzpc). Untuk TiO2, pHzpc bernilai
6.25. Di bawah nilai ini TiO2 akan bermuatan
positif, sedangkan di atasnya bermuatan negatif berdasarkan reaksi:
2
TiOH+H+ →TiOH+ (21)
2
TiOH+OH− →TiO− +H O (22) Pengaruh pH terhadap proses degradasi MB diamati pada kondisi ekperimen fotokatalisis. Konsentrasi awal
MB yang digunakan adalah 5 x 106 M. pH
10
Uji ini memperlihatkan bahwa degradasi terbesar teramati pada larutan dengan pH 11, diikuti dengan larutan pH 7 dan 3. Setelah 150 menit perlakuan, larutan MB pH 11 terdegradasi sebesar 70 %, sedangkan untuk larutan pH 7 dan 3 sebesar 44 % dan 30 % (Gambar 10).
MB merupakan senyawa yang memiliki ikatan S+ sehingga MB termasuk dalam jenis dye kationik. Pada larutan dengan pH tinggi, MB yang bermuatan positif (bersifat basa) akan mudah teradsorbsi pada permukaan
TiO2 yang bermuatan negatif. Adsorbsi MB
meningkat karena adanya interaksi elektrostatik antara MB dan partikel TiO2.
sebaliknya, pada pH rendah (bersifat asam),
adsorbsi MB pada permukaan TiO2 menjadi
sulit karena adanya gaya tolak menolak antara MB dan partikel TiO2 yang sama-sama
bermuatan positif. Dari hasil ini dapat disimpulkan bahwa degradasi MB paling baik dilakukan pada keadan basa. Semakin bersifat basa larutan tersebut, degradasi MB akan semakin baik.
0
Gambar 10. Hubungan antara pH dan persen degradasi MB
Evaluasi Aktivitas Fotolisis, Fotokatalisis dan Fotoelektrokatalisis
Evaluasi Aktivitas Fotolisis
Warna pada dye muncul karena adanya grup kromofor. Kromofor merupakan konfigurasi radikal yang mengandung elektron terdelokalisasi. Konfigurasi kromoforik diantaranya azo (-N=N-), karbonil (=C=O), karbon (=C=C), karbon nitrogen (>C=NH atau –CH=N-); nitroso
(-NO atau N-OH); nitro (-(-NO2 atau =NO-OH);
sulfur (C=S).
Fotolisis adalah proses dimana ikatan kimia MB diputus oleh energi foton cahaya UV. Ketika foton UV memasuki medium, foton akan ditransmitansi atau diabsorbsi oleh medium dan molekul MB yang terlarut.
Foton yang diabsorbsi dapat mengawali reaksi fotolisis dengan menyerang ikatan kromofor MB. Foton juga mampu mengaktifkan molekul air untuk membentuk radikal hidroksil, yang akan ikut berperan dalam menguraikan molekul MB.
Degradasi melalui penyinaran langsung oleh UV hanya memberikan penurunan konsentrasi sebesar 27,22 % setelah penyinaran selama 150 menit, dengan tetapan kelajuan degradasi sebesar 0.00005 menit-1 (Tabel 5). Kurva degradasinya memperlihatkan penurunan kurva yang landai (Gambar 11b) dibandingkan kurva proses degradasi lainnya. Setelah proses penyinaran, tidak tampak adanya perubahan warna larutan jika dibandingkan kontrol (perlakuan pada menit ke-0). Hal ini mengindikasikan bahwa foton tidak cukup mampu untuk menguraikan ikatan kromofor MB, dimana jumlah radikal hidroksil yang dihasilkan oleh foton tidak banyak, sehingga tidak tampak adanya perubahan warna larutan.
Evaluasi Aktivitas Fotokatalisis dan Fotoelektrokatalisis
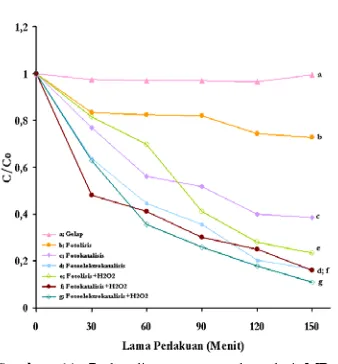
Gambar 11. Perbandingan proses degradasi MB. a : gelap, b : fotolisis, c : fotokatalisis, d : fotoelektrokatalisis, e : fotolisis+ H2O2, f :
fotokatalisis+ H2O2 dan g :
fotoelektrokatalisis+ H2O2
Penambahan semikonduktor sebagai katalis pada proses fotolisis dinamakan fotokatalisis. Pada proses fotokatalisis, ikatan kimia pada MB akan dipecah oleh radikal hidroksil, OH•, yang tersedia dalam larutan.
sebesar 61.50 % (Gambar 13), sedangkan konstanta kelajuan degradasinya bernilai 0.0065 menit-1. Perubahan warna larutan MB terlihat dengan jelas pada menit ke-150 (Gambar 14), dimana warna larutan menjadi lebih bening dibandingkan kontrolnya.
-2,5
Pemberian potensial bias eksternal sebesar +1.0 Volt memperlihatkan hasil yang lebih baik dibandingkan proses fotokatalisis dan fotolisis, dimana pada menit ke-90, konsentrasi MB sudah terdegradasi lebih dari setengah konsentrasi awalnya. Pada akhir menit ke-150, degradasi dengan metode ini memberikan hasil yang sangat memuaskan dengan persentase degradasi sebesar 84.19% (Gambar 13) dan tetapan kelajuan degradasi
sebesar 0.011 menit-1. Pada Gambar 11.d,
dapat dilihat bahwa grafik degradasi fotoelektrokatalisis lebih curam dibandingkan dua metode sebelumnya, dan dari Gambar 14, dapat diamati bahwa warna larutan menjadi lebih jernih dibandingkan kontrol.
89,23 %
Gambar 13. Grafik persentase penurunan konsentrasi MB untuk beberapa variasi perlakuan, dimana a: fotolisis; b: fotokatalisis; c: fotolisis+H2O2; d: fotoelektrokatalisis; e: fotokatalisis+H2O2; f: fotoelektrokatalisis+H2O2
Tingginya hasil degradasi dengan metode fotoelektrokatalisis mengindikasikan bahwa rekombinasi pasangan elektron/hole dapat dikurangi, sehingga keberadaan radikal yang bertanggung jawab untuk memecah ikatan kimia molekul akan lebih banyak tersedia dalam larutan, dan cukup untuk memecah ikatan kromofor MB sehingga larutan menjadi tidak berwarna setelah 150 menit perlakuan, sedangkan pada proses fotokatalisis tidak banyak terjadi perubahan warna karena kurangnya konsentrasi radikal dalam larutan.
Gambar 14. Foto hasil degradasi untuk fotolisis (kiri atas), fotokatalisis (kanan atas) dan fotoelektrokatalisis (bawah)
Pengaruh Penambahan H2O2
Penambahan H2O2 dapat meningkatkan
konsentrasi radikal hidroksil. Radikal ini dapat menghambat rekombinasi berdasarkan reaksi
2 2
H O +e− →OH−+OH• (23)
H2O2 mempunyai dua fungsi dalam proses
degradasi, yaitu H2O2 selain mengikat
elektron sehingga terjadi pemisahan muatan juga berfungsi membentuk radikal OH•
.
2 2 2 2
H O +O•− →OH−+OH•+O (24)
Penambahan senyawa H2O2 dapat
mempengaruhi proses fotolisis, fotokatalisis dan fotoelektrokatalisis. Pada fotolisis, pengaruh penambahan H2O2 terlihat sangat
signifikan. Hal ini dapat dilihat dari Gambar 11.e, dimana grafik fotolisis+H2O2 menurun
dengan tajam dibandingkan proses fotolisis saja. Hal ini dikarenakan adanya tambahan radikal hidroksil melalui reaksi
2 2 2
H O +hv→ OH• (25)
Proses fotolisis + H2O2 menyumbangkan
12
Pada proses fotokatalisis dan fotoelektrokatalisis, penambahan H2O2 tidak
memperlihatkan hasil maksimal dibandingkan pada proses fotolisis (Gambar 11f dan 11g). Pertambahan persentase degradasi hanya sebesar 22.69 % untuk proses fotokatalisis+H2O2 dan 5.55 % untuk
fotoelektrokatalisis+H2O2. Sangat kecil jika
dibandingkan dengan pertambahan persentase degradasi pada proses fotolisis yang mencapai 49.41% (Gambar 13). Hal ini disebabkan karena konsentrasi yang ditambahkan dalam larutan terlalu tinggi, sehingga akan menimbulkan efek negatif. Efek negatif ini yaitu terbentuknya radikal
2
OH• yang kurang reaktif dibandingkan
radikalOH•
,
dan terbentuknya molekul gas dalam sistem. Molekul gas ini tidak terlarut, melainkan menempel pada permukaan film dan elektroda Pt, sehingga akan menghalangi transfer energi foton.Secara umum penambahan H2O2 dapat
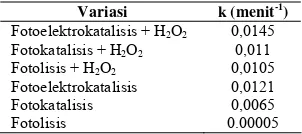
meningkatkan kecepatan degradasi MB, dilihat dari nilai tetapan kelajuan degradasi,
dimana untuk proses fotokatalisis+H2O2
tetapan ini bernilai 0.011 menit-1 dan untuk
fotoelektrokatalisis+H2O2 sebesar 0.0145
menit-1. Nilai ini diperoleh dari kurva linear
hubungan antara C/Co terhadap waktu
perlakuan (Gambar 12).
Tabel 5.Tetapan kelajuan degradasi methylene blue Variasi k (menit-1)
Fotoelektrokatalisis + H2O2 0,0145
Fotokatalisis + H2O2 0,011
Fotolisis + H2O2 0,0105
Fotoelektrokatalisis 0,0121 Fotokatalisis 0,0065 Fotolisis 0.00005
KESIMPULAN DAN SARAN
Kesimpulan
Film TiO2 dapat dibuat menggunakan
metoda squeegee printing dengan
mencampurkan TiO2 degussa, asetilaseton,
PEG, dan akuades, kemudian melapiskannya pada permukaan ITO. Pemanasan hingga
450o terbukti menumbuhkan kristal anatase
TiO2. PEG dalam pembuatan film terbukti
meningkatkan gaya adhesi TiO2 dengan
substrat dilihat dari tidak mudah rusaknya film setelah penggunaan berulang.
Rancangan reaktor takalir skala laboratorium menghasilkan reaktor dengan daya tampung dan luas film yang
proporsional. Hal ini dapat dilihat dari hasil degradasinya yang baik.
Metode fotoelektrokatalisis dan
fotokatalisis berbasis semikonduktor TiO2
terbukti mampu menurunkan konsentrasi MB dalam air. Konsentrasi dan pH awal larutan MB merupakan faktor penting yang harus diperhatikan untuk mendapatkan hasil degradasi yang maksimal. Degradasi MB memperlihatkan hasil yang baik pada konsentrasi awal yang rendah dan pada keadaan basa. Kombinasi fotoelektrokatalisis dan penambahan H2O2 memperlihatkan hasil
terbaik diikuti fotoelektrokatalisis,
fotokatalisis+H2O2 dan fotokatalisis.
Penambahan potensial bias dan H2O2 terbukti
dapat meningkatkan kecepatan degradsi melalui pemisahan elektron/hole.
Saran
Masih banyak metode yang dapat digunakan untuk meningkatkan hasil degradasi. Diantaranya adalah penambahan oksigen terlarut. Penambahan oksigen dalam sistem degradasi juga dapat mengurangi rekombinasi elektron/hole, dimana elektron bertindak sebagai donor elektron. Keberadaan oksigen dalam sistem juga sangat penting, dimana beberapa peneliti telah menemukan bahwa proses degradasi sangat dipengaruhi oleh kadar oksigen dalam sistem.
Penelitian sebelumnya selalu menggunakan reaktor takalir dalam proses degradasi. Perlu dilakukan penelitian lebih lanjut dengan menggunakan reaktor alir, dan melihat pengaruhnya pada proses degradasi.
DAFTAR PUSTAKA
[1] Carneiro, et al. 2004. Evaluation of color removal and degradation of a reactive textile azo dye on nanoporous TiO2 thin-film electrodes. Electrochimica Acta 49: 3807–3820.
[2] Silva, et al. Catalytic oxidation of methylene blue in aqueous solutions. Instituto de Ingenieria Quimica– Universidad Nasional de San Juan– Argentina.
[4] Mills, A and Hunte, L.S. 1997. An Overview of Semiconductor Photocatalysis. J. of Photochem. and Photobio A: 108: 1-35.
[5] Aitali, Khadija M. 2002. Wastewater depollution by photocatalytic and bidegradation processes. Universite Hassan II Faculte Des Sciences Ain Chok Departement De Chime.
[6] Balasubramanian, G, et al. 2003.
Titania Powder Modified Sol-gel Process for Photocatalytic Aplications. J. of Material Science. 83: 823-831.
[7] Vulliet, E, et al. 2003. Factors
influencing the Photocatalytic Degradation of Sulfonylurea Herbicides by TiO2 Aqueous
Suspension. J. of Photochem. and
Photobio A. 159:71-79
[8] Macias, L, T. 2003. The Design and Evaluation of A Continuous Photocatalytic Reactor Utilizing Titanium Dioxida in Thin Film of Mesoporous Sililca. A Thesis for the Degree of Master of Science in Chemical Engineering in Mississippi State University.
[9] Jiang, D., et al. 2004. Stuedies of Photocatalytic Processes at Nanoporous TiO2 Film Electrodes
By Photoelektrochemical Techniques and Development of A
Novel Methodology for Rapid Determination of Chemical Oxygen Demand. University Griffith, School of Environmental and Applied Sciences
[10] Marlupi, I. 2003. Desinfeksi
Escherichia coli melalui fotokatalisis Titanium Dioksida (TiO2) Bubuk Fase Rutil. [Skripsi].
Bogor: Institut Pertanian Bogor, Fakultas Matematika dan Ilmu Pengetahuan Alam.
[11] Linsebigier, A L, et al. 1995.
photocatalysis on TiO2 surface:
principles, mechanisms, and selected results. Chem. Rev 95: 735-758.
[12] Diebold, U. 2003. The surface science of titanium dioxide. Surface science report 48: 53-229
[13] Gunlazuardi, J. 2001. Fotokatalisis pada permukaan TiO2 : Aspek
fundmental dan aplikasinya. Seminar Nasional Kimia Fisika II. Jurusan kimia, FMIPA, Universitas Indonesia.
[14] EPA. 2003. Photoelectrocatalytic
degradation and removal of organic and inorganic contaminants in ground waters. Cincinnati, Ohio.
[15] Senthilkumaar, et al. 2004.
photodegradation of a textile dye catalyze by sol-gel derived nanocristalline TiO2 via ultrasonic
irradiation. J. of Photochemistry and Photobiology A : Chemistry 170 : 225-232
[16] Sudana, A. 2003. Deposisi dan
karakerisasi lapisan tipis titanium dioksida (TiO2) dalam proses
desinfeksi escherichia coli. [Skripsi]. Bogor: Institut Pertanian Bogor, Fakultas Matematika dan Ilmu Pengetahuan Alam.
[17] Poulios and Tsachpinis. 1999.
Photodegradation of the textile dye reactive black 5 in the presence of
semiconducting oxides. J. Chem
Technol Biotechnol 74: 349-357.
[18] Allen, S.J. and Koumanova, B. 2005.
Decolourisation of water/waste water using absorpsi (Review). Journal of the University of Chemical Technology and Metallurgy 40: 175-192
[20] Shen, Q and Toyoda, T. 2003. Studies of optical absorption and electron transport in nanocrystalline TiO2
electrodes. Thin solid film: 167-170.
[21] Taicheng, et al. 2001.
Photoelectrochemical degradation of
methylene blue with nano TiO2
under high potensial bias. Mater. Phys. Mech 4: 101-106
14
nitrobenzene using artificial
ultraviolet light. Chemical
engineering journal 102: 283-290
[23] Irmak, et al. 2004. Degradation of 4-chloro-2-methylpenol in aqueous solution by UV irradiation in the presence of titanium dioxide. Applied catalyst B: Environmental 54: 85-91
[24] Zhang, et al. Photoelectrocatalytic
degradation of reactive brilliant orange K-RBOKR in a new
continuous flow photoelectrocatalytic reactor.
Applied catalysis A: 221-229
[25] Qamar, et al. 2005. Photocatalytic
15
17
Lampiran 3. Penentuan parameter kisi dengan metode Cohen (Cullity & Stock, 2001)
3.1 Persamaan-persamaan dalam menentukan parameter kisi dengan metode Cohen. Persamaan umum:
λ=2d sin ...(3.1.1) Penentuan sistem kristal tetragonal menggunakan persamaan:
2
λ : panjang gelombang
: sudut difraksi
A,B,C : numerator
Numerator diperoleh dengan menggunakan mengeliminasi persamaan (3.3)
Persentase ketepatan hasil perhitungan parameter kisi yang diperoleh dibandingkan dengan nilai literatur, dengan menggunakan persamaan:
3.2 Penentuan parameter kisi kristal pada TiO2
3.2.1 Data-data pendukung analisis parameter kisi kristal TiO2
hkl 2 α α2 γ γ2 αγ sin 22 Sin2 δ δ2 γδ αδ α Sin2 γ Sin2 δ Sin2
101 25,127 12,564 1 1 1 1 1 0,180285 0,047315 1,802852 3,250274 1,802852 1,802852 0,047315 0,047315 0,085302 004 37,755 18,878 0 0 16 256 0 0,374887 0,104678 3,748868 14,054011 59,981888 0,000000 0,000000 1,674850 0,392424 200 47,891 23,946 4 16 0 0 0 0,550371 0,164722 5,503711 30,290834 0,000000 22,014844 0,658889 0,000000 0,906584 105 53,798 26,899 1 1 25 625 25 0,651136 0,204675 6,511360 42,397812 162,784006 6,511360 0,204675 5,116870 1,332711 211 54,882 27,441 5 25 1 1 5 0,669059 0,212364 6,690586 44,763936 6,690586 33,452928 1,061821 0,212364 1,420841 204 62,633 31,317 4 16 16 256 64 0,788686 0,270150 7,886861 62,202574 126,189774 31,547443 1,080602 4,322407 2,130639
Σ 15 59 59 1139 95 3.214424 1.003905 32.44237 196,959442 357,449105 95,329427 3,053302 11,373807 6,268502
3.2.2 Hasil penentuan parameter kisi kristal TiO2
a c ∆a/a ∆c/c % ketepatan a % ketepatan c
B C
Sampel Literatur Sampel Literatur
19
Lampiran 4. Penentuan ukuran kristal dengan metode Cohen
Untuk mementukan ukuran kristal digunakan persamaan:
θ : sudut difraksi sinar X (derajat)
σ : ukuran partikel,
: mikro strain
Ukuran kristal didapatkan dengan cara memasukkan semua puncak yang muncul ke dalam persamaan diatas, dengan menganggap y = Bcos , dan x = sin persamaan diatas menjadi
y = a + bx,
Dengan menggunakan regresi linear akan bisa didapatkan nilai a dan b, dari nilai a dapat diketahui ukuran kristal (σ).
sin θ b cos θ
; maka ukuran partikel TiO
Lampiran 5. Pengolahan data degradasi Methylene Blue
5.1 Data scanning larutan Methylene Blue pada panjang gelombang 640 – 682 nm menggunakan Thermo Spectronic 20D+. Data ini digunakan untuk mendapatkan kurva standar untuk penentuan konsentrasi larutan setelah diberi perlakuan.
λ 7 x 10-6- M 6 x 10-6- M 5 x 10-6- M 4 x 10-6- M 3 x 10-6- M
640 0,29 0,248 0,204 0,174 0,112
643 0,306 0,259 0,211 0,183 0,122
646 0,32 0,27 0,222 0,19 0,125
649 0,334 0,281 0,233 0,197 0,131
652 0,353 0,297 0,245 0,207 0,134
655 0,368 0,312 0,257 0,22 0,145
658 0,384 0,322 0,266 0,227 0,149
661 0,392 0,332 0,273 0,232 0,157
664 0,398 0,335 0,276 0,237 0,159
667 0,396 0,333 0,274 0,232 0,157
670 0,382 0,324 0,265 0,229 0,151
673 0,362 0,309 0,252 0,219 0,146
676 0,338 0,29 0,233 0,202 0,137
679 0,307 0,257 0,217 0,184 0,122
682 0,264 0,228 0,186 0,162 0,102
0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45
620 640 660 680 700
Panjang Gelombang (nm)
A
b
so
rb
ansi
Konsentrasi 7 x 10 E-6 M
Konsentrasi 6 x 10 E-6 M
Konsentrasi 5 x 10 E-6 M
Konsentrasi 6 x 10 E-6 M
Konsentrasi 3 x 10 E-6 M
21
y = 0,0576x - 0,007
R2 = 0,9919
0 0,1 0,2 0,3 0,4 0,5
2,5 3,5 4,5 5,5 6,5 7,5
Konsentrasi
A
b
so
rb
a
n
si
Gambar 5.1.2. Hubungan linear antara absorbansi dan konsentrasi MB pada panjang gelombang
664 nm.
Dari grafik di atas diperoleh persamaan y = 0.0576x - 0.007, dimana x adalah konsentrasi, C, dan y adalah absorbansi, A. Persamaan tersebut dapat ditulis kembali dalam bentuk:
A + 0.007 C =
0.0576
Persamaan ini selanjutnya digunakan untuk menghitung nilai konsentrasi larutan setelah diberi perlakuan.
5.2 Perbandingan degradasi fotokatalisis variasi konsentrasi
Variasi Menit
ke- A C C/Co Ln(C/Co)
0 0,292 5,190 1,000 0,000 30 0,158 2,882 0,555 -0,588 60 0,129 2,383 0,459 -0,778 90 0,097 1,832 0,353 -1,041 120 0,073 1,418 0,273 -1,297 Konsentrasi 5 x 10-6 M
150 0,065 1,281 0,247 -1,399 0 0,345 6,102 1,000 0,000 30 0,236 4,225 0,692 -0,368 60 0,195 3,519 0,577 -0,550 90 0,153 2,796 0,458 -0,780 120 0,123 2,279 0,374 -0,985 Konsentrasi 6 x 10-6 M
150 0,118 2,193 0,519 -0,656 0 0,492 8,634 1,000 0,000 30 0,364 6,429 0,745 -0,295 60 0,287 5,103 0,591 -0,526 90 0,227 4,070 0,471 -0,752 120 0,195 3,519 0,408 -0,897 Konsentrasi 7 x 10-6 M
dimana:
A : Absorbansi
C : Konsentrasi MB pada menit ke-
CO : Konsentrasi awal MB (tidak diberi perlakuan, pada menit ke – 0)
5.3 Perbandingan degradasi fotokatalisis variasi pH
Variasi Menit
ke- A C C/Co Ln(C/Co)
0 0,354 6,257 1,000 0,000 30 0,321 5,689 0,909 -0,095 60 0,298 5,293 0,846 -0,167 90 0,252 4,501 0,719 -0,329 Konsentrasi 5 x 10-6 M, pH 3
120 0,244 4,363 0,697 -0,361
0 0,27 4,811 1,000 0,000
30 0,231 4,139 0,860 -0,150 60 0,178 3,226 0,671 -0,399 90 0,184 3,330 0,692 -0,368 Konsentrasi 5 x 10-6 M, pH 7
120 0,149 2,727 0,567 -0,568 0 0,204 3,674 1,000 0,000 30 0,179 3,244 0,883 -0,125 60 0,167 3,037 0,827 -0,190 90 0,125 2,314 0,630 -0,462 Konsentrasi 5 x 10-6 M, pH 11
120 0,061 1,212 0,330 -1,109
5.4 Perbandingan metoda fotolisis, fotokatalisis, fotoelektrokatalisis dan penambahan H2O2
Perlakuan Menit
ke- A C C/Co Ln(C/Co)
0 0,189 3,416 1,000 0,000 30 0,184 3,330 0,975 -0,026 60 0,183 3,313 0,970 -0,031 90 0,183 3,313 0,970 -0,031 120 0,182 3,295 0,965 -0,036 Gelap
150 0,188 3,399 0,995 -0,005 0 0,189 3,416 1,000 0,000 30 0,156 2,848 0,834 -0,182 60 0,154 2,813 0,824 -0,194 90 0,153 2,796 0,819 -0,200 120 0,138 2,538 0,743 -0,297 Fotolisis
150 0,135 2,486 0,728 -0,318 0 0,189 3,416 1,000 0,000 30 0,143 2,624 0,768 -0,264 60 0,102 1,918 0,561 -0,577 90 0,093 1,763 0,516 -0,662 120 0,07 1,367 0,400 -0,916 Fotokatalisis
23
0 0,189 3,416 1,000 0,000 30 0,117 2,176 0,637 -0,451 60 0,079 1,522 0,445 -0,809 90 0,061 1,212 0,355 -1,036 120 0,031 0,695 0,203 -1,592 Fotoelektrokatalisis
150 0,023 0,557 0,163 -1,813 0 0,189 3,416 1,000 0,000 30 0,152 2,779 0,813 -0,206 60 0,129 2,383 0,698 -0,360 90 0,072 1,401 0,410 -0,891 120 0,046 0,953 0,279 -1,276 Fotolisis+H2O2
150 0,037 0,798 0,234 -1,454 0 0,189 3,416 1,000 0,000 30 0,086 1,642 0,481 -0,732 60 0,072 1,401 0,410 -0,891 90 0,05 1,022 0,299 -1,206 120 0,04 0,850 0,249 -1,391 Fotokatalisis+H2O2
150 0,022 0,540 0,158 -1,844 0 0,189 3,416 1,000 0,000 30 0,115 2,142 0,627 -0,467 60 0,061 1,212 0,355 -1,036 90 0,042 0,885 0,259 -1,351 120 0,026 0,609 0,178 -1,724 Fotoelektrokatalisis+H2O2
150 0,012 0,368 0,108 -2,228
5.5 Konstanta kelajuan degradasi
Variasi k (menit-1)
Fotoelektrokatalisis+H2O2 0,0145
fotokatalisis + H2O2 0,011
fotolisis+H2O2 0,0105
fotoelektrokatalisis 0,0121 fotokatalisis 0,0065 fotolisis 0.0018
5.6 Persentase penurunan konsentrasi methylene blue (dalam persen)
waktu 0 30 60 90 120 150
Fotoelektrokatalisis+H2O2 0 37,30 64,53 74,11 82,17 89,23
fotokatalisis+H2O2 0 51,92 58,98 70,07 75,11 84,19
fotolisis+H2O2 0 28,73 30,25 58,98 72,09 76,63
fotoelektrokatalisis 0 36,30 55,45 64,53 79,65 83,68
fotokatalisis 0 23,19 43,86 48,40 59,99 61,50