ANALISA KERAGAMAN GENETIK DAN STRUKTUR
POPULASI BABI W T A N SULAWESI
(Sus
celebensis)
DI SEMENANJUNG UTARA DAN TENGGARA
PULAU SULAWESI
CHANDRAMAYA SISKA DAMAYANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
P E R N Y A T M MENGENAI TESIS
DAN
SUMBER INFORMAS1
Dengan ini saya menyatakai bahwa tesis Analisa Keragaman Genetik dan
Struktur Populasi Babi Hutan Sulawesi (Sus celebensis) di Semenanjung Utara
dan Tenggara Pulau Sulawesi adalah karya saya sendii dan belum diajukan dalam
bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang
berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2007
ABSTRAK
CHANDRAMAYA SISKA DAMAYANTI. Analisa Keragaman Genetik dan
Struktur Populasi Babi Hutan Sulawesi (Sus celebensis) di Semenanjung Utara
dan Tenggara Pulau ~ulawesi. Dibimbing oleh ITA DJUWITA dan MULADNO.
Penelitian ini bertujuan untuk mendapatkan data tentang keragaman
genetik dan struktur populasi babi hutan sulawesi (Sus celebensis) menggunakan
marker mikrosatelit. Sampel jaringan daging yang digunakan untuk isolasi DNA diperoleh dari 62 individu S. celebensis yang hidup di semenanjung utara dan tenggara pulau Sulawesi. Tigabelas marker mikrosatelit dipilih secara acak dan digunakan sebagai primer dalam proses amplifikasi alel menggunakan teknik Polymerase Chain Reaction. Analisa ukuran alel mikrosatelit dilakukan dengan
teknik elekhaforesis kapiler di dalam alat ABI PRISM 310 Genetic Analyzer
menggunakan program GeneScan 3.2.1 dan Genotyper 3.7. Frekuensi alel,
observed heterozygosity, expected heterozygosity, znd Hardy-wei~berg exact test
diitung menggunakan program GENEPOP 3.4, nilai FST dihitung menggunakan
metode Nei, sedangkan struktur populasi dianalisa menggunakan program
STRUCTURE ver. 2. Kedua kelompok babi hutan Sulawesi di semenanjung utara
dan tenggara memperlihatkan keragaman genetik yang tinggi (HE = 0.787 dan
0.809). Terdapat perbedaan genetik yang sedang antara kelompok babi hutan ulawesi di semenanjung utara dan tenggara (Fs~0.08). Hasil analisa
menggunakan STRUCTURE ver. 2 menunjukkan ada empat subpopulasi babi
ABSTRACT
CHANDRAMAYA SISKA DAMAYANTI. The Analysis of Genetic Variation and Population Structure of Sulawesi Warty Pig (Sus celebensis) in North and Southeast ~eninsul& of Sulawesi Island. Under the direction of ITA DJUWTA and MULADNO
The aim of this study was to determine the genetic variation and population structure of Sulawesi warty pig (Sus celebensis) using microsatellite markers. Tissue samples for DNA isolation were obtained from 62 individuals of S. celebensis living in north and southeast peninsulas of Sulawesi island. Thirteen microsatellite loci were mndornly chosen as markers and used on amplification process of microsatellite alleles using Polymerase Chain Reaction technique. The
size of microsatellite alleles were analyzed in ABI PRISM 310 Genetic Analyzer
instrument using GeneScan 3.2.1 and Genotyper 3.7. Thz aliele frequencies, observed heterozygosity, expected heterozygosity, and Hardy Wejnberg Equilibrium were analyzed using GENEPOP 3.4, FS= value was calculated using
Nei's methods, while population substructuring was analyzed using
O Hak cipta milik Institut Pertanian Bogor, tahun 2007
Hak cipta dilindungi
ANALISA KERAGAMAN GENETIK DAN STRUKTUR
POPULASI BABI HUTAN SULAWESI
(Sus celebensis)
DI SEMENANJUNG UTARA DAN TENGGARA
PULAU SULAWESI
CHANDRAMAYA SISKA DAMAYANTI
Tesis
Sebagai salah satu syarat untuk memperoleh gelat
Magister Sains pada Program Studi Sains Veteriner
SEKOLAH
PASCASARJANA
INSTITUT
PERTANIAN
BOGOR
BOGOR
Judul Tesis : Analisa Keragarnan Genetik dan Struktur Populasi Babi Hutan
Sulawesi (Sus celebensis) di Semenanjung Utara dan Tenggara
Pulau Sulawesi
Nama : Chandramaya Siska Damayanti
NIM : B151034011
Disetujui
Kornisi Pernbirnbing
zyh
-
L
A
.
Dr. drh. Ita Diuwita. MPhil Dr. Ir. Muladno, MSA
Ketua Anggota
Diketahui
Ketua Program Studi Sains
Tanggal Ujian : 17 Januari 2007 Tanggal Lulus :
2
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga karya ilmiah yang be rjudul Analisa Keragaman Genetik dan
Struktur Populasi Babi Hutan Sulawesi (Sus celebensis) di Semenanjung Utara
dan Tenggara Pulau Sulawesi ini berhasil diselesaikan.
Penelitian ini terlaksana atas dukungan dari The Stichting Dierentuin Helpen (Consortium of Dutch Zoo), The University of Edinburgh Development Trust, Royal Zoological Society of Scotland, Royal Zoological Society of Antwerp, Royal Zoological Society of the North of England, Yayasan Morowali, Katopasa, Yayasan Gunung Hijau, FK3GI Gorontalo, TNC Pdu, Steve dan Puji Oliver, serta
AH Mustari sebagaiproject counterpart.
Terima kasih penulis ucapkan kepada Dekan Sekolah Pascasarjana IPB, Ketua Program Studi Sains Veteriner, Dekan Fakultas Kedokteran Hewan IPB,
Dr. drh. Ita Djuwita, MPhil selaku ketua komisi pembimbing dan Dr. 11. Muladno,
MSA sel3ku anggota kornisi pembimbing atas bimbiigannya selama penu!is melaksanakan penelitian dan penulisan tesis ini, Dr. Peter Galbusera dan Dr. James A. Burton yang telah banyak memberi masukan kepada penulis untuk
memecahkan masalah yang berkaitan dengan penelitian dan analisa (we have had
a very great communication in this two years! I really appreciate it!), Dr. Alastair
A. MacDonald (thanks for the attentions and supports), Sarah Gillemot dan
Muhamad Yasin Paada yang membantu penulis dalam teknis laboratorium dan pengurnpulan sarnpel. Dr. drh. I Wayan Teguh Wibawan, MS dan Dr. drh. Retno D Soejoedono, MS yang selalu memberikan semangat untuk menyelesaikan studi
ini. Dr. drh. I Wayan Batan, MS, I Wayan Wisaksanayasa, SKH, dan Muhammad
Angga Wijaya, SKH sebagai teman setia dikala susah dan senang, drh. I Ketut
Mudite Adnyane, MSi, drh. Waliono Esthi Praetymingtyas, MSi, drh. Hamny, MSi, drh. I G M Suartini, MSi, Dr. k. Takciir Saili, MSi, Ir. P e t r ~ s D Satsoeitoeboen, MSi, Dr. drh. I N y o m a Suartha, MS, drh. Christian Bernard Saragih, MSi teniau-teman di PS SVT, teman-tenian di Lab. Embriologi dan
Lab. Imunologi, teman-teniar, GENETIKA 21, penghuni Lab. Terpadu FKH IPB,
teman-teman WISMA RIZA (Mbak Jurn, Bang Rizal, Susan, Intan, Khalid, Bu
Ros, Bu Epi, Nisa, Mbak Arti dan Ben!).
Ungkapan terima kasih juga penulis ucapkan kepada kedua orangtua,
Brigjen TNI (Pum) Drs. Subandriyo dan Ida Rosilawati, SPd, kakak Kapten Adm
Nurul Askar Jmjunan dan Cenderawasih Yulia Shanti, SPt, adii Ipda Douglas Mahendrajaya dan Pilar Wirotama, SSos, keponakan Dmda, Griezka dan Giezha, keluarga besar Cipto Putranto, serta suamiku tersayang Aditya Wardhana, STP, MENGPRAC atas kesabaran, dukungan, doa dan kasih sayangnya selama penulis menjalankan studi di PS SVT IPB ini.
Semoga karya ilmiah
ini
bermanfaat.Bogor, Januari 2007
RIWAYAT HIDW
Penulis dilahirkan di Bandung pada tanggal 23 Maret 1979 dari ayah Brigjen TNI (Purn) Drs. Subandriyo dan ibu Ida Rosilawati, SPd. Penulis merupakan anak kedua dari empat bersaudara.
Penulis menyelesaikan jenjang pendidikan SD, SMP, dan SMA di kota
Bandung, yaitu di SDN Ciujung IV, SMPN 14, dan SMAN 1 Bandung. Pada
DAFTAR IS1
Halaman DAFTAR TABEL
...
viiiDAFTAR GAMBAR
...
ixDAFTAR LAMPIRAN
...
xPENDAHULUAN
...
Latar Belakano
.
.
Tujuan Penelihan
. .
...
...
Manfaat Penelitian
TINJAUAN PUSTAKA
Sistematika Babi Hutan Asia Tenggara
...
Morfolcgi, Habitat, Biologi Reproduksi, d m Karakteristik Genetik...
Babi Hutan Sulawesi (S. celebensis)
...
Peranan Studi Genetika dalam Kegiatan Konsemasi
Peranan Marker DNA dalam Konsemasi Genetik
...
BAHAN DAN METODE
. .
Waktu dan Tempat Penelltian
. .
...
...
Bahan dan Alat Penelitian
. .
Metode Penelltian
...
HASIL PENELITIAN
...
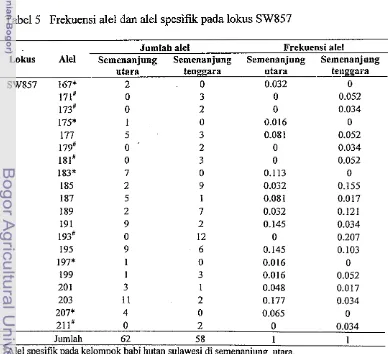
Hasil Isolasi DNA 37
...
Keragaman Genetik 37
...
Shuktur Populsi 50
SIMPULAN DAN SAR4N
...
58DAFTAR. PUSTAKA
...
59DAFTAR TABEL
Halaman Tigabelas marker mikrosatelit beserta keterangan tentang nomor
akses GenBank, tipe unit berulang. sekuens. lokasi. dan suhu
annealing optimum
...
32Ukuran. jumlah alel per l o b . dan jumlah individu yang berhasil
...
diketahui genotipenya di kedua kelompok babi . hutan sulawesi 38
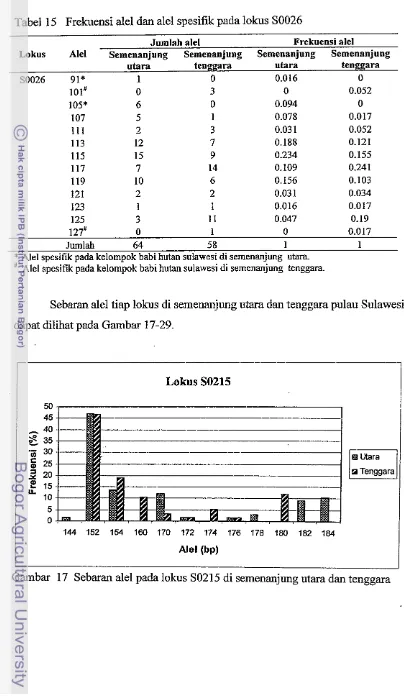
Frekuensi ale1 dan ale1 spesifik pada lokus SO215
...
38...
Frekuensi ale1 dan ale1 spesifik pada lokus SW72 39
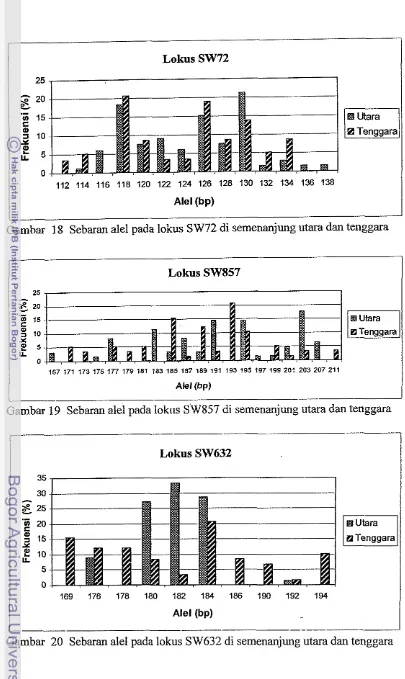
Frekuensi ale1 dan ale1 spesifik pada lokus SW857
...
39Frekuensi ale1 dan ale1 spesifik psda lokus SW632
...
40Frekuensi ale1 dan ale1 spesifik pada l o b SW936
...
40...
Frekuensi ale1 dan ale1 spesifik pada lokus SW240 41
Frekuensi ale1 dan ale1 spesifik pada lokus SO149
...
41...
Frekuensi ale1 dan ale1 spesilik pada lokus SO386 42
...
Frekuensi ale1 dan ale1 spesifik pada lokus SW951 42
...
Frekuensi ale1 dan ale1 spesifk pada lokus SW911 42
Frekuensi ale1 dan ale1 spesifik pada lokus SO224
...
43Frekuensi ale1 dan ale1 spesifik pada lokus SO228
...
43Frekuensi ale1 d a ~ ale1 spesifik pada lokus SO026
...
44Jumlah genotype homozigot dan heterozigot dari 13 lokus di
...
semenanjung utara dan tenggara 49
Nilai observed dan expected heterozygosity di dua kelompok babi
hutan sulawesi
...
49Hardy-Weinberg exact test
...
50...
Nilai I-IS dan HT di ketigabelas lokus mikrosatelit 51
Penentuan jumlah subpopulasi (K) babi hutan sulawesi di pulau
...
Sulawesi berdasarkan nilai Pr (K
I
x
)
5121 Penentuan jumlah subpopulasi (K) babi hutan sulawesi di
...
semenanjung utara dan tenggara berdasarkan nilai Pr (K
I
X)
5222 Perbandingan kisaran ukuran alel pada S . celebensis dan spesies babi
lainnya
...
55...
Halaman Babi hutan sulawesi hasil buruan penduduk untuk diionsumsi
dagingnya
...
3Anak babi hutan sulawesi
...
7Babi hutan sulawesi jantan dewasa
...
7Wilayah penyebaran babi hutan sulawesi di kepulauan Sulawesi
...
8Struktur kimia basa nitrogen
...
16Struktur kirnia gula ribosa dan deoksiribosa dengan penomoran pada atom karbon (C)
...
17Nukleotida tunggal (mononuk!eotida)
...
18Pasangan basa A-T dan G-C
...
18Struktur molekul DNA untai ganda
...
19Lokasi rnikrosatelit di dalam kromosom
...
21Proses slippage pada mikrosatelit
...
23Lokasi pengambilan sarnpel babi hutan sulawesi di semenanjung utara dan tenggara pulau Sulawesi
...
26Skema proses amplifiasi dengan t e r n PCK menggunakan
...
metode M13
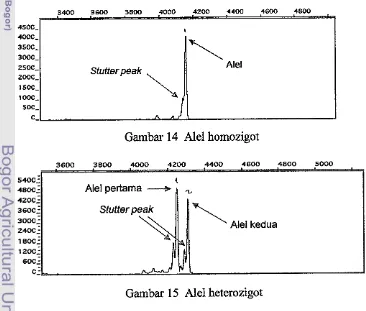
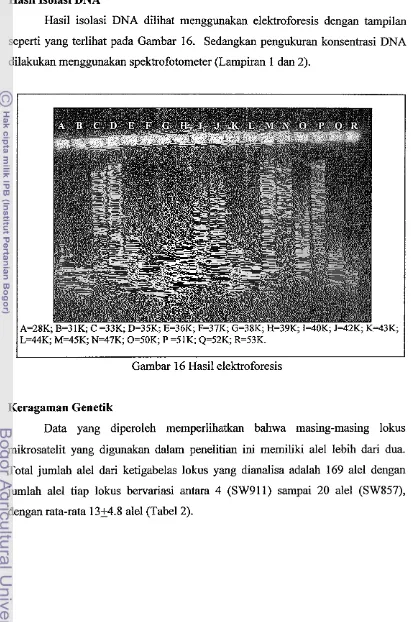
Ale1 hoinozigot
...
Ale1 heterozigoi
...
Hasil elektrohresis
...
Sebaran ale1 pada lokus SO215 di semenanjung utara dan tenggara
....
Sebaran ale1 pada lokus SW72 di semenanjung utara dan tenggara
....
Sebaran ale1 pada lokus SW857 di semenanjung utara d m tenggara
..
Sebaran alel pada lokus SW632 di semenanjung utara dan tenggara
..
Sebaran ale1 pada lokus SW936 di semenanjung utara dan tenggara
..
Sebaran alel pada lokus SW240 di semenanjung utara dan tenggara
..
....
Sebaran alel pada lokus SO149 di semenanjung utara dan tenggara
....
Sebaran alel pada lokus SO386 di semenanjur.g utara d m tenggara
Sebaran alel pada lokus SW951 di semenanjung utara dan tenggara
..
27 Sebaran alcl pada lokus SO214 di semenanjung utara dan tenggara
....
4828 Sebaran ale1 pada lokus SO228 di semenanjung utara dan tenggara
....
4829 Sebaran ale1 pada lokus SO026
di
semenanjung utara dan tenggara....
4830
Bagan struktur populasi babi hutan sulawesidi
pulau Sulawesi...
523 1 Bagan struktur populasi babi hutan sulawesi di semenanjung utara
....
53DAFTAR LAMPIRAN
Halaman
1 Konsentrasi dan status kemumian sampel DNA babi hutan sulawesi
di senenanjug utara
...
652 Konsentrasi dan status kemumian sample DNA babi hutan sulawesi
di semenanjung tenggara
...
66Latar belakang
Alam di seluruh permukaan bumi tersusun atas berbagai spesies makhluk
hidup liar yang tanpa disadari telah memberikan berbagai kemudahan dan
pelayanan pada manusia untuk memenuhi kebutuhan hidupnya, yang bisa jadi
sangat mahal atau bahkan tidak mungkin diciptakan sendiri oleh manusia.
Berkurangnya jumlah spesies liar di dam dalarn jangka panjang dapat
memberikan dampak yang sangat buruk bagi kelangsungan hidup manusia itu
sendiri.
Indonesia merupakan salah satu negara pang memiliki keragaman hayati
yang sangat tinggi. Menempati hanya 1.3 persen wilayah permukaan bumi,
Indonesia memiliki 12 persen spesies mamalia, 16 persen spesies reptil dan
amphibi, 17 persen spesies burung, dan 25 persen spesies ikan dari seluruh spesies
hewan yang ada di bumi ini. Hal ini berarti Indonesia memiliki sekitar 600
spesies mamalia (280 diantaranya merupakan spesies endemik), 41 1 spesies reptil
(150 diantaranya mempakan spesies endemik), 270 spesies amphibi (100
diantaranya add& spesies endernik), 1.531 spesies burung (26 persen
diantaranya adalah spesies endemik), dan 2.906 spesies vertebrata bnkan ikan
(927 dian'manya adalah spesies endemik). Indonesia memiliki 30.000 sarnpai
35.000 spesies tumbuh-tumbuhan, menempati urutan 5 tertinggi di dunia.
Indonesia juga kayz akan keragaman spesies terumbu karzng, terdapat sekitar 450
spesies terumbu karang (BAF'PENAS 1993).
Kondisi hutan di Indonesia sudah sangat memprihatinkan. Saat ini, hutan
yang tersisa di wilayah Indonesia makin lama makin berkurang. Laju degradasi
hutan di Indonesia sudah mencapai 2.8 juta hektar are per tahun (Media Indonesia
2005). Aktifitas miillusia yang berlebihan tanpa memperhatikan kelestarian
lingkungan demi untuk mendapatkan keuntungan finansial telah mengakibatkan
terjadiiya degradasi dan deforestasi hutan yang berujung pada terjadiiya
fragmentasi habitat. Kebakaan nutan sepanjang tahun 2006 semakin
memperburuk keadaan ini dan akan berdampak luas pada seluruh ekosistem yang
ini akan m e n d a n h - a n populasi (population size) spesies-spesies yang zda
di dalarnnya P e n m a n
ukuran
populasi ini akan menyebabkan suatu spesiesmenjadi rawan terhadap stochastic processes (demographic, environmental and
genetic stochasficity) yang dapat meningkatkan resiko kepunahan spesies tersebut.
Spesies dengan
ukuran
populasi yang kecil akan lebii beresiko terhadap kejadiangenetic drift (Amos dan Harwood 1998), inbreeding (kawin antar saudara) dan
akhimya menyebabkan p e n m a n keragaman genetik (Reed et al. 2002). Generic
drzp menyebabkan hilangnya ale1 pada suatu populasi (Halliburton 2004),
sedangkan kejadian inbreeding akan menyebabkan p e n w a n kualitas reproduksi
(Reed et al. 2002) dan menyebabkan individu menjadi lebii sensitif terhadap
patogen (O'Brien 1994). Kedua faktor ini akan menyebabkan p e n m a n
keragaman genetik di dalam suatu populasi sedangkan keragaman genetik
m e ~ p a k a n salah satu bagian dari keragaman hayati yang sangat berperan dalam
proses seleksi alam. Keragaman genetik yang tinggi dalam suatu populasi akan
membantu spesies tersebut untuk beradaptasi terhadap pembahan-pembahan
kondisi yang te jadi pada lingkungan di sekitarnya (Rhymer 1999).
Babi hutan sulawesi atau Sulawesi Warty Pig (Sus celebensis) mempakan
sal& satu spesies mamalia endemis di Sulawesi, salah satu pulau di wilayah
Indonesia tirCur yang dikenal sebagai Wallacea bioregion (CI 2001). Babi hutan
sulawesi termasuk ke ddam Filuni Chordata, Kelas Mammalian, Ordo
Artiodactyla, Famiii Suidae, Subfamili Suinae dan Genus Sus. Walaupun sampai
saat ini jumlah dan ukuran populasi babi hutan sulawesi masih cukup aman
(IUCN 2005), narnun keragaman genetik populasi spesies ini masih belum
diketahui. Selain terancam karena semakin tingginya tingkat kemsakan hutan,
babi hutan sulawesi juga sangat rawan terhadap perburuan, baik untuk keperluan
konsumsi penduduk setempat (Alvard 2000), maupun diburu karena dianggap sebagai hama pemsak lahan pertanian (Bailey 2000). Di bebempa wilayah di
Sulawesi, seperti Sulawesi Utara, banyak ditemukan daging babi hutan sulawesi,
dan juga babiisa yang dijual di pasar-pasar tradisional (Lee 2000; Meijaard
2002). Babi hutan sulawesi juga 'oanyak ditemukan dijual di sepaljang jalan di
Babi hutan sulawesi merupakan salah satu spesies babi, selain S. scrofa,
yang telah didomestikasi dan didistribusikan ke luar wilayah aslinya (MacDonald
1993). Babi hutan sulawesi di wilayah lain kemudian berhibridisasi dengan babi
lain keturunan S. scrofa yang menghasilkan babi-babi yang sampai saat ini
terdapat di pulau-pulau seperti Salawati, Kei Besar, Dobu, Seram, Ambon, Bacan,
Ternate, Morotai, New Guinea (Oliver et al. 1993), dan Halmahera (Larson et al.
2005).
Gambar 1 Babi hutan sulawesi hasil buruan penduduk untuk dikonsumsi dagingnya
Adanya degradasi dan deforestasi hutan, fiagmentasi habitat dan perburuan
yang terus-menerus terjadi serta adanya percampuran genetik dengan babi
domestik S. scrofa mengakibatkan munculnya ancaman potensial yang sangat
serius bagi spesies babi hutan sulawesi di masa mendatang (MacDonald 1993).
Selain itu masih terus berlangsungnya diskusi mengenai sistematika
pengelompokkan babi, baik berdasarkan morfologi maupun genetik,
memperlihatkan betapa perlunya dilakukan analisa genetik terhadap spesies ini
untuk menjawab hal-ha1 yang berkaitan dengan keragaman genetik dan struktur
populasi. Beberapa metode telah digunakan untuk mengetahui keragaman genetik
dan struktur populasi suatu spesies, salah satunya adalah dengan menggunakan
marker DNA mikrosatelit.
Mikrosatelit telah digunakan untuk mengetahui keragaman genetik populasi
beruang hitam (Paetkau dan Strobeck 1994), Turdzrs helleri (Galbusera et al.
2000), kucing liar (Felis silvestris) di Skotlandia (Beaumont et al., 2001), ras babi
babi Taihu, Jiangqhuai, clan Dongchuan (Tan et al., 2002), bada! hdia
(Rhinoceros unicornis) (Zschoke et al. 2003), dan keragaman genetik pada
spesies-spesies lainnya Miosatelit juga telah digunakan untuk mengetahui
struktur populasi ikan Triperygion delaisi (Carreras-Carbonell et al. 2006), rusa
Capreolus capreolus (Coulon et al. 2006), walabi (Petrogale penicillata) (Hazlitt
et al. 2006), burung robin (Pogonocichla stellata) (Galbusera et al. 2004), dan
struktur populasi pada spesies laimya.
Tujuan penelitian
Penelitian ini bertujuan untuk memperoleh data tentang keragarnan genetik
dan struktur populasi babi hutan sulawesi (S. celebensis) di dua semenanjung
pulau Sulawesi, yaitu semenanjung utara dan tenggara.
Manfaat penelitian
Penelitian ini bermanfaat sebagai informasi dalam usaha pemeliharaan dan
konservasi babi hutan sulawesi (S. celebensis) secara in situ dan ex-situ. Dan
penelitian ini juga bermanfaat sebagai pelengkap data genetik spesies babi hutan
Sistematika Babi Hutan Asia Tenggara
Asia Tenggara memilii keanekaragaman babi hutan yang tertinggi di
dunia (Lucchini et al. 2005). Banyak studi telah dilakukan untuk menentukan
sistematika babi hutan asia tenggara ini walaupun jumlah spesiesnya masih belum
diketahui dengan jelas. Babi hutan sulawesi termasuk di dalam salah satu
kelompok babi hutan asia tenggara yang jumlahnya masih sangat banyak
ditemukan di Sulawesi dan pulau-pulau kecil sekitamya maupun di wilayah lain
di luar pulau Sulawesi (MacDonald 1993; Groves dan Grubb 1993; Oliver et al.
1993).
Groves (2001) membagi babi hutan asia tenggara ke dalam tiga kelompok,
yaitu kelompok S. scrofa, S. verrucosus, dan S. philippensis. Kelompok S. scrofa
umumnya memiliki indeks gigi taring kurang dari 100. Seluruh babi dalam
kelompok S. scrofa ini diasuklcan ke dalam satu spesies yang disebut Eurasian
Wild Pig (S. scrofa) kecuali Pigmy Hog (S. salvanius). Eurasian wild pig
ditemukan hampir di seluruh Eropa, Afrika Utara, dan Asia, termasuk di
Semenanjung Malaya, Sumatera, Jawa., Bali, I,ornbok, dan Sumbawa. Babi dari
semenanjung dan pulau, disebut Banded Pig, b e d u r a n kecil, berambut jarang,
dengan perbedaan tengkorak yang sangat nyata, &an biasanya diklasifikasikan
sebagai S. scrofa vittatus.
Kelompok S. verrucosus memiliki indeks gigi taring sekitm 106
-
160, lurusdan permukaan bawahnya luas. Babi dewasa dari kelompok ini memiliki kutil
(warts) pada wajahnya. Kelompok S. verrucossus terdiri dari Warty Pig (S.
verrucossus) yang ditemukan di Jawa, Madura, dan Bawean, Indochinese Pig (S.
bucculentus) yang hanya ditemukan di Laos, Palawan Pig (S. ahoenobarbus) yang
ditemukan di Palawan dan Calamianes, Sulawesi Warty Pig (S. celebensis) dari
Sulawesi dan pulau-pulau kecil di sektamya, Visayan Pig (S. ceb@ons) dari
Negros, Panay, Masbate, dan Cebu, Bearded Pig (S. barbatus) dari Borneo,
Sumatera, Bmgka, Kepulauan Riau dan Semenanjung Malaya. S. barbatus
memiliki dua subspecies, yaitu S. b. barbatus dari Borneo dan S b. oi dari
Kelompok S. philippensis memiliki indeks gigi taring yang tinggi, yaitu
sekitar 145-180, dan memiliki dua pasang kutil. Babi-babi kelompok ini terlihat
memiliki hubungan dengan kelompok S. scrofa. Kelompok S. philippensis terdiri
dari dua spesies, yaitu Philippines Pig (S. philippensis) yang berasal dari Luzon,
Mindanao, Balabac, Samar, Bohol, Catanduanes, dan Leyte, serta Mindoro Pig (S.
oliveri) yang berasal dari Mmdoro. Perbedm kedua spesies ini didasarkan pada
struktur tulang belulangnya.
Oliver (2001) mengungkapkan bahwa telah ditemukan populasi babi hutan
baru, termasuk spesies baru dari Pulau Tawi-Tawi dan pulau-pulau kecil di
sekitarnya. Lucchini et al. (2005) me~emukan adanya hubu~lgan intraspesifk di
antara babi-babi hutan asia tenggara berdasarkan teknik moleMer dan
morfometrik yang akhirnya dikelompokkan ke dalam 3 kelompok. Kelompok
pertama adalah babi-babi dari Filipina (S. cebzj?ons) dan Sulawesi (S. celebensis)
yang mempertahankan karakter-karakterplesiomorphic dan merupakan kelompok
babi-babi primitif yang memiliki relic distribution. Kelompok kedua adalah
subspesies S. barbatus dari wilayah bant (western), walaupun ditemukan sediit
perbedm morfologi, tetapi terbagi ke dalarn kelompok Sumatera dan
Malaysian/Bomeo berdasarkan sekuens DNAnya. Kelompok ketiga aaalah
kelompok yang terdiri
dui
S. scrofa, S. verrzrcossus, dan S. cJ. barbatuschoenobarbus, diiana dua spesies pertama terlihat m e m i l i kesamaan
morfometrik.
Morfologi, Habitat, Biologi Reproduksi, dan Karakteristik Genetik Babi
Hutan Sulawesi (S. celebensis)
Morfologi. Di dalam Huffman (1999) dijelaskan bahwa babi hutan
sulawesi merniliki panjang badan 80-130 cm, tinggi bahu 70 cm, dan berat 40-70
kg. Warna rambut umumnya hitam, sering disisipi dengan warna kuning atau
putih, atau coklat kemerahan, kaki-kaki relatif pendek, ekor panjang dan
berambut. Bagian ventral terlihat lebih terang hingga putih/kuning krem sesuai
usia dan terlihat garis lebih gelap di bagiaq dorsal. Ada jambul pada bagian dahi
dan garis kuning mencolok mengelilmgi moncong. Anak babi dilahirkan dengan
bulan. Jantan dewasa memiliki tiga bagian kutil di wajah dan yang terbesar
[image:20.532.122.416.110.330.2]terletak di preorbital. Kutil ini terbentuk sempuma setelah umur 8 tahun.
Gambar 2 Anak babi hutan sulawesi, terlihat garis-garis kekuningan di sepanjang
tubuhnya
Habitat. Babi hutan sulawesi hidup di berbagai kondisi lingkungan yang
beragam di kepulauan Indonesia, yaitu di hutan hujan, rawa, padang rumput, dan
area pertanian. Babi hutan ini juga dapat ditemukan di hutan lumut dengan
ketinggian sampai 2.300 m di atas permukaan laut (Huffman 1999). Babi hutan
sulawesi berasal dari pulau Sulawesi termasuk pulau-pulau kecil di sekitarnya
yaitu Selayar, Buton, Muna, Peleng, Lembeh dan kepulauan Togian (MacDonald
1993), tetapi banyak penduduk yang membawa babi hutan ini keluar dari
kepulauan Sulawesi menuju Pulau Buru, Hdmahera, Seram, Flores, Timor, Pulau
Roti, Simeleu dan Nias (Groves dan Grubb 1993). Diduga babi hutan sulawesi
dahulu dibawa ke Mduku dan sepanjang Lesser Sunda Chain sebagai hewan
peliharaan yang kemudian dilepaskan untuk ditangkap jika diperlukan.
Gambar 4 Wilayah penyebaran babi hutan sulawesi di kepulauan Sulawesi
(ditunjukkan oleh warna hijau) (MacDonald 1993 diacu dalam
Huffman 1999)
Babi hutan sulawesi biasanya hidup berkelompok (McDonald 1993). Unit
terkecil kelompok tersebut merupakan kelompok keluarga, 2-3 kelompok
benunur 18 bulan. Babi hutan sulawesi diduga meiniliki sistexn reproduksi yang
mirip dengan anggota genus Sus lainnya (Nowak 1999 diacu dalam Noel 2004).
Karakteristik genetik. Karakteristik genetik babi hutan sulawesi belum
banyak diketahui. Bosrna ef al. (1991) melakukan studi tentang perbandingan
sitogenetik dari beberapa genus Sus, yaitu S. verrucosus, S. celebensis dan S.
scrofa vittatus. Dari studi ini diketahui bahwa S. verrucosus, S.. celebensis dan S.
scrofa vittatus memiliki 38 kromosom diploid. Morfologi dan ukuran pita C (C-
bands) pada kromosom 10 dari ketiga spesies tersebut saling berbeda. Pita C
merupakan metode pewarnaan kromosom untuk memvisualisasikan sentromer
(Lewin 2004). S. verrusosus dan S. celebensis memiliki kromosom Y yang lebih
besar dari kromosom Y S. scrofa. S. verrucosus, S. celebensis, dan S. scrofa
memilii pola pita G (G-bands) yang berbeda-beda pada bagian tangan kromosom
Y-nya. Pita G merupakan metode pewarnaan Giemsa untuk mengetahui
karakteristik kromosom, yang ditunjukkan dengan adanya pita-pita G pada
kromosom. Area pita G merupakan area kromosom yang mengandung sedikit
kandungan basa nitrogen G-C dibandingkan dengan area interbands. Perbedaan
kariotipe (kromosom 10 dan kromosom Y) pada ketiga spesies ini menunjukkan
bahwa mereka adalah spesies yang berbeda.
Beranan Studi Genetika dalam Kegiatan Konsewasi
Keanekaragaman hayati (biodiversity) dibagi menjadi tiga kategori dasar,
yaitu keragaman genetik, keragaman spesies, dan keragaman ekosistem
(Frankham et al. 2002). Keragaman genetik merupakan variasi genetik di dalam
setiap spesies yang mencakup aspek biokirnia, struktur, dan sifat organisme yang
ditumnkan secara fisik dari induknya dan dibentuk dari DNA. Keragaman spesies
merupakan variasi seluruh tumbuhan, hewan, fungi, dan mikroorganisme yang
masing-masing bertumbuh dan berkembangbiak sesuai dengan karakteristiknya.
Keragaman ekosistem merupakan variasi ekosistem, dimana ekosistem adalah
unit ekologis yang mempunyai komponen biotik dan abiotik yang saling
berinteraksi, dan antar komponen-komponen tersebut terjadi penyambilan dan
perpindahan energi. Kegiatan konservasi diperlukan untuk mempertahankan
ulah manusia tidak hanya ~llengurangi populasi spesies hewan dan tumbuhan,
tetapi juga menyebabkan spesies-spesies tersebut terancam punah (Dhondt 1996).
Ilmu konservasi biologi mempelajari individu dan populasi yang sudah
terpengaruh oleh kemsakan habitat, eksploitasi, dan pembahan lingkungan.
Informasi ini digunakan untuk membuat suatu keputusan yang dapat
mempertahankan keberadaan suatu spesies di alam. Sudah lebih dari satu dekade
ini, studi genetik digunakan untuk mendapatkan informasi yang lebih mendalam
dalam pengambilan keputusan tersebut karena, dengan studi genetik, informasi
tentang keragaman antar individu di dalam dan antar populasi, temtama pada
spesies-spesies yang terancam punah, dapat diketahui (Hedrick 2001; Sunnuck
2000). Perkembangan teknik molekuler dewasa ini, seperti penemuan teknik
Po&rnerase Chain Reaction (PCR) yang mampu mengamplifikasi untai DNA
hingga mencapai konsentrasi tertentq penggunaan untai DNA lestari (conserved)
sebagai marker dalam proses PCR, penemuan lokus mikrosatelit yang
hipervariabel, dan penemuan metode sekuensing DNA, telah menyebabkan ilmu
genetik molekuler mempunyai pengaruh yang sangat besar dalam studi biologi
suatu populasi (Sunnuck 2000). Terobosan-terobosan ini, bersanlaan dengan
berkembangnya teknik pemode:an matematika melalui program-program
komputer, telah mempermudah para peneliti untrlk mendapatkan data genetik
suatu populasi yang sangar berguna d a l m merancang program konsemasi suatu
spesies tertentu.
Penerapan studi genetik dalam permasalahan konsen~asi didasari oleh teori
genetika populasi. Genetika populasi mempakan salah satu cabang ilmu biologi
populasi yang mempelajari tentang faktor-faktor yang menentukan komposisi
genetik suatu populasi dan bagaimana faktor-faktor tersebut berperan dalam
proses evolusi (Halliburton 2004). Genetika populasi juga meliputi studi terhadap
berbagai faktor yang membentuk struktur genetik suatu populasi dan
menyebabkan pembahan-perubahan evolusioner suatu spesies sepanjang waktu
(Balloux dan Lougon-Mouli 2002).
Terdapat beberapa faktor yang sangat berperan dalam kejadian evolusi
pada suatu populasi, yaitu mutasi, rekombinasi, seleksi dam, genetic drift, gene
Faktor-faktor tersebut akan memunculkan keragaman genetik pada suatu populasi,
dan keragamm genetik merupakan informasi yang paling berguna untuk
memaharni informasi tentang kekuatan-kekuatan yang menyebabkan evolusi
(Cavalli-Sforza 1998). Memahami dan mempertahankan keragaman genetik
suatu populasi sangat penting dalam konsewasi karena keragaman genetik yang
tinggi akan sangat membantu suatu populasi beradaptasi terhadap perubahan-
pembahan yang terjadi di liigkungan sekitarnya (Rhymer 1999).
Mutasi didefinisikan sebagai segala pembahan di dalam material genetik
yang akan ditunmkan ke generasi selanjutnya Mutasi dapat disebabkan oleh
beberapa faktor, di antarmya adalah kesalahan saat proses replikasi DNA,
unequal crossing over, chromosome breakage, atau meiotic disjunction. Mutasi
merupakan sumber utama dari semua keragaman genetik. Tanpa mutasi, tidak
akan ada keragaman genetik dan berarti tidak akan ada evolusi.
Rekombinasi mempakan penyebab kedua munculnya keragaman genetik.
Rekombiiasi menyebabkan kombiiasi baru suatu pasangan alel, tetapi tidak
memunculkan alel baru. Hal ini menjadi penting karena fenotip, yang merupakan
hasil dari interaksi berbagai gen, sangat berperan dalam proses seleksi dam.
Kombinasi b m suatu pasangan alel dapat memicu munculnya fenotip baru pada
suatu individu.
Seleksi darn merupakan i&e yang dilontarkan oleh Charles Darwin yang
menyatakan bahwa suatu individu yang memiliki keragaman yang
mengmtungkw. akan berthan hidup dan bereproduksi lebih baik dibandingkan
dengan individu lain di dalam populasi. Mereka akan memilki keturunan yang
lebih banyak, dan menunmkan keragaman yang d i l i k i n y a pada keturunannya
tersebut. Oleh karena it^^, keragaman ini akan semakin banyak pada generasi
berikutnya.
Genetic drift menyebabkan perubahan frekuensi alel sepanjang waktu
sebagai akibat dari pemilihan gamet dan gen-gennya secara acak pada saat proses
pembentukkan suatu generasi baru berlangsung. Karena sifatnya yang sangat
acak, generic drzj? dapat menyebabkan e l i i a s i keragaman yang
menguntungkan. Dalam jangka panjang, genetic drift memiliki efek yang
genetik di M a m populasi dan akan memunculksn perbed= genetik antar
populasi (Hart1 and Clark 1997).
Geneflow akan te jadi pada saat suatu individu berpindah dari satu area ke
area lain, bahkan antar populasi. Jika individu-individu tersebut dapat bertahan
hidup dan bereproduksi di tempat b m y a , maka mereka akan memasukkan gen-
gen mereka ke dalam lingkungan atau populasi harunya dan pada saat inilah gene
flow tejadi. Gene flow menyebabkan populasi-populasi memiliki genetik yang
semakin mirip satu sama lain dan dalam jangka panjang gene flow akan
menimbulkan efek yang bertolak belakang dengan genetic drifi.
Faktor lain yang mempengmhi keragaman genetik adalah kejadian
perkawinan yang tidak acak. Peristiwa ini tejadi jika individu-individu yang
melakukan perkawinan merupakan individu-individu yang secara genetik saling
berhubungan satu sama lain.
Dalam Halliburton (2004) disebutkan bahwa perhitungan dasar pada
genetika populasi meliputi frekuensi alel dan genotip. Dua komponen ini dapat
dihitung dari sarnpel individu-individu dalam suatu populasi, dan kedua
komponen ini akan memberikan informasi tentang seberapa banyak keragaman
gene& yang ada di dalam suatu populasi dan seberapa besar persamaan atau
perbedaan aiitar dua populasi. Kemgaman genetik dapzt terlihat dari nilai
heterozygosify. Heterozygosity didefinisikan sebagai proporsi individu dalam
suatu populasi yang membawa dua alel berbeda dalam satu lokus (Ellegren 2004).
Rataan observed heterozygosity didefinisikan sebagai proporsi ale1 beterozigot
pada seluruh lokus, sedangkan expected heterozygosify diinterpretasikan sebagai
probabilitas bergabungnya alel-ale1 yang berbeda sebagai akibat dari pemilihan
kopi-kopi gen secara acak (Halliburton 2004). Sedangkan untuk melihat seberapa
besar persamaan atau perbedaan antar populasi dapat diliiat dari nilai F-statistik.
Sedangkan prinsip dasar dalam genetik populasi adalah prinsip Hardy-
Weinberg. Prinsip Hardy-Weinberg menduga bahwa, dalam kondisi tertentu,
,
frekuensi alel dan genotipe akan tetap konstan dalam suatu populasi, dan
keduanya saling berhubungan satu sama lain. Kondisi-kondisi tertentu yang
dimaksud dalam prinsip Hardy-Weinberg meliputi reproduksi antar individu yang
diabaikan, tidak ada individu yang mas& atau keluar dari suatu populasi, dan
ukuran populasi yang cukup besar. Jika kondisi-kondisi ini terpenuhi oleh suatu populasi, maka populasi tersebut disebut sebagai populasi yang berada dalam
keseimbangan Hardy-Weinberg (Hardy-Weinberg Equilibrium).
Keseimbangan Hardy-Weinberg sangat penting di dalam konservasi dan
kejadian evolusi genetik, karena penyimpangan dari keseimbangan Hardy-
Weinberg ini mempakan dasar untuk mendeteksi kejadian inbreeding,
fiagmentasi populasi, rnigrasi, dan seleksi (Hart1 dan Clark 1997).
Peranan Marker DNA dalan Konservasi Genetik
Menganalisa keragaman genetik pada level DNA akan memberikan
keuntungan yang berlipat ganda d i b a n d i i a n dengan analisa yang dilakukan
pada level protein karena informasi yang terdapat pada sekuens DNA jauh lebih
banyak daripada informasi yang ada pada sekuens protein (Cavalli-Sforza 1998;
Hanotte dan Jianlin 2005). Beberapa marker DNA telah digunakan dalam analisa
genetik suatu populasi, yaitu DNA mitokondria, lokus Major Histocompatibili~
Complex (MHC), Single Nucleotide Polymorphism (SNP) d m mikrosatelit pada
kromosom Y ymg diperoleh secara paternal, d m !okus mikrosateiit autosomai
yang diperoleh secara bipaiental (Murray 1996; Hanotte dan Jianlin 2005).
Beberapa hal yang periu diperhatikan dalam memilih marker DNA dalam analisa
keragaman genetik suatu populasi di antaranya adalah bahwa polimorfisme yang
terdapai pada marker DNA bersifat netrai, dan keragaman geoomik suatu populasi
dapat diwakili hanya dengan penggunaan sejumlah lokus yang independen
(Hanotte dan Jianlin 2005).
Pemilihan marker DNA disesuaikan dengan tujuan analisa yang akan
dicapai. Untuk analisa keragaman genetik dan struktur populasi, marker DNA
yang umum digunakan lebih dari satu dekade terakhir ini adalah mikrosatelit,
karena sifatnya yang polimorfik dan kodominan (Jarne dan Lagoda 1996).
Milcrosatelit dapat digunakan untuk sejumlah analisa molekuler seperti pemetaan
genetik, linkage anclysis dalam kaiWya dengan gen penyebab penyakit tertentu,
dan sejumlah analisa genetik populasi. Dalam analisa genetik populasi,
hibridisasi antar spesies. Perbandmgan derajat keragaman mikrosatelit antar
spesies dan populasi juga berguna dalam penilaian keragaman genetik secara
keseluruhan. Miosatelit juga dapat digunakan untuk menduga ukuran populasi
(Spong dan Hellborg 2002), derajat substruktur populasi termasuk jumlah migrasi
antar subpopulasi, serta hubungan genetik di antara subpopulasi yang berbeda
(Murray 1996). Selain itu mikrosatelit juga telah digunakan dalam analisa silsilah
.
dan kekerabatan, serta sejarah populasi (Zhang dan Hewitt 2003). Data-data yang diperoleh dari analisa genetik populasi inilah yang kemudian digunakansebagai landasan untuk merancang program konservasi terhadap suatu spesies
tertentu, terutama bagi spesies-spesies yang terancam punah.
Asam deoksiribonukleat (DNA).
Ivfakhluk
hidup menggunakanDeoxyribonucleic Acid (DNA) atau asam deoksiribonukleat untuk menyimpan
informasi genetik dan m e n d a n n y a pada generasi selanjutnya. Oleh karena itu
DNA disebut juga sebagai material genetik suatu individu. DNA dapat ditemukan
di dalam inti sel, mitokondria, clan Moroplas. DNA inti adalah DNA linear yang
ditemukan di dalam inti sel yang membawa kode untuk fenotip, yaitu sifat
tarnpilan fisik suatu individu. DNA inti dikemas terpisah-pisah dalam kromosom-
kromosom yang kemudian d i t d a n ke generasi selanjutnya. Seiuruh DNA
yang ada di dalam satu set kromosom suatu organisme kemudian disebut dengan
genom.
DNA mitokondria (mtDNA) adalah DNA sirkuler yang ada di dalam
mitokondria, yaitu organel sel yang berperan dalam metabolisme sel. Uliwan
DNA mitokondria sangat pendek, biasanya kurang dari 17.000 pasang b a a , dan
tersusun atas gen yang mengontrol metabolisme selular. Jika setengah dari DNA
inti diperoleh dari garis maternal clan setengah lagi diperoleh dari garis paternal,
maka tidak demikian dengan mtDNA. Seluruh mtDNA diperoleh dari garis
maternal.
DNA Moroplas (cpDNA) adalah salah satu DNA yang d i i l i k i oleh
tumbuhan selain DNA inti dan mtDNA. DNA kloroplas terdapat di dalam
kloroplas, yaitu organel yang hanya ada pada tumbuhan dan berperan untuk
fotosintesis. DNA Moroplas berbentuk sirkuler berukuran antara 120.000-
proses fotosintesis. DNA kloroplas diperoleh secara maternal atau paternal, dan
cpDNA bersama dengan mtDNA, diturunkan ke generasi selanjut~ya di dalam
sitoplasma benih.
DNA me~p&aII makromolekul untai ganda yang tidak mudah msak
sehingga DNA dapat tersimpan dengan sangat baik pada es atau tulang-tulang
fosil hingga beribu-ribu tahun lamanya (Robinson 2005). Faktor yang
bertanggungjawab terhadap kemampuan DNA untuk tetap bertahan dalam kondisi
baik selama beribu-ribu tahun lamanya adalah struktur kimia penyusunnya yang
menyebabkan DNA tersusun kompak dan sangat kuat. Secara kimiawi, DNA
tersusun atas tiga komponen, yaitu basa yang kaya akan nitrogen, gula
deoksiribosa, dan fosfat. Ketiga komponen ini bergabung membentuk nukleotida,
dan ribuan nukleotida kemudian saling menyambung dan berpasang-pasangan
untuk membentuk untai DNA yang panjang.
Dalam Muladno (2002) disebutkan bahwa setiap molekul DNA merniliki
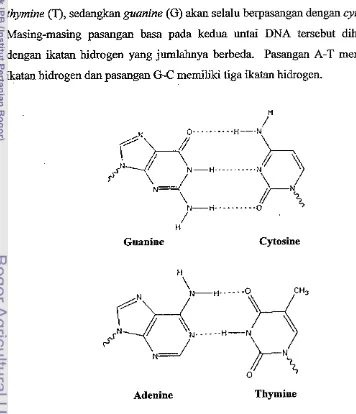
ratusan kopi keempat basa nitrogen berikut, Adenine (A), Guanine (G), Thymine
(T), dan Cytosine (C). Setiap basa tersusun atas atom karbon (C), hidrogen @I),
nitrogen (N), dan oksigen
(0).
Keempat basa nitrogen ini berasal dari duakelompk basa, yaitu purin dan pirimidii. Secarz hdah, pu6n berarti stnktur
yang tersusun atas dua cincin, sedangksn pifimidin adalah stnlktur cincin tunggal
dengan enam sisi. Basa purin yang ada dalam DNA adalah adenine (A) dan
guanine (G), sedangkan yang terrnaz.uk basa pirinidii adalah thymine (T) dan
cytosine (C).
Adenine Guanine Thymine Cytosine
Informasi dalam DNA dibawa oleh masing-masing bass. Untuk dapat
membuat nukleotida yang lengkap, basa-basa ini hams melekat pada molekul
deoksiribosa dan fosfat. Deoksiribosa mernpakan gula ribosa yang telah
kehilangan satu atom oksigen. Ketika tubuh memecah Adenosine TriPhosphate
(ATP), ribosa dibebaskan dan molekul fosfat masih melekat padanya. Ribosa
menghilangkan satu atom oksigen untuk menjadi deoksiribosa dan tetap berikatan
pada molekul fosfat yang diperlukan untuk mengubah basa tunggal menjadi
nukleotida. Ribosa juga merupakan unsur penyusun RNA di samping sebagai
prekursor untuk deoksiribosa. Kelompok hidroksil (-OH), yang terletak pada
posisi 3' struktur ribosa dan deoksiribosa mernpakan kelompok aktif, dimana
secara kimiawi atom oksigen pada kelompok ini bebas berikatan dengan molekd
lain, dalam hal ini molekul fosfat.
Ribosa Deoksiribosa
Gambar 6 Struktur kirnia gula ribosa dan deoksiribosa dengan penomoran pada
atom karbon (C) (modifikai dari Robinson (2005)).
Nukleotida hanya mampu saling berhubungan dengan menyambungkan
molekul fosfat pada gula. Molekul fosfat akan berikatan dengan molekul gula di
posisi 5', dan gugus hidroksil pada posisi 3' dari rnolekul gula juga akan berikatan
dengan molekul fosfat. Oleh karena itu, biasanya bagian ujung molekul fosfat
disebut 5' (5-prime) end, dan bagian ujung molekul gula disebut 3' (3-prime)
end Ikalan b a a nitrogen pada &a disebut ikatan glikosidik (Alberts et ai.
2004), sedangkan ikatan antara moleknl fosfat dan dua moleknl gula pada untai
(OH -
ILibole)
pento* [image:31.532.73.429.264.678.2]( H-Dmrrribore)
Gambar 7 Nukleotida tunggal (mononukleotida)
Setelah selesai terbentuk, untai-untai DNA tidak akan berdiri sendiri tetapi
akan selalu mencari pasangannya masing-masing untuk membentuk
makromolekul DNA
un??
ganda. Adenine (A) akan szlalu berpasangan denganthymine (T), sedangkan guanine (G) akan selalu berpasangan dengan cytosine (C).
Masing-masing pasangan basa pada kedua untai DNA tersebut dihubungkan
dengan ikatan hidrogen yang jumlahnya berbeda. Pasangan A-T memiliki dua
ikatan hidrogen dan pasangan G-C memiliki tiga ikatan hidrogen.
Guanine Cytosine
Adenine Thymine
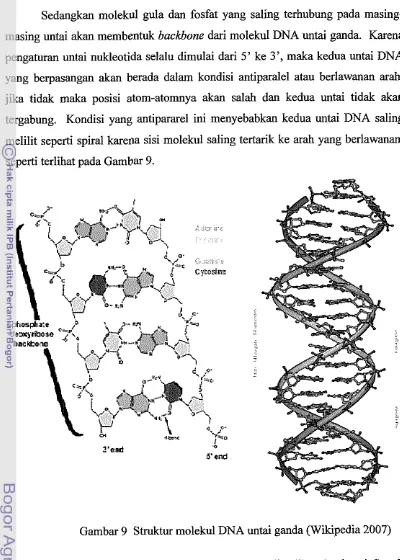
Sedangkan molekul gula dan fosfat yang saling terhubung pada masing-
masing untai akan membentuk backbone dari molekul DNA untai ganda. Karena
pengaturan untai nukleotida selalu dimulai dari 5' ke 3', maka kedua untai DNA
yang berpasangan akan berada dalam kondisi antiparalel atau berlawanan arah,
jika tidak maka posisi atom-atomnya akan salah dan kedua untai tidak akan
tergabung. Kondisi yang antipararel ini menyebabkan kedua untai DNA saling
melilit seperti spiral karena sisi molekul saling tertarik ke arah yang berlawanan,
seperti terlihat pada Gambar 9.
Gambar 9 Struktur molekul DNA untai ganda (Wikipedia 2007)
Mikrosatelit. Mikrosatelit, dan juga minisatelit, dikenal sebagai Simple Sequence Repeats (SSRs), Short Tandem Repeats (STRs), dan Variable Number of Tandem Repeats (VNTRs), yang merupakan unit nukleotida DNA yang berulang secara tandem. Satu unit mikrosatelit memiliki panjang 1-6 pasang basa
[image:32.539.65.465.39.599.2]unit minis~telii memiliki panjang DNA berulang identik sekitar 15-70 bp (Murray
1996).
Mikrosatelit banyak dimiliki oleh sel-sel eukariot dan relatif jarang pada
sel prokariot (Li et al. 2004). Mikrosatelit banyak ditemukan di dalam genom
(Selkoe dan Toonen 2006), termasuk di dalam genom-genom bakteri terkecil
(Field dan Wills 1996; Hancock 1996). Mikrosatelit ditemukan di dalam segmen
yang mengkode protein maupun yang tidak mengkode protein (T6th et al. 2000),
namun lebih sering ditemukan pada segmen DNA yang tidak mengkode protein
(Li et al. 2002). Analisa awal pada genom manusia memperlihatkan bahwa 3%
sus~man genom terdii atas mikrosatelit, dan genom manusia memiliki lebih dari
satu juta lokus mihosatelit (Ellegren 2004). Penyebaran mikrosatelit secara acak
di dalam genom kemungkinan disebabkan karena pengaruhnya dalam penyusunan
kromatin, replikasi DNA, siklus sel, Mismatch Repair System dan lain-lain (Li et
~1.2004).
Panjang lokus mikrosatelit biasanya beragam antara 5 sampai 40 unit
berulang, tetapi ulangan unit yang lebih panjang dari 40 unit juga masih mungkin
terjadi (Selkoe dan Toonen 2006). Unit yang t e r a dari 1 (mono-), dua (di-),
tiga
(ti-)
dan empat (tetra-) nukleotida merupakan ripe utama mikrosatelit, tetapiunit y u ~ g terdiri dari lima (penta-) dan enam (hexa-) nukleotida juga masih dapat
dikategorikan sebagai mni.kosatelit (Ellegren 2004). Mikrosatelit dengan unit
nukleotida yang panjang jarang terdapat pada prokariot (Ellegren 2004). Unit
nukleotida mikrosatelit yang panjang pada prokariot biasanya berhubungm
dengan faktor virulen dan berperan sebagai translation and transcriptional
'witches' (Himmelreich et al. 1996). Trinukleotida dan hexanukleotida
merupakan unit mikrosatelit yang paling banyak ditemukan pada segmen DNA
yang mengkode protein karena kedua unit mikrosatelit tersebut tidak
menyebabkan terjadinya j?amesh$t mutation (T6th et al. 2000) yaitu mutasi
genetik akibat penambahan dan penghilangan sejurnlah nukleotida yang
menyebabkan kesalahan pada proses penyusunan kodon dan tmnslasi sehingga
niengakibatkan pembahan pada sekuens dan struktur protein yang dihasilkan
diketahui terlibat dalam kejadian penyakit neurogeneratif (Kashi dan King 2006),
seperti penyakit Huntington danfragile X (Schliitterer 2000).
Sekitar 48-67% mikrosatelit yang ditemukan pada berbagai spesies adalah
dinukleotida (Li et al. 2002), tetapi tipe mikrosatelit yang paling banyak
ditemukan pada primata adalah mononukleotida, terutarna unit A/T (T6th et al.
2000). Di antara mikrosatelit tipe dinukleotida, unit berulang yang paling sering
diternukan adalah (CA)n, diikuti dengan (AT)n, (GA)n, dan (GC)n (Ellegren
2004). Unit berulang (GC)n adalah yang paling jarang ditemukan. Ferlu diingat
bahwa hanya ada 4 tipe yang mungkin dimiliki oleh unit berulang dinukleotida,
karena CA=AC=GT=TG, GA=AG=CT=TC, AT=TA, dan GC=CG (Ellegren
2004).
Gambar 10 Lokasi mikrosatelit di dalam kromosom
Secara rnudah, lokasi rnikrosatelit di dalam genom inti sel eukariot dapat
diilustrasikan dalam Gambar 10. Inti sel di dalam sel terdiri atas kromosom-
kromosorn yang berpasangan. Dalam Alberts et al. (2003) disebutkan bahwa
kromosom bertugas untuk membawa gen-gen yang rne~pakan unit fungsional
informasi untuk memproduksi protein tertentu. Lokasi gen di dalan~ kromosom
disebut lokus, dan bentuk alternatif dari gen disebut alel. Selain tersusun atas
segmen DNA yang mengkode protein, kromosom pada berbagai eukariot juga
tersusun atas sejumlah besar segmen-segmen DNA yang tidak membawa
informasi untuk mengkode produk apapun. Segmen DNA ini diienal sebagai
'junk DNA' atau 'noncoding-protein region'. Walaupun segmen DNA yang tidak
mengkode produk ini tidaklah penting bagi sel, namun segmen DNA ini
kemungkinan berperan penting bagi proses evolusi jangka panjang suatu spesies
dan keberhasilan aktifitas suatu gen. Di dalam segmen-segmen DNA yang
mengkode dan tidak mengkode protein inilah unit-unit mikrosatelit dapat
ditemukan. Lokus mikrosatelit diapit oleh sekuens DNA yang urutan basanya
selalu identik pada setiap individu dalam satu spesies, atau terkadang pada
individu dengan spesies yang berbeda (Selkoe dan Toonen 2006), tetapi jarang
pada individu yang secara taksonomi saling berjauhan. Sekuens yang mengapit
rnikrosatelit ini disebut flanking sequence yang kemudian digunakan sebagai
penanda bagi lokus mikrosatelit tersebut.
Mikrosatelit sering digunakan sebagai marker genetik karena merniliki
kerceragaman yang sangat tinggi atau sangat polirnorfik. Penyebab utarna tingginya
keragaman mikrosatelit adalah karena terjadi~ya mutasi. Laju mutasi
~nikrosatelit berkisar antara 10" sampai lo-' per l o b s per generasi (Schlotterer
2000; Selkoe dan Toonen 2006), dengan laju rata-rata 5x10"' (Selkoe dan Toonen
2006). Laju mutasi berbeda antar lokus dan antar alel, dan kemungkinan juga
antar spesies (Ellegren 2000). Laju mutasi pada mikrosatelit lebih tinggi
dibandingkan laju penambahan basa (Schlotterer 2000). Laju mutasi mikrosatelit
dipengwhi oleh panjang unit berulang, komposisi basa, jurnlah ulangan, dan
kemumian pengulangan washi dan King 2006). Laju mutasi pada unit berulang
dinukleotida 1.5-2 kali lebih tinggi dibandingkan laju mutasi pada tetranukleotida,
sedangkan unit berulang trinukleotida yang tidak menyebabkan penyakit memiliki
laju mutasi rata-rata di antara laju mutasi di- dan tetranukleotida (Cbakraborty et
al. 1997). Laju mutasi pada mikrosatelit ATITA lebih rendah dari pada laju
yang panjang temyata sangat tidak stabil dan cenderung untuk bermutasi (Lai dan
Sun 2003).
Walaupun mekanisme mutasi pada mikrosatelit sampai saat ini masih
belum jelas (Selkoe dan Toonen 2006), namun mutasi pada mikrosatelit yang
menyebabkan perubahan panjang mikrosatelit diduga secara umum disebabkan
oleh DNA replication slippage (Blankenship et al. 2002; Ellegren 2004; Li et a1
2004). Sedikit data yang memperlibatkan bahwa rekombinasi ikut menyebabkan
mutasi pada mikrosatelit (Ellegren 2004). Rekombinasi, yang melibatkan
persilangan yang tidak sarna (unequal crossover) dan konversi gen, menyebabkan
mutasi pada sekuens minisatelit yang lebih panjang (Ellegren 2004).
DNA replication slippage adalah proses pemisahan sementara untai DNA hasil replikasi pada saat proses replikasi berlangsung yang diikuti dengan
kesalahan penyusunan pada saat penyatuannya kembali (Ellegren 2004).
Replication Slippage menyebabkan mikrosatelit mengalami kehilangan atau
peneunbahan unit berulang tunggal, tergantung pada untai DNA yang menjadi
tempat te jadinya slippage (Blankeship et al. 2002).
a
Increase in repeat length Decrease in repeat length
[T
1,2,3,4 - - - bI
* I 2' '3'4 ' 5 ' 6 '7-Gambar 1 1 Proses slippage pada mikrosatelit (Ellegren 2004)
Biasanya, kesalahan pada saat replikasi DNA ini dapat dikoreksi oleh
Mismatch Repair System (Ellegren 2004; Li et a1 2004), dan hanya sejumlah
mutasi pada rnikrosatelit (Ellegren 2004). Jika inutslsi terjadi pada gen, maka
akan menyebabkan terjadinya perubahan pada fenotip (Li et a1 2004). Tidak
seperti laju mutasi, proses mutasi yang terjadi pada mikrosatelit tidak berbeda
antar lokus (Bachtrog et al. 2000).
DNA slippage memerlukan pemutusan ikatan hidrogen di antara kedua
untai DNA (Bachtrog et al. 2000). Secara skematis proses replication slippage
dapat dilihat pada Gambar 1 1. Setelah proses replikasi mikrosatelit diinisiai, untai
DNA hasil replikasi (nascent strand) terpisah sesaat dari untai DNA asal yang
akan d i r e p l i i i (template strand) dan menyimpang dari jalur yang semestinya.
Oleh karena itu, proses replikasi selanjutnya akan menyebabkan perbedaan
panjang dengan untai DNA template. Proses penyimpangan ini &an
menyebabkan terbentuknya loop pada untai DNA. Jika penyimpangan ini
menyebabkan loop pada untai yang baru, maka hasil akhir replikasi
akan
bempapenambahan panjang untai DNA. Sedangkan jika loop terbentuk pada untai
template, maka
akan
menyebabkan pengurangan ukuran panjang untai DNA (Ellegren 2004). Pada saat mutasi slippage terjadi, ekspansi akan terjadi lebih sering jika jumlah unit bemlang sediit, dan kontraksi akan lebih sering terjadijika jumlah unit berulang lebih banyak. Setingga pada saat mutasi terjadi,
mikrosatelit dengan ukuran ymg panjang cen&erung untuk - bermutasi menjadi
inikrosateiit pendek, sedangkarl mikrosatelit dengar,
ukuran
yang pendekcendenmg bermutasi menjadi mikrosatelit yang lebih panjang (Lai dan Sun 2003).
Efisiensi Mismatch Repair System merupakan titik kritis bagi laju slippage
mikrosatelit karena kemampuan Mismatch Repair System untuk mendeteksi loop
yang diakibatkan oleh kejadian slippage pada saat replikasi berbeda pada tiap
spesies (Yamada et al. 2002). Sedangkan dalam evolusi molekuler, aktifitas
Mismatch Repair System mempakan faktor penting yang berpengaruh dalam
fluktuasi panjang mikrosatelit (Li et al. 2004). Dan dalam proses evolusi,
mikrosatelit sendii berperan sebagai evolutionary tuning knobs yang memberikan
keuntungan berupa kemampuan beradaptasi yang cepat terhadap lingkungan yang
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2005 sampai dengan
September 2006 di Laboratoriurn P e n d i d i i dan Pelayanan Terpadu, Fakultas
Kedokteran Hewan, Institut Pertanian Bogor.
Bahan dan Alat Penelitian
Bahan-bahan yang digunakan adalah daging babi hutan sulawesi, air
MilliQ, akuades, buffer lisis, proteinase K, RNAase, ammonium asetat, glikogen,
isopropanol, etanol, buffer Tris EDTA (TE), agarose biologi molekder
(BIORAD), buffer Tris Acetic Acid EDTA (TAE), NaCl, DMSO, loading dye,
etidium bromide, Eppendorf PCR kit, primer mikrosatelit forward dan reverse,
primer MI3 berlabel Qcarboxy-fluorescine (FAM), formamide terdeionisasi,
GS500 [TAMRA] labeled Size Standard, l x Genetic Analyzer Bufler dengan
EDTA, Per$ormance Optimized Polymer 4% (F'OP-4TM).
Peralatan yang digunakan adalah parafilm, mikropipet 0.5-10 p1: 10 - 100
p1, d m 100-1000 p1, mikrotip, kapiler, tabung PCR, tabung eppeiidorf 1.5 ml,
botol-botol ukum 20 ml, 50 ml, 100 ml, gela. ukur, tabung Erlenmeyer, gelas
piala, pH meter, ndwosentilfus, I.W transluminator, shaker water bath, fortex,
timbangan analitik, ABI prismffi 310 Genetic analyzer, G e n e h p PCR System
9700, BIORAD s u b - c e l l f f i ~ ~ , spektrofotometer HITACHI U-2001.
Metode Penelitian
Pengumpulan Sampel. Sampel daging dari 62 individu babi hutan
sulawesi diperoleh dari semenanjung utam dan tenggara Pulau Sulawesi dengan
media transpor bempa 25% DMSO dan 4.5 M NaCl (Seutin et al. 1991). Tiga
puluh tiga sampel yang berasal dari semenanjung utara diperoleh dari daerah di
antara kota Palu di Sulawesi Tengah sampai ke Kotamobagu di Sulawesi Utara.
Sedangkan 29 sampel yang berasal dari semenanjung tenggara diperoleh dari
daerah-daerah di semenanjung tenggara sampai ke sekitar daerah perbatasan
Garnbar 12 Lokasi pengambilan sampel di semenanjung utara dan tenggara pulau Sulawesi (angka pada peta menunjukkan jumlah sampel per lokasi)
Isolasi DNA. Sebanyak 100 mg sampel daging S. celebensis dihancurkan
di dalam tabung 1.5 ml dan ditambahkan 500 pl buffer lisis. Sampel kemudian
diinkubasi pada suhu 55 O C selama 1 jam dengan shaker waterbath pada
kecepatan 60 rpm. Sebanyak 3 p1 Proteinase K (20 mgtml) ditambahkan ke
dalam sampel dan diinkubasi pada suhu 55 OC selama 3 jam atau semalam.
Selanjutnya, larutan RNAse-A (20 mg/ml) sebanyak 3 pl ditambahkan ke dalam
selesai, tabung berisi sarnpel disimpan di dalarn es selama 30 meiut d m kemudim
disentrifus pada suhu 4 "C dengan kecepatan 9000 g selama 10 menit. Supematan
yang diperoleh kemudian dimasukkan ke dalam tabung baru dan ditambahkan
ammonium asetat 5M sebanyak 500 p1 untuk mengendapkan protein-protein yang
ada pada sampel. Sampel selanjutnya divortex selama 20 rnenit pada kecepatan
maksimurn dan didiamkan selama 10 menit pada suhu ruang. Sampel kemudian
disentrifus pada suhu 4 "C dengan kecepatan 3000 rpm selama 15 menit dan
kemudian supematan yang diperoleh dimasukkan lagi ke dalam tabung baru.
Proses sentrifus dapat dilakukan sebanyak dua kali sampai tidak ada lagi sisa-sisa
endapaii protein yang melekat pada dinding tabung. Supematan yang diperoleh
kemudian dipindahkan lagi ke dalam tabung baru yang sudah diisi 600 p1
isopropanol (2-propanol) absolut dan 0.5 p1 gliiogen (20 mglml) untuk
mengendapkan DNA. Larutan kemudian diiomogenkan dengan cara membolak-
balikkan tabung dan didiamkan semalam pada suhu mang. Sampel kemudian
disentrifus pada suhu 4 "C dengan kecepatan 3000 rpm selama 5 menit, DNA
akan terlihat sebagai pelet kecil berwarna putih. Supem.ztan kemudian dibuang,
dan pelet DNA kemudian dicuci dengan cara menambahkan 300-600 p1 etanol
70% dingin. Tabung kemudian dibolak-balik secara perlahan untuk rnembantu
pencucian DNA. Sampel kemudian disentrifus pada suhu 4 O C dengan keceparan
13.000-16.000 g seiama 1 menit. Etanol kemudian dibuang secara hati-hati agar
pelet DNA tidak ikut terbuang. Sisa-sisa etanol di dalam tabung kemudian
dihilangkan dengan cara memanaskan tabung pada suhu 75 "C selama 6 menit.
Setelah etanol hilang, pelet DNA kemudian direhidrasi dengan menambahkan TE
buffer pH 8 sebanyak 30-50 p1, disesuaikan dengan banyaknya pelet DNA yang
diperoleh. Sampel DNA kemudian didiamkan selama semalam atau diinkubasi
pada suhu 60 "C selama 3 menit untuk melarutkan DNA. Setelah DNA terlarut,
DNA kemudian disimpan di dalam freezer bersuhu -20 "C sampai saat akan
digunakan.
Elektroforesis. Elektroforesis dilakukan dengan melalukan DNA di
dalam agar dengan menggunakan m s list&. DNA yang bermuatan negatif akan
bergerak menuju muatan positif. DNA dengan ukuran basa yang kecil akan
Ekstrak DNA sanlpel (template) dilihat keberadaarlnya dengan teknik
elektroforesis menggunakan agarose biologi molekuler 1% @IO-RAD).
Sebanyak 1
gram
agarose dilmtkan dalam 100 buffer TAE l x dengan caradididihkan. Agarose kemudian dicetak dan dibiarkan membeku. Sampel DNA
yang telah dicampur loading dye dengan perbandingan 9 : 1 dimasukkan ke dalam
sumur-sumur yang tercetak pada agarose, kemudian dilalukan dengan tegangan
100 V selama 2 jam. Agarose kemudian direndam di dalam larutan etidhium
bromida (0.5 pglml) selama 15 menit dan hasilnya dilihat di atas W
transluminator. Hasil positif ditunjukkan dengan adanya pendaran pita
fluorescent bermma jingga pada agarose.
Penentuan Konsentrasi dan Kemurnian DNA. Penentuan konsentrasi
dan kemumian DNA dilakukan berdasarkan Sambrook et al. (1989), dengan
meggunakan alat spektrofotometer HITACHI U-2001. Ekstrak DNA yang akan
diperiksa dipanaskan terlebii dahulu pada suhu 60 OC selama 3 menit agar DNA
terlarut sempuma dan kemudian disimpan di dalam es. Sebanyak 2 ml larutan
buffer TE pH 8 yang sudah difilter dimasukkan ke dalam kuvet kuarsa dan
digunakan untuk mengnolkan spektrofotometer. Setelah spektrofotometer
dinolkan maka kemudim sebanyak 10 p1 ekstrak DNA sampel dimasukkan ke
dalam kuvet kuarsa ke dua yarig sudah diisi dengan 1,9 mi buffer TE p1-I 8 yang
sudah difilter dan keinudian disimpan di dalam alat spektrofotometer. Pembacaan
kemudian dilakukan pada panjang gelombang 260 nm untuk mengetahui
konsentrasi DNA dan 280 nm untuk mengetahui konsentrasi protein di dalam
sampel.
Rasio dari hasil pembacaan pada panjang gelombang 260 nm dan 280 nm
digunakan untuk mengetahui tingkat kemumian DNA. DNA dianggap mumi jika
rasio pembacaan merniliki nilai 1.7-1.9. Jika nilai rasio yang diperoleh kurang
dari 1.7 maka ha1 ini menunjukkan bahwa sampel DNA terkontaminasi oleh
protein atau fenol, sedangkan jika nilai rasio lebih tinggi dari 1.9 maka ha1 ini
menunjukkan adanya kontaminasi dengan RNA. NiIai yang diperoleh pada
pembacaan dengan panjang gelombang 260 nm digunakan untuk menentukan
ganda sebesar 50 pg/ml. Selanjutnya penghihuigan konsentrasi DNA dilakukan
dengan rumus sebagai berikut :
Konsentrasi DNA ( ~ g l m l ) = A260 x 50 x faktor pengenceran
Keterangan : Az60 adalah ~ l a i yang diperoleh dari pembacaan pada panjang
gelombang 260 nrn. Nilai dalam (pg/ml) sama dengan Nlai dalarn
(ng/vl).
Proses amplifikasi DNA. Proses amplifikasi DNA dilakukan dengan
teknik Polvmerase Chain Reaction (FCR). Tigabelas marker mikrosatelit yang
diisolasi dari Sus scrofa telah dipilih secara acak untuk digunakan dalam analisa
keragaman genetik pada penelitian ini (Lowden et al. 2002). Ketigabelas marker
mikrosatelit yang digunakan terdiri dari 12 dinukleotida sempurna dan 1 marker
yang merupakan mikrosatelit dengan unit berulang d i i e o t i d a campuan.
Dinukleotida, trinukleotida, dan teh-anukleotida adalah unit mikrosatelit yang
paling urnum digunakan sebagai marker molekuler genetik, sedangkan
niononukleotida adalah unit mikrosatelit yang jarang digunakan sebagai marker
genetik karena sering menimbulkan masalah pada proses q l i f i k a s i (Selkoe dan
Toonen 2006). Unit mikrosatelit yang lebih panjang sangat tidak m u m
digunakan sebagai marker genetik dan sedikit data yang dapat menzrangkan
tentang kejadian evolusi pada unit mikrosaielit tersebut (Li et al. 2002). Duabelas
marker mikrosatelit diiukleotida yang digunrtkan dalarn penelitian ini adalah
50214, S0149, S0228, SW911, SW240, SW857, SW72, SW951, SW936, SW632,
S0386, dan S0026. Sedangkan satu marker mikrosatelit dengan unit berulang
gabungan yang digunakan ddam penelitian ini adalah SO215 (Yue ef al. 2002).
Informasi tentang sekuens masing-masing marker mikrosatelit dapat dilihat pada
Lampiran 3.
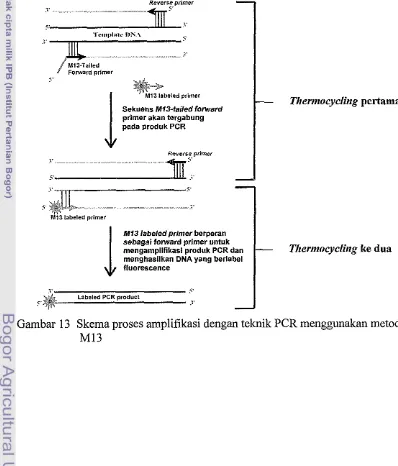
PCR dilakukan pada GeneAmp PCR System 9700 dengan menggunakan
metode MI3 (Schuelke 2000; Tomasdo-Seccomandi et al. 2003). Metode M13
merupakan pendekatan altematif yang digunakan -mtuk menekan biaya yang
diperlukan
untuk
melakukan genotyping dengan marker mikrosatelit, terutamapewarna fluorescent diperlukm untuk mendeteksi ukuran h g m e n h a i l PCR
dengan elektroforesis ataupun deteksi laser, sehingga salah satu primer harus
berlabel fluorescent agar ukumn fragmen dapat terdeteksi. Ada empat macam
p e w m a fluorescent yang biasa digunakan untuk analisa fragmen rnikrosatelit,
yaitu 6-carboxy-fluorescine (FAM), hexachloro-6-carboxy-fluorescine (HEX), 6-
carboxy-X-rhodarnine (ROa, dan tetrachloro-6-carboxy-fluoreseine (TET).
Karena harga pewama-pewama fluorescent ini sangat mahal, Schuelke (2000)
menciptakan metode altematif yang lebih ekonomis, yaitu metode M13. Dengan
metode M13, peneliti tidak perlu melabel masing-masing primer mikrosatelit
pewmafluorescent, tetapi hanya primer MI3 saja yang dilabel dengan pewarna
fluorescent.
Tiga macam primer yang digunakan pada penelitian ini untuk proses
amplifikasi menggunakan metode MI3 adalah primer universal MI3 (5'-
CACGACGTTGTAAAACG