PENGARUH WAKTU SONOKIMIA TERHADAP UKURAN KRISTAL KALSIUM KARBONAT (CaCO3)
RIDHO BAHANAN
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PENGARUH WAKTU SONOKIMIA TERHADAP UKURAN KRISTAL KALSIUM KARBONAT (CaCO3)
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
RIDHO BAHANAN
104096003096
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
ABSTRAK
Ridho Bahanan. PENGARUH WAKTU SONOKIMIA TERHADAP UKURAN
KRISTAL KALSIUM KARBONAT (CaCO3). Dibawah Bimbimgan
Dr. Mirzan T. Razzak, M.Eng, APU dan Drs. Sudirman, M.Sc, APU.
Kalsium karbonat (CaCO3) disintesis dari campuran larutan natrium karbonat
(Na2CO3) dan kalsium klorida (CaCl2) melalui proses sonokimia. CaCl2
dituangkan ke dalam larutan Na2CO3 dengan variasi waktu sonokimia 30, 60, 90,
120, 150 dan 180 menit. Hasilnya di analisis menggunakan x- ray diffraction (XRD) dan scanning electron microscope (SEM). Full Width at Half Maximum (FWHM) dari pola difraksi sinar-x digunakan untuk menghitung ukuran kristal menggunakan persamaan schererr. Data yang diperoleh diuji secara statistik menggunakan Korelasi Pearson. Hasil yang didapat menunjukan bahwa ukuran kristal CaCO3 menurun seiring meningkatnya waktu sonokimia. Morfologi
permukaan sampel dipelajari dengan SEM.
ABSTRACT
Ridho Bahanan. EFFECT OF SONOCHEMISTRY TIME TO CRYSTAL SIZE CALCIUM CARBONATE (CaCO3). Advisor by Dr. Mirzan T. Razzak, M.Eng,
APU and Drs. Sudirman, M.Sc, APU
Calcium carbonate were synthesized from mixed aqueous solution of sodium carbonate ( Na2CO3) and calcium chloride (CaCl2) by sonochemical reaction.
CaCl2 poured in to Na2CO3 solution with different sonochemical time 30, 60, 90,
120, 150 and 180 minutes. The result was investigated with x- ray diffraction (XRD) and scanning electron microscope (SEM). Full Width at Half Maximum (FWHM) from x-ray diffraction pattern used for calculating crystal size with schererr equation. Data was examined by Pearson Correlation. The result show that crystal size decrease together with increasing sonochemical time. Morfology surface examined by SEM.
Keywords: Calcium carbonate, sonochemical reaction, crystal size.
KATA PENGANTAR
Bismillahirrohmanirrohim,
Assalamu’alaikum Wr. Wb.
Puji syukur ke hadirat Allah SWT yang telah melimpahkan rahmat, karunia dan hidayah-Nya kepada kita semua. Shalawat serta salam semoga senantiasa tercurah kepada baginda Rasulullah Muhammad SAW, keluarga dan para sahabatnya, serta para wali Allah dan para ulama yang telah menyebarkan agama Allah ke seluruh penjuru dunia.
Perkembangan teknologi di bidang material dewasa ini sangat pesat. Kebutuhan akan material baru yang mampu memenuhi kebutuhan pasar mendorong dilakukannya penelitian dan pengembangan di bidang ini. Tidak terkecuali penelitian di bidang sintesis nanomaterial, yang mana material dalam ukuran ini dapat memiliki sifat-sifat dan kinerja yang lebih unggul untuk memenuhi kebutuhan dalam modifikasi material.
Skripsi dengan judul “Pengaruh Waktu Sonokimia Terhadap Ukuran Kristal Kalsium Karbonat (CaCO3)” ini dibuat selain sebagai syarat untuk
Penulis yakin dan sadar dalam penulisan skripsi ini penulis mendapatkan bantuan dan dukungan dari berbagai pihak. Untuk itu, pada kesempatan ini penulis ingin menyampaikan rasa terimakasih yang mendalam kepada :
1. Bapak DR. Syopiansyah Jaya Putra, M. Sis, Dekan Fakultas Sains dan Teknologi.
2. Ibu Sri Yadial Chalid, M. Si, Ketua Program Studi Kimia.
3. Bapak Drs. Sudirman, M.Sc, APU yang telah memberi kesempatan pada penulis untuk melakukan penelitian sekaligus sebagai pembimbing lapangan yang senantiasa sabar dalam memberikan arahan dan ilmunya kepada penulis.
4. Bapak Dr. Mirzan T. Razzak, M.Eng, APU selaku dosen pembimbing dari Program Studi kimia atas segala bimbingan dan arahan yang telah diberikan kepada penulis.
5. Bapak Ir. Iman Kuntoro, selaku Kepala Pusat Teknologi Bahan Industri Nuklir BATAN PUSPIPTEK.
6. Bapak Dr. Setyo Purwanto M.Eng, selaku Kepala Bidang Karakterisasi dan Analisis Nuklir BATAN PUSPIPTEK
7. Kedua orang tua dan sanak saudara penulis atas segala kepercayaan serta dukungan moril dan materil yang telah diberikan (I hope everythings start
from here).
9. Ibu Dra. Deswita dan Para staf di Laboratorium Pusat Teknologi Bahan Industri Nuklir.
10. Brigita Widya Hapsari S.Si, selaku rekan penelitian di Laboratorium, atas segala bantuan baik dalam penelitian maupun dalam penulisan skripsi. 11. Teman-teman Prodi Kimia angkatan 2002-2008, atas segala bantuan baik
selama penulis menempuh masa studi maupun dalam mengerjakan tugas akhir.
12. Teman-teman satu atap, seperjuangan, Bed Company ; Rijal, Jibhul, Mimi, Aan dan Dj Ian.
Penulis tidak lupa menyampaikan permohonan maaf sebesar-besarnya apabila dalam penulisan skripsi ini masih banyak kekurangan. Segala komentar, kritik dan saran demi kesempurnaan skripsi ini sangat penulis harapkan. Akhir kata, semoga skripsi ini dapat bermanfaat baik bagi penulis maupun bagi semua yang membacanya.
Terima Kasih.
Assalamu’alaikum Wr. Wb.
Jakarta, Maret 2010
DAFTAR ISI
Halaman
KATA PENGANTAR... v
DAFTAR ISI... viii
DAFTAR TABEL... xi
DAFTAR GAMBAR... xii
DAFTAR LAMPIRAN... xiv
BAB I PENDAHULUAN... 1
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 3
1.3. Ruang Lingkup Penelitian... 3
1.4. Hipotesis ... 3
1.5. Tujuan Penelitian... 3
1.6. Manfaat Penelitian... 4
BAB II TINJAUAN PUSTAKA... 5
2.1. Kalsium Karbonat (CaCO3)... 5
2.2. Nanoteknologi... 6
2.3. Kalsium Karbonat Presipitat (PCC)... 10
2.4. Sonokimia ... 14
2.4.1. Ultrasonik ... 14
2.4.2. Kavitasi Akustik ... 16
2.5. Struktur kristal ... 19
2.5.1. Konsep Dasar... 19
2.5.2. Unit Sel... 20
2.5.3. Sistem Kristal ... 21
2.5.4. Bidag Kristalografi (Indeks Miller)... 23
2.6. X- ray Diffraction (XRD)... 24
2.7. Scanning Electron Microscope (SEM)... 29
2.8. Rietveld Analysis (Rietan)... 35
BAB III METODOLOGI PENELITIAN... 37
3.1. Waktu dan Tempat Penelitian... 37
3.2. Alat dan Bahan... 37
3.2.1. Alat yang digunakan ... 37
3.2.2. Bahan yang digunakan ... 37
3.3. Diagram Alir Penelitian... 38
3.4. Prosedur Penelitian ... 39
3.4.1. Pembuatan Larutan CaCl2 dan Na2CO3 Jenuh... 39
3.4.2. Proses Presipitasi CaCO3 dan Sonokimia ... 39
3.4.3. Pencucian Sampel ... 40
3.4.4. Karakterisasi dengan XRD... 40
3.4.5. Karakterisasi dengan SEM... 41
BAB IV HASIL DAN PEMBAHASAN... 43
4.1. Analisis Kualitatif Pola XRD Sampel CaCO3... 43
4.2. Analisis ukuran kristal sampel CaCO3... 45
4.3. Analisis Mikrograf Scanning Elektron Microscopy (SEM)... 50
4.4. Hasil Pengujian Statistik ... 53
BAB V KESIMPULAN DAN SARAN... 55
5.1. Kesimpulan...55
5.2. Saran...56
DAFTAR PUSTAKA... 57
DAFTAR TABEL
Halaman Tabel 1. Hubungan sistem kristal dengan parameter kisi ... 23 Tabel 2. Ukuran kristal sampel CaCO3 dengan varisasi waktu sonokimia ... 46
Tabel 3. Persentase penurunan ukuran kristal sampel CaCO3 dengan variasi
DAFTAR GAMBAR
Halaman
Gambar 1. Proses yang terjadi pada metode LEM... 9
Gambar 2. Mikrograf SEM dari CaCO3 berbentuk spherical dan needle-like... 12
Gambar 3. Mikrograf SEM dari CaCO3 berbentuk kubus... 13
Gambar 4. Frekuensi gelombang suara... 15
Gambar 5. Proses terjadinya kavitasi... 17
Gambar 6. Kristal tunggal dan polikristal ... 20
Gambar 7. Unit sel dan kisi kristal (lattice) ... 21
Gambar 8. Unit sel dengan sumbu koordinat (x, y, z), aksial (a, b, c), dan sudut interaksial ( , , )... 22
Gambar 9. Bidang kristalografi (Indeks Miller) ... 24
Gambar 10. Spektrum gelombang elektromagnetik ... 25
Gambar 11. Proses Difraksi sinar-X... 27
Gambar 12. Full Width at Half Maximum (FWHM) ... 29
Gambar 13. Skema Scanning Electron Microscope... 32
Gambar 14. Sinyal – sinyal emisi pada SEM ... 33
Gambar 15. Proses Kerja Scanning Electron Microscope (SEM)... 34
Gambar 16. Diagram alir penelitian... 38
Gambar 17. Diagram skematik proses presipitasi ... 39
Gambar 18. Diagram skematik proses Difraksi Sinar-X... 40
Gambar 19. Difraktogram CaCO3 standar ICSD, dan hasil penelitian... 44
Gambar 21. Grafik hubungan waktu sonokimia terhadap ukuran
kristal sampel CaCO3 ... 47
Gambar 22. Mikrograf SEM sampel CaCO3 dengan waktu Sonokimia
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Diagran Alir Penelitian... 60
Lampiran 2. Diagram Kerja... 61
Lampiran 3. Data hasil perhitungan ukuran Kristal sampel CaCO3 menggunakan program Microcal Origin... 65
Lampiran 4. Data hasil perhitungan ukuran Kristal sampel CaCO3 menggunakan program RIETAN... 66
Lampiran 5. Data Parameter kisi sampel CaCO3 ... 67
Lampiran 6. Data criteria and goodness of fit sampel CaCO3... 67
Lampiran 7. Diffraktogram sampel CaCO3... 68
Lampiran 8. Hasil refinement pola XRD sampel CaCO3... 68
Lampiran 9. Ukuran kristal sampel CaCO3 dengan varisasi jumlah tetesan per menit ... 69
BAB I PENDAHULUAN
1.1. Latar Belakang
Bubuk kalsium karbonat (CaCO3) nanostrukutur memiliki aplikasi yang
luas didalam berbagai bidang industri. CaCO3 digunakan untuk pigmen putih,
pengisi dan pengembang untuk kertas, karet, cat, dan plastik. Meskipun produk komersial yang tersedia memilki rata-rata ukuran partikel dari submikron sampai dengan beberapa mikron, partikel terkecil tanpa penggumpalan menjadi syarat
untuk mengembangkan sifat-sifat penting lainnya dalam produk akhir [Tsuzuki et.al, 2000].
Material nanostruktur belakangan ini menjadi bidang yang sangat menarik,
gelembung kavitasi. Dalam fotokimia, sejumlah besar energi diintroduksi dalam waktu singkat, tetapi energi termal ini lebih baik dari eksitasi elektron. Suhu termal yang tinggi dapat dicapai. Sonokimia memiliki komponen bertekanan tinggi yang memungkinkan dapat digunakan untuk produksi dalam skala mikroskopis, kondisi skala yang sama besar yang dihasilkan selama letusan atau guncangan gelombang (guncangan gelombang adalah kompresi gelombang yang terbentuk ketika kecepatan badan cairan relatif melebihi medium yang dapat mengirimkan suara) [Suslick, 1994].
Pada penelitian ini dilakukan pembuatan CaCO3 berukuran nanometer
dengan metode presipitasi melalui proses sonokimia. Sesuai persamaan reaksi berikut :
Na2CO3 + CaCl2 CaCO3 + 2NaCl
Karakterisasi CaCO3 digunakan Instrumen X-Ray Diffraction (XRD) dan
1.2. Rumusan Masalah
Apakah waktu sonokimia dapat berpengaruh terhadap ukuran kristal dalam sintesis kalsium karbonat (CaCO3)?
1.3. Ruang Lingkup penelitian
1. Membuat kalsium karbonat (CaCO3) dengan berbagai variasi waktu
sonokimia.
2. Karakterisasi sampel kalsium karbonat (CaCO3) dengan menggunakan
X-Ray Diffraction (XRD) dan Scanning Electron Microscope(SEM).
1.4. Hipotesis
H0 = Lamanya waktu sonokimia berpengaruh terhadap ukuran kristal
kalsium karbonat (CaCO3)
H1 = Lamanya waktu sonokimia tidak berpengaruh terhadap ukuran
kristal kalsium karbonat (CaCO3)
1.5. Tujuan Penelitian
1. Mensintesis kalsium karbonat (CaCO3)dengan metode presipitasi melalui
proses sonokimia.
2. Karakterisasi CaCO3 menggunakan X-Ray Diffraction (XRD) dan
3. Mempelajari pengaruh waktu sonokimia terhadap ukuran kristal. Hasil yang diharapkan adalah berkurangnya ukuran kristal sampel CaCO3.
1.6. Manfaat Penelitian
Kalsium karbonat (CaCO3)nanopartikel banyak digunakan dalam berbagai
bidang industri, yaitu untuk pigmen putih, pengisi dan pengembang untuk kertas, karet, cat, dan plastik, dikarenakan pada ukuran nanopartikel CaCO3 dapat
terdispersi lebih merata di dalam matriks sehingga dapat tercampur dengan homogen. CaCO3 nanopartikel sebagai pengisi pada plastik dapat menghasilkan
BAB II
TINJAUAN PUSTAKA
2.1. Kalsium Karbonat (CaCO3)
CaCO3 adalah senyawa kimia berwarna putih yang paling umum dari
mineral nonsilikat. CaCO3 terdapat di alam dalam bentuk limestone dan kapur
(Alger, 1989). CaCO3 terdapat dalam tiga bentuk kristal, calcite
(trigonal-rhombohedral), Aragonite, dan Vaterite. CaCO3 tidak larut dalam air
tetapi sedikit larut dalam air yang mengandung CO2 terlarut bergabung
membentuk bikarbonat Ca (HCO3)2 seperti reaksi pada limestone (yang sebagian
besar tersusun dari calcite) yang menyebabkan terbentuknya stalaktit dan stalagmit pada gua (The Columbia Encyclopedia). Limestone tanah, yang memiliki ukuran partikel 0,5 – 30 µm adalah jenis dengan kemurnian paling rendah, sedangkan kapur tanah atau biasa disebut whiting memiliki kemurnian sampai dengan 99% calcite dengan ukuran partikel sekitar 1,5 µm (Alger, 1989). Terdapat tiga proses pembentukan CaCO3 di bumi :
a. Alamiah (life process)
Kalsium (yang berasal dari kehidupan) bergabung dengan karbonat (dalam air laut atau dari atmosfir), yang telah ditemukan pada zaman dahulu di dalam fossil yang disebut limestone.
b. Presipitasi kimia dibawah suhu rendah.
CaCO3 terlarut di dalam air dan karbondioksida (CO2) dan dapat
c. Reaksi shockwave
Terdapat tiga jenis CaCO3 yang terbentuk melalui reaksi shockwave :
1. Tumbukan alamiah pada batu limestone
2. Tumbukan alamiah pada batu yang banyak mengandung kalsium (biasanya berasal dari meteorit) dengan material yang kaya akan karbon dari komet dan meteorit.
3. Shockwave buatan dari ledakan besar di udara (contoh: bom atom hiroshima). Kalsium yang berasal dari meteor bergabung dengan karbon dan oksigen dari atmosfir membentuk CaCO3. Reaksi
tumbukan ini dihasilkan dengan mudah dengan komposisi yang tidak tentu antara kalsium dan ion karbonat melalui reaksi yang cepat (Miura, 2007).
CaCO3 secara luas digunakan sebagai pengisi (filler) dalam komposit
plastik dan karet. Material ini memiliki banyak keunggulan, seperti warnanya yang sangat putih, harga terjangkau dan ukuran partikelnya dapat diatur (Alger, 1989). Pada bidang industri, CaCO3 digunakan sebagai modifier dan sebagai
bahan pelapis (coating) dalam pembuatan kertas. CaCO3 termasuk zat padat
kristalin dengan kelarutan rendah, sedikit terhidrolisis pada pH diatas 7 (colloidal dynamics).
2.2. Nanoteknologi
bentuk dan ukuran materi dalam skala nanometer. Nanoteknologi merupakan awal yang memungkinkan para ilmuwan, perekayasa, dan ahli medis untuk bekerja pada tingkat seluler dan molekuler untuk kemajuan ilmu dan perawatan kesehatan (Yulianti 2008). Nanostruktur dapat secara signifikan mengubah sifat-sifat material, seperti sifat optik, kekerasan, bentuk dan morfologi (Gupta, 2004).
Nanopartikel didefinisikan sebagai partikel padat yang berukuran kecil dengan kisaran ukuran dari 1 sampai 100 nanometer. Partikel yang sangat halus dengan skala nanometer ini merupakan daerah transisi antara skala molekuler dan skala makroskopis (Yulianti, 2008).
Dipandang dari segi molekuler, nanopartikel ini berukuran cukup besar sehingga pendekatan melalui sifat kuantum kurang tepat; sedangkan bila dipandang sebagai materi, mereka sangat kecil dan mempunyai ciri khas yang tidak teramati pada partikel berukuran lebih besar (> 100 nm). sebagai contoh, pada logam mulia seperti emas, nanopartikelnya memperlihatkan warna merah dan memperlihatkan sifat katalis yang unggul pada temperatur rendah. Nanopartikel logam juga memperlihatkan sifat mekanik yang luar biasa seperti
superplasticity. Komposit matriks keramik dengan skala nanometer juga mempunyai sifat mekanik yang lebih baik. Alasan utama yang mendasari perubahan sifat ini yaitu meningkatnya luas permukaaan dan munculnya efek kuantum pada material berukuran nanometer (Yulianti, 2008).
dengan kekerasan menyamai atau bahkan melebihi berlian (IPRIME). Beberapa metode untuk sintesis material nanopartikel telah dikembangkan, salah satunya yaitu High energy ball milling (cara fisik) dan membran emulsi cair (Liquid
emulsion membrane).
High energy ball milling adalah suatu metode sintesis material yang telah berkembang pada proses industri. Metode ini telah berhasil membuat campuran logam dan fasa campuran pada tahun 1970-an. Pada penelitian nanomaterial, teknik ini sangat baik digunakan untuk mengatur ukuran partikel dalam skala nano. Beberapa jenis peralatan milling telah dikembangkan untuk tujuan yang berbeda, yaitu tumbler mills, attrition mills, shaker mills, vibratory mills, dan
planetarymills. Pada planetary micro mills, bola milling dan material dimasukan ke dalam wadah penggiling dan kemudian disentrifugasi, yang diatur dalam intensitas yang efisien. Wadah milling dan tiang cakram berputar ke arah yang berlawanan sehingga terjadi gesekan, bola milling bergerak di bagian dalam wadah milling, dan terjadi efek tumbukan, bola milling menumbuk dinding wadah dari arah berlawanan. Energi tersebut dihasilkan dari tumbukan yang lebih banyak
dari cara penggilingan konvensional. Menghasilkan kinerja milling yang sangat baik dalam waktu yang sangat singkat.
High energy ball milling adalah , jenis milling, atmosfir miling, media milling, bola sesuai ratio berat serbuk, waktu milling, suhu milling (Spinelnews, 2007).
Liquid emulsion membrane (LEM) pertama kali dikembangkan oleh Li at Exxon. Metode LEM pertama kali menjadi perhatian yaitu pada tahun 1970-an dan 1980-an. LEM memiliki sejumlah aplikasi dalam penghilangan dan recovery pada larutan. Saat ini, metode ini telah digunakan untuk sintesis nanopartikel dan makromolekul. Penggunaan fase internal untuk mengontrol ukuran partikel dan morfologi menjadi bidang sangat menarik belakangan ini. Prosesnya terdiri dari empat tahap utama, tahap pertama adalah pencampuran fasa larutan internal dengan fasa organik untuk membentuk emulsi minyak – air. Kemudian dicampur di dalam tempat pencampuran yang lebih besar dengan fasa larutan eksternal untuk membentuk emulsi air – minyak – air . fasa eksternal mengandung ion yang akan dikirim melewati membrane untuk bereaksi dengan fasa internal. Proses yang terjadi pada metode LEM dapat dilihat pada Gambar 1.
Gambar 1. Proses yang terjadi pada metode LEM
Transport ion logam terjadi melalui fasilitas transport menggunakan
emulsi umumnya digunakan sebagai pereaksi mikro. Tetesan emulsi internal berukuran mikro dianggap sebagai pemisah sedemikian rupa sehingga control ukuran partikel tidak tergantung pada keseluruhan larutan tetapi di dalam tetesan emulsi.
Salah satu keuntungan menggunakan metode LEM adalah dapat dirancang dengan selektivitas tinggi tergantung tujuan yang diinginkan, contohnya pada penghilangan litium dari campuran kalium dan natrium. Keuntungan lain menggunakan metode LEM adalah biaya operasional terjangkau selama layer organik (minyak) dapat digunakan kembali dan memiliki tingkat pemisahan yeng tinggi dari area permukaan. Hirui et.al, melaporkan bahwa metode LEM dapat digunakan untuk sintesis kalsium fosfat bulat (spherical) (Gupta, 2004).
Kondisi operasional yang optimum untuk setiap sistem berbeda dari setiap proses. Faktor – faktor seperti konsentrasi ion di kedua fasa, pH, dan suhu berperan besar dalam sifat produk. Salah satu kelemahan metode LEM yaitu emulsi bisa menjadi tidak stabil setelah kontak dengan feed solution dan pada pencampuran kecepatan tinggi (Gupta, 2004).
2.3. Precipitated Calcium Carbonate (PCC)
Precipitated Calcium Carbonate (PCC) sangat murni dan memiliki ukuran partikel yang sangat halus, sampai 0,05 m, terdiri dari campuran calcite dan
a. Meningkatkan kualitas cetak dengan merubah kehalusan dan penyerapan tinta.
b. Meningkatkan sifat-sifat fisik,tekstur dan stabilitas bentuk.
Dalam industri plastik PCC digunakan sebagai pengisi (filler) dalam komposit polimer seperti PVC plastis dan kaku, poliester tak jenuh, polipropilen, dan polietilen. PCC juga digunakan dalam pelapisan (coating). Opasitas pelapisan dipengaruhi oleh kehalusan dan distribusi ukuran partikel. PCC dapat meningkatkan sifat pelapisan seperti, tahan cuaca, anti korosi, sifat reologi, dan tahan gesek. PCC juga digunakan dalam bidang pertanian sebagai pupuk. Berguna untuk menstabilkan pH tanah. Juga digunakan sebagai suplemen kalsium pada makanan hewan (Gupta, 2004).
Kovacevic et.al menemukan bahwa CaCO3 nanokomposit memperlihatkan
sifat khas dan meningkatkan sifat-sifat dalam komposit polimer. Dalam matriks polyvinyl acetate (PVac), morfologi komposit bergantung pada ukuran partikel pengisi. Bentuk jaringan nanopartikel terdispersi di dalam matriks, dimana partikel dalam skala mikro berbentuk pulau. Qui et.al mempelajari aplikasi
CaCO3 nanopartikel sebagai aditif dalam minyak pelumas telah ditemukan bahwa
CaCO3 nanopartikel menunjukan kapasitas good load-carrying dan sifat mereduksi gesekan (Gupta, 2004).
Ada beberapa metode untuk sintesis nanopartikel. Pembuatan material nanofase dengan evaporasi gas adalah salah satu metodenya, yang diperkenalkan oleh Granqvist dan Burman. Adanya evaporasi termal telah diketahui membatasi metode ini untuk logam dan senyawa intermetalik. Keterbatasan ini dapat diatasi oleh Hahn dan Averback dengan mengganti sumber evaporasi termal dengan
sputtering source sehingga memungkinkan untuk sintesis nanopartikel. Ukuran partikel bergantung pada tekanan Ar pada ruang pengoperasian. Sedikit perubahan pada tekanan akan merubah ukuran partikel (Gupta, 2004).
Wong et.al mensintesis PCC berukuran nanometer (15-40 nm) menggunakan suspensi lime dalam reaktor berputar dan memiliki distribusi yang sangat terbatas. Tahapan terpenting dalam metode tersebut adalah pengaturan jumlah karbonasi yang terserap CO2, kemudian ditemukan pengontrolan dengan
dissolusi Ca(OH)2. Metode ini juga dikenal dengan Presipitasi Reaktif Multifase
Gravitasi Tinggi. Metode ini membutuhkan Centrifuge dengan akselerasi tinggi untuk membuat gravitasi yang besar melebihi gravitasi bumi. Dibutuhkan peralatan sintesis yang mahal. Wong et.al melaporkan bahwa bentuk (spherical
dan needle-like seperti ditunjukan pada Gambar 2 ) dan morfologinya dapat diatur (Gupta, 2004).
Tsuzuki et.al mensintesis CaCO3 nanopartikel menggunakan reaksi
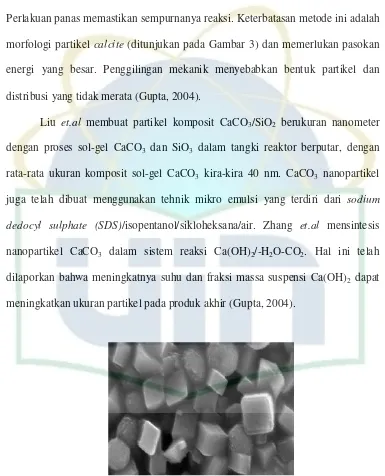
mechanochemical diikuti dengan perlakuan panas. Reaksi perubahan fasa padat akan terjadi selama penggilingan mekanik pada reaksi pencampuran serbuk. Perlakuan panas memastikan sempurnanya reaksi. Keterbatasan metode ini adalah morfologi partikel calcite (ditunjukan pada Gambar 3) dan memerlukan pasokan energi yang besar. Penggilingan mekanik menyebabkan bentuk partikel dan distribusi yang tidak merata (Gupta, 2004).
Liu et.al membuat partikel komposit CaCO3/SiO2 berukuran nanometer
dengan proses sol-gel CaCO3 dan SiO3 dalam tangki reaktor berputar, dengan
rata-rata ukuran komposit sol-gel CaCO3 kira-kira 40 nm. CaCO3 nanopartikel
juga telah dibuat menggunakan tehnik mikro emulsi yang terdiri dari sodium
dedocyl sulphate (SDS)/isopentanol/sikloheksana/air. Zhang et.al mensintesis nanopartikel CaCO3 dalam sistem reaksi Ca(OH)2/-H2O-CO2. Hal ini telah
dilaporkan bahwa meningkatnya suhu dan fraksi massa suspensi Ca(OH)2 dapat
meningkatkan ukuran partikel pada produk akhir (Gupta, 2004).
2.4. Sonokimia 2.4.1 Ultrasonik
Gelombang suara (bunyi) pada dasarnya mempunyai frekuensi dari yang rendah hingga tinggi, seperti ditunjukan pada Gambar 4. Berdasarkan kegunaannya dapat dibedakan menjadi : 1) bunyi yang bisa didengar oleh manusia (16 Hz-18 Hz): 2) ultrasonik konvensional (20 KHz-100 KHz); 3) sonokimia (20 KHz-2 MHz); 4) ultrasonik untuk diagnostik (5 MHz-10 MHz). Frekuensi yang lebih rendah dimana energi akustiknya lebih besar bisa menginduksi terjadinya kavitasi dalam cairan. Peristiwa kavitasi inilah yang dimanfaatkan untuk sonokimia. Sonokimia biasanya menggunakan frekuensi antara 20 dan 40 KHz karena daerah ini merupakan kisaran frekuensi yang umum digunakan pada peralatan laboratorium. Ultrasonik frekuensi tinggi mulai dari 5 MHz dan di atasnya tidak menghasilkan kavitasi dan kisaran frekuensi ini banyak digunakan di bidang kesehatan (Yulianti, 2008). .
Gelombang ultrasonik adalah gelombang suara yang memiliki frekuensi tinggi di atas ambang pendengaran manusia yaitu di atas 20 KHz, di mana pada
Gambar 4. Frekuensi gelombang suara
Jauh sebelum ultrasonik ditemukan pada umumnya untuk meningkatkan reaksi kimia yang terjadi hal yang dilakukan adalah dengan memvariasikan panas, tekanan, cahaya atau dengan menambahkan katalis. Para ilmuwan menemukan bahwa ketika gelombang ultrasonik melalui medium sebagai gelombang tekanan dapat meningkatkan terjadinya reaksi kimia. Hal tersebut dikarenakan gelombang suara ultrasonik yang melalui medium diubah menjadi gelombang tekanan yang kemudian mempengaruhi panas dan tekanan yang pada akhirnya dapat meningkatkan reaksi kimia yang terjadi (Gareth, 1995).
dapat menyebabkan perbedaan tekanan dan suhu yang tinggi sehingga dapat menciptakan pencampuran antara larutan yang cukup efektif (emulsi) (Gareth, 1995).
Perkembangan ultrasonik dimulai pada tahun 1880 ketika Curie menemukan efek dari piezoelektrik. Kelebihan dari material ini adalah ketika diberikan tegangan dengan frekuensi yang tinggi maka kristal dalam material tersebut akan mengubah energi listrik menjadi energi vibrasi mekanik (suara). Perkembangan dari material ini kemudian dijadikan sebagai transduser sebagai bagian yang penting dalam pembuatan alat ultrasonik dalam berbagai macam aplikasi.
Dalam perkembangannya gelombang ultrasonik dapat dipakai untuk menciptakan gelembung yang dapat menimbulkan berbagai macam efek yang salah satunya adalah mempercepat reaksi kimia. Hal tersebut dapat terjadi ketika gelombang ultrasonik pada frekuensi ultrasonik diterapkan pada sebuah objek (cairan homogen) maka adalah mungkin untuk menghasilkan reaksi kimia sebagai akibat dari efek gelombang akustik yang menghasilkan kavitasi yang lebih dikenal
dengan kavitasi akustik (Ariyandi, 2006).
2.4.2 Kavitasi Akustik
Kavitasi adalah proses terbentuknya gelembung mikro di dalam media
perantara dalam hal ini cairan akibat pengaruh gelombang ultrasonik yang
diberikan. Proses peregangan dan tekanan membuat gelombang kavitasi tersebut
mengecil dan membesar sebagaimana perubahan gradient tekanan yang terjadi
mana gelombang tersebut menghasilkan noda dan anti noda yang berhubungan
dengan tegangan dan regangan yang terjadi pada gelombang suara.
(Ariyandi, 2006).
Menurut teori hot spot, ketika kavitasi terbentuk maka akan mucul dua
jenis kavitasi, yang pertama adalah kavitasi stabil di mana terjadi perbedaan
tekanan yang dapat menyebabkan gelembung tersebut bertahan pada cairan
daripada mengalir ke permukaan, fenomena ini disebut akustik levitasi. Hal ini
berbeda dengan gelembung pada umumnya yang cenderung mengalir ke
permukaan di mana pergerakan gelembung mengarah ke tekanan yang lebih
rendah. Kavitasi yang juga terbentuk adalah kavitasi transien, di mana gelembung
yang terbentuk naik ke permukaan dan pecah akibat perbedaan tekanan dan
perbedaan suhu yang sangat tinggi (Brennen, 1995). Proses terjadinya kavitasi
ditunjukan pada Gambar 5, prosesnya diawali dengan terbentuknya gelembung
(bubble), diikuti dengan pertumbuhan gelembung (bubble grows), mencapai
ukuran yang tidak stabil (unstable size) dan akhirnya pecah (collapse) pada
temperature yang sangat tinggi (diatas 5000oC).
Ketika tekanan luar rendah, gelembung melebar dan luas permukaan
meningkat yang dapat menyebabkan gas/uap terdifusi ke dalam gelembung.
Hasilnya tekanan di dalam meningkat. Lalu ketika tekanan di luar meningkat lagi
maka ada tekanan di dalam yang kemudian menyebabkan gelembung pecah
menjadi ukuran yang lebih kecil. Pada saat yang sama, meningkatnya tekanan di
dalam akan memaksa gas/uap untuk berdifusi keluar cairan (Brennen, 1995).
Semakin lama siklus dari kavitasi tersebut maka kavitasi yang terbentuk
akan semakin banyak. Pertumbuhan dari kavitasi ini akan mencapai titik kritis
ketika secara efisien dapat menyerap energi dari iradiasi ultrasonik (ukuran kritis)
(Ariyandi, 2006).
2.4.3 Aplikasi Sonokimia
Salah satu aplikasi baru yang terpenting dari sonokimia adalah untuk
sintesis dan modifikasi material anorganik. Pada zat cair yang diiradiasi dengan
gelombang ultrasonik intensitas tinggi, kavitasi akustik membuat pecahnya
gelembung memproduksi pemanasan yang tinggi, tekanan tinggi, dengan waktu
yang singkat, kejadian ini membatasi Hot spot yang merangsang terjadinya reaksi
kimia berenergi tinggi. Hot spot ini memiliki suhu sampai 5000 oC, dan tekanan
sekitar 1000 atm. Dengan demikian manfaat dari kavitasi berarti memusatkan
energi bunyi yang tersebar kedalam kondisi yang khusus untuk membuat material
khusus dari prekursor terlarut (Suslick, et al, 1999).
Zat padat yang terbuat dari komponen berukuran nanometer sering
kelompok kecil yang memiliki struktur elektronik yang memiliki densitas yang
tinggi. Material nanostruktur telah menjadi sesuatu yang mutakhir, dan beberapa
metode telah dikembangkan untuk pembuatannya. Beberapa metode sintesis
material nanostruktur adalah :
a. Metode fasa gas ( molten metal evaporation, flash vacuum thermal,
and laser pyrolysis decomposition of volatile organometallics),
b. Metode fasa cair (reduction of metal halides with various strong
reductants, colloid techniques with controlled nucleation),
c. Penggabungan keduanya (synthesis of conventional heterogeneous
catalist on oxide supports, metal atom vapor deposition into
cryogenic liquids, explosive shock synthesis) (Suslick, et al 1999).
2.5. Struktur Kristal 2.5.1 Konsep Dasar
Kristal adalah padatan yang atom-atomnya, ion-ionnya, atau molekul-molekulnya berada dalam susunan tiga dimensi yang teratur. Kebanyakan logam bersifat kristalin, sedangkan kaca dan sebagian besar polimer bersifat amorphous. Terdapat dua jenis kristal, yaitu kristal tunggal (single crystal) dan polikristal, seperti dtunjukan pada Gambar 6. Kristal tunggal adalah suatu material dimana semua atom-atomnya tersusun sendiri dalam satu arah, sedangkan polikristal adalah suatu material yang tersusun atas beberapa kelompok atom atau butir
Beberapa sifat dari material kristalin tergantung dari struktur kristalnya, dimana atom-atom, ion-ion, dan molekul-molekulnya tersusun (Callister, 2007).
Gambar 6. Kristal tunggal dan polikristal.
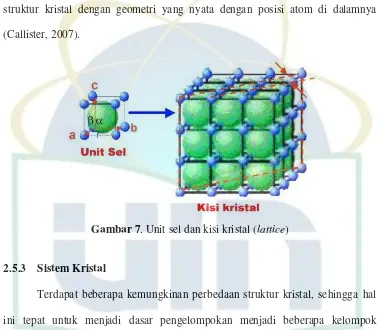
Ketika menggambarkan struktur kristal, atom-atomnya digambarkan dengan bola dengan diameter yang telah ditentukan. Gambaran tersebut dikenal dengan model bola atom banyak (atomic hard sphere model), yang mana bola-bola tersebut menggambarkan atom-atom dari jarak terdekat yang saling bersentuhan, seperti ditunjukan pada Gambar 7. Dalam hal ini semua atom identik, terkadang istilah kisi (lattice) digunakan dalam konteks struktur kristal; kisi adalah susunan titik-titik dalam ruang tiga dimensi sedemikian rupa sehingga setiap titik memiliki lingkungan yang sama (Callister, 2007).
2.5.2 Unit Sel
ditunjukan pada Gambar 7. Unit sel untuk kebanyakan struktur kristal adalah bidang sejajar atau prisma yang memiliki tiga bidang muka (face) yang sejajar yang digambarkan dengan bola, yang dalam hal ini membentuk kubus. Unit sel merupakan unit struktur dasar atau blok penyusun struktur kristal dan menegaskan struktur kristal dengan geometri yang nyata dengan posisi atom di dalamnya (Callister, 2007).
Gambar 7. Unit sel dan kisi kristal (lattice)
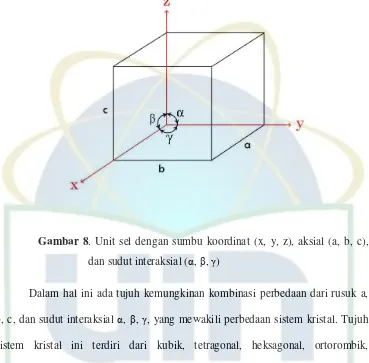
2.5.3 Sistem Kristal
Terdapat beberapa kemungkinan perbedaan struktur kristal, sehingga hal
Gambar 8. Unit sel dengan sumbu koordinat (x, y, z), aksial (a, b, c), dan sudut interaksial ( , , )
Tabel 1. Hubungan sistem kristal dengan parameter kisi
Sistem kristal Parameter kisi Kisi Bravais
Kubik a = b = c , = = = 90o Simple Body-centered
Face-centered Tetragonal a = b c , = = = 90o Simple Body-centered
Ortorombik a b c , = = = 90o Simple Body-centered
Base-centered Face-centered
Rombohedral (Trigonal) a = b = c , = = 90o Simple
Heksagonal a = b c , = = 90o , = 120 o Simple
Monoklinik a b c , = = 90o, Simple Base-centered
Triklinik a b c , 90o Simple
2.5.4 Bidang Kristalografi (Indeks Miller)
Orientasi bidang dari struktur kristal telah digambarkan dengan cara yang sama, yaitu dengan dasar unit sel dengan sistem tiga sumbu koordinat, seperti yang ditunjukan pada Gambar 8.
Seluruh sistem kristal, kecuali heksagonal, bidang kristalografinya ditetapkan dengan tiga Indeks Miller, yaitu h, k, dan l. Seperti ditunjukan pada Gambar 9. Prosedur untuk menentukan Indeks Miller adalah sbb :
1 1
1 1
1
2) Tentukan titik potong antara bidang dan sumbu : 1, 1, 3) Tentukan kebalikannya : => 1, 1, 0 4) Tentukan kelipatan terkecil (faktorisasi) : (110)
Gambar 9. Bidang kristalografi (Indeks Miller)
2.6. X-Ray Diffraction (XRD)
Sinar-X ditemukan pertama kali oleh seorang fisikawan Jerman bernama Rontgen pada tahun 1895 pada saat sedang melakukan percobaan dengan
ultraviolet dalam spektrum gelombang elektromagnetik. Gambar 10. memperlihatkan spektrum gelombang elektromagnetik.
Gambar 10. Spektrum gelombang elektromagnetik.
Adanya struktur kristal dapat dibuktikan dengan analisis difraksi sinar-X. berkas gelombang elektromagnetik yang mengenai kristal mengalami difraksi sesuai dengan hukum fisika. Penggunaan sinar-X sebagai sumber dalam proses difraksi untuk meyelidiki struktur kristal material dikarenakan sinar-X adalah spektrum gelombang elektromagnetik yang memiliki panjang gelombang 0,1- 100 Å. Panjang gelombang ini seorde dengan jarak antar atom pada kristal sehingga cahaya yang datang akan didifraksikan oleh atom-atom dalam kristalnya. Jika digunakan cahaya yang panjang gelombangnya tidak seorde maka cahaya yang datang tidak akan terdifraksi dan struktur kristalnya tidak dapat diketahui (Cullity, 2001).
digunakan untuk XRD berbeda dengan yang digunakan untuk keperluan medis. Untuk keperluan medis menggunakan soft x-ray dengan panjang gelombang 10 - 50 Å, sedangkan untuk XRD menggunakan panjang gelombang 0,5 - 2,5 Å (Sumhaeni, 2005).
Ketika berkas sinar-X menumbuk permukaan kristal membentuk sudut , maka akan dihamburkan oleh lapisan atom pada permukaan. Berkas sinar-X yang tidak dihamburkan menembus ke lapisan atom kedua dimana berkas dihamburkan lagi, dan berlanjut sampai ke lapisan ketiga (Gambar 11.) (Skoog, 1998). Jika panjang gelombang hamburan sinar-X tidak berubah (foton sinar-X tidak kehilangan banyak energi) dinamakan hamburan elastik (hamburan Thompson) dan terjadi transfer momentum dalam proses hamburan (Afandi, 2006). Persyaratan untuk difraksi sinar-X adalah, ruang antar lapisan atom harus keras dan pusat hamburan harus terdistribusi meregang (Skoog, 1998).
Pada tahun 1912 W.L. Bragg mempelajari difraksi sinar-X oleh kristal seperti ditunjukan pada Gambar 11. Disini terlihat bahwa berkas tipis radiasi menumbuk permukaan kristal membentuk sudut , terjadi hamburan sebagai
konsekuensi terjadinya interaksi radiasi dengan atom pada posisi O, P, dan R. Jika jarak AP + PC = n dimana n adalah integer, radiasi yang dihamburkan akan berada pada O, C, D, dan kristal akan memantulkan radiasi sinar-X. Sedangkan AP = PC = d sin dimana d adalah jarak antar bidang kristal. Sehingga kita dapat menuliskan sebuah persamaan sebagai berikut :
n = 2d sin
h2 a2 1
d2
k2 l2 n : nomor orde hamburan
: panjang gelombang
: sudut difraksi yang menggambarkan posisi puncak d : jarak antar bidang
Persamaan tersebut dikenal dengan persamaan Bragg dan merupakan pokok yang sangat penting dalam XRD. Perlu dicatat bahwa pantulan sinar-X dari kristal
terjadinya jika hanya sudut yang terjadi memenuhi kondisi berikut, Sin = n / 2 d (Skoog 1998). Dalam pola difraksi XRD, sudut difraksi yang
ditampilkan adalah 2 , dikarenakan sudut datang dianggap sama dengan sudut difraksi.
Gambar 11. Proses Difraksi sinar-X.
Parameter kisi dapat dihitung dengan menggunakan prinsip persamaan jarak antar bidang, yaitu :
h
Derajat kristalinitas yaitu besaran yang menyatakan banyaknya kandungan
kristal dalam suatu material dengan membandingkan luasan kurva kristal dengan total luasan amorf dan kristalit. Derajat kristalinitas dihitung menggunakan parameter Full Width at Half Maximum (FWHM), ditunjukan pada Gambar 12. Fraksi luas kristal atau amorf dihitung dengan mengkalikan FWHM (B) dengan intensitas. FWHM dianggap sebagai setengah alas dan intensitas sebagai tingginya (Nurmawati, 2007).
FWHM (B) =
Fraksi luas kristal = B kristal Intensitas
K Bcos D
Gambar 12. Full Width at Half Maximum (FWHM)
Perhitungan ukuran kristal digunakan Persamaan Scherrer yaitu
Di mana D merupakan diameter rata-rata, K merupakan faktor keadaan, B merupakan perluasan full width at half maximum (FWHM) puncak difraksi yang dihitung dalam radian, merupakan panjang gelombang sinar-x dan merupakan
sudut difraksi Bragg (Skoog 1998).
2.7. Scanning Electron Microscope(SEM)
Scanning Electron Microscope (SEM) adalah alat deteksi yang menggunakan sinar elektron berenergi tinggi untuk melihat objek pada skala yang sangat kecil. Scanning Electron Microscope (SEM) memberikan penjelasan yang detail dari suatu permukaan, memberikan informasi mengenai ukuran dan bentuk dan ukuran dari suatu nanopartikel (Afandi, 2006).
mudah. Kombinasi dari perbesaran kedalaman jarak fokus, resolusi yang bagus, dan persiapan yang mudah, membuat SEM merupakan alat yang sangat penting untuk digunakan dalam penelitian saat ini, skema SEM ditunjukan pada Gambar 13.
SEM terdiri dari dua bagian utama, yaitu konsol elektronik dan kolom electron. Pada konsol terdapat tombol-tombol yang berguna untuk mengatur fokus, perbesaran, dan intensitas gambar pada tampilan layar. Kolom merupakan tempat berkas elektron dihasilkan, difokuskan ke suatu titik kecil dan di scan melewati sampel untuk membuat sinyal yang dapat mengontrol intensitas gambar pada layar. Di bawah ini adalah komponen-komponen penyusun SEM :
a. Penembak elektron (Electrongun)
Sumber elektron ditempatkan pada bagian atas kolom dimana elektron diemisikan dari kawat tungstein dan diakselerasikan melewati kolom vakum. Tiga komponen penghasil elektron yaitu, kawat pijar (filament), wehnelt yang berguna mengatur jumlah elektron yang dikeluarkan, dan anoda yang mempercepat electron pada tegangan 0,2 –
40 kV, vakum minimal mendekati 10-5 torr, karena elektron hanya dapat melaju dalam jarak pendek di udara.
b. Lensa elektron (Electron lens)
c. Sistem scanning (Scanningsystem)
Gambar dibentuk dengan melewatkan berkas elektron pada permukaan sampel dengan cara yang sama dengan yang terjadi pada tabung sinar-x. koil scan yang berada pada lensa objektif berguna untuk membelokan berkas elekron.
d. Celah objektif (Objectiveaparture)
Plat tebal (dari platinum atau molybdenum) dengan lubang kecil berdiameter 50 – 170 µm ditempatkan pada lensa objektif. Celah ini berguna untuk membatasi pelebaran berkas elektron sehingga mengurangi penyimpangan meningkatkan kedalaman pada gambar.
e. Ruang sampel (Specimen chamber)
Ruang kosong dibawah lensa objektif berisi tempat sampel (holder) yang berdekatan dengan detektor dan sistem vakum.
f. Detektor elektron (electron detector)
Detektor elektron sensitif dengan elektron terpantul (backscattered
elecron) dan elektron kedua (secondary electron). Elektron terpantul cukup berenergi untuk langsung tertarik ke detektor, sedangkan elektron kedua tertarik ke detektor dengan positive charge yang berada di depan detektor. Kedua berkas elektron tersebut diteruskan ke layar scintillator dimana kedua elektron tersebut menghasilkan cahaya yang diperjelas oleh tabung photomultiplier untuk menghasilkan sinyal elektron yang akan digunakan untuk mengatur intensitas gambar pada layar.
Sistem vakum pada kebanyakan instrumen SEM dihasilkan dengan pompa difusi menggunakan pompa mekanik. Pompa mekanik dan sistem klep digunakan untuk memvakumkan sistem, karena pompa difusi hanya dapat beroperasi dalam keadaan vakum (Gabriel, 1992).
Gambar 13. Skema Scanning Electron Microscope (SEM)
a
.
elektron sekunder (secondary electrons), b.
elektron terpantul (backscattered electrons), c.
Auger electrons,d
.
Karakteristik sinar-X (characteristic x-ray), dan e.
foton dengan energi yang berbeda-beda.Gambar 14. Sinyal – sinyal emisi pada SEM
Sinyal-sinyal ini berasal dari volume terkecil yang disebut volume emisi spesifik dari sampel dan dapat digunakan untuk mengetahui beberapa karakteristik dari sampel seperti: komposisi, topografi permukaan, kristalografi.
Proses kerja SEM ditunjukan pada Gambar 15. Penembak elekron (electron gun) menghasilkan pancaran elektron monokromatis. Lensa pemfokus pertama menghasilkan pancaran dan batas arus, pada celah lensa berfungsi untuk mengurangi pembelokan sudut. Lensa pemfokus kedua membentuk pelemahan (pancaran sinar koheren), celah lensa dikendalikan untuk mengurangi pembelokan sudut dari pancaran lensa pertama.
Gambar 15. Proses Kerja Scanning Electron Microscope (SEM)
2.8. Rietveld Analysis (Rietan)
Rietveld Analysis (Rietan) adalah merupakan suatu paket perangkat lunak (sofware) komputer yang telah dikembangkan penggunaannya dalam metode
Rietveld untuk menganalisis data difraksi neutron maupun difraksi sinar-x.
Dalam metode difraksi, analisis yang paling ideal adalah menggunakan cuplikan kristal tunggal. Namun pada prakteknya sering ditemukan kesulitan dalam menemukan kristal tunggal dikarenakan biaya yang sangat tinggi, dan untuk mengatasi hal tersebut biasanya digunakan cuplikan serbuk polikristal. Sekarang problem yang dihadapi dalam penggunaan cuplikan serbuk polikristal adalah hilangnya sebagian informasi yang penting akibat saling bertumpuknya beberapa puncak difraksi, sehingga hasil percobaannya kurang teliti dan akurat. Untuk mengatasi hal ini, digunakan metode Rietvield. Keunggulan metode
Rietvield dibandingkan dengan metode lain (database Joint Commite Powder Diffraction Standar), adalah dapat menganalisis dan memisahkan puncak-puncak pola difraksi yang saling bertumpuk dan kompleks.
Prinsip dasar analisis Rietvield adalah mencocokan (fitting) profil puncak perhitungan terhadap profil puncak pengamatan. Pencocokan profil tersebut dilakukan dengan menerapkan prosedur perhitungan kuadrat terkecil non linier yang diberi syarat batas. Jadi analisis Rietvield tidak lain adalah problem optimasi fungsi non linier dengan pembatas (constrains). Sehingga meminimumkan fungsi
objektif, yang dapat dinyatakan dalam persamaan berikut :
dimana wi adalah faktor bobot, yi(o) adalah intensitas pengamatan (observation)
dan yi(c) adalah intensitas perhitungan (calculation) (Adi, 2009)
BAB III
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian Tugas Akhir
Penelitian ini dilakukan selama delapan bulan yang dilaksanakan dari bulan Juli 2008 sampai dengan bulan Maret 2009, dilaksanakan setiap hari kerja yaitu dari hari Senin sampai Jum’at. Penelitian tugas akhir ini dilakukan di Pusat Teknologi Bahan Industri Nuklir (PTBIN) Badan Tenaga Nuklir Nasional (BATAN) kawasan PUSPIPTEK Serpong.
3.2 Alat dan Bahan 3.2.1 Alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah gelas beaker, batang pengaduk, cawan petri, buret, neraca analitik, oven, dan ultrasonic probe
(Sonics Vibracell), centrifuge (Medifriger,BL-s P-Selecta), SEM Coating Units
(Taab SEM S500).
Karakterisasi pada penelitian ini menggunakan X-Ray Diffraction (XRD)
Phillips PW 2213/30 dan Analytical Scanning Electron Microscope (SEM) JEOL JSM 6510 LA.
3.2.2 Bahan yang digunakan
Bahan-bahan yang digunakan dalam percobaan ini adalah CaCl2 (p.a),
3.3 Diagran Alir Penelitian
Pada Gambar 16 ditunjukan diagram alir penelitian. Dimulai dengan penelusuran literatur dan penyusunan proposal, kemudian memasuki tahapan kerja, dibuat larutan jenuh CaCl2 dan Na2CO3, kemudian direaksikan melalui
3.4.1 Pembuatan larutan CaCl2 dan NaCO3
Dibuat larutan CaCl2 jenuh sebanyak 100 ml dengan cara melarutkan
CaCl2 serbuk kedalam 100 ml aquadest hingga jenuh. Dengan cara yang sama
dibuat juga larutan Na2CO3 jenuh sebanyak 100 ml. Untuk mencapai kejenuhan
dibutuhkan 60 gram CaCl2 dan 30 gram Na2CO3.
3.4.2 Proses Presipitasi CaCO3dengan Sonokimia
Ditempatkan larutan Na2CO3 jenuh dan CaCl2 jenuh masing-masing
sebanyak 15 ml ke dalam wadah beaker glass. Dimasukan alat ultrasonic probe ke dalam larutan Na2CO3, diatur besar amplitudo 40% dan dinyalakan. Kemudian
dituangkan larutan CaCl2 ke dalam larutan Na2CO3. Waktu sonokimia
divariasikan, yaitu 0, 30, 60, 90, 120, 150, dan 180 menit. Diagram skematik proses presipitasi dengan Sonokimia ditunjukan pada Gambar 17.
Persamaan reaksi : Na2CO3 + CaCl2 CaCO3 + 2NaCl
Keterangan : 1) Statif
2) Larutan CaCl2 jenuh
3) Ultrasonik Probe
4) Panel control Ultrasonik 5) Larutan Na2CO3 jenuh
6) Wadah batu es 7) Penyangga
3.4.3 Pencucian Sampel
Sampel CaCO3 yang telah terbentuk dicuci dengan aquadest untuk
menghilangkan NaCl yang terbentuk selama reaksi berlangsung. Setelah dicuci diendapkan kembali menggunakan Centrifuge dengan kecepatan 9000 rpm selama 15 menit. Proses pencucian dilakukan sebanyak 4 kali untuk meyakinkan tidak ada NaCl tersisa. Keberadaan NaCl pada sampel CaCO3 diuji dengan
menggunakan larutan AgNO3. Sampel CaCO3 yang telah bersih dari NaCl
dikeringkan di dalam oven 150 oC selama ± 60 menit dan disimpan di dalam
wadah plastik.
3.4.4 Karakterisasi dengan X ray Diffraction (XRD)
!" # $ %&'%() * +
+ ' ',° + ' %
- . / 0
- .
Karakterisasi dilakukan dengan langkah-langkah berikut : 1. Disiapkan sampel CaCO3 yang sudah dikeringkan ± 2 gram.
2. Sampel dimasukkan ke dalam sample holder berukuran 2 x 2 cm2. 3. Sample holder dikaitkan pada lingkar diffraktometer.
4. Pada komputer diset nama sampel, sudut awal, sudut akhir, dan kecepatan analisis, kemudian di-run.
3.4.5 Karakterisasi dengan Scanning Electron Microscope (SEM)
Pada pengukuran menggunakan SEM, sampel haruslah merupakan zat yang dapat menghantarkan arus listrik seperti halnya logam, karena CaCO3 tidak
dapat menghantarkan arus listrik maka sebelum dianalisis terlebih dahulu dilapisi logam. Logam emas lebih disukai karena emas merupakan logam inert dan bersifat konduktif. Preparasi sampel dengan SEM dilakukan sebagai berikut :
1. Sampel dilekatkan diatas stube menggunakan carbon doubletape.
2. Kemudian sampel dilapisi dengan lapisan emas dengan menggunakan alat
SEM coatings unit dengan metode sputtering coating selama 3 menit (Gabriel, 1992)
3.4.6 Uji Statistik Korelasi Pearson
Data yang diperoleh dari hasil analisis ukuran kristal CaCO3 kemudian
diinput ke dalam program SPSS 16 menggunakan Korelasi Pearson untuk diuji hubungan antara waktu sonokimia terhadap ukuran kristal. Adapun langkah-langkahnya sebagai berikut :
1. Input data yang terdiri dari dua variabel, kolom 1 sebagai variabel x (waktu sonokimia) dan kolom 2 sebagai variabel y (ukuran kristal) . 2. Klik analyze correlate Bivariate
3. Pindahkan kedua variabel ke dalam box variables 4. Centang koefisien Korelasi Pearson, klik OK
BAB IV
HASIL DAN PEMBAHASAN
4.1. Analisis Kualitatif Pola XRD Sampel CaCO3
Pada Gambar 19 dapat dilihat puncak-puncak difraksi hasil sampel
(CaCO3). Tampak dalam gambar pola difraksi sinar-x sampel CaCO3 hasil
penelitian terjadi beberapa puncak, tiga puncak tertinggi (intensitas besar) yaitu pada sudut 2 : 29,52 ; 48,58 ; 47,58. Mengacu pada referensi , puncak difraksi 29,52 dihasilkan oleh bidang 104, puncak difraksi 48,58 dihasilkan oleh bidang 116 dan puncak difraksi 47,58 dihasilkan oleh bidang 018. Referensi diambil dari
data calcium carbonate calculated from Inorganic Crystal Structure Database
(ICSD) using POWD-12++, (1997) maslen, E.N., streltsov, V.A., streltsova, N.R.,
Acta crystallography., Sec.B; structural science, 49, 636 (1993) dimana puncak terjadi pada sudut 2 : 29,394 (bidang 104) ; 48,494 (bidang 116) ; 47,499 (bidang 018). Kesesuaian nilai-nilai puncak difratksi hasil penelitian dengan puncak difraksi pada referensi mengindikasikan bahwa sampel yang dibuat dengan proses
sonokimia pada penelitian ini adalah CaCO3. Ketiga puncak difraksi tertinggi
tersebut kemudian digunakan untuk analisis perhitungan ukuran kristal sampel
CaCO3 dengan menggunakan persamaan Scherrer.
0
CaCO3. Hasil refinement tersebut kemudian digambarkan menggunakan program
grafik IGOR Pro Wavemetrics dan diperoleh kurva pola difraksi sinar-x hasil pengukuran (observasi) yang telah difitting dengan pola difraksi sinar-x hasil
perhitungan (kalkulasi) dari sampel CaCO3.
Gambar 19. Difraktogram CaCO3 (atas) standar ICSD, dan hasil penelitian (bawah).
Gambar 20 adalah pola difraksi sinar-x sampel CaCO3 hasil refinement
1400
atau indeks Miller ditunjukkan dengan simbol bar (I) berwarna hitam, dan kurva selisih antara hasil observasi dengan kalkulasi ditunjukkan dengan simbol line (-) berwarna biru. Kurva selisih ini yang kemudian digunakan untuk menunjukkan kualitas hasil fitting dari pola difraksi sinar-x hasil observasi dan simulasi. Semakin datar atau semakin lurus kurva selisih ini, maka kualitas fitting semakin baik.
Gambar 20. Hasil refinement dari pola difraksi sinar-x sampel CaCO3.
4.2. Analisis ukuran kristal sampel CaCO3
Dalam analisis ukuran kristal sampel CaCO3, pola difraksi sinar-x
dianalisis menggunakan program Microcal Origin 3.5 scientific and technical
graphics dan program Rietvield Analysis (RIETAN) untuk menentukan ukuran kristal CaCO3. Full Width at Half Maximum (FWHM) dari hasil pola difraksi
Dimana :
D = Diameter kristal K = Konstanta Scherrer = Panjang gelombang B = FWHM (radian) sinar-x
= Sudut diffaksi Bragg
Tabel 2. Ukuran kristal sampel CaCO3 dengan varisasi waktu sonokimia. Ukuran kristal (nm)
Ukuran kristal sampel CaCO3 dengan varisasi waktu sonokimia dapat
dilihat pada Tabel 2. Ukuran kristal sampel CaCO3 hasil análisis menggunakan
Microcal Origin, menurun seiring meningkatnya waktu sonokimia. Ukuran kristal sampel CaCO3 pada waktu sonokimia 0 menit (blanko) sebesar 45,17103 nm, dan
terus mengalami penurunan dengan meningkatnya waktu sonokimia. Ukuran kristal sampel CaCO3 terkecil terjadi pada waktu sonokimia 180 menit, yaitu
dengan varisasi waktu sonokimia hasil análisis menggunakan program RIETAN. Ukuran kristal sampel CaCO3 menurun seiring meningkatnya waktu proses
sonokimia. Ukuran kristal sampel CaCO3 pada waktu sonokimia 0 (blanko) menit
sebesar 63,1376 nm, dan terus mengalami penurunan dengan meningkatnya waktu sonokimia. Ukuran kristal sampel CaCO3 terkecil terjadi pada waktu sonokimia
180 menit, yaitu sebesar 43,13037 nm. Terdapat satu data hasil pengukuran yang menyimpang, yaitu pada waktu sonokimia 60 menit. Ukuran kristal sampel
CaCO3 mengalami kenaikan dari 43,32310 nm (pada waktu sonokimia 30 menit)
menjadi 47,74511 nm untuk hasil pengolahan data menggunakan Microcal
Origin, dan dari 60,46959 nm (pada waktu sonokimia 30 menit) menjadi 67,59576 nm untuk hasil pengolahan data menggunakan program RIETAN. Hal tersebut mungkin disebabkan kesalahan dalam proses preparasi sampel.
Terjadinya penurunan ukuran kristal pada sampel CaCO3 disebabkan
karena semakin lama waktu sonokimia maka makin banyak gelembung kavitasi yang terbentuk. Pecahnya gelembung kavitasi memperluas permukaan zat padat menjadi non-sperik dan menimbulkan shockwave. Kavitasi dan shockwave dapat membuat pergerakan partikel-partikel zat padat menjadi lebih cepat. Tumbukan antar partikel yang dihasilkan menyebabkan perubahan yang signifikan di dalam
morfologi permukaan, komposisi, dan reaktivitas [Suslick, et al, 1999]. CaCO3
yang terbentuk selama reaksi berlangsung akan terus menerus mengalami tumbukan antar partikelnya yang disebabkan oleh gelombang ultrasonik, sehingga menyebabkan perubahan ukuran kristal menjadi lebih kecil. Perubahan ukuran
kristal sampel CaCO3 dapat dilihat pada Gambar 21
Persentase penurunan ukuran kristal sampel CaCO3 dengan varisasi waktu
sonokimia dapat dilihat pada Tabel 3. Penurunan ukuran kristal pada waktu 0
menit sebesar 0 %, hal ini disebabkan sampel CaCO3 berupa blanko dan tidak
melewati proses sonokimia. Pada saat waktu sonokimia 30 menit mulai terjadi penurunan persentase sebesar 4,10 % untuk hasil pengolahan data dengan menggunakan Microcal Origin dan 4,22 % untuk hasil pengolahan data dengan program RIETAN., dan terus mengalami penurunan sampai pada waktu sonokimia
180 menit. Persentase terbesar penurunan ukuran kristal sampel CaCO3 terjadi
pada saat waktu sonokimia 180 menit yaitu sebesar 25,98 % untuk hasil pengolahan data dengan menggunakan Microcal Origin dan 31,69 % untuk hasil pengolahan data dengan program RIETAN.
Pada penelitian ini, peneliti juga mencoba melakukan pembuatan CaCO3
dengan cara lain, yaitu dengan meneteskan larutan kalsium klorida (CaCl2) ke dalam natrium karbonat (Na2CO3) dengan variasi jumlah tetesan 2, 4 dan 6 tetes,
waktu sonokimia dibuat tetap yaitu 180 menit, mengacu pada hasil terbaik yang
didapat pada pengaruh waktu sonokimiaterhadap ukuran kristal. Hal ini dilakukan untuk melihat pengaruh jumlah tetesan CaCl2 terhadap ukuran kristal CaCO3dan juga sebagai additional data. Ukuran kristal sampel CaCO3 dengan varisasi
jumlah tetesan per menit dengan waktu sonokimia 180 menit dapat dilihat pada lampiran 9. Terlihat pada tabel, ukuran kristal sampel CaCO3 menurun seiring
berlangsung dengan perlahan dan lebih homogen, sehingga kemungkinan terbentuk ukuran kristal yang lebih kecil. Namun hasil yang terjadi sebaliknya, ukuran kristal semakin kecil seiring bertambahnya jumlah tetesan per menit, hal ini bisa terjadi dikarenakan jika dengan menggunakan tetesan, reaksi berlangsung secara bertahap sehingga pasokan energi sonokimia yang diterima menjadi tidak merata antara reaksi yang berlangsung sejak awal dengan reaksi yang berlangsung belakangan
4.3. Analisis Mikrograf Sampel CaCO3 menggunakan Scanning Elektron Microscopy (SEM)
Hasil analisis dengan menggunakan SEM untuk sampel CaCO3 dapat
dilihat pada Gambar 22. Terlihat pada gambar 22 (a) bahwa sampel CaCO3
dengan waktu sonokimia 60 menit partikel-partikelnya berbentuk kubus dengan
ukuran yang cukup merata dan homogen dengan prediksi ukuran per partikel ± 3 µm..
Pada sampel CaCO3 dengan waktu sonokima 120 menit (Gambar 22 b),
partikel-partikelnya berbentuk kubus yang berukuran lebih kecil bila dibandingkan dengan sampel CaCO3 dengan waktu sonokimia 60 menit, dengan
(a) Sampel CaCO3 dengan waktu sonokimia 60 menit.
(b)Sampel CaCO3 dengan waktu sonokimia 120 menit.
(c) Sampel CaCO3 dengan waktu sonokimia 180 menit.
Pada sampel CaCO3 dengan waktu sonokima 180 menit (Gambar 22 c),
partikel-partikelnya semakin bertambah kecil bila dibandingkan dengan sampel
CaCO3 dengan waktu sonokimia 60 dan 120 menit, dengan prediksi ukuran per
partikel < 1 µm. Hasil analisis SEM ketiga variasi waktu sonokimia tersebut menunjukan ukuran partikel yang lebih kecil dan bentuk partikel yang lebih yang lebih homogen bila dibandingkan dengan CaCO3 blanko (ditunjukan pada
Gambar 23). Hasil analisis SEM ini juga dapat memperkuat hasil analisis XRD yang menunjukan bahwa semakin lama waktu sonokimia maka akan semakin memperkecil ukuran kristal CaCO3 karena menurunnya ukuran partikel
mengindikasikan menurunnya ukuran kristal.
4.4. Hasil Pengujian Statistik
Pengujian statistik dilakukan dengan program SPSS 16 menggunakan Uji Korelasi Pearson untuk mencari hubungan antara waktu sonokimia terhadap
ukuran kristal CaCO3. Output yang dihasilkan dapat dilihat pada Tabel 4 dan 5 di
bawah ini.
Tabel 4. Deskripsi Statistik
Mean Std. Deviation N
Waktu Sonokimia (menit) 90.00 64.807 7
Ukuran Kristal CaCO3 (nm) 4.0850413E1 5.23342499 7
Tabel 5. Korelasi Pearson Pearson Correlation 1 -.883**
Sig. (1-tailed) .004
Waktu Sonokimia (menit)
N 7 7
Pearson Correlation -.883** 1
Sig. (1-tailed) .004 Ukuran Kristal CaCO3 (nm)
N 7 7
Interpretasi output:
• Nilai signifikansi 0.004 < 0.05 menunjukkan bahwa terdapat hubungan
yang signifikan antara waktu sonokimia terhadap ukuran kristal CaCO3.
• Koefisien korelasi bernilai - 0.883 (bertanda minus), menunjukkan arah
Berdasarkan hasil pengujian statistik menggunakan Korelasi Pearson yang
ditunjukan pada Tabel 5, didapat nilai signifikansi 0,004 yang artinya, terdapat hubungan yang signifikan antara waktu sonokimia terhadap ukuran kristal
CaCO3. Sedangkan hubungannya dapat dilihat dari nilai koefisien Korelasi
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat ditarik beberapa kesimpulan, di antaranya adalah :
1. Peningkatan waktu sonokimia pada pembuatan CaCO3 semakin
memperkecil ukuran kristal CaCO3.
2. Waktu sonokimia berpengaruh signifikan terhadap ukuran kristal CaCO3, dimana nilai signifikansi pada uji Korelasi Pearson sebesar
0,004 yang jauh dibawah (0,05) sehingga hipótesis nol (Lamanya waktu sonokimia berpengaruh terhadap ukuran kristal CaCO3) pada
penelitian ini diterima.
3. Arah hubungan antara waktu sonokimia dengan ukuran kristal CaCO3. bernilai – 0,884 sehingga semakin lama waktu sonokimia
5.2. Saran
DAFTAR PUSTAKA
Adi, Wisnu Ari. 2009. Analisis Fasa dan Struktur Mikro Paduan Sistem Mg-Ni dan Mg-Al Untuk Aplikasi Hygrogen Storage. Badan Tenaga Nuklir Nasional : Tangerang.
Affandi, S. 2006. Sintesa dan Karakterisasi Partikel Magnetik Submikron Berbasis Oksida Fe dan Polimer Polilaktat (PLA). Skripsi. Institut Pertanian Bogor : Bogor.
Alger, Mark S.M. 1989. Polymer Science Dictionary. Elsevier Applied Science : London and New York.
Anonimous. 2008. Calcium Carbonate. The Columbia Encyclopedia, sixth edition.
Anonimous. Electroacoustic Behaviour of Calcium Carbonate. Colloidal Dinamics Inc.
Anonimous. Nanoparticle Technology program. Industrial Partnership for Research in Interfacial and Material Engineering (IPRIME). University of Minnesota.
Ariyandi, Nono. 2006. Pembuatan Nanosfer Berbasis Biodegradable Polilaktat dengan Metode Sonofikasi. Skripsi. Institut Pertanian Bogor : Bogor
B.D. Cullity. 2001. Element of X ray diffraction 3rd edition. Addition Wesley Publishing Company Inc.: London.
Brennen, C.E. 1995. Cavitation and Bubble Dynamics. California Institute of Technology. Oxford University Press : New York. Callister, William. D, Jr. 2007. Materials Science and Engineering an
Douglas A. Skoog et. al. 1998. Principles of Instrument Analysis 5th edition. Harcourt Brace College Publisher : USA
Gabriel, B.L. 1992. SEM : A User’s Manual for Materials Science. American Society for Metals : USA
Gareth, J.P. 1995. Ultrasonically Enhanced Polymer Synthesis. Elsevier Ultrasonic Chemistry.
Gupta, R. 2004. Synthesis of Precipicated Calcium Carbonate Nanoparticles Using Modified Emulsion membranes. Thesis. Georgia Institute of Technology.
Izumi, F. 1989. Rietvield Analysis System “ RIETAN” Part I, A Software Package for The Rietvield Analysys and Simulation of X-Ray and Neutron Diffraction Patterns.
Miura, Y. 2007. Formations of CaCO3 by Natural and Artificial
Shockwave Impact. Yamaguchi University : Japan.
Nurmawati, M. 2007. Analisis Derajat Kristalinitas, Ukuran Kristal, dan Bentuk Partikel Mineral Tulang Manusia Berdasarkan Variasi Umur dan Jenis Tulang. Skripsi. Institut Pertanian Bogor : Bogor. Sofyan, Bondan.T. 2007. Cristallography. Lecture Notes. Department of Metallurgy and Materials Engineering, Faculty of Engineering, University of Indonesia : Depok
Sumhaeni. 2005. Pembuatan dan Karakterisasi Kristalografi Bubuk dan Lapisan Tipis PZT Doping Indium. Skripsi. FMIPA. Universitas Indonesia : Depok.
Suslick. S.K. 1994. The Chemistry of Ultrasound. The Yearbook of Science and The Future. Encyclopedia Britannica. Page 138-155. Suslick. S.K, M.M. Fang T. Hyeon, M.M. Mdleleni. 1999. Application of