STUDI PEMANFAATAN KALSIUM KARBONAT (CaCO
3)
DARI SERBUK CANGKANG TELUR SEBAGAI
ADSORBEN TERHADAP ION RAKSA (Hg
2+)
SKRIPSI
IRWANTO
090802004
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
STUDI PEMANFAATAN KALSIUM KARBONAT (CaCO
3)
DARI SERBUK CANGKANG TELUR SEBAGAI
ADSORBEN TERHADAP ION RAKSA (Hg
2+)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
IRWANTO
090802004
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Studi Pemanfaatan Kalsium Karbonat (CaCO3)
dari Serbuk Cangkang Telur Sebagai Adsorben Terhadap Ion Raksa (Hg+)
Kategori : Skripsi
Nama : Irwanto
Nomor Induk Mahasiswa : 090802004
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Disetujui di
Medan, Februari 2014
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Drs. Chairuddin, M.Sc Drs. Ahmad Darwin Bangun, M.Sc NIP. 195912311987011001 NIP.195211161980031001
Disetujui oleh :
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
STUDI PEMANFAATAN KALSIUM KARBONAT (CaCO3) DARI
SERBUK CANGKANG TELUR SEBAGAI ADSORBEN
TERHADAP ION RAKSA (Hg2+)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Februari 2014
PENGHARGAAN
Bismillahirrahmanirrahim,
Alhamdulillahrabbilalamin, segala puji bagi Allah SWT atas segala rahmat, nikmat, karunia, dan hidayah-Nya yang selalu dilimpahkan kepada Penulis, sehingga Penulis dapat menyelesaikan penyusunan skripsi ini. Serta shalawat dan salam Penulis haturkan kepada Rasulullah Muhammad SAW, semoga kelak kita mendapat syafa’at Beliau di hari akhir nanti, Amin.
Dengan segala kerendahan hati Penulis mengucapkan terima kasih dan penghargaan kepada Ayahanda tersayang Sutarno, dan Ibunda tercinta Katijem atas semua kasih sayang, pengorbanan, kerja keras, dan doanya yang selalu menyertai perjuangan Penulis, sehingga Penulis dapat menyelesaikan semua ini. Untuk Abang, Kakak dan Adik terbaikku Katijan, Sumarni, Merry Yustika, Sunarto dan Sri Rahayu, terima kasih untuk semua nasihat, semangat, dan dukungannya semoga kita dapat membahagiakan kedua orang tua kita. Serta untuk semua keluarga yang selalu memberi dukungan kepada Penulis.
Kepada Bapak Drs. Ahmad Darwin Bangun, M.Sc, dan Bapak Drs. Chairuddin, M.Sc selaku Pembimbing I dan II yang dengan sabar dan tulus membimbing dan mendampingi selama proses penelitian dan penulisan skripsi ini. Bapak Prof. Dr. Harlem Marpaung selaku Penasehat Akademik, Ibu Dr. Rumondang Bulan, MS dan Bapak Dr. Albert Pasaribu, M.Sc selaku Ketua dan Sekretaris Departemen Kimia. Bapak Dr. Darwin Yunus Nasution, MS selaku Kepala Laboratorium Kimia Dasar LIDA USU, Bapak dan Ibu dosen serta seluruh staf Departemen Kimia FMIPA USU, terima kasih untuk semua yang telah diberikan kepada Penulis.
Kepada keluarga LIDA, kak Ayu, Ilman, Indah, Rina, Raissa, Dwi, Ayu dan adik-adik asisten, teman-teman seperjuangan 2009, teman-teman HMI Komisariat FMIPA USU, teman-teman Asrama Putera USU, terima kasih untuk persahabatan, kebersamaan dan kekeluargaan yang selama ini diberikan kepada Penulis, serta semua pihak yang telah membantu Penulis menyelesaikan studinya disini. Semoga Allah SWT membalas dengan kebaikan berlipat ganda. Amin.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan, karena keterbatasan Penulis baik dalam literatur maupun pengetahuan. Oleh karena itu Penulis mengharapkan saran dan masukan yang membangun demi kesempurnaan skripsi ini, dan semoga skripsi ini bermanfaat bagi kita semua.
STUDI PEMANFAATAN KALSIUM KARBONAT (CaCO3) DARI
SERBUK CANGKANG TELUR SEBAGAI ADSORBEN
TERHADAP ION RAKSA (Hg2+)
ABSTRAK
Telah dilakukan penelitian tentang pemanfaatan kalsium karbonat (CaCO3) dari
serbuk cangkang telur sebagai adsorben terhadap ion Raksa (Hg2+). Pada penelitian ini serbuk cangkang telur dipreparasi dengan dihaluskan pada ukuran partikel lolos ayakan 100 mesh dan dipanaskan pada suhu 500 oC selam 2 jam, kemudian kadar kalsium karbonat ditentukan dengan metode titrasi balik (Asam-Basa). Serbuk cangkang telur yang telah dipanaskan kemudian digunakan sebagai adsorben ion Hg2+ 5 mg/L sebanyak 100 mL, dimana proses adsorpsi dilakukan dengan berbagai variasi perlakuan yaitu variasi pH larutan, waktu pengadukan, dan variasi berat adsorben. Penentuan kadar ion Hg2+ sebelum dan setelah
diadsorpsi dengan menggunakan inductively Coupled Plasma-Optical Emission Spectrometry (ICP-OES). Hasil penelitian menunjukkan bahwa kadar kalsium
STUDY OF THE USE CALCIUM CARBONATE (CaCO3) FROM
EGGSHELL POWDER AS AN ADSORBENT
OF MERCURY (Hg2+) ION
ABSTRACT
The use of calcium carbonate (CaCO3) from eggshell powder as an adsorbent to
Mercury (Hg2+) ion has been studied. In this research eggshell powder prepared by mashed on the particle size of 100 mesh pass sieves and heated at a temperature of 500oC for 2 hours, then calcium carbonate content was determined by back-titration method (Acid-Base). Eggshell powder which has been heated then used as an adsorbent of 5 mg/L of 100 mL Hg2+ ion solution, where the
adsorption process is done with a wide variety of treatment are variations of pH , stirring time, and doses of adsorben. The determination of Hg2+ ions before and after adsorbed using Inductively Coupled Plasma-Optical Emission Spectrometry
DAFTAR ISI
Bab 2 Tinjauan Pustaka
2.1 Cangkang Telur 6
2.2 Kalsium Karbonat 7
2.2.1 Penggunaan Klasium Karbonat 9
2.3 Karakteristik dan Pencemaran Logam berat 10
2.3.1 Raksa (Merkuri) 12
2.3.1.1 Pemanfaatan Raksa 13
2.3.1.2 Efek Toksik Raksa 14
2.4 Adsorpsi 15
2.4.1 Jenis Adsorpsi 15
2.5 Inductively Coupled Plasma-Optical Emission Spectrometry 16
2.5.1 Definisi Umum 16
2.5.2 Karakteristik ICP-OES 18
2.5.3 Instrumentasi ICP-OES 19
Bab 3 Metodologi Penelitian
3.1 Alat dan Bahan 23
3.1.1 Alat-alat 23
3.1.2 Bahan-bahan 24
3.2 Prosedur Penelitian 24
3.2.1 Preparasi Cangkang Telur Ayam 24
3.2.2 Pembuatan Pereaksi 24
3.2.2.2 Pembuatan Larutan NaOH 0,1 M 25 3.2.2.3 Pembuatan Larutan NaOH 0,2 M 25 3.2.2.4 Pembuatan Indikator Phenolpthalein 25
3.2.3 Pembuatan Larutan Hg2+ 25
3.2.3.1 Pembuatan Larutan Standar Hg2+ 1000 mg/L 25
3.2.3.6 Pembuatan Kurva Kalibrasi Ion Hg2+ 26 3.2.4 Penentuan Kadar Kalsium Karbonat 27 3.2.5 Adsorpsi ion Hg2+ Menggunakan Serbuk Cangkang
Telur 27
3.2.5.1 Penentuan pH Optimum 27
3.2.5.2 Penentuan Waktu Pengadukan Optimum 28 3.2.5.3 Penentuan Berat Optimum Adsorben 28
3.3 Bagan Penelitian 29
3.3.1 Preparasi Cangkang Telur Ayam 29
3.3.2 Penentuan Kadar Kalsium Karbonat 30 3.3.3 Penentuan Kurva Kalibrasi Larutan Seri Standar Hg2+ 31 3.3.4 Adsorpsi ion Hg2+ Menggunakan Serbuk Cangkang
Telur 32
3.3.4.1 Penentuan pH Optimum 32
3.3.4.2 Penentuan Waktu Pengadukan Optimum 33 3.3.4.3 Penentuan Berat Optimum Adsorben 34
Bab 4 Hasil dan Pembahasan
4.1 Hasil Penelitian 35
4.1.1 Penentuan Kadar Kalsium Karbonat dalam Serbuk
Cangkang Telur 35
4.1.2 Pengukuran Ion Raksa (Hg2+) 36
4.1.2.1 Penurunan Persamaan Garis Regresi dengan
Metode Least Square 37
4.1.2.2 Penentuan Koefisien Korelasi 38 4.1.3 Adsorpsi ion Raksa (Hg2+) dengan Menggunakan
Kalsium Karbonat (CaCO3) dari Serbuk Cangkang Telur 39
4.1.3.1 Data Penentuan pH Optimum 39
4.1.3.2 Data Penentuan Waktu Pengadukan Optimum 40 4.1.3.3 Data penentuan Berat Optimum Adsorben 40 4.1.4 Persentase Penurunan Kadar Ion Raksa (Hg2+) dalam
Larutan (Penentuan Persen (%) Adsorpsi) 41
4.2 Pembahasan 42
4.2.1 Preparasi dan Penentuan Kadar Kalsium Karbonat dalam
Serbuk Cangkang Telur 42
4.2.2 Adsorpsi Ion Raksa (Hg2+) dengan Menggunakan
Kalsium Karbonat (CaCO3) dari Serbuk Cangkang Telur 43
4.2.2.2 Penentuan Waktu Pengadukan Optimum 45 4.2.2.3 Penentuan Berat Optimum Adsorben 46 4.2.2.4 Interaksi Serbuk Cangkang Telur dengan Ion
Raksa (Hg2+) 47
Bab 5 Kesimpulan dan Saran 48
5.1 Kesimpulan 48
5.2 Saran 48
Daftar Pustaka 49
DAFTAR TABEL
Nomor Judul Halaman Tabel
2.1. Komposisi Nutrisi Cangkang Telur Ayam yang Dikeringkan
dengan Penempelan Albumin 7
2.2. Kelarutan Ion Kalsium Sebagai Fungsi dari Tekanan Parsial CO2
pada 25 oC. 9
4.1. Data Kadar Kalsium Karbonat dalam Serbuk Cangkang Telur Sebelum dan Setelah Pemanasan dengan Metode Titrasi Asam
Basa. 35
4.2. Kondisi Operasi Peralatan Inductively Coupled Plasma-Optical Emission Spectrometry (ICP-OES) Merek Varian-Liberty 8000
pada Penentuan Intensitas Ion Raksa (Hg2+). 36 4.3. Data Intensitas Cahaya Larutan Seri Standar Ion Raksa (Hg2+) 36
4.4. Penurunan Persamaan Garis Regresi untuk Penentuan Konsentrasi Ion Raksa (Hg2+) Berdasarkan Pengukuran Intensitas Cahaya
Larutan Ion Raksa (Hg2+) 37
4.5. Data Penentuan pH Optimum Adsorpsi 39
4.6. Data Penentuan Waktu Pengadukan Optimum Adsorpsi 40
DAFTAR GAMBAR
Nomor Judul Halaman Gambar
2.1. Perjalanan Logam Sampai ke Tubuh Manusia 11 2.2. Proses yang Terjadi Ketika Sampel Diinjeksikan ke dalam Debit
ICP-OES 17
2.3. Komponen Utama dan Susunan dari Peralatan Inductively Coupled
Plasma-Optical Emission Spectrometry 33
DAFTAR LAMPIRAN
Nomor Judul Halaman Lampiran
1. Standarisasi Larutan NaOH dan HCl 54
2. Uji Kualitatif Ion Karbonat dalam Serbuk Cangkang Telur 56 3. Persentase Penurunan Kadar Ion Raksa (Hg2+) dalam Larutan 57 4. Interferensi Intensitas Cahaya atau Gangguna Spektral pada ICP-OES
yang Mungkin Terjadi pada Pengukuran Ion Raksa 58
STUDI PEMANFAATAN KALSIUM KARBONAT (CaCO3) DARI
SERBUK CANGKANG TELUR SEBAGAI ADSORBEN
TERHADAP ION RAKSA (Hg2+)
ABSTRAK
Telah dilakukan penelitian tentang pemanfaatan kalsium karbonat (CaCO3) dari
serbuk cangkang telur sebagai adsorben terhadap ion Raksa (Hg2+). Pada penelitian ini serbuk cangkang telur dipreparasi dengan dihaluskan pada ukuran partikel lolos ayakan 100 mesh dan dipanaskan pada suhu 500 oC selam 2 jam, kemudian kadar kalsium karbonat ditentukan dengan metode titrasi balik (Asam-Basa). Serbuk cangkang telur yang telah dipanaskan kemudian digunakan sebagai adsorben ion Hg2+ 5 mg/L sebanyak 100 mL, dimana proses adsorpsi dilakukan dengan berbagai variasi perlakuan yaitu variasi pH larutan, waktu pengadukan, dan variasi berat adsorben. Penentuan kadar ion Hg2+ sebelum dan setelah
diadsorpsi dengan menggunakan inductively Coupled Plasma-Optical Emission Spectrometry (ICP-OES). Hasil penelitian menunjukkan bahwa kadar kalsium
STUDY OF THE USE CALCIUM CARBONATE (CaCO3) FROM
EGGSHELL POWDER AS AN ADSORBENT
OF MERCURY (Hg2+) ION
ABSTRACT
The use of calcium carbonate (CaCO3) from eggshell powder as an adsorbent to
Mercury (Hg2+) ion has been studied. In this research eggshell powder prepared by mashed on the particle size of 100 mesh pass sieves and heated at a temperature of 500oC for 2 hours, then calcium carbonate content was determined by back-titration method (Acid-Base). Eggshell powder which has been heated then used as an adsorbent of 5 mg/L of 100 mL Hg2+ ion solution, where the
adsorption process is done with a wide variety of treatment are variations of pH , stirring time, and doses of adsorben. The determination of Hg2+ ions before and after adsorbed using Inductively Coupled Plasma-Optical Emission Spectrometry
STUDI PEMANFAATAN KALSIUM KARBONAT (CaCO3) DARI
SERBUK CANGKANG TELUR SEBAGAI ADSORBEN
TERHADAP ION RAKSA (Hg2+)
ABSTRAK
Telah dilakukan penelitian tentang pemanfaatan kalsium karbonat (CaCO3) dari
serbuk cangkang telur sebagai adsorben terhadap ion Raksa (Hg2+). Pada penelitian ini serbuk cangkang telur dipreparasi dengan dihaluskan pada ukuran partikel lolos ayakan 100 mesh dan dipanaskan pada suhu 500 oC selam 2 jam, kemudian kadar kalsium karbonat ditentukan dengan metode titrasi balik (Asam-Basa). Serbuk cangkang telur yang telah dipanaskan kemudian digunakan sebagai adsorben ion Hg2+ 5 mg/L sebanyak 100 mL, dimana proses adsorpsi dilakukan dengan berbagai variasi perlakuan yaitu variasi pH larutan, waktu pengadukan, dan variasi berat adsorben. Penentuan kadar ion Hg2+ sebelum dan setelah
diadsorpsi dengan menggunakan inductively Coupled Plasma-Optical Emission Spectrometry (ICP-OES). Hasil penelitian menunjukkan bahwa kadar kalsium
STUDY OF THE USE CALCIUM CARBONATE (CaCO3) FROM
EGGSHELL POWDER AS AN ADSORBENT
OF MERCURY (Hg2+) ION
ABSTRACT
The use of calcium carbonate (CaCO3) from eggshell powder as an adsorbent to
Mercury (Hg2+) ion has been studied. In this research eggshell powder prepared by mashed on the particle size of 100 mesh pass sieves and heated at a temperature of 500oC for 2 hours, then calcium carbonate content was determined by back-titration method (Acid-Base). Eggshell powder which has been heated then used as an adsorbent of 5 mg/L of 100 mL Hg2+ ion solution, where the
adsorption process is done with a wide variety of treatment are variations of pH , stirring time, and doses of adsorben. The determination of Hg2+ ions before and after adsorbed using Inductively Coupled Plasma-Optical Emission Spectrometry
BAB 2
TINJAUAN PUSTAKA
2.1 Cangkang Telur
Secara umum struktur cangkang telur terdiri atas tiga lapisan, yaitu lapisan kutikula, lapisan spons, dan lapisan lamelar. Lapisan kutikula merupakan permukaan terluar yang mengandung sejumlah protein. Lapisan spons dan lamelar membentuk matriks yang dibentuk oleh serat protein yang terikat oleh kalsium karbonat dalam cangkng telur. Cangkang telur mewakili 11% dari total bobot telur dan tersusun oleh kalsium karbonat (94%), kalsium fosfat (1%), material organik (4%), dan magnesium karbonat (1%) (Rivera et al.1999).
Sebagian besar kalsium dalam cangkang telur mengendap dalam kurun waktu 16 jam. Tidak ada ayam yang dapat menkonsumsi kalsium begitu cepat untuk memenuhi tuntutan ini. Sebagai gantinya, kalsium dipasok oleh massa-massa tulang khusus yang terdapat pada tulang ayam, yang mengumpulkan cadangan kalsium dalam jumlah besar untuk pembentukan cangkang. Jika ayam diberi pakan rendah kalsium, cangkang telurnya menjadi semakin tipis, ayam dapat menggunakan 10% dari jumlah seluruh kalsium dalam tulangnya hanya untuk membentuk sebutir telur. Bila pakannya terus-menerus rendah kalsium, produksi telur pada akhirnya akan berhenti.
Biasanya, bahan bakunya ion Ca2+ dan ion CO32-, dipasok oleh darah ke
kelenjar cangkang. Proses kalsifikasinya adalah reaksi pengendapan: Ca2+(aq) + CO32-(aq) CaCO3(s)
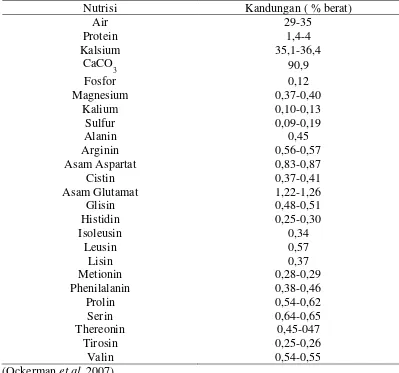
Kandungan kalsium karbonat dari cangkang telur ayam yang dikeringkan dengan penempelan albumin dapat dilihat pada tabel di bawah ini :
Tabel 2.1 Komposisi nutrisi cangkang telur ayam yang dikeringkan dengan penempelan albumin.
Nutrisi Kandungan ( % berat)
Air 29-35
Kalsium karbonat adalah senyawa kimia dengan rumus CaCO3 dan umumnya
berwarna putih. Nama lain dari kalsium karbonat antara lain limestone, kalsit,
aragonit, kapur, marbel, pearl dan oyster. Kalsium karbonat memiliki masa molar
825 oC (aragonit); 1339 oC (kalsit). Kalsium karbonat adalah zat yang umum ditemukan pada bebatuan di semua bagian bumi. dan merupakan komponen utama dari cangkang organisme laut, kerang, siput, batu karang, mutiara, dan cangkang telur. Kalsium karbonat adalah bahan aktif pada batu kapur, dan ini terbentuk ketika ion Ca dalam air sadah bereaksi dengan ion karbonat membentuk
limescale. Kalsium karbonat juga umum digunakan pada bidang medis sebagai
suplemen kalsium atau sebagai antasida, namun konsumsi yang berlebihan dapat berbahaya bagi tubuh.
Kalsium karbonat memiliki sifat yang khas dibandingkan dengan senyawa karbonat yang lain, khususnya:
1. Bereaksi dengan asam kuat, melepaskan karbon dioksida : CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
2. Melepaskan karbon dioksida jika dipanaskan, disebut dengan reaksi dekomposisi termal, atau kalsinasi, (diatas 840 oC pada kalsium karbonat), untuk membentuk kalsium oksida, yang biasa disebut batu kapur, dengan entalpi reaksi 178 kJ/mol:
CaCO3(s) → CaO(s) + CO2(g)
Kalsium karbonat akan bereaksi dengan air akan tetapi jenuh terhadap karbon dioksida untuk membentuk kalsium bikarbonat yang terlarut.
CaCO3 + CO2 + H2O → Ca(HCO3)2
Reaksi ini sangat penting dalam erosi batu karbonat, pembentukan rongga pada gua, dan membentuk air sadah di berbagai wilayah.
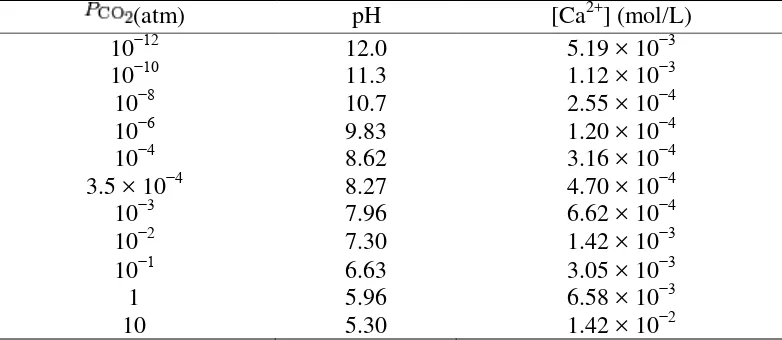
Kalsium karbonat kurang larut dalam air (47 mg/L pada tekanan parsial CO2 dalam atmosfer normal). Kesetimbangan larutan ini dapat dituliskan dengan
persamaan :
CaCO3 Ca2+ + CO32– Ksp = 3.7×10−9 to 8.7×10−9 pada 25 °C.
2-terlarut tidak dapat melebihi nilai Ksp. Kelarutan maksimum kalsium karbonat pada tekanan atmosfer normal (Tekanan CO2 = 3.5 x 10-4 atm) pada variasi pH
larutan berbeda-beda.
Kelarutan ion kalsium sebagai fungsi dari tekanan parsial CO2 pada 25 oC
(Ksp = 4.47 x 10-9) dapat dilihat pada tabel berikut:
Tabel 2.2 Kelarutan ion kalsium sebagai fungsi dari tekanan parsial CO2 pada
25oC (Ksp = 4.47 x 10-9)
Penggunaan utama kalsium karbonat dalam bidang industri adalah sebagai bahan semen. Kalsium karbonat juga digunakan pada proses pemurnian besi dari bijih besi dalam blast furnace. Karbonat yang dikalsinasi secara in situ membentuk
kalsium oksida, yang membentuk slag yang mengandung pengotor dan terpisah
dari besi murni. Dalam industri perminyakan, kalsium karbonat ditambahkan pada cairan pengebor sebagai agen formation-bridging dan filtercake-sealing, yang
Kalsium karbonat secara umum merupakan komponen utama dari kapur papan tulis. Pengendapan kalsium karbonat digunakan sebagai pengisi sarung tangan lateks dengan tujuan penghematan biaya produksi. Kalsium karbonat juga digunakan sebagai extender dalam cat, khususnya cat emulsi yang mengandung 30 % kapur. Kalsium karbonat juga digunakan dalam pembutan pipa PVC.
Dalam bidang medis kalsium karbonat banyak digunakan sebagai suplemen kalsium atau antasida pada lambung. Pada bidang farmasi biasa digunakan sebagai pengisi inert pada tablet atau obat-obatan. Kalsium karbonat juga digunakan sebagai bahan pembuat pasta gigi, pengawet makanan dan
retainer warna pada bahan organik atau makana
2.3 Karakteristik dan Pencemaran Logam Berat
Istilah logam biasanya diberikan kepada semua unsur-unsur kimia dengan ketentuan atau kaidah-kaidah tertentu. Unsur ini dalam kondisi suhu kamar, tidak selalu berbentuk padat melainkan ada yang berbentuk cair. Logam-logam cair, contohnya adalah air raksa atau hidragyrum, serium, dan galium (Palar, H. 2008). Logam berat adalah unsur-unsur kimia yang terletak di sudut kanan bawah sistem periodik, mempunyai afinitas yang tinggi terhadap unsur sulfidril dan biasanya bernomor atom 22 sampai 92 dari perioda 4 sampai 7 (Miettinen, J. K. 1977).
Terdapat 80 jenis logam berat dari 109 unsur kimia dimuka bumi ini. Logam berat dibagi kedalam dua jenis, yaitu :
1. Logam berat essensial; yakni logam dalam jumlah tertentu yang sangat dibutuhkan oleh organisme. Dalam jumlah yang berlebihan, logam tersebut bisa menimbulkan efek toksik. Contohnya adalah Zn, Cu, Fe, Co, Mn dan lain sebagainya.
Logam berat dapat menimbulkan efek gangguan terhadap kesehatan manusia, tergantung pada bagian mana dari logam berat tersebut yang terikat dalam tubuh serta besarnya dosis paparan. Efek toksik dari logam berat mampu menghalangi kerja enzim sehingga mengganggu metabolisme tubuh, menyebabkan alergi, bersifat mutagen, teratogen atau karsinogen bagi manusia maupun hewan.
Toksisitas logam berat bisa dikelompokkan menjadi 3, yaitu bersifat toksik tinggi yang terdiri dari unsur-unsur Hg, Cd, Pb, Cu, dan Zn; bersifat toksik sedang, yang terdiri dari unsur-unsur Cr, Ni, dan Co; dan bersifat toksik rendah yang terdiri atas unsur Mn dan Fe. Tingkat toksisitas logam berat terhadap hewan air, mulai dari yang paling toksik, adalah Hg, Cd, Zn, Pb, Cr, Ni, dan Co. Tingkat toksisitas terhadap manusia dari yang paling toksik adalah Hg, Cd, Ag, Ni, Pb, As, Cr, Sn, dan Zn (Widowati dkk. 2008).
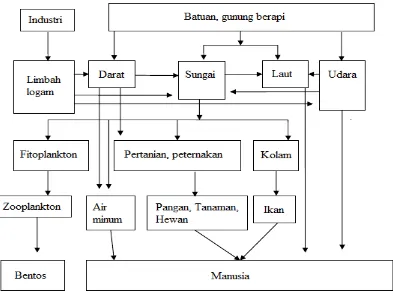
Berikut gambar perjalanan logam sampai ke tubuh manusia.
Gambar 2.1 Perjalanan Logam Sampai ke Tubuh Manusia (Klaassen et al.
Pencemaran lingkungan perairan oleh logam berat beracun (toxic heavy
metals) disebabkan terutama oleh meningkatnya skala kegiatan sektor
perindustrian yang tidak disertai dengan proses penanggulangan air limbah yang dihasilkan. Umumnya air limbah industri mengandung unsur logam berat beracun seperti Hg, Cd, Pb, Cu, Zn, dan lainnya (Sanusi dkk. 1985).
Faktor yang menyebabkan logam berat dikelompokkan ke dalam bahan pencemar adalah karena logam berat tidak dapat terurai melalui biodegradasi seperti pencemaran organik. Logam berat dapat terakumulasi dalam lingkungan terutama dalam sedimen sungai kemudian terikat dengan senyawa organik dan anorganik melalui absorpsi dan pembentukan kompleks.
Pencemaran logam berat dapat menimbulkan berbagai masalah, antara lain (Harahap, S. 1991):
1. Berhubungan dengan estetika seperti perubahan bau, warna, dan rasa air. 2. Dapat menimbulkan bahaya bagi kehidupan tanaman dan binatang. 3. Berbahaya bagi kesehatan manusia.
4. Dapat menyebabkan kerusakan ekosistem.
2.3.1 Raksa ( Merkuri )
Di alam raksa dapat membentuk ratusan senyawa kimia. Pada dasarnya ratusan senyawa kimia ini dapat diklasifikasikan atas 5 kelompok yaitu (Goldwater et al. 1977):
1. Raksa metalik, misalnya cairan atau padatan raksa.
2. Garam-garam anorganik, misalnya raksa -sulfida, - klorida dan - oksida. 3. Senyawa-senyawa alkil, yaitu senyawa raksa yang mengandung gugus
metil (CH3) atau gugus etil (-C2H5).
4. Senyawa alkoksi-alkil, senyawa ini biasanya bersifat kompleks.
5. senyawa aril, yaitu senyawa raksa yang mengandung gugus fenil (-C6H5).
Kelimpahan Hg dibumi menempati urutan ke -67 diantara elemen lainnya pada kerak bumi. Merkuri jarang didapatkan dalam bentuk bebas di alam, tetapi berupa bijih cinnabar (HgS). Untuk mendapatkan Hg dari cinnabar, dilakukan pemanasan bijih cinnabar diudara sehingga menghasilkan logam Hg (Widowati dkk. 2008).
2.3.1.1 Pemanfaatan Raksa
Dengan semakin meningkatnya perkembangan teknologi maka penggunaan Hg pun makin meningkat baik untuk kebutuhan-kebutuhan industri maupun kebutuhan rumah tangga. Penggunaan dalam rumah tangga yang menyolok adalah untuk alat-alat listrik, dimana yang terbanyak digunakan sebagai bahan untuk katalisator.
dan perak (Ag). Amalgam tersebut harus dibakar untuk menguapkan merkuri guna menangkap dan memisahkan butir-butir emas dari butir-butir batuan. Hg bersifat sangat toksik sehingga penggunaan Hg dalam berbagai industri sebaiknya dikurangi, termasuk dalam industri farmasi, kedokteran gigi, industri pertanian, industri baterai, dan lampu fluorescence (Widowati dkk. 2008).
2.3.1.2 Efek Toksik Raksa
Ada tiga bentuk merkuri yang toksik terhadap manusia, yaitu merkuri murni, bentuk garam anorganik, dan bentuk organik. Bentuk garam anorganik Hg dapat berbentuk merkuri (Hg2+) dan bentuk merkuro (Hg+), dimana bentuk garam merkuri lebih toksik dari pada merkuro. Bentuk organik Hg seperti aril, alkil, dan alkoksi alkil sangat beracun diantara bentuk garam lainnya (Darmono. 2001).
Efek toksik Hg berkaitan dengan susunan syaraf yang sangat peka terhadap Hg dengan gejala pertama adalah parestesia, lalu ataksia, disartria, ketulian, dan akhirnya kematian. Terdapat hubungan antara dosis Hg dengan gejala toksisitas, seperti keracunan metil merkuri di Irak yang menunjukkan kadar Hg pada rambut korban minimum 100 ppm sehingga muncul kasus parestesia.
Merkuri (Hg) bisa menghambat pelepasan GnRH (gonadotropin releasing
hormone) oleh kelenjar hipotalamus dan menghambat ovulasi sehingga terjadi
akumulasi Hg pada korpus luteum . Keracunan akut oleh Hg uap bisa terjadi pada konsentrasi Hg uap sebesar 0,5-1,2 mg/m3. Keracunan akut oleh Hg uap menunjukkan gejala farangitis, sakit pada bagian perut, mual-mual dan muntah yang disertai darah, dan shock. Apabila tidak diobati akan berlanjut dengan
2.4. Adsorpsi
Adsorpsi adalah suatu proses pemisahan bahan dari campuran gas atau cair, bahan yang harus dipisahkan ditarik oleh permukaan sorben padat dan diikat oleh gaya-gaya yang bekerja pada permukaan tersebut. Karena selektivitasnya yang tinggi, proses adsorpsi sangat sesuai untuk memisahkan bahan dengan konsentrasi yang kecil dari campuran yang mengandung bahan lain yang berkonsentrasi tinggi. Bahan yang akan dipisahkan tentu saja harus dapat diadsorpsi. Sebaliknya, untuk memisahkan bahan dengan konsentrasi yang lebih besar lebih disukai proses pemisahan yang lain, karena mahalnya regenerasi adsorben.
Adsorben adalah bahan padat dengan luas permukaan dalam yang sangat besar. Permukaan yang sangat luas ini terbentuk karena banyaknya pori yang halus pada padatan tersebut. Biasanya luasnya berada dalam orde 200 – 1000 m2/g adsorben. Diameter pori sebesar 0,0003 – 0,02 µm. Di samping luas spesifik dan diameter pori, maka kerapatan unggun, distribusi ukuran partikel maupun kekerasannya merupakan data karakteristik yang penting dari suatu adsorben. Tergantung pada tujuan penggunaannya, adsorben dapat berupa granulat (dengan ukuran butir sebesar beberapa mm) atau serbuk (khusus untuk adsorpsi campuran cair) (Bernasconi, G. 1995).
2.4.1. Jenis Adsorpsi
Jenis Adsorpsi ada dua macam (Barrow, G. M. 1997): 1. Adsorpsi Fisik
a. Panas adsorpsi kurang dari 40 kJ/mol. b. Adsorpsi berlangsung pada suhu rendah. c. Kesetimbangan adsorsi reversibel dan cepat.
2. Adsorpsi Kimia
a. Panas adsorpsi lebih besar dari ± 80 kJ/mol. b. Adsorpsi berlangsung pada temperature tinggi. c. Kesetimbangan adsorpsi irreversibel.
d. Energi aktivasi mungkin terlibat didalam proses ini. e. Terjadi adsorpsi monolapisan.
Proses adsorpsi tergantung pada sifat zat padat yang mengadsorpsi, sifat atom/molekul yang diserap, konsentrasi, temperatur dan lain-lain. Pada proses adsorpsi terbagi menjadi 4 tahap yaitu (Amri, A. 2004):
1. Transfer molekul-molekul zat terlarut yang teradsorpsi menuju lapisan film yang mengelilingi adsorben.
2. Difusi zat terlarut yang teradsorpsi melalui lapisan film.
3. Difusi zat terlarut yang teradsorpsi melalui kapiler/pori dalam adsorben. 4. Adsorpsi zat terlarut yang teradsorpsi pada dinding pori atau permukaan
adsorben.
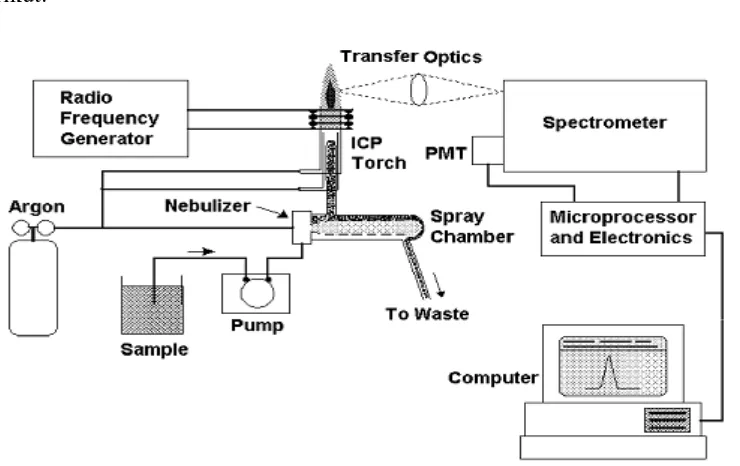
2.5. Inductively Coupled Plasma – Optical Emission Spectrometry 2.5.1. Definisi Umum
Inductively Coupled Plasma – Optical Emission Spectrometry ( ICP/OES ) adalah
instrumen yang sangat baik untuk penentuan logam dalam berbagai matriks sampel yang berbeda. Dengan teknik ini, sampel cair di injeksikan ke dalam
Radio Frequency (RF)-induksi plasma argon menggunakan satu jenis nebulizer.
hingga 70 unsur dengan kombinasi polikromator dan array detektor. Kinerja
analisa sistem tersebut kompetitif dengan teknik analisis anorganik lainnya, terutama berkaitan dengan throughput dan sensitivitas sampel.
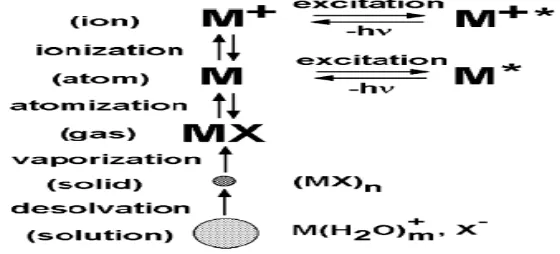
Sampel cair dan gas dapat diinjeksikan secara langsung ke dalam instrumen, sedangkan sampel padat memerlukan ekstraksi atau pelarutan dengan asam sehingga analit berbentuk larutan. Larutan sampel diubah menjadi aerosol dan bergerak ke saluran pusat plasma. Pada bagian inti Inductively Coupled
Plasma (ICP) temperatur mencapai 10.000 K, sehingga aerosol menguap dengan
cepat. Unsur analit dibebaskan sebagai atom-atom bebas dalam keadaan gas. Tumbukan eksitasi lebih lanjut dalam plasma memberikan energi tambahan pada atom, yang menyebabkan atom-atom pada keadaan tereksitasi. Energi yang ada memungkinkan untuk mengubah atom menjadi ion-ion dan kemudian menjadikan ion-ion pada keadaan tereksitasi (Hou, X. and Jones, B. T. 2000).
Proses yang terjadi ketika sampel diinjeksikan kedalam debit ICP dapat dilihat pada gambar:
Gambar 2.2 Proses yang terjadi ketika sampel diinjeksikan ke dalam debit ICP. (Boss, C. B. and Freeden, K. J. 1997)
Instrumentasi yang terkait dengan sistem ICP/OES relatif sederhana. Sebagian dari foton yang diemisikan oleh ICP dikumpulkan dengan sebuah lensa atau cermin cekung. Optik pemokus ini memberi gambaran ICP pada jalur masuk perangkat penyaring panjang gelombang seperti monokromator. Panjang gelombang partikel melewati sebuah monokromator yang akan diubah menjadi sinyal listrik oleh fotodetektor. Sinyal diperkuat dan diproses oleh elektronik detektor, kemudian ditampilkan dan disimpan oleh komputer (Hou, X. and Jones, B. T. 2000).
2.5.2 Karakteristik ICP-OES
Keuntungan utama dari analisis menggunakan ICP dibanding dengan instrumen yang menggunakan sumber eksitasi lain adalah kemampuannya untuk efisiensi dan kebolehulangan pada penguapan, atomisasi, eksitasi, dan ionisasi untuk berbagai unsur dalam berbagai sampel yang berbeda. Hal ini terutama disebabkan oleh suhu yang tinggi, 6000-7000 K pada ICP. Suhu ini jauh lebih tinggi dari suhu maksimum pada flame atau tungku (3300 K). Suhu yang tinggi pada ICP membuatnya mampu untuk mengeksitasi unsur yang tahan terhadap panas, dan tahan terhadap interferensi.
Berikut ini beberapa karakteristik yang paling menguntungkan dari penggunaan ICP (Hou, X. and Jones, B. T. 2000):
1. Temperatur tinggi (7000-8000 K).
2. Densitas elektron tinggi (1014 - 1016 cm-3). 3. Derajat ionisasi berbagai unsur cukup besar.
4. Kemampuannya dalam penentuan multiunsur secara simultan (lebih dari 70 unsur termasuk P dan S).
5. Background emisi yang rendah, dan gangguan kimia yang relatif rendah.
6. Stabilitas tinggi sehingga akurasi dan presisi sangat baik.
8. Jarak dinamis linerar (LDR) yang lebar (empat sampai enam kali perbesaran).
9. Dapat digunakan untuk unsur-unsur yang tahan panas. 10.Analisis efektif dan terjangkau.
2.5.3. Instrumentasi ICP-OES
Representasi dan tampilan dari ICP-OES dapat dilihat dari gambar berikut:
Gambar 2.3 Komponen utama dan susunan dari peralatan Inductively Coupled Plasma - Optical Emission Spectrometry.
1. Pemasukan Sampel
a. Nebulizer
Nebulizer adalah perangkat yang digunakan untuk mengkonversi cairan
untuk berbagai sampel sangat menentukan kegunaan dari nebulizer pada
ICP-OES. Banyak perangkat yang dapat digunakan untuk memecah cairan menjadi aerosol, namun hanya dua yang dapat digunakan pada ICP, yaitu pneumatik force
dan ultrasonic mechanical force.
b. Pompa
Pompa adalah perangkat yang digunakan untuk mengalirkan sampel larutan kedalam nebulizer. Dengan adanya pompa maka laju aliran konstan dan
tidak tergantung pada parameter larutan seperti viskositas dan tegangan permukaan larutan. Selain itu laju aliran dapat dikontrol dan memungkinkan
washout lebih cepat dari nebulizer dan ruang semprot.
c. Spray Chamber (Tempat Penyemprot)
Setelah sampel aerosol terdapat pada nebulizer, harus segera dialirkan
pada torch sehingga dapat diinjeksikan ke dalam plasma. Karena hanya tetesan
kecil aerosol cocok untuk diinjeksikan ke dalam plasma, spray chamber
ditempatkan antara nebulizer dan torch. Fungsi utama dari spray chamber adalah
untuk menghilangkan tetesan besar dari aerosol. Tujuan kedua dari spray chamber
adalah untuk melancarkan keluaran pulsa yang terjadi selama nebulisasi, karena
spray chamber ikut memompa larutan.
d. Drains
Drains pada ICP berfungsi untuk membawa kelebihan sampel dari spray
chamber menuju ke tempat pembuangan. Selain itu, sistem drains memberikan
tekanan balik yang dibutuhkan untuk memaksa aerosol pada nebulizer melalui
aliran gas pada tungku injector tube kedalam plasma discharge. Jika sistem drains
2. Penghasil Emisi
a. Torches (Tungku)
Dari spray chamber aerosol diinjeksikan melalui torch kedalam plasma
yang akan terdesolvasi, menguap, teratomisasi, tereksitasi dan terionisasi oleh plasma. Torch terdiri dari tiga tabung konsentrik, untuk aliran argon dan injeksi
aerosol. Tiga tabung itu terdiri dari plasma flow, auxiliary flow dan nebulizer
flow.
b. Radio Frequency Generator.
Radio frequency (RF) generator adalah peralatan yang menyediakan daya
untuk pembangkit dan pemeliharaan debit plasma. Daya ini biasanya berkisar antara 700 sampai 1.500 watt, yang ditransfer ke gas plasma melalui kumparan yang terdapat pada sekitar bagian atas torch. Kumparan, yang bertindak sebagai
antena untuk mentransfer daya RF ke plasma, biasanya terbuat dari pipa tembaga dan didinginkan oleh air atau gas selama operasi.
3. Pengumpulan dan Pendeteksian Emisi. a. Optik
Radiasi biasanya dikumpulkan oleh fokus optik seperti lensa cembung atau cermin cekung. Optik ini bersifat mengumpulkan sinar, sehingga sinar difokuskan menuju celah pada monokromator atau polikromator.
b. Monokromator
c. Detektor
Detektor digunakan untuk mengukur intensitas garis emisi setelah garis emisi dipisahkan oleh monokromator/polikromator. Jenis detektor yang paling banyak digunakan pada ICP-OES adalah tabung photomultiplier (PMT).
4. Pemrosesan Sinyal dan Instrumen Kontrol a. Pemrosesan Sinyal
Setelah emisi dideteksi oleh detektor (PMT), maka arus anoda PMT dapat dikonversi, yang mewakili intensitas emisi menjadi sinyal tegangan yang diubah menjadi informasi digital. Informasi digital inilah yang mewakili intensitas emisi relatif atau konsentrasi dari sampel.
b. Komputer dan Processor
Komputer digunakan sebagai instrumen untuk mengontrol, memanipulasi dan mengumpulkan data analisis. Pada komputer kita dapat memilih parameter operasi yang tepat untuk analisis seperti panjang gelombang, tegangan PMT, mengkoreksi background pengukuran dan konsentrasi larutan standar.
BAB 3
METODE PENELITIAN
3.1 Alat dan Bahan 3.1.1 Alat-Alat
- Inductively Coupled Plasma Optical Varian-Liberty 8000
Emission Spectrometer (ICP-OES)
- Furnace Galenkamp
- Oven Carbolite
- Kertas Saring No. 42 Whatman
- Neraca Analitis AND
- Sentrifugator Fisher Scientific
- Hotplate Cimarec
- pH meter Trans Instrument TI 9000
3.1.2 Bahan-Bahan
- Etanol Absolut p.a (E.Merck)
- Phenolphthalain p.a (E.Merck)
- Akuades
3.2 Prosedur Penelitian
3.2.1 Preparasi Cangkang Telur Ayam
Limbah cangkang telur ayam yang digunakan pada penelitian ini diperoleh dari rumah makan di daerah Jalan Dr. Mansyur, Medan. Limbah cangkang telur kemudian dibersihkan dari kotoran dengan cara dicuci dengan air kemudian dibilas dengan akuades. Selanjutnya dikeringkan dalam oven pada suhu 110oC
selama 2 jam untuk menghilangkan air dalam cangkang. Kemudian cangkang telur dihaluskan dengan alu dan lumpang, diayak hingga diperoleh serbuk cangkang telur dengan ukuran butir lolos ayakan 100 mesh. Selanjutnya serbuk cangkang telur dipanaskan pada suhu 500oC selama 2 jam dalam furnace untuk
menghilangkan residu pengotor yang masih tertinggal pada serbuk cangkang telur.
3.2.2 Pembuatan Pereaksi
3.2.2.1 Pembuatan Larutan HCl 0,2 M
Dimasukkan ± 50 mL akuades ke dalam labu takar 100 mL dan ditambahkan 16,67 mL HCl(P) 37% secara perlahan-lahan. Dibiarkan larutan hingga dingin,
labu takar 250 mL lainnya. Ditambahkan akuades hingga garis batas dan dihomogenkan.
3.2.2.2 Pembuatan Larutan NaOH 0,1 M
Sebanyak 4 gram NaOH pellet dimasukkan ke dalam labu takar 100 mL (Larutan NaOH 1 M). Dilarutkan dengan akuades secara perlahan-lahan sampai garis tanda dan dibiarkan hingga dingin, kemudian dihomogenkan. Selanjutnya dipipet sebanyak 10 mL larutan tersebut dan dimasukkan ke dalam labu takar 100 mL lainnya. Ditambahkan akuades hingga garis batas dan dihomogenkan.
3.2.2.3 Pembuatan Larutan NaOH 0,2 M
Sebanyak 10 mL larutan NaOH 1 M dimasukkan ke dalam labu takar 50 ml, lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
3.2.2.4 Pembuatan Indikator Phenolphthalein
Sebanyak 0,5 gram Phenolphthalein dimasukkan ke dalam labu takar 100 mL. Ditambahkan 50 mL etanol absolut dan diguncang perlahan-lahan hingga larut. Kemudian ditambahkan akuades hingga garis batas dan dihomogenkan.
3.2.3 Pembuatan Larutan Standar Hg2+
3.2.3.1 Pembuatan Larutan Standar Hg2+ 1000 mg/L
Sebanyak 1,7081 gram kristal Hg(NO3)2.H2O dimasukkan ke dalam gelas beaker
250 mL lalu ditambahkan 2 mL HNO3(p) sambil diaduk hingga larut kemudian
3.2.3.2 Pembuatan Larutan Standar Hg2+ 100 mg/L
Sebanyak 10 mL larutan induk Hg2+ 1000 mg/L dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan akuades sampai garis tanda dan dihomogenkan.
3.2.3.3 Pembuatan Larutan Standar Hg2+ 10 mg/L
Sebanyak 10 mL larutan standar raksa 100 mg/L dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan akuades sampai garis tanda dan dihomogenkan.
3.2.3.4 Pembuatan Larutan Standar Hg2+ 1 mg/L
Sebanyak 10 mL larutan standar raksa 10 mg/L dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan akuades sampai garis tanda dan dihomogenkan.
3.2.3.5 Pembuatan Larutan Seri Standar Hg2+ 0,005; 0,010; 0,050; dan 0,100
mg/L
Sebanyak 0,5; 1,0; 5,0; dan 10,0 mL larutan standar raksa 1 mg/L dimasukkan ke dalam masing-masing labu takar 100 mL lalu diencerkan dengan akuades sampai garis tanda dan dihomogenkan.
3.2.3.6 Pembuatan Kurva Kalibrasi Hg2+
Larutan blanko diukur intensitas cahayanya dengan menggunakan ICP-OES pada
λspesifik 253,652 nm. Dilakukan hal yang sama untuk larutan seri standar Hg2+
3.2.4 Penentuan Kadar Kalsium Karbonat
Sebanyak 0,2 gram serbuk cangkang telur dimasukkan ke dalam erlenmeyer. Dilarutkan dengan 25 mL HCl 0,2 M dan ditambahkan 5 mL etanol absolut untuk membantu HCl melarutkan cangkang dan sebagai wetting agent. Ditambahkan
aquadest hingga volumenya ± 50 mL. Kemudian didihkan larutan selama ± 10 menit untuk menghilangkan CO2, lalu di biarkan hingga dingin. Tambahkan 3
tetes indikator phenolphthalein, kemudian dititrasi dengan larutan baku NaOH 0,1 M hingga berubah warna dari bening menjadi merah lembayung. Dicatat volume NaOH 0,1 M yang terpakai dan ditentukan kadar kalsium karbonatnya. Diulangi perlakuan yang sama sebanyak 3 kali. Dilakukan prosedur yang sama untuk menentukan kadar kalsium karbonat dalam serbuk cangkang telur yang telah dipanaskan pada suhu 500 oC.
3.2.5 Adsorpsi Ion Hg2+ Menggunakan Serbuk Cangkang Telur
(Charlena dkk. 2012)
3.2.5.1 Penentuan pH Optimum
Sebanyak 100 ml larutan standar Hg2+ 5 mg/L diatur pada pH 4 dengan penambahan HNO3 0,2 M, kemudian dimasukkan kedalam botol plastik dan
ditambahkan 0,50 gram serbuk cangkang telur. Kemudian botol dikocok menggunakan shaker selama 120 menit dan didiamkan selama 24 jam agar terjadi kesetimbangan pada suhu ruang. Suspensi yang terbentuk dipisahkan dengan cara disentrifugasi pada kecepatan 5000 rpm selama 20 menit dan kemudian disaring dengan kertas saring Whatman No. 42 untuk memisahkan supernatan. Setelah itu, dipipet sebanyak 10 mL dan dimasukkan kedalam labu takar 100 mL. Kemudian ditambahkan akuadest hingga garis tanda sambil diatur pada pH ≤ 2 dan dihomogenkan. Selanjutnya ditentukan kandungan ion raksanya menggunakan ICP-OES pada λspesifik 253,652 nm. Diulangi perlakuan yang sama dengan variasi
3.2.5.2 Penentuan Waktu Pengadukan Optimum
Sebanyak 100 ml larutan standar Hg2+ 5 mg/L diatur pada pH 8 (pH optimum) dengan penambahan NaOH 0,2 M, kemudian dimasukkan kedalam botol plastik dan ditambahkan 0,50 gram serbuk cangkang telur. Kemudian botol dikocok menggunakan shaker selama 30 menit dan didiamkan selama 24 jam agar terjadi kesetimbangan pada suhu ruang. Suspensi yang terbentuk dipisahkan dengan cara disentrifugasi pada kecepatan 5000 rpm selama 20 menit dan kemudian disaring dengan kertas saring Whatman No 42 untuk memisahkan supernatan. Selanjutnya dipipet sebanyak 10 mL dan dimasukkan kedalam labu takar 100 mL. Kemudian ditambahkan akuadest hinga garis tanda sambil diatur pada pH ≤ 2 dan dihomogenkan. Selanjutnya ditentukan kandungan ion raksanya menggunakan ICP-OES pada λspesifik 253,652 nm. Diulangi perlakuan yang sama dengan variasi
waktu pengadukan 60, 90, 120, 150, dan 180 menit.
3.2.5.3 Penentuan Massa Optimum Adsorben
Sebanyak 100 ml larutan standar Hg2+ 5 mg/L diatur pada pH 8 (pH optimum) dengan penambahan NaOH 0,2 M, kemudian dimasukkan kedalam botol plastik dan ditambahkan 0,25 gram serbuk cangkang telur. Kemudian botol dikocok menggunakan shaker selama 120 menit (waktu optimum) dan didiamkan selama 24 jam agar terjadi kesetimbangan pada suhu ruang. Suspensi yang terbentuk dipisahkan dengan cara disentrifugasi pada kecepatan 5000 rpm selama 20 menit dan kemudian disaring dengan kertas saring Whatman No 42 untuk memisahkan supernatan. Selanjutnya, dipipet sebanyak 10 mL dan dimasukkan kedalam labu takar 100 mL. Kemudian ditambahkan akuadest hinga garis tanda sambil diatur pada pH ≤ 2 dan dihomogenkan. Selanjutnya ditentukan kandungan ion raksanya menggunakan ICP-OES pada λspesifik 253,652 nm. Diulangi perlakuan yang sama
3.3 Bagan Penelitian
3.3.1 Preparasi Cangkang Telur Ayam
Dicuci dengan air hingga bersih dan dibilas dengan akuades
Dikeringkan dalam oven pada suhu 110oC selama 2 jam
Dihaluskan dengan alu dan lumpang
Diayak hingga diperoleh serbuk cangkang telur dengan ukuran butir lolos ayakan 100 mesh
Dipanaskan menggunakan furnace pada suhu 500oC selama 2 jam
Serbuk Cangkang Telur Ayam Serbuk Cangkang Telur
3.3.2 Penentuan Kadar Kalsium Karbonat
Dimasukkan kedalam erlenmeyer 250 mL
Dilarutkan dengan 25 mL HCl 0,2 M
Ditambahkan 5 mL etanol absolut
Ditambahkam akuadest hingga volumenya ± 50 mL
Dididihkan selama ± 10 menit
Dibiarkan hingga dingin
Ditambahkan 3 tetes indikator phenolphthalein
Dititrasi dengan larutan baku NaOH 0,1 M hingga berubah warna dari bening menjadi merah lembayung
Dihitung volume NaOH 0,1 M yang terpakai
Catatan : - Diulangi percobaan dengan perlakuan yang sama sebanyak 3 kali. - Dilakukan prosedur yang sama untuk menentukan kadar kalsium
karbonat dalam serbuk cangkang telur setelah pemanasan.
0,2 gram Serbuk Cangkang Telur
3.3.3. Penentuan Kurva Kalibrasi Larutan Seri Standar Hg2+
Dipipet sebanyak 10 mL
Dimasukan kedalam labu takar 100 mL
Diencerkan dengan aquadest hingga garis tanda Dihomogenkan
Dipipet sebanyak 10 mL
Dimasukan kedalam labu takar 100 mL
Diencerkan dengan aquadest hingga garis tanda Dihomogenkan
Dipipet sebanyak 10 mL
Dimasukan kedalam labu takar 100 mL
Diencerkan dengan aquadest hingga garis tanda Dihomogenkan
Dipipet sebanyak 0,5; 1,0; 5,0; dan 10,0 mL
Dimasukan masing-masing dalam labu takar 100 mL Diencerkan dengan aquadest hingga garis tanda Dihomogenkan
Diatur pada pH ≤ 2 dengan menambahkan HNO3
Diukur intensitas cahayanya dengan menggunakan ICP-OES pada λspesifik 253,652 nm
Larutan Standar Hg2+ 1000 mg/L
Larutan Standar Hg2+ 100 mg/L
Larutan Standar Hg2+ 10 mg/L
Larutan Seri Standar Hg2+ 0,005; 0,010; 0,050; dan 0,100 mg/L
Hasil
3.3.4 Adsorpsi Ion Hg2+ Menggunakan Serbuk Cangkang Telur (Charlena dkk. 2012)
3.3.4.1 Penentuan pH Optimum
Dimasukkan kedalam botol
Dipipet 10 mL dan dimasukkan ke dalam labu takar 100 mL
Ditambahkan aquadest hingga garis tanda sambil diatur pada pH ≤ 2 dan dihomogenkan.
Diukur intensitas cahayanya menggunakan ICP-OES pada
λspesifik 253,652 nm
Catatan : Perlakuan yang sama dilakukan dengan variasi pH 5; 6; 7; 8; dan 9 dengan penambahan NaOH 0,2 M.
100 mL Larutan Standar Hg2+ 5 mg/L
Hasil
3.3.4.2 Penentuan Waktu Pengadukan Optimum
Dipipet 10 mL dan dimasukkan ke dalam labu takar 100 mL
Ditambahkan aquadest hingga garis tanda sambil diatur pada pH ≤ 2 dan dihomogenkan.
Diukur intensitas cahayanya menggunakan ICP-OES pada
λspesifik 253,652 nm
Catatan : Perlakuan yang sama dilakukan dengan variasi waktu pengadukan 60, 90, 120, 150, dan 180 menit.
100 mL Larutan Standar Hg2+ 5 mg/L
Hasil
3.3.4.3 Penentuan Berat Optimum Adsorben
Dipipet 10 mL dan dimasukkan ke dalam labu takar 100 mL
Ditambahkan aquadest hingga garis tanda sambil diatur pada pH ≤ 2 dan dihomogenkan.
Diukur intensitas cahayanya menggunakan ICP-OES pada
λspesifik 253,652 nm
Catatan : Perlakuan yang sama dilakukan dengan variasi berat serbuk cangkang telur 0,50; 0,75; 1,00; dan 1,25 gram.
100 mL Larutan Standar Hg2+ 5 mg/L
Hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Penentuan Kadar Kalsium Karbonat dalam Serbuk Cangkang Telur
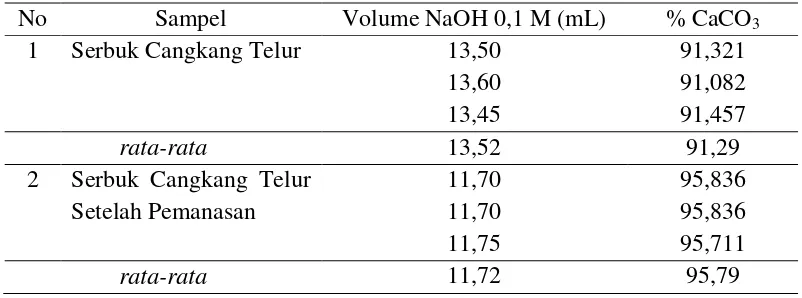
Penentuan kadar kalsium karbonat dalam serbuk cangkang telur sebelum dan setelah pemanasan dilakukan dengan metode titrasi asam-basa, dimana titrasi dilakukan sebanyak 3 kali agar hasil pengukuran yang diperoleh lebih tepat dan teliti. Data kadar kalsium karbonat dalam serbuk cangkang telur sebelum dan setelah pemanasan dapat dilihat pada tabel 4.1, dengan menggunakan persamaan berikut:
Keterangan :
V = Volume
N = Konsentrasi
BE = Berat Ekivalen
Tabel 4.1 Data Kadar Kalsium Karbonat dalam Serbuk Cangkang Telur Sebelum dan Setelah Pemanasan dengan Metode Titrasi Asam-Basa.
No Sampel Volume NaOH 0,1 M (mL) % CaCO3
1 Serbuk Cangkang Telur 13,50 91,321
13,60 91,082
13,45 91,457
rata-rata 13,52 91,29
2 Serbuk Cangkang Telur Setelah Pemanasan
11,70 95,836
11,70 95,836
11,75 95,711
4.1.2. Pengukuran Ion Raksa (Hg2+)
Kondisi operasi peralatan Inductively Coupled Plasma - Optical Emission
Spectrometry (ICP-OES) pada penentuan intensitas ion Raksa (Hg2+) dapat dilihat
pada tabel 4. 2 dan data intensitas cahaya larutan seri standar ion Raksa (Hg2+) dapat dilihat pada tabel 4.3 berikut :
Tabel 4.2 Kondisi Operasi Peralatan Inductively Coupled Plasma - Optical Emission Spectrometry (ICP-OES) Merek Varian-Liberty 8000 pada
Penentuan Intensitas Ion Raksa (Hg2+)
No Parameter ion Raksa (Hg2+)
1 Panjang Gelombang (nm) 253,652
2 Tipe Gas Plasma Argon
3 Power (kW) 1,20
4 Kecepatan Aliran Gas Plasma (L/min) 1,50
5 Kecepatan Gas Pendukung (L/min) 1,50
6 Ketinggian Tungku (mm) 8
7 Tekanan Nebulizer (kPa) 200
8 Kecepatan Pompa (rpm) 20
9 Penundaan Penyerapan sampel (s) 30
10 Lama Pembilasan (s) 10
11 Waktu Pembacaan Replikasi (s) 1
12 Penundaan Stabilisasi Instrumen (s) 15
13 Replikasi 3
14 Tegangan PMT (V) 650
Tabel 4.3 Data Intensitas Cahaya Larutan Seri Standar Ion Raksa (Hg2+)
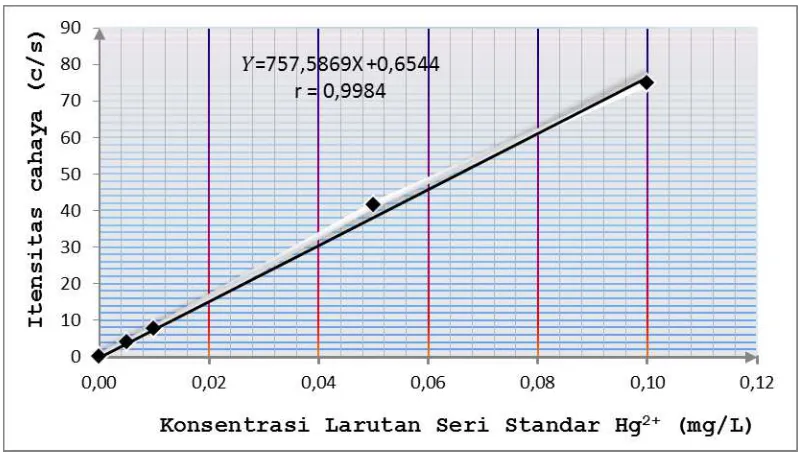
Konsentrasi (mg/L) Intensitas Cahaya (c/s)
0,0000 0,0000
0,0050 4,0105
0,0100 7,6805
0,0500 41,6527
4.1.2.1 Penurunan Persamaan Garis Regresi dengan Metode Least Square
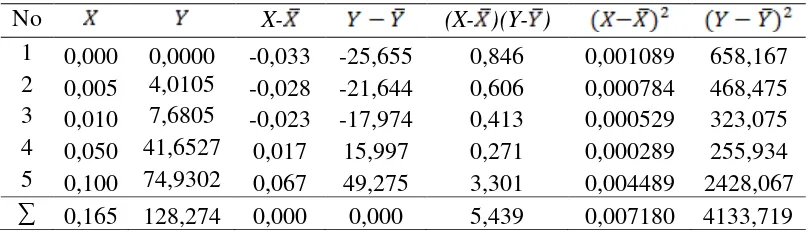
Hasil pengukuran intensitas cahaya larutan seri standar ion Raksa (Hg2+) pada Tabel 4.3 diplotkan terhadap konsentrasinya sehingga diperoleh suatu kurva kalibrasi berupa garis linear. Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode Least Square dan dapat dilihat pada Tabel 4.4 berikut:
Tabel 4.4 Penurunan Persamaan Garis Regresi untuk Penentuan Konsentrasi Ion Raksa (Hg2+) Berdasarkan Pengukuran Intensitas Cahaya Larutan Seri Standar Ion Raksa (Hg2+)
No X- (X- )(Y- )
1 0,000 0,0000 -0,033 -25,655 0,846 0,001089 658,167 2 0,005 4,0105 -0,028 -21,644 0,606 0,000784 468,475 3 0,010 7,6805 -0,023 -17,974 0,413 0,000529 323,075 4 0,050 41,6527 0,017 15,997 0,271 0,000289 255,934 5 0,100 74,9302 0,067 49,275 3,301 0,004489 2428,067
∑ 0,165 128,274 0,000 0,000 5,439 0,007180 4133,719
Keterangan :
X = Data konsentrasi larutan standar
Y = Data intensitas cahaya yang ditentukan oleh alat Inductively Coupled
Plasma-Optical Emission Spectrometry.
Nilai dan dari data diatas dapat ditentukan dengan persamaan :
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan:
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least Square sebagai berikut :
Sehingga diperoleh harga slope (a) =
Harga intersept (b) diperoleh melalui substitusi (a) ke persamaan berikut :
Sehingga diperoleh harga intersept (b) = 0,6544
Maka persamaan garis regresi yang diperoleh adalah :
4.1.2.2 Penentuan Koefisien Korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
Kurva kalibrasi larutan seri standar Hg2+ dapat dilihat pada gambar 4.1 berikut:
Gambar 4.1 Kurva kalibrasi larutan seri standar Hg2+
4.1.3 Adsorpsi Ion Raksa (Hg2+) dengan Menggunakan Kalsium Karbonat
(CaCO3) dari Serbuk Cangkang Telur
4.1.3.1 Data Penentuan pH Optimum
Penentuan pH optimum pada penelitian ini dilakukan mulai dari pH 4 sampai dengan pH 9. Data penentuan pH optimum dapat dilihat pada Tabel 4.5 berikut :
Tabel 4.5 Data Penentuan pH Optimum Adsorpsi
No pH Larutan Konsentrasi Akhir Larutan Hg2+ (mg/L)
1 4 0,4116
2 5 0,4034
3 6 0,3315
4 7 0,2817
5 8 0,1362
4.1.3.2 Data Penentuan Waktu Pengadukan Optimum
Penentuan waktu pengadukan optimum pada penelitian ini dilakukan mulai dari waktu 30 menit sampai dengan 180 menit, dimana pH larutan yang digunakan adalah pH 8 (pH Optimum). Data penentuan waktu pengadukan optimum dapat dilihat pada Tabel 4.6 berikut:
Tabel 4.6 Data Penentuan Waktu Pengadukan Optimum Adsorpsi
No Waktu Pengadukan (Menit) Konsentrasi Akhir Larutan Hg2+ (mg/L)
1 30 0,5061
4.1.3.3 Data Penentuan Berat Optimum Adsorben
Penentuan berat optimum adsorben pada penelitian ini dilakukan mulai dari berat serbuk cangkang telur 0,25 g sampai dengan 1,25 g, dimana pH larutan yang digunakan adalah pH 8 (pH optimum) dengan waktu pengadukan 120 menit (waktu pengadukan optimum). Data penentuan berat optimum adsorben dapat dilihat pada Tabel 4.7 berikut:
Tabel 4.7 Data Penentuan Berat Optimum Adsorben
No Berat Adsorben (gram) Konsentrasi Akhir Larutan Hg2+ (mg/L)
1 0,25 0,8117
2 0,50 0,1304
3 0,75 0,0975
4 1,00 0,0907
4.1.4 Persentase Penurunan Kadar Ion Raksa (Hg2+) dalam Larutan (Penentuan Persen (%) Adsorpsi)
Persentase penurunan kadar ion Hg2+ dalam larutan sebelum dan setelah di adsorpsi dapat ditentukan dengan menggunakan persamaan berikut:
Dari data hasil pengukuran yang terdapat pada Tabel 4.5; Tabel 4.6; dan Tabel 4.7, maka penentuan % adsorpsi pada berbagai perlakuan dapat ditentukan sebagai berikut:
1. Pada penentuan pH optimum (pH 8) :
Data % adsorpsi pada penentuan pH optimum secara lengkap dapat dilihat pada Lampiran 3.B.
2. Pada penentuan waktu pengadukan optimum (waktu 120 menit) :
Data % adsorpsi pada penentuan waktu pengadukan optimum secara lengkap dapat dilihat pada Lampiran 3.C.
3. Pada penentuan berat optimum adsorben (berat 0,5 gram) :
4.2 Pembahasan
4.2.1 Preparasi dan Penentuan Kadar Kalsium Karbonat dalam Serbuk Cangkang Telur
Cangkang telur secara umum terdiri dari 3 lapisan, yaitu lapisan kutikula, lapisan spons dan lapisan lamellar. Cangkang telur mewakili 11 % dari bobot total telur yang tersusun atas 94 % kalsium karbonat, 1 % kalsium fosfat, 4 % material organik dan 1 % magnesium karbonat (Rivera at al. 1999). Menurut Rivera et al
(1999), pemanasan cangkang telur pada suhu 450 oC selama 2 jam akan menghilangkan residu magnesium karbonat, protein, serta pengotor lainnya.
Penelitian Sigh dan Mehta (2012), dengan menggunakan Differential
Thermal Analysis/Thermogravimetric Analysis (DTA/TGA) untuk mengetahui
dekomposisi termal dari cangkang telur pada suhu 450 o – 625 oC dan suhu 650 o – 1000 oC menunjukkan bahwa pada rentang suhu 450 o – 625 oC akan diperoleh senyawa CaCO3 dengan suhu maksimum 650 oC , sedangkan pada rentang suhu
650 o – 1000 oC senyawa CaCO3 akan terdekomposisi menjadi CaO dengan suhu
maksimum 850 oC. Berdasarkan hal diatas, maka pada penelitian ini serbuk cangkang telur yang diperoleh dipanaskan pada suhu 500 oC selama 2 jam dengan tujuan untuk menghilangkan residu magnesium karbonat dan protein sehingga didapatkan kadar CaCO3 yang lebih tinggi.
Titrasi yang digunakan dalam penelitian ini adalah titrasi balik (asam-basa), hal ini dikarenakan NaOH tidak bereaksi dengan kalsium karbonat dari cangkang telur tetapi bereaksi dengan kelebihan HCl yang digunakan untuk melarutkan kalsium karbonat dari serbuk cangkang telur. Hal ini dapat dijelaskan dengan reaksi berikut:
2HCl(aq) + CaCO3(s) Ca2+(aq) + CO2(g) + H2O(l) + 2Cl-(aq)
kemudian kelebihan HCl yang digunakan dititrasi balik dengan NaOH: HCl(aq) + NaOH(aq) H2O(l) + Na+(aq) + Cl-(aq)
Dimana, volume dari NaOH pada titrasi digunakan untuk menentukan mol dari HCl yang bereaksi dengan CaCO3, kemudian digunakan untuk menentukan kadar
CaCO3 dalam serbuk cangkang telur (Faruruwa, D. M. and Danladi, C. 2013).
4.2.2. Adsorpsi Ion Raksa (Hg2+) dengan Menggunakan Kalsium Karbonat
(CaCO3) dari Serbuk Cangkang Telur
Serbuk cangkang telur yang digunakan untuk mengadsorpsi ion Hg2+ pada penelitian ini adalah serbuk cangkang telur yang telah dipanaskan pada suhu 500oC selama 2 jam. Dimana proses adsorpsi dilakukan dengan beberapa variasi perlakuan.
4.2.2.1Penentuan pH Optimum Adsorpsi
Berdasarkan data tersebut dan data pada Lampiran 3.B maka persentase adsorpsi pada berbagai pH dapat kita gambarkan sebagai berikut:
Gambar 4.2 Persen (%) adsorpsi pada berbagai pH larutan.
Menurut Kalyani et al. (2009), efek dari pH terhadap kemampuan adsorpsi
kalsium karbonat dapat dijelaskan dengan mekanisme ion-exchange, dimana sifat grup karbonat dalam cangkang telur memainkan perannya sangat penting dalam proses kation-exchange. Pada pH rendah, adsorpsi ion logam terhambat oleh persaingan yang terjadi antara ion hidrogen dan ion logam untuk teradsorpsi pada permukaan adsorben. Sedangkan pada pH yang lebih tinggi, grup karbonat pada cangkang telur akan keluar, meningkatkan muatan negatif pada permukaan adsorben, menarik kation logam dan membiarkannya teradsorpsi pada permukaan adsorben.
4.2.2.2Penentuan Waktu Pengadukan Optimum
Penentuan waktu pengadukan dalam proses adsorpsi sangat penting untuk dilakukan, karena dengan mengetahui waktu pengadukan optimum akan mempersingkat proses adsorpsi dengan hasil penyerapan yang baik. Pada penelitian ini, variasi waktu yang digunakan pada proses adsorpsi adalah 30-180 menit. Konsentrasi ion Hg2+ yang digunakan 5 mg/L sebanyak 100 mL, dengan pH larutan 8, dan berat adsorben 0,50 g (Bagan 3.3.4.2). Dimana data penentuan waktu pengadukan optimum dapat dilihat pada Tabel 4.6. Berdasarkan data tersebut dan data pada Lampiran 3.C maka persentase adsorpsi pada berbagai waktu pengadukan dapat kita gambarkan sebagai berikut:
Gambar 4.3 Persen (%) adsorpsi pada berbagai waktu pengadukan.
Proses adasorpsi berlangsung dengan cepat pada awal kontak antara permukaan adsorben dengan sejumlah adsorbat. Hal ini dikarenakan ketersediaan permukaan aktif pada permukaan adsorben yang masih banyak. Penyerapan yang cepat biasanya dikarenakan oleh proses difusi yang terjadi antara adsorbat dengan permukaan adsorben (Bhaumik et al. 2011). Selanjutnya proses adsorpsi
Berdasarkan Gambar 4.3, kita ketahui bahwa waktu pengadukan selama 30 menit dapat menyerap ion Hg2+ sebesar 90,00 %, dan mencapai optimum pada waktu 120 menit dengan penyerapan 97,02 %. Sedangkan pada waktu pengadukan 150 dan 180 menit didapatkan kenaikan penyerapan yang tidak signifikan. Hal ini dikarenakan permukaan aktif pada adsorben sudah cukup jenuh sehingga tidak memungkinkan untuk menyerap adsorbat lebih banyak.
4.2.2.3 Penentuan Berat Optimum Adsorben
Penentuan berat optimum adsorben pada penelitian ini dilakukan dengan menggunakan adsorben sebanyak 0,25-1,25 g. Tujuan dari penentuan berat optimum adsorben adalah untuk mengetahui jumlah minimum adsorben yang digunakan untuk proses adsorpsi, sehingga jumlah penggunaan adsorben lebih efisien dan lebih hemat biaya. Pada penelitian ini, konsentrasi ion Hg2+ yang digunakan 5 mg/L sebanyak 100 mL, dengan pH larutan 8, dan waktu kontak 150 menit (Bagan 3.3.4.3). Dimana data penentuan berat optimum adsorben dapat dilihat pada Tabel 4.7. Berdasarkan data tersebut dan data pada Lampiran 3.D maka persentase adsorpsi pada berbagai berat adsorben dapat kita gambarkan sebagai berikut:
Ketika serbuk cangkang telur dicampurkan dengan larutan, sedikit dari garam kalsium mungkin akan terlarut dan melepaskan ion Ca2+, HCO3-, CO32- dan
ion OH-, seperti reaksi berikut:
CaCO3 + H2O Ca2+ + HCO3- + OH- + CO32-
Ion-ion ini terdapat dalam keadaan dasar (setimbang) dan membentuk muatan negatif pada permukaan partikel adsorben. Sehingga ketika jumlah berat adsorben diperbesar maka muatan negatif pada permukaan adsorben semakin besar dan adsorpsi juga akan meningkat (Zulfikar et al.(2012)). Semakin banyak
berat adsorben yang ditambahkan semakin tinggi % adsorpsi, tetapi pada jumlah tertentu penyerapan berjalan lambat dan bisa dianggap sama.
Berdasarkan Gambar 4.4, kita ketahui bahwa pada berat 0,25 g adsorben diperoleh penyerapan 83,96 % dan sangat meningkat pada berat adsorben 0,50 g, yaitu sebesar 97,43 %. Tetapi pada berat adsorben 0,75; 1; dan 1,25 g, kenaikan persentase peneyerapan tidak signifikan. Hal ini dikarenakan pada berat 0,50 g adsorben, ketersediaan permukaan aktif pada adsorben sebanding dengan banyaknya adsorbat yang akan terserap pada permukaan adsorben dalam larutan.
4.2.2.4Interaksi Serbuk Cangkang Telur dengan Ion Raksa (Hg2+)
Cangkang telur hampir secara keseluruhan mengandung kalsium karbonat. Menurut Godelitsas et al. (2003), kalsium karbonat berinteraksi kuat dengan
beberapa ion logam divalent (M2+), penghilangan ion logam dalam larutan dapat dilakukan dengan beberapa proses seperti presipitasi/kopresipitasi, adsorpsi, dan absorpsi/difusi fase padat. Proses penyerapan biasanya terjadi secara bersamaan dengan pelarutan pada permukaan kalsium karbonat.
Penelitian yang dilakukan oleh Godelitsas et al.(2003), yang menganalisa
Hg2+ (adsorpsi dan mungkin juga absorpsi) pada permukaan kalsium karbonat terjadi dengan cara pertumbuhan kristal pada lubang pori atau permukaan aktif kalsium karbonat, sedangkan anion hanya menunjukkan pengaruh yang kecil pada penyerapan. Selain terserap, ion Hg2+ dalam larutan juga menghambat proses pelarutan pada permukaan kalsium karbonat. Jenis kristal yang tumbuh pada permukaan kalsium karbonat adalah kristal ortorhombik (type monotrydite) Hg(II) Oksida terhidrasi (HgO.nH2O) sebagai akibat dari penyerapan ion Hg2+
dalam larutan. Sementara itu, kemungkinan terbentuknya Hg(II) karbonat (HgCO3
atau HgCO3.H2O) seperti interaksi kalsium karbonat dengan logam divalent
lainnya dalam hal ini tidak ditemukan. Menurut Khodakopsky and Shikina (1981), HgCO3.H2O sangat tidak stabil dalam kondisi tekanan atmosfer normal dan secara
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari penelitian yang telah dilakukan dapat disimpulkan bahwa:
1. Kadar kalsium karbonat dalam serbuk cangkang telur setelah pemanasan pada suhu 500 oC selama 2 jam yaitu 95,79 %, lebih tinggi dibanding dengan kadar kalsium karbonat sebelum pemanasan yaitu 91,29%.
2. Kalsium karbonat dari serbuk cangkang telur yang telah dipanaskan pada suhu 500 oC selama 2 jam dapat digunakan untuk mengadsorpsi ion logam Hg2+ dalam larutan dengan pH optimum 8 dan persentase penyerapan 97,31 %, waktu pengadukan optimum 120 menit dan persentase penyerapan 97,02 %, berat optimum adsorben 0,5 gram dengan persentase penyerapan 97,42 %, dalam 100 mL larutan Hg2+ 5 mg/L.
5.2 Saran
DAFTAR PUSTAKA
Adekola, F.A., Salam, N.A., Adegoke, H.I., Adesola, H.M., Adekeye, J.I.D. 2012. Removal of Pb(II) from Aqueous Solution by Natural and Synthetic Calcites. Bull. Chem. Soc. Ethiop. 26(2) : 195-210.
Agustiningtyas, Z. 2012. Optimasi Adsorpsi Ion Pb(II) menggunakan Zeolit Alam Termodifikasi Ditizon. Bogor: Institut Pertanian Bogor.
Aimi, N., Norhafizah., Sien, W.C. 2013. Removal of Cu(II) from Water by Adsorpsion on Chicken Eggshell. International Journal of Engineering & Technology IJET-IJENS Vol:13 No:01.
Amri, A. 2004. Kesetimbangan Adsorpsi Optional Campuran Biner Cd(II) dan Cr(II) dengan Zeolit Alam Terimpregnasi 2-Merkaptobenzotiazol. Yogyakarta: Jurnal Nature Yogyakarta.
Barrow, G. M. 1997. Physical Chemistry. Fourth Edition. New York: McGraw-Hill Book Company.
Bernasconi, G. 1995. Teknologi Kimia. Cetakan Pertama. Jilid 2. Jakarta: Paradnya Paramita.
Bhaumik, R., Mondal, N. K., Das, B., Roy, P., Pal, K. C., Banerjee, A., Datta, J. K. 2011. Eggshell Powder as an Adsorbent for Removal of Fluoride from Aqueous Solution: Equilibrium, Kinetic and Thermodynamic Studies. E-Journal of Chemistry. Vol. 9(3) : 1457-1480.
Boss, C. B. and Freeden, K. J. 1997. Concepts, Instrumentation, and Techniques in Inductively Coupled Plasma Optical Emission Spectrometry. USA: Perkin Elmer.
Chang, R. 9999. Kimia Dasar Konsep-Konsep Inti. Edisi Ketiga. Jilid 2. Jakarta: Erlangga.
Charlena., Purwaningsih, H., Hafid, R. 2012. Fosfatisasi Kalsium Karbonat Cangkang Telur Ayam dan Kajiannya Pada Proses Adsorpsi Logam Timbal. Prosiding Seminar Nasional Sains V Bogor.
Darmono. 2001. Lingkungan Hidup dan Pencemaran Hubungannya dengan Toksikologi Senyawa Logam.Jakarta: UI-Press.
Faruruwa, D. M. and Danladi, C. 2013. Quantification of Calcium and Calcium Carbonate in Eggshell Obtained from Local, Improved Chickens and Ducks of Gombe (Northern Nigeria). Topclass Journal of Agricultural Research. Vol. 1(1) : 8-10
Ghaffar, A. 2007. Removal of Lead(II) Ions from Aqueous Solution Under Different Physicochemical Conditions Using Various Sorbents. Pakistan :
Health Physics Division, PINSTECH.
Godelitsas, A., Astilleros, J. M., Hallam, K. R., Lons, J., Putnis, A. 2003. Microscopic and Spectroscopic Investigation of the Calcite Surface Interacted with Hg(II) in Aqueous Solutions. Mineralogical Magazine.
Vol. 67(6): 1193-1204.
Goldwater, J. L. and Stopford, W. 1977. Mercury. In : The Chemical Environment and Man. London: Blackic Glasgow.
Harahap, S. 1991. Tingkat Pencemaran Air Kali Cakung Ditinjau Dari Sifat Fisika Khususnya Logam Berat dan Keanekaragaman Jenis Hewan Bentos Makro. Bogor: Institut Pertanian Bogor.
Hou, X. and Jones, B. T. 2000. Inductively Coupled Plasma/Optical Emission Spectrometry. Encyclopedia of Analytical Chemistry. Chicester: John Wiley & Sons Ltd,
Telur-Susu.pdf
Diakses tanggal 26 Juli 2013.
Diakses tanggal 26 Juli 2013.
Diakses tanggal 20 Juli 2013.
Jai, P.H., Wook, J.S., Kyu, Y.J., Gil, K. B., Mok, L.S. 2007. Removal of Heavy Metals using Waste Eggshell. Journal of Environmental Science.
19(2007); 1436-1441.
Kalyani, G., Rao, G. B., Saradhi, V., Kumar, P. 2009. Equilibrium Kinetic Studies on Biosorption of Zinc onto Gallus Domesticus Shell Powder. ARPN Journal of Engginering and Applied Science. Vol. 4 : 39-49
Miettinen, J.K. 1977. Inorganic Trace Element as Water Pollutants. New York: Academic Press.
Ockerman, H. W. and Hansen, C.L. 2007. Nutrient Composition of Dried Eggshells (with Adhering Albumin). Bioinfobank Library 200: 7.
Palar, H. 2008. Pencemaran dan Toksikologi Logam Berat. Jakarta: Rineka Cipta.
Quek, S.Y., Wase, D.A.J., Forster, C.F. 1998. The Use of Sago Waste For the Sorption of Lead and Copper. Water SA, Vol. 24, No. 3.
Ribeiro, A., Graca, J., Castro, F., Valarinho, C., Carvalho, J. 2012. Developement of a Process for Waste Eggshell Volarisation. 4th International Conference on Engineering for Waste and Biomass Valorisation. Porto: Portugal.
Rivera, E.M., Araiza, M., Brostow, W., Castano, V.M., Diaz, E.J., Hernandez, R., Rodriguez, J. 1999. Sythesis of hydroxyapatite from eggshells. Meksiko: UniÍersidad Nacional Autonoma de Mexico.
Sanusi, H. S. 1980. Akumulasi Logam Berat Hg dan Cd pada Tubuh Ikan Bandeng (Chanos chanos Forskal). Bogor: Institut Pertanian Bogor.
Sight, V and Mehta, N. 2012. Synthesis of Nano Crystalline Hydroxyapatite from Eggshells by Combustion Method. International Journal Science Engginering Investigation 1: 92 – 94.
Vogel, A.I. 1994. Buku Teks Anorganik Kualitatif Makro dan Semimikro.Edisi Kelima. Jakarta: PT Kalman Media Pustaka.
Widowati, W., Sastiono, A., Jusuf, R. 2008. Efek Toksik Logam Pencegahan dan Penanggulangan Pencemaran. Yogyakarta: Penerbit Andi.
Lampiran 1. Standarisasi Larutan NaOH dan HCl
1. Standarisasi Larutan NaOH dengan Asam Oksalat (H2C2O4) 0,1 M.
a. Ditimbang 1,26 g H2C2O4.2H2O di dalam gelas beker 100 mL,
b. Ditambahkan 25-30 mL akuades, kemudian diaduk hingga larut.
c. Pindahkan asam oksalat ke dalam labu ukur 100 mL, dan bilas dengan sedikit akuades, lalu masukkan air bilasan tersebut ke dalam labu ukur. d. Tambahkan akuadest hingga tanda batas, dan dikocok hingga homogen. e. Bilas buret yang sudah bersih dengan sedikit larutan asam oksalat 0,1 M.
Lalu isi buret dengan asam oksalat.
f. Timbang sebanyak 0,4 gram NaOH pellet dan dimasukkan kedalam labu takar 100 mL. Dilarutkan dengan akuadest secara perlahan-lahan sampai garis tanda dan dibiarkan hingga dingin, kemudian dihomogenkan.
g. Pipet 10 mL larutan NaOH yang akan distandarisasi, lalu masukkan kedalam erlenmeyer kemudian ditambahkan 3 tetes indikator phenolphtalein.
h. Dititrasi dengan larutan asam oksalat 0.1 M hingga terjadi perubahan warna dari bening menjadi merah lembayung. Catat volume asam oksalat yang digunakan untuk titrasi.
i. Ulangi standarisasi NaOH dua kali (Tahap g dan h). Hitung rata-rata asam oksalat yang digunakan dan hitung konsentrasi NaOH.
Konsentrasi akhir lautan NaOH dapat ditentukan dengan persamaan:
A. Data Standarisasi NaOH