(Pomacea Canaliculata L.) SEBAGAI
ADSORBEN TERHADAP ION
KADMIUM (Cd
2+)
SKRIPSI
MEY RINA EKASARI
100802002
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
STUDI PEMANFAATAN KALSIUM OKSIDA (CaO) DARI SERBUK CANGKANG KEON MAS
(Pomacea Canaliculata L.) SEBAGAI ADSORBEN TERHADAP ION
KADMIUM (Cd2+)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
MEY RINA EKASARI 100802002
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Studi Pemanfaatan Kalsium Oksida (CaO) dari
Serbuk Cangkang Keong Mas (Pomacea
Canaliculata L.) Sebagai Adsorben Terhadap Ion Kadmium (Cd2+)
Kategori : Skripsi
Nama : Mey Rina Ekasari
Nomor Induk Mahasiswa : 100802002
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Disetujui di
Medan, Agustus 2014
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Prof. Dr. Harry Agusnar, M.Sc Prof. Dr. Zul Alfian, M.Sc
NIP. 195308171983031002 NIP.195504051983031002
Disetujui oleh :
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
STUDI PEMANFAATAN KALSIUM OKSIDA (CaO) DARI SERBUK CANGKANG KEONG MAS
(Pomacea canaliculata L.) SEBAGAI ADSORBEN TERHADAP ION
KADMIUM (Cd2+)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2014
PENGHARGAAN
Alhamdulillah, puji dan syukur penulis ucapkan kepada Allah SWT atas segala rahmat, nikmat serta hidayah-Nya penelitian dan skripsi ini dapat diselesaikan sebagai salah satu persyaratan untuk meraih gelar Sarjana Sains pada jurusan Kimia di Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Serta shalawat dan salam kepada Rasulullah SAW sebagai sosok yang membawa kebenaran bagi umatnya.
Dengan segala kerendahan hati, penulis menyampaikan penghargaan, cinta kasih yang tulus kepada Ayahanda Syamsul Hadi dan Ibunda Lasmini atas segala bentuk dukungan moril dan materil serta segala pengorbanan dan doa yang telah diberikan sehingga penulis dapat menyelesaikan pendidikan sampai sekarang. Serta untuk Adinda tersayang Rini Nurvita Sari dan seluruh keluarga besar yang tiada henti memberikan dorongan semangat kepada penulis.
Ucapan terima kasih penulis kepada Bapak Prof. Dr. Zul Alfian, M.Sc selaku dosen pembimbing 1 dan Bapak Prof. Dr. Harry Agusnar, M.Sc, M.Phill selaku dosen pembimbing 2 yang telah memberikan arahan, bimbingan dan saran sehingga skripsi ini dapat terselesaikan. Ibu Dr. Rumondang Bulan Nst, MS dan Bapak Drs. Albert Pasaribu, M.Sc selaku ketua dan sekretaris departemen Kimia FMIPA USU. Bapak dan Ibu dosen yang telah memberikan ilmunya selama masa studi penulis di FMIPA USU, terkhusus kepada Ibu Dra. Nurhaida Pasaribu, MS selaku dosen wali yang telah memberikan bimbingan demi kelancaran kuliah penulis, serta para asisten laboratorium departemen Kimia FMIPA USU yang telah memberikan bimbingan kepada penulis selama melakukan praktikum.
Kepada seluruh keluarga besar LIDA USU, Bapak Saharman Gea, Ph.D, dan kak Ayu atas segala fasilitas yang sudah diberikan. Seluruh asisten LIDA USU, serta semua pihak yang telah membantu penulis menyelesaikan studi di sini. Semoga Allah SWT membalas dengan kebaikan yang berlipat ganda. Amin.
STUDI PEMANFAATAN KALSIUM OKSIDA (CaO) DARI SERBUK CANGKANG KEONG MAS
(Pomacea canaliculata L.) SEBAGAI ADSORBEN TERHADAP ION
KADMIUM (Cd2+)
ABSTRAK
STUDY OF THE USE CALCIUM OXIDE (CaO) FROM SNAILSHELL (Pomacea canaliculata L.) POWDER
AS AN ADSORBENT OF CADMIUM (Cd2+) ION
ABSTRACT
DAFTAR ISI
2.2.1 Penggunaan Kalsium Oksida 9
2.3 Pencemaran Logam Berat 10
2.3.1 Kadmium (Cd) 11
2.3.1.1 Pemanfaatan Kadmium 12
2.3.1.2 Efek Logam Kadmium dalam Tubuh 13
2.4 Adsorpsi 14
2.5 Hamburan Sinar-X 15
2.6 Spektrofotometri Serapan Atom (SSA) 15
2.6.1 Prinsip Dasar Spektrofotometri Serapan Atom (SSA) 15 2.6.2 Instrumentasi Spektrofotometri Serapan Atom (SSA) 16
Bab 3 METODE PENELITIAN 19
3.1 Alat dan Bahan 19
3.1.1 Alat-alat 19
3.1.2 Bahan-bahan 20
3.2 Prosedur Penelitian 20
3.2.1 Preparasi dan Karakterisasi CaO dari Cangkang
Keong Mas 20
3.2.2 Pembuatan Pereaksi 20
3.2.2.2 Pembuatan Larutan NaOH 0,1M 21
3.2.3 Pembuatan Larutan Standar Cd2+ 21
3.2.3.1 Pembuatan Larutan Standar Cd2+ 1000 mg/L 21 3.2.3.2 Pembuatan Larutan Standar Cd2+ 100 mg/L 21 3.2.3.3 Pembuatan Larutan Standar Cd2+ 10 mg/L 21 3.2.3.4 Pembuatan Larutan Seri Standar Cd2+ 0,5;
1,0; 1,5; 2,0; dan 2,5 mg/L 22
3.2.3.5 Pembuatan Kurva Kalibrasi Cd2+ 22
3.2.4 Adsorpsi Ion Cd2+ Menggunakan Serbuk Cangkang
Keong Mas 22
3.2.4.1 Penentuan pH Optimum Penyerapan 22
3.2.4.2 Penentuan Waktu Pengadukan Optimum 22
3.3 Bagan Penelitian 23
3.3.1 Preparasi dan Karakterisasi CaO dari Cangkang
Keong Mas 23
3.3.2 Penentuan Kurva Kalibrasi Larutan Standar 24
3.3.3 Adsorpsi Ion Cd2+ Menggunakan Serbuk Cangkang
Keong Mas 25
3.3.3.1 Penentuan pH Optimum Penyerapan 25
3.3.3.2 Penentuan Waktu Pengadukan Optimum 26
Bab 4 HASIL DAN PEMBAHASAN 27
4.1 Hasil Penelitian 27
4.1.1 Karakterisasi Kalsium Oksida dalam Serbuk
Cangkang Keong Mas (Pomacea canaliculata L.) 27
4.1.2 Pengukuran Ion Kadmium (Cd2+) 27
4.1.2.1 Penurunan Persamaan Garis Regresi dengan
Metode Least Square 28
4.1.2.2 Penentuan Koefisien Korelasi 30
4.1.3 Adsorpsi Ion Kadmium (Cd2+) Menggunakan Kalsium Oksida (CaO) dari Serbuk Cangkang
Keong Mas 31
4.1.3.1 Data Penentuan pH Optimum 31
4.1.3.2 Data Penentuan Waktu Pengadukan
Optimum 32
4.1.4 Persentase Penurunan Kadar Ion Kadmium (Cd2+)
dalam Larutan (Penentuan Persen (%) Adsorpsi) 32
4.2 Pembahasan 33
4.2.1 Preparasi dan Karakterisasi Kalsium Oksida dalam Serbuk Cangkang Keong Mas
(Pomacea canaliculata L.) 33
4.2.2 Adsorpsi Ion Kadmium (Cd2+) Menggunakan Kalsium Oksida (CaO) dari Serbuk Cangkang
Keong Mas (Pomacea canaliculata L.) 34
4.2.3 Interaksi Serbuk Cangkang Keong Mas
Bab 5 KESIMPULAN DAN SARAN 38
5.1 Kesimpulan 38
5.2 Saran 38
Daftar Pustaka 39
DAFTAR TABEL
Nomor Judul Halaman
Tabel
4.1 Data 2Ɵ Senyawa Kalsium Oksida dari JCPDS 27
4.2 Kondisi Alat SSA Merk Shimadzu Tipe AA-6300 28
4.3 Data Absorbansi Larutan Seri Standar Ion Kadmium (Cd2+) 28 4.4 Penurunan Persamaan Garis Regresi untuk Penentuan
Konsentrasi Ion Kadmium (Cd2+) Berdasarkan Pengukuran
Absorbansi Larutan Seri Standar Ion Kadmium (Cd2+) 29
4.5 Data Penentuan pH Optimum 32
4.6 Data Penentuan Waktu Pengadukan Optimum Adsorpsi 33
4.7 Data 2Ɵ Senyawa Kalsium Karbonat dan Kalsium Oksida
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
2.1 Keong Mas (Pomacea canaliculata L.) 6
2.2 Komponen-komponen Spektrofotometer Serapan Atom 16
4.1 Kurva Kalibrasi Larutan Seri Standar Cd2+ 31
4.2 Persen (%) Adsorpsi pada Berbagai pH Larutan 35
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lamp
1. Karakterisasi Kalsium Oksida dalam Cangkang Keong Mas
(Pomacea canaliculata L.) 43
2. Persentase Penurunan Kadar Ion Kadmium (Cd2+) dalam
Larutan 44
3. Gambar Bahan Penelitian 45
STUDI PEMANFAATAN KALSIUM OKSIDA (CaO) DARI SERBUK CANGKANG KEONG MAS
(Pomacea canaliculata L.) SEBAGAI ADSORBEN TERHADAP ION
KADMIUM (Cd2+)
ABSTRAK
STUDY OF THE USE CALCIUM OXIDE (CaO) FROM SNAILSHELL (Pomacea canaliculata L.) POWDER
AS AN ADSORBENT OF CADMIUM (Cd2+) ION
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Hampir semua industri memiliki limbah berupa logam berat, namun
penanggulangannya ini masih sangat minim. Limbah industri yang mengandung
logam berat bisa berasal dari industri tekstil, industri cat, dan lain-lain.
Pencemaran perairan akan memberikan dampak buruk bagi kehidupan makhluk
hidup dan manusia, karena semua makhluk hidup memerlukan air untuk dapat
bertahan hidup. Pencemaran lingkungan perairan yang disebabkan oleh
logam-logam berat seperti kadmium, timbal dan tembaga yang berasal dari limbah
industri sudah lama diketahui. Pencemaran karena logam berat dapat
menyebabkan berbagai kelainan dan penyakit pada manusia (Permanasari, A dkk,
2010).
Ion kadmium (Cd) adalah salah satu ion logam berat yang penyebarannya
sangat luas di alam dengan tingkat toksisitas di bawah logam merkuri dan timbal.
Berdasarkan Peraturan Pemerintah Republik Indonesia No. 82 Tahun 2001,
kandungan logam untuk timbal (Pb) dan kadmium (Cd) tidak boleh melebihi 0,03
ppm dan 0,01 ppm pada suatu perairan (Rahman, 2006).
Upaya mengatasi limbah logam berat telah dilakukan dengan berbagai
cara, salah satunya dengan menggunakan adsorben. Beberapa penelitian antara
lain telah dilakukan oleh Kusmiyati dkk (2012) dengan memanfaatkan karbon
aktif arang batu bara, yang dilakukan dengan merendamnya dalam peroksida
kemudian dilakukan pemanasan pada suhu 500 0C kemudian digunakan untuk
menyerap logam berat yaitu Cu2+ dan Ag+, hasilnya menunjukkan semakin tinggi
konsentrasi awal ion logam dalam cairan maka persentase ion logam yang terserap
dalam adsorben semakin menurun. Mirwan dan Wijayanti (2011) melakukan
penelitian terhadap penurunan ion Fe dan Mn menggunakan adsorben tanah
lempung gambut yang diaktivasi secara fisika dengan pemanasan pada suhu 600
0
C dan aktivasi secara kimia dengan cara penambahan HCl 0,25 M, dan hasilnya
daya serap yang cukup baik. Hanjaya dkk. (2013) menggunakan adsorben kitin
terfosforilasi dari limbah cangkang bekicot (Achatina fulica) untuk mengadsorpsi
ion Cd2+, hasil dari penelitian ini diperoleh kondisi optimum adsorpsi ion Cd2+
oleh kitin terfosforilasi terjadi pada pH 4, dan waktu kontak 60 menit dengan
persen adsorpsi masing-masing 92,3 % dan 75,3 %. Krisnawati dkk. (2013)
menggunakan cangkang telur bebek yang telah diaktivasi pada suhu 600 0C untuk
menyerap ion Cd2+, dan adsorpsi paling maksimum sebesar 64,6667 % pada
jumlah adsorben 1,5 gram.
Dari hasil penelitian terdahulu tentang penggunaan berbagai adsorben
sebagai bahan penyerap logam, maka peneliti tertarik untuk melakukan penelitian
tentang pembuatan adsorben dari limbah cangkang keong mas (Pomacea
canaliculata L.) yang telah dikalsinasi (CaO), karena selama ini pemanfaatan
cangkang keong mas masih sangat terbatas.
Pemanfaatan kalsium oksida (CaO) telah banyak digunakan baik sebagai
adsorben maupun sebagai katalis heterogen. Pembuatan kalsium oksida telah
banyak dilakukan oleh para peneliti terdahulu. Mohadi dkk. (2013) melakukan
penelitian tentang preparasi dan karakterisasi kalsium oksida (CaO) dari tulang
ayam, dimana CaO dapat diperoleh dari pemanasan sampel pada suhu 800 0C, 900
0
C, 1000 0C, dan 1100 0C. Semakin tinggi suhu dekomposisi, maka kristalinitas
CaO semakin baik. Lesbani et al. (2013) telah melakukan penelitian mengenai
pembuatan CaO dari cangkang bekicot (Achatina fulica) dengan suhu
dekomposisi selama 3 jam pada variasi temperatur 600 0C, 700 0C, 800 0C dan
900 0C. Serbuk cangkang bekicot yang telah dikalsinasi dianalisa menggunakan
X-ray Diffraction dan pola difraksi disesuaikan dengan pola XRD kalsium oksida
standar dari Joint Committee on Powder Diffraction Standards (JCPDS). Hasil
pola XRD menunjukkan cangkang bekicot yang didekomposisi pada suhu 700 0C
mirip dengan pola XRD kalsium oksida standar dari JCPDS.
Dari uraian di atas, peneliti melakukan penelitian tentang penyerapan ion
Cd2+ menggunakan cangkang keong mas (Pomacea canaliculata L.) yang telah
didekomposisi selama 3 jam pada temperatur 800 0C kemudian dihaluskan
sehingga menghasilkan serbuk cangkang keong dengan ukuran butir lolos ayakan
adsorben terhadap larutan yang mengandung logam Cd2+. Penentuan kadar ion
Cd2+ sebelum dan setelah diadsorpsi dilakukan dengan menggunakan
Spektrofotometer Serapan Atom(SSA).
1.2 Permasalahan
Berapakah pH optimum dan waktu pengadukan optimum untuk penyerapan ion
Cd2+ menggunakan serbuk cangkang keong mas.
1.3PembatasanMasalah
Dalam penelitian ini permasalahan dibatasi pada:
1. Cangkang keong yang digunakan adalah cangkang keong mas (Pomacea
canaliculata L.).
2. Ukuran serbuk keong mas yang digunakan adalah serbuk yang lolos
ayakan 100 mesh.
3. Konsentrasi ion Cd2+ yang digunakan adalah 5 mg/L sebanyak 50 mL.
4. Temperatur dekomposisi cangkang keong mas adalah 800 0C selama 3
jam.
1.4 Tujuan Penelitian
Untuk mengetahui pH optimum dan waktu pengadukan optimum penyerapan ion
Cd2+ menggunakan adsorben CaO dari serbuk cangkang keong mas.
1.5Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat memberikan informasi ilmiah bahwa
kalsium oksida yang berasal dari serbuk cangkang keong mas (Pomacea
berbagai industri, sehingga keong mas yang merupakan hama bagi tanaman padi
dapat dimanfaatkan dan bernilai ekonomis.
1.6Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Dasar LIDA USU, analisa
kualitatif kalsium oksida menggunakan X-Ray diffraction (XRD) di Laboratorium
Fisika umum UNIMED dan analisia ion Cd2+ dengan menggunakan
Spektrofotometer Serapan Atom (SSA) di Laboratorium Kimia Analitik FMIPA
USU.
1.7Metodologi Penelitian
Penelitian ini bersifat eksperimen laboratorium, yang meliputi beberapa tahapan :
1. Preparasi kalsium oksida dari cangkang keong mas (Pomacea canaliculata
L.).
2. Analisa kalsium oksida dalam cangkang keong mas setelah dikalsinasi
menggunakan X-ray Diffraction (XRD).
3. Penentuan pH optimum untuk penyerapan ion Cd2+.
4. Penentuan waktu kontak optimum adsorben terhadap penyerapan ion Cd2+.
5. Penentuan konsentrasi ion Cd2+ sebelum dan setelah diadsorpsi
Adapun variabel yang digunakan dalam penelitian ini adalah :
1. Variabel tetap, meliputi :
a. Ion logam yang diserap oleh adsorben adalah ion Cd2+.
b. Konsentrasi ion Cd2+ yang digunakan adalah 5 mg/L.
c. Volume ion Cd2+ yang digunakan adalah 50 mL.
d. Suhu dekomposisi cangkang keong mas yaitu 800 0C
e. Berat adsorben yang digunakan adalah 0,5 g.
f. Ukuran butir adsorben yang digunakan adalah 100 mesh.
2. Variabel terikat, meliputi :
a. pH penyerapan ion Cd2+ yaitu 3, 4, 5, 6 dan 7
BAB 2
TINJAUAN PUSTAKA
2.1 Keong Mas (Pomacea canaliculata L.)
Keong mas satu famili dengan keong lokal, yaitu keong gondang Pila
ampullacea, famili Ampullariidae yang merupakan siput air tawar. Siput ini
berbentuk bundar atau setengah bundar. Rumah siput berujung pada menara
pendek dengan 4 hingga 5 putaran kanal yang dangkal. Pada mulut rumah siput
terdapat penutup mulut yang disebut operculum yang kaku.keluarga siput
Ampullariidae berukuran besar, rumah siput bisa mencapai 100 mm.
Menurut Cowie, R.H (2007), Pomacea canaliculata L. sama dengan P.
insularum. Penamaan yang berbeda dari spesies yang sama tersebut karena P.
canaliculata banyak ditemukan pada lahan yang tergenang, sedangkan P.
insularum banyak ditemukan pada air dengan arus yang mengalir. Berdasarkan
contoh keong mas yang diambil dari beberapa Negara di Asia Tenggara, keong
mas termasuk P. canaliculata berasal dari beberapa daerah di Amerika Selatan,
termasuk Argentina.
Keong mas (Pomacea canaliculata L.) termasuk golongan mollusca atau siput
adalah golongan hewan bertubuh lunak dan tidak beruas. Binatang ini suka
mengeluarkan lendir, dan aktif makan pada malam hari. Pada siang hari biasanya
bersembunyi di tempat teduh dan lembab. Alat makannya berbentuk seperti lidah
dengan permukaan kasar yang disebut dengan radula. Jenis mollusca ini
menyerang tanaman dengan cara memakan atau merusak daun sehingga dalam
waktu relatif singkat tanaman sudah gundul (Rukmana, 1997).
P. canaliculata secara morfologi ditandai oleh karakteristik rumah siput
yang bundar dan menara pendek, rumah siput yang tebal, besar, lima sampai enam
putaran di dekat menara dengan kanal yang dalam, mulut yang besar dengan
sampai kuning muda, bergantung pada tempat berkembangnya, dagingnya lunak
berwarna putih krem atau merah jambu keemasan atau kuning orange.
Gambar 2.1 : Keong Mas (Pomacea canaliculata L.)
Klasifikasi ilmiah untuk keong mas adalah sebagai berikut:
Kingdom : Animalia
Filum : Mollusca
Kelas : Gastropoda
Sub family : Ampullarioidea
Family : Ampullariidae
Genus : Pomacea
Spesies : Pomacea canaliculata
Keong mas mempunyai gizi yang tinggi, selain protein, kalori dan
karbohidrat keong mas ini mengandung vitamin dan mineral, ini menjadi alasan
mengapa bisa menjadi alternatif terpenting dalam pembuatan rangsum untuk
pakan ternak. Habitat keong mas ini (khususnya di sumatera) berada pada
rawa-rawa, persawahan daerah tropik dan sub tropik dengan suhu terendah 10 0C.
Adapun rumah keong mas (cangkang) memiliki kandungan protein kasar, kalium,
bahan kering (kalsium) dan sejumlah kecil nitrogen dan fosfor. Komposisi
cangkang keong mas ini juga dipengaruhi oleh lingkungan tempat hidup keong
mas tersebut.
Setiawan (2008) telah meneliti kandungan cangkang keong mas dengan
kandungan CaCO3 sebanyak 95-99 %. Cangkang keong mas ini digunakan
sebagai energizer di dalam proses karburisasi padat pada baja karbon rendah.
Komposisi pada cangkang keong mas hampir sama dengan jenis hewan mollusca
lainnya. Cangkang keong mas hampir seluruhnya dari kalsium karbonat. Kalsium
komposisi protein struktural, dan senyawa fosfor (Gosu, 2011). Secara kimia abu
cangkang keong mas terdiri dari oksida logam berupa 61,95 % CaO, 10,20 %
SiO2, 3,15 % Fe2O3, 0,18 % MgO, 4,81 % Al2O3, 0,03 % SO3, 0,05 % K2O, 0,04
% Na2O, 0,01% P2O5, 0,01 %MnO3 dan 0,01 % TiO2 (Etuk dkk., 2012).
2.2 Kalsium Oksida
Kalsium oksida merupakan padatan kristal berwarna putih yang memiliki titik
lebur 2572 0C. Kalsium oksida dapat dibuat dengan memanaskan limestone, coral,
kerang laut, atau kapur, yang sebagian besar disebut dengan CaCO3 pada suhu
500 – 6000C, untuk menghilangkan karbon dioksida.
CaCO3(s) → CaO(s) + CO2(g)
Reaksi ini merupakan reaksi reversibel, kalsium oksida akan bereaksi dengan
karbon dioksida untuk membentuk kalsium karbonat. Produksi kalsium oksida
dari batu kapur merupakan salah satu transformasi kimia tertua yang diproduksi
oleh manusia.
Kalsium oksida memiliki berbagai sebutan dalam bahasa kuno. Dalam
bahasa latin, kalsium oksida disebut dengan abu yang diambil dari elemen
kalsium. Dalam bahasa inggris kuno, namanya adalah lime, yang merupakan
asal-usul nama komersial modern untuk kalsium oksida yaitu kapur. Banyaknya kapur
di kerak bumi dan kemudahannya transformasi kalsium oksida cukup untuk
menjelaskan mengapa kapur merupakan salah satu produk kimia tertua. Lime
memiliki banyak sifat yang membuatnya cukup berharga. Hal ini sangat berguna
dan saat ini diproduksi industri dalam skala besar, lebih dari 22 juta ton yang
diproduksi di Amerika Serikat pada tahun 2000.
Pada awal penggunaan lime, mengeksploitasi kemampuannya untuk
bereaksi dengan karbon dioksida untuk membentuk kalsium karbonat. Ketika
kapur dicampur dengan air dan pasir, hasilnya adalah mortar, yang digunakan
dalam konstruksi untuk mengamankan batu bata. Campuran ini secara bertahap
Hal ini dipercepat dengan mencampurkan kapur dengan air, membentuk kalsium
hidroksida, yang disebut kapur mati.
CaO(s) + H2O(l) → Ca(OH)2(s)
Bahkan dengan kecepatan reaksi yang terus meningkat, mortar membutuhkan
bertahun-tahun untuk dapat bereaksi dan reaksi tersebut dapat terjadi secara
lengkap (http://en.wikipedia.org/wiki/Calcium_Oxide.html).
2.2.1 Penggunaan Kalsium Oksida
Kalsium oksida banyak digunakan sebagai adsorben untuk menyerap logam.
Jasinda dkk. (2013) menggunakan cangkang telur bebek yang telah diaktivasi
pada suhu 600 0C dan menggunakannya sebagai adsorben ion kadmium. Nilai
persentase kemampuan adsorbsi cangkang telur bebek dalam menyerap logam
adalah 64,6667 %.
Perkembangan katalis CaO menjadi katalis CaO super basa untuk reaksi
transesterifikasi pembentukan biodiesel. Aktivitas katalis CaO dan katalis CaO
super basa diuji melalui reaksi transesterifikasi di dalam reaktor gelas pada suhu
60-65 0C. kadar metal ester biodiesel yang dihasilkan mencapai 98,8 % (Fanny et
al. 2012).
CaO juga merupakan bahan penting dalam pembuatan bahan kimia.
Penggunaannya yang utama yaitu dalam memproduksi kalsium karbida, CaC2.
Kalsium karbida diproduksi dengan memanaskan kapur. Penggunaan yang kapur
yang paling penting juga bergantung pada kemampuannya untuk membentuk
larutan dengan silikat. Hampir 45 % dari kapur yang digunakan dalam industri
baja. Baja dan besi yang dihasilkan dari bijih, yaitu batuan yang mengandung besi
oksida. Bijih ini juga mengandung sejumlah besar silikat. Ketika kalsium oksida
dicampur dengan bijih dan campuran meleleh, silikat ini bergabung dengan kapur,
membentuk larutan cair.
Dalam industri kertas menggunakan kayu dalam pembuatan pulp, karena
kalsium oksida sangat alkali, sehingga dapat digunakan untuk melarutkan lignin
menyebabkan koagulasi bahan tanaman, yang memungkinkan untuk lebih mudah
dipisahkan dari sirup gula (http://en.wikipedia.org/wiki/Calcium_Oxide.html).
2.3 Pencemaran Logam Berat
Logam berat adalah unsur logam yang mempunyai densitas <5 g/cm3 dalam air
laut, logam berat terdapat dalam bentuk terlarut dan tersuspensi. Dalam kondisi
alam ini, logam berat dibutuhkan oleh organism untuk pertumbuhan dan
perkembangan hidupnya (Effendi, 2000).
Selain bersifat racun, logam berat juga terakumulasi dalam sedimen dan
biota melalui proses biokonsentrasi, bioakumulasi dan biomagnifikasi oleh biota
laut. Logam-logam berat yang masuk ke dalam tubuh hewan umumnya tidak
dikeluarkan lagi dari tubuh mereka. Karena itu logam-logam cenderung untuk
menumpuk dalam tubuh mereka. Sebagai akibatnya, logam-logam ini akan terus
ada di sepanjang rantai makanan. Hal ini disebabkan karena predator pada satu
trofik level yang lebih rendah yang telah tercemar (Hutabarat, 1991).
Logam berat biasanya ditemukan sangat sedikit sekali dalam air secara
alamiah, yaitu kurang dari 1 ηg/l. Bila terjadi erosi alamiah, konsentrasi logam
tersebut dapat meningkat. Dalam mempelajari konsentrasi dalam lingkungan
perairan, terlebih dahulu perlu diketahui tujuan dan pengetahuan mengenai
spesiasi logam. Idealnya penelitian tersebut harus terllebih dahulu mengetahui
alur pergerakan logam yang diteliti, hubungan interaksi masing-masing logam
terhadap logam lain, model distribusi logam dalam jaringan biota air, dan
akumulasinya dalam setiap jaringan.
Logam juga dapat menyebabkan timbulnya suatu bahaya pada makhluk
hidup. Hal ini terjadi jika sejumlah logam mencemari lingkungan. Logam-logam
tertentu sangat berbahaya jika ditemukan dalam konsentrasi tinggi dalam
lingkungan, karena logam tersebut mempunyai sifat merusak tubuh makhluk
hidup. Di samping hal tersebut, beberapa logam sangat diperlukan dalam proses
kehidupan makhluk hidup. Dalam hal ini logam dapat dibagi menjadi dua bagian,
membantu di dalam proses fisiologi makhluk hidup dengan jalan membantu kerja
enzim atau pembentukan organ dari makhluk yang bersangkutan. Sedangkan
logam non esensial adalah logam yang peranannya dalam tubuh makhluk hidup
belum diketahui, kandungannya dalam jaringan hewan sangat kecil dan apabila
kandungannya tinngi akan merusak organ tubuh makhluk yang bersangkutan
(Vogel, A.I. 1994).
Toksisitas logam berat bisa dikelompokkan menjadi 3, yaitu bersifat toksik
tinggi yang terdiri dari unsur-unsur Hg, Cd, Pb, Cu dan Zn; bersifat toksik sedang
yang terdiri dari unsur-unsur Cr, Ni dan Co; dan bersifat toksik rendah yang
terdiri atas unsure Mn dan Fe. Tingkat toksisitas logam berat terhadap hewan air,
mulai dari yang paling toksik, adalah Hg, Cd, Zn, Pb, Cr, Ni dan Co. tingkat
toksisitas terhadap manusia dari yang paling toksik adalah Hg, Cd, Ag, Ni, Pb,
As, Cr, Sn, dan Zn (Widowati dkk. 2008).
2.3.1 Kadmium (Cd)
Kadmium merupakan salah satu unsur logam transisi golongan 2B yang berwarna
putih perak dan mudah dibentuk.kadmium memiliki massa atom 112,41 sma,
densitas 8,65 gram/cm3, dan memiliki titik lebur 594,26 K. Kadmium ditemukan
di alam dalam mineral greenockite, dan dipisahkan dengan seng melalui
penyulingan (destilasi) bertingkat atau melalui proses elektrolisis (Sunardi. 2006).
Unsur logam berat Kadmium (Cd) terdapat dalam tanah secara alami
dengan kandungan rata-rata rendah yaitu 0,4 mg/kg tanah. Pada tanah yang bebas
polusi kandungannya adalah 0,06-1,00 mg/kg tanah. Peningkatan kandungan
kadmium dapat berasal dari asap kendaraan dan pupuk fosfat yang terakumulasi di
tanah. Pada umumnya tanaman menyerap hanya sedikit (1-5 %) larutan kadmium
yang ditambahkan ke dalam tanah. Akumulasi dalam jangka waktu lama dapat
meningkatkan kandungan kadmium dalam tanah dan tanaman yang sedang
tumbuh. Sayuran mengakumulasi kadmium lebih banyak dibandingkan tanaman
2.3.1.1 Pemanfaatan Kadmium
Logam kadmium digunakan untuk elektrolisis, bahan pigmen untuk industri cat,
enamel dan plastik. Logam kadmium masuk ke dalam jaringan makhluk hidup
melalui beberapa cara seperti pernapasan, pencernaan dan penetrasi melalui kulit
(Darmono, 1999).
Kadmium merupakan logam yang sangat penting dan banyak
kegunaannya, khususnya untuk electroplating (pelapisan elektrik) serta
galvanisasi karena kadmium memiliki keistimewaan nonkorosif. Kadmium
banyak digunakan dalam pembuatan alloy, pigmen warna pada cat, keramik,
plastik, stabilizer plastik, katode untuk Ni-Cd pada baterai, bahan fotografi,
pembuatan tabung TV, karet, sabun, kembang api, percetakan tekstil, dan pigmen
untuk gelas dan email gigi (Widowati dkk. 2008).
Pemanfaatan kadmium dan persenyawaannya meliputi:
1. Senyawa CdS dan CdSeS yang banyak digunakan sebagai zat warna.
2. Senyawa Cd sulfat (CdSO4) yang digunakan dalam industry baterai
yang berfungsi sebagai pembuatan sel wseton karena memiliki
potensial voltase stabil.
3. Senyawa Cd-bromida dan Cd-iodida yang digunakan untuk fotografi.
4. Senyawa dietil-Cd yang digunakan dalam pembuatan tetraetil-Pb.
5. Senyawa Cd-stearat untuk perindustrian polivinilklorida sebagai bahan
untuk stabilizer.
Kadmium dalam konsentrasi rendah banyak digunakan dalam industri pada proses
pengolahan roti, pengolahan ikan, pengolahan minuman serta industri tekstil.
2.3.1.2 Efek Logam Kadmium dalam Tubuh
Kadmium sangat membahayakan kesehatan karena pengaruh racun akut dari
unsur tersebut sangat buruk. Diantara penderita yang keracunan kadmium
mengalami tekanan darah tinggi, kerusakan ginjal, kerusakan jaringan testicular,
beras yang berasal dari lahan sawah yang lama mengalami kekeringan telah
menimbulkan penyakit itai-itai dengan gejala nyeri pada pinggang dan otot kaki
(Subowo et al. 1999).
Jonak et al. (2004) menjelaskan bahwa kadmium tidak diketahui memiliki
fungsi biologis di dalam sel tetapi memiliki sifat reaktif yang sangat tinggi dan
dapat menginaktifkan berbagai macam aktivitas enzim yang diperlukan oleh sel.
Setelah diabsorpsi, logam berat kadmium menimbulkan toksisitas (Rico et al.
2002). Di dalam ginjal, akumulasi kadmium terjadi umumnya di dalam tubulus
proximal serta segmen-segmen nefron lainnya yang hanya terjadi pada akhir tahap
intoksifikasi (Yokouchi et al. 2007).
Menurut Sudarmadji (2006), dalam tubuh manusia kadmium terutama
dieliminasi melalui urin. Hanya sedikit yang diabsorbsi, yaitu 5-10 %. Absorbsi
dipengaruhi oleh faktor diet seperti intake protein, kalsium, Vitamin D dan trace
logam seperti seng (Zn). Proporsi yang besar adalah absorbsi melalui pernapasan
yaitu antara 10-40 % tergantung keadaan fisik. Uap kadmium sangan toksik
dengan lethal close melalui pernapasan diperkirakan 10 menit terpapar sampai
dengan 190 mg/m3 selama 240 menit akan dapat menimbulkan kematian. Gejala
umum keracunan Cd adalah sakit di dada, nafas sesak, batuk-batuk dan lemah.
Terpapar akut oleh kadmium (Cd) menyebabkan gejala nausea (mual),
muntah, diare, kram otot, anemia, dermatitis, pertumbuhan lambat, kerusakan
ginjal dan hati dan gangguan kardiovaskuler, emphysema dan degenerasi
testicular. Perkiraan dosis mematikan akut adalah sekitar 500 mg/kg untuk
dewasa dan efek dosis akan Nampak jika terabsorbsi 0,043 mg/kg per hari. Gejala
akut keracunan kadmium adalah sesak dada, kerongkongan kering dan dada terasa
sesak, nafas pendek, terengah-engah, distress dan bisa berkembang kearah
penyakit radang paru-paru, sakit kepala dan menggigil, bahkan dapat diikuti
dengan kematian. Gejala kronis keracunan kadmium adalah nafas pendek,
kemampuan mencium bau menurun, berat badan menurun, gigi terasa ngilu dan
2.4 Adsorpsi
Adsorpsi adalah proses akumulasi substansi adsorbat pada permukaan adsorben
yang disebabkan oleh gaya tarik antar molekul atau interaksi kimia atau suatu
akibat dari medan gaya pada permukaan padatan (adsorben). Proses ini dapat
terjadi sebagai proses fisika yang melibatkan gaya van der Waals dan ikatan
hydrogen, dan selanjutnya dikenal dengan fisisorpsi dan dapat juga terjadi proses
kimia yang melibatkan pembentukan senyawa kimia melalui ikatan kimia yang
lebih kuat dan dikenal sebagai kemisorpsi.
Adsorpsi kimia melibatkan ikatan koordinasi sebagai hasil penggunaan
bersama pasangan electron oleh padatan (adsorben) dan adsorbat. Pada adsorpsi
fisika ikatan pada permukaan adsorben lemah dan bersifat reversibel, sehingga
molekul-molekul yang telah teradsorpsi mudah lepas dengan cara menurunkan
tekanan gas atau konsentrasi zat terlarut (Oscik, 1982). Luas permukaan spesifik
sangat mempengaruhi besarnya kapasitas adsorpsi dari adsorben (Saputra, 2008)
Berkat selektivitasnya yang tinggi, proses adsorpsi sangat sesuai untuk
memisahkan bahan dengan konsentrasi yang kecil dari campuran yang
mengandung bahan lain yang berkonsentrasi tinggi. Bahan yang akan dipisahkan
tentu saja harus dapat diadsopsi. Sebaliknya, untuk memisahkan bahan dengan
konsentrasi yang lebih besar lebih disukai proses pemisahan, karena mahalnya
regenerasi adsorben (Bernasconi, 1995).
2.5 Hamburan Sinar-X
Sinar-x dihasilkan dalam tabung sinar katoda ketika elektron-elektron berenergi
tinggi mengenai target-target logam. Ketika sinar-x difokuskan ke suatu sampel
(dalam bentuk pellet atau silinder), maka terjadi dua tipe hamburan. Jika sampel
tersebut kristal, sinar-x dihamburkan secara koheren, artinya tidak ada panjang
gelombang atau fasa antara sinar-sinar insiden dan yang dihamburkan. Hamburan
koheren umumnya dinyatakan sebagai difraksi sinar-x. jika sampel memiliki
morfologi yang nonhomogen (semi kristal), hamburan tersebut tidak koheren,
terjadi perubahan panjang gelombang dan fasa. Hamburan tidak koheren (juga
disebut hamburan Compton) dinyatakan sebagai difraksi difusi atau yang
2.6 Spektrofotometri Serapan Atom (SSA)
2.6.1 Prinsip Dasar Spektrofotometri Serapan Atom (SSA)
Interaksi materi dengan berbagai energi seperti energi panas, energi radiasi, energi
kimia, dan energi listrik selalu memberikan sifat-sifat yang karakteristik untuk
setiap unsur (persenyawaan), dan besarnya perubahan yang terjadi biasanya
sebanding dengan jumlah unsur atau persenyawaan . Di dalam kimia analisis yang
mendasarkan pada proses interaksi itu antara lain cara analisis speltrofotometri
atom yang berupa cara emisi dan cara absorbsi (serapan).
Pada cara emisi interaksi dengan energi menyebabkan eksitasi atom yang
mana keadaan ini tidak berlangsung lama dan akan kembali ke tingkat semula
dengan melepaskan sebagian atau seluruh energi eksitasinya dalam bentuk radiasi.
Frekuensi radiasi yang dipancarkan bersifat karakteristik untuk setiap unsur dan
intensitasnya sebanding dengan jumlah atom yang tereksitasi dan yang mengalami
proses de-eksitasi. Pemberian energi dalam bentuk nyala merupakan slaah satu
cara untuk eksitasi atom ke tingkat yang lebih tinggi. Cara tersebut dikenal dengan
nama spektrofotometri emisi nyala.
Pada absorbsi, jika pada populasi atom yang berada pada tingkat dasar
dilewatkan suatu berkas radiasi maka akan terjadi penyerapan energi radiasi oleh
atom-atom tersebut. Frekuensi radiasi yang paling banyak diserap adalah
frekuensi radiasi resonan dan bersifat karakteristik untuk tiap unsur. Pengurangan
2.6.2 Instrumentasi Spektrofotometri Serapan Atom (SSA)
Sistem peralatan pada Spektrofotometri serapan atom adalah :
Gambar 2.2. Komponen-komponen spektrofotometer serapan atom (Day, 1998)
1. Sumber Sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hollow cathode
lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung suatu katoda
dan anoda. Katoda sendiri berbentuk silinder berongga yang terbuat dari logam
atau dilapisi dengan logam tertentu. Tabung logam ini diisi dengan gas mulia
(neon atau argon) dengan ttekanan rendah (10-15 torr). Neon biasanya paling
sering dipakai karena memberikan intensitas pancaran yang lebih rendah. Bila
antara katoda dan anoda diberikan tegangan yang tinggi (600 volt), maka katoda
akan memancarkan berkas-berkas electron yang bergerak menuju anoda yang
mana kecepatan dan energinya sangat tinggi. Elektron-elektron dengan energi
tinggi ini dalam perjalanannya menuju anoda akan bertabrakan dengan gas-gas
mulia yang diisikan tadi.
Akibat dari tabrakan-tabrakan ini membuat unsur-unsur gas mulia akan
kehilangan elektron dan menjadi ion bermuatan positif. Ion-ion gas mulia yang
bermuatan positif selanjutnya akan bergerak ke katoda dengan kecepatan dan
energi yang tinggi pula. Sebagaimana disebutkan di atas, pada katoda terdapat
unsur-unsur yang sesuai dengan unsur yang akan dianalisis. Unsur-unsur ini akan
Tabung Katoda
berongga Pemotong berputar Nyala Monokromator Detektor Penguat arus Pencatat
Sumber
Tenaga Motor
Bahan
ditabrak oleh ion-ion positif gas mulia. Akibat tabrakan ini, unsur-unsur akan
terlempar keluar dari permukaan katoda. Atom-atom unsur dari katoda ini
kemudian akan mengalami eksitasi ke tingkat energi-energi elektron yang lebih
tinggi dan akan memancarkan spektrum pancaran dari unsur yang sama dengan
unsur yang akan dianalisis.
2. Tempat sampel
Dalam analisis dengan spektrofotometri serapan atom, sampel yang akan
dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan
gas. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu
sampel menjadi uap atom-atom yaitu :
a. Nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan
menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi. Pada cara
spektrofotometri emisi atom, nyala ini berfungsi untuk mengeksitasikan atom dari
tingkat dasar ke tingkat yang lebih tinggi.
Suhu yang dapat dicapai oleh nyala tergantung pada gas-gas yang
digunakan, misalnya untuk gas batubara-udara, suhunya kira-kira sebesar 1800
0
C, gas alam-udara 1700 0C, asetilen-udara 2200 0C, dan gas asetilen-dinitrogen
oksida (N2O) sebesar 3000 0C.
b. Tanpa nyala (Flameless)
Proses pengatoman tanpa nyala dapat dilakukan dalam tungku dari grafit seperti
tungku yang dikembangkan oleh Masmann. Sistem pemanasan dengan tanpa
nyala ini dapat melalui tiga tahap yaitu pengeringan (drying) yang membutuhkan
suhu yang rendah, pengabuan (ashing) yyang membutuhkan suhu yang lebih
tinggi karena untuk menghilangkan matriks kimia dengan mekanisme volatilitasi
atau pirolisis, dan pengatoman (atomising). Pada umumnya waktu dan suhu
3. Monokromator
Pada spektrofotometri serapan atom, monokromator dimaksudkan untuk
memisahkan dan memilih panjang gelombang yang digunakan dalam analisis.
Disamping sistem optik, dalam monokromator juga terdapat suatu alat yang
digunakan untuk memisahkan radiasi resonansi dan kontinyu yang disebut dengan
chopper.
4. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat
pengatoman. Biasanya digunakan tabung penggandaan foton (photomultiplier
tube). Ada dua cara yang dapat digunakan dalam sistem deteksi yaitu yang
memberikan respon terhadap radiasi resonansi dan radiasi kontinyu, dan yang
hanya memberikan respon terhadap radiasi resonansi
5. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai sistem
pencatat hasil. Pencatat hasil dilakukan dengan suatu alat yang telah terkalibrasi
untuk pembacaan suatu angka transmisi atau absorbs. Hasil pembacaan dapat
berupa angka atau berupa kurva dari suatu recorder yang menggambarkan
BAB 3
METODE PENELITIAN
3.1 Alat dan Bahan 3.1.1 Alat-Alat
− Spektrofotometer Serapan Atom Shimadzu AA-6300
− Difraksi Sinar-X Shimadzhu 6100
− Furnace Galenkamp
− Oven Carbolite
− Kertas Saring No. 42 Whatman
− Neraca Analitis AND
− Hotplate
− Alu dan Lumpang
− Botol Kaca
− Ayakan 100 Mesh
− Cawan Porselin
− Pengaduk magnet
− pH meter Trans Instrumen TI 9000
− Batang pengaduk
− Spatula
− Gelas Beaker Pyrex
− Pipet Volume Pyrex
− Pipet Skala Pyrex
− Labu Takar Pyrex
− Erlenmeyer Pyrex
3.1.2 Bahan-Bahan
− Cangkang Keong Mas
− Cd(NO3)2.5H2O p.a ( E. Merck )
− HCl(P) 65% p.a ( E. Merck )
− NaOH pellet p.a ( E. Merck )
− Akuades
3.2 Prosedur Penelitian
3.2.1 Preparasi dan Karakterisasi CaO dari Cangkang Keong Mas
Cangkang keong mas dicuci dengan air kemudian dibilas menggunakan akuades.
Selanjutnya dikeringkan di dalam oven pada suhu 1100C selama 2 jam. Cangkang
keong mas selanjutnya dipecah-pecah menjadi bagian-bagian yang lebih kecil,
kemudian di kalsinasi di dalam Furnace pada suhu 8000C selama 3 jam. Abu
cangkang keong kemudian dihaluskan dan diayak hingga diperoleh serbuk
cangkang dengan ukuran butir lolos ayakan 100 mesh dan ditentukan kandungan
kalsium oksidanya secara kualitatif menggunakan X-Ray Diffraction (XRD).
3.2.2 Pembuatan Pereaksi
3.2.2.1 Pembuatan Larutan HCl 0,1M
Dimasukkan ± 50 mL akuades ke dalam labu takar 100 mL dan ditambahkan 8,3
mL HCl(P) 37% secara perlahan-lahan. Dibiarkan larutan hingga dingin, kemudian
ditambahkan akuades hingga garis batas dan dihomogenkan (HCl 1M).
Selanjutnya dipipet sebanyak 10 mL larutan tersebut dan dimasukkan ke dalam
labu takar 100 mL lainnya. Ditambahkan akuades hingga garis batas dan
dihomogenkan.
3.2.2.2 Pembuatan Larutan NaOH 0,1M
Sebanyak 4 gram NaOH pellet dimasukkan ke dalam beaker glass dan dilarutkan
menggunakan 50 mL akuades. Dimasukkan larutan NaOH tersebut ke dalam labu
takar 100 mL dan ditambahkan dengan akuades hingga garis batas lalu
dan dimasukkan ke dalam labu takar 100 mL lainnya. Ditambahkan akuades
hingga garis batas dan dihomogenkan.
3.2.3 Pembuatan Larutan Standar Cd2+
3.2.3.1 Pembuatan Larutan Standar Cd2+ 1000 mg/L
Sebanyak 2,9107 g Cd(NO3)2.5H2O dimasukkan ke dalam gelas beaker 250 mL
yang berisi akuades, diaduk hingga seluruh kristal larut, dimasukkan ke dalam
labu takar 1000 mL, ditambahkan akuades hingga garis batas dan dihomogenkan.
3.2.3.2 Pembuatan Larutan Standar Cd2+ 100 mg/L
Dipipet sebanyak 10 mL larutan induk Cd2+ 1000 mg/L dan dimasukkan ke dalam
labu takar 100 mL, kemudian ditambahkan akuades hingga garis batas dan
dihomogenkan.
3.2.3.3 Pembuatan Larutan Standar Cd2+ 10 mg/L
Dipipet 10 mL larutan induk Cd2+ 100 mg/L dan dimasukkan ke dalam labu takar
100 mL, kemudian ditambahkan akuades hingga garis tanda dan dihomogenkan.
3.2.3.4 Pembuatan Seri Larutan Standar Cd2+ 0,5; 1,0; 1,5; 2,0; dan 2,5 mg/L
Dipipet 2,5; 5,0; 7,5; 10 dan 12,5 mL larutan induk Cd2+ 10 mg/L dan dimasukkan
ke dalam labu takar 50 mL, kemudian ditambahkan akuades hingga garis tanda
dan dihomogenkan.
3.2.3.5 Pembuatan Kurva Kalibrasi Cd2+
Larutan blanko diukur absorbansinya dengan Spektrofotometer Serapan Atom
(SSA) pada λ = 228,8 nm dan dilakukan hal yang sama untuk larutan seri standar
Cd2+ 0,5; 1,0; 1,5; 2,0 dan 2,5 mg/L.
3.2.4 Adsorbsi Ion Cd2+ Menggunakan Serbuk Cangkang Keong Mas 3.2.4.1 Penentuan pH Optimum Penyerapan
Sebanyak 50 mL larutan standar Cd2+ 5 mg/L dimasukkan ke dalam erlenmeyer
250 mL dan diatur pada pH 3. Ditambahkan sebanyak 0,5 g serbuk CaO lalu
kemudian disaring menggunakan kertas saring whatman no. 42, dan filtratnya
diukur kadar kadmiumnya menggunakan spektrofotometer serapan atom pada λ =
228,8 nm. Dilakukan hal yang sama dengan variasi pH larutan 4, 5, 6 dan 7.
3.2.4.2 Penentuan Waktu Pengadukan Optimum
Sebanyak 50 mL larutan standar Cd2+ 5 mg/L dimasukkan ke dalam erlenmeyer
250 mL dan diatur pada pH 4. Ditambahkan sebanyak 0,5 g serbuk CaO. Larutan
kemudian diaduk menggunakan pengaduk magnet pada kecepatan 350 rpm
selama 15 menit, kemudian disaring menggunakan kertas saring whatman no. 42,
dan filtratnya diukur kadar kadmiumnya menggunakan spektrofotometer serapan
atom pada λ = 228,8 nm. Dilakukan hal yang sama dengan variasi waktu
3.3 Bagan Penelitian
3.3.1 Preparasi dan Karakterisasi CaO dari Cangkang Keong Mas
Cangkang Keong Mas
Dicuci dengan air hingga bersih dan dibilas
dengan akuades
Dikeringkan dalam oven pada suhu 1100C selama
2 jam
Dipanaskan menggunakan furnace pada suhu
8000C selama 3 jam
Dihaluskan dengan alu dan lumpang
Diayak hingga diperoleh serbuk cangkang keong mas dengan ukuran butir lolos ayakan 100 mesh
Serbuk cangkang keong mas
Dianalisa kandungan kalsium oksida menggunakan
X-Ray Diffraction (XRD)
3.3.2 Penentuan Kurva Kalibrasi Larutan Standar
Larutan standar Cd2+ 1000 mg/L
Dipipet sebanyak 10 mL
Dimasukkan ke dalam labu takar 100 mL
Diencerkan dengan akuades hingga garis batas
Dihomogenkan
Larutan standar Cd2+ 100 mg/L
Dipipet sebanyak 10 mL
Dimasukkan ke dalam labu takar 100 mL
Diencerkan dengan akuades hingga garis batas
Dihomogenkan
Larutan standar Cd2+ 10 mg/L
Dipipet sebanyak 2,5; 5,0; 7,5; 10,0 dan 12,5 mL
Dimasukkan ke dalam labu takar 50 mL
Diencerkan dengan akuades hingga garis batas
Dihomogenkan
Larutan seri standar Cd2+ 0,5; 1,0; 1,5; 2,0 dan 2,5 mg/L
Diukur absorbansinya menggunakan Spektrofotometer Serapan Atom pada
λ = 228,8 nm
3.3.3 Adsorpsi Ion Cd2+ Menggunakan Serbuk Cangkang Keong Mas 3.3.3.1 Penentuan pH Optimum Penyerapan
Catatan : Perlakuan yang sama dilakukan pada pH larutan 4, 5, 6 dan 7 50 mL Larutan Standar Cd2+ 5 ppm
Dimasukkan ke dalam erlenmeyer 250
mL
Diatur pada pH 3
Ditambahkan 0,5 g serbuk cangkang keong mas ukuran butir lolos ayakan 80 mesh
Diaduk pada kecepatan 350 rpm selama 30 menit menggunakan magnetik stirer
Disaring menggunakan kertas saring whatman No. 42
Filtrat Residu
Dicek pH-nya hingga 3,50
Diukur absorbansinya dengan menggunakan Spektrofotometer Serapan Atom pada λ = 228,8
3.3.3.2 Penentuan Waktu Pengadukan Optimum
Catatan : Perlakuan yang sama untuk variasi waktu pengadukan selama 30, 45 dan 60 menit
Dicek pH-nya hingga 3,50
Diukur absorbansinya dengan menggunakan Spektrofotometer Serapan Atom pada λ = 228,8 nm 50 mL Lerutan Standar Cd2+ 5 ppm
Dimasukkan ke dalam erlenmeyer 250 ml
Diatur pada pH 4
Ditambahkan 0,5 g serbuk cangkang keong mas ukuran butir lolos ayakan 100 mesh
Diaduk pada kecepatan 250 rpm selama
15 menit menggunakan magnetik stirrer
Disaring menggunakan kertas saring whatman No. 42
Filtrat Residu
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Karakterisasi Kalsium Oksida dalam Serbuk Cangkang Keong Mas (Pomacea Canaliculata L.)
Karakterisasi kalsium oksida dalam serbuk cangkang keong mas dilakukan
dengan menggunakan difraksi sinar-X (XRD), dimana pola hasil difraksi ini
kemudian dicocokkan dengan pola difraksi kalsium oksida murni dari Joint
Commite on Powder Diffraction Standards (JCPDS). Kandungan kalsium oksida
dalam serbuk cangkang keong mas yang dikalsinasi pada suhu 800 0C dianalisa
melalui pengamatan 2Ɵ.
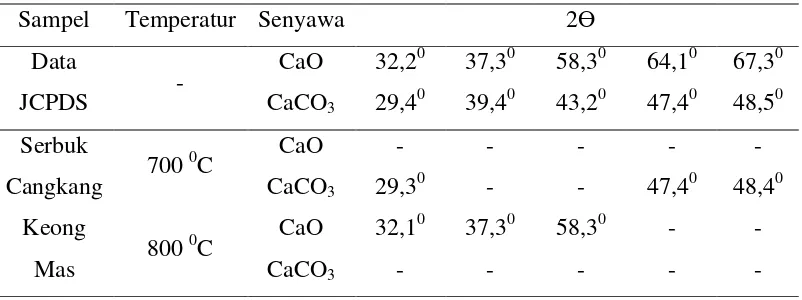
Tabel 4.1 Data 2Ɵ senyawa kalsium oksida dari JCPDS
Sampel Temperatur
Dekomposisi 2Ɵ
Data JCPDS - 32,20 37,30 58,30 64,10 67,30
Serbuk
Cangkang Keong
Mas
800 0C 32,10 37,30 58,30 - -
4.1.2. Pengukuran Ion Kadmium (Cd2+)
Kondisi alat spektrofotometer serapan atom (SSA) pada pengukuran ion kadmium
(Cd2+) dapat dilihat pada tabel 4.2 dan data absorbansi larutan seri standar ion
Tabel 4.2 Kondisi alat SSA Merk Shimadzu tipe AA-6300
No Parameter Ion Kadmium (Cd2+)
1 Panjang Gelombang (nm) 228,8
2 Tipe Nyala Udara-C2H2
3 Kecepatan Aliran Gas Pembakar (L/min) 1,8
4 Kecepatan Aliran Udara (L/min) 15,0
5 Lebar Celah (nm) 0,7
6 Ketinggian Tungku (mm) 7,0
Tabel 4.3 Data Absorbansi Larutan Seri Standar Ion Kadmium (Cd2+)
Konsentrasi (mg/L) Absorbansi Rata-Rata (A)
0,0000 0,0036
0,5000 0,1791
1,0000 0,3078
1,5000 0,4913
2,0000 0,6642
2,5000 0,7934
4.1.2.1 Penurunan Persamaan Garis Regresi dengan Metode Least Square
Hasil pengukuran absorbansi larutan seri standar ion Kadmium (Cd2+) pada Tabel
4.3 diplotkan terhadap konsentrasinya sehingga diperoleh suatu kurva kalibrasi
berupa garis linear. Persamaan garis regresi untuk kurva kalibrasi ini dapat
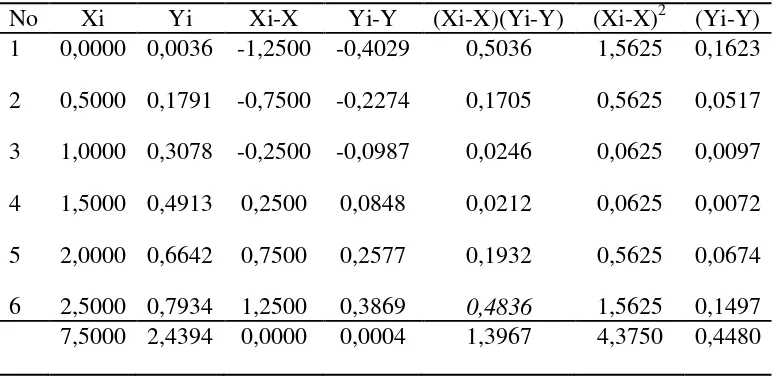
Tabel 4.4 Penurunan Persamaan Garis Regresi untuk Penentuan Konsentrasi Ion Kadmium (Cd2+) Berdasarkan Pengukuran Absorbansi Larutan Seri Standar Ion Kadmium (Cd2+)
X = Data konsentrasi larutan seri standar
Y = Data absorbansi yang ditentukan menggunakan alat spektrofotometer serapan
atom.
Nilai X dan Y dari data di atas dapat ditentukan dengan persamaan :
� =∑ ��
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan:
�=��+�
Dimana: � =���������
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least
Square sebagai berikut :
�= ∑(�� − �)(�� − �)
∑(�� − �)2
� =1,3967
4,3750
� = 0,3192
Sehingga diperoleh harga slope (�) = 0,3192
Harga intersept (�) diperoleh melalui substitusi (�) ke persamaan berikut :
�= ��+�
�=� − ��
�= 0,4065−(0,3192)(1,2500)
�= 0,0075
Sehingga diperoleh garis regresi yang diperoleh adalah :
�= 0,3192�+ 0,0075
4.1.2.2 Penentuan Koefisien Korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai
berikut:
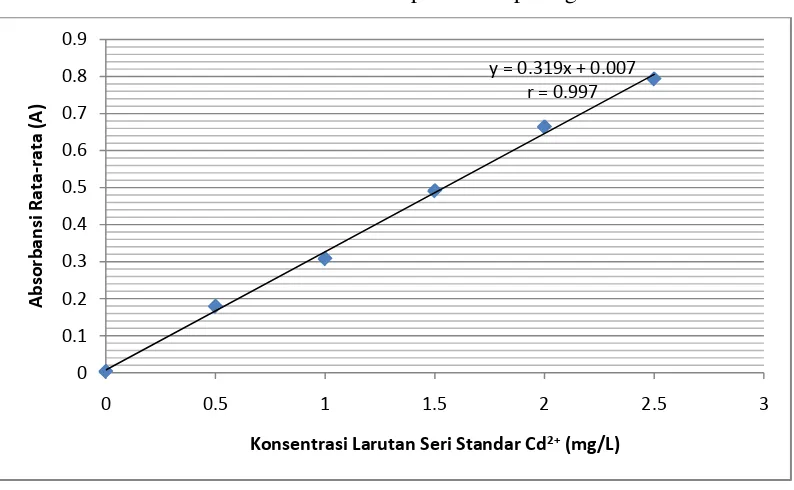
Kurva kalibrasi larutan seri standar Cd2+ dapat dilihat pada gambar 4.1 berikut:
Gambar 4.1 Kurva kalibrasi larutan seri standar Cd2+
4.1.3 Adsorpsi Ion Kadmium (Cd2+) Menggunakan Kalsium Oksida (CaO) dari Serbuk Cangkang Keong Mas
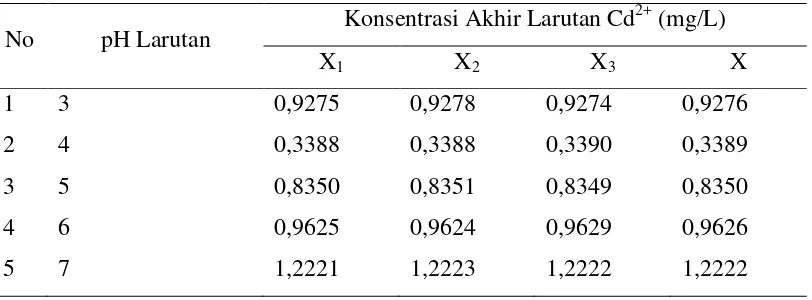
4.1.3.1 Data Penentuan pH Optimum
Penentuan pH optimum pada penelitian ini dilakukan mulai dari pH 3 sampai
dengan pH 7. Data penentuan pH optimum dapat dilihat pada tabel 4.5 berikut :
y = 0.319x + 0.007
Tabel 4.5 Data Penentuan pH Optimum Adsorpsi pada 3 kali Pengukuran
No pH Larutan Konsentrasi Akhir Larutan Cd
2+
4.1.3.2 Data Penentuan Waktu Pengadukan Optimum
Penentuan waktu pengadukan optimum pada penenlitian ini dilakukan mulai dari
waktu 15 menit sampai 60 menit, dimana pH larutan yang digunakan adalah pH 4
(pH optimum). Data penentuan waktu pengadukan optimum dapat dilihat pada
Tabel 4.6 berikut:
Tabel 4.6 Data Penentuan Waktu Pengadukan Optimum Adsorpsi pada 3 kali Pengukuran
No Waktu Pengadukan (menit) Konsentrasi Akhir Larutan Cd
2+
4.1.4 Persentase Penurunan Kadar Ion Kadmium (Cd2+) dalam Larutan (Penentuan Persen (%) Adsorpsi)
Persentase penurunan kadar ion Cd2+ dalam larutan sebelum dan setelah
% �������� =��������������� − �������������ℎ��
��������������� × 100 %
Dari data hasil pengukuran yang terdapat pada Tabel 4.5 dan Tabel 4.6, maka
penentuan % adsorpsi pada berbagai perlakuan dapat ditentukan sebagai berikut:
1. Pada penentuan pH optimum (pH 4) dengan waktu pengadukan selama 30
menit :
% �������� =5,0001−0,3389
5,0001 × 100 %
= 93,22 %
Data % adsorpsi pada penentuan pH optimum secara lengkap dapat dilihat pada
Lampiran 2A.
2. Pada penentuan waktu pengadukan optimum (waktu 30 menit) dengan
kondisi larutan pada pH 4 :
% �������� =5,0001−0,3261
5,0001 × 100 %
= 93,48 %
Data % adsorpsi pada penentuan waktu pengadukan optimum secara lengakap
dapat dilihat pada Lampiran 2B.
4.2 Pembahasan
4.2.1 Preparasi dan Karakterisasi Kalsium Oksida dalam Serbuk Cangkang Keong Mas (Pomacea Canaliculata L.)
Kalsium oksida yang merupakan kristal berwarna putih dapat dibuat dengan cara
pemanasan batu kapur, batu koral dan cangkang-cangkang mollusca yang
mengandung CaCO3 dengan melepaskan karbon dioksida. Reaksi tersebut bersifat
reversibel, dimana kalsium oksida bereaksi dengan karbon dioksida membentuk
kalsium karbonat kembali. Berdasarkan hal tersebut, serbuk cangkang keong mas
dikalsinasi pada suhu 800 0C untuk mendapatkan kalsium oksida.
Pada suhu 700 0C dekomposisi kalsium oksida belum terjadi, pada suhu ini
kalsium karbonat belum terurai menjadi kalsium oksida. Berdasarkan karakterisasi
menggunakan difraksi sinar-X, CaO terbentuk pada suhu pemanasan 800 0C.
keong mas pada suhu 700 0C dan 800 0C selama 3 jam dengan data 2Ɵ untuk
CaCO3 dan CaO murni.
Tabel 4.7 Data 2Ɵ senyawa kalsium karbonat dan kalsium oksida dari JCPDS
Sampel Temperatur Senyawa 2Ɵ
Data
Dari data di atas, terlihat bahwa kalsium oksida dari cangkang keong mas dapat
terbentuk pada suhu dekomposisi 800 0C selama 3 jam. Abu cangkang keong mas
ini kemudian digunakan sebagai adsorben untuk menyerap logam.
4.2.2 Adsorpsi Ion Kadmium (Cd2+) Menggunakan Kalsium Oksida (CaO)
dari Serbuk Cangkang Keong Mas (Pomacea Canaliculata L.)
Serbuk cangkang keong mas yang digunakan untuk mengadsorpsi ion Cd2+ pada
penelitian ini adalah serbuk cangkang keong mas yang telah dipanaskan pada suhu
800 0C selama 3 jam dengan ukuran serbuk yang lolos ayakan 100 mesh. Dimana
proses adsorpsi dilakukan dengan variasi pH penyerapan dan waktu kontak
optimum penyerapan.
Salah satu parameter kontrol yang sangat penting dalam proses adsorpsi
ion logam adalah derajat keasaman atau pH larutan. Hal ini dikarenakan setiap
logam yang terkandung dalam limbah membutuhkan kondisi penyerapan yang
berbeda. Pada penelitian ini, pH yang digunakan pada proses adsorpsi adalah pH
3-7. Konsentrasi ion Cd2+ yang digunakan 5 mg/L sebanyak 50 mL, dengan berat
adsorben 0,50 g dan waktu pengadukan 30 menit (Bagan 3.3.4.1). Dimana data
Berdasarkan data tersebut dan data pada lampiran maka persentase adsorpsi pada
berbagai pH dapat kita gambarkan sebagai berikut:
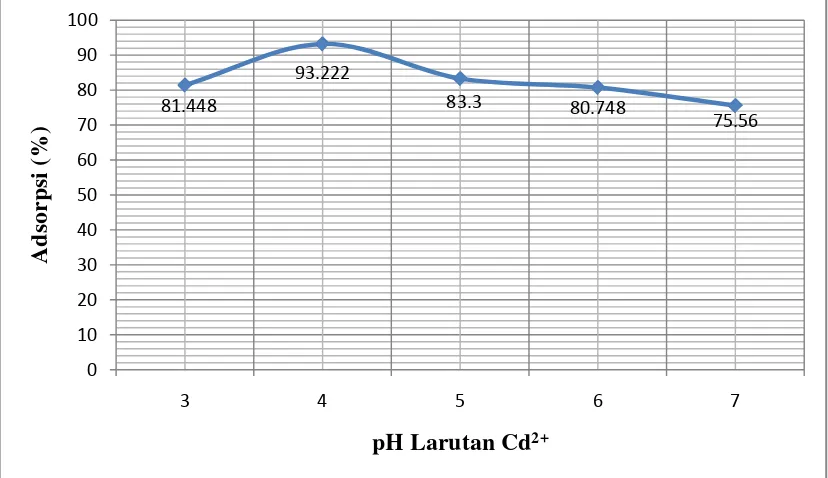
Gambar 4.2 Persen (%) adsorpsi pada berbagai pH larutan.
Berdasarkan gambar 4.2, dapat kita lihat bahwa persen (%) Cd2+ yang teradsorpsi
mengalami peningkatan dari pH 3 sampai 4, hal ini karena dipengaruhi oleh
penambahan HCl. Pada pH 3 dan pH 4 penambahan HCl relatif banyak sehingga
menyebabkan peningkatan jumlah ion H+ dalam larutan dan terjadi persaingan
antara ion H+ dengan ion Cd2+ untuk berikatan dengan pasangan elektron bebas
pada CaO.
Pada perlakuan variasi pH 3, 6 dan 7 menunjukkan perbedaan yang nyata
pada persen Cd2+ teradsorpsi. Pada pH 7, persen Cd2+ teradsorpsi sangat kecil
yaitu 75,56 % karena pada pH netral ion-ion logam mengalami reaksi hidrolisis
dalam larutan sehingga logam tersebut tidak stabil dalam bentuk ion logam
semula dan kemampuan menyerap adsorben menjadi menurun. Dari hasil analisis,
perbedaan persen penyerapan pada pH 4 dan 5 paling dekat jika dibandingkan
dengan variasi pH yang lainnya yaitu 93,22 % dan 83,30 %. Sehingga pH
optimum penyerapan dalam penelitian ini adalah pada pH 4.
Penentuan waktu pengadukan optimum dalam proses adsorpsi sangat
penting untuk dilakukan, karena waktu pengadukan antara adsorben dan adsorbat
dapat mempengaruhi kesetimbangan dan kestabilan CaO terhadap Cd2+ yang
tersisa dalam larutan. Pada penelitian ini, variasi waktu pengadukan yang
digunakan pada proses adsorpsi adalah 15, 30, 45 dan 60 menit. Konsentrasi ion
Cd2+ yang digunakan adalah 5 mg/L sebanyak 50 mL dengan pH larutan 4, dan
berat adsorben 0,50 g (Bagan 3.3.4.2), dengan waktu pengadukan optimum dapat
dilihat pada tabel 4.6. Berdasarkan data tersebut dan data pada Lampiran maka
persentase adsorpsi pada berbagai waktu pengadukan dapat dilihat pada gambar
berikut:
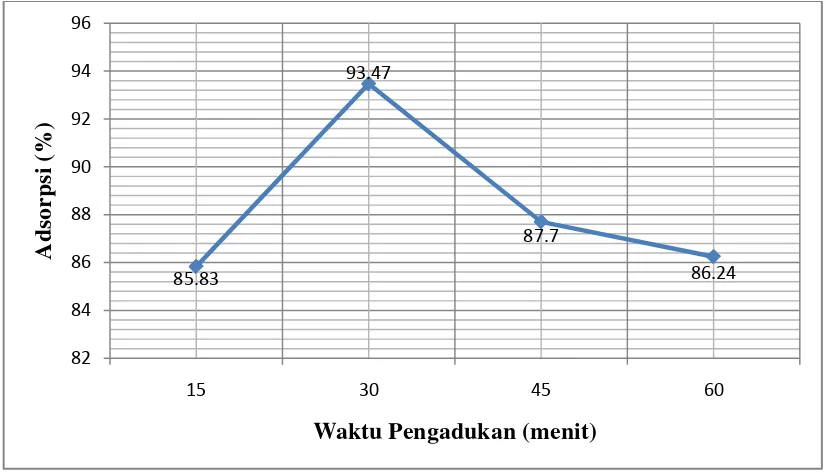
Gambar 4.3 Persen (%) adsorpsi pada berbagai waktu pengadukan
Berdasarkan Gambar 4.3, dapat kita ketahui bahwa waktu pengadukan
selama 15 menit dapat menyerap ion Cd2+ sebesar 85,83 %, dan mencapai
optimum pada waktu 30 menit yaitu dengan penyerapan 93,47 %. Sedangkan pada
pada waktu pengadukan 45 dan 60 menit didapatkan penurunan penyerapan. Hal
ini dikarenakan permukaan aktif adsorben sudah cukup jenuh dan interaksi antara
adsorben dan adsorbat yang lemah sehingga menyebabkan ion logam terlepas dari
4.2.3 Interaksi Serbuk Cangkang Keong Mas dengan Ion Kadmium (Cd2+)
Kandungan kalsium karbonat dalam cangkang keong mas sangat tinggi, dan
dengan pemanasan pada suhu kalsinasi yang sesuai, maka kalsium karbonat
tersebut dapat diubah menjadi kalsium oksida. Struktur CaO adalah bentuk kubik
heksagonal dimana ada kisi-kisi di dalamnya terselingi oleh ion H+, Na+ dan
lain-lain. Besarnya penyerapan serbuk abu cangkang keong mas disebabkan struktur
abu yang terbuka akibat dari pemanasan pada suhu tertentu sehingga pori-pori abu
cangkang berpotensi untuk menyerap ion-ion logam. Mekanisme yang terjadi
dalam adsorpsi ion Cd2+ yaitu adanya ikatan van der Waals yang terjadi antara
adsorben dan adsorbat merupakan ikatan yang lemah karena kesetimbangan
adsorpsi reversibel (dapat terjadi reaksi balik) dan berlangsung cepat sehingga
mudah untuk diganti dengan molekul yang lain. Mekanisme adsorpsi selanjutnya
BAB 5
KESIMPULAN DAN SARAN
5.1Kesimpulan
Dari penelitian yang telah dilakukan dapat disimpulkan bahwa kalsium oksida
dari serbuk cangkang keong mas yang telah dipanaskan pada suhu 800 0C selama
3 jam dapat digunakan untuk mengadsorpsi ion logam Cd2+ dalam larutan dengan
pH optimum 4 dan waktu pengadukan selama 30 menit dengan persentase
penyerapan sebesar 93,47 % dengan menggunakan adsorben sebanyak 0,5 g
dalam 50 mL larutan Cd2+ 5 mg/L.
5.2 Saran
Pada penelitian ini abu serbuk cangkang keong mas hanya diaktivasi secara fisika
sehingga perlu dilakukan penelitian lanjutan aktivasi serbuk cangkang keong mas
secara kimia dan perbandingan ukuran serbuk adsorben untuk penyerapan
DAFTAR PUSTAKA
Bernasconi, G. 1995. Teknologi Kimia. Cetakan Pertama. Jilid 2. Paradnya Paramita. Jakarta.
Cotton, F.A and Wilkinson, G. 1962. Advanced Inorganic Chemistry. John Wiley and Sons. New York.
Cowie, R.H. 2007. Global Advances in Ecology and Management of Golden Apple Snail. Ingnieria DICTUC and FAO. 1: 3-23.
Darmono. 1999. Kadmium (Cd) Dalam Lingkungan dan Pengaruhnya Terhadap Kesehatan dari Produktivitas Ternak. Wartazoa. 8 (1): 28-32.
Day, R.A.Jr., dan Underwood A.L. 1998. Analisa Kimia Kuantitatif. Erlangga. Jakarta.
Effendi, H. 2000. Telaah Kualitas Air. IPB Press. Bogor.
Etuk, B. R., Etuk, I. F., and Asuquo. L.O. 2011. Feasibility of Using Sea Shell Ash as Admixtures for concrete. Journal of Environmental Science and Engineering. 1:121-127.
Fanny, W.A., Subagjo., dan Prakoso, T. 2012. Pengembangan Katalis Kalsium Oksida Untuk Sintesis Biodiesel. Jurnal Teknik Kimia Indonesia. 11 (2): 66-73.
2014
Hamzah. 2009. Studi Kualitas Air Lokasi Pertambangan Nikel Pomalaa Sulawesi Tenggara. [Tesis]. Bogor: Institut Pertanian Bogor, Program Pasca Sarjana.
Hanjaya, S., Darjito., dan Purwonugroho, D. 2013. Pengaruh pH dan Waktu Kontak Pada Adsorpsi Cd(II) Menggunakan Adsorben Kitin Terfosforilasi dari Limbah Cangkang Bekicot (Achatina Fulica). Kimia Student Journal. 2 (2): 503-509.
Hutabarat, S dan S.M. Evans. 1986. Pengantar Osenografi. UI Press. Jakarta.
Jonak, C., Nagami, H., and Hirt, H. 2004. Heavy Metal Stress. Activation Mitogen-Activated Protein Kinase Pathways by Copper and Cadmium.
Plant Physiology. 136: 3276-3283.
Krisnawati., Jasinda., dan Iriany. 2013. Penyerapan Logam Kadmium (Cd2+) Dengan Adsorben Cangkang Telur Bebek Yang Telah Diaktivasi. Kimia Student Journal.
Kusmiyati., Puspita, A., dan Kunthi, P. 2012. Pemanfaatan Karbon Aktif Arang Batubara (KAAB) Untuk Menurunkan Kadar Ion Logam Berat Cu2+ dan Ag+ Pada Limbah Cair Industri. Reaktor. 14 (1): 51-60.
Lawrence, A. 2003. Effects of Pollutan On Fish Molecular Effects and Population Responses. Blackwell Science Ltd. Oxford.
Lesbani, A., Palita, T., Risfidian, M., and Fahmariyanti. 2013. Preparation Of Calcium Oxide From Achatina fulica As Catalyst For Production Of Biodiesel From Waste Cooking Oil. Indonesian Journal Chemistry. 13 (2): 176-180.
Mirwan, A. dan Wijayanti, H. 2011. Penurunan Ion Fe dan Mn Air Tanah Kota Banjarbaru Menggunakan Tanah Lempung Gambut Sebagai Adsorben.
Info Teknik. 1 (1).
Oscik, J. 1982. Adsorption. John Wiley and Sons. New York.
Permanasari, A., Wiwi, S., dan Irnawati, W. 2010. Uji Kinerja Adsorben Kitosan-Bentonit Terhadap Logam Berat dan Diazinon Secara Simultan. Jurnal Sains dan Teknologi Kimia. 1 (2): 121-134.
Rahman, L.A. 2006. Kandungan Logam Berat Timbal (Pb) dan Kadmium (Cd) pada Beberapa Jenis Krustasea Di Pantai Batakan dan Takisung Kabupaten Tanah Laut Kalimantan Selatan. Bioscientiae. 3: 93-101.
Rico, L.G., Felix, C.F., Burguenso, R.R., and Marini, M.J. 2002. Determination of Cadmium and zinc and Its Relationship to Metalloghionein Level in Swine Kidney. Rev. In. Contact Ambient. 18: 157-162.
Rohman, A. 2007. Kimia Farmasi Analisis. Pustaka pengajar. Yogyakarta.
Rukmana, R. 1997. Hama Tanaman dan Teknik Pengendalian. Penerbit Kanisius. Yogyakarta.
Setiawan, D. 2008. Pemakaian Cangkang Bekicot (Achatina Fulica) dan Keong Mas (Pomacea Canaliculata Lamarck) Sebagai Energizer di dalam Proses Karburisasi Padat Pada Baja Karbon Rendah. [Skripsi]. Bandung: Institut Teknologi Bandung, Program Sarjana.
Stevens, M.P. 2001. Kimia Polimer. Cetakan pertama. Pradnya Parawita. Jakarta.
Subowo., Mulyadi, S., Widodo., dan Asep Nugraha. 1999. Status dan Penyebaran Pb, Cd, dan Pestisida pada Lahan Sawah Intensifikasi di Pinggir Jalan Raya. Puslittanak Bogor. Bogor.
Sudarmadji., J. Mukono., dan Corie, I.P. 2006. Toksikologi Logam Berat B3 dan Dampaknya Terhadap Kesehatan. Jurnal Kesehatan Lingkungan. 2 (2): 129-142.
Sunardi. 2006. 116 Unsur Kimia Deskripsi dan Pemanfaatannya. Yrama Widya. Bandung.
Vogel, A.I. 1994. Buku Teks Anorganik Kualitatif Makro dan Semimikro. Edisi Kelima. PT Kalman Media Pustaka. Jakarta.
Widowati, W., Sastiono, A., dan Jusuf, R. 2008. Efek Toksik Logam Pencegahan dan Penanggulangan Pencemaran. Penerbit Andi. Yogyakarta.
Lampiran 1. Karakterisasi Kalsium Oksida dalam Cangkang Keong Mas
(Pomacea Canaliculata L.)
Difraktogram kalsium oksida dari serbuk cangkang keong mas setelah dikalsinasi
Lampiran 2. Persentase Penurunan Kadar Ion Kadmium (Cd2+) dalam
larutan
A. Data persen (%) adsorpsi penentuan pH optimum pada waktu pengadukan 30
menit dalam 50 mL larutan Cd2+ 5 ppm yang dilakukan sebanyak 3 kali
pengukuran
B. Data persen (%) adsorpsi penentuan waktu pengadukan optimum pada pH
4 dalam 50 mL larutan Cd2+ 5 ppm yang dilakukan sebanyak 3 kali
pengukuran
Lampiran 3. Gambar Bahan Penelitian
Gambar cangkang keong mas (Pomacea canaliculata L. ) sebelum dan sesudah
pemanasan pada suhu 8000C.
1. Cangkang Keong Mas sebelum 2. Serbuk Cangkang Keong Mas
Dipanaskan pada Suhu 800 0C Setelah Dipanaskan pada suhu 800 0C
Lampiran 4. Gambar Alat Penelitian
A. Gambar Peralatan Spektrofotometer Serapan Atom Merk Shimadzu tipe
AA-6300