GAMBARAN HISTOPATOLOGI KAUDA EPIDIDIMIS
DOMBA LOKAL (Ovis sp.) YANG DISIMPAN PADA SUHU 4 ºC
DENGAN DAN TANPA DMEM
FAISAL AMRI SATRIO
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Gambaran Histopatologi Kauda Epididimis Domba Lokal (Ovis sp.) yang Disimpan pada Suhu 4 ºC dengan dan Tanpa DMEM adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
FAISAL AMRI SATRIO. Gambaran Histopatologi Kauda Epididimis Domba Lokal (Ovis sp.) yang Disimpan pada Suhu 4 ºC dengan dan Tanpa DMEM. Dibimbing oleh SRI ESTUNINGSIH dan NI WAYAN KURNIANI KARJA.
Penyimpanan kauda epididimis pada suhu 4 ºC dapat menjaga kualitas spermatozoa dan menjadi metode alternatif penyelamatan plasma nutfah. Dulbecco’s Modified Eagle Medium (DMEM) mengandung nutrisi yang lengkap untuk kebutuhan metabolisme sel. Tujuan penelitian ini adalah menganalisis kerusakan jaringan kauda epididimis setelah penyimpanan selama empat hari dengan dan tanpa DMEM pada suhu 4 ºC. Sebanyak 15 pasang kauda epididimis dikoleksi dari tempat pemotongan domba dan disimpan mulai dari hari ke-0 sampai dengan hari ke-4 setelah kematian. Hari ke-0 tidak dilakukan penyimpanan pada suhu 4 ºC, hari ke-1 disimpan selama 24 jam, hari ke-2 selama 48 jam, hari ke-3 selama 72 jam, dan hari ke-4 selama 96 jam. Penyimpaan dilakukan dengan cara salah satu dari setiap pasang kauda epidididimis dimasukkan ke dalam centrifuge tube yang berisi DMEM sedangkan pasangan yang lain dimasukkan ke dalam palstik bersih dan centrifuge tube tanpa DMEM. Jaringan kauda epididimis kemudian difiksasi menggunakan Buffered Neutral Formalin (BNF) 10% dan dibuat preparat histopatologi dengan pewarnaan Haematoxylin Eosin (HE). Hasil penelitian menunjukan bahwa kapsula kauda epididimis yang disimpan tanpa menggunakan DMEM mengalami penebalan sampai hari ke-2 penyimpanan dan mengalami penurunan sampai hari ke-4 penyimpanan. Sementara kapsula kauda epididimis yang disimpan menggunakan DMEM secara signifikan (P<0.05) menebal sampai hari ke-4 penyimpanan. Kerusakan epitel kauda epididimis yang disimpan dengan dan tanpa DMEM mengalami peningkatan secara signifikan (P<0.05) mulai hari ke-1 seiring dengan lamanya waktu penyimpanan. Berdasarkan hasil tersebut mengindikasikan bahwa penyimpanan kauda epididimis pada suhu 4 ºC menggunakan DMEM dapat mengurangi tingkat kerusakan jaringan.
Kata kunci: DMEM, kauda epididimis, kerusakan jaringan, penyimpanan
ABSTRACT
FAISAL AMRI SATRIO. Histopathological Overview of Local Ram’s Cauda
Epididymis Stored at 4 ºC with and without DMEM. Supervised by SRI ESTUNINGSIH and NI WAYAN KURNIANI KARJA.
hours, and day 4 were stored for 96 hours. One of the cauda epididymis was stored in centrifuge tube with DMEM, while the other in a clean plastic and centrifuge tube without DMEM. Then, cauda epididymis were fixed using Buffered Neutral Formalin (BNF) 10% and histopathological preparations were made using Haematoxylin Eosin (HE) staining. The results showed that the capsule of cauda epididymis were stored without DMEM thickened until day 2 of storage and decreased until day 4 of storage. Meanwhile, the capsule of cauda epididymis were stored in DMEM thickened significantly (P<0.05) until day 4 of storage. Epithelial damage of cauda epididymis that were stored with and without DMEM increased significantly (P<0.05) along with the storage period from day 1. In conclusion, the storage of cauda epididymis at 4 ºC in DMEM can reduce the level of tissue damage.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
GAMBARAN HISTOPATOLOGI KAUDA EPIDIDIMIS
DOMBA LOKAL (Ovis sp.) YANG DISIMPAN PADA SUHU 4 ºC
DENGAN DAN TANPA DMEM
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Alloh SWT atas karunia-Nya
sehingga karya ilmiah ini berhasil diselesaikan dengan judul “Gambaran
Histopatologi Kauda Epididimis Domba Lokal (Ovis sp.) yang Disimpan pada
Suhu 4 ºC dengan dan Tanpa DMEM”. Skripsi ini disusun berdasarkan hasil penelitian yang dilaksanakan pada bulan Juni 2014 hingga Januari 2015 dan merupakan salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr Drh Sri Estuningsih MSi (APVet) dan Drh Ni Wayan Kurniani Karja MP PhD selaku dosen pembimbing yang telah memberikan bimbingan dan saran kepada penulis selama penelitian dan penulisan karya ilmiah. Terima kasih kepada Ibu, Bapak, Dik Afita dan keluarga besar di rumah yang senantiasa ikhlas memberikan doa dan dukungannya. Terima kasih penulis ucapkan kepada Prof Drh Arief Boediono PhD selaku dosen pembimbing akademik, Dr Drh Wiwin Winarsih MSi selaku dosen penilai seminar, Dr Drh Damiana Rita Ekastuti MS dan Dr Ir Etih Sudarnika MSi selaku dosen penguji luar UASKH, serta seluruh dosen Fakultas Kedokteran Hewan IPB yang telah memberikan ilmu yang bermanfaat.
Terima kasih juga penulis ucapkan kepada Pak Kasnadi, Pak Soleh, Mba Kiki, Mba Oka, Pak Bondan, Mba Selly, Pak Ugan, Teman senasib seperjuangan Tant Cit, Amah Devi, Mba prista, Kak Yasmin, Kak Umul, Tatat, Ayu, Naim, Sri, Faris, Zikra, Bhanu, Keluarga besar Bimbingan belajar Al-Fattaah (Mba Chandra, Fendy, Amir, Syam, Mba Mila, Lukman, Abi, Imah, Gina, Tri, Amel, Mba Inong, Mba Mae) atas semangat, bantuan, nasihat, dan dukungannya, serta rekan-rakan Ganglion 48 tercinta atas dukungan, bantuan, serta kekompakan selama menempuh pendidikan sarjana dan untuk semua pihak yang turut membantu kelancaran penelitian ini yang tidak bisa disebutkan satu persatu.
Penulis menyadari karya ilmiah ini masih jauh dari sempurna dikarenakan keterbatasan pengetahuan penulis. Namun demikian penulis berharap agar hasil penelitian ini dapat bermanfaat untuk berbagai pihak.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Waktu dan Tempat 2
Bahan dan Alat 2
Prosedur Penelitian 2
Pembuatan Media 2
Koleksi dan Penyimpanan Kauda Epididimis domba 3
Pembuatan Sediaan Histopatologi 3
Parameter Penelitian 4
Pengamatan Penelitian 4
Analisis Data 4
HASIL DAN PEMBAHASAN 5
Gambaran Umum Kauda Epididimis 5
Perubahan Histopatologi Kapsula Kauda Epididimis 6 Perubahan Histopatologi Epitel Kauda Epididimis 8
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 12
DAFTAR TABEL
1 Ketebalan kapsula kauda epididimis (µm) yang disimpan dengan dan
tanpa DMEM selama empat hari pada suhu 4 ºC 6
2 Kerusakan epitel kauda epididimis (%) yang disimpan dengan dan
tanpa DMEM selama empat hari pada suhu 4 ºC 10
DAFTAR GAMBAR
1 Fotografi mikro keadaan umum kauda epididimis domba dengan
pewarnaan HE perbesaran 4×10. 5
2 Fotografi mikro ketebalan kapsula kauda epididimis domba dengan
pewarnaan HE perbesaran 4×10. 7
3 Fotografi mikro kerusakan epitel kauda epididimis domba dengan
1
PENDAHULUAN
Latar Belakang
Epididimis domba secara anatomi terdiri dari tiga bagian yaitu kaput, korpus, dan kauda epididimis. Kaput epididimis berada di dorsal kraniolateral dari testis sedangkan korpus epididimis melingkari sebagian testis di bagian lateral dan kauda epididimis berada di kaudomedial dari testis (Flesch dan Gladella 2000; Pugh 2002). Secara histologi epididimis domba terdiri dari kapsula, duktus epididimis, dan jaringan interstisial. Duktus epididimis terdiri dari epitel silindris pseudostratified sterosilia dan lumen kauda epididimis yang di tengahnya terdapat spermatozoa jika sudah mengalami dewasa kelamin (Elzoghby 2014). Spermatozoa yang ada di dalam kauda epididimis telah melewati proses pematangan di bagian kaput dan korpus epididimis serta memiliki motilitas yang sama dengan spermatozoa hasil ejakulat, sehingga spermatozoa kauda epididimis mampu menembus oosit dan melakukan fertilisasi (Robaire et al. 2006).
Penyimpanan kauda epididimis pada suhu 4 ºC dilakukan untuk menghambat kerusakan jaringan dikarenakan pada suhu tersebut dapat menekan metabolisme sel (Carey et al. 2003). Selain itu, upaya penyimpanan kauda epididimis pada suhu 4 ºC dilakukan untuk menjaga kualitas spermatozoa sebelum pengolahan. Metode penyimpanan kauda epididimis pada suhu 4 ºC menjadi metode alternatif dalam upaya penyelamatan plasma nutfah dari suatu spesies yang terancam punah (Lima et al. 2013), ternak atau pejantan unggul dan satwa liar yang mati secara mendadak (Rizal et al. 2004). Metode tersebut sudah dikembangkan pada penelitian sebelumnya, yaitu pada kucing (Yulnawati dan Setiadi 2005), domba (Rizal et al. 2006), anjing (Setiadi et al. 2007), dan sapi (Bhakat et al. 2011). Namun gambaran histologis mengenai kerusakan jaringan kauda epididimis yang terjadi selama penyimpanan belum pernah dilaporkan.
Penyimpanan kauda epididimis setelah kematian menyebabkan kerusakan jaringan karena lingkungan kauda epididimis sudah tidak mendukung jaringan untuk bertahan hidup. Lingkungan yang tidak mendukung tersebut disebabkan adanya ketidakseimbangan pH, ketidaktersediaan oksigen (Dacheux et al. 2005), dan tidak adanya asupan nutrisi ke dalam jaringan (Harjana 2011). Kerusakan jaringan akibat perubahan lingkungan menyebabkan kerusakan berupa nekrosis (Pellegrin et al. 2008). Bagian kauda epididimis yang mengalami nekrosis dimungkinkan adalah kapsula dan epitel kauda epididimis, karena kedua bagian tersebut berkontak secara langsung dengan lingkungan.
2
epididimis setelah penyimpanan sehingga ketahanan dan kualitas hidup spermatozoa akan terjaga lebih lama.
Tujuan Penelitian
Menganalisis kerusakan jaringan kauda epididimis setelah penyimpanan selama empat hari dengan dan tanpa DMEM pada suhu 4 ºC
Manfaat Penelitian
Hasil penelitian mengenai gambaran kerusakan jaringan kauda epididimis diharapkan dapat digunakan sebagai acuan untuk mengetahui kualitas spermatozoa setelah penyimpanan kauda epididimis pada suhu 4 ºC selama empat hari.
METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juni 2014 hingga Januari 2015. Tempat penelitian adalah Laboratorium Histopatologi Divisi Patologi dan Laboratorium Fertilisasi In Vitro Divisi Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi, dan Patologi (KRP), Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah lima belas pasang kauda epididimis domba lokal yang sudah mengalami dewasa kelamin, Dulbecco’s Modified Eagle Medium atau DMEM (GibcoBRL® cat no: 12100-038, Lot No: 1101712), Milli-Q water, sodium bikarbonat, antibiotik (1000 IU penisillin dan 0.1 gram streptomycin), Buffered Neutral Formalin (BNF) 10%, alkohol konsentrasi bertingkat (70%, 80%, 90%), alkohol absolut pa (Merck), xylol pa (Merck), larutan Mayer’s Hematoksilin, larutan Eosin, lithium karbonat, dan parafin.
Alat yang digunakan selama penelitian yaitu centrifuge tube, labu Erlenmeyer 1000 ml, syringe 50 ml dan single use syringe filter ukuran 0,22 µm, magnetic mixer dan stir bar, refrigator, tissue cassette, automatic tissue processor, mikrotom, inkubator, mikroskop cahaya, electronic eyepiece camera, dan software ImageJ® 1.46.
Prosedur Penelitian
Pembuatan Media
3 bar ukuran 4 cm. Larutan yang telah homogen ditambah dengan sodium bicarbonate sebanyak satu gram dan diaduk sampai larut. Antibiotik penisillin dan streptomycin sebanyak 1000 µL (1000 IU Penisillin dan 0.1 gram streptomycin) ditambahkan ke dalam campuran dan diaduk sampai larut. Setelah itu dilakukan penyaringan dengan menggunakan syringe 50 ml dan single use syringe filter ukuran 0.22 µm. Larutan media ditutup dan diberi label nama dan tanggal pembuatan media kemudian disimpan dalam lemari pendingin.
Koleksi dan Penyimpanan Kauda Epididimis Domba
Testis beserta dengan epididimis diperoleh dari tempat pemotongan hewan yang dikelola oleh perusahaan penyelenggara aqiqah di wilayah Bogor. Kauda epididimis yang dikoleksi kemudian dibagi menjadi lima kelompok yaitu satu kelompok kontrol dan empat kelompok perlakuan. Seluruh kauda epididimis diikat dengan benang steril dan dipisahkan dari testis. Salah satu dari pasangan kauda epididimis segera dimasukkan ke dalam centrifuge tube yang berisi DMEM sedangkan yang lainnya dimasukkan ke dalam plastik bersih dan centrifuge tube tanpa DMEM sesaat setelah pemotongan domba. Kauda epididimis dimasukan ke dalam sterofoam box untuk ditranspor ke laboratorium. Setelah sampai di laboratorium kedua sampel ditempatkan pada cawan petri yang berisi NaCl fisiologis. Kauda epididimis disayat di bagian ujungya untuk dilihat motilitas spermatozoanya. Hanya kauda epididmis dengan motilitas spermatozoa ≥ 70% yang digunakan dalam penelitian ini.
Penyimpaan kauda epididimis dilakukan dengan cara salah satu dari setiap pasang kauda epidididimis dimasukkan ke dalam centrifuge tube yang berisi DMEM sedangkan pasangan yang lain dimasukkan ke dalam plastik bersih tanpa DMEM dan dimasukan ke dalam centrifuge tube. Kauda epididimis kelompok kontrol (kelompok H-0) tidak dilakukan penyimpanan pada suhu 4 ºC melainkan langsung dimasukan ke dalam larutan BNF 10%. Kelompok kauda epididimis perlakuan disimpan dalam DMEM dan tanpa DMEM pada suhu 4 ºC selama satu hari atau 24 jam (kelompok H-1), dua hari atau 48 jam (kelompok H-2), tiga hari atau 72 jam (kelompok H-3), dan empat hari atau 96 jam (kelompok H-4). Setelah penyimpanan, semua sampel dimasukan ke dalam larutan BNF 10% untuk dibuat sediaan histopatologi.
Pembuatan Sediaan Histopatologi
Pembuatan sediaan histopatologi dilakukan dengan beberapa tahapan yaitu fiksasi, trimming, dehidrasi, pembenaman (embedding) dan pencetakan (blocking), pemotongan, dan pewarnaan. Fiksasi dilakukan dengan cara kauda epididimis direndam dalam larutan BNF 10% selama satu minggu. Trimming dilakukan dengan cara kauda epididimis dipotong setebal kurang lebih 0.5 cm dan dimasukan ke dalam tissue cassete untuk proses dehidrasi. Dehidrasi dilakukan dengan merendam potongan tersebut secara berturut-turut ke dalam alkohol 70%, 80%, 90%, alkohol absolut I, alkohol absolut II, xylol I, xylol II, parafin I dan parafin II masing-masing selama dua jam. Proses tersebut berjalan secara otomatis dalam alat automatic tissue processor (Bancroft dan Gamble 2008).
4
setelah mulai mengeras sampai alat pencetak penuh, kemudian didiamkan hingga mengeras seluruhnya. Pemotongan dilakukan dengan cara jaringan dipotong dengan ketebalan 5 µ m menggunakan mikrotom. Hasil pemotongan yang berbentuk pita (ribbon) diletakkan di atas permukaan air bersuhu 45 ºC untuk menghilangkan lipatan akibat pemotongan. Sediaan kemudian diangkat dari permukaan air menggunakan gelas objek dan dikeringkan dalam inkubator bersuhu 60 ºC selama satu malam. Sediaan dimasukkan ke dalam xylol untuk proses deparafinisasi sebanyak dua kali masing-masing selama dua menit, dilanjutkan proses rehidrasi. Proses tersebut diawali dengan pencelupan ke alkohol absolut, alkohol 90% hingga alkohol 80% masing-masing selama dua menit. Sediaan dicuci dengan air kran mengalir kemudian dikeringkan untuk proses pewarnaan (Bancroft dan Gamble 2008).
Pewarnaan diawali dengan aplikasi reagen pewarna Mayer’s hematoksilin
selama delapan menit, kemudian dibilas dengan air mengalir, direndam dalam lithium karbonat selama 15–30 detik, dan dibilas kembali dengan air mengalir. Sediaan diwarnai dengan pewarna eosin selama dua menit, setelah itu sediaan dicuci dengan air mengalir dan dikeringkan. Selanjutnya sediaan dicelupkan ke dalam alkohol 90% sebanyak sepuluh kali celupan, alkohol absolut I sebanyak sepuluh kali celupan, alkohol absolut II selama dua menit, xylol I selama satu menit dan xylol II selama dua menit. Setelah itu, sediaan dikeringkan kemudian ditetesi dengan perekat permount dan ditutup dengan gelas penutup. Sediaan histopatologi siap untuk diperiksa dibawah mikroskop (Kiernan 1990).
Parameter Penelitian
Penelitian dilakukan sebanyak tiga kali ulangan. Parameter yang dilihat dalam penelitian adalah Rata-rata ketebalan kapsula kauda epididimis dan persentasi kerusakan epitel kauda epididimis.
Persentasi kerusakan epitel = Jumlah epitel rusak
Total epitel ×100% Pengamatan Penelitian
Pengamatan sediaan histopatologi dilakukan dengan menggunakan bantuan mikroskop cahaya. Ketebalan kauda epididimis diamati dengan perbesaran 4 kali lensa objektif pada 15 lapang pandang. Kerusakan epitel kauda epididimis diamati dengan perbesaran 40 kali lensa objektif pada sepuluh lapang pandang. Keduanya dibuat mikrofotografi menggunakan electronic eyepiece camera. Pengukuran ketebalan kapsula kauda epididimis dan perhitungan jumlah epitel dilakukan dengan software ImageJ®1.46.
Analisis Data
5
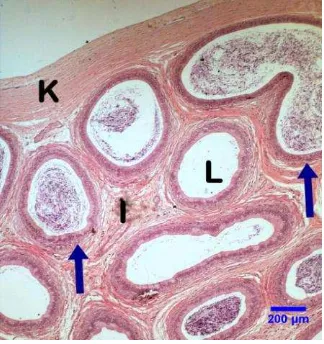
Gambar 1 Fotografi mikro keadaan umum kauda epididimis hari ke-0 menggunakan DMEM dengan pewarnaan HE perbesaran 4×10. Keterangan (K) Kapsula, (Panah biru) Epitel duktus epididimis, (L) Lumen duktus, (I) Jaringan interstisial, (S) Spermatozoa.
HASIL DAN PEMBAHASAN
Gambaran Umum Kauda Epididimis
6
Perubahan Histopatologi Kapsula Kauda Epididimis
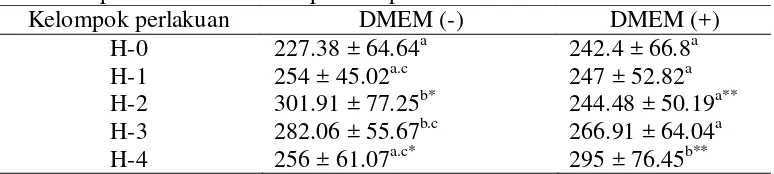
Kapsula kauda epididimis merupakan bagian terluar dari kauda epididimis yang berfungsi untuk melindungi kauda epididimis dari tekanan dan regangan (Samuelson 2007). Kapsula kauda epididimis berkontak secara langsung dengan kedua perlakuan yaitu perlakuan penyimpanan pada suhu 4 °C dan penyimpanan menggunakan DMEM. Perubahan ketebalan kapsula kauda epididimis terdapat pada Gambar 2 dan analisis statistik data yang diperoleh terdapat pada Tabel 1. Tabel 1 Ketebalan kapsula kauda epididimis (µ m) yang disimpan dengan dan
tanpa DMEM selama empat hari pada suhu 4 ºC.
Kelompok perlakuan DMEM (-) DMEM (+)
Data disajikan dalam bentuk rataan dengan standar deviasi ( x ± SD). Huruf superscipt
yang berbeda pada kolom (a,b,c) dan baris (*,**) yang sama menunjukan ada perbedaan
yang nyata (P<0.05). H-0: Kontrol, H-1: Hari ke-1, H-2: Hari ke-2, H-3: Hari k-3, H-4: Hari ke-4.
Berdasarkan data pada Tabel 1, ketebalan kapsula kauda epididimis yang disimpan tanpa menggunakan DMEM mengalami kenaikan secara signifikan (P<0.05) mulai dari hari pertama sampai dengan hari kedua penyimpanan. Hal ini terjadi karena kauda epididimis yang telah dikoleksi sudah tidak mendapatkan pasokan oksigen dari darah sehingga mengakibatkan keadaan hipoksia jaringan (Dacheux et al. 2005; Jones et al. 2006; Myers et al. 2012). Keadaan hipoksia jaringan mengakibatkan kerusakan sel (Dacheux et al. 2005; Jones et al. 2006; Leo et al. 2008; Myers et al. 2012). Oksigen digunakan oleh mitokondria untuk membentuk Adhenosine Triphosphate (ATP). Hipoksia jaringan menyebabkan penurunan produksi ATP akibatnya terjadi gangguan pompa ion natrium kalium (Na+-K+). Energi yang dihasilkan oleh ATP dalam keadaan normal digunakan untuk mengatur pompa ion Na+-K+, tiga ion natrium keluar dari sel dan sebagai penyeimbangnya dua ion kalium masuk ke dalam sel (Jones et al. 2006; Myers et al. 2012). Namun, dalam keadaan hipoksia jaringan ion natrium masuk ke dalam sel dan ion kalium keluar sel. Hal ini mengakibatkan tekanan osmotik meningkat. Peningkatan tekanan osmotik mengakibatkan air berpindah secara pasif melewati membran ke intraseluler sehingga sel mengalami pembengkakan (Myers et al. 2012).
7
8
seperti phospholipase dan protease. Aktivasi enzim tersebut mengakibatkan penurunan fungsi membran fosfolipid yang berada di membran plasma dan menyebabkan membran plasma rusak sehingga terjadi kebocoran sel (Myers et al. 2012).
Penyimpanan kauda epididimis menggunakan DMEM mengalami kenaikan ketebalan kapsula secara signifikan (P<0.05) pada hari keempat. Mekanisme bertambahnya ketebalan kapsula kauda epididimis yang disimpandengan DMEM sama dengan penyimpanan kauda epididimis tanpa menggunakan DMEM. Kenaikan ketebalan kapsula kauda epididimis yang signifikan diduga karena selama empat hari penyimpanan jaringan kauda epididimis tetap melakukan metabolisme sel sehingga asam laktat dan karbondioksida (CO2) semakin banyak terakumulasi di dalam sel. Karbon dioksida akan bereaksi dengan air membentuk H2CO3 dan diuraikan kembali menjadi ion H+ dan HCO3- akibatnya lingkungan sel semakin asam. Namun, DMEM mengandung buffer berupa natrium bikarbonat (NaHCO3). Buffer tersebut digunakan untuk menyeimbangkan kadar CO2 dan asam laktat hasil metabolisme sel (Pellegrin et al. 2008; Moraes et al. 2008). Adanya DMEM mengakibatkan aktivasi enzim lisosom terhambat, kerusakan membran sel tertekan dan kebocoran sel terhambat. Perubahan ketebalan kapsula kauda epididimis yang disimpan dengan dan tanpa DMEM pada suhu 4ºC selama empat hari diperjelas dengan adanya Gambar 2.
Perubahan Histopatologi Epitel Kauda Epididimis
Epitel kauda epididimis memiliki peran penting dalam pengaturan lingkungan lumen berupa pengaturan sekresi dan reabsorbsi komponenen yang berada di lumen (Arroteia et al. 2012). Komponen tersebut berperan dalam menjalankan fungsi kauda epididimis yaitu penyimpanan spermatozoa (Flesch dan Gadella 2000; Robaire et al. 2006; Arroteia et al. 2012). Spermatozoa pada mamalia hidup disimpan selama 3 sampai 10 hari di dalam kauda epididimis. Massa atau konsentrasi spermatozoa terbesar ditemukan di lumen kauda epididimis yaitu sebesar 50% dari total spermatozoa (Robaire et al. 2006; Cornwall 2009). Pada hewan hidup, spermatozoa mendapatkan kebutuhan nutrisi yang cukup dari epitel kauda epididimis selama penyimpanan. Spermatozoa yang rusak atau mati akan memberikan tanda kepada sel epitel untuk segera di fagositosis (Robaire et al. 2006).
9
10
Tabel 2 Kerusakan epitel kauda epididimis (%) yang disimpan dengan dan tanpa DMEM selama empat hari pada suhu 4 ºC.
Kelompok Perlakuan DMEM (-) DMEM (+)
ada perbedaan yang nyata (P<0.05). H-0: Kontrol, H-1: Hari ke-1, H-2: Hari ke- 2, H-3: Hari k-3, H-4: Hari ke-4.
Berdasarkan data pada Tabel 2 persentasi kerusakan epitel mengalami peningkatan mulai dari hari pertama secara signifikan (P<0.05) pada penyimpanan menggunakan atau tidak menggunakan DMEM. Jaringan kauda epididmis yang disimpan sudah tidak mendapatkan pasokan oksigen dari darahsehingga mengakibatkan kondisi lingkungan yang anaerob. Hasil metabolisme sel dalam keadaan anaerob adalah asam laktat. Asam laktat merupakan hasil konversi piruvat dari proses glikolisis anaerob (Pellegrin et al. 2008; Moraes et al. 2008). Asam laktat dalam keadaan normal akan diubah menjadi karbon dioksida dan H2O (Moraes et al. 2008). Adanya asam laktat mengakibatkan penurunan derajat keasaman sehingga mengakibatkan stres bagi jaringan. Semakin lama waktu penyimpanan akumulasi asam laktat semakin banyak dan lingkungan sel semakin asam sehingga jaringan kauda epididimis semakin stres (Pellegrin et al. 2008).
Stres pada jaringan akibat penurunan derajat keasaman berdampak pada kerusakan jaringan berupa nekrosis (Pellegrin et al. 2008). Kejadian nekrosis diawali dengan pembengkakan sel karena sel mengalami kerusakan dan terjadi hipoksia. Hipoksia akan mengakibatkan penurunan produksi ATP dan mengganggu pompa ion Na+-K+. Terganggunya pompa tersebut berdampak pada pengeluaran ion kalium dan pemasukan ion natrium akibatnya tekanan osmotik meningkat. Peningkatan tekanan osmotik menjadikan air dari ekstraseluler berpindah menuju intraseluler semakin bertambah sehingga terjadi kebengkakan sel dan organel. Menjelang kematian sel, sel semakin membengkak sehingga plasma membran tidak mampu menahannya dan pecah. Selain menyebabkan pecahnya plasma membran, kebengkakan sel menyebabkan penggumpalan nukleus dan melisiskan mikrovili (Myers et al. 2012). Sterosilia merupakan bentuk mikrovili yang memilki ukuran lebih panjang (Samuelson 2007) sehingga pada Gambar 3 terlihat jaringan epitel kauda epididimis sudah tidak memiliki sterosilia.
11 menyeimbangkan CO2 dan asam laktat hasil metabolisme sel (Pellegrin et al. 2008; Moraes et al. 2008). Persentasi kerusakan epitel terlihat signifikan (P<0.05) pada hari keempat penyimpanan menggunakan DMEM. Hal ini dimungkinkan dengan keadaan lingkungan epitel yang sudah tidak mendukung sel untuk bertahan hidup dikarenakan cadangan nutrisi untuk metabolisme sel sudah semakin habis, tekanan osmotik berubah dan pH lingkungan semakin asam. Menurut Dacheux et al. (2005) dan Harjana (2011) lingkungan menjadi faktor penting bagi kehidupan suatu jaringan, jika faktor tersebut tidak mendukung maka jaringan akan mengalami kerusakan.
Penyimpanan kauda epididimis pada suhu 4 ºC tanpa menggunakan DMEM menyebabkan lebih banyak jaringan epitel yang mengalami nekrosis (ditandai dengan sel epitel yang terdeskuamasi) dari pada penyimpanan menggunakan DMEM, hal tersebut terlihat pada Gambar 3. Kerusakan jaringan epitel kauda epididimis mengakibatkan gangguan reabsorbsi dan sekresi dari epitel. Epitel epididimis mensekresikan protein yang berfungsi sebagai media transportasi spermatozoa, aktivasi enzim, dan kapasitasi spermatozoa. Selain itu, epitel epididimis mereabsorbsi hasil metabolisme sel dan memfagosit spermatozoa yang rusak atau mati (Robaire et al. 2000; Dacheux et al. 2005). Terganggunya fungsi epitel tersebut menyebabkan penurunan kualitas spermatozoa dan memperpendek daya tahan hidup spermatozoa.
SIMPULAN DAN SARAN
Simpulan
Kauda epididimis yang disimpan pada suhu 4 ºC mengakibatkan penambahan ketebalan kapsula dan peningkatan kerusakan epitel seiring dengan bertambahnya waktu penyimpanan. Penggunaan DMEM ketika penyimpanan dapat mengurangi tingkat kerusakan epitel kauda epididimis dan memperlambat kerusakan kapsula kauda epididimis.
Saran
12
DAFTAR PUSTAKA
Arroteia KF, Garcia PV, Barbieri MF, Justino ML, Pereira LAV. 2012. The Epididymis: Embryology, Structure, Function and Its Role in Fertilization and Infertility. Shanghai (CN) :InTech.
Bancroft JD, Gamble M. 2008. Theory and Practice of Histological Techniques 6th Edition.United of States America (US): Churchill Livingstone.
Bhakat M, Mohanty TK, Raina VS, Gupta AK, Pankaj PK, Mahapatra RK, Sarkar M. 2011. Study on siutable additives incorporation into the extender stored at refrigerated temperature. Asian- Aust. J. Anim. Sci. 24 (10): 1384–1357. Bacha WB,Bacha LM. 2000. Color Atlas Veterinary Histology Second Edition.
United States of America (US): Lippincott Williams & Wilkins.
Carey HV, Andrews MT, Martin SL. 2003. Mammalian hibernation: cellular and molecular responses to depressed metabolism and low temperature.Physiol Rev. 83: 1153–1181.
Cornwall GA. 2009. New insights into epididymal biology and function.Human Reproduction Update. 15 (2): 213–227.
Dacheux JL, Castella S, Gatti LJ, Dacheux F. 2005. Epididymal cell secretory membrane in the process of fertilization. Biochimica et Biophysica Acta. 1469 (3): 197–235.
Harjana T. 2011. Buku Ajar Histologi. Yogyakarta (ID): UNY Pr.
Jones TC, Hunt RD, King NW. 2006. Veterinary Pathology Sixth Edition. State Avanue (US): Blackwell Scientific.
Kiernan BG. 1990. Histological and Histochemical Methods: Theory and Practice 2nd Edition. England (UK): Pergamon Pr.
Leo P, Balesi ALL, Suazo CAT, Moraes AM. 2008. Animal Cells Basic Concepts.Di dalam: Castilho LR, Moraes AM, Agusto EFP, Butler M, editor. Animal Cells Technology: From Biopharmacenticals to Gene Therapy. Amilton Park Abingdon (UK): Taylor and Francis Group.
Lima ICS, Andrade IRA, Aguiar GV, Silva MM, Catunda AGV, Martins GA, Gadelha CRF, Campos ACN. 2013. In vitro evaluation of goat caudaepididimal sperm cooled in different extenders at 4 ºC. Arch. Zootec. 62 (239): 429–437.
Mather JP, Barnes D. 1998. Animal Cell Culture Methods. USA: Academic Pr. Moraes Am, Mendonca RZ, Suazo CAT. 2008. Culture Media for Animal Cells.
Di dalam: Castilho LR, Moraes AM, Agusto EFP, Butler M, editor. Animal Cells Technology: From Biopharmacenticals to Gene Therapy. Amilton Park Abingdon (UK): Taylor and Francis Group.
13 JF, Gavin MDM,editor. Pathologic Basis of Veterinary Disease Fifth Edition.Misouri (US): Elsevier.
Pellegrin MP, Pinto RCV, Castilho LDR. 2008. Mechanism Of Cells Proliferation and Cell Death In Animal Cell Culture In Vitro. Di dalam: Castilho LR, Moraes AM, Agusto EFP, Butler M, editor. Animal Cells Technology: From Biopharmacenticals to Gene Therapy. Amilton Park Abingdon (UK): Taylor and Francis Group.
Pugh DG. 2002. Sheep and Goat Medicine First Edition. Philadelphia (US): Saunders.
Rizal M, Herdis, Boediono A. 2004. Daya hidup sperma epididimis domba setelah disimpan pada suhu rendah (5 ºC). Animal Production .6(1): 30–36.
Rizal M, Surachman M, Herdis, Aku AS. 2006. Peranan plasma semen dalam mempertahankan kualitas spermatozoa asal epididimis domba yang disimpan pada suhu rendah (3–5ºC). Indonesian Journal of Animal and Veterinary Sciences. 11 (4): 287–294.
Robaire B, Hinton BT, Crist MCV. 2006. Knobil and Neill’s Physiology of Reproduction, Thrid Edition. Neill JD, editor. United States of America (US): Elsevier.
Robaire B, Syntin P, Jervis K. 2000. The coming of age of the epididymis. In: Testis, Epididymis and Technologies in the Year 2000, Jegou B, Pineau C, Saez J, editor. Hildenberg (DE): Springer.
Samuelson DA. 2007. Textbook of Veterinary Histology. Philadelphia (US): Saunders Elseveir.
Setiadi MA, Yulnawati, Suprayogi A. 2007. Kualitas spermatozoa anjing selama penyimpanan pada suhu 4 ºC. Indonesian Journal of Animal and Veterinary Sciences. 12 (2): 134–138.
Toshimori K. 2003. Biology of spermatozoa maturation: an overview with an introduction to this issue. Microscopy Research and Technique. 61 (1): 1–6. Yulnawati, Setiadi MA. 2005. Motilitas dan keutuhan membran plasma
14
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 5 Juli 1993 di Brebes Propinsi Jawa Tengah. Penulis merupakan putra pertama dari dua bersaudara dari pasangan Ali Subekhi dan Nur Afifah. Penulis mengenyam pendidikan formal di SD Negeri Galuhtimur 1 (2005), SMP Negeri 1 Bumiayu (2008), dan SMA Negeri 1 Bumiayu (2011). Pada tahun 2011 penulis diterima di Fakultas Kedokteran Hewan Institut Pertanian Bogor Melalui Jalur Seleksi Nasional Masuk Perguruan tinggi Negeri (SNMPTN) Undangan dan mendapatkan Beasiswa BIDIKMISI.
Selama menjadi Mahasiswa IPB, penulis pernah menjadi Manger Akademik Bimbel Al-Fattaah pada tahun 2012, Sekertaris Umum Bimbel Al-Fattaah pada Tahun 2012-2013, Anggota Dewan Perwakilan Mahasiswa Tingkat Persiapan Bersama (DPM TPB) pada tahun 2011-2012, Anggota Pengurus Cabang Ikatan Mahasiswa Kedokteran Hewan Indonesia (PC IMAKAHI) pada tahun 2012-2013, Kepala Divisi Kajian Strategis PC IMAKAHI pada tahun 2013-2014, Anggota Himpunan Minat dan Profesi (HIMPRO) Ruminansia pada tahun 2012-2013, Ketua umum klan HIMPRO Ruminansia pada tahun 2013-2014. Anggota Kesekretariatan Pembentukan Tim Penyusun Dokumen Evaluasi Diri (Self Assessment Report) dalam Rangka Memperoleh Sertifikasi ASEAN University Network Assurance (AUN-QA) pada tahun 2015, Anggota Kesekretariatan Panitia Pemeriksa Kesehatan Hewan dan Daging Kurban 1436 H/2015 M.