PERANGSANGAN MOLTING PASCALARVA LOBSTER AIR TAWAR JENIS CAPIT MERAH (Cherax quadricarinatus, Von Martens)
DENGAN PERLAKUAN SUHU
A Z I S
PROGRAM STUDI ILMU PERAIRAN SEKOLAH PASCA SARJANA INSTITUT PERTANIAN BOGOR
PERANGSANGAN MOLTING PASCALARVA LOBSTER AIR TAWAR JENIS CAPIT MERAH (Cherax quadricarinatus, Von Martens)
DENGAN PERLAKUAN SUHU
A Z I S
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Perairan
PROGRAM STUDI ILMU PERAIRAN SEKOLAH PASCA SARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis dengan judul Perangsangan Molting Pascalarva Lobster Air Tawar Jenis Capit Merah (Cherax quadricarinatus, Von Martens) dengan Perlakuan Suhu adalah karya saya sendiri dan belum dipublikasikan dalam bentuk apapun. Sumber informasi yang berasal dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2008
ABSTRACT
The objective of this research was to observe the influence of subletal temperature on moulting of red claw Cray fish’s postlarva. The research has two phases. The first phase was to determine sublethal temperature of red claw by bioassay, the result was 380C. The second was the red claw postlarva treated with sublethal temperature at diferent exposure i.e., 0 (control) (A), 15 minutes (B), 30 minutes (C), 45 minutes (D) and 60 minutes (E). Completely randomized design with one way Anova was used in statistical test. Stress indicators observed were the haemocyte total and the blood glucose levels. Subletahl temperature treatments affect the percentage of the molting, the survival rate, the haemocyte total and the blood glucose levels significantly. The highest percentage of moulting was on 30 minutes (63.33%) of exposure time, but the highest survival rate (80%) and highest growth rate (6.89 g) was on treatment 15 minutes with avarege of the haemocyte total was 9.98 x 106 cell/mL and avarege of the blood glucose levels was 8.344 mg/dL.
RINGKASAN
AZIS. Perangsangan Molting Pascalarva Lobster Air Tawar Jenis Capit Merah (Cherax quadricarinatus, Von Martens) dengan Perlakuan Suhu. Dibimbing oleh DANIEL DJOKOSETIYANTO dan RIDWAN AFFANDI.
Untuk tumbuh lobster air tawar harus melalui fase molting, Secara alami larva lobster air tawar akan mengalami siklus ganti kulit secara teratur jika kondisi lingkungan dan nutrisi tercukupi. Sebab potensi tumbuh larva sangat bergantung pada efisiensi penggunaan energi, yaitu ratio antara energi untuk tumbuh dan metabolisme termasuk energi yang digunakan untuk adaptasi. Pada penelitian ini dikaji mengenai perlakuan suhu subletal untuk merangsang pascalarva lobster air tawar molting secara serempak. Penelitian dilaksanakan dalam dua tahap, yaitu penelitian tahap pertama merupakan penelitian untuk mendapatkan suhu subletal. Penelitian tahap kedua merupakan penelitian lanjutan untuk mengetahui pengaruh suhu subletal dengan waktu pemaparan yang berbeda terhadap penyerempakan molting dan mengetahui total hemosit dan kadar glukosa darah sebagai indikator stres.
Penelitian dilaksanakan dalam dua tahap, yaitu penelitian tahap pertama dan penelitian tahap kedua (penelitian pendukung). Penelitian tahap pertama melalui uji bioassay untuk menentukan suhu subletal, sebagai hewan uji adalah lobster air tawar jenis Cherax quadricarinatus berasal dari Parung-Bogor, dengan stadia pascalarva yang memiliki berat antara 3,5 – 4,9 gram (juvenil III). Wadah percobaan yang digunakan berupa akuarium berukuran 50 x 30 x 30 (pxlxt cm) untuk perlakuan suhu dan akuarium berukuran 100 x 50 x 50 (pxlxt cm) untuk pemeliharaan, masing-masing akuarium yang digunakan sebanyak 15 unit. Untuk mendapatkan suhu subletal, maka suhu air diatur (30, 35, 40, 450C percobaan I dan 36, 37, 38 dan 390C percobaan II), dengan menggunakan heater sebanyak 3 unit dan diberi Cherax sebanyak 5 ekor per akuarium.
Penelitian tahap ke-II suhu subletal yang diperoleh diuji dengan waktu pemaparan yang berbeda (0, 15, 30, 45 dan 60 menit), hewan uji pascalarva cherax sebanyak 10 ekor per akuarium. Penghitungan jumlah molting dan pengukuran total hemosit serta glukosa darah dilakukan pada hari 1 – 5 setelah perlakuan suhu subletal. Hewan uji diberi pakan komersial dengan ukuran 582 dan 583. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) Anova satu arah dengan 5 perlakuan dan 3 ulangan. Data yang diolah secara statistik adalah jumlah molting, total hemosit, kadar glukosa darah dan pertumbuhan.
dapat mempengaruhi udang molting secara serempak dan berpengaruh nyata terhadap total hemosit dan kadar glukosa darah sebagai indikator stres. Sehingga diduga bahwa penggunaan suhu subletal 380C dapat menekan tingkat kanibalisme pascalarva cherax sehingga produksi dapat ditingkatkan.
Judul Tesis : Perangsangan Molting Postlarva Lobster Air Tawar Jenis Capit Merah (Cherax quadricarinatus, Von Martens) dengan Perlakuan Suhu
Nama : Azis
NRP : C151060081 Program Studi : Ilmu Perairan
Disetujui, Komisi Pembimbing
Dr. Ir. D. Djokosetiyanto, DEA Dr. Ir. Ridwan Affandi, DEA
Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Perairan
Prof. Dr.Ir. Enang Harris, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 3 Januari 1970 di kota Ujung Pandang, Provinsi Sulawesi Selatan. Penulis merupakan anak kedua dari pasangan Bapak Razak Hamzah (Alm.) dan Ibu Hasnah.
Tahun 1990 penulis menyelesaikan pendidikan menengah atas di SMA LPP UMI Ujung Pandang, dan pada tahun yang sama diterima di Politeknik Pertanian Unhas Program Studi Budidaya Perairan, dan lulus sebagai Sarjana Muda pada Tahun 1993. Pada tahun 1994 penulis melanjutkan studi di Universitas Brawijaya Malang pada Fakultas Perikanan program studi Budidaya Perairan, dan lulus sebagai Sarjana Perikanan pada tahun 1997. Kesempatan untuk melanjutkan ke program magister pada program studi Ilmu Perairan, Institut Pertanian Bogor diperoleh pada tahun 2006. Beasiswa pendidikan pascasarjana diperoleh dari Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional Republik Indonesia.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan hidayah-Nya sehingga penulisan tesis penelitian mengenai ” Perangsangan Molting Pascalarva Lobster Air Tawar Jenis Capit Merah (Cherax quadricarinatus, Von Martens) dengan Perlakuan Suhu ” dapat terselesaikan dengan baik. Penelitian ini mengkaji tentang pengaruh perlakuan suhu terhadap molting pascalarva Cherax Jenis Red Claw.
Penelitian ini terinspirasi dari hasil kunjungan ke petani pembesaran lobster air tawar (Cherax) yang ada di Bogor. Kendala utama yang di hadapi dalam usaha budidaya Cherax adalah tingginya tingkat kematian (mortalitas) pada fase larva dan pascalarva akibat kanibal. Setelah penulis mengamati, ternyata peluang terjadinya kanibalisme karena molting yang tidak serempak. Dalam kondisi molting (ganti kulit), Cherax tidak mempunyai kemampuan untuk menghindar dari upaya pemangsaan dari Cherax yang tidak mengalami molting. Sehingga dari fenomena ini, penulis mengupayakan agar pascalarva Cherax dapat molting secara serempak dengan perlakuan suhu.
Ucapan terima kasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada Rektor Universitas Borneo yang telah memberikan izin untuk melanjutkan pendidikan, Dr. Ir. D. Djokosetiyanto, DEA dan Dr. Ir. Ridwan Affandi, DEA selaku Pembimbing yang telah banyak memberikan masukan dan arahan yang diberikan sejak kuliah, penyusunan proposal, pelaksanaan penelitian dan penulisan tesis ini. Terima kasih pula kepada Departemen Pendidikan Nasional yang telah memberikan bantuan dana studi dan penelitian, serta semua pihak yang telah membantu penulis selama penelitian dan penyusunan tesis terutama rekan-rekan pasca 2006.
Terima kasih yang tulus penulis sampaikan kepada Ayah dan Ibu serta seluruh keluarga yang telah memberikan dorongan moril. Ucapan terima kasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada istri tercinta Nur ayu yang dengan setia dan sangat sabar mendampingi penulis dan membimbing anak-anak kami tercinta Nurul Gina Zahra A. dan Alya Salsabilah A.
DAFTAR ISI
Halaman
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 1
Perumusan Pemecahan Masalah 3
Tujuan dan Manfaat Penelitian 3
Hipotesis 4
TINJAUAN PUSTAKA 6
Taksonomi dan Morfologi Lobster Air Tawar (Cherax quadricarinatus) 6
Distribusi, Habitat dan Tingkah Laku 7
Molting dan Pertumbuhan 8
Kalsium Sebagai Penyeimbang Pada Krustasea 13 Total Hemosit dan Glukosa Darah Krustasea Sebagai Indikator
Respon Terhadap Stres 14
Kualitas Air 16
METODOLOGI 20
Waktu dan Tempat Penelitian 20
Metode Penelitian 20
a. Penelitian Tahap Pertama (Uji Bioassay) 20
b. Penelitian Tahap Kedua 22
c. Pengukuran Total Hemosit Hemolim dan Glukosa Darah Sebagai
DAFTAR TABEL
Halaman
1 Tahapan perkembangan larva Cherax ... 10 2 Rata-rata persentase dan kategori molting pascalarva lobster air tawar pada
tiap-tiap perlakuan ... 31 3 Rata-rata total hemosit (x 106 sel/ml) dan standar deviasi pascalarva Cherax ... 31
4 Rata-rata total kadar glukosa darah (mg/dl) dan standar deviasi
pascalarva Cherax ... 33 5 Jumlah total konsumsi pakan oleh pascalarva Cherax selama penelitian ... 35 6 Rata-rata pertumbuhan bobot biomassa mutlak dan standar deviasi
setiap perlakuan dan ulangan ... 36 7 Rata-rata pertumbuhan rerata harian biomassa dan standar deviasi
DAFTAR GAMBAR
Halaman
1 Skema perumusan masalah . 5 2 Struktur Morfologis Cherax 6 3 Skema siklus hidup Cherax 11
4 Pengaruh photoperiod dan temperatur terhadap kinerja hormon
Molting dan reproduksi pada Cherax 13
5 Alur penelitian uji bioassay 21
6 Alur peneltian tahap kedua 23
7 Sintasan pascalarva Cherax dengan perlakuan suhu yang berbeda 27 8 Sintasan (%) pascalarva Cherax dengan perlakuan suhu yang berbeda ... 28 9 Kondisi pascalarva pada saat uji bioassay dengan suhu 380C ... 29 10 Kondisi pascalarva pada saat uji bioassay dengan suhu 400C ...
... 29
11 Rata-rata persentase molting pascalarva Cherax dengan waktu perlakuan yang berbeda ... 30
12 Rata-rata total hemosit (x106 sel/ml) pada masing-masing perlakuan 32 13 Rata-rata kadar glukosa darah pascalarva pada hari ke-1 sampai hari ke-5
dengan waktu berbeda ... ... 34
DAFTAR LAMPIRAN
Halaman
1 Alur penelitian perangsangan molting pascalarva Cherax dengan perlakuan suhu54
2 Prosedur analisis kadar glukosa darah 55
3 Data jumlah molting pascalarva lobster air tawar (Cherax quadricarinatus)
pada hari ke-1 sampai hari ke-5 56
4 Analisa ragam dan uji lanjut BNT terhadap jumlah molting pascalarva lobster air tawar (Cherax quadricarinatus) pada hari ke-1 sampai hari ke-5 57 5 Hasil pengukuran total hemosit pascalarva lobster air tawar
(Cherax quadricarinatus) pada hari ke-1 sampai hari ke-5 58 6 Analisa ragam dan uji lanjut BNT terhadap total hemosit pascalarva lobster
air tawar (Cherax quadricarinatus) pada hari ke-1 sampai hari ke-5 59 7 Data kadar glukosa darah pascalarva lobster air tawar (Cherax quadricarinatus)
pada hari ke-1 sampai hari ke-5 60
8 Analisa ragam dan uji lanjut BNT terhadap kadar glukosa darah pascalarva lobster air tawar (Cherax quadricarinatus) pada hari ke-1 sampai hari ke-5 61 9 Data pertumbuhan, sintasan, laju pertumbuhan rerata harian dan pakan pascalarva
Lobster air tawar (Cherax quadricarinatus) selama penelitian 62 10 Analisa ragam terhadap sintasan pascalarva lobster air tawar
(Cherax quadricarinatus) 63
11 Data pertumbuhan pascalarva Lobster air tawar (Cherax quadricarinatus)
selama penelitian 64
12 Analisa ragam terhadap pertumbuhan pascalarva lobster air tawar
(Cherax quadricarinatus) 65
13 Hasil analisa kualitas air pada media pemeliharaan lobster air tawar
PENDAHULUAN
Latar Belakang
Berdasarkan habitatnya, lobster dapat dikelompokkan ke dalam dua jenis, yaitu lobster air laut dan lobster air tawar. Salah satu jenis lobster air tawar yang cukup dikenal adalah dari genus Cherax (Olszewski, 1980), sehingga seringkali kata Cherax digunakan untuk istilah lobster air tawar.
Salah satu spesies lobster air tawar yang termasuk dalam genus Cherax adalah jenis Cherax quadricarinatus atau yang biasa dikenal redclaw (capit merah), merupakan salah satu spesies asli asal Australia yang memiliki potensi untuk pengembangan budidaya air tawar. Hal ini dimungkinkan karena laju pertumbuhan relatif cepat dan toleransi lebih tinggi terhadap fluktuasi parameter kualitas air dibandingkan dengan spesies lobster air tawar lain yang bukan tergolong genus Cherax (Merrick, 1993).
Daerah sebaran dari genus Cherax cukup luas, dapat ditemukan di benua Australia dan sebagian benua Amerika, sedangkan di Indonesia ditemukan di daerah Irian Jaya. Keberadaan lobster air tawar di Indonesia dapat dikatakan suatu yang baru, khususnya lobster jenis Cherax quadricarinatus yang berasal dari Queensland, Australia. Sampai saat ini, bentuk usaha budidayanya masih bersifat skala rumah tangga sebagai hobi dan usaha sampingan bagi para pelaku agroindustri udang dan belum menjadi komoditi komersil.
Budidaya lobster air tawar jenis capit merah sangat potensial untuk terus dikembangkan, karena memiliki tingkat produktivitas yang tinggi, dalam setahun seekor capit merah betina mampu bertelur sebanyak empat kali dan menghasilkan ribuan telur dan benih. Ukuran rata-rata konsumsi relatif lebih besar dibandingkan dengan lobster air tawar lain yang bukan tergolong genus Cherax, yaitu 50-150 gram dapat dicapai dengan masa pemeliharaan 6-12 bulan, bahkan 300 gram dalam 2 tahun (Pinto dan Rouse, 1996).
sering dijumpai pada budidaya Cherax jenis capit merah baik di pembenihan maupun pembesaran adalah tingginya mortalitas pada stadia awal atau stadia pascalarva, terutama saat molting. Berbagai cara telah dilakukan untuk menekan tingginya tingkat mortalitas benih lobster air tawar diantaranya ; penyeragaman ukuran (grading), penggunaan shelter dan perbaikan kualitas dan kuantitas pakan. Namun kematian akibat kanibalisme pascalarva masih cukup tinggi.
Pada saat pascalarva mengalami proses ganti kulit, maka Cherax berada pada kondisi yang sangat lemah sehingga dengan mudah terjadi proses kanibalisme oleh Cherax yang tidak ganti kulit. Dari fenomena ini, perlu diupayakan penyerempakan molting, sehingga peluang terjadinya kanibalisme dapat dikurangi.
Diharapkan, dengan perlakuan suhu subletal akan merangsang pascalarva Cherax memproduksi Molting Hormon (MH) melalui organ Y. Akibat adanya pengaruh stressor dari lingkungan, maka krustase melakukan reaksi dengan cara menghindari atau mengatasi ancaman yang potensial atau kondisi- kondisi yang dapat merusak atau merugikan. Respon-respon fisiologis dan biokimia pada krustase merupakan respon akibat adanya stres yang berasal dari lingkungan yang tidak mendukung. Indikator stress dari lobster air tawar diantaranya dapat dilihat dari jumlah hemosit dan kadar glukosa yang bersirkulasi dalam hemolim dan menunjukkan reaksi yang berbeda terhadap stressor lingkungan dan penyakit, sehingga dapat menjadi indikator status kesehatan Cherax dan adanya stressor lingkungan.
Berbagai penelitian telah dilakukan mengenai pengaruh stres terhadap krustasea diantaranya Chang, et al. (2004), mengamati tentang respon stres dua jenis lobster terhadap Crustasean Hyperglycemic Hormone (CHH) dan metabolit hemolim. Lebih lanjut Chang (2005), melaporkan hasil penelitiannya mengenai pengaruh stres luar pada lobster terhadap Crustasean Hyperglycemic Hormon dan protein stres. Berbagai tingkatan Crustasean Hyperglycemic Hormone (CHH) dan hemolim dalam tangkai mata udang Palaemon elegans yang terkena stres juga telah dilaporkan oleh Lorenzon, et al. (2004).
Perumusan Pemecahan Masalah
Pertumbuhan larva dan pascalarva Cherax merupakan perpaduan antara proses perubahan struktur melalui metamorfosis dan ganti kulit (molting). Selama stadia larva, Cherax mengalami beberapakali molting sampai stadia pascalarva. Saat terjadi pergantian kulit merupakan saat rawan bagi Cherax karena ketika kulitnya terlepas, tubuh bagian dalam tidak memiliki pelindung lagi, sehingga akan mudah menjadi mangsa oleh hewan lain.
Berbagai cara telah dilakukan untuk menghindari tingginya mortalitas akibat kanibalisme pada Cherax, mulai dari perbaikan nutrisi, penggunaan shelter, penyeragaman umur dan ukuran sampai perbaikan kualitas media pemeliharaan. Namun upaya ini belum mampu menekan tingginya mortalitas larva Cherax akibat kanibalisme.
Melihat kendala yang ada, maka perlu suatu upaya untuk mengurangi tingkat kanibalisme Cherax dengan mengupayakan agar Cherax dapat molting secara serempak (Molting 51 – 75% setelah 1-5 hari perlakuan) . Sehingga mengurangi resiko pemangsaan terutama pada saat molting. Dengan adanya perlakuan suhu, diharapkan Cherax yang stress akibat perubahan suhu yang ekstrim memacu Cherax untuk molting. Perlakuan suhu dilakukan dalam dua tahap, yaitu tahap pertama menentukan suhu subletal dan tahap selanjutnya suhu subletal diujikan dengan waktu yang berbeda. Sebelum dilakukan perlakuan suhu, diupayakan agar Cherax dalam keadaan sehat dengan cara mengontrol kualitas dan kuantitas pakan serta di upayakan agar kualitas air berada pada kondisi optimum dan terkontrol.
Tujuan dan Manfaat Penelitian
Penelitian perangsangan molting pascalarva lobster air tawar jenis capit merah (Cherax quadricarinatus) melalui perlakuan suhu, bertujuan untuk :
1. Menentukan suhu yang tepat yang dapat menyebabkan pascalarva lobster air tawar dapat molting secara serempak.
Manfaat penelitian ini diharapkan dapat menjadi bahan informasi tentang ;
1. Cara menekan tingginya mortalitas akibat kanibalisme pada pascalarva Cherax melalui penyerempakan molting sehingga dapat meningkatkan produksi.
2. Total hemosit dan kadar glukosa hemolim Cherax quadricarinatus akibat stres suhu subletal.
Hipotesis
TINJAUAN PUSTAKA
Taksonomi dan Morfologi Lobster Air Tawar (Cherax quadricarinatus)
Lobster air tawar umumnya terdiri dari 3 bagian, yaitu kepala, thorax merupakan bagian yang menunjang kaki jalan dan abdomen yang mengandung sebagian besar karkas (Jones, 1990). Sedangkan menurut Martosudarmo dan Ranoemihardjo (1980), udang secara morfologi dapat dibagi menjadi 2 bagian, yaitu sepalotoraks (bagian kepala dan dada) dan bagian abdomen (perut). Penutup sepalotoraks terdiri dari zat tanduk atau kitin yang tebal dan disebut karapas. Zat tanduk ini merupakan Nitrogen Polisakarida (C8H13O5N)x yang disekresikan oleh epidermis dan dapat mengelupas
(molting) pada interval waktu tertentu. Fungsi karapas adalah untuk melindungi organ-organ bagian dalam seperti insang, alat pencernaan termasuk organ-organ hepatopankreas, jantung dan organ reproduksi.
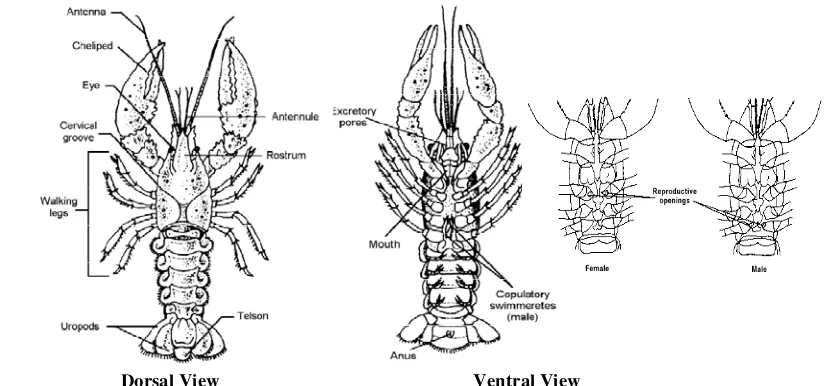
Secara umum tubuh udang terdiri dari segmen-segmen atau ruas-ruas, namun segmentasi ini tidak terlihat dari luar karena tertutup oleh karapas. Masing-masing segmen memiliki anggota badan dengan fungsi yang bermacam-macam. Anggota badan tersebut mulai ruas badan terdepan hingga ruas badan terakhir terdiri atas : tangkai mata, antennula, antena, mandibula, maksila, maksiliped, periopoda, pleopoda dan uropoda. Struktur morfologis Cherax dapat dilihat pada Gambar 2.
Dorsal View Ventral View
Gambar 2. Struktur morfologis Cherax sp (dilihat dari arah punggung dan perut ;
Distribusi, Habitat dan Tingkah Laku
Menurut Olszewki (1980), jenis lobster air tawar terdiri dari famili Astacidae yang terdapat di belahan bumi utara, dan famili Parastacidae di belahan bumi bagian selatan. Dijelaskan lebih lanjut oleh Riek (1968) dalam Widha (2003), bahwa famili Parastacidae yang terdiri dari 14 genus tersebar di belahan bumi selatan, yaitu Madagaskar, Tasmania, Australia, Selandia Baru, Irian dan Amerika Selatan.
Menurut Holthuis (1949) dalam Widha (2003), genus Cherax banyak terdapat di daerah Australia, Irian dan pulau-pulau di sekitarnya. Hingga kini telah diketahui bahwa di Irian Jaya terdapat 12 spesies, di Papua New Guinea ada 2 spesies (Sabar, 1975) sedangkan di Australia ada 27 spesies (Riek, 1968 dalam Kaligis, 2005). Menurut Rouse (1977), dari sekian spesies Cherax yang ada di Australia, ada tiga spesies yang saat ini sedang digalakkan pembudidayaannya, yaitu Cherax tenuimanus (marron), Cherax destructor (yabbie) dan Cherax quadricarinatus (redclaw atau capit merah). Ketiga spesies ini berasal dari wilayah Australia yang berbeda-beda dan memiliki penyebaran alamiah yang berbeda.
Habitat Cherax adalah pada aliran air yang dangkal dan pada perairan tawar (Storer dan Usinger, 1961). Menurut Holthuis (1949) dalam Widha (2003), Cherax dapat hidup di daerah dataran tinggi maupun dataran rendah. Sedangkan menurut Frost (1975), Cherax di Australia hidup pada kedalaman 0,8 – 1,0 meter dan pada kedalaman kurang dari 0,8 meter menyebabkan kematian, karena perubahan temperatur selama musim panas. Menurut Holdich dan Lowery (1988), pada suhu yang terlalu rendah atau terlalu tinggi akan menghambat pertumbuhan dan cenderung Cherax akan membenamkan diri dalam lumpur atau menjadi tidak aktif.
Menurut Rouse (1977), habitat alami Cherax jenis capit merah adalah wilayah tropis Australia bagian utara yaitu daerah Queesland. Cherax jenis capit merah akan mengalami pertumbuhan terbaik pada suhu air 24o – 29oC. Kondisi kualitas air untuk Cherax jenis capit merah meliputi , oksigen terlarut (>1 ppm), alkalinitas (20 – 300 ppm CaCO3) dan pH (6,5 – 9). Cherax jenis capit merah dewasa menunjukkan toleransi
jenis capit merah juga toleran terhadap konsentrasi ammonia terionisasi sampai 1,0 ppm dan nitrit sampai 0,5 ppm dalam jangka waktu yang pendek.
Menurut Salmon dan Hyatt (1983), teritorialitas atau sistem daerah teritorial merupakan ciri utama hewan krustasea, terutama ordo decapoda, karena pada umumnya jenis hewan non soliter. Namun menurut Rouse (1977), Cherax jenis capit merah relatif suka berkelompok dan toleran terhadap kondisi yang padat, akan tetapi pada umur yang muda sering menunjukkan sifat agresif yang tinggi dan perilaku kanibalisme.
Menurut Jones (1998), genus Cherax merupakan pemakan oportunis, terutama sisa-sisa tumbuhan (serasah) dan koloni mikroba yang banyak ditemukan pada dasar kolam. Beberapa studi menunjukkan bahwa penggunaan pellet komersial dapat memberikan hasil yang memuaskan. Tingkat pertumbuhan benih yang bagus dapat juga dicapai jika zooplankton berkembang dengan baik dikolam. Menurut Rouse (1977), pakan alami yang cocok untuk Cherax adalah jenis makanan seperti wortel, seledri dan hati. Menurut Wickins dan Lee (2002), Cherax bersifat nokturnal, artinya aktif mencari makan dan beraktifitas pada malam hari atau pada suasana gelap. Sebaliknya, pada siang hari aktivitasnya menurun dan lebih banyak membenamkan dirinya kedalam Lumpur, pasir atau bersembunyi di sela-sela batu. Ketika mencari makan Cherax akan berenang dan merayap di dasar perairan sambil menangkap mangsanya. Cherax memerlukan makanan yang mudah dicerna karena anatomi dan susunan ususnya sangat sederhana.
Untuk menghindari pemangsaan Cherax senang menggali untuk bersembunyi terutama saat molting. Sebagai tempat berlindung (shelter) pada usaha pembesaran Cherax, umumnya digunakan bahan-bahan seperti pipa PVC, batu koral, batu bata atau mesh. Sehingga Cherax dapat bersembunyi dan menghindari pemangsaan terutama pada saat molting.
Molting dan Pertumbuhan
pertumbuhan dapat diekspresikan dengan perubahan kandungan total energi (kalori) tubuh pada periode tertentu (Hartnoll, 1982). Pertumbuhan larva dan pascalarva udang merupakan perpaduan antara proses perubahan struktur melalui metamorfosis dan ganti kulit (molting), serta peningkatan biomassa sebagai proses transformasi materi dari energi pakan menjadi massa tubuh udang (Yamaoka dan Scheer, 1970 ; Hartnoll, 1982). Molting adalah proses pergantian cangkang pada udang dan terjadi ketika ukuran daging udang bertambah besar sementara eksoskeleton tidak bertambah besar karena eksoskeleton bersifat kaku, sehingga untuk menyesuaikan keadaan ini udang akan melepaskan eksoskeleton lama dan membentuk kembali dengan bantuan kalsium (Wickins dan Lee, 2002). Semakin baik pertumbuhannya semakin sering Cherax berganti cangkang (Rouse, 1977).
Lama periode perkembangan stadia pascalarva udang ditentukan oleh waktu antar ganti kulit yang disebut juga periode intermolth (Sastry 1983). Semakin singkat periode intermolth maka perkembangan pascalarva cenderung semakin cepat. Menurut Effendie (2002), pertumbuhan dipengaruhi oleh dua faktor, yaitu faktor internal meliputi sifat genetik dan kondisi fisiologis dan faktor eksternal yakni berkaitan dengan lingkungan yang menjadi media pemeliharaan. Faktor-faktor eksternal tersebut diantaranya yaitu, komposisi kimia air, substrat dasar, temperatur air dan ketersediaan pakan.
Tabel 1. Tahapan perkembangan larva Cherax
Tahap Ciri-ciri dan masa Inkubasi Stadia
Pra larva Telur berwarna krem, pada saat dikeluarkan dari
induknya (1-4 hari) 1
Warna telur berwarna coklat muda (5-7 hari) 2 Warna telur berwarna coklat tua (8–14 hari) 3 Warna telur menjadi ungu keabu-abuan (15-17 hari) 4 Larva Warna telur berubah menjadi merah, tanpa bercak
mata (18-21 hari) Nauplius
Warna telur berwarna merah, dengan bercak mata
(22-27 hari) Protozoea
Warna telur berwarna merah, hampir menetas (28-35
hari) Mysis
Pascalarva Berwarna kelabu, jatuh dari pleopoda/ dilepaskan
induk (35-40 hari) Juvenil
Sumber : Rouse (2001) dalam Widha (2003)
Pada organisme yang tidak memiliki eksoskeleton pertumbuhan dapat berlangsung terus menerus, tetapi pada krustasea hal ini tidak dapat terjadi karena dibatasi oleh adanya eksoskeleton, sehingga proses pertumbuhan menjadi terputus-putus (Hartnoll 1982). Lebih lanjut dijelaskan bahwa pertumbuhan panjang individu merupakan fungsi berjenjang (step function), tubuh bertambah panjang pada setiap pergantian kulit dan tidak bertambah panjang antar pergantian kulit. Pada setiap ganti kulit intergumen membuka, pertumbuhan terjadi cepat pada periode waktu yang pendek, sebelum intergumen yang baru menjadi keras. Wickins dan Lee (2002), secara sederhana menjelaskan karakteristik ganti kulit pada udang mengikuti alur proses sebagai berikut;
1. Mobilisasi dan akumulasi cadangan material metabolik, seperti Ca, P dan bahan organik ke dalam hepatopankreas selama akhir periode antar ganti kulit (intermolt akhir)
2. Pembentukan kulit baru diiringi dengan resorpsi material organik dan anorganik dari kulit lama selama periode persiapan (awal) ganti kulit (premolt)
4. Pembentukan dan pengerasan kulit baru dari cadangan material organik dan anorganik yang berasal dari hemolimfee (darah) dan hepatopankreas (sebagian kecil berasal dari media eksternal), yang terjadi pada periode setelah ganti kulit (postmolt).
5. Pertumbuhan jaringan somatik selama periode setelah ganti kulit dan awal antar ganti kulit, fase dimana Cherax akan mengalami homeostasis kalsium yakni proses yang bertujuan untuk menyeimbangkan kandungan ion kalsium tubuh dengan ion kalsium diperairan (intermolt awal).
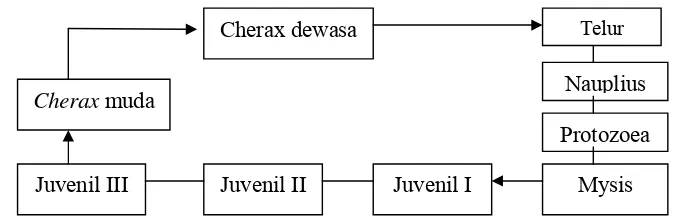
Menurut Merrick (1993), frekuensi pergantian cangkang akan selalu beriringan dengan pertambahan umur, pada juvenile terjadi setiap 10 hari, sedangkan setelah dewasa terjadi 4-5 kali setahun, ketika sudah menjadi induk dan pernah memijah biasanya melakukan molting 1-2 kali setahun. Sedangkan menurut Sokol (1988) dalam Tapilatu (1996), pada tahapan juvenil Cherax terdiri dari 3 tahap yaitu ; Juvenil I, II dan III. Juvenil biasanya akan meninggalkan induknya setelah mencapai panjang tubuh antara 3-4 mm. Setelah tahapan Juvenil, Cherax akan terus tumbuh dan akhirnya menjadi dewasa, Skema daur hidup Cherax disajikan dalam Gambar 3.
Gambar 3. Skema siklus hidup Cherax (Sokol, 1988 dalam Tapilatu, 1996)
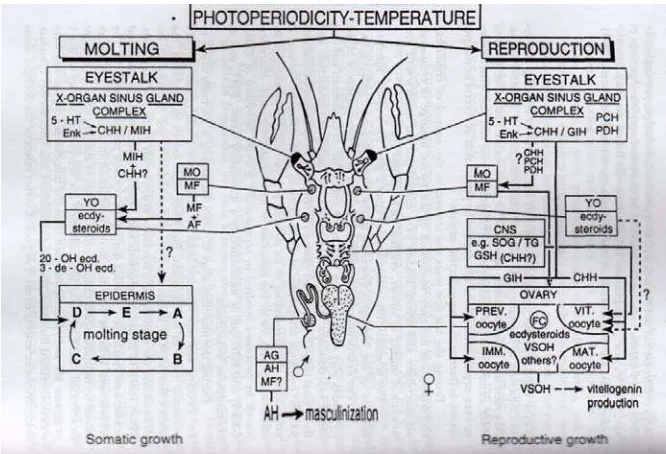
Diketahui bahwa, ada 2 faktor yang mempengaruhi molting pada krustasea yaitu faktor eksternal dan faktor internal. Faktor eksternal diantaranya; adanya stressor, nutrisi, photoperiod dan temperatur sedangkan faktor internal terkait dengan produksi hormon ekdisteroid dan Molt Inhibiting Hormon (MIH) (Quackenbush, 1986 ; Fingerman, Nagabhusanam dan Thompson, 1997). Menurut Aiken (1980) , Skinner (1985) dan Quackenbush (1986), ada beberapa faktor yang mempengaruhi siklus ganti kulit pada krustasea dintaranya faktor lingkungan eksternal. Pelepasan hormon
Telur
Cherax dewasa
Juvenil III Mysis
Protozoea Nauplius
ekdisteroid oleh organ-Y yang bervariasi berdasarkan stadium yang dilaluinya dalam siklus ganti kulit dan juga tergantung pada kadar hormon ekdisteroid yang terdapat dalam hemolim.
Gambar 4. Pengaruh photoperiod dan temperatur terhadap kinerja hormon molting dan reproduksi pada Cherax (Sumber ; Fingerman, Nagabhusanam dan Thompson, 1997)
Kalsium sebagai penyeimbang pada krustasea
Mineral utama pada eksoskeleton krustasea adalah CaCO3. Postmolt lobster air
tawar mengambil zat kapur dari lingkungan sebagai pembentuk eksoskeleton yang baru. Sumber dari karbonat (CO3 2-) tersedia dari proses-proses metabolisme atau dari
lingkungan yang salah satunya dalam wujud bikarbonat. Zat kapur (Ca2+) dan bikarbonat (HCO3-) kemudian membentuk kalsium karbonat CaCO3dan ion Hidrogen
(H+) (Zanotto dan Wheatly, 1995).
Ruang penyimpanan zat kapur dalam eksoskeleton lobster air tawar adalah hampir tak terbatas dan pengambilan yang aktif akan memerlukan energi selama proses pergantian kulit. Kandungan zat kapur pada lobster air tawar sangat bervariasi, karena hilangnya kalsium dari eksoskeleton yang dikerahkan kedalam lingkungan pada proses premolth yang berjalan lambat, diikuti penyerapan pada tahap postmolth (Jussila, 1997).
Menurut Adegboye (1981), ketika terjadi proses molting, terjadi pula proses homeostasis kalsium yaitu penyesuaian konsentrasi antara ion kalsium bagian dalam tubuh dengan ion kalsium perairan. Hal ini diperjelas oleh Dick (2004), bahwa proses penyerapan kalsium dari lingkungan dilakukan dengan cara diangkut melintasi sel dan disimpan untuk menjaga keseimbangan ion kalsium tersebut di dalam sel. Untuk melindungi gangguan-gangguan yang terjadi pada sistem penyerapan, maka sel tetap mempertahankan sejumlah kalsium dalam sitoplasmanya. Maka untuk itu proses pembentukan cangkang pada media yang memiliki ion Ca2+ tinggi, akan lebih efektif karena dapat membantu dalam proses homeostasis kalsium. Menurut Wickins dan Lee (2002), mineralisasi kulit baru dipengaruhi ketersediaan ion tertentu (seperti kalsium dan bikarbonat) dalam lingkungan perairan dan makanan yang dikonsumsinya.
Total hemosit dan glukosa darah krustasea sebagai indikator respon terhadap
stres
Stres adalah suatu fenomena biologi yang non-spesifik dari suatu perubahan lingkungan atau faktor-faktor lain yang mempengaruhi daya adaptasi homeostasis, dimana konstalasi proses perubahan secara stabil tersebut akan mempengaruhi proses-proses fisiologis yang pada akhirnya dapat menyebabkan kerusakan fisik bahkan kematian (Makmur, 2002). Lebih lanjut Esch dan Hazen (1978) dalam Adams (1990) mengemukakan bahwa stres didefinisikan sebagai pengaruh beberapa perubahan lingkungan yang memperluas homeostasis atau proses penstabilan diluar batas normalnya, pada berbagai tingkat organisasi biologi.
1. Perubahan lingkungan (environmental change), yang terdiri dari perubahan suhu, kepadatan, salinitas, perubahan tekanan air, polusi, pH, penyakit, perubahan arus air, muatan-muatan sedimen, konsentrasi DO dan ketersediaan makanan.
2. Penanganan (handling), seperti pemeliharaan di tank, transportasi dan pemindahan ikan dengan serok atau ember.
3. Penangkapan (capture) dengan pukat harimau, tramel net, gill net, hand line, dan lainnya (tujuan penangkapan untuk ikan hidup misalnya untuk ikan yang akan dijadikan induk, ikan hias atau pada ikan yang lolos dari alat tangkap tersebut). Sementara Afrianto dan Liviawati (1992), mengelompokkan penyebab stres atas :
1. Stres kimia, stres yang diakibatkan oleh terjadinya penurunan konsentrasi oksigen, meningkatnya konsentrasi karbondioksida, konsentrasi amonia maupun konsentrasi nitrit, konsentrasi sublethal dari insektisida dan pestisida maupun logam berat. 2. Stres lingkungan, parameternya antara lain suhu yang ekstrim dan air yang terlalu
jenuh dengan gas atau intensitas cahaya yang berlebihan.
3. Stres biologi yaitu stres yang disebabkan oleh aktivitas parasit eksternal maupun internal, serta kondisi pakan yang tidak sesuai dengan kebutuhan ikan.
Menurut Jusilla (1997), jumlah hemosit yang bersirkulasi dalam hemolim lobster air tawar menunjukkan reaksi yang berbeda terhadap stressor lingkungan dan penyakit, sehingga dapat menjadi indikator status kesehatan lobster air tawar dan adanya stressor lingkungan. Sedangkan menurut Jiravanichpaisal (2005), hemosit yang bersirkulasi dalam hemolim krustasea mengandung sejumlah enzim-enzim antioksidan dan memainkan peran kunci dalam sistem imunitas.
Stres menyebabkan peningkatan sekresi kortisol (glukokortikoid). Dengan demikian stres dapat meningkatkan glukosa darah. Beberapa mekanisme yang berperan dalam mempertahankan kestabilan glukosa darah adalah glukoneogenesis, lipolisis, glikogenesis, dan lipogenesis. Homeostatis kadar glukosa dalam darah dipertahankan oleh beberapa mekanisme, yaitu mekanisme yang mengatur kecepatan konversi glukosa menjadi glikogen atau lemak yang disimpan, dan mekanisme yang mengatur pelepasan kembali dari bentuk simpanan untuk dikonversi menjadi glukosa yang masuk ke dalam darah. Oleh karena itu, dengan banyaknya mekanisme yang berperan dalam mempertahankan homeostatis glukosa darah, kestabilan glukosa darah menjadi sangat penting bagi kesehatan bahkan kehidupan (Piliang dan Al Haj, 2006).
Kualitas air
Dalam pengertian yang sangat luas, kualitas air ditentukan oleh banyak variabel biologi, fisika dan kimia yang mempengaruhi kesesuaian air untuk suatu penggunaan tertentu. Dalam budidaya perikanan , kualitas air biasanya diartikan sebagai kesesuaian air untuk kejayaan dan pertumbuhan ikan, dan biasanya ditentukan oleh hanya beberapa variabel (Boyd, 1982). Beberapa variabel pendukung untuk budidaya Cherax adalah sebagai berikut :
a. Suhu
Suhu merupakan salah satu faktor penting yaitu sebagai controlling factor yang dapat mempengaruhi aktivitas fisiologis dan biokimiawi organisme perairan termasuk Cherax (Sianipar, 2004). Menurut Wedemeyer (1996), salah satu faktor yang mempengaruhi kesehatan ikan atau udang dalam budidaya intensif adalah variasi suhu dari media tempat hidupnya.
mengakibatkan peningkatan viskositas, reaksi kimia, evaporasi dan volatilisasi. Selain itu peningkatan suhu juga menyebabkan penurunan kelarutan gas dalam air seperti ; gas-gas O2, CO2, N2, CH4 dan sebagainya. Lebih lanjut Effendi (2000), menjelaskan
bahwa kecepatan metabolisme dan respirasi organisme air juga memperlihatkan peningkatan dengan naiknya suhu yang selanjutnya mengakibatkan peningkatan konsumsi oksigen. Peningkatan 10oC suhu perairan meningkatkan konsumsi oksigen oleh organisme akuatik sekitar 2-3 kali lipat. Peningkatan suhu ini dibarengi dengan menurunnya kadar oksigen terlarut di perairan, sehingga keberadaan oksigen di perairan kadangkala tak mampu memenuhi peningkatan oksigen yang dibutuhkan oleh organisme akuatik untuk metabolisme dan respirasi.
b. Derajat keasaman
Mackereth et al. (1989) dalam Effendi (2000), berpendapat bahwa pH berkaitan erat dengan karbondioksida dan alkalinitas. Pada pH < 5, alkalinitas bisa mencapai nol. Semakin tinggi nilai pH, semakin tinggi pula nilai alkalinitas dan semakin sedikit kadar karbondioksida bebas. Menurut Tebbut (1992) dalam Effendi (2000), toksisitas dari senyawa kimia juga dipengaruhi oleh pH. Senyawa ammonium yang dapat terionisasi banyak ditemukan pada perairan dengan pH rendah. Pada suasana alkalis (pH tinggi) lebih banyak ditemukan ammonia yang tak terionisasi (unionized) dan bersifat toksik. Ammonia tak terionisasi ini lebih mudah terserap ke dalam tubuh organisme akuatik dibandingkan ammonium.
Menurut Setiawan (2006), bahwa pH yang ideal untuk lobster air tawar ada pada kisaran 6-8. Sedangkan menurut Novotny dan Olem (1994) dalam Effendi (2000), sebagian besar biota akuatik sensitif terhadap perubahan pH dan menyukai nilai pH sekitar 7-8,5. Proses biokimia perairan seperti nitrifikasi sangat dipengaruhi oleh nilai pH. Proses nitrifikasi akan berakhir jika pH bersifat asam. Toksisitas logam memperlihatkan peningkatan pada pH rendah.
c. Oksigen terlarut (DO)
Effendi, 2000). Boyd (1982), menyatakan bahwa laju respirasi (konsumsi oksigen) oleh ikan bervariasi menurut spesies, ukuran, aktivitas, suhu, keadaan nutrisi dan faktor-faktor lain. Hilangnya oksigen di perairan selain karena proses respirasi tumbuhan dan hewan, juga dimanfaatkan oleh mikroba untuk mengoksidasi bahan organik yang berlangsung pada suasana aerob.
Kandungan oksigen terlarut dalam air yang dapat mendukung kehidupan udang yaitu antara 4-8 ppm, kebutuhan minimal oksigen terlarut adalah 4 ppm, sedangkan kandungan optimal untuk pertumbuhan udang adalah 6-8 ppm dan kandungan oksigen terlarut sebesar 3 ppm merupakan konsentrasi kritis bagi udang (Wickins dan Lee, 2002).
d. Karbondioksida bebas (CO2)
Menurut Boyd (1982), jika konsentrasi oksigen terlarut rendah, keberadaan karbondioksida yang cukup besar akan menghambat penyerapan oksigen terlarut oleh ikan. Konsentrasi karbondioksida biasanya sangat tinggi ketika konsentrasi oksigen terlarut rendah, terutama setelah kematian massal fitoplankton di kolam.
Pada dasarnya keberadaan karbondioksida di perairan bisa dalam bentuk gas karbondioksida bebas (CO2), ion bikarbonat (HCO3-), ion karbonat (CO32-) dan asam
karbonat (H2CO3) (Boney, 1989 dan Cole, 1988 dalam Effendi, 2000). Menurut Boyd
(1988) dalam Effendi (2000), perairan yang diperuntukkan bagi kepentingan perikanan sebaiknya memiliki kadar karbondioksida bebas < 5 mg/l. Kadar karbondioksida bebas 10 mg/l masih dapat ditolerir oleh organisme akuatik untuk tumbuh asalkan dibarengi dengan kadar oksigen yang cukup.
e. Ammonia (NH3)
Ammonia (NH3) di alam berasal dari pupuk, kotoran ikan dan dari pelapukan
Kandungan ammonia merupakan hasil dari sisa-sisa pakan dan metabolisme yang mengakibatkan pembusukan senyawa-senyawa organik oleh bakteri yang dapat menghambat pertumbuhan organisme perairan. Kandungan ammonia yang masih dapat ditolerir oleh udang adalah 1 ppm, sedangkan kandungan ammonia lebih dari 1 ppm dapat menurunkan pertumbuhan udang sebesar 60-70% (Tiensonrusme, 1989 dalam Sianipar, 2004).
f. Nitrit (NO2)
Nitrit biasanya ditemukan dalam jumlah yang sangat sedikit di perairan alami, kadarnya lebih kecil dari nitrat karena nitrit bersifat tidak stabil jika terdapat oksigen. Nitrit merupakan bentuk peralihan (intermediate) antara ammonia dan nitrat (nitrifikasi), dan antara nitrat dan gas nitrogen (denitrifikasi) (Novotny dan Olem, 1994 dalam Effendi, 2000).
Menurut Colt (1983) dalam Arista (2001), toksisitas nitrit berhubungan dengan konsentrasi asam nitrit yang bergantung pada suhu dan pH. Rendahnya pH akan meningkatkan pembentukan asam nitrit. Selain itu toksisitas nitrit akan meningkat apabila konsentrasi DO rendah dan suhu tinggi. Konsentrasi toksik nitrit berbeda-beda tergantung spesies, tetapi secara umum konsentrasi nitrit yang aman bagi ikan adalah antara 0,5-5,0 ppm.
g. Alkalinitas
Alkalinitas adalah gambaran kapasitas air untuk menetralkan asam atau sebagai penyangga (buffer capacity) terhadap perubahan pH perairan (Effendi, 2000).
Menurut Kaligis (2005), tingkat alkalinitas 140 ppm memberikan pertumbuhan yang terbaik dan dapat meningkatkan efisiensi pemanfaatan pakan serta frekuensi ganti kulit pada pascalarva Cherax jenis red claw. Sedangkan menurut Zaelani (2006), dosis CaCO3 yang terbaik bagi pertumbuhan dan efisiensi pakan pada Cherax adalah 100
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Lingkungan Akuakultur Fakultas Perikanan dan Ilmu Kelautan IPB dari Februari 2008 hingga April 2008. Penelitian terdiri dari dua tahap, yaitu Uji pendahuluan selama 30 hari dan penelitian lanjutan 60 hari, mulai dari persiapan, pengadaan larva, aklimatisasi hingga perlakuan. Pascalarva Cherax yang digunakan didatangkan dari Parung-Bogor yang memiliki ukuran 3,5 – 4,9 cm dan berat 3-6 – 5,1 gram/ekor. Pengamatan total hemosit dalam hemolim dilakukan di Laboratorium Kesehatan Ikan IPB, analisis kadar glukosa darah dilakukan di laboratorium Fakultas Kedokteran Hewan IPB sedangkan pengukuran parameter kualitas air dilakukan di Laboratorium Lingkungan Akuakultur BDP IPB.
Metode Penelitian
Penelitian dilaksanakan dalam dua tahap, yaitu penelitian tahap pertama dan penelitian tahap kedua (penelitian pendukung). Alur penelitian dapat dilihat pada Lampiran 1.
a. Penelitian tahap pertama (Uji Bioassay)
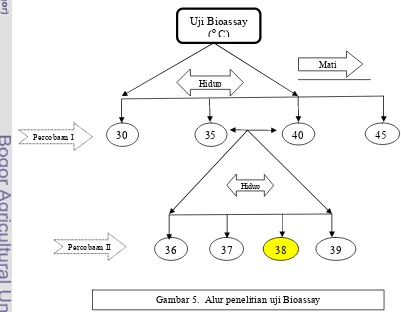
Penelitian ini berlangsung dalam 2 tahap percobaan, tujuan penelitian tahap ini adalah mendapatkan suhu sublethal, yakni suhu tertinggi yang mampu ditolerir oleh cherax setelah 24 jam perlakuan. Alat yang digunakan adalah akuarium, heather, stopwatch, thermometer, blower, pompa dan selang sedangkan bahan yang digunakan adalah pascalarva Cherax dan pakan.
Prosedur Percobaan Ke-I
akuarium dan diset dengan cara menambah atau mengurangi jumlah heater yang hidup sesuai waktu yang dibutuhkan. Kemudian memasukkan Cherax masing-masing 5 ekor per akuarium selama 60 menit. Setelah perlakuan Cherax dimasukkan ke akuarium dengan suhu normal untuk dipelihara. Indikator yang digunakan adalah Cherax tidak mati setelah 24 jam dari perlakuan. Dari percobaan Ke-I diperoleh suhu sublethal antara suhu 350C dan 400C, selanjutnya interval suhu dipersempit pada percobaan Ke-II.
Prosedur Percobaan Ke-II
Prosedur percobaan ini sama dengan percobaan ke-I, namun menggunakan suhu 36, 37, 38 dan 390C. Untuk mengatur suhu agar tetap bertahan sesuai waktu yang dibutuhkan, maka penggunaan heater diatur dengan cara menambah atau mengurangi jumlah heater yang hidup. Setelah memperoleh suhu yang diinginkan, maka Cherax dimasukkan sebanyak 5 ekor per akuarium selama 60 menit. Dari perlakuan ini diperoleh suhu sublethal 380C, dengan indikator cherax hidup 100% setelah 24 jam dari perlakuan.
Uji Bioassay (oC)
30 35 40 45
Hidup
Mati
36 37 38 39
Hidup
Percobaan I
Percobaan II
b. Penelitian tahap kedua
Penelitian tahap kedua merupakan rangkaian dari penelitian tahap pertama. Penelitian pertama untuk menentukan suhu sublethal, sedangkan penelitian tahap kedua untuk menentukan hubungan antara perlakuan suhu sublethal dengan persentase molting, total hemosit dan kadar glukosa darah. Alat yang digunakan pada penelitian tahap kedua adalah akuarium, stopwatch, thermometer, timbangan, blower, pompa dan selang sedangkan bahan yang digunakan adalah pascalarva Cherax dan pakan.
Suhu sublethal masing-masing diuji dengan selang waktu yang berbeda. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL), Anova satu arah terdiri dari 5 perlakuan dengan 3 ulangan. Penelitian tahap kedua berlangsung selama 60 hari, terdiri dari persiapan dan adaptasi pascalarva Cherax selama 10 hari serta perlakuan dan pemeliharaan selama 50 hari.
Prosedur percobaan.
molting dihitung dari hari ke-1 sampai ke-5 setelah perlakuan. Penghitungan sintasan, pertumbuhan dan total pakan dilakukan pada hari ke-50.
Keterangan Gambar :
= persiapan dan adaptasi (10 hari)
= Penghitungan total hemosit dan kadar glukosa darah (5 hari) = Penghitungan sintasan dan pertumbuhan (hari ke-40)
c. Pengukuran total hemosit hemolim dan glukosa darah sebagai indikator stres
• Total hemosit
Uji total hemosit bertujuan untuk mengetahui hubungan antara masing-masing perlakuan suhu sublethal terhadap total hemosit pascalarva Cherax. Menurut petunjuk Jusilla (1997), hemolim diambil sebanyak 0,2 ml dari pangkal kaki jalan keempat menggunakan syringe tuberkulin yang sudah berisi antikoagulan 0,2 ml. Selanjutnya dilakukan homogenisasi dengan cara menggoyangkan tangan membentuk angka delapan selama 5 menit sampai homogen. Tetesan pertama dibuang, lalu tetesan
Suhu Sublethal (38oC)
B=15 menit C=30 menit D=45 menit E=60 menit
A = Kontrol
3
1 2 4 5 50
A
selanjutnya diteteskan ke dalam haemocytometer dan segera dihitung jumlah selnya per ml dibawah mikroskop cahaya binokuler dengan pembesaran 40 kali.
• Glukosa darah
Uji glukosa darah bertujuan untuk mengetahui hubungan antara masing-masing perlakuan suhu terhadap konsentrasi glukosa dalam darah pascalarva Cherax (prosedur pengukuran glukosa darah dapat dilihat pada Lampiran 2). Kit yang digunakan adalah Glucose Enzymatic Colorimetric Test dengan panjang gelombang 500 nm.
d. Pengumpulan data
• Jumlah individu
Penentuan sintasan pascalarva Cherax dilakukan berdasarkan perhitungan jumlah seluruh individu Cherax pada tiap perlakuan, dengan menghitung jumlah yang hidup tiap 20 hari sekali sampai akhir percobaan.
• Jumlah molting
Jumlah molting pada tiap individu Cherax diamati selama percobaan. Selain itu dimonitor pula periode waktu antar molting.
• Kualitas air
Pemantauan beberapa sifat fisika kimia air media pemeliharaan meliputi : a) Suhu air media, yang diukur dengan thermometer air raksa dua kali sehari.
b) Kandungan oksigen terlarut, diukur dengan DO meter dan dilaksanakan setiap 20 hari sekali.
c) Nilai pH air, diukur dengan pH meter elektrik setiap 20 hari sekali.
e. Penghitungan data
Sintasan Pascalarva Cherax
Penghitungan sintasan pascalarva Cherx dilakukan dengan menghitung jumlah individu pada setiap 20 hari sekali sampai akhir penelitian. Data sintasan dihitung berdasarkan perumusan Effendie (2002), sebagai berikut :
S (%) = (Nt / No) x 100
Keterangan :
S = Persentase udang yang hidup
Nt = Jumlah individu udang uji pada akhir penelitia (ekor) No = Jumlah individu udang uji pada awal penelitian (ekor)
Total hemosit menggunakan rumus Jusilla (1997), sebagai berikut :
THC = (HC x D x C) / 0,4 Keterangan :
HC = rata-rata hemosit terhitung D = Faktor pengenceran (10)
C = Faktor konversi dari 0,1 mm3 sampai 1 ml (1000)
Pertumbuhan
1) Pertumbuhan individu mutlak (Effendie, 2002), yaitu : ΔW = Wt – Wo
Keterangan :
2) Laju pertumbuhan rerata harian (Huisman, 1976)
% x
Keterangan :
α = Laju pertumbuhan rerata harian (%)
Wt = bobot rata-rata individu pada waktu t (gram) Wo = bobot rata-rata udang pada awal percobaan (gram)
t = lama percobaan (hari)
Konsumsi pakan
Konsumsi pakan dihitung berdasarkan selisih antara bobot pakan awal dan bobot pakan sisa. Dengan demikian jumlah pakan yang dikonsumsi udang selama penelitian dapat diketahui.
Persentase ganti kulit
Persentase ganti kulit merupakan jumlah udang yang ganti kulit dalam populasi perlakuan. Dalam percobaan ini data diambil dari jumlah Cherax yang ganti kulit rata-rata tiap individu setiap perlakuan. Kategori persentase molting pada pascalarva Cherax adalah sebagai berikut;
• Molting < 25% termasuk kategori molting tidak serempak • Molting 26 – 50% termasuk kategori molting cukup serempak • Molting 51 – 75% termasuk kategori molting serempak
• Molting 76 – 100% termasuk kategori molting sangat serempak
f. Analisa data
Gambar 8 Sintasan (%) pascalarva Cherax dengan perlakuan suhu yang berbeda
Pada suhu 390C sintasan mencapai 40-60% sedangkan pada suhu 380C sintasan mencapai 100%, Selain pascalarva harus tetap hidup, pengamatan tentang tingkah laku terutama nafsu makan Cherax setelah perlakuan juga dilakukan. Ternyata perlakuan dengan suhu subletal tidak mempengaruhi nafsu makan pada hari kedua setelah perlakuan tetapi pada hari pertama pakan tersisa sekitar 50-60%. Uji bioassay untuk memperoleh suhu subletal pada media pemeliharaan pascalarva Cherax dapat dilihat pada Gambar 9 dan 10.
Gambar 9 Kondisi pascalarva pada saat uji bioassay dengan suhu 380C. Gambar 10 Kondisi pascalarva pada saat uji bioassay dengan suhu 400C.
Pada perlakuan dengan suhu 380C setelah 10 - 15 menit, Cherax sudah dapat beradaptasi dengan kondisi lingkungannya sedangkan pada perlakuan dengan suhu 400C pascalarva mati diatas menit ke 10.
Cherax yang ti
Penelitian Tahap Kedua
A. Pengaruh lama waktu perlakuan suhu subletal terhadap persentase molting
pascalarvaCherax.
Penelitian tahap kedua merupakan rangkaian dari penelitian tahap pertama, dimana suhu subletal (380C) diuji cobakan dengan selang waktu berbeda yaitu; 15, 30, 45 dan 60 menit. Sedangkan sebagai pembanding digunakan kontrol tanpa perlakuan suhu subletal.
Rata-rata persentase molting pascalarva dengan perlakuan waktu berbeda disajikan pada Gambar 11. Sedangkan hasil percobaan dengan perlakuan suhu 380C dengan waktu yang berbeda terhadap persentase molting pascalarva Cherax dapat dilihat pada Lampiran 3.
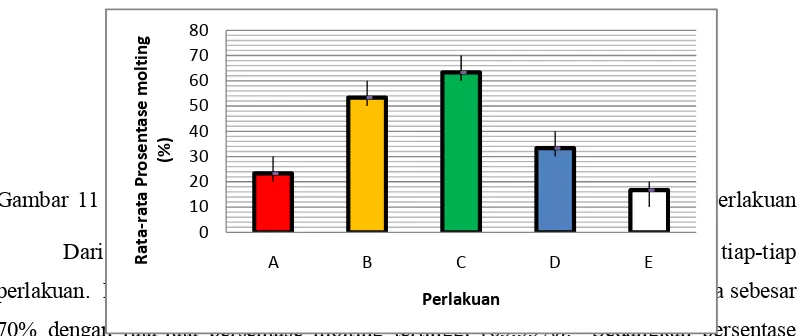
Gambar 11 Rata-rata persentase molting pascalarva Cherax dengan waktu perlakuan yang berbeda.
Dari grafik terlihat bahwa persentase molting bervariasi pada tiap-tiap perlakuan. Persentase molting tertinggi terjadi pada perlakuan C ulangan kedua sebesar 70% dengan rata-rata persentase molting tertinggi (63,33%). Sedangkan persentase molting terendah pada perlakuan E ulangan kedua yaitu 10% dengan rata-rata persentase molting terendah (16,67%).
Dari hasil analisa ragam dengan menggunakan Rancangan Acak Lengkap, Anova satu arah (p<0,05) diperoleh F hitung perlakuan sebesar 35,3 lebih besar dari F tabel 3,48, artinya perlakuan suhu subletal berpengaruh nyata terhadap molting pascalarva lobster air tawar. Setelah melalui uji lanjut dengan menggunakan Uji Beda Nyata Terkecil (BNT) diketahui bahwa perlakuan A berbeda nyata terhadap perlakuan B dan perlakuan C, tetapi tidak berbeda nyata terhadap perlakuan D dan E. Untuk perlakuan B, berbeda nyata pada perlakuan D dan E tetapi tidak berbeda nyata terhadap perlakuan C. Sementara perlakuan C berbeda nyata terhadap perlakuan D dan E. Sedangkan perlakuan D berbeda nyata terhadap perlakuan E, tetapi tidak berbeda nyata terhadap perlakuan A, B, dan C. Dari hasil yang diperoleh selama penelitian,
menunjukkan persentase dan kategori molting yang berbeda pada tiap-tiap perlakuan, seperti tersaji pada Tabel 2.
Tabel 2 Rata-rata persentase dan kategori molting pascalarva lobster air tawar pada tiap-tiap perlakuan
Perlakuan Persentase Molting (%) Kategori
A (Kontrol) 23,33 Tidak serempak
B 53,33 Serempak
C 63,33 Serempak
D 33,33 Cukup serempak
E 16,67 Tidak serempak
Dari Tabel 2, terlihat bahwa kategori molting serempak terjadi pada perlakuan B (53,33%) dan perlakuan C (63,33%), sedangkan perlakuan A (23,33%) dan perlakuan E (16,67) menunjukkan kategori molting tidak serempak.
B. Pengaruh lama waktu pemaparan suhu subletal terhadap total hemosit dan kadar glukosa hemolim pascalarva Cherax
Untuk mengetahui pengaruh perlakuan suhu subletal terhadap tingkat stres pascalarva Cherax, maka perlu diketahui indikator stres akibat perlakuan. Dalam penelitian ini, indikator stres yang diukur adalah total hemosit dan kadar glukosa darah.
1. Total Hemosit
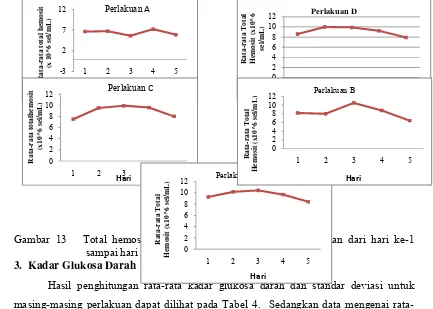
Hasil penghitungan rata-rata total hemosit dan standar deviasi untuk masing-masing perlakuan dapat dilihat pada Tabel 3. Sedangkan total hemosit setiap perlakuan dan ulangan selama penelitian dapat dilihat pada Lampiran 5.
Tabel 3 Rata-rata total hemosit (x 106 sel/mL) dan standar deviasi pascalarva Cherax pada.
Perlakuan
Rata‐rata total Hemosit (x106
sel/mL)
Standar deviasi Sandi
A 6,45 0,15 a
B 8,51 0,29 b
C 8,9 0,61 c
D 9,13 0,59 bc
E 9,58 0,53 bc
-3
3,4780, artinya perlakuan suhu subletal berpengaruh nyata terhadap total hemosit pascalarva lobster air tawar. Setelah melalui uji lanjut dengan menggunakan Uji Beda Nyata Terkecil (BNT) diketahui bahwa perlakuan A berbeda nyata terhadap perlakuan B,C,D dan perlakuan E. Untuk perlakuan B, berbeda nyata pada perlakuan A dan C tetapi tidak berbeda nyata terhadap perlakuan D dan E. Sementara perlakuan C berbeda nyata terhadap perlakuan A dan B tetapi tidak berbeda nyata terhadap perlakuan D dan E. Sedangkan perlakuan D berbeda nyata terhadap perlakuan A, tetapi tidak berbeda nyata terhadap perlakuan B, C dan E. Rata-rata total hemosit pada masing-masing perlakuan dan ulangan selama penelitian tersaji pada Gambar 13.
Gambar 13 Total hemosit (sel/mL) pada masing-masing perlakuan dari hari ke-1 sampai hari ke-5.
3. Kadar Glukosa Darah
Hasil penghitungan rata-rata kadar glukosa darah dan standar deviasi untuk masing-masing perlakuan dapat dilihat pada Tabel 4. Sedangkan data mengenai rata-rata kadar glukosa darah setiap perlakuan dan ulangan selama dapat dilihat pada Lampiran 7.
Tabel 4 Rata-rata total kadar glukosa darah (mg/dL) dan standar deviasi pascalarva Cherax.
Perlakuan Rata‐rata Kadar
Glukosa (mg/dL) Standar Deviasi Sandi
B 8,344 0,171 b
C 9,803 0,601 c
D 10,156 0,124 c
E 14,048 0,533 d
Kadar glukosa darah menunjukkan konsentrasi yang fluktuatif. selisih rata-rata kadar glukosa darah masing-masing perlakuan jika dibandingkan dengan kontrol masing-masing ; perlakuan B (197,5%), perlakuan C(286,1%), perlakuan D (300%) dan perlakuan E (453,3%). Dari hasil analisa ragam dengan menggunakan Rancangan Acak Lengkap (p<0,05), menunjukkan bahwa perbedaan waktu perlakuan dapat mempengaruhi jumLah total hemosit lobster air tawar dimana diperoleh F hitung perlakuan sebesar 251,829 lebih besar dari F tabel 5,19217 (Lampiran 8). Setelah melalui uji lanjut dengan menggunakan Uji Beda Nyata Terkecil (BNT) diketahui bahwa perlakuan A berbeda nyata terhadap perlakuan B,C,D dan E. Untuk perlakuan B, berbeda nyata pada perlakuan A, C, D dan E. Sementara perlakuan C berbeda nyata terhadap perlakuan A, B dan E, tetapi tidak berbeda nyata terhadap perlakuan D. Sedangkan perlakuan D berbeda nyata terhadap perlakuan A, B dan E, tetapi tidak berbeda nyata terhadap perlakuan E. Grafik rata-rata kadar glukosa untuk masing-masing perlakuan dan ulangan dari hari kesatu sampai hari kelima setelah perlakuan tersaji pada Gambar 15.
Gambar 15 Rata-rata kadar glukosa darah pascalarva pada hari ke-1 sampai hari ke-5 dengan waktu berbeda.
C. Sintasan PascalarvaCherax
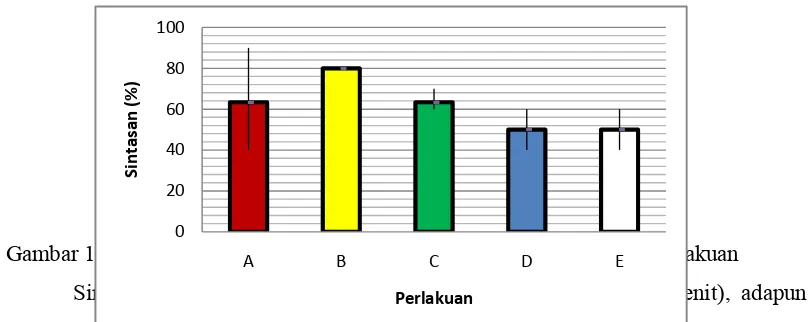
Hasil percobaan yang menggunakan suhu subletal dengan waktu perlakuan yang berbeda terhadap sintasan pascalarva Cherax pada akhir pengamatan disajikan pada Lampiran 9. Sedangkan rata-rata penurunan sintasan pada masing-masing waktu perlakuan tersaji pada Gambar 16.
Gambar 16 Rata-rata sintasan pascalarva Cherax pada masing-masing perlakuan
Sintasan tertinggi sebesar 80% pada perlakuan B (waktu 15 menit), adapun kontrol dan perlakuan C (waktu 30 menit) sintasan sebesar 63,33%, sedangkan pada pelakuan D (45 menit) dan perlakuan E (60 menit) mempunyai sintasan paling rendah yaitu 50%. Hasil sidik ragam (p<0,05), dimana F hitung (3,478) lebih kecil dari F tabel (2,654), menunjukkan bahwa perlakuan stres suhu tidak berbeda nyata terhadap sintasan pascalarva cherax selama percobaan (Lampiran 10).
D. Tingkat Konsumsi Pakan
Rincian data tingkat konsumsi pakan untuk masing-masing perlakuan dan ulangan dapat dilihat pada Lampiran 9. Tingkat konsumsi pakan harian dihitung berdasarkan selisih antara bobot pakan awal dan bobot pakan sisa, sedangkan total pakan yang dikonsumsi pascalarva Cherax selama penelitian tersaji pada Tabel 5. Tabel 5 JumLah total konsumsi pakan oleh pascalarva Cherax selama penelitian
B 127,1 C 113,7 D 91,17 E 91,52
Dari Tabel 5, terlihat bahwa jumLah total pakan konsumsi tertinggi pada perlakuan B (127,1 gram) sedangkan konsumsi pakan terendah pada perlakuan D (91,17 gram).
E. Pertumbuhan Bobot Biomassa Mutlak
Pertumbuhan bobot biomassa setiap perlakuan dan ulangan selama penelitian disajikan pada Lampiran 9. Untuk rata-rata pertumbuhan biomassa dan standar deviasi setiap perlakuan dan ulangan dapat dilihat pada Tabel 6.
Tabel 6 Rata-rata pertumbuhan bobot biomassa mutlak dan standar deviasi setiap perlakuan dan ulangan
Perlakuan ∆W (gram) Standar Deviasi Sandi
A 6,21 0,156 a
B 6,89 0,435 b
C 5,76 0,403 a
D 5,32 0,290 c
E 5,48 0,347 d
F. Laju Pertumbuhan Rerata Harian
Data lengkap yang menjadi dasar pengolahan laju pertumbuhan rerata harian tercantum dalam Lampiran 9. Untuk rata-rata pertumbuhan biomassa dan standar deviasi setiap perlakuan dan ulangan dapat dilihat pada Tabel 7.
Tabel 7 Rata-rata pertumbuhan rerata harian biomassa dan standar deviasi pascalarva Cherax selama percobaan
Perlakuan α(%) Standar Deviasi
A 2,35 0,283
B 2,87 0,178
C 2,69 0,29
D 2,47 0,459
E 1,81 0,202
Laju pertumbuhan rerata harian dipengaruhi oleh bobot rata-rata individu selama masa pemeliharaan dan bobot rata-rata udang pada awal percobaan. Dari Tabel 7, terlihat bahwa perlakuan E memiliki laju pertumbuhan rerata harian terendah (1,81%), sedangkan laju pertumbuhan rerata harian tertinggi pada perlakuan B (2,87%).
G. Kualitas Air
Kualitas media pemeliharaan, yang terdiri dari beberapa peubah fisika dan kimia air, berperan sebagai penentu kelayakan habitat bagi kehidupan pascalarva lobster air tawar. Hasil analisa terhadap peubah fisika dan kimia air disajikan pada Lampiran 13. Dari hasil analisa kualitas air, diperoleh kisaran sebagai berikut ; suhu 26 ±10C ; pH 6,9 - 7,8 ; Alkalinitas 112,9 – 195,5 ppm setara CaCO3; NH3-N 0,01 – 0,17 ppm; NO2
0,01 – 0,09 ppm dan CO2 1,81 – 3,69 ppm.
Pembahasan
1. Suhu Subletal
Parameter kualitas air yang merupakan faktor pengendali dalam penelitian ini adalah suhu. Penelitian dengan suhu subletal diperoleh melalui uji bioassay dengan menguji daya tahan pascalarva lobster air tawar dengan perlakuan suhu yang cukup ekstrim. Dengan mengacu pada indikator penggunaan suhu subletal, dimana Cherax masih dapat bertahan hidup dengan perlakuan suhu 380C selama 24 jam setelah perlakuan, maka diperoleh kesimpulan bahwa suhu 380C merupakan suhu subletal.
Respon stres yang ditunjukkan oleh Cherax dengan perlakuan suhu subletal adalah dengan gerakan yang aktif dan sesekali menghentakkan tubuhnya pada 10-15 menit awal perlakuan. Selanjutnya, diatas 15 menit terlihat bahwa Cherax mulai memperlambat gerakan dan sudah mulai beradaptasi dengan kondisi lingkungannya. Hal ini berbeda pada perlakuan suhu 39 dan 400C, yang mana dengan suhu tersebut terjadi kematian diatas menit ke-10, bila ditelaah lebih lanjut, ternyata kematian terbesar terjadi pada suhu 400C. Indikasi ini menunjukkan bahwa daya tahan tubuh pascalarva Cherax tidak mampu beradaptasi dengan suhu 39 dan 400C dimana mortalitas pada suhu 390C sebesar 40-60% sedangkan pada suhu 400C mortalitas mencapai 100% tetapi mulai suhu 380C ke bawah (suhu 300C) tidak dijumpai lagi adanya kematian pascalarva lobster air tawar.
Kenyataan ini menunjukkan bahwa stres suhu sebagai akibat perlakuan hanya mengakibatkan kematian pascalarva diatas suhu 380C, yaitu pada saat kemampuan adaptasi homeostasisnya belum cukup kuat. Pada suhu diatas subletal, lobster air tawar tidak cukup memiliki simpanan energi untuk beradaptasi, maka terjadinya stres suhu yang tinggi dari media eksternal dapat berakibat fatal bagi kehidupannya.
2. Pengaruh Perlakuan Suhu Subletal Terhadap Molting, Total Hemosit dan Kadar Glukos Darah
molting yang berbeda pada tiap-tiap perlakuan. Persentase molting terbesar, pada perlakuan C (63,33%), indikasi ini menunjukkan bahwa respon fisiolgis yang memacu pascalarva untuk molting sangat baik pada perlakuan ini kemudian berturut-turut Perlakuan B, Perlakuan D, Perlakuan A dan Perlakuan E. Hal ini diduga berkaitan dengan kerja hormonal terutama hormon ekdisteroid yang dapat memacu proses molting pada Cherax. Menurut Fingerman et al. (1997), (ahli fisiologi mengetahui) bahwa stres pada hewan dapat merugikan atau menguntungkan. Konsep hormesis bisa relevan, organisme tumbuh secara normal dan berfungsi sedikit dibawah kapasitas maksimalnya, stres-stres yang sedikit kadang-kadang meningkatkan aktifitas fungsi fisiologi.
Akan tetapi jika dilihat lebih lanjut sebenarnya pertumbuhan merupakan proses biologis yang kompleks dimana banyak faktor mempengaruhinya. Menurut Effendie (2002), pertumbuhan dalam individu ialah pertambahan jaringan akibat dari pembelahan sel secara mitosis. Hal ini terjadi apabila ada kelebihan input energi dan asam amino (protein) yang berasal dari makanan. Bahan yang berasal dari makanan akan digunakan oleh tubuh untuk metabolisme dasar, pergerakan, produksi organ seksual, perawatan bagian-bagian tubuh atau mengganti sel-sel yang sudah tidak terpakai. Bahan-bahan tidak berguna akan dikeluarkan dari tubuh melalui eksresi. Apabila terdapat bahan berlebih dari keperluan tersebut akan dibuat sel baru sebagai penambahan unit atau penggantian sel dari bagian tubuh, secara keseluruhan resultantenya merupakan perubahan ukuran.
Akibat pengaruh stres suhu akan memacu organ Y untuk menghasilkan Molt Accelerating Hormone (MAH) yang dapat membantu kelancaran proses ganti kulit (Sullivan, 1982 dalam Anggoro, 1992). Sedangkan menurut Fingerman et al. (1997), dengan adanya rangsangan suhu, akan merangsang organ Y untuk lebih banyak memproduksi hormon ekdisteroid yang berfungsi mempercepat proses molting . Sejauh mana pengaruh perlakuan suhu subletal dengan waktu yang berbeda terhadap produksi hormon ekdisteroid dan zat pemercepat ganti kulit pada Cherax, masih perlu penelitian lanjutan.
Cherax yang molting terbanyak pada masing-masing perlakuan pada hari ketiga, sejalan dengan hasil pengamatan total hemosit yang menunjukkan konsentrasi yang tinggi pada hari kedua dan ketiga kecuali pada perlakuan A (Kontrol). Tetapi hubungan total hemosit terhadap molting akibat berbagai respon stres belum banyak diketahui.
Glukoneogenesis merupakan istilah yang digunakan untuk mencakup semua mekanisme dan lintasan yang bertanggung jawab untuk mengubah senyawa nonkarbohidrat menjadi glukosa atau glikogen. Substrat utama bagi glukoneogenesis adalah asam amino glukogenik, laktat, gliserol dan propionat. Hati dan ginjal merupakan jaringan utama yang terlibat, karena kedua organ tersebut mengandung komplemen lengkap enzim-enzim yang diperlukan (Murray, et al. 2003).
Kadar glukosa darah pada masing-masing perlakuan berfluktatif. Pada hari pertama setelah perlakuan kadar glukosa menunjukkan peningkatan yang cukup signifikan jika dibandingkan dengan kontrol. Rata-rata peningkatan kadar glukosa darah terjadi pada hari ke-3 dan terjadi penurunan kembali pada hari ke-4 dan ke-5 mendekati kadar glukosa darah kontrol. Dengan demikian penurunan kadar glukosa darah pada hari ke-5 mengindikasikan bahwa kondisi pascalarva Cherax setelah 5 hari perlakuan relatif mulai stabil. Menurut Piliang dan Al Haj (2006), homeostasis gula dalam darah diatur melalui mekanisme hormonal, untuk mempertahankan kadar gula darah agar tetap stabil, memberi arti amat penting untuk kesehatan dan bahkan untuk kehidupan, karena setiap sel dalam tubuh membutuhkan suplai energi agar fungsi dan kehidupan sel dapat berlangsung. Setiap gangguan yang terjadi pada suplai glukosa akibat tidak berfungsinya mekanisme-mekanisme homeostasis glukosa, seperti kekurangan makan dan stres akan membawa dampak serius yang mungkin dapat mengancam kehidupan organisme tersebut.
kadar glukosa dalam hemolim selama perlakuan stres hypoxia meningkat dari 15 menjadi 65 µg/100 µl hemolim setelah 4 jam.
Menurut Murray, et al. (2003), bahwa Glukoneogenesis memenuhi kebutuhan tubuh akan glukosa pada saat karbohidrat tidak tersedia dalam jumlah yang cukup di dalam makanan. Pasokan yang terus menerus diperlukan sebagai sumber energi khususnya bagi sistem syaraf dan eritrosit, akan mengakibatkan kegagalan pada glukoneogenesis yang biasanya berakibat fatal.
3. Hubungan antara perlakuan stres suhu terhadap konsumsi pakan
Peubah ini ditentukan berdasarkan tingkat konsumsi pakan selama percobaan. Tingkat konsumsi pakan sangat dipengaruhi oleh kesehatan pascalarva, sintasan dan ukuran Cherax. Dari data selama percobaan Lampiran 12, terlihat bahwa rata-rata konsumsi pakan tertinggi pada perlakuan B (127,1 gram), kemudian berturut-turut perlakuan C (113,7 gram), perlakuan A (108,8), perlakuan E (91,52 gram) dan perlakuan D (91,17).
Tingkat konsumsi pakan ditentukan oleh tiga faktor, yaitu; (1) kualitas dan kuantitas pakan, (2) tata cara pemberian pakan (frekuensi dan waktu), (3) kualitas media pemeliharaan (Capuzzo, 1983 dalam Anggoro, 1992). Dalam percobaan ini, baik kualitas dan kuantitas maupun tata cara pemberian pakan (at satiation), semuanya diatur dan diusahakan seragam (sama). Begitu pula suhu (25-270C) serta kandungan oksigen terlarut (4,09-6,65) masih berada pada kisaran yang layak untuk budidaya Cherax. Satu-satunya faktor yang berbeda adalah lamanya perlakuan suhu subletal.
4. Hubungan antara perlakuan stres suhu terhadap sintasan dan pertumbuhan
biomassa mutlak
Persentase sintasan ditentukan oleh banyaknya kematian larva Cherax selama masa percobaan. Ada beberapa faktor yang diduga dapat menyebabkan kematian Cherax pada media percobaan, diantaranya adalah ; (1) Kualitas air yang tidak layak, (2) Hadirnya hama dan penyakit, (3) Penanganan yang kurang baik pada saat pengamatan, (4) Pakan yang tidak tepat jenis dan ukurannya, (5) Terjadinya gagal molting, (6) Terjadinya kanibalisme, (7) Akibat perlakuan suhu subletal.
Ditinjau dari aspek kualitas air, kondisinya cukup baik dan tingkat kelayakannya relatif seragam pada media percobaan. Dengan demikian dugaan kematian Cherax karena jeleknya kualitas air tidak terbukti. Demikian pula dengan dugaan adanya hama dan penyakit, peluang terjadinya relatif kecil karena media percobaan telah dibebaskan dari hama dan penyakit melalui pengendapan dibak tandon dan sterilisasi alat sebelum digunakan. Dari aspek penanganan percobaan, dapat diketengahkan bahwa kegiatan pengambilan sampel hemolim telah dilakukan dengan sangat hati-hati dan telah melalui beberapa kali latihan pengambilan hemolim. Sehingga pengaruhnya relatif kecil terhadap kematian Cherax. Selanjutnya, bila ditinjau dari aspek pakan, dapat dilihat bahwa pakan yang diberikan adalah pakan udang dengan kadar protein 30%, kadar air maximal 11%, lemak minimal 5% dan fiber maximal 4%. Jumlah dan ukuran pakan yang diberikan telah disesuaikan dengan umur Cherax dan terbukti disukai oleh pascalarva Cherax. Bila ditelaah lebih lanjut dan sesuai pengamatan selama percobaan bahwa kematian terjadi akibat gagal molting dan stres akibat perlakuan suhu subletal terutama pada perlakuan D dan E. Kejadian yang menarik dan sekaligus perlu penelitian lanjutan mengenai kematian akibat kanibalisme, sebab dari hasil pengamatan tidak terjadi kanibalisme pada perlakuan dengan suhu subletal. Hal ini berbanding terbalik jika dibandingkan dengan kontrol, dimana kematian akibat kanibalisme masih terjadi.