KARAKTERISASI KOMPONEN BIOAKTIF GORGONIAN
AKAR BAHAR SEBAGAI ANTIOKSIDAN, INHIBITOR
XANTIN OKSIDASE DAN INHIBITOR LIPOKSIGENASE
YUNIALDI HAPYNES TEFFU
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Komponen Bioaktif Gorgonian Akar Bahar sebagai Antioksidan, Inhibitor Xantin Oksidase dan Inhibitor Lipoksigenase adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2016 Yunialdi Hapynes Teffu
RINGKASAN
YUNIALDI HAPYNES TEFFU
.
Karakterisisasi Komponen Bioaktif Gorgonian Akar Bahar Sebagai Antioksidan, Inhibitor Xantin Oksidase dan Inhibitor Lipoksigenase. Dibimbing oleh RUDDY SUWANDI dan NURJANAH.Akar bahar telah lama dikenal oleh masyarakat karena bentuknya yang menyerupai tumbuhan laut. Akar bahar termasuk dalam kelompok hewan. Keunikan bentuknya banyak dimanfaatkan oleh masyarakat sebagai perhiasan berupa gelang. Selain keunikan bentuknya, akar bahar juga secara empiris oleh masyarakat digunakan sebagai obat reumatik. Kegunaannya sebagai obat reumatik perlu dikaji secara ilmiah terutama kandungan metabolit sekunder yang bermanfaat sebagai bahan obat dalam bidang farmasi.
Penelitian ini bertujuan untuk mengidentifikasi akar bahar, logam berat, metabolit primer, dan metabolit sekunder yang bermanfaat sebagai antioksidan, bahan obat anti-reumatik dan anti-inflamasi dalam bidang farmasi. Penelitian ini terdiri dari identifikasi jenis akar bahar, analisis proksimat, logam berat, kandungan radium, ekstraksi, fitokimia, uji toksisitas (brine shrimp lethality test), uji aktivitas antioksidan, inhibitor xantin oksidase dan inhibitor lipoksigenase.
Hasil identifikasi berdasarkan bentuk sklerit, akar bahar teridentifikasi sebagai Rumphella sp. dan Hicksonella sp. mengandung komponen protein yang tinggi pada bagian aksial sebesar 22.23%; dan kadar air terendah pada kulit akar bahar 2.28%. Kandungan logam berat Hg, As, Cu, dan Cd berada dalam kisaran batas aman sedangkan logam berat Pb melebihi standar yang ditetapkan BSN dan BPOM. Akar bahar mengandung radium 0.65 Bq/kg sampai 0.79 Bq/kg; ekstraksi bertingkat dengan pelarut berbeda diperoleh rendemen terbanyak menggunakan pelarut metanol kulit sebesar 56%; mengandung metabolit sekunder alkaloid, flavonoid, fenol hidrokuinon, steroid/triterpenoid, dan saponin. Penetapan kadar ekstrak akar bahar secara semi kuantitatif berdasarkan nilai Rf menunjukkan nilai Rf ekstrak akar bahar mendekati bahkan sama dengan nilai Rf baku standar.
Hasil analisis menunjukkan aktivitas ekstrak akar bahar termasuk dalam kategori toksik dengan nilai LC50 190.81 µg/mL – 873.19 µg/mL. Hasil uji
menggunakan metode DPPH ekstrak akar bahar tidak potensial sebagai antioksidan karena nilai IC50 diatas 1 000 µg/mL; dan standar vitamin C nilai IC50
4.82 µg/mL; ekstrak n-Heksana kulit akar bahar menghambat aktivitas enzim xantin oksidase dengan nilai IC50 24.90 µg/mL (konsentrasi 30.25 µg/mL), dan
standar alopurinol nilai IC50 1.03 µg/mL (25 µg/mL). Ekstrak n-Heksana kulit
akar bahar tidak berpotensi sebagai anti-inflamasi dalam menghambat aktivitas enzim lipoksigenase dengan nilai IC50 2.14 µg/mL (konsentrasi 3.33 µg/mL) dan
standar baikelain 0.01 µg/mL (konsentrasi 0.05 µg/mL).
SUMMARY
YUNIALDI HAPYNES TEFFU
.
Characterization of Bioactive Compounds of Gorgonian Akar Bahar as Antioxidants, Inhibitor Xanthine Oxidase and Lipoxygenase. Supervised by RUDDY SUWANDI and NURJANAH.Akar bahar has been widely known by local people as a sea plumes, but it is actually belongs to Animalia kingdom. Empirically, akar bahar has been used by local people as anti-rheumatic agent. The uniqueness of its form, widely used by people as bracelet. However, there is no information of akar bahar as anti-rheumatic agent. Its usefulness as anti-anti-rheumatic agent needs to be observated scientifically, especially content of secondary metabolites useful as drugs in the pharmaceutical field.
The aims of this research were to identify genus of akar bahar and characterize akar bahar including its heavy metal contents and bioactive compounds. The analyzes of this research consisted of identification, proximate analysis, heavy metal and radium contents, phytochemical, toxicity assay, antioxidant activity assay, xanthine oxidase inhibitor and lipoxygenase inhibitor.
Akar bahar was identified as Rumphella sp. and Hicksonella sp based on its schlerite shape. The highest protein was found in its axial part at 22.23% and the lowest moisture content was identified in its bark at 2.28%. Hg, As, Cu, and Cd contents of akar bahar were in the save levels, but its Pb content was exceeded the BSN and BPOM standards. Radium content in akar bahar was 0.65 Bq/kg-0.79 Bq/kg. The highest yield was obtained from bark methanol extract. The methanol extract contained alkaloids, flavonoids, phenol hydroquinone, steroids/triterpenoids, and saponins. Assay of akar bahar extract semi quantitatively based on the value of Rf showed that Rf value of akar bahar extract approached even equal to the value of standard Rf.
Toxicity assay showed that akar bahar extract was a toxic. LC50 of akar
bahar was 190.8 µg/mL-873.19 µg/mL. Antioxidant activity of akar bahar was not potential as antioxidant because the value of IC50 was above 1 000 µg/mL by
using DPPH method; while IC50 of vitamin C as a standard was 4.82 µg/mL.
n-Hexana extract of akar bahar bark potential as anti-rheumatic agents. n-n-Hexana extract of akar bahar bark could inhibit xanthine oxidase and lipoxygenase activities (as anti-rheumatic and anti-inflammatory agents). IC50 of n-Hexana
extract as anti-rheumatic agent was 24.90 µg/mL (concentration of 30.25 µg/mL), while IC50 of allopurinol standard was 1.03 µg/mL (concentration of 25 µg/mL).
IC50 of n-Hexana extract was not potential as anti-inflammatory agent 2.14 µg/mL
(concentration of 3.33 µg/mL) and baicelain standard was 0.01 µg/mL (concentration of 0.05 µg/mL).
© Hak Cipta Milik IPB, Tahun 2016 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
KARAKTERISASI KOMPONEN BIOAKTIF GORGONIAN
AKAR BAHAR SEBAGAI ANTIOKSIDAN, INHIBITOR
XANTIN OKSIDASE DAN INHIBITOR LIPOKSIGENASE
YUNIALDI HAPYNES TEFFU
Tesis
sebagai salah satu syarat untuk mendapatkan gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Karakterisasi Komponen Bioaktif Gorgonian Akar Bahar Sebagai Antioksidan, Inhibitor Xantin Oksidase dan Inhibitor Lipoksigenase
Nama : Yunialdi Hapynes Teffu
NIM : C351120221
Disetujui oleh Komisi Pembimbing
Dr Ir Ruddy Suwandi, MS M.Phil Ketua
Prof Dr Ir Nurjanah, MS Anggota
Diketahui oleh
Ketua Program Studi Teknologi Hasil Perairan
Dr Ir Wini Trilaksani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus atas berkat karunia dan rahmatNya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis ini dengan judul “Karakterisasi Komponen Bioaktif Gorgonian Akar Bahar Sebagai Antioksidan, Inhibitor Xantin Oksidase dan Inhibitor Lipoksigenase”. Tesis ini merupakan salah satu syarat untuk mendapatkan gelar Magister Sains di Program Studi Teknologi Hasil Perairan, Sekolah Pascasarjana, Insitut Pertanian Bogor. Penulisan tesis ini tak lepas dari bantuan berbagai pihak. Penulis mengucapkan terima kasih kepada:
1. Dr. Ir. Ruddy Suwandi, MS, M.Phil sebagai ketua komisi pembimbing dan Prof. Dr. Ir. Nurjanah, MS sebagai anggota komisi yang telah banyak mencurahkan waktu dan penuh kesabaran dalam membimbing penulis selama penelitian dan penulisan tesis.
2. Dr. Ir. Wini Trilaksani, MSc sebagai Ketua Program Studi Pascasarjana Teknologi Hasil perairan dan Prof. Dr. Ir. Joko Santoso, MSi sebagai Ketua Departemen Teknologi Hasil Perairan.
3. Prof. Ir. Linawati Hardjito, MS, PhD sebagai Gugus Kendali Mutu Program Studi Teknologi Hasil Perairan dan Dr. Desniar, SPi, MSi sebagai penguji luar komisi atas saran dan masukannya yang begitu berharga dalam penyempurnaan penulisan tesis.
4. Orang tua tercinta Julius Teffu dan Juliana Teffu-Leosae, saudara-saudari Junariaty Teffu, Marlince Teffu, Noviani Teffu, Erni Teffu, Jefri Teffu, Marvel Teffu, keponakan Eka dan Devina, keluarga Yakob Sanak dan Efrodina Sanak-Teffu atas ketulusan doa, cinta, motivasi dan kasih sayang. 5. Dosen dan staf pegawai Program Studi Pascasarjana Teknologi Hasil Perairan
FPIK IPB yang telah memberikan banyak ilmu dan pengalaman kepada penulis selama studi.
6. Keluarga besar Fakultas Perikanan dan Ilmu Kelautan Universitas Kristen Artha Wacana Kupang-NTT atas doa, semangat dan motivasinya.
7. Keluarga besar Bapak Simon Leo Riwu, Martinus Leo Riwu, Bapak Ruben Pa Mau, Bapak Petrus Alo Ruha, dan Bapak Wempi Alo Ruha, atas bantuan pengambilan sampel di perairan Raijua. Ir. M.I. Yosephine Tuti H sebagai staf peneliti LIPI Ancol Jakarta atas bantuan dalam mengidentifikasi sampel. Ibu Berna Elya, Ibu Marista, Ibu Sari, Mbak Ulfah, atas bantuan penggunaan fasilitas laboratorium Fakultas Farmasi Universitas Indonesia.
8. Kementrian Pendidikan Tinggi dan Kebudayaan yang telah memberikan beasiswa BPPS dan Kampus Universitas Kristen Artha Wacana Kupang-NTT atas bantuan biaya studi dan penelitian selama penulis menempuh pendidikan. 9. Teman-teman seperjuangan S2 THP angkatan 2012, angkatan 2010, 2011, 2013, teman-teman GAMANUSTRATIM, Wisma Baristar, Keluarga PA Oekumene atas kebersamaan, persahabatan dan persaudaraannya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup 2
2 METODE 3
Waktu dan Lokasi Penelitian 3
Bahan dan Alat 3
Prosedur Penelitian 3
3 HASIL DAN PEMBAHASAN 16
Pengambilan Sampel dan Identifikasi 16
Komposisi Kimia Akar Bahar 18
Logam Berat 21
Radium 26
Ekstrak Akar Bahar 28
Komponen Aktif Ekstrak Kasar Akar Bahar (Genus Rumphella
dan Hicksonella) 30
Penetapan Kadar Komponen Aktif Ekstrak Kasar Akar Bahar dengan
Kromatografi Lapis Tipis Densitometri 35
Toksisitas Ekstrak Akar Bahar 39
Aktivitas Antioksidan Ekstrak Akar Bahar 40
Aktivitas Inhibitor Xantin Oksidase Ekstrak Akar Bahar 44 Aktivitas Inhibitor Lipoksigenase Ekstrak Akar Bahar 48
4 SIMPULAN DAN SARAN 52
Simpulan 52
Saran 52
DAFTAR PUSTAKA 53
LAMPIRAN 63
DAFTAR TABEL
1 Komposisi kimia gabungan sampel akar bahar (genus Rumphella
dan Hicksonella) 18
2 Kandungan logam berat gabungan sampel akar bahar (genus
Rumphella dan Hicksonella) 22
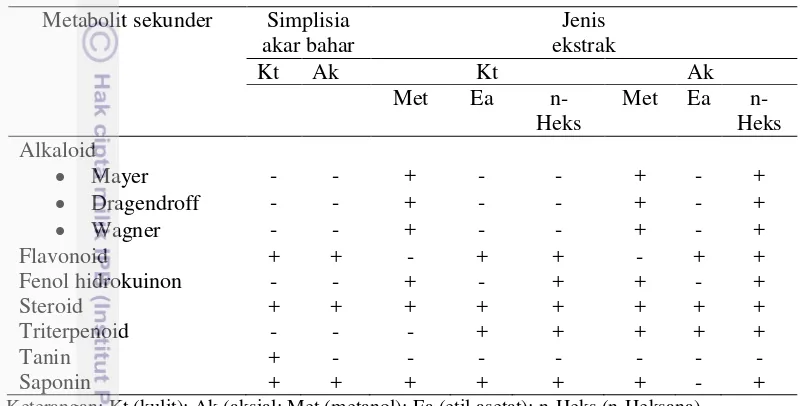
3 Komponen aktif simplisia dan ekstrak kasar gabungan sampel akar
bahar (genus Rumphella dan Hicksonella). 30
4 Nilai Rf ekstrak dan Nilai Rf baku standar dengan metode
KLT-densitometri pada panjang gelombang 366 nm 38
5 Nilai LC50 ekstrak akar bahar 39
6 Hasil pengujian aktivitas antioksidan (IC50) berbagai ekstrak akar
bahar dengan vitamin C sebagai pembanding 42
7 Persentase penghambatan xantin oksidase ekstrak kasar akar bahar
dan standar alopurinol 45
8 Nilai IC50 ekstrak kasar akar bahar dan alopurinol 46
9 Aktivitas penghambatan lipoksigenase ekstrak kasar akar bahar dan
standar baikailein 48
10 Nilai IC50 terhadap penghambatan lipoksigenase 50
DAFTAR GAMBAR
1 Tahapan penelitian 4
2 Metode ekstraksi bertingkat (Wikanta et al. 2005) 9 3 Bentuk sklerit akar bahar (a) sklerit Rumphella sp.; (b) Rumphella
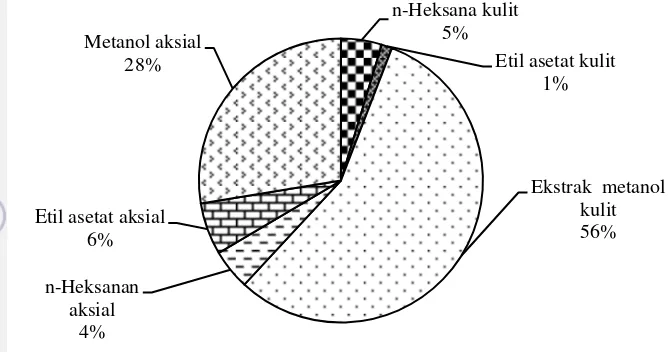
sp.; (c) sklerit Hicksonella sp.; (d) Hicksonella sp 17 4 Rendemen ekstrak kulit dan aksial gabungan sampel akar bahar
(genus Rumphella dan Hicksonella. 29
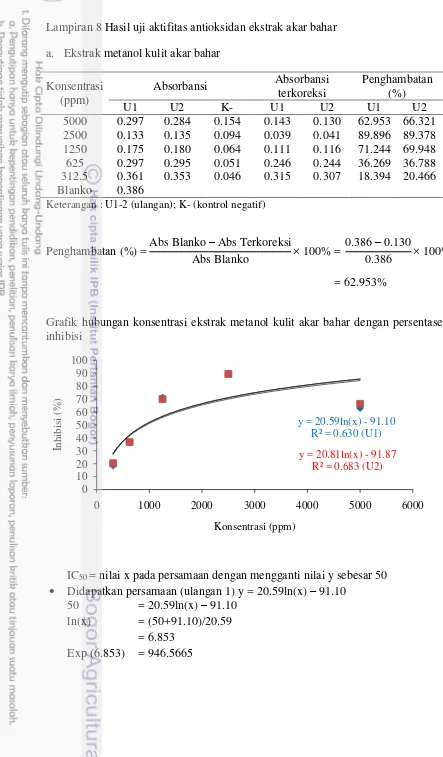
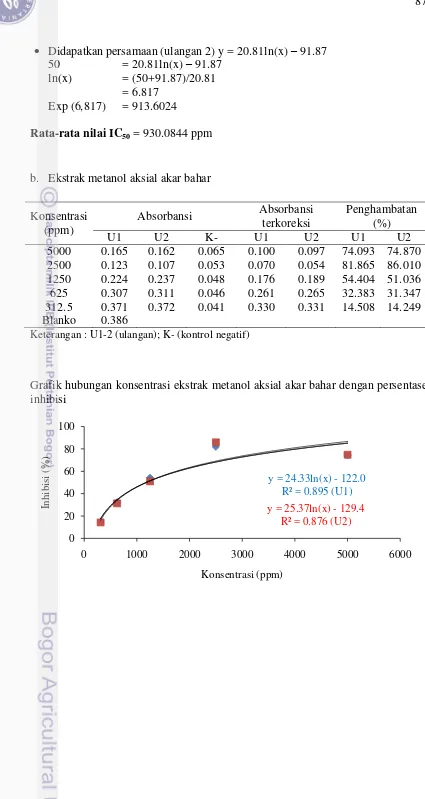
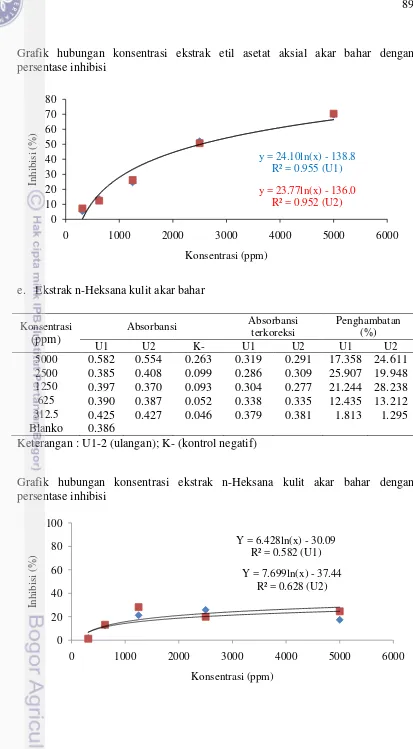
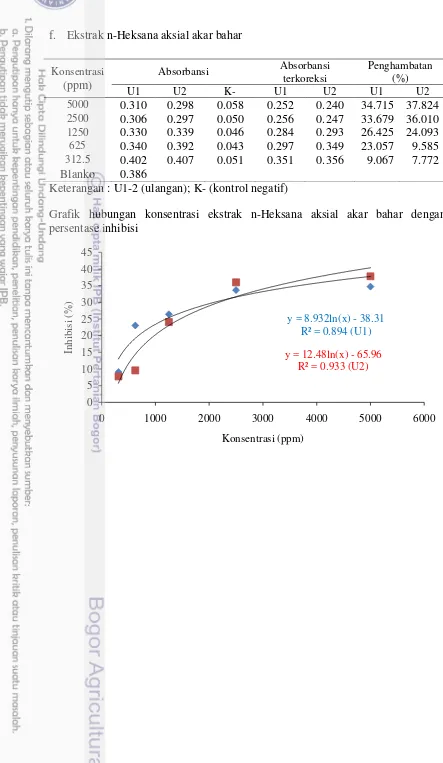
5 6
Profil kromatografi ekstrak kulit akar bahar
Persentase penghambatan terbaik bermacam ekstrak kasar akar bahar terhadap larutan DPPH pada konsentrasi 500 ppm dan vitamin C konsentrasi 20 ppm. MK (ekstrak metanol kulit); EAK (ekstrak etil kulit); HK (ekstrak heksan kulit); MA(ekstrak metanol aksial) ; EAA (ekstrak etil asetat aksial); HA (ekstrak heksan aksial); vitamin C
37
DAFTAR LAMPIRAN
1 Determinasi/klasifikasi akar bahar 65
2 Hasil uji proksimat akar bahar 66
3 Hasil uji radium akar bahar 66
4 Hasil uji logam berat akar bahar 67
5 Hasil uji fitokimia kualitatif ekstrak akar bahar 72 6 Hasil spektrum luas area bercak standar dan ekstrak akar bahar 74 7 Hasil analisis probit penentuan LC50 ekstrak akar bahar 80
8 Hasil uji aktivitas antioksidan ekstrak akar bahar 86
9 Hasil uji antioksidan vitamin C 91
10 Hasil uji aktivitas penghambatan xantin oksidase ekstrak akar
bahar 92
11 Hasil uji aktivitas penghambatan xantin oksidase standar
allopurinol 95
12 Hasil uji aktivitas penghambatan lipoksigenase ekstrak akar
bahar 96
1
PENDAHULUAN
Latar Belakang
Usaha pemanfaatan organisme laut sebagai sumber senyawa obat mulai berkembang seiring dengan penemuan senyawa-senyawa bioaktif dari laut. Usaha pencarian obat baru tersebut bertujuan untuk mengatasi penyakit-penyakit yang hingga kini belum ditemukan obatnya, seperti penyakit AIDS. Kegiatan ini dilakukan oleh berbagai institusi dan industri obat terkemuka di dunia. Salah satunya adalah NCI (National Cancer Institute) yang setiap tahunnya giat meneliti bioaktivitas senyawa kimia dari beribu-ribu jenis organisme laut terutama invertebrata dari seluruh dunia. Melalui skrining terhadap aktivitas sitotoksisitas diharapkan bisa ditemukan senyawa-senyawa baru sebagai antioksidan, antiinflamasi, antibakteri, antitumor dan antivirus (Suffnes et al. 1989).
Lingkungan laut adalah salah satu ekosistem terkaya dan paling kompleks. Lingkungan kimia yang keras dan kondisi fisik di lingkungan tersebut telah mendorong produksi berbagai macam molekul penting dengan ciri struktural yang unik. Molekul yang berasal dari laut tersebut menunjukkan berbagai jenis kegiatan biologis (Jain et al. 2008).
Perairan laut di Nusa Tenggara Timur kaya akan berbagai jenis gorgonian. Gorgonian termasuk dalam kelompok karang Octocorallia yang memiliki tekstur tubuh yang lunak, disokong oleh duri-duri atau spikula yang terdapat didalam jaringan tubuhnya serta memiliki delapan tentakel (Manuputty 1996). Salah satu organisme laut gorgonian yang penting dan perlu mendapat perhatian yaitu akar bahar, karena keberadaannya melimpah hampir di seluruh perairan Nusa Tenggara Timur. Penelitian oleh Tuti (2014) pada perairan Maumere Kabubapen Sikka Nusa Tenggara Timur melaporkan keberadaan gorgonian akar bahar yang ditemukan sebanyak 16 marga (genus) gorgonian dari 8 suku (family) yang diamati pada 14 stasiun pengamatan. Gorgonian dari marga Isis atau dikenal sebagai “patah tulang” atau “bambu laut” merupakan marga yang paling banyak dijumpai dan mendominasi perairan Maumere.
Keberadaan gorgonian akar bahar yang melimpah di perairan Nusa Tenggara Timur merupakan salah satu potensi yang perlu dikaji dan diteliti. Penelitian ini difokuskan pada gorgonian akar bahar yang banyak digunakan oleh masyarakat pulau Sabu-Raijua sebagai gelang dan obat tradisional. Masyarakat di Pulau Sabu-Raijua Nusa Tenggara Timur, menggunakan akar bahar sebagai obat, dengan cara akar bahar yang telah dikeringkan digerus untuk diambil serbuknya lalu diseduh dengan air panas dan diminum sebagai obat nyeri pada sendi. Pengetahuan empiris yang berkembang di masyarakat bahwa akar bahar mengandung radium alami yang dipercaya sebagai zat yang berfungsi untuk mengobati reumatik.
tanda-tanda radang/inflamasi pada sendi seperti bengkak, panas, sakit bila digerakkan, dan kulit di atas sendi tampak kemerahan. Serangan pertama kali memberikan gejala yang khas, berupa nyeri hebat pada persendian yang timbul secara mendadak (Dalimartha 2002).
Penelitian terhadap famili gorgonian akar bahar beberapa tahun terakhir yang dilaporkan menunjukan potensi aktivitas biologis yang menjanjikan. Penelitian pada gorgonian Rumphella antiphaties, Carijoa sp., oktokoral Carijoa multiflora menunjukan sifat potensial biologis sebagai antibakteri (Sung et al. 2007a; Sung et al. 2007b; Zhao et al 2013; Díaz-Marrero et al. 2011), sebagai antiprotozoa (Reimão et al. 2008). Oktokoral Dendronephthya griffin dan Soft Coral Scleronephthya gracillimum berfungsi sebagai anti-inflamasi (Chao et al. 2008; Fang et al. 2011); gorgonian Rumphella antipathies menunjukan penghambatan turunan anion superoksida dan pelepasan elastase oleh neutrofil manusia (Chung et al. 2013; Chung et al. 2014).
Pengetahuan masyarakat tentang khasiat akar bahar sebagai obat didasarkan pada pengetahuan empiris. Pembuktian akan khasiat akar bahar perlu adanya penelitian ilmiah di laboratorium akan komponen metabolit primer dan komponen metabolit sekunder yang terkandung didalamnya serta manfaat dari senyawa lain yang bermanfaat bagi manusia dalam pengembangannya sebagai bahan obat di bidang farmasi.
Tujuan Penelitian
Tujuan dari penelitian ini adalah : 1. Mengidentifikasi jenis akar bahar
2. Mengkarakterisasi komposisi kimia dan komponen bioaktif akar bahar
3. Menentukan aktivitas antioksidan, inhibitor xantin oksidase dan inhibitor lipoksigenase.
Manfaat Penelitian
Manfaat dari penelitian ini antara lain:
1. Memperoleh informasi mengenai klasifikasi akar bahar, kandungan proksimat, kandungan radium, kandungan logam berat dan komponen aktif akar bahar. 2. Memperoleh informasi konsentrasi ekstrak akar bahar sebagai antioksidan,
persentase penghambatan xantin oksidase dan persentase penghambatan lipoksigenase.
Ruang Lingkup
1. Mengidentifikasi jenis akar bahar
2. Mengkarakterisasi akar bahar meliputi klasifikasi, analisis proksimat, analisis logam berat, kandungan radium, menghitung rendemen, ekstraksi dan uji komponen aktif akar bahar.
2
METODE
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan Januari 2014 sampai bulan Juni 2015 di perairan Pulau Sabu-Nusa Tenggara Timur, Laboratorium Karakteristik Bahan Baku Teknologi Hasil Perairan IPB, Laboratorium Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian IPB, Laboratorium Nutrisi Ternak Perah Fakultas Peternakan IPB, Laboratorium Pusat Teknologi Keselamatan dan Metrologi Radiasi-BATAN Jakarta Selatan, Laboratorium Biofarmaka IPB, Laboratorium Kimia Organik Departemen Kimia IPB dan Laboratorium Pusat Studi Bahan Alam Fakultas Farmasi Universitas Indonesia.
Bahan dan Alat
Bahan utama dalam penelitian adalah akar bahar. Bahan kimia yang digunakan etanol 70% (Brataco), pelarut n-Heksana p.a (Merck, KGaA), etil asetat p.a (Merck KGaA), metanol p.a. (Merck KGaA), kloroform ((Merck KGaA), Artemia salina Leach, 1,1- difenil-2-pikrilhidrazil (DPPH) (Sigma Aldrich), dimetil sulfoksid (DMSO) (Merck KGaA), xantin (Sigma Aldrich), HCl (Merck KGaA), allopurinol (Sigma-Aldrich), rutin hidrat (Sigma-Aldrich), boldin (Sigma-Aldrich), digoksin (Sigma-Aldrich), diosgenin (Sigma-Aldrich), kuersetin (Sigma-Aldrich) -sitosterol (Sigma-Aldrich), TLC silika gel 60 F254 (Merck
KGaA), enzim lipoksigenase (Sigma-Aldrich), asam borat p.a (Merck KGaA) KCl (Merck KGaA)
Alat yang digunakan pH meter, salinometer, flow/current meter, sechi disk, global positioning system (GPS Garmin etrex), coolbox, mikroskop binokuler Olympus (U-RFLT 50), Atomic Absorption Spectrofotometer (AA700-Shimadzu), MVU-1A (Mercury Vaporizer Unit-(AA700-Shimadzu), HVG-1((AA700-Shimadzu), Spektrometer Gamma (DETEKTR HPGe ORTEG GMX-25P4), orbital shaker (wiseshake SHO-1D), rotary evaporator (Heidolph VV 2000), timbangan analitik (AND HR-200), pH meter (EU TECH INSTRUMENTS PH 700), single channel pippetor (Corning Lambda Plus), pipet 10 µL (Thermo Scientific Finnpipette® F2), spektrometer UV/VIS Double Beam T80+ (PG Instruments Ltd), TLC Scanner 3 (Camaq).
Prosedur Penelitian
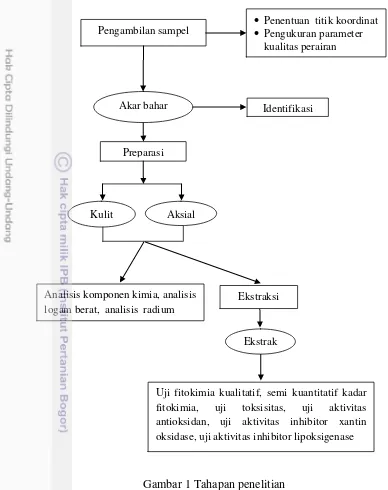
Gambar 1 Tahapan penelitian
Pengambilan sampel
Akar bahar diambil dalam keadaan hidup di perairan sekitar Pulau Raijua, Nusa Tenggara Timur dengan metode penyelaman berkisar 2 sampai 5 meter di bawah permukaan laut oleh nelayan setempat. Pengambilan data kondisi perairan meliputi suhu, salinitas, pH, kedalaman, kecepatan arus, dan kecerahan. Penentuan titik koordinat pengambilan sampel menggunakan alat GPS.
Sampel dicuci dengan air laut bersih, kemudian dikeringkan selama enam hari menggunakan sinar matahari. Sampel kering dimasukan dalam kemasan plastik polietilen, lalu dibawa ke laboratorium di Bogor, dalam wadah yang tertutup. Selanjutnya dilakukan tahapan karakterisasi, ekstraksi dan pengujian
Preparasi sampel
Identifikasi Pengambilan sampel
Ekstraksi
Ekstrak Akar bahar
Penentuan titik koordinat
Pengukuran parameter
kualitas perairan
Aksial Kulit
Uji fitokimia kualitatif, semi kuantitatif kadar
fitokimia, uji toksisitas, uji aktivitas
antioksidan, uji aktivitas inhibitor xantin oksidase, uji aktivitas inhibitor lipoksigenase Analisis komponen kimia, analisis
ekstrak. Sampel basah untuk keperluan identifikasi dilakukan dengan merendam sampel dalam larutan alkohol 70%.
Identifikasi sampel gorgonian akar bahar
Identifikasi gorgonian dilakukan dengan mengamati bentuk koloni, bentuk morfologi jarum sklerit yang terletak di badan maupun di tentakelnya. Langkah-langkah yang dilakukan untuk mengidentifikasi sampel gorgonian menurut Tuti (2014) dengan cara sampel diambil kira-kira 15 cm. Bagian ujung, tengah dan pangkal sampel dipotong 1 cm. Selanjutnya jaringan sampel dipisahkan dengan pemutih sebanyak 5-7 tetes. Sampel dibiarkan selama 5-10 menit. Aksis tengah koloni akan terpisah dengan sklerit berupa tepung, lalu sklerit dicuci dengan air bersih. Sklerit yang sudah bersih dapat dilihat bentuk morfologinya dengan mikroskop pembesaran 40x. Hasil foto bentuk sklerit dibandingankan dengan referensi untuk menentukan bentuk polip, surface dan subsurface menggunakan buku identifikasi Fabricius dan Alderslade (2001).
Analisis proksimat (AOAC 2005)
Pengujian proksimat terhadap akar bahar meliputi uji kadar air, protein, lemak, abu, karbohidrat, abu tak larut asam (AOAC 2005), dan abu larut asam dihitung secara by difference.
- Analisis kadar air
Cawan porselin dikeringkan dalam oven pada suhu 105 oC selama 60 menit. Cawan porselin tersebut diletakkan ke dalam desikator (kurang lebih 15 menit) atau dibiarkan hingga beratnya konstan kemudian ditimbang. Sebanyak 5 g sampel dimasukkan ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada suhu 105 °C selama 300 menit, kemudian dimasukkan ke dalam desikator dan dibiarkan sampai dingin selama 30 menit, selanjutnya ditimbang sampai beratnya konstan. Kadar air dihitung dengan rumus :
Keterangan: A = berat cawan kosong (gram)
B = berat cawan dengan sampel (gram)
C = berat cawan dan sampel setelah dikeringkan (gram) - Analisis kadar lemak
Sampel seberat 5 g (W1) dimasukkan ke dalam kertas saring. Pada kedua ujung kertas saring ditutup dengan kapas bebas lemak dan selanjutnya dimasukkan ke dalam selongsong lemak, kemudian sampel yang telah dibungkus dimasukkan dalam labu lemak yang sudah ditimbang beratnya (W2) dan disambungkan dengan tabung sokhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung sokhlet dan disiram dengan pelarut lemak (n-Heksana). Kemudian dilakukan refluks selama 360 menit. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak
B - C Kadar air (%) = x 100%
kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105 °C, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3). Kadar lemak dihitung dengan rumus:
Keterangan :
W1 = berat sampel (g)
W2 = berat labu lemak kosong (g) W3 = berat labu lemak dengan lemak (g) - Analisis kadar protein
Prinsip dari analisis protein yaitu untuk mengetahui kandungan protein kasar (crude protein) pada suatu bahan. Pengukuran kadar protein dilakukan dengan metode Kjeldahl. Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap yaitu:
(a) Tahap destruksi
Sampel ditimbang sebanyak 1 gram kemudian dimasukkan ke dalam labu Kjeldahl. Setengah butir kjeltab dimasukkan ke dalam tabung tersebut dan ditambahkan 10 mL H2SO4 p.a 98%. Tabung yang berisi larutan tersebut
dimasukkan ke dalam alat pemanas dengan suhu 400 °C. Proses destruksi dilakukan sampai larutan menjadi bening.
(b) Tahap destilasi
Hasil destruksi diencerkan dengan akuades hingga 100 mL dengan labu takar. Air dipanaskan sampai mendidih di heater rangkaian alat destilator. Asam borat sebanyak 25 mL dimasukkan ke dalam erlenmeyer. Erlenmeyer tersebut kemudian dipasang pada tempatnya (di tempat pengeluaran sampel dan NaOH). Hasil destruksi (larutan sampel) dipipet sebanyak 10 mL dan dimasukkan ke dalam destilator. Setelah itu, larutan NaOH 50% sebanyak 10 mL juga dimasukkan ke dalam destilator. Setelah larutan di dalam erlenmeyer yang berisi asam borat berubah warna menjadi biru kehitaman atau hijau toska, erlenmeyer diangkat dan dilakukan proses titrasi.
(c) Tahap titrasi
Titrasi dilakukan dengan menggunakan HCl 0.0947 N sampai terjadi perubahan warna menjadi merah (warna asam borat semula). Perhitungan kadar protein dihitung dengan rumus:
N (%) = mL HCl−mL blanko x N HCl x 14.007
mg contoh x faktor koreksi alat x 100%
Faktor konversi = 6.25
- Analisis kadar abu
Cawan abu porselen dibersihkan dan dikeringkan di dalam oven suhu 105 ºC selama 30 menit. Cawan tersebut kemudian dimasukkan ke dalam
W3- W2
desikator (30 menit) dan ditimbang. Sampel sebesar 5 g ditimbang dan dimasukkan ke dalam cawan abu porselen. Selanjutnya dibakar di atas kompor listrik sampai tidak berasap dan dimasukkan ke dalam tanur pengabuan (600 ºC) selama 420 menit. Cawan dimasukkan ke dalam desikator dibiarkan sampai dingin kemudian ditimbang.
Kadar abu dihitung dengan rumus:
Keterangan: A = berat cawan kosong (gram)
B = berat cawan abu porselen dengan sampel (gram)
C = berat cawan abu porselen dengan sampel setelah dikeringkan (gram)
- Analisis kadar karbohidrat
Sampel sebanyak 5 g dimasukkan ke dalam erlenmeyer ukuran 500 mL. Sampel ditambahkan 200 mL HCl 3% dan selanjutnya dididihkan selama 180 menit dengan pendingin tegak. Larutan hidrolisat didinginkan dan dinetralkan menggunakan NaOH 30%. Larutan hidrolisat ditambahkan indikator fenolpthalein 3 tetes dan diencerkan dengan akuades sampai batas tera 500 mL dalam labu ukur kemudian disaring menggunakan kertas saring. Larutan hidrolisat diambil 10 mL menggunakan pipet dan dimasukkan ke dalam erlenmeyer 500 mL, lalu larutan ditambahkan 25 mL larutan Luff Schrool dan 15 mL akuades serta batu didih. Larutan dipanaskan selama 3 jam dan waktu mulai hitung saat mendidih. Larutan hidrolisat yang telah didinginkan kemudian ditambahkan 15 mL larutan KI 20% dan 25 ml H2SO4 25%. Larutan hidrolisat kemudian dititrasi dengan larutan
natrium tiosulfat 0.1 N yang telah distandarisasi. Kadar karbohidrat dihitung dengan rumus:
Kadar Karhohidrat (%) = B−V x N thio x Bst Glukosa x FP
mg contoh x 100%
Keterangan : B = bobot setara/ekuivalen ½ dari Mr. V = volume thiosulfat
FP = faktor pengenceran
- Analisis kadar abu tak larut asam
Abu hasil penetapan kadar abu total dilarutkan dalam 25 mL HCl 10% dan dididihkan selama 5 menit. Larutan tersebut kemudian disaring dengan kertas saring bebas abu dan dicuci dengan air suling sampai bebas klorida. Kertas saring kemudian dikeringkan dalam oven. Abu yang telah kering kemudian diabukan kembali dalam tanur dengan menggunakan wadah cawan porselen. Cawan porselen tersebut kemudian didinginkan dalam desikator dan ditimbang hingga beratnya konstan. Kadar abu tidak larut asam ditentukan dengan rumus:
- Analisis kadar abu larut asam
Penetapan kadar abu larut asam ditentukan berdasarkan selisih antara kadar abu total dikurangi dengan kadar abu tak larut asam.
Kadar abu larut asam = kadar abu total – kadar abu tak larut asam.
Analisis logam berat Hg ,Cd, Pb, As dan Cu (AOAC 2002)
Sampel ditimbang 0.5 gram, dan ditambahkan asam nitrat pekat 5 mL. panaskan dengan suhu 180 C sampai 200 C sampai 1 mL. Larutan ditambahkan asam nitrat 10 mL dan asam perkolat 10 mL, panaskan lagi dengan suhu 180 C sampai 200 C hingga larutan menjadi ± 5 mL. Larutan diencerkan dengan aquades ke dalam 100 mL. Larutan disaring menggunakan kertas milipore. Filtrat dianalisis menggunakan Atomic Absorption Spectrophotometer (AAS).
Analisis kandungan radium (Badan Tenaga Nuklir Nasional 1998)
Analisis kandungan radium dilakukan untuk mengetahui kandungan radium yang terkandung dalam akar bahar mengacu pada Badan Tenaga Nuklir Nasional (1998). Prosedur pengujian yaitu sampel dibersihkan, kemudian ditimbang berat sampel (200 g - 500 g). Sampel dikeringkan pada suhu 105 C hingga kering. Sampel yang telah kering dimasukkan dalam tanur dengan suhu 500 C sampai menjadi abu. Sampel abu tersebut kemudian dimasukan ke dalam vial 250 mL. Sampel ditutup rapat dan didiamkan selama 40 hari pada suhu ruang. Setelah 40 hari disimpan, sampel siap diukur kandungan radium menggunakan spektrometer gamma.
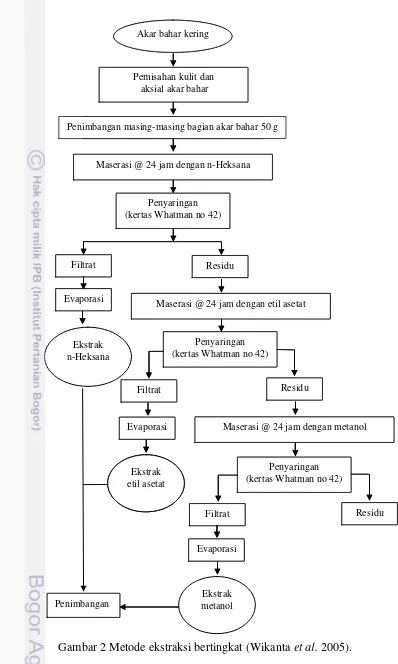
Ekstraksi (Wikanta et al. 2005)
Ekstraksi dilakukan secara bertingkat berdasarkan Wikanta et al. (2005) menggunakan metode maserasi. Akar bahar kering dipisahkan antara kulit dan aksial lalu dihaluskan. Sampel ditimbang sebanyak 50 g kulit dan aksial akar bahar dan ditambahkan masing-masing pelarut n-Heksana p.a sebanyak 300 mL dengan perbandingan 1:6. Campuran dikocok dengan menggunakan shaker selama 24 jam kemudian disaring menggunakan kertas whatman no 42. Filtrat pertama disimpan dalam lemari pendingin. Ekstraksi dilakukan sampai larutan menjadi jernih. Hasil penyaringan (filtrat) masing-masing bagian akar bahar (kulit dan aksial) ditampung dan digabung kemudian dievaporasi menggunakan rotary evaporator dengan suhu 40 C sampai pekat. Ekstrak pekat kemudian dipindahkan ke dalam botol vial. Proses ekstraksi terhadap residu hasil ekstraksi n-Heksana diulang menggunakan pelarut etil asetat p.a dan metanol p.a. Hasil ekstrak kasar ditimbang untuk mengetahui rendemen berdasarkan jenis pelarut menggunakan rumus:
Berat ekstrak kering (g)
Akar bahar kering
Pemisahan kulit dan aksial akar bahar
Penimbangan masing-masing 50 gram
Maserasi (@ 24 jam) x 3 dengan n-Heksana
Penyaringan (kertas whatman 42)
Residu
Evaporasi Filtrat
Maserasi (@ 24 jam) x 3 dengan etil asetat
Ekstrak
Maserasi (@ 24 jam) x 3 dengan metanol Evaporasi
Gambar 2metode ekstraksi bertingkat(Wikanta et al. 2005).
Akar bahar kering
Pemisahan kulit dan aksial akar bahar
Penimbangan masing-masing bagian akar bahar 50 g gram
Maserasi @ 24 jam dengan n-Heksana
Penyaringan (kertas Whatman no 42)
Residu
Evaporasi Filtrat
Maserasi @ 24 jam dengan etil asetat
Penyaringan (kertas Whatman no 42)
Residu Filtrat
Maserasi @ 24 jam dengan metanol Evaporasi
Uji Kualitatif Fitokimia (Harborne 1984)
Pengujian fitokimia secara kualitatif dilakukan untuk mengetahui ada tidaknya komponen-komponen bioaktiktif dalam ekstrak akar bahar. Pengujian fitokimia secara kualitatif dilakukan menurut Harborne (1984) terdiri dari uji alkaloid, steroid/tripenoid, flavanoid, saponin, fenol hidrokinon dan tanin.
Alkaloid
Sebanyak 1 mg ekstrak dari masing-masing pelarut dilarutkan dalam beberapa tetes asam sulfat 2 N, setelah itu akan di uji dengan beberapa pereaksi alkaloid diantaranya Dragendorff, Meyer dan Wagner. Hasil uji positif jika terbentuk endapan coklat untuk pelarut Wagner, endapan putih kekuningan untuk pelarut Meyer, dan endapan merah sampai jingga untuk pelarut Dragendorff.
Pereaksi Meyer dibuat dengan cara menambahkan 1 mL HgCl2 dengan
0.5 g KI lalu dilarutkan dan diencerkan dengan akuades menjadi 100 mL dengan labu takar. Pereaksi ini tidak berwarna.
Pereaksi Wagner dibuat dengan cara 10 mL akuades dipipet kemudian ditambahkan 2.5 g iodin dan 2 g kalium iodida lalu dilarutkan dan diencerkan dengan akuades menjadi 200 mL dalam labu takar. Pereaksi ini berwarna coklat.
Pereaksi Dragendorff dibuat dengan cara melarutkan 0.8 g bismut subnitrat dalam 10 mL asam asetat dan 40 mL air. Larutan ini dicampur dengan larutan yang dibuat dari 8 g kalium iodida dalam 20 mL air. Sebelum digunakan, 1 volume campuran ini diencerkan dengan 2.3 volume campuran 20 mL asam asetat glasial dan 100 mL air. Pereaksi ini berwarna jingga.
Steroid/Triterpenoid
Sebanyak 1 mg sampel dilarutkan dalam 2 mL kloroform pada tabung reaksi. Kemudian ke dalamnya ditambahkan 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat kedalam campuran larutan tersebut. Hasil uji positif apabila terbentuk larutan berwarna merah dan berubah menjadi biru dan hijau.
Flavonoid
Sebanyak 1 mg ekstrak dari masing-masing pelarut ditambahkan 0.1 mg magnesium dan 0.4 mL amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 mL alkohol, selanjutnya dikocok. Hasil uji positif jika terbentuk warna merah, kuning atau jingga pada lapisan amil alkohol.
Saponin (uji busa)
Sebanyak 1 mg sampel dilarutkan dalam air panas dan dikocok maka akan menghasilkan busa. Hasil positif jika pada sampel menghasilkan busa yang stabil selama 30 menit dan tidak hilang jika ditambahkan 1 tetes HCl 2 N.
Fenol hidrokuinon (pereaksi FeCl3)
2 tetes larutan FeCl 5%. Hasil positif bila ditunjukkan dengan terbentuknya larutan berwarna hijau atau hijau biru.
Tanin
Sampel sebanyak 1 mg ditambahkan FeCl3 kemudian campuran
dihomogenkan. Adanya warna hijau kehitaman menandakan sampel mengandung komponen tanin.
Penetapan Kadar Semi Kuantitatif Komponen Aktif (Kromatografi Lapis Tipis-Densitometri) (Desmiaty et al. 2014; Katrin et al. 2014)
Penetapan kadar ekstrak akar bahar dilakukan dengan metode KLT-densitometer mengacu pada Desmiaty et al. (2014) dan Katrin et al. (2014) yang dimodifikasi dan dibandingkan dengan standar yang digunakan. Flavanoid (standar rutin hidrat); alkaloid (standar boldin); saponin (standar digoksin) dan steroid/triterpenoid (standar -sitosterol).
Larutan baku standar
Standar yang digunakan ditimbang sebanyak 5 mg dilarutkan dalam metanol p.a sebanyak 10 mL sehingga di peroleh larutan standar 500 ppm. Sebanyak 10 µL larutan standar pembanding ditotolkan pada lempeng KLT silika gel GF254. Larutan uji
Sampel ditimbang sebanyak 25 mg dilarutkan dalam 5 mL pada masing-masing pelarut (metanol, etil asetat dan n-Heksana) sehingga di peroleh larutan uji 500 ppm. Sampel selanjutnya ditotolkan sebanyak 5 sampai 10 µL pada lempeng KLT silika gel GF254, bersama standar yang digunakan pada lempeng KLT yang
sama. Selanjutnya lempeng dikembangkan atau dielusidasi sesuai eluen masing-masing standar. Elusidasi alkaloid menggunakan eluen diklorometana : metanol (9:1); flavonoid menggunakan eluen metanol : aquades (80:20); steroid/triterpenoid menggunakan eluen n-Heksana : etil asetat (8:2); saponin menggunakan eluen kloroform : metanol (4:1).
Hasil elusidasi berupa bercak noda diamati di bawah lampu UV dengan panjang gelombang 254 dan 366 nm. Bila bercak yang diharapkan tidak ter-deteksi dengan UV, maka bercak ditandai pada tepi plat sesuai dengan KLT sampel yang telah dilakukan sebelumnya dan dideteksi dengan pereaksi berdasarkan standar yang digunakan. Pereaksi dragendrof untuk mendeteksi alkaloid; flavonoid disemprot dengan AlCl3; steroid/triterpenoid disemprot
Uji Toksisitas dengan Brine Shrimp Lethality Test (BSLT) (Meyer et al. 1982; Juniarti et al. 2009)
Uji Toksisitas dengan Metode brine shrimp lethality test (BSLT) berdasarkan metode Meyer et al 1982; Juniarti et al 2009. Metode BSLT digunakan untuk menguji toksisitas sampel secara umum dengan menggunakan telur udang (Artemia salina Leach).
Penetasan larva udang
Bejana disiapkan untuk penetasan telur udang. Selanjutnya dalam bejana tersebut diletakkan lampu untuk menghangatkan suhu dalam penetasan, sedangkan di ruang sebelahnya diberi air laut. Ke dalam air laut dimasukkan ± 50 sampai 100 mg telur udang untuk ditetaskan. Pada bagian telur ditutup dengan aluminium foil, dan lampu dinyalakan selama 48 jam untuk menetaskan telur. Larva udang yang akan diuji diambil menggunakan pipet.
Persiapan larutan sampel yang akan diuji
Ekstrak yang akan diuji dibuat dalam konsentrasi 10 ppm, 100 ppm, 500 ppm dan 1000 ppm dalam air laut. Bila sampel tidak larut tambahkan 2 tetes dimetil sulfoksid (DMSO).
Prosedur uji toksisitas
Sebanyak 100 µL air laut yang mengandung larva udang sebanyak 10-12 ekor dengan cara dipipet, kemudian dimasukkan ke dalam wadah uji. Di tambahkan larutan sampel yang akan diuji masing-masing sebanyak 100 µL, dengan konsentrasi 10 ppm; 100 ppm; 500 ppm; dan 1000 ppm. Setiap konsentrasi dilakukan 3 kali ulangan. Larutan diaduk sampai homogen. Kontrol dilakukan tanpa penambahan sampel (ekstrak). Semua vial diinkubasi pada suhu kamar selama 24 jam di bawah penerangan lampu TL 20 Watt. Pengamatan dilakukan setelah 24 jam dengan melihat jumlah Artemia salina yang mati pada tiap konsentrasi. Selanjutnya dihitung mortalitas dengan cara: akumulasi mati dibagi jumlah akumulasi hidup dan mati (total) dikali 100%. Penentuan nilai
LC50 dalam μg/mL atau ppm dilakukan menggunakan analisis probit. Meyer et
al. (1982) menyatakan suatu zat dikatakan aktif atau toksik bila nilai LC50 <1000
ppm untuk ektrak dan <30 ppm untuk suatu senyawa.
Uji Aktivitas Antioksidan
sehingga diperoleh % aktivitas antioksidannya. Perhitungan persentase aktivitas antioksidan digunakan rumus :
Absorbsi kontrol- Absorbsi sampel
Aktivitas antioksidan (%) = x 100% Absorbsi kontrol
Data hasil penentuan aktivitas antioksidan dengan metode DPPH dihitung nilai IC50 dengan menggunakan persamaan regresi linier. Nilai hambatan dan
konsentrasi ekstrak diplot masing-masing pada sumbu x dan y, persamaan garis yang diperoleh digunakan untuk mencari inhibition concentration 50 (IC50). Uji Aktivitas Inhibitor Xantin Oksidase (Umamaheswari et al. 2007); Wardah 2012)
Uji aktivitas anti-reumatik dilakukan dengan pengujian penghambatan terhadap aktivitas xantin oksidase menggunakann metode spektrofotometri berdasarkan Umamaheswari et al. (2007); Wardah (2012). Prinsip pengujian anti-reumatik dengan mengukur asam urat yang terbentuk akibat adanya penghambatan pembentukan asam urat oleh enzim xantin oksidase
Pembuatan larutan reaksi
Pembuatan dapar pospat pH 7.8
Larutan K2HPO4 dipipet sebanyak 45.4 mL dan 4.6 mL larutan KH2PO4,
lalu dimasukkan ke dalam gelas piala yang telah dikalibrasi dan berisi 500 mL aquademin bebas CO2, kemudian diaduk dan ditambahkan kembali aquademin
bebas CO2 hingga volume akhir 1000 mL, dan diaduk hingga homogen, cek pH
menggunakan pH meter dan adjust dengan KH2PO4 atau K2HPO4 hingga tepat pH
7.8.
Pembuatan larutan HCl 1 N
Larutan asam klorida 1 N dibuat dengan cara, dimasukkan 9 mL HCl kedalam gelas piala yang telah dikalibrasi dan berisi 50 mL aquademin bebas CO2, kemudian tambahkan kembali aquademin bebas CO2 hingga volume akhir
100 mL, aduk hingga homogen. Pembuatan Larutan NaOH 0.15 M
Larutan natrium hidroksida 0.05 M dibuat dengan cara ditimbang 0.2 g NaOH, dimasukkan ke dalam gelas piala yang telah dikalibrasi dan berisi 50 mL aquademin bebas CO2, diaduk hingga larut dan ditambahkan kembali aquademin
bebas CO2 hingga volume akhir 100 mL, diaduk hingga homogen. Pembuatan larutan uji ekstrak
Pembuatan larutan substrat xantin
xantin dibuat dengan mengencerkan larutan induk sampai diperoleh larutan xantin dengan konsentrasi 0.05 mM; 0.1 mM; 0.15 mM; 0.2 mM dan 0.25 mM.
Pembuatan larutan standar alopurinol
Larutan induk standar allopurinol dibuat dengan menimbang 10 mg allopurinol lalu dimasukkan ke dalam labu ukur 10 mL. Kemudian ditambahkan dengan NaOH 1 N beberapa tetes hingga larut lalu diencerkan dengan aquademin bebas CO2 di dalam labu ukur, kemudian dicukupkan volumenya hingga batas dan
diperoleh larutan induk dengan konsentrasi 1 000 ppm (1 000 μg/mL). Larutan standar allopurinol dibuat dengan mengencerkan larutan induk hingga diperoleh larutan standar alopurinol dengan konsentrasi 0.1 μg/mL, 0.2 μg/mL, 0.5 μg/mL dan 1.0 μg/mL.
Pembuatan larutan xantin oksidase
Ditimbang 22.17 mg xantin oksidase dengan menggunakan botol timbang dan sendok tanduk, kemudian dimasukkan ke dalam labu ukur 25 mL dan diencerkan dengan dapar fosfat di dalam labu ukur, kemudian dicukupkan volumenya hingga batas dan diperoleh larutan xantin oksidase 0.1 unit/mL.
Uji Penghambatan Aktivitas Xantin Oksidase
Pengujian sampel
Larutan uji sebanyak 1 mL dtambahkan 2.9 mL dapar fosfat 0.05 M pH optimum dan 2 mL larutan substrat xantin pada konsentrasi optimum kemudian dilakukan pra inkubasi masing-masing pada suhu optimum selama 10 menit. Setelah pra inkubasi selesai 0.1 mL larutan xantin oksidase ditambahkan ke dalam tabung reaksi dan dihomogenkan menggunakan vortex mixer. Larutan campuran kemudian diinkubasikan pada suhu optimum selama 30 menit. Reaksi dihentikan dengan penambahan 1 mL HCl 1 N, kemudian diukur serapannya pada panjang gelombang maksimum menggunakan spektrofotometer.
Pengujian kontrol sampel
Larutan uji sebanyak 1 mL ditambahkan 3 mL dapar fosfat 0.05 M pH optimum dan 2 mL larutan substrat xantin pada konsentrasi optimum. Larutan dilakukan pra inkubasi selama 10 menit, kemudian ditambahkan larutan HCl 1 N. Larutan campuran kemudian diinkubasikan pada suhu optimum selama 30 menit. Setelah inkubasi selesai larutan diukur serapannya menggunakan spektrofotometer pada panjang gelombang maksimum.
Pengujian standar
Larutan standar alopurinol sebanyak 1 mL (konsentrasi 0.1 μg/mL;
0.2 μg/mL; 0.5 μg/mL dan 1.0 μg/mL) ditambahkan 2.9 mL dapar fosfat 0.05 M
dihentikan dengan penambahan 1 mL HCl 1 N, kemudian diukur serapannya pada panjang gelombang maksimum menggunakan spektrofotometer.
Pengujian kontrol standar
Larutan standar alopurinol sebanyak 1 mL dengan konsentrasi 0.1; 0.2; 0.5
dan 1 μg/mL ditambahkan 3 mL dapar fosfat 0.05 M pH optimum dan 2 mL
larutan substrat xantin pada konsentrasi optimum. Larutan dilakukan pra inkubasi selama 10 menit, kemudian ditambahkan larutan HCl 1 N. Larutan campuran kemudian diinkubasikan pada suhu optimum selama 30 menit. Setelah inkubasi selesai, larutan diukur serapannya menggunakan spektrofotometer pada panjang gelombang maksimum.
Pengujian blanko
Dapar fosfat 0.05 M pH optimum sebanyak 3.9 mL dan 2 mL larutan substrat xantin pada konsentrasi optimum kemudian dilakukan pra inkubasi masing-masing pada suhu optimum selama 10 menit. Setelah prainkubasi selesai 0.1 mL larutan xantin oksidase ditambahkan ke dalam tabung reaksi dan dihomogenkan menggunakan vortex mixer. Larutan campuran kemudian diinkubasikan pada suhu optimum selama 30 menit. Reaksi dihentikan dengan penambahan 1 mL HCl 1 N, kemudian diukur serapannya pada panjang gelombang maksimum menggunakan spektrofotometer.
Pengujian kontrol blanko
Dapar fosfat 0.05 M pH optimum sebanyak 4.0 mL dan 2 mL larutan substrat xantin pada konsentrasi optimum. Larutan dilakukan pra inkubasi selama 10 menit, kemudian ditambahkan larutan HCl 1 N. Larutan campuran kemudian diinkubasikan pada suhu optimum selama 30 menit. Setelah masa inkubasi selesai larutan diukur serapannya menggunakan spektrofotometer pada panjang gelombang maksimum.
Perhitungan penghambatan aktivitas xantin oksidase (IC50)
Inhibisi (%) = Dimana :
A = aktivitas enzim tanpa ekstrak uji; B = kontrol A tanpa ekstrak uji dan enzim; C = pengujian ekstrak dengan xantin oksidase; D = pengujian ekstrak tanpa xantin oksidase.
Sebagai kontrol positif digunakan alopurinol dengan konsentrasi 0.1; 0.2; 0.5 dan 1.0 μg/mL. Nilai IC50 dihitung menggunakan rumus persamaan regresi:
y = a + bx. Sebagai variabel x adalah konsentrasi sampel dan sebagai variabel y adalah % inhibisi.
(A – B) – (C – D)
Uji Aktivitas Inhibitor Lipoksigenase (Tappel 1962; Khan et al. 2012; Choironi 2014).
Uji aktivitas anti-inflamasi dilakukan dengan metode penghambatan lipoksigenase (LOX) berdasarkan metode Tappel (1962); Khan et al. 2012; Choironi (2014). Larutan uji 100 ppm sebanyak 10 μL dengan 1000 μL larutan
asam linoleat dan 1690 μL larutan buffer borat (0.2 M) di prainkubasi pada 25 °C
selama 10 menit, kemudian ditambahkan larutan LOX 300 μL (10 000 U/mL dan diinkubasi selama 5 menit pada suhu yang sama. Produk yang dihasilkan hidroperoksieikosatetranoat (HPETE) dan diukur absorbansinya pada panjang gelombang 234 nm menggunakan spektrofotometer UV-Vis. Kontrol positif yang digunakan adalah baikailein. Persentase penurunan kadar HPETE dihitung menggunakan rumus:
absorbansi kontrol – absorbansi uji
penghambatan (%) = x 100 %
absorbansi kontrol
3 HASIL DAN PEMBAHASAN
Pengambilan Sampel dan Identifikasi
Pengambilan akar bahar di perairan Pulau Raijua, Kabupaten Sabu-Raijua Nusa Tenggara Timur pada bulan April 2014. Akar bahar diambil pada kedalaman 2 sampai 5 meter, pada titik kordinaat 1060’09’’ LS dan 12160’24’’ BT. Suhu perairan 29.6 C; salinitas 27‰; pH perairan 8.5; kecepatan arus 0.25 m/detik serta kecerahan 5 meter.
Hasil identifikasi berdasarkan pengamatan polip dengan mikroskop ditemukan bentuk sklerit berupa tonjolan-tonjolan menyerupai gada dan spindle. Hasil tersebut dibandingkan dengan bentuk polip pada buku identifikasi soft coral and sea fans menurut Fabricius dan Alderslade (2001). Hasil identifikasi bentuk sklerit dan wujud jenis akar bahar disajikan pada Gambar 3.
Identifikasi pada buku identifikasi soft coral and sea fans menurut Fabricius dan Alderslade (2001) menunjukan sklerit Rumphella sp. berbentuk gada dengan tonjolan-tonjolan kecil, sedangkan sklerit Hicksonella sp. berbentuk spindle.
Berdasarkan bentuk sklerit tersebut klasifikasi/determinasi akar bahar berdasarkan hasil penelitian bersama dengan Lembaga Ilmu Pengetahuan Indonesia (LIPI) sebagai berikut:
1. Genus : Rumphella Spesies : Rumphella sp 2. Genus : Hicksonella
Spesies : Hicksonella sp
Gambar 3 Bentuk sklerit akar bahar; (a) sklerit Rumphella sp.; (b) Rumphella sp.; (c) sklerit Hicksonella sp.; (d) Hicksonella sp
Akar bahar yang terdapat di Pulau Raijua, oleh masyarakat setempat menyebut dengan nama lokal na’i dahi. Pemberian nama lokal terhadap akar bahar juga biasanya berdasarkan warna kulit luar dan aksial pada akar bahar. Misalnya akar bahar merah kulitnya berwarna merah, aksialnya juga berwarna merah disebut na’i dahi mea; kulit berwarna cokelat, aksial berwarna putih disebut na’i dahi pudi; kulit berwarna cokelat, aksial berwarna hitam disebut na’i dahi meddi. Ada juga kipas laut (sea fan) oleh masyarakat setempat menggolongkannya juga sebagai akar bahar dengan nama lokal wila wadu. Masyarakat menyangka akar bahar Rumphella sp. dan Hicksonella sp serta beberapa jenis akar bahar yang lain seperti Isis spp. adalah tumbuhan karena bentuknya seperti semak, tetapi sebenarnya jenis-jenis akar bahar termasuk dalam kelompok hewan.
Masyarakat pesisir sulit untuk membedakan kedua jenis tersebut bila berada dalam air, karena mempunyai kemiripan dalam bentuk fisik dan sifatnya yang lentur bila diterpa arus air laut. Umumnya ukuran dan bentuk-bentuk cabang Rumphella sp. bentuknya lebih panjang, permukaan kulit halus dan bagian
a b
ujungnya lebih bulat sedangkan Hicksonella sp. permukaan kulit kasar dan ujungnya sedikit tajam; bentuk dan ukuran cabang-cabangnya nya lebih pendek; dibandingkan dengan ukuran dan bentuk cabangnya; Isis spp masih lebih pendek ukuran dan bentuk cabang-cabangnya dari kedua jenis akar bahar tersebut. Menurut Tuti (2014) untuk membedakan kedua jenis ini sangat sulit. Identifikasi bentuk sklerit digunakan untuk memastikan jenisnya.
Status perlindungan terhadap akar bahar jenis Rumphella sp. dan Hicksonella sp. sampai saat ini belum ada regulasi hukum yang tertuang dalam Peraturan Pemerintah atau Keputusan Menteri Kelautan dan Perikanan mengenai status perlindungan dari kedua jenis akar bahar tersebut. Status perlindungan terbatas hanya pada akar bahar jenis bambu laut (Isis spp) berdasarkan Keputusan Menteri Kelautan dan Perikanan No.46/KEPMEN-KP/2014 menetapkan status perlindungan terbatas bambu laut (Isis spp) untuk menjaga dan menjamin ketersediaan bambu laut yang telah mengalami penurunan populasi akibat eksploitasi yang berlebihan.
Komposisi Kimia Akar Bahar
Pengujian komposisi kimia dilakukan pada bagian kulit dan aksial akar bahar dengan tujuan untuk membandingkan kandungan yang terdapat didalam kulit dan aksial akar bahar. Hasil pengujian proksimat pada kulit akar bahar dan aksial menunjukkan komposisi yang relatif sama; tetapi pada komposisi tertentu seperti kadar air, protein dan lemak menunjukkan kandungan yang berbeda. Hasil pengujian proksimat merupakan gabungan (campuran) dua sampel akar bahar genus Rumphella dan Hicksonella. Kandungan proksimat terhadap kulit dan aksial akar bahar dari kedua genus tersebut disajikan pada Tabel 1.
Tabel 1 Komposisi kimia gabungan sampel akar bahar (genus Rumphella dan Hicksonella).
Komposisi akar bahar
Bagian akar bahar (genus Rumphella dan Hicksonella)
Kadar abu 14.06±0.34 13.80±0.52
Kadar abu larut asam 11.45±0.03 12.51±0.02
Kadar abu tak larut asam 2.58±0.07 1.27±0.02
Kadar air
mengandung air ikut menguap sedangkan bagian aksial terlindungi oleh kulit yang membungkusnya, sehingga air yang diuapkan terhalang oleh lapisan kulit.
Katno (2008) menyatakan pengeringan simplisia bertujuan untuk mencegah aktivitas enzim perusak kandungan kimia pada bahan. Bahan setelah dipanen lemah karena terserap (teradsorbsi) pada permukaan koloid makro molekuler seperti protein, pektin pati, selulosa. Air juga terdispersi di antara koloid tersebut dan merupakan pelarut zat-zat yang ada di dalam sel. Air yang ada dalam bentuk ini masih tetap mempunyai sifat air bebas dan dapat dikristalkan pada proses pembekuan. Ikatan antara air dengan koloid tersebut merupakan ikatan hidrogen; dan 3) air yang dalam keadaan terikat kuat yaitu membentuk hidrat. Ikatannya berifat ionik sehingga relatif sukar dihilangkan atau diuapkan. Air ini tidak membeku meskipun pada suhu -18 oC.
Kadar protein
Persentase kandungan protein akar bahar termasuk dalam kategori kandungan protein yang cukup besar. Pada kulit akar bahar kandungan protein dengan metode Kjeldahl sebesar 19.14% dan aksial akar bahar sebesar 22.23%.
Kandungan protein tersebut berbeda dengan penelitian Mistri (1996) pada aksial gorgonian Paramuricea clavata 82.56% dan Lophogorgia ceratophyta 48.19%. Kandungan protein tersebut dihitung berdasarkan metode analisis Leco CHN-600 (penentun karbon-hidrogen-nitrogen). Protein yang dihitung termasuk nitrat dengan asumsi bahwa semua nitrogen termasuk matriks protein.
Penelitian Goldberg (1978) dengan metode bovin serum albumin (BSA) melaporkan kandungan protein berkisar 70.4-93.6% pada tiga skeleton (aksial) gorgonian Muricea muricata, Swiftia exserta, Gorgonia ventalina, dan dua Anthiparia yaitu Cirrhipathes lutkeni dan Antipathes rhipidion.
Kandungan protein yang terdapat pada bagian aksial menunjukkan jumlahnya lebih banyak pada hasil penelitian dan beberapa penelitian yang dilaporkan dibandingkan dengan bagian kulit; dan kandungannya berbeda untuk setiap gorgonian.
Tingginya kandungan protein pada aksial diduga dari hasil penimbunan sisa-sisa makanan selama proses metabolisme yang makin lama makin tebal dan keras. Aziz (1978) menyatakan sisa-sisa makanan akan disimpan di dalam vakuola oleh sel-sel mesoglea dan kelak akan ditimbun ke arah sumbu (axial) dari koloni. Lapisan sebelah dalam ini makin lama makin tebal karena aktivitas dari mesoglea. Zat-zat yang ditimbun oleh mesoglea berupa zat tanduk atau keratin. Hal ini didukung oleh Manuputty (2008) bahwa kerangka dalam (axial) terdiri dari gorgonian yang keras dan padat, sama dengan zat tanduk yang mengandung substansi kolagen dan senyawa protein.
kolagen, berfungsi memperkuat penutup pelindung tubuh dan memperkuat jaringan ikat. Kandungan protein yang tinggi tersebut perlu dilakukan analisis lanjutan mengenai jenis-jenis asam amino yang terdapat di dalamnya. Asam-asam amino tersebut perlu dianalisis dan diuji aktivitas biologisnya karena termasuk dalam senyawa bioaktif. Asam-asam amino tersebut, diduga berperan sebagai antioksidan dan aktivitas biologis lainnya.
Kadar lemak
Persentase kadar lemak untuk kulit akar bahar sebesar 3.11% dan persentase kadar lemak untuk aksial akar bahar sebesar 0.56%. Kandungan lemak yang terdapat pada kulit akar bahar diduga berasal dari tubuh hewan karang (polip) yang melakukan proses metabolisme; lemak pada bagian kulit juga diduga berperan sebagai cadangan energi dan pelindung dari perubahan suhu.
Kandungan lemak yang terdapat pada aksial diduga sebagai hasil penimbunan selama metabolisme. Kandungan lemak yang terdapat pada akar bahar tergolong rendah dibandingkan penelitian Goldberg (1978) pada tiga skeleton (aksial) gorgonian Muricea muricata, Swiftia exserta, Gorgonia ventalina, dan dua Anthiparia yaitu Cirrhipathes lutkeni dan Antipathes rhipidion dengan kandungan lemak 0-8.4%.
Kandungan lemak yang terdapat dalam kulit akar bahar berpotensi untuk dikembangkan sebagai bahan antibiotik. Potensi tersebut didukung dengan hasil uji toksisitas yang menunjukkan ekstrak akar bahar pada kulit bersifat toksik. Trianto et al. (2004) melaporkan asam lemak pada ekstrak gorgonian Isis hippuris pada fraksi KKT 7; 9 dan 10 diduga bersifat toksik dan dipakai sebagai antibiotik.
Karbohidrat
Kandungan karbohidrat menggunakan metode Luff Schrool pada pada kulit akar bahar 4.54% dan pada bagian aksial 5.47%. Kandungan karbohidrat pada akar bahar relatif tinggi jika dibandingkan dengan penelitian Goldberg (1978) dengan metode asam fenol sulfat melaporkan kandungan karbohidrat sebesar 1.24-3.94% pada tiga skeleton (aksial) gorgonian Muricea muricata, Swiftia exserta, Gorgonia ventalina, dan dua Anthiparia yaitu Cirrhipathes lutkeni dan Antipathes rhipidion. Metode pengujian total karbohidrat yang berbeda menghasilkan hasil uji yang berbeda.
Kandungan karbohidrat yang relatif sama antara kulit dan aksial akar bahar diduga berasal dari hubungan simbiosis antara polip dan alga uniseluler zooxanthela. Zooxanthela menyediakan makanan bagi polip karena dapat melakukan proses fotosintesa. Makanan tersebut digunakan akar bahar untuk kelangsungan hidupnya dan disimpan dalam bentuk glikogen. Menurut Winarno (2008) karbohidrat yang terhitung berupa glikogen dan serat kasar. Hal ini dikarenakan karbohidrat yang terdapat pada hewan umumnya berbentuk glikogen.
Kadar abu
(CaCO3) diduga banyak terkandung dalam akar bahar; serta beberapa komponen
organik lainnya seperti magnesium, pospor, natrium, sulfur, besi, dan mineral organik lainnya. Aziz (1977) melaporkan gorgonian Corralium spp. mengandung kapur (CaCO3) 40-50%, asam karbonik 40% sisanya berupa magnesia, besi
oksida, asam sulfat dan silika. Sudarmadji et al. (2007) menyatakan kadar abu dalam suatu bahan menunjukkan kandungan mineral yang terdapat dalam suatu bahan.
Kandungan abu larut asam akar bahar pada bagian kulit 11.45% dan pada bagian aksial kadar abu larut asam 12.51%. Kadar abu larut asam pada bagian kulit dan aksial relatif sama kandungannya pada akar bahar. Kadar abu tak larut asam 2.58% pada bagian kulit akar bahar cukup tinggi dan bagian aksial akar bahar 1.27%.
Kadar abu larut asam pada bagian kulit dan aksial yang relatif sama diduga berasal dari pasir dan partikel-partikel tempat akar bahar hidup. Pasir dan partikel-partikel tersebut berupa komponen garam dan mineral-mineral, yang terbawa arus, diserap dan terakumulasi dalam tubuh akar bahar. Bai et al. (2011) melaporkan pada black coral Antipathes mengandung 13 komponen organik; kandungan fosfor dan kalsium merupakan komponen organik yang paling besar. Menurut Konishi (1991) karang lunak (Alcyonaria) merupakan hewan pemasok terbesar senyawa karbonat yang berguna bagi pembentukan terumbu karang. Hal ini terbukti sejak ditemukannya sejumlah besar spikula berkapur di dalam jaringan tubuhnya, yang tidak ditemukan pada hewan lain yang hidup di terumbu karang yang sama.
Kadar abu tak larut asam pada kulit akar bahar tergolong tinggi kandungannya, dibandingkan dengan bagian aksialnya. Tingginya kadar abu tak larut asam pada kulit diduga berasal dari dasar perairan tempat hidup akar bahar berupa silika, pasir, dan sedimen lainnya yang menempel pada karang. Kadar abu yang tak larut asam tersebut terakumulasi dalam tubuh akar bahar dan tidak dapat disekresikan pada saat proses metabolisme. Aziz (1977) melaporkan komposisi kimia gorgonian Corralium spp. mengandung 0.5% silikat. Isnawati et al. (2006) menyatakan kadar abu total dan abu tidak larut asam hendaknya menghasilkan nilai rendah karena uji ini merupakan indikator adanya cemaran logam yang tidak mudah hilang pada suhu tinggi.
Pengujian komposisi kimia pada akar bahar penting dilakukan sebagai data penelitian mengenai komponen kimia penyusun akar bahar. Komposisi kimia tersebut berguna sebagai dasar pertimbangan pemilihan metode ekstraksi dan jenis pelarut untuk penelitian pada tahapan selanjutnya terhadap komponen metabolit sekunder. Penelitan-penelitian sebelumnya jarang yang melaporkan informasi mengenai komposisi proksimat; penelitian difokuskan pada senyawa metabolit sekunder dan pengujian aktivitas biologi senyawa tersebut.
Logam Berat
Nilai atau rentang yang diperbolehkan terkait dengan kemurnian dan kontaminasi. Hasil pengujian logam berat pada akar bahar dapat dilihat pada Tabel 2.
Tabel 2 menunjukkan hasil pengujian logam berat merkuri, arsen, kadmium dan tembaga pada kulit dan aksial akar bahar masih berada dalam batas standar keamanan kandungan logam berat yang dipersyaratatkan dalam produk perikanan dan cemaran kimia dalam makanan. Logam berat timbal melebihi dari standar yang ditetapkan berdasarkan Badan Standar Nasional Indonesia (BSN) dan Badan Pengawasan Obat dan Makanan (BPOM).
Tabel 2 Kandungan logam berat gabungan sampel akar bahar (genus Rumphella dan Hicksonella).
Logam berat
Bagian akar bahar (genus
Rumphella dan Hicksonella) BSN (2009)
(ppm) dalam sampel sangat kecil sehingga tidak terdeteksi.
Keberadaan logam berat di perairan laut dapat berasal dari berbagai sumber, antara lain dari kegiatan pertambangan, rumah tangga, limbah pertanian dan buangan industri (Rochyatun et al. 2006). Pencemaran logam berat dapat menyebabkan terjadinya perubahan struktur komunitas perairan, jaringan makanan, tingkah laku, efek fisiologi, genetik dan resistensi. Berbeda dengan logam biasa, logam berat biasanya menimbulkan efek khusus pada makhluk hidup. Logam berat dapat menjadi bahan racun yang akan meracuni tubuh makhluk hidup (Palar 2008).
Merkuri (Hg)
Kandungan logam berat merkuri pada kulit dan aksial akar bahar terdeteksi < 0.002 ppm; berada dalam kisaraan yang dipersyaratan oleh BSN dan BPOM yaitu 1 ppm. Kandungan logam berat merkuri yang sangat kecil ini menunjukkan lingkungan perairan disekitar tempat hidup akar bahar jauh dari lokasi industri ataupun pabrik yang menggunakan merkuri dalam aktivitasnya seperti penambangan emas.
Merkuri (Hg) merupakan salah satu logam berat yang berbahaya dan dapat terjadi secara alamiah di lingkungan sebagai hasil perombakan mineral di alam melalui proses cuaca/iklim dari angin dan air. Umumnya merkuri ditemukan di alam dalam bentuk merkuri metalik, merkuri sulfida, merkuri klorida dan metal merkuri (BSN 2009).
akut (mual, muntah-muntah, diare, kerusakan ginjal dan kematian) (Darmono 2001).
Arsen (As)
Logam berat arsen pada kulit dan aksial akar bahar terdeteksi <0.002 ppm. Nilai tersebut lebih kecil dari 1 ppm dari nilai yang dipersyaratan oleh BSN dan BPOM. Hasil penelitian menunjukkan kandungan logam berat arsen dalam akar bahar masuk dalam kategori aman.
Arsenik diakui sebagai komponen esensial bagi sebagian hewan dan tumbuh-tumbuhan, namun demikian arsenik lebih populer dikenal sabagai raja racun dibandingkan kapasitasnya sebagai komponen esensial. Arsen anorganik seperti arsen pentaoksida memiliki sifat mudah larut dalam air, sedangkan arsen trioksida sukar larut di air, tetapi lebih mudah larut dalam lemak. Penyerapan melalui saluran pencernaan dipengaruhi oleh tingkat kelarutan dalam air, sehingga arsen pentaoksida lebih mudah diserap dibanding arsen trioksida (Widaningrum et al. 2007).
Kadmium (Cd)
Logam berat kadmium terdeteksi pada akar bahar. Kandungan logam berat kadmium pada kulit akar bahar 0.41 ppm dan aksial akar bahar 0.15 ppm. kandungan cadmium tersebut lebih kecil 1 dan berada dalam kisaran persyaratan logam berat yang ditetapkan oleh BSN dan BPOM.
Kadar Cd pada akar bahar masih berada pada ambang batas dan standar yang ditetapkan. Kandungan Cd tersebut masih lebih rendah dibandingkan dengan kadar Cd yang dilaporkan Chan et al. (2012) dalam karang gorgonian subergorgia suberosa pada kondisi terkontrol yang diambil dari perairan laut Taiwan, bekas penambangan dengan kandungan Cd sebesar 12.72 mg/L. Hal ini menunjukkan lingkungan yang berbeda kandungan logam berat juga berbeda.
Kadar Cd dalam akar bahar diduga berasal dari sedimen pada dasar perairan yang banyak mengandung Cd. Sedimen yang mengandung Cd terakumulasi dalam tubuh akar bahar dalam jangka waktu lama. Cd merupakan logam berat yang sangat berbahaya karena tidak dapat dihancurkan (non degradable) oleh organisme hidup dan dapat terakumulasi ke lingkungan, terutama mengendap di dasar perairan membentuk senyawa kompleks bersama bahan organik dan anorganik secara adsorbsi dan kombinasi (Rochyatun dan Rozak 2007; Ayeni et al. 2010).
Kadmium merupakan logam yang ditemukan alami dalam kerak bumi. Kadmium murni berupa logam lunak berwarna putih perak. Dalam kondisi asam lemah, kadmium akan mudah terabsorpsi ke dalam tubuh. Sebanyak 5% kadmium diserap melalui saluran pencernaan, dan terakumulasi dalam hati dan ginjal. Kadmium dan senyawanya bersifat karsinogen dan racun kumulatif (BSN 2009).
Tembaga (Cu)
Makanan tidak mencantumkan Cu sebagai salah satu syarat logam dalam produk perikanan maupun cemaran kimia dalam makanan.
Hasil penelitian menunjukan kandungan Cu lebih tinggi dari semua kandungan logam berat pada akar bahar. Sampel diambil dari perairan yang bukan bekas daerah penambangan dan jauh dari daerah industri. Hal ini berbeda dengan penelitian Chan et al .(2012) pada karang gorgonian subergorgia suberosa pada kondisi terkontrol yang diambil dari perairan laut Taiwan bekas penambangan, kandungan Cu sebesar 13.67 mg/L lebih rendah dari kandungannya Cu kulit akar bahar, tetapi kandungan Cu-nya lebih besar dari kandungan Cu pada aksial akar bahar.
Tingginya kandungan Cu dalam akar bahar diduga berasal dari kontaminasi alat grinder yang dipakai untuk menggiling akar bahar. Grinder yang dipakai diduga berbahan dasar logam Cu. Hal lain yang menyebabkan tingginya kandungan Cu diduga berasal dari pengikisan batuan alami yang mengandung mineral sangat tinggi. Rochyatun et al. (2006) menyatakan kemungkinan besar Cu yang dikandung di perairan berasal dari buangan sampah yang berasal dari kegiatan manusia di darat dan erosi batuan mineral yang terbawa arus pada saat hujan kemudian mengalir ke laut melalui sungai.
Jalur masuknya Cu dari aktivitas manusia disekitar pesisir pantai tempat pengambilan sampel kecil sekali karena jauh dari aktivitas pabrik atau industri seperti buangan dari industri, pengecetan kapal, dan aktivitas di pelabuhan. Palar (1994) menyatakan aktivitas manusia seperti buangan industri, pertambangan Cu, industri galangan kapal dan bermacam-macam aktivitas pelabuhan lainnya merupakan salah satu jalur yang mempercepat terjadinya peningkatan kelarutan Cu dalam badan-badan perairan.
Logam Cu dalam akar bahar diduga dibutuhkan dalam proses metabolisme karena logam Cu bersifat essensial, jika dibandingkan dengan logam yang lain. Hutagalung (1991) menyatakan karang lunak membutuhkan logam Cu yang ada di perairan untuk kebutuhan pertumbuhan dan perkembangan hidupnya sebagai cofaktor kerja enzim dalam metabolisme hewan karang. Hasil logam berat Cu yang tinggi pada akar bahar yang hidup di perairan-NTT sudah melebihi ambang batas. Kandungan logam berat berdasarkan Keputusan Menteri Lingkungan Hidup No. 51 Tahun 2004 terhadap biota laut sebesar 0.01 ppm.