PENENTUAN KONSENTRASI OPTIMUM SUPEROKSIDA
DISMUTASE, LINEARITAS, DAN STABILITAS
BIOSENSOR ANTIOKSIDAN MENGGUNAKAN
ELEKTRODE PASTA KARBON
BARA TAUFAN SAFRIZAL
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Dismutase, Linearitas, dan Stabilitas Biosensor Antioksidan Menggunakan
Elektrode Pasta Karbon. Dibimbing oleh DYAH ISWANTINI PRADONO dan
TRIVADILA.
Penelitian ini bertujuan mengoptimumkan konsentrasi superoksida
dismutase (SOD) imobilisasi dan menentukan aktivitas SOD imobilisasi. Metode
biosensor elektrokimia berbasis superoksida dismutase digunakan sebagai metode
alternatif karena instrumentasi sederhana, sentitivitas tinggi, dan biaya rendah.
Hasil penelitian menunjukkan bahwa kondisi optimum untuk aktivitas SOD murni
adalah konsentrasi 10 unit dengan waktu respons 4 detik. Elektrode pasta kabon
yang terimobilisasi enzim mencapai kestabilan elektrode hingga 72 jam sebesar
85,7% dan mengalami penurunan kestabilan sesudahnya 72 jam. Hubungan
konsentrasi substrat dan aktivitas SOD imobilisasi menghasilkan persamaan garis
linear
y
= -2,2700 + 13,400x
pada rentang konsentrasi xantina 0,200
–0,275 mM
dengan nilai
r sebesar 0,9761. Hasil tersebut menunjukkan analisis ini memiliki
linearitas yang tinggi dan untuk meningkatkan kestabilan aktivitas enzim
diperlukan pendekatan dengan parameter analisis yang lain.
Kata kunci: aktivitas enzim, biosensor antioksidan, superoksida dismutase
ABSTRACT
BARA TAUFAN SAFRIZAL. Optimum Concentration Determination of
Superoxide Dismutase, Linearity, and Stability of Antioxidants Biosensor Using
Carbon Paste Electrode. Supervised by DYAH ISWANTINI PRADONO and
TRIVADILA.
The objectives of this research was to optimize the concentration of
immobilized superoxide dismutase SOD and to determine the activity of the
immobilized SOD. Electrochemical biosensor method based on superoxide
dismutase is used as an alternative method due to simple instrumentation, high
sentitivity, and low cost. The results showed that the optimum conditions for pure
SOD activity is the concentration of 10 units with a response time of 4 seconds.
The immobilized enzyme on the carbon paste electrode achieved its stability up to
72 hours for 85.7% and decreased thereafter. Substrate concentration relationships
and SOD activity immobilization yield a linear equation
y
= -2.2700 + 13.400x
in the concentration range from 0.200 to 0.275 mM xanthine with r value of
0.9761. The results of this analysis showed a high linearity and to improve the
stability of the enzyme activity need another approach using analysis of other
parameters.
PENENTUAN KONSENTRASI OPTIMUM SUPEROKSIDA
DISMUTASE, LINEARITAS, DAN STABILITAS
BIOSENSOR ANTIOKSIDAN MENGGUNAKAN
ELEKTRODE PASTA KARBON
BARA TAUFAN SAFRIZAL
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Penentuan Konsentrasi Optimum Superoksida Dismutase,
Linearitas, dan Stabilitas Biosensor Antioksidan Menggunakan
Elektrode Pasta Karbon
Nama
: Bara Taufan Safrizal
NIM
: G44070034
Disetujui
Pembimbing I
Dr Dyah Iswantini Pradono, MAgr
NIP 19670730 199103 2 001
Pembimbing II
Trivadila, SSi, MSi
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Penulis memanjatkan puji dan syukur kepada Allah SWT atas segala rahmat
dan karunia-Nya sehingga karya ilmiah yang bertema “Biosensor Antioksidan”
dengan judul “Penentuan Konsentrasi Optimum Superoksida Dismutase,
Linearitas, dan Stabilitas Biosensor Antioksidan Menggunakan Elektrode Pasta
Karbon” dapat diselesaikan. Penelitian ini mengoptimumkan konsentrasi SOD
murni imobilisasi serta menentukan aktivitasnya sebagai metode biosensor
antioksidan sejak bulan Februari hingga Agustus 2011 di Laboratorium Bersama
dan Laboratorium Kimia Fisik, Departemen Kimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Penulis menyampaikan ucapan terima kasih kepada Dr Dyah Iswantini
Pradono, MAgr dan Trivadila, SSi, MSi selaku pembimbing yang selalu memberi
bimbingan, motivasi, saran, dan meluangkan waktunya kepada penulis selama
berkonsultasi. Terima kasih kepada Laboratorium Bersama yang telah
memberikan fasilitas dan penggunaan peralatan selama penulis melaksanakan
penelitian, serta kepada BUMN atas bantuan dana yang diberikan dalam
penelitian. Ucapan terima kasih juga penulis sampaikan kepada Mama, kakak
Nita Annisa Rachmi, dan adik Iqbal Zen Ramadhan Govinda, serta seluruh
keluarga yang senantiasa mendoakan, memberi motivasi, dan kasih sayang tiada
henti. Tidak lupa penulis ucapkan terima kasih kepada Pak Mail, Pak Nano,
Bu Ai, dan para pegawai di Laboratorium Kimia Fisik, juga kepada Mas Eko,
Pak Wawan dan Bu Heny, dan para pegawai di Laboratorium Bersama, serta
kepada Laboratorium Analitik yang telah memberikan izin untuk menggunakan
bahan untuk penelitian. Ucapan terima kasih juga penulis sampaikan kepada
rekan-rekan IPB dari luar Departemen Kimia, rekan-rekan dari Departemen
Kimia, dan rekan-rekan Kimia 44 yang selalu memberi dukungan dan menjadi
teman diskusi yang menyenangkan. Akhir kata, semoga karya ilmiah ini
bermanfaat.
Bogor, Desember 2011
RIWAYAT HIDUP
Penulis dilahirkan di Surabaya pada tanggal 9 Februari 1990 dari Papa
Moch. Imron Fauzi dan Mama Sunarti. Penulis merupakan putra kedua dari tiga
bersaudara. Tahun 2007 penulis lulus dari SMA Negeri 5 Kediri Jawa Timur dan
pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi
Masuk IPB. Penulis memilih mayor Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi pengajar PRIVAT SMA
mata pelajaran, Fisika, Kimia, dan Matematika (2007-2008 dan 2011), pengajar
mahasiswa S1 mata kuliah Fisika (2008-2010) di bimbingan belajar EXPRESS
dibawah naungan Unit Kreativitas Mahasiswa (UKM) IAAS, pengajar mahasiswa
S1 mata kuliah Kimia (2009-2010) di bimbingan belajar AVOGADRO dibawah
naungan IMASIKA IPB, pengajar mahasiswa S1 mata kuliah Fisika
(2009-Des 2011), Fisika Umum, Fisika Dasar, Kimia, Kimia Umum (Juli-Des
2011) di bimbingan belajar MAFIA CLUBS, serta menjadi pengajar PRIVAT
mahasiswa S1 untuk mata kuliah Fisika dan Kimia pada tahun 2008 sampai
sekarang (Des 2011), Fisika Umum, Fisika Dasar, Kimia Dasar, Kimia Umum
(Juli-Des 2011). Penulis juga pernah menjadi asisten mata kuliah Praktikum
Kimia Fisik S1 Kimia dan layanan pada tahun ajaran 2010/2011. Pada tahun 2008
penulis menjadi Juara II Pertandingan Catur saat Dies Natalis Asrama Sylvalestari
ke-39, pemenang beregu Juara III Catur OMI IPB 2009, pemenang beregu Juara II
Catur OMI IPB 2010, pemenang beregu Juara III Catur OMI IPB 2011, pemenang
beregu Juara III Spirit FMIPA IPB 2011, dan pada tahun 2011 penulis berprestasi
mendapat gelar Karate sebagai pemegang sabuk hitam “DAN I”.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
BAHAN DAN METODE
Alat dan Bahan ... 1
Metode Penelitian ... 2
Modifikasi Elektrode Pasta Karbon menggunakan Ferosena sebagai
Mediator ... 2
Imobilisasi Enzim SOD pada Permukaan Elektrode Pasta Karbon
Termodifikasi ... 2
Pengukuran Elektrokimia ... 2
Penentuan Stabilitas Elektrode... 2
Pengoptimuman Konsentrasi SOD ... 3
Pengukuran aktivitas SOD secara Elektrokimia ... 3
HASIL DAN PEMBAHASAN
Pengoptimuman Aktivitas SOD Terimobilisasi ... 3
Penentuan Stabilitas Elektrode ... 4
Penentuan Linearitas Pengukuran Aktivitas SOD ... 4
SIMPULAN DAN SARAN
Simpulan ... 5
Saran... 5
DAFTAR PUSTAKA ... 6
DAFTAR GAMBAR
Halaman
1
Data optimisasi SOD dengan konsentrasi xantina 2,1 mM. ... 3
2
Kurva stabilitas antara waktu terhadap aktivitas SOD
.... 4
3
Kurva hubungan antara konsentrasi substrat dengan aktivitas SOD. ... 4
4
Kurva Linearitas konsentrasi xantina (0,200; 0,225, 0,250; dan 0,275 mM). .. 5
5
Voltamogram linearitas pada konsentrasi xantina 0,200; 0,225, 0,250, dan
0,275 mM. ... 5
6
Voltamogram siklik untuk bufer fosfat, XO, dan xantina. ... 5
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Pengukuran kapasitas antioksidan dengan metode in vitro dan in vivo telah banyak diperkenalkan. Kapasitas antioksidan diukur melalui efek antioksidan untuk mengontrol proses oksidasi sehingga pengukuran aktivitas antioksidan perlu diperhatikan sumber radikal bebasnya (O’Brien et al. 2007). Antiradikal bebas (antioksidan) adalah bahan yang dalam kadar rendah dapat mencegah terjadinya oksidasi dari substrat yang mudah teroksidasi. Metode yang umum digunakan untuk mengukur sifat-sifat antioksidan adalah spektrofotometri, fluoresensi, kromatografi gas, kromatografi cairan (Prieto-Simon et al. 2008), voltametri siklik (Kilmartin 2001), dan biosensor (Campanella et al. 2005).
Metode spektrofotometri memiliki kelemahan, yaitu sulit mengukur pada konsentrasi tinggi. Pengukuran antioksidan menggunakan metode spektrofotometri seringkali terkendala terhadap preparasi sampel, sebagai contoh metode 1,1-difenil-2-pikrilhidrazil atau DPPH (Diphenyl Picril Hydrazil Hydrate) sangat peka terhadap cahaya sehingga harus dilakukan dalam kondisi gelap dan sangat dipengaruhi oleh tingkat kekeruhan. Metode ABTS atau 2,2-bis-azino (asam 3-etil-benzotiazolina-6-sulfonat) dan FRAP (Ferric Reducing Antioxidant Power) juga sangat sensitif terhadap cahaya bahkan pembentukan ABTS memerlukan waktu inkubasi selama 12–16 jam dalam kondisi gelap (Tawaha et al. 2007).
Pengukuran kapasitas antioksidan selain terkendala masalah preparasi sampel, juga ada beberapa pengukuran yang memerlukan peralatan yang mahal, seperti Kapasitas Serapan Radikal Oksigen dengan Fluorescen atau ORAC-FL (Oxygen Radical Absorbance Capacity with Fluorescein) dan Kromatografi Cair Kinerja Tinggi atau HPLC (High Pressure Liquid Chromathography) (Du et al. 2009). Oleh karena itu dibutuhkan metode yang lebih tepat, cepat, dan sensitif untuk mengukur sifat-sifat antioksidan.
Biosensor merupakan suatu piranti yang memanfaatkan interaksi hayati untuk mendeteksi analat target (Hartati et al. 2005). Biosensor mengkombinasikan keunggulan analisis dari teknik elektrokimia dengan kespesifikan proses pengenalan hayati untuk menghasilkan sinyal listrik sebagai konsentrasi suatu analat (Wang 1994). Penelitian dan pengembangan biosensor sangat luas dan multidisiplin mencakup biokimia, ilmu bioreaktor, kimia fisik,
elektrokimia, elektronik, dan rekayasa perangkat lunak (Chaplin 2004).
Biosensor elektrokimia merupakan alternatif metode yang dikembangkan untuk mengukur kapasitas antioksidan. Metode ini sangat menjanjikan, karena analisisnya cepat, membutuhkan instrumen yang tidak mahal, protokol operasi yang sederhana, dan biayanya rendah (Campanella et al. 2004). Metode biosensor berbasis enzim superoksida dismutase (SOD) digunakan untuk menguji aktivitas suatu sampel yang berpotensi sebagai antioksidan telah dilakukan oleh Campanella
et al. (2004) dan Trivadila (2011).
Enzim superoksida dismutase merupakan suatu metaloenzim yang bertindak sebagai intraseluler utama yang melindungi kerusakan sel karena radikal superoksida dengan cara mengkatalisis radikal O2- menjadi hidrogen
peroksida (H2O2) dan oksigen (O2)
berdasarkan reaksi 2O2- + 2H+ → O2 + H2O2
(Kankofer 2002). Pemanfaatan SOD untuk biosensor antioksidan telah banyak dilakukan. Hal ini dikarenakan beberapa kelebihan yang dimiliki oleh SOD, yaitu enzim ini spesifik mengakatalisis radikal superoksida menjadi oksigen dan peroksida (Donnely et al. 1989). Perkembangan biosensor antioksidan berbasis enzim SOD dengan pengukuran secara elektrokimia hingga saat ini baru pada tahap penelitian dan belum terdapat biosensor antioksidan komersial yang diproduksi. Penelitian oleh Trivadila (2011) telah mendapatkan parameter pH dan suhu yang optimum bagi aktivitas SOD murni yang berasal dari eritrosit sapi yang diimobilisasi pada pH 11 dan suhu 20 oC. Namun, penelitian yang telah dilakukan sebelumnya belum menentukan konsentrasi enzim SOD imobilisasi yang optimum sehingga penelitian ini mengoptimumkan konsentrasi SOD imobilisasi, linearitas pengukuran, dan juga stabilitas elektrode enzim yang dihasilkan.
Penelitian bertujuan mengoptimumkan konsentrasi SOD imobilisasi, menentukan linearitas pengukuran, dan mengukur stabilitas elektrode pasta karbon terimobilisasi SOD yang dihasilkan untuk mengukur aktivitas SOD.
BAHAN DAN METODE
Alat dan Bahan
sel elektrokimia (Lampiran 1), peralatan gelas, tabung mikro, pipet mikro, neraca analitik, pH meter, dan oven.
Bahan-bahan yang digunakan adalah superoksida dismutase (SOD), xantina oksidase (XO), xantina, grafit, ferosena, dimetil sulfoksida (DMSO), parafin cair, larutan bufer fosfat pH 11, membran dialisis, dan jaring nilon.
Metode Penelitian
Metode penelitian ini meliputi, preparasi elektrode rujukan Ag/AgCl, modifikasi elektrode pasta karbon, imobilisasi enzim SOD pada permukaan elektrode pasta karbon, optimisasi serta stabilitas aktivitas SOD imobilisasi. Bagan alir penelitian secara umum dilampirkan pada Lampiran 2.
Modifikasi Elektrode Pasta Karbon
menggunakan Ferosena sebagai Mediator (Campanella et al. 1997, Ikeda et al. 1998)
Sebanyak 1 mL DMSO digunakan untuk melarutkan 3 mg ferosena (mediator) dan campuran ditambahkan 100 mg grafit kemudian didiamkan selama 2 jam. Setelah 2 jam didiamkan, pelarut diuapkan menggunakan pengering vakum sehingga diperoleh grafit termodifikasi mediator. Grafit termodifikasi kemudian dicampur dengan parafin cair sampai membentuk pasta dengan perbandingan campuran 100 mg grafit termodifikasi dan 35 µ L parafin cair. Pasta karbon yang terbentuk dimasukkan ke dalam badan elektrode hingga padat sampai permukaan. Permukaan gelas elektrode dihaluskan dan dibersihkan dengan amplas serta kertas minyak (Lampiran 3).
Imobilisasi Enzim SOD pada Permukaan Elektrode Pasta Karbon Termodifikasi (Ikeda et al. 1998)
Larutan SOD sebanyak 5 L diteteskan pada permukaan elektrode pasta karbon kemudian didiamkan agar pelarutnya menguap. Selanjutnya permukaan elektrode dilapisi dengan membran dialisis, ditutup dengan jaring nilon dan diikat dengan parafilm. Elektrode kemudian direndam dalam larutan bufer fosfat 50 mM (pH 11) pada suhu 4 ºC ketika tidak digunakan, untuk memberikan keadaan yang sama dengan lingkungan sebenarnya. Elektrode dapat langsung digunakan untuk pengukuran aktivitas SOD dengan metode elektrokimia.
Pengukuran Elektrokimia
Pengukuran elektrokimia metode voltametri siklik dilakukan dengan menggunakan seperangkat alat potensiostat/galvanostat eDAQ dan komputer beserta perangkat lunak pengolah data Echem
v2.1.0. Elektrode yang digunakan, yaitu elektrode Ag/AgCl, platina, dan elektrode pasta karbon-enzim berturut-turut sebagai elektrode rujukan, counter, dan kerja. Parameter pengukuran diatur sebagai berikut;
Mode: Cyclic, Initial E: 100 mV, Final E: 100 mV, Rate: 250 mV/s, Step W: 25ms, Upper E: 600 mV, Lower E: 50 mV, dan Range: 10V.
xantina asam urat
(Campanella 2000). Radikal superoksida dihasilkan oleh oksidasi dalam larutan xantin untuk asam urat dalam enzim xanthine oksidase.
xantina+ H2O + O2 XO> asam urat + 2H+ +
2O2
•-Radikal superoksida dihasilkan melalui reaksi enzimatis xantina dengan xantina oksidase (XO). Selanjutnya radikal yang dihasilkan akan didismutasi membentuk O2
dengan katalis SOD melalui reaksi:
2O2•- + 2H+ SOD> O2 + H2O2
Larutan bufer fosfat sebanyak 1,9 mL dan larutan XO 0,1 U/mL sebanyak 100 µL ditambahkan ke dalam sel pengukuran dan puncak arus anoda yang terbentuk diamati sebagai puncak blangko. Selanjutnya ditambahkan substrat xantina 2,1 mM sebanyak 1 mL dan diukur kembali perubahan atau kenaikan puncak arus anode yang terjadi.
Penentuan Stabilitas Elektrode
tiap kurun waktu tertentu tersisa diukur. sa I saat I (%) SOD Aktivitas = Pengoptimuman Konsen
Optimisasi yang dilak SOD murni adalah opt SOD pada pH dan suhu o suhu 20 ºC). Konsentra yang digunakan pada ele adalah 0,2; 0,5; 1,0; 2,0; 50,0 unit.
Pengukuran aktivitas
Elektrokimia
Uji aktivitas dilakuk rentang konsentrasi 0,200–0,325 mM (interv prosedur elektrokimia se adanya hubungan linear korelasi (r) pada anal (y = a + bx).
Linearitas dilakukan rentang konsentrasi 0,200–0,275 mM (interv prosedur pengukuran el kemudian dibuat kurva konsentrasi substrat xant SOD murni.
Sebagai parameter ada digunakan koefisien kore regresi linier y = a + bx. H ideal dicapai jika nilai b = bergantung pada arah gari menunjukkan kepekaan instrumen yang digunakan
HASIL DAN PEM
Pengoptimuman A Terimobil
Pengoptimuman aktivi untuk kerja optimum SOD menggunakan metod Konsentrasi optimisasi digunakan adalah 0,2; 0,5 20,0; dan 50,0 unit pada pH 11, suhu 20 oC. memiliki nilai konsentras karena arus rerata memil nilai koefisien variasi ber dibawah 10% sebesar 3 oksidasi pada konsentrasi unit sebesar 2,371 µA (La lebih tinggi dari yan
ntu dan aktivitas yang
% 100 A) ( awal saat A) ( jam -ke
aat ×
µ µ
sentrasi SOD
lakukan untuk aktivitas optimisasi konsentrasi optimum (pH 11 dan trasi SOD imobilisasi elektrode pasta karbon ; 5,0; 10,0; 20,0; dan
itas SOD secara
ukan dengan variasi substrat xantina erval 0,05 mM) pada sebelumnya sehingga ar digunakan koefisien
nalisis regresi linear
kan dengan variasi substrat xantina erval 0,05 mM) pada
elektrokimia di atas, rva hubungan antara ntina dengan aktivitas
adanya hubungan linier orelasi r pada analisis . Hubungan linier yang = 0 dan r = +1 atau -1 aris. Sedangkan nilai a an analisis terutama kan (Harmita 2004).
EMBAHASAN
Aktivitas SOD bilisasi
tivitas SOD imobilisasi OD ditentukan dengan tode elektrokimia. i SOD murni yang 0,5; 1,0; 2,0; 5,0; 10,0; da larutan bufer fosfat Konsentrasi SOD trasi optimum 10 unit, iliki nilai terbesar dan berada pada persentase 3,99%. Arus puncak asi SOD optimum 10,0 (Lampiran 4). Hasil ini ang dihasilkan oleh
Trivadila (2011) dan Wen berurutan sebesar 0,12 µA Mn-SOD 701,02 µg/mL konsentrasi SOD 1500 aktivitas SOD murni Trivadila (2011) sebesar aktivitasnya lebih rend dengan aktivitas yang penelitian ini.
Perbedaan hasil ini karena adanya perlakuan penyimpanan elektrode pa Elektrode disimpan dala pH 11. Nilai Penyimpanan berbeda ini menyebabkan yang berbeda. Penga pengukuran aktivitas SOD memberikan keadaan yang digunakan dengan saat peng
Gambar 1 memperliha semakin besar konsentra besar kenaikan arus dan a yang dihasilkan, serta sem yang dibutuhkan arus maksimum. Hasil peng konsentrasi SOD dib menunjukkan arus b maksimum.
Gambar 1 Data optimisa konsentrasi xant Berdasarkan hasil konsentrasi SOD pada 0 memiliki koefisien varias rerata (Irerata) negatif
pengukuran. Artinya pada aktivitasnya tidak ada atau terbesar dihasilkan ketika k unit, yaitu sebesar 2,371 disimpulkan bahwa konse optimum sebesar 10,0 unit yang lebih besar dari 10 penurunan aktivitas. Arus tertinggi dihasilkan dala 4 detik. Waktu respon in
0 0.5 1 1.5 2 2.5
0,2 0,5 1,0 2,0 5
Irerat
a
(µ
A
)
waktu (jam
eniarti (2011), yaitu µA pada konsentrasi dan 0,43 µA pada µg/mL, sedangkan i yang didapatkan r 0,09 µA sehingga ndah dibandingkan ng didapat dalam
i dapat disebabkan n yang berbeda saat pasta karbon-enzim. alam larutan bufer an pada kondisi yang an hasil pengukuran garuhnya terhadap D pada elektrode agar ng sama ketika tidak engukuran.
hatkan secara umum trasi SOD, semakin aktivitas maksimum semakin cepat waktu s untuk mencapai engamatan aktivitas ibawah 10 unit belum mencapai
isasi SOD dengan antina 2,1 mM.
pengukuran, arus 0,2 dan 0,5 unit iasi (KV) dan arus if setiap ulangan da 0,2 dan 0,5 unit au sangat kecil. Irerata
a konsentrasi SOD 10 710 µA. Jadi dapat nsentrasi SOD yang nit. Konsentrasi SOD 10,0 unit mengalami rus puncak oksidasi alam waktu respon
ini lebih baik dari
waktu respon rata-rata p berbasis membran khitin (Nazaruddin 2007) se elektrokimia untuk deteks indikator hibridisasi wakt 20 menit agar diperoleh target (Hartati et al. 2007)
Berbagai macam tekni digunakan, meliputi adsor padat (Yao et al. 2007, pengikatan kovalen (Kun 2007, Wu et al. 1999) dalam polimer (Fei et al. Pan et al. 2005, Hiratsuka menawarkan metode untu biomolekul agar dapat me fungsional biomolekul dengan matriks yang ber 2006, Gupta et al. 2007) mengembangkan teknik kedalam silica gel dengan membentuk sensor sebaga dapat dipasangkan elektrokimia.
Penentuan Stabilit
Stabilitas elektrode pengukuran aktivitas en didapatkan kondisi optim secara langsung melalui p didapat. Stabilitas elek sebagai hubungan w ditunjukkan dalam Gamba
Gambar 2 Kurva stabili terhadap aktivi Arus puncak oks pengukuran awal (waktu dikondisikan 100%. K untuk 72 jam sebesar 85 menurun sampai 4,52% Pengukuran dilakukan s pada hari yang sama (intr
yang berlainan (interda 0 50 100 150 200 250 300 350 400 0 2 10 24 A k ti v it a s S O D ( d a la m 1 0 -3 µ A ) waktu (jam)
pada biosensor urea itin, yakni 3-6 menit sedangkan biosensor eksi urutan DNA tanpa aktu responnya sebesar
eh deteksi pada DNA 07).
knik immobilisasi telah sorpsi pada penyangga Wang et al. 2009), unzelmann & Botther ) dan pemerangkapan l. 2003, Li et al. 2004, ka et al. 2008). Sol-gel ntuk mengimmobilisasi menunjukkan aktivitas l yang terselubungi berpori (Coradin et al. 07). Nur et al. (2010) k immobilisasi enzim an teknik sol-gel untuk agai lapisan tipis yang dengan teknik
ilitas Elektrode
de ditentukan dari enzim SOD setelah timum aktivitas SOD i pengukuran arus yang lektrode digambarkan waktu dan arus, bar 2.
bilitas antara waktu tivitas SOD.
ksidasi pada saat ktu untuk jam ke-0) Kestabilan elektrode 85,68% dan semakin 2% untuk 168 jam. sebanyak 6 ulangan
intraday) dan pada hari
rday) selama 5 hari
berturut-turut. Arus m signifikan, yaitu sebesa 0,398 µA dan mencapai pu 10 jam dan cenderung turu waktu 168 jam.
Salah satu faktor p elektrode adalah kestabilan sendiri. Proses imobilis permukaan elektrode meningkatkan kestabilan en
et al. (2010) imobilisasi enz enzim yang telah berha mempunyai aktivitas da cukup bagus sehingga dapa aplikasi biosensor.
Berdasarkan hasil pe kondisi stabil elektrode dar setelah 72 jam inkubasi pa karbon dengan enzim SOD aktivitas SOD (dalam 10 sampai dengan 72 jam tid signifikan namun aktivitas drastis setelah 72 jam.
Penentuan Linearitas Aktivitas S
Setelah diperoleh k elektrode pasta karbon-SOD mengukur aktivitas SOD variasi substrat xantina, s hubungan antara konsentra aktivitas SOD Gambar 3. K yang digunakan, yaitu a mM.
Gambar 3 Kurva hubungan substrat dengan Hubungan linear konsentrasi xantina 0 (Gambar 4). Kurva yang d persamaan garis y = -2,27 R2 = 95,28%. Berdasarka diperoleh koefisien regres sebesar 0,9761. Menurut dalam Chan 2004), nilai ini syarat yang ditetapkan, y
24 48
72 120 168
0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6
0.175 0.200 0.225
A k ti v it a s S O D ( µ A ) [xantina] (
meningkat secara esar lebih kurang puncak dalam waktu
run hingga mencapai
penentu kestabilan lan aktivitas enzim itu ilisasi enzim pada diketahui dapat enzim. Menurut Nur enzim metode sol gel, rhasil diimmobilisasi dan stabilitas yang apat digunakan untuk
pengujian diperoleh dari pengukuran SOD pada elektrode pasta D imobilisasi karena 10-3 A) dari 0 jam tidak berbeda secara tas SOD turun secara
itas Pengukuran s SOD
kondisi optimum, OD digunakan untuk imobilisasi dengan , sehingga diperoleh trasi substrat dengan . Konsentrasi xantina antara 0,200–0,325
gan antara konsentrasi an aktivitas SOD.
diperoleh ketika 0,200–0,275 mM g dihasilkan memiliki 2700 + 13,400x dan rkan hasil pengujian,
resi untuk linearitas ut ICH (1995 diacu ini hampir memenuhi yaitu 0,9970. Nilai
0,0 0,1 0,2 0,3 0,4 0,5 0,6 -5,0x10-5 -4,5x10-5 -4,0x10-5 -3,5x10-5 -3,0x10-5 -2,5x10-5 -2,0x10-5 -1,5x10-5 -1,0x10-5 -5,0x10-6 0,0 5,0x10-6 1,0x10-5 1,5x10-5 2,0x10-5 I (A )
E (V) vs Ag/AgCl
Buferfosfat XO xantina
koefisien yang tinggi menyatakan bahwa kenaikan konsentrasi, akan memberikan kenaikan arus yang sebanding. Semakin besar konsentrasi xantina maka aktivitas SOD semakin tinggi pada rentang konsentrasi xantina 0,200–0,275 Mm (Lampiran 6), sedangkan konsentrasi xantina lebih dari 0,275 mM mengalami penurunan aktivitas SOD.
Gambar 4 Kurva Linearitas konsentrasi xantina (0,200; 0,225, 0,250; dan 0,275 mM).
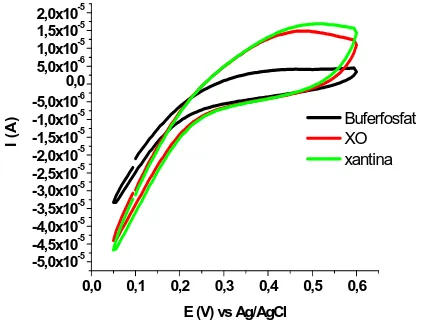
Linearitas dinyatakan dengan koefisien korelasi (r). Nilai koefisien korelasi yang tinggi menunjukkan hubungan yang linear antara konsentrasi xantina dengan aktivitas SOD. Gambar 6 menyajikan voltamogram siklik pada konsentrasi persamaan linearitas tersebut.
Gambar 5 Voltamogram linearitas pada konsentrasi xantina 0,200; 0,225, 0,250, dan 0,275 mM.
Linearitas juga dapat diketahui dari kemiringan garis, intersep, dan residual (Ermer & Miller 2005). Berdasarkan hasil pengujian didapat persamaan regresi linear untuk kurva garis y = -2,2700 + 13,400x. Berdasarkan persamaan tersebut didapat nilai intersep (a) sebesar -2,2700. Nilai intersep
yang semakin jauh dari nol disebabkan oleh semakin besarnya pengaruh matriks dalam substrat. Hal ini dapat mengganggu penentuan aktivitas SOD dalam variasi konsentrasi xantina sebagai substrat.
Gambar 6 Voltamogram siklik untuk bufer fosfat, XO, dan xantina.
Konsentrasi xantina yang digunakan pada kurva linearitas sebesar 0,200; 0,225, 0,250; dan 0,275 mM. Kisaran linear yang diperoleh dalam penelitian ini lebih kecil dibandingkan dengan penelitian Trivadila (2011), dalam teknik imobilisasi yang sama, hasil kisaran yang diperoleh lebih besar, yaitu 0,1–0,7 mM. Menurut Campanella et al. (2000), persamaan kurva linear y = (328,9 ± 6,4)x – (2,3 ± 1,3) dengan koefisien korelasi 0,9761 dengan kisaran variasi rentang konsentrasi substrat xantina 0,02–2,00 mM. Artinya hasil pada penelitian ini memiliki koefisien korelasi yang lebih sempit dengan hasil pada Campanella et al. sehingga pada penelitian ini dapat dikatakan baik.
SIMPULAN DAN SARAN
Simpulan
Konsentrasi SOD imobilisasi yang optimum pada pH 11 dengan suhu 20 oC adalah konsentrasi 10 unit. Kurva linearitas konsentrasi xantina sebesar 0,200; 0,225, 0,250; dan 0,275 mM didapatkan persamaan garis y = -2,2700 + 13,400x dengan r = 0,9761 dan R² = 95,28%. Elektrode akan stabil bila disimpan dalam larutan bufer pH 11 pada suhu 20 oC selama 72 jam.
Saran
Perlu dilakukan penelitian lanjutan untuk meningkatkan kevalidan metode dan keajegan metode analisis melalui pendekatan metode dengan parameter yang lain.
y = 13,4400x - 2,2700 r = 0,9761
0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6
0.175 0.200 0.225 0.250 0.275 0.300
A k ti v it a s S O D ( A ) [xantina] (mM)
0.0 0.1 0.2 0.3 0.4 0.5 0.6
-11 -10 -9 -8 -7 -6 -5 -4 -3 -2 -1 0 1 2 3
E (V) vs Ag/AgCl
DAFTAR PUSTAKA
Campanella L, Favero G, Tomasetti M. 1997. A modified amperometric electrode for the determination of free radical. Sens. Actators B 44:559–565.
Campanella L, Favero G, Persi L, Tomassetti M. 2000. Evaluation of radical scavenging properties of several plants, fresh or from a herbalist’s, using a superoxide dismutase biosensor.
Pharmaceutical and Biomedical Analysis
24: 1055–1064.
Campanella L, Bonanni A, Finotti E, Tomassetti M. 2004. Biosensors for determination of total and natural antioxidant capacity of red and white wines: comparison with other spectrophotometric and fluorimetric methods. Biosensors and Bielectronics
19: 641–651.
Campanella L, Martini E, Tomasetti M. 2005. Antioxidant capacity of the algae using a biosensor method. Talanta 66: 902–911.
Chaplin M. 2004. Apa biosensor?. [terhubung berkala]. http://www.lsbu. ac.uk/biology/enztech/biosensors.html. [24 Januari 2011].
Coradin T, Boissierre M, Livage J. 2006. Sol-Gel Chemistry in Medicinal Science.
Current Medicinal Chemistry 13: 99–108.
Donnelly JK, Mc Lellan KM, Walker JL, Robinson DS. 1989. Superoxide Dismutase in Foods. A Review. J Food Chem. 33: 243-270.
Du G, Li M, Ma F, Liang D. 2009. Antioxidant capacity and the relationship with polyfenol and Vitamin C in Actinidia fruits. J. Foodchem 113: 557– 562.
Ermer J, Miller JH, editor. 2005. Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-VCH.
Fei J, Wu Y, Ji X, Wang J, Hu S, Gao Z. 2003. An Amperometric Biosensor for Glucose Based on Electrodeposited Redox polymer/Glucose Oxidase Film on a Gold Electrode. Analitical sciences, 19.
Gupta R, Chaudhury NK. 2007. Entrapment of Biomolecules in Sol-Gel Matrix for Applications in Biosensors: Problems and Future Prospects. Biosensors and Bioelectronics, 22p: 2387–2399.
Harmita. 2004. Petunjuk pelaksanaan validasi metode dan cara perhitungannya.
Majalah Ilmu Kefarmasian 1: 117–135.
Hartati YW, Rochani S, Bahti HH, Agma M. 2005. Biosensor elektrokimia untuk deteksi urutan DNA tanpa indikator hibridisasi. [Seminar]. Bandung: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Padjadjaran.
Hartati YW, Rochani S, Bahti HH, Agma M. 2007. Elektrokimia untuk Deteksi Urutan DNA Tanpa Indikator Hibridisasi. [Seminar]. Bandung: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Padjadjaran.
Hattu N. 2009. Studi voltametri dan analisis antihistamin setirizin dihidroklorida dan deksklorfeniramin maleat dalam medium surfaktan menggunakan elektroda pasta karbon. [Disertasi]. Bandung: Program Studi Kimia, Institut Teknologi Bandung.
Hiratsuka A, Fujisawa K, Muguruma H. 2008. Amperometric Biosensor based on Glucose Dehydrogenase and Plasma-polymerized Thin Films. Analitical sciences, 24.
Huda M, Kurniawan F, Suprapto. 2010. Pembuatan elektrode pembanding Ag/AgCl dengan menggunakan membran komposit karbon-rotan. [Prosiding Skripsi]. Surabaya: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh Nopember.
[ICH] International Conference on Harmonization. 1995. Validation of Analytical Prosedures: Methodology Q2B
[terhubung berkala]. www.ich.org. [20 Maret 2011].
Ikeda et al. 1998. Electrochemical monitoring of in vivo recronstitution of glucose dehydrogenase in Escherichia coli cells with externally added pyrroloquinoline quinone. J. Electroanal. Chem
Kankofer M. 2002. Superoxide dismutase and glutathione peroxidase activities in bovine placenta: spectrophotometric and electrophoretic analysis. Revue Med Vet
153: 121–124.
Kilmartin PA. 2001. Electrochemical detection of natural antioxidant: principles and protocol. Antioxidant & redox signaling. Marry Ann Lieb Inc.
Kunzelmann U, Bottcher H. 1997. Biosensor Properties of Glucose Oxidase Immobilized within SiO2 gels. Sensors and Actutors, 38–39: 222–228.
Li CX, Deng KQ, Shen GL, Yu RQ. 2004. Amperometric Hydrogen Peroxide Biosensor Based on Horse Peroxidase labeled Nano-Au Colloids Immobilized on Poly (2,6-pyridinedicarboxylic acid) Layer by Cysteamine. Analytic Sciences
20: 1277–1281.
Nazaruddin. 2007. Biosensor Urea Berbasis Biopolimer Khitin sebagai Matriks Immobilisasi. Jurnal Rekayasa Kimia dan Lingkungan 6: 41–44.
Nur A, Dhini SUW, Febriana Y, Setyawan H. 2010 immobilisasi enzim glucose oxidase (god) dan horse radish peroxidase (hrp) untuk aplikasi biosensor dengan metode sol-gel. Seminar Rekayasa Kimia dan Proses. Surabaya: Fakultas Teknologi Industri, Institut Teknologi Sepuluh Nopember.
O’Brien KB, Killoran SJ, O’Neill RD, Lowrya JP. 2007. Development and characterization in vitro of a catalase-based biosensor for hydrogen peroxide monitoring. Biosensors and Bioelectronics 22: 2994–3000.
Pan D, Chen J, Yao S, Tao W, Nie L. 2005. An Amperometric Glucose Biosensor Based on Glucose Oxidase Immobilized in Electropolymerized Poly (o-aminophenol) and Carbon Nanotubes Composite Film on a Gold Electrode.
Analitic Sciences 21p: 367–371.
Prieto-Simon B, Cortina M, Campas M, Calas-Blanchard C. 2008. Electrochemical biosensor as a tool for antioxidant capacity assessment. Sens Actuators B 129: 459–466.
Tawaha K, Alali FQ, Gharaibeth M, Mohammad M, El-Elimat T. 2007. Antioxidant activity and total phenolic content of selected Jordanian plant species. J. Foodchem 104: 1372–1378.
Trivadila. 2011. Biosensor antioksidan menggunakan superoksida dismutase
Deinococcus radiodurans yang
diimobilisasi pada permukaan elektrode pasta karbon dan parameter kinetikanya. [Tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Wang J. 1994. Analytical Electrochemistry. New York: VCH.
Wang K, et al. 2009. Direct Electrochemistry and Electrocatalysis of Glucose Oxidase Immobilized on Glassy Carbon Electrode Modified by Nafion and Ordered Mesoporous. Journal of molecular Catalysis B: Enzymatic 58: 194–198
Weniarti. 2011. Biosensor antioxidant berbasis superoksida dismutase dari mikroba Indonesia yang diimobilisasi dalam nanokomposit zeolit alam Indonesia. [Tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Wu J, Suls J, Sansen W. 1999. Amperometric Glucose sensor with Enzyme Covalently Immobilized by Sol-Gel Technology.
Analitical science 15.
Lampiran 1 Elektrode potensiostat
(a) Elektrode rujuka dan sel elektrokim
Lampiran 2 Bagan alir ke
Preparasi elektro
Im
Optimisasi konsentrasi SOD
rujukan, kerja, pembantu, dan sel elektrok tat/galvanostat
ukan, kerja, pembantu, kimia.
(b) Seperangkat alat potensi
kerja penelitian secara umum
trode pendukung Ag/AgCl dan elektrode pasta karbon se modifikasi grafit dengan mediator
Imobilisasi SOD pada elektrode pasta karbon
Elektrode pasta karbon–SOD
Stabilitas &
Pengukuran elektrokimia Linearitas
okimia, serta alat
nsiostat/galvanostat
serta
Lampiran 3 Pembuatan elektrode pasta karbon dan imobilisasi enzim (Trivadila 2011)
parafin cair : grafit (1 : 2)
campuran digerus
pasta karbon
permukaan karbon dihaluskan dengan kertas minyak
5 µL enzim SOD diimobilisasi pada permukaan elektrode
permukaan elektrode dilapisi dengan membran dialisis
tutup dengan jaring nilon dan ikat dengan parafilm
elektrode disimpan dalam larutan bufer fosfat pH 11
dengan suhu 20 oC
dimasukkan ke dalam badan elektrode hingga padat sampai permukaan
pipet mikro
Lampiran 4 Optimisasi konsentrasi SOD imobilisasi
Konsentrasi SOD ∆Ipa
(unit) (µA)
0,2 -0,3977
0,5 -0,3583
1,0 0,4627
2,0 1,5845
5,0 1,5655
10,0 2,3710
20,0 0,3310
50,0 0,2445
Lampiran 5 Stabilitas elektrode pasta karbon yang diimobilisasi 10 unit SOD
Waktu Aktivitas SOD
(jam) ∆I( A (%)
0 0,360 -
2 0,375 -
10 0,398 100,00
24 0,369 92,71
48 0,359 90,20
72 0,341 85,68
120 0,191 47,99
168 0,018 4,52
Lampiran 6 Pengaruh konsentrasi xantina terhadap aktivitas SOD imobilisasi
[Xantina] Aktivitas (mM) SOD (μA)