MELALUI INDUKSI APOPTOSIS
EUIS NURHAYATI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
EUIS NURHAYATI. Sitotoksisitas Ekstrak dan Senyawa Flavonoid Daun Sukun
(
Artocarpus altilis
) Terhadap Sel T47D Melalui Induksi Apoptosis. Dibimbing
oleh LAKSMI AMBARSARI dan TJANDRAWATI MOZEF
Tanaman sukun (
Artocarpus altilis
) merupakan salah satu tanaman herbal
yang telah dilaporkan aktivitas biologisnya, meliputi sifat sitotoksik, antioksidan,
antiinflamasi, antimikrob, dan sebagai inhibitor tirosinase. Senyawa aktif yang
dimiliki daun sukun diduga dapat menghambat proliferasi sel kanker, termasuk sel
kanker payudara T47D. Penelitian ini bertujuan menentukan efek sitotoksik
ekstrak dan senyawa flavonoid daun sukun menggunakan uji
microculture
tetrazolium technique
(MTT) dengan parameter konsentrasi penghambatan 50%
proliferasi sel (IC50) dan menentukan efektivitas sampel dalam memacu apoptosis
sel T47D menggunakan analisis
flow cytometry
.
Tahapan penelitian terdiri atas
kultur sel, perlakuan sampel, pengamatan morfologi sel, uji sitotoksik dengan
metode MTT, analisis induksi apoptosis, dan analisis data. Hasil penelitian dari
keempat ekstrak (etanol, heksana, etil asetat, butanol) dan senyawa turunan
flavonoid (AC-5-1, AC-3-1, siklokomunol) yang diujikan menunjukkan bahwa
sampel yang memiliki efek sitotoksik terhadap sel T47D adalah ekstrak heksana
(IC50= 61.02 µg/mL), ekstrak etil asetat (IC50= 264.67 µg/mL), senyawa AC-5-1
(IC
50= 260.44 µM), senyawa AC-3-1 (IC
50= 110.33 µM), dan senyawa
siklokomunol (IC50= 266.83 µM). Sampel yang memiliki efek sitotoksik paling
baik melalui mekanisme induksi apoptosis ditunjukkan oleh ekstrak etil asetat
(60.54%) dan senyawa AC-5-1 (25.47%), hasil isolasi dari ekstrak etil asetat.
Kata kunci: flavonoid,
Artocarpus altilis
, sel T47D, sitotoksik, apoptosis, analisis
ABSTRACT
EUIS NURHAYATI. Cytotoxicity of Extracts and Flavonoid Compounds Leaves
of Breadfruit (
Artocarpus altilis
) to The T47D Cells Through Induction of
Apoptosis. Under the direction of LAKSMI AMBARSARI and TJANDRAWATI
MOZEF.
Breadfruit plants (
Artocarpus altilis
) is one of the herbal plants that has
been reported its biological activities, such as cytotoxic, antioxidant, anti
inflammatory, antimicrobial, and tirosinase enzyme inhibitors. Active compounds
from the leaves of breadfruit were investigated to inhibit the proliferation cancer
cells, including T47D breast cancer cell. This study aimed to establish cytotoxic
effect of extract and flavonoid compounds from the leaves of breadfruit using the
microculture tetrazolium technique
(MTT)-assay and determine inhibit
concentration 50% proliferation cell (IC
50), and to examine the effectiveness of
sample to stimulate T47D cells apoptosis by analysis
flow cytometry
. The methods
consisted of T47D cell culture, treatment of samples in cell culture, observation of
cell morphology, cytotoxic with MTT-assay, analysis induction of apoptosis, and
data analysis. The results from four extract (ethanol, ethyl acetate, hexane,
butanol) and flavonoid derivatives compounds (AC-5-1, AC-3-1, cyclocomunol)
have been cytotoxic activity shown by the hexane extract (IC50= 61.02 µg/mL),
ethyl acetate extract (IC
50= 264.67 µg/mL), AC-5-1 compund (IC
50= 260.44 µM),
AC-3-1 compound (IC50= 110.33 µM), and cyclocomunol compound (IC50=
266.83 µM). The best samples have cytotoxic activity through mechanism
induction of apoptosis were shown by ethyl acetate extract (60.54%) and AC-5-1
compound (25.47%), results isolation from ethyl acetate extract.
Keywords: flavonoid,
Artocarpus altilis
, T47D cell, cytotoxic, apoptosis, analysis
SITOTOKSISITAS EKSTRAK DAN SENYAWA FLAVONOID
DAUN SUKUN (
Artocarpus altilis)
TERHADAP SEL T47D
MELALUI INDUKSI APOPTOSIS
EUIS NURHAYATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sitotoksisitas Ekstrak dan Senyawa Flavonoid Daun Sukun
(
Artocarpus altilis
) Terhadap Sel T47D Melalui Induksi
Apoptosis
Nama
: Euis Nurhayati
NRP
: G84070076
Disetujui
Komisi Pembimbing
Diketahui
Dr. Ir. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
Tanggal Lulus:
Dr. Laksmi Ambarsari, M.S
Ketua
PRAKATA
Puji dan syukur penulis panjatkan kepada allah SWT atas segala rahmat
dan karunia-Nya, sehingga penulis dapat menyelesaikan karya tulis yang berjudul
“
Sitotoksisitas Ekstrak dan Senyawa Flavonoid Daun Sukun (
Artocarpus altilis
)
Terhadap Sel T47D Melalui Induksi Apoptosis
”
. Karya tulis ini merupakan hasil
kerjasama penulis dengan LIPI-Bandung yang dilaksanakan dalam kurun waktu
bulan Oktober sampai November 2011 di Laboratorium Bioassay Pusat Penelitian
Kimia, LIPI-Bandung.
Karya tulis ini terwujud atas doa, bantuan, dukungan, bimbingan dan saran
dari berbagai pihak baik secara langsung maupun tidak langsung. Oleh sebab itu,
penulis menyampaikan terima kasih kepada Dr. Laksmi Ambarsari, M.S selaku
pembimbing skripsi dari Departemen Biokimia, Tjandrawati Mozef M.Es.Sc.DU
selaku pembimbing penelitian yang telah membimbing penulis selama lima bulan.
Ucapan terima kasih juga penulis sampaikan kepada peneliti di Laboratorium
Bioassay Pusat Penelitian Kimia, LIPI-Bandung, Chandra Risdian, S.Si, Sri
Handayani, S.Si dan Ratih Asmara Ningrum, M.Si dari Pascasarjana Farmasi ITB
atas pinjaman inkubatornya. Penulis tidak lupa mengucapkan terima kasih kepada
kedua orang tua dan keluarga yang tak pernah lelah mendukung, menasehati,
memberikan semangat dan motivasi, serta mendoakan penulis sehingga dapat
menyelesaikan karya tulis ini dengan baik. Penulis juga mengucapkan terima
kasih kepada para sahabat; Endah, Yoshita, Sitha, dan Ayu atas dukungannya,
teman satu laboratorium di LIPI Bandung; Milannissa dan Nyi Mas R Anica G
(Icha), teman kostan Zulfa, serta semua pihak yang mendukung penyusunan karya
tulis ini.
Penulis menyadari bahwa karya tulis ini belum sempurna. Oleh karena itu,
penulis sangat mengharapkan saran dan kritik yang membangun dari berbagai
pihak terhadap karya tulis ini. Penulis berharap semoga karya tulis ini dapat
bermanfaat bagi berbagai pihak.
Bogor, Maret 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bandung, Jawa Barat, 12 Maret 1989 dari pasangan
Enan Ruchimat dan Iim Saripah. Bungsu dari dua bersaudara ini menempuh
pendidikan formal di SD Negeri ASMI 7 Bandung (1994-2000), SLTP Pasundan
1 Bandung (2000-2003), SMAN 22 Bandung (2003-2006). Penulis mengikuti
program Seleksi Penerimaan Mahasiswa Baru (SPMB) pada tahun 2007 untuk
melanjutkan pendidikan di Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
Organisasi mahasiswa yang pernah diikuti oleh penulis yaitu Himpunan
Profesi Departemen Biokimia,
Community Research and Education of
Biochemistry Student
(CREBs) pada tahun 2008-2009 sebagai staf divisi PSDM.
Penulis juga aktif dalam organisasi mahasiswa daerah, Paguyuban Mahasiswa
Bandung (Pamaung) pada tahun 2007-2010. Selain aktif berorganisasi, penulis
juga tergabung pada beberapa kepanitian di Institut Pertanian Bogor, di antaranya
masa pengenalan departemen Biokimia (2009), Seminar Keselamatan dan
Kesehatan Kerja (2009), Seminar Kanker (2009), IPB Art Contest 2009.
Ketertarikan penulis terhadap karya tulis mengantarkan penulis untuk
menorehkan prestasi selama menempuh pendidikan di Institut Pertanian Bogor.
Prestasi yang diperoleh penulis, yaitu Peraih Hibah Dikti Program Kreativitas
Mahasiswa Bidang Gagasan Tertulis 2010
dengan judul “Bioetanol Nipah (
Nypa
fruticans
) Sebagai Bahan Bakar Murah Masa Depan”
. Penulis pernah
mendapatkan pengalaman bekerja di laboratorium Pusat Riset Obat dan Makanan
(PROM) BPOM RI di Jakarta dalam memenuhi mata kuliah praktek lapang
selama
dua bulan dan membuat laporan yang berjudul “Deteksi Mikroba Patogen
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 2
Flavonoid ... 2
Sukun (
Artocarpus altilis
) ... 2
Kanker Payudara ... 3
Apoptosis ... 4
Kultur Sel ... 4
Sitotoksik ... 5
Analisis
Flow cytometry
... 6
BAHAN DAN METODE ... 7
Alat dan Bahan ... 7
Metode ... 7
HASIL DAN PEMBAHASAN ... 8
Uji Sitotoksik ... 8
Morfologi Sel Setelah Perlakuan ... 11
Analisis Induksi Apoptosis ... 13
SIMPULAN DAN SARAN ... 15
Simpulan ... 15
Saran ... 15
DAFTAR PUSTAKA ... 15
DAFTAR TABEL
Halaman
1 Hasil uji sitotoksik ekstrak daun sukun ... 9
2 Hasil uji sitotoksik senyawa daun sukun ... 10
3 Distribusi sel T47D pada fase siklus sel ... 14
DAFTAR GAMBAR
Halaman
1 Struktur flavonooid ... 2
2 Tanaman Sukun (
Artocarpus altilis
) ... 2
3 Struktur senyawa flavonooid daun sukun ... 3
4 Sel T47D ... 4
5 Mekanisme apoptosis ... 5
6 Perubahan MTT menjadi formazan ... 5
7 Proses kerja
flow cytometry
... 6
8 Analisis populasi sel dengan
flow cytometry
... 7
9 Hasil uji sel sitotoksik dengan metode MTT ... 9
10 Morfologi sel perlakuan normal dan kontrol positif ... 11
11 Morfologi sel dengan perlakuan ekstrak ... 12
12 Morfologi sel dengan perlakuan senyawa ... 12
13 Analisis siklus sel T47D dengan
flow cytometry
... 13
14 Diagram rata-rata persentase induksi apoptosis ... 15
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 19
2 Ekstraksi dan ekstraknasi flavonoid daun sukun ... 20
3 Ekstraksi senyawa AC-3-1 ... 21
4 Ekstraksi senyawa siklokomunol ... 22
5 Foto uji MTT ... 23
6 Data hasil uji aktivitas antikanker ... 24
PENDAHULUAN
Memasuki dasawarsa terakhir ini, masalah kesehatan menjadi hal utama yang harus diperhatikan masyarakat luas. Menurut World
Health Organization (WHO), lebih dari satu
juta kasus kanker terjadi setiap tahunnya dan lebih dari setengahnya terdapat di negara-negara berkembang (Heti 2008). Di Indonesia, kasus kanker payudara merupakan kasus kanker tertinggi kedua yang menyerang wanita, yaitu sebanyak 18% setelah kanker rahim 29% (Kumala et al. 2010). Data Sistem Informasi Rumah Sakit (SIRS) menyebutkan bahwa dalam tiga tahun terakhir kasus kanker payudara sebanyak 8 227 kasus atau sebanyak 17% (Tribun Jabar 2010).
Kanker terbentuk alami dari suatu sel yang mengalami mutasi DNA. Kerusakan genetik pada DNA akibat radiasi, radikal bebas, atau gen penekan tumor akan mengubah kecepatan proliferasi dan penghambatan apoptosis
(programmed cell death) (Silalahi 2006 &
Sukardiman et al. 2006). Kanker payudara, khususnya sel T47D merupakan hasil diferensiasi lanjut dari sel T-47 yang diisolasi dari payudara seorang wanita penderita kanker payudara. Pada sel T47D terdapat mutasi gen
p53 yang terjadi pada residu 194, sehingga tidak dapat berikatan dengan sekuen pada DNA dan mengakibatkan gen tersebut tidak mampu untuk menginduksi apoptosis (Zampieri et al. 2002). Mekanisme kerja apoptosis melibatkan serangkaian transduksi sinyal biokimiawi yang dapat menyebabkan perubahan ciri morfologis, seperti pengerutan sel, adanya fragmentasi DNA, kerusakan membran dan terbentuknya badan apoptosis yang nantinya akan difagositosis oleh sel makrofag (Gewies 2003).
Penggunaan obat kemoterapi sel kanker, yaitu doxorubicin belum memberikan hasil optimal, karena obat tersebut bekerja tidak hanya menyerang sel kanker, tetapi dapat menyerang sel atau jaringan lain seperti terjadinya kerontokan pada rambut (Kumala et al. 2010). Oleh karena itu, kecendrungan masyarakat untuk kembali ke alam (back to
nature) semakin tinggi dengan lebih memilih
menggunakan obat-obatan tradisional dari tanaman. Target pengembangan obat antikanker salah satunya diarahkan pada induksi/pemacuan apoptosis (Fisher 1994).
Kandungan aktif dari beberapa tanaman telah banyak dipelajari untuk mengetahui potensi dalam mencegah aktivitas kanker. Salah satu kandungan aktif yang dimiliki oleh suatu tanaman adalah senyawa metabolit
sekunder seperti flavonoid (Heldt 2005). Flavonoid telah diketahui memiliki aktivitas biologis sebagai antiinflamasi, antioksidan, antivirus, hepatoprotektor, antikanker, dan lain sebagainya (Middelton et al. 2009).
Uji farmakologis isolat flavonoid menunjukkan bahwa daun pepaya memiliki aktivitas penghambatan pertumbuhan kanker dengan IC50 104 µg/mL, serta mampu
menginduksi apoptosis terhadap sel mieloma secara in vitro (Sukardiman 2006). Penelitian Da‟i (2007) untuk menghambat pertumbuhan sel T47D melalui jalur pemacuan apoptosis dilakukan terhadap analog kurkumin. Kemampuan tanaman sebagai obat herbal masih banyak lagi dan perlu dilakukan penelitiannya lebih lanjut.
Sukun (Artocarpus altilis) adalah salah satu tanaman „nangka-nangkaan‟ yang dikenal baik di Indonesia. Keseluruhan bagian tanaman sukun telah banyak dimanfaatkan oleh masyarakat. Bagian kayu sukun biasanya digunakan sebagai bahan bangunan, buahnya bermanfaat dalam menyembuhkan sakit gigi, dan bagian getahnya dapat dibuat menjadi pakan burung. Selain kayu dan bagian lain tanaman sukun, daunnya diketahui dapat mengobati penyakit kulit (Heyne 1987). Sebagian besar metabolit sekunder yang berhasil diisolasi dari tanaman sukun telah ditentukan aktivitas biologisnya, antara lain memiliki sifat sitotoksik, antioksidan, antikanker, antiinflamasi, dan sebagai inhibitor tirosinase (Syah 2005). Antioksidan dan antikanker dalam senyawa flavonoid dapat membantu menginduksi apoptosis sehingga sel yang tidak terkontrol akibat kerusakan genetik dapat ditekan pertumbuhannya (Silalahi 2006). Lotulung et al. (2008) menjelaskan bahwa senyawa flavonoid daun sukun memiliki efek sitotoksik terhadap sel kanker leukimia (P388) dengan IC50 7 µg/mL. Penelitian daun sukun sebagai
sitotoksik terhadap sel kanker payudara (T47D) masih sedikit, sehingga perlu adanya serangkaian uji untuk menentukan sitotoksisitas daun sukun.
Tujuan dari penelitian ini, yaitu untuk menentukan sitotoksisitas ekstrak dan senyawa flavonoid daun sukun terhadap sel T47D yang ditentukan dengan nilai IC50
menggunakan uji microculture tetrazolium
technique (MTT). Selain itu juga untuk
menentukan potensi daun sukun dalam memacu apoptosis sel T47D menggunakan analisis flow cytometry. Hipotesis penelitian ini, yaitu sukun (Artocarpus altilis)
yang memiliki bioaktivitas sebagai sitotoksik dan penghambatannya diduga dapat menginduksi apoptosis. Manfaat penelitiannya, yaitu daun sukun dapat digunakan sebagai obat kanker payudara secara alami.
TINJAUAN PUSTAKA
Flavonoid
Tanaman yang berpotensi sebagai obat herbal mengandung senyawa kimia hasil dari metabolisme tanaman itu sendiri. Senyawa kimia hasil metabolisme primer seperti karbohidrat, protein, dan lemak digunakan sendiri oleh tanaman tersebut untuk pertumbuhannya. Senyawa metabolit sekunder seperti terpenoid, steroid, kumarin, flavonoid, dan alkaloid merupakan produk alami tanaman yang berfungsi sebagai pelindung dari gangguan hama penyakit (Heldt 2005).
Kerangka dasar flavonoid terdiri atas 15 atom karbon. Kerangka tersebut membentuk dua cincin benzena (C6) yang mengikat pada
suatu rantai propana (C3) sehingga
membentuk suatu susunan C6-C3-C6. Susunan
tersebut membentuk senyawa polifenol. Gugus hidroksil (OH) pada senyawa fenol diketahui dapat meningkatkan sitotoksisitas suatu senyawa (Syah 2005) (Gambar 1). Flavonoid memiliki tiga jenis struktur yang berbeda, yaitu flavonoid, isoflavonoid, dan neoflavonoid. Lebih dari 4000 struktur unik flavonoid telah teridentifikasi dari berbagai jenis tanaman (Middelton et al. 2009). Banyaknya jenis flavonoid disebabkan oleh berbagai tingkat hidroksilasi, alkoksilasi, atau glikosilasi dari struktur tersebut. Masing-masing senyawa flavonoid mempunyai struktur dasar tertentu. Senyawa flavonoid diklasifikasikan berdasarkan kerangka karbonnya seperti khalkon, flavanon, flavon, flavan-3-ol, dan 3-prenilflavon (Hakim 2007). Sintesis flavonoid pada suatu tanaman berasal dari asam amino fenilalanin dan tirosin yang merupakan hasil dari jalur sikimat. Asam amino tersebut akan mengubah struktur cincinnya menjadi fenol dan masuk dalam jalur malonat. Tahap awal jalur malonat menggunakan p-komaril-KoA dan 3 molekul malonil KoA membuat sintesis khalkon yang dibutuhkan dalam jalur ini menjadi bersifat yang tidak dapat dirubah sehingga menghasilkan flavonoid (Heldt 2005).
Flavonoid yang merupakan senyawa fenolik alam memiliki sifat antioksidan dan berpotensi dalam menghambat pertumbuhan
sel kanker melalui mekanisme penghambatan siklus sel, pemacuan apoptosis, penghambatan angiogenesis, antiproliferatif atau kombinasi dari beberapa mekanisme tersebut. Jenis flavonoid, misalnya genestein dan kuersetin, mampu menghambat aktivitas protein kinase pada daerah pengikatan ATP. Peran dari protein kinase sendiri, yaitu sebagai sinyal pertumbuhan pada sel-sel kanker dan pada jalur antiapoptosis (Meiyanto et al. 2007).
Gambar 1 Struktur flavonoid (Middelton et al. 2009).
Sukun (Artocarpus altilis)
Sukun merupakan tanaman Plantae yang termasuk ke dalam divisi Spermatophyta dan subdivisi Angiospermae. Keluarga tanaman Moraceae ini termasuk ke dalam kelas Dicotyledonae dengan ordo Urticales, genus
Artocarpus, dan spesies Artocarpus altilis.
Sukun atau breadfruit dikenal sebagai sumber makanan yang banyak terdapat di kawasan tropis termasuk Indonesia dan Malaysia. Di pulau Jawa tanaman ini dijadikan tanaman budidaya oleh masyarakat (Heyne 1987).
Buah sukun berbentuk bulat atau bulat panjang dengan diameter mencapai 25.4 cm dan beratnya kurang lebih 4.54 kg dengan ketinggian pohon 20 m. Pada Gambar 2 terlihat sebagian warna daun hijau dan coklat, serta kulit buah berwarna hijau yang menunjukkan tanaman sukun siap untuk panen (Koswara 2006). Buah sukun terbentuk dari keseluruhan kelopak bunganya. Perbungaan terjadi dalam ketiak daun, dekat ujung ranting. Sukun tumbuh baik di daerah basah, tetapi juga dapat tumbuh di tempat yang sangat kering. Di musim kering, disaat tanaman lain tidak memproduksi atau
merosot produksinya, justru sukun dapat tumbuh dan berbuah dengan lebat. Pohon sukun mulai berbuah setelah berumur lima sampai tujuh tahun dan akan terus berbunga hingga umur 50 tahun, sehingga membuktikan bahwa tanaman sukun produktivitasnya cukup tinggi (Koswara 2006).
Hasil analisis menunjukkan sukun memiliki nilai gizi, antara lain kandungan fosfor, kalsium, vitamin C, vitamin B1 (Mustafa 1998). Pada bagian daun sukun ditemukan senyawa turunan flavonoid jenis piranoflavon, yaitu siklokomunin, siklokomunol dan sikloartokarpin (Hakim 2007). Selain itu, senyawa turunan geranil flavonoid jenis dihidrokhalkon yang telah berhasil diisolasi, yaitu AC-3-1 (1-[2,4-dihidroksifenil]- 3-[8- hidroksi-2-metil-2-(4-metil- 3-pentenil -2H-1- benzopiran-5-il]-1-propanon), AC-5-1 (2-geranil-2‟,4‟,3,4 tetrahidroksidihidrokhalkon), 2-geranil-3,4,7-trihidroksiflavanon, dan sikloaltilisin (Wang
et al. 2007). Syah (2005) melaporkan bahwa
senyawa AC-5-1, AC-3-1, dan siklokomunol memiliki efek biologis yang potensial sebagai sitotoksik. Pada Gambar 3 terdapat gugus hidroksil yang terikat pada struktur senyawa AC-5-1, AC-3-1, dan siklokomunol. Gugus hidroksil tersebut diketahui dapat membantu dalam mekanisme penghambatan sel kanker sebagai antioksidan (Middelton et al. 2009).
Daun tanaman sukun mengandung beberapa zat berkhasiat seperti asam hidrosianat, asetilkolin, tanin, riboflavin, fenol, flavonoid, dan saponin (Mulyati 2009). Beberapa senyawa turunan dihidrokhalkon dan piranoflavon A. altilis tersebut hampir memiliki kesamaan dengan A. communis, tetapi sebagian senyawa A. communis diisolasi berasal dari bagian bunga tanaman sukun, bukan dari bagian daunnya (Syah 2005).
Pada masyarakat Indonesia umumnya, sukun biasa juga digunakan sebagai obat tradisional yang dapat mengobati berbagai penyakit seperti sirosis hati, hipertensi, dan diabetes melitus (Mustafa 1998). Secara
tradisional air rebusan daun sukun dilaporkan dapat mengobati penyakit kulit, menurunkan tekanan darah, menyembuhkan penyakit asma, hepar, juga ginjal (Syah et al. 2006).
Kanker Payudara
Secara umum kanker didefinisikan sebagai suatu kondisi sel telah kehilangan pengendalian dan mekanisme normalnya, sehingga mengalami pertumbuhan yang tidak normal, cepat, tidak terkendali dan berusaha menghindari kematiannya (apoptosis). Sel kanker tidak peduli dengan keterbatasan zat makanan, ruang dan fakta jika harus berbagi dengan sel-sel normal yang ada disekitarnya. Lebih jauh dari itu, sel kanker mengabaikan perintah untuk berhenti berkembangbiak oleh tubuh yang bersangkutan. Sel-sel kanker dibentuk dari sel-sel normal dalam suatu proses rumit yang disebut transformasi. Tahapan transformasi, yaitu inisiasi (terjadinya mutagenesis), promosi (kerusakan gen), dan perkembangan (Diananda 2008).
Kanker terjadi karena kerusakan struktur genetik yang menyebabkan pertumbuhan sel tidak terkontrol. Kerusakan gen dapat disebabkan karena radiasi, radikal bebas, atau gen penekan tumor (Silalahi 2006). Tahapan terjadinya kanker, yaitu: (1) induksi: adanya perubahan pertumbuhan sel (displasia), (2) kanker in situ: pertumbuhan kanker terbatas pada jaringan tempat asalnya tumbuh, (3) kanker invasif: sel kanker telah menembus membran basal dan masuk ke jaringan atau organ sekitar yang berdekatan, (4) metastasis: penyebaran kanker ke jaringan atau organ lain (Diananda 2008).
Kanker payudara merupakan salah satu penyebab kanker tertinggi bagi wanita di dunia. Penyebab kanker payudara dapat diakibatkan karena interaksi rumit dari banyak faktor genetik, hormonal, dan lingkungan. Jenis sel kanker payudara, diantaranya adalah sel T47D, sel MCF-7, sel MDA-MB-231, sel MB-MDA-468, sel BT-20, dan sel BT-549
(1) (2) (3)
(Yang et al. 2010). Sel T47D merupakan
continous cell lines yang diambil dari jaringan
payudara seorang wanita berumur 54 tahun yang terkena ductal carcinoma yang diisolasi pada tahun 1970 (Kristyowati 2009). Sel T47D mengekspresikan gen p53 yang termutasi sehingga gen p53 tidak dapat berikatan dengan DNA sekuen. Hal ini mengakibatkan hilangnya kemampuan gen
p53 untuk regulasi siklus sel. Mutasi gen p53
ini pun mengakibatkan tidak dapat meregulasi protein proapoptosis yang diatur oleh p53
seperti Bax dan Puma (Gewies 2003).
Pada Gambar 4 menunjukkan sel T47D yang sedang mengalami pertumbuhan dan perkembangannya setelah inkubasi 18 jam. Morfologi sel yang terlihat pada gambar seperti sel epitel dan memiliki sifat yang bergerombol yang menandakan sel akan bersifat kanker (Diananda 2008). Sel T47D sering digunakan dalam penelitian kanker secara in vitro karena mudah penanganannya, memiliki kemampuan replikasi yang tidak terbatas atau cepat dalam pertumbuhannya. Selain itu memiliki homogenitas yang tinggi dan mudah diganti dengan sel baru yang telah dibekukan jika terjadi kontaminasi. Metode in vitro ini merupakan alternatif pengganti metode hewan uji. (Zampieri et al.
2002).
Gambar 4 Sel T47D dengan perbesaran 10x.
Apoptosis
Apoptosis merupakan mekanisme kematian sel secara alami dan terprogram. Berbeda dengan nekrosis, yaitu kematian sel yang merupakan penghancuran sel secara total. Apoptosis terjadi ketika sel mengalami kerusakan yang tidak dapat diperbaiki lagi, misalnya terjadi kerusakan DNA akibat radiasi ionisasi atau bahan kimia beracun, atau bisa juga disebabkan aktivitas gen penekan tumor dan radikal bebas. Oleh karena itu, apoptosis bekerja untuk melenyapkan sel-sel yang mengalami kerusakan tersebut. Selain itu, apoptosis memiliki peranan penting untuk menjaga keseimbangan perkembangbiakan sel dan untuk membatasi proliferasi sel yang
dapat menyebabkan kanker (Darzynkiewicz et al. 1992).
Apoptosis melibatkan serangkaian kejadian biokimiawi melalui transduksi sinyal yang menyebabkan perubahan morfologis bahkan kematian sel. Mekanisme apoptosis yang dapat merubah morfologis sel tersebut, yaitu penyusutan sel, kondensasi kromatin fragmentasi DNA, kerusakan membran inti dan sel pecah menjadi beberapa vesikel yang disebut badan apoptosis (Gambar 5). Badan apoptosis tersebut akan dikenali oleh sel makrofag dan dimakan (fagositosis). Perubahan yang terjadi dalam sel apoptosis memediasi pembelahan DNA menjadi fragmen-fragmen (Gewies 2003). Perubahan biokimia pada proses apoptosis melibatkan dua kelompok transduksi sinyal, yaitu internal dan eksternal. Transduksi sinyal internal diantaranya adalah gen penekan tumor, gen
bcl-2, dan „killer caspases’. Transduksi sinyal
eksternal, salah satunya reseptor faktor nekrosis pada tumor (Doseff 2004).
Gen penekan tumor (gen p53) adalah faktor transkripsi yang mengaktivasi sejumlah besar ekspresi gen yang terlibat dalam regulasi siklus sel dan apoptosis. Gen p53
adalah gen penekan tumor pertama yang diidentifikasi dalam sel kanker. Jejaring kerja gen p53 secara normal berada dalam keadaan tidak aktif. Keadaan ini akan menjadi aktif jika sel mengalami stress atau terluka. Kehilangan fungsi gen p53 karena mutasi dapat mempengaruhi mekanisme pembentukan apoptosis yang melibatkan gen
bcl-2 dan caspase (Syaifudin 2007).
Mekanisme gen p53 dalam menginduksi apoptosis, yaitu gen bekerja merangsang mitokondria dengan adanya induksi dari gen
Bax untuk mengeluarkan sitokrom c ke sitosol membentuk caspase cascade (Gewies 2003).
Kultur Sel
Kultur sel merupakan metode pertumbuhan sel yang dikembangkan secara
in vitro dengan lingkungan yang disesuaikan
(nutrisi, pH, oksigen, osmolalitas, konsentrasi CO2, dan suhu) seperti dalam kondisi in vivo.
Kultur sel banyak digunakan dalam berbagai aplikasi ilmiah, seperti genetika, biologi molekul, dan teknik kultur jaringan (Freshney 2005).
Gambar 5 Mekanisme apoptosis (Gewies 2003). karakteristik seperti penurunan protein dan
sintesis DNA. Sel yang ditransformasi terkadang memiliki waktu hidup yang tak terbatas disebut dengan immortal cell atau
countinous cell. Waktu hidup sel yang tidak
terbatas membuat sel akan terus-menerus membelah, serta proses tersebut membuat sel secara kontinyu dapat dikultur (Freshney 2005).
Sel T47D ditumbuhkan dalam media kultur sel, yaitu Dulbecco‟s Modified Eagle‟s Medium (DMEM) Gibco 12800-017, 10% Fetal Bovine Serum (FBS), dan Penicillin Streptomicin Fungizon Genthamicin (PSFG). Fungsi media dalam pertumbuhan sel adalah untuk menyediakan nutrisi dan energi yang dibutuhkan dalam pertumbuhan dan proliferasi sel. Kandungan dalam media pertumbuhan sel terdiri atas dua bagian, yaitu media dasar dan suplemen (Freshney 2005).
Media dasar dalam kultur sel T47D adalah DMEM yang kandungannya terdiri atas glukosa yang tinggi, larutan garam, asam amino esensial, vitamin, dan merah fenol
(phenol red). Media ini tidak mengandung
gen pembunuh dan membutuhkan suplementasi untuk menjadi media yang lengkap. Larutan FBS memiliki albumin dalam kandungannya yang berfungsi sebagai protein pembawa untuk molekul-molekul kecil, transferin untuk pengikat besi, serta terdapat antiprotease untuk menghambat enzim protease dalam menghancurkan sel. Larutan PSFG bertindak sebagai antibiotik dan antimikotik yang melindungi sel dari kontaminasi bakteri dan jamur (Freshney 2005).
Kultur sel ditumbuhkan dalam inkubator pada suhu 37°C, 5% CO2, dan 95%
kelembaban. Kondisi inkubator yang tepat sangat dibutuhkan oleh sel agar dapat tumbuh dengan baik. Suhu diatur sesuai kondisi suhu fisiologis sel, kelembaban dijaga 95% dengan tujuan untuk mencegah kelebihan evaporasi media, serta 5% CO2 berfungsi sebagai buffer
bikarbonat, jika kepadatan sel rendah, maka CO2 mengkompensasi kekurangannya. Kultur
sel T47D akan tumbuh membentuk satu lapisan pada dasar flask (wadah kultur sel).
Jika kultur sel telah mencapai 95% konfluen (kepadatan), maka sel disubkultur dengan proses tripsinisasi. Enzim tripsin yang digunakan berfungsi untuk melepas ikatan antar sel dan sel dengan permukaan wadah. Kerja enzim tripsin dapat dihentikan dengan menambahkan media yang mengandung FBS, karena FBS merupakan antiprotease.
Sitotoksik
Uji sitotoksik merupakan perkembangan untuk mengidentifikasi obat sitotoksik baru atau deteksi obat dengan aktivitas antitumor/antikanker. Uji sitotoksik digunakan untuk menentukan parameter nilai IC50. Nilai IC50 menunjukkan nilai konsentrasi
yang menghasilkan hambatan proliferasi sel 50% dan menunjukkan potensi ketoksikan suatu senyawa terhadap sel. Semakin besar nilai IC50 maka senyawa tersebut semakin
tidak toksik (Arung et al. 2009).
Metode umum yang digunakan untuk uji sitotoksik dalam pengukuran nilai IC50, yaitu
uji microculture tetrazolium technique
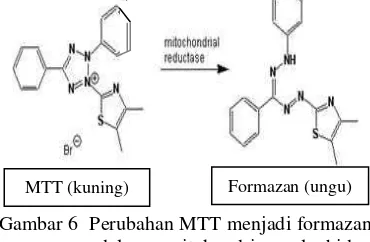
(MTT). Prinsip dari uji MTT, yaitu terjadinya mekanisme perubahan warna kuning dari garam tetrazolium yang tereduksi menjadi kristal formazan dalam mitokondria sel hidup (Gambar 6). Mitokondria dari sel hidup berperan penting dalam menghasilkan dehidrogenase. Bila dehidrogenase tidak aktif karena efek sitotoksik, maka formazan tidak akan terbentuk. Konsentrasi formazan dapat ditentukan dengan menggunakan spektrofotometri. Kristal formazan berwarna
Gambar 6 Perubahan MTT menjadi formazan dalam mitokondria sel hidup (Amalia 2008).
ungu yang terbentuk dapat larut dengan adanya penambahan dimetil sulfoksida (DMSO). Absorban dibaca pada panjang gelombang 550 nm pada spektrofotometer atau microplatereader. Konsentrasi formazan yang berwarna ungu berbanding lurus dengan jumlah sel hidup (Amalia 2008).
Analisis Flow cytometry
Flow cytometry merupakan prinsip
berteknologi tinggi yang digunakan untuk menganalisis karakteristik fisik beberapa partikel tunggal seperti sel. Karakteristik ini ditentukan dengan menggunakan sistem pasangan elektronik-optik. Sifat-sifat yang diukur diantaranya partikel yang relatif berukuran, granular, atau kompleksitas internal, dan memiliki intensitas flouresensi (Becton 2000).
Sebuah flow cytometer terdiri atas tiga sistem utama: fluida, optik, dan elektronik. Sistem fluida membawa sel menuju laser untuk dianalisis. Sistem optik terdiri atas laser untuk mengeksitasi sel dalam aliran sampel dan filter optik untuk mengarahkan sinyal cahaya yang dihasilkan ke detektor yang sesuai. Sistem elektronik mengubah sinyal cahaya yang diterima oleh detektor menjadi sinyal elektronik oleh komputer.
Partikel atau sel yang akan dianalisis berukuran 0.2-150 mikrometer. Sel-sel dari jaringan padat harus dipisahkan sebelum dianalisis. Ketika partikel dalam suatu fluida mengalir dan dilewati sinar laser, sel menyerap energi cahaya dan mengemisikan energi cahaya pada panjang gelombang tertentu. Cahaya tersebut diarahkan menuju detektor melalui serangkaian sistem filter dan diseleksi menurut flouresensi yang terserap. Detektor sendiri memiliki sensor yang dapat mengubah foton cahaya menjadi sinyal elektronik (Gambar 7) (Becton 2000).
Salah satu analisis flow cytometry adalah pengukuran populasi sel pada suatu siklus sel. Siklus sel merupakan alur dari suatu proses kehidupan yang diawali pada sebuah sel. Sel
Gambar 7 Proses kerja Flow cytometry
(Becton 2000).
memiliki material genetik yang memberikan perbedaan pada setiap sel lainnya yang dikenal dengan DNA. Fase siklus sel, yaitu fase G1, fase S, fase G2, dan fase M. Fase G1 merupakan fase persiapan untuk sintesis DNA. Fase S adalah fase berlangsungnya sintesis DNA atau replikasi. Fase G2 merupakan fase perbaikan DNA atau reorganisasi struktur DNA. Fase M merupakan fase mitosis atau fase pembelahan sel (Rabinovitch 1990).
Pengukuran populasi sel dari siklus sel dengan populasi sel yang mengalami apoptosis dapat dilakukan secara beriringan dalam flow cytometry. Fase siklus sel akan berproliferasi secara kontinuitas dan mengalami apoptosis secara normal pada bagian tertentu. Namun, jika DNA mengalami penyimpangan, maka fase dari siklus sel, seperti apoptosis akan terganggu dan memunginkan terbentuknya penyakit seperti kanker. Selama apoptosis DNA nukleus terfragmentasi, sel yang mengalami apoptosis akan membentuk fragmen-fragmen DNA yang lebih pendek dari sel normal (Darzynkiewicz et al. 1992). Pengukuran populasi sel dari analisis yang dihasilkan flow
cytometry adalah pengukuran perbandingan
kandungan DNA dalam suatu populasi sel (Becton 2000).
Berbagai zat warna yang digunakan memiliki afinitas tinggi untuk mengikat DNA. Lokasi pengikatan warna pada molekul DNA bervariasi dengan jenis zat warna yang digunakan. Pewarna yang paling umum adalah pewarna biru-cerah Propidium Iodida (PI) atau Ethidium Bromida (EtBr) dan pewarna UV-cerah Diamidino-Fenilindol (DAPI), serta Hoechst. Propidium Iodida (PI) adalah pewarna yang mengikat DNA dan RNA untai ganda, sedangkan pengikatan warna DAPI dan Hoechst terjadi pada alur yang pendek dari heliks DNA dan pada dasarnya tidak mengikat RNA (Rabinovitch 1990).
Gambar 8 Analisis populasi siklus sel dengan
flow cytometry (Becton 2000).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan pada penelitian, yaitu mikroskop inverted, inkubator CO2,
laminar air flow cabinet, microwadahreader,
pemanas, tabung conical steril, tissue culture
flask, pH meter, wadah 96-sumur, wadah
24-sumur, kamera digital, bunsen, sentrifus, pipet mikro, eppendorf, tip, tabung ependorf, botol kaca, dan kantong plastik. Untuk analisis sel yang diuji menggunakan flow cytometer.
Sampel yang digunakan merupakan stok hasil ekstraksi bertingkat dari daun sukun yang dimiliki oleh Pusat Penelitian Kimia, Lembaga Penelitian Indonesia (LIPI) Bandung. sampel tersebut meliputi, ekstrak etanol, ekstrak heksana, ekstrak etil asetat, ekstrak butanol, senyawa AC-5-1, senyawa AC-3-1, dan senyawa siklokomunol. Kontrol positif adalah doxorubicin. Pelarut sampel adalah DMSO. Bahan untuk kultur sel adalah sel T47D yang diperoleh dari stok Laboratorium Kimia LIPI Bandung. Bahan kimia dan media yang digunakan diantaranya adalah trypsin-EDTA (Gibco 25200), media DMEM Gibco 12800-017, media yang mengandung DMEM, 10% FBS Gibco 10099-141, dan PSFG Gibco 15240-062, larutan dapar Phosphat Buffer Saline (PBS) pH 7.4,
freezing solution, etanol 70%, larutan MTT
(3- (4,5- dimetiltiazol-2-il) -2,5-difeniltetrazolium bromida) (Sigma), Propidium Iodida (PI) (Sigma P3566), dimetilsulfoksida (DMSO) yang berperan dalam melarutkan senyawa polar dan senyawa nonpolar, dan kertas saring 0.2 µm.
Metode
Metode penelitiannya terdiri atas kultur sel, perlakuan sampel, pengamatan morfologi sel, uji sitotoksik, analisis induksi apoptosis, dan analisis data. (lampiran 1).
Kultur Sel
Sel kanker payudara T47D yang digunakan merupakan koleksi Pusat Penelitian Kimia, LIPI Bandung. Kultur sel ditumbuhkan dalam media penumbuh Dulbecco‟s Modified Eagle‟s Medium (DMEM) yang mengandung 10% FBS, antibiotik penisilin-streptomisin 1 % dan gentamisin 0.1%. Sel dipanen dari flask
setelah 90% terjadi kepadatan pertumbuhan, dengan trypsin-EDTA dan diinkubasi pada suhu 37oC dengan atmosfer 5% CO2.
Persiapan Sampel
Sampel yang diperoleh berasal dari stok daun sukun yang diekstraksi bertingkat menggunakan pelarut yang berbeda kepolarannya dari nonpolar sampai polar. Pelarut yang digunakan dalam ekstraksi daun sukun adalah etanol, heksana, etil asetat, dan butanol. Proses ekstraksi dan purifikasi tersebut menghasilkan fraksi-fraksi sehingga diperoleh senyawa turunan flavonoid jenis dihidrokhalkon dan prenilflavon, salah satunya adalah senyawa AC-5-1, senyawa AC-3-1, dan senyawa siklokomunol. Isolasi dan identifikasi senyawa tersebut pada Lampiran 2, 3, dan 4.
Kemampuan daun sukun dalam menghambat sel T47D diujikan pada semua hasil ekstraksi dan senyawa yang telah diperoleh, dikarenakan belum ditemukannya nilai IC50 yang berpotensi. Sampel-sampel
yang diperoleh dari stok memiliki konsentrasi berbeda sehingga perlu diencerkan dengan DMSO terlebih dahulu sebelum perlakuan. Konsentrasi stok awal ekstrak etanol, ekstrak heksana, ekstrak etil asetat, dan ekstrak butanol daun sukun berturut-turut sama yaitu 100 mg/mL dan senyawa AC-5-1, senyawa AC-3-1, serta senyawa siklokomunol mempunyai konsentrasi stok awal 50 mM. Konsentrasi akhir yang diperlukan untuk uji sel hidup dalam menentukan nilai IC50 dibuat
lima konsentrasi berseri, yaitu 500 µg/mL, 250 µg/mL, 125 µg/mL, 62.5 µg/mL, dan 31.25 µg/mL pada ekstrak daun sukun. Begitupun, untuk senyawa dibuat lima konsentrasi berseri, yaitu 500 µM, 250 µM, 125 µM, 62.5 µM, dan 31.25 µM.
x 100% serta doxorubicin 1 µM. Penentuan nilai
konsentrasi pada flow cytometry berdasarkan daya penghambatan yang dimungkinkan pada uji sel hidup dan rataan tengah dari range konsentrasi perlakuan.
Uji Sitotoksik
Pengujian sitotoksik pada umunya menggunakan uji MTT untuk menentukan efektivitas suatu sampel pada sel T47D dengan parameter nilai IC50. Kultur sel T47D
yang telah tumbuh dan berkembang sangat banyak dipanen dan sel dipindahan dengan konsentrasi 5x104 sel/sumur ke dalam wadah 96-sumur (Nunclon). Kultur sel diinkubasi selama 24 jam untuk adaptasi. Tiap sumuran kultur sel ditambahkan DMSO, media, dan sampel sebanyak 1 μL dengan konsentrasi berbeda, lalu inkubasi kembali selama 24 jam. Media kultur yang mengandung sampel dibuang dan dicuci dengan larutan PBS, kemudian dalam kondisi gelap ditambahkan 100 μL media kultur yang mengandung MTT [3- (4,5-dimetiltiazol -2-il)-2,5 difeniltetrazolium bromida]. Wadah diinkubasi kembali selama 2-4 jam pada suhu 37°C. Sel yang hidup akan bereaksi dengan MTT membentuk kristal formazan berwarna ungu. Setelah 2-4 jam, media yang mengandung MTT dibuang (diambil secara hati-hati menggunakan mikropipet) kemudian ditambahkan 100 μL DMSO untuk melarutkan kristal formazan. Wadah digoyang di atas shaker selama 10 menit kemudian dibaca absorbannya dengan spektrofotometri pada panjang gelombang 515 nm. Data yang ditunjukkan dalam absorban dan dihitung persen sel hidup (%), kemudian dianalisis dengan menghitung konsentrasi media hambatan dari 50% proliferasi sel (IC50)
dengan Microsot Excel (Arung et al. 2009).
Analisis Siklus Sel dengan Flow Cytometry
Kultur sel dimasukkan pada wadah 24-sumur dengan konsentrasi 25x104 sel/sumur dan inkubasi selama 24 jam. Media kultur dalam wadah 24-sumur dibuang dan diganti dengan media kultur baru serta sampel 5 uL, DMSO atau hanya media saja, Sel hasil perlakuan ditampung dalam tabung flow cytometer dan disentrifugasi dengan kecepatan 1500 rpm selama 5 menit, kemudian supernatannya dibuang. Sel difiksasi dengan 500 µL etanol 70% dingin, disimpan dalam suhu 4oC selama 15 menit dan disentrifugasi kembali selama 5 menit, kemudian supernatannya dibuang kembali. Pelet sel disuspensikan dengan 900 µL PBS
dan 100 µl Propidium Iodida (Sigma P3566), pewarna analisis kandungan DNA, lalu dihomogenkan. Sel yang telah tersuspensi diinkubasi dalam gelap selama 30 menit dan dianalisis siklus sel dengan flow cytometry
(Arung et al. 2009).
Analisis Statistik
Data yang diperoleh berupa absorban masing-masing sumur dikonversi ke dalam persen sel hidup menggunakan rumus: absorban sampel – absorban media absorban normal – absorban media
Nilai IC50 dilihat dari uji sel hidup dengan
metode MTT dan dikalkulasikan menggunakan analisis regresi linear pada Microsoft Excel. Analisis statistik untuk perbandingan antara sel yang diberi perlakuan dan tidak diberi perlakuan dilakukan uji statistiknya menggunakan uji T. Analisis data untuk uji T dilakukan menggunakan Microsoft Excel. Jika rataan normal lebih besar dari rataan sampel dengan p 0,05 maka terjadi perbedaan yang dianggap statistik signifikan (Walpole 1993).
HASIL DAN PEMBAHASAN
Uji Sitotoksik
Hasil uji sitotoksik dengan metode MTT secara visual dapat dilihat pada Gambar 9. Sel kanker normal tanpa perlakuan pada gambar ditunjukkan dengan warna ungu pekat dan kontrol positif (doxorubicin) berwarna ungu yang sangat pudar. Hal tersebut menunjukkan bahwa dalam sel normal telah terjadi reduksi garam tetrazolium menjadi kristal formazan ungu, sedangkan pemberian doxorubicin tidak memperlihatkan hal tersebut yang menunjukkan sel telah mati.
Perlakuan dengan sampel daun sukun, baik ekstrak dan senyawa memperlihatkan warna yang bervariasi. Sampel yang memiliki potensi penghambatan sel T47D oleh ekstrak daun sukun adalah ekstrak heksana, terlihat dengan warna ungu yang sangat pudar hampir bening. Ekstrak etanol, ekstrak etil asetat, dan ekstrak butanol secara visual tidak menunjukkan efek sitotoksiknya dan pada Gambar 9 memperlihatkan warna ungu yang bervariasi pula pada tiap konsentrasi dan tiap pengulangan. Hasil sitotoksik senyawa flavonoid daun sukun yang berpotensi menghambat sel T47D adalah AC-3-1 dengan perubahan warna larutan ungu pudar (Lampiran 5). Wadah kultur sel senyawa, warna ungu yang terlihat pada sampel
Gambar 9 Hasil uji sitotoksik dengan metode MTT-assay secara kualitatif. senyawa tersebar rata pada semua konsentrasi
kecuali pada senyawa AC-3-1.
Penentuan utama hasil uji sitotoksik adalah untuk menghitung nilai IC50 dari
penggunaan metode MTT-assay. Sebelum perhitungan nilai IC50, penggunaan DMSO
dalam melarutkan sampel harus dilihat pengaruhnya terhadap perlakuan normal dengan menggunakan analisis statistik (uji T). Hasil uji T dari perbandingan nilai absorban normal dan DMSO menunjukkan bahwa DMSO yang memiliki sifat semipolar tidak berpengaruh signifikan terhadap perlakuan normal dengan nilai p=0.24, jika p 0.05 terdapat beda yang signifikan pada pelarut dan
dapat mempengaruhi kerja dari sampel secara utuh (Walpole 1993).
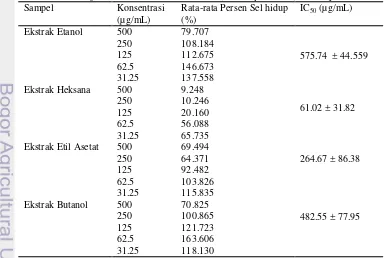
Nilai absorban perlakuan sampel daun sukun dari tiga kali ulangan dengan konsentrasi yang berseri dirata-ratakan, kemudian dihitung persen sel hidupnya. Tabel 1 menunjukkan persen sel hidup ekstrak daun sukun dan yang berpotensi terbaik untuk sitotoksisitas adalah ekstrak heksana. Pada konsentrasi 62.5 µg/mL ekstrak heksana mampu mendekati 50% penghambatan sel T47D sebesar 43.91% atau persen sel hidup sebesar 56.09%. Ekstrak lainnya, seperti ekstrak etanol, ekstrak etil asetat, dan ekstrak butanol belum mampu memperlihatkan Tabel 1 Hasil uji sitotoksik ekstrak daun sukun (Artocarpus altilis) terhadap sel T47D Sampel Konsentrasi
(µg/mL)
Rata-rata Persen Sel hidup (%)
IC50 (µg/mL)
Ekstrak Etanol 500 79.707
575.74 ± 44.559 250 108.184
125 112.675 62.5 146.673 31.25 137.558 Ekstrak Heksana 500 9.248
61.02 ± 31.82 250 10.246
125 20.160 62.5 56.088 31.25 65.735 Ekstrak Etil Asetat 500 69.494
264.67 ± 86.38 250 64.371
125 92.482 62.5 103.826 31.25 115.835 Ekstrak Butanol 500 70.825
482.55 ± 77.95 250 100.865
125 121.723 62.5 163.606 31.25 118.130
Sampel Ekstrak
Doxorubicin Konsentrasi (dari kiri ke kanan) dari tinggi ke rendah
Normal Konsentrasi (dari atas ke bawah) dari tinggi ke rendaah
DMSO
Heksan EtAC Butanol
Etanol
penghambatan 50% proliferasi sel. Pada konsentrasi 500 µg/mL. ekstrak etanol hanya mampu menghambat 20.30%. ekstrak etil asetat 30.51%. dan ekstrak butanol 29.18%. Ekstrak etanol merupakan tahapan awal proses ekstraksi dan purifikasi sampel (Lampiran 3) sehingga sampel masih ekstrak kasar dan belum menunjukkan spesifikasi dalam membantu penghambatan sel T47D.
Persentase sel hidup pada masing-masing konsentrasi dikonversikan dalam persamaan linear untuk mendapatkan nilai IC50. Nilai
IC50 yang tertera pada Tabel 1 menunjukkan
bahwa ekstrak heksana dengan kemampuan penghambatan mendekati 50% proliferasi sel memperoleh konsentrasi penghambatan 61.01 ± 31.82 µg/mL. Ekstrak etanol dan ekstrak butanol terlihat memiliki nilai IC50 yang tinggi
dan berada di luar rentang konsentrasi perlakuan (31.25 µg/mL-500 µg/mL) yang menunjukkan ekstrak tersebut tidak toksik. Kemampuan ekstrak etil asetat dibandingkan dengan ekstrak etanol dan ekstrak butanol diduga masih memiliki kemampuan sebagai sitotoksik dilihat dari daya hambat proliferasi selnya mendekati 50%. walaupun konsentrasi yang diperoleh 264.67 ± 86.38 µg/mL. Sehingga pada penelitian ini. ekstrak heksana pada sampel ekstrak daun sukun memiliki potensi tinggi dalam menghambat sel T47D.
Identifikasi tanaman sukun telah dilakukan sampai pada pemurnian senyawa. Penelitian yang dilakukan Syah (2005). pada bagian
daun sukun diidentifikasi terdapat sekitar tujuh senyawa. Salah satunya terdapat senyawa AC-5-1. senyawa AC-3-1. dan senyawa siklokomunol. Senyawa daun sukun tersebut berasal dari hasil isolasi ekstrak etil asetat yang mempunyai turunan flavonoid tergeranilasi jenis dihidrokhalkon dan prenilflavon (Syah 2005. Indraswati 2009. & Mulyati 2009). Ketiga senyawa ini dipilih dalam penelitian karena memiliki aktivitas biologis sebagai antitumor/antikanker. Selain itu. senyawa siklokomunol telah diidentifikasi memiliki efek sitotoksik pada sel leukimia (Syah 2005).
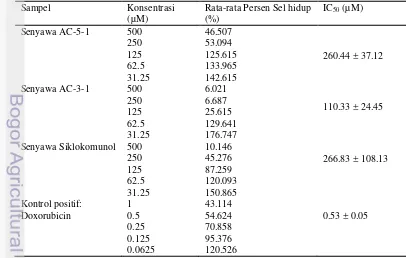
Persen sel hidup pada Tabel 2 menunjukkan bahwa senyawa AC-5-1 memiliki kemampuan penghambatan pada konsentrasi 500 µM dengan persen sel hidup sebesar 46.51% atau penghambatan proliferasi sel sebesar 53.49%. Senyawa AC-3-1 memperoleh persen penghambatan proliferasi sel 74.39% dengan persen sel hidup sebesar 25.61% pada konsentrasi perlakuan 125 µM. Sedangkan. senyawa siklokomunol pada konsentrasi perlakuan 250 µM mampu menghambat 54.72% proliferasi sel dengan persen sel hidup sebesar 45.28%. Persen sel hidup yang diperoleh tersebut dikonversikan untuk memperoleh konsentrasi penghambatan. Nilai IC50 yang ditunjukkan pada Tabel 2
menunjukkan bahwa senyawa AC-3-1 memberikan potensi konsentrasi penghambatan tertinggi sebesar 110.33 ± Tabel 2. Hasil uji sitotoksik senyawa flavonoid daun sukun (Artocarpus altilis) terhadap sel T47D
Sampel Konsentrasi (µM)
Rata-rata Persen Sel hidup (%)
IC50 (µM)
Senyawa AC-5-1 500 46.507
260.44 ± 37.12 250 53.094
125 125.615 62.5 133.965 31.25 142.615 Senyawa AC-3-1 500 6.021
110.33 ± 24.45 250 6.687
125 25.615 62.5 129.641 31.25 176.747 Senyawa Siklokomunol 500 10.146
266.83 ± 108.13 250 45.276
125 87.259 62.5 120.093 31.25 150.865 Kontrol positif: 1 43.114
Doxorubicin 0.5 54.624 0.53 ± 0.05 0.25 70.858
24.46 µM. dibandingkan dengan dua senyawa lainnya. yaitu senyawa AC-5-1 dan senyawa siklokomunol. Ketiga senyawa memiliki potensi menghambat 50% proliferasi sel pada rentang konsentrasi perlakuan yang berbeda. Kemampuan konsentrasi penghambatan yang berbeda disebabkan karena keanekaragaman senyawa flavonoid dari adanya pola terprenilasi atau tergeranilasi sehingga membentuk senyawa yang lebih kompleks (Syah 2005).
Nilai IC50 yang diperoleh dituliskan nilai
standar deviasi yang menjelaskan bahwa terjadinya keragaman data. Jika nilai standar deviasi besar maka keragaman data semakin tinggi (Walpole 1993). Standar deviasi terbesar yang menandakan semakin ragamnya data pada ekstrak dilihat dari absorban (Lampiran 6) ditunjukkan oleh ekstrak etil asetat. Keragaman tersebut dapat disebabkan oleh faktor waktu inkubasi kultur sel yang kurang optimal sehingga sampel yang diujikan belum berpotensi menghambat sel T47D. Hasil sampel yang diuji jika dibandingkan dengan doxorubicin sebagai kontrol positif. senyawa AC-3-1 masih jauh seratus kalinya dari IC50 yang diperoleh
doxorubicin. yaitu 0.53 ± 0.05 µM.
Morfologi Sel Setelah Perlakuan
Berdasarkan hasil uji sitotoksik dengan uji MTT menunjukkan sel yang potensi sebagai sitotoksik adalah ekstrak heksana. ekstrak etilasetat. senyawa AC-5-1. senyawa AC3-1. dan senyawa siklokomunol. Sampel daun sukun yang berpotensi menghambat sel T47D mengakibatkan terjadinya perubahan morfologi sel dibandingkan normal. Penghambatan proliferasi sel tersebut dimungkinkan karena sel mati. baik dapat terjadi secara apoptosis maupun nekrosis. Perubahan ciri morfologi sel karena obat kanker ditunjukkan dengan sel yang mengkerut. nukleus yang rusak karena terjadinya fragmentasi DNA dan sel yang tidak beraturan dalam ukuran. Morfologi kematian sel secara nekrosis ditunjukkan dengan sel yang membengkak. rusaknya dinding sel dan lisis sampai terjadi inflamasi (Gewies 2003). Sel T47D yang diberikan perlakuan selama 24 jam dilihat morfologi selnya menggunakan mikroskop inverted pada perbesaran 10 x 10. Sel yang diambil gambarnya merupakan salah satu contoh dari tiga ulangan pada konsentrasi perlakuan 100 µg/mL untuk ekstrak. 100 µM untuk senyawa. dan 1 µM untuk doxorubicin.
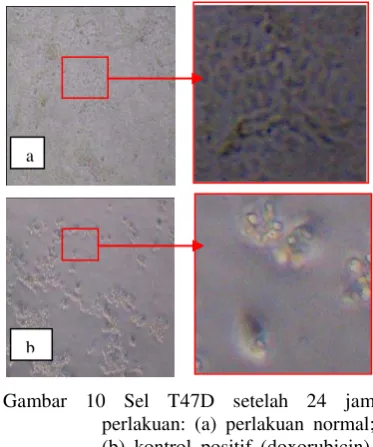
Morfologi sel normal memperlihatkan pertumbuhan yang cepat. menutupi dan menempel semua bagian permukaan tempat tumbuh (satu lapisan). serta bentuknya hampir menyerupai jaringan (Gambar 10a). Jika dibandingkan dengan doxorubicin sebagai kontrol positif memberikan perubahan morfologi sel yang sangat nyata. Hal tersebut terlihat bahwa morfologi sel yang ditunjukkan pada Gambar 10b. yaitu sel yang telah mengapung pada media tumbuh. Jika dilihat lebih dekat pada morfologi selnya yang ditunjukkan oleh tanda panah merah. terlihat bentuk sel yang tidak beraturan dan sel telah lepas dari ikatannya. Apabila dilakukan pewarnaan khusus DAPI pada sel akan terlihat bentuk sel dengan kondisi DNA yang mengalami apoptosis dan nekrosis yang ditunjukkan dengan rusaknya membran plasma (Darzynkiewicz et al. 1992).
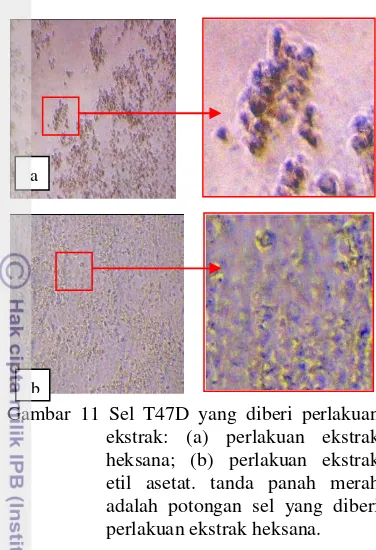
Ekstrak heksana memperlihatkan morfologi sel yang menyerupai morfologi sel dari perlakuan doxorubicin. Morfologi sel yang terjadi pada perlakuan ekstrak heksana (Gambar 11a) adalah sel yang mengapung pada media tumbuh dan terlepasnya ikatan antar sel. Bentuk sel yang tidak beraturan yang telah mengalami kematian ditunjukkan oleh panah warna merah. Ekstrak etil asetat menunjukkan perubahan yang berbeda dengan ekstrak heksana. Gambar 11b memperlihatkan morfologi sel yang sebagaian besar sel telah terlepas ikatan antar selnya. tetapi belum mengapung secara sempurna pada media
Gambar 10 Sel T47D setelah 24 jam perlakuan: (a) perlakuan normal; (b) kontrol positif (doxorubicin). tanda panah merah potongan sel normal dan sel yang diberi perlakuan kontrol positif.
a
Gambar 11 Sel T47D yang diberi perlakuan ekstrak: (a) perlakuan ekstrak heksana; (b) perlakuan ekstrak etil asetat. tanda panah merah adalah potongan sel yang diberi perlakuan ekstrak heksana. tumbuh. Bentuk sel yang ditunjukkan oleh kotak berwarna merah memperlihatkan sel dengan bentuk yang tidak beraturan seperti terjadi pengerutan membran plasma.
Morfologi sel ketiga senyawa secara visual pada perbesaran 10 x 10 memperlihatkan bentuk gambar yang hampir mirip. Senyawa AC-5-1 (Gambar 12a) menggambarkan sebagian sel yang masih hidup. ditunjukkan oleh kotak berwarna hijau. Sel hidup pada gambar masih membentuk satu lapisan. walaupun ikatan antar sel tidak padat. Lekukannya menunjukkan sel akan mulai melepaskan ikatan antar sel. Bentuk sel tidak beraturan yang ditunjukkan oleh kotak warna merah memperlihatkan sel mati.
Morfologi sel senyawa AC-3-1 memberikan perubahan morfologi yang sama dengan senyawa AC-5-1 karena senyawa flavonoid satu ini memiliki jenis dan struktur yang menyerupai senyawa AC-5-1. Perubahan yang terjadi (Gambar 12b). yaitu sebagian sel akan mengapung. terlepas ikatan dengan sel lainnya. dan bentuk membran plasma yang tidak beraturan. Ciri morfologi tersebut menjadi ciri sel mengalami kematian (kotak warna merah). Di sisi lain pada permukaan sel tumbuh terdapat morfologi sel yang membentuk satu lapisan yang menunjukkan sel masih hidup (kotak warna hijau).
Perubahan morfologi sel yang terjadi pada sel T47D yang diberi perlakuan senyawa siklokomunol (Gambar 12c) adalah dominan sel melakukan pemisahan dirinya dari sel lain. Sel yang berwarna kuning merupakan ciri sel
mengalami kematian. Perubahan morfologi sel dalam satu sumur yang tidak merata dapat disebabkan kurangnya waktu inkubasi sehingga sampel belum efektif dalam menghambat proliferasi sel T47D. Faktor ketelitian dalam pengerjaan kultur sel dapat menjadi salah satu penyebab terjadinya keragaman antar morfologi sel suatu sampel.
Gambar 12 Sel T47D yang diberi perlakuan senyawa: (a) perlakuan senyawa AC-5-1; (b) perlakuan senyawa AC-3-1; (c) perlakuan siklokomunol. tanda panah merah adalah potongan sel yang menunjukkan sel mati dan tanda panah hijau adalah sel hidup.
a
b
c a
Analisis Induksi Apoptosis
Penentuan sitotoksisitas suatu sel T47D oleh daun sukun dengan menggunakan metode MTT-assay hanya menjelaskan kemampuan sampel dalam menghambat pertumbuhan sel T47D dengan parameter nilai IC50. Perubahan morfologi sel untuk
mengetahui penghambatan yang terjadi terlihat hanya dengan bentuk sel yang mengapung pada media. sel yang telah terlepas ikatan antar selnya. dan bentuk sel yang tidak beraturan. serta mengkerut menjadi indikasi sel telah mati. Penghambatan dengan parameter nilai IC50 dan ciri perubahan
morfologi sel belum menjelaskan penyebab sel mengalami kematian yang diharapkan pada penelitian ini. yaitu sampel dapat menginduksi apoptosis. Oleh karena itu. pengujian dengan analisis flow cytometry
dilakukan untuk memberikan penjelasan kematian sel yang terjadi melalui induksi apoptosis.
Analisis siklus sel dengan flow cytometry
memperlihatkan persen populasi sel pada setiap fase yang direpresentasikan dengan histogram. Parameter yang diamati pada penelitian ini adalah persentase populasi sel di fase apoptosis (daerah H) dengan adanya kandungan DNA dari populasi sel tersebut
yang telah terfragmentasi karena proses apoptosis. Akumulasi persen populasi sel dari suatu analisis siklus sel pada flow cytometry
dihitung berdasarkan jumlah kandungan DNA yang terdeteksi dari suatu populasi sel dalam media uji. Populasi sel pada fase sub-G1 merupakan populasi sel yang memiliki kandungan DNA terfragmentasi karena adanya sampel yang bekerja menginduksi apoptosis. (Rabinovitch 1990 & Arung et al. 2009).
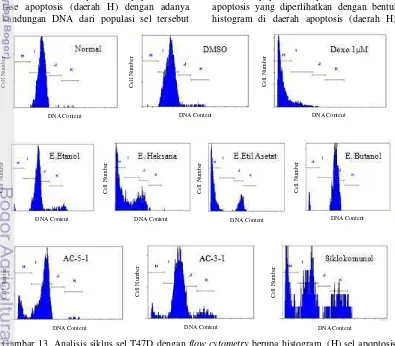
Gambar 13 memperlihatkan histogram distribusi analisis siklus sel untuk semua perlakuan dan Tabel 3 merupakan persentase distribusi siklus sel dari Gambar 13. Histogram yang ditampilkan merupakan salah satu analisis dari tiga analisis yang dilakukan pengujiannya dengan flow cytometry. Sel T47D yang diberi perlakuan normal menunjukkan akumulasi populasi sel tertinggi pada fase G1(daerah I) dengan persentase 85.93%. Hal yang sama terlihat pada kontrol negatif. DMSO yang menunjukkan tidak adanya pengaruh yang nyata terhadap normal dan sampel. Pada kontrol positif. yaitu doxorubicin menunjukkan terjadinya akumulasi populasi sel pada fase kematian apoptosis yang diperlihatkan dengan bentuk histogram di daerah apoptosis (daerah H).
Gambar 13 Analisis siklus sel T47D dengan flow cytometry berupa histogram, (H) sel apoptosis; (I) fase G1; (J) fase S; (K) fase G2/M.
DNA Content DNA Content DNA Content DNA Content DNA Content DNA Content
DNA Content DNA Content
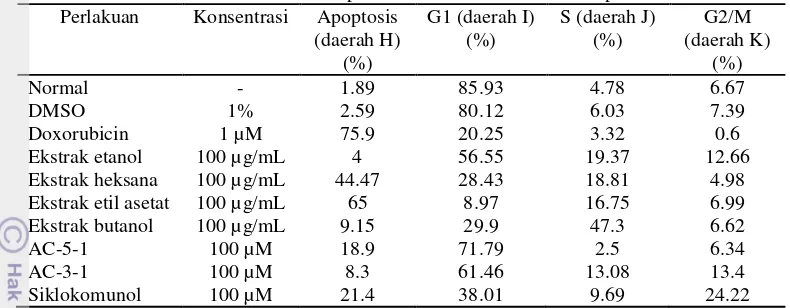
Tabel 3 Distribusi sel T47D pada fase-fase siklus sel setelah perlakuan. Perlakuan Konsentrasi Apoptosis
(daerah H) (%)
G1 (daerah I) (%)
S (daerah J) (%)
G2/M (daerah K)
(%)
Normal - 1.89 85.93 4.78 6.67
DMSO 1% 2.59 80.12 6.03 7.39
Doxorubicin 1 µM 75.9 20.25 3.32 0.6 Ekstrak etanol 100 µg/mL 4 56.55 19.37 12.66 Ekstrak heksana 100 µg/mL 44.47 28.43 18.81 4.98 Ekstrak etil asetat 100 µg/mL 65 8.97 16.75 6.99 Ekstrak butanol 100 µg/mL 9.15 29.9 47.3 6.62 AC-5-1 100 µM 18.9 71.79 2.5 6.34 AC-3-1 100 µM 8.3 61.46 13.08 13.4 Siklokomunol 100 µM 21.4 38.01 9.69 24.22 Persentase populasi sel pada saat apoptosis
untuk doxorubicin adalah 75.9%.
Sampel ekstrak daun sukun yang berpotensi dalam menginduksi apoptosis adalah ekstrak heksana dan ekstrak etil asetat. Persentase populasi sel tidak hanya terakumulasi dominan pada fase apoptosis. distribusi fase siklus sel lain pun terlihat bentuk histogramnya. Akumulasi populasi sel pada perlakuan ekstrak etanol terjadi pada fase G1 dan mengalami penurunan populasi pada fase berikutnya. Hal tersebut menunjukkan bahwa ekstrak etanol mengalami penghambatan setelah fase G1. Akumulasi populasi sel pada perlakuan ekstrak butanol terjadi pada fase S.
Perlakuan senyawa flavonoid daun sukun terhadap sel T47D mengalami akumulasi persen populasi sel terbesar pada fase G1. Potensi dalam menginduksi apoptosis dari ketiga senyawa tidak terlalu besar. Potensi apoptosis terbaik terjadi pada senyawa siklokomunol. Pada ketiga perlakuan senyawa. penyebaran populasi sel pada setiap fase tidak merata. Persen populasi mengalami peningkatan dan penurunan pada setiap tahapan fasenya. Penyebaran jumlah populasi sel pada analisis siklus sel flow cytometry
dengan perlakuan sampel daun sukun mengalami keragaman disebabkan terjadinya perbedaan pertumbuhan dan perkembangan. serta terdapatnya sistem pengontrolan
checkpoint pada fase G1. fase G2. dan fase M
(Campbell et al. 2002).
Analisis siklus sel dengan flow cytometry
yang dilakukan tiga kali ulangan untuk semua sampel pada fase apoptosis menunjukkan hasil yang berbeda signifikan dibandingkan dengan normal. Ekstrak daun sukun yang terdiri atas ekstrak etanol. ekstrak heksana. ekstrak etil asetat. dan ekstrak butanol pada konsentrasi 100 µg/mL menghasilkan
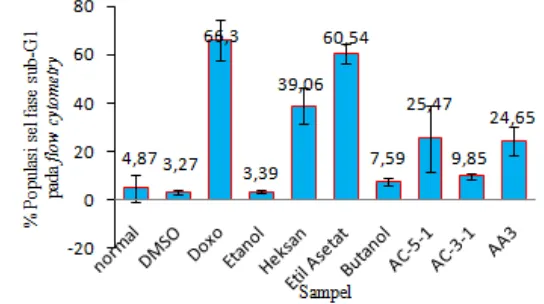
rata-rata persentase populasi sel pada fase apoptosis tertinggi diperoleh ekstrak etil asetat sebesar 60.54 ± 4.15%. Persen populasi sel yang mengalami apoptosis tertinggi untuk senyawa flavonoid daun sukun pada konsentrasi 100 µM ditunjukkan oleh senyawa AC-5-1 sebesar 25.47 ± 13.64%. Apabila dibandingkan dengan persen apoptosis kontrol positif. yaitu doxorubicin 71.49 ± 9.70%. maka ekstrak etil asetat dan senyawa AC-5-1 merupakan sampel yang berpotensi untuk menginduksi sel dalam melakukan apoptosis dan mengurangi kelangsungan hidup sel T47D (Gambar 14).
Tahapan uji dan pengamatan yang telah dilakukan menunjukkan bahwa ekstrak dan senyawa flavonoid daun sukun memiliki potensi sitotoksik melalui induksi apoptosis pada sel T47D. Ekstrak yang memiliki potensi sebagai sitotoksik melalui uji MTT adalah ekstrak heksana. Hal tersebut dibuktikan pada pengamatan morfologi sel yaitu sel yang mengapung pada media. bentuk sel yang mengkerut dan tidak beraturan yang diindikasikan sel mengalami kematian. Kematian sel secara apoptosis dengan perlakuan ekstrak heksana dilihat pada rata-rata analisis flow cytometry sebesar 39.05 ± 7.65%. Hasil terbaik analisis tersebut diperoleh oleh ekstrak etilasetat. meskipun potensi IC50 ekstrak etilasetat tidak sebaik
ekstrak heksana. Senyawa AC-3-1 merupakan senyawa yang berpotensi terbaik dalam uji sitotoksik. akan tetapi tidak memberikan hasil yang terbaik dalam persentase apoptosis pada
flow cytometry. Persentase apoptosis tertinggi
diinduksi oleh senyawa AC-5-1.
Gambar 14 Diagram batang persentase sel pada sub-G1 siklus sel. diperkirakan pertumbuhan dan
perkembangannya. Selain itu. faktor waktu inkubasi juga dapat menjadi penyebab berbedanya hasil sehingga memungkinkan kematian sel belum teramati secara keseluruhan.
Mekasinme penghambatan dan kerja dalam menginduksi apoptosis suatu sampel terhadap sel tidak lepas dari sistem pengontrolan siklus sel dan sinyal-sinyal biokimia. Mekanisme doxorubicin sebagai obat kemoterapi. yaitu adanya interaksi antara obat dan DNA dengan cara pengikatan dan penghambatan enzim topoisomerase II. Sehingga sel T47D sangat sensitif terhadap perlakuan doxorubicin karena aktivitas biologisnya. Mekanisme kerja ekstrak dan senyawa flavonoid daun sukun dimungkinkan akibat kerja dari gugus hidroksil pada senyawa fenol struktur flavonoid. Gugus hidroksil tersebut bekerja menghambat sel kanker untuk berproliferasi (Syah 2005). Struktur senyawa yang membentuk orto-dihidroksibenzena mempunyai kemampuan lebih efektif sebagai antioksidan (Middelton
et al. 2009). Struktur senyawa AC-5-1
mempunyai gugus orto-dihidroksibenzena yang membuktikan bahwa senyawa tersebut lebih potensi sebagai sitotoksik melalui induksi apoptosis dibandingkan senyawa uji lainnya. Sitotoksisitas sel T47D oleh daun sukun melalui induksi apoptosis lebih akurat dan spesifik diamati menggunakan flow
cytometry karena hasil analisis memberikan
besarnya persentase populasi sel pada setiap fase siklus sel. terutama mengamati populasi sel pada saat apoptosis (Rahman 2006).
SIMPULAN DAN SARAN
Simpulan
Ekstrak dan senyawa flavonoid daun sukun (Artocarpus altilis) mampu
menunjukkan penghambatan sel kanker payudara T47D melalui induksi apoptosis secara in vitro dengan flow cytometry. Ekstrak dan senyawa flavonoid daun sukun yang mempunyai potensi sitotoksik paling baik dalam menginduksi apoptosis pada sel kanker payudara T47D adalah ekstrak ekstrak etil asetat dan senyawa AC-5-1. hasil isolasi dari ekstrak etil asetat.
Saran
Perlu dilakukan penambahan waktu inkubasi pada saat perlakuan. agar morfologi sel teramati dengan baik. Selain itu. untuk mengetahui lebih lanjut tentang pengaruh daun sukun terhadap kejadian apoptosis pada sel T47D. sebaiknya dilakukan pengamatan pada ekspresi gen p53. Bax. dan caspase.
DAFTAR PUSTAKA
[Tribun Jabar]. 2010. Penderita kanker payudara terus bertambah. [terhubung berkala].
http://jabar.tribunnews.com/index.php/ read/artikel/19737 [10 Feb 2011]. Amalia. 2008. Uji sitotoksik ekstrak etanol
70% buah merica (Piper nigrum L.) terhadap sel heLa [skripsi]. Surakarta: Universitas Muhammadiyah Surakarta. Arung et al. 2009. Anti-cancer properties of diethylether extract of wood from sukun (Artocarpus altilis) in human breast cancer (T47D) cells. Trop J
Pharm Res 8:317-324.
Becton. 2000. Introduction To Flow
Cytometry. San Jose: BD Biosiences.
Darzynkiewicz et al. 1992. Features of apoptotic cells measured by flow cytometry. Cytometry 13:795-808. Da‟i M et al. 2007. Potensi antiproliferative
analog kurkumin pentagamavunon terhadap sel kanker payudara T47D [disertasi]. Yogyakarta: Universitas Gajah Mada.
Diananda R. 2008. Mengenal Seluk Beluk
Kanker. Yogyakarta: Katahati.
Doseff AI. 2004. Apoptosis: the sculptor of development. Stem Cells and Dev
13:473-483.
Fisher DE. 1994. Apoptosis in cancer therapy: crossing the threshold. Cell 78:539-542.
Freshney RI. 2005. Culture of Animal Cells (A Manual of Basic Technique) Fifth
Edition. New Jersey: J Willey.
Gewies A. 2003. Introduction to apoptosis.
Aporeview 1:1-26.
Hakim EH. 2007. Keanekaragaman hayati sebagai sumber keanekaragaman molekul yang unik dan potensial untuk bioindustri [laporan tahunan]. Bandung: Institut Teknologi Bandung. Heldt HW. 2005. Plant Biochemistry. Ed
ke-3. Germany: Elsevier.
Heti D. 2008. Uji sitotoksik ekstrak etanol 70% herba sisik naga (Drymoglossum
piloselloides Presl.) terhadap sel T47D
[skripsi]. Surakarta: Universitas Muhammadiyah Surakarta.
Heyne K. 1987. Tumbuhan berguna Indonesia II. Jakarta: Departemen Kehutanan Republik Indonesia.
Indraswati D. 2009. Ekstraksi dan fraksinasi daun sukun (Artocarpus altilis). [laporan program latihan akademik]. Bandung: Universitas Pendidikan Indonesia.
Koswara S. 2006. Sukun sebagai cadangan pangan alternatif. [terhubung berkala]. http://ebookpangan.com. [10 Feb 2011].
Kristyowati AD. 2009. Uji sitotoksik ekstrak kloroform herba bandotan terhadap sel T47D dan profil kromatografi lapis tipis [skripsi]. Surakarta: Universitas Muhammadiyah Surakarta.
Kumala et al. 2010. Sinergisme fraksi butanol metabolit sekunder kapang
endofit 1.3.11 dengan doxorubicin dalam modulasi daur sel T47D dan MCF-7. Jurnal Ilmu Kefarmasian
Indonesia 8:1-9.
Lankelma J et al .1999. Doxorubicin gradients in human breast cancer. Clin Can Res
5:1703-1707.
Lotulung P et al. 2008. Identification of cytotoxic compound from Artocarpus
communis leavesa against P-388 cells.
Pak J Bio Sci 1:1-4.
Meiyanto et al. 2007. Penghambatan karsinogenesis kanker payudara tikus terinduksi DMBA pada fase post inisiasi oleh ekstrak etanolik daun
Gynura procumbens (Lour). Merr.
Majalah Farmasi Indonesia
18:169-175.
Mentari D. 2010. Ekspresi p53 mutan pada sel kanker payudara T47D pemberian asam laurat dari Virgin Coconut Oil
(VCO). [terhubung berkala]. http://etd.eprints.ums.ac.id/8989/1/K10 0060021.pdf. [28 Mei 2011].
Middleton et al. 2000. The effects of plant flavonoids on mammalian cells: implications for inflammation. heart disease. and cancer. Pharm Rev
52:673-751.
Mulyati S. 2009. Isolasi dan karakterisasi siklokomunol dari daun sukun
(Artocarpus Altilis) [skripsi].
Sukabumi: Universitas Muhammadiyah Sukabumi.
Mustafa AM. 1998. Budidaya Sukun. Jakarta: Universitas Terbuka.
Rabinovitch PS. 1990. Introduction of Cell
Cycle Analysis. San Diego: Phoenix
Flow System.
Silalahi J. 2006. Antioksidan dalam diet dan karsinogenesis. Cermin Dunia
Kedokteran 153:39-42.
Sukardiman et al. 2006. Aktivitas antikanker dan induksi apoptosis ekstrak kloroform daun pepaya (Carica
papaya L) terhadap kultur sel kanker
mieloma. Media Kedokteran Hewan
22:104-111.
Syah YM. 2005. Fitokimia. kemotaksonomi. dan sifat biologis metabolit sekunder dari tanaman sukun (Kelewih). Bull
Syah YM et al. 2006. Dua flavonoid tergrenilasi dari daun sukun (A.altilis).
Jurnal Matematika & Sains
11:100-104.
Syaifudin M. 2007. Gen penekan tumor p53. kanker dan radiasi pengion. IPTEK Ilmiah Populer. Bul Ala 8:119-128. Walpole RE. 1993. Pengantar Statistika. Ed
ke-3. Sumantri B. penerjemah. Jakarta: Gramedia Pustaka Utama.
Wang et al. 2007. Geranyl flavonoids from the leaves of Artocarpus altilis.
Phytochemistry 68:1300-1306.