ADELIA RAHMAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa Tesis Seleksi Pektinase
Trichoderma sp. untuk Meningkatkan Kualitas Teh Hitam adalah karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2012
Adelia Rahmah
ADELIA RAHMAH. Selection of Pectinase Producing Trichoderma sp. to Improve the Quality of Tea Leaves Fermentation. Under supervision of ANJA MERYANDINI and YOPI.
Trichoderma spp. are one of the source to produce pectinolytic enzymes. Pectinolytic enzyme has an important role to breakdown pectin molecule of plant cell wall, which is very important in fermentation stage. The fungus was selected after primary screening of 44 isolates and named T.005, T.058 and T.066. This study was aimed to obtain pectinolytic enzyme from Trichoderma spp. which belong to Biotechnology Culture Collection (BTCC) LIPI. The best isolate was applied to improve fermentation of black tea. T.066 appears to be the best isolate which produced highest pectinase activity of 0,1723 UmL-1 followed by T.058 of 0,126 UmL-1 and T.005 of 0,105 UmL-1. Highest activity of pectinolytic enzyme from T.066 resulted in buffer pH 5 and 40 0C. Different enzyme activity from T.066: 0,086 UmL-1, 0,172 UmL-1 and 0,258 UmL-1 was added to fermentation of black tea. Crude enzyme of 0,258 UmL-1 enhance the Teaflavin (TF) component of black tea by 31,25% and Total Liquor Color (TLC) by 12,92%. Meanwhile crude enzyme of 0,172 UmL-1 improving Tearubigin (TR) component by 16,86% and High Polymerized Substance (HPS) by 19,72%.
ADELIA RAHMAH. Seleksi Pektinase Trichoderma sp. untuk Meningkatkan Kualitas Teh Hitam. Dibimbing oleh Anja Meryandini dan Yopi.
Teh merupakan minuman yang banyak dikonsumsi masyarakat dunia. Minuman ini memiliki kandungan katekin yang tinggi. Katekin adalah antioksidan utama yang ditemukan dalam teh. Salah satu manfaat antioksidan adalah menangkal radikal bebas. Seiring dengan perubahan gaya hidup masyarakat perkotaan modern yang serba instan serta pengaruh polusi udara, kesadaran akan pentingnya manfaat antioksidan semakin meningkat. Dengan kandungan katekin 25-30% total berat kering, teh diakui sebagai minuman antioksidan yang mudah diperoleh dan sudah cukup komersil.
Berdasarkan proses pengolahannya teh terbagi menjadi tiga yaitu teh hijau, teh oolong, dan teh hitam. Perbedaan dasar di antara ketiganya yaitu pada proses fermentasi. Teh hijau diolah tanpa melalui proses fermentasi, teh oolong mengalami semi-fermentasi sedangkan teh hitam mengalami fermentasi sempurna. Pada proses pengolahan teh hitam, proses penggilingan merupakan proses awal terjadinya reaksi oksimatis yaitu bertemunya polifenol dan enzim polifenol oksidase dengan bantuan oksigen. Penggilingan akan mengakibatkan dinding sel pada daun teh menjadi rusak sehingga cairan sel akan keluar. Selama proses ini berlangsung, katekin akan diubah menjadi theaflavin dan thearubigin yang merupakan komponen penting baik terhadap warna, rasa maupun aroma seduhan teh hitam.
Pektinase adalah enzim yang membantu merombak pektin pada dinding sel sehingga proses penggilingan dan fermentasi dapat berlangsung cepat. Salah satu kapang penghasil pektinase adalah Trichoderma sp.. Biotechnology Culture Collection LIPI telah mengkoleksi isolat ini dari wilayah Indonesia. Uji kualitatif aktivitas pektinase dilakukan dengan mengukur indeks pektinolitik yang dihasilkan kapang pada media agar-agar yang mengandung substrat pektin. Isolat T.005, T.058, dan T.066 adalah isolat dengan indeks pektinolitik tertinggi masing-masing sebesar 2, 3 dan 4,8. Uji kuantitatif yang dilakukan terhadap aktivitas pektinase yang dihasilkan tiga isolat tersebut menghasilkan isolat T.066 sebagai penghasil aktivitas pektinase tertinggi pada hari ketujuh produksi dengan aktivitas sebesar 0,172 UmL-1. Aktivitas enzim ini tertinggi pada pH 5 dan suhu 40 0C.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
ADELIA RAHMAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Puji Syukur kepada Allah SWT atas Rahmat dan KaruniaNya sehingga tesis yang berjudul “Seleksi Pektinase Trichoderma sp. untuk Meningkatkan Kualitas Teh Hitam” ini dapat diselesaikan.
Penulis mengucapkan terima kasih dan penghargaan yang tinggi kepada
Ibu Prof. Dr. Anja Meryandini selaku ketua komisi pembimbing yang telah
memberikan bimbingan dan perhatian penuh dalam penulisan tesis. Ucapan terima
kasih dan penghargaan yang tinggi juga disampaikan kepada Bapak Dr. Yopi
selaku anggota komisi pembimbing yang telah memberikan kesempatan kepada
penulis untuk melakukan penelitian dan bimbingan selama penelitian, kepada Ibu
Nanik Rahmani M.Si. atas saran dan bimbingan selama penelitian. Tidak lupa
penulis mengucapkan terima kasih kepada Bapak Prof. Dr. Ir. Suharsono, DEA.
sebagai ketua Program Studi Bioteknologi dan Ibu Dr. Nisa Rachmania Mubarik
M.Si. selaku dosen penguji ujian tesis yang telah memberikan saran dan masukan
terhadap penulisan untuk kesempurnaan tesis ini. Disamping itu penulis juga
menyampaikan terima kasih kepada Lembaga Ilmu Pengetahuan Indonesia (LIPI)
yang telah membiayai dan memberikan segala fasilitas kepada penulis untuk
melakukan penelitian di Laboratorium Biokatalis dan Fermentasi Pusat Penelitian
Bioteknologi, LIPI Cibinong.
Ucapan terima kasih yang sangat mendalam kepada kedua orangtua
tercinta Ayahanda H. Zainal Abidin dan Ibunda Hj. Shalfida atas doa dan kasih
sayang tulus yang telah mereka berikan kepada anak-anaknya. Saudara ku the one and only Uni Defiza serta Kakanda Refvly Sihombing atas doa dan semangat yang terus mengalir. Terima kasih kepada rekan-rekan di Laboratorium Biokatalis
dan Fermentasi Ade Andriani S.Si., Ashif Irvan Yusuf S.Pt., Roida Ervina
Sinaga SP., Wahyu Wida Sari M.Sc., Alex Pratama S.Si. dan Dicky Wahyudi atas
bantuan selama penelitian serta rekan-rekan Pascasarjana Bioteknologi 2009 atas
kebersamaan dan persahabatan selama penulis menuntut ilmu di Institut Pertanian
Bogor, Juni 2012
Penulis dilahirkan di Bukittinggi pada tanggal 26 Desember 1984 dari
Ayah Zainal Abidin dan Ibu Shalfida. Penulis merupakan anak kedua dari dua
bersaudara.
Tahun 2003 penulis lulus dari SMU Negeri 1 Padang dan pada tahun yang
sama lulus Seleksi Penerimaan Mahasiswa Baru Universitas Andalas. Penulis
diterima di Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam
dan menyelesaikan studi pada tahun 2008. Tahun 2009 penulis melanjutkan studi
di Sekolah Pascasarjana Institut Pertanian Bogor pada program studi
Halaman
Uji Kualitatif Isolat Penghasil Pektinase ... 17
Penentuan Waktu Produksi Tertinggi Enzim Pektinase ... 18
Produksi Enzim Pektinase ... 19
Pengaruh Suhu dan pH ... 19
Pemanfaatan Enzim Pektinase Ekstrak Kasar pada Fermentasi Teh ... 20
Analisis Parameter Kualitas Teh Hitam: Theaflavin, Tearubigin, High Polimerized Substance dan Total Liquor Colour ... 20
HASIL DAN PEMBAHASAN Analisis Kualitatif Isolat Trichoderma sp. Penghasil Pektinase ... 23
Analisis Kuantitatif Isolat Penghasil Pektinase ... 24
Optimasi Waktu Produksi Isolat Penghasil Pektinase ... 25
Optimasi pH ... 27
Optimasi Suhu ... 28
Produksi Pektinase Trichoderma sp. dan Fermentasi Teh ... 29
DAFTAR PUSTAKA ... 35
Halaman
1 Senyawa bioaktif penyusun daun teh ... 7
2 Berat molekul pektin dari substrat yang berbeda ... 9
3 Komposisi pektin dari sayuran dan buah-buahan ... 10
4 Klasifikasi enzim pektinolitik ... 13
5 Indeks pektinolitik yang dihasilkan berbagai jenis isolat Trichoderma sp. pada media PSAM ... 23
Halaman
1 Tanaman teh varietas sinensis dan assamica ... 5
2 Struktur epikatekin, epigalokatekin, epikatekin galat, dan
epigalokatekin galat ... 8
3 Struktur dasar molekul pektin ... 11
4 Tipe pektinase berdasarkan mekanisme pemotongan pektin ... 12
5 Visualisasi Trichoderma sp. secara makroskopis dan mikroskopis. 14
6 Indeks pektinolitik tertinggi yang dihasilkan Trichoderma spp. .... 24
7 Kurva produksi enzim pektinase yang dihasilkan tiga isolat
Trichoderma spp. pada suhu 30 0C dan pH 5,8 ... 26
8 Pengaruh pH terhadap aktivitas pektinase Trichoderma sp.
isolat T.066 pada suhu ruang ... 27
9 Pengaruh suhu terhadap aktivitas pektinase Trichoderma sp.
isolat T.066 dilakukan pada pH 5 ... 28
10 Daun teh sebelum fermentasi, ketika fermentasi dan setelah
Halaman
1 Prosedur pembuatan media dan reagen yang digunakan
dalam penelitian ... 41
2 Kurva standar asam galakturonat... 43
3 Hasil uji aktivitas pektinase isolat T.066 ... 45
4 Analisis komponen teh hitam ... 45
PENDAHULUAN
Latar Belakang
Teh adalah salah satu bahan minuman alami yang sangat populer di
masyarakat. Minuman ini dibuat dengan cara menyeduh daun, pucuk daun atau
tangkai daun yang dikeringkan dari tanaman Camelia sinensis dengan air panas. Kandungan flavonoid dalam teh merupakan antioksidan yang bersifat
antikarsinogenik, kariostatik serta hipokolesterolemik (Tuminah 2004).
Saat ini tanaman teh ditemukan di lebih dari 30 negara di dunia. Salah
satunya adalah Indonesia yang merupakan negara penghasil teh ke-4 terbesar di
dunia setelah India, Cina, dan Jepang. Tanaman teh Indonesia berbeda dengan
Cina dan Jepang dalam hal varietas tehnya. Tanaman teh yang tumbuh di
Indonesia adalah Camellia sinensis var assamica, sedangkan tanaman teh yang tumbuh di Cina dan Jepang adalah Camellia sinensis var sinensis. Salah satu kelebihan varietas assamica ini adalah kandungan polifenolnya yang tinggi
(Andrianis 2009).
Teh merupakan minuman universal yang dikonsumsi berbagai lapisan
masyarakat di berbagai negara. Teh hitam diproduksi oleh lebih dari 75% negara
di dunia sedangkan teh hijau diproduksi oleh sekitar 22% negara di dunia. Seiring
dengan perubahan gaya hidup masyarakat perkotaan modern yang serba instan
serta pengaruh polusi udara, kesadaran akan pentingnya manfaat antioksidan
semakin meningkat. Oleh sebab itu kebutuhan konsumen akan teh sebagai
minuman yang mengandung antioksidan juga meningkat. Tingginya permintaan
konsumen menyebabkan industri dan kajian terapetik tanaman teh juga
berkembang pesat.
Teh memiliki kandungan polifenol yang tinggi yaitu sekitar 25-30% dari
total berat kering. Polifenol merupakan senyawa bioaktif penting karena
mengandung flavonoid yang merupakan sumber antioksidan utama. Flavonoid
secara alami ditemukan pada sayuran, buah-buahan, minuman anggur dan teh.
Flavonoid utama dalam teh adalah katekin. Kandungan katekin dalam teh dapat
EGCG merupakan antioksidan kuat dengan kekuatan 100 kali lebih efektif dari
vitamin C dan 25 kali lebih efektif dari vitamin E (Muchtar & Ahmad 2000). Teh
hitam memiliki kandungan katekin yang lebih sedikit karena hilang selama proses
fermentasi. Teh hijau mengandung katekin lebih tinggi disebabkan karena tidak
dilakukan fermentasi sebelumnya. Minuman teh juga mengandung kafein,
karbohidrat, asam amino, antocyanidin, vitamin dan mineral dalam jumlah sedikit
(Harold & Graham 1992).
Pengolahan teh meliputi lima proses utama yaitu pelayuan, penggilingan,
fermentasi, pengeringan dan pengemasan. Tahap fermentasi merupakan tahapan
penting dalam menentukan rasa dan kualitas teh (Wang et al. 2008). Selama proses fermentasi, katekin teh mengalami oksidasi menjadi ortokuinon yang
memadat membentuk theaflavin (TF). Senyawa ini bertanggung jawab terhadap
kekentalan, kejernihan, dan kualitas teh. Senyawa TF bertindak sebagai agen
oksidasi pada substansi seperti asam galat menjadi thearubigin (TR). Thearubigin
berperan dalam menentukan rasa dan aroma dari minuman teh (Hafezi et al. 2006; Kim et al. 2011; Obanda et al. 2004). Keseimbangan kandungan TF dan TR dalam teh akan menghasilkan minuman dengan warna, rasa, kekentalan dan
aroma teh terbaik.
Kualitas teh yang diproduksi oleh India dan Cina lebih baik daripada
kualitas teh di Indonesia. Hal ini disebabkan salah satunya oleh tingginya biaya
produksi untuk meningkatkan kualitas teh tersebut (PPTK 2011). Tanaman teh di
Indonesia mempunyai tekstur yang lebih keras. Selain dipengaruhi oleh faktor
varietasnya, kualitas teh yang dihasilkan juga dipengaruhi oleh metoda berkebun
yang mengadaptasi teknologi organik sehingga daun teh memiliki warna yang
lebih pekat dengan kandungan biopolimer yang cukup tinggi diantaranya adalah
pektin.
Pektin merupakan kompleks makromolekul glikosidik yang penyusun
utamanya adalah polimer asam D-galakturonat dengan ikatan α-1,4-glikosidik,
dimana polisakarida utama penyusun pektin terdiri atas homogalacturonan (HG),
rhamnogalacturonan I (RGI) dan rhamnogalacturonan II (RGII). Maserasi pada proses penggilingan tidak cukup membuat sel terpecah sempurna sehingga proses
selama fermentasi akan membantu lisis dinding sel sehingga proses oksidasi dapat
ditingkatkan (Angayarkanni et al. 2002).
Pektinase terdapat secara alami pada organisme dan telah banyak diisolasi
dari fungi seperti Aspergillus indicus, A. flavus, A. niveus (Angayarkanni
et al. 2002), A. fumigatus (Phutela et al. 2005), Trichoderma viridae, Penicillium sp. (Kutateladze et al. 2009) dan dari bakteri seperti Erwinia carotovora, E. crysanthemi (Sittidilokratna et al. 2007), Bacillus sphaericus
(Jayani et al. 2010).
Enzim pektinase banyak dimanfaatkan untuk industri seperti industri
pembuatan kertas, penjernihan jus dan minuman dari buah-buahan serta untuk
industri tekstil (Sittidilokratna et al. 2007). Namun informasi mengenai aplikasi enzim pektinase pada fermentasi teh masih terbatas, sehingga merupakan peluang
yang baik untuk diteliti.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan enzim pektinase yang
diperoleh dari isolat Trichoderma sp. asal Indonesia koleksi Biotechnology Culture Collection (BTCC), LIPI sehingga dapat dimanfaatkan untuk membantu proses fermentasi daun teh.
Manfaat Penelitian
Dari penelitian ini diharapkan dapat diperoleh enzim pektinase dari isolat
TINJAUAN PUSTAKA
Minuman Teh dari Tanaman Camellia sinensis L.
Teh adalah suatu minuman yang diseduh dari daun muda (pucuk daun)
tanaman Camellia sinensis L. Tanaman ini dijumpai di lebih dari 30 negara. Secara botanis terdapat 2 jenis teh yaitu Camellia sinensis var. sinensis dan
Camellia sinensis var. assamica (Gambar 1). C.sinensis var. sinensis ditandai dengan ciri-ciri tumbuhnya lambat, jarak cabang dengan tanah sangat dekat,
daunnya kecil, pendek, ujungnya agak tumpul dan berwarna hijau muda.
C. sinensis var. assamica mempunyai ciri-ciri tumbuh cepat, cabang agak jauh dari permukaan tanah, daunnya lebar, panjang dan ujungnya runcing serta
berwarna hijau mengkilat, memiliki struktur batang yang lebih kokoh dan kuat
(Andrianis 2009).
Gambar 1 Tanaman teh varietas sinensis (kiri) dan assamica (kanan).
Varietas tanaman teh yang banyak ditanam di Indonesia yaitu C. sinensis
var. assamica (PPTK 2011). Taksonomi dari tanaman teh adalah sebagai berikut.
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledoneae
Sub kelas : Dialypetalae
Ordo : Guttiferales (Clusiales) Familia : Camelliaceae (Theaceae) Genus : Camellia
Spesies : Camellia sinensis
Beberapa jenis produk teh dihasilkan melalui berbagai cara pengolahan.
Daun teh akan segera layu dan mengalami oksidasi jika tidak segera dikeringkan
setelah dipetik. Proses pengeringan membuat daun menjadi berwarna gelap,
karena terjadi pemecahan klorofil dan terlepasnya unsur tanin. Proses selanjutnya
berupa pemanasan basah dengan uap panas agar kandungan air pada daun
menguap dan proses oksidasi bisa dihentikan pada tahap yang sudah ditentukan.
Pengolahan teh tidak menggunakan ragi tetapi terjadi secara alami. Pengolahan
teh yang tidak tepat dapat menyebabkan teh ditumbuhi jamur yang mengakibatkan
terjadinya proses fermentasi. Teh yang sudah mengalami fermentasi dengan jamur
harus dibuang, karena mengandung unsur racun dan bersifat karsinogenik
(Harold & Graham 1992).
Berdasarkan cara pengolahannya, teh dapat dikelompokkan menjadi tiga
yaitu teh fermentasi (teh hitam), teh semi fermentasi (teh oolong dan teh
pouchong) serta teh tanpa fermentasi (teh hijau). Secara umum, pengolahan teh
dengan fermentasi dapat dikategorikan dalam dua sistem, yaitu sistem ortodoks
dan sistem baru. Sistem baru dalam pengolahan teh dibagi menjadi dua yaitu CTC
(Crushing-Tearing-Curling) dan LTP (Lowrie Tea Processor). Meski sistem yang digunakan berbeda, secara prinsip proses pengolahannya tidaklah jauh berbeda.
Daun dilayukan dan kemudian digulung dengan alat pemutar OTR (Open Top Roller), kemudian dihamparkan ke udara agar teroksidasi. Daun kemudian dikeringkan dengan udara panas, dan dihasilkan teh hitam (Andrianis 2009).
Berdasarkan potensi aktivitas kesehatan yang paling baik, teh hijau lebih
baik dibandingkan dengan jenis lainnya. Pada teh hijau, katekin yang merupakan
komponen bioaktif yang terdapat di daun tetap dipertahankan jumlahnya dengan
menginaktivasi enzim polifenol oksidase baik melalui pelayuan ataupun
pemanasan tanpa proses fermentasi. Pada proses ini katekin dioksidasi menjadi
senyawa orthokuinon, bisflavanol, theaflavin dan thearubigin. Pengolahan teh
hijau di Indonesia menganut serangkaian proses fisik dan mekanis tanpa atau
sedikit mengalami proses fermentasi terhadap daun teh melalui sistem
panning/sangrai. Posisi teh oolong berada diantara teh hijau dan teh hitam
teh ini hanya berlangsung sebentar dan cepat sebelum dan sesudah penggulungan
(Andrianis 2009).
Tabel 1 Senyawa bioaktif penyusun daun teh
Kandungan ( %) Berat kering Kontribusi
Polifenol Total 25 – 30 Sepat
(Xiamen FML Exp&Imp Co. Ltd. 2001)
Daun teh memiliki senyawa bioaktif yang kompleks (Tabel 1) salah satunya
Katekin merupakan senyawa dominan dari polifenol teh hijau dan terdiri atas
epikatekin (EC), epikatekin galat (ECG), epigalokatekin (EGC), epigalokatekin
galat (EGCG) (Gambar 2) (Harold & Graham 1992; Angayarkanni et al. 2002; Wang 2002; Wang et al. 2008).
Epikatekin Epigalokatekin
Epikatekin galat Epigalokatekin galat
Gambar 2 Struktur epikatekin, epigalokatekin, epikatekin galat, dan Epigallokatekin galat (Kashyap et al. 2001; Jayani et al. 2005).
Selain katekin yang merupakan senyawa flavonoid, teh juga mengandung
senyawa flavonol seperti kuersetin, kaempferol, dan mirisetin. Sekitar 2-3%
bagian teh yang larut dalam air merupakan senyawa flavonol (Harold & Graham
1992). Senyawa flavonoid dapat meningkatkan asam askorbat pada beberapa
proses metabolisme, menurunkan kadar kolesterol total dan LDL, serta efektif
mencegah virus influenza A dan B dalam masa kontak yang pendek. Pemberian
ekstrak teh hijau pada mencit yang menderita tumor kulit ternyata secara
substansial dapat memperkecil ukuran tumor meskipun belum dapat menurunkan
jumlahnya, bersifat anti karsinogenik terhadap hewan dan manusia termasuk
wanita post menopause dimana flavonoid dapat bersifat estrogenik (Tuminah
2004). Seduhan teh 10x dosis manusia (0,54 g/200 g bb/hari) dapat menurunkan
total kolesterol dan LDL tikus putih yang diberi diet kuning telur dan sukrosa
bb/hari) menunjukkan efek hipoglikemik pada tikus putih setelah 30 dan 60 menit
perlakuan (Sutarmaji 1994).
Senyawa utama yang dikandung teh adalah katekin, yaitu suatu turunan
tanin terkondensasi yang juga dikenal sebagai senyawa polifenol karena
banyaknya gugus fungsional hidroksil yang dimilikinya. Selain itu, teh juga
mengandung kafein yang bersama-sama dengan katekin teh akan membentuk rasa
yang menyegarkan. Beberapa vitamin yang dikandung teh di antaranya ialah
vitamin C, vitamin B, dan vitamin A yang diduga akan menurun kadarnya akibat
pengolahan, namun masih dapat dimanfaatkan oleh peminumnya. Beberapa jenis
mineral juga terkandung dalam teh, terutama fluorida yang dapat memperkuat
struktur gigi (Harold & Graham 1992).
Pektin dan Pektinase
Pektin adalah kompleks makromolekul yang ditemukan pada tanaman
tingkat tinggi. Pektin ikut menyusun dinding sel primer tanaman dan juga sebagai
komponen utama dari lamella tengah (Pedrolli et al. 2009). Didalam sel, pektin berupa kalsium pektat dan magnesium pektat dengan jumlah 0,5-4,0% dari berat
segar daun. Berbeda dengan protein, lemak dan asam nukleat yang memiliki berat
melokul tetap, pektin memiliki berat molekul yang berbeda-beda tergantung
sumbernya. Berat molekul pektin bervariasi (Tabel 2) dari 25 kDa hingga 360
kDa
Tabel 2 Berat molekul pektin dari substrat yang berbeda (Jayani et al. 2005)
Sumber Berat molekul (kDa) α-1,4 glikosidik. Rantai samping dari pektin terdiri atas rhamnosa, arabinosa,
kokoh. Selain itu, pektin juga berperan dalam pematangan buah. Secara alami
pektin banyak dijumpai pada buah-buahan, sayuran, dan teh (Tabel 3).
Tabel 3 Komposisi pektin dari sayuran dan buah-buahan (Jayani et al. 2005)
Sayuran/ buah-buahan Jenis sampel Pektin (%)
Apel penyusun utama asam galakturonat pada pektin terbagi 4 yaitu:
1. Protopektin: merupakan substrat pektin tidak larut air yang ditemukan
pada jaringan tanaman. Pada kondisi hidrolisis terbatas akan menghasilkan
pektin atau asam pektat.
2. Asam pektat: merupakan polimer galakturonan yang larut air dan
mengandung gugus metoksil.
3. Asam pektinat: merupakan rantai poligalakturonan dengan kandungan
galakturonat metilasi kurang dari 75% serta dapat membentuk gel jika
bereaksi dengan gula atau asam.
4. Pektin: merupakan rantai poligalakturonan dengan komposisi 75% gugus
karboksil pada galakturonat teresterifikasi dengan metanol. Tipe ini
memberikan rigiditas terhadap dinding sel tanaman ketika berikatan dengan
selulosa karena membentuk ikatan yang tidak larut air seperti halnya
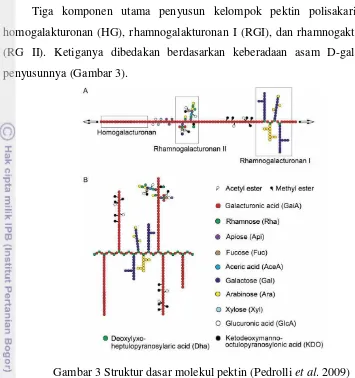
Tiga komponen utama penyusun kelompok pektin polisakarida yaitu
homogalakturonan (HG), rhamnogalakturonan I (RGI), dan rhamnogakturonan II
(RG II). Ketiganya dibedakan berdasarkan keberadaan asam D-galakturonat
penyusunnya (Gambar 3).
Gambar 3 Struktur dasar molekul pektin (Pedrolli et al. 2009)
Homogalakturonan adalah polimer tunggal yang dibentuk oleh asam
D-galakturonat yang dapat dimetilasi atau diesterifikasi. Rhamnogalakturonan I
adalah molekul yang terdiri atas pengulangan asam rhamnose-galakturonat
disakarida. Selain itu, homogalakturonan juga tersusun atas rantai samping
galaktosa, arabinosa, dan xilosa. Rhamnogalakturonan II adalah rantai
homogalakturonan dengan rantai samping kompleks yang melekat pada rantai
utama asam galakturonat (Pedrolli et al. 2009).
Enzim adalah katalis biologi yang dapat mempercepat reaksi namun tidak
berubah hingga akhir reaksi. Salah satu mekanisme kerja enzim adalah dengan
memecah substrat menjadi satu atau beberapa produk. Substrat untuk suatu enzim
Pektinase adalah enzim yang mempunyai kemampuan merombak substrat
pektin melalui reaksi depolimerisasi (hidrolase dan liase) dan reaksi diesterifikasi
(esterease). Enzim ini tergabung dalam kelompok hidrolase yang banyak dijumpai
pada tanaman dan mikroorganisme (Glazer & Nikaido 2007).
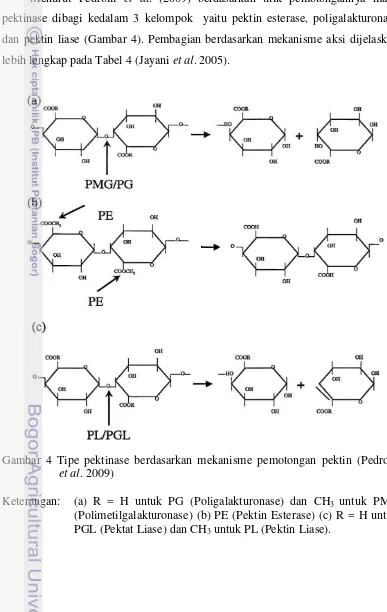
Menurut Pedrolli et al. (2009) berdasarkan titik pemotongannya maka pektinase dibagi kedalam 3 kelompok yaitu pektin esterase, poligalakturonase
dan pektin liase (Gambar 4). Pembagian berdasarkan mekanisme aksi dijelaskan
lebih lengkap pada Tabel 4 (Jayani et al. 2005).
Gambar 4 Tipe pektinase berdasarkan mekanisme pemotongan pektin (Pedrolli
et al. 2009)
Pektin esterase terbagi menjadi pektin metil esterase dan pektin asetil
esterase. Poligalakturonase terbagi menjadi polimetilgalakturonase dan
poligalakturonase. Pektin liase terbagi menjadi pektat liase dan pektin liase.
Pektin metil esterase mengkatalis esterifikasi grup metoksil sehingga
menghasilkan asam pektat dan metanol. Pektin asetil esterase menghidrolisis
asetil ester membentuk asam pektat dan asetat. Polimetilgalakturonase memotong ikatan α-1,4-glikosidik membentuk 6-metil-D-galakturonat. Poligalakturonase menghidrolisis ikatan α-1,4-glikosidik membentuk D-galakturonat. Pektat liase memotong ikatan glikosidik dari asam poligalakturonat membentuk
4,5-D-galakturonat melalui reaksi transeliminasi. Pektin liase memotong ikatan
glikosidik dari pektin terutama pektin teresterifikasi tinggi membentuk metil
oligogalakturonat (Pedrolli et al. 2009).
Tabel 4 Klasifikasi enzim pektinolitik (Jayani et al. 2005)
Pektinase berperan dalam proses ekstensi dinding sel tanaman, melunakkan
jaringan tanaman pada proses pemasakan dan penyimpanan, juga berperan dalam
degradasi material-material tanaman yang telah membusuk sehingga membantu
menjaga keseimbangan ekologi (Jayani et al. 2005). Enzim pektinase yang diproduksi dari mikroorganisme memenuhi 25% dari total produksi enzim yang
digunakan untuk industri makanan. Pektinase yang digunakan bersumber dari
fungi diantaranya ialah Aspergillus niger (Naidu & Panda 1998; Jayani et al.
2005), Aspergillus fumigatus (Phutella et al. 2005), Trichoderma viridae
(Kutateladze et al. 2009), Fusarium sp., Penicillum chrysogenum, dan
Trichoderma sp. (Okafor et al. 2010).
Industri makanan dan minuman telah lama memanfaatkan enzim pektinase
dalam proses produksi. Diantaranya adalah dalam industri penjernihan minuman
jus dan anggur, fermentasi teh dan kopi (Kashyap et al. 2001), meningkatkan mutu dan rendemen jus mangga kuini (Iriani et al. 2005). Pektinase juga banyak digunakan bersamaan dengan enzim lain seperti dalam industri tekstil untuk
menghilangkan racun dari soda yang digunakan pada proses pencucian kain,
bleaching pada industri kertas, industri makanan hewan peliharaan, serta ekstraksi minyak (Jayani et al. 2005).
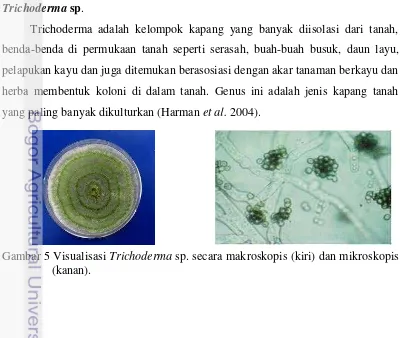
Trichoderma sp.
Trichoderma adalah kelompok kapang yang banyak diisolasi dari tanah,
benda-benda di permukaan tanah seperti serasah, buah-buah busuk, daun layu,
pelapukan kayu dan juga ditemukan berasosiasi dengan akar tanaman berkayu dan
herba membentuk koloni di dalam tanah. Genus ini adalah jenis kapang tanah
yang paling banyak dikulturkan (Harman et al. 2004).
Secara makroskopis, genus ini mempunyai koloni berwarna putih keabuan dengan permukaan yang halus dan warna konidia hijau keputihan sampai hijau
terang bervariasi tergantung spesies (Gambar 5). Hifa bersekat, dinding licin
dengan ukuran 1,5-12 µm, dan percabangan membentuk sudut siku-siku dengan
percabangan utama (Barnet & Hunter 1972; Samuels 1996).
Taksonomi kapang ini adalah:
Genus ini telah lama dikenal sejak tahun 1920-an sebagai agen biokontrol
hayati yang mampu menghambat perkembangan patogen tanaman. Penelitian
tentang peranan kapang ini sebagai agen biokontrol hayati terus berkembang
hingga diketahui mekanismenya dalam menyerang patogen seperti
mikoparasitisme, antibiosis, serta kompetisi ruang dan nutrisi (Chet et al. 2006; Harman 2006; Sharma et al. 2011). Selain menangkis patogen yang menyerang tanaman, kapang ini juga mampu meningkatkan resistensi tanaman terhadap
patogen dan meningkatkan kemampuan akar menyerap nutrisi sehingga
pertumbuhan dan perkembangan tanaman juga meningkat (Harman et al. 2004; Harman 2006; Rahmah 2008).
Trichoderma juga diketahui menghasilkan metabolit sekunder berupa antibiotik trichodermin, suzukalin, dan alamotisin serta enzim β-1,3-glukonase dan kitinase yang mampu mendegradasi dinding sel patogen (Nurbailis 2007).
Oleh sebab itu, eksplorasi tentang Trichoderma terus meningkat sehubungan
dengan kemampuannya memproduksi enzim.
xilanase dan pektinase. Okafor et al. (2010) juga melaporkan bahwa
Trichoderma sp. yang diproduksi dalam limbah pertanian mampu menghasilkan enzim pektinase dan selulase.
Informasi pemanfaatan pektinase yang bersumber dari Trichoderma dalam industri makanan dan minuman masih sangat sedikit namun di bidang industri lain
seperti industri tekstil untuk menghilangkan racun soda akibat proses pencucian,
industri makanan hewan peliharaan, industri kertas dan ekstraksi minyak telah
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Biokatalis dan Fermentasi, Pusat
Penelitian Bioteknologi LIPI Cibinong. Penelitian dilakukan dari bulan Maret
2011 – Januari 2012
Alat dan Bahan
Alat yang digunakan dalam penelitian antara lain spektrofotometer UV-Vis
(Shimadzu UV-Pharmaspec 1700), laminar air flow (Sander Lab Type K.5025),
autoklaf (Everlight Model: TA-630), inkubator bergoyang (Thermolyne ROSI
1000TM), penangas air (CV Klaten Engineriing Type F.St.02.2007), vortex (Mixer Fisher Scientific), sentrifuge (Centrifuge 5415 R dan SORVALL RC 26 PLUS),
hot plate (IKA RH BASIC 2), pH meter (HM-30 G TOA), neraca analitik (Perciso 303 A, dan Sartorius TE 15025), pipet mikro, dan berbagai peralatan gelas yang
umum digunakan dalam laboratorium.
Bahan yang digunakan yaitu isolat Trichoderma spp. koleksi BTCC (Biotechnology Culture Collection, LIPI), media Potato Dextrosa Agar (PDA), media Pectin Screening Agar Medium (PSAM), media produksi Trichoderma sp. yang mengandung substrat pektin (Khairnar et al. 2009), reagen DNS (Asam dinitrosalisilat) (Phutela et al. 2005), asam galakturonat, daun teh segar dari perkebunan teh Gunung Mas, PTPN VII Jawa Barat, bahan-bahan kimia terkait
analisis TF, TR, HPS dan TLC (Takeo & Ozawa 1976).
Metode Penelitian
Peremajaan Isolat Trichoderma spp. Peremajaan Trichoderma sp. dilakukan pada media PDA. Isolat tersebut diinkubasi selama 3x24 jam pada suhu
ruang.
Uji Kualitatif Isolat Trichoderma sp. Penghasil Enzim Pektinase.
Empat puluh empat isolat koleksi BTCC digunakan sebagai kandidat penghasil
enzim pektinase. Isolat yang akan diseleksi ditumbuhkan pada medium PSAM
awal isolat potensial dilakukan secara kualitatif, berdasarkan kemampuan isolat
mendegradasi pektin. Zona hambat yang terbentuk disekitar koloni ditentukan
dengan Kalium Iodida-Iodin (5,0 g KI dan 1,0 g Iodin dalam 330 mL akuades
steril). Jarak diameter zona bening digunakan untuk menghitung indeks
pektinolitik (IP). Isolat penghasil enzim pektinase tertinggi adalah yang memiliki
nilai indeks pektinolitik terbesar. Isolat ini akan digunakan untuk uji selanjutnya.
Rumus untuk menghitung indeks pektinolitik adalah sebagai berikut:
Penentuan Waktu Produksi Tertinggi Enzim Pektinase. Isolat potensial penghasil enzim pektinase kemudian ditentukan waktu produksi
tertinggi dengan menumbuhkan isolat pada medium pertumbuhan yang
mengandung substrat pektin. 1 ose isolat dikultur dalam 20 mL media cair yang
mengandung substrat pektin 1%. Kultur diinkubasi pada suhu 30 0C dengan
kecepatan agitasi 150 rpm. Inokulum tersebut lalu dituang ke dalam 180 mL
media produksi. Pengambilan sampel dilakukan setiap 24 jam selama 11 hari
waktu inkubasi dilakukan.
Supernatan yang dihasilkan kemudian diuji aktivitas enzim pektinase
dengan menggunakan metode Miller tahun 1959 yang dimodifikasi oleh Phutela
et al. (2005). Larutan sampel disentrifugasi pada suhu 4 0C dengan kecepatan 10000 x g selama 10 menit. Sebanyak 0,5 mL substrat (pektin 1%) yang
dilarutkan dalam 0,1 M bufer sitrat pH 5.8, kemudian ditambah dengan 0,5 mL enzim pektinase, dikocok kuat dengan vortex, selanjutnya diinkubasi selama 30
menit pada suhu ruang. Setelah itu, ditambah dengan 1,5 mL DNS, didihkan
selama 15 menit dan absorbansi diukur pada λ 575 nm. Perlakuan kontrol dan
blanko dilakukan secara bersamaan dengan metode dan tahapan yang sama. Pada
kontrol, enzim yang akan direaksikan dengan substrat telah diinaktivasi terlebih
dahulu dengan memanaskan enzim selama 15 menit dalam air mendidih. Pada
blanko, larutan enzim diganti dengan bufer untuk direaksikan dengan substrat.
Aktivitas enzim diukur pada setiap pengambilan sampel yang dilakukan sehingga
Nilai absorbansi yang diperoleh kemudian dimasukkan ke dalam
persamaan yang diperoleh dari kurva standar asam galakturonat. Kemudian
aktivitas pektinase dihitung berdasarkan rumus sebagai berikut (Phutela et al.
2005).
Keterangan: Xs = jumlah gula tereduksi sampel Xk = jumlah gula tereduksi kontrol P = pengenceran
t = waktu inkubasi
BM = berat molekul asam galakturonat
Aktivitas pektinase dinyatakan dalam U mL-1. Satu unit merupakan jumlah
enzim yang dibutuhkan untuk memecah 1 µmol pektin menjadi asam galakturonat
permenit pada kondisi pengujian.
Produksi Enzim Pektinase. Produksi enzim pektinase dilakukan berdasarkan prosedur dan waktu inkubasi yang telah diketahui aktivitas pektinase
tertinggi pada kurva aktivitas pektinase yang dihasilkan. Media produksi
diinkubasi pada suhu ruang di inkubator bergoyang dengan kecepatan agitasi 150
rpm, kemudian enzim pektinase dipanen pada waktu produksi tertinggi yang telah
didapatkan sebelumnya.
Kultur sel pada media produksi yang mengandung enzim pektinase
disentrifugasi pada kecepatan 10.000 x g selama 15 menit untuk memisahkan
larutan enzim dengan pelet. Supernatan hasil sentrifugasi kemudian disimpan
pada suhu 10 0C sebagai enzim ekstrak kasar.
Optimasi Suhu dan pH. Pengaruh suhu terhadap aktivitas enzim dilakukan dengan mereaksikan 0,5 mL enzim dengan 0,5 mL substrat di mana
substrat dibuat dengan mencampurkan 0,5 g pektin dalam bufer sitrat pH 5,8.
Enzim yang telah dicampurkan dengan substrat kemudian diinkubasi pada
menit waktu inkubasi. Aktivitas enzim pektinase diukur sesuai dengan prosedur
pengujian sebelumnya.
Pengaruh pH terhadap aktivitas enzim diuji dengan menambahkan 0,5 mL
enzim yang direaksikan dengan 0,5 mL substrat. Substrat dibuat dengan
mencampurkan 0,5 g pektin ke dalam bufer dengan berbagai tingkatan pH 4-8,
antara lain yaitu 0,02 M bufer sitrat (4, 5, 6), dan 0,02 M bufer fosfat (7,8).
Masing-masing enzim diinkubasi pada suhu optimum selama 30 menit. Aktivitas
enzim pektinase diukur sesuai dengan prosedur pengujian sebelumnya.
Pemanfaatan Ekstrak Kasar Pektinase dalam Fermentasi Teh. Teh yang digunakan dalam penelitian ini berasal dari perkebunan teh di Jawa Barat.
Sampel yang digunakan adalah sampel daun teh segar yang baru dipetik pada hari
yang sama. Hal ini bertujuan untuk mengontrol proses fermentasi. Jika daun teh
sudah tidak segar, kemungkinan proses oksidasi telah terjadi.
Sebanyak 750 g daun teh segar dilayukan pada suhu ruang selama 2-3 jam.
Selain pada suhu ruang, perlakuan pelayuan dengan bantuan matahari juga dapat
dilakukan selama 60 menit dengan kontrol optimal untuk menghindari daun
menjadi kering dan berwarna kecoklatan. Standar daun yang telah mengalami
pelayuan cukup ditandai seperti daun terasa lemas, mudah digulung tetapi tidak
hancur, serta baunya masih segar. Sebanyak 15 g daun yang telah layu kemudian
dicacah dan ditempatkan pada wadah bersih dan steril. Pada tahapan ini
ditambahkan ekstrak kasar enzim pektinase sesuai dengan perlakuan yaitu 0,086
UmL-1, 0,1723 UmL-1, dan 0,258 UmL-1 dengan cara disemprotkan secara merata
diatas permukaan daun teh yang telah dicacah. Fermentasi dilakukan selama 60
menit pada suhu ruang. Semua perlakuan fermentasi diulang sebanyak 3 kali.
Untuk kontrol perlakuan, fermentasi daun teh tidak ditambahkan ekstrak kasar
pektinase.
Analisis Parameter Kualitas Teh Hitam: Theaflavin (TF), Tearubigin
(TR), Highly Polymerized Substance (HPS), dan Total Liquor Colour (TLC).
Daun teh hitam yang telah dikeringkan kemudian di analisis parameter
komponennya dengan metode ekstraksi pelarut (Takeo & Ozawa 1976).
sedangkan nilai total liquor color dan highly polimerized substance mewakili
tampilan warna dari minuman teh yang dihasilkan.
Sebanyak 4 g daun teh hitam kering direbus bersama 200 mL air hingga
mendidih. Larutan kemudian disaring dan hasil saringannya disebut ekstrak teh
hitam. Satu mL ekstrak teh hitam yang dilarutkan dengan 9 mL air adalah nilai
TLC yang dibaca dengan UV Spektrofotometer pada panjang gelombang 460 nm
(A). Untuk nilai TF, TR, dan HPS sebanyak 25 mL ekstrak teh hitam dilarutkan
dengan 25 mL pelarut polar Isobuthyl Methyl Ketone (IBMK). Proses selanjutnya dilanjutkan dengan ekstraksi menggunakan etanol 45%, Na2HPO4 2,5% serta
n-butanol. Hasil masing-masing diukur pada panjang gelombang 380 nm (B, C, D,
E). Skema ekstraksi daun teh untuk menentukan parameter teh hitam disajikan
lengkap di Lampiran 5.
Parameter TF, TR, HPS, dan TLC dihitung berdasarkan nilai absorbansi
sebagai berikut:
TF (%) : 4,313 x C
TR (%) : 13,643 x (B+D-C)
HPS (%) : 13,643 x E
HASIL DAN PEMBAHASAN
Analisis Kualitatif Isolat Trichoderma spp. Penghasil Pektinase. Empat puluh empat isolat Trichoderma spp. koleksi Biotechnology Culture Collection
(BTCC) LIPI yang bersumber dari serasah daun di koleksi dari Liwa, Lampung
telah diseleksi pada penelitian ini. Isolat diremajakan pada media Potato Dextrosa Agar (PDA). Setelah inkubasi pada suhu ruang selama 5 hari isolat membentuk koloni yang ditutupi spora yang masing-masingnya memiliki warna berbeda.
Analisis aktivitas pektinolitik Trichoderma spp. secara kualitatif dilakukan untuk mengetahui kemampuan kapang tersebut dalam mendegradasi media
pertumbuhannya yang mengandung pektin. Analisis aktivitas ini menggunakan
metoda pewarnaan lugol pada media Pectin Screening Agar Medium (PSAM) (Khairnar et al. 2009). Sebanyak 9 dari 44 isolat yang diseleksi memperlihatkan adanya zona bening (Tabel 5). Zona yang terbentuk adalah daerah bening yang
terdapat disekitar koloni yang menandakan bahwa kapang tersebut telah
mendegradasi media pektin disekitarnya.
Tabel 5 Indeks pektinolitik yang dihasilkan berbagai jenis isolat Trichoderma sp. pada media PSAM
Zona bening dapat diukur berdasarkan indeks pektinolitik yaitu
perbandingan diameter koloni dengan diameter zona bening. Hasil pengujian
menunjukkan 3 isolat memiliki nilai IP tertinggi yaitu T.066 (Gambar 6c) sebesar
masing-masing 3 dan 2. Indeks pektinolitik yang dihasilkan relatif tinggi dibandingkan
dengan penelitian Phutela et al. (2005) dari 43 isolat kapang termofilik, 15 isolat menghasilkan zona bening dengan indeks pektinolitik berkisar 2,5-3,5.
a b c d
Gambar 6 Indeks pektinolitik tertinggi yang dihasilkan Trichoderma spp.
Keterangan: a) T.005, b) T.058, c) T.066, d) isolat yang tidak menghasilkan zona bening.
Indeks pektinolitik ini juga menunjukkan adanya pektinase yang dihasilkan
Trichoderma sp. Hasil ini dapat dijadikan indikasi bahwa isolat T.066 menghasilkan pektinase dengan aktivitas lebih besar dari dua isolat lainnya.
Bhardwaj (2010) mengelompokkan indeks kemampuan mendegradasi pektin menjadi 3 yaitu: sangat baik jika IP ≥ 3,5; baik jika IP 2,5-3 dan kurang baik jika IP ≤ 2,5.
Hasil diatas juga menunjukkan bahwa Trichoderma spp. mengeluarkan ekstraseluler pektinase yang menghidrolisis kulit jeruk yang digunakan sebagai
sumber karbon. Kandungan pektin di dalam kulit jeruk nipis adalah tertinggi yaitu
25-35% berat kering diikuti oleh biji bunga matahari, apel, gula bit, gandum
dengan kandungan dibawah 20% (Bhardwaj 2010). Limbah industri pertanian
seperti gandum, kulit jeruk, kulit nenas juga banyak digunakan sebagai sumber
karbon untuk produksi pektinase (Phutela et al. 2005; Khairnar et al. 2009; Okafor et al. 2010).
Analisis Kuantitatif Isolat Potensial Penghasil Pektinase. Analisis isolat potensial penghasil pektinase dilakukan dengan menghitung nilai aktivitas
enzim pektinase yang dihasilkan. Prinsip pengujian aktivitas pektinase merupakan
reaksi antara enzim dan substrat yang akan menghasilkan produk asam
kemudian konsentrasi produk diukur dengan spektrofotometer. Reagen
dinitrosalisilat yang terdiri atas komponen utama asam 3,5-dinitrosalisilat yang
berwarna kuning akan mengalami reduksi menjadi asam 3 amino 5 nitrosalisilat.
Reaksi reduksi pada gugus nitro dikarenakan adanya gula pereduksi yang
merupakan hasil hidrolisis substrat oleh pektinase (Miller 1959). Selain untuk
menghentikan reaksi, DNS juga berfungsi memberikan warna pada larutan
sehingga absorbannya dapat diukur pada spektrofotometer dengan panjang
gelombang 575 nm.
Berdasarkan hasil uji aktivitas enzim diketahui bahwa aktivitas enzimatik
tertinggi isolat T.066, T.058 dan T.005 berturut-turut yaitu 0,1723 UmL-1, 0,126
UmL-1 dan 0,105 UmL-1. Beberapa penelitian lain melaporkan aktivitas pektinase
pada Aspergillus fumigates sebesar 1,270 Umg-1 (Phutela et al. 2005); A. Indicus
0,460 UmL-1, A. Flavus 0,410 UmL-1 (Angayarkanni et al. 2002); Tubercularia vulgaris 0,184 UmL-1; Aspergillus niger 2,462 UmL-1 (Megawati 1995).
Produksi pektinase oleh Trichoderma belum terlalu banyak dilaporkan, namun pada penelitian Kutateladze et al. (2009), Trichoderma viridae yang dikultur dengan beetroot pektin sebagai sumber karbon menghasilkan pektinase tertinggi yaitu 14,5 UmL-1. Jika dibandingkan dengan penelitian tersebut maka
pektinase yang dihasilkan T.066 masih tergolong kecil. Hal ini mungkin
dikarenakan kemampuan isolat serta faktor pendukung pertumbuhan yang
berbeda-beda.
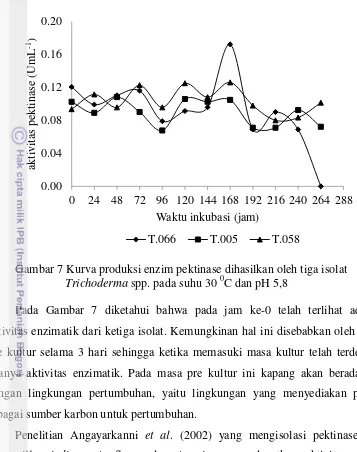
Optimasi Waktu Produksi Isolat Penghasil Pektinase. Penentuan waktu produksi dari kapang penghasil pektinase dilakukan untuk mendapatkan aktivitas
harian enzim sehingga bisa diketahui aktivitas enzimatik tertinggi. Nilai ini akan
menentukan waktu produksi tertinggi sebab aktivitas enzimatik yang tinggi
menandakan bahwa enzim yang dihasilkan kapang tersebut sudah mencapai hasil
yang maksimal.
Hasil pengukuran aktivitas enzimatik sebagai acuan penentuan waktu
terbaik produksi pektinase dapat terlihat pada kurva aktivitas enzimatik. Aktivitas
Trichoderma sp. isolat T.066 tertinggi setelah 7 hari sebesar 0,172 UmL-1. Berdasarkan hal tersebut maka waktu produksi terbaik pektinase oleh
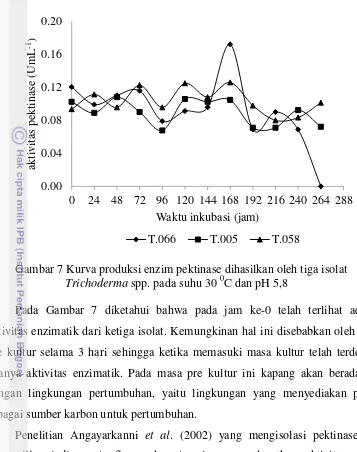
Gambar 7 Kurva produksi enzim pektinase dihasilkan oleh tiga isolat
Trichoderma spp. pada suhu 30 0C dan pH 5,8
Pada Gambar 7 diketahui bahwa pada jam ke-0 telah terlihat adanya
aktivitas enzimatik dari ketiga isolat. Kemungkinan hal ini disebabkan oleh masa
pre kultur selama 3 hari sehingga ketika memasuki masa kultur telah terdeteksi
adanya aktivitas enzimatik. Pada masa pre kultur ini kapang akan beradaptasi
dengan lingkungan pertumbuhan, yaitu lingkungan yang menyediakan pektin
sebagai sumber karbon untuk pertumbuhan.
Penelitian Angayarkanni et al. (2002) yang mengisolasi pektinase dari
Aspergillus indicus, A. flavus dan A. niveus mendapatkan aktivitas enzim 0,46 UmL-1; 0,41UmL-1 dan 0,43 UmL-1. Kutateladze et al. (2009) mendapatkan aktivitas pektinase dari Trichoderma viridae sebesar 14,9 UmL-1 dengan mengganti sumber karbon menjadi beetroot pectin serta memodifikasi sumber nitrogen sehingga diperoleh peningkatan aktivitas sebesar 98%. Okafor et al.
(2010) mengganti sumber karbon dengan limbah gandum untuk produksi
pektinase dari Penicillium chrysogenum dan didapatkan aktivitas 478,25 Umg-1. Isolat T.066 memiliki aktivitas enzim dari jam ke-24 hingga jam ke-96
cenderung fluktuatif dengan rentang yang tidak terlalu besar. Hingga jam ke-168
terjadi peningkatan aktivitas yang signifikan. Hal ini menandakan bahwa kapang
mendegradasi substrat pektin menjadi molekul yang lebih sederhana. Penurunan
aktivitas enzimatik terlihat pada jam ke-192 dimana sepertinya kapang sudah
tidak dapat memanfaatkan substrat pektin sebagai sumber karbon karena telah
habis.
Isolat T.058 dan T.005 dari awal periode kultur hingga jam ke-264 tidak
memperlihatkan peningkatan aktivitas enzimatik. Hal ini kemungkinan
disebabkan oleh kurangnya kemampuan kapang untuk memanfaatkan sumber
karbon yaitu pektin secara maksimal serta kemampuan kapang yang berbeda-beda
dalam mendegradasi substrat. Dari hasil analisis aktivitas tersebut dipilih isolat
T.066 sebagai isolat terbaik yang memproduksi pektinase.
Optimasi pH. Aktivitas enzim dipengaruhi oleh beberapa faktor diantaranya adalah pH. Kebanyakan enzim sangat sensitif terhadap pH dan
memiliki kisaran aktivitas yang spesifik. Aktivitas enzim akan maksimal pada pH
optimum.
Gambar 8 Pengaruh pH terhadap aktivitas pektinase Trichoderma sp. T.006 pada suhu ruang.
Aktivitas optimum enzim pektinase yang dihasilkan oleh kapang
Trichoderma sp. T.006 pada bufer sitrat pH 5 dengan aktivitas sebesar 0,174 UmL-1. Setiap enzim memiliki pH optimal untuk bekerja paling aktif. Nilai
pH optimum untuk sebagian besar enzim secara umum adalah sekitar 6-8
(Campbell et al. 2000). Penelitian Alana et al. (1999) terhadap P. italicum
menunjukkan bahwa aktivitas pektinase tertinggi diperoleh pada pH 4,8. Hasil
aktivitas poligalakturonase Aspergillus fumigatus adalah pH 5 sedangkan untuk aktivitas pektinase pH 4. pH asam yaitu pH 4-5 merupakan kondisi terbaik untuk
menghasilkan aktivitas pektinase dan poligalakturonase tertinggi. Namun
penelitian Kutateladze et al. (2009) terhadap Trichoderma viridae menghasilkan aktivitas pektinase tertinggi pada pH 7,5 yang berarti bahwa pektinase
Trichoderma viridae bersifat alkalifil.
Optimasi Suhu. Enzim bekerja dalam kisaran suhu spesifik. Secara umum peningkatan suhu akan mempercepat laju reaksi. Akan tetapi, suhu yang terlalu
tinggi juga dapat menurunkan laju reaksi dengan pesat. Hal ini disebabkan
denaturasi protein karena putusnya ikatan ion dan hidrogen. Pengaruh suhu
terhadap aktivitas pektinase diperlihatkan pada Gambar 9.
Gambar 9 Pengaruh suhu terhadap aktivitas pektinase Trichoderma sp. T.066 dilakukan pada pH 5
Berdasarkan pengujian pengaruh suhu terhadap aktivitas pektinase
Trichoderma sp. terlihat bahwa suhu 40 0C merupakan suhu optimum aktivitas pektinase yang menghasilkan aktivitas sebesar 0,144 UmL-1. Kenaikan suhu
sebesar 10 0C ternyata mengakibatkan penurunan aktivitas enzim secara drastis.
Aktivitas enzim pektinase isolat T.066 menurun diatas suhu optimum disebabkan
oleh terputusnya ikatan sekunder enzim karena besarnya energi kinetika dari
molekul enzim sehingga mengakibatkan hilangnya struktur sekunder dan tersier
Phutela et al. (2005) melaporkan bahwa pada suhu 50 0C Aspergillus fumigatus menunjukkan aktivitas pektinase tertinggi (1071 Ug-1), Angayarkanni
et al. (2002) terhadap Aspergilus indicus; A. flavus; A. niveus melaporkan suhu optimum untuk masing-masingnya adalah 50 0C. Kutateladze et al. (2009) menyatakan suhu optimum pektinase Penicillium canescens adalah 27 0C,
Aspergillus niger 40 0C dan Trichoderma viridae 30 0C. Kapang termofilik telah dilaporkan memiliki aktivitas optimum pada rentangan suhu 40-50 0C (Rubinder
et al. 2002).
Produksi Pektinase dari Trichoderma sp. dan Fermentasi Teh. Produksi enzim pektinase dilakukan setelah diperoleh waktu produksi saat Trichoderma sp. menghasilkan enzim pektinase dengan aktivitas tertinggi. Produksi dilakukan
dengan skala 1L. Enzim pektinase dipisahkan dari sel dengan cara sentrifugasi
pada suhu 4 0C untuk menghindari denaturasi protein. Proses sentrifugasi akan
memisahkan massa sel (pelet) dengan enzim ekstrak kasar (supernatan). Enzim
ekstrak kasar yang terlarut dalam supernatan dengan aktivitas 0,172 UmL-1 akan
digunakan untuk proses selanjutnya yaitu aplikasinya pada proses fermentasi teh.
Daun teh segar yang telah disortir ditempatkan dalam nampah dan
dilayukan sehingga menghasilkan daun yang layu namun tidak berubah warna dan
baunya tetap segar (Gambar 10a).
a b c
Gambar 10a) Daun teh sebelum fermentasi, b) daun teh ketika fermentasi, c) daun teh setelah fermentasi.
Selama proses pelayuan, daun teh akan mengalami dua perubahan yaitu
perubahan senyawa-senyawa kimia yang terdapat dalam daun serta menurunnya
kandungan air sehingga daun teh menjadi lemas (Andrianis 2009). Waktu, suhu
yang terlalu layu hingga berubah warna menjadi kecoklatan akan menurunkan
kualitas teh yang dihasilkan (Obanda et al. 2004).
Pencacahan daun hingga menjadi substrat yang kecil merupakan proses
awal terjadinya reaksi oksimatis yaitu bertemunya polifenol dan enzim polifenol
oksidase dengan bantuan oksigen (Andrianis 2009), penambahan enzim pektinase
pada tahap ini mengakibatkan daun berubah warna menjadi kecoklatan seiring
dengan lamanya waktu fermentasi (Gambar 10b). Penggilingan akan
mengakibatkan memar dan merusak dinding sel daun. Cairan sel akan keluar
dipermukaan daun secara rata. Proses ini merupakan dasar terbentuknya mutu teh.
Setelah reaksi dihentikan, daun teh menjadi kering (Gambar 10c) dan siap untuk
dianalisis.
Analisis Parameter Kualitas teh Hitam. Selama proses fermentasi, katekin teh akan dioksidasi menjadi ortoquinon membentuk teaflavin (TF)
kemudian senyawa ini bertindak sebagai agen oksidasi pada asam galat dan
membentuk tearubigin (TR). Perubahan katekin menjadi senyawa theaflavin akan
mempengaruhi warna dari minuman teh.
Tabel 6 Pengaruh penambahan enzim pektinase terhadap perubahan kualitas teh
No. Perlakuan TR (%) TF (%) HPS (%) TLC (%)
1. Pektinase 0,086 Uml-1 5,47±1,02 0,54±0,09 4,91±1,54 1,92±0,18
2. Pektinase 0,172 Uml-1 5,96±1,16 0,56±0,04 5,16±1,67 1,97±0,17
3. Pektinase 0,258 Uml-1 5,08±0,12 0,63±0,02 4,72±1,02 2,01±0,32
4. Kontrol 5,10±0,76 0,48±0,13 4,31±0,73 1,78±0,19
Pada analisis senyawa TF (Tabel 6), setiap perlakuan mulai dari kontrol
hingga penambahan pektinase 0,258 UmL-1 menunjukkan peningkatan TF yang
linear. Peningkatan nilai TF berturut-turut adalah 12,5%; 16,67%; dan 31,25%.
Hal yang sama juga berlaku untuk nilai total liqour color (TLC). Semakin meningkat nilai TF pada setiap perlakuan, nilai TLC juga meningkat yaitu 7,86%;
10,67% dan 12,92% yang berarti semakin tinggi nilai TF warna teh akan semakin
Senyawa theaflavin merupakan komponen penyusun teh hitam yang
memberikan kontribusi terhadap warna dan kejernihan teh. Pemberian pektinase
0,258 UmL-1 (perlakuan 3) ternyata mampu meningkatkan nilai senyawa ini
menjadi 1,3 kali lipat. Hasil ini didukung oleh nilai TLC pada perlakuan yang
sama yang juga memberikan nilai tertinggi yaitu kenaikan sebesar 1,1 kali lipat.
Pada analisis tearubigin, pola linear seperti halnya pada analisis TF tidak
berlaku. Murugesan et al. (2002) menyatakan bahwa TR akan meningkat sesuai pola linear selama fermentasi hingga mencapai maksimum ketika daun telah over-fermented. Semakin tinggi penambahan pektinase ternyata tidak berdampak pada semakin tinggi nilai TR. Pada penambahan pektinase 0,086 UmL-1 terjadi
peningkatan nilai TR sebesar 7,25%. Penambahan pektinase 0,172 UmL-1 analisis
TR menunjukkan nilai tertinggi dimana terjadi kenaikan 16,86%, sedangkan
penambahan pektinase 0,258 UmL-1 memberikan nilai TR yang lebih rendah
daripada kontrol. Senyawa tearubigin merupakan komponen yang memberikan
aroma dan rasa pada teh (Obanda et al. 2004) meskipun demikian, tingginya kandungan senyawa TF dalam minuman teh tidak selalu berbanding lurus dengan
TR.
Harold dan Graham (1992) menjelaskan bahwa semakin tinggi kandungan
teaflavin dalam minuman teh maka rasanya akan semakin sepat dan sedikit pahit
karena diikuti oleh peningkatan kandungan kafein. Pernyataan ini mendukung
hasil nilai TF yang tinggi pada penambahan pektinase 0,258 UmL-1 tetapi
memberikan nilai yang rendah pada TR. Penambahan pektinase 0,258 UmL-1
mampu meningkatkan TF menjadi 1,3 kali namun hanya perlu penambahan
pektinase 0,172 UmL-1 untuk meningkatkan nilai TR menjadi 1,2 kali.
Penelitian Hafezi et al. (2006) menunjukkan bahwa fermentasi teh varietas assamica selama 60 menit menghasilkan nilai TF dan TR yang tinggi yaitu 1,05%
dan 9% dibandingkan varietas lain. Penelitian perubahan senyawa flavonoid
selama pembentukan teh hitam telah banyak dilakukan, hanya saja hasil yang
diberikan berbeda-beda. Hal ini dikarenakan banyak faktor lingkungan yang
mempengaruhi hasil akhir komponen senyawa ini seperti cara bercocok tanam dan
kondisi pemrosesan (standar daun yang dipetik, kondisi temperatur dan
Penambahan enzim eksternal selama proses fermentasi telah dilaporkan
mampu meningkatkan kandungan TF dan TR dalam teh (Angayarkanni et al.
2002). Enzim pektinase yang diberikan akan membantu lisis komponen pektin di
daun menghasilkan maserasi sel yang sempurna sehingga meningkatkan optimasi
fermentasi.
Enzim ekstrak kasar 2,5 IU (selulase, hemiselulase, pektinase) yang berasal
dari Aspergillus indicus ternyata mampu meningkatkan nilai TF 43,81%, TR 12%, HPS 19,93% dan TLC 18,91% (Angayarkanni et al. 2002) setelah fermentasi teh hitam selama 60 menit menggunakan metoda CTC (crush, tearing, curling).
Metoda ini meningkatkan kualitas teh lebih baik daripada metoda ORTH karena
dengan metoda ini interaksi antara oksigen dengan daun lebih besar sehingga
fermentasi berjalan merata (Hafezi et al. 2006).
Untuk menghasilkan teh hitam dengan kualitas tinggi, hal pertama yang
harus dipastikan adalah teh bersumber dari daun teh hijau pilihan, faktor varietas
teh dimana varietas asamica memiliki kandungan flavonoid 2 kali lipat daripada
varietas sinensis, dan yang terakhir adalah proses pengolahan teh (Obanda et al.
2004; Hafezi et al. 2006; Kim et al. 2011). Pada penelitian ini terlihat bahwa penambahan enzim pektinase eksogenus pada proses pengolahan teh yaitu tahap
SIMPULAN
Sembilan dari 44 isolat Trichoderma spp. koleksi BTCC LIPI mampu mendegadasi pektin dengan indeks pektinolitik sebesar 0,65-4,8. Isolat dengan
indeks pektinolitik tertinggi (T.066) menghasilkan aktivitas pektinase tertinggi
sebesar 0,1723 UmL-1 pada hari ke-7 inkubasi. Enzim ini menghasilkan aktivitas
tertinggi pada pH 5 dan suhu 40 0C.
Penambahan enzim pektinase pada fermentasi teh dapat meningkatkan
nilai parameter kualitas teh hitam. Nilai Theaflavin (TF) tertinggi yaitu
0,63±0,02% dengan peningkatan sebesar 31,25% dihasilkan setelah penambahan
0,258 UmL-1 pektinase. Peningkatan Total Liquor Colour (TLC) juga terdapat
pada perlakuan yang sama yaitu sebesar 12,92%. Nilai Tearubigin (TR) tertinggi
yaitu 5,96±1,16% dihasilkan setelah penambahan 0,172 UmL-1 pektinase dengan
peningkatan sebesar 16,86%. Perlakuan yang sama juga menghasilkan nilai High
Polimerized Substance (HPS) tertinggi yaitu 5,16±1,67% dengan peningkatan
DAFTAR PUSTAKA
Alana A et al. 1999. Pectin lyase production by a Penicillium italicum strain. Appl Environ Microbiol. 55: 1612 – 1616.
Andrianis Y. 2009. Pengolahan teh hitam. www.rumahteh.com [20 Januari 2011].
Angayarkanni J, Muthusamy P, Subbaiyan M, Krishnasamy S. 2002. Improvement of tea leaves fermentation withAspergillus spp. pectinase.
J Biosci Bioeng 94: 299 – 303
Barnet G, Hunter M. 1972. Illustrated Genera of Imperfect Fungi. Cambridge: Burgess Publ Pr.
Bhardwaj V. 2010. Exploitation of microorganism for isolation and screening of pectinase from environment. Di dalam: Making Innovation Work for Society: Linking, Leveraging and Learning. Proceedings of the 8th International Conference Globelics; Malaysia, 1-3 Nov 2010.
Campbell NA, Reece JB, Mitchell LG. 2000. Biologi edisi 5. Lestari R et al., kadar kolesterol dan trigliserida tikus putih yang diberi diet kuning telur dan sukrosa [skripsi]. Jakarta: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia.
Glazer AN, Nikaido H. 2007. Microbial Biotechnology: Fundamental of Applied Microbiology. Ed ke-2. Cambridge: Cambridge Univ Pr.
Gummadi SN, Panda T. 2003. Purification and biochemical properties of microbial pectinase: Review. Process Biochem 38: 987-996.
Hafezi M, Nasernejad B, Vahabzadeh F. 2006. Optimation of fermentation time for Iranian black tea production. Iran J Chem Chem Eng 25: 39-44.
Harman GE, Howell CR, Viterboy A, Chet I, Lorito M. 2004. Trichoderma
species-opportunistic, avirulent plant symbionts. Nat Review Microbiol 2: 43-56.
Harman GE. 2006. Overview of mechanism and uses of Trichoderma spp.
Harold N, Graham PD. 1992. Green tea composition, consumption and polyphenol chemistry. J Prev Med Hygiene 21:34-50.
Iriani ES, Said EG, Suryani A, Setyadjit. 2005. Pengaruh konsentrasi penambahan pektinase dan kondisi inkubasi terhadap rendemen dan mutu jus mangga kuini (Mangifera odorata G.). J Pascapanen 2: 11-17.
[ISTH] International Subcommission on Trichoderma and Hypocrea Taxonomy. 2012. [16 Februari 2012].
Kashyap DR, Vohra PK, Chopra S, Tewari R. 2001. Application of pectinases in the comercial sector: a review. Biores Tech 77: 215-227.
Khairnar Yet al. 2009. Study of pectinase production in submerged fermentation using different strains of Aspergillus niger. Int J Microbiol Res 1: 13-17.
Kim Y, Goodner KL, Park J, Choi J, Talcott ST. 2011. Changes in antioxidant phytochemical and volatile composition of Camellia sinensis by oxidation during tea fermentation. Food Chem 129: 1331-1342.
Kutateladze Let al. 2009. Selection of microscopic fungi-pectinase producer.
Bull Georg Natl Acad Sci 3:136-141.
Megawati. 1995. Kajian kemampuan produksi pektinase (poligalakturonase) oleh
Aspergillus niger hasil isolasi dari perkebunan cacao [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Muchtar H, Ahmad N. 2000. Tea polyphenols: prevention of cancer and optimizing health. Am J Clin Nutr 71: 1698s-1702s.
Murugesan GS, Angayarkanni J, Swaminatha K. 2002. Effect of tea fungal enzymes on the quality of black tea. Food Chem 79: 411-417.
Naidu GSN, Panda T. 1998. Production of pectinolytic enzymes: Review.
Bioprocess Eng 19: 355-361.
Obanda M, Owour PO, Mang’oka R, Kavoi MM. 2004. Changes in thearubigin fractions and theaflavin level due to variations in processing conditions and their influence on black tea liquor brightness and total colour. Food Chem
85: 163-173.
Okafor UA, Okochi VI, Shalom NC, Ebuehi OAT, Onygemeokerenta BM. 2010. Pectinolytic activity of wild type filamentous fungi fermentedon Agro-waste. Afr J Microbiol Res 4: 2729-2734.
Phutela U, Dhuna V, Sandhu S, Chadha BS. 2005. Pectinase and polygalacturonase production by a thermophilic Aspergillus fumigatus
isolated from decomposting orange peels. Braz J Mirobiol 36: 63-69.
Pedrolli DB, Monteiro AC, Gomes E, Carmona EC. 2009. Pectin and pectinase: production, characterization, and industrial aplication of microbial pectinolytic enzymes. J Biotechnol 3: 9-18.
[PPTK] Pusat Penelitian Teh dan Kina. 2011. Selera pasar teh dunia secara umum terhadap teh hitam orthodox. www.ritc.co.id. [8 Mei 2011].
Rahmah A. 2008. Pengendalian penyakit layu fusarium pada pisang barangan dan pisang kepok menggunakan Trichoderma harzianum di Pasar Usang Kab. Padang Pariaman [skripsi]. Padang: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Andalas.
Rubinder K, Chadha BS, Singh S, Saini HS. 2002. Amylase hyper production by deregulated mutants of the termophilic fungus Thermomyces lanuginosus. J Ind Microbiol Biotechnol 29: 70-74.
Samuels GJ. 1996. Trichoderma: a review of biology and systematics of the genus. Mycol Res 100: 923-935.
Sharma P et al. 2011. Biocontrol genes from Trichoderma species: a review.
Afr J Biotech 10: 19898-19907.
Sittidilokratna C et al. 2007. Screening of pectinase producing bacteria and their efficiency in biopulping of paper mulberry bark. Sci Asia 33: 131-135.
Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor: IPB.
Sutarmaji A. 1994. Pengaruh sari seduhan teh hijau terhadap kadar glukosa darah tikus normal yang diberi diet glukosa [skripsi]. Jakarta: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia.
Tjitrosoepomo G. 1989. Taksonomi Tumbuhan (Spermatophyta). Jogjakarta: UGM Pr.
Tuminah S. 2004. Teh (Camellia sinensis var. assamica) sebagai salah satu sumber antioksidan. Cermin Dunia Kedokteran 144: 52-55
WangLF, Lee JF, Park SO. 2008. Discrimination of teaswith different degrees of fermentation by SPME–GC analysisof the characteristic volatile flavour compounds. Food Chem 109:196-206.
Wang H. 2002. Catechins: The essense of tea.
http://www.ifis.org/library.html#ifis/11609. [22 November 2011].