Lampiran 1. Data Hasil Penyerapan Amoniak Oleh Zeolit Aktif
Lampiran 2. Data Hasil Recovery Amoniak
DAFTAR PUSTAKA
Alaerts, G. dan Santika,S. S. 1984. Metoda Penelian Air. Penerbit Usaha Nasional. Surabaya.
Anita, S. 1994. Pengaruh Suhu Aktivasi Terhadap Zeolit Alam Sarulla. Skripsi. FMIPA USU.
Atkins, P.W. 1997. Kimia Fisika. Jilid2. Edisi Keempat. Erlangga. Jakarta.
Basset, J. 1994. Buku Ajar Vogel: Kimia Analisis kuantitatif Anorganik. Terjemehan A. Hanyana Pudjaatmaka dan L.Setiono. EGC. Jakarta.
Cotton dan Wilkinson. 1989. Kimia Anorganik Dasar. UI Press. Jakarta.
Day, R.A. Jr, A.L Underwood. 1998. Analisis Kimia Kuantitatif. Erlangga. Jakarta.
Dixon dan Wee. 1989. Mineral in Soil Environtments. SSA books Series. USA.
Ginting, A. 2007. Karakterisasi Komposisi Kimia, Luas Permukaan, Pori, dan Sifat Termal dari Zeolit Bayah Tasikmalaya dan Lampung. BATAN. Serpong.
Handayani dan Widiastuti. 2010. Adsorpsi Ammonium (NH4+) pada Zeolit
Berkarbon dan Zeolit A yang Disintesis dari Abu Dasar Batubara PT. IPMOMI PAITON dengan Metode Batch. Prosiding Kimia FMIPA – ITS. Harahap, S.H. 2013. Pemanfaatan Zeolit Alam Sarulla sebagai Penyerap
Amonium/Ammoniak dari Limbah Cair Peternakan Babi. Skripsi. FMIPA USU.
Harjanto, S. 1983. Bahan galian Zeolit: Penggunaan dan Penyebarannya di Indonesia. Ditjen Pertambangan Umum, DepartemenPertambangan dan Energi. Bandung.
Keller, G.E. dan Anderson, R.A. 1987. Handbook of Separation Process Technologi. Jhon Willey and Sons. New York.
Metcalf and Winkler. 1998. Wastewater Engineering—Treatment and Reuse. dalam Handayani dan Widiastuti. 2010. Adsorpsi Ammonium (NH4+)
pada Zeolit Berkarbon dan Zeolit A yang Disintesis dari Abu Dasar Batubara PT. IPMOMI PAITON dengan Metode Batch. Prosiding Kimia FMIPA – ITS.
Narita, I. 2012. Imobilisasi Nano Au Pada Zeolit Alam Serta Modifikasinya dengan Asam 11-Merkapto Undekanoat dan L-Sistein untuk Adsorpsi Ion Logam Berat. Skripsi. Universitas Indonesia, Jakarta.
Pasaribu,B. 2013. Pemanfaatan Zeolit Alam Sarulla Untuk Menyerap Sulfida Dari Limbah Padat Peternakan Di Simalingkar B Medan. Skripsi. FMIPA USU.
Renta, M.L.T, Nainggolan. S, dan Nainggolan H. 1997. Perolehan Kembali (Recovery) Ammoniak dari Serum Pengolahan Lateks Pekat dengan Metode Stripping Ammoniak. Skripsi. Jurusan Kimia FMIPA USU.
Rikardo, T. 2010. Analisis kadar Amoniak, Nitrat, TSS, TDS dari Limbah Cair Peternakan Babi. Skripsi. FMIPA USU.
Rina, U. 2012. Modifikasi Zeolit Alam dengan Nano Kitosan sebagai Adsorben Ion Logam Berat dan Studi Kinetikanya Terhadap Ion Pb (II). Skripsi. Universitas Indonesia. Jakarta.
Sastiono, A. 1991. Karakterisasi Deposit Mineral Zeolit dalam aspek Pemanfaatannya di Bidang Pertanian. J.IL. Pert. Indonesia. Bogor.
Saragih, F. R. 2013. Pemanfaatan Kembali Zeolit Alam Setelah Mengalami Proses Regenerasi Sebagai Penyerap Logam Cu (Tembaga) Dan Zn (Seng) Di Dalam Air Limbah Industri Pertambangan Emas. Skripsi. FMIPA USU.
Schroeder, E.D. 1977. Water and Wastewater Treatment. McGraw-Hill. Tokyo.
Setyamidjaja, D. 1982. Seri Budidaya Karet. Kanisius. Yogyakarta.
Simangunsong, V. 2012. Optimasi Suhu Aktivasi dan Dosis Zeolit sebagai Adsorben Seng dan Besi yang Terkandung di Dalam Limbah Cair Industri Sarung Tangan Karet. Skripsi. FMIPA USU.
Simanjuntak, I. 2013. Studi Perbandingan daya Serap Zeolit Aktif dengan Zeolit Termodifikasi Etilendiamintetraasetat (EDTA) sebagai Adsorben Ion Campuran Tembaga (II), Nikel (II), dan Zinkum (II). Skripsi. FMIPA USU.
Suyartono, 1992. Kegiatan Litbang Zeolit Indonesia. Periode 1980-1981. Forum Pendapatan Pertambangan dan Energi No. 5/THN XVII/1992, Bandung.
Swingle. D. dan Walter W.G. 1997. Review Geral Bacteriology. 2nd Edition. Nostrand Company Inc. Toronto.
Viesman.W.Jr. 1985. Water Supply and Pollution Control. Fourth Edition. Harper and Row Publisher. New York.
BAB 3
METODE PENELITIAN
3.1. Bahan
- Zeolit Alam Sarulla - Aquadest Bebas Ammonia
- Limbah Cair Pabrik Karet
- HgI2(s) p.a. (E-merck)
- KI(s) p.a. (E-merck)
- NaOH(s) p.a. (E-merck)
- NH4Cl p.a. (E-merck)
- H3BO3(s) p.a. (E-merck)
- HCl (p) p.a. (E-merck)
3.2 Alat
- Spektrofotometer Spektronik 20 Milton Roy
- Neraca Analitik Mettler AE 200
- Botol Aquadest - Alu dan Lumpang
- Oven Fisher
- Furnace Fisher
- Peralatan Gelas Pyrex
- Kertas Saring Whatman No. 42
3.3. Prosedur Penelitian
3.3.1. Pembuatan Larutan HCl 5 %
Sebanyak 135,13 mL larutan HCl(p) dimasukkan ke dalam labu takar 1000 mL,
diencerkan dengan aquadest hingga garis tanda lalu dihomogenkan.
3.3.2. Larutan Asam Boraks
Sebanyak 20 gram kristal H3BO3 dimasukkan ke dalam beaker glass 250 mL lalu
dilarutkan dengan 100 mL aquadest. Kemudian dimasukkan ke dalam labu ukur 500 mL dan diencerkan dengan aquadest sampai garis tanda.
3.3.3. Larutan NaOH 6 N
Sebanyak 240 gram NaOH pellet dimasukkan ke dalam beaker glass 600 mL lalu dilarutkan dalam 500 mL aquadest dan didinginkan sampai suhu kamar. Kemudian dimasukkan ke dalam labu ukur 1000 mL kemudian diencerkan sampai garis tanda dan dihomogenkan.
Sebanyak 25 gram kristal HgI2 dan 17,5 gram kristal KI dimasukkan ke dalam
beaker glass 100 mL yang telah diisi 50 mL aquadest, kemudian diaduk hingga seluruh kristal larut. Larutan ini kemudian dicampurkan dengan 50 mL NaOH 6N secara perlahan-lahan lalu dimasukkan larutan dalam labu ukur 250 mL dan diencerkan dengan aquadest sampai garis tanda dan dihomogenkan. Larutan ini disimpan dalam botol kaca yang gelap dan dihindarkan terkena sinar matahari.
3.3.5. Larutan Induk Amoniak 1000 mg/L
Sebanyak 3,819 gram Kristal NH4Cl yang telah dikeringkan terlebih dahulu pada
suhu 100oC dimasukkan ke dalam beaker glass lalu dilarutkan dengan 200 mL aquadest. Kemudian diencerkan dengan aquadest dalam labu ukur 1000 mL sampai garis tanda dan dihomogenkan.
3.3.6. Larutan Standar Amoniak 100 mg/L
Sebanyak 10 mL larutan induk amoniak 1000 mg/L diencerkan dengan aquadest
dalam labu ukur 100 mL sampai garis tanda dan dihomogenkan.
3.3.7. Larutan Standar Amoniak 0,5 ; 2,0 ; 3,5 ; 5,0 ; 6,5 mg/L
3.3.8. Pengolahan Zeolit
3.3.8.1. Preparasi Zeolit
Batuan zeolit alam Sarulla yang masih berbentuk granula dipanaskan di dalam oven pada suhu 100 ± 10oC selama 3 jam, lalu didinginkan dan dihaluskan. Kemudian diayak dengan ayakan 100 Mesh.
3.3.9. Aktivasi Zeolit
Sebanyak 100 gram zeolit alam Sarulla yang telah dipreparasi kemudian dipanaskan sampai suhu 250oC selama 3 jam lalu didinginkan di dalam desikator.
3.3.10. Pembuatan Kurva Kalibrasi Larutan Standar Amoniak
Dipipet masing-masing sebanyak 50 mL larutan standar 0,5 ; 2,0 ; 3,5 ; 5,0 ; 6,5
mg/L dan dimasukkan ke dalam labu ukur 50 mL. Kemudian ditambahkan 2,0 mL reagen Nessler lalu dikocok dan didiamkan selama 10 menit. Diukur %
transmitansinya pada maks = 410 nm dengan spektrofotometer visibel.
3.3.11. Pengambilan dan Pengawetan Sampel
Diambil limbah cair pabrik karet buangan pertama dan dimasukkan ke dalam botol gelap tanpa gelembung udara. Ditambahkan dengan H2SO4(p) sampai pHnya
3.3.12. Pengolahan Limbah Cair Pabrik Karet
3.3.12.1. Destilasi Limbah Cair Pabrik Karet
Sebanyak 400 mL limbah cair pabrik karet dimasukkan ke dalam labu destilasi, kemudian didestilasi selama 30 menit. Destilat ditampung dalam labu Erlenmeyer yang telah berisi 400 mL larutan asam boraks. Campuran destilat dan asam boraks ini kemudian dimasukkan ke dalam labu ukur 1000 mL dan diencerkan dengan aquadest sampai garis tanda.
3.3.13. Penentuan Amoniak yang diserap oleh Zeolit Aktif
Ke dalam 5 buah labu takar yang telah bersih dan kering diisi dengan 100 mL larutan hasil destilasi limbah cair pabrik karet, lalu diatur pH larutannya = 6 dengan menambahkan NaOH 6 N. Kemudian ditambahkan masing-masing secara berurutan sebanyak 2,0 ; 4,0 ; 6,0 ; 8,0 ; 10,0 gram zeolit aktif. Diaduk lalu didiamkan selama 3 jam. Kemudian disaring dengan menggunakan kertas saring Whatman no. 42 dan filtratnya dikumpulkan. Dipipet masing-masing sebanyak 25 mL filtrat setelah penambahan zeolit aktif lalu dimasukkan ke dalam labu takar 50
mL. Kemudian dinetralkan dengan penambahan NaOH 6N lalu ditambahkan 2,0 mL reagen Nessler lalu dikocok dan didiamkan selama 10 menit. Diukur %
transmitansinya pada maks = 410 nm dengan spektrofotometer visibel.
3.3.14. Recovery Amoniak
Dikeringkan masing-masing zeolit yang telah digunakan untuk menyerap amoniak, kemudian dimasukkan ke dalam gelas beaker, lalu ditambahkan 100 mL
mL. Ditambahkan 2,0 mL reagen Nessler lalu dikocok dan didiamkan selama 10
menit. Diukur % transmitansinya pada maks = 410 nm dengan spektrofotometer
visibel.
Catatan: Setiap proses Recovery dilakukan setelah zeolit digunakan sebagai
3.4. Bagan Penelitian 3.4.1. Pengolahan Zeolit 3.4.1.1. Preparasi Zeolit
Batuan zeolit alam sarulla
Serbuk zeolit 100 mesh
Dipanaskan di dalam oven pada suhu 100 sampai 110 oC selama 3 jam
Didiginkan Dihaluskan
Diayak dengan ayakan 100 mesh
3.4. 1.2. Aktivasi Zeolit
100 gram serbuk zeolit alam sarulla 100 mesh
Zeolit aktif
Dipanaskan pada suhu 250oC selama 3 jam
3.4.2. Pembuatan Kurva Kalibrasi Larutan Standar Amoniak
50 mL larutan standar 0,5 mg/L
dimasukkan ke dalam labu ukur 50 mL
ditambahkan 2,0 mL larutan Reagen Nessler
dikocok
didiamkan selama 10 menit
diukur %transmitansinya pada panjang gelombang maksimum 410 nm
Hasil
Catatan: 1. Dilakukan prosedur yang sama untuk larutan standar 2,0 ; 3,5 ; 5,0 ; 6,5 mg/L.
3.4.3. Pengambilan dan Pengawetan sampel
Limbah karet buangan pertama
dimasukkan ke dalam botol gelap tanpa gelembung udara
ditambahkan dengan H2SO4(p) sampai pHnya < 2
didinginkan pada 4oC
3.4.4. Pengolahan Limbah cair Pabrik Karet
3.4.4.1. Destilasi Limbah cair Pabrik Karet
400 mL limbah cair pabrik karet
dimasukkan ke dalam labu destilasi ditambahkan NaOH 6N hingga pHnya > 7 didestilasi selama 30 menit
Destilat Residu
ditampung dalam labu erlenmeyer yang telah diisi dengan 400 mL larutan asam boraks
larutan bening
dimasukkan ke dalam labu ukur 1000 mL diencerkan dengan aquadest sampai garis tanda dihomogenkan
Hasil
3.4.4.2. Penentuan Amoniak yang Diserap oleh Zeolit Aktif
100 ml larutan hasil destilasi
dimasukkan ke dalam labu takar 250 ml
diatur pH-nya = 6 dengan penambahan NaOH 6N dimasukkan 2,0 gram zeolit aktif
diaduk
didiamkan selama 3 jam
disaring dengan menggunakan kertas saring Whatman no. 42
Filtrat Residu
dipipet sebanyak 25 mL dan dimasukkan ke dalam labu takar 50 mL
dinetralkan dengan penambahan NaOH 6N ditambahkan 2,0 mL larutan reagen Nessler dikocok
didiamkan selama 10 menit
diukur %transmitansinya pada panjang gelombang maksimum = 410 nm Hasil
Catatan: 1. Dilakukan prosedur yang sama dengan penambahan zeolit 4,0 ; 6,0 ; 8,0 ; 10,0 gram zeolit aktif.
3.4.5. Recovery Amoniak
Zeolit yang telah terpakai
dikeringkan
dimasukkan ke dalam gelas beaker
ditambahkan dengan 100 mL larutan HCl 5% diaduk
didiamkan selama 3 jam disaring
filtrat residu
dipipet sebanyak 25 mL
dimasukkan ke dalam labu takar 50 mL ditambahkan 2,0 mL reagen Nessler dikocok
didiamkan 10 menit
diukur % transmitansinya pada panjang gelombang maksimum= 410 nm
Hasil
Catatan: 1. Dilakukan prosedur yang sama untuk Zeolit yang telah terpakai masing-masing 4,0 ; 6,0 ; 8,0 ; 10,0 gram.
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Data hasil percobaan yang diperoleh ditunjukkan pada tabel berikut : Tabel 4.1. Hasil Penyerapan Amoniak Oleh Zeolit
Konsentrasi Amoniak Awal = 5,4679 mg/L
Zeolit (gram) mg/L Amoniak % Penyerapan
2 2,0704 62,1353
4 1,8842 65,5407
6 1,7041 68,8344
8 1,5864 70,9870
10 1,5002 72,5635
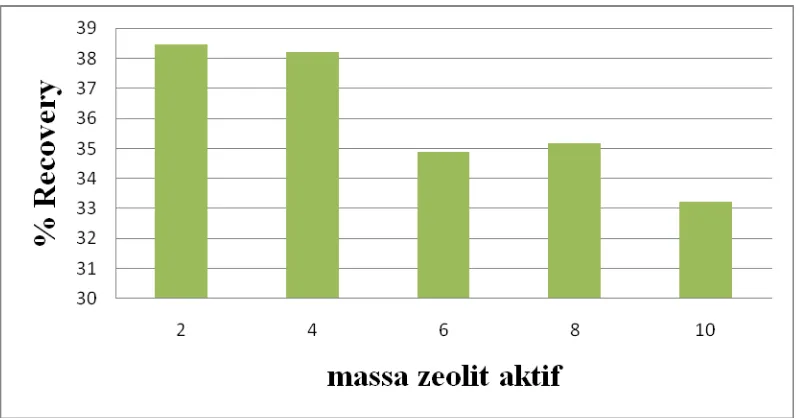
Tabel 4.2. Data Hasil Recovery Amoniak Setelah Diserap Zeolit
Zeolit (gram) mg/L Amoniak % Recovery
2 1,2739 38,4708
4 1,1643 38,2071
6 1,1095 34,8923
8 1,0283 35,1802
\
4.2. Pengolahan Data
4.2.1. Penentuan Amoniak yang Terserap Oleh Zeolit Aktif
4.2.1.1. Penurunan persamaan garis regresi untuk kurva kalibrasi
Data yang diperoleh dari pengukuran transmitansi larutan standar amoniak dikonversikan ke dalam bentuk absorbansi dengan menggunakan persamaan A = 2 – log %T.
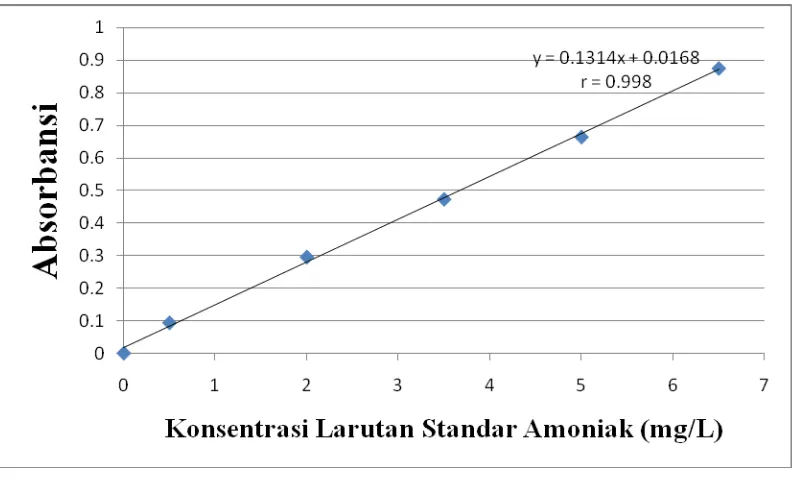
Data absorbansi yang diperoleh dari larutan standar amoniak diplotkan terhadap konsentrasi larutan standar sehingga diperoleh kurva kalibrasi berupa garis linear seperti pada gambar 4.1 berikut ini :
Data – data absorbansi sebagai fungsi konsentrasi larutan standar amoniak
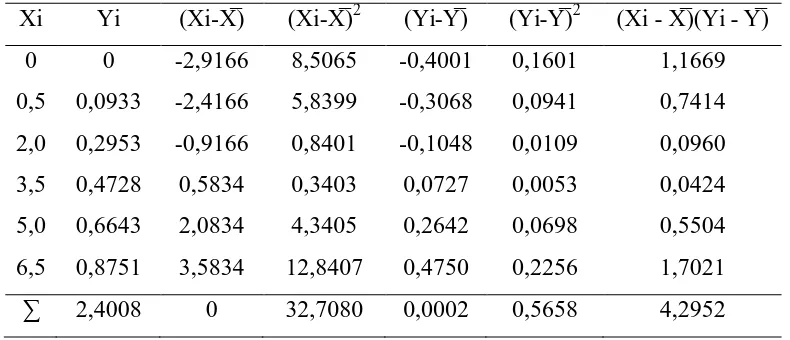
kemudian diolah dengan metode Least-Square dimana konsentrasi dinyatakan sebagai Xi dan absorbansi dinyatakan sebagai Yi seperti pada tabel berikut:
Tabel 4.3. Penurunan Persamaan Garis Regresi untuk Kurva Kalibrasi
Xi Yi (Xi-X̅) (Xi-X̅)2 (Yi-Y̅) (Yi-Y̅)2 (Xi - X̅)(Yi - Y̅)
0 0 -2,9166 8,5065 -0,4001 0,1601 1,1669 0,5 0,0933 -2,4166 5,8399 -0,3068 0,0941 0,7414
2,0 0,2953 -0,9166 0,8401 -0,1048 0,0109 0,0960 3,5 0,4728 0,5834 0,3403 0,0727 0,0053 0,0424 5,0 0,6643 2,0834 4,3405 0,2642 0,0698 0,5504 6,5 0,8751 3,5834 12,8407 0,4750 0,2256 1,7021 ∑ 2,4008 0 32,7080 0,0002 0,5658 4,2952
Dari tabel di atas diperoleh =
dan harga
Persamaan garis regresi untuk kurva kalibrasi dinyatakan dengan y = ax + b Dimana: a = slope
b = intersept
Harga slope (a) dapat ditentukan dengan persamaan sebagai berikut :
=
Sedangkan harga intersept (b) dapat diperoleh melalui persamaan: Y̅ = ax̅ + b
Atau b = Y̅ - ax̅
= 0,4001 – 0,3832
= 0,0168
Dengan demikian persamaan garis regresi untuk kurva kalibrasi amoniak adalah : Y = 0,1314x + 0,0168
Selanjutnya persamaan ini digunakan untuk menghitung konsentrasi amoniak tersisa di dalam larutan setelah penyerapan oleh zeolit aktif.
Contoh perhitungan:
Konsentrasi amoniak awal = 5,5479 mg/L Penyerapan amoniak oleh 2 gram zeolit aktif:
%T konsentrasi amoniak sisa = 70,33; maka A = 2 – log 70,33 = 0,1528 disubsitusikan harga A terhadap Y pada persamaan garis regresi Y = 0,1314x + 0,0168
Diperoleh : 0,1528 = 0,1314x + 0,0168
Atau X = = 1,0350
Hasil ini dikalikan dengan faktor pengenceran yaitu 2x sehingga diperoleh konsentrasi amoniak sisa yang sebenarnya yaitu : 2,0700 mg/L
4.2.1.2. Penentuan Koefisien Korelasi
Koefisien korelasi (r) untuk kurva kalibrasi amoniak dapat ditentukan:
r =
= 0,9986
Penyerapan Amoniak oleh zeolit aktif dapat ditentukan dengan metode kurva
kalibrasi dengan mensubstitusi nilai absorbansi yang diperoleh dari hasil pengukuran terhadap persamaan garis regresi dari kurva kalibrasi. Hasil perhitungan dapat dilihat pada tabel 1 dalam lampiran.
4.2.1.4. Penentuan Amoniak Sisa Setelah Diserap Oleh Zeolit Aktif dari Limbah Pabrik Karet (mg/L)
Dari data pengukuran absorbansi amoniak untuk sampel limbah pabrik karet dengan penambahan 2 gram zeolit aktif, diperoleh absorbansi sebagai sebagai berikut:
A1 = 0,1549 A2 = 0,1549 A3 = 0,1487
Dengan mensubstitusi nilai Y (absorbansi) kepersamaan garis regresi Y = 0,1314x
+ 0,0168 dan dengan adanya pengenceran sebanyak 2x, makan diperoleh: X1 = 2,1019
X2 = 2,1019 X3 = 2,0076
Sehingga diperoleh :
= 2,0704
+
(X1 - X̅)2 = 59,2834 x 10-4 Maka,
=
= 5,4444 x 10-2
= 0,0544
didapat harga = 0,0314
dari data hasil distribusi t student untuk n = 3, dengan derajat kebebasan (dk) = n -1 = 2 untuk derajat kepercayaan 95% (p – 0,05), t = 4,30 maka :
d = t (0,05x (n – 1)) Sx
d = 4,30 (0,05 x 2) 0,0314 = 0,0135
Sehingga diperoleh hasil pengukuran amoniak sisa dengan penambahan 2 gram zeolit aktif sebesar 2,0704 ± 0,0135 mg/L
Data perhitungan untuk konsentrasi amoniak sisa setelah diserap oleh zeolit aktif 2,0 ; 4,0 ; 6,0 ; 8,0 ; 10,0 gram dapat dilihat pada tabel 1 dalam lampiran.
4.2.1.5. Perhitungan Jumlah Amoniak Terserap
Jumlah amoniak yang terserap dihitung dengan menggunakan persamaan: [Amoniak]terserap = [Amoniak]awal – [Amoniak]sisa
Jumlah amoniak yang tersisa dapat dihitung dengan menggunakan rumus seperti dijelaskan pada butir 4.2.1.1 dan dicantumkan pada tabel 4.1.
Hasil perhitungan yang diperoleh dicantumkan pada tabel yang sama.
4.2.1.6. Penentuan Amoniak Hasil Recovery
Dari data pengukuran absorbansi hasil recovery amoniak untuk sampel limbah pabrik karet dengan penambahan 2 gram zeolit aktif, diperoleh absorbansi sebagai sebagai berikut:
A1 = 0,1023
A2 = 0,1023 A3 = 0,0969
Dengan mensubstitusi nilai Y (absorbansi) kepersamaan garis regresi Y = 0,1314x + 0,0168 dan dengan adanya pengenceran sebanyak 2x, makan diperoleh:
X1 = 1,3013 X2 = 1,3013 X3 = 1,2191
Sehingga diperoleh :
= 1,2739
(X1 - X̅)2 = (1,3013 – 1,2739)2 = 7,5076 x 10-4 (X2 - X̅)2 = (1,3013 – 1,2739)2 = 7,5076 x 10-4 (X3 - X̅)2 = (1,2191 – 1,2739)2 = 30,0304 x 10-4
(X1 - X̅)2 = 45,0456 x 10-4 Maka,
=
= 4,7458 x 10-2
= 0,0474
didapat harga = 0,0273
dari data hasil distribusi t student untuk n = 3, dengan derajat kebebasan (dk) = n
-1 = 2 untuk derajat kepercayaan 95% (p – 0,05), t = 4,30 maka :
d = t (0,05x (n – 1)) Sx
d = 4,30 (0,05 x 2) 0,0273 = 0,0117
Sehingga diperoleh hasil Recovery amoniak dengan penambahan 2 gram zeolit aktif sebesar: 1,2739 ± 0,0117 mg/L
Data perhitungan untuk hasil recovery amoniak setelah penambahan zeolit aktif 2,0 ;4,0 ; 6,0 ; 8,0 ; 10,0 gram dapat dilihat pada tabel 2 dalam lampiran.
4.2.1.7. Perhitungan Jumlah Amoniak Terrecovery
Jumlah amoniak yang terrecovery dihitung dengan menggunakan persamaan: [Amoniak]terserap = [Amoniak]awal – [Amoniak]sisa
Jumlah amoniak yang tersisa dapat dihitung dengan menggunakan rumus
seperti dijelaskan pada butir 4.2.1.1 dan dicantumkan pada tabel 4.2.
Data – data ini digunakan untuk menghitung % amoniak yang terrecovery dengan
4.3. Pembahasan
Studi Penyerapan Amoniak dari Limbah Pabrik Karet dengan Menggunakan Zeolit Alam serta Perolehan Kembali (Recovery) Amoniak yang Telah Diserap Zeolit dilakukan dengan memvariasikan berat dari zeolit alam (2,0 ; 4.0 ; 6,0 ; 8,0 ; 10,0 gram) dimana batuan zeolit alam dipanaskan di dalam oven pada suhu 100 – 110oC, didinginkan, dihaluskan, kemudian diayak dengan ayakan 100 mesh. Dimana aktivasi dari zeolit alam tersebut dilakukan secara fisika yaitu dengan pemanasan pada suhu 250oC selama 3 jam. Zeolit alam yang diaktivasi dengan pemanasan pada suhu 250oC menyebabkan molekul-molekul air yang terperangkap dalam ruang-ruang rongga dalam kristal zeolit akan keluar dan menyebabkan luas permukaan pori-pori akan bertambah sehingga zeolit tersebut dapat berfungsi sebagai penyerap gas ataupun cairan.
Sampel limbah pabrik karet diambil dari salah satu Pabrik Karet yang terdapat di Kisaran yang diambil dari limbah buangan pertama. Limbah buangan pertama tersebut ditampung dalam suatu wadah dan selanjutnya diawetkan dengan
penambahan H2SO4 (p) sampai pH < 2 dan didinginkan dalam cool box (wadah
pendingin) pada 4oC. Reaksi yang terjadi, yaitu :
2 NH3 (g) + H2SO4 (NH4)2SO4 ( pH < 2 )
Sampel limbah cair pabrik karet tersebut selanjutnya ditambahkan dengan NaOH 6 N sampai pHnya ≥ 7, lalu kemudian didestilasi.
(NH4)2SO4 + 2 NaOH 2 NH3 (g) + Na2SO4 + 2 H2O ( pH ≥ 7 )
Pada proses destilasi, hasil destilasi yang mengandung amoniak ditampung oleh larutan absorben asam borat yang mengikat amoniak tersebut. Selanjutnya, hasil dari destilasi tersebut diatur pHnya = 6 dengan penambahan NaOH 6N dan kemudian ditambahkan dengan zeolit aktif (2,0 ; 4,0 ; 6,0 ; 8,0 ; 10,0 gram), setelah itu diaduk, dan dibiarkan selama 3 jam.
(NH4)3BO3 + 2 NaOH NH3 + Na2HBO3 + 5 H2O
Kemudian diambil filtratnya dengan melakukan penyaringan dengan kertas saring Whatman No. 42. Filtratnya kemudian dinetralkan pHnya dengan NaOH 6N, dikocok, setelah itu ditambahkan dengan Reagen Nessler yang mana reaksinya menghasilkan larutan berwarna kuning-coklat yang mengikuti hukum Beer-Lambert. Intensitas warna yang terjadi berbanding lurus dengan konsentrasi NH3
yang ada dalam sampel, yang kemudian ditentukan secara spektrofotometris pada panjang gelombang maksimum 410 nm.
Gambar 4.2 Bagan Penyerapan Amoniak oleh Zeolit Aktif
Dari hasil penelitian yang telah dilakukan, penyerapan amoniak yang paling tinggi terjadi dengan penambahan 10 gram zeolit yaitu sebesar 72,5635 % dari total amoniak yang terdapat dalam sampel limbah pabrik karet. Hal ini menunjukkan bahwa kemampuan adsorpsi zeolit akan bertambah seiring dengan pertambahan berat zeolit tersebut. Pertambahan persen penyerapan seiring dengan penambahan massa zeolit aktif ini belum menunjukkan kemampuan optimum zeolit dalam menyerap amoniak. Hal ini disebabakan oleh perlakuan pengadukan dan perendaman yang sama untuk masing-masing penambahan zeolit aktif, yaitu setengah jam pengadukan dan 3 jam perendaman. Setiap pertambahan massa aktif zeolit seharusnya memerlukan waktu pengadukan dan perendaman yang lebih
banyak sehingga waktu kontak atau waktu untuk melakukan penyerapan pun lebih
banyak. Hasil recovery (perolehan kembali) amoniak yang paling besar yaitu dengan 2 gram zeolit sebesar 38,4708 %.
Gambar 4.3 Bagan Perolehan Kembali (Recovery) Amoniak
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian yang telah dilakukan diperoleh kesimpulan sebagai berikut : 1. Penyerapan Amoniak dari Limbah Pabrik Karet dengan menggunakan
zeolit alam yang diaktivasi secara fisika pada suhu 250oC dengan variasi berat zeolit 2,0 ; 4,0 ; 6,0 ; 8,0 ; 10,0 gram berturut-turut adalah 62,1353% ; 65,5407% ; 68,8344% ; 70,9870% ; 72,5635%.
2. Perolehan Kembali (Recovery) amoniak dapat dilakukan, dimana persen recovery yang didapat dari 2,0 ; 4,0 ; 6,0 ; 8,0 ; 10,0 gram zeolit
berturut-turut adalah: 38,4708% ; 38,2071% ; 34,8923% ; 35,1802% ; 33,2155%.
5.2. Saran
1. Disarankan untuk peneliti selanjutnya agar memvariasikan massa zeolit aktif lebih banyak lagi sehingga dapat diperoleh penyerapan optimum zeolit aktif tersebut.
2. Disarankan untuk peneliti selanjutnya agar dalam analisa penyerapan amoniak oleh zeolit dilakukan dengan metode lain selain metode Nessler yaitu dengan menggunakan elektroda khusus amoniak, dan juga
BAB 2
TINJAUAN PUSTAKA
2.1. Zeolit
Zeolit pertama kali ditemukan oleh seorang ahli mineral berkebangsaan Swedia, Baron Axel Frederick Cronsted pada tahun 1756 pada rongga-rongga batuan basalt di pertambangan Lappmark. Nama zeolit berasal dari bahasa Yunani, “zein” yang berarti membuih dan “lithos” berarti batu. Nama ini sesuai dengan sifat zeolit yang akan membuih bila dipanaskan pada suhu 100oC hingga 350oC (Harjanto,S.,1983).
Zeolit dapat didefinisikan sebagai mineral hidrat Alumino Silikat, dimana mineral ini terhidrasi dari logam-logam alkali dan alkali tanah (terutama Ca dan Na) dengan struktur tiga dimensi yang mempunyai rongga dan saluran yang
dibentuk atas penggabungan dan pengulangan unit-unit tetrahedral AlO4 dan SiO4
yang dihubungkan oleh atom oksigen. Rumus umum zeolit ditulis : Mx/n (AlO2)x (SiO2)y m H2O
dimana :
M : Logam Alkali atau Alkali Tanah n : Valensi dari Kation Logam
m : banyaknya Molekul air per unit sel zeolit
x,y : bilangan total tetrahedral per unit sel dan perbandingan y/x berkisar 1 – 5
2.2. Sifat-sifat Mineral Zeolit
Zeolit memiliki sejumlah sifat kimia maupun fisika yang menarik diantaranya, mampu menyerap (adsorpsi) zat organik maupun anorganik, sebagai penukar kation (ion exchange), katalisator (catalyst), dan penyaring molekul berukuran halus (molecular sieving) (Dixon dan Weed, 1989).
2.2.1. Sifat-sifat adsorpsi dari zeolit
Adsorpsi adalah suatu proses penyerapan suatu zat oleh zat lainnya, yang hanya terjadi pada permukaan. Zat yang diserap disebut fase terserap (adsorbat) dan zat yang menyerap disebut adsorben. Struktur zeolit mempunyai sistem mikropori yang biasanya diisi oleh kation dan air. Molekul tersebut bebas bergerak sehingga dapat disubstitusi secara reversibel oleh molekul lain (Atkins, 1999).
Dalam keadaan normal maka ruang-ruang rongga dalam kristal zeolit terisi
oleh molekul air bebas yang membentuk bulatan di sekitar kation. Bila kristal tersebut dipanaskan selama bebarapa jam, biasanya pada temperatur 200-300oC,
tergantung dari jenis mineral zeolitnya, maka molekul-molekul air pada rongga-rongga tersebut akan keluar, sehingga zeolit yang bersangkutan dapat berfungsi sebagai penyerap gas atau cairan mineral zeolit.
pusat rongga tersebut. Molekul-molekul yang lebih besar dari slauran rongga,
tidak akan dapat masuk ke dalamnya (Sastiono,A. 1991).
2.2.2. Sifat Pertukaran Ion dari Zeolit
Sifat Penukar ion dari zeolit berhubungan dengan ion - ion yang berada pada rongga - rongga. Ion – ion ini dapat bergerak bebas sehingga pertukaran ion yang terjadi tergantung dari ukuran dan muatan maupun jenis zeolitnya. Sifat sebagai penukar ion pada zeolit tergantung dari sifat kation, suhu, dan anion. Penukaran kation dapat menyebabkan perubahan beberapa sifat zeolit seperti stabilitas terhadap panas, sifat adsorpsi, dan aktivitas katalitis (Narita,2012).
2.2.3. Sifat Zeolit sebagai Katalis
Zeolit sebagai katalis hanya mempengaruhi laju reaksi tanpa mempengaruhi kesetimbangan reaksi karena mampu menaikkan perbedaan lintasan molekular
dari reaksi. Katalis berpori dengan pori – pori sangat kecil akan memuat molekul kecil tetapi mencegah molekul besar masuk. Selektivitas molekuler seperti ini
disebut molecular sieves yang terdapat dalam substansi zeolit alam (Ginting,2007).
2.3. Pengaktifan Mineral Zeolit
efek pencucian atau penghilangan komponen pengotor (impurities) dari mineral
zeolit.
Pengaruh pengaktifan zeolit, yaitu dapat memurnikan zeolit dari komponen pengotor, menghilangkan jenis kation logam tertentu dan molekul air yang terdapat dalam rongga, atau memperbesar volume pori, sehingga memiliki kapasitas yang lebih tinggi. Oleh karena itu, zeolit alam perlu diaktifkan terlebih dahulu sebelum digunakan, untuk mempertinggi daya kerjanya. Pengaktifan zeolit dapat dilakukan melalui beberapa cara, antara lain :
1. Pemanasan dalam jangka waktu dan suhu tertentu
2. Mengubah atau mempertukarkan kation yang dapat dipertukarkan 3. Mengubah ratio perbandingan Si/Al dengan perlakuan dealuminasi
(Pasaribu, B.2013).
2.3.1. Pengaktifan dengan Pemanasan
Pemanasan terhadap zeolit alam bertujuan untuk mengeluarkan air atau garam pengotor dari dalam rongga-rongga kristal zeolit. Aktivasi secara fisis berupa
pemanasan zeolit dengan tujuan untuk menguapkan air yang terperangkap dalam pori-pori Kristal zeolit, sehingga luas permukaan pori-pori bertambah (Suyartono,
1992).
2.3.2. Pengaktifan dengan Pengasaman
Pengaktifan zeolit secara kimia melalui pengasama bertujuan untuk mengurangi efek hambatan dari pertukaran kation dengan cara pencucian kation dan Al3+ dalam kerangka zeolit dan posisinya akan digantikan oleh ion H+.
Pemberian suatu larutan asam mineral pada mineral zeolit akan menyebabkan:
1. Membukanya saluran ataupun rongga dari struktur zeolit melalui penghilangan pengaruh penutupan silika atau senyawa yang terbungkus pada saluran yang terjadi selama proses pembentukan zeolit.
2. Al pada kisi Kristal akan terlepas dan membentuk hidroksil zeolit.
Pemilihan konsentrasi larutan asam perlu diperhatikan. Pada konsentrasi tertentu, ternyata asam juga menghidrolisa aluminium dari kerangka zeolit sehingga merusak struktur zeolit (Sastiono,A. 1991).
2.4. Zeolit Alam Sarulla
Berdasarkan hasil penelitian laboratorium Departemen Pertambangan dan Energi Sumatera Utara, zeolit alam ada terdapat di Sarulla (Tapanuli Utara) yang
merupakan salah satu lokasi yang memiliki potensi zeolit alam yang besar. Penambangan zeolit di daerah ini umumnya dapat dilakukan dengan tambang terbuka dengan terlebih dahulu mengupas tanah penutupnya setebal antara 1 – 2 meter. Sedangkan jenis zeolit yang terdapat di Sarulla tersebut pada umumnya zeolit jenis klinoptilolit, Na6(Al6Si30O72).24H2O
Sifat-sifat yang dimiliki zeolit alam Sarulla, sebagai berikut: Warna : Putih Kehijauan
Pecahan : Chonchoidal (seperti kaca)
Sifat lain : ringan, kompak, padat
Tabel 2.1 Komposisi kimia yang terkandung dalam zeolit alam Sarulla
Senyawa Kandungan
Amoniak NH3, merupakan senyawa nitrogen yang menjadi NH4+ pada pH rendah
yang disebut amonium; amoniak sendiri berada dalam keadaan tereduksi (-3). Amoniak dalam air permukaan berasal dari air seni dan tinja; juga dari oksidasi zat organis (HaObCcNd) secara mikrobiologis, yang berasal dari air alam atau air
buangan dan penduduk.
Dapat dikatakan bahwa amoniak berada di mana-mana, dari kadar beberapa mg/l pada air permukaan dan air tanah, sampai kira-kira 30 mg/l lebih pada air buangan. Kadar amoniak yang tinggi pada air sungai selalu menunjukkan adanya pencemaran. Rasa NH3 kurang enak, sehingga kadar NH3 harus rendah;
pada air minum kadarnya harus nol dan pada air sungai harus dibawah 0,5 mg/l N (syarat mutu air sungai di Indonesia) (Alaerts, 1984).
Amoniak merupakan gas tajam yang tidak berwarna dengan titik didih -33,5oC. Cairannya mempunyai panas penguapan sebesar 1,37 kJ g-1 pada titik didihnya. Secara fisik cairan NH3 mirip dengan air dalam perilaku fisikanya
Dalam fase cair amoniak terdapat dalam dua bentuk, yaitu : bentuk amoniak bebas (NH3) dan bentuk ion ammonium (NH4+). Perbandingan jumlah keduanya sangat
dipengaruhi oleh pH dan suhu. NH3 + H2O NH4+ + OH
-Pada pH rendah bentuk yang paling banyak dijumpai adalah bentuk ion ammonium. Pada pH 11 atau lebih yang paling banyak dijumpai adalah bentuk ammonia bebas (Schroeder, 1977 dan Viesman, 1985).
Menurut Swingle dan Walter (1997), gas amoniak terbentuk dengan tiga cara, yaitu:
1. Dekomposisi Protein. Protein diuraikan oleh bakteri proteolitik menjadi asam amino. Asam amino mengalami deaminasi menghasilkan amoniak dan melalui proses ini dihasilkan amoniak paling banyak.
2. Hidrolisis Urea. Urea yang sebagian besar berasal dari limbah cair bersama asam urat dihidrolisis oleh enzim urease membentuk ammonium karbonat, yang mudah terurai menjadi gas amoniak, karbondioksida, dan air.
3. Reduksi Nitrat. Nitrat tereduksi menjadi nitrit dan selanjutnya nitrit tereduksi menjadi gas amoniak.
Dalam proses pengolahan lateks menjadi ribbed smoked sheet (RSS) diperlukan bahan pembantu yaitu amonia dan asam format (asam semut). Amoniak (NH3) dalam bentuk sikloheksilamin dan setelah diencerkan menjadi ammonium (NH4OH). Amoniak berfungsi sebagai antikoagulan dan juga desinfektan agar tidak terjadi pembusukan yang dapat menimbulkan bau. Tiap
2.6. Analisis Spektrofotometri
Intensitas warna adalah salah satu faktor utama dalam penentuan suatu analit secara spektrofotometri. Pada analisa spektrokimia, spectrum radiasi elektromagnetik digunakan untuk menganalisa spesies kimia dengan menelaah interaksinya dengan radiasi elektromagnetik. Radiasi berinteraksi dengan spesies kimia dan kita dapat memperoleh informasi mengenai spesies tersebut. Cara interaksinya dapat berupa absorpsi, penghamburan, atau pemendaran tergantung dari sifat materi.
Untuk menentukan konsentrasi suatu larutan secara kuantitatif dengan mengukur jumlah cahaya yang ditransmisikan, perlu ada suatu hubungan antara konsentrasi, larutan, dan transmisi cahayanya. Hubungan ini dinyatakan oleh Lambert-Beer (Day, R.A.Jr. 1983).
Bagian-bagian penting pada spektrofotometer adalah: (1) suatu sumber cahaya, (2) sebuah monokromator, yakni sebuah piranti untuk memancarkan
cahaya monokromatik atau lebih tepat, pita-pita sempit energi cahaya dari sumbernya, (3) sel/kuvet kaca atau silica atau pelarut dalam larutan yang diuji dan
tempat sebuah piranti untuk menerima atau mengukur berkas0berkas energy cahaya yang melewati pelarut atau larutan (Basset,J.1994).
2.6.1. Hukum Lambert
2.6.2. Hukum Beer
Beer (1850) menjumpai bahwa intensitas cahaya monokromatik berkurang secara eksponensial dengan bertambahnya konsentrasi zat penyerap secara linier (Basset,J.1994).
2.6.3. Hukum Lambert-Beer
Gabungan hukum Lambert-Beer dapat dituliskan sebagai berikut:
Dimana: Io : Intensitas radiasi yang datang
It : Intensitas radiasi yang diteruskan
: Absorbansi molar (L.mol-1.cm-1) b : Tebal larutan yang dilalui sinar (cm) c : Konsentrasi (mol L-1)
Analisis dengan spektrofotometri uv/vis selalu melibatkan pembacaan absorbansi radiasi elektromagnetik oleh molekul atau radiasi elektromagnetik yang diteruskan. Keduanya dikenal sebagai absorbansi (A) tanpa satuan dan transmitansi dengan satuan % (%T).
Secara matematik, hubungan antara %T dan A, adalah :
A = 2 – log %T dimana:
A : absorbansi
Grafik absorbansi versus konsentrasi diketahui sebagai lukisan hokum Beer. Kurva spektrum yang diperoleh membantu sebagai petunjuk dalam menyelidiki sebuah panjang gelombang yang diinginkan untuk sebuah analisa (Mulja,M.1995).
2.7. Penentuan Amoniak secara Spektrofotometri
Amoniak dapat ditentukan dengan atau tanpa didahului oleh suatu pengolahan pendahuluan (destilasi). Bila destilasi tidak dilakukan maka amoknia langsung ditentukan dengan analisis Nessler atau melalui titrasi. Destilasi tidak dilakukan bila sampel cukup jernih yaitu tidak melebihi batas kadar kekeruhan 10 NTU dan batas kadar warna 5 mg Pt-Co/L. Keadaan ini terdapat pada air PDAM, air sungai jernih, air sumur jernih, dan effluent system pengolahan air buangan yang jernih. Destilasi perlu dilakukan pada sampel air buangan penduduk, air buangan industri, air sungai yang keruh dan air yang mengandung warna.
Pada proses destilasi, hasil yang mengandung amoniak ditampung dalam
larutan absorben asam borat. Kadar nitrogen kemudian ditentukan dengan metode Nessler atau melalui titrasi dengan standar asam sulfat dan penambahan indikator campuran. Pemilihan metode berdasarkan perkiraan ammonia dalam sampel. Bila perkiraan kadar ammonia dalam sampel antara 1 sampai 25 mg/L maka digunakan titrasi dengan standar asam sulfat, bila kadar ammonia antara 0,05 sampai 5 mg/L dapat ditentukan dengan metode Nessler. Kadar amoniak >5 mg/L juga dapat ditentukan dengan metode Nessler dengan pengenceran.
larutan yang bersifat basa. Reaksi yang menghasilkan larutan berwarna
kuning-cokelat yang mengikuti hokum Beer-Lambert. Intensitas warna yang terjadi berbanding lurus dengan konsentrasi NH3 yang terdapat dalam sampel, yang
kemudian ditentukan secara spektrofotometri (Alaerts.G. 1984).
Reagen Nessler dibuat dengan melarutkan 100 g Merkurium(II)Iodida dan 70 g Kalium iodida dalam 100cm3 air bebas ammonia, kemudian ditambahkan perlahan-lahan ke dalam larutan yang telah didinginkan dari 160 g NaOH dalam 700 cm3 air bebas ammonia. Biarkan endapan turun, sebaiknya untuk beberapa hari, sebelum menggunakan cairan di atasnya. Bila 1 cm3 reagen Nessler ditambahkan ake dalam contoh, dapat diukur serapannya dalam daerah panjang gelombang 400-425 nm dengan menggunakan spektrofotometer visibel (Basset,J.1994).
2.8. Gangguan dalam analisis Nessler
Gangguan dalam analisis amoniak secara Nessler adalah kekeruhan dan warna. Pada analisis Nessler tanpa destilasi sampel jernih harus ditambahkan larutan basa
dan ZnSO4 untuk mencegah gangguan ion Ca, Mg, Fe, dan Sn yang dapat
menimbulkan kekeruhan. Dengan penambahan larutan basa dan ZnSO4, ion-ion
tersebut akan mengendap. Larutan sampel akan bebas gangguan setelah pengendapan 15 sampai 30 menit. Kemudian penambahan EDTA membantu agar sisa-sisa ion Ca, Mg, dan Fe dalam larutan tidak ikut mengendap. Dengan destilasi sampel, gangguan warna dan kekeruhan akan hilang, sedang kation yang dapat menimbulkan kekeruhan diendapkan dengan pH tinggi (Alaerts, G. 1984).
Dilihat dari tahapan poduksi baik dari bahan baku berasal dari lateks dan bahan
olahan karet rakyat (bokar), maka limbah yang terbentuk pada industri karet dapat berupa limbah padat, limbah cair, dan limbah gas. Kualitas bahan baku berpengaruh terhadap tingkat kuantitas dan kualitas limbah yang akan terjadi dengan rincian sebagai berikut :
1. Semakin kotor bahan karet olahan akan mkin banyak air yang diperlukan untuk proses pembersihannya, sehingga debit limbah cairpun meningkat.
2. Semakin kotor dan makin tinggi kadar air dari bahan baku karet olahan, akan semakin mudah terjadinya pembusukan, sehingga kuantitas limbah gas/bau pun meningkat.
3. Bahan baku karet olahan yang kotor menyebabkan kuantitas lumpur, tatal dan pasir relatif tinggi.
Pembersihan dilakukan melalui pengecilan ukuran, proses ini juga bertujuan untuk memperbesar luas pemukaan karet agar waktu pengeringan relatif singkat. Dengan demikian, limbah yang terbentuk dominan berbentuk limbah cair. Sumber limbah cair dapat dikategorikan dari proses produksi dengan rincian sebagai berikut:
1. Bahan baku olahan karet rakyat Bahan baku karet rakyat berbentuk koagulum
(bongkahan) yang telah dibubuhi asamsemut, dan banyak mengandung air dan unsur pengotor dari karet baik disengaja maupun tidak disengaja oleh kebun
rakyat. Sumber limbahnya antara lain: a. penyimpanan koagulum
b. sebelum produksi terlebih dulu karet disempot air sehingga menghasilkan limbah
peremahan. Pengaruh tiap parameter terhadap lingukungan dapat dijelaskan
sebagai berikut:
a. BOD
BOD merupakan salah satu parameter limbah yang diberi gambaran atas tingkat polusi air. Semakin tinggi nilai BOD menunjukkan makin besar oksigen yang dibutuhkan olehmikroorganisme merubah organik. Semakin tinggi kandungan bahan organik akan menyebabkan makn berkurangnya konsentrasi oksigen terlarut di dalam air yang akhirnya berakibat kematian berbagai biota air. Pengurangan konsentrasi oksigen terlarut menyebabkan kondisi aerob bergeser ke kondisi anaerob.
b. COD
COD mirip dengan BOD, bedanya osigen yang diperlukan merupakan oksigen kimiawi seperti O2 atau oksidator lainnya untuk mengoksidasi secara kimia bahan
organik menjadi senyawa lain seperti gas metan, amoniak, dan karbon dioksida. Nilai COD selalu lebih tinggi daripada nilai BOD karena hampir seluruh jenis bahan organik dapat teroksidasi secara kimia termasuk bahan organik yang teroksidasi secara biologis.
c. Padatan Terendap
Padatan terendap menunjukkan jenos padatan yang terkandung di dalam cairan limbah yang mampu mengendap di dasar cairan secara gravitasi dalam waktu paling lama sekitar 1 jam.
d. Padatan Tersuspensi
Padatan tersuspensi adalah padatan yang membentuk suspensi atau koloid. Secarakasat mata padatan ini terlihat mengapung atau mengambang serta mengeruhkan air karena berat jenisnya relatif rendah.
Padatan ini bersama-sama dengan suspensi koloid tidak dapat dipisahkan secara
penyaringan. Pemisahannya hanya dapat dilakukan dengan proses oksidasi biologis atau koagulasi kimia.
f. Kandungan Nitrogen
Bentuk senyawa nitrogen yang paling umum adalah protein amonia, nitrit dan nitrat. Ketiga jenis terakhir ini dihasilkan dari perombakan protein, sisa tanaman dan pupuk yang tersisa di dalam cairan limbah.
g. Derajat Keasaman (pH)
Suatu cairan dikatan bersifat normal bila pH = 7. Semakin rendah nilai pH artinya air makin bersifat asam, sebaliknya makin tinggi bersifat basa.
2.9.1. Limbah Yang Dihasilkan
a. Limbah Cair
Limbah cair karet merupakan air sisa produksi dari pengolahan karet menjadi benang karet dan air dari pembersihan alat/area. Limbah karet mengandung
amoniak dan nitrogen total yang berbahaya apabila melewati batas standar yang telah ditetapkan sehingga dapat mencemari air sungai dan lingkungan sekitarnya.
Pengolahan limbah cair tersebut dilakukan dengan menampungnya pada bak penampungan limbah untuk kemudian diendapkan, disaring dan sisanya dialirkan ke lingkungan.
b. Limbah Padat
Limbah padat yang dihasilkan berupa busa lateks dan sisa slab. Limbah padat hasil pengolahan dari IPAL berasal dari proses koagulasi kimia dengan Ferosulfat dikeringkan di drying bed ditampung di bak penampung.
BAB I
PENDAHULUAN
1.1. Latar Belakang
Keberadaan industri di Sumatera Utara tidak terlepas dari permasalahan mengenai pengolahan limbah, baik padat, cair, dan gas. Dari sekian banyak industri yang ada di Sumatera Utara, terdapat industri pengolahan lateks yang di dalam operasinya menggunakan amoniak sebagai anti koagulan, pengawet, dan juga
menggunakan diammonium fosfat untuk mengendapkan magnesium yang mana, dalam tahap akhirnya, sebagian besar amoniak ini akan tercampur di dalam limbah cair dan jika langsung dibuang ke perairan bebas akan menyebabkan gangguan terhadap ekosistem perairan dan akan menimbulkan polusi udara karena akan menimbulkan bau busuk. Penanggulangan masalah limbah tersebut dapat dilakukan dengan menggunakan adsorben. Salah satu adsorben yang dapat digunakan yaitu zeolit.
limbah pabrik karet di dalam penelitian ini. Zeolit alam memiliki kemampuan
adsorpsi dan pertukaran ion yang sangat tinggi namun zeolit alam memiliki beberapa kelemahan, yaitu mengandung banyak pengotor seperti Na, K, Ca, Mg dan kristalinnya kurang baik (Yuanita,2010). Oleh karena itu, zeolit harus diaktivasi baik secara fisika ataupun secara kimia untuk meningkatkan daya adsorpsivitasnya.
Pemakaian zeolit sebagai adsorben sudah pernah dilakukan, hanya saja zeolit tersebut kebanyakan digunakan untuk menyerap logam – logam berat pada air. Simanjuntak pada tahun 2013, melakukan penelitian tentang Studi Perbandingan daya Serap Zeolit Aktif dengan Zeolit Termodifikasi Etilendiamintetraasetat (EDTA) sebagai adsorben ion campuran Tembaga (II), Nikel (II) dan Zinkum (II). Simangunsong pada tahun 2011 tentang Optimasi Suhu Aktivasi dan Dosis Zeolit sebagai Adsorben Seng dan Besi yang Terkandung di Dalam Limbah Cair Industri Sarung Tangan Karet. Rina pada tahun 2012 tentang Modifikasi Zeolit Alam dengan Nano Kitosan sebagai Adsorben Ion Logam Berat dan Studi Kinetikanya terhadap Ion Pb(II).
Saragih pada tahun 2013, tentang Pemanfaatan Kembali Zeolit Alam Setelah Mengalami Proses Regenerasi Sebagai Penyerap Logam Cu (Tembaga) Dan Zn
(Seng) Di Dalam Air Limbah Industri Pertambangan Emas.
Penggunaan zeolit alam dalam menyerap amoniak belum banyak dilakukan. Widiastuti dan Handayani, 2010 melakukan penelitian tentang Adsorpsi Amonium (NH4+) dengan menggunakan zeolit berkarbon dan zeolit A
yang disintesis dari Abu dasar Batubara PT. IPMOMI PAITON. Harahap pada tahun 2013 melakukan penelitian tentang Pemanfaatan Zeolit Alam Sarulla sebagai Penyerap Amonium/Amoniak dari Limbah Cair Peternakan Babi.
Selain itu, perolehan kembali (recovery) amoniak yang telah diserap zeolit juga belum banyak dilakukan. Penelitian sebelumnya dilakukan tentang perolehan kembali (recovery) ammoniak dari serum pengolahan lateks pekat dengan metode stripping amoniak, dimana hasil yang diperoleh sebesar 94% (3529 ± 4,4357) mg/L ammoniak (Renta,M.L.T, Nainggolan S, dan Nainggolan H.1997).
Dari uraian di atas, penulis tertarik untuk melakukan penelitian dengan judul “Studi Penyerapan Amoniak dari Limbah Pabrik Karet dengan Menggunakan Zeolit Alam Serta Perolehan Kembali (Recovery) Amoniak yang Telah Diserap Zeolit”, karena sampai saat ini belum banyak informasi tentang petunjuk penggunaan zeolit untuk tujuan penyerapan komponen-komponen
tertentu di dalam limbah cair khususnya amoniak.
1.2. Permasalahan
1. Apakah zeolit alam dapat menyerap amoniak dari limbah pabrik karet? 2. Apakah amoniak yang telah diserap oleh zeolit dapat diperoleh kembali
(direcovery)?
1.3. Pembatasan Masalah
1. Penelitian ini menggunakan Zeolit Alam Sarulla yang diaktivasi pada suhu 250oC selama 3 jam.
2. Variasi massa zeolit aktif yang digunakan sebagai penyerap adalah 2 gram, 4 gram, 6 gram, 8 gram, dan 10 gram untuk 100 mL limbah cair.
3. Sampel air limbah diambil dari salah satu pabrik karet yang terdapat di Kisaran.
1.4. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kemampuan Zeolit Alam Sarulla dalam menyerap amoniak dari limbah pabrik karet dan untuk mengetahui apakah amoniak yang telah diserap oleh zeolit tersebut dapat diperoleh kembali (direcovery), serta untuk mengetahui berapa persen hasil perolehan kembali (recovery) amoniak yang telah diserap oleh zeolit alam.
1.5. Manfaat Penelitian
Penelitian ini berguna sebagai informasi penggunaan zeolit sebagai penyerapan amoniak dari limbah pabrik karet untuk mengurangi polusi air dan polusi udara.
1.6. Lokasi Penelitian
1.7. Metodologi Penelitian
1. Penelitian ini merupakan penelitian laboratorium yang bersifat purposif (tujuan khusus).
2. Pada penelitian digunakan metode impregnasi basah, yaitu perendaman zeolit dalam limbah cair dengan variasi massa zeolit aktif..
3. Zeolit yang digunakan diambil dari Sarulla Kecamatan Pahae kabupaten Tapanuli Utara.
4. Zeolit diayak pada 100 mesh.
5. Aktivasi zeolit dilakukan secara fisika yaitu pemanasan pada suhu 250oC. 6. Sampel yang digunakan adalah limbah cair buangan pertama dari salah
satu pabrik karet yang terdapat di Kisaran.
STUDI PENYERAPAN AMONIAK DARI LIMBAH PABRIK KARET DENGAN MENGGUNAKAN ZEOLIT ALAM SERTA PEROLEHAN
KEMBALI (RECOVERY) AMONIAK YANG TELAH DISERAP ZEOLIT
ABSTRAK
THE STUDY ON AMMONIA ABSORPTION FROM WASTE RUBBER FACTORY WITH USE NATURAL ZEOLITE AND AMMONIA
RECOVERY WHICH HAS BEEN ABSORBED BY THE ZEOLITE
ABSTRACT
STUDI PENYERAPAN AMONIAK DARI LIMBAH PABRIK KARET
DENGAN MENGGUNAKAN ZEOLIT ALAM SERTA
PEROLEHAN KEMBALI (RECOVERY)
AMONIAK YANG TELAH
DISERAP ZEOLIT
SKRIPSI
EMILIA YOLANDA HUTAPEA
090802012
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
STUDI PENYERAPAN AMONIAK DARI LIMBAH PABRIK KARET DENGAN MENGGUNAKAN ZEOLIT ALAM SERTA
PEROLEHAN KEMBALI (RECOVERY) AMONIAK YANG TELAH
DISERAP ZEOLIT
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
EMILIA YOLANDA HUTAPEA 090802012
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : STUDI PENYERAPAN AMONIAK DARI
LIMBAH PABRIK KARET DENGAN MENGGUNAKAN ZEOLIT ALAM SERTA PEROLEHAN KEMBALI (RECOVERY)
AMONIAK YANG TELAH DISERAP ZEOLIT
Kategori : SKRIPSI
Nama : EMILIA YOLANDA HUTAPEA
NIM : 090802012
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM ( FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di,
Medan, April 2014
KomisiPembimbing :
DosenPembimbing 2, DosenPembimbing 1,
Dr. Hamonangan Nainggolan, M.Sc Jamahir Gultom, Ph.D NIP. 195510131986011001 NIP.195209251977031001
DisetujuiOleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
STUDI PENYERAPAN AMONIAK DARI LIMBAH PABRIK KARET DENGAN MENGGUNAKAN ZEOLIT ALAM SERTA
PEROLEHAN KEMBALI (RECOVERY) AMONIAK YANG TELAH
DISERAP ZEOLIT
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing – masing disebutkan sumbernya.
Medan, Maret 2014
PENGHARGAAN
Segala puji serta syukur kepada Tuhan Yesus Kristus yang telah memberikan kasih karuniaNya kepada Penulis sehingga dapat menyelesaikan penelitian dan penulisan skripsi ini. Skripsi ini merupakan tugas akhir untuk melengkapi salah satu syarat untuk memeperoleh gelar sarjana Kimia Universitas Sumatera Utara.
Selanjutnya, Penulis ingin mempersembahkan skripsi ini kepada Ayahanda tercinta W. Hutapea dan Ibunda tercinta Alm. M. br Matondang yang selalu mengasihi dan mendukung baik moril maupun materil serta memberikan doa restu kepada penulis mulai dari masa perkuliahan sampai selesainya skripsi ini. Juga kepada Bang Andi, Kak Ika, Noni, Bang Jefri, Kak Nova, Wewen, Bang Hendrik, Tante Tian, serta seluruh keluarga yang tak dapat dituliskan satu persatu.
Dengan segala kerendahan hati, penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Bapak Jamahir Gultom, Ph.D selaku dosen pembimbing I penulis, serta Bapak Dr. Hamonangan Nainggolan, M.Sc selaku dosen pembimbing II penulis yang selalu dengan penuh perhatian dan kesabaran membimbing dan mengarahkan penulis selama melakukan penelitian hingga selesainya skripsi ini.
2. Bapak Prof. Harlem Marpaung selaku Kepala Laboratorium bidang Kimia Analitik FMIPA USU yang telah memberikan saran – saran kepada penulis.
3. Ketua dan Sekretaris Departemen Kimia FMIPA USU, Ibu Dr. Rumondang Bulan Nst, MS dan Bapak Dr. Albert Pasaribu yang turut memberikan pengarahan dan mensahkan skripsi ini.
4. Ibu Dra. Saur Lumbanraja, M.Si selaku dosen pembimbing akademis yang telah membimbing penulis selama mengikuti perkuliahan di FMIPA USU Medan.
5. Kepada Laboran dan seluruh asisten Kimia Analitik FMIPA USU Kak Tiwi, Kak Indah, Kak Bela, Royman, Desta, Juli, Malem, dan adik-adikku Zulfanri, Beni, Dorkas, Wiwi, Andi, Roberta, Fatya, Ena, Emi atas bantuan dan semangatnya selama ini.
6. Sahabat terbaik sekaligus keluarga penulis ABLE, Sheyla, Malem, Melda, Sabam, Iwan, Royman, Sudirman atas segala dukungan, doa, semangat serta kebersamaan selama ini. Juga kepada Bang Michel, Bang Aditra, Bang Gomgom, Bang Bachtiar, Bang Frans, Bang Noaksen, Bang Johntinus untuk segala bantuan serta dukungannya kepada penulis. Juga kepada SPD-IC Vames, Chanwi, Juliana Tarigan, Ana, Gloria, Dwi, serta semua sahabat penulis.
STUDI PENYERAPAN AMONIAK DARI LIMBAH PABRIK KARET DENGAN MENGGUNAKAN ZEOLIT ALAM SERTA PEROLEHAN
KEMBALI (RECOVERY) AMONIAK YANG TELAH DISERAP ZEOLIT
ABSTRAK
THE STUDY ON AMMONIA ABSORPTION FROM WASTE RUBBER FACTORY WITH USE NATURAL ZEOLITE AND AMMONIA
RECOVERY WHICH HAS BEEN ABSORBED BY THE ZEOLITE
ABSTRACT
DAFTAR ISI
Bab 1. Pendahuluan 1.1.
2.7. Penentuan Amoniak Secara Spektrofotometri 15
2.8. Gangguan dalam Analisis Nessler 16
2.9. Sumber Limbah Cair Industri Karet 16
2.9.1. Limbah yang Dihasilkan 19
Bab 3. Bahan dan Metode Penelitian 3.1. Bahan 20
3.3.10. Pembuatan Kurva Kalibrasi Larutan Standar Amoniak 23
3.3.11. Pengambilan dan Pengawetan Sampel 23
3.3.12. Pengolahan Limbah Cair Pabrik Karet 23
3.3.12.1. Destilasi limbah cair Pabrik Karet 23
3.3.13. Penentuan Amoniak yang diserap oleh Zeolit Aktif 24
3.3.14. Recovery Amoniak 24
3.4. Bagan Penelitian 3.4.1. Pengolahan Zeolit 25
3.4.1.1. Preparasi Zeolit 25
3.4.2. Pembuatan Kurva Kalibrasi Larutan Standar Amoniak 26
3.4.3. Pengambilan dan Pengawetan Sampel 27
3.4.4. Pengolahan Limbah Cair Pabrik Karet 28
3.4.4.1. Destilasi Limbah Cair Pabrik Karet 28
3.4.4.2. Penentuan Amoniak yang Diserap Zeolit Aktif 29
3.4.5. Recovery Amoniak 30
Bab 4. Hasil dan Pembahasan 4.1. Hasil Penelitian 31
4.2. Pengolahan Data 32
4.2.1. Penentuan Amoniak yang Terserap Zeolit Aktif 32
4.2.1.1. Penurunan Persamaan Garis Regresi Untuk Kurva Kalibrasi 32
4.2.1.3. Penentuan Amoniak yang Telah
Diserap Oleh Zeolit Aktif 34
4.2.1.4. Penentuan Amoniak Sisa Setelah Diserap Oleh Zeolit Aktif dari Limbah Pabrik Karet (mg/L) 35
4.2.1.5. Perhitungan Jumlah Amoniak Terserap 36
4.2.1.6. Penentuan Amoniak Hasil Recovery 37
4.2.1.7. Perhitungan Jumlah Amoniak Terrecovery 38
4.3. Pembahasan 39
Bab 5. Kesimpulan dan Saran 5.1. Kesimpulan 42
5.2. Saran 42
DAFTAR TABEL
Nomor Judul Halaman
Tabel
2.1. Komposisi Kimia Yang Terkandung dalam Zeolit 11
4.1. Data Hasil Penyerapan Amoniak Oleh Zeolit 30
4.2. Data Hasil Recovery Amoniak Setelah Diserap Zeolit 30
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lamp
1. Data Hasil Penyerapan Amoniak oleh Zeolit Aktif 43