ABSTRAK
PREPARASI DAN KARAKTERISASI NANOKATALIS Ni0,7Cu0,3Fe2O4 UNTUK UJI KATALITIK PADA KONVERSI SELULOSA MENJADI
GULA ALKOHOL
Oleh
EVA DEWI NOVIYANTHI. S
Telah dilakukan preparasi nanokatalis Ni0,7Cu0,3Fe2O4 dengan metode sol gel-
freezedry menggunakan pektin sebagai agen pengemulsi pada suhu kalsinasi 600
dan 800ºC serta uji aktivitas katalitiknya dalam mengkonversi selulosa menjadi gula alkohol. Karakterisasi katalis meliputi analisis fasa kristalin menggunakan XRD, analisis keasaman katalis menggunakan FTIR, analisis distribusi ukuran partikel menggunakan PSA, serta analisis morfologi permukaan menggunakan TEM. Selanjutnya, hasil konversi uji katalitik selulosa dianalisis menggunakan KCKT. Analisis difraksi sinar-X (XRD) menunjukan terbentuknya struktur katalis Ni0,7Cu0,3Fe2O4. Katalis suhu kalsinasi 600 dan 800oC menunjukkan jenis
situs asam Brönsted-Lowry dengan jumlah situs asam masing-masing 5,53 mmol piridin/g dan 4,30 mmol piridin/g serta memiliki volume distribusi partikel sebesar 22,30 dan 13,60 % pada rentang 10–100 nm. Analisis morfologi pada katalis suhu kalsinasi 600oC menunjukkan persebaran yang seragam dan merata. Katalis Ni0,7Cu0,3Fe2O4 suhu kalsinasi 600oC mampu mengkonversi selulosa dan
menghasilkan sorbitol 0,046%, mannitol 76,89% serta fruktosa sebagai produk konversi.
ABSTRACT
PREPARATION AND CHARACTERIZATION NANO-SIZE Ni0.7Cu0.3Fe2O4 AS CATALYTIC FOR CONVERSION OF CELLULOSE
INTO SUGAR ALCOHOL
By
EVA DEWI NOVIYANTHI. S
Ni0.7Cu0.3Fe2O4 nanocatalyst has been prepared with sol gel- freezedry method
using pectin as emultion agent, followed by calcination at temperature of 600 and 800ºC, respectively and then applied for conversion of cellulose into alcohol sugar. Catalyst was characterized using X-ray Difraction (XRD) for identifying crystalline phase formed, Fourier Transform Infra Red (FTIR) for acid sites identification, Particle Size Analyzer (PSA) for distribution of the particles, and Transmission Electron Microscopy (TEM) for surface morphology determination. Then the product of catalytic experiment was analysed using HPLC. XRD analysis confirmed that the Ni0.7Cu0.3Fe2O4 has been formed. The FTIR results
indicate the presence of Brönsted-Lowry acid site, with the acidity of 5.53 mmol piridine/g for the catalyst calcined at 600ºC, and 4.30 mmol piridine/g for the catalyst calcined at 800ºC. According to PSA, the quantity of the particle in nano size (10-100 nm) accounts for 22.30 and 13.60 % in the catalyst calcined at 600 and 800ºC, respectively. The catalyst has a homogeneous surface morphology as seen by TEM. The catalyst calcined at 600ºC was found to result in conversion of cellulose into sorbitol (0.046%) and mannitol (76.9%), with fructose as additional product.
PREPARASI DAN KARAKTERISASI NANOKATALIS Ni0,7Cu0,3Fe2O4 UNTUK UJI KATALITIK PADA KONVERSI SELULOSA MENJADI
GULA ALKOHOL
Oleh
Eva Dewi Noviyanthi. S
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 27 November 1993, anak pertama dari tiga bersaudara pasangan bapak Nelson Sirait dan ibu Sumihar Adelina Hutapea. Penulis menyelesaikan pendidikan Taman Kanak-Kanak di TK. Xaverius 3 Bandar Lampung pada Tahun 1997. Pendidikan Sekolah Dasar di Xaverius 3 Bandar Lampung pada tahun 2005, dan Sekolah Menengah Pertama di Xaverius 4 Bandar Lampung pada tahun 2008. Penulis kemudian menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negri 3 Bandar Lampung pada tahun 2011. Pada tahun yang sama penulis juga diterima sebagai mahasiswa Jurusan S1 Kimia FMIPA Universitas Lampung melalui jalur undangan SNMPTN.
PERSEMBAHAN
Segala puji, hormat serta ucapan syukur kepada Tuhan Yesus Kristus,
dengan ketulusan hati, kupersembahkan karya ini sebagai cinta-kasih dan tanggung
jawabku kepada :
Bapakku terkasih Nelson Sirait dan Mamahku tersayang Sumihar Adelina Hutapea
yang selalu berjuang untukku dan senantiasa
mendoakanku, mendukungku, memotivasiku
disetiap perjalanan hidupku,
Adik-adikku tersayang
Edy Haryanto Sirait dan Djob Albert Grandito Sirait
yang selalu menyayangiku, mendoakan, menyemangatiku, menghiburku, dan selalu
memberikan keceriaan di dalam hidupku,
Dosen-dosen yang senantiasa membimbing dan memberikan ilmunya untukku,
Segenap keluarga besarku yang senantiasa mendoakan keberhasilanku,
Almamater tercinta
Segala hal adalah mungkin,
tak ada yang mustahil untuk dilakukan.
Apapun bisa dilakukan,
karena adanya Keinginan, Semangat dan juga Tekad.
Dan aku percaya Keberhasilan itu tidak akan mengecewakan,
Saat aku mau Bekerja keras tanpa henti, Berusaha dan
tentunya selalu Berdoa.
Sejauh mana engkau mau Tuhan campur tangan dalam hidupmu, maka sejauh itulah Dia akan campur tangan dalam hidupmu
Dia memberi Kekuatan pada yang lelah
dan menambah Semangat kepada yang tiada berdaya
(Yesaya 40:29)
Orang yang hebat
tidak dihasilkan melalui : Kemudahan, Kesenangan dan
Ketenangan.
SANWACANA
Shalom..,
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus, atas segala kasih, berkat dan karunia-Nya yang melimpah sehingga penulis mampu menyelesaikan skripsi ini sebagai salah satu syarat untuk mendapatkan gelar Sarjana Sains pada Jurusan Kimia FMIPA Unila yang berjudul :
PREPARASI DAN KARAKTERISASI NANOKATALIS Ni0,7Cu0,3Fe2O4 UNTUK UJI KATALITIK PADA KONVERSI SELULOSA
MENJADI GULA ALKOHOL
Tidak sedikit kendala yang dihadapi penulis dalam pelaksanaan serta dalam proses penulisan skripsi ini, tapi berkat penyertaan Tuhan Yesus Kristus juga bantuan dan semangat melalui orang-orang terkasih yang dipercaya untuk membantu penulis, sehingga skripsi ini dapat terselesaikan dengan baik.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada :
penulis atas bimbingan, kesediaan waktu, bantuan, saran, solusi serta nasihat dalam menyelesaikan skripsi ini.
3. Ibu Dr. Noviany, M.Si selaku Pembahas atas segala saran dan kritik yang sangat membangun dalam penulisan skripsi ini.
4. Bapak Prof. Dr. John Hendri M.S. selaku Pembimbing akademik pertama atas segala saran, bantuan, kritikan, dukungan moral serta motivasi kepada penulis selama ini.
5. Ibu Dra. Zipora Sembirng, M.S selaku Pembimbing akademik kedua atas bimbingannya selama ini kepada penulis.
6. Bapak Dr. Eng Suripto Dwi Yuwono., M.T. selaku Ketua Jurusan Kimia FMIPA Universitas Lampung.
7. Prof. Dr. Suharso, Ph.D selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
8. Seluruh dosen FMIPA Unila yang telah mendidik dan memberikan ilmu pengetahuan yang sangat berguna kepada penulis selama kuliah.
9. Segenap staf pengajar dan karyawan khususnya Jurusan Kimia dan FMIPA Universitas Lampung pada umumnya.
12.Teruntuk keluarga besar Op. Simon Sirait (Alm)/ br. Napitupulu dan keluarga besar Op. Purnama Hutapea (Alm)/ br. Butar-butar (Alm) terimakasih atas cinta, kasih, doa, dan dukungannya kepada penulis.
13.Ramos Vicher Hutajulu, S.Si. terima kasih atas segala doa, semangat, dukungan, motivasi, saran, kritik, nasihat dan bantuannya hingga penulis dapat menyelesaikan skripsi ini. Kiranya Tuhan Yesus selalu menyertai mu.
14.Sahabat-sahabat tersayang penulis Florensia Bangun, S.Pd (Flo); Kinana Hasda, A.Md (Kiki) ; Ruspinondang (Ondang) ; Domonica Atma (Dome), Marisa Merary (Ica) serta Bang Mean yang selalu menemani, memotivasi dan memberi semangat atas segala keluh kesah penulis.
15.Mbak Liza Apriliya S, S.Si selaku Laboran Laboratorium Kimia Anorganik/Fisik atas bantuan dan saran dalam kepada penulis dalam melaksanakan penelitian.
16.Catalyst Crew; Kak Septian M.Si, Pak Rodi M.Si, Kak Dani S.Si, Mbak
kebersamaan, canda tawa dan saran dalam memberikan arahan pada penelitian ini. Terimakasih banyak ya buat kalian.
18.Ivan Halomoan S.Si (Abang) dan Jelita P. Saroinsong, trimakasih untuk kebersamaan yang telah kita lewati dari awal perkuliahan.
19.Keluarga Cheven kesayangan ; Ajeng, Ana, Anggino, April, Ari, Arik, Asti S.Si, Ay-Ay, Ayu, Azies, Cindy, Daniar, Dewi S.Si, Dia, Gegek S.Si (Endah), Mila, Fatma, Bejo (Windi), Tante (Frederica), Irkham, Abang S.Si (Ivan), J.J (Julianser), Tata (Jelita), Lili S.Si (Jelita Siahaan), Junaidi, Lewi, Lusi S.Si, Mardian, Mega, Melli S.Si, Mely S.Si, Bunny S.Si (Miftah), Mirfat, M.Andri, M.Yusri, Nico S.Si, Nira, Nopitasari, Pandegani, Ridho S.Si, Rina, Rio F, Rio W, Yudha, Umi, Uswatun, Vevi, Wagiran S.Si, Yulia, Yunia atas persahabatan, pertemanan, kebersamaan dan kekeluargaannya yang terjalin selama ini. Trimakasih untuk semuanya.
20.Adik-adik ku Netty Manalu, Hermayan Simamora, Yunitri Sianturi (Tri B) ; Sophian, Arya, Edy, Della (Biopolimer Crew) ; dan adik-adik Lab. Polimer lainnya. Trimakasih untuk kebersamaan, bantuan, canda tawa juga semangat dari kalian.
21.Keluarga Besar POMMIPA yang tidak bisa disebutkan satu-satu namanya, terimakasih untuk kebersamaan selama kepelayanan kita. Kiranya Tuhan Yesus selalu menyertai kita semua. Amin.
24.Semua pihak yang tidak dapat penulis sebutkan satu persatu yang secara tulus memberikan bantuan moril dan materil kepada penulis.
Penulis menyadari bahwa skripsi ini masih terdapat kekurangan, namun penulis berharap skripsi ini dapat bermanfaat dan berguna bagi rekan–rekan khususnya mahasiswa kimia dan pembaca pada umumnya.
Bandar lampung, 23 November 2015
DAFTAR ISI
C. Metode Preparasi Katalis... 11
1. Distribusi komponen prekursor pada permukaan katalis... 11
2. Penentuan Morfologi Kristalin Katalis... 29
3. Penentuan Ukuran Partikel Katalis... 31
4. Penentuan Fasa Kristalin Katalis... 32
I. Kromatografi Cair Kinerja Tinggi (KCKT)... 34
III. METODE PENELITIAN……...……….. 39
A. Waktu dan Tempat Penelitian...………….…………... 39
C. Prosedur Kerja …...………...………... 40
1. Pembuatan Nanokatalis... 40
2 Karakterisasi Katalis... 41
a. Analisis Struktur Katalis... 41
b. Analisis Morfologi Katalis... 42
c. Analisis Distribusi Ukuran Partikel Katalis... 42
d. Analisis Keasaman Katalis... 42
3. Uji Katalitik... 44
4. Analisis dengan Kromatografi Cair Kinerja Tinggi (KCKT) ... 45
IV. HASIL DAN PEMBAHASAN………....……….. 46
A. Pembuatan Nanokatalis Ni0,7Cu0,3FeO4... 46
B. Karakterisasi Nanokatalis...…………. 50
1. Analisis Fasa Kristalin Katalis... 51
2. Analisis Keasaman Katalis... 56
3. Analisis Ukuran Partikel Katalis... 62
4. Uji Katalitik... 66
5. Analisis Morfologi Permukaan Katalis Terbaik... 73
V. KESIMPULAN DAN SARAN... 75
A. KESIMPULAN………... 75
B. SARAN……….... 76
DAFTAR PUSTAKA……… 77
DAFTAR TABEL
Tabel Halaman
1. Pengaruh tekanan, waktu, dan temperatur pada rendemen gula alkohol 23
2. Puncak-puncak representatif difraktogram katalis Ni0,7Cu0,3Fe2O4... 51
3. Puncak-puncak representatif masing-masing difraktogram acuan pada katalis Ni0,7Cu0,3Fe2O4... 54
4. Presentase fasa-fasa kristalin pada katalis Ni0,7Cu0,3Fe2O4... 55
5. Jumlah situs asam per 1 gram katalis Ni0,7Cu0,3Fe2O4... 56
6. Distribusi ukuran partikel Ni0,7Cu0,3Fe2O4 600oC... 62
7. Distribusi ukuran partikel Ni0,7Cu0,3Fe2O4 800oC... 63
8. Hasil produk dari konversi selulosa dengan katalis Ni0,7Cu0,3Fe2O4... 69
9. Data 2θ dan nilai FWHM difaktogram fasa kristalin... 89
10. Data pengukuran jumlah situs asam katalis... 90
11. Data analisa spektrum FTIR pektin... 91
12. Data hasil analisa spektrum FTIR katalis Ni0,7Cu0,3Fe2O4... 91
13. Data hasil distribusi ukuran partikel (10-100 nm)... 92
DAFTAR GAMBAR
Gambar Halaman 1. (a) Struktur α-galakturonat, (b) Struktur metilasi α-galakturonat, (c)
Struktur pektin... 16
2. Struktur Kristal Spinel Ferite... 19
3. Struktur Selulosa... 20
4. Reaksi konversi selulosa menjadi sorbitol dan mannitol... 23
5. Reaksi konversi xylitol... 24
6. Reaksi basa piridin... 28
7. Spektra IR dari katalis NiFe2O4, Co3O4, dan Co3O4/NiFe2O4... 28
8. Skema alat Transmission Electron Microscope..…...……….. 30
9. Difraktogram Katalis NiFe2O4...………. 33
10. Skema alat KCKT...……….. 36
11. Kromatogram dari gula alkohol, monosakarida dan disakarida……….. 38
12. Seperangkat alat reaktor... 44
13. Preparasi nanokatalis Ni0,7Cu0,3Fe2O4... 47
14. Padatan serbuk kering Ni0,7Cu0,3Fe2O4,setelah proses frezee dry... 48
15. Profil suhu kalsinasi... 49
16. Serbuk kering katalis Ni0,7Cu0,3Fe2O4 setelah proses kalsinasi... 50
17. Difaktogram dan hasil pencocokan pola difraksi katalis Ni0,7Cu0,3Fe2O4... 52
19. Grafik PSA Katalis Ni0,7Cu0,3Fe2O4 suhu kalsinasi 600oC... 63
20. Grafik PSA Katalis Ni0,7Cu0,3Fe2O4 suhu kalsinasi 800oC... 64
21. Grafik % konversi selulosa... 67
22. Hasil Uji Fehling... 68
23. Kromatogram pada katalis Ni0,7Cu0,3Fe2O4 suhu kalsinasi 600oC... 70
24. Kromatogram pada katalis Ni0,7Cu0,3Fe2O4 suhu kalsinasi 800oC... 71
25. Tahapan reaksi konversi selulosa menjadi gula alkohol... 72
26. Mikrograf hasil analisis TEM katalis Ni0,7Cu0,3Fe2O4 pada suhu kalsinasi 600oC... 73
27. Skema Prosedur Sintesis Katalis Ni0,7Cu0,3Fe2O4... 86
28. Skema Prosedur Uji Katalitik... 87
29. Difaktogram XRD katalis Ni0,7Cu0,3Fe2O4 (600 oC)... 88
30. Difaktogram XRD katalis Ni0,7Cu0,3Fe2O4 (800 oC)... 88
31. Morfologi partikel katalis Ni0,7Cu0,3Fe2O4 (600 oC) 100nm... 93
32. Morfologi partikel katalis Ni0,7Cu0,3Fe2O4 (600 oC) 50nm... 93
33. Kromatogram standart sorbitol... 95
34. Kromatogram standart mannitol... 96
35. Kromatogram standart fruktosa... 97
36. Kromatogram hasil sorbitol 600 oC... 98
37. Kromatogram hasil sorbitol 800 oC... 99
38. Kromatogram hasil manitol 600 oC... 100
39. Kromatogram Hasil Manitol 800 oC... 101
I. PENDAHULUAN
A. Latar Belakang
Saat ini biomassa telah banyak menarik perhatian para peneliti. Hal ini dikarenakan sifatnya yang ramah terhadap lingkungan dan dapat dimanfaatkan sebagai sumber energi terbaharukan (renewable). Biomassa dapat dihasilkan dari
bahan organik atau hasil pembuangan limbah yang telah diambil produk primernya dan umumnya memiliki nilai ekonomis rendah. Keberadaan biomassa di Indonesia sangatlah berlimpah, salah satu bahan biomassa yang sering dimanfaatkan ialah selulosa. Kayu, bambu, serat daun, sekam padi, kulit buah coklat dan tandan kosong kelapa sawit merupakan beberapa sumber dari selulosa.
Di alam, selulosa banyak dijumpai sebagai selulosa natif, yaitu selulosa tidak murni yang masih berikatan dengan senyawa lain seperti lignin dan hemiselulosa. Selulosa dapat dengan mudah terdegradasi pada temperatur tinggi (>180oC) menjadi senyawa furfural, HMF(5-hydroxymethylfurufural), asam asetat, asam levulinat dan asam formiat (Taherzadeh and Niklasson, 2003), juga dapat membentuk CMC (Carboxy Methyl Celulose) yaitu senyawa turunan dari selulosa yang berfungsi sebagai sumber karbon pada Aspergillus niger untuk produksi
Selain dimanfaatkan sebagai bahan utama produksi biofuel dan dimodifikasi sebagai bahan kimia lainnya, selulosa juga memiliki potensi besar sebagai bahan baku penghasil gula alkohol. Hal ini dikarenakan hidrolisis dari selulosa dapat menghasilkan komponen glukosa lebih dari 5.000 unit sehingga dapat dikonversi menjadi gula-gula alkohol seperti sorbitol, mannitol, dan xylitol (Frieder, 2002). Konversi karbohidrat melalui reaksi hidrogenasi telah banyak dilakukan dengan bantuan katalis heterogen asam. Selain itu, faktor lain yang mempengaruhi hasil konversi ialah tekanan, waktu dan temperatur (Fukuoka and Dhepe, 2008).
Berdasarkan penelitian yang telah dilakukan sebelumnya, katalis Ru/C mampu mengkonversi selobiosa (pada 245 oC; 0,5 jam; 6 MPa) menjadi sorbitol sebanyak 34,6% dan mannitol 11,4% sebagai produk samping (Luo et al., 2007), dan katalis
Pt/γ‐Al2O3 (pada 190 oC; 24 jam; 5 MPa) dapat menghasilkan sorbitol 25% dan
mannitol 6% (Fukuoka and Dhepe, 2006), sedangkan katalis Ni/CNF (pada 230
oC; 4 jam; 6 MPa) dapat menghasilkan sorbitol 50,3% dan mannitol 6,2% (Van
et
al., 2010).
Aktivitasi optimal dari suatu katalis dapat meningkatkan uji katalitik pada proses konversi. Katalis dengan ukuran nanopartikel akan memiliki aktifitas yang jauh lebih baik sebagai katalis karena memiliki luas area permukaan yang cukup tinggi dengan rasio atom-atom yang menyebar merata pada permukaan sehingga memudahkan transfer massa reaktan untuk dapat berdifusi sampai masuk ke dalam situs aktif katalis di dalam pori- pori (Widegren et al., 2003). Dalam
metode sol gel. Hal ini dikarenakan prosesnya yang sederhana dengan mencampurkan logam-logam aktif secara bersamaan kedalam prekursor katalis. Selain itu penggunaan emulsifier (pengemulsi) yang tepat juga merupakan faktor
pendukung dalam preparasi katalis. Emulsifier yang umum digunakan adalah
senyawa organik (polimer) dengan banyak pasangan elektron bebas yang nantinya akan membentuk susunan teratur pada permukaan logam aktif untuk saling terdispersi dan terikat kuat satu sama lain (Hanke, 2001). Sebagai contoh preparasi nanokatalis menggunakan metode sol-gel yaitu, preparasi katalis α -Fe2O3 dengan pelarut asam sitrat dan (PEG)-6000 menghasilkan ukuran partikel
30 nm pada kalsinasi 600oC (Wu and Wang, 2011), katalis CuFe2O4 dan γ -Al2O3
dengan pelarut asam sitrat menghasilkan ukuran partikel < 45 nm (Faungnawakij
et al., 2009), dan katalis NiFe2O4 dengan pelarut putih telur menghasilkan ukuran
partikel < 60 nm pada kalsinasi 500oC (Maensiri et al., 2007), sedangkan katalis
NiFe2O4 dengan pelarut glisin menghasilkan ukuran partikel 4-70 nm pada
kalsinasi 300oC (Alarifiet al., 2009).
Jenis logam yang umum digunakan adalah logam-logam transisi seperti: Cr, Mn, Fe, Co, Ni, Cu, dan Zn yang memiliki orbital d yang masih kekurangan elektron.
Konversi selulosa menjadi gula alkohol menggunakan katalis logam transisi telah dilakukan sebelumnya dan memberikan hasil yang cukup besar serta efektif dengan penggunaan katalis Ni4.63Cu1Al1.82Fe0.79 (pada 488 K; 3 jam; 4 MPa)
menghasilkan sorbitol 68.07% (Liu et al., 2014) dan katalis CuO/CeO2-ZrO2
(pada 245˚C, 4 jam) menghasilkan sorbitol 99,081% (Dar et al., 2015).
Berdasarkan penjelasan diatas, maka pada penelitian ini akan dilakukan preparasi nanokatalis Ni0,7Cu0,3Fe2O4 melalui metode sol-gel menggunakan pengemulsi
pektin dan freeze dry yang diharapkan dapat menghasilkan sorbitol, mannitol dan
xylitol dengan rendemen tinggi melalui uji katalitik. Selanjutnya, katalis akan dikarakterisasi untuk mengukur jumlah keasaman dan jenis situs asamnya menggunakan metode gravimetri dan Fourier Transform Infra Red (FTIR),
menentuan fasa kristalin katalis menggunakan sinar-X (X-ray Difraction/ XRD),
menentuan distribusi ukuran partikel katalis dengan Particle Size Analyzer (PSA)
dan menentuan morfologi katalis dengan Transmission Electron Microscopy
B. Tujuan Penelitian
Adapun tujuan dilakukannya penelitian ini adalah:
1. Mensintesis nanokatalis Ni0,7Cu0,3Fe2O4 dengan metode sol-gel-freeze dry.
2. Menyelidiki konversi selulosa menjadi gula alkohol.
3. Menganalisa potensi aktivitas dari nanokatalis Ni0,7Cu0,3Fe2O4 dalam
mengkonversi selulosa.
C. Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah memberikan informasi mengenai kemampuan nanokatalis Ni0,7Cu0,3Fe2O4 dalam menguji aktivitas katalis tersebut
II. TINJAUAN PUSTAKA
A. Nanopartikel
Saat ini perkembangan teknologi tidak terlepas dari material nano. Meningkatnya kebutuhan industri akan ukuran partikel yang semakin kecil menyebabkan nanopartikel mengalami kemajuan pesat. Pemanfaatan material nanopartikel kini tidak hanya di bidang farmasi maupun bioteknologi (Jahanshahi dan Babaei, 2008). Namun juga memiliki peran penting dalam bidang material konduktor, fotonik, elektronik, sensor, serta berbagai teknologi lain dalam penanganan pencemaran lingkungan. Suatu material dapat dinyatakan sebagai nanopartikel apabila mempunyai rentang ukuran dari 1 hingga 100 nm (Sietsma et al., 2007).
Material nanopartikel secara luas telah banyak menarik perhatian para peneliti. Hal ini dikarenakan material nanopartikel memiliki ukuran partikel yang sangat kecil dan sifat permukaannya dapat dengan mudah diatur dan diubah sesuai pemanfaatannya.
Abdullah (2008) menjelaskan bahwa terdapat dua poin utama yang menjadikan material nanopartikel lebih unggul dibandingkan dengan material besarnya (bulk).
bersentuhan langsung dengan material lain. Kedua, perubah sifat, seperti sifat kekuatan mekanik, transparansi, konduktifitas listrik dan magnetisasi pada material nanopartikel yang berkaitan dengan fenomena kuantum akibat pengaruh keterbatasan ruang gerak. Sedangkan perbandingan jumlah atom yang menempati luas permukaan dan volume berkaitan dengan perubahan sifat seperti titik leleh, titik didih dan reaktivitas kimia dari material nanopartikel tersebut.
Preparasi material nanopartikel juga menunjukkan potensi dalam bidang katalis. Hal ini dikarenakan suatu material nanopartikel memiliki luas area permukaan yang cukup tinggi dan rasio atom-atomnya dapat menyebar merata pada permukaan serta dapat meningkatkan stabilitas termal. Hal ini menguntungkan terjadinya transfer massa di dalam pori-pori akan memberikan kemudahan reaktan untuk dapat berdifusi sampai masuk ke dalam situs aktif dan juga menyumbangkan antar muka yang besar untuk reaksi-reaksi adsorpsi dan katalitik (Widegren et al., 2003).
Menurut Alleman (1993) material nanopartikel dapat disintesis dari metode pemecahan material makro molekul melalui reduksi top down dan bottom up. Top down merupakan proses yang berawal dari bulk kemudian menjadi serbuk dan
menjadi material nanopartikel, tanpa melibatkan reaksi kimia. Sedangkan bottom up merupakan proses yang melibatkan reaksi kimia dari gabungan
bersifat hidrofobik akan langsung teradsorpsi pada permukaan nanopartikel logam dan bagian yang bersifat hidrofilik akan berada pada bulk larutan. Senyawa organik tersebut (surfaktan dan polimer) dapat mengontrol kecepatan reduksi dan agregasi yang terjadi pada nanopartikel logam (Hanke, 2001).
Dalam bidang katalis telah banyak peneliti yang mampu menghasilkan nanokatalis dengan metode nanopartikel yang umum digunakan, seperti metode hidrotermal (Ohara et al., 2004), metode simple heating (Abdullah dkk, 2008),
metode combustion, metode sintesis koloid (Soderlind, 2008), metode
kopresipitasi (Kanade et al., 2006) dan metode sol-gel (Ismunandar, 2006).
B. Katalis
Katalis memiliki peranan penting dalam berbagai proses industri, baik pada industri energi, farmasi dan bahan kimia lainnya. Penggunaan senyawa organik maupun anorganik yang tepat sebagai salah satu unsur terpenting dalam proses sintesis katalis, sangat menarik untuk diteliti dan dimodifikasi, sehingga diharapkan dapat meningkatkan efisiensi dan aktifitas kerja katalis serta dapat semaksimal mungkin mengurangi efek samping yang akan ditimbulkan ke lingkungan (Clark, 2001).
bentuk semula. Maka dari itu, katalis tidak memberikan tambahan energi pada sistem, tapi menurunkan energi aktivasi, yang menyebabkan reaksi berlangsung lebih cepat. Penurunan energi aktivasi tersebut terjadi akibat adanya interaksi antara reaktan dengan situs-situs aktif yang terdapat pada katalis (Anderson et al.,
1976).
Dalam Nasikin dan Susanto (2010) katalis pada umumnya memiliki sifat-sifat sebagai berikut :
1. Aktivitas
Katalis harus memiliki kemampuan untuk dapat aktif bereaksi. Keaktifan tersebut dapat dibuktikan dari hasil kerja katalis dalam mengubah bahan baku menjadi produk baru yang diinginkan. Katalis dikatakan memiliki aktivitas yang baik, jika katalis mampu menuju kesetimbangan dengan waktu yang sangat singkat.
2. Selektivitas
Katalis harus memiliki kemampuan untuk dapat menghasilkan produk yang diinginkan. Selektivitas diperlukan dalam pemilihan setiap material yang akan digunakan. Hal ini dikarenakan dalam suatu proses reaksi, terdapat zat yang berperan dalam meningkatkan laju reaksi, namun juga dapat menjadi penghambat pada proses lainnya. Katalis dikatakan memiliki selektivitas yang baik, jika katalis mampu secara efektif meningkatkan jumlah produk yang diinginkan.
3. Stabilitas
4. Waktu Hidup
Katalis harus memiliki kemampuan untuk bertahan pada level yang cukup sesuai kinerja katalis yang diinginkan. Masa hidup katalis dipengaruhi oleh aktivitas dari katalis.
5. Regenerasi
Katalis harus memiliki sifat mudah diregenerasi. Sifat ini akan memberi kemudahan dalam meminimumkan setiap gangguan yang terjadi saat bereaksi. 6. Kekuatan mekanik
Katalis harus memiliki kemampuan untuk dapat digunakan dalam kondisi apapun, meskipun dalam tekanan dan temperatur tinggi.
Berdasarkan fasanya, katalis digolongkan menjadi katalis homogen dan katalis heterogen. Katalis homogen adalah katalis yang memiliki fasa yang sama dengan fasa reaktan. Katalis ini memiliki beberapa kekurangan yaitu sulit dipisahkan dari campuran reaksi sehingga tidak dapat digunakan kembali dan pada akhirnya akan ikut terbuang sebagai limbah yang dapat mencemarkan lingkungan serta bersifat korosif (Kirk and Othmer, 1980). Sedangkan katalis heterogen merupakan katalis yang memiliki fasa berbeda dengan reaktan. Katalis ini berada pada fasa padat sedangkan reaktan berada pada fasa cair atau gas. Aktivitas optimum dari suatu katalis heterogen sangat bergantung pada komponen penyusunnya.
meningkatkan sifat katalitiknya. Penyangga sebaiknya merupakan senyawa pembawa yang inert terhadap reaksi yang tidak diinginkan, seperti alumina, silika dan karbon aktif (Hegedus et al., 1987). Sedangkan situs aktif umumnya adalah
logam oksida dari logam-logam transisi deret pertama, seperti: Cr, Mn, Fe, Co, Ni, Cu, dan Zn yang memiliki orbital d yang masih kekurangan elektron sehingga dapat menangkap elektron dari reaktan dan membentuk ikatan yang kuat.
Penggunaan katalis heterogen lebih disukai dibandingkan katalis homogen karena memiliki berbagai keunggulan. Antara lain memiliki efisiensi yang tinggi, tidak korosif, dapat dipisahkan dari campuran reaksi, dan dapat digunakan secara berulang (Moffat, 1990; Frenzer and Maier, 2006). Oleh karena itu dalam penelitian ini digunakan katalis Ni0,7Cu0,3Fe2O4 sebagai katalis heterogen.
C. Metode Preparasi Katalis
Metode preparasi merupakan salah satu faktor yang dapat mempengaruhi karakteristik suatu katalis. Pemilihan metode preparasi yang tepat akan menunjukkan hasil karakteristik katalis yang diharapkan memiliki aktivitas, selektivitas dan stabilitas yang maksimal. Metode preparasi tersebut terdiri dari tiga tahapan, yaitu:
1. Distribusi komponen prekursor pada permukaan penyangga
ini dibutuhkan peran dari prekursor aktif, umumnya berupa logam-logam anorganik atau senyawa logam organik yang dikelilingi oleh ligan reaktif seperti logam alkoksida. Hal ini dikarenakan sifat logam alkoksida yang mudah bereaksi dengan air.
Beberapa keunggulan metode sol-gel yaitu :
Memiliki tingkat stabilitas termal dan mekanik yang baik.
Memiliki daya tahan pelarut dan kehomogenan yang baik.
Memiliki kemurnian yang tinggi karena dapat meminimalkan kehilangan bahan akibat penguapan
2. Pengeringan
Pada proses sintesis katalis, molekul-molekul pelarut juga ikut terperangkap dalam pori-pori katalis. Oleh karena itu, pelarut harus dihilangkan dari zat padatnya sampai nilai kadar airnya rendah dengan cara pengeringan. Umumnya pengeringan dapat dilakukan dengan pemanasan pada temperatur 120 oC. Namun, pemanasan dapat menyebabkan tidak meratanya warna katalis dan rusaknya situs aktif katalis sehingga aktivitas katalis tidak optimal. Peningkatan temperatur yang lebih tinggi juga dapat menyebabkan kerusakan terhadap pembentukan kisi kristal katalis dan luas permukaannya. Maka diperlukan metode lain yang lebih baik untuk mengatasi permasalahan tersebut. Freeze Dry merupakan suatu alat pengeringan yang termasuk
kedalam Conduction Dryer, dimana proses perpindahan terjadi secara tidak
langsung antara sampel yang akan dikeringkan (bahan basah) dan media pemanas, dimana terdapat dinding pembatas sehingga air dalam sampel (bahan basah) yang terlepas tidak terbawa bersama media pemanas tapi perpindahan panas terjadi secara konduksi.
Freeze drying adalah salah satu metode pengeringan yang dapat
mempertahankan mutu hasil pengeringan. Dimana mampu menghilangkan air hidrat dalam rongga prekursor katalis tanpa merusak struktur jaringan katalis tersebut karena memiliki efektivitas yang tinggi. Untuk proses pengeringan menggunakan freeze dryer, menurut Muchtadi (1992), sampel yang akan
langsung tervakum dan terbuang menjadi uap, dikenal dengan istilah sublimasi. Pengeringan menggunakan alat freeze dryer lebih baik
dibandingkan dengan oven karena kadar airnya lebih rendah sampai 1%. Pengeringan menggunakan alat freeze dryer lebih aman terhadap resiko
terjadinya degradasi senyawa dalam sampel. Hal ini mungkin dikarenakan penggunaan temperatur yang relatif rendah saat pengering dan lamanya proses pengeringan membuat sampel lebih stabil dibandingkan dengan metode pengeringan yang lain. Keuntungan menggunakan metode freezer drying yaitu
hasilnya homogen, murni, dengan ukuran partikel dapat diproduksi kembali serta memiliki aktivitas yang seragam (Bermejo et al., 1997).
Keunggulan pengeringan menggunakan alat freeze dryer dibandingkan metoda
lainnya, antara lain adalah :
a. Dapat mempertahankan stabilitas produk dan struktur bahan (menghindari pengkerutan bentuk, perubahan aroma, warna, dan unsur organoleptik lain). b. Dapat meningkatkan daya rehidrasi (hasil pengeringan sangat berongga sehingga daya rehidrasi sangat tinggi dan dapat kembali ke sifat fisiologis, organoleptik dan bentuk fisik yang hampir sama dengan sebelum pengeringan).
3. Kalsinasi
partikel yang lebih optimum. Perubahan ini terjadi karena atom-atom karbon, hidrogen dan oksigen dapat teruapkan menjadi air dan karbon dioksida.
Pada proses kalsinasi terjadi tiga tahapan penting, yaitu pada kisaran suhu 120˚C-300˚C akan terjadi pelepasan molekul air (H2O) yang masih terikat
pada prekursor katalis. Kemudian pada kisaran suhu 550˚C akan terjadi pelepasan gas CO2 dan gas-gas lain akibat reaksi oksida yang terbentuk
dengan penyangga. Setelah itu dibutuhkan pemanasan lanjutan (> 600˚C) untuk membentuk ikatan yang lebih kuat dan tidak mudah lepas pada katalis sehingga stabilisasi sifat-sifat mekaniknya akan semakin meningkat, pada tahap ini prekursor katalis telah berubah menjadi padatan yang mengandung fasa kristalin. Katalis yang telah dikalsinasi akan dapat bertahan lebih lama dalam masa penyimpanannya dan tidak aktif.
D. Pektin
Pektin merupakan suatu polimer dari polisakarida yang memiliki bobot molekul tinggi dan terkandung dalam lamella tengah dinding sel pada tumbuhan darat. Polisakarida ini tersusun atas monomer-monomer α-D-galakturonat yang
membentuk rantai lurus dan saling terikat satu sama lain oleh ikatan α – 1,4 –
Gambar 1. (a) Struktur α-galakturonat, (b) Stuktur metilasi α-galakturonat (c) Struktur pektin
Buah-buahan dan sayuran merupakan sumber paling utama dalam isolasi senyawa pektin, seperti pada kulit apel pomace kering (10-15%), kulit jeruk (20-30%) (May, 1990), bunga matahari (15-25%), (Ridley et al., 2001), kulit buah coklat
(8-11%) (Adomako, 1972), buah pisang (22,4%), terong (±(8-11%), dan bayam (11,58%) (Kertesz, 1951). Isolasi pektin paling sederhana dapat dilakukan dengan cara ekstraksi. Dalam proses ekstraksi, pektin akan mengalami perubahan senyawa yang disebabkan oleh proses hidrolisis. Senyawa pektin diklasifikasikan menjadi 3 bagian, yaitu protopektin, asam pektinat dan asam pektat (Farobie, 2006).
protopektin dapat terlarut dalam air dengan reaksi hirolisis. Asam pektinat adalah poligalakturonat yang sebagian gugus karboksilnya telah mengalami reaksi esterifikasi dengan metanol, sehingga mengandung gugus metil ester dan bersifat koloid. Sedangkan asam pektat adalah poligalakturonat yang juga bersifat koloid dan seluruh gugus karboksilnya terbebas dari gugus metil ester.
Saat ini pemanfaatan pektin cukup luas, baik dalam bidang industri pangan maupun non-pangan. Pektin yang digunakan pada produk non pangan antara lain dalam bidang farmasi untuk obat diare sebagai adsorbent dalam usus, untuk menurunkan kadar kolesterol darah dan juga digunakan untuk menyembuhan luka sebagai pembekuan darah (Akhmalludin, 2005). Pektin dapat pula digunakan sebagai bahan pengental lateks dalam industri karet, dapat juga meningkatkan kualitas warna, stabilitas, kekentalan dan konsistensi produk karet yang dihasilkan. Dalam industri kertas dan textile, pektin digunakan sebagai bahan pengisi, karena dapat memberi bentuk lapisan yang baik (Towle and Christensen, 1973). Sedangkan dalam industri produk pangan, secara meluas pektin digunakan sebagai bahan penstabil dan bahan pembentuk gel (pengental dalam makanan) pada pembuatan saus, sari buah, jeli, selai berdasarkan kadar metoksil yang dimiliki (Glicksman, 1969).
kondisi asam, ikatan glikosidik gugus metil ester dari pektin juga akan cenderung terhidrolisis menghasilkan asam galakturonat (Nelson et al., 1977). Faktor lain
yang juga menentukan mutu pektin adalah kadar metoksil yang terkandung (Goycoolea dan Adriana, 2003). Kadar metoksil menyatakan besarnya Derajat esterifikasi pada pektin (Degree of Esterification/ DE), yang menunjukkan persentase gugus karbonil yang telah teresterifikasi dengan metanol pada asam galakturonat. Kadar asam galakturonat dan kadar metoksil pada pektin memiliki peranan penting dalam menentukan sifat kelarutan pektin dan mempengaruhi kemampuan mengel dari pektin itu sendiri (Constenla and Lozano, 2006).
E. Spinel Ferite
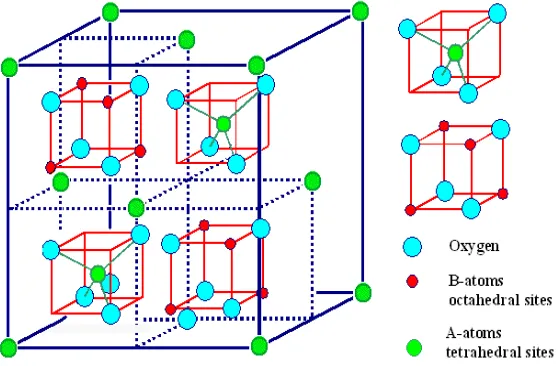
Spinel ferite adalah salah satu bentuk struktur katalis yang memiliki rumus umum AB2O4 yang membentuk kubus. Struktur ini terdiri atas 2 tipe. Tipe A merupakan
kation-kation bervalensi 2, yang akan menempati posisi tetrahedral dalam struktur kristalnya, sedangkan tipe B merupakan kation-kation bervalensi 3, yang nantinya akan menempati posisi oktahedral dalam struktur kristal dan terdistribusi pada lattice fcc yang terbentuk oleh ion O2- (Faungnawakij et al., 2009). Kation-kation
bervalensi pada tipe A, seperti Fe, Ni, Co, dll dan pada tipe B umumnya Fe, Mn, Cr (Almeida et al., 2008). Gambar 2 berikut adalah struktur kristal spinel ferite.
Gambar 2. Struktur Kristal Spinel Ferite.
Terdapat tiga bentuk distribusi kation-kation dalam sruktur spinel, yaitu keadaan normal, keadaan terbalik (inverse) dan keadaan antara normal dan terbalik. Pada
keadaan normal ion-ion logam bervalensi 2 akan terletak pada posisi tetrahedral atau dapat dituliskan (M2+)A[M23+]BO4, pada keadaan terbalik (inverse) ion-ion
(M3+)A[M2+M3+]BO4 dan keadaan antara normal dan terbalik, setengah dari ion-ion
logam bervalensi 2 dan 3 akan menempati posisi tetrahedral dan oktahedral atau dapat dituliskan (M2+M3+)A[M1-x2+M2-λ3+]BO4 (Manova et al.,2005).
Salah satu spinel ferite yang telah banyak digunakan sebagai katalis adalah nikel ferite (NiFe2O4). Nikel ferite ini memiliki struktur spinel terbalik (inverse) yang
mana setengah dari ion Fe mengisi pada posisi tetrahedral (posisi A) dan sisanya menempati posisi pada oktahedral (posisi B) hal ini dapat dituliskan dengan rumus (Fe3+1.0)[Ni2+1.0Fe3+1.0]O2-4 (Amalia, 2013).
F. Selulosa
Selulosa merupakan biomassa yang paling berlimpah di alam, umumnya selulosa banyak terdapat pada kayu dan dinding sel tanaman bisa mencapai 40-50% (Fukuoka and Dhepe, 2008). Selulosa adalah polisakarida yang tersusun atas molekul-molekul β-D-glukosa, membentuk rantai lurus dan saling terikat satu
sama lain oleh ikatan β – 1,4 – glikosidik juga mempunyai massa molekul relatif
tinggi yang setara dengan 5.000 unit glukosa. Keberadaan selulosa tidak pernah terlepas dari polisakarida biomassa karbohidrat lainnya, seperti hemiselulosa dan lignin (Frieder, 2002).
Hidrolisis sempurna dari selulosa akan menghasilkan monosakarida yaitu glukosa, sedangkan hidrolisis yang tidak sempurna akan menghasilkan oligosakarida dari selulosa yaitu selobiosa. Namun, proses hidrolisis yang sempurna sangat sulit untuk dilakukan. Hal ini dikarenakan keberadaan hemiselulosa dan lignin dapat menghambat proses hidrolisis. Selulosa dapat dihidrolisis menjadi gula reduksi (glukosa, fruktosa, selbiosa) dengan menggunakan media air dan dibantu dengan katalis asam atau enzim (Huber et al., 2006), degradasi dengan supercritical water
(Saka and Ueno, 1999), depolimerisasi dalam cairan ionik (Rinaldi et al., 2010),
dan pirolisis suhu tinggi dengan atau tanpa katalis (Carlson et al., 2008).
Hasil hidrolisis selulosa dapat dikonversi menjadi gula alkohol (sorbitol, mannitol, xylitol) serta glukosa anhidrat. Dimana hasil konversi ini dapat dipergunakan lebih lanjut sebagai produksi bahan kimia atau bahan produksi biofuel karena memiliki banyak manfaat lainnya (Hansen et al., 2006).
Konversi dipengaruhi oleh berbagai faktor lain seperti indeks kristalinitas, tingkat polimerisasi, dan fraksi gugus ujung yang terikat dengan substrat. Indeks kristalinitas merupakan faktor utama dalam proses konversi selulosa. Hal ini dikarenakan struktur kristal yang dimiliki selulosa sebagai hasil ikatan jaringan hidrogen yang luas, mampu membuat selulosa tahan terhadap reaksi enzimatik. Jika struktur kristal yang dimiliki selulosa semakin kristalin, maka katalis akan semakin sulit untuk berinteraksi dengan situs inti kristal pada selulosa (Zang et al., 2010). Oleh karena itu dibutuhkan pemilihan katalis yang tepat yang mampu
G. Gula Alkohol
Gula alkohol atau poliol merupakan hasil turunan sakarida yang gugus karbonilnya dapat tereduksi membentuk gugus hidroksil. Secara kimia disebut sebagai gula alkohol karena bagian strukturnya mirip dengan alkohol dan rasanya menyerupai gula tebu. Rasa manis yang dimiliki menjadikan gula alkohol sebagai pemanis yang rendah kalori, sehingga sering digunakan sebagai pemanis untuk penderita diabetes karena tidak menaikkan kadar glukosa darah. Bentuk gula alkohol diantaranya yaitu sorbitol, mannitol, xylitol, erythritol, maltitol, laksitol, palatinit, dll.
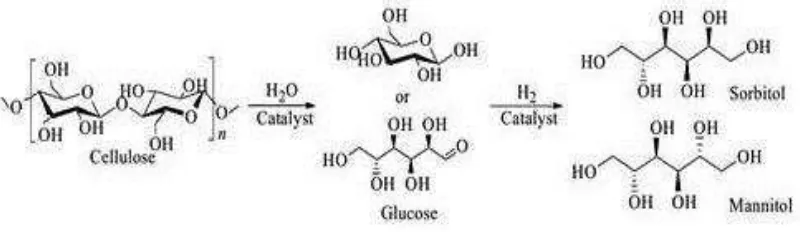
1. Sorbitol dan Mannitol
Sorbitol dan mannitol adalah gula alkohol yang terdiri dari enam rantai karbon dengan rumus kimia C6H14O6 dan BM 182,17 g/mol. Sorbitol dan mannitol
Gambar 4. Reaksi konversi selulosa menjadi sorbitol dan mannitol
Gambar.4 merupakan tahapan proses konversi selulosa menjadi sorbitol dan mannitol. Pada tahap awal selulosa akan terlebih dahulu mengalami hidrolisis menjadi monomer-monomer glukosa yang kemudian mengalami reaksi hidrogenasi dengan bantuan katalis asam dan tekanan tinggi sampai keadaan
superacid dibawah kondisi kritis dalam waktu serta temperatur yang tinggi.
Sedangkan pada kondisi dan temperatur yang lebih ekstrim lagi (400 oC) dapat dihasilkan gas seperti CO, CO2, CH4 dan H2 (Osada et al., 2004). Seperti yang
dapat dilihat pada Tabel.1
Tabel 1.Pengaruh tekanan, waktu dan temperatur terhadap rendemen gula alkohol (Jiping et al, 2013)
2. Xylitol
Xylitol merupakan gula alkohol yang terdiri dari lima rantai karbon yang banyak terdapat di alam khususnya pada buah-buahan dan sayuran, dengan rumus kimia C5H12O5 dan BM 152,15 g/mol.Senyawa ini merupakan gula
tereduksi yang memiliki kelarutan 169 g/ 100 g air dengan pH 5-7, dimana kemanisannya sama dengan sukrosa bahkan lebih manis dibandingkan gula alkohol lainnya. Hal ini menyebabkan xylitol sering digunakan sebagai pengganti gula dalam industri pengolahan makanan seperti pada produk industri coklat, permen, es krim, selai, jus juga pada produksi roti dan minuman.
Sama halnya dengan sorbitol dan mannitol, xylitol juga dapat dikonversi dari bahan lignoselulosa khususnya hemiselulosa atau xilan. Melalui proses hidrolisis xilan akan membentuk xilosa dan arbinosa yang kemudian dapat dihidrogenasi menjadi xylitol. Reaksi konversi dapat dilihat pada Gambar 5
Gambar 5. Reaksi konversi xylitol
H. Karakterisasi Katalis
1. Penentuan Keasaman Katalis
Analisis keasaman katalis dilakukan dengan metode gravimetri dan dilanjutkan dengan menggunakan instrumentasi Fourier Transform Infra Red
(FTIR).
a. Gravimetri
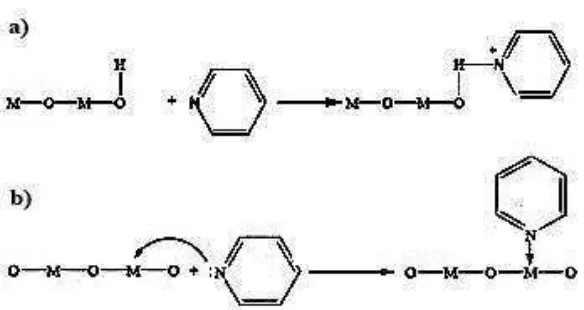
Aktivitas katalisdipengaruhi oleh besarnya keasaman dari katalis tersebut. Semakin banyak jumlah situs asam suatu katalis, maka situs aktif yang terkandung dalam katalis.juga semakin banyak. Sehingga aktivitas katalitik katalis juga semakin meningkat. Situs asam katalis dapat ditentukan berdasarkan kekuatan asam Lewis, sebagai akseptor pasangan elektron dan asam Brønsted – Lowry, sebagai donor proton (Burch et al.,
2002). Penentuan jumlah situs asam dalam katalis dapat dilakukan dengan menggunakan metode gravimetri dengan cara menghitung jumlah basa yang teradsorpsi secara kimia (kemisorpsi) dalam fase gas (ASTM, 2005). Basa yang dapat digunakan sebagai adsorbat adalah amoniak, piridin, piperidin, quinolin, trimetil amin, dan pirol (Richardson, 1989).
Dimana, w1 = Berat wadah kosong
w2 = Berat wadah + katalis
w3 = Berat wadah + katalis yang telah mengadsorpsi piridin
BM = Bobot molekul piridin.
b. Fourier TransformInfra Red (FTIR)
Penentuan jenis situs asam pada katalis dilakukan menggunakan Fourier Transform Infra Red (FTIR). Katalis yang telah dibiarkan mengadsorpsi
basa adsorban kemudian dianalisis untuk diidentifikasi keberadaan situs asamnya melalui puncak serapan. FTIR merupakan suatu metode analisis yang mengamati interaksi antar atom-atom dalam molekul berdasarkan perubahan vibrasi-vibrasi yang terbentuk pada saat sampel teradsorpsi dengan energi khusus dan dilewati oleh sinar inframerah (Ayyad, 2011). Sinar inframerah ini berada pada jangkauan panjang gelombang 2,5 – 25 µm atau jangkauan frekuensi 2000 – 400 cm-1. Hal ini karena di daerah jangkauan antara 2000 – 400 cm-1 adalah daerah khusus yang berguna untuk identifkasi gugus fungsional.
sebuah kurva spektrum inframerah. Hal yang perlu diperhatikan dalam menginterpretasi kurva serapan inframerah adalah bilangan gelombang, bentuk kurva serapan (sempit tajam atau melebar) dan intensitas serapan (kuat, sedang, atau lemah). Dimana hubungan antara persen absorbansi dengan frekuensi dapat menghasilkan sebuah spektrum inframerah (Kosela, 2010).
Gambar 6. Reaksi basa piridin (a) Situs asam Brӧnsted-Lowry (b) Situs asam Lewis
Pada Gambar 7 hasil puncak serapan katalis menunjukkan bahwa situs asam Brønsted-Lowry lebih dominan daripada situs asam Lewisnya (Fransisca, 2011).
Gambar 7. Spektra IR dari katalis: (a) NiFe2O4, (b) Co3O4, dan
(c) Co3O4/NiFe2O4
Pada penelitian ini nanokatalis Ni0,7Cu0,3Fe2O4 akan diuji keasaman
akan diidentifikasi menggunakan FTIR untuk mengetahui jenis situs asam yang terbetuk, yang akan terlihat jelas dari spektrum inframerah yang diperoleh.
2. Penentuan Morfologi Kristalin Katalis
Analisis morfologi kristalin katalis dilakukan menggunakan instrumentasi
Transmission Electron Microscopy (TEM). TEM merupakan salah satu dari
banyak alat nanoteknologi yang sangat penting untuk menggambarkan bentuk, struktur, serta distribusi pori padatan dari material nano dengan resolusi sub-nanometer (High-Resolution TEM). Pada teknik ini sebuah
spesimen tipis digambarkan oleh sebuah sinar elektron, yang mana diradiasikan melalui sampel dengan ketebalan yang seragam. Tipe tegangan dalam pengoperasian TEM biasanya sekitar 80-200 KV. Sumber elektron yang diemisikan bersumber dari sebuah thermionic [filament tungsten (W)
atau lanthanum hexaboride (LaB6)]. Celah cahaya dan area spesimen yang disinari dikontrol oleh serangkaian lensa kondensor. Fungsi dari lensa objektif adalah untuk menggambarkan maupun membentuk pola difraksi dari sebuah spesimen.
lensa fluorescent. Gambar yang dihasilkan ditangkap diatas pelat fotografi
atau kamera CCD. Kapasitas analisis pada TEM telah ditingkatkan dengan integrasi dengan beberapa teknik yang unggul pada instrument. Teknik ini termasuk spektroskopi, seperti analisis energy dispersive X-rays (EDX) dan
electron energy loss spectroscopy (EELS) (Ayyad, 2011).
Analisis TEM juga dapat melihat perbesaran dengan resolusi tinggi hingga diatas perbesaran 500000 kali. Analisis ini dapat melihat perbesaran sampai kristal ataupun kolom atom suatu molekul sehingga penglihatan perbesaran dapat dilakukan secara tembus gambar. Karakterisasi TEM dapat meningkatkan penggambaran sehingga jika terjadi penumpukan pada perbesaran sampel tetap dapat dilihat ukuran dan bentuknya (Harahap, 2012). Skema alat Transmission Electron Microscope disajikan pada gambar 8.
Gambar 8. Skema alatTransmission Electron Microscope
3. Penentuan Ukuran Partikel Katalis
Analisis ukuran partikel katalis dilakukan menggunakan instrumentasi Particle Size Analyzer (PSA). PSA merupakan salah satu metode karakterisasi yang
tidak hanya dapat digunakan untuk mengetahui ukuran partikel dari suatu material, namun juga dapat menginformasikan besaran distribusi ukuran partikel tersebut. Sehingga dapat diasumsikan bahwa hasil pengukuran tersebut merupakan gambaran keseluruhan dari kondisi sampel. Hal ini lah yang menjadi kelebihan PSA dari instrumentasi lain yang pada umumnya menggunakan metode mikroskopi dan holografi dalam penentuan ukuran partikel, seperti pada SEM dan TEM. Alat ini mampu mengukur ukuran partikel dan molekul dalam rentang 0,15 nm sampai 10 µm.
Prinsip kerja PSA pada dasarnya menggunakan metode Dinamyc Light Scattering (DLS). Suatu material yang akan dianalisis (sampel) dimasukkan
kedalam suspensi yang telah diinduksi oleh penambahan molekul pelarut. Hal ini menyebabkan partikel dari material akan bergerak bebas secara acak bersamaan dengan molekul pelarut mengikuti aturan gerak Brown. Molekul pelarut bergerak karena adanya energi termal. Saat partikel terus bergerak dan kemudian ditembakan cahaya, kecepatan gerak partikel akan berfluktuasi akibat adanya intensitas cahaya yang dihamburkan oleh partikel tersebut, kecepatan gerak ini bergantung pada besarnya ukuran partikel. Pengukuran dilakukan dengan prinsip bahwa partikel-partikel yang lebih kecil akan bergerak lebih cepat daripada partikel-partikel yang lebih besar (Skoog et al.,
PSA terbagi dalam dua metode, terdiri atas :. a. Metode kering (Dry Dispersion Unit)
Metode ini memanfaatkan aliran udara sebagai media pelarut partikel yang akan dianalisis. Metode ini lebih baik digunakan pada material yang berukuran besar atau kasar, karena hubungan yang terjadi antar partikel cukup lemah dan kecil memungkinkan partikel saling beraglomerasi.
b. Metode basah (Wet Dispersion Unit)
Metode ini memanfaatkan media cair untuk mendispersi partikel yang akan dianalisis. Pada umumnya metode ini lebih baik digunakan pada material yang berukuran nano dan submicron, karena akan besar kemungkinan untuk partikel saling beraglomerasi.
4. Penentuan Fasa Kristalin Katalis
Analisis struktur kristal katalis dilakukan menggunakan instrumentasi difraksi sinar-X (X-ray Difraction/XRD). XRD merupakan salah satu metode
karakterisasi untuk mengidentifikasi fasa suatu material juga untuk menentukan sifat kristal atau kristalinitas dari suatu material dengan cara menentukan parameter kisi. Metode karakterisasi ini adalah metode yang penggunaannya paling sering digunakan hingga saat ini. Hal ini dikarenakan penggunaan metode ini juga cukup mendasar untuk pengukur besaran partikel suatu material (Leofanti et al., 1997).
sebagian lagi akan dihamburkan serta didifraksikan. Pola difraksi yang dihasilkan oleh analog akan menghasilkan pola pembiasan yang sama seperti pola difraksi cahaya pada permukaan air. Pola ini akan diplotkan berdasarkan intensitas peak yang menyatakan indeks Miller (hkl) atau letak parameter kisi
kristal sebagai fungsi 2θ, sehingga jarak antar atom pada lapisan permukaan
kristal (d) dapat ditentukan berdasarkan hukum Bragg :
n λ= 2 d sin θ
dimana, n dinyatakan sebagai bilangan bulat tingkatan difraksi Sinar-X, λ dinyatakan sebagai panjang gelombang yang dihasilkan katoda (seperti Cu
Kα = 1,5414 Ǻ), sedangkan θ dinyatakan sebagai sudut difraksi Sinar-X
terhadap permukaan kristal (Richardson, 1989)
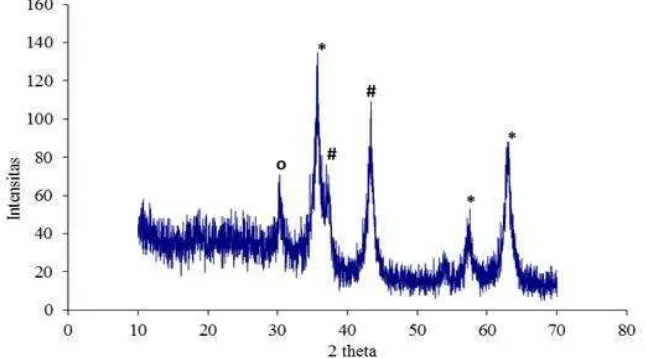
Gambar 9. Difraktogram Katalis NiFe2O4 (Tanda * fasa kristalin NiFe2O4 ;
Tanda # fasa kristalin NiO ; Tanda o fasa kristalin Fe3O4).
dengan intensitas tertinggi. Sedangkan pada fasa kristalin Fe3O4, dan NiO
puncak yang muncul kurang mendukung keberadaan fasa tersebut (Fransisca, 2011).
Tiap puncak yang muncul pada pola XRD dapat mewakili satu puncak bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi. Sehingga ukuran partikel dari suatu material juga dapat dihitung dengan persamaan Debye-Scherrer (Maiti et al., 1973):
Dimana, D = diameter rata-rata partikel (nm)
k = konstanta dari instrumen yang digunakan
λ = panjang gelombang sinar-X yang digunakan (nm) β = pelebaran puncak (radian)
θ = sudut Bragg (radian)
I. Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi adalah salah satu cara pemisahan untuk mengidentifikasi dan menentuan kadar tiap komponen dari suatu campuran berdasarkan perbedaan pola pergerakan antara fase gerak berupa zat gas atau zat cair dan fase diam (kolom) berupa zat cair (Skoog et al., 1996). Kromatografi Cair Kinerja Tinggi (KCKT)
atau sering dikenal dengan HPLC (High Performance Liquid Chromatography)
memiliki kecepatan dan efisiensi yang tinggi dalam sistem pemisahan. KCKT dilengkapi dengan pompa bertekanan tinggi, detektor yang sensitif dan kolom yang beragam sehingga mampu menganalisis berbagai cuplikan secara kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran.
Dalam Johnson dan Stevenson (1991) instrumentasi KCKT pada dasarnya terdiri atas :
a. Wadah fasa gerak
Wadah fasa gerak berfungsi menampung fasa gerak yang akan dialirkan ke dalam kolom. Biasanya wadah terbuat dari bahan yang inert terhadap fase gerak. Bahan yang umum digunakan adalah gelas dan baja anti karat. Fase gerak yang digunakan harus murni (tidak ada pencemar/kontaminan), dan terbebas dari udara terlarut. Menghindari hasil akhir analisis yang memiliki banyak noise yang menyebabkan data tidak dapat digunakan. b. Pompa
Pompa berfungsi menggerakkan fasa gerak melalui kolom. Dimana, pompa harus mampu menghasilkan tekanan tinggi sampai 6000 psi (400 atm). Untuk menjamin proses penghantaran fase gerak berlangsung secara tepat, reprodusibel, konstan, dan bebas dari gangguan.
c. Injektor
d. Kolom
Kolom berfungsi memisahkan masing-masing komponen. Kolom merupakan jantung pada kromatografi. Keberhasilan atau kegagalan analisis dipengaruhi pada pemilihan kolom dan kondisi kerja yang tepat. e. Detektor
Detektor berfungsi mendeteksi adanya komponen cuplikan dalam aliran yang keluar dari kolom. Terdapat beragam jenis detektor, penggunaanya harus selektif tergantung pada jenis komponen yang akan dipisahkan. f. Rekorder
Rekorder berfungsi menangkap sinyal elektronik yang dihasilkan detektor, untuk selanjutnya dibaca dalam bentuk peak yang disebut kromatogram. Sample yang mengandung banyak komponen akan mempunyai kromatogram dengan banyak peak. Bahkan tak jarang antar peak saling bertumpuk (overlap). Skema alat KCKT disajikan pada Gambar 10.
Pada Kromatografi Cair Kinerja Tinggi (KCKT) ada 2 tipe pemisahan yaitu : 1. Pemisahan dengan Fasa Normal
Pemisahan yang dilakukan jika Fasa diamnya bersifat lebih polar dibandingkan dengan fasa geraknya.
2. Pemisahan dengan Fasa Terbalik
Pemisahan yang dilakukan jika fasa diamnya bersifat kurang non polar dibandingkan dengan fasa geraknya (Panggabean dkk, 2009).
Prinsip kerja KCKT pada dasarnya sama dengan kromatografi lapis tipis dan kromatografi kolom, yang membedakan adalah pada kolom (fasa diam) KCKT memperbolehkan ukuran butir partikel yang lebih kecil sehingga memberi luas permukaan yang lebih besar untuk molekul-molekul yang lewat berinteraksi dengan fasa diamnya. Hal ini membuat keseimbangan antar fasa menjadi lebih baik dan efisien. Tekanan tinggi menyebabkan fasa gerak berdifusi menjadi sekecil-kecilnya karena gerakan yang begitu cepat. Sehingga akan didapatkan hasil pemisahan komponen-komponen dari campuran yang sebaik-baiknya. Metode ini dapat digunakan pada senyawa yang tidak tahan terhadap panas dan berbobot molekul besar (Kupiec, 2004).
beberapa gula alkohol, monosakarida dan disakarida. Untuk gula alkohol seperti gliserol, xylitol, sorbitol dan manitol, kromatogram akan muncul pada waktu retensi kurang dari 5 menit. Sedangkan untuk monosakarida seperti glukosa dan fruktosa kromatogram akan muncul pada rentang kromatogram dari beberapa gula alkohol monosakarida, dan disakarida seperti pada Gambar 11 :
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Anorganik Fisik Universitas Lampung. Analisis distribusi ukuran partikel dilakukan di UPT. Laboratorium Terpadu dan Sentra Inovasi Teknologi, Universitas Lampung dan analisis struktur kristal dilakukan di BATAN Serpong. Analisis jenis situs asam dan morfologi katalis dilakukan di Laboratorium Universitas Gadjah Mada. Serta uji katalitik katalis dilakukan di PT. SIG Bogor. Penelitian dilakukan dari bulan April 2015 sampai September 2015.
B. Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini adalah peralatan gelas, termometer, oven, neraca digital, desikator, ultrasonikasi, Magnetic Strirrer, Freezer Dry, Fourier Transform Infra Red (FTIR), Particle Size Analyzer (PSA), Transmission Electron Microscopy (TEM), X-ray Difraction (XRD) dan High Performance Liquid Chromatography (HPLC).
Cu(NO3)2.3H2O (Merck, 99%), piridin C5H5N (J.T Baker), NH3 (Merck, 99%),
gas hidrogen, selulosa (Merck, 99%), dan aquades.
C. Prosedur Kerja
Penelitian ini akan dilakukan dalam beberapa tahap yaitu pembuatan katalis dan karakterisasi katalis, serta uji aktivitas dalam reaksi konversi selulosa.
1. Pembuatan Nanokatalis
Pembuatan nanokatalis Ni0,7Cu0,3Fe2O4 dilakukan dengan cara melarutkan
8 gram pektin dalam 400 mL aquades. Larutan tersebut diaduk menggunakan magnetik stirer pada temperatur ruang sampai diperoleh larutan yang homogen (± 3 jam ). Sebanyak 25 mL NH3 ditambahkan
kedalam larutan tersebut untuk menjaga pH larutan pektin dalam keadaan basa. Kemudian kedalam larutan tersebut ditambahkan tetes demi tetes secara perlahan sebanyak 40 mL larutan yang mengandung 2,14 gram Ni(NO3)3.6H2O, 400 mL larutan yang mengandung 8,33 gram
Fe(NO3)3.9H2O dan 120 mL larutan yang mengandung 0,75 gram
Cu(NO3)2.3H2O yang dilarutkan dalam aquades menggunakan heating
magnetic stirrer pada suhu ruang sampai campuran benar-benar homogen.
Kemudian sistem larutan tersebut dipanaskan pada suhu 100˚C hingga volum larutan menyusut dan membentuk gel. Gel yang didapatkan selanjutnya di frezee dry untuk menghilangkan molekul air sampai
dengan laju temperature 2˚C/menit. Kemudian katalis digerus hingga halus menggunakan mortar, ditimbang dan dilanjutkan untuk uji karakterisasi katalis.
2. Karakterisasi Katalis
a) Analisis Struktur Katalis
Penentuan struktur kristal dilakukan menggunakan instrumentasi difraksi sinar-X. Prosedur analisis ini disesuaikan dengan penelitian yang telah dilakukan oleh Maiti et al. (1973). Analisis dilakukan menggunakan
radiasi CuKα (1,5425 Å), tabung sinar-X dioperasikan pada 40 kV dan 200 mA. Rentang difraksi yang diukur (2θ) dalam rentang 10 – 80o, dengan
scan step size 0,02o/menit. Puncak-puncak yang terdapat pada
difraktogram kemudian diidentifikasi menggunakan metode Search Match
dengan standar file data yang terdapat dalam program Macth Crystal Impact. Ukuran partikel dihitung menggunakan persamaan Scherrer
sebagai berikut.
D
=
Dimana,
D = ukuran partikel (nm)
K = konstanta (0,94)
Λ = 1,5425 Å
β = radian (FWHM)
b) Analisis Morfologi Katalis
Penentuan morfologi katalis dilakukan menggunakan instrumentasi
Transmission Electron Microscop (TEM). Karakterisasi biasanya
dilakukan dengan teknik lift out Focus ion Beam (FIB). Sedikit sampel
nanokalis disiapkan dan diletakan pada thin membarane foil dan ditutup
dengan logam tungsten atau platina. Kemudian sampel di cutting oleh ion beam. Thin membrane selanjutnya ditransfer kedalam carbon-coated TEM grid menggunakan in-situ or ex-situ micromanipulator untuk melihat
pengamatan pada TEM.
c) Analisis Distribusi Ukuran Partikel Katalis
Penentuan distribusi ukuran partikel katalis dilakukan menggunakan instrumentasi Particle Size Analyzer (PSA). Karakterisasi biasanya
dilakukan dengan pengukuran wet dispersion unit. Sampel katalis yang
diperoleh di masukkan kedalam chamber yang berisi aquades hingga
warna indikator pada control PC menunjukan warna hijau pada skala
10-12 secara stabil dan ditunggu beberapa menit selama proses berlangsung.
d) Analisis Keasaman Katalis
Penentukan sifat keasaman katalis dalam penelitian ini dilakukan dengan metode gravimetri dan Fourier Transform Infra Red (FTIR). Dengan
telah divakum dan berisi piridin. Kemudian proses ini dibiarkan selama 24 jam dalam desikator. Wadah yang berisi katalis selanjutnya dikeluarkan dan didiamkan di tempat terbuka selama 2 jam, agar basa yang terikat secara adsorbsi fisika terlepas kembali. Kemudian wadah ditimbang kembali, selisih berat katalis tersebut merupakan banyaknya basa yang teradsorbsi pada permukaan katalis.
Banyaknya mol basa yang teradsorpsi pada cuplikan dapat dihitung dengan rumus:
Dimana,
w1 = Berat wadah kosong
w2 = Berat wadah + katalis
w3 = Berat wadah + katalis yang telah mengadsorpsi piridin
BM = Bobot molekul piridin.
Serbuk katalis hasil dari metode gravimetri selanjutnya dilakukan penentuan jenis situs asam Bronsted-Lowry dan situs asam Lewis menggunakan Fourier TransformInfra Red (FTIR). Sampel katalis 20 mg
3. Uji Katalitik
Katalis Ni0,7Cu0,3Fe2O4 yang dihasilkan pada penelitian ini selanjutnya
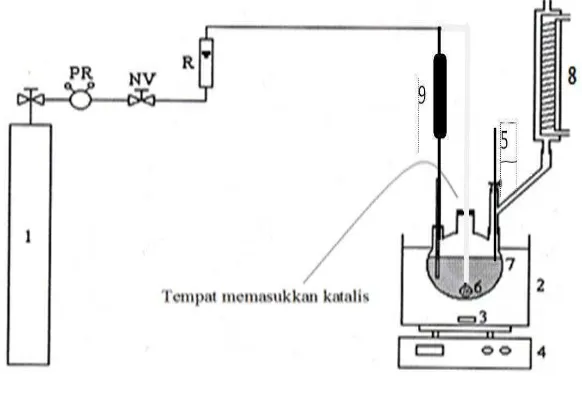
digunakan dalam proses uji katalitik konversi selulosa menjadi gula alkohol. Sebanyak 0,5 g selulosa dan 100 mL aquades diultrasonik selama 8 jam. Dipindahkan ke dalam labu leher tiga (Gambar 12), lalu diaduk dengan pengaduk. Dipanaskan hingga variasi suhu 100 oC, 120 oC dan 140 oC. Selanjutnya ditambahkan katalis Ni0,7Cu0,3Fe2O4 sebanyak 0,1 g dan
dialirkan gas hidrogen dengan laju 10 mL/ menit dengan variasi waktu reaksi 2 jam dan 3 jam. Setelah itu, hasil reaksi disaring dan dianalisis dengan instrumentasi Kromatografi Cair Kinerja Tinggi (KCKT).
1.Tabung hidrogen 4. Pemanas magnet stirer 7. Wadah PR.Pengatur tekanan 2. Penangas air 5. Termometer 8. Kondensor NV.Kran pengatur 3. Stirer 6. katalis 9. Silinder R Alat Pemutar
4. Analisis dengan Kromatografi Cair Kinerja Tinggi (KCKT)
Hasil reaksi selulosa dengan katalis Ni0,7Cu0,3Fe2O4 selanjutnya diuji fehling
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
Berdasarkan penelitian yang telah dilakukan, maka dapat diambil kesimpulan bahwa :
1. Penelitian ini mampu menghasilkan katalis dengan ukuran partikel skala nano dengan metode sol gel-freezedry menggunakan pektin sebagai agen pengemulsi.
2. Hasil analisis difraksi sinar-X (XRD) menunjukan terbentuknya struktur katalis Ni0,7Cu0,3Fe2O4 dengan fasa kristalin NiFe2O4 (96-591-0065), Ni1,43Fe1,7O4
(96-100-0117), Cu0,86Fe2,14O4 (96-901-2842), CuFe2O4 (96-901-2439) juga NiO
sebagai produk samping.
3. Kedua katalis memperlihatkan pita serapan yang menunjukkan jenis situs asam Brönsted-Lowry.
4. Katalis Ni0,7Cu0,3Fe2O4 suhu kalsinasi 600oC memiliki jumlah situs asam yang
lebih besar yaitu 5,53 mmol piridin/g katalis dibandingkan katalis suhu kalsinasi 800oC sebesar 4,30 mmol piridin/g katalis.
6. Hasil analisis TEM (Transmission Electron Microscope) menunjukkan bahwa
nanokatalis Ni0,7Cu0,3Fe2O4 memiliki morfologi permukaan yang seragam dan
marata.
7. Katalis Ni0,7Cu0,3Fe2O4 suhu kalsinasi 600oC dan 800oC mampu mengkonversi
selulosa menjadi gula akohol berupa sorbitol dan mannitol dengan % konversi dan produk terbaik dihasilkan pada katalis Ni0,7Cu0,3Fe2O4 suhu kalsinasi 600 oC.
B. SARAN
Berdasarkan hasil penelitian yang diperoleh, maka pada penelitian selanjutnya disarankan untuk :
1. Menggunakan agen pengemulsi lainnya dalam mempreparasi nanokatalis. 2. Melakukan uji katalitik pada suhu dan tekanan yang lebih tinggi (T >150 oC )
DAFTAR PUSTAKA
Abdullah, M., V. Yudistira, Nirmin and Khairurrijal. 2008. Sintesis Nanomaterial.
Jurnal Nanosains dan Nanoteknologi. 1: hal. 33 – 36.
Adomako, D. 1972. Cocoa Pod Husk Pectin. Phytochemistry. 11: pp1145-1148.
Akmalludin dan Kurniawan, Arie. 2005. Pembuatan Pektin dari Kulit Coklat dengan Cara Ekstraksi. Skripsi. Fakultas Teknik Kimia, Universitas
Diponogoro. Semarang.
Allemann, E., R. Gurny, and E. Doelker. 1993. Drug-loaded Nanoparticles-Preparation Methods and Drug Targeting Issues. Eur. J. Pharm. Biopharm.
39: pp 173-191.
Almeida, J. M. A., C. T. Meneses, A. S. de Menezes, R. F. Jardim and J. M. Sasaki. 2008. Synthesis and Characterization of NiMn2O4 Nanoparticles Using
Gelatin as Organic Precursor. Journal of Magnetism and Magnetic Materials. 320: pp. 304 – 307.
Anderson, B. Robert and Peter, T. Dawson. 1976. Experimental Methods In Catalytic Reseach. Vol. II. Academic Press. New York.
Antony. 2012. Produksi Enzim Selulase. Skripsi. Fakultas Teknologi Industri,
Institut Teknologi Bandung. Bandung. hal 1-33.
Amalia, R. 2013. Studi Pendahuluan Konversi Selulosa Menjadi Gula Alkohol dengan Katalis NixFe2-xO4 dengan Variabel x=0,5; 0,8 dan 1. Skripsi.
Fakultas Matematika dan Ilmu Pengetahuan Alam , Universitas Lampung. Bandar Lampung.
ASTM D4824-03. 2005. Test Method for Determination of Catalyst Acidity by Ammonia Chemisortption. Annual Book of ASTM.
Auda, H. Y. 2009. Analisa Pola-Pola Difraksi Sinar-X Pada Material Serbuk Nd6Fe13Sn, Nd6Fe13Ge, Nd6Fe13Si Menggunakan Metode Rietveld GSAS.
Skripsi. Fakultas Teknik, Universitas Sebelas Maret. Surakarta.