ISOLASI DAN KARAKTERISASI BAKTERI ENDOFIT DARI
TANAMAN PADI VARIETAS ROJOLELE YANG
BERPOTENSI SEBAGAI BIOKONTROL
DWI ENDAH KUSUMAWATI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi dan Karakterisasi Bakteri Endofit dari Tanaman Padi Varietas Rojolele yang Berpotensi sebagai Biokontrol adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Penelitian ini didanai oleh DIPA LIPI atas nama Dr. Eng. Desriani, M.Si. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Lembaga Ilmu dan Pengetahuan Indonesia (LIPI).
ABSTRAK
DWI ENDAH KUSUMAWATI. Isolasi dan Karakterisasi Bakteri Endofit dari Tanaman Padi Varietas Rojolele yang Berpotensi sebagai Biokontrol. Dibimbing oleh MARIA BINTANG dan DESRIANI.
Bakteri endofit merupakan bakteri yang hidup di dalam jaringan tanaman, tidak menimbulkan efek negatif pada tanaman inangnya, dan diketahui dapat berperan sebagai agen biokontrol. Penggunaan pupuk kimia untuk meningkatkan produktivitas padi rojolele dapat digantikan dengan memanfaatkan bakteri endofit. Penelitian ini bertujuan mengisolasi dan mengkarakterisasi bakteri endofit dari padi rojolele untuk mendapatkan isolat potensial sebagai kandidat agen biokontrol. Karakterisasi yang dilakukan meliputi morfologi, fisiologi (aktivitas enzim ekstraseluler secara kualitatif, resistensi terhadap antibiotik, dan konsumsi karbon secara kualitatif), dan molekuler (analisis sekuen 16S rRNA). Isolat bakteri endofit yang diperoleh berjumlah 43 yang secara umum memiliki ciri morfologi berwarna putih, berbentuk bundar dengan tepian licin dan elevasi timbul. Berdasarkan hasil pengujian karakteristik fisiologi, isolat BU6A, BU6B, dan BO3M berpotensi sebagai kandidat agen biokontrol. Ketiga isolat tersebut diidentifikasi sebagai Bacillus subtilis strain GB4, Bacillus subtilis strain HU48, dan Pseudomonas sp. CTN-2.
Kata kunci: bakteri endofit, biokontrol, padi rojolele, 16S rRNA
ABSTRACT
DWI ENDAH KUSUMAWATI. Isolation and Characterization of Endophytic Bacteria from Paddy Varieties Rojolele which Potential as A Biocontrol. Supervised by MARIA BINTANG and DESRIANI.
Endophytic bacteria are bacteria that live inside plant tissues but do not cause negative effects on their host and are known to act as a biocontrol agent. The use of chemical-based fertilizers to increase the productivity of paddy var rojolele can be replaced with endophytic bacteria. The aim of this research are to isolate and characterize endophytic bacteria from paddy var rojolele to get potential isolate that can be used as a candidate of biocontrol agent. Characterization was conducted on the morphology, physiology (activity of extracellular enzymes qualitatively, resistance to antibiotics, and carbon consumption qualitatively), and molecular (16S rRNA sequence analysis). Endophytic bacterial isolates obtained amounted to 43 which generally has a characteristic morphology white, round with smooth edges and a raised elevation. Based on physiological characteristics of the test results, isolates BU6A, BU6B, and BO3M were potential as a candidate of biocontrol agent. All three isolates were identified as Bacillus subtilis strain GB4, Bacillus subtilis strain HU48, and Pseudomonas sp. CTN-2.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
ISOLASI DAN KARAKTERISASI BAKTERI ENDOFIT DARI
TANAMAN PADI VARIETAS ROJOLELE YANG
BERPOTENSI SEBAGAI BIOKONTROL
DWI ENDAH KUSUMAWATI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi dan Karakterisasi Bakteri Endofit dari Tanaman Padi Varietas Rojolele yang Berpotensi sebagai Biokontrol
Nama : Dwi Endah Kusumawati
NIM : G84090009
Disetujui oleh
Prof. Dr. drh. Maria Bintang, MS Pembimbing I
Dr. Eng. Desriani, M.Si Pembimbing II
Diketahui oleh
Dr.Ir.I Made Artika, M.App Sc Ketua Departemen
PRAKATA
Bismillahirrahmanirrahim
Puji syukur penulis panjatkan kepada Allah SWT atas segala nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah yang berjudul “Isolasi dan Karakterisasi Bakteri Endofit dari Tanaman Padi Varietas Rojolele yang Berpotensi sebagai Biokontrol” ini telah dilakukan sejak bulan Februari hingga Mei 2013.
Ucapan terima kasih penulis sampaikan kepada Prof. Dr. drh. Maria Bintang, MS dan Dr. Eng. Desriani, M.Si selaku pembimbing. Penulis juga mengucapkan terima kasih kepada kedua orang tua, Mba Wulan, Staf Laboratorium Rekayasa Protein untuk Aplikasi Kesehatan Pusat Penelitian Bioteknologi LIPI (Pak Rivai, Mba Neneng, Mba Wiwit, Mba Lita), Mas Adhi, Ukhradiya, serta rekan-rekan Biokimia 46 atas doa dan dukungannya.
Penulis menyadari masih terdapat kekurangan dalam penulisan karya ilmiah ini. Oleh karena itu, saran serta kritik yang membangun sangat penulis harapkan demi perbaikan di kemudian hari. Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1 METODE 2
Bahan dan Alat 2
Prosedur Penelitian 2
HASIL 4
Isolasi Bakteri Endofit 4
Aktivitas Enzim Ekstraseluler secara Kualitatif 5
Daya Resistensi Antibiotik 6
Konsumsi Karbon secara Kualitatif 7
Analisis Sekuen 16S rRNA 8
PEMBAHASAN 9 SIMPULAN 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR GAMBAR
1 Presentase bakteri endofit yang diisolasi dari padi rojolele 5 2 Beberapa koloni tunggal hasil pemurnian bakteri endofit 5 3 Zona bening yang terbentuk disekitar isolat bakteri endofit 5 4 Diameter zona bening yang dihasilkan pada media CMC 6
5 Hasil uji resistensi antibiotik 6
6 Daya tahan isolat bakteri endofit terhadap antibiotik 6 7 Perubahan warna medium pada uji konsumsi karbon 7 8 Konsumsi berbagai jenis karbon dari isolat bakteri endofit 7 9 Elektroforegram ekstraksi DNA genom isolat potensial 8 10 Elektroforegram hasil amplifikasi isolat potensial 8
DAFTAR LAMPIRAN
PENDAHULUAN
Padi rojolele merupakan padi unggul asal Klaten yang dirilis oleh Departemen Pertanian pada tahun 2003 dan digunakan sebagai tetua persilangan pada program penelitian IRRI. Padi rojolele berumur 155 hari, tahan wereng, dan hasil produksinya berkualitas tinggi yakni beras yang dihasilkan pulen dan wangi. Mengingat kelebihan yang dimiliki oleh padi jenis ini maka diperlukan upaya untuk tetap mempertahankan kualitas dan kuantitas hasil produksinya (Mudjisihono et al. 2001). Akan tetapi, luas areal pertanian semakin berkurang dan serangan hama maupun penyakit dapat menjadi kendala rendahnya produksi beras.
Salah satu upaya yang sering dilakukan oleh petani sebagai upaya pencegahan dari serangan hama dan penyakit adalah menggunakan pupuk kimia. Penggunaan bahan kimia berakibat pada terganggunya keseimbangan ekosistem, menyebabkan resistensi bakteri patogen, dan residu yang ditinggalkan juga dapat berdampak negatif bagi manusia dan hewan. Selain itu, pupuk kimia atau sintetis dapat menurunkan jumlah mikroflora tanah (Tian et al. 2004). Alternatif yang dapat digunakan untuk menggantikan penggunaan pupuk kimia adalah memanfaatkan bakteri endofit (Momota et al. 2012).
Bakteri endofit merupakan mikroorganisme simbiotik yang hidup di dalam jaringan tanaman dan tidak menimbulkan efek negatif pada tanaman inangnya (Mano dan Morisaki 2008). Bakteri endofit diketahui dapat meningkatkan produktivitas tanaman dengan cara memproduksi hormon pertumbuhan seperti auksin, berperan terhadap kesehatan tanaman, dan sebagai agen biokontrol. Bakteri endofit dapat ditemukan pada tanaman pertanian, seperti padi. Tanaman padi dapat berumur lama sehingga kemungkinan terdapat bakteri endofit yang masuk ke dalam jaringan tanaman padi lalu menetap dan menghasilkan senyawa tertentu atau metabolit sekunder yang sama dengan yang dihasilkan oleh tanaman inangnya. Bakteri endofit pada padi dapat bermigrasi dari permukaan tanaman ke bagian dalam tanaman atau sebaliknya (Mano et al. 2007).
Keberadaan bakteri endofit di dalam jaringan tanaman diketahui dapat memacu pertumbuhan tanaman dan berperan sebagai agen pengendali hayati. Kemampuan bakteri untuk melakukan penetrasi ke jaringan internal tanaman dapat disebabkan oleh adanya enzim ekstraseluler berupa selulase yang dihasilkan oleh bakteri tersebut (Eliza et al. 2007). Setelah melakukan penetrasi, bakteri tersebut akan berkolonisasi sehingga menghambat pertumbuhan bakteri patogen melalui mekanisme kompetisi ruang dan nutrisi (Pal et al. 2012).
Karakterisasi secara fisiologis dapat digunakan sebagai langkah awal dalam menyeleksi isolat yang berpotensi sebagai agen biokontrol. Beberapa uji pendekatan potensi bakteri endofit sebagai agen pengendali hayati diantaranya dapat dilakukan dengan uji kualitatif enzim ekstraseluler berupa selulase (Eliza et al. 2007), pengujian daya tahan bakteri endofit terhadap antibiotik dan uji konsumsi berbagai sumber karbon (Zinniel et al. 2002). Isolat potensial yang didapatkan berdasarkan karakteristik fisiologis tersebut kemudian diidentifikasi secara molekuler menggunakan analisis sekuen 16S rRNA.
2
daya tahan terhadap antibiotik, uji konsumsi berbagai jenis karbon secara kualitatif, serta analisis sekuen 16S rRNA belum dilaporkan. Oleh sebab itu, penelitian ini bertujuan mengisolasi dan mengkarakterisasi bakteri endofit dari padi rojolele untuk mendapatkan isolat potensial sebagai kandidat agen biokontrol.
METODE
Bahan dan Alat
Bahan yang digunakan antara lain: tanaman padi utuh (Oryza sativa) varietas rojolele, Na-hipoklorit, Nutrient Agar (NA), nistatin 100 mg/mL, etanol 96%, agar, yeast extract, sukrosa, Carboxy Methyl Cellulose (CMC), MgSO4.7H2O, KNO3, K2HPO4, FeSO4.7H2O, CaCl2, akuades, H2O steril, congo red, NaCl, ampisilin, kanamisin, kloramfenikol, tripton, maltosa, laktosa, gula pasir, indikator phenol red 0.25%, agarosa, buffer TAE, loading dye, primer 63F ( 5’- CAG GCC TAA CAC ATG CAA GTC -3’ ) dan 1387R ( 5’- GGG CGG CGT GTA CAA GGC C -3’), Purelink Genomic Digestion Buffer, Proteinase-K, RNase A, Purelink Genomic Lysis/Binding Buffer, Purelink Genomic Elution Buffer, wash buffer 1, wash buffer 2, RNase pure water, Superscript III RT Platinum Taq mix, 1kb DNA Ladder, dan EtBr.
Alat yang digunakan diantaranya: laminar air flow cabinet, alat gelas, pipet mikro, cawan Petri, vorteks, magnetic stirrer, inkubator, tabung eppendorf, PureLinkTM Genomic DNA Mini Kit dari Invitrogen, mesin Polymerase Chain Reaction (PCR), UV Transluminator, dan seperangkat alat elektroforesis.
Prosedur Penelitian
Pembuatan Media Uji
Media NA. Sebanyak 4 gram NA ditambahkan dengan 200 mL akuades kemudian dipanaskan sambil diaduk. Setelah itu, media disterilisasi dan didiamkan beberapa saat lalu dituang ke cawan Petri, sedangkan dalam pembuatan agar miring media yang telah homogen dapat langsung dituang ke tabung reaksi (± 5 mL) lalu disterilisasi. Khusus untuk media NA yang ditambahkan nistatin 200 µL/200 mL. Penambahan nistatin dilakukan pada saat media selesai disterilisasi saat suhu sudah tidak terlalu panas.
Media CMC. Sebanyak 1 gram CMC, 0.2 gram yeast extract, 0.1 glukosa, 200 µL MgSO4.7H2O, 750 µL KNO3, 100 µL K2HPO4, 20 µL FeSO4.7H2O, 40 µL CaCl2, dan 2 gram agar ditambahkan dengan 100 mL akuades kemudian dipanaskan sambil diaduk. Setelah itu, media disterilisasi dan didiamkan beberapa saat lalu dituang ke cawan Petri.
3
Kaldu karbohidrat. Sebanyak 1 g tripton, 0.5 g NaCl, dan 0.72 mL indikator merah fenol 0.25%, dan 1 g karbohidrat tertentu dilarutkan ke dalam 100 mL akuades lalu disterilisasi.
Isolasi Bakteri Endofit
Sampel berupa serabut akar (S), bonggol akar (BO), batang tengah (BT), batang ujung (BU), dan daun (D) tanaman padi varietas rojolele dengan ukuran sekitar 1 cm. Sampel dicuci dengan air mengalir hingga bersih lalu direndam etanol 96% selama 1 menit. Setelah itu, cairan perendam dibuang dan diganti dengan Na-hipoklorit lalu didiamkan selama 5 menit. Cairan perendam dibuang kembali dan sampel dibilas dengan etanol 96% sebanyak tiga kali. Sampel yang telah steril dipotong lagi menjadi beberapa bagian lalu ditanam pada media NA yang telah ditambahkan nistatin (200 µL/200mL) dan diinkubasi pada ruang gelap. Pemurnian dilakukan dengan memindahkan bakteri endofit yang tumbuh pada media NA yang ditambahkan nistatin di cawan Petri ke cawan Petri yang berisi NA yang masih kosong. Setelah diperoleh biakan murni, bakteri endofit disimpan ke agar miring NA.
Aktivitas Enzim Ekstraseluler secara Kualitatif
Bakteri endofit pada agar miring diambil seujung ose lalu ditotolkan pada media CMC lalu diinkubasi selama 24 jam. Setelah itu, larutan congo red 0.1% dituang ke cawan Petri hingga bakteri terendam lalu didiamkan selama 30 menit. Setelah itu, cairan dibuang dan dibilas dengan NaCl 2% selama 15 menit dan diulang sebanyak tiga kali. Diameter zona bening yang terbentuk diukur menggunakan penggaris.
Daya Resistensi Antibiotik (Zinniel et al. 2002)
Isolat endofit diambil seujung ose lalu digoreskan pada cawan Petri yang berisi media LB yang telah ditambahkan antibiotik dengan konsentrasi akhir: ampisilin 50 µg/mL, kloramfenikol 50 µg/mL, dan kanamisin 10 µg/mL. Bakteri dikatakan resisten terhadap antibiotik dengan konsentrasi yang diujikan apabila terlihat adanya pertumbuhan setelah masa inkubasi 48 jam pada suhu 27 ºC.
Konsumsi Karbon secara Kualitatif
Isolat bakteri yang potensial diambil seujung ose lalu ditumbuhkan ke dalam kaldu karbohidrat yang telah ditambahkan indikator merah fenol. Kontrolnya adalah kaldu tanpa penambahan karbohidrat. Setelah itu, tabung diinkubasi pada suhu 35 - 37 ˚C selama 24 – 48 jam. Inkubasi lebih lama dapat digunakan untuk memastikan hasil yang negatif. Perubahan warna media dari merah menjadi kuning menandakan bakteri tersebut mampu memanfaatkan sumber karbon yang ada pada media.
Analisis Sekuen 16S rRNA
4
Buffer dan 20 µL Proteinase-K ditambahkan ke dalam tabung berisi pelet isolat lalu diinkubasi pada suhu 55 ˚C selama 1 jam kemudian disentrifugasi pada 12000 rpm selama 5 menit. Supernatan yang dihasilkan dipindah ke tabung baru lalu ditambahkan 20 µL RNase A. Campuran dihomogenkan lalu diinkubasi pada suhu ruang selama 2 menit. Setelah itu, sebanyak 200 µL Purelink Genomic Lysis/Binding Buffer ditambahkan ke dalam campuran lalu dihomogenkan kembali dan ditambahkan 200 µL etanol 96% kemudian dicampur selama 5 menit. Tahap selanjutnya yaitu sebanyak 640 µL sampel yang diperoleh dari tahap sebelumnya dipindahkan ke spin column lalu disenrifugasi 12000 rpm selama 3 menit pada suhu ruang. Setelah itu cairan dibuang, sebanyak 500 µL wash buffer 1 ditambahkan ke spin column dan disentrifugasi kembali 12000 rpm selama 1 menit. Cairan kembali dibuang lalu ditambahkan 500 µL wash buffer 2 ke dalam spin column dan disentrifugasi 12000 rpm selama 3 menit. Cairan ini tidak dibuang dan ditambahkan 25 µL Purelink Genomic Elution Buffer kemudian diinkubasi pada suhu ruang selama 10 menit lalu disentrifugasi 12000 rpm selama 1 menit.
Amplifikasi DNA. Amplifikasi DNA hasil isolasi sebelumnya dilakukan menggunakan mesin PCR. Primer yang digunakan adalah 63F dan 1387R (Marchesi et al. 1998). Sebanyak 25 μL total volume reaksi yang terdiri atas: 20 µL RNase pure water, 2 µL Superscript III RT Platinum Taq mix, 1 µL primer 63F, 1 µL primer 1387R, dan 1 µL DNA hasil isolasi (template). Amplifikasi dilakukan 35 siklus dengan kondisi denaturasi awal 94 ˚C selama 2 menit, denaturasi 94 ˚C selama 20 detik, penempelan primer 45 ˚C selama 30 detik, pemanjangan 68 ˚C selama 1.5 menit, dan ekstensi akhir 68 ˚C selama 5 menit. Reaksi dihentikan pada saat suhu turun ke 4 ˚C.
Visualisasi PCR. Hasil PCR kemudian diperiksa menggunakan elektroforesis gel agarosa 110 V selama 30 menit dan marker yang digunakan adalah 1kb DNA Ladder. Setelah itu, gel hasil elektroforesis direndam ke dalam EtBr selama 5 menit lalu diamati menggunakan UV Transluminator.
Penentuan Urutan Basa DNA. Produk PCR selanjutnya ditentukan urutan basanya dan hasilnya dianalisis menggunakan BLASTN guna mengidentifikasi jenis bakteri endofit tersebut.
HASIL
Isolasi Bakteri Endofit
Isolasi bakteri endofit dari padi rojolele menghasilkan 43 isolat ( 2 isolat dari daun, 11 isolat dari batang ujung, 13 isolat dari batang tengah, dan 17 isolat dari bonggol akar), namun tidak ada isolat endofit yang berhasil diisolasi dari serabut akar (Gambar 1). Hasil penelitian menunjukkan isolat terbanyak didapatkan dari bonggol akar dan semakin berkurang pada batang dan daun.
6
Gambar 4 Diameter zona bening yang dihasilkan pada media CMC
Daya Resistensi Antibiotik (Zinniel et al. 2002)
Pengujian daya tahan bakteri endofit dilakukan terhadap tiga jenis antibiotik, yaitu: ampisilin, kloramfenikol, dan kanamisin. Isolat endofit dikatakan resisten apabila mampu tumbuh pada media yang telah ditambahkan antibiotik tertentu pada konsentrasi yang diujikan (Gambar 5). Sebanyak 86.04% dari total isolat resisten terhadap ampisilin 50 µg/mL, 88.37% isolat resisten terhadap kanamisin 10 µg/mL, dan 33.48% isolat resisten terhadap kloramfenikol 50 µg/mL (Gambar 6).
Gambar 5 Hasil uji resistensi antibiotik
Gambar 6 Daya tahan isolat bakteri endofit terhadap antibiotik 0
5 10 15 20 25
d = 0 d < 0.2 0.2 ≤ d ≤ 0.4 d > 0.4
Jum
lah iso
lat
Diameter zona bening (cm)
0 5 10 15 20
Ampisilin Kanamisin Kloramfenikol
Jum
lah Isolat
7 Berdasarkan hasil tersebut, terdapat 9 isolat bonggol akar (BO1, BO2, BO2M, BO3M, BO7A, BO7B, BO8, BO9, dan BO10), 2 isolat batang tengah (BT7 dan BT11), dan 2 isolat batang ujung (BU6A dan BU6B) yang resisten terhadap ketiga jenis antibiotik pada konsentrasi yang diujikan.
Konsumsi Karbon secara Kualitatif
Konsumsi karbon secara kualitatif dari isolat bakteri dilakukan terhadap lima jenis karbohidrat (glukosa, maltosa, sukrosa, selulosa, dan laktosa) menggunakan indikator merah fenol. Hasil positif ditunjukkan oleh perubahan warna medium dari merah menjadi kuning yang menandakan adanya perubahan pH medium menjadi asam sebagai hasil konsumsi karbon oleh isolat. Pada kontrol tidak ditambahkan sumber karbon apapun sehingga tidak terjadi perubahan pH pada medium sebagai akibat konsumsi karbon oleh isolat (Gambar 7).
Berdasarkan hasil penelitian, sebanyak 25 isolat) mampu memanfaatkan glukosa sebagai sumber karbon, 23 isolat mampu memanfaatkan maltosa, 24 isolat mampu memanfaatkan sukrosa sebagai sumber karbon, dan 14 isolat dapat menggunakan laktosa sebagai sumber karbon. Namun, semua isolat nampak menunjukkan hasil negatif terhadap selulosa (Gambar 8).
K + -
Gambar 7 Perubahan warna medium pada uji konsumsi karbon
Gambar 8 Konsumsi berbagai jenis karbon dari isolat bakteri endofit 0
Glukosa Maltosa Sukrosa Laktosa Selulosa
8
Analisis Sekuen 16S rRNA
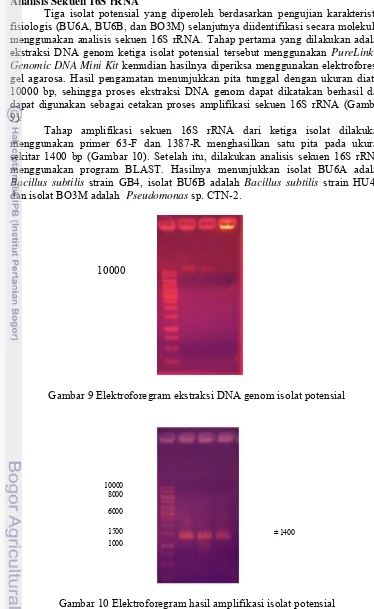
Tiga isolat potensial yang diperoleh berdasarkan pengujian karakteristik fisiologis (BU6A, BU6B, dan BO3M) selanjutnya diidentifikasi secara molekuler menggunakan analisis sekuen 16S rRNA. Tahap pertama yang dilakukan adalah ekstraksi DNA genom ketiga isolat potensial tersebut menggunakan PureLinkTM Genomic DNA Mini Kit kemudian hasilnya diperiksa menggunakan elektroforesis gel agarosa. Hasil pengamatan menunjukkan pita tunggal dengan ukuran diatas 10000 bp, sehingga proses ekstraksi DNA genom dapat dikatakan berhasil dan dapat digunakan sebagai cetakan proses amplifikasi sekuen 16S rRNA (Gambar 9).
Tahap amplifikasi sekuen 16S rRNA dari ketiga isolat dilakukan menggunakan primer 63-F dan 1387-R menghasilkan satu pita pada ukuran sekitar 1400 bp (Gambar 10). Setelah itu, dilakukan analisis sekuen 16S rRNA menggunakan program BLAST. Hasilnya menunjukkan isolat BU6A adalah Bacillus subtilis strain GB4, isolat BU6B adalah Bacillus subtilis strain HU48, dan isolat BO3M adalah Pseudomonas sp. CTN-2.
Gambar 9 Elektroforegram ekstraksi DNA genom isolat potensial
Gambar 10 Elektroforegram hasil amplifikasi isolat potensial 10000
10000 8000
6000
1500 1000
± 1400
M BU6A BU6B BO3M
9
PEMBAHASAN
Bakteri endofit dapat diisolasi dari dalam bagian tanaman yang telah disterilisasi permukaannya atau dari ekstrak bagian tanaman (Mano dan Morisaki 2008). Pada penelitian ini, isolat bakteri endofit didapatkan dari dalam sampel yang telah disterilisasi permukaannya lalu ditumbuhkan pada media NA. Penggunaan sodium hipoklorit pada proses sterilisasi permukaan akan mengakibatkan mikroba pada permukaan sampel mati, sehingga bakteri yang tumbuh selama masa inkubasi adalah bakteri endofit (Barac et al. 2004). Selain itu, pada proses isolasi juga digunakan nistatin yang berfungsi sebagai antifungi (Kumala dan Siswanto 2007).
Sebanyak 43 isolat bakteri berhasil diisolasi dari padi rojolele dengan isolat terbanyak berasal dari bonggol akar, dan semakin berkurang pada batang dan daun. Hal ini sesuai dengan pernyataan Lamb et al. (1996) yaitu jumlah bakteri endofit pada akar lebih banyak daripada di batang dan daun. Koloni bakteri tidak didapatkan pada serabut akar padi rojolele. Hal ini dapat disebabkan karena pemilihan sampel yang berupa akar masih terlalu muda dan berukuran tipis, sehingga kemungkinan bakteri endofit mati ketika proses sterilisasi berlangsung.
Isolat bakteri endofit kemudian dikarakterisasi secara morfologi yaitu dengan cara memperhatikan ciri-ciri fisiknya. Isolat endofit yang muncul memiliki ciri morfologi yang mirip, namun secara umum isolat endofit yang didapatkan berwarna putih, berbentuk bundar dengan tepian licin dan elevasi timbul. Tahap selanjutnya adalah karakterisasi secara fisiologi (pengujian terhadap kemampuan menghasilkan enzim ekstraseluler, resistensi terhadap antibiotik, dan konsumsi berbagai jenis karbon secara kualitatif). Tahap akhir adalah karakterisasi molekuler (analisis sekuen 16S rRNA) dari isolat potensial berdasarkan hasil uji sebelumnya.
Karakterisasi fisiologi pertama yang dilakukan adalah pengujian aktivitas enzim ekstraseluler yang dihasilkan oleh isolat secara kualitatif. Enzim ekstraseluler berfungsi melakukan perubahan seperlunya pada nutrien yang ada di sekitarnya yang memungkinkan nutrien tersebut untuk masuk ke dalam sel (Pelczar dan Chan 1986). Hal ini berhubungan dengan penetrasi bakteri endofit ke jaringan internal tanaman yang diakibatkan oleh kemampuan bakteri dalam menghasilkan enzim ekstraseluler, salah satunya adalah selulase (Eliza et al. 2007).
Berdasarkan hasil penelitian, aktivitas selulolitik dari 21 isolat bakteri endofit ditunjukkan oleh terbentuknya zona bening (Gambar 3). Zona bening yang terbentuk divisualisasikan dengan pemberian larutan congo red 0.1% dan larutan NaCl 2%. Larutan congo red memiliki interaksi yang kuat dengan polisakarida yang memiliki ikatan β-1,4 (dalam hal ini selulosa) sehingga apabila selulosa yang terdapat pada media telah terdegradasi, maka daerah tersebut tidak akan terwarnai oleh congo red sedangkan larutan NaCl 2% berfungsi mengurangi kepekatan warna congo red pada media sehingga zona bening yang terbentuk akan lebih jelas. Selain itu, larutan NaCl 2% akan menghentikan aktivitas enzim selulolitik dalam mendegradasi substrat (Teather dan Wood 1982).
10
yaitu selobiosa lalu disederhanakan menjadi dua molekul glukosa yang dapat diserap oleh sel (Perez et al. 2002). Tidak semua isolat bakteri dapat menghasilkan zona bening, sebanyak 22 isolat tidak mampu membentuk zona bening. Hal ini kemungkinan disebabkan oleh cara masuk endofit ke dalam jaringan internal tanaman yang bisa melalui stomata, lentisel, luka, daerah munculnya tunas akar lateral, dan tunas perkecambahan (Huang 1986). Kemungkinan lain adalah enzim ekstraseluler sebenarnya dihasilkan, namun terdapat inhibitor yang menghambat kerja dari enzim tersebut, baik melalui mekanisme kompetitif maupun nonkompetitif yang menyebabkan enzim yang dihasilkan tidak mampu untuk mendegradasi substrat sehingga tidak terbentuk zona bening.
Karakterisasi fisiologi selanjutnya adalah pengujian terhadap daya resistensi antibiotik. Hal ini merupakan salah satu langkah penting untuk mengetahui potensinya sebagai agen biokontrol, yaitu untuk memenangkan kompetisi ruang agar dapat menghambat pertumbuhan bakteri patogen. Beberapa isolat ternyata mampu tumbuh pada media yang ditambahkan antibiotik, baik berupa ampisilin, kanamisin, dan kloramfenikol. Resistensi antibiotik pada beberapa isolat tersebut dapat disebabkan oleh adanya transfer gen resisten antibiotik secara horizontal dari lingkungan ke mikroorganisme termasuk endofit (Arunachalam dan Gayathri 2010).
Kemampuan isolat dalam mengkonsumsi berbagai jenis karbon juga merupakan parameter penting dalam mendukung kompetisi nutrisi antara bakteri endofit dengan patogen. Isolat endofit menunjukkan hasil yang bervariasi dalam memanfaatkan sumber karbon (glukosa, maltosa, sukrosa, dan laktosa) yang terdapat di media. Pemanfaatan glukosa dan sukrosa tentunya akan mendukung kemampuan bakteri endofit dalam memenangkan kompetisi nutrisi karena glukosa merupakan produk hasil fotosintesis sedangkan sukrosa merupakan bentuk gula transpor yang ada di dalam tanaman (Heldt 2005).
Perubahan warna media dari merah menjadi kuning merupakan visualisasi dari metabolisme karbohidrat menjadi asam yang dapat menurunkan pH media. Karbohidrat akan diglikolisis oleh bakteri menjadi asam piruvat yang selanjutnya dapat dimetabolisme menghasilkan produk yang bersifat asam, seperti asam laktat dan asam asetat. Akan tetapi, semua isolat nampak menunjukkan hasil yang negatif terhadap selulosa. Hal ini kemungkinan dapat disebabkan oleh adanya suatu inhibitor yang menghambat kerja enzim ataupun terdapat sumber nutrisi yang lebih sederhana pada media untuk dikonsumsi oleh bakteri tersebut. Ukuran molekul selulosa yang besar menyebabkan bakteri perlu waktu lebih lama untuk mencerna selulosa, sehingga dapat dikatakan bahwa selulosa bukan merupakan sumber karbon utama bagi bakteri. Perbedaan dan keunikan karakter bakteri endofit tergantung kepada lingkungan hidupnya. Perbedaan dan keunikan ini tentunya akan memberi keuntungan bagi manusia untuk pemanfaatannya dalam berbagai jenis kebutuhan. Berdasarkan pengamatan terhadap daya resistensi antibiotik, aktivitas kualitatif enzim ekstraseluler , dan konsumsi karbon secara kualitatif diperoleh tiga isolat potensial, yaitu: BU6A, BU6B, dan BO3M.
11 konservatif dan sekuen variatif yang dapat digunakan untuk mengidentifikasi bakteri melalui perbedaan dan variasi urutan pasang basanya (Bottger 1996).
Hasil identifikasi melalui analisis sekuen 16S rRNA menunjukkan isolat BU6A adalah Bacillus subtilis strain GB4, isolat BU6B adalah Bacillus subtilis strain HU48, dan isolat BO3M adalah Pseudomonas sp. CTN-2. Kedua genus bakteri endofit tersebut telah dilaporkan berperan terhadap peningkatan pertumbuhan dan kesehatan dan proteksi tanaman. Pseudomonas sp., Enterobacter sp., Staphylococcus sp., Azotobacter sp., dan Azospirilum sp. merupakan bakteri endofit yang berperan terhadap pertumbuhan tanaman, sedangkan bakteri endofit yang berperan terhadap kesehatan dan proteksi tanaman diantaranya: Pseudomonas sp., Serratia sp., Clavibacter sp., dan Bacillus sp. (Ryan et al. 2008).
Kemampuan Bacillus sebagai agen biokontrol didukung oleh kemampuannya dalam membentuk spora sehingga bakteri tersebut mampu bertahan dan masih mampu untuk mengeluarkan metabolit aktifnya pada kondisi lingkungan tidak stabil (Kloepper dan Schroth 1999). Selain itu, Compant et al. (2005) juga melaporkan bahwa Bacillus sp. berpotensi sebagai agen biokontrol dengan cara menginduksi sistem kekebalan tanaman dan menghasilkan senyawa antibiotik.
SIMPULAN
Bakteri endofit dari padi rojolele berhasil diisolasi dan dikarakterisasi secara morfologi, fisiologi, dan molekuler. Terdapat tiga isolat yang berpotensi sebagai agen biokontrol dengan kemampuan menghasilkan enzim ekstraseluler, resitensi terhadap antibiotik dan kemampuan menggunakan beberapa jenis sumber karbon, berturut-turut adalah BU6A, BU6B, dan BO3M. Hasil analisis sekuen 16S rRNA tiga isolat potensial tersebut berturut-turut diidentifikasi sebagai Bacillus subtilis strain GB4, Bacillus subtilis strain HU48, dan Pseudomonas sp. CTN-2.
DAFTAR PUSTAKA
Arunachalam C, Gayathri P. 2010. Studies on bioprespecting of endophytic bacteria from the medicinal plant of Andrographis paniculata for their antimicrobial activity and antibiotic susceptibility. Int J Curr Pharm Res. 2:63-68.
Barac T, Taghavi S, Borremans B, Provoost A, Oeyen L, Colpaert JV, Vangronsveld J, Ledie VD. 2004. Engineered endophytic bacteria improve phytoremediation of water-soluble, volatile, organicpollutants. Nat Biotechnol. 22:583–588.
12
Compant S, Duffy B, Nowak J, Clement C, Barka EA. 2005. Use of plant-growth promoting bacteria for biocontrol of plant disease: principles, mechanism of action, and future prospect. Appl Environ Microbiol. 71: 4951-495. Eliza, Munif A, Djatnika I, Widodo. 2007. Karakter fisiologis dan peranan
antibiosis bakteri perakaran Graminae terhadap Fusarium dan pemacu pertumbuhan tanaman pisang. J Hort. 17:150-160.
Heldt HW. 2005. Plant Biochemistry 3ed. USA:Elsevier Inc.
Huang JS. 1986. Ultrastructure of bacterial penetration in plants. Ann Rev Phytopatol 24:897-905.
Kloepper JW, Schroth MN. 1978. Plant growth promoting rhizobacteria on radish in proceeding of the 4th conference of plant pathogenic bacteria Station de Pathogenic. Angers INRA 2:879-882.
Kumala S, Siswanto EB. 2007. Isolation and screening of endophytic microbes from Morinda citrifolia and their ability to produce anti-microbial subtances. Microbiol Indones. 1:145-148.
Lamb TG, Tonkyn DW, Kluepfel DA. 1996. Movement of Pseudomonas aureofaciens from the rhizosphere to aerial plant tissue. J Microbiol. 42:1112–1120.
Mano H, Tanaka F, Nakamura C, Kaga H, Morisaki H. 2007. Culturable endophytic bacterial flora of the maturing leaves and roots of rice plants (Oryza sativa) cultivated in a paddy field. Microbes and Environments 22: 175-185.
Mano H, Morisaki H. 2008. Minireview: Endophytic bacteria in the rice plant. Microbes and Environments 23:109-117.
Momota P, Singh BK, Devi SI. 2012. Role of endophytic microorganism in sustainable agriculture. NeBIO 3:69-77.
Mudjisihono R., Santoso T, Hendrata R. 2001. Laporan Hasil Pengkajian Uji Varietas Rojolele Kabupaten Klaten. Yogyakarta: Balai Pengkajian Teknologi Pertanian.
Pal A, Chattopadhyay A, Paul AK. 2012. Diversity and Antimicrobial Spectrum of Endophytic Bacteria Isolated from Peaderi foetida L. Int J Curr Pharm Res. 4:123-127.
Pelczar MJJr, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Volume ke-1, 2. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Press. Terjemahan dari: Elements of Microbiology.
Perez J, Dorado JM, Rubia T, Martinez J. 2002. Biodegradation and biochemical treatments of cellulose, polysaccharide, and lignin: an overview. Int Microbiol. 5:53-63.
Ryan RP, Germaine K, Franks A, Ryan DJ, Dowling DN. 2008. Minireview: Bacterial endophytes: recent development and application. FEMS Microbiol Lett. 278: 1-9.
Teather RM, Wood PJ. 1982. Use of congo red polysaccharide interactions in enumeration and characterization of cellulolytics bacteria from the bovine rumen. Appl Environ Microbiol. 43:777-780.
13 Zinniel DK, Lambrecht P, Harris NB, Feng Z, Kuczmarski D, Higley P, Ishimaru
14
Lampiran 1 Karakterisasi morfologi seluruh isolat endofit dari padi rojolele
Kode Isolat
Ciri Morfologi
Warna Bentuk Tepian Elevasi
D1 Putih Tak beraturan dan
menyebar Berlekuk Datar
D2 Putih Tak beraturan dan
menyebar Licin
Tumbuh ke dalam medium BU1 Putih Tak beraturan dan
menyebar Berombak Cembung
BU2 Putih Bundar Licin Cembung
BU3 Kuning
muda Bundar Berombak Timbul
BU4 Putih Tak beraturan dan
berair Licin Datar
BU5 Putih Bundar Tak beraturan Timbul
BU6 Putih Tak beraturan dan
menyebar Berombak Timbul
BU6a Putih Bundar Berombak Cembung
BU6b Putih Bundar Berlekuk Cembung
BU7 Kuning Bundar Tak beraturan Timbul
BU7a Putih Bundar Tak beraturan Timbul
BU8 Putih kekuningan
Bundar Licin Timbul
BTnew Putih Bundar Tak beraturan Timbul
BT2 Putih kekuningan
Bundar Licin Cembung
BT3 Putih
Bundar Licin Cembung
BT5 Putih Bundar Berombak Timbul
BT6 Putih kekuningan
Bundar Licin Datar
BT7 Kuning Bundar Licin Cembung
Bundar Licin Datar
BT9 Putih Bundar Tak beraturan Cembung
BT10 Putih Bundar Berombak Timbul
BT11 Putih kekuningan
Bundar Licin Cembung
BT12 Kuning tua Bulat Licin Timbul
BO1 Putih Bundar Berombak Datar
15 Lanjutan lampiran 1
BO3 Putih Bundar Licin Timbul
BO1M Kuning muda
Bundar Tak beraturan Timbul
BO2M Putih Bundar Tak beraturan Datar
BO3M Putih Bundar Licin Cembung
BO7a Putih Bundar Licin Timbul
BO7b Kuning muda
Bundar Licin Timbul
BO8 Putih Bundar Licin Timbul
BO9 Putih Bundar Licin Datar
BO10 Putih Bundar Licin Datar
BO11 Putih Bundar Licin Cembung
BO12 Putih Bundar Berlekuk Timbul
BO13 Kekuningan Bundar Licin Timbul
BO14 Putih Bundar Berombak Cembung
BO15 Putih Bundar Licin Cembung
16
18
Lampiran 3 Hasil analisis homologi isolat BU6A, BU6B, dan BO3M
Isolat BU6A
Isolat BU6B
19 Lampiran 4 Hasil pensejajaran sekuen isolat BU6A, BU6B, dan BO3M
Isolat BU6A
20
Isolat BU6B
21
Isolat BO3M
22
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 5 Februari 1991 dari pasangan Tukimin dan Kasini.Penulis merupakan putri kedua dari dua bersaudara.
Tahun 2009 penulis lulus dari SMAN 3 Depok dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.