PENGARUH K
SUHU TERH
FA
KONSENTRASI KOAGULAN CaSO
RHADAP PROSES KOAGULASI PROT
TEKSTUR CURD
SKRIPSI
DITA ADI SEPTIANITA
F 24053053
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
2011
SO4.2H2O DAN
PROTEIN DAN
EFFECT OF CaSO
4.2H
2O (COAGULANT) CONCENTRATION
AND TEMPERATURE ON THE PROTEIN COAGULATION PROCESS
AND CURD TEXTURE
Dita Adi Septianita and Dahrul Syah
Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus, PO Box 220, Bogor, West Java, Indonesia.
Phone +62 813 80166208, e-mail: dita.adi.septianita@gmail.com
ABSTRACT
Texture is an important aspect to determine consumer preferences for products based curd, one of them is tofu. Differences in texture of are influenced by the parameters of the coagulation process which consists of coagulant concentration and coagulation temperature. Effect of differences in coagulation parameters was represented by the data of whey transmittance, whey protein content, pH value of whey, curd protein profiles, moisture content and total solids of curd, and curd texture (objectively by TPA devices). This study used CaSO4.2H2O as a coagulant for soybean milk with the
concentration of 0.015 N (A), 0.030 N (B), and 0.045 N (C). Soy milk was coagulated at the temperature of 60 and 80°C. Coagulation produced curd tofu and whey. The data suggest that whey C had the highest transmittance [23.52% (60°C) and 19.30% (80°C)], whey protein B had the lowest [0.448 mg/mL (80°C) and 0.390 mg/mL (60°C )], while the whey pH values were not significantly different in the range of 5.72 to 5.90. The curd C had the highest moisture content (wet basis) [20.63% (80°C) and 18.69% (60°C)] and the highest total solids/yields (raw material basis) [40.88% (60°C) and 37.75% (80°)]. The function f(x) = y = 2.896x + 1358 was obtained to correlate the curd texture by objective measurement (x) and the sensory evaluation (y). Curd C (80°C) had the highest hardness 2.474 (slightly hard) while the curd A (60°C) had the lowest hardness 1.164 (soft).
Meanwhile, the curd protein profiles consists of 7S globulin (β-conglycinin) and 11S globulin (glycinin) protein subunits. The 7S protein consists of subunits α, α’, and β, while the 7S protein consists of the acid subunits (A1, A2, A4, A6) and the base subunit. Percent of 11S subunits in the curd
increased with increasing concentration of coagulant in all the coagulation temperature. The percent of 7S subunits indicated otherwise, as well as its components, α+α’ and β. Overall, subunits of proteins that have an influence on the texture are the A1 subunit and the base subunit of the 11S
proteins with the highest Pearson correlation on the curd cohesiveness.
DITA ADI SEPTIANITA. F24053053. Pengaruh Konsentrasi Koagulan CaSO4.2H2O dan Suhu terhadap Proses Koagulasi Protein Dan Tekstur Curd. Di bawah bimbingan Dahrul Syah. 2011
RINGKASAN
Tekstur curd merupakan aspek mutu yang penting dalam produk berbasis curd. Contoh produk hasil koagulasi yang umum di Indonesia adalah tahu dan keju. Tekstur mempengaruhi preferensi konsumen ketika mereka membeli produk. Tahu yang diinginkan memiliki tekstur kompak, padat, seperti gel, tidak keras dan tidak terlampau lunak, serta mudah dalam penanganan untuk pengolahan selanjutnya. Teknologi koagulasi protein dalam pembentukan curd telah banyak dikaji dalam penelitian-penelitian sebelumnya. Curd protein dapat diperoleh dari sumber nabati yakni sari kacang-kacangan, seperti kacang kedelai (Glycine max), yang biasa disebut tahu. Parameter proses yang mempengaruhi mutu curd yang dihasilkan diantaranya adalah jenis koagulan dan konsentrasi koagulan. Perbedaan komponen proses koagulasi tersebut menyebabkan perbedaan mutu
curd, terutama dari segi tekstur curd yang dihasilkan.
Garam CaSO4.H2O dipilih sebagai koagulan dalam pengujian ini. Curd dihasilkan melalui
koagulasi pada skala produksi tahu (seperti di pabrik tahu) dan skala laboratorium. Tekstur tahu dianalisis secara objektif dan subjektif. Tekstur tahu skala makro dikorelasikan dengan komposisi protein skala mikro. Protein yang terkoagulasi membentuk molekul agregat dengan bobot molekul yang spesifik. Komposisi ini diperoleh melalui screening protein dengan metode elektroforesis. Sehingga diketahui bobot molekul protein spesifik (subunit protein) yang mempengaruhi tekstur curd
tahu yang dihasilkan pada konsentrasi koagulan CaSO4.H2O dan suhu koagulasi yang berbeda.
Penelitian ini terdiri dari tiga tahap, dengan perbedaan konsentrasi koagulan pada 0.015 N (A), 0.030 N (B), dan 0.045 N (C). CaSO4.H2O pada suhu 60°C dan 80°C. Tahap pertama adalah analisis
whey dan curd. Analisis whey terdiri atas pengukuran transmitan, kadar protein (metode Bradford), dan pH whey. Analisis curd terdiri atas pengukuran kadar protein curd/tahu dengan metode Bradford dan Kjeldahl, kadar air, total padatan dan tekstur curd secara objektif dengan Texture Profile Analyzer (TPA). Lalu, dilanjutkan ke tahap kedua yaitu analisis komponen protein spesifik curd yang terdiri atas ekstraksi protein curd dan elektroforesis protein terekstraksi. Tahap ini menghasilkan komposisi protein curd berdasarkan bobot molekulnya. Dan tahap ketiga adalah analisis subjektif tahu oleh panelis yang meliputi seleksi panelis terlatih dan pengujian atribut kekerasan tahu. Data ini digunakan untuk mendukung data analisis tekstur objektif sebelumnya. Kemudian dilanjutkan dengan analisis keterkaitan/korelasi antar parameter analisis yang terukur.
Data menunjukkan bahwa nilai transmittan whey tertinggi diperoleh whey C [23.52 (60°) dan 19.30% (80°C)], kadar protein whey terendah oleh whey B [0.448 mg/ml (80°) dan 0.390 mg/ml (60°C)], pH whey tidak berbeda signifikan dalam kisaran 5.72-5.90, kadar air curd tertinggi oleh curd
C [20.63% (80°C) dan 18.69 (60°C)], total padatan tertinggi curd (basis bahan baku kedelai) oleh
curd C [40.88% (60°C) dan 37.75 (80°)], dan kekerasan curd tertinggi 2.474 (agak keras) diperoleh oleh curd C (suhu 80°C) serta kekerasan terendah 1.164 (lunak) oleh curd A (suhu 60°C). Penentuan nilai kekerasan subjektif dilakukan dengan memasukkan nilai kekerasan objektif ke dalam persamaan tekstur yang diperoleh dengan pengujian organoleptik 8 tahu komersil. Fungsi tekstur objektif (x) terhadap tekstur subjektif (y) menggunakan persamaan y = 2.896x + 1.358.
Sementara profil protein curd terdiri dari subunit protein globulin 7S (β-conglisinin) dan globulin 11S (glisinin). Protein 7S terdiri dari subunit α, α’, dan β, sedangkan protein 11S terdiri dari subunit asam (A1, A2, A4, A6) dan basa. Persen subunit 7S dalam curd menurun seiring peningkatan
konsentrasi koagulan di kedua suhu koagulasi, begitu juga dengan komponen α+α’ dan β. Sedangkan persen subunit 11S menunjukkan hal yang sebaliknya, walaupun kondisinya tidak serupa untuk komponen protein di dalamnya. Dari semua subunit, subunit protein yang memiliki pengaruh terhadap tekstur adalah subunit A1 dan subunit basa dari protein 11S dengan korelasi Pearson tertinggi
pada atribut daya kohesif curd.
Protein 11S menempati porsi paling besar dalam curd. Antar subunit protein dan variabel terukur yang menjadi parameter mutu tekstur curd memiliki korelasi satu sama lain yang diukur dengan analisis regresi linear. Keterkaitan antara atribut tekstur dan subunit protein tertinggi dimiliki oleh daya kohesif dan subunit A1 (korelasi Pearson = 0.4049, Yx = 0.4003 – 0.0610Xj) namun efeknya
tidak signifikan. Efek yang signifikan dan memiliki keterkaitan tertinggi dimiliki oleh daya kohesif dan subunit basa (korelasi Pearson = 0.3660, Yx = 0.1687 + 0.0470Xj) dengan efek linieritas yang
berarti, namun masih perlu dilakukan pengujian regresi lengkung. Keterkaitan tertinggi dimiliki oleh daya kohesif dan total padatan (%BBBK) (korelasi Pearson = 0.9613, Yx = 0.4921 – 0.1237Xj).
Linieritas terbaik (tidak perlu pengujian regresi lengkung) dimiliki oleh daya kohesif dan total padatan (%BB) (korelasi Pearson = 0.6894, Yx = 0.7935 + 0.0245Xj). Kekerasan curd memiliki keterkaitan
paling besar dengan kadar air (%BB) (korelasi Pearson = 0.6513, Yx = 0.1755 + 0.0048Xj).
Sementara kelengketan curd memiliki keterkaitan paling besar dengan total padatan (%BB) (korelasi Pearson = 0.6124, Yx = 0.8207 – 0.0096Xj). Keterkaitan tertinggi dan linieritas terbaik selanjutnya
dimiliki oleh total padatan (%BBBK) curd dan subunit basa (korelasi Pearson = 0.5258, Yx = 0.3806 -
0.0053Xj). Linieritas yang berarti pula dimiliki oleh total padatan (%BBBK) dengan subunit A1
(korelasi Pearson = 0.5156, Yx = 0.1512 + 0.0060Xj) namun efeknya tidak signifikan.
Maka secara umum, di antara subunit A1 dan subunit basa, subunit basa yang memiliki
pengaruh paling tinggi terhadap atribut tekstur, kadar air, dan total padatan. Sementara itu, subunit basa juga berpengaruh terhadap total padatan (%BBBK) yang merepresntasikan kesempurnaan koagulasi protein kedelai. Dan atribut tekstur yang paling dipengaruhi adalah daya kohesif curd, yaitu kemampuan curd dalam menahan deformasi kedua (dengan alat objektif maupun kunyahan subjektif).
Tekstur curd juga merupakan produk kestabilan struktur jaringan molekul protein bersama molekul organik lain di dalamnya untuk mengikat air. Daya ikat curd terhadap air menentukan kadar air tahu dipengaruhi oleh suhu koagulasi. Semakin tinggi suhu, semakin cepat koagulasi terjadi, semakin kasar matriks protein, semakin sedikit air yang terikat, semakin padat curd yang dibentuk. Semakin tinggi kadar air ketika struktur curd menyerupai gel pada konsentrasi tidak optimum, kemungkinan sinersesis terjadi akan semakin besar karena kekuatan ionik antarmolekul protein tidak maksimal.
Kondisi optimum dipengaruhi oleh ketercapaian nilai pI dari suatu protein. Perbedaan parameter proses menghasilkan pH whey pada kisaran nilai 5.72-5.90 yang tidak berbeda signifikan. Semakin tinggi konsentrasi koagulan dan suhu koagulasi, nilai pH semakin mendekati pI glisinin (globulin 11S) yaitu 6.3-7.0. Semakin rendah konsentrasi koagulan dan suhu koagulasi, nilai pH semakin mendekati pI β-conglisinin (globulin 7S) yaitu 4.5-5.0. Suhu yang rendah mengakibatkan proses koagulasi berlangsung lebih lama, sehingga kemungkinan terjadinya pengasaman whey karena kadar protein yang tinggi lebih besar.
Adanya keterkaitan antara komposisi protein 11S-7S dan tekstur serta daya ikat air curd
disebabkan oleh ikatan disulfida (ikatan –SS–). Jaringan protein 11S memiliki ikatan disulfida yang lebih banyak daripada jaringan protein 7S. Oleh karena itu jumlah protein 11S dalam curd yang tinggi akan diikuti oleh tektstur curd yang lebih keras. Tetapi ketika jumlah protein 7S dalam curd mulai meningkat, tekstur curd mulai menurun. Dan kisaran 0.030-0.045 N pada suhu 80°C merupakan kondisi lebih baik bagi koagulasi protein 11S. Kondisi ini akan membentuk tahu yang agak keras yang dapat dicetak dengan alat pembuat tahu. Jika kondisi dibuat optimum bagi koagulasi protein 7S, tahu yang dihasilkan adalah tahu lembut yang berwujud gel dan tidak bisa dicetak dengan alat.
PENGARUH KONSENTRASI KOAGULAN CaSO4.2H2O DAN
SUHU TERHADAP PROSES KOAGULASI PROTEIN DAN
TEKSTUR CURD
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian,
Institut Pertanian Bogor
Oleh
DITA ADI SEPTIANITA
F 24053053
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengaruh Konsentrasi Koagulan CaSO4.2H2O dan Suhu terhadap Proses Koagulasi
Protein dan Tekstur Curd
Nama : Dita Adi Septianita
NIM : F24053053
Menyetujui,
Dosen Pembimbing,
(Dr. Ir. Dahrul Syah M.Sc.Agr) NIP. 19650814 19902.1.001
Mengetahui : Plt. Ketua Departemen,
(Dr. Ir. Nurheni Sri Palupi, M.Si) NIP. 19610802 198703.2.002
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Pengaruh Konsentrasi Koagulan CaSO4.2H2O dan Suhu terhadap Proses Koagulasi Protein dan Tekstur Curd adalah hasil
karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2011
Yang membuat pernyataan
© Hak cipta milik Dita Adi Septianita, tahun 2011
Hak cipta dilindungi
D So Pe ta Pe Pe m as Ev be K Himpunan Mahasiswa Il tahun 2006-2007, di redak serta dalam berbagai kep prestasi selama duduk di b Tepat Engineering Compe
tim dalam dua judul karya
Isolat Protein Belalang S
2006 dan Minuman Serbu dengan Pengujian In V
Kewirausahaan Nugget T
nonakademis, penulis me Lomba Poster Muslim S Physics in Comic ITB ti penelitian skripsi dalam ra 2010 di laboratorium Biot
BIODATA PENULIS
Dita Adi Septianita. Lahir di Bogor, 30 September 1 Soewandi Dinata dan ibu Ismulyati, sebagai putri per Penulis menamatkan SMA pada tahun 2005 dari SMA tahun yang sama diterima di IPB melalui jalur Unda Penulis diterima di Departemen Ilmu dan Teknologi P Pertanian setelah melalui seleksi Tingkat Persiapan mengikuti perkuliahan, penulis aktif dalam berbagai k asisten praktikum mata kuliah Analisis Pangan pa Evaluasi Nilai Bahan Pangan pada tahun 2010-2 berorganisasi di dalam dan luar kampus. Di kam Konservasi Fauna (UKF) sebagai anggota divisi Reptil
Ilmu dan Teknologi Pangan (HIMITEPA) sebagai an aksi majalah pangan Emulsi sebagai kartunis pada tahu epanitiaan kegiatan mahasiswa tingkat IPB. Selain i i bangku kuliah. Di bidang akademis, penulis menjadi j
petition tingkat TPB IPB tahun 2006 dan lolos seleksi rya ilmiah Program Kreativitas Mahasiswa Penelitian (P
g Sawah (Locusta migratoria) dalam Formulasi Pemb buk Berzim untuk Peningkatan Penyerapan Nutrisi pada Vivo pada Mencit pada tahun 2008, serta satu j
Tayashi, Trend Baru Makanan Khas Bogor pada ta eraih juara III pada Lomba Lukis Art IPB Days tingk
Scientist Competition IPB tingkat Nasional tahun 2 tingkat Nasional tahun 2011. Di akhir masa perku rangka proyek penelitian SEAFAST terkait profil prote ioteknologi SEFAST Center, Kampus IPB, Bogor.
r 1988 dari ayah Dedi Andi ertama dari dua bersaudara. A Negeri 1 Bogor dan pada dangan Seleksi Masuk IPB. Pangan, Fakultas Teknologi an Bersama IPB. Selama i kegiatan termasuk menjadi pada tahun 2009-2010 dan 2011. Penulis pun aktif mpus, penulis aktif di Uni til pada tahun 2005-2008, di anggota divisi Profesi pada hun 2007-2008, dan berperan itu, penulis juga mengukir i juara III pada Lomba Cepat pendanaan DIKTI bersama (PKM-P), yaitu Pemanfaatan mbuatan Nugget pada tahun
da Masa Pertumbuhan Anak
KATA
PENGANTAR
Alhamdulillahi robbil ‘alamin. Segala puji dan syukur dipanjatkan ke hadapan Allah WST atas karunia-Nya sehingga skripsi ini berhasil diselesaikan. Penelitian dengan judul Pengaruh Konsentrasi Koagulan CaSO4.2H2O dan Suhu terhadap Proses Koagulasi Protein dan Tekstur Curd dilaksanakan
sejak bulan April sampai November 2010.
Dengan telah selesainya penelitian hingga tersusunnya skripsi ini, penulis ingin menyampaikan penghargaan dan terima kasih yang sebesar-besarnya kepada:
1. Dr. Ir. Dahrul Syah, M.Sc.Agr sebagai dosen pembimbing utama.
2. Victor dan Yogi yang telah bekerja sama dan berbagi ilmu dan pemikiran serta saling menyemangati selama penelitian dan pembuatan laporan skripsi.
3. Dilla dan Rizal yang telah berbagi ilmu dan pengalaman terkait penelitian profil protein curd
kedelai.
4. Ayah, ibu, dan adik serta keluarga besar atas do’a dan dukungannya.
5. Sahabat-sahabat tercinta, MK Squad dan Kesebelasan Platina yang tidak pernah lelah menyemangati penulis.
6. Sahabat-sahabat alumni di FORKOM ALIMS, adik-adik mentee, dan guru-guru SMA Negeri 1 Bogor yang selalu memberikan dukungan moril, semangat, dan do’a selama penelitian dan penulisan.
7. Adik-adik ITP 44, yaitu Nadiah, Cynthia, Nadea, Lukman, Rojak, Ajeng, Tami, Rossy, Melia, Belinda, TC, dan Agy, sebagai panelis uji organoleptik curd yang telah membantu terlaksananya penelitian tahap III, serta adik-adik lainnya yang telah bersedia mengikuti seleksi panelis.
8. Teknisi dan pegawai di laboratorium ITP dan SEAFAST yang telah membantu kelancaran penelitian.
9. Teman-teman ITP 42 dan 43 yang telah belajar dan memberikan potret kenangan indah selama melakukan studi di kelas ITP.
10.Adik-adik praktikan Analisis Anpang dan ENBP, yang selalu memberi semangat.
11.Pihak Tanoto Foundation, keluarga IPB, dan Rumah Zakat yang telah memberikan bantuan riil dan moril kepada penulis selama melaksanakan studi.
12.Teman-teman minor ARL 42, 43, 44, dan teman-teman IPB.
13.Serta semua pihak yang tidak disebutkan satu persatu, yang telah membantu pelaksanaan penelitian dan penulisan.
Akhirnya penulis berharap semoga tulisan ini bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan di bidang ilmu dan teknologi pangan.
Bogor, Juli 2011
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... ix
I. PENDAHULUAN... 1
1.1. LATAR BELAKANG ... 1
1.2. PERUMUSAN MASALAH ... 1
1.3. TUJUAN PENELITIAN ... 2
1.4. MANFAAT PENELITIAN ... 2
II. TINJAUAN PUSTAKA ... 3
2.1. PROTEIN DALAM SISTEM PANGAN ... 3
2.1.1. Sifat Fisikokimia Protein ... 4
2.1.2. Sifat Fungsional Protein ... 5
2.2. PROTEIN KEDELAI ... 6
2.3. KOAGULASI PROTEIN ... 7
2.3.1. Ekstraksi Kedelai ... 7
2.3.2. Proses Koagulasi ... 8
2.3.3. Jenis Koagulan ... 8
2.4. CURD TAHU ... 10
2.4.1. Gelasi Protein ... 11
2.4.2. Tahu Sebagai Curd Kedelai ... 13
2.5. TEKNIK ELEKTROFORESIS DALAM ANALISIS PROTEIN ... 14
2.6. TEKSTUR CURD ... 16
III. METODE PENELITIAN ... 17
3.1. BAHAN DAN ALAT ... 17
3.1.1. Bahan ... 17
3.2. METODE PENELITIAN ... 17
3.2.1. Tahap I ... 18
3.2.2. Tahap II ... 23
3.2.3. Tahap III ... 29
IV. HASIL DAN PEMBAHASAN ... 31
4.1 EKSTRAKSI DAN KOAGULASI PROTEIN KEDELAI... 31
4.1.1 Analisis terhadap Whey ... 33
4.1.2 Pengaruh Parameter Proses ... 37
4.2 PROFIL PROTEIN CURD ... 38
4.2.1 Ekstraksi ... 38
4.2.2 Profil Protein dengan Teknik Elektroforesis ... 39
4.2.3 Pengaruh Parameter Proses ... 41
4.3 ANALISIS CURD... 44
4.3.1 Tekstur dan Kadar Air ... 44
4.3.2 Pengaruh Parameter Proses ... 50
4.4 UJI ORGANOLEPTIK ... 54
V. SIMPULAN DAN SARAN ... 57
5.1. SIMPULAN ... 57
5.2. SARAN ... 59
DAFTAR PUSTAKA ... 60
DAFTAR TABEL
Halaman
Tabel 1. Sifat fungsional yang dapat dihasilkan protein... 5
Tabel 2. Sifat fungsional protein serta mekanisme pembentukannya dalam sistem pangan ... 6
Tabel 3. Beberapa golongan bahan penggumpal tahu yang umum digunakan ... 8
Tabel 4. Sifat-sifat curd hasil koagulasi dengan beberapa koagulan ... 10
Tabel 5. Persentase akrilamid yang digunakan untuk pemisahan molekul protein dengan kisaran berat molekul tertentu ... 15
Tabel 6. Pengaturan TA-XT2i untuk pengukuran TPA curd ... 21
Tabel 7. Parameter rheologi dan cara penentuannya dalam analisis profil... 23
Tabel 8. Komposisi separating gel untuk dua plat ... 27
Tabel 9. Komposisi stacking gel untuk dua plat ... 27
Tabel 10. Nilai pH whey yang terpisah dari curd ... 36
Tabel 11. Perbandingan ekstraksi protein dengan 2-ME dan HCl ... 39
Tabel 12. Data analisis tekstur per parameter... 45
Tabel 13. Hasil analisis korelasi Pearson antara kadar subunit protein, kadar air, dan total padatan curd ... 48
Tabel 14. Hasil analisis korelasi Pearson antara atribut tekstur, kadar subunit protein, kadar air, dan total padatan curd ... 49
DAFTAR GAMBAR
Halaman
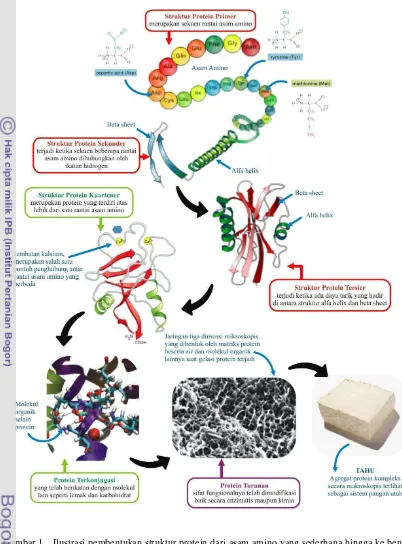
Gambar 1. Ilustrasi pembentukan struktur protein dari asam amino yang sederhana hingga ke
bentuk komples sebagai sistem pangan pada produk tahu (iopscience.org,
Kusnandar 2010, kvhs.nbed.nb.ca 2008, www.genome.gov 2006, Yasir 2007) ... 4
Gambar 2. Mekanisme gelasi protein dengan koagulan kalsium sulfat dan GDL (Kohyama et al. 1995) ... 9 Gambar 3. Mekanisme gelasi tahu yang dikoagulasi oleh CaSO4 (Kohyama et al. 1995) ... 12
Gambar 4. Hasil elektroforesis SDS-PAGE ekstrak protein dari berbagai galur varietas
kedelai (Poysa et al. 2006) ... 16 Gambar 5. Kerangka pemikiran penelitian ... 18
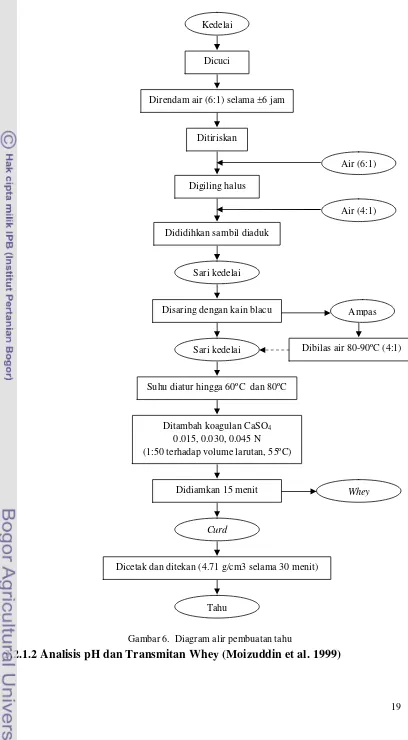
Gambar 6. Diagram alir pembuatan tahu ... 19
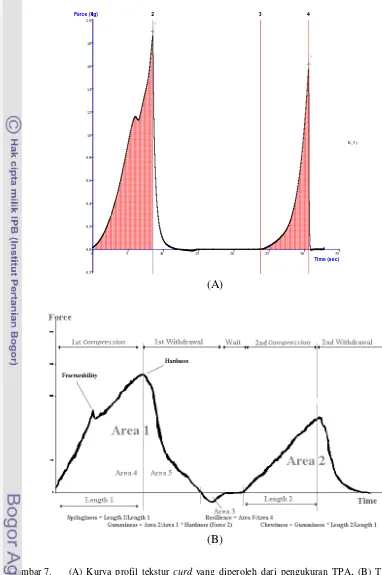
Gambar 7. (A) Tipe kurva TPA untuk produk pangan dengan parameter tekstur dan
perhitungannya (www.texturetechnologies.com
),
(B) Kurva profil tekstur curdyang diperoleh dari pengukuran TPA ... 22
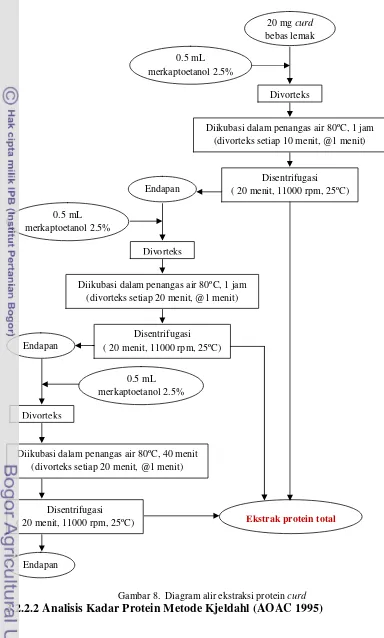
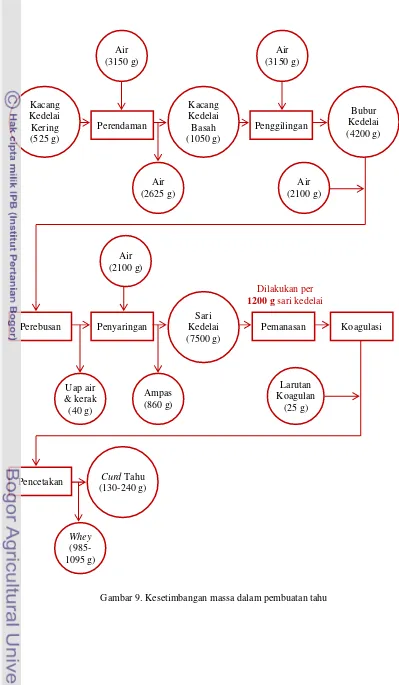
Gambar 8. Diagram alir ekstraksi protein curd ... 24 Gambar 9. Kesetimbangan massa dalam pembuatan tahu... 32
Gambar 10.Pengaruh konsentrasi koagulan dan suhu koagulasi terhadap nilai transmitan whey 33 Gambar 11.Pengaruh konsentrasi koagulan dan suhu koagulasi terhadap jumlah protein whey .. 34 Gambar 12.Grafik hubungan antara transmitan whey dan jumlah protein whey ... 35 Gambar 13.Profil protein curd hasil SDS-PAGE (diidentifikasi berdasarkan hasil penelitian
Poysa et al. 2006 dan Yasir et al. 2006) ... 40 Gambar 14.Pembacaan tebal pita dengan Image J© ... 41 Gambar 15.Pengaruh konsentrasi koagulan terhadap komposisi subunit protein β-conglisinin
(7S) dalam curd yang dikoagulasi pada suhu 60°C (A) dan 80°C (B) ... 42 Gambar 16.Pengaruh konsentrasi koagulan terhadap komposisi subunit asam pada protein
glisinin dalam curd yang dikoagulasi pada suhu 60°C (A) dan 80°C (B) ... 43 Gambar 17.Pengaruh konsentrasi koagulan terhadap komposisi subunit protein glisinin (11S)
dalam curd yang dikoagulasi pada suhu 60°C (A) dan 80°C (B) ... 43 Gambar 18.Pengaruh konsentrasi koagulan terhadap komposisi subunit protein 7S san 11S
dalam curd yang dikoagulasi pada suhu 60°C (A) dan 80°C (B) ... 44 Gambar 19.Pengaruh konsentrasi koagulan dan suhu koagulasi terhadap total padatan curd ... 46 Gambar 20.Pengaruh konsentrasi koagulan dan suhu koagulasi terhadap kadar air curd ... 47 Gambar 21.Pengaruh konsentrasi koagulan terhadap kekerasan curd (A), daya kohesif curd
(B), dan kelengketan curd (C) ... 50 Gambar 22.Model tipe formasi struktur jaringan protein berdasarkan perubahan konsentrasi
Gambar 23.Diagram skematik jaringan teruntai (A) dan jaringan teragregasi (B), dengan skala
garis 40-50 µ m (Renkema 2001) ... 52
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Form seleksi panelis uji organoleptik ... 66
Lampiran 1a. Uji segitiga ... 67
Lampiran 1b. Uji rangking ... Lampiran 2. Analisis ragam/varian (ANAVA) rancangan percobaan faktorial 3 x 2 model tetap ... 68
Lampiran 2a. Model percobaan yang digunakan ... 68
Lampiran 2b. Tabel ANAVA yang digunakan ... 68
Lampiran 2c. Perhitungan yang dilakukan ... 69
Lampiran 2d. Tabel distribusi Fα (baris atas α = 0.05, baris bawah α = 0.01) ... 71
Lampiran 3. Data analisis transmittan whey ... 71
Lampiran 4. Hasil analisis ragam (ANAVA) transmittan whey ... 71
Lampiran 5. Data analisis kadar protein whey ... 72
Lampiran 6. Hasil analisis ragam (ANAVA) kadar protein whey ... 73
Lampiran 6a. Pengaruh perlakuan terhadap signifikasi data ... 73
Lampiran 6b. ANAVA regresi linier antara kadar protein dan transmittan whey ... 73
Lampiran 7. Data analisis pH whey ... 75
Lampiran 8. Hasil analisis ragam (ANAVA) pH whey ... 75
Lampiran 9. Data ekstraksi protein curd ... 77
Lampiran 9a. Dengan buffer tris pH 8.4 + merkaptoetanol ... 77
Lampiran 9b. Dengan HCl 0.2 M + merkaptoetanol ... 78
Lampiran 10. Data Rf subunit protein curd ... 79
Lampiran 10a. Standar marker ... 79
Lampiran 10b. Curd 0.015 N 60°C ... 80
Lampiran 10c. Curd 0.030 N 60°C ... 80
Lampiran 10d. Curd 0.045 N 60°C ... 82
Lampiran 10e. Curd 0.015 N 80°C ... 84
Lampiran 10f. Curd 0.030 N 80°C ... 85
Lampiran 10g. Curd 0.045 N 80°C ... 87
Lampiran 11. Komposisi subunit protein curd ... 89
Lampiran 12. ANAVA kadar subunit protein curd ... 90
Lampiran 12a. Subunit α’ + α ... 90
Lampiran 12b. Subunit β ... 91
Lampiran 12c. Subunit A4 ... 92
Lampiran 12d. Subunit A1 ... 93
Lampiran 12e. Subunit A2 ... 94
Lampiran 12g. Total subunit asam ... 96
Lampiran 12h. Subunit basa ... 97
Lampiran 12i. Total subunit 7S ... 98
Lampiran 12j. Total subunit 11S ... 99
Lampiran 12k. Proporsi subunit 11S/7S ... 100
Lampiran 13. Data analisis tekstur curd ... 101
Lampiran 13a. Hasil Texture Profile Analyzer (TPA) ... 101
Lampiran 13b. Pengukuran parameter tekstur curd ... 103
Lampiran 14. Hasil analisis ragam (ANAVA) tekstur curd ... 106
Lampiran 14a. Kekerasan curd ... 106
Lampiran 14b. Daya kohesif curd ... 107
Lampiran 14c. Kelengketan curd ... 108
Lampiran 15. Data analisis total padatan curd ... 110
Lampiran 16. Hasil analisis ragam (ANAVA) total padatan curd ... 111
Lampiran 16a. Persen basis basah ... 111
Lampiran 16b. Persen basis bahan baku kedelai ... 111
Lampiran 17. Data analisis kadar air curd ... 112
Lampiran 18. Hasil analisis ragam (ANAVA) kadar air curd ... 113
Lampiran 19. Analisis ragam/varian (ANAVA) untuk regresi linier ... 114
Lampiran 19a. Model percobaan yang digunakan ... 114
Lampiran 19b. Tabel ANAVA yang digunakan ... 114
Lampiran 19c. Perhitungan yang dilakukan ... 114
Lampiran 19d. Model linier untuk sampel ... 115
Lampiran 19e. Tabel ANAVA regresi linier ... 116
Lampiran 19f. Perhitungan ANAVA regresi linier yang dilakukan ... 116
Lampiran 20. ANAVA regresi linier antara atribut tekstur dan subunit protein curd ... 117
Lampiran 20a. Kekerasan dan subunit A1 ... 117
Lampiran 20b. Kekerasan dan subunit Basa ... 118
Lampiran 20c. Daya kohesif dan subunit A1 ... 119
Lampiran 20d. Daya kohesif dan subunit Basa ... 120
Lampiran 20e. Kelengketan dan subunit A1 ... 121
Lampiran 20f. Kelengketan dan subunit Basa ... 122
Lampiran 21. ANAVA regresi linier antara subunit protein dan kadar air serta total padatan curd ... 123
Lampiran 21a. Kadar air (%BB) dan subunit A1... 123
Lampiran 21b. Kadar air (%BB) dan subunit Basa ... 124
Lampiran 21c. Total padatan (%BB) dan subunit A1 ... 125
Lampiran 21d. Total padatan (%BB) dan subunit Basa ... 126
Lampiran 21f. Total padatan (%basis bahan baku kedelai) dan subunit Basa ... 128
Lampiran 22. ANAVA regresi linier antara atribut tekstur dan kadar air curd ... 129
Lampiran 22a. Kekerasan dan kadar air ... 129
Lampiran 22b. Daya kohesif dan kadar air ... 130
Lampiran 22c. Kelengketan dan kadar air ... 131
Lampiran 23. ANAVA regresi linier antara atribut tekstur dan total padatan curd (% basis basah) ... 132
Lampiran 23a. Kekerasan dan total padatan (%BB) ... 132
Lampiran 23b. Daya kohesiv dan total padatan (%BB) ... 133
Lampiran 23c. Kelengketan dan total padatan (%BB) ... 134
Lampiran 24. ANAVA regresi linier antara atribut tekstur dan total padatan curd (% basis bahan baku kedelai) ... 135
Lampiran 24a. Kekerasan dan total padatan (% basis bahan baku kedelai) ... 135
Lampiran 24b. Daya kohesif dan total padatan (% basis bahan baku kedelai) ... 136
Lampiran 24c. Kelengketan dan total padatan (% basis bahan baku kedelai) ... 137
BAB I
PENDAHULUAN
1.1
LATAR BELAKANG
Tekstur curd merupakan aspek mutu yang penting dalam produk berbasis curd. Contoh produk hasil koagulasi yang umum di Indonesia adalah tahu dan keju. Tekstur mempengaruhi preferensi konsumen ketika mereka membeli produk. Tahu yang diinginkan memiliki tekstur kompak, padat, seperti gel, tidak keras dan tidak terlampau lunak, serta mudah dalam penanganan untuk pengolahan selanjutnya.
Teknologi koagulasi protein dalam pembentukan curd telah banyak dikaji dalam penelitian-penelitian sebelumnya. Curd protein dapat diperoleh dari sumber nabati yakni sari kacang-kacangan, seperti kacang kedelai (Glycine max), yang biasa disebut tahu. Berbagai parameter terukur yang mempengaruhi mutu curd yang dihasilkan, diantaranya adalah jenis koagulan dan konsentrasi koagulan (Kao et al. 2003). Perbedaan komponen proses koagulasi tersebut disertai suhu koagulasi yang diatur menyebabkan perbedaan mutu curd, terutama dari segi tekstur curd yang dihasilkan.
Kacang kedelai mengandung protein 35% bahkan pada varitas unggul kadar proteinnya dapat mencapai 40%-43% (Margono 1993). Tahu sendiri merupakan agregat protein yang diendapkan dari suspensi kedelai oleh koagulan protein. Protein kedelai dapat dibentuk gel curd jika sari kedelai telah mengalami pemanasan (Liu 1997). Pemanasan ini mendenaturasi protein dan membuka struktur kuartener protein yang akan mempermudah proses koagulasi.
Koagulasi protein terjadi saat asam amino memiliki muatan netral yang mangakibatkan kelarutannya menurun. Suasana ini disebut titik isoelektrik. Titik ini dapat dicapai dengan mengubah pH dan menambahkan garam ke dalam sari kacang kedelai. Garam yang umumnya digunakan adalah garam kalsium sulfat (CaSO4.H2O), yang memilihi bilangan valensi 2. Muatan 2+ dari logam Ca
dalam garam dapat menetralisir muatan negatif asam amino (Kohyama et al. 1995). Hal ini dapat meningkatkan interaksi hidrofobik sesama molekul asam amino sehingga protein teragregasi dan bobot molekul proteinnya meningkat. Dan terbentuklah endapan protein yang disebut curd atau tahu.
Perbedaan parameter proses dapat menyebabkan perbedaan komposisi agregat protein yang terbentuk dan berdampak pada tekstur curd yang dihasilkan. Agregat protein membentuk matriks
curd yang mempengaruhi kekompakan tekstur (Oakenfull et al. 1997). Matriks ini pula yang mampu mengikat air, yang turut berkonstribusi terhadap penentuan tekstur. Protein merupakan makromolekul oraganik yang memiliki bobot molekul bervariasi. Perlakuan temperatur koagulasi dan konsentrasi koagulan mempengaruhi mutu tekstur curd. Maka disinyalir perbedaan perlakuan tersebut juga akan menyebabkan perbedaan bobot molekul protein yang terkoagulasi.
1.2
PERUMUSAN MASALAH
Adanya perbedaan perlakukan selama proses koagulasi protein menyebabkan perbedaan tekstur curd tahu yang dihasilkan. Parameter perlakuan meliputi konsentrasi koagulan dan suhu koagulasi. Garam CaSO4.H2O dipilih sebagai koagulan dalam pengujian ini. Curd dihasilkan melalui
objektif (dari curd yang diproduksi pada skala pabrik) dikorelasikan dengan komposisi protein curd (yang dibuat pada skala lab). Protein yang terkoagulasi membentuk molekul agregat dengan bobot molekul yang spesifik. Komposisi protein ini diperoleh melalui screening protein dengan metode elektroforesis.
1.3
TUJUAN PENELITIAN
Penelitian ini bertujuan mengetahui bobot molekul protein spesifik yang mempengaruhi tekstur
curd tahu yang dihasilkan pada konsentrasi koagulan CaSO4.H2O dan suhu koagulasi yang berbeda.
1.4
MANFAAT PENELITIAN
BAB II
TINJAUAN PUSTAKA
2.1
PROTEIN DALAM SISTEM PANGAN
Protein merupakan polimer yang disusun oleh asam amino, dengan jumlah yang lebih banyak dari peptida (2-50 asam amino), bahkan mencapai ratusan. Struktur protein dapat disusun oleh sekitar 100-2.000 unit asam amino. Berat molekul protein dapat mencapai sekitar 5.500 hingga 220.000 Dalton1 (Kusnandar 2010). Protein tersusun atas rangkaian 20 jenis asam amino yang berikatan kovalen dalam urutan yang khas. Semua asam amino yang ditemukan dalam protein memiliki susunan dasar yang sama, yaitu gugus karboksil dan gugus amina yang diikat pada atom karbon kiral (kecuali glisin). Perbedaan antar asam amino terletak pada rantai sampingnya (gugus R) yang bervariasi dalam hal struktur, ukuran, muatan listrik, serta kelarutannya dalam air. Lehninger (1995) mengutarakan bahwa ada empat golongan asam amino, yaitu golongan dengan gugus R non-polar (hidrofobik), golongan dengan gugus R polar tapi tidak bermuatan, golongan dengan gugus R bermuatan positif, dan golongan dengan gugus R bermuatan negatif.
Protein dapat digolongkan berdasarkan karakternya, antara lain berdasarkan susunan molekulnya, kelarutannya, adanya senyawa lain dalam molekul, tingkat degradasi, dan fungsinya. Menurut Kusnandar (2010), perbedaan rantai samping asam amino dalam protein membuat protein dapat dibagi ke dalam beberapa bentuk makromolekul, yaitu struktur primer, sekunder, tersier dan, kuartener. Struktur primer merupakan susunan linier asam amino dalam protein. Struktur sekunder adalah struktur polipeptida yang terlipat-lipat yang merupakan bentuk tiga dimensi dengan cabang-cabang rantai polipeptidanya tersusun saling berdekatan. Struktur sekunder ini memberikan bentuk α -heliks dan β-sheet. Struktur tersier merupakan susunan dari struktur sekunder yang satu dengan yang lainnya. Sedangkan struktur kuartener adalah struktur protein yang melibatkan lebih dari satu rantai polipeptida yang terbentuk oleh adanya interaksi antar beberapa rantai molekul protein berbeda melalui ikatan-ikatan hidrogen, interaksi hidrofobik, interaksi elektrostatik, dan jembatan sulfida.
Kusnandar (2010) juga memaparkan bahwa protein dapat dikelompokan menjadi protein sederhana (simple protein), protein konjugasi (conjugated protein), dan protein turunan (derived protein). Protein sederhana adalah protein yang hanya mengandung residu asam amino. Protein sederhana dapat dikelompokkan menjadi protein globular dan protein fibrilar. Protein globular memiliki struktur molekul bulat (spherical), seperti albumin, globulin, histon, dan protemin. Protein fibrilar memiliki bentuk serat dan bersifat tidak larut dalam air. Protein ini banyak mengandung asam amino prolin, hidroksiprolin, sistein, dan sistin, yang biasanya menyusun struktur jaringan daging mamalia ataupun unggas. Selanjutnya, protein konjugasi, yaitu protein yang berikatan dengan molekul lainnya, seperti karbohidrat (glikoprotein), lemak (lipoprotein), logam (metaloprotein), dan fosfor (fosfoprotein). Sedangkan protein turunan adalah protein yang telah dimodifikasi sifat fungsionalnya, baik secara enzimatis maupun kimia. Protein hasil modifikasi ini dapat berubah sifat kelarutannya dalam air, sifat koagulasi, ataupun panjang rantainya. Skema pembentukan struktur protein bertahap dari primer ke kuartener hingga menjadi sebuah sistem pangan dalam curd tahu dapat dilihat pada Gambar 1.
1
Gambar 1. Ilustrasi pembentukan struktur protein dari asam amino yang sederhana hingga ke bentuk komples sebagai sistem pangan pada produk tahu (iopscience.iop.org, Kusnandar 2010, kvhs.nbed.nb.ca 2008, www.genome.gov 2006, Yasir 2007)
2.1.1
Sifat Fisikokimia Protein
protein dilarutkan dalam air. Apabila dalam suatu larutan protein ditambahkan garam, daya larut protein akan berkurang, akibatnya protein akan terpisah sebagai endapan. Peristiwa pemisahan protein ini disebut salting out.
Dalam larutan asam (pH rendah), gugus amino bereaksi dengan H+, sehingga protein bermuatan positif. Bila pada kondisi ini dilakukan elektrolisis, molekul protein akan bergerak ke arah katoda yang bermuatan negatif. Sebaliknya, dalam larutan basa (pH tinggi), molekul protein akan bermuatan negatif, sehingga molekul protein akan bergerak menuju anoda yang bermuatan positif. Pada pH tertentu yang disebut titik isoelektrik (pI), muatan gugus amino dan karboksil bebas akan saling menetralkan sehingga molekul bermuatan nol. Menurut Suciono (1995), pada titik isoelektriknya, muatan total masing-masing asam amino dalam protein sama dengan nol, artinya terjadi kesetimbangan antara gugus bermuatan positif dengan gugus bermuatan negatif. Interaksi elektrostatik antar asam amino akan maksimum karena muatan yang tidak sejenis cenderung untuk tarik menarik, fenomena ini dapat diamati melalui terjadinya penggumpalan protein.
2.1.2
Sifat Fungsional Protein
Sifat fungsional protein adalah sifat-sifat protein baik fisik maupun kimia yang mampu mempengaruhi tingkah laku protein dalam sistem pangan selama proses, penyimpanan, persiapan dan konsumsi. Protein memberikan kontribusi yang cukup signifikan terhadap sifat fungsional dan kualitas dari sebagian besar produk pangan seperti susu, daging, keju, telur, dan roti. Mutu organoleptik dari produk pangan tersebut tergantung dari sifat fisik, kimia serta interaksi komponen protein (Kinsella 1982). Sifat-sifat fungsional protein akan mempengaruhi mutu organoleptik produk pangan, seperti yang dapat dilihat pada Tabel 1.
Tabel 1. Sifat fungsional yang dapat dihasilkan protein
Sifat Umum Kriteria Fungsional
Organoleptik Warna, flavor
Kinestetik Tekstur, mouthfeel, kehalusan, kekeruhan
Hidrasi Kelarutan, pengembangan, absorpsi air, gelling, sineresis, viskositas, ketebalan Struktural Elastisitas, kohesifitas, chewiness, adhesi, agregasi, pembentukan ikatan
Rheologi Viskositas, gelasi
Enzimatik Koagulasi (rennet), keempukan (papain)
Sumber: Kinsella (1979)
Tabel 2. Sifat fungsional protein serta mekanisme pembentukannya dalam sistem pangan
Sifat Fungsional Mekanisme Sistem Pangan
Daya ikat Ikatan hidrogen dengan air, pemerangkapan
air oleh protein
Daging, sosis, bakery, cake
Viskositas Pengikatan air Sup
Kohesi-adhesi Protein bertindak sebagai material adhesif Daging, sosis, produk pasta
Elastisitas Ikatan hidrofobik, ikatan disulfida dalam gel Daging, bakery
Sumber: Kinsella (1982)
Sementara itu, Chaftel et al., (1985) mengklasifikasikan sifat fungsional protein ke dalam tiga golongan, yaitu: 1) sifat hidrasi, yaitu sifat yang ditentukan oleh interaksi protein-air, misalnya absorpsi air, kelarutan, dan viskositas; 2) sifat yang berhubungan dengan interaksi protein-protein, misalnya pengendapan, gelasi dan pembentukan serat-serat protein; 3) sifat permukaan yang terutama berhubungan dengan tegangan permukaan, misalnya pembentukan buih.
2.2
PROTEIN KEDELAI
Protein merupakan komponen kimia tertinggi yang terkandung dalam kacang kedelai. Kedelai mengandung jumlah protein yang bervariasi (38-49%) (Saidu 2005). Menurut Koswara (1992), zat gizi dominan yang terdapat dalam kedelai adalah protein dan karbohidrat. Per 100 gramnya, kedelai kering mengandung 34.9 gram protein, 34.8 gram karbohidrat, 18.1 gram lemak, dan 227.0 mg kalsium. Sebagian besar protein terdapat pada bagian hipokotil dan kotiledonnya. Hanya 8.8% protein yang terdapat pada kulitnya.
Menurut Liu (1997), protein kedelai mengandung asam amino esensial yang lengkap dengan metionin sebagai asam amino pembatas. Leusin, isoleusin, lisin, dan valin merupakan asam amino yang paling tinggi yang terkandung di dalam kedelai. Kandungan protein yang tinggi menyebabkan protein memiliki peran yang penting dalam memberikan sifat-sifat fungsional yang khas Belitz dan Grosch (1999) menjelaskan bahwa protein kedelai juga dapat digolongkan ke dalam 4 fraksi berdasarkan kelarutannya, yaitu albumin (larut dalam air), globulin (larut dalam larutan garam), prolamin (larut dalam alkohol 70%) dan glutelin (larut dalam basa encer) (Belitz dan Grosch, 1999). Mereka menambahkan bahwa fraksinasi protein kacang-kacangan berdasarkan kelarutannya, seperti yang dilakukan oleh Osborne, menghasilkan tiga fraksi protein paling dominan dalam kacangkacangan, yaitu albumin, globulin, dan glutelin. Pada kedelai, distribusi ketiga fraksi protein tersebut terdiri atas 10% albumin, 90% globulin, dan 0% glutelin.
Melalui ultrasentrifugasi, protein kedelai dapat digolongkan menjadi empat golongan utama, yaitu protein 2S, 7S, 11S, dan 15S. Protein 7S dan 11S merupakan dua protein utama yang menyusun globulin dengan jumlah masing-masing sekitar 18.5% dan 31% dari total protein kedelai. Liu et al.
memiliki berat molekul sekitar 35 kD, sedangkan polipetida basanya memiliki berat molekul sekitar 20 kD. Betaconglisinin merupakan protein trimer yang tersusun atas 3 subunit, yaitu α’, α dan β. Subunit α’ memiliki berat molekul sekitar 72 kD, sedangkan α dan β memiliki berat molekul masing-masing sekitar 68 dan 52 kD. Blazek (2008) menambahkan bahwa glisinin merupakan protein heksamer (AB 6) dengan berat molekul berkisar 300-380 kD. Subunit-subunit glisinin terdiri atas polipeptida asam (A) dan polipeptida basa (B) yang dihubungkan oleh ikatan disulfida. Kombinasi subunit-subunit tersebut memberikan berat molekul sekitar 180 kD tergantung dari subunit penyusunnya. Dan menurut Lewis & Chen (1978), β-conglisinin merupakan glikoprotein yang mengandung 3.8-5.4% karbohidrat. Jenis gula yang terdapat dalam protein ini adalah manosa dan glukosamin.
2.3
KOAGULASI PROTEIN
2.3.1
Ekstraksi Kedelai
Ekstraksi kedelai menghasilkan suspensi yang tidak hanya mengandung air dan protein, melainkan juga senyawa organik lain yang jumlahnya makro maupun mikro, seperti karbohidrat, lemak, dan asam fitat. Senyawa ini dapat berinteraksi dengan protein kedelai. Namun, interaksi tersebut tidak selamanya berdampak positif terhadap tekstur tahu yang dihasilkan, contohnya asam fitat. Karena, menurut Kakade (1974) asam fitat dapat bereaksi dengan protein menjadi kompleks fitat-protein sehingga terjadi perubahan konfigurasi protein. Perubahan konfigurasi protein berpengaruh terhadap proses pengikatan ion Ca2+ pada gugus fungsi tertentu. Koswara (1992) menjelaskan bahwa kedelai mentah mengandung 1.4% asam fitat yang tersebar merata di seluruh bagian biji. Asam fitat merupakan senyawa pengkelat mineral Zn, Ca, Mg, dan Fe. Jumlahnya tidak dapat diturunkan dengan pemanasan, tetapi dapat dihirolisis oleh enzim fitase. Fitase dapat diaktivasi dengan perendaman dalam air hangat. Hidrolisis mengubah asam fitat menjadi inositol dan asam fosfat. Bentuk ini tidak akan merusak sifat fungsional protein kedelai.
Perendaman dengan air hangat pada pembuatan curd kedelai dapat digantikan dengan melakukan pemanasan pendahuluan. Tahap tersebut dilakukan pada saat pendidihan bubur kedelai, pembilasan ampas kedelai, dan pemanasan kembali untuk pengkondisian suhu koagulasi. Pemanasan ini, yang dilakukan sebelum penambahan garam kalsium, akan memicu pembentukan ikatan silang antara ion kalsium dan molekul protein. Pemanasan akan memodifikasi struktur globular protein susu kedelai menjadi bentuk agregat yang kompak dalam sebuah struktur jaringan tiga dimensi. Pemanasan awal sebelum koagulasi mengubah struktur molekul protein dari fase koloid yang stabil menjadi struktur jaringan tiga dimensi melalui dua tahapan, yaitu denaturasi, agregrasi, dan, dilanjutkan ke tahap ketiga dengan adanya penambahan ion positif (koagulan) yang disebut gelasi (Aguilera 1995, Clark and Ross-Murphy 1987, & Schmidt 1981).
2.3.2
Proses Koagulasi
proses ini akan menentukan mutu tekstur produk akhir. Proses penggumpalan merupakan tahapan proses paling menentukan sifat-sifat fisik dan organoleptik dalam pembuatan tahu. Penambahan koagulan dengan jenis dan konsentrasi tertentu berpengaruh terhadap tekstur curd yang akan diperoleh. Johnson dan Wilson (1984) menyatakan bahwa jumlah koagulan yang dibutuhkan tergantung pada kadar padatan yang terdapat dalam sari kedelai.
Koagulasi protein sari kedelai berlangsung pada pH 4.1-4.6. Melalui koagulasi tersebut, akan diperoleh padatan curd dan suspensi cair whey. Curd mengandung protein yang sebagian besar terdiri dari globulin. Whey ekstrak kedelai yang merupakan hasil samping dari koagulasi, mengandung albumin, protease, pepton, nitrogen non protein, gula, antitripsin, urease, lipoksidase, serta enzim-enzim lain dan bahan lain yang larut dalam air (Smith, 1958). Menurut Shurtleff & Aoyogi (1986), penambahan bahan penggumpal sebaiknya dilakukan setelah sari kedelai mencapai suhu 70-90oC, hal ini tergantung dari jenis bahan penggumpal yang digunakan.
2.3.3
Jenis Koagulan
Poysa & Woodrow (2004) menyatakan bahwa koagulan yang berbeda akan memberikan tekstur serta flavor yang berbeda pula. Lebih rinci lagi Beddows & Wong (1987) menyatakan bahwa kalsium sulfat, yang merupakan koagulan yang umum dipakai dalam produksi tahu, akan membantu memudahkan protein dalam sari kedelai uantuk beragregasi. Kalsium sulfat juga akan berinteraksi dengan protein untuk menciptakan ikatan silang antar polimer protein. Kombinasi panas dengan mekanisme kerja kalsium tersebut akan menghasilkan struktur tahu. Menurut Shurtleff dan Aoyagi (1984), bahan penggumpal tahu dapat digolongkan menjadi beberapa golongan, yaitu : 1) golongan garam klorida atau nigari, 2) golongan garam sulfat, 3) golongan lakton, dan 4) golongan asam. Contoh senyawa dari keempat golongan tersebut dapat dilihat pada Tabel 3.
Tabel 3. Beberapa golongan bahan penggumpal tahu yang umum digunakan
Golongan Jenis yang umum digunakan
Garam klorida (nigari) nigari alami, MgCl2.6H2O, air laut, CaCl2, CaCl2.2H2O
Garam sulfat CaSO4 dan MgSO4.7H2O
Lakton C6H10O6 (glukono-δ-lakton)/GDL
Asam Asam laktat, sari buah jeruk, asam asetat, cuka (larutan asam asetat 4%)
Sumber: Shurtleff dan Aoyogi (1984)
2.3.3.1
Garam Klorida (
Nigari
)
diekstrak dari air laut dengan menghilangkan sebagian besar (NaCl) dan air. Koagulan jenis ini mengandung komponen mineral air laut alami terutama magnesium klorida. Penggunaan koagulan jenis nigari membutuhkan waktu pembuatan tahu yang cukup lama karena koagulan jenis ini harus ditambahkan sedikit demi sedikit dan perlahan-lahan, akibatnya dibutuhkan teknik yang baik dalam pembuatan tahu. Selain itu, penggunaan koagulan nigari akan menghasilkan tahu dengan tekstur yang cenderung kurang lembut.
2.3.3.2
Garam Sulfat
Garam sulfat merupakan golongan koagulan yang paling umum digunakan dalam pembuatan tahu. Jenis yang paling umum adalah kalsium sulfat (garam gypsum) dan magnesium sulfat (garam Epsom). Garam hidrat CaSO4.2H2O memiliki kelarutan yang sangat rendah di dalam air. Sehingga,
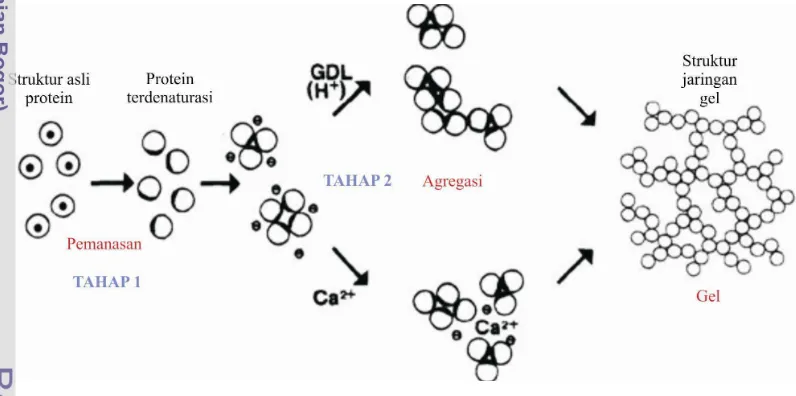
koagulan ini akan terdispersi perlahan di dalam sari kedelai sehingga memberikan waktu koagulasi yang lambat (Shurtleff dan Aoyogi, 1984). Mekanisme pembentukan gel protein dengan bantuan garam kalsium dapat dilihat pada Gambar 2. Menurut Obatolu (2007), semakin lambat waktu koagulasi dari koagulan, semakin baik rendemen tahu yang akan diperoleh. Cai et al., (1997) mengkorelasikan antara kandungan air yang tinggi dengan rendemen tahu yang diperoleh. Menurutnya, tahu dengan kandungan air yang tinggi akan memberikan penampakan yang lembut, sebaliknya, tahu dengan kandungan air rendah akan memberikan penampakan tekstur kasar.
Gambar 2. Mekanisme gelasi protein dengan koagulan kalsium sulfat dan GDL (Kohyama et al. 1995)
2.3.3.3
Lakton
menghasilkan asam glukonat yang mengkoagulasikan protein sari kedelai menjadi curd tahu sutra (Shurtleff dan Aoyogi, 1984).
2.3.3.4
Asam
Koagulan asam yang digunakan untuk mengendapkan protein kedelai antara lain asam laktat, asam asetat dan sari buah jeruk. Asam laktat diperoleh melalui aktivitas bakteri asam laktat. Keberadaan asam laktat akan menurunkan pH sari kedelai menjadi 4.5 yang merupakan titik isoelektrik bagi protein globulin sari kedelai sehingga terjadi koagulasi protein kedelai. Di Indonesia, koagulan asam diperoleh melalui fermentasi whey hasil pengolahan tahu sebelumnya. Fermentasi dilakukan selama semalam. Whey hasil fermentasi kemudian diinokulasikan kembali pada whey hasil pengolahan tahu hari berikutnya untuk memperoleh koagulan yang baru. Penggunaan koagulan yang berbeda akan memberikan tingkat kekerasan yang berbeda pada curd yang dihasilkan. Hang & Jackson (1967) meneliti sifat-sifat curd asetat, kalsium sulfat, dan asam laktat. Hasil analisa sifat-sifat
curd kedelai disajikan pada Tabel 4.
Tabel 4. Sifat-sifat curd hasil koagulasi dengan beberapa koagulan
Bahan Penggumpal Kadar Air (%) Kadar Proteina (%) Kekerasan b (mm)
Asam asetat 4% pH 4.5 77.6 56.3 126
Kalsium sulfat 84.8 51.3 142
Asam laktat 76.9 52.4 82
a
pengukuran berdasar basis kering b
pengukuran dengan penetrometer dengan beban 50 g selama 10 detik Sumber: Hang & Jackson (1967)
2.4
CURD
TAHU
Tahu merupakan gel protein yang dibuat dengan menambahkan koagulan ke dalam susu2 kedelai yang dipanaskan (Poysa & Woodrow 2002). Gel hasil penggumpalan protein inilah yang selanjutnya disebut curd. Proses pembentukan struktur curd diperlukan dalam proses pembuatan beberapa produk pangan diantaranya dalam proses pembuatan keju dan tahu. Kemampuan pembentukan gel dari protein susu serta proses pembentukan curd adalah proses penting dalam menghasilkan produk berbasis susu protein (Zayas, 1997).
2
2.4.1
Gelasi Protein
Kinsella (1976), mendefinisikan gelasi sebagai sifat struktural, hidrasi, tekstural, dan reologi dari protein. Sedangkan Schmidt (1981) mendefinisikan gel sebagai fenomena agregasi protein di mana interaksi polimer-polimer dan polimer-solven setimbang sehingga jaringan atau matriks tersier terbentuk. Dan gel menurut Foegeding (1989) adalah suatu unit struktur yang konsisten dan saling berhubungan dengan fase cair berada di seluruh matriks tiga dimensinya. Gel terbentuk ketika sebagian protein unfolded membentuk segmen uncoilded yang berinteraksi pada titik tertentu sehingga membentuk jaringan tiga dimensi. Zayas (1997) menambahkan bahwa formasi gel tiga dimensi tersebut merupakan hasil dari ikatan hidrogen, interaksi ion dan hidrofobik, ikatan Van der Waals, dan ikatan kovalen disulfida. Gel bervariasi dalam hal sifat reologinya, yang meliputi kekerasan, kelengketan, kohesivitas, dan adhesivitas. Oleh karena itu, protein sering digunakan untuk menghasilkan sifat reologi (tekstur) tertentu melalui fenomena gelasi protein. Sifat unik dari gel protein adalah bentuknya yang padat tetapi memiliki karakteristik seperti cairan.
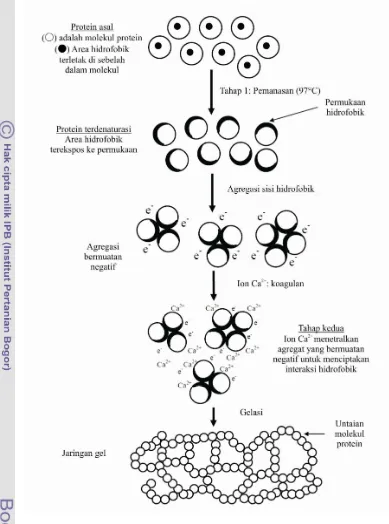
Mekanisme gelasi dalam pembuatan tahu melibatkan dua tahap utama, yaitu denaturasi protein akibat panas dan agregasi hidrofobik akibat koagulasi. Pada tahap pertama, sisi hidrofobik dari protein kedelai yang terletak di sebelah dalam molekul akan terekspos ke luar. Maka, protein yang terdenaturasi bermuatan negatif akan dinetralkan oleh ion positif dari koagulan, seperti ion Ca2+ (Kohyama and Nishinari 1993). Selanjutnya, pada tahap kedua, protein yang telah dinetralisasi tersebut akan teragregasi oleh adanya interaksi hidrofobik. Interaksi hidrofobik ini terjadi secara acak (deMan et al. 1986), dan berperan dalam pembentukan struktur gel (Kohyama et al. 1995). Ilustrasi mekanisme pembentukan gel oleh koagulan CaSO4 tahap demi tahap dapat dilihat pada Gambar 3.
Seperti yang dapat dilihat pada Gambar 3, berbeda dengan tahu yang dikoagulasi oleh GDL, GDL mengkoagulasi protein dengan cara mengubah nilai pH suspensi dan meningkatkan konsentrasi ion H+. Sehingga ion H+ inilah yang menetralkan muatan negatif protein. Sedangkan, pada koagulasi
yang dilakukan garam kalsium, kalsium berikatan dengan gugus karboksil bebas dari protein kedelai (Saio et al.1969). Sebagian besar sisi protein yang diikat oleh kalsium adalah gugus imidiazole dari histidin (Appu Rao & Narasinga Rao 1975). Dengan kata lain, ion kalsium akan berikatan silang dengan molekul protein. Fenomena inilah yang dikatakan dengan terkoagulasinya susu kedelai membentuk curd (Lee & Ra 1978). Dengan adanya ikatan silang tersebut, koagulasi akan berlangsung lebih cepat daripada koagulasi oleh GDL. Namun, koagulan CaSO4 masih tergolong
koagulan lambat seperti GDL (Blazek 2008). Adapaun garam kalsium yang dapat mengkoagulasi protein kedelai dengan cepat adalah CaCl2 dan MgCl2. Hal tersebut dikarenakan kelarutan CaSO4
(0.24 g/100mL pada 20°C dalam bentuk dihidrat CaSO4.2H2O) dalam air yang lebih rendah daripada
garam kalsium lainnya (CaCl2 74.5 g/100mL pada 20 °C) (American Chemical Society 2006).
Gambar 3. Mekanisme gelasi tahu yang dikoagulasi oleh CaSO4 (Kohyama et al. 1995)
2.4.2
Tahu sebagai
Curd
Kedelai
Tahu adalah protein kedelai yang digumpalkan dengan penambahan suatu bahan penggumpal. Komponen utama tahu terdiri dari protein yang terekstrak, disamping air, lemak, mineral dan vitamin (Shurtleff & Aoyogi 1984). Menurut Obatolu (2007), tahu merupakan makanan serbaguna dengan kandungan nutrisi yang tinggi yang terbuat dari curd kedelai. Kandungan gizi yang tinggi membuat tahu dijadikan sebagai makanan pengganti daging. Dan menurut Zayas (1997), tahu merupakan makanan pertama yang memanfaatkan pembentukan gel dari protein kedelai. Gel protein kedelai memiliki kemampuan bekerja sebagai matriks yang mampu menahan air, lemak, polisakarida, flavor, dan komponen lainnya. Karakteristik utama gel protein kedelai adalah kemampuannya dalam menahan air yang disebut sebagai water holding capacity (WHC).
Tahu merupakan produk pangan yang berasal dari Asia Timur. Masyarakat Cina biasa menggunakan sioko untuk membuat tahu. Sioko adalah ramuan CaSO4 dan garam. Di Jepang, tahu
atau tofu dibagi menjadi dua jenis, yaitu regular tofu dan kinugishi tofu. Regular tofu disebut juga tahu press sedangkan kinugishi tofu disebut juga tahu sutra (Koswara 1992). Sedangkan Tsai et al.
membagi tahu ke dalam 3 kelompok, yaitu soft tofu, hard tofu, dan dry tofu. Soft tofu (tahu sutra) dapat disajikan sebagai tahu yang dapat “disendok”. Hard tofu adalah tahu yang mengalami penekanan untuk menghilangkan sebagian air. Dan dry tofu yang disebut juga tou-kan atau chen
-chang atau tou-chi dibuat dengan mendidihkan pasta kedelai bersama bumbu, sehingga tekstur tahunya lebih kenyal dan bertekstur seperti daging.
Tahu atau curd kedelai, diperoleh melalui pengendapan sari kedelai panas dengan menggunakan koagulan. Secara tradisional, tahu diproduksi dengan menggumpalkan sari kedelai panas menggunakan garam (CaCl2 atau CaSO4) maupun asam (glukono-δ-lakton) sebagai koagulan
(Oboh 2006). Proses koagulasi ini akan menghasilkan gel protein kedelai yang mampu memerangkap air, lemak kedelai, dan komponen lainnya di dalam matriks curd. Setelah itu, curd kemudian dipress
untuk membentuk padatan tahu (Cai & Chang 1998).
Menurut Shurtleff & Aoyagi (1984) tahapan pembuatan tahu terdiri atas dua tahap utama, yaitu pembuatan susu kedelai dan tahap koagulasi (penggumpalan) sari kedelai, sehingga terbentuk curd yang selanjutnya dipress membentuk tahu. Subardjo (1987) menjelaskan bahwa kedelai yang akan dibuat susu, terlebih dahulu direndam dalam air bersih dengan tujuan untuk melunakkan struktur sel kedelai sehingga mempermudah dan mempercepat penggilingan serta menghasilkan ekstrak optimum. Lamanya perendaman perlu diperhatikan, karena perendaman yang terlalu singkat akan membuat biji kedelai sulit pecah ketika penggilingan, sedangkan bila terlalu lama akan terjadi pembentukan busa pada permukaan air rendaman akibat fermentasi kedelai.
Lalu Cai et al. (1997) menuturkan bahwa rendemen dan kualitas pada pembuatan tahu dipengaruhi oleh varietas kedelai, kualitas kedelai, kondisi selama proses serta koagulan yang dipakai. Dan berdasarkan Cai & Chang (1998), selama koagulasi sari kedelai, efisiensi dan efektifitas proses dipengaruhi oleh interaksi yang kompleks antara tipe kedelai, suhu pemasakan sari kedelai, volume, kandungan padatan, pH, tipe koagulan, serta waktu koagulasi. Dijelaskan pula oleh Beddows & Wong (1987), bahwa produk akhir tahu dipengaruhi oleh pH, konsentrasi koagulan, dan kecepatan pengadukan selama proses.
air yang tinggi, secara visual akan memberikan penampakan yang lembut sedangkan tahu dengan kandungan air yang rendah cenderung memiliki penampakan yang kasar. Kualitas pembentukan tahu dipengaruhi oleh banyak faktor, yaitu mutu kedelai, kondisi pengadukan, koagulan serta penekanan yang diberikan pada curd. Blazek (2008) menambahkan bahwa perbedaan penggunaan jenis dan konsentrasi koagulan, pengadukan yang dilakukan selama koagulasi, dan tekanan terhadap curd akan memberikan variasi tahu mulai dari keras hingga lunak dengan kandungan air berkisar antara 70 hingga 90% dan kandungan protein 5 hingga 16% berdasarkan berat basah.
2.5
TEKNIK ELEKTROFORESIS DALAM ANALISIS PROTEIN
Elektroforesis adalah suatu metode pemisahan fraksi-fraksi suatu zat dengan adanya migrasi partikel bermuatan atau ion-ion makromolekul di bawah pengaruh medan listrik. Migrasi partikel bermuatan tersebut dapat terjadi karena perbedaan muatan total, ukuran, dan bentuk (Pomeranz & Meloan 1994). Menurut Rybicky & Purves (1996), tingkat migrasi partikel dipengaruhi oleh muatan total, ukuran partikel, kekuatan ionik, viskositas, dan suhu medium. Teknik elektroforesis telah banyak digunakan dalam analisis protein untuk menentukan tingkat kemurnian sampel, berat molekul, maupun titik isoelektrik (Copeland 1994). Selain itu, teknik ini juga sering digunakan untuk menentukan komposisi protein dari suatu produk pangan. Contohnya adalah dalam penentuan komposisi konsentrat protein kedelai dan konsentrat protein whey (Nielsen 2003).
Molekul protein memiliki gugus fungsi yang dapat berionisasi dalam larutan sebagai kation (muatan positif) ataupun anion (muatan negatif). Jenis muatan dipengaruhi oleh derajat keasaman (pH) larutan. Jika partikel bermuatan ini ditempatkan dalam medan listrik, akan terjadi migrasi pertikel baik ke katoda maupun anoda, tergantung muatan alaminya. Migrasi ini pun dapat dihambat oleh gaya gesek partikel itu sendiri terhadap gel. Gaya gesek tersebut dipengaruhi oleh ukuran molekul, bentuk molekul, ukuran pori medium, dan viskositas buffer (Wilson & Walker 2000). Di samping itu, besarnya muatan protein dan gradien potensial juga akan menentukan jarak migrasi yang dilakukan oleh molekul protein dalam medan listrik (Nielsen 2003).
Salah satu teknik elektroforesis yang sering digunakan dalam analisis protein adalah teknik elektroforesis zonal. Dengan teknik ini, protein dipisahkan dari campuran kompleksnya menjadi pita melalui migrasi dalam matriks polimer padat yang disebut gel (gel tersebut direndam di dalam larutan buffer). Gel poliakrilamid merupakan gel yang paling umum digunakan pada teknik pemisahan protein secara elektroforesis zonal (Nielsen 2003).
Gel poliakrilamid dibentuk dari polimerisasi akrilamid dengan sejumlah kecil metilen-bisakrilamid yang bertindak sebagai cross-linking agent, dan diinisiasi oleh tetrametil-etilendiamin (TEMED) dan amonium persulfat (APS) (Wilson & Walker 2000). Spesies-spesies radikal bebas dari amonium persulfat akan bereaksi dengan akrilamid sehingga terbentuk akrilamid aktif. Akrilamid aktif ini akan bereaksi dengan akrilamid lainnya dengan cara yang sama sehingga terbentuk polimer yang panjang. Larutan yang mengandung polimer yang panjang ini tidak membentuk gel. Gel hanya akan terbentuk apabila terdapat N,N’–metilen-bis-akrilamid. Polimerisasi menyebabkan terbentuknya jala dari rantai akrilamid. Ukuran pori dari jala tersebut ditentukan oleh jumlah akrilamid yang digunakan per unit volume medium reaksi dan derajat ikatan silangnya (Nur & Adijuwana 1989).
Adapun tahap pendahuluan yang perlu sebelum melakukan teknik elektroforesis adalah denaturasi protein pada kondisi ekstrim (misalnya panas, penambahan reduktor, deterjen, dan lain-lain) yang dilanjutkan oleh pembungkusan dengan deterjen anionik. Pada tahap ini, protein sampel dilarutkan dan didisosiasi menjadi subunit di dalam larutan buffer yang mengandung deterjen dan
teknik ini lebih dikenal sebagai SDS-PAGE (Sodium Dodecyl Sulfate-Polyacrylamide Gel Elctrophoresis). Reduktor (reducing agent) seperti merkaptoetanol dan dithiothreithol digunakan untuk mereduksi ikatan disulfida di dalam subunit protein maupun antar subunit protein. Protein yang mengikat SDS akan memiliki muatan negatif, sehingga pemisahan subunit protein hanya didasarkan atas ukuran partikelnya (Nielsen 2003).
Bailey (1992) menuturkan, SDS merupakan grup ion sulfat dan rantai alkil lipofilik yang dapat menyebabkan peptida dan protein tidak saling berikatan yang dinamakan denaturasi. Kemudian SDS mengelilinginya sehingga peptida dan protein bermuatan negatif. Akibatnya, semua peptida dan protein dalam campuran akan bermigrasi menuju anoda (elektroda positif). Voet et al. (1999) menambahkan bahwa pergerakannya itu tidak lagi dipengaruhi oleh bentuk partikel karena denaturasi telah mengubah bentuk molekul menjadi seragam, yaitu berbentuk rantai lurus. Dengan demikian pergerakan protein merupakan fungsi dari berat molekulnya. Kompleks SDS-protein yang lebih besar akan memiliki mobilitas yang lebih kecil daripada kompleks yang lebih kecil.
Kualitas resolusi data yang dihasilkan oleh teknik SDS-PAGE ditentukan oleh ukuran pori-pori polimer gel. Oleh sebab itu, persentase akrilamid yang digunakan pada tahap persiapan gel akan mempengaruhi kemampuan elektroforesis dalam memisahkan protein. Persentase akrilamid yang diperlukan dalam fraksinasi protein disesuaikan dengan bobot molekul protein yang diperkirakan, seperti yang ditunjukkan pada Tabel 5.
Tabel 5. Persentase akrilamid yang digunakan untuk pemisahan molekul protein dengan kisaran berat molekul tertentu
Kisaran Berat Molekul Protein (kD) Persentase Akrilamid
200.000-60.000 5.0%
120.000-30.000 7.5%
75.000-18.000 10.0%
60.000-15.000 12.5%
45.000-12.000 15.0%
Sumber: Copeland (1994)
Proses elektroforesis dapat berlangsung dengan bantuan buffer sebagai medium yang menjaga konsistensi pH agar sampel protein tidak rusak. Menurut Copeland (1994), penggunaan buffer dalam elektroforesis gel dapat dilakukan dengan dua macam sistem, yaitu sistem kontinyu (homogenous) dan sitem diskontinyu (multiphasic). Sistem diskontinyu menggunakan dua macam gel dalam satu slab, yakni stacking gel dan separating gel. Buffer dan konsentrasi akrilamid yang digunakan pada kedua jenis gel tersebut berbeda (Boyer 1993). Stacking gel menggunakan buffer dengan pH 6.8 dan konsentrasi akrilamid yang lebih rendah (ukuran pori besar) sedangkan separatinggel menggunakan buffer dengan pH 8.8 dan konsentrasi akrilamid yang tinggi (ukuran pori kecil) pada proses pembuatan gelnya. Sistem diskontinyu akan menghasilkan pemisahan yang baik dengan pita yang tajam karena protein terkonsentrasi pada stacking gel dan mengalami resolusi yang tinggi pada
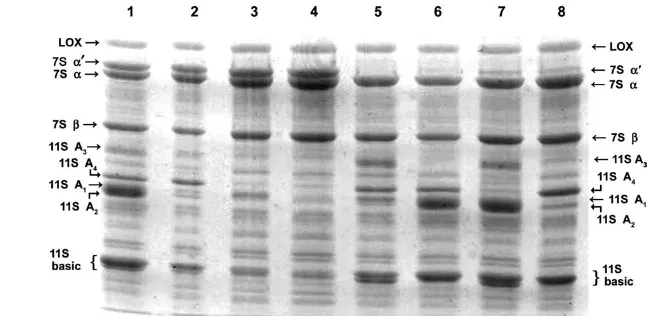
Gambar 4. Hasil elektroforesis SDS-PAGE ekstrak protein dari berbagai galur varietas kedelai (Poysa et al. 2006)
2.6
TEKSTUR
CURD
Tekstur merupakan salah satu faktor penerimaan produk pangan (oleh konsumen), selain rasa, aroma, dan penampakan visual. Menurut Micha (1987), karakteristik dari suatu tekstur ditentukan oleh sifat fisik dan fisikokimia yang berbeda-beda antar produk pangan dan responnya dipengaruhi oleh karakteristik sistem sensori manusia yang kompleks. Persepsi tekstur yang dirasakan pada suatu produk pangan juga dipengaruhi oleh faktor keadaan visual dan auditori produk tersebut, karena menurut Faridi & Faubion (1990), tekstur merupakan atribut sensori yang dipersepsikan oleh indera manusia melalui sentuhan, penglihatan dan pendengaran. Dan ISO (1981) mendefinisikan tekstur produk pangan sebagai semua atribut reologi maupun struktural (geometrik dan permukaan) produk yang dipersepsikan oleh reseptor mekanikal, peraba, visual, dan pendengaran manusia. Tekstur bukan merupakan atribut berdimensi tunggal, akan tetapi merupakan atribut multidimensional
Faridi & Faubion (1990) menguraikan tiga kategori parameter tekstur yang digunakan untuk mengklasifikasikan atribut tekstur secara sensori, yaitu karakteristik mekanikal, karakteristik geometrikal, dan karakteristik mouthfeel. Karakteristik mekanikal adalah reaksi bahan pangan terhadap tekanan yang dipersepsikan oleh indra kinestetik, meliputi kekerasan, kohesivitas, viskositas, dan kerenyahan. Karakteristik geometrikal adalah karakteristik yang berhubungan dengan ukuran, bentuk, dan orientasi partikel yang dipersepsikan oleh syaraf pengecap dalam mulut atau dengan sentuhan meliputi gritty, grainy, flaky, stringy, dan smooth. Dan karakteristik mouthfeel meliputi atribut mouthfeel yang berhubungan dengan persepsi terhadap lemak dan air selama proses pengunyahan dan penelanan.
BAB III
METODE PENELITIAN
3.1
BAHAN DAN ALAT
3.1.1
Bahan
Bahan baku yang digunakan yaitu kacang kedelai (Glycine max) dari koperasi produsen tahu PT. Diazara Tresna, Bogor (Koperasi Produsen Tahu Tempe Indonesia [KOPTI]), air, dan koagulan CaSO4.2H2O. Dan bahan-bahan yang diperlukan untuk analisis terdiri dari NaCl, etanol 70%, NaOH,
n-heksana, coomassie brilliant blue G-250, etanol 95%, asam fosforat 85%, bovine serum albumin (BSA), K2SO4, HgO, H2SO4 pekat, Na2S2O3.5H2O, H3BO3, HCl, akuades, indikator metilen, akrilamid, N,N’-metilen bisakrilamid, ammonium persulfat (APS), sodium dodecyl sulfate (SDS), tetrametil-etilendiamin (TEMED), tris base, glisin, gliserol, bromphenol blue, 2-merkaptoetanol, coomassie brilliant blue R-250, methanol, asam asetat glasial, akua-biodestilat, standar low molecular weight protein (LMW).
3.1.2
Alat
Alat-alat yang digunakan selama penelitian meliputi alat pemasakan tahu, alat analisis tekstur, dan alat analisis komposisi protein tahu. Pemasakan tahu memerlukan peralatan dapur seperti blender, panci, kompor, pisau, cetakan tahu, kain blacu dan kain saringan tahu, termometer -10-100°C, sendok kayu pengaduk, perlengkapan penyaji, serta neraca kasar. Analisis tekstur secara objektif menggunakan perangkat texture profile analyzer TA-XT2i dan perangkat lunak terkait. Analisis komposisi protein tahu memerlukan sentrifuge, sentrifuge kondisi 4°C, hot plate, perlengkapan elektroforesis SDS-PAGE, spektrofotometer UV-visible, perangkat analisis Kjeldahl, pH meter, termometer -10-100°C, neraca analitik, tabung Eppendorf, tabung sentrifuge, tabung reaksi, kuvet, sudip, magnetic stirrer, mikropipet, sarung tangan, gelas kimia, labu takar 10 mL, labu takar 100 mL, dan labu takar 1000 mL.
3.2
METODE PENELITIAN
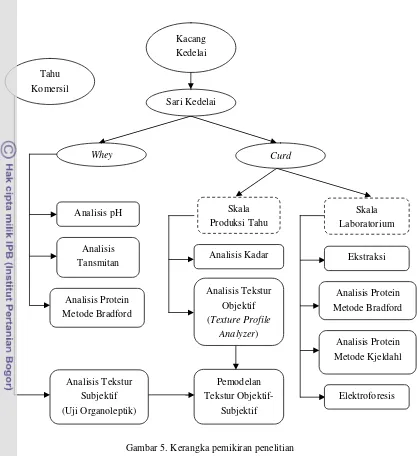
Gambar 5. Kerangka pemikiran penelitian
3.2.1
Tahap I
3.2.1.1
Pembuatan Tahu (Fahmi 2010)
Kacang kedelai yang telah dicuci dan direndam air (1:6) selama 6 jam, digiling dengan penambahan air (1:6) hingga diperoleh bubur kedelai. Bubur kedelai ditambah air (1:4) lalu didihkan selama 3 menit sambil terus diaduk. Selanj