MEMPELAJARI PENGARUH JENIS DAN KONSENTRASI KOAGULAN TERHADAP POLA ELEKTROFORESIS PROTEIN TERKOAGULASI
SERTA KORELASINYA TERHADAP TEKSTUR
FAKULTAS
SKRIPSI
MEMPELAJARI PENGARUH JENIS DAN KONSENTRASI KOAGULAN TERHADAP POLA ELEKTROFORESIS PROTEIN TERKOAGULASI
SERTA KORELASINYA TERHADAP TEKSTUR CURD (Glycine max) YANG DIHASILKAN
Oleh : RIZAL FAHMI
F24052486
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
BOGOR
MEMPELAJARI PENGARUH JENIS DAN KONSENTRASI KOAGULAN TERHADAP POLA ELEKTROFORESIS PROTEIN TERKOAGULASI
MEMPELAJARI PENGARUH JENIS DAN KONSENTRASI KOAGULAN TERHADAP POLA ELEKTROFORESIS PROTEIN TERKOAGULASI
SERTA KORELASINYA TERHADAP TEKSTUR
Sebagai salah
Pada Departemen Ilmu dan Teknologi Pangan
FAKULTAS TEKNOLOGI PERTANIAN
MEMPELAJARI PENGARUH JENIS DAN KONSENTRASI KOAGULAN TERHADAP POLA ELEKTROFORESIS PROTEIN TERKOAGULASI
SERTA KORELASINYA TERHADAP TEKSTUR CURD (Glycine max) YANG DIHASILKAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
RIZAL FAHMI F24052486
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
BOGOR
MEMPELAJARI PENGARUH JENIS DAN KONSENTRASI KOAGULAN TERHADAP POLA ELEKTROFORESIS PROTEIN TERKOAGULASI
Judul Skripsi : Mempelajari Pengaruh Jenis dan Konsentrasi Koagulan terhadap Pola Elektroforesis Protein Terkoagulasi serta Korelasinya terhadap Tekstur Curd Kedelai (Glycine max) yang Dihasilkan
Nama : Rizal Fahmi
NIM : F24052486
Menyetujui,
Pembimbing 1 Pembimbing 2
(Dr. Ir. Dahrul Syah) (Ir. Dadang Supriatna, MP)
NIP : 19650814.199002.1.001 NIP : 19630304.199003.1.004
Mengetahui, Ketua Departemen
(Dr. Ir. Dahrul Syah) NIP : 19650814.199002.1.001
Rizal Fahmi. F24052486. Mempelajari Pengaruh Jenis dan Konsentrasi Koagulan
terhadap Pola Elektroforesis Protein Terkoagulasi serta Korelasinya terhadap Tekstur
Curd Kedelai (Glycine max) yang Dihasilkan. Di bawah bimbingan Dahrul Syah dan
Dadang Supriatna.
RINGKASAN
Curd merupakan produk hasil koagulasi (penggumpalan) protein menggunakan
bahan penggumpal (koagulan). Pembentukan struktur curd menjadi tahapan kritis dalam menentukan preferensi konsumen terhadap produk akhir. Perbedaan dalam penggunaan koagulan pada taraf konsentrasi tertentu akan memberikan hasil koagulasi yang berbeda dan mempengaruhi kesukaan konsumen terhadap tekstur curd yang dihasilkannya. Perbedaan dalam pembentukan tekstur curd ini dapat pula disebabkan oleh beberapa faktor, diantaranya adalah mutu kedelai, kondisi proses yang dilakukan dan komposisi protein penyusun curd. Pengetahuan mengenai pengaruh koagulan, baik dari segi jenis maupun konsentrasi yang digunakan, terhadap tekstur curd yang diperoleh akan membantu pelaku produksi pangan dalam menciptakan produk yang konsisten secara organoleptik dan meningkatkan kualitas produk yang dihasilkannya. Melalui penelitian ini, dipelajari pengaruh jenis dan konsentrasi koagulan terhadap komposisi protein yang difraksinasi dengan metode Osborne, pola elektroforesis masing-masing protein fraksi Osborne, dan pengaruhnya terhadap tekstur produk curd yang diperoleh, sehingga diharapkan dapat memberikan informasi ilmiah yang diperlukan dalam pengembangan produk berbasis curd.
Penelitian ini terdiri dari dua tahap, tahap pertama berupa persiapan, penentuan proses standar, serta pembuatan curd, sedangkan tahap kedua berupa tahap analisis
curd. Curd diperoleh melalui proses koagulasi menggunakan koagulan CaSO4.2H2O dan CH3COOH pada tiga konsentrasi, yaitu 0.015 N, 0.030 N, dan 0.045 N. Analisis yang dilakukan meliputi analisis tekstur curd secara subjektif dan objektif, analisis kadar protein Kjeldahl, analisis kadar air, analisis pH whey curd, analisis transmittan
whey curd, fraksinasi protein metode Osborne, analisis kadar protein Bradford, dan
analisis SDS-PAGE.
Jenis dan konsentrasi koagulan yang digunakan memberikan variasi profil koagulasi protein yang diperoleh dan dapat diamati melalui pengukuran parameter-parameter kimia seperti pH, kadar protein whey dan curd, nilai transmittan whey, serta kadar air curd. Penggunaan koagulan CaSO4.2H2O akan menghasilkan curd dengan pH yang lebih tinggi (5.69-5.96) dibandingkan koagulan CH3COOH (4.71-5.26). Selain itu
curd yang dihasilkan melalui penggunaan koagulan CaSO4.2H2O memiliki kandungan protein (bb) yang lebih rendah (6.91%-10.81%) dan kadar air (bb) yang lebih tinggi (79.30%-87.83%) dibandingkan koagulan CH3COOH (kadar protein (bb) = 10.75%-11.06%; kadar air (bb) = 76.44%-80.14%). Kandungan protein curd yang rendah menyebabkan whey hasil pengepressan curd memiliki kandungan protein yang tinggi dan berbanding terbalik dengan nilai transmittannya.
Parameter tekstur curd yang diamati secara objektif menggunakan instrumen TA-XT2i menunjukkan bahwa nilai hardness sampel curd koagulan CaSO4.2H2O lebih rendah daripada curd dari koagulan CH3COOH dengan nilai kisaran masing-masing (pada konsentrasi 0.015N-0.045N) adalah 401.85g-749.21g dan 667.93g-862.93g. Kisaran nilai untuk parameter cohesiveness dan gumminess sampel curd koagulan
CaSO4.2H2O dan curd koagulan CH3COOH masing-masing adalah 74.36%-76.03% dan 69.44%-71.24% serta 298.75g-563.15g dan 468.22g-599.23g. Hasil analisis tekstur subjektif dengan metode penekanan menunjukkan bahwa koagulasi dengan CaSO4.2H2O memberikan nilai kekerasan terendah, selain itu peningkatan konsentrasi cenderung meningkatkan kekerasan. Urutan sampel dari yang terlunak hingga yang terkeras menurut metode penggigitan adalah CaSO4.2H2O-0.015 N, CaSO4.2H2O-0.030
N, CH3COOH-0.045 N, CH3COOH-0.030 N, CaSO4.2H2O-0.045 N dan CH3
COOH-0.015 N. Sementara itu, urutan sampel dari yang terlunak hingga yang terkeras menurut metode penggigitan adalah CaSO4.2H2O-0.030 N, CH3COOH-0.045 N, CaSO4.2H2 O-0.045 N, CaSO4.2H2O-0.015 N, CH3COOH-0.030 N dan CH3COOH-0.015 N. Hasil pengukuran kerapuhan sampel curd dengan penggigitan memberikan urutan sampel (dari yang paling rapuh hingga yang paling tidak rapuh) CH3COOH-0.045 N, CaSO4.2H2O-0.030 N, CH3COOH-0.030 N, CaSO4.2H2O-0.045 N, CaSO4.2H2O-0.015 N, CH3COOH-0.015 N. Kesukaan panelis secara umum menunjukkan bahwa sampel
curd CaSO4.2H2O lebih disukai. Nilai korelasi antara kekerasan objektif dengan kekerasan subjektif menggunakan metode penekanan menunjukkan nilai yang lebih tinggi (0.757 untuk CaSO4.2H2O dan 0.649 untuk CH3COOH) dibandingkan dengan metode penggigitan (-0.383 untuk CaSO4.2H2O dan 0.455 untuk CH3COOH).
Proporsi masing-masing fraksi protein albumin, globulin, prolamin dan glutelin dalam sampel curd untuk masing-masing sampel adalah 2.29%, 0.41%, 0.13%, 64.01% (curd CaSO4.2H2O konsentrasi 0.015 N), 1.68%, 1.07%, 0.07%, 55.75% (curd CaSO4.2H2O konsentrasi 0.030 N), 1.48%, 1.37%, 0.27%, 56.74% (curd CaSO4.2H2O konsentrasi 0.045 N), 1.19%, 0.96%, 0.10%, 66.48% (curd CH3COOH konsentrasi 0.015 N), 0.74%, 1.15%, 0.30%, 69.17% (curd CH3COOH konsentrasi 0.030 N), 0.70%, 1.27%, 0.96%, 63.05% (CH3COOH konsentrasi 0.045 N). Melalui analisis regresi linear berganda, hubungan antara porsi protein fraksi Osborne dengan parameter kekerasan objektif dapat dijelaskan dengan persamaan Y = 401.306 -178.043 X1 +270.204 X2 -298.194 X3 +5.415 X4, dimana Y adalah kekerasan curd terhadap porsi protein fraksi Osborne, X1 adalah porsi fraksi albumin, X2 adalah porsi fraksi globulin, X3 adalah porsi fraksi prolamin, dan X4 adalah porsi fraksi glutelin. Globulin menjadi fraksi protein Osborne yang berkorelasi positif terhadap kekerasan curd, dimana berat molekul protein dominan untuk koagulan CaSO4.2H2O dan CH3COOH masing-masing adalah 40 kDa dan 15 kDa.
Secara umum, pembentukan kekerasan tekstur curd dipengaruhi oleh profil koagulasi protein, terutama kandungan air yang terdapat di dalam sampel curd. Proporsi protein fraksi Osborne diduga juga berpengaruh terhadap kekerasan yang ditimbulkan
curd, dimana porsi fraksi albumin dan prolamin bersifat menurunkan kekerasan sampel curd, sedangkan fraksi protein globulin berkorelasi positif terhadap kekerasan curd
RIWAYAT HIDUP PENULIS
Penulis dilahirkan di Tanjung Karang, Lampung pada tanggal 17 Oktober 1986. Penulis merupakan anak kedua dari lima bersaudara pasangan Hari Nugraha dan Puspita Dewi. Penulis menamatkan pendidikan dasar di SD Regina Pacis Bogor pada tahun 1999, sekolah lanjutan tingkat pertama di SLTP Regina Pacis Bogor pada tahun 2002, dan sekolah lanjutan tingkat atas di SMA Regina Pacis Bogor pada tahun 2005. Penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menjalani studi di Institut Pertanian Bogor, penulis aktif di berbagai kegiatan dan organisasi kemahasiswaan, diantaranya menjadi koordinator divisi beverages (Food Proscessing Club, HIMITEPA IPB) serta kepanitian di berbagai kegiatan seperti BAUR 2007, HACCP ke-5 (Hazard
Analysis and Critical Control Point), Penyuluhan Makanan Tambahan Anak
Sekolah 2008 (PMTAS), dll.
Penulis pernah mengikuti beberapa kegiatan seminar dan pelatihan seperti Seminar Hazard Analysis Critical Control Point (HACCP) with ISO 22000, pelatihan Sistem Manajemen Halal, pelatihan PMTAS (Penyuluhan Makanan Tambahan Anak Sekolah), dan pelatihan Auditor Sistem HACCP.
Penulis juga pernah mengikuti Program Kreatifitas Mahasiswa bidang penelitian dengan judul “Bubur Sorgum (Sorghum bicolor) Instan sebagai Pangan Alternatif Berindeks Glisemik Rendah bagi Penderita Diabetes” serta menjadi asisten praktikum Evaluasi Sensori di Departemen Ilmu dan Teknologi Pangan (2009). Sebagai tugas akhir, penulis melakukan penelitian dengan judul “Mempelajari Pengaruh Jenis dan Konsentrasi Koagulan terhadap Pola Elektroforesis Protein Terkoagulasi serta Korelasinya terhadap Tekstur Curd Kedelai (Glycine max) yang Dihasilkan” di bawah bimbingan Dr. Ir. Dahrul Syah dan Ir. Dadang Supriatna, MP.
KATA PENGANTAR
Puji dan syukur saya panjatkan kehadirat Allah SWT karena berkat rahmat dan karunia-Nya saya dapat menyelesaikan laporan tugas akhir ini. Laporan ini dibuat sebagai salah satu syarat untuk menyelesaikan pendidikan tahap Sarjana di Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Laporan tugas akhir ini mempelajari pengaruh jenis dan konsentrasi koagulan terhadap pola elektroforesis protein terkoagulasi serta korelasinya terhadap tekstur curd kedelai (Glycine max) yang dihasilkan. Laporan ini juga mencakup pembahasan mengenai profil koagulasi protein dan pengenalan fraksinasi protein dengan menggunakan metode Osborne.
Tidak lupa penulis ucapkan terima kasih yang sedalam-dalamnya kepada pihak-pihak yang telah banyak memberikan bantuan dalam pembuatan laporan tugas akhir ini, yaitu:
1. Dr. Ir. Dahrul Syah selaku dosen pembimbing akademik atas waktu, pengertian, kritik, saran, dan seluruh bentuk bimbingan yang diberikan.
2. Ir. Dadang Supriatna, MP selaku pembimbing lapang atas waktu, arahan, kritik, dan saran yang mendukung terselesaikannya laporan akhir ini.
3. Ir. Sutrisno Koswara, MSi selaku dosen penguji atas waktu, kritik, dan saran yang diberikan.
4. Keluarga tercinta (Bapak Hari Nugraha, Ibu Puspita Dewi, Farah Dina, Ariansyah, Ervin Farhan dan Fahri Rasyadhan) atas segala bentuk dukungan, semangat dan doa yang diberikan hingga penulis mampu menuntaskan tugas akhir ini.
5. Teman-teman pondok sahabat: Mas Stefanus, Dolly, Janji, Aris, Agung, Bembeng, Apid, Kemal, Mas Daud, Ade, Gunawan, Acuy, Eldi, Joger atas semua persahabatan serta canda dan tawa yang selalu memberikan semangat. 6. Tuti, Nanda, Haris, Zaqaw, Aji, Juju, Umam, Adi Woko, Beqi, Wiwi, Hesti,
Fera, Indri, Cha2, Eping, Beli, Dion, Wahyu, Nina, dan Venty atas persahabatannya selama ini, semoga tidak akan pernah berakhir.
ii 7. Teman-teman lab biokim dan SEAFAST: Siyam, Arya, Dina, Esther, Dewi, Tere, Ceu2, Riza, Veni, Bombay, Adi Leo, Marcel, Mba Ria, Mba Desty, Mas Arif, Mba Maya dll. Terima kasih atas kebersamaan dan bantuannya selama ini.
8. Sahabat-sahabatku ITP 42, The Golden Generation !!!!
9. Teman satu bimbingan, Septi, Dita, Yogi, Yua, Victor, Jessica.
10. Laboran yang sangat saya hormati, Mba Ari, Abah, Pak Jun, Pak Deni, Bu Rub, Pak Gatot, Pak Wahid, Pak Yahya, Pak Sidiq, Pak Rojak untuk semua bimbingan, bantuan dan dukungan yang diberikan.
11. ITP 40, 41, 43 dan keluarga besar ITP.
12. Semua pihak yang sudah membantu dalam menyelesaikan tugas akhir ini. Penulis menyadari bahwa laporan ini masih memiliki banyak kekurangan baik dalam penyampaian maupun dalam kajian masalah. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun dari pembaca.
Akhir kata, semoga laporan tugas akhir ini dapat memberi manfaat bagi semua yang menggunakannya.
Bogor, Februari 2010
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... viii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
C. MANFAAT ... 3
II. TINJAUAN PUSTAKA ... 4
A. KEDELAI ... 4
1. Komposisi Kimia Kedelai ... 5
2. Protein Kedelai ... 6
3. Gelasi Protein Kedelai ... 7
4. Curd Kedelai ... 9
B. KOAGULASI ... 10
C. TEKNIK ELEKTROFORESIS DALAM ANALISIS PROTEIN ... 13
D. TEKSTUR ... 15
III. METODOLOGI PENELITIAN ... 20
A. BAHAN DAN ALAT ... 20
B. TAHAPAN PENELITIAN ... 20
1. Tahap Persiapan ... 20
2. Tahap Penelitian Utama ... 21
C. PROSEDUR ANALISIS ... 21
1. Analisis Kadar Air Metode Oven ... 21
2. Analisis Kadar Protein Metode Kjeldahl ... 23
3. Analisis pH dan Transmittan Whey Curd ... 23
4. Fraksinasi Protein Metode Osborne ... 23
5. Analisis Kadar Protein Metode Bradford ... 25
iv
7. Analisis Tekstur Curd secara Objektif ... 28
8. Analisis Tekstur Curd secara Subjektif ... 29
D. RANCANGAN PERCOBAAN ... 30
IV. HASIL DAN PEMBAHASAN ... 31
A. TAHAP PERSIAPAN ... 31
1. Penguasaan Teknik Pembuatan Curd ... 31
2. Penentuan Proses Standar Pembuatan Curd ... 33
B. PENELITIAN UTAMA ... 36
1. Profil Koagulasi ... 36
2. Fraksinasi Osborne ... 42
3. Analisis Tekstur Objektif ... 48
4. Analisis Tekstur Subjektif ... 51
5. Korelasi Tekstur Subjektif dan Objektif ... 56
6. Korelasi Fraksi Protein dengan Tekstur ... 57
7. Analisis Elektroforesis ... 62
V. KESIMPULAN DAN SARAN ... 68
A. KESIMPULAN ... 68
B. SARAN ... 69
DAFTAR PUSTAKA ... 70
DAFTAR TABEL
Halaman
Tabel 1 Komposisi kimia kedelai dan bagian-bagiannya ... 5
Tabel 2 Beberapa contoh koagulan penggumpal protein kedelai ... 12
Tabel 3 Definisi parameter tekstur dari grafik TPA ... 17
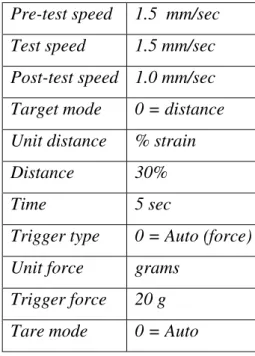
Tabel 4 Setting TA-XT2i untuk pengukuran TPA curd ... 28
Tabel 5 Kadar protein whey dan transmittan whey... 38
Tabel 6 Kadar protein dan kadar air curd... 41
Tabel 7 Kadar protein sampel untuk masing-masing fraksi Osborne ... 43
Tabel 8 Analisis sensori curd dengan metode penggigitan ... 54
vi
DAFTAR GAMBAR
Halaman
Gambar 1 Struktur biji kedelai ... 4
Gambar 2 Mekanisme gelasi protein dengan koagulan kalsium sulfat dan GDL ... 13
Gambar 3 Diagram skematik dari persepsi indera manusia terhadap produk pangan ... 15
Gambar 4 Grafik TPA untuk produk pangan secara umum beserta parameter analisis dan perhitungannya ... 18
Gambar 5 Contoh grafik TPA pada pengukuran tahu ... 19
Gambar 6 Skema penelitian tahap 2: Analisis... 22
Gambar 7 Skema fraksinasi protein metode Osborne ... 24
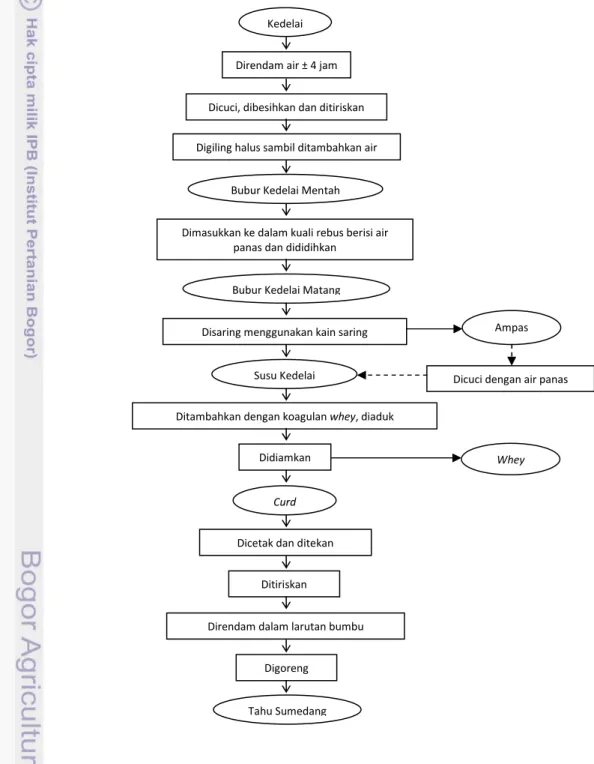
Gambar 8 Diagram alir pembuatan tahu Sumedang di pabrik ‘Diazara Tresna ... 32
Gambar 9 Proses standar pembuatan curd yang meliputi: (a) persiapan susu kedelai, (b) koagulasi, (c) persiapan koagulan ... 34
Gambar 10 Grafik hubungan pH whey dengan jenis dan konsentrasi koagulan ... 37
Gambar 11 Grafik hubungan antara konsentrasi koagulan dengan transmittan dan kadar protein Bradford whey pada penggunaan koagulan: (a) CaSO4.2H2O dan (b) CH3COOH ... 40
Gambar 12 Persentase fraksi protein Osborne per total protein yang terekstrak ... 44
Gambar 13 Perbandingan komposisi tiga protein fraksi Osborne pada enam sampel curd yang diekstrak ... 47
Gambar 14 Perbandingan fraksi protein glutelin pada ketujuh sampel ... 48
Gambar 15 Hasil pengukuran tekstur curd untuk parameter: (a) hardness, gumminess dan (b) cohesiveness ... 49
Gambar 16 Grafik tekstur penekanan untuk variabel jenis koagulan ... 52
Gambar 17 Grafik tekstur penekanan untuk variabel konsentrasi koagulan ... 53
Gambar 18 Grafik tekstur penekanan untuk variabel jenis dan konsentrasi koagulan ... 53
Gambar 19 Plot grafik evaluasi kekerasan objektif dan subjektif sampel CaSO4.2H2O ... 56
Gambar 20 Plot grafik evaluasi kekerasan objektif dan subjektif sampel CH3COOH... 57
Gambar 21 Perbandingan porsi fraksi albumin, globulin dan prolamin
curd ... 60
Gambar 22 Profil SDS-PAGE protein fraksi Osborne tepung kedelai ... 62 Gambar 23 Profil SDS-PAGE protein fraksi Osborne curd dari
CaSO4.2H2O konsentrasi: (a) 0.015 N, (b) 0.030 N,
(c) 0.045 N ... 65 Gambar 24 Profil SDS-PAGE protein fraksi Osborne curd dari
CH3COOH konsentrasi: (a) 0.015 N, (b) 0.030 N,
viii
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Larutan-larutan untuk SDS-PAGE ... 74
Lampiran 2 Kuesioner uji penekanan sampel curd ... 76
Lampiran 3 Kuesioner uji rating sensori curd kukus ... 76
Lampiran 4 Hasil pengukuran tekanan penekan cetakan curd di ‘Diazara Tresna’ ... 77
Lampiran 5 Data analisis pH whey hasil penekanan curd ... 78
Lampiran 6 Hasil analisis ragam (ANOVA) untuk pengaruh jenis dan konsentrasi koagulan terhadap pH whey ... 79
Lampiran 7 Data analisis kadar protein metode Bradford untuk whey hasil penekanan curd ... 80
Lampiran 8 Hasil analisis ragam (ANOVA) untuk pengaruh jenis dan konsentrasi koagulan terhadap kadar protein whey dengan metode Bradford ... 81
Lampiran 9 Data analisis transmittan whey hasil penekanan curd ... 81
Lampiran 10 Hasil analisis ragam (ANOVA) untuk pengaruh jenis dan konsentrasi koagulan terhadap transmittan whey ... 82
Lampiran 11 Hasil analisis korelasi antara kadar protein metode Bradford dan transmittan whey ... 83
Lampiran 12 Data analisis kadar protein curd metode Kjeldahl (%basis basah) ... 83
Lampiran 13 Hasil analisis ragam (ANOVA) untuk pengaruh jenis dan konsentrasi koagulan terhadap kadar protein Kjeldahl curd (%basis basah) ... 84
Lampiran 14 Data analisis kadar air curd (%basis basah) ... 85
Lampiran 15 Hasil analisis ragam (ANOVA) untuk pengaruh jenis dan konsentrasi koagulan terhadap kadar air curd (%basis basah) ... 86
Lampiran 16 Data analisis kadar protein fraksi Osborne dengan metode Bradford ... 87
Lampiran 16a Sampel tepung kedelai ... 87
Lampiran 16b Sampel curd CaSO4.2H2O-0.015N ... 88
Lampiran 16c Sampel curd CaSO4.2H2O-0.030N ... 89
Lampiran 16d Sampel curd CaSO4.2H2O-0.045N ... 90
Lampiran 16f Sampel curd CH3COOH-0.030N ... 92
Lampiran 16g Sampel curd CH3COOH-0.045N ... 93
Lampiran 17 Data analisis protein fraksinasi Osborne ... 94
Lampiran 18 Hasil analisis ragam (ANOVA) untuk fraksinasi protein metode Osborne ... 96
Lampiran 18a Fraksi protein albumin ... 96
Lampiran 18b Fraksi protein globulin ... 96
Lampiran 18c Fraksi protein prolamin ... 97
Lampiran 18d Fraksi protein glutelin ... 98
Lampiran 18e Total protein ekstraksi fraksi Osborne ... 99
Lampiran 18f Kadar protein Kjeldahl sampel fraksinasi Osborne ... 100
Lampiran 18g Persentase recovery protein fraksinasi Osborne ... 100
Lampiran 19 Data analisis tekstur objektif ... 101
Lampiran 19a Sampel Curd CaSO4.2H2O ... 101
Lampiran 19b Sampel Curd CH3COOH ... 102
Lampiran 20 Hasil analisis ragam (ANOVA) untuk parameter tekstur curd ... 103
Lampiran 20a Hardness curd ... 103
Lampiran 20b Cohesiveness curd ... 104
Lampiran 20c Gumminess curd ... 104
Lampiran 21 Data skor analisis tekstur subjektif: penekanan curd ... 105
Lampiran 22 Hasil analisis ragam (ANOVA) untuk tekstur subjektif: penekanan curd ... 106
Lampiran 23 Hasil analisis ragam (ANOVA) untuk respon panelis terhadap skor ... 107
Lampiran 24 Data analisis tekstur subjektif: penggigitan curd ... 108
Lampiran 25 Hasil analisis ragam (ANOVA) untuk tekstur subjektif: penggigitan curd ... 110
Lampiran 25a Kekerasan penggigitan sampel curd ... 110
Lampiran 25b Mouthfeel rapuh sampel curd ... 110
Lampiran 25c Kesukaan tekstur secara umum selama berada di dalam mulut ... 111
Lampiran 26 Hasil analisis korelasi kekerasan objektif dan subjektif ... 112
x
Lampiran 26b Sampel Curd CH3COOH ... 112
Lampiran 27 Data analisis proporsi protein fraksi Osborne ... 113
Lampiran 28 Hasil analisis ragam (ANOVA) untuk proporsi fraksi protein pada fraksinasi protein metode Osborne ... 114
Lampiran 28a Persen fraksi albumin ... 114
Lampiran 28b Persen fraksi globulin ... 114
Lampiran 28c Persen fraksi prolamin ... 115
Lampiran 28b Persen fraksi glutelin ... 116
Lampiran 29 Data analisis multiple linear regression kekerasan terhadap proporsi fraksi protein ... 117
Lampiran 30 Hasil analisis multiple linear regression kekerasan terhadap proporsi fraksi protein ... 117
Lampiran 30a Sampel curd CaSO4.2H2O ... 117
Lampiran 30b Sampel curd CH3COOH ... 118
Lampiran 30c Sampel curd keseluruhan ... 119
Lampiran 31 Hubungan Rf dengan log BM ... 119
Lampiran 31a Sampel tepung kedelai ... 119
Lampiran 31b Sampel curd CaSO4.2H2O-0.015N ... 120
Lampiran 31c Sampel curd CaSO4.2H2O-0.030N ... 120
Lampiran 31d Sampel curd CaSO4.2H2O-0.045N ... 120
Lampiran 31e Sampel curd CH3COOH-0.015N ... 121
Lampiran 31f Sampel curd CH3COOH-0.030N ... 121
I. PENDAHULUAN A. LATAR BELAKANG
Preferensi konsumen terhadap suatu produk pangan tidak hanya ditentukan melalui kandungan gizi yang terdapat di dalamnya. Bentuk, rasa dan mouthfeel yang baik seringkali menjadi faktor utama yang berperan dalam penerimaan konsumen, sehingga yang terjadi saat ini adalah upaya peningkatkan kualitas produk pangan dari segi organoleptiknya tanpa melupakan kandungan gizi produk tersebut. Hal inilah yang mendorong dilakukannya berbagai penelitian ilmiah dalam bidang rekayasa pangan.
Upaya peningkatan mutu organoleptik produk pangan juga terjadi pada berbagai produk yang menggunakan kacang-kacangan sebagai bahan baku maupun bahan penyusunnya. Melalui pemanfaatan kacang-kacangan, seringkali diperoleh produk akhir dengan karakteristik yang unik. Hal ini didukung oleh fakta bahwa kacang-kacangan mengandung protein yang tinggi sehingga mampu memberikan sifat fungsional yang dapat memperbaiki karakteristik produk pangan yang diinginkan secara organoleptik.
Salah satu sifat fungsional protein kacang-kacangan yang sering dimanfaatkan untuk menghasilkan karakteristik organoleptik tertentu adalah sifat gelasi protein melalui penambahan koagulan, yang prosesnya dikenal sebagai koagulasi protein. Di Indonesia, produk yang paling umum memanfaatkan koagulasi protein kacang-kacangan adalah tahu. Pada dasarnya, produk ini memanfaatkan kemampuan koagulasi protein kacang-kacangan untuk membentuk struktur curd-nya, yaitu matriks yang komponennya terdiri atas protein yang terekstrak disamping komponen air, mineral, dan vitamin.
Fenomena koagulasi protein kacang-kacangan menjadi gumpalan yang disebut curd menjadi bagian penting dalam proses pengolahan produk seperti tahu. Curd yang terbentuk akan menentukan mutu akhir dari produk yang dihasilkan, dan secara tidak langsung akan mempengaruhi preferensi konsumen terhadap produk tersebut. Pada produk tahu sendiri, dikenal berbagai jenis tahu dengan tingkat kekerasan yang berbeda-beda mulai dari tahu sangat keras (extra
2 Koagulan dalam hal ini, memberikan peran yang dominan terhadap karakteristik curd yang dihasilkan. Perbedaan dalam penggunaan jenis koagulan dengan konsentrasi tertentu akan memberikan variasi pembentukan curd, baik dalam hal kekerasan, mouthfeel maupun komponen proteinnya. Oleh karena itu, untuk memperoleh produk dengan karakteristik organoleptik yang seragam diperlukan pengetahuan mengenai penggunaan koagulan serta sifat-sifat organoleptik yang dihasilkan, khususnya tekstur.
Pada tingkat molekuler, perubahan tekstur dapat diduga karena adanya perubahan komposisi protein dalam curd. Penggunaan koagulan yang berbeda dalam hal jenis dan konsentrasinya akan mengendapkan fraksi protein tertentu, sehingga mampu mengikat komponen lain pembentuk tekstur curd. Akibat fraksi protein yang berbeda-beda ini akan dihasilkan sensasi tekstur produk yang berbeda pula selama berada di dalam mulut (mouthfeel).
Mekanisme koagulasi protein dalam menghasilkan sensasi tekstur tertentu melalui koagulasi fraksi protein belum banyak diteliti, meskipun hal ini penting dalam upaya memperoleh produk pangan yang konsisten secara organoleptik. Melalui penelitian ini, diharapkan akan diperoleh korelasi yang spesifik antara pengaruh penggunaan koagulan dengan koagulasi fraksi protein. Selain itu diharapkan akan diperoleh pula hubungan antara fraksi endapan protein yang terbentuk dengan pengaruhnya terhadap tekstur yang dihasilkan secara objektif dan subjektif, sehingga akan bermanfaat bagi proses pembuatan produk-produk berbasis curd.
B. TUJUAN
Secara umum, tujuan penelitian ini adalah mempelajari karakteristik koagulasi protein dan hubungannya dengan tekstur curd yang dihasilkan. Secara khusus, tujuan penelitian ini dijabarkan sebagai berikut:
1. Memperoleh standar operasional prosedur untuk proses produksi curd pada skala laboratorium.
2. Mempelajari pengaruh jenis dan konsentrasi koagulan terhadap profil koagulasi protein serta pola elektroforesis protein terkoagulasi yang muncul.
3. Mempelajari tekstur curd yang dihasilkan secara objektif serta sensasi subjektif yang timbul melalui penggunaan jenis dan konsentrasi koagulan. 4. Mempelajari korelasi antara fraksi protein yang terkoagulasi dengan tekstur
curd, khususnya kekerasan, yang dihasilkan. C. MANFAAT
Manfaat penelitian ini adalah memberikan dasar ilmiah dalam proses rekayasa pangan, khususnya dalam teknik pembuatan produk pangan berbasis
II. TINJAUAN PUSTAKA A. KEDELAI
Kedelai merupakan tanaman kacang-kacangan yang termasuk dalam famili
Leguminosa, sub famili Papillionaceae dan genus Glycine L. Struktur biji kedelai
terdiri atas 3 bagian utama, yaitu kulit biji, keping biji (kotiledon) dan hipokotil (Wolf dan Cowan, 1971). Struktur biji kedelai secara lengkap dapat dilihat pada Gambar 1.
Gambar 1. Struktur biji kedelai (Anonima, 2009)
Penampakan fisik kedelai memiliki keragaman yang cukup luas. Warna, ukuran, bentuk biji, sifat fisik maupun sifat kimia kacang kedelai sangat bervariasi. Perbedaan ini dipengaruhi oleh faktor varietas dan keadaan lingkungan tanamnya (Smith dan Circle, 1977).
Menurut Saidu (2005), seluruh bagian kedelai termasuk daun, batang dan bijinya dapat dimanfaatkan untuk pangan, obat dan pakan. Bagian keping biji (kotiledon) merupakan bagian yang paling umum untuk diolah menjadi berbagai produk olahan pangan. Hal ini disebabkan oleh komposisi yang tinggi pada kandungan protein dan lemaknya (Wolf dan Cowan, 1971).
1. Komposisi Kimia Kedelai
Kedelai mengandung jumlah protein yang bervariasi antara 38% hingga 49% (Saidu, 2005). Menurut Liu (1997), protein kedelai mengandung asam amino essensial yang lengkap dengan methionin sebagai asam amino pembatas. Leusin, isoleusin, lisin dan valin merupakan asam amino yang paling tinggi yang terkandung di dalam kedelai. Kadar protein kedelai yang tinggi menjadikan tanaman ini memiliki kualitas yang sama dengan protein hewani.
Kandungan lemak dalam kedelai adalah sekitar 18% dan sebanyak 85% bagian lemaknya merupakan asam lemak tak jenuh yang tinggi akan kandungan asam linoleat dan asam linolenat (Saidu, 2005). Kandungan asam lemak lainnya dalam kedelai antara lain asam oleat (23%), asam palmitat (16%) serta asam stearat dan arachidat (2%) (Saidu, 2005; Syarief dan Irawati, 1988). Sebagian besar asam lemak dalam kedelai beserta turunannya merupakan asam lemak tak jenuh, sehingga mudah sekali teroksidasi (Penalvo et al.,2004 yang dikutip oleh Saidu, 2005)
Kandungan karbohidrat dalam kedelai sekitar 30% yang terdiri dari 15% karbohidrat tak dapat larut (insoluble carbohydrate) dan 15% karbohidrat yang dapat larut (soluble carbohydrate). Selain itu kedelai juga memiliki kandungan isoflavone dan zat anti-nutrisi seperti saponin, fosfolipid, protease inhibitor, fitat dan tripsin inhibitor (Saidu, 2005). Komposisi kimia bagian bji kedelai dapat dilihat pada Tabel 1.
Tabel 1. Komposisi kimia kedelai dan bagian-bagiannya. Bagian
Kedelai Keseluruhan Porsi (%)
Protein
(%) Lemak (%) Karbohidrat (%) Abu (%)
Keseluruhan - 40 21 34 4.9
Kotiledon 90 43 23 29 5
Kulit 3-8 9 1 86 4.3
Hipokotil 2 41 11 23 4.4
6 Vitamin-vitamin yang terdapat dalam kacang kedelai antara lain vitamin A, vitamin B, terutama niacin, ribovlafin, dan thiamin, vitamin D,E dan K. Sedangkan mineral yang dikandungnya antara lain Ca, P, Fe, Na, K dan yang terdapat dalam jumlah kecil Mg, Mn, Zn, Co, Cu, Se, dan F (Smith dan Circle, 1977)
2. Protein Kedelai
Protein merupakan komponen kimia tertinggi yang terkandung dalam kacang kedelai. Kandungan protein kacang kedelai didominasi oleh 85% sampai 95% globulin serta sisanya adalah albumin, proteosa, prolamin, dan glutelin (Wolf, 1977). Kandungan protein yang tinggi menyebabkan protein memiliki peran yang penting dalam memberikan sifat-sifat fungsional yang khas.
Menurut Wolf dan Cowan (1971), protein kedelai terdiri dari campuran komponen-komponen yang mempunyai berat molekul 8 sampai 600 kilo Dalton. Melalui ultrasentrifugasi, protein kedelai dapat digolongkan menjadi empat golongan utama, yaitu protein 2S, 7S, 11S, dan 15S. Protein kedelai juga dapat digolongkan ke dalam 4 fraksi berdasarkan kelarutannya, yaitu albumin (larut dalam air), globulin (larut dalam larutan garam), prolamin (larut dalam alkohol 70%) dan glutelin (larut dalam basa encer) (Belitz dan Grosch, 1999).
Globulin merupakan protein terpenting pada kedelai. Protein ini tidak larut dalam air di sekitar titik isoelektriknya, tetapi akan segera larut dengan penambahan garam seperti natrium klorida atau kalsium klorida. Globulin larut dalam larutan garam encer pada pH di atas atau di bawah titik isoelektriknya (Pearson, 1983).
Protein 7S dan 11S merupakan dua protein utama yang menyusun globulin dengan jumlah masing-masing sekitar 18.5% dan 31% dari total protein kedelai (Wolf dan Cowan, 1971). Baik globulin 7S maupun globulin 11S terdiri atas subunit-subunit protein. Glycinin atau protein 11 S tersusun atas polipeptida asam dan basa yang saling dihubungkan oleh ikatan
disulfida. -conglycinin atau protein 7S, merupakan protein dengan struktur trimer yang terdiri atas 3 tipe subunit ( ’, dan ) (Liu et al., 2008)
Glycinin merupakan protein heksamer (AB)6 dengan berat molekul berkisar 300-380 kD. Subunit-subunit glycinin terdiri atas polipeptida asam (A) dan polipeptida basa (B) yang dihubungkan oleh ikatan disulfida (Blazek, 2008). Polipeptida asam glycinin memiliki berat molekul sekitar 35 kD, sedangkan polipetida basanya memiliki berat molekul sekitar 20 kD (Mujoo
et al., 2003).
-conglycinin merupakan protein trimer yang tersusun atas 3 subunit, yaitu ’, dan . Subunit ’ memiliki berat molekul sekitar 72 kD, sedangkan dan memiliki berat molekul masing-masing sekitar 68 dan 52 kD (Mujoo et al., 2003). Kombinasi subunit-subunit tersebut memberikan berat molekul sekitar 180 kD tergantung dari subunit penyusunnya (Blazek,
2008). Menurut Lewis dan Chen (1978) -conglycinin merupakan
glikoprotein yang mengandung 3.8-5.4% karbohidrat. Jenis gula yang terdapat dalam protein ini adalah manosa dan glukosamin.
3. Gelasi Protein Kedelai
Menurut Liu et al. (2008), protein kedelai memiliki banyak sifat fungsional yang telah dipelajari dengan sangat luas. Sifat fungsional itu diantaranya adalah kemampuan larut, kemudahan terdenaturasi oleh panas, kemampuan membentuk gel, emulsifier, kemampuan membentuk busa, kemampuan mengikat air (water holding capacity), pembentuk karakteristik struktur, sifat reologi, dan kemampuan membentuk tekstur.
Karakteristik mutu suatu produk pangan, khususnya sifat tekstur dan
juiciness, ditentukan melalui kapasitas gelasi protein. Gel dapat bervariasi
dalam hal sifat reologinya yaitu kekerasan, kelengketan, kohesivitas, dan adhesivitas. Dalam hal ini, protein sering digunakan untuk menghasilkan sifat tekstur tertentu melalui fenomena gelasi protein. Sifat unik dari gel protein adalah bentuknya yang padat tetapi memiliki karakteristik seperti cairan (Zayas, 1997).
8 Sifat gelasi protein berhubungan dengan agregasi protein. Gelasi protein terjadi ketika protein beragregasi membentuk jaringan (Tay et al., 2005). Menurut Schmidt (1981) yang dikutip oleh Zayas (1997), gelasi protein adalah fenomena agregasi protein di mana interaksi polimer-polimer dan polimer-solven setimbang sehingga jaringan atau matriks tersier terbentuk. Agregasi protein sendiri menurut Tay et al. (2005) dapat terjadi melalui proses pemanasan, pengaturan pH atau pengaturan kekuatan ionik dalam larutan protein.
Gel terbentuk ketika protein yang strukturnya terbuka sebagian (unfold) terurai menjadi segmen-segmen polipeptida yang kemudian berinteraksi pada titik tertentu untuk membentuk jaringan ikatan silang tiga dimensi. Protein dengan struktur unfold, dimana struktur sekundernya mengalami perubahan, diperlukan pada proses gelasi protein. Perubahan ini dapat terjadi melalui perlakuan panas, asam, alkali dan urea (Zayas, 1997).
Menurut Zayas (1997), pada proses pembentukan gel, transisi dari bentuk alami menjadi bentuk terdenaturasi merupakan prekursor penting dalam interaksi protein-protein. Jaringan gel baru akan terbentuk setelah sebagian protein mengalami denaturasi. Pembentukan gel protein merupakan hasil dari ikatan hidrogen, interaksi ionik dan hidrofobik, ikatan Van der Waals, dan ikatan kovalen disulfida.
Sifat gelasi protein kedelai sering dihubungkan dengan keberadaan protein 7S dan 11S yang merupakan penyusun utama protein globulin kedelai. Kandungan protein 11S dan rasio 11S/7S dilaporkan memberikan korelasi positif terhadap kekerasan gel dari protein kedelai (Mujoo, 2003). Menurut Corredig (2006), gel yang diperoleh dari isolasi glycinin (11S) memberikan karakter gel yang lebih keras dibandingkan gel yang diperoleh dari -conglycinin, dan struktur jaringan yang terbentuk memiliki perbedaan antar keduanya, tergantung dari komposisi protein. Blazek (2008) melaporkan bahwa rasio 11S/7S mempengaruhi karakter kekerasan dan elastisitas gel.
Glycinin berkontribusi terhadap peningkatan kekerasan dan kekokohan gel,
sedangkan -conglycinin memberikan pengaruh terhadap elastisitas gel yang dihasilkan.
4. Curd Kedelai
Curd adalah produk hasil penggumpalan protein dalam larutan susu. Curd kedelai diperoleh dengan terlebih dahulu mengekstrak protein kacang
kedelai, kemudian mengendapkannya dengan menggunakan koagulan. Pembentukan curd merupakan fenomena yang memanfaatkan sifat fungsional protein kedelai, yaitu sifat gelasi protein. Gel dari protein kedelai ini, atau yang dikenal sebagai curd, memiliki kemampuan untuk membentuk matriks yang mampu menahan air, lemak, polisakarida, flavor dan komponen lainnya (Zayas, 1997). Secara komersial, produk curd kedelai dikenal sebagai tahu.
Tahapan pembuatan tahu terdiri atas dua tahap utama, yaitu pembuatan susu kedelai dan tahap koagulasi (penggumpalan) susu kedelai, sehingga terbentuk curd yang selanjutnya dipress membentuk tahu (Shurtleff dan Aoyagi, 1984). Kedelai yang akan dibuat susu terlebih dahulu direndam dalam air bersih dengan tujuan untuk melunakkan struktur seluler kedelai sehingga mempermudah dan mempercepat penggilingan serta menghasilkan ekstrak optimum. Lamanya perendaman perlu diperhatikan, karena perendaman yang terlalu singkat akan membuat biji kedelai sulit pecah ketika penggilingan, sedangkan bila terlalu lama akan terjadi pembentukan busa pada permukaan air rendaman akibat fermentasi kedelai (Subardjo et al., 1987).
Kedelai yang telah direndam kemudian digiling hingga menghasilkan bubur kedelai. Penggilingan kedelai ini bertujuan untuk meningkatkan efektivitas ekstraksi kedelai selama pemasakan. Selanjutnya, bubur kedelai disaring dan dimasak pada suhu mendidih. Literatur lain (Supriatna, 2005) menyebutkan bahwa untuk menghasilkan sari kedelai yang optimal dari segi kualitas dan kuantitasnya, bubur kedelai terlebih dahulu dimasak sebelum akhirnya disaring. Menurut Liu et al.(2004), pemanasan optimal dalam pembuatan susu kedelai dilakukan selama 3-10 menit setelah mendidih yang tujuannya untuk mengekstrak protein kedelai dan mendenaturasi protein serta memudahkan proses koagulasi. Fungsi lain dari pemanasan dalam pembuatan susu kedelai menurut Koswara (1992) adalah mengurangi bau langu,
10 menginaktifasi antitripsin, meningkatkan daya cerna dan menambah daya awet produk.
Proses selanjutnya adalah penggumpalan protein susu kedelai dengan bantuan bahan penggumpal. Proses penggumpalan dilakukan pada suhu tertentu, tergantung pada jenis koagulan yang dipakai. Gumpalan protein kedelai ini selanjutnya dipress dan dicetak. Menurut Shurtleff dan Aoyagi (1984), untuk mendapatkan hasil yang baik pengepressan dilakukan pada tekanan sebesar 0.15-0.21 psi selama 15-20 menit.
Menurut Obatolu (2007), kualitas pembentukan tahu dipengaruhi oleh banyak faktor, yaitu mutu kedelai, kondisi pengadukan, koagulan serta penekanan yang diberikan pada curd. Perbedaan penggunaan jenis dan konsentrasi koagulan, pengadukan yang dilakukan selama koagulasi, dan tekanan terhadap curd akan memberikan variasi tahu mulai dari keras hingga lunak dengan kandungan air berkisar antara 70 hingga 90% dan kandungan protein 5 hingga 16% berdasarkan berat basah (Blazek, 2008).
Obatolu (2007) melaporkan bahwa perbedaan karakteristik tekstur, khususnya kekerasan, dapat dihubungkan dengan kandungan air di dalam tahu. Tahu dengan kekerasan tinggi memiliki kemampuan menahan air (WHC) yang rendah. Hal ini disebabkan oleh pembentukan matriks curd yang lebih rapat sehingga menurunkan kemampuannya dalam menahan air. Sebaliknya tahu yang lunak memiliki matriks yang renggang sehingga air dapat terperangkap dalam jumlah yang lebih banyak. Tahu yang lunak memiliki kandungan air yang tinggi yaitu antara 84 hingga 90%. Tahu dengan kandungan air yang tinggi secara visual akan memberikan penampakan yang lembut sedangkan tahu dengan kandungan air yang rendah cenderung memiliki penampakan yang kasar.
B. KOAGULASI
Koagulasi dan gelasi merupakan sifat fungsional protein pangan yang penting yang memberikan kontribusi terhadap mouthfeel dan tekstur dari berbagai sistem pangan. Koagulasi didefinisikan sebagai interaksi acak molekul-molekul protein yang menyebabkan pembentukan agregat-agregat protein baik bersifat
larut ataupun tidak larut (Meng et al., 2002). Koagulasi dapat terjadi melalui penambahan bahan penggumpal protein (koagulan).
Koagulasi susu kedelai merupakan langkah yang paling penting dalam proses pembuatan curd sekaligus menjadi tahapan paling sulit untuk dikendalikan karena merupakan hasil interaksi yang kompleks dari berbagai variabel (Prabhakaran et al., 2006; Blazek, 2008). Penggunaan jenis maupun konsentrasi koagulan yang berbeda akan mempengaruhi rendemen, sifat tekstur dan flavor
curd yang berbeda pula (Blazek, 2008; Mujoo, 2003). Menurut Obatolu (2007),
proses koagulasi susu kedelai dipengaruhi oleh interaksi kompleks antara jenis kedelai, suhu pemasakan susu kedelai, volume, kandungan padatan, pH, jenis dan jumlah koagulan serta waktu koagulasi.
Menurut Blazek (2008), kurangnya jumlah koagulan yang digunakan untuk koagulasi akan menyebabkan pengendapan protein menjadi tidak sempurna serta menyulitkan proses pemisahan whey dan curd. Jumlah koagulan yang kurang juga akan menghasilkan pembentukan struktur matriks curd yang renggang karena tidak sempurnanya pengendapan, akibatnya curd yang terbentuk terlalu lunak (Obatolu, 2007). Sebaliknya, kelebihan jumlah koagulan akan membuat tekstur curd kedelai menjadi keras dan mengurangi palatabilitas.
Perbedaan jenis koagulan yang digunakan akan menghasilkan perbedaan kandungan air di dalam curd. Hal ini disebabkan karena pembentukan struktur jaringan gel oleh koagulan dipengaruhi oleh perbedaan kekuatan anion dan kation terhadap kemampuan pengikatan air (WHC) dalam gel protein kedelai. Oleh karena itu, konsentrasi koagulan dan jenis anion ini mempengaruhi kekerasan
curd yang dihasilkan (Prabhakaran, 2006).
Rendemen pembentukan curd juga dipengaruhi oleh penggunaan koagulan. Semakin lambat kemampuan koagulan dalam mengkoagulasi susu akan memberikan rendemen curd yang lebih baik karena agregat protein akan memerangkap air lebih banyak di dalam curd. Sebaliknya, koagulan yang mengkoagulasikan protein lebih cepat, kurang memerangkap air sehingga curd yang dihasilkan lebih sedikit (Obatolu, 2007). Peningkatan temperatur koagulasi dan kecepatan pengadukan sesaat setelah penambahan koagulan juga akan
12 menurunkan rendemen curd dan mempengaruhi kekerasan curd yang terbentuk (Blazek, 2008).
Menurut Shurtleff dan Aoyogi (1984), bahan penggumpal protein kedelai dalam pembuatan tahu dapat digolongkan menjadi beberapa golongan, yaitu : 1) golongan garam klorida atau nigari; 2) golongan garam sulfat; 3) golongan lakton; dan 4) golongan asam. Beberapa contoh koagulan penggumpal protein kedelai dapat dilihat pada Tabel 2.
Tabel 2. Beberapa contoh koagulan penggumpal protein kedelai
Golongan Contoh yang umum dipakai
Garam klorida (nigari) MgCl2.6H2O, air laut, CaCl2, CaCl2.2H2O
Garam sulfat CaSO4. 2H2O dan MgSO4.7H2O
Lakton C6H10O6 (glukono- -lakton)
Asam Asam laktat, asam asetat, sari buah jeruk
Sumber : Shurtleff dan Aoyagi (1984)
Garam sulfat merupakan golongan koagulan yang paling umum digunakan dalam pembuatan curd protein kedelai. Koagulan ini akan terdispersi perlahan di dalam susu kedelai sehingga memberikan waktu koagulasi yang lambat (Shurtleff dan Aoyogi, 1984). Koagulan sulfat mengkoagulasi protein kedelai dengan cara membentuk jembatan antar molekul protein dan meningkatkan ikatan silang polimer sehingga terjadi agregasi protein (Obatolu, 2007). Ilustrasi mekanisme koagulasi dengan koagulan kalsium sulfat dan GDL dapat dilihat pada Gambar 2.
Pengendapan menggunakan koagulan asam akan menurunkan pH sistem dan memungkinkan agregasi protein terjadi (Obatolu, 2007). Melalui proses pemanasan susu kedelai, sebagai prasyarat terbentuknya gel, struktur molekul protein kedelai akan terbuka (unfold), akibatnya ikatan hidrogen (-SH), ikatan disulfida (S-S), dan sisi rantai asam amino hidrofobik akan terekspos. Selanjutnya, dengan penambahan koagulan, misalnya koagulan asam, muatan negatif molekul protein akan berkurang akibat protonasi COO- pada residu asam amino. Sebagai akibatnya, molekul-molekul protein akan cenderung saling mendekat karena memiliki muatan yang sama. Keadaan ini membuat ikatan
hidrogen (-SH), ikatan disulfida (S-S) serta interaksi hidrofobik terjadi secara intermolekul. Reaksi ini memfasilitasi terjadinya agregasi protein membentuk struktur jaringan tiga dimensi gel curd (Liu et al., 2004).
Gambar 2. Mekanisme gelasi protein dengan koagulan kalsium sulfat dan GDL
(Kohyama et al., 1995)
C. TEKNIK ELEKTROFORESIS DALAM ANALISIS PROTEIN
Elektroforesis didefinisikan sebagai migrasi molekul atau partikel bermuatan di dalam larutan atau medium melalui pengaruh medan listrik (Nielsen, 2003). Migrasi partikel bermuatan tersebut dapat terjadi karena perbedaan muatan total, ukuran dan bentuk partikel (Pomeranz dan Meloan, 1994). Metode analisis elektroforesis protein merupakan metode analisis yang memisahkan molekul protein berdasarkan berat molekulnya (Bolag dan Edelstein, 1991).
Teknik elektroforesis telah banyak digunakan dalam analisis protein untuk menentukan tingkat kemurnian sampel, berat molekul, maupun titik isoelektrik (Copeland, 1994). Selain itu, teknik elektroforesis juga sering digunakan untuk menentukan komposisi protein dari suatu produk pangan (Nielsen, 2003).
Pemisahan protein berdasarkan muatannya tergantung pada karakter asam dan basa protein. Hal ini ditentukan oleh jumlah dan jenis rantai samping (gugus R) yang dapat terionisasi dalam rantai polipeptida serta pH lingkungan. Pada pH lingkungan yang lebih besar daripada pH isoelektriknya (pI), protein akan memiliki muatan negatif sehingga migrasi protein akan menuju anoda yang bermuatan positif. Sebaliknya, bila pH lingkungan di bawah pI, muatan protein
14 menjadi positif yang membuatnya akan bermigrasi menuju katoda yang bermuatan negatif (Autran, 1996). Hal inilah yang menjadi dasar pemisahan protein dengan elektroforesis.
Metode elektroforesis protein yang paling umum dan banyak dilakukan adalah SDS-PAGE (Sodium Dodecyl Sulfate-Polyacrylamide Gel
Electropho-resis). SDS-PAGE merupakan teknik elektroforesis dalam sistem buffer
diskontinyu yang menggunakan dua tipe gel sebagai medianya, yaitu stacking gel dan separating gel. Sistem buffer yang diskontinyu membuat sampel terkonsentrasi dalam stacking gel sehingga menghasilkan resolusi yang lebih baik ketika pemisahan protein terjadi di separating gel (Garfin, 1990).
Gel poliakrilamid dibentuk dari hasil ko-polimerisasi monomer akrilamid (CH2=CH-CO-NH2) dengan bantuan senyawa yang bertindak sebagai
cross-linking agent yaitu N,N’-metilen-bisakrilamid
(CH2=CH-CO-NH-CH2-NH-CO-CH=CH2). Mekanisme polimerisasi akrilamid tersebut dikatalisis oleh TEMED (tetrametietilendiamin) dan APS (amonium persulfat). TEMED akan menyebabkan pembentukan radikal bebas dari amonium persulfat yang mengakibatkan reaksi pembentukan akrilamid aktif. Akrilamid aktif ini akan bereaksi dengan akrilamid lainnya membentuk rantai polimer yang panjang. Hasil dari polimerisasi ini adalah terbentuknya gel dengan struktur jala dari rantai akrilamid. Ukuran pori dan jala gel tersebut ditentukan oleh jumlah akrilamid yang digunakan per unit volumenya dan derajat ikatan silangnya (Garfin, 1990; Autran, 1996).
Sodium dodecyl sulfate (SDS) adalah detergen anionik yang paling umum
digunakan dalam elektroforesis. SDS memiliki dua fungsi, yaitu : (1) untuk memisahkan protein-protein yang beragregasi, hidrofobik, atau memiliki kelarutan yang rendah, seperti membran protein; dan (2) memisahkan protein berdasarkan bentuk, ukuran dan berat molekulnya. SDS menyelimuti protein dengan muatan negatif serta mengikat protein dengan rasio yang konstan, yaitu 1.4 g SDS per gram polipeptida (Garfin, 1990; Autran, 1996).
Interaksi SDS dengan protein akan merusak seluruh ikatan non-kovalen protein sehingga struktur protein akan terbuka. Selanjutnya, penggunaan reducing
protein melalui pemutusan ikatan disulfida pada protein sehingga memecahnya menjadi subunit-subunit protein. Akibatnya, mobilitas elektroforetik dari kompleks detergen-polipeptida hanya merupakan fungsi dari berat molekul protein (Garfin, 1990).
D. TEKSTUR
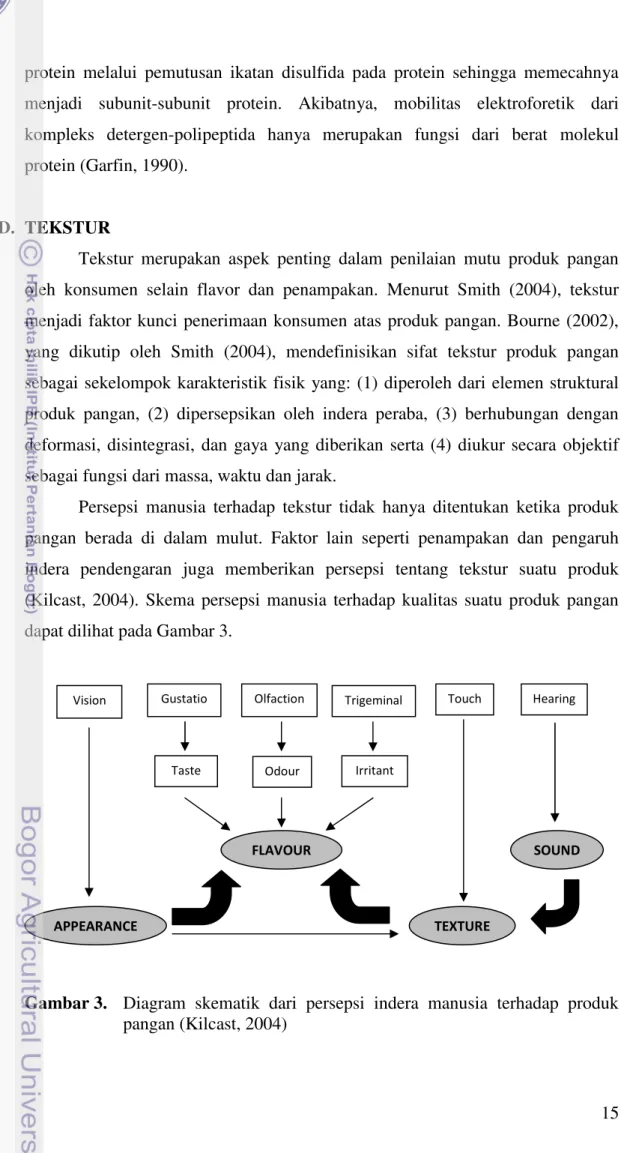
Tekstur merupakan aspek penting dalam penilaian mutu produk pangan oleh konsumen selain flavor dan penampakan. Menurut Smith (2004), tekstur menjadi faktor kunci penerimaan konsumen atas produk pangan. Bourne (2002), yang dikutip oleh Smith (2004), mendefinisikan sifat tekstur produk pangan sebagai sekelompok karakteristik fisik yang: (1) diperoleh dari elemen struktural produk pangan, (2) dipersepsikan oleh indera peraba, (3) berhubungan dengan deformasi, disintegrasi, dan gaya yang diberikan serta (4) diukur secara objektif sebagai fungsi dari massa, waktu dan jarak.
Persepsi manusia terhadap tekstur tidak hanya ditentukan ketika produk pangan berada di dalam mulut. Faktor lain seperti penampakan dan pengaruh indera pendengaran juga memberikan persepsi tentang tekstur suatu produk (Kilcast, 2004). Skema persepsi manusia terhadap kualitas suatu produk pangan dapat dilihat pada Gambar 3.
Gambar 3. Diagram skematik dari persepsi indera manusia terhadap produk
16 Persepsi tekstur yang diterima oleh manusia melalui indera peraba dapat diperoleh melalui dua cara, yaitu: somesthesis (secara taktil) yang merupakan respon yang diperoleh manusia melalui sentuhan dari kulit, dan kinesthesis yaitu respon yang diterima melalui aktivitas otot dan tendon. Stimulus sentuhan dapat dilakukan melalui pengujian produk pangan menggunakan tangan dan jari sedangkan kontak oral (kinesthesis) diperoleh melalui pengujian di dalam mulut akibat aktivitas bibir, lidah, langit-langit mulut dan gigi (Kilcast, 1999).
Analisis tekstur produk pangan dapat dilakukan secara organoleptik menggunakan indera manusia ataupun secara instrumen menggunakan alat. Analisis tekstur secara organoleptik memberikan hasil yang subjektif dan beragam, tergantung pada penilaian yang diberikan oleh panelis dalam pengujian. Sebaliknya, analisis secara instrumen akan memberikan hasil yang lebih akurat karena bersifat objektif (Peleg, 1983). Menurut Smewing (1999), analisis tekstur dapat dilakukan menggunakan alat atau instrumen seperti Instron, LFRA Texture Analyser, dan Stable Micro System TA-XT2i Texture Analyser.
Menurut Scott-Blair (1958) yang dikutip Rosenthal (1999) teknik instrumental untuk pengukuran tekstur pangan dikategorikan ke dalam tiga kategori, yaitu : (1) pengukuran empiris, yaitu metode yang mengukur atribut mekanik produk dengan mengkombinasikan beberapa tipe prinsip pengujian seperti penetrasi, kompresi, pemotongan, dan sebagainya; (2) pengukuran imitatif, yaitu metode pengukuran yang didesain dengan mengimitasi proses pengunyahan makanan di dalam mulut manusia. Dalam hal ini Texture Profile Analysis (TPA) merupakan metode yang paling umum dipakai; (3) pengukuran fundamental, yaitu metode yang mengukur atribut reologi atau fisik seperti viskositas atau modulus elastis.
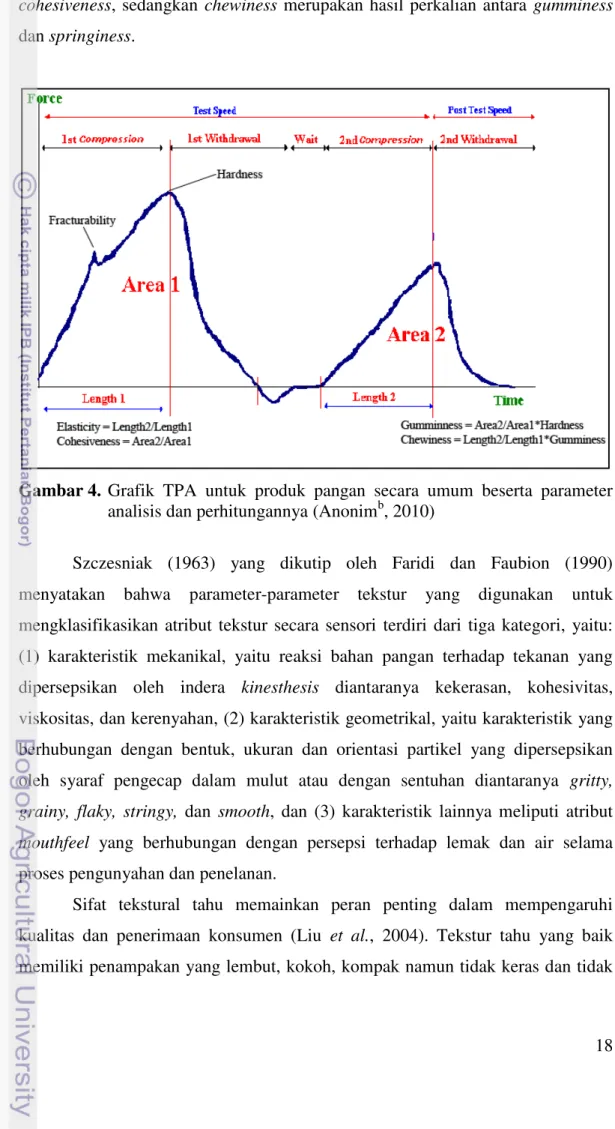
Texture Profile Analysis (TPA) merupakan bentuk penilaian objektif dari
analisis tekstur secara sensori. Pada TPA, probe akan melakukan kompresi sebanyak dua kali terhadap sampel. Hal ini dapat dianalogikan sebagai gerakan mulut pada saat mengunyah atau menggigit makanan (Larmond, 1976). Oleh karena itu, TPA disebut juga sebagai “two-bite test”.
Larmond (1976), menyatakan bahwa analisis menggunakan TPA merupakan analisis yang multipoint karena hanya dengan sekali analisis akan
diperoleh nilai dari beberapa parameter tekstur. Parameter tekstur yang dapat diukur menggunakan TPA meliputi hardness, fracturability, springiness,
cohesiveness, adhesiveness, gumminess dan chewiness. Definisi
parameter-parameter dari grafik TPA tersebut beserta cara perhitungannya dapat dilihat pada Tabel 3 dan Gambar 4.
Tabel 3. Definisi parameter tekstur dari grafik TPA
Parameter Definisi
Hardness/ firmness
Gaya yang diberikan hingga terjadi perubahan bentuk (deformasi) pada objek
Fracturability/ brittleness
Titik dimana besarnya gaya yang diberikan membuat objek menjadi patah (break/fracture). Fracturability sangat berkaitan dengan hardness dan cohesiveness.
Adhesiveness Gaya yang dibutuhkan untuk menahan tekanan yang timbul
diantara permukaan objek dan permukaan benda lain saat terjadi kontak antara objek dengan benda tersebut
Springiness/ elasticity
Laju suatu objek untuk kembali kebentuk semula setelah terjadi perubahan bentuk (deformasi)
Cohesiveness Kekuatan dari ikatan-ikatan yang berada di dalam objek yang
menyusun bentuk objek
Gumminess Tenaga yang dibutuhkan untuk menghancurkan (memecah) pangan semi padat menjadi bentuk yang siap untuk ditelan.
Gumminess berhubungan dengan hardness dan cohesiveness Chewiness Tenaga yang dibutuhkan untuk mengunyah (menghancurkan)
pangan padat menjadi bentuk yang siap untuk ditelan. Chewiness berhubungan dengan hardness, cohesiveness dan elasticity Sumber : DeMan (1985)
Nilai dari beberapa parameter tekstur TPA dapat langsung ditentukan dari grafik yang dihasilkan. Namun terdapat pula beberapa parameter yang nilainya bergantung pada parameter lain. Parameter tersebut yaitu gumminess dan
18
cohesiveness, sedangkan chewiness merupakan hasil perkalian antara gumminess
dan springiness.
Gambar 4. Grafik TPA untuk produk pangan secara umum beserta parameter
analisis dan perhitungannya (Anonimb, 2010)
Szczesniak (1963) yang dikutip oleh Faridi dan Faubion (1990) menyatakan bahwa parameter-parameter tekstur yang digunakan untuk mengklasifikasikan atribut tekstur secara sensori terdiri dari tiga kategori, yaitu: (1) karakteristik mekanikal, yaitu reaksi bahan pangan terhadap tekanan yang dipersepsikan oleh indera kinesthesis diantaranya kekerasan, kohesivitas, viskositas, dan kerenyahan, (2) karakteristik geometrikal, yaitu karakteristik yang berhubungan dengan bentuk, ukuran dan orientasi partikel yang dipersepsikan oleh syaraf pengecap dalam mulut atau dengan sentuhan diantaranya gritty,
grainy, flaky, stringy, dan smooth, dan (3) karakteristik lainnya meliputi atribut mouthfeel yang berhubungan dengan persepsi terhadap lemak dan air selama
proses pengunyahan dan penelanan.
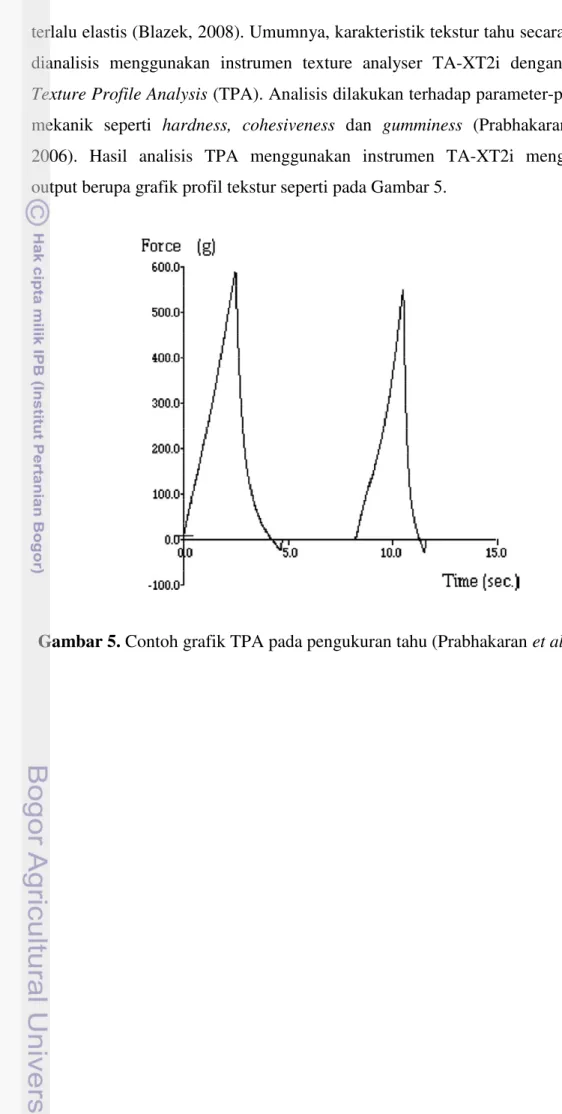
Sifat tekstural tahu memainkan peran penting dalam mempengaruhi kualitas dan penerimaan konsumen (Liu et al., 2004). Tekstur tahu yang baik memiliki penampakan yang lembut, kokoh, kompak namun tidak keras dan tidak
terlalu elastis (Blazek, 2008). Umumnya, karakteristik tekstur tahu secara objektif dianalisis menggunakan instrumen texture analyser TA-XT2i dengan metode
Texture Profile Analysis (TPA). Analisis dilakukan terhadap parameter-parameter
mekanik seperti hardness, cohesiveness dan gumminess (Prabhakaran et al., 2006). Hasil analisis TPA menggunakan instrumen TA-XT2i menghasilkan output berupa grafik profil tekstur seperti pada Gambar 5.
III. METODOLOGI PENELITIAN A. BAHAN DAN ALAT
Bahan-bahan utama yang digunakan dalam penelitian ini yaitu kedelai impor yang diperoleh dari KOPTI, koagulan CaSO4.2H2O dan koagulan CH3COOH. Bahan-bahan yang digunakan untuk analisis antara lain NaCl, etanol 70%, NaOH, n-heksana, coomassie brilliant blue G-250, etanol 95%, asam fosforat 85%, dan bovine serum albumin (BSA), K2SO4, HgO, H2SO4 pekat, Na2S2O3.5H2O, H3BO3, HCl, akuades, indikator metilen, akrilamid, N,N’-metilen bisakrilamid, amonium persulfat (APS), sodium dodecyl sulfate (SDS), tetrametil-etilendiamin (TEMED), tris base, glisin, gliserol, bromphenol blue, 2-merkaptoetanol, coomassie brilliant blue R-250, methanol, asam asetat glasial, akua-biodestilat, standar low molecular weight protein (LMW).
Alat-alat yang digunakan untuk pembuatan curd antara lain waring
blender, blender, hammer-mill, heater, panci, kain saring, penekan curd. Alat-alat
yang digunakan untuk analisis adalah alat soxhlet, alat kjeldahl, sentrifuge, refraktometer, perangkat alat elektroforesis, tabung Eppendorf, mikropipet,
magnetic stirrer, shaker, gelas piala, timbangan analitik, pH meter, labu takar,
gelas ukur, hot plate, sudip, sarung tangan, spektrofotometer, tabung reaksi, kuvet, pipet, vortex, alat gelas untuk analisis sensori dan perangkat alat analisis tekstur (TA-XT2i).
B. TAHAPAN PENELITIAN
Secara umum, penelitian ini terdiri dari dua tahapan. Tahap pertama merupakan tahap persiapan berupa penguasaan teknik pembuatan curd dan penetapan proses standar pembuatan curd. Tahap kedua merupakan tahapan penelitian utama. Pada tahap ini dilakukan analisis terhadap bahan baku kacang kedelai serta produk hasil berupa curd dan whey curd.
1. Tahap Persiapan
Penguasaan teknik pembuatan curd dilakukan di pabrik tahu Sumedang ‘Diazara Tresna’ di daerah Dermaga Bogor selama satu minggu.
Teknik dan proses yang diperoleh selama tahapan ini diaplikasikan dalam pembuatan curd pada skala laboratorium.
Penetapan proses standar pembuatan curd skala laboratorium dilakukan secara trial and error dengan mempertimbangkan faktor-faktor yang dapat mempengaruhi pembentukan tekstur curd. Faktor-faktor yang dipertimbangkan yaitu jenis dan konsentrasi koagulan yang digunakan, perbandingan total penambahan air, kandungan padatan total susu kedelai, suhu koagulasi, waktu koagulasi serta tekanan penekan cetakan curd.
2. Tahap Penelitian Utama
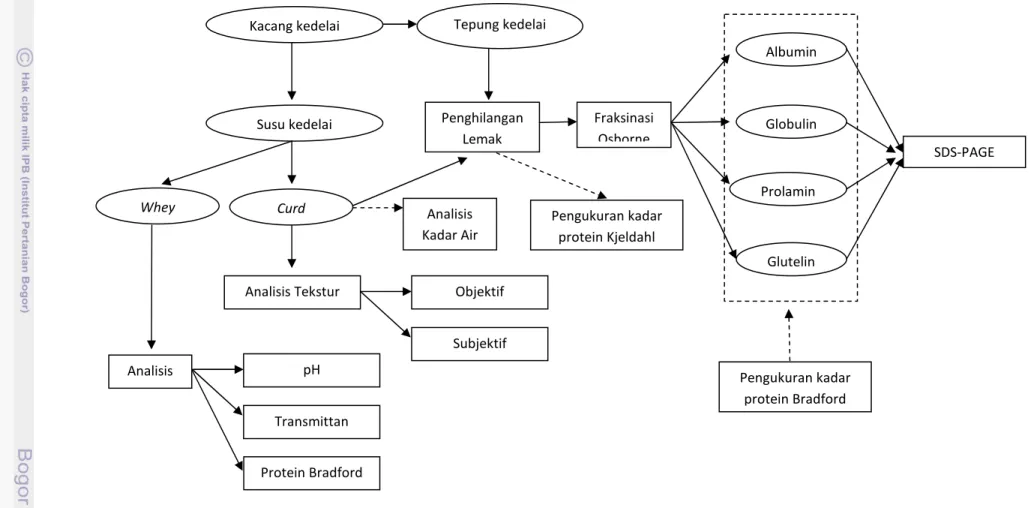
Pada tahap ini dilakukan analisis terhadap bahan baku tepung kedelai,
curd yang diperoleh melalui standar proses pada tahapan pertama, serta whey
hasil sampingan produk curd. Analisis yang dilakukan meliputi analisis tekstur curd secara subjektif dan objektif, analisis kadar protein Kjeldahl, analisis kadar air, analisis pH whey curd, analisis transmittan whey curd, fraksinasi protein metode Osborne, analisis kadar protein Bradford, dan analisis SDS-PAGE. Skema penelitian pada tahap analisis ini dapat dilihat pada Gambar 6.
C. PROSEDUR ANALISIS
1. Analisis Kadar Air Metode Oven (SNI, 1992 yang Dimodifikasi)
Sejumlah sampel (1-2 g) dimasukkan ke dalam cawan yang telah diketahui beratnya. Kemudian cawan dimasukkan ke dalam oven bersuhu 105oC hingga diperoleh berat yang konstan. Perhitungan kadar air dilakukan berdasarkan berat basah dengan menggunakan rumus :
Dimana :
a = berat cawan dan sampel awal (g) b = berat cawan dan sampel akhir (g) c = berat sampel awal (g)
Gambar 6. Skema penelitian tahap 2 : Analisis ! " # $ $ % $ 22
2. Analisis Kadar Protein Metode Kjeldahl (AOAC, 1995 yang Dimodifikasi)
Sejumlah sampel (100-250 mg) ditimbang ke dalam labu Kjeldahl. Kemudian ditambahkan 1.9 ± 0.1 g K2SO4 , 40 ± 10 mg HgO dan 2 ± 0.1 ml H2SO4. Sampel dididihkan selama 1-1.5 jam dengan kenaikan suhu secara bertahap sampai cairan menjadi jernih, lalu didinginkan. Sejumlah kecil akuades diteteskan secara perlahan lewat dinding labu kemudian labu digoyang pelan agar kristal yang terbentuk larut kembali. Isi labu kemudian dipindahkan ke dalam alat destilasi dan labu dibilas 5-6 kali dengan 1-2 ml akuades. Selanjutnya ditambahkan 8-10 ml larutan 60% NaOH-5% Na2S2O3 ke dalam alat destilasi. Erlenmeyer yang berisi 5 ml H3BO3 dan 2 tetes indikator metilen red-metilen blue diletakkan di bawah kondensor dengan kondisi ujung kondensor terendam di bawah larutan H3BO3. Destilasi dilakukan hingga diperoleh destilat sebanyak ± 15 ml. Destilat yang diperoleh selanjutnya diencerkan hingga ± 50 ml dan dititrasi dengan HCl terstandar sampai terjadi perubahan warna menjadi abu-abu. Perhitungan kadar protein dilakukan dengan rumus :
N = ml HCl-ml blanko)× N HCl ×
Kadar protein g
100g bahan basah =%N ×Faktor konversi
3. Analisis pH dan Transmittan Whey Curd (Moizuddin et al., 1999)
Tingkat keasaman whey hasil koagulasi dan pengepresan curd diukur dengan menggunakan pH meter pada suhu ruang, sedangkan % transmittan (%T) whey diukur secara spektrofotometri pada panjang gelombang 400 nm.
4. Fraksinasi Protein Metode Osborne (Lookhart dan Bean, 1995 yang Dimodifikasi)
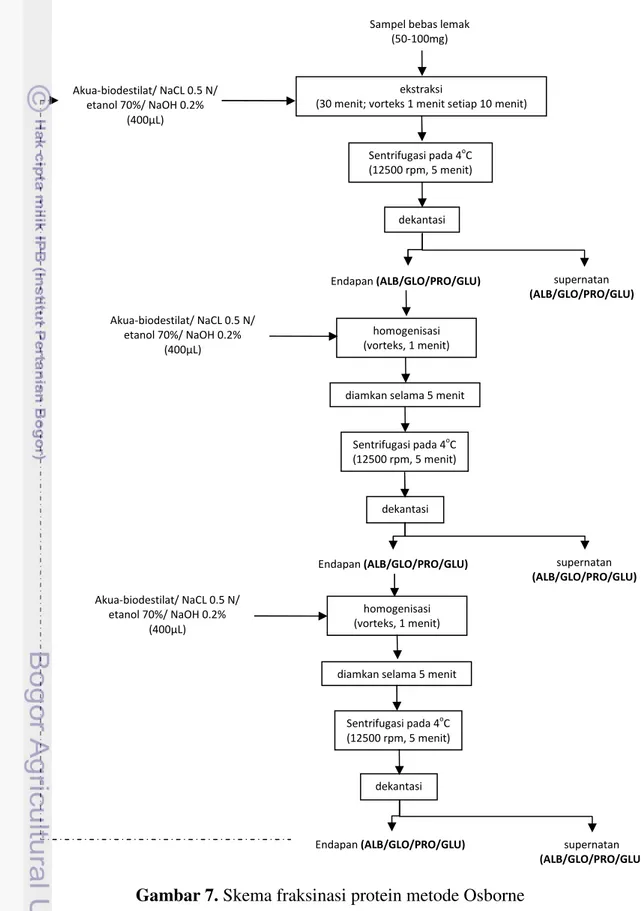
Fraksinasi Osborne dilakukan terhadap kacang kedelai giling dan curd tahu dengan terlebih dahulu menghilangkan kandungan lemak yang terdapat di dalam sampel. Sampel yang telah dihilangkan lemaknya (50-100 mg) diekstraksi secara bertahap dengan menggunakan pelarut akua-biodestilat,
24 NaCl 0.5 N, etanol 70%, dan NaOH 0.2% untuk memperoleh fraksi albumin, globulin, prolamin dan glutelin secara berturut-turut. Skema fraksinasi Osborne dapat dilihat pada Gambar 7.
Gambar 7. Skema fraksinasi protein metode Osborne
&'( )* + +( , - . &+/0(( 10 , " 2 3 .% (40 3 2 5(6 2 3 (4/6 &-((7%, # &* 1+ , 0 - . &+/0(( 10 , - . &+/0(( 10 , 0 &* 1+ , &0("+(( , " 2 3 .% (40 3 2 5(6 2 3 (4/6 &-((7%, " 2 3 .% (40 3 2 5(6 2 3 (4/6 &-((7%, # #
5. Analisis Kadar Protein Metode Bradford (Owusu-Apenten, 2002) a. Preparasi pereaksi Bradford
Sebanyak 100 mg pewarna CBB G-250 dilarutkan ke dalam 50 ml etanol 95%. Selanjutnya ditambahkan 100 ml asam fosforat 85% dan ditepatkan hingga 1 L dengan menggunakan akuades. Larutan kemudian disaring menggunakan kertas Whatman No.1 dan disimpan dalam botol gelap.
b. Pembentukan kurva standar
Sebanyak 100 ul larutan BSA (100-1000 ug/ml) dipipet ke dalam tabung reaksi berukuran 1.2 x 10 cm. Kemudian ditambahkan 5 ml pereaksi Bradford. Larutan kemudian divorteks dan diukur secara spektrofotometri pada = 595 nm setelah 5 menit. Untuk blanko, sebanyak 100 ul akuades ditambahkan 5 ml perekasi Bradford dan diukur dengan cara yang sama. Kurva standar yang diperoleh digunakan untuk mengukur konsentrasi sampel.
c. Pengukuran sampel
Sebanyak 100 ul sampel dipipet ke dalam tabung reaksi berukuran 1.2
x 10 cm. Kemudian ditambahkan 5 ml pereaksi Bradford. Larutan kemudian divorteks dan diukur secara spektrofotometri pada = 595 nm setelah 5 menit.
6. Analisis SDS-Polyacrylamide Gel Electrophoresis (Bolag dan Edelstein, 1991)
Analisis SDS-PAGE dilakukan menggunakan gel akrilamid dengan konsentrasi separating gel 12% dan stacking gel 5%. Sampel yang dielektroforesis adalah supernatan protein hasil fraksinasi dengan metode Osborne dari sampel kacang kedelai giling dan curd kedelai. Tahapan yang harus dilakukan dalam melakukan SDS-PAGE adalah 1) pembuatan
26
4) running SDS-PAGE; 5) pewarnaan gel; 6) destaining gel; dan 7) penentuan berat molekul protein-protein yang terpisahkan. Pembuatan
larutan stok dan larutan kerja untuk analisis SDS-PAGE dapat dilihat pada Lampiran 1.
1) Pembuatan separating gel
Dua lempengan kaca (mini slab) yang akan digunakan sebagai
cetakan gel dirangkai sesuai dengan petunjuk pemakaian. Sebanyak 4 ml larutan A dipipet ke dalam gelas piala, kemudian ditambahkan 2.5 ml larutan B dan 3.5 ml akua-biodestilat. Campuran kemudian diaduk perlahan dengan menggoyangkan gelas piala. Selanjutnya, sebanyak 50 ul APS 10% dan 5 ul TEMED ditambahkan ke dalam campuran dan diaduk kembali dengan perlahan. Campuran dimasukkan ke dalam lempengan kaca (mini slab) tanpa menimbulkan gelembung udara dengan menggunakan mikropipet sampai sekitar 1 cm dari atas lempengan. Bagian yang tidak diisi gel diberi akuades untuk meratakan gel yang terbentuk. Gel kemudian dibiarkan mengalami polimerisasi selama 30-60 menit. 2) Pembuatan stacking gel
Air dibuang dari atas separating gel dan dikeringkan dengan menggunakan tissue. Akua-biodestilat, larutan A, dan larutan C masing-maasing sebanyak 2.3 ml, 0.67 ml, dan 1.0 ml dicampurkan ke dalam gelas piala dan diaduk perlahan dengan cara menggoyangkan gelas piala. Selanjutnya, sebanyak 30 ul APS 10% dan 5 ul TEMED ditambahkan ke dalam campuran dan diaduk kembali dengan perlahan. Kemudian sisir dimasukkan dengan cepat tanpa menimbulkan gelembung udara. Stacking
gel dibiarkan mengalami polimerisasi selama 30-60 menit. Setelah gel
berpolimerisasi, sisir diangkat dari atas gel dengan perlahan dan slab ditempatkan ke dalam wadah elektroforesis. Buffer elektroforesis dimasukkan ke dalam wadah elektroforesis di bagian dalam dan luar agar gel terendam.
3) Preparasi dan injeksi sampel
Sebanyak 40 ul sampel dimasukkan ke dalam tabung Eppendorf dan ditambahkan 10 ul buffer sampel. Tabung kemudian dipanaskan selama 5 menit dalam air mendidih 100oC. Sampel kemudian siap diinjeksikan ke dalam sumur menggunakan mikropipet. Mikropipet dibilas menggunakan akuades setiap kali ingin memesukkan sampel lain. Pada salah satu sumur, ditempatkan sebanyak 7 ul protein marker.
4) Running SDS-PAGE
Katup elektroda dipasang dengan arus mengalir ke anoda. Sumber listrik dinyalakan dan dijaga konstan pada 70 V. Running dilakukan selama 180 menit sampai migrasi dye tersisa sekitar 0.5 cm dari dasar. Setelah selesai, aliran listrik dimatikan dan katup elektroda dilepaskan, lalu plat gel dipindahkan dari elektroda.
5) Pewarnaan gel
Gel diangkat dari slab dan dipindahkan ke dalam wadah tertutup yang telah berisi pewarna coomassie brilliant blue (kurang lebih 20 ml). Kemudian diagitasi dalam rotary shaker selama 5-10 menit.
6) Destaining gel
Gel diangkat dan dicuci dengan menggunakan akuades beberapa kali. Larutan penghilang warna ditambahkan (destaining solution) dan diagitasi dalam rotary shaker hingga latar belakang pita protein menjadi terang. Selanjutnya, larutan penghilang warna dibuang dan gel siap dianalisis.
7) Penentuan berat molekul protein yang terpisahkan
Berat molekul protein sampel dapat dihitung dari persamaan regresi antara mobilitas relatif protein marker (penanda protein) dengan logaritma dari berat molekul marker yang telah diketahui.