PENGEMBANGAN TEKNOLOGI PERBANYAKAN BIBIT
NENAS SMOOTH CAYENNE SECARA IN VIVO MELALUI
APLIKASI AUKSIN DAN SITOKININ
NAEKMAN NAIBAHO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa Tesis Pengembangan Teknologi Perbanyakan Bibit Nenas Smooth Cayenne Secara In Vivo melalui Aplikasi Auksin dan Sitokinin adalah karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis.
Bogor, Agustus 2012
ABSTRACT
Development of Pineapple Seed Propagation In Vivo Through Aplication of Auxin dan Cytokinin. Under supervision of M. RAHMAD SUHARTANTO and SOBIR
Pineapple plantation needs 40.000-60.000 seedlings per hectare, so it is important to have simple, efficient and effective propagation technology. The objectives of this research are to study the effect of IBA and BA to improve the success of seed production by in vivo. The study was conducted in three experiments. The first and the second experiment were to study the effect of indole-3-butyric acid (IBA) at 0, 25, 50 ppm and Benzyl Adenine (BA) at 0,25,50 and 75 ppm on the successful of basal leaf cuttings from stem and crown of pineapple GP-1 (Ananas comosus L. Merr). The third experiment was to determine the effect of sytokinin on the different size of buds generated from crown leaf cuttings. The result showed that leaf cutting from stem potential used as an alternative materials for seed propagation of pineapple. Increased of auxin concentration up to 50 ppm on leaf cuttings of stem inhibit shoot height. Contrarily, cytokinin treatment up to 50 ppm increased the height of shoots. Application of auxin up to 50 ppm on leaf cuttings of crown increase the percentage of rooted cuttings and percentage of budding per shoots (2-3 shoot per cutting), but application of cytokines up to75 ppm suppress seedling height, width leave and reduce the emergence rate of shoots at 50 ppm. Application of cytokinin (BA) 25 ppm and 50 ppm increased the percentage of sprouted cuttings and number of nodules on small buds and medium buds. Percentage sprouted cutting on small buds higher than medium and bigger buds. Using economic analysis, it is showed that IBA 50 ppm application on crown leaf cuttings is the most optimum materials used for seed propagation by in vivo.The success of seed multiplication in vivo through cuttings leave from the crown better than cuttings from leave stem.
RINGKASAN
NAEKMAN NAIBAHO. Pengembangan Teknologi Perbanyakan Bibit Nenas Smooth Cayenne Secara In Vivo melalui Aplikasi Auksin dan Sitokinin. Dibimbing oleh M. RAHMAD SUHARTANTO dan SOBIR.
Produksi nenas terus menurun seiring dengan penurunan luas pertanaman sejak 2010 hingga 2012. Hal ini bertolak belakang dengan kondisi Indonesia yang potensial untuk mengembangkan tanaman nenas. Pengembangan nenas secara luas membutuhkan jumlah bibit yang sangat besar sekitar 40.000-60.000 bibit per ha. Penyediaan bibit secara massal selama ini hanya bisa disediakan melalui perbanyakan in vitro. Namun demikian perbanyakan nenas dengan in vitro memerlukan biaya yang sangat mahal, membutuhkan kemampuan khusus dan sering terjadi variasi somaklonal pada bibit yang dihasilkan.
Kebutuhan bibit nenas Smooth Cayenne umumnya tergantung pada jumlah anakan yang dihasilkan oleh induk tanaman. Jenis nenas Smooth Cayenne umumnya hanya memproduksi satu atau dua anakan/sucker per tanaman. Demikian halnya dengan sumber bibit asal mahkota, menjadi tidak tersedia ketika penanaman selanjutnya karena buah dan mahkota terjual bersama sebagai buah segar. Oleh karena itu, perlu dicari alternative teknik perbanyakan yang mudah dilakukan dan manfaatkan sumber perbanyakan yang ada dan mudah diperoleh. Teknologi pembibitan yang diharapkan adalah teknologi perbanyakan yang mudah dilakukan tetapi dapat memproduksi secara massal, berkualitas, cepat, seragam dan murah.
Perbanyakan melalui stek basal daun merupakan salah satu cara konvensional yang dimodifikasi untuk memperbanyak bibit secara cepat dan massal. Keberhasilan perbanyakan bibit nenas Smooth Cayenne dengan stek basal daun belum banyak diketahui terutama yang menggunakan potongan basal daun dari batang dan mahkota. Teknik ini merupakan modifikasi sistem perbanyakan menggunakan stum batang (stem splitting) dan stek daun (stem leaf budding) yang tingkat keberhasilan dan daya multiplikasinya belum maksimal dan sebagian belum diketahui responnya terhadap ZPT. Oleh karena itu perlu usaha mengoptimalkan teknik tersebut dengan cara pemberian zat pengatur tumbuh (ZPT) sehingga diharapkan penyediaan bibit di lapang terpenuhi.
Penelitian ini bertujuan untuk mempelajari pengaruh pemberian zat pengatur tumbuh auksin dan sitokinin serta interaksinya pada stek basal daun asal batang dan mahkota. Penelitian ini juga bertujuan untuk mempelajari pengaruh sitokinin terhadap berbagai ukuran mata tunas yang efektif meningkatkan jumlah stek bernodul melalui stek basal daun asal mahkota. Disamping itu, diperoleh informasi efesiensi ekonomis dan teknis teknologi produksi bibit nenas secara stek.
IPB. Penelitian ini dilakukan pada Bulan Juli 2011 sampai dengan Februari 2012. Penelitian terdiri atas tiga percobaan. Percobaan pertama dan kedua adalah mempelajari pengaruh sitokinin (BA) dan auksin (IBA) terhadap keberhasilan produksi bibit dengan menggunakan eksplan stek basal daun asal batang dan mahkota. Percobaan ketiga adalah aplikasi sitokinin BA terhadap berbagai ukuran mata tunas yang dihasilkan oleh stek basal daun asal mahkota (crown). Percobaan pertama dan kedua menggunakan Rancangan Acak Kelompok Lengkap (RAKL) faktorial, dengan dua faktor. Faktor pertama adalah taraf konsentrasi auksin dengan tiga taraf yaitu, taraf 0 ppm, 25 ppm, 50 ppm dan faktor kedua adalah taraf konsentrasi sitokinin dengan empat taraf yaitu, 0 ppm, 25 ppm, 50 ppm dan 75 ppm. Masing-masing percobaan terdiri dari 12 kombinasi perlakuan, dengan tiga kali ulangan untuk setiap kombinasi perlakuan, sehingga terdapat 36 satuan percobaan. Setiap satuan percobaan terdiri dari 10 sampel stek basal daun. Percobaan ketiga menggunakan model Rancangan Acak Lengkap Faktorial (RAL) dengan dua faktor. Faktor pertama adalah konsentrasi sitokinin tiga taraf yaitu 0, 25 dan 50 ppm dan faktor kedua adalah tiga ukuran mata tunas hasil stek daun asal mahkota yang terdiri dari tiga taraf yaitu mata tunas kecil, sedang (tunas belum berdaun) dan mata tunas besar (tunas telah berdaun). Setiap perlakuan diulang tiga kali sehingga diperoleh 27 satuan percobaan. Setiap satun percobaan terdiri dari 10 stek basal daun asal mahkota.
Secara umum, perlakuan auksin dan sitokinin pada stek daun asal batang dan mahkota, tidak memberikan pengaruh interaksi pada semua peubah yang diamati namun sebagian peubah berpengaruh nyata berdasarkan faktor tunggal. Percobaan pertama, menunjukkan bahwa stek basal daun asal batang dapat digunakan sebagai bahan alternatif perbanyakan bibit nenas secara in vivo. Pemberian auksin hingga konsentrasi 50 ppm pada stek batang dapat menghambat pertumbuhan tunas dan sebaliknya pemberian Sitokinin hingga konsentrasi 50 ppm mampu meningkatkan tinggi tunas. Percobaan kedua, menunjukkan bahwa pemberian ZPT auksin dan sitokinin pada stek basal daun asal mahkota mampu meningkatkan keberhasilan perbanyakan bibit nenas melalui peningkatan persentase stek berakar dan jumlah tunas. Kemampuan stek berakar dan bertunas dipengaruhi kadar hormon endogen dan protein yang terdapat dalam jaringan stek. Taraf konsentrasi auksin 50 ppm mampu meningkatkan persentase stek yang berakar dan persentase jumlah stek yang menghasilkan 2-3 tunas per eksplan. Sebaliknya, berdasarkan peubah tinggi dan lebar daun, pemberian taraf sitokinin hingga 75 ppm justru menghambat pertumbuhan bibit berdasarkan peubah tinggi bibit dan lebar daun serta dapat memperlambat waktu bertunas pada perlakuan 50 ppm. Percobaan ketiga menunjukkan bahwa aplikasi sitokinin (BA) 25 ppm dan 50 ppm pada stek basal daun asal mahkota yang tunas kecil menghasilkan persentase stek bernodul dan jumlah nodul lebih tinggi daripada terhadap tunas sedang dan besar. Berdasarkan analisis efesiensi dan ekonomi, menunjukkan bahwa penggunaan auksin (IBA) 50 ppm pada stek daun asal mahkota adalah yang paling optimal dan efesien. Secara umum, keberhasilan perbanyakan bibit melalui stek asal mahkota lebih baik daripada asal batang.
©Hak Cipta Milik Institut Pertanian Bogor, tahun 2012 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutif sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis dalam bentuk apapun tanpa seizin IPB
PENGEMBANGAN TEKNOLOGI PERBANYAKAN BIBIT
NENAS
SMOOTH CAYENNE
SECARA
IN VIVO
MELALUI
APLIKASI AUKSIN DAN SITOKININ
NAEKMAN NAIBAHO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Megister Sains pada
Program Studi Agronomi dan Hortikultura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tugas akhir : Pengembangan Teknologi Perbanyakan Bibit Nenas Smooth Cayenne Secara In Vivo melalui Aplikasi Auksin dan Sitokinin.
Nama : Naekman Naibaho
NIM : A251090061
Disetujui
Komisi Pembimbing
Dr. Ir. M. Rahmad Suhartanto, MSi. Dr. Ir. Sobir, MSi
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu dan Teknologi Benih
Prof. Dr. Ir. Satriyas Ilyas, MS Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT karena atas rahmat dan karunia-Nya sehingga penelitian ini berhasil diselesaikan. Judul tesis yang dipilih dalam penelitian ini adalah Pengembangan Teknologi Perbanyakan Bibit Nenas Smooth Cayenne Secara In Vivo melalui Aplikasi Auksin dan Sitokinin
Penulis menyampaikan terima kasih kepada :
1. Dr. M. Rahmad Suhartanto selaku dosen Ketua Komisi Pembimbing yang telah memberikan kepercayaan dan bimbingan kepada penulis selama penelitian hingga penyusunan tesis ini selesai.
2. Dr. Sobir selaku Anggota Komisi Pembimbing yang pengarahkan dan memberikan bimbingan kepada penulis serta nasehat dan kemudahan selama kuliah dan penelitian.
3. Dr. Ir. Tatiek Kartika, selaku penguji luar komisi yang telah memberikan pengarahan dalam penyusunan tesis.
4. Prof. Dr. Satriyas Ilyas, MS, selaku penguji luar komisi yang telah memberikan dukungan, pengarahan dan masukan dalam penyusunan tesis ini. 5. Prof. Dr. Sri Setyati Harjadi, atas dorongan dan dukungannya.
6. Orang tua tercinta dan seluruh keluarga di Sumatera dan Tasikmalaya, terimaksih atas doa dan perhatiannya.
7. Pimpinan dan seluruh jajarannya di PKHT, atas izin dan bantuan biaya pendidikan selama mengikuti program pendidikan S2.
8. Istri dan anak saya tercinta, atas doa dan motivasinya.
9. Rekan-rekan sejawat di PKHT IPB, atas dukungannya selama ini.
10. Rekan-rekan ITB 2009 dan 2010, atas kebersamaan dan semangat yang diberikan.
11. Arya, atas bantuannya
12. Semua pihak yang membantu namun tidak tersebutkan satu per satu dalam karya tulis ini, semoga tuhan memberi hidayahnya.
Semoga karya tulis ini dapat bermanfaat
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 13 Desember 1977 di Simalungun, Sumatera Utara dari pasangan Purasa Naibaho (Alm) dan Nurhayati S. Penulis merupakan Putra ke enam dari delapan bersaudara.
i
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... ... 1
Latar Belakang ... 1
Perumusan Masalah ... 3
Tujuan Penelitian ... 5
TINJAUAN PUSTAKA ... ... 6
Morfologi Tanaman Nenas ... 6
Klasifikasi Nenas Klon GP-1 ... 7
Syarat Tumbuh ... 9
Bahan Perbanyakan Nenas ... 10
Zat Pengatur Tumbuh ... 11
Efesiensi Ekonomis dan Teknis ... 12
BAHAN DAN METODE ... 15
Tempat dan Waktu ... 15
Metode Penelitian ... 15
Percobaan I : Pengaruh Auksin dan Sitokinin terhadap Keberhasilan Stek Basal Daun Asal Batang ... 15
Percobaan II : Pengaruh Auksin dan Sitokinin terhadap Keberhasilan Stek Basal Daun Asal Mahkota ... 18
Percobaan III : Pengaruh Pemberian BA terhadap Berbagai Ukuran Mata Tunas Asal Stek Basal Daun Mahkota ... 19
Analisis Data ... 19
HASIL DAN PEMBAHASAN ... 20
ii
Daun Asal Batang Nenas Smooth Cayenne ... 22
Pengaruh Auksin dan Sitokinin terhadap Keberhasilan Stek Basal Daun Asal Mahkota Nenas Smooth Cayenne ... 34
Pengaruh Sitokinin BA pada Berbagai Ukuran Tunas terhadap Kemampuan Stek Bernodul ... 45
Efesiensi Ekonomis dan Teknis ... 49
Pembahasan Umum ... 54
SIMPULAN DAN SARAN ... 65
Simpulan ... 65
Saran ... 66
DAFTAR PUSTAKA ... 67
iii
DAFTAR TABEL
Nomor Halaman
1. Rekapitulasi Hasil Sidik Ragam Pengaruh Auksin dan Sitokinin terhadap Keberhasilan Stek Basal Daun Asal Batang Nenas
Smooth Cayenne Klon GP-1 ... 22 2. Pengaruh Konsentrasi Auksin dan Sitokinin terhadap Tinggi Tunas
pada Stek Basal Daun Asal Batang ... 25 3. Pengaruh Konsentrasi Auksin dan Sitokinin terhadap Tinggi Bibit
pada Stek Basal Daun Asal Batang ... 27 4. Ekstrapolasi Tinggi Bibit Nenas Hasil Stek Basal Daun Asal
Batang ... 28 5. Pengaruh Konsentrasi Auksin terhadap Jumlah Daun pada Stek
Basal Daun Asal Batang ... 29 6. Pengaruh Konsentrasi Auksin terhadap Lebar Daun pada Stek
Basal Daun Asal Batang ... 30 7. Pengaruh Auksin dan Sitokinin terhadap Panjang Akar, Persentase
Berakar, Bobot Kering Akar dan Bobot Bibit pada Stek
Basal Daun Asal Batang ... 31 8. Pengaruh Auksin dan Sitokinin terhadap Persentase Stek Hidup
Jumlah Tunas per Stek, Persentase Stek Bertunas 2-3 Tunas per Eksplan serta Waktu Bertunas pada Stek Basal Daun Asal
Batang ... 33 9. Rekapitulasi Hasil Sidik Ragam Pengaruh Auksin dan Sitokinin
terhadap Keberhasilan Stek Basal Daun Asal Mahkota (crown) Nenas Smooth Cayenne Klon GP-1 ... 35 10. Respon Pemberian Auksin dan Sitokinin terhadap Tinggi Tunas pada
Stek Basal Daun Asal Mahkota ... 36 11. Respon Pemberian Auksin dan Sitokinin terhadap Tinggi Bibit pada
Stek Basal Daun Asal Mahkota ... 37 12. Hasil Ekstrapolasi Data Tinggi Bibit Nenas Asal Stek Basal Daun
Asal Mahkota ... 38 13. Pengaruh Konsentrasi Auksin terhadap Jumlah Daun pada Stek Basal
Daun Asal Mahkota ... 39 14. Pengaruh Konsentrasi Auksin terhadap Peubah Lebar Daun pada
Stek Basal Daun Asal Mahkota ... 41 15. Pengaruh Auksin dan Sitokinin terhadap Panjang Akar, Persentase
Stek Berakar, Bobot Kering Akar dan Bobot Bibit pada Stek Basal
iv
Tunas/Stek, Stek Bertunas 2-3 Tunas per Eksplan serta Waktu
Bertunas pada Stek Basal Daun Asal Mahkota ... 43 17. Hasil Sidik Ragam Pengaruh Sitokinin BA dan Ukuran Mata
Tunas terhadap Persentase Stek Berkalus dan Jumlah Mata Tunas .. 46 18. Pengaruh Interaksi Sitokinin dengan Ukuran Mata Tunas Stek
Terhadap Persentase Stek Bernodul pada 4 MST ... 46 19. Pengaruh Interaksi Sitokinin dengan Ukuran Stek pada Jumlah Nodul
per Stek pada 4 MST ... 47 20. Efisiensi Ekonomis dan Teknis Kegiatan Produksi Bibit Nenas
Smooth Cayenne pada Stek Basal Daun Asal Mahkota ... 51 21. Hasil uji T Perlakuan Auksin dan Sitokinin pada Batang Vs Auksin
dan Sitokinin pada Mahkota terhadap Tinggi Bibit, Persentase Stek Tumbuh, Stek Berakar, Waktu Bertunas, Waktu Produksi Bibit
v
DAFTAR GAMBAR
Nomor Halaman
1. Gambar Nenas Smooth Cayenne Smooth Cayenne Klon GP-1
(Sumber PKHT) ... 8 2. Kondisi stek basal daun yang mengalami gejala pembusukan akibat Cendawan Phytopthora sp (A), gejala serangan Red spider
(Dolichote tranychus) (B), Kutu sisik (Diaspis bromeliad) (C), serta serangan Dysmicoccos brevipes (kutu putih) pada pangkal
batang bibit (D).) ... 21 3. Morfologi Tunas Bernodul Asal Stek Mahkota : (A). Mata Tunas
Umur 1 MSA dan (B). Mata Tunas Umur 4 MSA (Pembesaran
vi
DAFTAR LAMPIRAN
Nomor Halaman
1. Bagan Alir Pelaksanaan Penelitian ... 74 2. Data Klimatologi Wilayah Ciawi Selama Penelitian ... 75 3. Data Analisis Kandungan Karbohidrat, Nitrogen dan Protein
pada Stek Basal Nenas Asal Batang dan Mahkota ... 75 4. Keragaan Keberhasilan Stek 4 MST. (A) Stek Bertunas dan
Berakar (B).Stek Berakar tanpa Bertunas, (C). Stek Bertunas tanpa
Akar ... 76 5. Keragaan Perkembangan Akar dan Tunas pada Potongan Mahkota
PENDAHULUAN
Latar Belakang
Nanas (Ananas comosus (L) Merr.) merupakan tanaman buah ketiga yang paling penting di daerah tropis dan subtropis, setelah pisang dan jeruk (Rohrbach et al. 2003). Industri nanas dunia didominasi oleh kultivar Smooth Cayenne dan turunannya. Data statistik menunjukkan bahwa produksi nenas Indonesia tahun 2010 terjadi penurunan produksi dari 1.558.049 ton menjadi 1.390.380 ton pada tahun 2011. Terjadinya penurunan produksi ini sejalan dengan penurunan luas pertanaman nenas produktif dari 22.500 Ha menjadi 20.000 Ha (FAO STAT, 2012). Hal ini sangat disayangkan karena Indonesia memiliki keunggulan agroklimat dan lahan yang tersedia cukup luas dan pasar terbuka lebar.
Ketersediaan bibit merupakan hal yang sangat penting diperhatikan dalam rangka perluasan penanaman terutama untuk skala pertanaman menengah dan besar. Beberapa hal yang ditenggarai menyebabkan menurunnya luasan pertanaman nenas di Indonesia adalah tidak tersedianya bibit siap tanam, terbatasnya jumlah bibit yang berkualitas, tingginya biaya produksi bibit jika melalui tehnik kultur jaringan serta rendahnya produksi bibit jika menggunakan sumber bibit dari anakan. Menurut Prihatman (2000) tiap hektar dibutuhkan 40.000-60.000 bibit nenas. Perkebunan nenas skala besar umumnya mempunyai lahan seluas 10.000-35.000 Ha, sehingga perlu penyediaan bibit nenas yang berkualitas dalam jumlah banyak dan seragam.
Salah satu usaha untuk mengurangi biaya produksi dan meningkatkan kualitas panen serta keseragaman pertanaman adalah melalui teknologi pembibitan. Teknologi pembibitan sangat penting untuk membantu menghasilkan bibit yang berkualitas dan seragam. Teknologi pembibitan yang diharapkan adalah teknologi perbanyakan yang mudah dilakukan tetapi dapat memproduksi secara massal, berkualitas, cepat, seragam dan murah. Ukuran bibit yang berkualitas adalah bibit yang mampu tumbuh maksimal atau memiliki vigor yang tinggi dan seragam sehingga meningkatkan meningkatkan kualitas hasil (Py et al. 1987).
2
stek basal daun. Perbanyakan secara in vivo sudah banyak dilakukan dengan berbagai cara namun hasilnya masih belum optimal seperti perlakuan fisik terhadap terminal meristem (Heenkenda, 1993), membagi batang menjadi beberapa bagian (stem splitting) (Macluskie, 1939; Seow dan Wee, 1970; Kotalawala, 1971; Wee, 1979; Singh dan Yadav, 1980) dan perlakuan tanaman dengan bahan kimia seperti Morphactin (methylester chlorflurenol) (Sanford dan Ravoof, 1971; Watson, 1974; Keetch dan Dalldorf, 1980; Glennie, 1981; Kudo dan Koga, 1981).
Metode perbanyakan stek basal daun mahkota (mahkota leaf budding) berpotensi menghasilkan bibit lebih banyak dan seragam. Teknik ini telah diperkenalkan cukup lama dan telah banyak mengalami perubahan (Seow. et al. 1970; Lee et al. 1978; Dass et al. 1984.). Stek basal daun memanfaatkan jaringan meristem pada setiap ketiak daun. Setiap daun mahkota nenas memiliki tunas aksilar yang dorman dan melekat pada setiap ketiak batang daun. Tunas dorman tersebut berpotensi untuk mengasilkan mata tunas (bud) dan menjadi calon bibit (Py et al. 1984; Hepton, 2003.). Selanjutnya, menurut Naibaho et al. (2008), satu mahkota tanaman nenas dapat menghasilkan 25-30 potongan basal daun yang berpotensi untuk menghasilkan bibit.
Kebutuhan bibit nenas Smooth Cayenne umumnya tergantung pada jumlah anakan yang dihasilkan oleh induk tanaman. Jenis nenas Smooth Cayenne umumnya hanya memproduksi satu atau dua anakan/sucker per tanaman dan jarang lebih dari tiga anakan (Collins, 1960; Py et al. 1987; Nakasone dan Paull, 1998). Demikian halnya dengan sumber bibit asal mahkota, menjadi tidak tersedia ketika penanaman selanjutnya karena buah dan mahkota terjual bersama sebagai buah segar. Oleh karena itu, dibutuhkan suatu sistem produksi sumber bibit baik berupa plantlet (perbanyakan planlet) atau bibit siap tanam yang lebih efisien untuk mendukung produksi buah nenas di lapang, baik skala kecil maupun besar.
3
sitokinin berperan dalam meningkatkan pembelahan sel dan fungsi pengaturan pertumbuhan, serta perkembangan mata tunas dan pucuk. Salah satu jenis sitokinin sintetik yang banyak digunakan yaitu Benzylaminopurine (BA). Aplikasi sitokinin diharapkan mampu meningkatkan jumlah tunas yang terbentuk pada stek daun dan batang pada nenas.
Zat pengatur tumbuh lain yang mampu mendorong pertumbuhan adalah auksin. Auksin merupakan salah satu fitohormon yang terkenal untuk mendorong perpanjangan sel pucuk di daerah sub apikal. Menurut Hartmann (1997) zat pengatur tumbuh yang paling berperan pada pengakaran stek adalah auksin. Saat ini jenis hormon auksin sintetik yang banyak digunakan untuk tujuan perbanyakan adalah indole-3-butyric acid (IBA).
Sitokinin dan auksin dalam tanaman mendorong pembelahan sel dan sitokinin yang berinteraksi dengan auksin dalam menentukan arah terjadinya diferensiasi sel. Perubahan perbandingan auksin dan sitokinin akan berakibat pembentukan meristem yang kemudian berdiferensiasi kearah pembentukan akar, tunas dan batang (Kusumo, 1990).
Penggunaan bahan kimia atau zat pengatur tumbuh terhadap keberhasilan stek nenas penting untuk dipelajari. Berdasarkan hasil penelitian sebelumnya, tehnik perbanyakan secara in vivo berpotensi untuk dikembangkan sehingga perlu dilakukan studi perbanyakan bibit nenas Smooth Cayenne melalui penggunaan zat pengatur tumbuh seperti sitokinin (BA) dan auksin (IBA). Hasil penelitian ini diharapkan dapat memperoleh informasi teknologi sederhana sistem perbanyakan bibit nenas yang mampu meningkatkan keberhasilan perbanyakan bibit terutama untuk jenis nenas Smooth Cayenne. Selain hal tersebut, penelitian ini juga diharapkan dapat memberikan informasi efesiensi teknis dan ekonomis bagi pengambangan teknologi pembibitan nenas melalui stek basal daun sehingga bermanfaat bagi pengguna.
Perumusan Masalah
4
jaringan juga masih dianggap terlalu mahal dan seringkali memunculkan variasi somaklonal yang mengakibatkan bibit dan pertanaman di lapang menjadi tidak seragam. Beberapa klon potensial hasil persilangan atau hibridisasi juga sulit untuk dikembangkan karena hanya mengandalkan pembiakan secara vegetatif terutama dari anakan dan mahkota nenas dari tanaman induk.
Kebutuhan bibit nenas kultivar Cayenne tergantung pada jumlah bibit yang dihasilkan oleh induk tanaman. Jenis nenas Smooth Cayenne yang tanam biasanya hanya memproduksi satu atau dua anakan/sucker per tanaman dan jarang lebih dari tiga anakan (Collins, 1960; Pay et al. 1987; Nakasone dan Paull, 1998). Demikian halnya dengan sumber bibit asal mahkota, bibit yang berasal dari mahkota menjadi tidak tersedia ketika penanaman selanjutnya karena buah dan mahkota dijual bersama sebagai buah segar.
Teknik in vivo atau perbanyakan konvensional cepat masih dipandang sebagai metode perbanyakan yang dapat digunakan untuk perbanyakan bibit yang berkualitas dan seragam. Penelitian perbanyakan nenas secara in vivo telah banyak dilakukan diberbagai negara. Metode perbanyakan in vivo umumnya menggunakan stek batang (stem splitting) dan tunas basal daun mahkota (mahkota leaf budding ). Tehnik perbanyakan secara in vivo ini merupakan metode perbanyakan konvensional yang berpotensi digunakan untuk perbanyakan bibit yang berkualitas dan seragam. Beberapa hasil penelitian perbanyakan cara in vivo telah dilakukan dengan menggunakan bahan kimia. Suwunnamek (1993), mencoba untuk meningkatkan jumlah tunas nenas dengan menggunakan bahan paclobutrazol, tiourea, dan pendimethalin, tetapi efisiensi propagasinya masih rendah sekitar tiga tunas per tanaman. Adaniya et al. (2004) melakukan kajian pengaruh pemberian beberapa jenis ZPT dan agen kimia lain (regulator) terhadap tingkat multiplikasi dan manfaat praktisnya, seperti forchlorfenuron (N-(2-kloro-4-piridil)-N-phenylurea) (CPPU) dan 6-benziladenin (BA). Selanjutnya, Coelho et al (2007) juga melakukan kajian aplikasi BAP dan GA3 terhadap tingkat multiplikasi nenas Smooth Cayenne namun tingkat propogasinya juga masih rendah.
5
dikembangkan sehingga perlu dilakukan kajian perbanyakan melalui penggunaan zat pengatur tumbuh seperti sitokinin (BA) dan auksin (IBA) dalam meningkatkan keberhasilan dan laju multiplikasinya. Sitokinin jenis BA dan auksin jenis IBA merupakan zat pengatur tumbuh yang banyak digunakan di dalam perbanyakan secara in vitro karena fungsi fisiologis sitokinin maupun auksin berkaitan erat dengan pembelahan dan pembesaran sel. Dalam menginduksi tunas adventif, sitokinin dan auksin juga penting dalam menginduksi tunas aksilar dan berperan dalam menentukan terbentuknya kalus dan akar. Sitokinin bersinergi dengan auksin dalam menstimulasi pembelahan sel untuk perkembangan tanaman selanjutnya.
Tujuan Penelitian
Penelitian ini bertujuan untuk meningkatkan keberhasilan produksi bibit nenas melalui tehnik perbanyakan bibit melalui stek basal daun dengan cara : 1. Mengetahui pengaruh jenis zat pengatur tumbuh auksin (IBA) dan sitokinin
(BA) pada berbagai taraf konsentrasi terhadap keberhasilan produksi bibit nenas Smooth Cayenne klon GP-1 melalui stek basal daun asal batang.
2. Mengetahui pengaruh jenis zat pengatur tumbuh auksin (IBA) dan sitokinin (BA) dengan berbagai taraf konsentrasi terhadap keberhasilan produksi bibit Smooth Cayenne klon GP-1 melalui stek basal daun asal mahkota.
3. Mengetahui pengaruh taraf sitokinin (BA) pada berbagai ukuran mata tunas terhadap persentase stek bernodul dan jumlah nodul melalui stek basal daun asal mahkota.
TINJAUAN PUSTAKA
Morfologi Tanaman Nenas
Nenas memiliki daun berbentuk pedang dengan panjang mencapai 1 m atau lebih, lebar 5 - 8 cm, pinggir daun berduri atau hampir rata, berujung lancip, bagian atas daun berdaging, berserat, beralur, tersusun dalam spiral yang tertutup, bagian pangkalnya memeluk poros utama (Verheij & Coronel, 1992). Jumlah daun yang terbentuk dapat mencapai 70 sampai 80 helai. Permukaan daun atas, licin seperti lapisan lilin, berwarna hijau terang atau coklat kemerahan, permukaan bawahnya terdapat garis-garis linier berwarna putih keperakan, mudah lepas dari epidermis yang berwarna hijau terang. Stomata tersusun dalam garis putus-putus. Stomata berada di bagian sisi dan bawah permukaan daun diantara garis-garis linier (Collins, 1960).
Batang nenas selalu tertutup daun, jika daun dilepas terlihat ruas-ruas pendek dengan panjang bervariasi antara 1-10 cm dengan ruas yang paling panjang terdapat di bagian tengah batang, panjang batang berkisar 20-25 cm dengan diameter bagian bawahnya 2-3.5 cm dan semakin ke atas diameter batang semakin besar yaitu 5.5 - 6.5 cm serta bagian puncaknya mengecil (Collins, 1960).
Nenas memiliki akar serabut dengan sebaran ke arah vertikal dan horizontal. Perakaran dangkal dan terbatas walaupun ditanam pada media yang paling baik. Kedalaman akar nenas tidak akan lebih dari 50 cm (Samson, 1980). Akar tunggang hanya terbentuk jika bibit berasal dari biji.
self-7
fertile (Brewbaker & Gorrez 1967 dalam Hadiati, 2002), sehingga biji akan terbentuk jika terjadi penyerbukan silang. A. comosus mempunyai fertilitas yang rendah. Hal ini terlihat dari persentase ovule yang menghasilkan biji setelah penyerbukan, yaitu kurang dari 5 %. Pada kultivar Cayenne, Red Spanish, Singapore Spanish, Perola, dan Queen dihasilkan kurang dari dua biji/bunga, sedangkan pada genotipe yang mempunyai daun ‘piping’ dihasilkan 2-5 biji/bunga (Leal dan Coppens, 1996).
Buah nenas merupakan buah majemuk yang terbentuk dari gabungan 100 sampai 200 bunga, berbentuk silinder, dengan panjang buah sekitar 20.5 cm dengan diameter 14.5 cm dan beratnya sekitar 2.2 kg (Collins, 1960). Kulit buah keras dan kasar, saat menjelang panen, warna hijau buah mulai memudar. Soedibyo (1992) menyatakan bahwa diameter dan berat buah nenas semakin bertambah sejalan dengan pertambahan umurnya, sebaliknya untuk tekstur buah nenas, semakin tua umur buah maka teksturnya akan semakin lunak (Coronel dan Verheij, 1997).
Klasifikasi Nenas Klon GP-1
Nenas (Ananas comosus L. Merr) merupakan tanaman tahunan monokotil memiliki banyak macam dan jenis, namun yang bersifat komersil hanya Ananas comosus. Secara taksonomi Ananas comosus termasuk dalam Devisi Spermatophyta, Ordo Farinosae, Famili Bromeliaceae, Genus Ananas dan Spesies Ananas comosus.
Berdasarkan karakteristik tanaman dan buahnya, nenas dapat dikelompokkan dalam lima kelompok yaitu Cayenne, Queen, Spanish, Abacaxi dan Maipure (Nakasone & Paull, 1999). Pengelompokan tersebut berdasarkan pada ukuran tanaman, ukuran buah, warna dan rasa daging buah, serta pinggiran daun yang rata dan berduri (Nakasone & Paull 1999).
8
Nenas Smooth Cayenne klon GP-1 merupakan jenis yang sedang dikembangkan di Pusat Kajian Hortikultura Tropika. Klon GP-1 merupakan jenis nenas introduksi yang berpotensi untuk dikembangkan untuk tujuan konsumsi segar. Nenas klon GP-1 berasal dari negara Fhilipina (PKBT, 2009).
Sebagai genotipe unggul, varietas GP-1 mengakumulasi karakter unggul dari dua tipe nenas yaitu Smooth Cayenne dan Queen yang meliputi bobot buah 1.0-1.3 kg; PTT > 16%; mahkota buah tegak dan proporsional; warna daging buah kuning sampai jingga; daging buah renyah; hati kecil; umur simpan panjang; bentuk buah silindris; tidak berduri; dan responsif terhadap induksi pembungaan. Dalam rangka mempromosikan keunggulan tersebut maka perlu dilakukan kegiatan komersialisasi, perbanyakan bibit, uji lapang, pelepasan varietas, dan pengenalan pasar. Hal yang paling penting untuk mendukung itu semua adalah penyediaan bibit bemutu.
Nenas GP-1 memiliki deskripsi sebagai berikut : tinggi tanaman 80-100 cm, diameter tajuk 155 cm, jumlah daun 80, lebar daun 6-8 cm, panjang daun 95 cm, umur berbunga 15.0 BST (Bulan Sesudah Tanam), umur panen 18. BST (Bulan Sesudah Tanam), panjang tangkai buah 17 cm, diameter tangkai buah 3,50 cm, bobot buah 1386 gram, jumlah daun mahkota 95-98, lingkar tangkai buah 7.21, diamater buah tengah 11-13 cm, diamater hati 2-3 cm, kedalaman mata 0.8-0.9 cm, tingkat kemanisan14-19 brix, pH 3.5-4, total asam terlarut 1.3-1.5, tepi daun tidak berduri, warna buah matang kuning bercorak hijau dan warna daging buah kuning. (PKBT, 2009). Gambar nenas Smooth Cayenne Klon GP-1 dapat dilihat pada Gambar 1.
9
Syarat Tumbuh
Nenas secara alami merupakan tanaman yang tahan terhadap kekeringan karena nenas termasuk jenis tanaman CAM, yaitu tanaman yang membuka stomata pada malam hari untuk menyerap CO2 dan menutup stomata pada siang
hari. Hal ini akan mengurangi lajunya transpirasi. Nenas memerlukan sinar matahari yang cukup untuk pertumbuhan. Kondisi berawan pada musim hujan menyebabkan pertumbuhannya terhambat, buah menjadi kecil, kualitas buah menurun dan kadar gula menjadi berkurang. Sebaliknya bila sinar matahari terlalu banyak maka tanaman akan terbakar dan buah cepat masak. Intensitas rata-rata cahaya matahari pertahunnya yang baik untuk pertumbuhan nenas berkisar 33-71 % (Coronel dan Verheij, 1997).
Nenas dapat tumbuh pada berbagai jenis tanah. Nenas sering ditemukan di daerah tropis, terutama di tanah latosol coklat kemerahan atau merah. Tanaman ini memiliki sistem perakaran yang dangkal, sehingga memerlukan tanah yang memiliki sistem drainase dan aerase yang baik, seperti tanah berpasir dan banyak mengandung bahan organik. pH yang optimum untuk pertumbuhan nenas adalah 4.5-6.5. Sebaiknya nenas ditanam didaerah dengan pH di bawah 5.5 serta kandungan garamnya rendah (Pracaya, 1982).
Temperatur optimum untuk pertumbuhan nenas adalah 23oC sampai 32oC. Temperatur maksimum dan minimum adalah 30oC-20oC. Menurut Coronel & Verheij (1997) pada suhu dan kelembaban yang tinggi menyebabkan daun-daun tanaman menjadi lunak, buah menjadi besar dengan kandungan asam rendah dan pertumbuhan menjadi sangat rendah.
10
pada ketinggian 1.555 mdpl. Di Srilangka terdapat tanaman nenas yang ditanam pada daerah dengan ketinggian 1.221 mdpl. (Nakasone dan Paull, 1999)
Tanaman nenas dapat tumbuh di daerah dengan curah hujan 635 mm sampai dengan 2500 mm per tahun, namun curah hujan optimum untuk pertumbuhan dan perkembangannya adalah antara 1.000-1.500 mm per tahun. Daerah yang memiliki kelembaban tinggi baik untuk mencegah transpirasi yang terlalu besar, sehingga lahan di dekat pantai akan sangat mendukung pertumbuhan dan produksi nenas (Dinas Pertanian Tanaman Pangan, 1994).
Bahan Perbanyakan Nenas.
Tanaman nenas dapat diperbanyak dengan cara generatif maupun vegetatif. Teknik generatif jarang dilakukan dalam perbanyakan nenas dan biasanya dipergunakan di balai penelitian untuk memperoleh varietas baru melalui perkawinan silang. Hal ini dikarenakan perbanyakan dari biji membutuhkan waktu yang lama dan mempunyai keragaman yang tinggi (Tohir, 1981).
Stek adalah salah satu teknik pembiakan vegetatif yang dilakukan dengan cara melakukan pemisahan atau pemotongan bagian batang, akar atau daun dari pohon induknya. Perbanyakan yang dilakukan dengan cara stek akan terbentuk individu baru dengan genotipe sama dengan induknya (Hartmann et al. 1990). Dengan demikian di samping bertujuan untuk perbanyakan, teknik ini juga sangat membantu program pemuliaan tanaman yang bertujuan untuk mempertahankan sifat induknya.
Menurut Hartmann et al. (1990) perbanyakan dengan menggunakan stek mempunyai beberapa kelebihan antara lain : (1) bibit dapat diperoleh dalam jumlah besar dan waktu yang relatif singkat, (2) tanaman cukup homogen dan dapat dipilih dari bahan tanaman yang mempunyai kualitas tinggi yang diturunkan dari induknya, (3) membutuhkan bahan stek yang sedikit, (4) populasi tanaman yang dihasilkan relatif seragam, dan (5) mudah dan tidak memerlukan teknik yang rumit.
11
tangkai buah, (4) slips yaitu tunas yang tumbuh di dasar buah, perkembangan dari mata tunas pada tangkai buah, dan (5) mahkota yaitu tunas yang tumbuh di pucuk buah.
Metode perbanyakan in vivo, akhir-akhir ini banyak menggunakan stek batang (stem splitting) dan tunas basal daun mahkota (mahkota leaf budding). Menurut Hepton (2003) nenas memiliki banyak tunas vegetatif yang dapat dibagi untuk bahan perbanyakan stek batang dengan dua atau lebih mata tunas pada setiap bagiannya, termasuk batang mahkotanya. Potongan batang nenas dan basal daun mahkotanya berpotensi menghasilkan jumlah tunas yang lebih banyak dan menghasilkan bibit lebih banyak dalam setahun (Naibaho et al. 2008).
Metode perbanyakan stek basal daun (mahkota leaf budding) memiliki potensi menghasilkan bibit lebih banyak dan seragam. Teknik ini telah diperkenalkan dan banyak mengalami perubahan (Seow et al. 1970; Lee et al. 1978; Dass et al. 1984.). Setiap daun nenas memiliki tunas aksilar dorman yang melekat pada batang tanaman dan mahkota nenas. Tunas dorman yang ada disetiap basal daun tersebut berpotensi untuk mengasilkan mata tunas (bud) dan menjadi calon bibit (Py et al. 1984).
Zat Pengatur Tumbuh
Zat pengatur tumbuh (ZPT) adalah senyawa organik bukan nutrisi yang dalam konsentrasi rendah (< 1 µM) mendorong, menghambat atau secara kuantitatif dan kualitatif mengubah pertumbuhan dan perkembangan tanaman (Wattimena, 1988). Zat pengatur tumbuh terdiri dari golongan auksin, sitokinin, giberellin, ABA, polyamin dan oligosakarida. Pada umumnya zat pengatur tumbuh yang sering digunakan dalam kultur jaringan adalah dari golongan auksin dan sitokinin. Kedua zat ini berpengaruh dalam pembentukan akar, tunas dan kalus (Hartmann dan Kester, 1984).
12
tersebut dipelajari secara ekstensif karena merupakan faktor yang sangat mempengaruhi pertumbuhan dalam pengembangan tanaman.
Auksin digunakan secara luas dalam untuk merangsang pertumbuhan kalus, pemanjangan tunas dan pembentukan akar. Dalam konsentrasi rendah akan memacu akar adventif sedangkan konsentrasi tinggi mendorong terbentuknya kalus (Pierik, 1987). Auksin yang secara alami terdapat dalam tumbuhan adalah Indole-3-Acetic Acid (IAA). Selain itu auksin yang dibuat secara sintetik dan sering digunakan adalah Naphtalene Acetic Acid (NAA), Indole-4 Butiric Acid (IBA) dan 2,4 Dichlorophenoxy Acetic Acid (2,4-D). Pemilihan jenis auksin dan konsentrasinya ditentukan oleh tipe pertumbuhan, level auksin endogen, kemampuan jaringan dalam sintesis auksin dan zat pengatur tumbuh lain yang ditambahkan. Auksin NAA selang konsentrasi optimalnya sangat sempit untuk pertumbuhan yaitu aktif pada konsentrasi 0,001 – 10 mg/l, tetapi NAA memiliki sifat yang lebih tahan, tidak mudah terdegredasi dan lebih murah.
Sitokinin berperan dalam pengaturan pembelahan sel dan morfogenesis. Aktivitas utama sitokinin adalah mendorong pembelahan sel, menginduksi pertumbuhan tunas adventif dan dalam konsentrasi tinggi menghambat inisiasi akar (Pierik, 1987). Sitokinin juga dapat menghambat perombakan protein dan klorofil serta menghambat penuaan (senescence). Sitokinin yang biasa dipakai dalam kultur jaringan adalah 6-Benzilamino Purine (BAP), Benzil Adenin (BA), Kinetin, Zeatin dan 2 iP ( Wattimena dan Gunawan, 1988).
Efesiensi Ekonomis dan Teknis
13
kecil. Ide baru yang dapat dicoba dalam skala yang lebih kecil biasanya diadopsi lebih cepat daripada inovasi yang tidak dapat dicoba lebih dulu. (5) Mudah diamati ( observability), adalah status atau tingkat dimana inovasi dapat dengan mudah dilihat orang lain, sehingga akan mempercepat proses adopsinya. Jadi calon-calon pengadopsi lainnya tidak perlu lagi menjalani tahap-tahap percobaan, melainkan dapat terus ke tahap adopsi.
Analisis ekonomis dan efesiensi suatu kegiatan penelitian tidak terlepas dari lima ciri inovasi yang diungkapkan oleh teori Rogers (1970). Analisis ekonomi dapat juga dikatakan analisis efesiensi yang banyak digunakan untuk menilai suatu usaha layak atau tidak layak dilakukan. Salah satu metode analisis sederhana yang biasa dilakukan adalah analisis menggunakan B/C rasio. B/C ratio merupakan suatu rasio antara manfaat atau keuntungan terhadap biaya yang dikeluarkan.
Menurut Choiurul et al. (1988) efesiensi suatu usaha secara umum dirumuskan sebagai perbandingan antara output dan input. Out put adalah penerimaan (return) dalam ukuran fisik atau rupiah sedangkan in put adalah biaya (cost) yang digunakan untuk memperoleh hasil tersebut. Hasil nisbah penerimaan dan biaya inilah yang disebut sebagai indeks efesiensi usaha. Suatu usaha dikatakan telah efesien bila nilai B/C nya lebih besar atau sama dengan satu yang artinya bahwa penerimaan yang diperoleh telah mampu menutupi biaya yang dikeluarkan. Secara umum efesiensi usaha atau efesiensi ekonomis dapat dirumuskan sebagai berikut :
=
Dimana : Pj dan Pb : Harga jual dan Harga beli komoditi Qj dan Qb : Jumlah penjualan dan pembelian. Bu dan BO : Biaya umum dan Biaya operasional.
Disamping analisis ekonomis, juga dilakukan analisis Linear programming untuk mendapatkan optimasi dari perlakuan ZPT yang digunakan untuk mendapatkan nilai efesiensi teknis masing-masing perlakuan. Linear programming merupakan salah satu alat uji riset untuk tujuan optimasi suatu Efesiensi =
Penerimaan (B)
Biaya (C)
Pj . Qj
14
kasus tertentu (Reveliotis, 1997). Linear programing mempunyai karakterististik sebagai fungsi tujuan (objective function) dan kendala (constraint) yang berbentuk persamaan linear. Fungsi tujuan dapat berbentuk memaksimumkan atau meminimumkan tergantung tujuannya. Bila tujuannya adalah presepsi biaya maka optimasinya adalah meminimumkan sebaliknya jika keuntungan atau manfaat, maka optimasinya adalah memaksimumkan. (Miswanto & Winarno, 1993).
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilakukan di Rumah Plastik Kebun Penelitian Tajur dan
Laboratorium Kultur Jaringan dan Molekuler Pusat Kajian Hortikultura Tropika,
IPB. Penelitian ini berlangsung sejak Bulan Juli 2011 hingga Februari 2012.
Metode Penelitian
Penelitian terdiri atas tiga percobaan. Percobaan pertama adalah
mempelajari pengaruh sitokinin (BA) dan auksin (IBA) terhadap keberhasilan
produksi bibit dengan menggunakan eksplan stek basal daun asal batang.
Percobaan kedua adalah mempelajari pengaruh sitokinin (BA) dan auksin (IBA)
terhadap keberhasilan produksi bibit dengan menggunakan eksplan stek basal
daun asal mahkota. Percobaan ketiga adalah aplikasi sitokinin BA terhadap
berbagai ukuran mata tunas yang dihasilkan oleh stek basal daun asal mahkota
(mahkota). Bagan alir penelitian dapat dilihat pada Lampiran 1.
Percobaan I : Pengaruh Auksin dan Sitokinin terhadap Keberhasilan Stek Basal Daun Asal Batang.
Rancangan Percobaan
Percobaan pertama menggunakan Rancangan Acak Kelompok Lengkap
(RAKL) faktorial, dengan dua faktor. Faktor pertama adalah jenis zat pengatur
tumbuh auksin dengan tiga taraf konsentrasi dan faktor kedua adalah perlakuan
sitokinin dengan empat taraf konsentrasi. Taraf konsentrasi auksin IBA adalah 0
ppm, 25 ppm, 50 ppm sedangkan taraf konsentrasi sitokinin BA adalah 0 ppm, 25
ppm, 50 ppm, 75 ppm. Percobaan terdiri dari 12 kombinasi perlakuan. Tiap
kombinasi perlakuan diulang tiga kali, sehingga terdapat 36 satuan percobaan.
Setiap satu satuan percobaan terdiri dari 10 stek basal daun tanaman nenas.
Rancangan statistik menggunakan model aditif linear. Model aditif linier sebagai
16
Media tanam yang digunakan adalah arang sekam. Media arang sekam
terlebih dahulu dilembabkan atau dibasahi sampai pada kondisi kapasitas lapang.
Media tanam arang sekam diisi ke dalam bak persemaian yang terbuat dari
keranjang semai yang berlubang. Bagian dasar dan samping keranjang semai
dilapisi plastik mulsa agar media tidak tumpah. Ketebalan media tanam sekitar
10-12 cm. Media tanam yang sudah dibasahi dibiarkan selama dua hari agar air
meresap di seluruh pori-pori arang sekam sehingga kelembabannya merata.
Persiapan Bahan Tanam
Bahan tanam yang digunakan adalah potongan basal daun dari batang dan
mahkota nenas varietas Smooth Cayenne, klon GP-1. Sumber eksplan stek diperoleh dari Kebun Percobaan PKHT, Pasir Kuda, Bogor. Pada percobaan
pertama, tanaman induk nenas yang telah panen diambil dari lapang, kemudian
daunnya dipangkas hingga menyisahkan panjang daun 10-15 cm dengan
menggunakan golok yang tajam, lalu kotoran tanah yang melekat pada daun
dibersihkan dan selanjutnya dijadikan sebagai eksplan stek. Potongan basal daun
yang dijadikan eksplan stek adalah bagian daun yang berada pada bagian tengah
batang nenas. Bagian pucuk dan bawah (dasar) tidak digunakan.
Pada percobaan kedua, persiapan bahan dimulai dengan mengambil bahan
mahkota dari tanaman yang buahnya telah matang fisiologis di lapang. Setelah
diambil, dilakukan sterilisasi dengan cara merendam mahkota kedalam larutan
yang mengandung desinfektan selama 5 menit. Berbeda halnya dengan percobaan
pertama, daun asal mahkota tidak dipangkas karena daun mahkota ukurannya
tidak terlalu panjang. Potongan eksplan yang digunakan adalah bagian basal daun
mahkota dengan mengikut sertakan mata tunas dorman yang melekat disetiap
ketiak daun dan sedikit bagian meristem batangnya. Hal yang sama juga
dilakukan seperti pada percobaan pertama dimana bagian yang diambil adalah
17
dilakukan dengan menggunakan pisau (cutter) yang tajam supaya permukaan
potongan stek lebih rata.
Pembuatan Larutan Media ZPT.
Bahan auksin IBA dan sitokinin BA ditimbang sesuai dengan kebutuhan
dan taraf masing-masing perlakuan lalu dilarutkan ke dalam air aquades sampai
volume 1 Liter. Larutan diaduk dengan magnetic stirer sampai tercampur homogen kemudian dimasukkan dalam botol dan sebelum digunakan disimpan
dalam lemari pendingin(refrigerator).
Sterilisasi dan Perlakuan Auksin (IBA) dan Sitokinin (BA)
Potongan utuh batang nenas maupun mahkota direndam dalam larutan
bayclean yang mengandung klorox 5.25 % selama 10 menit, kemudian
dilanjutkan dengan pemotongan basal daun dan direndam kembali ke dalam
larutan desinfektan fungisida dengan dosis 2 g /l air untuk menghindari serangan
cendawan. Setelah perendaman dalam larutan desinektan, potongan stek dikering
anginkan selama 5 menit sebelum dilanjutkan dengan perendaman atau perlakuan
ZPT.
Perlakuan auksin IBA dan sitokinin BA dimulai dengan cara penyiapan
bak perendaman. Perendaman dimulai dengan cara memasukkan eksplan stek
yang sudah steril ke masing-masing bak perendaman yang sudah disediakan
sesuai konsentrasi perlakuan (12 kombinasi). Perlakuan yang diberikan terdiri dari
perlakuan tunggal dan kombinasi. Perlakuan kombinasi dilakukan dengan cara
perendaman dua kali. Perendaman pertama dilakukan selama 30 menit pada salah
satu jenis ZPT sesuai taraf konsentrasi yang dibutuhkan (perlakuan). Setelah itu,
eksplan stek dikering anginkan selama lima menit dan dilanjutkan kembali dengan
perendaman ZPT kombinasinya selama 30 menit sesuai taraf konsentrasi
perlakuan. Setelah perendaman ZPT terakhir, stek langsung ditanam ke media
tanam arang sekam.
Penyemaian/penanaman
Bahan stek yang sudah diberi perlakuan disemai ke dalam bak persemaian
18
kedalaman tanam sekitar 2 cm. Posisi tanam miring sekitar 30 derajat kearah
timur agar permukaan dauan mendapat cahaya yang merata.
Pemeliharaan.
Kegiatan pemeliharaan meliputi penyiraman, penyiangan gulma,
pengendalian hama dan penyakit. Penyiraman dilakukan 1-2 minggu sekali untuk
menjaga kelembaban media tanam agar tetap terjaga (stabil).
Pengamatan.
Pengamatan dilakukan 4-20 minggu setelah tanam (MST). Data diperoleh
dengan cara kualitatif dan kuantitatif. Secara kualitatif dilakukan dengan cara
mengamati secara visual gejala dan kejadian di lapang dan didokumentasikan
dengan kamera digital. Secara kwantitatif dilakukan dengan cara mengukur
langsung peubah agronomisnya. Peubah yang diukur adalah persentase stek
hidup, persentase stek berakar, persentase stek bertunas, persentase stek yang
menghasilkan 2-3 tunas per eksplan, panjang akar, tinggi tunas, waktu/kecepatan
bertunas, bobot kering akar (oven 600C selama 72 jam), bobot bibit, jumlah tunas
per eksplan, morfologi kalus/tunas, jumlah stek bernodul dan gejala serangan
hama dan penyakit. Disamping itu juga dilakukan pengukuran terhadap prestasi
kerja yaitu jumlah stek yang mampu diselesaikan oleh satu orang selama 7 jam
kerja, variabel input dan out put, suhu dan kelembaban mingguan serta analisis kandungan karbohidrat, nitrogen dan protein pada masing-masing potongan stek
asal batang dan mahkota secara komposit.
Percobaan II : Pengaruh Auksin dan Sitokinin terhadap Keberhasilan Stek Basal Daun Asal Mahkota.
Rancangan Percobaan dan Pelaksanaan
Umumnya metodologi percobaan kedua sama dengan percobaan pertama.
Bahan dan waktu pelaksanan berbeda, dimana pada percobaan kedua
menggunakan bahan stek asal daun mahkota dan dilakukan setelah dua minggu
percobaan pertama dimulai. Bahan eksplan stek asal daun mahkota tidak
dipangkas. Rancangan dan pengamatan pada percobaan ini mengacu pada
19
Percobaan III : Pengaruh Sitokinin BA terhadap Berbagai Ukuran Mata Tunas Asal Stek Basal Daun Mahkota
Rancangan Percobaan dan Pelaksanaan
Rancangan percobaan ketiga menggunakan model Rancangan Acak
Lengkap Faktorial (RAL) dengan dua faktor. Faktor pertama adalah konsentrasi
sitokinin BA tiga taraf yaitu 0, 25 dan 50 ppm dan fator kedua adalah tiga ukuran
mata tunas stek asal daun mahkota yaitu mata tunas kecil (mata tunas), tunas
sedang (tunas belum berdaun) dan mata tunas besar (tunas telah berdaun).
Masing-masing perlakuan diulang tiga kali sehingga diperoleh 27 satuan
percobaan. Setiap satuan percobaan terdiri dari 10 eksplan stek basal daun yang
telah bertunas.
Bahan eksplan stek yang digunakan adalah stek asal mahkota yang telah
bertunas atau berumur 3-4 MST. Stek dikelompokkan ke dalam tiga kategori
ukuran, yaitu tunas kecil, tunas sedang, dan tunas besar. Ukuran tinggi tunas kecil
memiliki rata-rata tinggi 0.2-0.5 cm, tunas sedang sekitar 0.6-1.0 cm dan ukuran
besar sekitar 1.2-1.5 cm.
Stek basal daun asal mahkota yang bertunas dicabut lalu dibersihkan dari
arang sekam yang menempel lalu direndam dengan fungisida selama 10 menit.
Setelah proses sterilisasi, stek dikeringanginkan kemudian dilanjutkan dengan
perendaman sitokinin BA selama 1 jam. Stek dibalut dengan kertas tissu sebelum
ditanam ke media persemaian. Jarak dan pola tanam sama dengan penelitian
pertama dan kedua. Pengamatan dilakukan setelah 4 MST. Peubah yang diukur
adalah persentase stek bernodul dan jumlah nodul yang dihasilkan tiap stek serta
pengamatan morfologi nodul.
Analisis Data
Analisis data dilakukan dengan uji F. Jika berbeda nyata maka dilakukan
HASIL DAN PEMBAHASAN
Kondisi Umum
Penelitian berlangsung mulai Bulan Juli 2011 hingga Februari 2012 di
Rumah Plastik Kebun Percobaan Tajur, Bogor. Kondisi suhu dan kelembaban
selama penelitian menunjukkan bahwa suhu rata-rata bulanan pada bulan Juli 2011
hingga Februari 2012 adalah 27-32 0C dan kelembaban rata-rata mingguan (RH)
sekitar 76-90 %. Selama penelitian berlangsung, jumlah hari hujan per bulan cukup
tinggi (20-24 hari) dengan curah hujan rata-rata per bulan 170-442 mm/bulan. Data
curah hujan dapat dilihat pada Lampiran 2.
Kondisi lingkungan yang sangat lembab dan ekstrim serta media yang
terlalu basah menyebabkan bahan setek yang ditanam banyak mengalami
pembusukan terutama pada bagian pangkal stek (basal stek). Kondisi lingkungan
yang lembab tersebut mempengaruhi proses fisiologi serta perkembangan stek basal
daun terutama ketika perakaran belum terbentuk. Menurut Rochimin dan Harjadi
(1973) berakarnya stek tergantung pada iklim mikro tempat penyetekan, medium
harus lembab tetapi tidak terlalu basah dan kelembaban nisbinya mendekati 100 %.
Media tanam yang terlalu basah dan kelembaban nisbih lebih dari 100 % diduga
menyebabkan pangkal setk mudah membusuk dan menggangu pembentukan
perakaran dan pembelahan sel serta menyebabkan cendawan mudah menyebar.
Frekwensi hari hujan dan kelembaban yang tinggi mendorong munculnya
cendawan dan mudah menyebar. Setelah berumur 2 MST, stek basal daun mulai
terlihat membusuk. Stek basal daun yang membusuk umumnya terserang cendawan
Phytopthora sp. Hal ini pernah terjadi pada penelitian Solihati (2010) pada jenis nenas Queen, dimana akibat cuaca ekstrim pada saat itu (kelembaban dan curah
hujan tinggi) eksplan yang ditanam pada media arang sekam mengalami busuk
pangkal hingga mencapai 80 %. Oleh karena itu, selama penelitian berlangsung
dilakukan pengendalian melalui penyemprotan fungisida Antracol 70 WP.
Fungisida Antracol ini mengandung bahan aktif Propineb 70 %. Konsentrasi yang
diberikan adalah 2 gr/ L air.
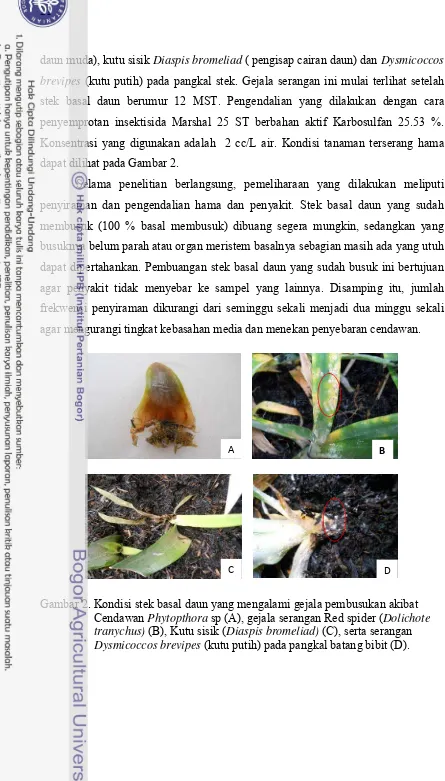
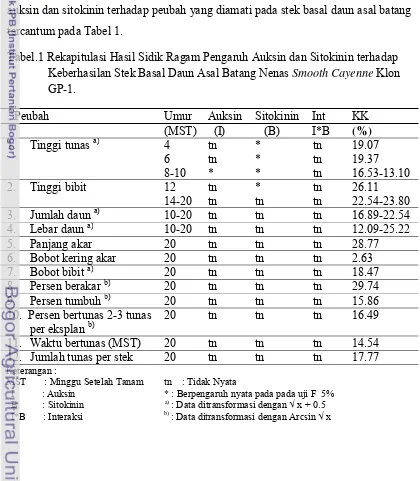
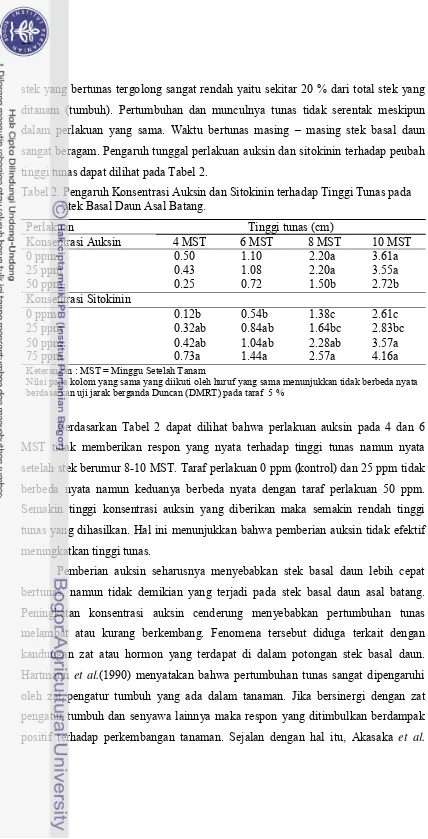
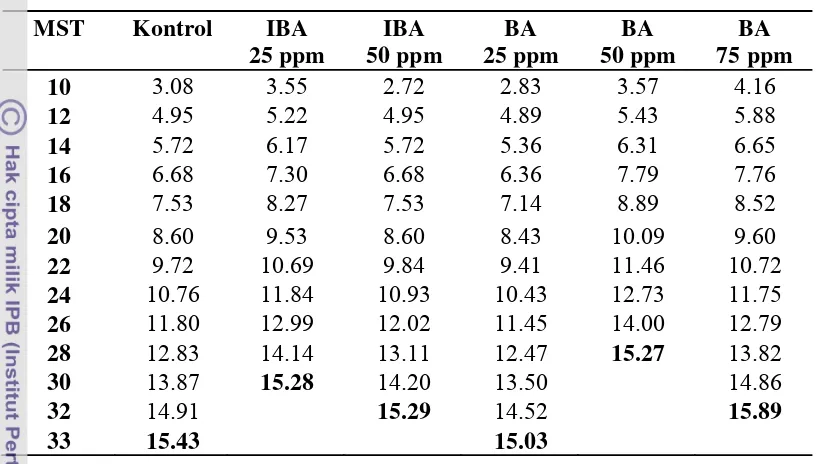
Selama penelitian berlangsung beberapa gejala serangan hama juga
21
daun muda), kutu sisik Diaspis bromeliad (pengisap cairan daun) dan Dysmicoccos brevipes (kutu putih) pada pangkal stek. Gejala serangan ini mulai terlihat setelah stek basal daun berumur 12 MST. Pengendalian yang dilakukan dengan cara
penyemprotan insektisida Marshal 25 ST berbahan aktif Karbosulfan 25.53 %.
Konsentrasi yang digunakan adalah 2 cc/L air. Kondisi tanaman terserang hama
dapat dilihat pada Gambar 2.
Selama penelitian berlangsung, pemeliharaan yang dilakukan meliputi
penyiraman dan pengendalian hama dan penyakit. Stek basal daun yang sudah
membusuk (100 % basal membusuk) dibuang segera mungkin, sedangkan yang
busuknya belum parah atau organ meristem basalnya sebagian masih ada yang utuh
dapat dipertahankan. Pembuangan stek basal daun yang sudah busuk ini bertujuan
agar penyakit tidak menyebar ke sampel yang lainnya. Disamping itu, jumlah
frekwensi penyiraman dikurangi dari seminggu sekali menjadi dua minggu sekali
agar mengurangi tingkat kebasahan media dan menekan penyebaran cendawan.
Gambar 2. Kondisi stek basal daun yang mengalami gejala pembusukan akibat Cendawan Phytopthora sp(A), gejala serangan Red spider (Dolichote tranychus) (B), Kutu sisik (Diaspis bromeliad) (C), serta serangan Dysmicoccos brevipes (kutu putih) pada pangkal batang bibit (D).
A
D
B
22
Pengaruh Auksin dan Sitokinin terhadap Keberhasilan Stek Basal Daun Asal Batang Nenas Smooth Cayenne
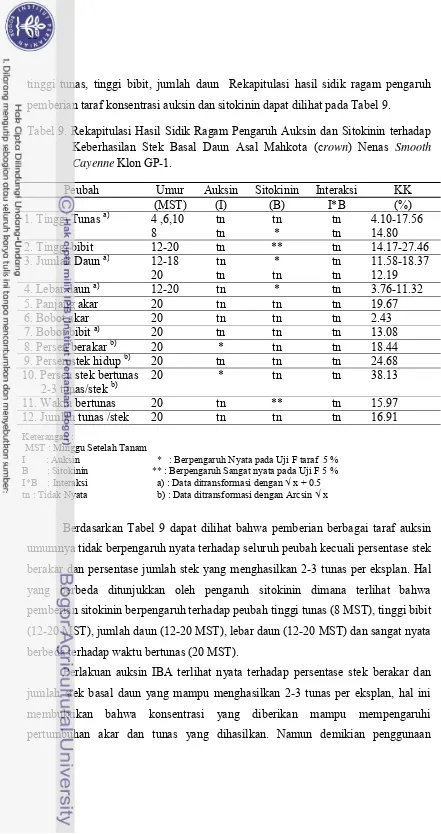
Berdasarkan analisis ragam diketahui bahwa interaksi antara perlakuan
auksin dan sitokinin terhadap stek basal daun asal batang tidak berpengaruh nyata
terhadap semua peubah yang diamati. Peubah yang diamati antara lain adalah tinggi
tunas, tinggi bibit, jumlah daun, lebar daun, panjang akar, bobot kering akar, bobot
bibit, persentase berakar, persentase tumbuh, persentase stek menghasilkan 2-3
tunas/eksplan, waktu bertunas serta jumlah tunas per stek. Hingga diakhir
pengamatan, pengaruh faktor tunggal auksin dan sitokinin hanya nyata terhadap
tinggi tunas Rekapitulasi hasil sidik ragam pengaruh pemberian berbagai taraf
auksin dan sitokinin terhadap peubah yang diamati pada stek basal daun asal batang
tercantum pada Tabel 1.
Tabel.1 Rekapitulasi Hasil Sidik Ragam Pengaruh Auksin dan Sitokinin terhadap Keberhasilan Stek Basal Daun Asal Batang Nenas Smooth Cayenne Klon GP-1.
23
Berdasarkan Tabel 1 dapat dilihat bahwa pemberian berbagai taraf auksin
umumnya tidak berpengaruh nyata terhadap seluruh peubah kecuali tinggi tunas.
Halnya yang sama diperlihatkan juga oleh perlakuan sitokinin yang juga hanya
berpengaruh nyata terhadap peubah tinggi tunas. Perlakuan auksin dan sitokinin
terlihat berbeda nyata terhadap tinggi tunas pada 8-10 MST. Hal ini menunjukkan
bahwa pemberian auksin hanya berpengaruh diawal fase pertumbuhan stek saja.
Secara umum, pemberian ZPT auksin dan sitokinin dengan berbagai
konsentrasi tidak mempengaruhi perkembangan stek basal daun asal batang.
Kurang efektifnya pengaruh perlakuan kedua ZPT tersebut diduga akibat
konsentrasi yang diberikan serta secara teknis belum tepat. Hal ini sesuai dengan
pendapat (Kusumo 1990) yang menyatakan bahwa auksin dan sitokinin aktif pada
berbagai konsentrasi dan jika tepat konsentrasi dan waktu pemberiannya maka akan
bermanfaat dan dapat berperan dalam merangsang pertumbuhan stek sejak awal
terbentuknya tunas.
Hal lain yang mungkin menyebabkan pemberian ZPT umumnya tidak
berpengaruh terhadap peubah yang diamati adalah akibat adanya kemungkinan
terjadinya interaksi antagonis antara ZPT yang diberikan dengan hormon yang
terdapat di dalam stek basal daun. Kejadian seperti ini sesuai dengan yang
dikemukakan oleh Lee (2002) dan Jones (2010) bahwa auksin dan sitokinin dapat
mengalami beberapa jenis interaksi yaitu interaksi yang bersifat antagonis maupun
sinergis. Disamping itu juga hormon endogen (hormone endogen) yang ada dalam
stek basal daun diduga sangat rendah sehingga hormon yang diberikan (hormon
eksogen) belum maksimal bekerja efektif dalam jaringan target.
Protein dapat berupa enzim–enzim yang berperan dalam pembelahan sel.
Ketersediannya di dalam sel akan menyebabkan proses pembelahan sel lebih efektif
(Catala et al. 2000). Rendahnya kandungan protein dalam stek basal daun asal batang juga diduga mempengaruhi tingkat keberhasilan dan perkembangan tunas.
Kandungan protein rata- rata bahan stek asal batang cukup rendah yaitu sekitar 0.61
% (w/w). Hartman et al. (1990) menyatakan bahwa dalam perbanyakan dan pertumbuhan tanaman terdapat lima faktor penting yang mempengaruhi yaitu
cahaya, air, suhu, gas, dan nutrisi. Lebih lanjut Ni’em (2000) yang menyatakan
24
dalam diantaranya adalah kondisi fisiologi stek, sterilisasi stek dan tehnik perlakuan
stek. Faktor luar antara lain adalah media perakaran, suhu, kelembaban, intensitas
cahaya, hormon pengatur tumbuh.
Berdasarkan pendapat Ni’em (2000), dapat diduga bahwa keberhasilan stek
basal daun asal batang sangat dipengaruhi oleh faktor dalam dan faktor luar. Faktor
dalamnya adalah keberadaan dan keseimbangan hormon yang terdapat dalam stek
(fitohormon) sedangkan faktor luarnya adalah, teknik perlakuan terutama proses
sterilisasi bahan dan media serta kelembaban media (kebasahan media).
Kondisi lingkungan dan keberadaan sumber penyakit yang terbawa sejak dari
lapang juga patut diduga mempengaruhi keberhasilan stek basal daun tersebut.
Berdasarkan pengamatan selama di lapang, tingginya curah hujan dan kelembaban
serta kondisi media yang masih jenuh air diawal penanaman menyebabkan
banyaknya stek yang busuk. Pembusukan ini disebabkan oleh cendawan dan bakteri
yang terbawa sejak dari lapang yang bersifat soil born.
Kontaminasi yang berasal dari lapangan (soil born) proses sterilisasinya sangat sulit terutama yang berada pada ruang antar sel. Biasanya bahan dari lapang
terutama yang dekat dengan permukaan tanah atau dalam tanah perlu sterilisasi
khusus. Tahap sterilisasi penting karena merupakan tahap mengeliminasi
mikroorganisme yang ada di luar jaringan tanaman maupun di dalam ruang antar
sel (Daisy et al. 1994). Jika menggunakan konsentrasi tinggi tidak hanya mikroorganime yang mati tetapi justru dapat mematikan sel tanaman itu sendiri.
Stek basal daun asal batang yang mati atau busuk ditandai dengan kondisi
basal stek menjadi lunak dan menghitam serta tidak ada tanda-tanda tunas tumbuh
dan berkembang. Warna potongan daun stek berubah coklat setelah 2 MST. Pada
awalnya kondisi seperti ini diduga merupakan gejala awal stek akan mati namun
setelah 6 MST tunas mulai muncul kepermukaan dan ternyata stek masih dapat
tumbuh dan bertunas meskipun umumnya tanpa akar. Hal ini diduga karena
aktivitas fisiologis tunas dorman yang ada pada ketiak basal daun masih aktif dan
mengandung cukup cadangan makanan.
Tinggi Tunas
Pengamatan tinggi tunas dilakukan sejak 4 MST hingga 10 MST karena
25
stek yang bertunas tergolong sangat rendah yaitu sekitar 20 % dari total stek yang
ditanam (tumbuh). Pertumbuhan dan munculnya tunas tidak serentak meskipun
dalam perlakuan yang sama. Waktu bertunas masing – masing stek basal daun
sangat beragam. Pengaruh tunggal perlakuan auksin dan sitokinin terhadap peubah
tinggi tunas dapat dilihat pada Tabel 2.
Tabel 2. Pengaruh Konsentrasi Auksin dan Sitokinin terhadap Tinggi Tunas pada Stek Basal Daun Asal Batang.
Perlakuan Tinggi tunas (cm)
Konsentrasi Auksin 4 MST 6 MST 8 MST 10 MST
Keterangan : MST = Minggu Setelah Tanam
Nilai pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT) pada taraf 5 %
Berdasarkan Tabel 2 dapat dilihat bahwa perlakuan auksin pada 4 dan 6
MST tidak memberikan respon yang nyata terhadap tinggi tunas namun nyata
setelah stek berumur 8-10 MST. Taraf perlakuan 0 ppm (kontrol) dan 25 ppm tidak
berbeda nyata namun keduanya berbeda nyata dengan taraf perlakuan 50 ppm.
Semakin tinggi konsentrasi auksin yang diberikan maka semakin rendah tinggi
tunas yang dihasilkan. Hal ini menunjukkan bahwa pemberian auksin tidak efektif
meningkatkan tinggi tunas.
Pemberian auksin seharusnya menyebabkan stek basal daun lebih cepat
bertunas, namun tidak demikian yang terjadi pada stek basal daun asal batang.
Peningkatan konsentrasi auksin cenderung menyebabkan pertumbuhan tunas
melambat atau kurang berkembang. Fenomena tersebut diduga terkait dengan
kandungan zat atau hormon yang terdapat di dalam potongan stek basal daun.
Hartmann et al.(1990) menyatakan bahwa pertumbuhan tunas sangat dipengaruhi oleh zat pengatur tumbuh yang ada dalam tanaman. Jika bersinergi dengan zat
pengatur tumbuh dan senyawa lainnya maka respon yang ditimbulkan berdampak
26
(2000) menyatakan bahwa penggunaan auksin dengan konsentrasi yang tinggi
secara in vitro dapat menghambat pemanjangan tunas, pembentukan akar serta menginduksi tunas tanpa meristem apikal pada peanut sehingga tunas yang terbentuk menyatu dengan saluran vaskuler yang tidak terorganisir dan akibatnya
pertumbuhan tunas melambat.
Berbeda halnya dengan pengaruh tunggal sitokinin, dimana semakin tinggi
taraf konsentrasi yang diberikan, semakin tinggi tunas yang dihasilkan. Tingginya
konsentrasi sitokinin menyebabkan proses biosintesis auksin pada mata tunas dapat
terpacu (Arteca, 2006). Pada 10 MST, terlihat bahwa pemberian sitokinin berbeda
nyata antara perlakuan kontrol (0 ppm) dengan 50 dan 75 ppm, sedangkan
perlakuan 25 ppm tidak nyata terhadap kontrol. Hal ini menunjukkan bahwa
pemberian sitokinin cukup efektif pada taraf konsentrasi 50 ppm meskipun
pemberian hingga 75 ppm masih menunjukkan trand yang terus meningkat. Hal ini mungkin terkait dengan pernyataan Jenick (1972) : Harman dan Kaster (1978),
yang mengatakan bahwa salah satu sifat sitokinin BA dalam aplikasinya adalah
memiliki kisaran konsentrasi yang lebar dibanding sitokinin lainnya sehingga lebih
aman dari kelebihan konsentrasi.
Fenomena di atas menunjukkan bahwa sitokinin berperan sebagai pengatur
positif bagi biosintesis auksin karena adanya kecenderungan bahwa sitokinin lebih
berpengaruh dibandingkan auksin (Jones et al. 2010). Lebih lanjut Dwidjoseputro (1990); Widianto (1988); Kusumo (1990), pendapat bahwa manfaat dari hormon
sangat tergantung dari dosis yang diberikan, jika dosisnya tepat akan membantu dan
menyebabkan sistem penunasan, pertumbuhan dan perakaran yang baik.
Tinggi Bibit
Pengamatan tinggi bibit dilakukan pada 12 hingga 20 MST. Berdasarkan
Tabel 3 dapat dilihat bahwa pemberian auksin tidak berpengaruh nyata terhadap
tinggi bibit pada 12 hingga 20 MST, namun perlakuan sitokinin hanya nyata pada
14 MST. Pengaruh perlakuan taraf sitokinin terhadap tinggi bibit semakin tidak
nyata seiring dengan bertambahnya umur bibit. Nilai rataan tinggi bibit dapat
27
Tabel 3. Pengaruh Konsentrasi Auksin dan Sitokinin terhadap Tinggi Bibit pada Stek Basal Daun Asal Batang.
Perlakuan Tinggi bibit (cm)
Konsentrasi Auksin 12 MST 14 MST 16 MST 18 MST 20 MST
Keterangan : MST = Minggu Setelah Tanam
Nilai pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT) pada taraf 5 %
Perlakuan taraf sitokinin hanya berpengaruh nyata pada 14 MST,
selanjutnya tidak nyata pada 16 MST hingga 20 MST. Pada 14 MST, perlakuan
sitokinin 75 ppm berbeda nyata dengan perlakuan kontrol dan 25 ppm tetapi tidak
nyata dengan perlakuan 50 ppm. Meskipun secara statistik perlakuan sitokinin tidak
nyata namun peningkatan konsentrasi sitokinin relatif meningkatkan tinggi bibit
dan hanya terlihat responnya diawal pertumbuhan bibit saja, termasuk pertumbuhan
tunas sebelumnya.
Dalam kaitannya dengan efisiensi waktu produksi, maka tinggi bibit
menjadi salah satu indikator penting karena berkaitan dengan waktu yang
dibutuhkan untuk menghasilkan bibit siap tanam. Tinggi bibit siap tanam adalah
bibit yang memiliki tinggi sekitar 15 cm. Sampai akhir pengamatan tinggi bibit
yang dihasilkan dari seluruh perlakuan belum menghasilkan atau bibit belum
mencapai tinggi 15 cm. Oleh karena itu, untuk mengetahui waktu yang dibutuhkan
untuk mencapai ukuran tersebut, maka dilakukan ekstrapolasi data tinggi bibit sejak
10 MST. Data tinggi bibit hasil ekstrapolasi masing- masing perlakuan dapat dilihat
pada Tabel 4.
Hasil percobaan ini menunjukkan bahwa waktu yang diperlukan untuk
mendapatkan kriteria tinggi bibit 15 cm berbeda setiap perlakuan. Waktu tercepat
adalah 28 MST dari perlakuan sitokinin BA 50 ppm dan terlama adalah 33 MST
28
ekstrapolasi ini menunjukkan bahwa pemberian sitokinin 50 ppm dibandingkan
kontrol dapat menghemat waktu produksi hingga enam minggu.
Tabel 4. Ekstrapolasi Tinggi Bibit Nenas Hasil Stek Basal Daun Asal Batang
MST Kontrol IBA
24 10.76 11.84 10.93 10.43 12.73 11.75
26 11.80 12.99 12.02 11.45 14.00 12.79
28 12.83 14.14 13.11 12.47 15.27 13.82
30 13.87 15.28 14.20 13.50 14.86
32 14.91 15.29 14.52 15.89
33 15.43 15.03
Jumlah daun
Waktu terbentuknya daun sempurna antar stek berbeda-beda meskipun
dalam perlakuan yang sama. Tingkat keragaman cukup tinggi sehingga pengamatan
dilakukan pada umur stek 10-20 MST karena pada umur stek 4-8 MST, sebagian
kuncup tunas belum membuka sempurna.
Tabel 5 menunjukkan bahwa perlakuan auksin tidak berpengaruh nyata
terhadap jumlah daun sejak 10 MST hingga 20 MST. Hal ini menunjukkan bahwa
auksin pada taraf tersebut tidak berperan dalam meningkatkan jumlah daun bibit.
Hingga akhir pengamatan, jumlah daun yang dihasilkan oleh bibit stek basal daun
asal batang hanya sekitar lima daun per tanaman sedangkan jumlah daun minimal
yang dibutuhkan untuk bibit yang siap tanam adalah delapan helai daun per
tanaman (PKBT, 2004). Hal ini menunjukkan bahwa jumlah daun yang dihasilkan
masih jauh dari yang diharapkan (standart mutu bibit siap tanam). Nilai rataan
29
Tabel 5. Pengaruh Konsentrasi Auksin terhadap Jumlah Daun pada Stek Basal Daun Asal Batang.
Perlakuan Jumlah daun
Konsentrasi Auksin 10 MST 12 MST 14 MST 16 MST 18 MST 20 MST
Keterangan : MST = Minggu Setelah Tanam
Nilai pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT) pada taraf 5 %
Perlakuan sitokinin antar konsentrasi yang diberikan tidak berbeda nyata.
Pemberian sitokinin tidak mampu meningkatkan jumlah daun pada bibit yang
dihasilkan stek basal daun asal batang. Sama halnya dengan penelitian Solihati
(2010) yang menunjukkan bahwa perlakuan sitokinin terhadap jumlah daun pada
stek basal daun pada nenas tipe Queen juga tidak nyata. Hal ini menunjukkan bahwa pertumbuhan bibit asal stek basal daun asal batang sangat lambat.
Pertumbuhannya dapat dikatakan lambat karena menurut Wee dan Thongtham
(1997) selama periode pertumbuhannya yang cepat tanaman nenas mampu
bertambah daunnya dengan kecepatan satu lembar daun per minggu atau 5-6 daun
per bulan (Nakasone dan Paull, 1998).
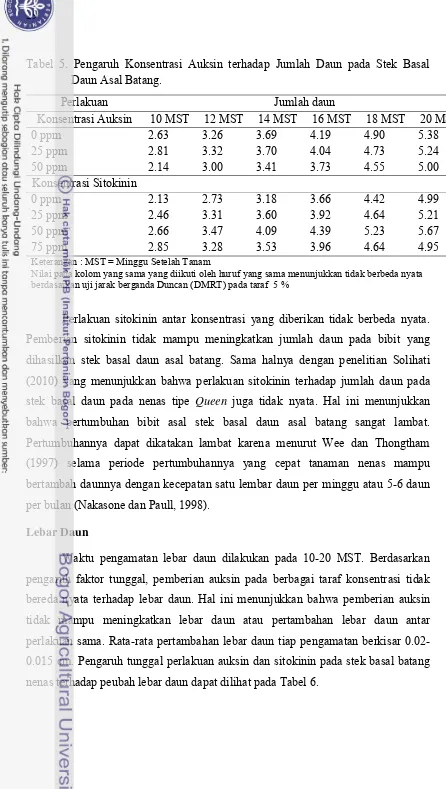
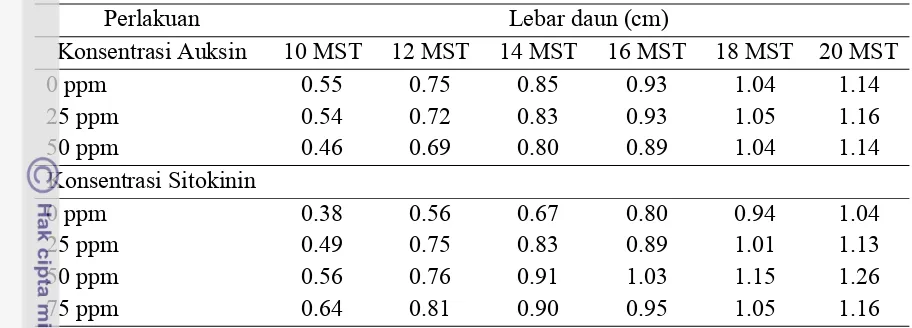
Lebar Daun
Waktu pengamatan lebar daun dilakukan pada 10-20 MST. Berdasarkan
pengaruh faktor tunggal, pemberian auksin pada berbagai taraf konsentrasi tidak
bereda nyata terhadap lebar daun. Hal ini menunjukkan bahwa pemberian auksin
tidak mampu meningkatkan lebar daun atau pertambahan lebar daun antar
perlakuan sama. Rata-rata pertambahan lebar daun tiap pengamatan berkisar
0.02-0.015 cm. Pengaruh tunggal perlakuan auksin dan sitokinin pada stek basal batang