ABSTRAK
ALVIN. Adsorptivitas berbagai perlakuan bentonit terhadap heksaklorobenzena
Dibimbing oleh HENNY PURWANINGSIH SUYUTI dan SRI SUGIARTI.
Dalam penelitian ini dikaji adsorptivitas bentonit terhadap senyawa
organoklorin, yaitu heksaklorobenzena. Berbagai perlakuan diberikan kepada
bentonit sebelum digunakan sebagai adsorben. Perlakuan yang diberikan adalah
perlakuan dengan asam dan pemanasan. Perlakuan yang memberikan kapasitas
adsorpsi dan efisiensi terbaik adalah perlakuan dengan menggunakan pemanasan
pada suhu 600 °C dilanjutkan dengan perlakuan asam H
2SO
430%. Waktu
adsorpsi optimum diperoleh pada 6 jam dengan bobot adsorben 0.5 g. Kajian atas
model isoterm adsorpsi menunjukkan bahwa adsorpsi heksaklorobenzena
menggunakan adsorben bentonit sesuai dengan isoterm Freundlich. Pada kondisi
yang sama adsorpsi heksaklorobenzena menggunakan bentonit menunjukkan
kapasitas dan efisiensi yang lebih baik daripada arang aktif komersial.
ABSTRACT
ALVIN. Adsorptivity various bentonite treatments to hexachlorobenzene.
Supervised by HENNY PURWANINGSIH SUYUTI and SRI SUGIARTI.
PENDAHULUAN
Penggunaan senyawa kimia berbahaya dalam industri membuat lingkungan semakin tercemar. Sistem pengelolaan limbah masih banyak yang belum memberikan hasil yang baik. Oleh sebab itu, diperlukan peningkatan kualitas dan efisiensi dalam penelitian lebih lanjut mengenai penanggulangan limbah, khususnya metode adsorpsi, agar memberikan hasil yang optimum.
Pestisida merupakan senyawa yang banyak digunakan dalam industri sehingga tingkat pencemarannya cukup tinggi. Penggunaan pestisida meningkat lebih dari 50 kali lipat sejak tahun 1950, dan sekarang sekitar 2.5 juta ton pestisida digunakan setiap tahunnya. Pestisida adalah bahan yang digunakan untuk mengendalikan, menolak, memikat, atau membasmi organisme pengganggu seperti serangga, tikus, gulma, burung, mamalia, ikan, atau mikroba (Sudarmo 1987).
Pestisida yang banyak digunakan adalah senyawaan organoklorin seperti heksakloro- benzena (HCB), heksakloroetana, klorofenol, asam 2,4-diklorofenoksiasetat (2,4-D), diklorodifeniltrikloroetana (DDT), dikofol, heptaklor, endosulfan, klordan, dan mireks. Organoklorin merupakan senyawa kimia yang mengandung karbon dan klorin. Kebanyakan organoklorin berbahaya karena tidak mudah rusak sehingga dapat tinggal di lingkungan dan tubuh untuk waktu yang relatif lama. Organoklorin dapat terkonsentrasi dalam rantai makanan sehingga hewan-hewan di bagian atas rantai makanan, seperti manusia lebih merasakan akibatnya (Frahmana 2010).
Pada bulan April 2005 terjadi 39 kasus penolakan produk makanan, terutama sayur-sayuran asal Indonesia oleh FAO karena mengandung bahan berbahaya yang dilarang. Kasus tersebut meningkat dibandingkan dengan bulan Januari 2005 dengan 15 kasus penolakan. Jenis bahan berbahaya yang digunakan dan menjadi perhatian antara lain mikrob, logam berat, dan residu pestisida. Upaya meningkatkan keamanan pangan produk pertanian, khususnya sayur-sayuran, telah dilakukan antara lain melalui program pengendalian hama terpadu (PHT). Pada PHT, tidak hanya dipertimbangkan tingkat produksi yang tinggi, tetapi juga kelestarian lingkungan dan keamanan pangan. Namun, upaya tersebut belum mampu memecahkan persoalan keamanan pangan karena adanya praktik produksi yang menyimpang seperti penggunaan senyawa kimia berbahaya (Winarti dan Miskiyah 2010).
Keberadaan senyawa organoklorin dalam lingkungan sangat membahayakan. Residu organoklorin pada manusia dapat menimbul- kan keracunan akut maupun kronis, karena sifat akumulatifnya terutama dalam lemak. Pemakaian pestisida organoklorin sebetulnya telah dilarang melalui Surat Keputusan Menteri Pertanian Nomor 434.1/Kpts/TP.270/7/2001 karena sifatnya yang persisten. Namun, hal ini masih sangat sulit dilaksanakan untuk negara berkembang dan sampai saat ini masih banyak ditemukan residunya. Salah satu alternatif untuk menanggulangi penggunaan organoklorin adalah dengan pengelolaan limbahnya.
Berbagai metode telah digunakan untuk mengatasi limbah organoklorin seperti koagulasi (cara kimia), yaitu penambahan zat agar terbentuk gumpalan (flok), adsorpsi menggunakan arang aktif (cara fisika), dan menggunakan bakteri (cara biologis). Kekurangan metode koagulasi adalah pembentukan lumpur dalam jumlah besar. Metode arang aktif cukup efektif karena memiliki daya serap yang tinggi, namun dibutuhkan biaya yang mahal (Manurung et al. 2004). Penggunaan adsorben merupakan metode alternatif dalam pengolahan limbah. Penelitian mengenai adsorpsi HCB dengan variasi adsorben telah banyak dilakukan. Dibandingkan dengan arang aktif, adsorben dari mineral liat memiliki kapasitas adsorpsi yang lebih baik (Krishna et al. 2001).
Dalam penelitian ini, digunakan bentonit sebagai adsorben. Adsorptivitas bentonit teraktivasi sebagai adsorben diukur terhadap organoklorin HCB. Penelitian ini diharapkan dapat menghasilkan adsorben alternatif bagi senyawa polutan organik persisten (POP).
TINJAUAN PUSTAKA
Bentonit
PENDAHULUAN
Penggunaan senyawa kimia berbahaya dalam industri membuat lingkungan semakin tercemar. Sistem pengelolaan limbah masih banyak yang belum memberikan hasil yang baik. Oleh sebab itu, diperlukan peningkatan kualitas dan efisiensi dalam penelitian lebih lanjut mengenai penanggulangan limbah, khususnya metode adsorpsi, agar memberikan hasil yang optimum.
Pestisida merupakan senyawa yang banyak digunakan dalam industri sehingga tingkat pencemarannya cukup tinggi. Penggunaan pestisida meningkat lebih dari 50 kali lipat sejak tahun 1950, dan sekarang sekitar 2.5 juta ton pestisida digunakan setiap tahunnya. Pestisida adalah bahan yang digunakan untuk mengendalikan, menolak, memikat, atau membasmi organisme pengganggu seperti serangga, tikus, gulma, burung, mamalia, ikan, atau mikroba (Sudarmo 1987).
Pestisida yang banyak digunakan adalah senyawaan organoklorin seperti heksakloro- benzena (HCB), heksakloroetana, klorofenol, asam 2,4-diklorofenoksiasetat (2,4-D), diklorodifeniltrikloroetana (DDT), dikofol, heptaklor, endosulfan, klordan, dan mireks. Organoklorin merupakan senyawa kimia yang mengandung karbon dan klorin. Kebanyakan organoklorin berbahaya karena tidak mudah rusak sehingga dapat tinggal di lingkungan dan tubuh untuk waktu yang relatif lama. Organoklorin dapat terkonsentrasi dalam rantai makanan sehingga hewan-hewan di bagian atas rantai makanan, seperti manusia lebih merasakan akibatnya (Frahmana 2010).
Pada bulan April 2005 terjadi 39 kasus penolakan produk makanan, terutama sayur-sayuran asal Indonesia oleh FAO karena mengandung bahan berbahaya yang dilarang. Kasus tersebut meningkat dibandingkan dengan bulan Januari 2005 dengan 15 kasus penolakan. Jenis bahan berbahaya yang digunakan dan menjadi perhatian antara lain mikrob, logam berat, dan residu pestisida. Upaya meningkatkan keamanan pangan produk pertanian, khususnya sayur-sayuran, telah dilakukan antara lain melalui program pengendalian hama terpadu (PHT). Pada PHT, tidak hanya dipertimbangkan tingkat produksi yang tinggi, tetapi juga kelestarian lingkungan dan keamanan pangan. Namun, upaya tersebut belum mampu memecahkan persoalan keamanan pangan karena adanya praktik produksi yang menyimpang seperti penggunaan senyawa kimia berbahaya (Winarti dan Miskiyah 2010).
Keberadaan senyawa organoklorin dalam lingkungan sangat membahayakan. Residu organoklorin pada manusia dapat menimbul- kan keracunan akut maupun kronis, karena sifat akumulatifnya terutama dalam lemak. Pemakaian pestisida organoklorin sebetulnya telah dilarang melalui Surat Keputusan Menteri Pertanian Nomor 434.1/Kpts/TP.270/7/2001 karena sifatnya yang persisten. Namun, hal ini masih sangat sulit dilaksanakan untuk negara berkembang dan sampai saat ini masih banyak ditemukan residunya. Salah satu alternatif untuk menanggulangi penggunaan organoklorin adalah dengan pengelolaan limbahnya.
Berbagai metode telah digunakan untuk mengatasi limbah organoklorin seperti koagulasi (cara kimia), yaitu penambahan zat agar terbentuk gumpalan (flok), adsorpsi menggunakan arang aktif (cara fisika), dan menggunakan bakteri (cara biologis). Kekurangan metode koagulasi adalah pembentukan lumpur dalam jumlah besar. Metode arang aktif cukup efektif karena memiliki daya serap yang tinggi, namun dibutuhkan biaya yang mahal (Manurung et al. 2004). Penggunaan adsorben merupakan metode alternatif dalam pengolahan limbah. Penelitian mengenai adsorpsi HCB dengan variasi adsorben telah banyak dilakukan. Dibandingkan dengan arang aktif, adsorben dari mineral liat memiliki kapasitas adsorpsi yang lebih baik (Krishna et al. 2001).
Dalam penelitian ini, digunakan bentonit sebagai adsorben. Adsorptivitas bentonit teraktivasi sebagai adsorben diukur terhadap organoklorin HCB. Penelitian ini diharapkan dapat menghasilkan adsorben alternatif bagi senyawa polutan organik persisten (POP).
TINJAUAN PUSTAKA
Bentonit
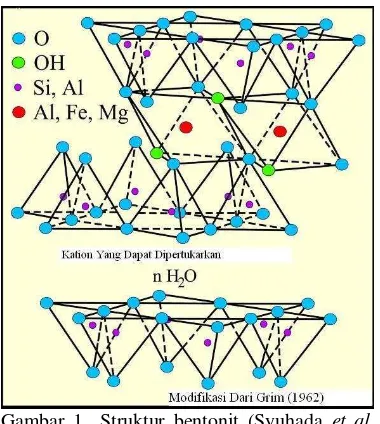
2 Gambar 1 Struktur bentonit (Syuhada et al.
2008).
Secara umum terdapat 2 jenis bentonit, yaitu natrium bentonit dan kalsium bentonit. Bentonit mengandung 85% montmorilonit dengan rumus kimia Al2O3∙4SiO2∙xH2O, yaitu senyawa silikat dan alumina yang mengikat air secara kimia. Kandungan lain bentonit adalah pengotor dari beberapa jenis mineral seperti kwarsa, ilit, kalsit, mika, dan klorit (Anonim 2005).
Natrium bentonit mengandung relatif lebih banyak ion Na+ dibandingkan dengan ion Ca2+ dan Mg2+. Bentonit ini dapat mengembang hingga 8−15 kali apabila dicelupkan ke dalam air dan tetap terdispersi beberapa waktu di dalam air. Posisi pertukaran ion terutama ditempati oleh ion natrium. Kalsium bentonit, di sisi lain, mengandung lebih banyak ion Ca2+ dan Mg 2+, kurang menyerap air, tetapi secara alamiah atau setelah diaktifkan dengan asam, menjadi adsorben yang baik dan tetap terdispersi dalam air. Nisbah kandungan Na dan Ca pada jenis bentonit ini cukup rendah. Posisi pertukaran ion lebih banyak diduduki oleh ion kalsium dan magnesium. Sifat-sifat bentonit umumnya lunak, plastis, sarang, berwarna pucat (putih, hijau muda, kelabu), kemudian berubah menjadi kuning, merah cokelat, serta hitam. Permukaannya licin, jika dimasukkan ke dalam air akan mengisap air (Syuhada et al. 2008).
Pestisida Organoklorin
Pestisida digunakan untuk mengendalikan dan mencegah gangguan organisme pengganggu atau hama. Pestisida dapat digolongkan menurut jasad sasarannya
menjadi insektisida, fungisida, herbisida, rodentisida, dan nematisida. Pestisida juga dapat digolongkan menurut asal dan sifat kimia, yaitu sintetik dan alam. Pestisida sintetik berasal dari bahan anorganik dan organik. Pestisida organik meliputi organo- klorin, heterosiklik, organofosfat, karbamat, dinitrofenol, tiosianat, sulfonat, dan lain-lain.
Pestisida dikatakan persisten jika dapat bertahan relatif lama pada bidang sasaran atau pada lingkungan setelah diaplikasikan. Senyawaan organoklorin tergolong sangat persisten. Senyawa ini dapat bertahan lama di lingkungan, tidak mudah disekresikan dari tubuh organisme, dan dapat berpindah dari organisme yang satu ke organisme lainnya melalui rantai makanan. Insektisida ini umumnya merupakan racun kontak dan racun perut yang efektif mengendalikan larva, nimfa, dan serangga dewasa. Organoklorin tidak mudah terurai, dan cenderung menumpuk pada jaringan lemak hewan. Insektisida organoklorin dibagi menjadi 3 golongan, yaitu DDT, senyawa siklodiena, dan terpena berklorin (Yu 2005).
Heksaklorobenzena
Heksaklorobenzena (HCB) (Gambar 2) adalah suatu padatan putih dengan kelarutan yang rendah dalam air, tetapi dapat larut dengan pelarut organik. HCB digunakan sebagian besar sebagai fungisida. Senyawa ini terbentuk sebagai hasil samping selama pembuatan bahan kimia yang mengandung klorin (Cudzilo et al. 2007). Sampai tahun 1965, HCB digunakan secara luas sebagai suatu pestisida, tetapi sekarang diketahui karsinogenik.
Gambar 2 Struktur heksaklorobenzena.
3 tahun. Jika dilepaskan ke air tanah, maka
umur paruhnya adalah 5.3−11.4 tahun. HCB merupakan buangan dalam produksi beberapa hidrokarbon berklorin seperti tetrakloroetilena, trikloroetilena, dan karbon tetraklorida, serta menjadi zat pencemar dalam beberapa pestisida seperti pentakloronitrobenzena dan pentaklorofenol. HCB stabil dan tahan terhadap biodegradasi. Ketika dipanaskan untuk pembusukan, senyawa ini memancarkan uap klorida beracun (ATDSR 2002).
Adsorpsi
Adsorpsi merupakan peristiwa terakumulasinya partikel pada suatu permukaan (Atkins 1999). Adsorpsi biasanya terjadi pada dinding-dinding pori atau pada tapak tertentu dalam partikel (McCabe et al.
2001). Istilah adsorbat dan adsorben digunakan dalam adsorpsi. Adsorbat adalah zat yang terjerap atau yang akan dipisahkan dari pelarutnya, sedangkan adsorben adalah medium penjerap.
Dalam proses adsorpsi, molekul meninggalkan larutan dan menempel pada permukaan adsorben. Proses ini terbagi menjadi 4 tahap, yaitu transfer molekul-molekul zat terlarut yang teradsorpsi menuju lapisan film yang mengelilingi adsorben, difusi zat terlarut yang teradsorpsi melalui lapisan film (film diffusion process) tersebut, difusi zat terlarut yang teradsopsi melalui kapiler/pori dalam adsorben (pore diffusion process), dan adsorpsi zat terlarut yang teradsorpsi pada dinding pori atau permukaan adsorben.
Mekanisme adsorpsi dapat dibedakan menjadi 2, yaitu adsorpsi secara fisika (fisisorpsi) dan secara kimia (kemisorpsi). Pada proses fisisorpsi, adsorbat diikat oleh adsorben dengan gaya-gaya van der Waals, sedangkan pada proses kemisorpsi, interaksi adsorbat dengan adsorben terjadi melalui pembentukan ikatan kimia. Kemisorpsi terjadi diawali dengan fisisorpsi, yaitu partikel-partikel adsorbat mendekat ke permukaan adsorben melalui gaya van der Waals atau ikatan hidrogen. Kemisorpsi baru terjadi setelah itu (Atkins 1999).
Pemilihan adsorben memengaruhi proses adsorpsi. Faktor yang berpengaruh meliputi luas permukaan adsorben, ukuran partikel, waktu kontak, dan distribusi ukuran pori. Kebanyakan adsorben merupakan bahan yang sangat berpori dan adsorpsi berlangsung terutama pada dinding-dinding pori atau
tapak-tapak tertentu di dalam partikel tersebut. Pemisahan dapat terjadi karena perbedaan bobot molekul atau polaritas yang menyebabkan suatu molekul melekat pada permukaan lebih erat daripada molekul-molekul lainnya (Alberty dan Silbey 1992).
Adsorpsi juga dipengaruhi oleh sifat fisika dan kimia adsorbat, seperti ukuran molekul, polaritas molekul, komposisi kimia, konsentrasi adsorbat dalam fase cair, dan sifat fase cair, serta oleh lamanya proses adsorpsi (Bird 1993). Semakin kecil ukuran partikel, semakin besar luas permukaan padatan per satuan volume tertentu sehingga akan semakin banyak zat yang diadsorpsi (Atkins 1999). Adsorben yang baik memiliki kapasitas adsorpsi dan persentase efisiensi adsorpsi yang tinggi. Kapasitas adsorpsi dapat dihitung dengan menggunakan rumus
Q = V(Co –C)/m
Efisiensi adsorpsi dapat dihitung dengan mengunakan rumus
Efisiensi adsorpsi (%) = ((Co –C)/Co) × 100% Keterangan:
Q = kapasitas adsorpsi (mg/g)
V = volume larutan (L)
Co = konsentrasi awal (mg/L)
C = konsentrasi akhir (mg/L)
m = massa (g)
Isoterm Adsorpsi
Isoterm adsorpsi menunjukkan hubungan kesetimbangan antara konsentrasi adsorbat dalam fluida dan pada permukaan adsorben, pada suhu tetap. Kesetimbangan terjadi saat laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya. Dalam istilah termodinamika, ini berarti potensial kimia antara adsorbat di fase fluida dan yang terikat di adsorben telah sama besar. Kesetimbangan mungkin, tetapi tidak harus, terjadi saat adsorben mencapai kapasitas adsorpsi.
4
Isoterm Adsorpsi Langmuir
Isoterm Langmuir berlangsung secara kemisorpsi satu lapisan. Kemisorpsi adalah adsorpsi yang terjadi melalui ikatan kimia sangat kuat antara tapak aktif permukaan dan molekul adsorbat dan dipengaruhi oleh densitas elektron. Adsorpsi satu lapisan, biasanya bersifat spesifik. Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoretis dengan menganggap terjadi kesetimbangan antara molekul-molekul zat yang diadsorpsi pada permukaan adsorben dan yang tidak teradsorpsi sebagai berikut:
x/m = αβ/(1+βC)
Tetapan α dan β dapat ditemukan dari kurva hubungan C/(x/m) terhadap C dengan persamaan
C/(x/m) = 1/(αβ) + C/α Keterangan:
x/m = massa adsorbat yang teradsorpsi per g adsorben
C = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm)
α,β = tetapan empiris
Isoterm Adsorpsi Freundlich
Isoterm Freundlich terjadi secara fisisorpsi banyak lapisan. Fisisorpsi adalah adsorpsi yang hanya melibatkan gaya antarmolekul dan ikatannya lemah. Persamaan isoterm adsorpsi Freundlich didasarkan atas terbentuknya lapisan tunggal molekul-molekul adsorbat pada permukaan adsorben. Namun, tapak-tapak aktif pada permukaan adsorben bersifat heterogen. Menurut Atkins (1999), isoterm Freundlich diterapkan pada proses adsorpsi zat terlarut ke permukaan padatan. Persamaan diturunkan secara empiris dengan bentuk sebagai berikut:
x/m = kC1/n
Apabila dilogaritmakan, persamaan tersebut menjadi
log(x/m) = log k + (log C)/n
Keterangan:
x/m = massa adsorbat yang teradsorpsi per gram adsorben
C = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm)
k,n = tetapan empiris
BAHAN DAN METODE
Bahan dan Alat
Alat-alat yang digunakan dalam penelitian ini terdiri atas peralatan kaca, sudip, cawan porselen, oven, neraca analitik, tanur,
desikator, pengaduk magnetik, kertas saring, mortar, ayakan, dan spektrofotometer UV-Visible Shimadzu tipe 1700. Bahan-bahan yang digunakan adalah bentonit dari PT. Sud Chemie, Jawa Barat, HCB, heksana, asam sulfat pekat (98%), padatan barium klorida, dan air distilasi.
Metode
Penelitian terdiri atas 5 tahapan (Lampiran 1), meliputi preparasi bentonit dan larutan HCB (pembuatan standar) (Lampiran 2), aktivasi bentonit, penentuan kondisi optimum dari berbagai perlakuan bentonit, penentuan waktu kontak optimum dan bobot adsorben optimum, serta penentuan tipe isoterm adsorpsi HCB.
Perlakuan Awal Bentonit
Bentonit yang masih dalam bentuk bongkahan dihancurkan hingga halus kemudian diayak (200 mesh) sehingga didapat serbuk bentonit. Serbuk bentonit dicuci dengan air distilasi dan dikeringkan pada suhu 105 °C selama 3 jam di dalam oven.
Preparasi Larutan HCB (Kommalapati 1997)
Sebanyak 0.05 g HCB dilarutkan dengan heksana dan ditera dalam labu takar 50 mL (larutan stok 1000 ppm). Dari larutan stok diambil masing-masing 1 mL (20 ppm), 2 mL (40 ppm), 3 mL (60 ppm), 4 mL (80 ppm), dan 5 mL (100 ppm) kemudian masing-masing ditera dalam labu takar 50 mL. Absorbans maksimum diukur menggunakan spektrofotometer UV-Vis pada panjang gelombang maksimum, yaitu 251 nm. Dari tahap ini didapat standar untuk penentuan konsentrasi selanjutnya.
Aktivasi Bentonit
Cara Pemanasan.Sebanyak 20 g bentonit dimasukkan ke dalam cawan porselen lalu dikalsinasi dalam tanur pada suhu 600 °C selama 3 jam. Bentonit disimpan dalam desikator untuk digunakan pada tahap selanjutnya.
4
Isoterm Adsorpsi Langmuir
Isoterm Langmuir berlangsung secara kemisorpsi satu lapisan. Kemisorpsi adalah adsorpsi yang terjadi melalui ikatan kimia sangat kuat antara tapak aktif permukaan dan molekul adsorbat dan dipengaruhi oleh densitas elektron. Adsorpsi satu lapisan, biasanya bersifat spesifik. Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoretis dengan menganggap terjadi kesetimbangan antara molekul-molekul zat yang diadsorpsi pada permukaan adsorben dan yang tidak teradsorpsi sebagai berikut:
x/m = αβ/(1+βC)
Tetapan α dan β dapat ditemukan dari kurva hubungan C/(x/m) terhadap C dengan persamaan
C/(x/m) = 1/(αβ) + C/α Keterangan:
x/m = massa adsorbat yang teradsorpsi per g adsorben
C = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm)
α,β = tetapan empiris
Isoterm Adsorpsi Freundlich
Isoterm Freundlich terjadi secara fisisorpsi banyak lapisan. Fisisorpsi adalah adsorpsi yang hanya melibatkan gaya antarmolekul dan ikatannya lemah. Persamaan isoterm adsorpsi Freundlich didasarkan atas terbentuknya lapisan tunggal molekul-molekul adsorbat pada permukaan adsorben. Namun, tapak-tapak aktif pada permukaan adsorben bersifat heterogen. Menurut Atkins (1999), isoterm Freundlich diterapkan pada proses adsorpsi zat terlarut ke permukaan padatan. Persamaan diturunkan secara empiris dengan bentuk sebagai berikut:
x/m = kC1/n
Apabila dilogaritmakan, persamaan tersebut menjadi
log(x/m) = log k + (log C)/n
Keterangan:
x/m = massa adsorbat yang teradsorpsi per gram adsorben
C = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm)
k,n = tetapan empiris
BAHAN DAN METODE
Bahan dan Alat
Alat-alat yang digunakan dalam penelitian ini terdiri atas peralatan kaca, sudip, cawan porselen, oven, neraca analitik, tanur,
desikator, pengaduk magnetik, kertas saring, mortar, ayakan, dan spektrofotometer UV-Visible Shimadzu tipe 1700. Bahan-bahan yang digunakan adalah bentonit dari PT. Sud Chemie, Jawa Barat, HCB, heksana, asam sulfat pekat (98%), padatan barium klorida, dan air distilasi.
Metode
Penelitian terdiri atas 5 tahapan (Lampiran 1), meliputi preparasi bentonit dan larutan HCB (pembuatan standar) (Lampiran 2), aktivasi bentonit, penentuan kondisi optimum dari berbagai perlakuan bentonit, penentuan waktu kontak optimum dan bobot adsorben optimum, serta penentuan tipe isoterm adsorpsi HCB.
Perlakuan Awal Bentonit
Bentonit yang masih dalam bentuk bongkahan dihancurkan hingga halus kemudian diayak (200 mesh) sehingga didapat serbuk bentonit. Serbuk bentonit dicuci dengan air distilasi dan dikeringkan pada suhu 105 °C selama 3 jam di dalam oven.
Preparasi Larutan HCB (Kommalapati 1997)
Sebanyak 0.05 g HCB dilarutkan dengan heksana dan ditera dalam labu takar 50 mL (larutan stok 1000 ppm). Dari larutan stok diambil masing-masing 1 mL (20 ppm), 2 mL (40 ppm), 3 mL (60 ppm), 4 mL (80 ppm), dan 5 mL (100 ppm) kemudian masing-masing ditera dalam labu takar 50 mL. Absorbans maksimum diukur menggunakan spektrofotometer UV-Vis pada panjang gelombang maksimum, yaitu 251 nm. Dari tahap ini didapat standar untuk penentuan konsentrasi selanjutnya.
Aktivasi Bentonit
Cara Pemanasan.Sebanyak 20 g bentonit dimasukkan ke dalam cawan porselen lalu dikalsinasi dalam tanur pada suhu 600 °C selama 3 jam. Bentonit disimpan dalam desikator untuk digunakan pada tahap selanjutnya.
5 direfluks selama 2 jam. Setelah didinginkan,
campuran disaring dengan vakum sehingga dihasilkan residu padat. Residu berulang kali dicuci dengan air distilasi sampai bebas ion SO42- dengan mendeteksi filtratnya dengan larutan barium klorida. Terakhir residu dikeringkan dalam oven pada suhu 105 °C selama 3 jam.
Dari tahap ini didapat 11 perlakuan berbeda, yaitu
A. Aktivasi dengan asam sulfat 10% selama 2 jam tanpa pemanasan
B. Aktivasi dengan asam sulfat 10% selama 4 jam tanpa pemanasan
C. Aktivasi dengan asam sulfat 10% selama 6 jam tanpa pemanasan
D. Aktivasi dengan asam sulfat 20% selama 2 jam tanpa pemanasan
E. Aktivasi dengan asam sulfat 20% selama 4 jam tanpa pemanasan
F. Aktivasi dengan asam sulfat 20% selama 6 jam tanpa pemanasan
G. Aktivasi dengan asam sulfat 30% selama 2 jam tanpa pemanasan
H. Aktivasi dengan asam sulfat 30% selama 4 jam tanpa pemanasan
I. Aktivasi dengan asam sulfat 30% selama 6 jam tanpa pemanasan
J. Dipanaskan dengan suhu 600 °C
K. Dipanaskan dengan suhu 600 °C dilanjutkan aktivasi dengan asam sulfat 30% selama 2 jam
Penentuan Perlakuan Optimum
Dari larutan stok HCB 1000 ppm, diambil sebanyak 3 mL (60 ppm) kemudian ditera dalam labu takar 50 mL menggunakan heksana. Larutan diukur absorbansnya menggunakan spektrofotometer UV-Vis pada panjang gelombang 251 nm sebagai absorbans awal. Masing-masing bentonit dengan perlakuan berbeda ditimbang sebanyak 0.5 g, lalu dimasukkan ke dalam botol kecil. Larutan yang telah dibuat dimasukkan ke dalamnya lalu dikocok selama 6 jam. Campuran lalu didekantasi, larutan jernihnya diukur menggunakan spektrofotometer UV-Vis pada panjang gelombang 251 nm sebagai absorbans akhir. Dari tahap ini didapat satu perlakuan optimum yang memiliki kapasitas adsorpsi terbesar.
Penentuan Waktu Optimum Adsorpsi
Sebanyak 0.5 g bentonit K (perlakuan optimum) dimasukkan ke dalam 50 mL larutan HCB 60 ppm, kemudian dikocok dengan variasi waktu adsorpsi 2, 4, 6, dan 8 jam. Setelah itu, campuran didekantasi dan
larutan jernihnya diukur pada panjang gelombang 251 nm.
Penentuan Bobot Optimum Bentonit
Variasi bobot yang digunakan adalah 0.25, 0.5, 1.0, dan 2.0 g. Masing-masing dimasukkan ke dalam 50 mL larutan HCB 60 ppm, kemudian dikocok selama waktu optimum. Setelah itu, campuran didekantasi dan larutan jernihnya diukur pada panjang gelombang 251 nm.
Penentuan Isoterm Adsorpsi HCB (Sennour et al. 2008)
Sebanyak 0.5 g bentonit K ditambahkan dengan 50 mL larutan HCB pada berbagai konsentrasi, yaitu 20, 40, 60, 80, dan 100 ppm. Kemudian campuran dikocok selama 6 jam. Setelah itu, campuran didekantasi dan larutan jernihnya diukur pada panjang gelombang 251 nm. Dengan membuat pola regresi linear isoterm Langmuir dan isoterm Freundlich, tipe isoterm adsorpsi dapat ditentukan.
HASIL DAN PEMBAHASAN
Bentonit yang digunakan diberi berbagai perlakuan berbeda, yaitu diaktivasi dengan asam (H2SO4) dengan variasi konsentrasi dan waktu, perlakuan suhu tinggi (600 °C), dan perlakuan gabungan dari keduanya. Penghalusan bentonit pada perlakuan awal bertujuan memperluas permukaan adsorben sehingga diharapkan akan lebih banyak adsorbat yang terjerap. Pencucian bentonit menggunakan air distilasi bertujuan agar bentonit bebas dari kotoran khususnya pada permukaan adsorben bersih sehingga tidak ada ion-ion pengganggu dalam proses adsorpsi.
5 direfluks selama 2 jam. Setelah didinginkan,
campuran disaring dengan vakum sehingga dihasilkan residu padat. Residu berulang kali dicuci dengan air distilasi sampai bebas ion SO42- dengan mendeteksi filtratnya dengan larutan barium klorida. Terakhir residu dikeringkan dalam oven pada suhu 105 °C selama 3 jam.
Dari tahap ini didapat 11 perlakuan berbeda, yaitu
A. Aktivasi dengan asam sulfat 10% selama 2 jam tanpa pemanasan
B. Aktivasi dengan asam sulfat 10% selama 4 jam tanpa pemanasan
C. Aktivasi dengan asam sulfat 10% selama 6 jam tanpa pemanasan
D. Aktivasi dengan asam sulfat 20% selama 2 jam tanpa pemanasan
E. Aktivasi dengan asam sulfat 20% selama 4 jam tanpa pemanasan
F. Aktivasi dengan asam sulfat 20% selama 6 jam tanpa pemanasan
G. Aktivasi dengan asam sulfat 30% selama 2 jam tanpa pemanasan
H. Aktivasi dengan asam sulfat 30% selama 4 jam tanpa pemanasan
I. Aktivasi dengan asam sulfat 30% selama 6 jam tanpa pemanasan
J. Dipanaskan dengan suhu 600 °C
K. Dipanaskan dengan suhu 600 °C dilanjutkan aktivasi dengan asam sulfat 30% selama 2 jam
Penentuan Perlakuan Optimum
Dari larutan stok HCB 1000 ppm, diambil sebanyak 3 mL (60 ppm) kemudian ditera dalam labu takar 50 mL menggunakan heksana. Larutan diukur absorbansnya menggunakan spektrofotometer UV-Vis pada panjang gelombang 251 nm sebagai absorbans awal. Masing-masing bentonit dengan perlakuan berbeda ditimbang sebanyak 0.5 g, lalu dimasukkan ke dalam botol kecil. Larutan yang telah dibuat dimasukkan ke dalamnya lalu dikocok selama 6 jam. Campuran lalu didekantasi, larutan jernihnya diukur menggunakan spektrofotometer UV-Vis pada panjang gelombang 251 nm sebagai absorbans akhir. Dari tahap ini didapat satu perlakuan optimum yang memiliki kapasitas adsorpsi terbesar.
Penentuan Waktu Optimum Adsorpsi
Sebanyak 0.5 g bentonit K (perlakuan optimum) dimasukkan ke dalam 50 mL larutan HCB 60 ppm, kemudian dikocok dengan variasi waktu adsorpsi 2, 4, 6, dan 8 jam. Setelah itu, campuran didekantasi dan
larutan jernihnya diukur pada panjang gelombang 251 nm.
Penentuan Bobot Optimum Bentonit
Variasi bobot yang digunakan adalah 0.25, 0.5, 1.0, dan 2.0 g. Masing-masing dimasukkan ke dalam 50 mL larutan HCB 60 ppm, kemudian dikocok selama waktu optimum. Setelah itu, campuran didekantasi dan larutan jernihnya diukur pada panjang gelombang 251 nm.
Penentuan Isoterm Adsorpsi HCB (Sennour et al. 2008)
Sebanyak 0.5 g bentonit K ditambahkan dengan 50 mL larutan HCB pada berbagai konsentrasi, yaitu 20, 40, 60, 80, dan 100 ppm. Kemudian campuran dikocok selama 6 jam. Setelah itu, campuran didekantasi dan larutan jernihnya diukur pada panjang gelombang 251 nm. Dengan membuat pola regresi linear isoterm Langmuir dan isoterm Freundlich, tipe isoterm adsorpsi dapat ditentukan.
HASIL DAN PEMBAHASAN
Bentonit yang digunakan diberi berbagai perlakuan berbeda, yaitu diaktivasi dengan asam (H2SO4) dengan variasi konsentrasi dan waktu, perlakuan suhu tinggi (600 °C), dan perlakuan gabungan dari keduanya. Penghalusan bentonit pada perlakuan awal bertujuan memperluas permukaan adsorben sehingga diharapkan akan lebih banyak adsorbat yang terjerap. Pencucian bentonit menggunakan air distilasi bertujuan agar bentonit bebas dari kotoran khususnya pada permukaan adsorben bersih sehingga tidak ada ion-ion pengganggu dalam proses adsorpsi.
6 yang lebih besar sehingga kemampuan
adsorpsinya lebih tinggi dibandingkan dengan sebelum diaktivasi (Komadel 2003).
Menurut Purwaningsih (2002), reaksi yang terjadi pada saat kaolin diaktivasi dengan asam adalah sebagai berikut:
Al2O3∙2SiO2∙2H2O + 3H2SO4 →
Al2(SO4)3 + 2SiO2 + 5H2O Pemanasan pada suhu tinggi membuat tapak aktif adsorben menjadi aktif. Pada suhu ini, ikatan antara Si dan Al diharapkan lebih mudah dipisahkan sehingga gabungan aktivasi pemanasan suhu tinggi dengan kimia akan melarutkan aluminium oksida dan meninggalkan residu SiO2. Berdasarkan reaksi diatas, reaksi aktivasi bentonit oleh asam, diduga sebagai berikut:
Al2O3∙4SiO2∙2H2O + 3H2SO4 →
Al2(SO4)3 + 4SiO2 + 5H2O Perlakuan bentonit dengan perbedaan waktu dan konsentrasi menghasilkan nilai kapasitas dan efisiensi adsorpsi yang berbeda. Dari banyak perlakuan, dipilih salah satu perlakuan yang memiliki persentase efisiensi adsorpsi tertinggi untuk penentuan isoterm adsorpsi. Bentonit yang tidak dikalsinasi masih memiliki ikatan Si dengan Al, sedangkan pada bentonit yang tidak diberi perlakuan asam, komponen aluminium oksida masih berikatan dengan silikat. Kedua hal ini dapat mengurangi kemampuan adsorpsi bentonit. Perlakuan dengan suhu tinggi dilanjutkan dengan aktivasi oleh asam diharapkan mampu memberikan efisiensi terbaik. Hasil penelitian menunjukkan bahwa bentonit yang diberi perlakuan suhu tinggi dilanjutkan dengan aktivasi asam merupakan adsorben yang memiliki efisiensi penjerapan optimum, yaitu sebesar 85.94%.
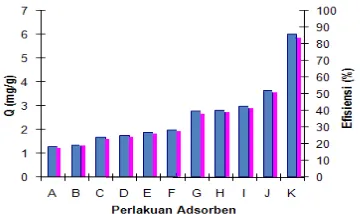
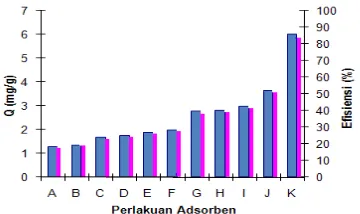
Perlakuan Optimum Bentonit
Pengaruh perlakuan adsorben dan nisbahnya terhadap kapasitas dan efisiensi adsorpsi larutan HCB 60 ppm dapat dilihat pada Gambar 3. Data selengkapnya diberikan pada Lampiran 3.
Gambar 3 Perlakuan optimum adsorpsi HCB.
Kapasitas Adsorpsi (Q)
Efisiensi Adsorpsi
Keterangan:
A = Aktivasi dengan H2SO4 10% selama 2 jam
B = Aktivasi dengan H2SO4 10% selama 4 jam
C = Aktivasi dengan H2SO4 10% selama 6 jam
D = Aktivasi dengan H2SO4 20% selama 2 jam
E = Aktivasi dengan H2SO4 20% selama 4 jam
F = Aktivasi dengan H2SO4 20% selama 6 jam
G = Aktivasi dengan H2SO4 30% selama 2 jam
H = Aktivasi dengan H2SO4 30% selama 4 jam
I = Aktivasi dengan H2SO4 30% selama 6 jam
J = Dipanaskan dengan suhu 600 °C tanpa asam K = Dipanaskan dengan suhu 600 °C dan aktivasi dengan
H2SO4 30% selama 2 jam
Adsorben yang digunakan dalam penentuan isoterm adsorpsi adalah bentonit yang diberi perlakuan suhu tinggi dilanjutkan dengan aktivasi asam (perlakuan dengan persentase efisiensi tertinggi). Persentase yang didapat 85.94% dengan kapasitas adsorpsi sebesar 5.9144 mg/g yang berarti setiap 1 g adsorben mampu mengadsorpsi 5.9144 mg HCB.
Waktu Optimum
Waktu optimum adalah waktu ketika adsorben telah jenuh dengan adsorbat. Dengan kata lain, adsorben tidak mampu lagi mengadsorpsi adsorbat. Waktu kontak yang lebih lama memungkinkan proses difusi dan penempelan molekul adsorbat berlangsung lebih baik (Wijaya 2008).
Konsentrasi larutan HCB yang digunakan adalah 60 ppm. Lamanya proses adsorpsi ditentukan berdasarkan efisiensi dan kapasitas adsorpsi selama waktu tertentu. Pengaruh waktu kontak terhadap efisiensi dan kapasitas adsorpsi ditunjukkan pada Gambar 4.
Gambar 4 Waktu optimum adsorpsi HCB. Kapasitas Adsorpsi (Q)
Efisiensi Adsorpsi
7 tidak jauh berbeda, sehingga dapat dikatakan
saat waktu 6 jam adsorben telah mencapai titik jenuh. Nilai kapasitas adsorpsi yang diperoleh adalah 6.1240 mg/g yang berarti setiap 1 g adsorben mampu mengadsorpsi 6.1240 mg HCB. Data selengkapnya dapat dilihat pada Lampiran 4.
Bobot Optimum
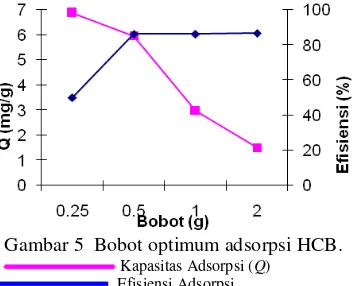
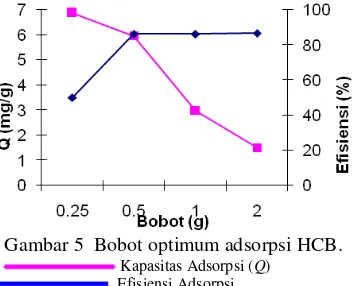
Hal lain yang memengaruhi adsorpsi adalah bobot adsorben. Semakin banyak adsorben yang digunakan, luas permukaan akan semakin besar sehingga mampu mengadsorpsi lebih banyak adsorbat. Pengaruh bobot adsorben terhadap efisiensi dan kapasitas adsorpsi larutan HCB 60 ppm dapat dilihat pada Gambar 5.
Gambar 5 Bobot optimum adsorpsi HCB. Kapasitas Adsorpsi (Q)
Efisiensi Adsorpsi
Gambar 5 menunjukkan bahwa kenaikkan bobot adsorben, akan meningkatkan efisiensi adsorpsi. Efisiensi 50.08% meningkat menjadi 86.74% dengan peningkatan bobot dari 0.25 g hingga 2.00 g. Namun, nilai kapasitas adsorpsi justru menurun dari 6.8827 mg/g ke 1.5012 mg/g dengan kenaikan bobot yang sama. Penurunan ini disebabkan saat bobot adsorben 0.50 g hampir seluruh permukaan adsorben telah terikat dengan adsorbat, sedangkan pada bobot 2.00 g masih banyak tapak adsorben yang tidak berikatan dengan adsorbat. Lain halnya dengan grafik efisiensi adsorpsi yang terlihat konstan setelah melewati bobot 0.50 g. Hal ini berarti efisiensi maksimum terjadi pada bobot 0.50 g. Data selengkapnya dapat dilihat pada Lampiran 5.
Kapasitas dan Efisiensi Adsorpsi Bentonit dan Arang Aktif
Hasil adsorpsi bentonit pada penelitian ini dievaluasi dengan membandingkannya dengan arang aktif komersial. Arang aktif diberi perlakuan yang sama dengan bentonit, yaitu dipanaskan dengan suhu 600 °C kemudian diaktivasi dengan asam sulfat 30% selama 2
jam. Kinerja adsorpsi dengan menggunakan adsorben bentonit didapati lebih baik daripada menggunakan arang aktif komersial. Hal ini dapat dilihat pada Tabel 1. Data selengkapnya diberikan pada Lampiran 6.
Tabel 1 Data adsorpsi HCB. Adsorben Efisiensi
(%)
Kapasitas (mg/g) Bentonit K 85.94 5.9144 Arang aktif komersial 73.44 4.6754
Isoterm Adsorpsi
Mekanisme adsorpsi HCB menggunakan adsorben bentonit dapat diketahui dengan menentukan jenis isoterm adsorpsinya. Isoterm adsorpsi Langmuir dibuat berupa kurva hubungan C/(x/m) terhadap C, sedangkan isoterm adsorpsi Freundlich berupa kurva hubungan log x/m terhadap log C. Linearitas yang paling tinggi merupakan jenis isoterm yang sesuai (Atkins 1999). Dari hasil yang diperoleh, linearitas untuk isoterm Langmuir adalah 40.10% (Gambar 6), sedangkan untuk isoterm Freundlich 96.90% (Gambar 7).
Gambar 6 Isoterm Langmuir adsorpsi HCB.
Gambar 7 Isoterm Freundlich adsorpsi HCB.
8 ion), melainkan secara fisika (ikatan hidrogen
atau van der Waals).
Isoterm Freundlich mengasumsikan bahwa adsorpsi yang melibatkan fase padat-cair berlangsung secara fisika. Adsorpsi secara fisika terjadi terutama karena adanya gaya tarik antara molekul zat terlarut dan adsorben lebih besar daripada gaya tarik antara molekul dan pelarutnya, sehingga zat terlarut tersebut akan diadsorpsi ke permukaan adsorben. Ikatan lemah antara bentonit dan HCB diperkirakan berupa ikatan van der Waals (gaya tarik menarik antara molekul-molekul yang berdekatan) antara atom O dari SiO2 pada bentonit dan atom Cl pada HCB.
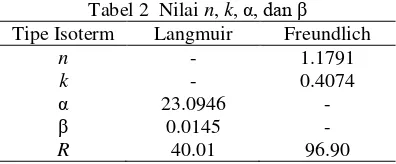
Nilai n, k, α, dan β dapat dihitung dari
persamaan regresi Freundlich dan Langmuir untuk adsorpsi HCB. Hasilnya ditunjukkan pada Tabel 2.
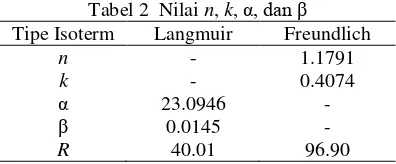
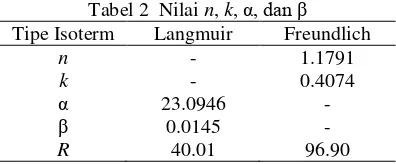
Tabel 2 Nilai n, k, α, dan β
Tipe Isoterm Langmuir Freundlich
n - 1.1791
k - 0.4074
α 23.0946 -
β 0.0145 -
R 40.01 96.90 Nilai n dan k pada isoterm Freundlich bergantung pada suhu, adsorben, dan unsur yang diadsorpsi. Nilai n menunjukkan intensitas adsorpsi, sedangkan nilai k
menunjukkan kapasitas adsorpsi adsorben. Semakin banyak adsorbat yang teradsorpsi, energi yang keluar juga semakin besar. Nilai α pada isoterm Langmuir menunjukkan jumlah yang diadsorpsi untuk membentuk lapisan sempurna pada adsorben. Nilai β adalah tetapan yang bertambah besar dengan kenaikan ukuran molekul dan menunjukkan kekuatan ikatan molekul adsorbat pada adsorben. Data selengkapnya diberikan pada Lampiran 7.
SIMPULAN DAN SARAN
Simpulan
Bentonit dapat digunakan untuk mengadsorpsi HCB. Kondisi optimum adsorpsi adalah 6 jam untuk waktu adsorpsi (kapasitas adsorpsi 6.1240 mg/g dan efisiensi adsorpsi 87.07%) dan 0.50 g untuk bobot adsorben (kapasitas adsorpsi 5.9659 mg/g dan efisiensi adsorpsi 86.22%). Perlakuan optimum bentonit ialah dipanaskan dengan suhu 600 °C dilanjutkan dengan aktivasi dengan asam sulfat 30% selama 2 jam.
Mekanisme adsorpsi HCB diduga mengikuti tipe isoterm Freundlich.
Saran
Penelitian lanjutan yang dapat dilakukan ialah melakukan aktivasi bentonit dengan senyawa basa. Selain itu, dapat dilakukan modifikasi terhadap bentonit dengan cara mencampurkannya dengan adsorben lain sehingga diharapkan memiliki kinerja adsorpsi yang baik.
DAFTAR PUSTAKA
Alberty RA, Silbey RJ. 1992. Physical Chemistry. Ed ke-1. New York: J Wiley. [Anonim]. 2005. Kaolin sebagai sumber SiO2
untuk pembuatan katalis Ni/SiO2 [terhubung berkala]. http://journal.ui.ac.id /upload/artikel/07_RidlaBakri_kaolin sbg sumber SiO2.pdf [15 Des 2010].
[ATDSR] Agency for Toxic Substances and Disease Registry. 2002.
Hexachlorobenzene [terhubung berkala]. http://www.atsdr.cdc.gov/toxfaqs/tf.asp?id =626&tid=115 [23 Des 2010].
Atkins PW. 1999. Kimia Fisika Jilid 2.Ed ke-4. Kartohadiprojo II, penerjemah. Jakarta: Erlangga. Terjemahan dari: Physical Chemistry.
Bird T. 1993. Kimia Fisik untuk Universitas. Jakarta: Gramedia Pustaka.
Cudzilo S, Zhu YQ, Kroto HW. 2007. Surface properties of carbons obtained from hexachlorobenzene and hexachloroethane by combustion synthesis. Carbon 45:103-109. www.sciencedirect.com [22 Des 2010].
Frahmana. 2010. Pencemaran Organoklorin
[terhubung berkala]. http://environment- forces.blogspot.com/2010/11/pencemaran-organoklorin.html [22 Des 2010].
8 ion), melainkan secara fisika (ikatan hidrogen
atau van der Waals).
Isoterm Freundlich mengasumsikan bahwa adsorpsi yang melibatkan fase padat-cair berlangsung secara fisika. Adsorpsi secara fisika terjadi terutama karena adanya gaya tarik antara molekul zat terlarut dan adsorben lebih besar daripada gaya tarik antara molekul dan pelarutnya, sehingga zat terlarut tersebut akan diadsorpsi ke permukaan adsorben. Ikatan lemah antara bentonit dan HCB diperkirakan berupa ikatan van der Waals (gaya tarik menarik antara molekul-molekul yang berdekatan) antara atom O dari SiO2 pada bentonit dan atom Cl pada HCB.
Nilai n, k, α, dan β dapat dihitung dari
persamaan regresi Freundlich dan Langmuir untuk adsorpsi HCB. Hasilnya ditunjukkan pada Tabel 2.
Tabel 2 Nilai n, k, α, dan β
Tipe Isoterm Langmuir Freundlich
n - 1.1791
k - 0.4074
α 23.0946 -
β 0.0145 -
R 40.01 96.90 Nilai n dan k pada isoterm Freundlich bergantung pada suhu, adsorben, dan unsur yang diadsorpsi. Nilai n menunjukkan intensitas adsorpsi, sedangkan nilai k
menunjukkan kapasitas adsorpsi adsorben. Semakin banyak adsorbat yang teradsorpsi, energi yang keluar juga semakin besar. Nilai α pada isoterm Langmuir menunjukkan jumlah yang diadsorpsi untuk membentuk lapisan sempurna pada adsorben. Nilai β adalah tetapan yang bertambah besar dengan kenaikan ukuran molekul dan menunjukkan kekuatan ikatan molekul adsorbat pada adsorben. Data selengkapnya diberikan pada Lampiran 7.
SIMPULAN DAN SARAN
Simpulan
Bentonit dapat digunakan untuk mengadsorpsi HCB. Kondisi optimum adsorpsi adalah 6 jam untuk waktu adsorpsi (kapasitas adsorpsi 6.1240 mg/g dan efisiensi adsorpsi 87.07%) dan 0.50 g untuk bobot adsorben (kapasitas adsorpsi 5.9659 mg/g dan efisiensi adsorpsi 86.22%). Perlakuan optimum bentonit ialah dipanaskan dengan suhu 600 °C dilanjutkan dengan aktivasi dengan asam sulfat 30% selama 2 jam.
Mekanisme adsorpsi HCB diduga mengikuti tipe isoterm Freundlich.
Saran
Penelitian lanjutan yang dapat dilakukan ialah melakukan aktivasi bentonit dengan senyawa basa. Selain itu, dapat dilakukan modifikasi terhadap bentonit dengan cara mencampurkannya dengan adsorben lain sehingga diharapkan memiliki kinerja adsorpsi yang baik.
DAFTAR PUSTAKA
Alberty RA, Silbey RJ. 1992. Physical Chemistry. Ed ke-1. New York: J Wiley. [Anonim]. 2005. Kaolin sebagai sumber SiO2
untuk pembuatan katalis Ni/SiO2 [terhubung berkala]. http://journal.ui.ac.id /upload/artikel/07_RidlaBakri_kaolin sbg sumber SiO2.pdf [15 Des 2010].
[ATDSR] Agency for Toxic Substances and Disease Registry. 2002.
Hexachlorobenzene [terhubung berkala]. http://www.atsdr.cdc.gov/toxfaqs/tf.asp?id =626&tid=115 [23 Des 2010].
Atkins PW. 1999. Kimia Fisika Jilid 2.Ed ke-4. Kartohadiprojo II, penerjemah. Jakarta: Erlangga. Terjemahan dari: Physical Chemistry.
Bird T. 1993. Kimia Fisik untuk Universitas. Jakarta: Gramedia Pustaka.
Cudzilo S, Zhu YQ, Kroto HW. 2007. Surface properties of carbons obtained from hexachlorobenzene and hexachloroethane by combustion synthesis. Carbon 45:103-109. www.sciencedirect.com [22 Des 2010].
Frahmana. 2010. Pencemaran Organoklorin
[terhubung berkala]. http://environment- forces.blogspot.com/2010/11/pencemaran-organoklorin.html [22 Des 2010].
ADSORPTIVITAS BERBAGAI PERLAKUAN BENTONIT
TERHADAP HEKSAKLOROBENZENA
ALVIN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
8 ion), melainkan secara fisika (ikatan hidrogen
atau van der Waals).
Isoterm Freundlich mengasumsikan bahwa adsorpsi yang melibatkan fase padat-cair berlangsung secara fisika. Adsorpsi secara fisika terjadi terutama karena adanya gaya tarik antara molekul zat terlarut dan adsorben lebih besar daripada gaya tarik antara molekul dan pelarutnya, sehingga zat terlarut tersebut akan diadsorpsi ke permukaan adsorben. Ikatan lemah antara bentonit dan HCB diperkirakan berupa ikatan van der Waals (gaya tarik menarik antara molekul-molekul yang berdekatan) antara atom O dari SiO2 pada bentonit dan atom Cl pada HCB.
Nilai n, k, α, dan β dapat dihitung dari
persamaan regresi Freundlich dan Langmuir untuk adsorpsi HCB. Hasilnya ditunjukkan pada Tabel 2.
Tabel 2 Nilai n, k, α, dan β
Tipe Isoterm Langmuir Freundlich
n - 1.1791
k - 0.4074
α 23.0946 -
β 0.0145 -
R 40.01 96.90 Nilai n dan k pada isoterm Freundlich bergantung pada suhu, adsorben, dan unsur yang diadsorpsi. Nilai n menunjukkan intensitas adsorpsi, sedangkan nilai k
menunjukkan kapasitas adsorpsi adsorben. Semakin banyak adsorbat yang teradsorpsi, energi yang keluar juga semakin besar. Nilai α pada isoterm Langmuir menunjukkan jumlah yang diadsorpsi untuk membentuk lapisan sempurna pada adsorben. Nilai β adalah tetapan yang bertambah besar dengan kenaikan ukuran molekul dan menunjukkan kekuatan ikatan molekul adsorbat pada adsorben. Data selengkapnya diberikan pada Lampiran 7.
SIMPULAN DAN SARAN
Simpulan
Bentonit dapat digunakan untuk mengadsorpsi HCB. Kondisi optimum adsorpsi adalah 6 jam untuk waktu adsorpsi (kapasitas adsorpsi 6.1240 mg/g dan efisiensi adsorpsi 87.07%) dan 0.50 g untuk bobot adsorben (kapasitas adsorpsi 5.9659 mg/g dan efisiensi adsorpsi 86.22%). Perlakuan optimum bentonit ialah dipanaskan dengan suhu 600 °C dilanjutkan dengan aktivasi dengan asam sulfat 30% selama 2 jam.
Mekanisme adsorpsi HCB diduga mengikuti tipe isoterm Freundlich.
Saran
Penelitian lanjutan yang dapat dilakukan ialah melakukan aktivasi bentonit dengan senyawa basa. Selain itu, dapat dilakukan modifikasi terhadap bentonit dengan cara mencampurkannya dengan adsorben lain sehingga diharapkan memiliki kinerja adsorpsi yang baik.
DAFTAR PUSTAKA
Alberty RA, Silbey RJ. 1992. Physical Chemistry. Ed ke-1. New York: J Wiley. [Anonim]. 2005. Kaolin sebagai sumber SiO2
untuk pembuatan katalis Ni/SiO2 [terhubung berkala]. http://journal.ui.ac.id /upload/artikel/07_RidlaBakri_kaolin sbg sumber SiO2.pdf [15 Des 2010].
[ATDSR] Agency for Toxic Substances and Disease Registry. 2002.
Hexachlorobenzene [terhubung berkala]. http://www.atsdr.cdc.gov/toxfaqs/tf.asp?id =626&tid=115 [23 Des 2010].
Atkins PW. 1999. Kimia Fisika Jilid 2.Ed ke-4. Kartohadiprojo II, penerjemah. Jakarta: Erlangga. Terjemahan dari: Physical Chemistry.
Bird T. 1993. Kimia Fisik untuk Universitas. Jakarta: Gramedia Pustaka.
Cudzilo S, Zhu YQ, Kroto HW. 2007. Surface properties of carbons obtained from hexachlorobenzene and hexachloroethane by combustion synthesis. Carbon 45:103-109. www.sciencedirect.com [22 Des 2010].
Frahmana. 2010. Pencemaran Organoklorin
[terhubung berkala]. http://environment- forces.blogspot.com/2010/11/pencemaran-organoklorin.html [22 Des 2010].
9 Kommalapati RR. 1997. Aqueous solubility
enhancement and desorption of hexachlorobenzene from soil using a plant-based surfactant. Water Res
31:2161-2170. http://www.elsevier.com [22 Mei 2010].
Komadel P. 2003. Chemically modified smectites. Clay Minera, 38:127-138. Manurung R, Hasibuan R, Irvan. 2004.
Perombakan zat wana azoreaktif secara anaerob-aerob [karya tulis]. Medan: Fakultas Teknik, Universitas Sumatera Utara.
McCabe WL, Smith JC, Harriott P. 2001. Unit Operation of Chemical Engineering. Ed ke-6. New York: McGraw-Hill.
Onal M, Sarikaya Y 2006. Preparation and characterization of acid-activated bentonite powders. Powder Technol
173:14-18. http://www.elsevier.com/ locate/powtec [21 Mar 2009].
Purwaningsih H. 2002. Pembuatan alumina dari kaolin dan studi katalisis heterogen untuk sintesis vanili dari eugenol minyak gagang cengkeh [tesis]. Depok: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia.
Sennour R, Mimane G, Benghalem A, Taleb S. 2008. Removal of the persistent pollutant chlorobenzene by adsorption onto activated monmorillonite. Appl Clay Sci 43:503-506. http://www.elsevier.com/ locate/clay. [20 Nov 2010].
Sudarmo. 1987. Penggunaan dan Klasifikasi Pestisida [terhubung berkala]. http://repos- itory.usu.ac.id/bitstream [15 Apr 2011].
Syuhada, Wijaya R, Jayatin, Rohman S. 2008.
Modifikasi bentonit (clay) menjadi organoclay dengan penambahan surfaktan.
Nanosains Nanoteknol 2:1-4.
Winarti, Miskiyah. 2010. Status Kontaminan pada Sayuran dan Upaya Pengendali- annya di Indonesia [terhubung berkala]. http://pustaka.litbang.deptan.
go.id/publikasi [24 Des 2010].
Wijaya H. 2008. Penggunaan tanah laterit sebagai media adsorpsi untuk menurunkan kadar chemical oxygen demand (COD) pada pengolahan limbah cair di Rumah Sakit Baktiningsih Klepu [skripsi]. Yogyakarta: Fakultas Teknik Sipil dan Perencanaan, Universitas Islam Indonesia.
ADSORPTIVITAS BERBAGAI PERLAKUAN BENTONIT
TERHADAP HEKSAKLOROBENZENA
ALVIN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ALVIN. Adsorptivitas berbagai perlakuan bentonit terhadap heksaklorobenzena
Dibimbing oleh HENNY PURWANINGSIH SUYUTI dan SRI SUGIARTI.
Dalam penelitian ini dikaji adsorptivitas bentonit terhadap senyawa
organoklorin, yaitu heksaklorobenzena. Berbagai perlakuan diberikan kepada
bentonit sebelum digunakan sebagai adsorben. Perlakuan yang diberikan adalah
perlakuan dengan asam dan pemanasan. Perlakuan yang memberikan kapasitas
adsorpsi dan efisiensi terbaik adalah perlakuan dengan menggunakan pemanasan
pada suhu 600 °C dilanjutkan dengan perlakuan asam H
2SO
430%. Waktu
adsorpsi optimum diperoleh pada 6 jam dengan bobot adsorben 0.5 g. Kajian atas
model isoterm adsorpsi menunjukkan bahwa adsorpsi heksaklorobenzena
menggunakan adsorben bentonit sesuai dengan isoterm Freundlich. Pada kondisi
yang sama adsorpsi heksaklorobenzena menggunakan bentonit menunjukkan
kapasitas dan efisiensi yang lebih baik daripada arang aktif komersial.
ABSTRACT
ALVIN. Adsorptivity various bentonite treatments to hexachlorobenzene.
Supervised by HENNY PURWANINGSIH SUYUTI and SRI SUGIARTI.
ADSORPTIVITAS BERBAGAI PERLAKUAN BENTONIT
TERHADAP HEKSAKLOROBENZENA
ALVIN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN ILMU KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Adsorptivitas Berbagai Perlakuan Bentonit Terhadap Heksaklorobenzena
Nama : Alvin
NIM : G44052265
Menyetujui
Pembimbing I,
Henny Purwaningsih, S.Si, M.Si.
NIP 19741201 200501 2 001
Pembimbing II,
Dr. Sri Sugiarti
NIP 19701225 199512 2 001
Mengetahui
Ketua Departemen,
Prof. Dr. Ir. Tun Tedja Irawadi, M.S.
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan yang Maha Esa atas
rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini
dengan baik. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan
pada bulan April sampai Oktober 2010 di Laboratorium Kimia Fisik, Departemen
Kimia FMIPA IPB dan Laboratorium Terpadu IPB. Karya ilmiah yang berjudul
Adsorptivitas Berbagai Perlakuan Bentonit Terhadap Heksaklorobenzena ini
merupakan salah satu syarat untuk memperoleh gelar sarjana sains pada
Departemen Kimia FMIPA IPB.
Penulis mengucapkan terima kasih kepada Ibu Henny Purwaningsih, S.Si,
M.Si. selaku pembimbing pertama dan Ibu Dr. Sri Sugiarti selaku pembimbing
kedua yang telah memberikan kritik, saran, dan dorongan selama pelaksanaan
penelitian dan penulisan karya ilmiah ini. Ungkapan terima kasih penulis berikan
kepada keluargaku, Nenek, Ayah, Ibu, adik-adikku, yang selalu memberikan doa
dan kasih sayang. Terima kasih kepada Evelyn yang selalu membantu, menghibur,
dan memberikan semangat. Terima kasih juga kepada Kakak Maksudin, Bapak
Nano, Bapak Ismail, Bapak Sawal, dan Ibu Ai atas fasilitas dan bantuan yang
diberikan. Ucapan terima kasih juga disampaikan kepada teman-temanku Mario
Paulus, Bayu Agus, Victoria, Maired, Ema, Maya, Rita, Mbak Dewi, Mbak Ii,
Mbak Adew, Kakak Riki, dan Kakak Ian yang turut membantu, memberikan
semangat dan dukungannya dalam penyusunan karya ilmiah ini.
Penulis menyadari karya ilmiah ini jauh dari sempurna. Kritik dan saran
dari para pembaca senantiasa diharapkan agar dapat bermanfaat pada penelitian
selanjutnya. Semoga karya ilmiah ini dapat bermanfaat bagi ilmu pengetahuan.
Bogor, Mei 2011
Alvin
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Bentonit ...
1
Pestisida Organoklorin ...
2
Heksaklorobenzena ...
2
Adsorpsi ...
3
Isoterm Adsorpsi ...
3
..
BAHAN DAN METODE
Bahan dan Alat ...
4
Metode...
4
HASIL DAN PEMBAHASAN
Perlakuan Optimum Bentonit ...
6
Waktu Optimum ...
6
Bobot Optimum ...
7
Kapasitas dan Efisiensi Adsorpsi Bentonit dan Arang Aktif ...
7
Isoterm Adso
rpsi……….
7
SIMPULAN DAN SARAN
DAFTAR TABEL
Halaman
1 Data adsorpsi HCB ...
7
2 Nilai n, k
, α, dan β
...
8
DAFTAR GAMBAR
Halaman
1 Struktur bentonit ...
2
2 Struktur heksaklorobenzena ...
2
3 Perlakuan optimum adsorpsi HCB ...
6
4 Waktu optimum adsorpsi HCB ...
6
5 Bobot optimum adsorpsi HCB ...
7
6 Isoterm Langmuir adsorpsi HCB ...
7
7 Isoterm Freundlich adsorpsi HCB ...
7
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 11
2 Pembuatan kurva standar HCB ... 12
3 Data optimasi perlakuan bentonit terhadap HCB ... 12
4 Data optimasi waktu kontak bentonit terhadap HCB ... 13
5 Data optimasi bobot bentonit terhadap HCB ... 13
6 Data adsorpsi HCB dengan arang aktif komersial ... 14
PENDAHULUAN
Penggunaan senyawa kimia berbahaya dalam industri membuat lingkungan semakin tercemar. Sistem pengelolaan limbah masih banyak yang belum memberikan hasil yang baik. Oleh sebab itu, diperlukan peningkatan kualitas dan efisiensi dalam penelitian lebih lanjut mengenai penanggulangan limbah, khususnya metode adsorpsi, agar memberikan hasil yang optimum.
Pestisida merupakan senyawa yang banyak digunakan dalam industri sehingga tingkat pencemarannya cukup tinggi. Penggunaan pestisida meningkat lebih dari 50 kali lipat sejak tahun 1950, dan sekarang sekitar 2.5 juta ton pestisida digunakan setiap tahunnya. Pestisida adalah bahan yang digunakan untuk mengendalikan, menolak, memikat, atau membasmi organisme pengganggu seperti serangga, tikus, gulma, burung, mamalia, ikan, atau mikroba (Sudarmo 1987).
Pestisida yang banyak digunakan adalah senyawaan organoklorin seperti heksakloro- benzena (HCB), heksakloroetana, klorofenol, asam 2,4-diklorofenoksiasetat (2,4-D), diklorodifeniltrikloroetana (DDT), dikofol, heptaklor, endosulfan, klordan, dan mireks. Organoklorin merupakan senyawa kimia yang mengandung karbon dan klorin. Kebanyakan organoklorin berbahaya karena tidak mudah rusak sehingga dapat tinggal di lingkungan dan tubuh untuk waktu yang relatif lama. Organoklorin dapat terkonsentrasi dalam rantai makanan sehingga hewan-hewan di bagian atas rantai makanan, seperti manusia lebih merasakan akibatnya (Frahmana 2010).
Pada bulan April 2005 terjadi 39 kasus penolakan produk makanan, terutama sayur-sayuran asal Indonesia oleh FAO karena mengandung bahan berbahaya yang dilarang. Kasus tersebut meningkat dibandingkan dengan bulan Januari 2005 dengan 15 kasus penolakan. Jenis bahan berbahaya yang digunakan dan menjadi perhatian antara lain mikrob, logam berat, dan residu pestisida. Upaya meningkatkan keamanan pangan produk pertanian, khususnya sayur-sayuran, telah dilakukan antara lain melalui program pengendalian hama terpadu (PHT). Pada PHT, tidak hanya dipertimbangkan tingkat produksi yang tinggi, tetapi juga kelestarian lingkungan dan keamanan pangan. Namun, upaya tersebut belum mampu memecahkan persoalan keamanan pangan karena adanya praktik produksi yang menyimpang seperti penggunaan senyawa kimia berbahaya (Winarti dan Miskiyah 2010).
Keberadaan senyawa organoklorin dalam lingkungan sangat membahayakan. Residu organoklorin pada manusia dapat menimbul- kan keracunan akut maupun kronis, karena sifat akumulatifnya terutama dalam lemak. Pemakaian pestisida organoklorin sebetulnya telah dilarang melalui Surat Keputusan Menteri Pertanian Nomor 434.1/Kpts/TP.270/7/2001 karena sifatnya yang persisten. Namun, hal ini masih sangat sulit dilaksanakan untuk negara berkembang dan sampai saat ini masih banyak ditemukan residunya. Salah satu alternatif untuk menanggulangi penggunaan organoklorin adalah dengan pengelolaan limbahnya.
Berbagai metode telah digunakan untuk mengatasi limbah organoklorin seperti koagulasi (cara kimia), yaitu penambahan zat agar terbentuk gumpalan (flok), adsorpsi menggunakan arang aktif (cara fisika), dan menggunakan bakteri (cara biologis). Kekurangan metode koagulasi adalah pembentukan lumpur dalam jumlah besar. Metode arang aktif cukup efektif karena memiliki daya serap yang tinggi, namun dibutuhkan biaya yang mahal (Manurung et al. 2004). Penggunaan adsorben merupakan metode alternatif dalam pengolahan limbah. Penelitian mengenai adsorpsi HCB dengan variasi adsorben telah banyak dilakukan. Dibandingkan dengan arang aktif, adsorben dari mineral liat memiliki kapasitas adsorpsi yang lebih baik (Krishna et al. 2001).
Dalam penelitian ini, digunakan bentonit sebagai adsorben. Adsorptivitas bentonit teraktivasi sebagai adsorben diukur terhadap organoklorin HCB. Penelitian ini diharapkan dapat menghasilkan adsorben alternatif bagi senyawa polutan organik persisten (POP).
TINJAUAN PUSTAKA
Bentonit
2 Gambar 1 Struktur bentonit (Syuhada et al.
2008).
Secara umum terdapat 2 jenis bentonit, yaitu natrium bentonit dan kalsium bentonit. Bentonit mengandung 85% montmorilonit dengan rumus kimia Al2O3∙4SiO2∙xH2O, yaitu senyawa silikat dan alumina yang mengikat air secara kimia. Kandungan lain bentonit adalah pengotor dari beberapa jenis mineral seperti kwarsa, ilit, kalsit, mika, dan klorit (Anonim 2005).
Natrium bentonit mengandung relatif lebih banyak ion Na+ dibandingkan dengan ion Ca2+ dan Mg2+. Bentonit ini dapat mengembang hingga 8−15 kali apabila dicelupkan ke dalam air dan tetap terdispersi beberapa waktu di dalam air. Posisi pertukaran ion terutama ditempati oleh ion natrium. Kalsium bentonit, di sisi lain, mengandung lebih banyak ion Ca2+ dan Mg 2+, kurang menyerap air, tetapi secara alamiah atau setelah diaktifkan dengan asam, menjadi adsorben yang baik dan tetap terdispersi dalam air. Nisbah kandungan Na dan Ca pada jenis bentonit ini cukup rendah. Posisi pertukaran ion lebih banyak diduduki oleh ion kalsium dan magnesium. Sifat-sifat bentonit umumnya lunak, plastis, sarang, berwarna pucat (putih, hijau muda, kelabu), kemudian berubah menjadi kuning, merah cokelat, serta hitam. Permukaannya licin, jika dimasukkan ke dalam air akan mengisap air (Syuhada et al. 2008).
Pestisida Organoklorin
Pestisida digunakan untuk mengendalikan dan mencegah gangguan organisme pengganggu atau hama. Pestisida dapat digolongkan menurut jasad sasarannya
menjadi insektisida, fungisida, herbisida, rodentisida, dan nematisida. Pestisida juga dapat digolongkan menurut asal dan sifat kimia, yaitu sintetik dan alam. Pestisida sintetik berasal dari bahan anorganik dan organik. Pestisida organik meliputi organo- klorin, heterosiklik, organofosfat, karbamat, dinitrofenol, tiosianat, sulfonat, dan lain-lain.
Pestisida dikatakan persisten jika dapat bertahan relatif lama pada bidang sasaran atau pada lingkungan setelah diaplikasikan. Senyawaan organoklorin tergolong sangat persisten. Senyawa ini dapat bertahan lama di lingkungan, tidak mudah disekresikan dari tubuh organisme, dan dapat berpindah dari organisme yang satu ke organisme lainnya melalui rantai makanan. Insektisida ini umumnya merupakan racun kontak dan racun perut yang efektif mengendalikan larva, nimfa, dan serangga dewasa. Organoklorin tidak mudah terurai, dan cenderung menumpuk pada jaringan lemak hewan. Insektisida organoklorin dibagi menjadi 3 golongan, yaitu DDT, senyawa siklodiena, dan terpena berklorin (Yu 2005).
Heksaklorobenzena
Heksaklorobenzena (HCB) (Gambar 2) adalah suatu padatan putih dengan kelarutan yang rendah dalam air, tetapi dapat larut dengan pelarut organik. HCB digunakan sebagian besar sebagai fungisida. Senyawa ini terbentuk sebagai hasil samping selama pembuatan bahan kimia yang mengandung klorin (Cudzilo et al. 2007). Sampai tahun 1965, HCB digunakan secara luas sebagai suatu pestisida, tetapi sekarang diketahui karsinogenik.
Gambar 2 Struktur heksaklorobenzena.
3 tahun. Jika dilepaskan ke air tanah, maka
umur paruhnya adalah 5.3−11.4 tahun. HCB merupakan buangan dalam produksi beberapa hidrokarbon berklorin seperti tetrakloroetilena, trikloroetilena, dan karbon tetraklorida, serta menjadi zat pencemar dalam beberapa pestisida seperti pentakloronitrobenzena dan pentaklorofenol. HCB stabil dan tahan terhadap biodegradasi. Ketika dipanaskan untuk pembusukan, senyawa ini memancarkan uap klorida beracun (ATDSR 2002).
Adsorpsi
Adsorpsi merupakan peristiwa terakumulasinya partikel pada suatu permukaan (Atkins 1999). Adsorpsi biasanya terjadi pada dinding-dinding pori atau pada tapak tertentu dalam partikel (McCabe et al.
2001). Istilah adsorbat dan adsorben digunakan dalam adsorpsi. Adsorbat adalah zat yang terjerap atau yang akan dipisahkan dari pelarutnya, sedangkan adsorben adalah medium penjerap.
Dalam proses adsorpsi, molekul meninggalkan larutan dan menempel pada permukaan adsorben. Proses ini terbagi menjadi 4 tahap, yaitu transfer molekul-molekul zat terlarut yang teradsorpsi menuju lapisan film yang mengelilingi adsorben, difusi zat terlarut yang teradsorpsi melalui lapisan film (film diffusion process) tersebut, difusi zat terlarut yang teradsopsi melalui kapiler/pori dalam adsorben (pore diffusion process), dan adsorpsi zat terlarut yang teradsorpsi pada dinding pori atau permukaan adsorben.
Mekanisme adsorpsi dapat dibedakan menjadi 2, yaitu adsorpsi secara fisika (fisisorpsi) dan secara kimia (kemisorpsi). Pada proses fisisorpsi, adsorbat diikat oleh adsorben dengan gaya-gaya van der Waals, sedangkan pada proses kemisorpsi, interaksi adsorbat dengan adsorben terjadi melalui pembentukan ikatan kimia. Kemisorpsi terjadi diawali dengan fisisorpsi, yaitu partikel-partikel adsorbat mendekat ke permukaan adsorben melalui gaya van der Waals atau ikatan hidrogen. Kemisorpsi baru terjadi setelah itu (Atkins 1999).
Pemilihan adsorben memengaruhi proses adsorpsi. Faktor yang berpengaruh meliputi luas permukaan adsorben, ukuran partikel, waktu kontak, dan distribusi ukuran pori. Kebanyakan adsorben merupakan bahan yang sangat berpori dan adsorpsi berlangsung terutama pada dinding-dinding pori atau
tapak-tapak tertentu di dalam partikel tersebut. Pemisahan dapat terjadi karena perbedaan bobot molekul atau polaritas yang menyebabkan suatu molekul melekat pada permukaan lebih erat daripada molekul-molekul lainnya (Alberty dan Silbey 1992).
Adsorpsi juga dipengaruhi oleh sifat fisika dan kimia adsorbat, seperti ukuran molekul, polaritas molekul, komposisi kimia, konsentrasi adsorbat dalam fase cair, dan sifat fase cair, serta oleh lamanya proses adsorpsi (Bird 1993). Semakin kecil ukuran partikel, semakin besar luas permukaan padatan per satuan volume tertentu sehingga akan semakin banyak zat yang diadsorpsi (Atkins 1999). Adsorben yang baik memiliki kapasitas adsorpsi dan persentase efisiensi adsorpsi yang tinggi. Kapasitas adsorpsi dapat dihitung dengan menggunakan rumus
Q = V(Co –C)/m
Efisiensi adsorpsi dapat dihitung dengan mengunakan rumus
Efisiensi adsorpsi (%) = ((Co –C)/Co) × 100% Keterangan:
Q = kapasitas adsorpsi (mg/g)
V = volume larutan (L)
Co = konsentrasi awal (mg/L)
C = konsentrasi akhir (mg/L)
m = massa (g)
Isoterm Adsorpsi
Isoterm adsorpsi menunjukkan hubungan kesetimbangan antara konsentrasi adsorbat dalam fluida dan pada permukaan adsorben, pada suhu tetap. Kesetimbangan terjadi saat laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya. Dalam istilah termodinamika, ini berarti potensial kimia antara adsorbat di fase fluida dan yang terikat di adsorben telah sama besar. Kesetimbangan mungkin, tetapi tidak harus, terjadi saat adsorben mencapai kapasitas adsorpsi.
4
Isoterm Adsorpsi Langmuir
Isoterm Langmuir berlangsung secara kemisorpsi satu lapisan. Kemisorpsi adalah adsorpsi yang terjadi melalui ikatan kimia sangat kuat antara tapak aktif permukaan dan molekul adsorbat dan dipengaruhi oleh densitas elektron. Adsorpsi satu lapisan, biasanya bersifat spesifik. Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoretis dengan menganggap terjadi kesetimbangan antara molekul-molekul zat yang diadsorpsi pada permukaan adsorben dan yang tidak teradsorpsi sebagai berikut:
x/m = αβ/(1+βC)
Tetapan α dan β dapat ditemukan dari kurva hubungan C/(x/m) terhadap C dengan persamaan
C/(x/m) = 1/(αβ) + C/α Keterangan:
x/m = massa adsorbat yang teradsorpsi per g adsorben
C = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm)
α,β = tetapan empiris
Isoterm Adsorpsi Freundlich
Isoterm Freundlich terjadi secara fisisorpsi banyak lapisan. Fisisorpsi adalah adsorpsi yang hanya melibatkan gaya antarmolekul dan ikatannya lemah. Persamaan isoterm adsorpsi Freundlich didasarkan atas terbentuknya lapisan tunggal molekul-molekul adsorbat pada permukaan adsorben. Namun, tapak-tapak aktif pada permukaan adsorben bersifat heterogen. Menurut Atkins (1999), isoterm Freundlich diterapkan pada proses adsorpsi zat terlarut ke permukaan padatan. Persamaan diturunkan secara empiris dengan bentuk sebagai berikut:
x/m = kC1/n
Apabila dilogaritmakan, persamaan tersebut menjadi
log(x/m) = log k + (log C)/n
Keterangan:
x/m = massa adsorbat yang teradsorpsi per gram adsorben
C = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm)
k,n = tetapan empiris
BAHAN DAN METODE
Bahan dan Alat
Alat-alat yang digunakan dalam penelitian ini terdiri atas peralatan kaca, sudip, cawan porselen, oven, neraca analitik, tanur,
desikator, pengaduk magnetik, kertas saring, mortar, ayakan, dan spektrofotometer UV-Visible Shimadzu tipe 1700. Bahan-bahan yang digunakan adalah bentonit dari PT. Sud Chemie, Jawa Barat, HCB, heksana, asam sulfat pekat (98%), padatan barium klorida, dan air distilasi.
Metode
Penelitian terdiri atas 5 tahapan (Lampiran 1), meliputi preparasi bentonit dan larutan HCB (pembuatan st