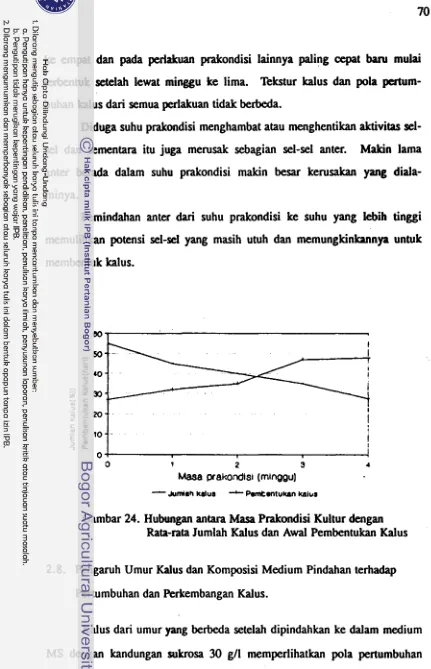
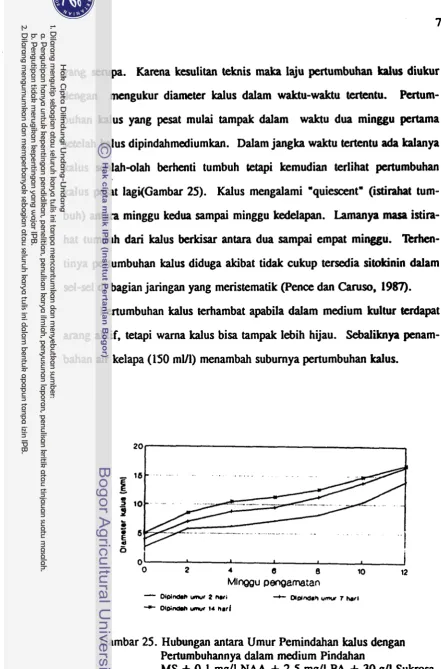
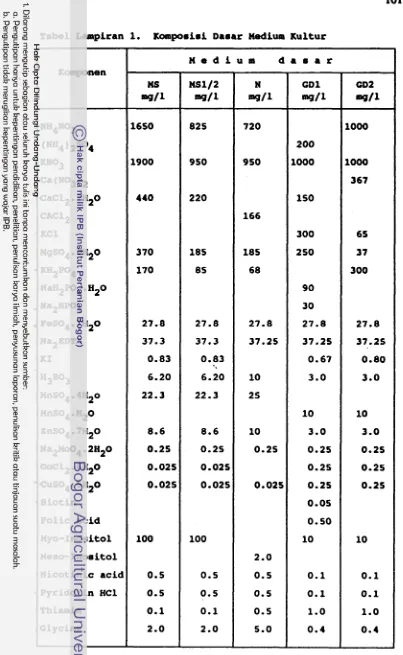
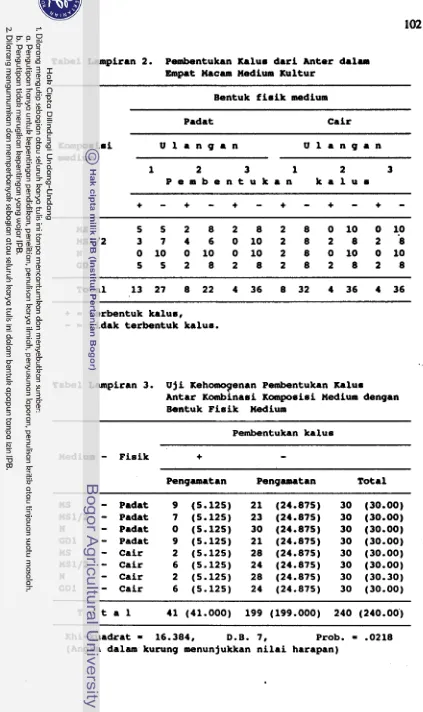
PERTUMBUHAN DAN PERKEMBANGAN ANTER SOLANUM KHASIANUM
CLARKE
DALAM
KULTUR IN-Vf TROJumlah obat-obatan yang berasal dari tumbuhan mencapai sekitar 25 persen dari seluruh obat-obatan yang dipakai di seluruh dunia (Fowler,
1983). Beberapa senyawa organik yang digunakan sebagai bahan obat sudah ada yang bisa dibuat secm sintetis, misalnya reserpin. Namun dalam proses sintetis ini masih dijumpai berbagai kendala. Senyawa organik yang
dibuat
secara
sintetis ada kalanya sulit dibuat murni, sehingga rnemerlukanproses pengujian yang cucup lama dan cukup mahal sebelum bisa dipa-
wkan. Akibatnya biaya produksi menjadi tinggi sehingga harga jualnya pun menjadi tinggi. Reserpin sintetis yang diproduksi di Amerika Serikat ternya-
ta harganya lebih mahal dibandingkan dengan harga reserpin produk alami
(Lewis dan Lewis, 1957). Atas dasar ha1 ini maka senyawa organik produk
alami nampaknya masih tetap lebih aman untuk digunakan dan harganya masih lebih murah dari pada p d u k sintetis
Solanwn khasimm Clarke dari suku terung-terungan (Solanaceae) merupakan salah satu tumbuhan penghasil solasodin. Solasodin digunakan
sebagai salah satu bahan dasar dalam pembuatan pi1 kontrasepsi. Penggu-
naan bahan dasar obat kontrasepsi ini sangat penting bagi Indonesia yang
sedang gencar menggalakkan program keluarga berencana. Untuk kelancar-
berswasembada dalam pengadaan bahan dasar tersebut. Kernandirian ini
juga rnempunyai arti membantu pemerintah dalam usaha menghemat &visa
negara. Berdasarkan keterangan dari
P.T.
Kimia Farma-Bandung dalam tahun 1992 Indonesia memerlukan sekitar 245 kg Levonorgestrel dan 49 kg Eithymal Estradiol yang bernilai sekitar Rp 4.6 milyar untuk pembuatan pi1 KB. Usaha Ire arah pengadaan bahan dasar tersebut di Indonesiaantara
lain telah dirintis oleh Balai Penelitian 'Emaman Rempah dan Obat (BALIlTRO) yang meagadakan kejasama denganPT.
Darya %a Laboratoria (Abdul- lah, 1985).Solanum Wlasimwn Clarke merupakan tanaman pendatang dan dimasukkan ke Indonesia dari India pada tahun 1977 (Sudiarto, 1981;
Sudiarto dan Rosita, 1982). Secara morfologi takson yang ada di Indonesia dapat dibagi atas tiga fenotipe; yaitu fenotipe berduri jarang-lurus, fenotipe
berduri banyak-lurus dan fenotipe berduri banyak-bengkok. Dalam pengem-
bangannya sifat berduri ini dipandang merupakan salah satu hambatan dalam
pembudidayaannya karena mempersulit penanganannya dilapangan terutama
saat pemanenan buah. Demikian juga keragaman produksi buah
,
kan- dungan solasodin dan gangguan hama atau penyakit merupakan kendala yangtak mudah diatasi.
Masalah yang perlu segera diatasi yaitu bahwa tanaman ini sangat
peka terhadap serangan bakteri Pseudomonas solanacearum. Usaha ke arah seleksi galur unggul sedang dilakukan oleh BALIlTRO bertempat di Kebun
Percobaan Manoko
-
Lembang.Mengingat bahwa untuk pemuliaan tanaman tersebut diperlukan
keragaman genetik yang tinggi, maka usaha menambah keragaman genetik dan pemanfaatan kultur anter ("anther" atau kepala sari) atau kultur polen
("pollen" atau serbuk sari) akan sangat membantu program pengembangan
2. lhjuan Penelitian.
'lbjuan penelitian ini adalah untuk mempelajari pertumbuhan dan
perkembangan anter atau polen Solanum khasianum Clarke dalam kultur in-
vitro yang pada akhirnya diharapkan mampu menghasilkan tanaman andro- gen yang akan sangat berguna dalam usaha pengembqannya.
3. Hipotesis.
Penelitian ini didasarkan pada teori totipotensi sel yang menyatakan
bahwa setiap sel tumbuhan pada dasarnya merupakan suatu unit yahg man-
din. Dalam stadium tertentu dan dalam kondisi kultur yang sesuai setiap sel
pada anter Sdanum Masianwn Clarke, termasuk polen, diharapkan mampu
11. TINJAUAN PUSTAKA
1. Kegunaan Solanwn Wtasianwn Clarke.
Solanwn khasianwn Clarke adalah salah satu jenis terung-terungan
penghasil solasodin. Solasodin adalah senyawa organik dengan struktur
steroid tetapi bersifat alkaloid. Solasodin dapat dikonvenikan menjadi
derivat pregnan seperti halnya diosgenin. Kesamaan sifat ini menyebabkan solasodin dijadikan pengganti diosgenin sebagai bahan dasar dalam pem-
buatan &at kontrasepsi oral.
Kandungan solasodin tertinggi pada Solanwn khmianwn Clarke
terdapat pada lapisan b d i r ("mucilage") yang menyelaputi biji. Kandungan
s o l a d i n pada jenis m n g ini mencapai 2 persen sampai 2.85 persen dari berat kering buah (Saini, 1966; Chatte rjee dan Nandi, 1977). Lapisan lendir
ini sifatnya semakin lengket dan warnanya semakin coklat pada buah yang
semakin tua.
Karena lokasi solasodin ini sifatnya ekstraselular maka kadarnya
setdah buah mencapai tingkat kematangan tertentu tidak terlalu banyak
dipengaruhi oleh umur buah. Oleh karena itu saat pemanenan buah tidak
terlalu merupakan masalah yang kritis. Waupun demikian disarankan agar
buah dipanen pada saat kulit buah berwarna kuning kehijauan untuk menda-
2. Masalah-masalah dalam Pembudidayaan Solanwn Wtmianwn Clarke.
2.1. Adaptasi dan Produksi. Solanwn khasianwn Clarke termasuk tanaman yang mempunyai adaptasi yang baik terhadap jenis tanah dan
letak ketinggian tempat. Jenis tanaman ini dapat tumbuh mulai dari
dataran rendah sampai ice dataran tinggi yang mencapai sekitar 2000 m di atas permukaan laut (Chatterjee dan Nandi, 1977; Chaudhuri dan
Chatterjee, 1979; Sudiarto, 1981). Chaudhuri dan Chatterjee (1979)
mendapatkan bahwa kandungan solasodin pada umumnya lebih tinggi
pada tanaman dari dataran rendah dibandingkan dengan tanaman dari
dataran tinggi, tetapi ha1 ini tergantung pada musim. Chatterjee dan
Nandi (1977) menyatalcan bahwa pada musim hujan produksi buah ter-
tinggi didapatkan pada tanaman dari ketinggian sedang (500 m di atas
permukaan laut) sedangkan kadar solasodin tertinggi didapatkan pada
tanaman dari dataran tinggi (2 000 m di atas permukaan laut). Sudiarto
(198 1) mendapatkan bahwa baik pertumbuhan vegetatif maupun pmduk-
si buah dari Sdanwn khasianwn Clarke ternyata lebih baik pada tanaman di datatan tinggi daripada tanaman di dataran rendah. Muljati
(1988) mendapatkan kadar solasodin tertinggi sebesar 1.93 persen dari
berat kering buah pada tanaman yang dipupuk dengan boron dan temba-
ga di Kebun Percobaan Cimanggu-Bogor (200 m di atas permukaan laut). Sudiatso (4990) mencatat kadar solasodin tertinggi sebesar 2.37 persen dari berat kering buah pada tanaman di Pasir Sarongge-Cianjur
(sekitar 1000 m di atas permukaan laut) yang diberi perlakuan ethrel dan
pemupukan nitrogen.
2.2. Penyakit. Hal yang cukup berat diatasi dalam pembudidayaan
sering menyerang tanaman ini di lapangan adalah bakteri dan nematoda
(Sudiarto, 1981). Gangguan penyakit di lapangan bisa timbul kapan-
saja. Adakalanya gangguan penyakit tersebut baru mulai muncul pada
waktu tanaman mulai berbunga, yaitu pada umur selcitar tiga bulan terhi-
tung sejak biji disemaikan. 'haman yang sudah terserang bakteri
biasanya tidak mungkin pulih lagi. W e r i yang umum menyerang
tanaman di lapangan adalah Pseudomonas solanaceam.
2.3. Sifat berduri. Hal lain yang juga cukup menjadi kendala pada pembudidayaan Solanwn khasianum Clarke ialah terdapatnya duri-duri tajam pada hampir seluruh bagian vegetatif. Batang tanaman terung ini,
terutama pada pangkal batang, ditumbuhi duriduri kecii yang tajam. Pada gagang daun (petiole) dan pada tulang-tulang daun duriduri terse-
but lebih besar dan lebih panjang. Duri-duri ini terdapat baik pada permukaan atas maupun permukaan bawah daun. Pada fenotipe berduri
banyak jumlah dun pada satu permukaan daun berkisar antara 7 sampai
16 buah, sedangkan pada fenotipe berduri jarang berkisar antara 3 sampai 8 buah.
Rmyata puh bahwa jumlah duri ini dipengaruhi oleh umur tanaman dan intensitas penyinaran. Makin tua tanaman dan makin
tinggi intensitas cahaya matahari maka jumlah duri pun makin lebih
banyak. Pada fenotipe yang berduri bengkok, duri bengkok ini terutama
terdapat pada permukaan daun sebelah atas, pada bagian vegetatif
lainnya duri tersebut adakalanya agak lurus.
Duri yang paling mengganggu para pemanen buah adalah duri
perih. Apabila daun telah rontok pemanenan buah relatif mudah, tetapi
daun ini hanya rontok masal apabila tanaman telah terlalu tua atau ter-
serang penyakit. Penggunaan ethrel diketahui selain menstimulasi
menguningnya buah juga dapat meluruhkan daun (Sudiatso, 1990). Penggunaan bahan kimia perontok daun secara teknis memang me-
mungkinkan, tetapi
secara
ekonomis pada saat ini belum menguntung-kan.
2.4. Pemuliaan. Solanurn khQsianwn Clarke yang didatangkan ke
Indonesia terdiri dari tiga fenotipe. Dari ketiga fenotipe ini kits belum bisa menggali informasi genetik yang memadai. Usaha ke arah ini baik
yang dilakukan oleh BALI'ITRO maupun oleh BPPT baru dalam taraf
awal.
3. Cara-cara Mendapatkan 'hnaman' Haploid.
nnaman haploid bisa diperoleh secara in-vim ataupun secara in-
vitro. Pierik (1987) menyebutkan cara-cara mendapatkan tanaman
haploid baik secara in-viw maupun
secara
in-vitro.3.1. Secara in-vim tanaman haploid dapat diperoleh dengan beberapa
cara, yaitu:
3.1.1. Ginogenesis: yaitu perkernbangan dari sel telur yang tidak
dibuahi sebagai hasil persilangan antar jenis.
3.1.2. Androgenesis; yaitu perkembangan dari sel telur yang
mengalami eliminasi intinya dan inti ini digantikan oleh inti
3.1.3. Eliminasi genom; yaitu perkembangan zigot yang
mengalami eliminasi salah satu genomnya sebagai hasil
persilangan antar jenis atau antar marga.
3.1.4. Semigami; inti sel telur dan inti sel generatif polen
masing-masing berkembang secara mandiri yang akhimya
menghasilkan suatu kimera haploid.
3.1.5. Pemberian perlakuan kimiawi untuk mengeliminasi homo-
som.
3.1.6. Pemberian perlakuan kejutan dengan suhu tinggi atau suhu
rendah.
3.1.7. Iradiasi dengan sinar X atau sinar UV.
3.2.
Secara in-vitro tanaman haploid bisa diperoleh dengan beberapa cam, antara lain :3.2.1. Kultur anter (kepala sari). Anter yang telah diisolasi
dari tanaman donor ditumbuhkan dalam medium buatan
secara aseptik.
3.2.2. Kultur polen (serbuk sari). Polen dalam tingkat perkem- bangan tertentu setelah diisolasi dari anter ditumbuhkan
dalam medium buatan secara aseptik.
3.2.3. Kultur perbungaan ("inflorescense"). Seluruh perbungaan
ditumbuhkan dalam medium buatan secara aseptik. Hal ini
terutama dilakukan pada jenis rumput-rumputan yang
3.2.4. Kultur embrio. Embrio hasil persilangan antar jenis atau antar marga biasanya mengalami eliminasi genom dan
tidak bisa berkembang dalam kondisi in-viw. Untuk
perkembangannya embrio tersebut ditumbuhkan secara aseptik dalam medium buatan.
3.2.5. Fertilisasi semu. Hasil fertilisasi semu antar marga bisa
berkembang dalam kultur buatan secara aseptik dan menghasilkan tanaman haploid.
3.2.6. Penumbuhan ovul yang tidak dibuahi dalam kultur buatan
secara
aseptik.3.2.7. Kombinasi antara radiasi gamet dan kultur ovari.
4. Kultur Anter atau Polen.
Kultur anter rnerupakan salah satu cara untuk mendapatkan tanaman haploid secara in-vitro. Dalam kenyataannya dari kultur ini tidak hanya
tanaman haploid yang bisa dihasilkan, tetapi juga bisa muncul tanaman-
tanaman dengan tingkat ploidi yang lebih tinggi. Kenyataan ini ada
keuntungannya karena berarti memperkaya keragaman genetik tanaman
tersebut yang mungkin berguna dalam usaha pemuliaannya.
4.1 Faktor-faktor yang bemngaruh terhada~ keberhasilan kul tur an ter
atau polen. Suatu pertumbuhan dan perkembangan hayati baik
dalam kondisi in-viw maupun dalam kondisi in-virro merupakan
hasil interaksi antara faktor genetik dan faktor lingkungan. Anter
sebagai organ tanaman merupakan gabungan dari jaringan sel-sel
somatik dengan sel-sel generatif. Secara fisik kedua macam jaring-
sulit dibedakan. Prinsip dalam kultur anter adalah menghambat
pertumbuhan dan perkembangan sei-sel somatik tetapi merangsang
pertumbuhan dan perkembangan sel-sel generatif. Hal ini dicajxii
dengan memanipulasi kondisi lingkungan secara empiris dan secara uji coba. Keberhasilan kultur anter ditentukan oleh banyak
faktor. Faktor-faktor tersebut antara lain:
4.1.1. Keraeaman tanaman donor. Berbagai percobaan klah
menunjukkan bahwa tanaman donor sangat menentukan
pertumbuhan dan perkembangan anter dalam kultur.
Keragaman donor bisa bersifat genetik bisa juga bersifat
fisiologis. Redenbaugh, West fall dan Karnosky (198 1)
melaporkan bahwa kemampuan membentuk kalus dari
anter UImus americana yang berasal dari empat macam genotip secara statistik berbeda nyata. Demikian juga Thuding dan Chay (1984) menyatakan bahwa pertumbuhan
dan perkembangan anter Brussica napus ssp.oleiftra dalam
kultur dipengaruhi genotipe dan kondisi tanaman donor.
Hal serupa juga dilaporkan pada kultur anter Arabidopsis
thaliaM (Gresshoff dan Doy, 1972a), Lycopersicon escu-
lentum (Gresshoff dan Doy, 1972b), Solanum tuberosum
(Dunwell dan Sunderland, 1973), Solanwn phureja dan
silangan-silangannya (Singsit dan Veilleux, 1989), Brussica
campcrrris (Keller, Raj hathy dan Lacapra, 1979, Oryza
sativa (Martin dan Millo, 1981), Prunus persica (Harn-
Fitch, 1984), ZFiticwn aestivwn (Jones dan Petolino, 1987). Solanwn spp. (Powell dan Uhrig, 1987). Hordewn vulgare (Powell, 1988) dan &paver somnivenun (Dieu dan Dunwell, 1988).
Di antara anter berbagai jenis tanaman, anter dari
suku Solanaceae termasuk paling tanggap terhadap perla-
kuan dalam kultur. Walaupun derniician ternyata anter dari
beberapa jenis dan galur Lycopersicon (Gresshoff dan Doy,
1972b) dan Solanwn (Dunwell dan Sunderland, 1973;
Singsit dan Veileux, 1989) ada yang kurang tanggap terha- dap berbagai perlakuan dalam kultur. Perbedaan daya
tanggap (respon) terhadap kondisi kultur tidak hanya terli-
hat antar jenis atau galur saja tetapi bisa terlihat antar
tangkai bunga. ~h'ien dan Kao (1983) melaporkan bahwa
kemampuan membentuk kalus dari anter yang berasal dari
bulir (spike) yang berbeda dari satu tanaman triticale
ternyata tidak sarna. Dunwell dan Cornish (1985) menda- patkan bahwa pada Brassica
napw
ssp. oleijiera kemam-puan membentuk embrio dari bunga apikal lebih tinggi
daripada bunga aksilar.
4.1.2. Stadium anter atau polen. Pertumbuhan dan perkem-
bangan anter atau polen dalam kultur tergantung pada
stadium anter atau polen yang dikulturkan. Nitsch dan
stadium tetrad atau polen yang sudah tua ("maturew) tidak
bisa beregenerasi menjadi tanaman. Pembentukan pinak
tanarnan atau planlet ("plantlet") paling banyak dihasilkan
dari polen dalam stadium berinti satu ("uninucleate") yang
belum mengandung pati ("starch").
Hu dan Zeng (1984) menyimpulkan bahwa untuk
berbagai jenis serealia stadium polen yang tepat untuk dikulturkan adalah pada stadium awal sampai stadium akhir
berinti satu. Hal serupa juga dijumpai pada berbagai jenis
tanaman lain seperti Brassica campestris (Keller et al, 1975), Oryta sativa (Genovesi dan Magill, 1979; Rush,
1981; Mercy dan Zapata, 1987), Ulmus america (Reden-
baugh et al, 1981), Carica papaya (Tsay dan Su, 1985),
Prunm persica (Hammerschlag, 1983), Hordeum vulgare
(Wheatley, Marsolais dan Kasha, 1986), Brassica napus
(Thurfing dan Chay, 1984; Pechan dan Keller, 1988) dan
Zea mays (Coumans, Sohota dan Swanson, 1989).
Sunderland dan Roberts (1977), Reynolds (1 986),
Mercy dan Zapata (1986) masing-masing pada tanaman
Nkotiana tabacm, Sokanum carolinenre dan Oryza sativa mendapatkan bahwa sampai pada stadium berinti dua
("binucleate") polen dari tanaman-tanaman tersebut masih
mampu menghasilkan planlet dalam kultur. Pada tanaman
Arabidopsis thaliana dan Lycopersicon esculenrwn polen
dalam stadium berinti satu tidak mampu menghasilkan
kaius apalagi menghasilkan planlet. Pada kedua jenis
stadium meiosis-metafase pertama (Gresshoff dan m y ,
1972a, 1972b).
4.1.3.
Pra~erlakuan.
Praperlakuan yang diberikan terhadappolenatauanter dimaksudkan untuk mempengaruhi pertum-
buhan dan perkembangannya dalam kultur. Praperlakuan
tersebut diharapkan mampu mengubah pola perkembangan
polen dari pola normal ke arah pembentukan embrio.
Praperlalcuan yang biasa diberikan pada umumnya berupa penyimpanan pada suhu rendah di tempat gelap (Sunder-
land dan Roberts, 1977; Genovesi dan Magill, 1979; Rush,
1981; Fitsch dan Moore, 1983).
Suhu penyimpanan yang biasa digunakan berkisar
antara 5°C sampai 13°C. Pada Pclpaver somnijienun L. perlakuan anter pada suhu 7°C selama 7 hari telah mening-
lcatkan jumlah antel yang tumbuh dan pembentukan kalus
rneningkat jadi dua kali lipat (Dieu dan Dunwell, 1988).
Powell (1988) mendapatkan bahwa jangka waktu perlakuan
dingin selama 21 hari pada suhu 4OC adalah yang optimum
bagi bulir Hordewn vulgare.
Menurut Marsolais, Swartz dan Kasha (1 984) perla-
kuan penyimpanan anter mticwn aestivurn pada suhu -5 _+
3°C sampai 10
+
2°C dianggap tidak perlu. Respon anterdalam kultur malah dihambat pada perlakuan yang lebih
diberi perlakuan dingin selama 14 hari pada suhu 4°C.
Sharma dan Bhojwani (1985) melaporkan bahwa anter
Brassica junceu yang diperlakukan pada suhu 35°C selama
1-5
hari memberikan respon jauh lebih baik daripada yangdiperlakukan pada suhu 5°C selama
1-5
hari atau perlakuankon trot (25°C).
Sunderland dan Roberts (1977) menyimpan anter
N W a m tabacwn pada suhu 7-8°C selama 12 hari. Selan- jutnya kultur diinkubasikan selama 14 hari pada suhu 28°C
dalam keadaan gelap kemudian diinkubasikan dalam
keadaan terang pada suhu 25°C.
Powell dan Uhrig (1987) menyimpan anter Wanwn tuberoswndan Solanwn papita pada suhu 6°C atau 30°C selama 2 hari sebelum dikulturkan. Secara keseluruhan praperlakuan pada suhu 6°C memberikan jumlah pem- bentukan embrioid jauh lebih tinggi daripada praperlakuan
pada suhu
30°C.
Waupun demikian ternyata pemben-tukan embrioid pada kedua praperlakuan suhu tersebut
tidalc berbeda nyata dengan kultur tanpa praperlakuan.
1.4. Komposisi medium. Pierik (1987) menyimpulkan bahwa
medium yang digunakan untuk kultur anter tergantung pada
jenis tanaman donor. Gresshoff dan Doy (1972b) menda-
p a t h dari 43 galur Lycopersicon esculenfwn hanya 3 galur saja yang bisa menghasilkan kalus dalam 2 macam
medium dasar yang dicobanya.
Di antara berbagai medium kultur nampaknya
paling umum digunakan. Medium Murashige dan Skoog
telah dipakai untuk kultur anter Solanwn tukroswn (Dunwell dan Sunderland, 1973), Nicotim tabucum (Sunderland dan
Roberts,
1977), Solanwn carolinense (Reynolds, 1986), Olym saiva (Martin dan Millo, 1981; Torrim dan Zapata, 1986), Loliwn multiJlonun (Dale, Thomas, Brettell dan Wemicke, 1981), Carica pcrpaya (Tsay dan Su, 1985) dan Hordewn vulgare (Powell, 1988).Pada kultur anter jenis-jenis serealia medium yang sering
digunakan anatara lain adalah medium N6 (Genovesi dan Magill, 1979; Chien dan Kao, 1982; Huang, 1987; Jones
dan Petollino, 1987; Mercy dan Zapata, 1987).
Di antara garam-garam anorganik penyusun medium, garam nitrat dan amonium merupakan sumber nitrogen
yang sering sangat berpengaruh terhadap pertumbuhan dan
perkembangan anter dalam kultur. Guo dan Ouyang
(1988) menyatakan bahwa peningkatan kadar
KNO,
sampai13 mM meningkatkan jumlah pembentukan kalus pada
kultur anter dari 4 kultivar Tnricwn aesrivum. Pening katan kadar
KNO,
j uga meningkatkan pembentukan planlet yang berwama hijau dan menurunkan pembentukan planlet yang albino. Apabila kadarKNO,
melebihi 20 mM makainduksi pembentukan kalus sangat menurun. Biddington,
Shuterland dan Robinson (1988) melaporkan bahwa anter
Brassica oleifera var.gemifara yang kurang tanggap terha- dap kondisi kultur ada harapan bisa membentuk embrio
kultur yang digunakan (medium
B5).
Nitsch dan Nitsch(1969) men yatakan bahwa pada kultur anter Nicotiana tabacum var. Wisconsin 38, ion nitrat jauh lebih ber- pengaruh terhadap pembentuh planlet daripada ion
amonium.
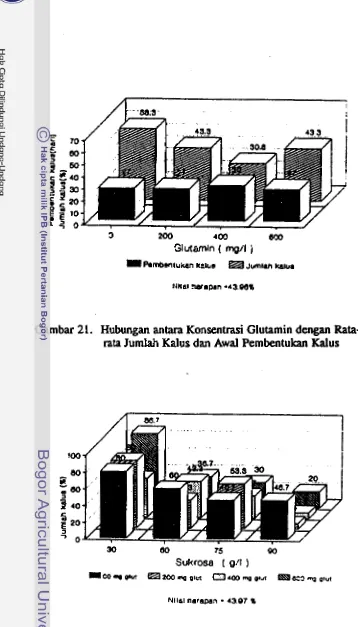
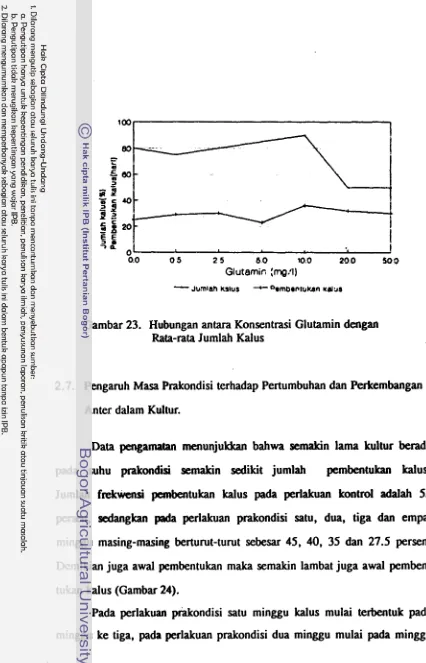
Dari kelompok asam-asam organik diketahui bahwa
glutamin atau L-asparagin dengan konsentrasi 1 x 1 0 4 ~
sampai 3 x 1 0 " ~ dalam medium kultur dapat merangsang
pembentukan planlet. Sebaliknya L-arginin atau adenin
dengan konsentrasi 1 x 104M sampai 4x 104M bersifat
rnenghambat (Nitsch dan Nitsch, 1969). Keller et al (1975) juga melaporkan bahwa perkembangan embrioid
kultur anter Brassica campestris dirangsang oleh glutamin. Reinert dan Bajaj (1977) menyatakan bahwa kebutu-
han hara bagi kultur anter lebih sederhana daripada untuk
kultur polen. Dunwell dan Sunderland (1973) dalam
percobaan kultur anter Solanwn tuberoswn dalam enam macam medium dasar menyimpulkan bahwa komposisi
hara medium tidak terlalu kritis dalam menginduksi
pembentukan kalus. Dalam ha1 tersebut nampaknya yang
paling berpengaruh terhadap pertumbuhan dan perkem-
bangan anter dalam kultur adalah jenis dan konsentrasi zat
pengatur tumbuh yang diberikan ke dalam medium.
Pembentukan kalus, pucuk, akar atau planlet tergantung pada macam, konsentrasi dan kornbinasi zat pengatur
Indol-3yl acetic acid (IAA) dengan konsentrasi
optimum 0.1 mgll merangsang pembentukan planlet pada
kultur anter Nicotiana tabacwn (Nitsch dan Nitsch, 1969).
Pada kultur anter Solanwn carolinense jumlah pemben-
tukan embrioid tertinggi didapatkan pada perlakuan dengan
konsentrasi IAA sebanyak 10 mgll medium (Reynolds,
1986).
Naphth-lyl acetic acid (NAA) dengan konsentrasi
0.1 mg atau 0.5 mgll medium pada kultur anter Lycopersi-
con esculentwn ternyata menghambat pembentukan klorofil
(warna hijau) pada kalus dan juga menghambat difefensiasi
kalus (Gresshoff dan Doy, 1972b). Pada kultur anter
empat kultivar Orym sariva, Martin dan Millo (1981) melaporkan bahwa NAA dengan konsentrasi 0.2 mg atau 2.0 mg/l medium merangsang pembentukan planlet dan
pembentukan akar.
2,4-dichlorophenoxyacetic acid (2,4-D) pada kultur
anter Nicotiana tabucum ternyata dapat merangsang
pembentukan planlet (Nitsch dan Nitsch, 1969). Pada
kultur anter Oryta sariva pemberian 2,4-D sebanyak
0.2 mg atau 2.0 mgll medium merangsang pembentukan
katus, tetapi pada dua dari empat varietas padi yang dicoba
malah menghambat pembentukan organ (Martin dan Millo,
1981).
Guha, Iyer, Gupta dan Swaminathan (1970) menya-
t a b bahwa perkembangan dari kalus menjadi planlet pada
tanpa auksin. Gresshoff dan Doy (1972a) menyatakan
bahwa induksi kalus dari anter Arabidopsis thaliana memerlulcan konsentrasi auksin yang tinggi, sebaliknya
untuk pembentukan embrioid dan planlet diperlulcan kon-
sentrasi auicsin rendah.
Pada kultur anter Arabidopsis thaliana diferensiasi
dari kalus menghendaki konsentrasi kinetin yang tinggi
(10 mgll) sebaliknya pada kultur anter Lycopenicon escu-
lentum konsentrasi kinetin sebanyak itu malah mematikan kalus yang sudah terbentuk (Gresshoff dan Doy, 1972b).
Chien dan Kao (1983) menyatakan bahwa di antara zeatin,
kinetin dan 6-benzyladenine (BA) maka BA adalah yang
paling efektif dalam meranmgsang pembentulcan kalus dari
anter tetapi menghambat pembentukan kalus dari filamen.
Gibberellic acid (GA) pada konsentrasi 1 mgll
medium tidak meningkatkan pembentukan embrio tetapi
memacu pembentukan planlet pada kultur anter Nicotiana spp. (Nitsch dan Nitsch, 1969). Pada konsnetrasi lmgll medium, GA menyebabkan pemanjangan hipokdil abnor-
mal dan menghasilkan tanaman yang kurus serta klorosis.
Abscisic acid (ABA) dengan konsentrasi sampai
lo-' M (0.02 sampai 2.0 mgll) pada kultur anter Nicotiana
spp. tidak berpengaruh terhadap jumlah pembentukan planlet tetapi menghambat perkembangan planlet selan-
jutnya (Nitxh dan Nitsch, 1969). Mereka juga mela-
porkan bahwa pemberian ABA dengan konsentrasi 104 M
yang terbentuk lebih pendek dan lebih tebal daripada
perlakuan kontrol dan tetap tidak berkembang sampai
paling singkat dua bulan kemudian. Sebaliknya pada
kultur anter Oryta sufivu grOrino dan Zapata, 1986) pemahian A M dengan konsentrasi 4 x 106 M (0.8 mg/l) temyata meningicah berat segar kalus dan juga mening- katkan jumlah kalus yang menghasilkan planlet yang
b e m a hijau. Penggunaan ABA pada konsentrasi yang
lebih tinggi menghambat pertumbuhan kalus dan kalus
yang terbentuk lebih kompak serta berwarna putih. Kalus
semacam ini mempunyai harapan rnenghasilkan planlet
lebih tinggi daripada kalus yang longgar. Pembentukan
plank yang bewarna hijau secara nyata semakin mening-
kat pada perlakuan dengan konsentrasi ABA yang lebih
tinggi. Peningkatan pembentukan kalus dan planlet pada
kultur anter Olyta sariva sebagai akibat pemberian ABA
juga telah dikemukakan oleh Zapata, Aldemira, Novero,
Torrizo, Megaling, Mazaredo, Visperas, Lim dan Moon
(1986). Mereka mengemukakan bahwa jumlah pemben-
tukan kalus tertinggi didapatkan pada perlakuan dengan
konsentrasi A M 20
-
30 mgll medium, sedangkan pem-bentukan planlet tertinggi didapatkan pada perlakuan
dengan konsentrasi ABA sebanyak 10
-
20 mgll medium.Gula dalam medium kultur tidak hanya berfungsi
sebagai pengatur tekanan osmotik tetapi juga merupakan
sumber karbohidrat yang efektif (Hu dan Zeng, 1984).
sumber gula terbaik dibanding dengan glukosa, maltosa
atau rafmosa. Mereka juga menyatakan bahwa anter Brassica cumpestris membutuhkan konsentrasi gula yang tirtggi bagi pertumbuhan dan perkembangannya dalam
kultur. Apabila konsentrasi gula dalam kultur kurang dari
6 persen (60 gll medium) maka tidak
akan
k h m t u k embrioid, sedangkan pada konsentrasi gula 2 persen ter- bentuk kalus dari filamen dan dinding anter. Peningkatankonsentrasi gula dalam medium kultur temyata mengham-
bat pernbesaran set-sel somatik dan pembentukan kalus dari sel-sel somatik tetapi merangsang pembelahan sel dari
polen. Frekwensi pembentukan embrioid tertinggi dida-
patkan pada perlakuan dengan kandungan gula sebanyalc 10
persen (100 gll medium). Waupun demikian ternyata
perkembangan emhrioid selanjutn ya han ya bisa berlang-
sung &lam medium dengan kadar gula rendah (2 persen)
dan tanpa zat pengatur tumbuh. Sebali kn ya Redenbaugh et a1 (1981) rnendapatkan bahwa pembentukan planlet dihapioid pada kultur anter Ulmus amricana makin meningkat akibat interaksi antara kandungan gula dan zat
pengatur tumbuh dalam medium kultur.
Pierik (1987) menyatakan bahwa kandungan gula
dalam medium kultur pada umumnya berkisar antara 2
-
4persen, tetapi untuk jenis-jenis tanaman tertentu kadar gula
ini bisa lebih tingggi. Hu dan Zeng (1984) mendapatkan
bahw untuk serealia kandungan gula tertinggi dalam
anter triticale pembentukan kalus jauh lebih baik pada perlakuan dengan kandungan gula 100 g/l dibanding
dewan kandungan gula 60 gll medium.
4.1.5. Rntuk fisik medium kultur. Bentuk fisik medium untuk
kultur anter bisa berbentuk padat bisa berbentuk a i r .
Medium bentuk cair antara lain telah digunakan pada
kultur anter Nicotiana tu6acum (Sunderland dan
Roberts,
1973, Sorghum bicolor (Rose, Dunwell clan Sunderland, 1986), Oryza sativa (Mercy dan Zapata, 1987) dan Wti- cum aesrivwn (Huang, 1987; Jones dan Petolino, 1988).Pescitelli, Mitchell, Jones, Pareddy dan Petdim
(1989) untuk pertama kalinya berhasil meregenemilcan
tanaman dari mikrospora jagung yang diisolasi. Pada
percobaannya didapatkan bahwa pembentukan embrioid
dalam medium c$r jauh lebih tinggi daripada dalam
medium semi padat.
Jones dan Petolino (1988) mendapatkan pada kultur
anter lkiticum aestivum jumlah pembentukan embrio dalam
medium cair sebanyak dua kali lipat dalam medium padat.
Walaupun kmikian ternyata jumlah planlet hasil regenera- si dari embrio yang terus menerus ditumbuhkan dalam
medium cair jauh lebih rendah daripada dalam medium
padat. Oleh sebab itu medium cair hanya digunakan untuk
merangsang embriogenesis dan pemben tukan kalus.
Perkembangan selanju tnya sampai pembentu kan planlet
4.1.6. pen~inara~. Sinar bagi tumbuhan berperan dalam proses fotosintesis yang selanjutnya mempengaruhi kegiatan
metabolism. Selain itu sinar juga mengatur metabolik
yang berarti mengatur perkembangan suatu unit melalui
sistem pigmen, hormon atau mekanism lainnya. Oleh
sebab itu pengaturan lama penyinaran, intensitas penyinar-
an dan kualitas sinar dapat digunakan untuk memanipulasi proses pertumbuhan dan perkembangan unit turnbuhan.
Sunderland dan Dunwell (1977) menyatakan bahwa
kultur anter bisa langsung disinari sejak awal atau setelah
melalui masa induksi singkat dalam kondisi gelap. Pada
kultur anter Nicotiana tabucum perlakuan gelap selama 14
hari pada suhu 2S°C sebelum perlakuan terang membexikan tingkat keberhasilan paling tinggi (Sunderland dan Roberts; 1977). Demikian juga pada kultur anter Carica papaya, Tsay dan Su (1985) mendapatkan tingkat pembentukan
kalus yang tinggi pada perlakuan gelap, sedangkan pem- bentukan embrio dan planlet juga dirangsang pada perla-
b a n dengan intensitas penyinaran yang rendah (1.500
Iuks). Pada kultur anter U h u s m r i c a n a , Redenbaugh et a1 (1981) mendapatkan bahwa kultur yang terus menerus diinkubasikan di tempat gelap menghasilkan tingkat kalus
haploid yang lebih tinggi (15.9 96) daripada kultur yang
dipindahkan dari tempat gelap ke tempat terang dengan
lama penyinaran 16 jam sehari; sedangkan kultur yang
terus menerus mendapat penyinaran 16 jam sehari
(1987) mendapatkan bahwa anter dari beberapa genotipe
mticwn aestivwn membutuhkan penyinaran harian yang
lebih panjang (16 jam) sedangkan beberapa genotipe
lainnya membutuhkan penyinaran harian yang lebih pendek
(12 jam) baik untuk pembentukan embrio maupun untuk
pembentukan planlet.
Pada umumnya pembentukan kalus atau pemben-
tulcan akar menghendaki kondisi gelap, sedangkan pemben-
tukan pucuk atau planlet menghendaki kondisi terang
(Gresshoff dan Doy, 1972a, 1972b; Martin dan Millo,
1981; Dieu dan Dunwell, 1988). Waupun demikian
ternyata pembentukan embrio ataupun plankt pada kultur
anter Digitalis obscura bisa tejadi dalam kondisi gelap
apabila medium kultur mengandung IAA atau IBA (Bermudez, Cornejo dan Segura, 1985).
4.1.7.
&&,-I.
Setiap reaksi metabolik dicirikan oleh koefisiensuhu. Perubahan suhu mempengaruhi perimbangan masing-
masing reaksi. Dampak lain dari perimbangan tersebut
antara lain akan terlihat dalam wujud pertumbuhan dan
perkembangan. Manipulasi suhu kultur untuk mem-
pengaruhi pertumbuhan dan perkembangan anter dapat
dimulai sejak praperlakuan, tetapi dapat juga hanya selama
kultur diinkubasikan.
Suhu inkubasi pada kultur anter dari beberapa jenis
tanaman pada umumnya berkisar pada 2S°C (Guha et al, 1970; Genovesi dan Magill, 1979 Redenbaugh et al, 198 1 ;
siang hari yang lebih tinggi daripada malam hari (Nitsch dan Nitsch, 1981) bisa juga suhu masa induksi yang berbe- da dari suhu masa inkubasi selanjutnya (Sunderland dan Roberts, 1977; Hammerschlag, 1983). Induksi punbentu- kan kalus biasanya dilakukan pada suhu rendah disertai kedaan gelap, sedangkan embriogenesis dan pembentukan planlet dilakulcan pada suhu lebih tinggi dan dalam keadaan terang (Rush, 1981). Nitsch dan Nitsch (1969) menginku-
basikan kultur poien N W a n a tabacum pada suhu 28°C siang hari dan 22°C pada malam hari. Sunderland dan Roberts (1977) melaporkan bahwa suhu terbaik untuk masa
induksi dan masa inkubasi bagi kultur polen Nicotiana tabacum adalah pada suhu 2S°C. Pada kultur anter Prunus persica suhu inkubasi untuk pembentukan kalus paling baik adalah pada suhu tetap 26°C dengin pemindahan kultur ke
dalam medium segar setiap tiga minggu sekali (Ham- merschhg, 1983).
Menurut Huang (1987) kulktur anter 'Ifiticurn aes- tivum yang diinkubasikan selama 8 hari pada suhu 3S°C atau 30°C &lum diinkubasikan pada suhu 25°C mengha- silkan kalus dan planlet jauh lebih banyak daripada yang
t e ~ s menerus diinkubasikan pada suhu 25°C. Rose et a1 (1986) melaporkan bahwa pembentukan kalus pada suhu
inkubasi 33°C jauh lebih baik daripada suhu inkubasi 25"C,
28°C atau 38°C bagi kultur anter Sorghum bicolor. Pada anter yang tidak diberi prapedakuan dingin malah hanya
anter yang diinkubasikan pada suhu 33°C saja yang
4.2.
.
Pertumbuhan danperkembangan anter atau polen dalam kultur merupalcan hasil interaksi antara faktor genetik dengan faktor luar. Sacara teori polen hapbid
akan
menghasilkan tanaman haploid, tetapikarena
pengaruh faktor luar polen tersebut dalam pertumbuhandan
perkermbangannya bisa mengalami endomitosis sehingga b i nmemunculkan individu-individu dengan tingkat ploidi yang
berbeda.
Sel-se4 somatik dari anter pun dapat tumbuh dan berkem-
bang menjadi tanaman. 'haman yang tumbuh dari kultur mu-
ngkin berasd tidak dari satu sel tetapi berasal dari beberapa sel dengan tingbt ploidi yang berbeda.
4.2.1. Tinekat ploidi. Konsekuensi dari interaksi antara faktor
genetik dengan faktor luar dalam kultur anter bisa mengha-
silkan terbentuknya tanaman-tanaman dengan tingkat ploidi
yang berbeda. Keragaman tersebut akan diperbesar apabila
sel-se4 somatik turut berkembang menjadi tanaman.
Pada kultur anter Oryu sarivu, Martin dan Millo
(1981) medapatkan bahwa semua planlet yang dihasilkan
adaiah haploid; Genovesi dan Magill (1979) mendapatkan
40 penen planlet haploid dan 60 persen diperkirakan diploid; sedangkan Mercy dan Zapata (1986) mendapatkan
hasil 42.1 persen haploid, 56.4 persen diploid dan 1.5
persen polyploid.
Marsolais er a1 (1984) mendapatkan 18 tanaman
haploid dan 1 tanaman diploid pada kultur anter Triricwn
et a1 (1975) mendapatkan 1 tanaman haploid
,
20 tanaman diploid, 2 tanaman tetraploid dan 2 tanaman heksaploid. Pada kultur anter Brassica juncea semua @anlet yang terbentuk adalah haploid (Sharma dan Bhoj wani, 1985).'Emaman yang diregenerasikan dari anter Digitalis
purpurea temyata sebanyak 50 persen haploid, selebihnya diploid atau tetraploid (Bermudez et al, 1985). Dieu dan Dunwell (1988) dari percobaannya mendapatkan hasil regenerasi anter Papaver somnijienun sebanyak 1 tanaman haploid, 60 tanaman diploid dan 2 tanaman haplo-diploid. Redenbaugh et a1 (1981) dari kultur anter Ulmw america- M (4x = 56) mendapatkan kalus dihaploid sebanyak 0
-
38 persen tagantung pada medium kultur yang digunakan.Gresshoff dan Doy (1972a, 1972b) mendapatkan semua tanaman hasil regenerasi dari kultur anter Arabidopsis thaliana dan Lycopersicon esculentwn adalah haploid.
Singsit dan Veileux (1989) pada kultur anter dari galur dan silangan-silangan antar jenis Solanwn phureja yang diploid mendapatkan 29 tanaman monoploid di
antam 91 tanaman yang berhasil diregenerasikan dari
9.465 anter yang dikulturkan. Pescitelli et a1 (1989) mendapatkan bahwa di antara tanaman yang diregenerasi-
kan dari kultur polen jagung ternyata ada yang bisa meng- hasilkan biji yang berarti teiah terjadi penggandaan jumlah
krornosom.
4.2.2. Mutan. Selain kelainan tingkat ploidi, planlet yang diha-
silkan dari kultur anter juga bisa menampakkan kelainan
kultur anter sangat rendah (Sunderland dan Dunwell, 1977). Untuk meningkatkan jumlah mutan bisa dilakukan
dengan penyinaran sinar gamma pada kuncup bunga yang
akan
dikulturkan atau pada saat planlet mulai muncul dari anter. Pembentukan mutan juga bisa dirangsang denganbahan kimia mutagenik seperti ethyl methane sulphonate
(EMS)
pada kultur suspensi.4.3. .Manfaat kultur anter. Kultur anter sebagaimana umumnya kultur
jaringan dapat dimanfaatkan untuk berbagai tujuan. Dalam pemu-
liaan tanaman kultur anter merupakan sumber keragaman genetik, sumber keragaman karakter dan juga dapat digunakan sebagai
jalan pintas dalam pembentuh galur murni.
4.3.1. Kera~aman iumlah kromosom. Kromosom dalam sel
diploid berada dalam pasangan-pasangan homolog.
Masing-masing anggota pasangan diwariskan dari tanaman
induk melalui penggabungan inti polen dan inti sel telur. Demikian juga gen-gen yang mengontrol suatu karakter
berada dalam pasangan-pasangan yang disebut alel. Dalam proses meiosis terjadi lagi segregasi kmmosom yamg
berarti juga segtegasi gen.
Keragaman jumlah kromosom pada tanaman andro-
gen (Keller et al, 1975; Bajaj
,
1983; Hu dan Zeng, 1984; Mercy dan Zapata, 1986; Dieu dan Dunwell, 1988)memiliki sifat yang sama. Owen, Veileux, Heynes dan
Heynes (1988) mendapatkan bahwa tanaman-tanaman
androgen monoploid dari Solanurn phureja memperlihatkan
pertKdaan
yang sangat nyata dalam ha1 berat umbi danjumlah umbi yang dihasilkan dalam lingkungan tumbuh
yang sama.
4.3.2. Seleksi karakter. m a m a n monoploid mempermudah
seleksi
kmna penampilan fenotipe daritanaman
tersebut merupakan reflelcsi dari sifat genotipenya (Owen et al, 1988). Pada tanaman monoploid tidak a& sifat yang terse- lubung karena tidak ada dominasi gen. Ekspresi gen resesifakan
muncul dan timbulnya mutasi mudah dilihat (Mercydan Zapata, 1986). Tmnaman padi haploid hasil dari h l t u r
anter dilaporkan berbatang lebih pendek, berdaun lebih
pendek dan lebih sempit, lebih banyak anakan, bermalai
lebih pendek dengan percabangan lebih sedikit dan ukuran
bulirnya lebih Icecil (Mercy dan Zapata, 1986).
Tingkat munculnya sifat resesif dalam populasi
tanaman androgen jauh lebih tinggi daripada dalam popula-
si tanaman
F2
(Hu dan Zeng, 1984). Dalam populasiF2
silangan gandum berbutir merah dengan gandum berbutir putih, perbandingan tanaman berbutir merah dengantanaman berbutir putih adalah 3.1 banding 1; dalam popu-
lasi H2 perbandingan tersebut rnenjadi 0.8 banding 1.
Sifat berbutir putih yang merupakan sifat resesif semakin
tinggi tingkat pemunculannya dalam populasi tanaman
androgen. Chien dan Kao (1983) pada kultur anter triti-
(bulai). Hunter (1985) melaporkan bahwa jumlah tanaman
albino pada kultur anter Hordewn vulgan jauh lebih banyak daripada tanaman yang hijau: sedangkan
Rose
et a1 (1973) dari kultur anter Sorghum bicolor hanya mendapat-kan 4 tanaman yang kesemuanya albino.
4.3.3. Pembentukan galur mumi. Pembentukan galur murni
dengan cara pembuahan sendiri dan seleksi pada ketunm- annya sangat memakan waktu. Galur murni yang mantap
sebagai turunan dari suatu hasil silangan baru akan dida- patkan padagenerasi keenam (Hu dan Zeng, 1984) bahkan mungkin baru pada generasi kesepuluh @epaepe, Nitsch,
Godard dan Pemes, 1977) apabila dilakukan dengan cara konvensional. Melalui teknik kultur anter dan penggan-
dam kromosom, galur murni yang mantap sudah bisa didapatkan pada generasi kedua (Hu dan Zeng, 1984).
Mereka melaporkan bahwa suatu varietas tembakau sudah
bisa dilepas untuk tujuan produksi dalam jangka waktu tiga tahun sejak anter dikulturkan.
Salahsatu teknik pmggandaan kromosom adalah
dengan penggunaan kolkisin. Griesbach (198 1) mengocok protokorm anggrek dalam medium Murashige-Skoog cair
yang diberi kolkisin sebanyak 50 mgll medium. Lama
pengocokan sepuluh hari dengan kecepatan kocokan 50 putaran permenit. Selanjutnya protokorm dipindahkan ke
dalam medium padat. Dengan teknik ini sekitar 50 persen tanaman yang ditumbuhkan dari biji tanaman diploid
Perlakuan kolkisin juga bisa diberikan terhadap
planlet yang barn muncul dari anter atau diberikan pada
ketiak daun pada planlet yang dewasa dengan rnengguna-
kan campuran kolkisin &%an lanolin (Bajaj, 1983).
Penggandaan jumlah kromosom juga bisa w a d i
1. Bahan dan Alat
1.1. Bahan tanaman. Biji Solanum Wurrianwn Clarke diperdeh dari kebun percobaan Balai Penelitian m a m a n Rempah dan Obat di Mano-
ko-Lembang. Biji krsebut masing-masing berasal dari tiga fenotipe
tanaman yaitu fenotipe berduri banyak-bengkok, fenotipe berduri banyak-
lurus dan fenotipe berduri jarang-lurus. Dalam penelitian ini hanya
bunga dari fenotipe berduri jarang yang dipakai sedangkan dari fenotipe
lainnya hanya &dar untuk pembanding.
Biji disemaikan dalam baki plastik atau dalam kantumg -kantung
plastik kecil yang berisi campuran tanah dan pupuk kandang dengan
perbandingan 2:l. Setelah berumur dua bulan semai dipilih dan dipin- dahkan Ire dalam kantung plastik hitam berukuran 40 x 60 cm yang diisi campuran tanah dan pupuk kandang seperti medium untuk penyemaian biji. Ke dalam campuran tanah tersebut juga ditambahkan pupuk TSP dan KC1 masing-masing sebanyak 100 g serta urea sebanyak 150 g per kantung tanaman. Pupuk
TSP
dan KC1 diberikan pada waktu pemin-dahan semai, sedangkan urea diberikan dua kali yaitu pada waktu pemin-
dahan semai sebanyak setengahnya dan sisanya diberikan sebulan kemu-
dim.
Tanaman ditempatkan di tempat terbuka atau pun dibawah naungan
atap plastik. Daerah penanaman dipilih di kompleks IPB Baranangsiang
1.2. ,&than kimia Bahan-bahan kimia penyusun medium kultur terdiri
dari bahan-bahan himia dengan mutu analitik, demikian pula zat pengatur
tumbuh yang dlgunalcan. Sukrosa yang digunakan berupa s u h s a mutu
teknis yang berwarna putih bersih. Medium padat dibuat dengan
menambahkan 0.6 persen Difco Bacto Agar. Pada kebanyakan perm- baan ini medium dasar yang digunakan dibuat dalam sediaan pekat
yang
d i b e k u b . Penambahan zat pengatur tumbuh, bahan otganik lain, gula, agar dan pengukuran keasaman medium dilakukan pada saat medium
akan disterilkan.
Alkohol telatis 70 p e r m digunakan untuk mengelap tangan, rnernbersihkan kotak kultur ("laminar flow cabinet") dan menyemprot semua alat yang akan dimasukkan ke dalam kotak kultur. Untuk mensu- cihamakan bahan tanaman digunakan sodium hypochloride dengan merek
dagang Clorox atau Bayclean y,ang mengandung bahan aktif sodium
hypochloride (NaCtO) sebesat 5.25 persen.
1.3. Alat-alat. Wmgai wadah kultur digunakan tabung kultur berukur-
an 10 x 160 mm, 20 x 200 mm, 250 x 200 mm, tabung Ehrlenmeyer atau botol bundar berbagai ukuran bahkan juga botol selai, tergantung
pada keperluannya. Alat-alat lainnya yang digunakan dalam pengerjaan
kultur aniara lain pinset ukuran 10 cm baik berujung lengkung maupun berujung lurus, pinset ukuran 30 cm, jarum Ose, kaca pembesar dan
cawan petri.
1.4. Sterilisasi bahan dan alat. Bunga yang akan digunakan sebagai
dingin dicuci bersih d q a n air ledeng yang diberi beberapa tetes sabun
cair seperti tween atau teepol. Setelah dibilas bersih dengan air jedeng dan akuades bunga krsebut disterilkan dalam larutan clorox 25 persen selama 20 sampai 30 menit. Selanjutnya lamtan clorox dibuang dan bunga dibilas beberapa kali &ngan akuades yang telah disttrilkan.
Kecuali pekerjaan pencucian bunga dengan air ledeng, semua peketjaan
sterilisasi bunga sampai pembuatan kultur anter dilakukan dalam
kondisi
suci hama di dalamkotak
steril ("laminar flow cabinet").Medium kultur disterilkan &ngan jalan dipanaskan di dalam auto-
clav pada suhu sekitar 121°c dengan tekanan uap 15-16 psi (sekitar 1.5 kg/cm2) selama 30 menit. Demikian juga alat-alat yang digunakan dalam
pengejaan kultur disberilkan dengan jalan pemanasan di dalam autoclav atau dibakar dulu sampai pijar di atas nyala api lampu spiritus. Alat-alat- lainnya yang tidak tahan panas ,api dan tidak berhubungan langsung
&%an medium atau bahan tanaman disterilkan dengan cara dibilas
dengan alkohol70 persen.
Metoda Penelitian
2.1. Temoat. P d i h a r a a n tanaman sebagai sumber eksplan dilakukan
di lingkungan Jurusan Agronomi-Fakultas Pertanian-Institut Pertanian
Bogor dan di limgkungan Puslitbang Biologi di Bogor. Kegiatan
pembuatan kultur anter dilakukan di Laboratorium Kultur Jaringan
Jurusan Budidaya Pertanian-Fakultas Pertanian-Institut Pertanian Bogor,
Laboratorium Anggrek Kebun Raya Bogor dan Laboratorium Treub-
2.2.
e
n
.
Penentuan stadium polen dilakukan dengancara
pewarnaan umtuk melihat inti polen. Untuk maksud tersebut contohbunga diukur dulu panjangnya sebelum anternya dikeluarkan untuk
dipedwi stadium polennya. Panjang bunga diukur dari ujung bunga
sampai ke batas pertemuan antara pangkal dasar bunga yang menggem- bung dengan gagang bunga yang mulai mengecil. Pewarna
aceto-car-
min, acetwrcein atau campuran fastgreen dengan giemsa digunakan
untuk mewamai inti polen. Berdasarkan hasil pemeriksaan stadium
polen maka dicari hubungan antara panjang bunga dengan stadium polen.
Anter yang berasal dari berbagai ukuran panjang bunga (berbagai stadium polen), yaitu ukuran 2 mm sampai 9 atau 10 mm (bunga
mekar), dikulturkan secara in-vitro untuk melihat kemungkinan pertum- buhannya dan perkembangannya. Sebagai medium kultur digunakan
medium MS dengan konsentrasi NAA sebanyak 0.5 mgll, kinetin 1 mg/l,
sukrosa 20 gll dan agar 6 gll. Pemilihan medium MS sebagai medium kultur didasarkan pada kenyataan bahwa medium tersebut paling umum
digunakan untuk mengkulturkan eksplan dari berbagai jenis tanaman
termasuk dari suku terung-terungan (Dunwell dan Sunderland, 1973;
Sunderland dan Roberts, 1977; Reynolds, 1986). Kowalczyk, Macken-
zie dan Cocking (1983) telah berhasil meregenerasikan tunas dari daun
,
Percwn
1.
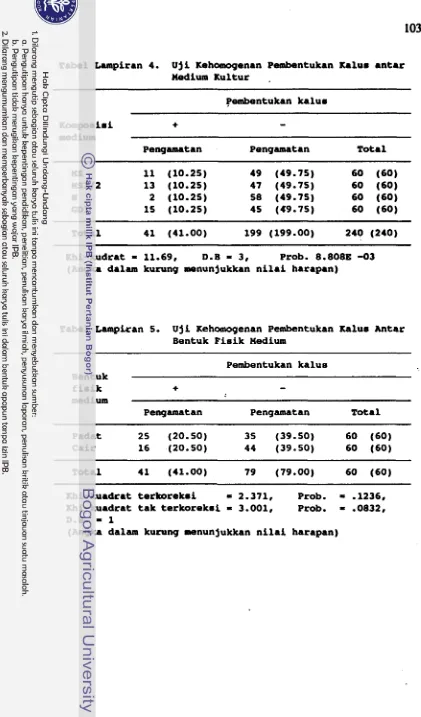
Pengaruh Komposisi Dasar dan Bentuk Fisik Medium Kultur terhadap Pertumbuhan dan Per- kernbangan Anter dalam Kultur.Dalam percabaan penjajagan tehukti bahwa anter mampu
membentuk kalus ddam medium Murashlge &
Skoog
(MS).
Berda- sarkan hasil penjajagan dan studi pustaka maka dicobakan untuk mag-kulturkan anter dalam beberapa medium kultur yang sudah baku. Susunan peroobaan adalah dua faktorial dengan rancangan percobaan
;beak Iengkap (RAL). Faktor pertama berupa empat macam komposisi
dasar medium kultur yaitu medium Murashige & Skoog (MS), medium
MS dengan konsentrasi ham makro setengahnya (MS1/2), medium Nitsch dan Nitsch (N) yang dimodifikasi dan medium
Gresshoff & Doy (GD). Komposisi medium dapat dilihat dalam Ethel Lampiran 1. Faktor kedua adalah bentuk fisik medium kultur yaitu bentuk padat {dengan penambahan agar) dan bentuk cair (tanpa agar
tetapi diberi kertas penyangga).
Ke
daiam medium ditambahltan sukrosa (mutu teknis) sebanyak 30 g/l, NAA sebanyak 0.01 mg/l dan kinetin sebanyak 0.1 mgll medium. Medium padat dibuat *an menambahkan agar Difco Bacto sebanyak 6gll medium sedangkan pada medium cair dipasang penyangga terbuat dari kertas saring. Keasaman medium kultur ditentukan sekitar 5.8
sebelum disterilkan dalam autoclave pada tekanan 15 psi selama 25
menit. Sebagai wadah digunakan tabung kultur (test tube) ukuran 1 x 16
Bunga yang bemkuran antara 4.5
-
5.0 mm setelah disimpanselama 48 jam pada suhu sekitar 10' C disterilkan dalam larutan clorox
25 persen selama 25 menit. Anter dikulturkan dalam tabung kultur.
Tiap tabuing berisi satu anter. Tiap perlakuan terdiri atas sepuluh
duplilcat dan masing-masing perlakuan diulang tiga kali. Kultur diletak-
kan pada rak dengan penyinaran 16 jam t e m g dan 8 jam gelap. Sumber cahaya berasal dari dua buah lampu tabung 40 watt yang terletak 50 cm di atas dasar rak. Suhu mangan berkisar sekitar 31' C pada s i q hari dan 26' C pada malam hari.
Pengamatan dilakukan selama tiga bulan. Unsur-unsur yang
diamati meliputi perubahan warna dari anter, jumlah anter yang berha- sil tumbuhlberkembang, bentuk pertumbuhanlperkembangan
dari
ankr dan morfolcgi bentuk pertumbuhanlperkemb~an anter.Analisis data kuantitatif disesuaikan dengan rancangan percobaan dan keadaan data.
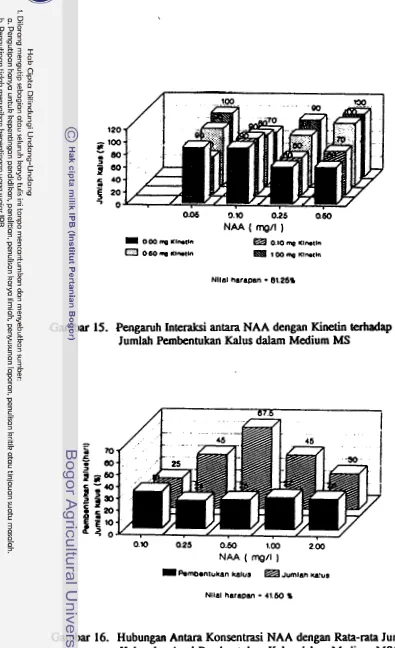
Percobaan 2, Pengaruh Konsentrasi NAA dan Kinetin terhadap
Pertumbuhan dan Perkembangan Anter dalam
Medium Kultur MS.
Dari hasil Peroobaan 1 didapatkan bahwa pembentukan kalus
terbanyak didapatkan dalam medium MS dan GDl dalam bentuk padat.
Waupun demikian tidak satu pun dari kalus yang terbentuk menghasil-
kan bentuk pertumbuhan lain selain dari kalus. Atas dasar ini dicoba
penggunaan auksin dan sitokinin dalam usaha memanipulasi kondisi
Susunan percobaan adalah dua faktorial dengan rancangan acak
lengkap (RAL). Sebagai medium kultur dipilih medium MS
.
Faktor pertama adalah lima taraf konsentrasi NAA, yaitu 0, 0.05, 0.10, 0.25dan 050 mgll medium hltur. Faktor kedua adalah empat taraf konsen-
trasi kinetin, yaitu 0, 0.10, 0.50 dan 1.00 mg/l medium kultur. Ke dalam medium ditambahkan sukrosa sebanyak 30 g/l d m agar sebanyak 6 d l . Keasaman medium ditentukan sekitar 5.8. Sebagai wadah diguna- kan botol bulat volume 50 ml yang masing-masing diisi 8 ml medium
hlturdan ditutupdengan kertas aluminum. Medium disterilkandalam auto-
clave pada tekanan 15 psi selama 25 menit.
Bunga yang berubran 4.5
-
5 mm setelah disimpan pada suhu 10'' C selama 48 jam disterilkan dalam larutan clorox 25 persen selama 25 menit. Anter dikeluarkan dari bunga dan dikulturkan dalam botolkultur yang berisi 8 ml medium kultur. Tiap perlakuan terdiri atas sepuluh duplikat dan masing-masing perlakuan diulang dua M i . Kultur diletakkan pada ralc yang mendapat penyinaran 16 jam terang dan 8 jam gelap dari dua buah lampu tabung 40 watt yang terietak 50 cm diatas dasar rak. Suhu ruangan berkisar anma 26°C
-
3@ C.Pengamatan dilakukan selama tiga bulan. Unsur unsur yang
diamati meliputi perubahan warna dari anter, jumlah anter yang berha-
sil tumbuh /betkernbang, bentuk pertumbuhan /perkembangan dari an ter
dan morfologi bentuk pertumbuhan/perkembangan an ter.
Analisis data kuantitatif disesuaikan dengan rancangan percobaan
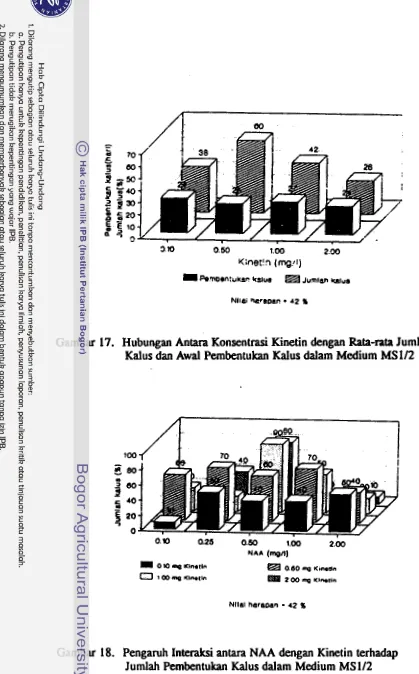
Percobaan 3. Pengaruh Konsentrasi NAA dan Kinetin terhadap Pertumbuhan dan Perkembangan Anter dalam
Medium Kultur MS112.
Dari Percobaan 2 diketahui bahwa anter hanya membentuk kalus
apabila dalam medium terdapat auksin (NAA), tetapi sejauh yang diarnati
tidak ada tanda bahwa kalus bisa meregenerasikan tanaman. Atas dasar
ini maka dicoba peningkatan konsentrasi NAA dan kinetin sedangkan
sebagai medium Icultur digunakan medium MS1/2 dengan harapan
penurunan hara makro bisa mengubah pola perkembangan kalus.
Konsemntrasi NAA yang dicoba adalah 0.10, 0.25, 0.50, 1.00 dan 2.00
mg/l yang dikombinasikan dengan kinetin pada konsentfasi 0.10, 0.50,
1.0