Laporan Pratikum Kultur Jaringan Tanaman SUBKULTUR NANAS
Nama Asisten : Tanggal :30 Mei – 6 Juni 2016
1. Rohayati (G34120022) Kelompok : 3 / Lab 1 2. Fauziah Tri Aprilianti (G34120080)
FEBIE LEONA TIFFANY G34130051
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PENDAHULUAN
Latar Belakang
Nanas merupakan tumbuhan tropis berasal dari Brasil, Bolivia, dan Paraguay. Nanas termasuk famili Bromeliaceae yang memiliki habitus rendah, herba menahun dengan bentuk daun yang memanjang, berdaun tajam, dan tersusun roset. Buah nanas termasuk buah agregat (Apriyanti 2009). Nanas merupakan buah yang memiliki nilai ekonomi yang tinggi karena kandungan vitamin C dan A yang cukup tinggi. Selain itu bermanfaat untuk menyembuhkan penyakit sembelit, gangguan saluran kencing, serta penyakit kulit (Prahasta 2009). Teknik perbanyak nanas yang dilakukan saat ini adalah perbanyakan secara vegetatif. Namun, cara ini membutuhkan waktu yang lama, jumlah bibit yang dihasilkan sedikit, dan tidak seragam (Yusnita 2003). Oleh karena itu, perbanyakan bibit melalui kultur jaringan merupakan salah satu solusi yang dilakukan.
Subkultur merupakan tahapan dalam metode kultur jaringan yang dilakukan diantara tahapan kultur. Subkultur adalah pemindahan planlet yang masih muda dari medium lama ke medium yang baru dan dilakukan secara aseptik. Umumnya subkultur yang dilakukan disertai pemisahan, pemotongan, pembelahan, penanaman kembali eksplan yang telah tumbuhsehingga jumlah tanaman akan bertambah banyak. Tujuan subkultur ini adalah agar kultur tetap mendapatkan unsur hara dan nutrisi untuk pertumbuhannya (Hendaryono dan Wijayani 1994).
Media yang digunakan dalam subkultur nanas kali ini ada dua macam, yaitu media MS dengan penambahan NAA dan media MS dengan penambahan BAP. NAA merupakan salah satu auksin buatan. NAA memiliki fungsi yang sama seperti auksin, yaitu terlibat dalam pemanjangan sel, fototropisme, geotropisme, dan dominansi apikal. BAP meruapakan sitokinin buatan yang berfungsi dalam pembelahan dan perkembang biakan tunas aksilar (Abidin 1993).
Tujuan
Praktikum ini bertujuan mengamati pertumbuhan jumlah daun, tinggi tanaman dan perakaran pada tanaman subkultur nanas.
METODE
Alat dan Bahan
Bahan yang digunakan adalah medium Murishage & Skoog (MS) dengan penambahan NAA dan BAP, kultur nanas, alkohol 70%, dan alkohol 96%. Alat yang digunakan adalah laminar air flow cabinet, autoklaf, alat diseksi, cawan petri, botol kultur, bunsen, dan seal.
Prosedur
kerja disterilisasi menggunakan alkohol 70%. Alat-alat gelas serta media yang akan dimasukkan ke dalam laminar disemprot dengan alkohol 70% terlebih dahulu. Kemudian dinyalakan bunsen. Alat desikasi disterilisasi dengan dicelupkan ke dalam alkohol 96% dan di lewatkan pada api bunsen. Selanjutnya botol kultur yang berisi kultur nanas dibuka dan kultur nanas diambil 4 planlet. Kemudian planlet nanas yang memiliki daun tua atau berwarna kuning dibuang daunnya dan dipotong akarnya. Setelah itu dua planlet dimasukkan ke dalam media MS yang ditambahkan BAP dan dua planlet lagi dimasukkan ke dalam media MS yang ditambahkan NAA. Selanjutnya tutup botol dengan seal dan plastik. Botol kultur diberi label pada bagian atasnya. Setelah itu simpan dalam ruang kultur dan diamati setiap minggunya selama 2 minggu.
[image:3.595.117.512.289.556.2]HASIL
Table 1 Pertumbuhan planlet nenas selama 2 minggu
Media Jumlah daun minggu ke-
Tinggi planlet minggu ke-
(mm) Jumlah akar minggu ke-
1 2 1 2 1 2
MS+NAA 3.33 4 46.7 55 - -
MS+BAP 2.50 2.50 42.5 45 - -
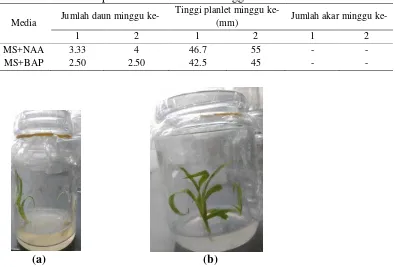
(a) (b)
Gambar 1 Subkultur nanas usia 2 minggu (a) pada media MS + BAP (b) pada media MS + NAA
PEMBAHASAN
jumlah daunnya (Gambar 1). Hal ini sesuai dengan literatur, menurut Rosmaina (2010) perlakuan faktor tunggal BAP menghasilkan rata-rata 6-9 tunas/eksplan, sedangkan perlakuan NAA faktor tunggal menghasilkan 5.8-15 tunas/eksplan, dimana jumlah tunas tertinggi diperoleh pada perlakuan 1.0 mM NAA. Tinggi tanaman pun menunjukkan hal yang sama.
Zat pengatur tumbuh yang sering digunakan dalam subkultur nanas adalah auksin buatan, yaitu NAA dan sitokinin buatan, yaitu BAP. Dalam menginduksi tunas adventif sitokinin dan auksin memiliki peran yang sangat penting. Nisbah auksin dan sitokinin menentukan apakah suatu kalus akan membetuk tunas adventif atau akar. Sitokinin bersinergi dengan auksin dalam menstimulasi pembelahan sel (Hartman dan Kester 1983). Menurut George dan Sherrington (1993), jika rasio auksin lebih rendah daripada sitokinin maka organogenesis akan mengarah ke tunas, jika rasio auksin seimbang dengan sitokinin maka akan mengarah ke pembentukan kalus sedangkan jika rasio auksin lebih tinggi daripada sitokinin organogenesis akan cenderung mengarah ke pembentukan akar. Hal ini menunjukkan auksin berperan dalam pembentukan akar pada tanaman, sedangkan sitokinin berperan dalam pembentukan tunas.
Hasil pengamatan selama lima minggu menunjukkan pertumbuhan akar yang lambat karena tidak munculnya akar pada planlet. Hal ini bisa disebabkan karena kurangnya komposisi nutrisi yang dibutuhkan tanaman pada media untuk pertumbuhan akar. Menurut Yuliarti (2010), laju pertumbuhan sel, jaringan, dan organ tanaman dalam kultur akan menurun setelah periode tertentu yang disebabkan oleh menurunnya kadar nutrien pada media dan senyawa racun yang terbentuk dan dilepaskan oleh planlet disekitar media. Selain itu, pertumbuhan akar sangat dipengaruhi dari nisbah auksin dan sitokinin yang diberikan karena sitokinin yang bersinergi dengan auksin dapat menstimulasi pembelahan sel (Hartman dan Kester 1983), sedangkan percobaan yang dilakukan hanya memberikan perlakuan NAA atau BAP, tidak mengombinasikan keduanya atau hanya memanfaatkan auksin alami dan BAP alami yang ada dalam tanaman untuk kombinasi. Sehingga pemberian konsentrasi yang kurang tepat menyebabkan laju pertumbuhan akar yang lambat.
SIMPULAN
DAFTAR PUSTAKA
Abidin Z. 1993. Dasar-dasar Pengetahuan tentang Zat Pengatur Tumbuh. Bandung (ID): Angkasa.
Apriyanti I. 2009. Seluk Beluk Nanas dan Penanamannya. Bandung (ID): Jasa Grafika Indonesia.
George EF, Sherrington PD. 1993. Plant Propagation by Tissue Culture. England (UK): Exegetic Limited.
Hartman, Kester. 1994. Plant Propagation Principle and Practice. New delhi (IN). Prentice-Hall of India Private Limited.
Hendaryono DPS, Wijayani A.1994. Teknik Kultur Jaringan. Yogyakarta (ID): Kanisius.
Prahasta A. 2009. Agribisnis Nanas. Bandung (ID): Pustaka Grafika.
Rosmaina. 2010. Laju multiplikasi tunas nenas (ananas comosus l. merr) pada media dasar murashige and skoog hasil perlakuan ba dan naa secara in vitro. Jurnal Agroteknologi.1(1):39-44.