SECARA
EX VITRO
(DI PERSEMAIAN POLIBAG DAN RAKIT)
DAN
IN VITRO
MELALUI KULTUR JARINGAN
SHANDRA AMARILLIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Perbanyakan Tanaman Sagu (Metroxylon spp.) secara Ex vitro (di Persemaian Polibag dan Rakit) dan In vitro Melalui Kultur Jaringan adalah benar hasil karya saya dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2013 Shandra Amarillis NIM A253100081
vitro (di Persemaian Polibag dan Rakit) dan In vitro Melalui Kultur Jaringan. Dibimbing oleh Nurul Khumaida dan Mochamad Hasjim Bintoro Djoefrie.
Penelitian ini bertujuan mempelajari pengaruh perlakuan jenis auksin, bobot sucker pada induksi perakaran dan peubah pertumbuhan di persemaian bibit sagu. Penelitian ini menggunakan aksesi Dramaga (tidak berduri). Beberapa peubah pertumbuhan dan perakaran dipelajari setelah diberikan perlakuan beberapa konsentrasi auksin yaitu tanpa auksin (kontrol), 7.40 mM IBA, 7.40 mM NAA, dan 7.40 mM auksin komersial dan bobot sucker yaitu 500-999 g, 1000-1499 g, dan 1500-2000 g di persemaian polibag dan rakit. Perlakuan dilakukan dengan metode perendaman sesaat setelah sebelumnya direndam selama 30 menit pada larutan pestisida. Penelitian dilaksanakan di Desa Cikarawang, Dramaga, Bogor, Jawa Barat dan Laboratorium Fisiologi dan Kromatografi, Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor dari Juli 2012 sampai dengan Maret 2013.
Hasil percobaan menunjukkan bahwa bobot sucker 1000-1499 g dan 1500-2000 g tidak berbeda nyata terhadap peubah pertumbuhan dan persentase bibit hidup di media persemaian polibag. Perlakuan tanpa auksin, IBA, NAA, dan auksin komersial menghasilkan persentase bibit hidup berturut-turut 52%, 70%, 62% dan 53%. Peningkatan persentase kandungan pati pada bagian rhizome berbanding lurus dengan peningkatan bobot sucker.
Di media persemaian rakit, perlakuan jenis auksin NAA secara signifikan menghambat pertumbuhan bibit, hal tersebut diindikasikan dengan tinggi rachis ke-1 dan jumlah anak daun rachis ke-1 yang lebih sedikit dibandingkan perlakuan kontrol dan auksin komersial. Perlakuan jenis auksin tidak memberikan hasil berbeda pada peubah jumlah akar primer, jumlah akar nafas, dan panjang akar terpanjang. Rata-rata persentase bibit hidup telah diperoleh 65% (untuk bobot sucker 1000-1 499 g dan 1500-2000 g) pada 4 bulan setelah semai (BSS), sementara bobot 500-999 g menghasilkan rata-rata persentase bibit hidup yang lebih rendah yaitu 40%.
Hasil percobaan menunjukkan bahwa ada perbedaan antara peubah tinggi rachis tidak normal, jumlah anak daun rachis tidak normal, jumlah anak daun rachis ke-1, diameter rachis ke-1, jumlah akar primer dan akar nafas. Kedua teknik persemaian tidak memberikan perbedaan pada persentase rata-rata bibit hidup. Nilai diameter rachis di rakit lebih tinggi dibandingkan dengan di polibag berturut-turut yaitu 5.9 cm dan 1.2 cm.
Kultur in vitro tanaman sagu dari eksplan shoot tip dan daun muda (young leaf) telah dilakukan. Penelitian ini bertujuan untuk mempelajari organogenesis dan embriogenesis tanaman sagu. Tunas tanaman sagu telah disterilisasi dengan berbagai sterilan. Perbanyakan bibit sagu melalui kultur invitro menunjukkan bahwa sterilisasi bahan tanam shoot tip sulit dilakukan. Beberapa metode sterilisasi telah dilakukan, namun kontaminasi bakteri dan cendawan masih cukup tinggi. Kultur asenik yang diperoleh masih terlalu sedikit, sehingga penelitian ini tidak dilanjutkan. Kalus tidak berhasil diinisiasi dari eksplan daun muda.
and Raft seedlings) and In vitro through Tissue Culture. Supervised by NURUL KHUMAIDA and MOCHAMAD HASJIM BINTORO DJOEFRIE.
Present studies were carried out to determine the effect of auxin, weight of sucker, on root induction and growth variables in nursery of sago seedlings. The research were used Darmaga accession (spineless). For this purpose some parameters were studied after treating suckers with some auxin concentrations, i.e. control (without growth regulators/ 0 mM), 7.40 mM naphthalene acetic acid (NAA), 7.40 mM indole butyric acid (IBA), and 7.40 mM commercial auxin, and weight of sucker i.e 500-999 g, 1 000-1 499 g, and 1 500-2 000 g, with polybag and raft nursery. The treatments were applied by one method (quick dip) and the treated suckers were submerged 30 minutes in pesticides before. This research was conducted at Cikarawang, Dramaga, Bogor, West Java and Physiology and Chromatoghraphy Laboratory, Department of Agronomy and Horticulture, Bogor Agricultural University, from July 2012 to Mart 2013.
The result from polybag nursery showed that suckers weight 1 000-1 499 g and 1 500-2 000 g were not significantly different on polibag nursery. The result of without auxin, IBA, NAA, and commercial auxin treatments for survival rate were 52%, 70%, 62%, 53% respectively. Increasing percentage of starch content in line with the increasing weight of sucker.
On the raft nursery,treatment of NAA showed significantly inhibit seedling growth, as indicated by reduction the 1st rachis height and amount of 1st rachis leaflets compare with kontrol and commercial auxin. Treatments of auxin did not give significantly different on some variables (number of primary roots, number of aerenchym roots, and the length of root. Survival rate percentage of seedlings were obtained 65% (for both weight sucker 1 000 – 1 499 g and 1 500-2 000 g) on 4 month after nursery (MAN), while the sucker weights 500-999 g produced survival rate percentage is lower than 40%.
Either polybag and raft nurseries, showed that there were significantly different to height of abnormal rachis, number of leaflets of abnormal rachis, number of leaflets of 1st rachis, diameter of 1st rachis, number of primary roots, and aerenchyma roots. Both of nursery techniques were not significantly different on percentage of survival rate seedlings. Rachis diameter in raft nursery was significantly higher than in polybag nursery, 5.9 cm and 1.2 cm respectively.
In vitro culture for sago palm from shoot tip and young leaf explants were conducted. This study was carried out to understand the embriogenesys and organogenesis of sago palm. Shoot tip of sago sucker was excised and simultaneously sterilised by using sterilizing agents. Some sterilization methods were conducted, but persentation of aseptic culture was limited. Callus was not succesfully induced from young leaf explant.
© Hak Cipta Milik Institut Pertanian Bogor, Tahun 2013 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruhnya karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
DAN
IN VITRO
MELALUI KULTUR JARINGAN
SHANDRA AMARILLIS
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Nama : Shandra Amarillis
NRP : A253100081
Program Studi : Pemuliaan dan Bioteknologi Tanaman
Disetujui oleh Komisi Pembimbing
Diketahui oleh
Tanggal Ujian : 16 September 2013 Tanggal Lulus : Dr Ir Nurul Khumaida, MSi.
Ketua
Prof Dr Ir H M H Bintoro Djoefrie, MAgr. Anggota
Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman
Dr Ir Yudiwanti EKS, MS.
Dekan Sekolah Pascasarjana
Puji syukur kehadirat Allah SWT atas limpahan karunia, rahmat dan hidayah-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul dari penelitian ini adalah Perbanyakan Tanaman Sagu (Metroxylon Spp.) secara Ex vitro (di Persemaian Polibag dan Rakit) dan In vitro Melalui Kultur Jaringan. Penulisan tesis ini dilakukan sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Pemuliaan dan Bioteknologi Tanaman, Sekolah Pascasarjana Institut Pertanian Bogor.
Penyusunan tesis ini dibimbing dan diarahkan oleh Dr. Ir. Nurul Khumaida, MSi., sebagai ketua komisi pembimbing, Prof. Dr. Ir. H. M. H. Bintoro Djoefrie, M. Agr, sebagai anggota komisi pembimbing. Penulis mengucapkkan banyak terima kasih dan penghargaan yang setinggi-tingginya kepada kedua pembimbing, atas segala curahan waktu dan arahannya ke penulis, sehingga tulisan ini dapat selesai pada waktunya.
Terima kasih dan penghargaan juga penulis sampaikan kepada orang tua tercinta Ayahanda Syafruddin Indra bin M. Thahir dan Ibunda Nurimah binti Sajimin atas doa, nasehat, dan dorongan yang diberikan kepada penulis selama ini dan kepada seluruh keluarga, serta kepada seluruh sahabat dan saudara atas segala dukungan dan perhatian.
Penghargaan dan terima kasih penulis sampaikan kepada seluruh teman-teman PBT 2010, kepada BPPT atas bahan tanam yang diberikan, kepad Pak Haji Dalimunte yang telah meminjamkan lahan penelitian, dan Pak Danu yang tanpa lelah membantu penelitian ini hingga akhir dan kepada seluruh sahabat yang terus memberikan dorongan dan semangat. Ucapan terima kasih akhirnya penulis ucapkan kepada semua pihak yang telah membantu namun tidak dapat disebutkan satu per satu dalam karya ilmiah ini. Semoga Allah SWT memberikan balasan yang setimpal. Semoga karya ilmiah ini bermanfaat untuk pengembangan sagu di Indonesia.
DAFTAR TABEL i
DAFTAR GAMBAR ii
DAFTAR LAMPIRAN iv
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Hipotesis Penelitian 3
Manfaat Penelitian 4
Kerangka Pemikiran 4
Ruang Lingkup Penelitian 5
2 TINJAUAN PUSTAKA 6
Tanaman Sagu (Metroxylon spp.) 6
Ekologi Tanaman Sagu 6
Media Persemaian Polibag 7
Media Persemaian Rakit 9
Persemaian Tanaman Sagu 10
Bibit Tanaman Sagu 11
Jenis Auksin 12
Teknologi Kultur Jaringan Tanaman Sagu 13
Organogenesis dan Embriogenesis 14
3 PERBANYAKAN TANAMAN SAGU (Metroxylon sagu spp.) MELALUI ORGANOGENESIS DAN EMRIOGENESIS SECARA
IN VITRO 17
Abstrak 17
Pendahuluan 18
Bahan dan Metode 19
Hasil dan Pembahasan 22
Simpulan 27
4 PENGARUH JENIS AUKSIN DAN BOBOT SUCKER TERHADAP
PERTUMBUHAN BIBIT SAGU DI PERSEMAIAN POLIBAG 29
Abstrak 29
Pendahuluan 30
Bahan dan Metode 31
Hasil dan Pembahasan 37
Pendahuluan 58
Bahan dan Metode 59
Hasil dan Pembahasan 60
Simpulan 75
6 ANALISIS PERBANDINGAN PERTUMBUHAN BIBIT SAGU
DI PERSEMAIAN POLIBAG DAN RAKIT 77
Abstrak 77
Pendahuluan 78
Bahan dan Metode 78
Hasil dan Pembahasan 79
Simpulan 91
7 PEMBAHASAN UMUM 93
8 SIMPULAN DAN SARAN 95
DAFTAR PUSTAKA 96
LAMPIRAN 107
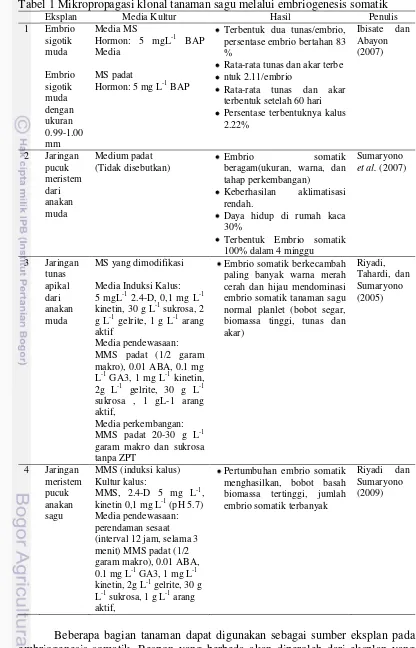
1 Mikropropagasi klonal tanaman sagu melalui embriogenesis somatik
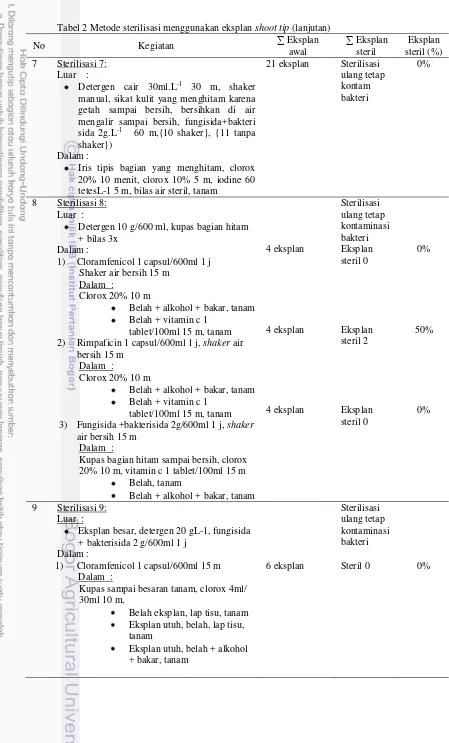
15 2 Metode sterilisasi menggunakan eksplan shoot tip 23 3 Kombinasi perlakuan induksi perakaran dengan empat jenis auksin dan
tiga bobot sucker pada persemaian di polibag
32 4 Data awal bobot segar dan kering sucker sebelum perlakuan persemaian 34 5 Interaksi perlakuan jenis auksin dan bobot sucker terhadap tinggi rachis
tidak sempurna bibit sagu (Metroxylon spp.) pada 1 BSS di polibag
38 6 Interaksi perlakuan jenis auksin dan bobot sucker terhadap tinggi rachis
tidak sempurna bibit sagu (Metroxylon spp.) pada 2 BSS di polibag
38 7 Interaksi perlakuan jenis auksin dan bobot sucker terhadap tinggi rachis
tidak sempurna bibit sagu (Metroxylon spp.) pada 3 BSS di polibag
39 8 Interaksi perlakuan jenis auksin dan bobot sucker terhadap jumlah anak
daun rachis tidak sempurna bibit sagu (Metroxylon spp.) pada 1 BSS di polibag
40
9 Interaksi jenis auksin dan bobot sucker terhadap diameter rachis ke-1 bibit sagu (Metroxylon spp.) pada 3 BSS di polibag
41 10 Pengaruh perlakuan jenis auksin terhadap peubah tinggi rachis tidak
normal, tinggi rachis ke-1, tinggi rachis ke-2, tinggi rachis ke-3, dan tinggi rachis tidak sempurna di persemaian polibag
41
11 Pengaruh perlakuan jenis auksin terhadap peubah jumlah anak daun rachis ke-1, jumlah anak daun rachis ke-2, jumlah anak daun rachis ke-3, jumlah anak daun rachis tidak sempurna, dan diameter rachis ke-1 di persemaian polibag
43
12 Pengaruh perlakuan jenis auksin terhadap peubah tinggi rachis tidak normal, tinggi rachis ke-1, tinggi rachis ke-2, tinggi rachis ke-3, dan tinggi rachis tidak sempurna di persemaian polibag
44
13 Pengaruh perlakuan bobot sucker terhadap peubah jumlah anak daun di persemaian polibag
45 14 Pengaruh jenis auksin terhadap persentase rachis terinisiasi dan rataan
tanaman hidup pada 4 BSS di persemaian polibag
47 15 Pengaruh perlakuan bobot sucker terhadap persentase rachis terinisiasi
dan rataan tanaman hidup pada 4 BSS di persemaian polibag
47 16 Pengaruh perlakuan jenis auksin terhadap jumlah akar primer, jumlah
akar nafas dan akar terpanjang pada 4 BSS di persemaian polibag
49 17 Pengaruh perlakuan bobot sucker terhadap jumlah akar primer, jumlah
akar nafas dan akar terpanjang pada 4 BSS di persemaian polibag
50 18 Pengaruh perlakuan jenis auksin terhadap persentase bibit berakar dan
rataan tanaman hidup pada 4 BSS di persemaian polibag
50 19 Pengaruh perlakuan bobot sucker terhadap persentase bibit berakar pada
4 BSS di persemaian polibag
pati
22 Interaksi perlakuan bobot sucker dan jenis auksin terhadap persentase bibit hidup pada 1 BSS di persemaian polibag 1 BSS
54 23 Persentase bibit hidup terhadap perlakuan bobot sucker berbeda 55 24 Kombinasi perlakuan induksi perakaran dengan empat jenis auksin dan
tiga bobot sucker pada persemaian di rakit
60 25 Interaksi jenis auksin dan bobot sucker terhadap tinggi rachis tidak
sempurna bibit sagu (Metroxylon spp.) pada 4 BSS di persemaian rakit 61 26 Interaksi jenis auksin dan bobot sucker terhadap akar terpanjang bibit
sagu (Metroxylon spp.) pada 4 BSS di persemaian rakit
61 27 Pengaruh perlakuan jenis auksin terhadap peubah tinggi rachis tidak
normal,tinggi rachis ke-1, tinggi rachis ke-2, tinggi rachis ke-3, dan tinggi rachis tidak sempurna di persemaian rakit
64
28 Pengaruh perlakuan jenis auksin terhadap peubah jumlah anak daun rachis dan diameter rachis ke-1 di persemaian rakit
65 29 Pengaruh perlakuan bobot sucker terhadap peubah tinggi rachis tidak
normal, tinggi rachis ke-1, tinggi rachis ke-2, tinggi rachis ke-3, dan tinggi rachis tidak sempurna di persemaian rakit
67
30 Pengaruh perlakuan bobot sucker terhadap peubah jumlah anak saun dan diameter rachis ke-1 di persemaian rakit
68 31 Perlakuan jenis auksin terhadap persentase rachis bertunas dan rataan
tanaman hidup pada 4 BSS di persemaian rakit
68 32 Perlakuan bobot sucker terhadap persentase rachis terinisiasi dan rataan
tanaman hidup pada 4 BSS di persemaian rakit
69 33 Pengaruh perlakuan jenis auksin terhadap jumlah akar primer, jumlah
akar nafas dan akar terpanjang pada 4 BSS di persemaian rakit
69 34 Pengaruh perlakuan bobot sucker terhadap jumlah akar primer, jumlah
akar nafas dan akar terpanjang pada 4 BSS di persemaian rakit
70 35 Pengaruh jenis auksin terhadap persentase bibit berakar dan rataan
tanaman hidup pada 4 BSS di persemaian rakit
71 36 Pengaruh bobot sucker terhadap persentase bibit berakardan rataan
tanaman hidup pada 4 BSS di persemaian rakit
71 37 Interaksi perlakuan bobot sucker dan jenis auksin pada 1 BSS di
persemaian rakit
72 38 Pengaruh perlakuan bobot sucker terhadap persentase bibit hidup 73 39 Keragaan bibit sagu di persemaian polibag pada 7 BSS 74 40 Hasil analisis perbandingan rata-rata tinggi rachis tidak normal
persemaian polibag dan rakit
80 41 Hasil analisis perbandingan rata-rata jumlah anak daun rachis tidak
sempurna di persemaian polibag dan rakit
81 42 Hasil analisis perbandingan rata-rata jumlah anak daun rachis ke-1 di
persemaian polibag dan rakit
persemaian polibag dan rakit
45 Hasil analisis perbandingan rata-rata jumlah akar nafas pada 4 BSS di persemaian polibag dan rakit
1 Kerangka Berpikir 4 2 Eksplan asal shoot tip yang terkontaminasi bakteri 25
3 Eksplan steril asal shoot tip 26
4 Eksplan steril daun muda 26
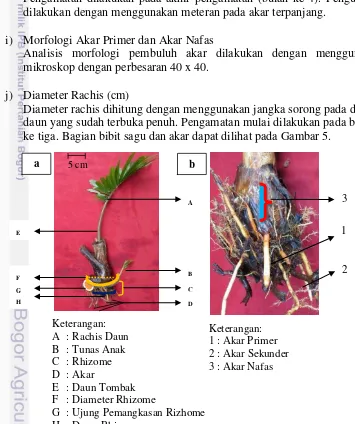
5 Bagian bibit sagu (a) dan akar primer, sekunder serta akar nafas (b) 36 6 Keragaan morfologi bibit sagu di persemaian polibag 40 7 Keragaan pertumbuhan bibit sagu asal bobot sucker 500-999 g pada
berbagai konsentrasi jenis auksin di persemaian polibag
46 8 Keragaan pertumbuhan bibit sagu asal bobot sucker 1000-1499 g pada
berbagai konsentrasi jenis auksin di persemaian polibag
48 9 Keragaan pertumbuhan bibit sagu asal bobot sucker 500-999 g pada
berbagai konsentrasi jenis auksin di persemaian polibag
48 10 Pengaruh bobot sucker terhadap keragaan perakaran bibit sagu pada 4
BSS di persemaian polibag
51 11 Analisis bobot sucker terhadap persentase kandungan pati 52 12 Perlakuan jenis auksin terhadap persentase bibit hidup di persemaian
polibag
55 13 Keragaan pertumbuhan bibit asal bobot sucker 500-999 g pada berbagai
konsentrasi jenis auksin di persemaian rakit
62 14 Kondisi bibit sagu pada bobot sucker 1500-2000 g pada 4 BSS di
persemaian rakit
63 15 Keragaan pertumbuhan bibit asal bobot sucker 1000-1499 g pada
berbagai konsentrasi jenis auksin di persemaian rakit
63 16 Keragaan pertumbuhan bibit asal bobot sucker 1500-2000 g pada
berbagai konsentrasi jenis auksin di persemaian rakit
66 17 Keragaan perakaran bibit sagu pada berbagai perlakuan bobot sucker 70 18 Pengaruh perlakuan jenis auksin terhadap persentase bibit hidup selama
4 BSS
72 19 Keragaan bibit sagu siap transplanting pada 7 BSS (a) 500-999 g; (b)
1000-1499 g; (c) 1500-2000 g
74 20 Bagian dan morfologi bibit sagu di (a) persemaian polibag dan (b) rakit
pada 4 BSS
79 21 Pengaruh jenis auksin dan bobot sucker terhadap keragaan jumlah anak
daun rachis ke-1 di persemaian polibag (a) dan rakit (b)
82 22 Pengaruh jenis auksin terhadap keragaan akar primer bibit sagu asal
bobot sucker 1500-2000 g pada 4 BSS di dua persemaian
1 Nilai tengah dan koefisien keragaman (KK) peubah pengamatan di persemaian polibag
2 Koefisien determinasi dan f-hitung peubah pengamatan di persemaian polibag
3 Nilai tengah dan koefisien keragaman (KK) peubah pengamatan di persemaian rakit
4 Koefisien determinasi dan f hitung peubah pengamatan di persemaian rakit
5 Persentase bibit hidup selama 4 BSS di persemaian polibag 6 Persentase bibit hidup selama 4 BSS di persemaian polibag
(transformasi ln (x+10))
7 Persentase bibit hidup selama 4 BSS di persemaian rakit 8 Persentase bibit hidup selama 4 BSS di persemaian rakit
(transformasi ln (x+10))
9 Hasil analisis perbandingan beberapa peubah pertumbuhan berdasarkan bobot sucker pada 1 BSS
10 Hasil analisis perbandingan beberapa peubah pertumbuhan berdasarkan bobot sucker pada 2 BSS
11 Hasil analisis perbandingan beberapa peubah pertumbuhan berdasarkan bobot sucker pada 2 BSS
12 Hasil analisis perbandingan beberapa peubah pertumbuhan berdasarkan bobot sucker 500-999 g pada 4 BSS
13 Hasil analisis perbandingan beberapa peubah pertumbuhan berdasarkan bobot sucker 1000-1499 g pada 4 BSS
Latar Belakang
Permasalahan pangan terus menjadi ancaman bagi keberlangsungan hidup manusia. Peningkatan jumlah populasi dunia, peningkatan suhu bumi yang disebabkan efek pemanasan global, dan berkurangnya luasan panen tanaman pangan merupakan beberapa faktor yang mengiringi masalah pangan dunia. Kegagalan panen karena banjir sebagai akibat pemanasan global dan serangan hama serta penyakit menyebabkan pangan terus menjadi persoalan yang belum teratasi. Meskipun usaha peningkatan produktivitas tanaman pangan terus dilakukan, namun konversi lahan pertanian menjadi area industri dan perumahan tidak dapat terhindarkan.
Populasi Indonesia mencapai 236 331 300 jiwa pada tahun 2011. Saat ini, produksi padi Indonesia sekitar 69 juta ton. Jumlah tersebut berasal dari luas area panen sebesar 13.44 juta ha dengan produktivitas 4.5 ton/ha. Perkiraan jumlah penduduk Indonesia mencapai 273 219 000 jiwa pada tahun 2025 dengan laju pertumbuhan penduduk sebesar 1.49 (BPS 2012). Dengan demikian, Indonesia akan membutuhkan peningkatan produksi padi nasional setara dengan 79.77 juta ton, luas area panen 15.54 juta ha, dengan produktivitas mencapai 5.2 ton/ha. Pemenuhan kebutuhan beras sebagai sumber utama karbohidrat menjadi tantangan tersendiri.
Program diversifikasi pangan seharusnya dapat mengatasi kebutuhan beras nasional yang semakin meningkat. Pangan lokal seperti umbi-umbian, jagung, kacang-kacangan dan sagu dapat dijadikan alternatif untuk pangan selain beras. Indonesia memiliki sekitar 1.25 juta ha (setara dengan 9.3% dari luas panen sagu nasional) hutan sagu alami. Jika potensi tanaman sagu 20-40 ton/ha, maka Indonesia dapat menghasilkan 25-50 juta ton pati.
Produktivitas tanaman pangan utama secara nasional mengalami peningkatan yaitu padi 5.1 ton/ha, jagung 4.5 ton/ha, ubi jalar 12.3 ton/ha, dan ubi kayu 20.2 ton/ha (BPS 2012). Luas area panen untuk masing masing tanaman pangan yaitu padi 13.44 juta ha, jagung 3.86 juta ha, ubi jalar 0.18 juta ha, dan ubi kayu 1.18 juta ha. Peningkatan kebutuhan pangan selaras dengan peningkatan jumlah penduduk. Upaya-upaya melalui ekstensifikasi dan intensifikasi perlu dilakukan untuk memenuhi kebutuhan pangan yang terus meningkat.
Ekstensifikasi lahan pertanian untuk tanaman pangan sepertinya sulit untuk dilakukan, mengingat konversi lahan pertanian semakin bertambah setiap tahunnya. Konversi lahan pertanian menjadi area industri dan perumahan di Pulau Jawa, yang merupakan sentra produksi beras nasional, terus mengalami peningkatan. Konversi lahan pertanian mengakibatkan berkurangnya area panen tanaman pangan, sehingga berimplikasi terhadap turunnya produksi pangan. Terbatasnya produksi pangan mengakibatkan mahalnya harga pangan, sehingga tidak terjangkau bagi masyarakat miskin.
Provinsi Papua. Masyarakat mengalami kekurangan pangan, sehingga membutuhkan suplai pangan darurat.
Data kemiskinan setiap provinsi menunjukkan bahwa masyarakat di bagian timur seolah terpinggirkan dan kurang mendapat perhatian. Berbagai hasil tambang dan pertanian merupakan kekayaan alam yang diharapkan dapat meningkatkan taraf hidup masyarakat lokal, sehingga berimplikasi terhadap pemerataan pendapatan secara nasional. Sagu merupakan salah satu kearifan lokal bangsa Indonesia.
Keunggulan kompetitif tanaman sagu dibandingkan tanaman penghasil karbohidrat lainnya yaitu penghasil karbohidrat tertinggi 20-40 ton/ha, mengkonservasi air tanah, penanaman hanya dilakukan satu kali seumur hidup, dan dapat dikonversi menjadi etanol dengan tidak berkompetisi penggunaannya sebagai pakan ternak dan pangan. Menurut Bintoro et al. (2007) memposisikan sagu sebagai komponen dalam membangun ketahanan pangan nasional yang tangguh merupakan langkah strategis yang berimplikasi jauh ke depan
Tanaman sagu merupakan tanaman asli Indonesia. Penyebarannya di Indonesia meliputi Aceh, Riau, Lampung, Jawa Barat, Kalimantan Barat, Kalimantan Selatan, Sulawesi Utara, Sulawesi Selatan, Sulawesi Tenggara, Maluku, Maluku Utara, Papua, dan Papua Barat. Keragaman genetik terbanyak di Papua dan Papua Barat. Tanaman sagu diharapkan mampu menjadi tanaman yang mendatangkan pendapatan bagi masyarakat lokal terutama di Indonesia Bagian Timur, dengan segala potensi besar yang ada pada tanaman tersebut.
Pemanfaatan potensi besar tanaman sagu dapat diupayakan dengan melakukan pengembangan dan penataan hutan alami menjadi kebun sagu, sehingga dapat menjadi pemasukan pendapatan bagi masyarakat lokal. Oleh karena itu, bibit merupakan hal yang mutlak diperlukan untuk pengembangan sagu. Teknik budidaya tanaman sagu mengenai persemaian anakan tanaman sagu (sucker) menjadi penting untuk dipelajari.
Perbanyakan tanaman sagu dapat dilakukan baik secara generatif maupun vegetatif. Perbanyakan generatif dapat dilakukan dengan menumbuhkan biji, sedangkan perbanyakan vegetatif dilakukan dengan menggunakan anakan tanaman sagu (biasa disebut sucker). Persemaian di kanal di sekitar perkebunan dijadikan salah satu cara pembibitan tanaman sagu sebelum ditanam di lapangan, sedangkan di kebun rakyat bibit sagu langsung ditanam ke lapangan. Anakan sagu disemai selama kurang lebih tiga bulan hingga mengeluarkan 2 sampai 3 helai daun muda dan perakaran yang baik. Pertumbuhan tajuk dan perakaran yang baik diharapkan akan dapat meningkatkan persentase tumbuh tanaman sagu di lapangan.
Teknik persemaian yang dilakukan di rakit menghasilkan persentase bibit yang tumbuh dengan baik yaitu sekitar 80% (Jong 2007). Persentase tersebut merupakan implikasi dari ketersediaan air yang cukup bagi anakan tanaman sagu. Anakan tanaman sagu sangat membutuhkan air dalam menunjang pertumbuhan tajuk dan perakaran selama dipersemaian sebelum dipindahkan ke lapangan. Pertumbuhan tajuk yang baik disertai dengan perkembangan perakaran yang baik pula akan meningkatkan rata-rata ketahanan hidup pada awal tanam di lapangan.
Ketersediaan air tanah yang cukup dan adanya naungan saat tanaman sagu mulai ditanam di lapangan sangat diperlukan untuk meningkatkan persentase hidup dilapangan.
Induksi perakaran dapat dilakukan dengan mengaplikasikan zat pengatur tumbuh jenis auksin, sehingga diharapkan dapat mengubah perbandingan (rasio) sitokinin dan auksin (endogen) di dalam jaringan tanaman. Perlakuan penambahan auksin tersebut diharapkan mampu meningkatkan induksi perakaran, melalui kombinasi dengan teknik pembibitan yang efektif diterapkan, sehingga diperoleh bibit dengan persentase hidup tinggi.
Beberapa penelitian mengenai kultur jaringan tanaman sagu telah dilakukan, namun masih terdapat kendala-kendala diantaranya jumlah perakaran yang sedikit dan persentase daya hidup planlet yang rendah saat aklimatisasi (Sumaryono et al. 2007), belum adanya penelitian mengenai organogenesis tanaman sagu serta masih kurangnya penelitian kultur jaringan pada beberapa aksesi tanaman sagu.
Pemanfaatan teknik budidaya yang tepat ditambah dengan pemanfaatan biteknologi melalui kultur jaringan secara in vitro dapat membantu upaya penyediaan bibit siap tanam. Pertumbuhan tajuk dan perakaran yang baik pada kedua kultur (ex vitro dan in vitro) dapat meningkatkan kemungkinan anakan sagu tumbuh bertahan hidup lebih baik di lapangan dan keseragaman bahan tanam.
Tujuan Umum Penelitian
Mempelajari teknik perbanyakan tanaman sagu secara ex vitro dan in vitro
Tujuan Khusus Penelitian
1. Memperoleh teknik persemaian dan percepatan pembibitan tanaman sagu jenis molat (tidak berduri), aksesi Dramaga.
2. Mempelajari proses organogenesis dan embriogenesis pada aksesi tanaman sagu (Metroxylon spp.) tidak berduri secara in vitro melalui beberapa komposisi media, kombinasi zat pengatur tumbuh
Hipotesis
Hipotesis pada percobaan ini adalah:
1. Memperoleh kombinasi terbaik pengaruh jenis auksin dan bobot sucker di persemaian polibag dan rakit terhadap pertumbuhan bibit sagu, perakaran dan persentase bibit hidup.
Manfaat Penelitian
Manfaat percobaan ini adalah:
1. Diperoleh informasi teknik persemaian dalam menghasilkan persentase bibit hidup tertinggi
2. Diperoleh informasi jenis auksin terbaik dalam menginduksi perakaran 3. Diperoleh informasi bobot sucker terbaik dalam menghasilkan persentase
pertumbuhan tajuk dan perakaran yang maksimal
4. Diperoleh informasi media kultur dan jenis eksplan yang menghasilkan persentase embrio somatik tertinggi serta organogenesis langsung
Kerangka berpikir dalam penelitian disajikan pada Gambar 1.
Gambar 1 Kerangka Berpikir
Meningkatnya Kebutuhan Pangan Peningkatan Jumlah Penduduk
Global warming
Sumber Karbohidrat Alternatif:
Sagu
Kendala:
Ketersediaan bibit dari aksesi unggul (pati tinggi dan genjah)
Pendataan luasan areal sagu
Rendahnya presentase hidup saat
tanam di lapangan
Potensi:
Sekitar 60% tanaman sagu dunia atau 1.128 juta ha tumbuh di Indonesia (Flach 1983)
Beragam manfaat sagu:
pangan, pakan, plywood, renewable energy, pestisida nabati, dan bio fuel
Perbanyakan bibit secara In vitro:
Organogenesis
Embriogenesis
Perbanyakan bibit secara Ex Vitro: Polibag
Ruang Lingkup Penelitian
Peningkatan persentase bibit hidup dapat dilakukan dengan mengoptimalkan pertumbuhan perakaran bibit, sehingga tajuk dapat berkembang baik. Perakaran berfungsi mengabsorbsi berbagai unsur hara, mineral dan air dari dalam tanah yang berguna bagi pertumbuhan dan perkembangan bibit. Kondisi lingkungan tumbuh bibit penting dalam mendukung pertumbuhan dan perkembangan bibit. Teknik persemaian yang umum digunakan untuk bibit sagu yaitu persemaian di rakit. Teknik persemaian di rakit menghasilkan persentase bibit hidup yang cukup tinggi yaitu 80%. Namun demikian, permasalahan yang terjadi di lapangan setelah transplanting yaitu persentase bibit hidup di lapangan yang masih rendah sekitar 50%. Dengan demikian, diperlukan upaya untuk meningkatkan persentase bibit hidup di lapangan dan percepatan pembibitan dengan penggunaa bibit dengan bobot kurang dari 2 kg. Penggunaan bibit yang lebih kecil akan meningkatkan ketersediaan bibit sagu di lapangan. Teknik persemaian menggunakan polibag dapat menjadi alternatif persemaian bibit sagu yang mampu meningkatkan persentase bibit hidup di lapangan. Teknik persemai-an tersebut dapat mengurpersemai-angi resiko transplanting shock bibit saat bibit dipindahtanamkan ke lapangan. Keberhasilan bibit hidup di lapangan diharapkan akan mengalami peningkatan, dikarenakan penyesuaian bibit dari media polibag ke lapangan lebih mudah hidup dibandingkan dengan bibit yang berasal dari persemaian rakit.
Penelitian ini terdiri atas dua percobaan yaitu aplikasi jenis auksin dan bobot sucker terhadap pertumbuhan bibit sagu di persemaian polibag dan rakit. Percobaan pertama dilakukan untuk memperoleh informasi persentase hidup bibit, induksi perakaran bibit, dan korelasi peubah vegetatif sucker dengan persentase kandungan pati sucker di persemaian polibag. Percobaan kedua dilakukan untuk memperoleh informasi persentase hidup bibit, induksi perakaran bibit di persemaian rakit. Analisis kedua percobaan di atas dilakukan untuk menentukan perlakuan terbaik dari teknik persemaian polibag dan rakit, serta analisis perbandingan keduanya.
TINJAUAN PUSTAKA
Tanaman Sagu (Metroxylon spp.)
Tanaman sagu merupakan jenis palma penghasil karbohidrat tinggi yang berasal dari batang. Potensi karbohidrat yang dapat diperoleh berupa pati kering dari tanaman sagu yaitu sekitar 838 kg/pohon (Saitoh et al. 2004) dan Yamamoto dalam Bintoro (2008) melaporkan adanya sagu unggul juga di Sentani yang mengandung 947 kg pati kering/pohon. Selain itu, tanaman sagu yang tergenang sampai dengan satu bulan memiliki kondisi pati tetap baik. Namun sampai dengan saat ini, pemanfaatan tanaman sagu belum memberikan dampak pada peningkatan ekonomi masyarakat lokal, terutama di daerah Papua.
Indonesia memiliki keragaman genetik tertinggi dan sebaran terluas untuk tanaman sagu. Ehara (2009) menyatakan bahwa sagu merupakan energi pokok di beberapa daerah seperti Pulau Siberut (Sumatera Barat), pulau-pulau di Bagian Timur Indonesia (Maluku dan Papua), Melanesia Bagian Barat (Papua New Guinea). Menurut Bintoro et al. (2010) luas area hutan alami sagu di Indonesia
mencapai lebih dari satu juta hektar dan keragaman sampai dengan 60 jenis sagu di Papua. Daerah sebaran sagu di Indonesia dari Sabang sampai Merauke. Luasan hutan sagu alami sekitar 90% dan keragaman yang tinggi dijumpai di Provinsi Papua dan Papua Barat.
Tanaman sagu di Indonesia merupakan 60% dari area sagu dunia. Berdasarkan beberapa penelitian menunjukkan bahwa Indonesia memiliki biodiversitas sagu terbesar. Kertopermono (1996) melaporkan bahwa luasan sagu di Indonesia sekitar 1 528 917 ha dan tersebar di beberapa wilayah di Indonesia. Sebaran dan luasan tanaman sagu dibeberapa kawasan di Indonesia diantaranya Irian Jaya 1 406 469 ha, Ambon 41 949 ha, Sulawesi 45 540 ha, Kalimantan 2 795 ha, Jawa Barat 292 ha, dan Sumatra 31 872 ha. Darmoyuwono (1984) menyatakan bahwa luasan hutan sagu untuk Irian Jaya saja sekitar 4.2 juta ha.
Hasil penelitian Abbas et al. (2009) mengelompokkan populasi sagu di Indonesia menjadi dua kelompok besar. Kelompok I yaitu Jayapura, Serui, Sorong, Pontianak, dan Selat Panjang. Kelompok kedua yaitu populasi tanaman sagu dari Manokwari, Ambon, Palopo, dan Bogor. Kelompok pertama dibagi kembali menjadi dua sub kelompok. Sub kelompok pertama yaitu Jayapura, Serui, Sorong, sedangkan sub kelompok kedua yaitu populasi dari Pontianak dan Selat Panjang. Perbedaan hubungan kekerabatan diantara pupulasi tanaman sagu mungkin disebabkan penyerbukan persilangan. Menurut Jong (1995) bahwa secara umum polinasi tanaman sagu terjadi secara menyerbuk silang dengan waktu kedewasaan bunga jantan dan betina yang berbeda. Ditambahkan oleh Latta dan Mitton (1997) bahwa perbedaan populasi mungkin disebabkan adanya migrasi polen.
Ekologi Tanaman Sagu
menyatakan bahwa habitat asli tanaman sagu di sekitar tepian sungai yang cenderung tergenang dan berlumpur tetapi secara berkala mengering. Ditambahkan oleh Flach (1997) bahwa pada lahan kering yang lembab, tanaman sagu kalah bersaing dengan tumbuhan hutan lainnya, akibatnya jumlah anakan berkurang, namun kadar patinya tinggi.
Tanaman sagu umumnya tumbuh di daerah marginal, seperti halnya di tanah gambut, dibandingkan dengan dengan tanaman lainnya. Tanaman tersebut juga banyak tumbuh di daerah rawa, lebak dan di daerah tergenang. Menurut Bintoro (2008) tanaman sagu masih dapat menghasilkan pati sagu pada lama genangan 9-12 bulan. Notohadiprawiro dan Louhenapessy (1993) menyatakan bahwa pada agro iklim Oldeman, sagu dapat tumbuh di zone A, B1, B2, C1, C2, D1, D2, dan E1 di Maluku dan Irian Jaya. Sagu dapat tumbuh pada kawasan yang memiliki bulan basah lebih dari 3-9 bulan, tetapi bulan keringnya kurang dari 2 bulan.
Pati sagu yang dihasilkan bervariasi dari 200-900 kg per pohonnya, bergantung pada daerah tumbuh, asal bibit (unggul), kerapatan pertanaman, dan teknik budidaya. Jenis tanah berpengaruh terhadap produksi pati per pohon. Mulyanto dan Suwardi (2000) menyatakan bahwa jenis tanah Sufic fluvaquent (tanah alluvial), Mollic psammaquent (tanah berpasir), Typic sulfaquent (mengandung bahan sulfidik), Typic (normal) dan Vertic (liat) tropaquent (kawasan iklim tropika) memberikan produksi pati per pohon berturut-turut 153, 160, 223, dan 345 kg.
Teknik budidaya juga diperlukan pada tanaman sagu untuk mendapatkan potensi optimal. Bahan tanam, jarak tanam, pemangkasan anakan (thinning out), pengontrolan jumlah anakan, pemenuhan kebutuhan nutrisi, sistem drainase dan periode panen merupakan hal-hal penting terkait budidaya tanaman sagu.
Media Persemaian Polibag
Media yang biasa digunakan sebagai media perbibitan adalah tanah. Selain itu, arang sekam juga dapat digunakan sebagai campuran media pembibitan. Octaviani (2009) menyatakan bahwa arang sekam memberikan pengaruh yang baik terhadap pertumbuhan stek nenas (Ananas comosus L Merr) terutama pada pertumbuhan tinggi tunas, panjang akar, jumlah akar dan persentase stek berakar. Selain itu, media arang sekam lebih mudah diaplikasikan dan sudah dapat dianggap steril, karena proses pembuatannya.
Warna hitam pada media arang sekam menyebabkan daya serap terhadap panas tinggi sehingga menaikkan suhu dan mempercepat perkecambahan. Campuran media tanah dan arang sekam (1:1) lebih baik dibandingkan media tanah, media tersebut menyebabkan media tanam menjadi lebih berpori, sehingga memungkinkan terjadinya aerasi yang lebih baik untuk pertumbuhan tanaman Ki pahang (diameter batang, jumlah helai daun, luas daun, panjang akar, dan jumlah akar). Pencampuran media antara tanah dan arang sekam juga meningkatkan daya pegang air, tanpa menimbulkan air jenuh (Sabur 2011).
baik aerasinya. Selain itu, media tanam juga harus mempunyai kemampuan memegang air yang baik, drainase yang baik, dan pH yang sesuai dengan jenis tanaman serta mengandung unsur hara untuk mendukung pertumbuhan tanaman.
Pada pertumbuhan vegetatif yang pesat, karbohidrat yang diangkut ke akar lebih sedikit jika dibandingkan ke tajuk, sehingga petumbuhan akar lebih lambat dari pertumbuhan tajuk. Porsi yang didapatkan oleh tajuk lewat indikator luas dan jumlah daun serta tinggi dan diameter lebih tinggi dibandingkan dengan akar. Hal tersebut dibuktikan dengan bobot tajuk yang lebih besar dibandingkan dengan bobot akar. Rasio tajuk akar banyak dipengaruhi oleh keadaan lingkungan, seperti konsentrasi nitrat pada media tanam. Semakin rendah rasio tajuk akar maka konsentrasi nitrat di media tersebut juga rendah. Pada fase vegetatif yang pesat, karbohidrat yang diangkut ke akar relatif sedikit. Akar kekurangan karbohidrat jika dibandingkan tajuk sehingga pertumbuhan akar lebih lambat dibandingkan dengan tajuk, akibatnya rasio tajuk akar menjadi lebih tinggi. Rasio tajuk akar pada tanaman juga berkaitan dengan asimilat yang ditranslokasikan ke daun dan akar. Setelah tanaman membentuk cabang, pembagian asimilat lebih banyak ditrasnlokasikan ke tajuk (batang, cabang, dan daun). Tajuk yang sedang berkembang menyerap karbohidrat lebih banyak, sedangkan akar menyerap lebih sedikit (Darmawan dan Baharsjah 2010).
Hartmann et al. (2002) juga mengemukakan bahwa tidak maksimalnya pertumbuhan vegetatif pada fase bibit disebabkan hambatan fisik media tumbuh. Perubahan diameter batang tanaman Ki pahang ternyata mirip dengan perubahan tinggi bibit pada fase vegetatif. Pengaruh media tanam cukup dominan dalam meningkatkan pertumbuhan.
Setiap tanaman memiliki kemampuan hidup yang relatif sama, namun kemampuan adaptasi dan pertumbuhan masing-masing tanaman pada media baru setelah disapih ternyata relatif bervariasi (Sofyan dan Islam 2007). Kondisi seperti ini diduga menjadi penyebab bertambahnya jumlah daun dan luas daun pada media yang berbeda menunjukkan hasil yang berbeda pula. Wicaksono (2009) menyatakan bahwa media tanam cemara gunung (Casuarina junghuhniana Miq) tidak perlu disiapkan secara khusus, campuran antara tanah dan arang sekam sudah dapat meningkatkan pertumbuhan semai.
Rofik dan Murniati (2008) menyatakan bahwa penggunaan media porous dari media arang sekam menghasilkan respon pertumbuhan panjang akar tertinggi pada benih aren jika dibandingkan dengan media lainnya karena banyaknya ruang pori yang memungkinkan akar dapat tumbuh dan berkembang baik. Gruda dan Schnitzler (2004) menambahkan bahwa ketersediaan O2 di dalam media tumbuh sangat esensial untuk respirasi dan pertumbuhan akar. Keberadaan O2 di dalam media tumbuh dipengaruhi oleh kadar air media dan sifat fisik media seperti distribusi ukuran pori, jaringan arsitektur pori, dan tingkat pemadatan media.
Fungsi air sebagai penyusun utama protoplas, bahan baku dalam proses fotosintesis, dan pelarut dalam sejumlah proses hidrolisis. Serapan air yang terbatas akan menyebabkan terhambatnya berbagai aktivitas sel (Taiz dan Zeiger 2012). Stress air yang ringan saja (sekitar -1 sampai -3 bar) sudah dapat menghambat pembelahan dan pembesaran sel, bahkan dapat berhenti sama sekali (Harjadi dan Yahya 1988).
lingkungan tumbuh yang disesuaikan dengan karakteristik tanaman. Media tanam, kecukupan aerasi tanah, ketersediaan air, dan kondisi bahan tanam berpengaruh terhadap keberhasilan persemaian.
Media tanam yang memiliki aerasi baik akan memberikan pertumbuhan dan perkembangan akar yang lebih baik. Hal tersebut sesuai dengan yang diungkapkan Gardner et al. (1991) bahwa peningkatan porositas akan meningkatkan aerasi sehingga mendorong peningkatan respirasi akar. Dresboll dan Kristensen (2011) menambahkan bahwa melalui proses respirasi akar dihasilkan sejumlah energi yang antara lain digunakan mendukung pertumbuhan tanaman. Hal ini menegaskan pentingnya aerasi dalam hubungannya dengan O2 karena kandungan O2 tersebut dipengaruhi oleh kadar air, porositas media dan derajat pemadatan. Pemadatan media kurang mendukung perkembangan akar. Media padat memberikan daya pegang air yang tinggi tetapi air tersebut tidak dapat tersedia bagi tanaman.
Unsur hara merupakan ion yang bermuatan positif seperti K+, Ca2+, NH4+, ataupun ion bermuatan negatif seperti NO3-, SO32-, HPO42- yang terlarut dalam air. Ion-ion tersebut berasal dari bahan mineral tanah sebagai hasil dekomposisi bahan organik ataupun dari pupuk yang diberikan. Air merupakan media penggerak bagi ion untuk berdifusi dan bergerak melalui aliran massa sehingga menjadi tersedia bagi tanaman. Air berperan penting dalam membantu ion-ion tersebut menjadi tersedia bagi tanaman. Hal inilah yang menyebabkan jika terjadi kekurangan air maka seringkali diikuti kekurangan hara disebabkan kelarutan hara yang rendah di dalam tanah (Taiz dan Zeiger 2012; Hamim 2007). Tanaman sagu merupakan tanaman monokotil yang memiliki akar primer, sekunder, dan akar nafas. Akar nafas membantu tanaman sagu untuk dapat beradaptasi dengan baik pada tanah-tanah tergenang.
Media Persemaian Rakit
Kegiatan persemaian bibit sagu umumnya dilakukan dengan menggunakan sistem rakit. Sistem rakit menggunakan pelepah sagu sebagai tempat persemaian. Anakan sagu yang memenuhi kriteria disusun di atas rakit sedemikian rupa agar banir yang terendam dan rakit ditempatkan dalam air yang mengalir di tempat teduh (Haryanto dan Pangloli, 1992). Suryana (2007) mengatakan bahwa bibit yang direndam bagian pangkal bawahnya pada air mengalir akan menghasilkan presentase bibit yang tumbuh lebih dari 80%.
Menurut Papilaya (2009) anakan sagu dapat direndam secara langsung dalam air atau sungai kecil atau kolam yang mengalir. Bintoro et al., (2010) menambahkan bahwa bibit sebelum disemai ter-lebih dahulu direndam pada larutan fungisida biasanya digunakan Manzate 200, Dithane M-45 dengan konsentrasi 2 gL-1 selama 1-2 menit, kemudian bibit di-keringanginkan. Tujuan perendaman bibit untuk mematikan hama dan penyakit yang mungkin terbawa.
Persemaian bibit sagu selama 3 bulan. Bibit sagu setelah berumur 3 bulan akan memiliki jumlah daun 2-3 helai dan perakaran yang baik sehingga bibit siap ditanam ke lapangan. Persemaian yang terlalu lama akan menyebabkan bibit menjadi besar (akar banyak, daun berkisar 4-6 daun) (Bintoro et al., 2007).
Teknik persemaian bibit sagu dapat menggunakan rakit (sistem kanal), kolam lumpur dan polibag (Schuiling 2009). Pinem (2008) menyatakan bahwa persemaian di media kanal yang paling baik, karena bibit sagu di media kanal selalu mendapatkan air sehingga mendukung penambahan jumlah dan lebar daun. Percepatan pembibitan dengan menggunakan bibit dengan bobot kurang dari 2 kg sangat dibutuhkan untuk meningkatkan ketersediaan bibit di lapangan. Menurut Jong (2007) persemaian di kanal memiliki persentase hidup bibit yang tinggi yaitu 80%. Wibisono (2011) menyatakan meskipun persentase bibit hidup di persemaian rakit tinggi yaitu sekitar 80%, namun lebih dari 40% bibit mati pada saat dipindahtanamkan ke lapangan. Pinem (2008) menambahkan bahwa persemaian menggunakan kolam, tinggi air kolam tidak selalu sama, hal tersebut membuat bibit sagu seringkali menjadi stres sehingga pertumbuhannya tidak maksimal.
Persemaian Tanaman Sagu
Persemaian anakan sagu pada kondisi yang sesuai merupakan hal penting dalam memaksimalkan persentase tumbuh bibit di persemaian. Anakan sagu yang akan disemai diambil dari induk tanaman sagu dengan kualitas baik. Bahan persemaian diambil pada saaat kondisinya masih segar. Kriteria sumber bibit sagu yang baik yaitu bibit sagu dipilih dari rumpun yang berproduksi tinggi. Bibit diambil saat fase anakan, cadangan energi yang berupa banir (bonggol) sudah keras, memiliki akar yang banyak, berbentuk huruf L, bagian tajuk berwarna hijau tua dan segar, anakan sagu tidak terserang hama atau penyakit, dan bibit tidak menempel pada pohon induk.
Jika sucker sagu yang diambil dari lapangan dalam keadaan segar tidak segera disemai, maka pengkabutan diperlukan untuk mengurangi transpirasi dan menjaga kadar air sucker. Hal yang harus dilakukan pada pengambilan anakan sagu, sebagai bahan persemaian yaitu mempertahankan kelembaban (status air), meminimalisasi terjadinya kekeringan dan serangan patogen.
Penggunaan fungisida sistemik penting diaplikasikan untuk mencegah serangan dari mikroorganisme. Perlakuan fungisida mampu memberikan ketahanan yang akan berimpikasi pada peningkatan kelangsungan hidup dan peningkatan kualitas akar tanaman. Peningkatan pengakaran bergantung pada metode aplikasi (pembasahan keseluruhan bagian tanaman, perendaman atau penyatuan ke media tanam), spesies tanaman, fase pertumbuhan, dan kondisi lingkungan (Arteca 1996).
bobot sucker 500-999 g tidak berpengaruh terhadap persentase bibit hidup rata-rata yaitu 68.2%. Namun demikian, Ahmad (2012) menyatakan bahwa penggunaan bobot sucker 500-999 g dengan perlakuan kontrol (tanpa pupuk), pemberian 3 g/polibag dan 15 g/polibag pupuk N setelah penanaman dan paranet 75% memberikan persentase bibit hidup berturut turut 68.5%, 77.5%, dan 45% pada 10 minggu setelah penanaman di persemaian polibag. Faktor lingkungan se-perti suhu dan kelembaban dalam paranet mempengaruhi tingkat kematian bibit. Suhu mencapai 32.31-34.67°C dan kelembaban 75.38-58.33 % diduga mengakibatkan persentase hidup yang menurun.
Bibit Tanaman Sagu
Tanaman sagu diperbanyak secara vegetatif. Perbanyakan tanaman sagu tersebut memberikan kemudahan memperoleh bibit sebagai bahan tanam sehingga memberikan keuntungan secara komersial bagi pembukaan kebun sagu skala kecil maupun skala luas. Bibit sagu diperoleh dari rumpun tanaman sagu, biasanya dalam satu rumpun dapat diperoleh 5-10 calon bibit, bergantung pada luas rumpun sagu.
Sampai saat ini, bibit sagu yang diambil dari anakan sagu masih menjadi pilihan terbaik untuk perluasan kebun sagu. Bibit sagu yang diambil dari lapangan memiliki keragaman umur dan bobot bibit, sehingga sulit untuk memperoleh bibit dalam jumlah banyak untuk memenuhi kebutuhan bibit skala luas. Masalah utama dalam pembibitan yaitu persentase hidup bibit sagu masih rendah yaitu sekitar 70 % di persemaian rakit, dan 50 % saat ditanam ke lapangan.
Penelitian terkait karakteristik bibit sangat dibutuhkan untuk mendapatkan bobot optimal yang mampu meningkatkan persentase hidup bibit pada awal pertumbuhan tanaman sagu. Menurut Bintoro et al. (2010), perlakuan pemangkasan sucker sebekum bahan tanam diletakkan di persemaian bertujuan untuk mempercepat inisiasi tunas dan akar. Perlakuan pemangkasan tidak berpengaruh nyata terhadap pertumbuhan panjang daun bibit sagu.
Omori et al. (2002) menyatakan bahwa beberapa faktor yang mem-pengaruhi persentase hidup bibit sagu diantaranya memangkas rhizome dan akar, perlakuan naungan di pembibitan, kedalaman penanaman, dan metode pemeliharaan bibit. Sebagai tambahan, rhizome bibit sagu yang mengandung nutrisi (karbohidrat) di bagian intinya diduga secara signifikan berkontribusi terhadap kemampuan hidup selama awal pertumbuhan. Selama pembentukan awal, tingginya kandungan pati juga sangat penting untuk kemunculan organ vegetatif baru seperti daun dan akar baru.
Jenis Auksin
Auksin komersial yang digunakan merupakan hormon tumbuh yang mampu merangsang tumbuhnya akar dan merupakan gabungan dari beberapa hormon tumbuh dengan komposisi yaitu Naftalenasetamida 0.20%, 2-metil-1-naftalen asetat 0.03%, Idol-3-butirat 0.06%, dan Thiram 4.00%, serta secara ekonomi penggunaannya hemat dan terjangkau. Menurut Suartini (2006), tiga senyawa yang memiliki inti naphathalene berfungsi memperbanyak dan mendorong timbulnya suatu perakaran sedangkan satu senyawa aktif yang mengandung indole bermanfaat untuk memperbanyak dan mempercepat perakaran. Selain itu, Thiram berfungsi sebagai fungisida.
IBA dan NAA masih merupakan auksin yang paling umum digunakan dalam merangsang perakaran (Blazich 1989). IBA dan NAA merupakan kelompok auksin sintetik yang banyak digunakan sebagai penginduksi akar. Sebagian besar tanaman memberikan respon yang baik dan efektif untuk merangsang pengakaran. Keuntungan penggunaan auksin yaitu: 1) stek menghasilkan persentase akar yang tinggi, 2) inisiasi akar lebih cepat, 3) jumlah dan kualitas akar per stek meningkat, dan 4) keseragaman panjang akar meningkat (Arteca 1996).
Metode aplikasi agen induksi perakaran ada tiga cara yaitu aplikasi campuran bubuk auksin, perendaman dalam larutan yang telah diencerkan, dan pencelupan cepat dalam larutan dengan konsentrasi tertentu. Metode pencelupan merupakan metode yang sangat populer karena murah, cepat, mudah, dan diperoleh keseragaman perlakuan stek (Hartmann et al. 1990).
Menurut Gaspar et al. (1996), NAA sangat diperlukan dalam masa pertumbuhan organogenesis termasuk pembentukan tunas daun. Menurut Riyadi dan Tahardi (2005) perlakuan kombinasi NAA dan IBA menghasilkan pengakaran yang lebih tinggi dibanding NAA secara tunggal, meskipun secara tunggal NAA dapat menginduksi pengakaran. Menurut Gaspar et al. (1996) auksin sangat diperlukan dalam pertumbuhan organogenesis termasuk dalam pembentukan akar.
Jika selama ini, bibit yang digunakan cukup terbatas pada bobot sucker sekitar 2.5-5 kg, masih diperlukan alternatif bobot sucker yang lebih kecil untuk meningkatkan ketersediaan bibit siap tanam di lapangan. Percobaan bobot sucker (500-999, 1000-1499, dan 1500-2000 g), penggunaan jenis auksin (IBA, NAA, dan auksin komersial) untuk merangsang perakaran, dan tempat persemaian yaitu polibag dan rakit diperlukan untuk mendapatkan kombinasi perlakuan terbaik, sehingga dapat menjamin ketersediaan bibit yang lebih banyak.
Martin (2003) menyatakan bahwa jenis auksin indole-3-acetic acid (IAA), indole-3-butyric acid (IBA), dan 1-naphthalene-acetic acid (NAA) dilaporkan telah banyak digunakan untuk menginduksi perakaran secara ex-vitro pada tanaman berkayu. Afzal et al. (2011) menambahkan bahwa aplikasi IAA, IBA, NAA, 2,4-dichlorophenoxy acetic acid (2,4-D) dan gibberellic acid (GA3) pada konsentrasi 1000, 2000 and 3000 mgL-1 serta kombinasinya berhasil menginduksi akar pada anakan (aerial offshoot) kurma kultivar Hallawi.
contoh anakan kurma. Aplikasi ZPT pada anakan kurma berakar dengan bobot 11-20 kg lebih baik dalam menginisiasi perakaran dibandingkan dengan bobot 1-4 kg. Konsentrasi IBA yang lebih tinggi menghasilkan jumlah akar, rambut akar, daun, dan panjang daun serta persentase bibit hidup yang lebih baik. Namun demikian, ketebalan akar menurun dengan semakin meningkatnya konsentrasi IBA. Metabolisme IBA ditemukan pada proses perakaran anakan kurma. Konsentrasi IBA menghasilkan jumlah akar yang lebih lebih banyak dan waktu perakaran yang lebih cepat dibandingkan dengan anakan yang tidak diberikan perlakuan (kontrol). Lebih lanjut, Qaddoury dan Amssa (2004) menyatakan bahwa aktivitas dari IAA oksidase dan peroksidase meningkat, sementara fenol dan tingkat auksin menurun. Jumlah akar yang sedikit dan keterlambatan akar terinduksi telah diamati pada anakan yang tidak diberi perlakuan (kontrol).
Teknologi kultur jaringan tanaman sagu
Teknologi kultur jaringan sudah banyak dikembangkan pada berbagai komoditas tanaman. Perkembangan kultur jaringan tanaman sagu melalui embrio somatik belum banyak memberikan hasil. Tanaman sagu merupakan tanaman monokotil dan tergolong jenis palem yang berkembang biak, baik secara vegetatif maupun generatif. Perbanyakan secara generatif seperti kebanyakan tanaman lainnya, yaitu dengan menggunakan biji. Tanaman sagu dapat menghasilkan biji dalam jumlah yang sangat banyak, namun karena batang tanaman sagu dipanen sebelum berbunga maka produksi biji sagu sangat jarang dan perkecambahannya rendah. Selain itu, terdapat perbedaanwaktu reseptif bungan jantan dan bunga betina sehingga penyerbukan tidak mudah terjadi, meskipun bungan jantan dan betina terletak dalam satu pohon yang sama.
Perbanyakan vegetatif tanaman sagu yaitu dengan menggunakan anakan (sucker). Sampai dengan saat ini, baik masyarakat maupun perkebunan sagu masih menggunakan anakan sebagai bibit dalam perbanyakan tanaman sagu. Namun dengan perluasan pengembangan tanaman sagu dalam skala komersial, perbanyakan tanaman sagu dengan menggunakan anakan menjadi sesuatu yang kurang menguntungkan. Hal tersebut dikarenakan bahwa tidak seluruhnya anakan sagu yang ada pada satu rumpun dapat digunakan sebagai bibit, ketersediaan bibit sagu sulit diprediksi, dan ketidakjelasan genetik sagu dari indukan tanaman sagu tempat pengambilan bibit.
Awal perkembangan kultur jaringan tanaman sagu telah dilakukan melalui embriogenesis zigotik Alang and Krishnapillary (1986)), selain itu Tahardi et al. (2002) telah melakukan kultur tanaman sagu tersebut melalui embriogenesis somatik (Tabel 1). Oropez et al. (2003) menyatakan bahwa kloning in vitro tanamna kelapa melalui embriogenesis somatik menjanjikan prospek yang baik di masa mendatang. Studi untuk mendapatkan embrio somatik telah dilaksanakan dengan menggunakan berbagai jenis eksplan, termasuk daun muda, akar, embrio muda dan infloresen dengan berbagai tingkat keberhasilan.
1994). Kasi dan Sumaryono (2007) menyatakan bahwa penggunaan eksplan jaringan meristem apikal pada kultur embrio somatik tanaman sagu sudah mencapai tahap aklimatisasi, namun menyatakan bahwa persentase keberhasilannya masih rendah.
Teknologi embriogenesis somatik telah digunakan untuk propagasi masal pada tanaman palem-paleman seperti kelapa sawit (Rival et al. 1997), kurma (Esraghi et al. 2005) dan sagu (Riyadi dan Sumaryono 2010). Namun demikian, sampai saat ini penelitian mengenai organogenesis dan embriogenesis tanaman sagu belum banyak dilakukan. Protokol yang telah ada untuk embriogenesis belum mampu menghasilkan planlet tanaman sagu yang benar-benar dapat tumbuh dengan baik, ditambah lagi daya tumbuh saat aklimatisasi rendah. Tahap sterilisasi eksplan shoot tip tanaman sagu juga cukup sulit karena diambila dari bagian anakan sagu yang tumbuh di dalam tanah.
Banyak tanaman yang kaya akan kandungan polifenolik. Setelah pelukaan jaringan akibat pemotongan eksplan, senyawa tersebut akan dioksidasikan oleh polifenol oksidase dan jaringan tersebut akan berwarna coklat atau hitam. Produk oksidasi diketahui menghambat aktivitas enzim, membunuh tanaman, dan menyebabkan jaringan berwarna gelap, serta media kultur yang mempengaruhi penegakan eksplan. Beberapa prosedur yang biasa digunakan untuk mengatasi masalah tersebut antara lain: (i) menambahkan antioksidan ke media kultur seperti asam askorbat, asam sitrat, polyvinylpyrrolidone (PVP), dithiothreitol, bovine, serum albumin (ii) perendaman eksplan dalam antioksidan sebelum eksplan dimasukkan ke dalam media kultur (iii) kultur primer diinkubasi pada periode awal dengan mengurangi intensitas cahaya karena diketahui bahwa produk oksidasi fenolik dibentuk di bawah cahaya, dan (iv) pemindahan kultur pada media baru agak sering dilakukan ketika media sudah mulai berwarna kecoklatan (browning) (Chawla, 2002).
Organogenesis dan Embriogenesis
Embriogenesis somatik berbeda dari organogenesis ketika embrio menjadi struktur bipolar diakhiri oleh akar lebih baik dari struktur monopolar. Embrio muncul dari sebuah sel dan tidak ada hubungan pembuluh dengan jaringan kalus induk atau ekplan kultur. Lebih jauh, induksi embriogenesis somatik membutuhkan pemberian hormon tunggal untuk menginduksi struktur bipolar yang mungkin untuk membentuk sel kompeten, sementara organogenesis membutuhkan dua jenis hormon untuk menginduksi pucuk dan kemudian baru akar. Embrio somatik yang dihasilkan dari embriogenesis somatik menyerupai bipolar alami dari embrio zigotik. (Chawla 2002). Menurut Gahan and George (2008) tahap perkembangan embriogenesis somatik pada dikotiledon dan monokotiledon.
Embriogenesis somatik menjanjikan teknik alternatif untuk multiplikasi tanaman karena potensi tingkat proliferasi tinggi dan resiko kimera pada tanaman yang dihasilkan dapat diminimalisasi dan dieliminasi (Chand dan Sahrawat 2002). Perkembangan penelitian teknik in vitro pada tanaman sagu disajikan pada Tabel 1.
Tabel 1 Mikropropagasi klonal tanaman sagu melalui embriogenesis somatik cerah dan hijau mendominasi embrio somatik tanaman sagu
berbeda, keadaan fisiologi eksplan, tanaman tempat pengambilan eksplan, dan musim selama pengambilan ekspan.
George and Debergh (2008) meyatakan bahwa pembentukan tunas secara langsung kadang-kadang bersamaan dengan proliferasi dari sel-sel yang tidak terorganisasi dan jaringan regeneratif yang dapat diklasifikasikan sebagai kalus. Pembentukan tunas biasanya dikurangi melalui penggunaan zat pengatur tumbuh yang sesuai dengan medium.
Penggunaan ZPT yang berbeda pada kultur jaringan dapat memberikan pengaruh yang berbeda pula seperti yang disampaikan Rohmah (2007) Zat pengatur tumbuh berbeda yang diberikan pada media kultur dapat memberikan pengaruh yang juga berbeda pada eksplan yang ditanam.
Beberapa penelitian mengenai kultur jaringan sagu sudah dilakukan oleh Riyadi dan Sumaryono (2009) menyatakan bahwa dengan menggunakan MS yang dimodifikasi, 2.4-D 5 mg L-1 + Kinetin 0.1 mg L-1 dapat menginduksi kalus tanaman sagu yang berasal dari eksplan meristem apikal.
Menurut Pierik (1987) penggunaan komposisi media tergantung pada jenis tanaman yang dikulturkan. Begitu pula halnya Gunawan (1998) menyatakan bahwa beberapa macam media yang banyak digunakan untuk menunjang perbanyakan tanaman secara in vitro adalah formulasi Murashige dan Skoog (MS), Vasin dan Went, Nitsch dan Nitsch, White dan Knudson C. Sampai saat ini, regenerasi kelapa sawit melalui embriogenesis telah dicapai dengan menggunakan media Murashige dan Skoog dan Sukendah (2009) menggunakan media Euweens pada kultur embrio kelapa kopyor.
PERBANYAKAN TANAMAN SAGU (
Metroxylon
spp.)
MELALUI ORGANOGENESIS DAN EMBRIOGENESIS
SECARA
IN VITRO
Abstrak
Penggunaan bahan tanam dari kultur in vitro, terutama dari embrio somatik memiliki keunggulan seperti secara genetik stabil, dan identik dengan tanaman induk. Penelitian ini bertujuan untuk mempelajari embriogenesis dan organogenesis dari tanaman sagu.Percobaan ini telah dilakukan di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor dari Oktober 2011 sampai dengan April 2012. Eksplan yang digunakan adalah pucuk dan daun muda. Pucuk dari anakan sagu telah disterilisasi menggunakan sterilan seperti alkohol 70%, sodium hipoklorit, 0.2% merkuri klorida, antibiotik dan pembakaran sesaat diikuti pencucian dengan akuades steril. Ada beberapa kendala sterilisasi bahan tanam. Beberapa metode sterilisasi telah dilakukan, tetapi kultur aseptik yang diperoleh masih rendah. Kalus tidak terinduksi dari eksplan daun muda dengan media tanpa hormon dengan manitol 3%. Kalus juga tidak terinduksi dari media tanpa zat pengatur tumbuh. Eksplan daun muda tidak terinisiasi menjadi kalus atau organ sampai empat minggu setelah tanam. Sementara itu, eksplan daun muda mengalami pencoklatan pada minggu ke-5. jumlah eksplan aseptik dari pucuk muda rendah, hanya sekitar 2-3 pucuk steril dari keseluruhan perlakuan. Perlakuan sterilisasi menggunakan hipoklorit dan pembakaran sesaat merupakan teknik sterilsasi pucuk tanaman sagu.
Keywords: daun muda, pucuk, sterilisasi, kalus Abstract
The use of planting material from in vitro culture, especially derived from somatic embryos has some advantages such as genetically stable and identical to the mother plants (true to type). This study was carried out to understand the embriogenesys and organogenesis of sago palm. This experiments was conducted in Tissue Culture Laboratory, Department of Agronomy and Horticulture, Bogor Agricultural University, from Oktober 2011-April 2012. Materials were used shoot tip and young leaf. Shoot tip of sago sucker was excised and simultaneously sterilised by using sterilizing agents such as 70% EtOH, sodium hypoclorite, 0.2% mercury cloride, antibiotic, and also heating followed by rising sterile-aquadest. There are some problems for sterilization of shoot tip explant. Some sterilization methods were conducted, but persentation of aseptic culture was still low. Callus was not succesfully induced from young leaf explant. Callus were not obtained on hormon-free MS medium consisting 3% mannitol. Four months after planting, young leaf explant has been not differentiated into callus or organ. Meanwhile, after 5 month the leaf expant was browning. However, the number of aseptic shoot tip explants remaind low, of which only about 2-3 shoot tips were obtained. This study also reported succesful sterilisation of shoot tip explant from fungal and bacteri contamination using hypoclorit and heating treatments.
Pendahuluan
Kebutuhan bibit dalam jumlah besar dan seragam mutlak diperlukan dalam usaha pengembangan perkebunan tanaman sagu skala komersial. Kebutuhan bibit sagu dengan jarak tanam 8 m x 8 m adalah sekitar 156 bibit sagu per hektar. Dengan demikian dibutuhkan bibit dalam jumlah besar, cepat, dan seragam untuk mendukung pengembangan tersebut.
Saat ini, kebutuhan bibit masyarakat maupun perkebunan tersebut hanya dipenuhi dari pengambilan anakan sagu (sucker) secara konvensional. Meskipun dalam satu rumpun tanaman sagu terdapat banyak anakan sagu, namun tidak semua anakan sagu memenuhi kriteria untuk dijadikan sebagai bibit. Menurut Bintoro et al. (2010) sebelum anakan berumur dua tahun, penjarangan dilakukan dengan membuang semua anakan, namun setelah tanaman berumur dua tahun dilakukan pemeliharaan satu anakan setiap dua tahun sehingga diperoleh 5-6 anakan dalam satu rumpun sehingga kegiatan panen dapat berkelanjutan. Dengan demikian, sulitnya memperkirakan jumlah bibit yang tersedia dan terbatasnya ketersediaan jumlah bibit menjadi kelemahan dalam penyediaan bibit secara konvensional.
Teknik kultur jaringan dapat membantu mengatasi masalah penyediaan bibit dalam jumlah banyak, cepat dan seragam melalui organogenesis maupun embriogenesis. Organogenesis dapat membentuk tunas baik adventif maupun aksilar secara langsung maupun tidak langsung (melalui kalus), biasanya dengan menggunakan zat pengatur tumbuh kelompok sitokinin dan auksin. Menurut George and Debergh (2008) embriogenesis dapat dilakukan secara langsung maupun tidak langsung, namun embriogenesis somatik secara tidak langsung melalui pengkalusan lebih sering dilakukan, karena sel embriogenik dapat diinduksi pada permulaan awal kultur jaringan muda yang meristematik. Stasolla and Yeung (2003) menambahkan bahwa kesuksesan penginduksian embrio somatik hanya terjadi pada jaringan yang masih muda dan kualitas dari embrio somatik yang diperoleh dan kecepatan perubahannya ke planlet tergantung pada genotipe dari eksplan awal.
Tunas kurma diperoleh melalui organogenesis setelah diinduksi dari ekplan daun tanaman kurma pada media yang mengandung 10 mg L-1 2.4-D dan ditransfer ke media MS solid dengan penambahan 0.04 mg L-1 NAA, 0.2 mg L-1BA
and 0.02 mgL-1 KT (media proliferasi). Periode sampai terbentuknya tunas kurma adalah 8 bulan. Penggunaan 10 mg L-1 2.4-D pada embriogenesis somatik eksplan daun tanaman kurma menghasilkan kalus yang embriogenik setelah diinduksi selama 8 bulan, kemudian ditransfer ke media MS solid dengan penambahan 0.1 mg L-1 2.4-D (media diferensiasi) untuk menstimulasi diferensiasi dari kalus embriogenik ke embrio somatik kotiledonari (Othmani et al. 2009).
dengan konsentrasi tinggi, sitokinin mungkin tidak terlalu penting (Staden et al. 2008).
Beberapa penelitian mengenai kultur jaringan tanaman sagu telah dilakukan, namun masih terdapat kendala-kendala diantaranya jumlah perakaran yang sedikit dan persentase daya hidup planlet yang rendah saat aklimatisasi (Sumaryono et al. 2007), belum adanya penelitian mengenai organogenesis tanaman sagu serta masih kurangnya penelitian kultur jaringan pada beberapa aksesi tanaman sagu. Penambahan bahan aditif seperti air kelapa dan vitamin perlu dilakukan untuk meningkatkan jumlah embrio somatik yang terbentuk. Hasil penelitian Sukendah et al. (2008) yang menyatakan bahwa penambahan air kelapa 150 ml L-1 yang memberikan pengaruh baik untuk meningkatkan perkecambahan dengan waktu berkecambah lebih cepat pada embrio kelapa kopyor asal Sumenep. Tujuan penelitian yaitu mempelajari organogenesis dan embriogenesis tanaman sagu dengan menggunakan eksplan pucuk dan daun muda
Bahan dan Metode
Penelitian ini dibagi menjadi dua percobaan yaitu 1) organogenesis tanaman sagu dari eksplan daun muda dan 2) embriogenesis tanaman sagu dari eksplan shoot tip.
Waktu dan Tempat
Penelitian dilaksanakan Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura Institut Pertanian Bogor. Penelitian dimulai bulan November 2011sampai dengan selesai.
Bahan dan Alat
Bahan tanaman yang digunakan dalam penelitian ini adalah shoot tip (anakan sagu berumur 1-2 tahun dengan bobot 2.5-4 kg) dan daun muda tanaman sagu (Metroxylon spp.) Sagu tidak berduri diperoleh dari Kebun Koleksi Balai Pengkajian dan Penerapan Bioteknologi Bogor.
Bahan kimia yang digunakan meliputi komposisi media MMS (MS modifikasi ½ garam makro), media Eeuwens, serta zat pengatur tumbuh (ZPT) 2,4-D, Kinetin, BAP, IBA, 2-iP dan ABA. Bahan lain yang digunakan yaitu fungisida, bakterisida, antibiotik, detergen, clorox (10, 20 dan 30%), alkohol 70% dan 95 %, aquades steril, spirtus, gelrite dan sukrosa.