KAJIAN PATOGENESIS INFEKSI BUATAN
BAKTERI
Edwardsiella ictaluri
PADA
IKAN LELE (
Clarias
sp.)
ASEP DADANG KOSWARA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kajian Patogenesis Infeksi Buatan Bakteri Edwardsiella ictaluri Pada Ikan Lele (Clarias sp.) adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2009
Asep Dadang Koswara
ABSTRACT
ASEP DADANG KOSWARA. Pathogenesis Study of Edwardsiella ictaluri Experimental Infection in catfish (Clarias sp.). Under supervision of DEWI RATIH AGUNGPRIYONO and SRI ESTUNINGSIH.
Disease in cultured of catfish Clarias sp. known to be one of mortality factors resulted in low production and harvest failure. One of the potent diseases is Edwardsiella ictaluri infecting catfish Clarias sp.
Therapy by antibiotics often evokes resistance of the pathogenic bacteria and therefore it is necessary to carry out its alternative control. One of the procedures is by controlling its introduction and spread of E. ictaluri carried by fish or other media from one area to the others and its potential infection.
The aim of the study is to observe the pathological sequence and to recognize the organ target of E. ictaluri experimental infection incatfish (Clarias sp.). Fifty fishes inject intraperitoneally with LD50 dose of 1,3 x 104 cfu/ml E. ictaluri while 10 control fishes inject with 0.1 ml of PBS. The fishes are observed
for their swim behaviour and gross lesion up to 72 hours post infection (pi). Sample for histopathology and bacteria re-isolation are obtained at sequential time of 2, 4, 8, 12, 24, 36, 48 and 72 hours pi.
The fishes infected with E. ictaluri demostrate the vertical swim behavior starting from 2 hours pi, and weak reaction of outer stimulation from 12 pi. Gross observation revealed swollen spleen and kidney from 4 hours pi, produced acute peritonitis (abdominal dropsy) since 12 hours pi. Ptechial hemorrhagic dermatitis detected from 24 hours pi while swollen pallor liver exposed from 36 hours pi. Histopathology examination revealed similar lesion of natural infection of E. ictaluri such ulcerative dermatitis, ophthalmitis, branchitis, encephalitis,
RINGKASAN
ASEP DADANG KOSWARA. Kajian Patogenesis Infeksi Buatan Bakteri Edwardsiella ictaluri Pada Ikan Lele (Clarias sp.). Di bawah bimbingan DEWI RATIH AGUNGPRIYONO dan SRI ESTUNINGSIH.
Edwardsiella ictaluri merupakan penyebab penyakit Enteric Septicemia of Catfish (ESC) termasuk hama dan penyakit ikan karantina (HPIK) golongan II
yang memerlukan kewaspadaan tinggi untuk dicegah masuk dan tersebarnya penyakit ini di wilayah Republik Indonesia. Bakteri ini menimbulkan hole in the head disease. Ikan lele (Clarias sp.) merupakan salah satu komoditas air tawar yang penting, dalam rangka pemenuhan peningkatan gizi masyarakat Indonesia. Masalah yang sering dihadapi pada budidaya ikan lele adalah serangan penyakit yang disebabkan oleh parasit dan bakteri. Ikan lele merupakan salah satu inang target infeksi E. ictaluri. Upaya pencegahan penyebaran penyakit ini dapat dilakukan dengan tindakan karantina melalui tindakan pemeriksaan penyakit ikan terhadap ikan lele yang dilalulintaskan. Sampai saat ini, perubahan patologi ikan lele yang terinfeksi E. ictaluri isolat lokal secara detail belum diketahui,
Tujuan penelitian ini adalah (1) untuk mengetahui tahapan perubahan jaringan ikan lele (Clarias sp.) secara makroskopis (Patologi Anatomi/PA) dan mikroskopis (HP) akibat infeksi buatan E. ictaluri, (2) untuk menentukan target organ ikan lele (Clarias sp.) yang terinfeksi E. ictaluri, sehingga akan memudahkan dalam diagnosa penyakit.
Penelitian ini diharapkan dapat bermanfaat untuk memberikan informasi dalam mengenali berbagai stadium perkembangan dari infeksi E. ictaluri pada ikan lele (Clarias sp.) melalui pengamatan patologi anatomi (PA) dan histopatologi (HP) agar memudahkan pengawasan lalulintas ikan lele yang kemungkinan membawa / terinfeksi E. ictaluri, sehingga serangan bakteri tersebut dapat dicegah masuk dan tersebarnya di wilayah negara Republik Indonesia.
Penelitian dilakukan dalam 2 tahap yaitu uji pendahuluan (uji pengembalian virulensi dan uji LD50) dan uji utama. Uji utama dilakukan terhadap 50 ekor ikan yang disuntik secara intraperitoneal dengan dosis LD50 1,3
ml PBS. Pengamatan yang dilakukan meliputi : (a) gejala klinis, (b) patologi anatomi, (c) histopatologi, (d) pengujian E. ictaluri pada ikan sampel, (e) penghitungan jumlah koloni bakteri, dan (f) kualitas air. Sampel ikan untuk histopatologi dan reisolasi bakteri diambil pada jam ke-2, 4, 8, 12, 24, 36, 48 dan 72 pi.
Hasil penelitian memperlihatkan ikan lele yang terinfeksi E. ictaluri mengalami perubahan gejala klinis yaitu berenang vertikal mulai jam ke-2 pi dan refleks terhadap rangsang melemah mulai jam ke-12 pi. Perubahan makroskopis (patologi anatomi) yang terjadi adalah ukuran limpa dan ginjal membesar serta berwarna lebih gelap mulai jam ke-4 pi. Pembesaran abdomen (peritonitis / dropsy) mulai jam ke-12 pi. Dermatitis hemoragik ptekhie mulai terjadi jam ke 24 pi, sementara warna hati pucat mulai jam ke-36 pi.
Adanya lesio mikroskopis (histopatologi) pada organ-organ ikan lele terlihat mulai jam ke-2 pi, yaitu pada jantung dan usus. Pada jantung ditemukan kongesti, hemoragi, epikarditis dan hiperleukositosis. Pada usus ditemukan hiperplasia sel goblet, hemoragi, edema, akumulasi sel radang dan proliferasi MMC. Lesio pada mata, hati, pankreas dan limpa mulai jam ke-4 pi. Pada mata ditemukan edema dan akumulasi sel radang. Pada hati ditemukan kongesti, hemoragi, degenerasi sel lemak, akumulasi sel radang dan nekrosa multifokal. Pada pankreas ditemukan atrofi sel asinar, nekrosa sel asinar, infiltrasi sel lemak, degenerasi dan nekrosa pulau Langerhans. Pada limpa ditemukan proliferasi makrofag, bakteri dalam makrofag, deplesi folikel dan nekrosa. Lesio pada ginjal mulai jam ke-8 pi, pada otak mulai jam ke-12 pi, pada kulit mulai jam ke-24 pi, dan pada insang mulai jam ke-48 pi. Pada ginjal ditemukan hialinisasi tubuli, infiltrasi makrofag, bakteri dalam makrofag, penebalan kapsul Bowman dan nekrosa. Pada otak ditemukan kongesti, hemoragi, gliosis, nekrosa neuron, neuronofagia dan perivaskular cuffing. Pada kulit ditemukan edema, erosi sel epidermis dan akumulasi sel radang. Pada insang ditemukan akumulasi sel radang.
Hasil penghitungan jumlah koloni E. ictaluri tertinggi pada jam ke-24 pi yaitu 7 x108 cfu/ml. Hal ini menunjukkan, pada jam ke-24 pi derajat septisemia pada limpa ikan lele adalah yang paling tinggi. Selanjutnya jumlah koloni menurun karena berangsur-angsur sel-sel pada limpa mengalami kerusakan atau nekrosa.
Hasil pemeriksaan kualitas air selama penelitian masih dalam kisaran layak untuk budidaya ikan lele, baik untuk parameter suhu, DO, pH, NO2, maupun NO3.
Simpulan dari penelitian ini adalah (1) perubahan gejala klinis, patologi anatomi (PA) dan histopatologi (HP) yang dimulai pada jam ke-2 pi dari organ-organ kulit, insang, otak, hati, pankreas, limpa dan ginjal ikan lele yang diinfeksi buatan E. ictaluri sesuai dengan perubahan channel catfish yang terinfeksi alami E. ictaluri. Lesio yang sesuai yaitu peritonitis, dermatitis ulseratif, ophthalmitis,
brankhitis, ensefalitis, sel asinar pankreas atrofi, hepatitis nekrosa multifokus, splenitis dan nephritis. Lesio yang tidak sesuai ditemukan pada jantung yaitu epikarditis dan hiperleukositosis, pada usus yaitu enteritis kataralis, dan belum menimbulkan hole in the head, (2) lesio khas infeksi E. ictaluri pertama kali dideteksi mulai jam ke-4 pi, berturut-turut pada jaringan limpa, hati dan ginjal, (3) dari organ limpa, ginjal dan hati ikan lele, koloni E. ictaluri mulai ditemukan pada jam 2 pi hingga dengan jam ke-72 pi dengan menggunakan uji biokimia. Pada pengamatan Histopatologi (HP), E. ictaluri mulai ditemukan pada jam ke-36 pi hingga jam ke 72 pi pada jaringan ginjal dan jam ke-8 pi hingga jam ke-72 pi pada jaringan limpa, sedangkan pada jaringan hati tidak ditemukan E. ictaluri, dan (4) ikan lele yang dilalulintaskan yang mempunyai gejala klinis dan patologi anatomi mengarah ke infeksi E. ictaluri seperti gerak renang vertikal, dropsy dan ptekhie hemoragik, pemeriksaan dilanjutkan ke laboratorium bakteri.
© Hak cipta milik IPB, tahun 2009 Hak cipta dilindungi
KAJIAN PATOGENESIS INFEKSI BUATAN
BAKTERI
Edwardsiella ictaluri
PADA
IKAN LELE (
Clarias
sp.)
ASEP DADANG KOSWARA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Kajian Patogenesis Infeksi Buatan Bakteri
Edwardsiella ictaluri Pada Ikan Lele (Clarias sp.) Nama : Asep Dadang Koswara
NIM : B053040071
Disetujui, Komisi Pembimbing
drh. Dewi Ratih Agungpriyono, PhD Dr. drh. Sri Estuningsih, MSi Ketua Anggota
Diketahui,
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
drh. Bambang Pontjo P., MS, PhD Prof.Dr. Ir. Khairil Anwar Notodiputro, MS
PRAKATA
Segala puji dan syukur kepada Allah SWT atas rahmat yang telah dilimpahkan sehingga penulis dapat menyelesaikan tesis ini yang berjudul Kajian Patogenesis Infeksi Buatan Bakteri Edwardsiella ictaluri pada Ikan Lele (Clarias sp.)
Ucapan terima kasih penulis sampaikan kepada drh Dewi Ratih Agungpriyono, PhD dan Dr. drh. Sri Estuningsih, MSi atas waktu, saran, kesempatan, dan bimbingan selama penyusunan tesis ini. Juga ucapan terima kasih disampaikan kepada drh. Bambang Pontjo Priyosoeryanto, MS, PhD selaku Ketua Program Studi Sains Veteriner, Kepala Balai Uji Standar Karantina Ikan Jakarta yang telah mengijinkan untuk tempat penelitian, Prof. drh. Kurniasih dan drh. Surya Amanu, MS yang telah membantu penyediaan isolat bakteri.
Semoga tesis ini bermanfaat.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bandung tanggal 12 Januari 1965 dari ayah Entang Suriadinata (alm) dan ibu Odjoh. Penulis merupakan anak ketujuh dari delapan bersaudara.
Halaman
Uji Utama ... 16
Pengamatan Gejala Klinis Ikan Uji ………..………. 16
Pemeriksaan Makroskopis dan Mikroskopis …….…….. 16
Pengembalian Virulensi E. ictaluri ... 20
Hasil LD50 ... 22
Uji Utama ... 24
Gejala Klinis ……….. 24
Pemeriksaan Makroskopis (Patologi Anatomi) ………. 26
Pemeriksaan Mikroskopis (Histopatologi) ……… 28
Pengujian E. ictaluri Pada Ikan Sampel …... 63 Penghitungan Jumlah Koloni E. ictaluri dari Limpa ….…… 63
DAFTAR TABEL
Halaman
1 Morfologi dan uji biokimia E. ictaluri dari isolat awal (asal UGM)
dan uji pengembalian virulensi bakteri (BUSKI) ... 21 2 Jumlah kematian ikan lele yang diinfeksi E. ictaluri pada uji LD50 23 3 Perhitungan LD50 ikan lele yang diinfeksi E. Ictaluri ... 23 4 Hasil Pengamatan gejala klinis ikan lele yang diinfeksi E. ictaluri
selama 72 jam infeksi ... 24 5 Jumlah kematian ikan dari 50 ekor ikan lele yang diinfeksi E.
ictaluri 1,3 x 104 cfu/ml. ... 25 6 Pengamatan makroskopis ikan lele yang diinfeksikan E. ictaluri
pada dosis 1,3 x 104 cfu/ml ... 26 7 Jumlah koloni bakteri pada limpa ikan lele yang diinfeksi E.
ictaluri ………..
64
DAFTAR GAMBAR
Halaman
1 E. ictaluri dengan pewarnaan Gram ... 5 2 Ptekhie hemoragik pada permukaan tubuh channel catfish
(Ictalurus punctatus) yang terinfeksi E. ictaluri ... 7 3 Hati channel catfish yang terinfeksi E. ictaluri ... 8 4 Channel catfish dengan lesio hole in the head ……….. 9 5 Denah alur penelitian kajian patogenesis infeksi E. ictaluri pada
ikan lele (Clarias sp.) ... 19 6 Koloni E. ictaluri yang tumbuh di media TSA ... 22 7 Gerak renang vertikal yang teramati pada ikan lele yang
diinfeksikan E. ictaluri
...
25 8 Perubahan makroskopis ikan lele yang diinfeksi E. ictaluri ... 28
9 Jaringan mata ikan lele yang normal
….………...
29 10 Edema ditemukan di belakang jaringan mata ikan lele
...
30 11 Akumulasi sel radang ditemukan di belakang bola mata ikan lele . 31 12 Jaringan kulit dan otot ikan lele yang normal ………. 32 13 Edema radang di bawah epidermis dan otot pada jaringan kulit
dan otot ikan lele ………... 33 14 Erosi sel epidermis dan infiltrasi sel radang ringan pada bagian
dermis kulit ikan lele ... 34 15 Akumulasi sel radang pada subkutan kulit ikan lele dan dermatitis
ulseratif
...
34 16 Jaringan insang ikan lele yang normal ... 35 17 Akumulasi sel radang pada lamella sekunder jaringan insang ikan
lele ... 36 18 Jaringan otak ikan lele yang normal ... 37 19 Ensefalitis pada jaringan otak ikan lele ... 37 20 Nekrosa neuron, gliosis dan aktivitas neuronofagia pada jaringan
otak ... 38 21 Nekrosa neuron, gliosis, aktivitas neuronofagia dan infiltrasi
monosit pada jaringan otak ... 39 22 Area dengan nekrosa neuron tipe iskemia pada jaringan otak.ikan . 40 23 Perivaskular cuffing dan difus gliosis pada jaringan otak ikan lele . 40 24 Jaringan miokardium ikan lele yang normal ... 42 25 Epikarditis dan kongesti pada jaringan jantung ikan lele ... 43 26 Hemoragi pada otot jantung dan epikarditis pada jaringan jantung
sentra melano-makrofag serta infiltrasi limfosit ... 47
31 Edema dan sel radang pada jaringan usus ikan lele ... 47
Halaman 32 Jaringan hati ikan lele yang normal ... 48
33 Kongesti dan dilatasi sinusoid hati pada ikan lele ... 49
34 Hemoragi pada jaringan hati ikan lele ... 49
35 Degenerasi lemak pada jaringan hati ikan lele ... 50 36 Nekrosis multifokal pada jaringan hati ikan lele disertai infiltrasi sel radang limfosit dan makrofag ... 51
37 Jaringan pankreas ikan lele yang normal ... 52
38 Sel asinar inaktif pada jaringan pankreas ikan lele ... 52
39 Daerah nekrosa sel asinar pankreas ikan lele ... 53
40 Degenerasi dan nekrosa dari sel-sel pada pulau Langerhans jaringan pankreas ikan lele ... 54
41 Infiltrasi sel lemak pada jaringan pankreas ikan lele ... 55
42 Jaringan limpa ikan lele yang normal ... 56
43 Bakteri dalam makrofag pada jaringan limpa ikan lele ... 56
44 Morfologi bakteri yang di fagosit makrofag pada jaringan limpa ikan lele ... 57
45 Deplesi dan nekrosa folikel limfoid pada jaringan limpa ikan lele ... 58
46 Daerah nekrosa di jaringan folikel limfoid limpa ikan lele ... 58
47 Jaringan ginjal ikan lele yang normal ... 59
48 Proliferasi makrofag pada jaringan interrenal dan sel epitel tubulus mengalami degenerasi hyalin pada jaringan ginjal ikan lele ... 60
49 Bakteri dalam makrofag pada jaringan interrenal ginjal ikan lele .. 60
50 Penebalan kapsula Bowman dan sel epitel tubulus mengalami degenerasi hialin pada jaringan ginjal ikan lele ... 61
51 Morfologi E. ictaluri ... 62
DAFTAR LAMPIRAN
Halaman
1 Prosedur Pembuatan Preparat Histopatologi (HP) ... 70 2 Pengamatan Histopatologi (HP) pada setiap jam pengamatan dan
setiap organ ikan lele ………...
72 3 Hasil pengujian morfologi dan biokimia (gula-gula) E. ictaluri
PENDAHULUAN
Latar Belakang
Edwardsiella ictaluri yang merupakan penyebab penyakit Enteric
Septicemia of Catfish (ESC) termasuk hama dan penyakit ikan karantina (HPIK)
golongan II yang memerlukan kewaspadaan tinggi untuk dicegah masuk dan
tersebarnya penyakit ini di wilayah Republik Indonesia, karena penyakit bakteri
ini membahayakan dalam waktu relatif cepat dapat mewabah dan merugikan sosio
ekonomi (Anonim 2006). Di Indonesia dilaporkan, E. ictaluri pertama kali
ditemukan telah menginfeksi ikan patin Siam (Pangasius hypophthalmus) di
Provinsi Jambi pada bulan Januari 2002 (Panigoro et al. 2005). Supriyadi et al.
(2005) juga menemukan adanya E. ictaluri yang telah menginfeksi ikan patin
yang dibudidayakan di Provinsi Jambi, dan ikan lele di daerah Blitar, Jawa Timur.
Terakhir bakteri ini ditemukan telah menginfeksi ikan bawal di daerah
Yogyakarta (Amanu, komunikasi pribadi 2007).
Penyakit ESC pertama kali dikenal pada tahun 1976 menyebabkan
kematian pada benih channel catfish (Ictalurus punctatus) di Alabama dan
Georgia, USA. Bakteri penyebab penyakit ini diidentifikasi sebagai spesies baru,
E. ictaluri, baru dilaporkan pada tahun 1981. Di daerah Mississippi, penyakit
ESC ini dilaporkan telah menyebabkan kematian sampai 47 % dari total produksi
setahun ikan channel catfish dan mengakibatkan kerugian ekonomi dalam jutaan
dolar (Hawke et al. 1998) dan pada tahun 1988 telah terjadi 2.456 kasus di
Mississippi (Durborow et al. 1991).
E. ictaluri juga dilaporkan telah menginfeksi walking catfish (Clarias
batrachus) yang dibudidayakan di Thailand pada tahun 1987. Sedangkan di
Vietnam, E. ictaluri juga telah menginfeksi ikan patin Siam (Pangasius
hypophthalmus) yang dipelihara di kolam-kolam pada tahun 1992 (Panigoro et al.
2005).
E. ictaluri umumnya menyerang golongan catfish dan dikenal dengan
penyakit Hole in the Head Disease. Gejala eksternal dari serangan bakteri ini
adalah luka-luka pada bagian permukaan kulit berukuran 3-5 mm, berkembang
akhir dari manifestasi penyakit ini adalah luka di bagian kepala. Luka menyebar
hingga tulang kranium dan menyebabkan rongga otak terbuka. Berbeda dengan
E. tarda, pada serangan E. ictaluri tidak menghasilkan gas H2S sehingga tidak
menimbulkan bau busuk pada ikan yang terinfeksi (Hawke et al. 1981; Inglis et
al. 1993)
Selain menginfeksi channel catfish, E. ictaluri juga dapat menginfeksi
blue catfish (Ictalurus furcatus), white catfish (I. melas), walking catfish (Clarias
batrachus), European catfish (Silurus glanis), Chinook salmon (Oncorhynchus
tshawytscha) dan rainbow trout (O. mykiss) (Inglis et al. 1993; Noga 2000). E.
ictaluri juga telah dapat diisolasi dari ikan-ikan hias sakit seperti ikan danio,
green knife fish dan rosy barb (Hawke et al. 1998; Noga 2000). Bakteri ini juga
berpotensi sebagai patogen pada ikan salmonid (Baxa et al. 1990)
Ikan lele (Clarias sp.) merupakan salah satu komoditas air tawar yang
penting, dalam rangka pemenuhan peningkatan gizi masyarakat Indonesia. Ikan
lele banyak dibudidayakan secara intensif di Indonesia dan harganya terjangkau
oleh lapisan masyakarat bawah (Khairuman dan Amri 2005). Produksi budidaya
ikan lele setiap tahunnya mengalami peningkatan, pada tahun 2002 produksinya
sebesar 39.193 ton (Anonim 2004). Masalah yang sering dihadapi pada budidaya
ikan lele adalah serangan penyakit yang disebabkan oleh parasit dan bakteri. Ikan
lele merupakan salah satu inang target infeksi E. ictaluri (Anonim 2006).
Upaya pencegahan penyebaran penyakit dapat dilakukan dengan tindakan
karantina melalui tindakan pemeriksaan penyakit ikan terhadap ikan lele yang
dilalulintaskan. Sampai saat ini, perubahan patologi ikan lele yang terinfeksi E.
ictaluri isolat lokal secara detail belum diketahui, sehingga perlu dilakukan
penelitian untuk mengetahui tahapan perubahan patologi (makroskopis dan
mikroskopis) ikan lele yang terinfeksi E. ictaluri.
Tujuan
Tujuan penelitian ini adalah sebagai berikut :
1. Untuk mengetahui tahapan perubahan jaringan ikan lele (Clarias sp.) secara
makroskopis (Patologi Anatomi/PA) dan mikroskopis (Histopatologi/HP)
2. Untuk menentukan target organ ikan lele (Clarias sp.) yang terinfeksi E.
ictaluri, sehingga akan memudahkan dalam diagnosa penyakit.
Manfaat
Penelitian ini diharapkan dapat bermanfaat untuk memberikan informasi
dalam mengenali berbagai stadium perkembangan dari infeksi E. ictaluri pada
ikan lele (Clarias sp.) melalui pengamatan patologi anatomi (PA) dan
histopatologi (HP) agar memudahkan pengawasan lalulintas ikan lele yang
kemungkinan membawa / terinfeksi E. ictaluri, sehingga serangan bakteri
tersebut dapat dicegah masuk dan tersebarnya di wilayah negara Republik
Indonesia.
Hipotesis
Hipotesis yang mendasari dilakukannya penelitian ini adalah tanda-tanda
klinis maupun patologis pada ikan lele (Clarias sp.) yang diinfeksi secara buatan
dengan E. ictaluri mempunyai karakteristik yang sama dengan channel catfish
TINJAUAN PUSTAKA
Enteric Septicemia of Catfish (ESC)
Penyakit Enteric Septicemia of Catfish (ESC) pertama kali dikenal pada
tahun 1976 menyebabkan kematian pada benih channel catfish (Ictalurus
punctatus) di Alabama dan Georgia, USA (Hawke et al. 1998). Penyakit ESC
pertama kali diinformasikan pada tahun 1979 (Hawke et al. 1981; Hawke et al.
1998). Penyakit ESC disebabkan oleh infeksi E. ictaluri umumnya menyerang
jenis-jenis ikan lele terutama channel catfish (I. punctatus) (Hawke et al. 1998;
Inglis et al. 1993).
E. ictaluri menimbulkan penyakit yang menyebabkan kerugian ekonomi
cukup besar pada industri budidaya lele. Di daerah Mississippi, penyakit ESC ini
dilaporkan telah menyebabkan kematian sampai 47 % dari total produksi setahun
ikan channel catfish dan mengakibatkan kerugian ekonomi dalam jutaan dolar
(Hawke et al. 1998). Semua isolat E. ictaluri yang berasal dari ikan channel
catfish delta Mississippi mempunyai profil plasmid yang sama (homolog),
sehingga bisa digunakan sebagai probe asam nukleat untuk menentukan
keberadaan bakteri pada ikan (Reid and Boyle 1989).
E. ictaluri ini juga berhasil diisolasi dari ikan hias air tawar termasuk
kelompok ikan Barbus. E. ictaluri secara eksperimental pernah diinfeksikan
pada ikan Rainbow Trout, Salmon, dan beberapa jenis ikan Tilapia, tetapi secara
alami belum pernah dilaporkan terjadi wabah penyakit ESC pada ketiga jenis ikan
tersebut (Hawke et al. 1998).
Etiologi
Bakteri penyebab penyakit ESC diidentifikasi sebagai spesies baru, E.
ictaluri, dilaporkan pada tahun 1981 (Hawke et al. 1981; Hawke et al. 1998).
Dua dari tiga spesies yang termasuk genus Edwardsiella berkaitan dengan proses
infeksi pada manusia dan hewan. E. ictaluri merupakan agen penyebab enteric
septicemia pada channel catfish, sementara E. tarda merupakan patogen pada
hewan (ikan) dan manusia (Wong et al. 1989). Identifikasi E. ictaluri didasarkan
mudah dapat dibedakan dari E. tarda dari ketidakmampuannya untuk
memproduksi indol dan H2S (E. tarda mampu memproduksi keduanya).
Kedua spesies tersebut tidak saling bereaksi silang secara serologis (Shotts and
Plumb 1987).
Sistematika bakteri E. ictaluri menurut Holt et al. (1994) adalah sebagai
berikut : Famili : Enterobacteriaceae Genus : Edwardsiella
Spesies : Edwardsiella ictaluri
E. ictaluri adalah bakteri fakultatif anaerob, batang Gram negatif (Gambar
1) termasuk famili Enterobacteriaceae (Holt et al. 1994). Karakteristik biokimia
E. ictaluri pertama kali digambarkan oleh Hawke et al. (1981), dan dipelajari
lebih lanjut oleh Waltman et al. (1986) dengan menguji 119 isolat E. ictaluri, dan
ditemukan 100% positif dalam pengujian metil red, nitrat reduktase, lisin
dekarbosilase, ornithin dekarbosilase dan katalase. Selain itu, hasil pengujian
menyatakan 100% negatif dalam pengujian sitrat, malonat, Voges-Proskauer, phenylalanin, indol, arginin dihidrolase, sitokrom oksidase, β - galactosidase dan hydrolyzing urea.
Karakteristik dari E. ictaluri adalah bergerak dengan flagella, tidak
berspora dan tidak berkapsul, batang, pleomorfik, Gram -, berukuran 0,75 – 2,5
µm, koloni kecil, bulat transparan, tidak berwarna, suhu optimum 28-30oC,
oksidase -, katalase +, H2S -, Indol - (dari tryptophan), fermentatif, 0/129 resistan,
lysin dekarboksilase +, arginin dihidrolase , ornithin +, Gelatin , Urea , Citrate
-, VP --, Glukosa +-, Inositol --, Sorbitol --, Rhamnose --, Mannitol --, Arabinose --,
Sukrose -, fakultatif anaerob (Austin and Austin 1987; Crumlish et al. 2002;
Anonim 2006a; Holt et al. 1994).
Masa inkubasi E. ictaluri adalah 36 - 48 jam, tampak sebagai koloni
nonpigmen yang halus, bundar (diameter 1-2 mm), cembung ramping sampai
keseluruhan tepi. Bakteri ini tumbuh lambat atau tidak sama sekali pada suhu
37oC (Anonim 2006a). Media yang lengkap untuk pertumbuhan E. ictaluri terdiri
dari 46 komponen, termasuk di dalamnya larutan garam basal, glukosa,
magnesium sulfat, iron sulfate, 6 trace metal, 4 nukleotida, 10 vitamin, dan 19
asam amino. Pertumbuhan optimal pada suhu 30oC dan pH 7,0 (Collins and
Ronald 1996)
E. ictaluri termasuk famili Enterobacteriaceae dengan karakterisik Gram
negatif, batang, sitokrom oksidase negatif, bergerak kuat pada suhu 25-30oC dan
tidak bergerak pada suhu tinggi. Bakteri ini dapat memfermentasi dan
mengoksidase glukosa dengan memproduksi gas pada suhu 20-30oC. Terdapat
satu dari tiga plasmid yang berhubungan dengan E. ictaluri, fungsi plasmid ini
belum jelas tetapi penting dalam peningkatan resistensi antibiotika. Bakteri ini
akan tumbuh lambat di dalam kultur media, memerlukan 36 – 48 jam untuk
membentuk koloni pada BHI agar dengan suhu 28-30oC dan akan tumbuh lambat
atau bahkan tidak sama sekali pada suhu 37oC (Inglis et al. 1993).
Gejala Klinis
Ikan yang terinfeksi E. ictaluri seringkali terlihat berenang berputar-putar,
kepala ikan tersebut mengejar ekornya. Keadaan tingkah laku berputar (whirling
/kepala mengejar ekor) tersebut merupakan tanda adanya E. ictaluri pada otak
ikan. Ikan yang terinfeksi akan berenang menggantung dengan kepala di atas dan
Gejala klinis dari serangan bakteri ini adalah adanya ptekhie hemoragik
(Gambar 2) atau peradangan pada kulit di bawah mulut, operkulum (tutup insang)
dan perut ikan. Lesio seringkali menjadi banyak pada kulit ikan dan berwarna
merah terang. Peradangan dan hemoragik juga terjadi pada dasar sirip, luka-luka
fokal merah pada bagian kutan berukuran kecil berdiameter 1-3 mm, luka tersebut
berada di posteriolateral badan. Pada ikan yang terinfeksi kronis, lesio terbuka
akan berkembang diantara tulang tengkorak bagian depan, belakang atau diantara
mata. Ikan ini juga mengalami eksoptalmia, insang pucat dan pembesaran
abdomen (Inglis et al. 1993).
Gambar 2. Ptekhie hemoragik (tanda panah) pada permukaan tubuh channel catfish (Ictalurus punctatus) yang terinfeksi E. ictaluri (Sumber : Inglis et al. 1993)
Perubahan makroskopis PA akibat penyakit ESC ini diantaranya adalah
adanya timbunan cairan atau perdarahan pada rongga tubuh (Hawke et al. 1998;
Inglis et al. 1993). Hati terlihat berwarna pucat pada jaringan yang nekrosis atau
nampak burik berwarna merah dan putih (Gambar 3). Ptekhie hemoragik dapat
dijumpai pada jaringan otot, usus, dan lemak pada ikan. Usus terkadang berisi
cairan yang mengandung darah (Hawke et al. 1998). Ginjal dan limpa membesar,
peritoneum dan usus (Inglis et al. 1993).
Gambar 3. Hati channel catfish yang terinfeksi E. ictaluri nampak warna belang putih (tanda kepala anak panah) (Sumber : Hawke et al. 1998).
Patogenesis
E. ictaluri dapat menginfeksi inangnya melalui hidung, saluran
gastrointestinal dan insang, kemudian akan menyebar ke organ tubuh melalui
bakteriemia akut. Sel bakteri akan difagositosis lebih efisien jika terdapat serum
antibodi anti-E. ictaluri (Nusbaum and Morrison 2002). Masuknya E. ictaluri ke
dalam channel catfish terjadi melalui jaringan epitel, termasuk saluran
gastrointestinal dan mukosa olfaktorius (Skirpstunas and Baldwin 2002).
Dua bentuk gejala klinis ESC pada channel catfish adalah ensefalitis
kronis dan septicemia akut (Anonim 2006a). Pada bentuk kronis, bakteri tersebut
setelah menginfeksi kantung olfaktorius akan menyebar sepanjang syaraf
olfaktorius menuju otak, menyebabkan peradangan granulomatosa.
Meningoencephalitis ini menyebabkan tingkah laku ikan abnormal, berenang
lemah dan tidak beraturan. Pada tahap akhir penyakit ini, pembengkakan pada
dorsum kepala akibat proses peradangan mengikis jaringan ikat pada bagian ini.
Luka di kulit yang menembus tulang kranium menyebabkan terbentuknya lubang
pada tulang kranium sehingga penyakit ini disebut hole in the head disease
Pada bentuk akut, bakteri ini diduga menginfeksi melalui mukosa usus dan
menyebabkan bakteremia. Ikan yang terinfeksi memperlihatkan ptekhie
hemoragik pada sekitar mulut, kerongkongan dan bagian dasar dari sirip.
Tanda-tanda umum adalah luka multifokal berdiameter 2 mm, lesio-lesio kutan
hemoragik berkembang menjadi luka tidak berpigmen, pucat, peradangan insang
tingkat sedang dan eksoptalmia. Hemoragik dan nekrosis fokal tersebar pada hati
dan semua organ internal lainnya. Enteritis hemoragik, edema sistemik,
akumulasi cairan asites pada rongga tubuh, dan pembesaran limpa adalah
tanda-tanda non-spesifik (Anonim 2006a).
Gambar 4. Channel catfish dengan lesio hole in the head yang disebabkan oleh erosi pada tengkorak (tanda panah) (Sumber : Noga 2000).
Pada bentuk akut ini, kematian ikan terlihat pada hari 4 – 12 hari (Keskin
et al. 2004). Organ channel catfish yang terinfeksi berat E. ictaluri adalah ginjal
dan limpa yang mengalami nekrosis, hati mengalami edema dan nekrosis.
Karakteristik darah yang terinfeksi E. ictaluri adalah berkurangnya konsentrasi
hematokrit, hemoglobin, glukosa plasma dan protein plasma. Jaringan insang
interlamella mengalami proliferasi, kulit epidermis hilang, infiltrasi mononuklear
miositis selama 2 (dua) minggu sejak infeksi. Ikan lele menunjukkan lesio
gastrointestinal, termasuk ptekhie atau ekimosa pada mukosa saluran
gastrointestinal dan distensi intestinal yang berhubungan dengan produksi gas.
Sel E. ictaluri dapat dijumpai dalam makrofag (Inglis et al. 1993 ; Noga 2000).
Enteritis, hepatitis, miositis dan nefritis interstitialis mulai timbul sebagai lesio
akut yang kemudian akan berkembang menjadi kronis aktif dan akhirnya menjadi
kronis (Noga 2000).
Epizootologi
E. ictaluri dapat bertahan hidup pada kolam berlumpur selama lebih dari
90 hari pada suhu 25oC. Bakteri ini mungkin bersifat karier dalam usus ikan
terinfeksi. E. ictaluri dapat dideteksi dengan fluorescent antibody dalam usus
burung pemakan ikan. Penyakit ESC merupakan penyakit musiman, terutama
terjadi pada akhir musin semi sampai awal musim panas dan mulai pada musim
gugur. Pola ini sesuai dengan suhu udara 20 – 27oC. Penyakit ini telah dapat
dideteksi setiap bulan. Pada penelitian channel catfish yang terinfeksi terjadi
mortalitas tertinggi pada suhu 25oC, terendah pada suhu 23oC dan 28oC, dan tidak
ada kematian pada suhu 17oC, 21oCatau 32oC (Inglis et al. 1993).
Penyakit ESC terjadi antara suhu 22 – 28 oC dengan puncak wabah terjadi
pada bulan Mei, Juni, September dan Oktober, dan menyebabkan kematian ikan
500 – 2.000 ekor per hari pada kolam yang berisi 80.000 – 1.000.000 ikan
(Francis-Floyd et al. 1987). Setelah beberapa tahun awal penemuan penyakit
ESC, telah dideteksi beberapa kasus penyakit. Dimulai awal tahun 1980, jumlah
isolat E. ictaluri mulai banyak ditemui. Sebagai contoh, pada tahun 1981 telah
dilaporkan terjadi 47 kasus di Southeastern USA, dan tahun 1985 terdapat 1042
kasus dimana 28 % di Southeastern USA. Tingkat mortalitas populasi ikan
terinfeksi E. ictaluri bervariasi kurang dari 10 % sampai dengan lebih dari 50 %,
mulai dari benih sampai ukuran dewasa yang dipelihara di kolam air tergenang,
Pengendalian
Penyakit ESC dapat dikontrol melalui kemoterapi dan/atau tindakan
profilaktik. Perawatan anti mikrobial yang paling sering digunakan adalah aplikasi
oral dengan potentiated sulfonamide sulfadimethoxine ormethoprim atau
oksitetrasiklin, tetapi plasmid-mediated akan melawan antibiotik ini. Manajemen
untuk mengurangi stress pada ikan, penghentian makanan pada saat penyebaran
penyakit ESC terdeteksi dan vaksinasi merupakan cara pencegahan (Anonim
2006a). Copper sulphate dengan konsentrasi 2 mg/l juga dapat digunakan untuk
mencegah serangan E. ictaluri (Griffin and Mitchell 2207). Hasil penelitian dari
McGinnis et al. (2003) menunjukkan E. ictaluri sensitif terhadap florfenicol
(FFC) secara in vitro.
Saeed and Plumb (1986) telah melakukan penelitian vaksin untuk
serangan E. ictaluri, ternyata vaksin yang terbuat dari LPS (lipopolysaccharide)
E. ictaluri mampu meningkatkan imunitas inang terhadap serangan E. ictaluri.
Channel catfish mempunyai antibodi protektif setelah ikan-ikan tersebut terpapar
E. ictaluri (Vinitnantharat and Plumb 1993).
Diagnosis
Diagnosis definitif penyakit ESC memerlukan isolasi dan identifikasi E.
ictaluri di dalam target jaringan dengan gejala klinis yang menyertai. Pada
bentuk akut, ginjal merupakan organ target, sementara pada bentuk kronis otak
merupakan target organ untuk isolasi (Noga 2000).
Untuk mendeteksi penyakit ESC, Shotts and Waltman telah
mengembangkan media selektif untuk E. ictaluri, yaitu Edwardsiella Ictaluri
Agar (EIA), dapat digunakan untuk isolasi primer dan identifikasi presumtif
(Inglis et al. 1993). Identifikasi penyakit ESC menggunakan pengujian
karakteristik biokimia, atau serologi dengan aglutinasi serum spesifik, fluorescent
antibody (FA), atau ELISA (Inglis et al. 1993; Hawke et al. 1998; Anonim 2006a)
atau PCR (Anonim 2006a). E. ictaluri juga dapat diidentifikasi dengan
menggunakan sistem miniatur test biokimia seperti Sistem Minitek (BBL
Untuk menentukan intra dan interspesifik E. ictaluri dapat dianalisa
dengan menggunakan gel elektroforesis protein, fatty acid methyl esters
(FAMEs) dan immunoblotting (Panangala et al. 2006).
Ikan Lele (Clarias sp.)
Sistematika ikan lele menurut Saanin (1968) adalah sebagai berikut :
Kelas : Pisces
Bentuk umum ikan lele adalah bulat memanjang dengan kepala pipih.
Mulut terminal dilengkapi dengan empat pasang sungut sekelilingnya, tubuh tidak
bersisik, kulit licin berwarna gelap atau coklat dengan bagian ventral yang lebih
terang. Sepanjang dorsal dan anal dilengkapi sirip lunak, sirip punggung hampir
bersambungan dengan sirip ekor (Saanin 1968).
Jenis ikan ini bersifat nokturnal yaitu aktif di malam hari, lebih suka
bersembunyi di balik batu atau tanaman air, mencari makanan di dasar perairan.
Sekalipun demikian ikan ini sekali kali harus keluar ke permukaan air untuk
mengambil oksigen. Ikan lele termasuk ikan karnivor atau juga omnivor yang
memangsa jenis ikan kecil, larva serangga atau hewan dasar lainnya. Ikan ini lebih
banyak menggunakan penciumannya daripada penglihatannya untuk mencari
makan (Saanin 1968). Ikan lele lebih menyukai tempat terbuka dengan suhu
berkisar antara 20-25ºC. Ikan lele disebut ‘Scavenger’ karena senang memakan
bangkai. Makanan tambahan seperti pelet juga di sukai lele (Lingga dan Susanto
1989).
Dari segi biologi ikan lele mempunyai daya tahan hidup yang tinggi,
sehingga dapat hidup dalam lumpur dan air dengan kandungan oksigen rendah,
asalkan tidak mengandung racun. Hal ini disebabkan karena ikan lele memiliki
alat pernafasan tambahan yang terdapat dalam ruang udara sebelah atas insang,
sehingga mampu mengambil udara secara langsung dari udara (Arsyad dan
yang dipunyai ikan gurame, sepat dan tambakan melainkan hanya berupa
beberapa lipatan kulit tipis yang menyerupai spons (arborescent) yang terdapat
dalam rongga diatas rongga insang serta melekat padanya (Soetomo 1987).
Kualitas Air
Air merupakan faktor yang paling penting dalam budidaya ikan. Bukan
hanya ikan lele, ikan-ikan lainpun untuk hidup dan berkembang biak memerlukan
air. Karenanya, kualitas dan kuantitas air harus diperhatikan agar kegiatan
budidaya berjalan sesuai dengan yang diharapkan. Kualitas air adalah variabel
yang dapat mempengaruhi kehidupan lele. Variabel tersebut dapat berupa sifat
fisika, kimia dan biologi air. Sifat fisika air meliputi suhu, kekeruhan dan warna
air. Sifat kimia air adalah kandungan oksigen, karbondioksida, pH, amoniak dan
alkalinitas. Sifat biologi meliputi jenis dan jumlah binatang renik. Beberapa
persyaratan sifat air untuk budidaya lele adalah suhu berkisar antara 20 – 30oC,
pH antara 6,5 – 8, DO sebesar 3 ppm, CO2 sebesar 15 ppm, N2 sebesar 102 %,
NH3 sebesar 0,05 ppm, NH4+ sebesar 8,80 ppm, NO2 sebesar 0,25 ppm, dan NO3
BAHAN DAN METODE
Waktu dan Tempat
Penelitian telah dilaksanakan di Laboratorium Balai Uji Standar Karantina
Ikan Departemen Kelautan dan Perikanan di Jakarta dan Bagian Patologi,
Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan IPB
yang dimulai pada bulan Nopember 2006 sampai dengan Januari 2008.
E. ictaluri
E. ictaluri diisolasi dari ginjal ikan Bawal (Colossoma macropomum) yang
berasal dari peternakan ikan di desa Pringgolayan, Yogyakarta. E. ictaluri
tersebut telah diidentifikasi berdasarkan morfologi dan sifat-sifat biokimianya di
Laboratorium Mikrobiologi, Fakultas Kedokteran Hewan, Universitas Gadjah
Mada Yogyakarta (Amanu, komunikasi pribadi 2007).
E. ictaluri tersebut dikultur kembali di Laboratorium Balai Uji Standar
Karantina Ikan Jakarta, dilanjutkan dengan pengujian ulang morfologi dan
biokimia, untuk membuktikan bahwa bakteri tersebut benar-benar E. ictaluri.
Ikan Lele (Clarias sp.)
Ikan lele yang digunakan dalam penelitian berukuran 9 – 10 cm (5 – 6
gram) yang berasal dari satu induk dan bebas dari infeksi E. ictaluri. Ikan lele
tersebut diambil secara acak berasal dari peternakan ikan di daerah Cijeruk
Kabupaten Bogor. Ikan tersebut diperiksa kesehatannya dan tidak menunjukkan
gejala sakit. Sebelum digunakan dalam penelitian, ikan diaklimatisasi selama 48
jam dalam akuarium berukuran 30 x 25 x 20 cm3 berisi air 10 liter dengan kondisi
air statis yang telah difilter dan diberi aerasi. Pakan ikan berupa pakan pelet yang
Metode Penelitian
Uji Pendahuluan
Pengembalian Virulensi E. ictaluri
Pengembalian virulensi bakteri dilakukan dengan cara menginfeksikan E.
ictaluri dari sediaan kultur murni laboratorium pada ikan lele (Clarias sp.) sebagai
inang target penyakit ESC. Sebelumnya bakteri dibiakkan pada media cair (BHI
broth) dan diinkubasi pada suhu 28oC selama 24 – 48 jam (Inglis et al. 1993;
Anonim, 2006a). Hasil pemanenan dimasukkan ke dalam tabung reaksi steril
dengan ditambah pelarut PBS dan diaduk dengan vortex mixer hingga homogen,
setelah itu suspensi isolat bakteri yang diperoleh dihitung tingkat kekeruhannya
dengan membandingkan kepadatan konsentrasi bakteri (109 cfu/ml) pada standar
kepadatan bakteri menurut McFarland (Jang 1980).
Biakan E. ictaluri konsentrasi kepadatan 109 cfu/ml sebanyak 0,1 ml
disuntikkan secara intraperitoneal pada ikan lele ukuran ± 6 gram sebanyak 5
ekor. Setelah 2 – 3 hari masa inkubasi ikan yang menunjukkan gejala menciri
penyakit ESC segera diisolasi dari organ ginjal dan dilakukan pemeriksaan
sifat-sifat biokimianya untuk mengetahui kemurnian isolat bakteri tersebut. Isolat
bakteri dimurnikan dengan menggunakan media TSA. Isolat bakteri dari organ
ginjal yang telah terbukti virulen kemudian digunakan untuk uji selanjutnya.
Penentuan Dosis Infeksi (LD50)
Untuk memperbanyak biakan E. ictaluri yang akan digunakan pada uji
penentuan LD50, bakteri dipupuk pada media plat TSA, selanjutnya diinkubasi
pada 27ºC. Bakteri dipanen setelah 18 - 24 jam dan dibuat suspensi dalam larutan
PBS steril untuk mendapatkan konsentrasi kepadatan 104, 106, 108, 1010 cfu/ml.
Dalam menentukan nilai LD50 digunakan 5 kelompok perlakuan
masing-masing terdiri dari 10 ekor ikan. Ikan-ikan diinfeksi oleh 4 tingkat konsentrasi
kepadatan bakteri 104, 106, 108 dan 1010 cfu/ml secara intraperitonial sebanyak 0,1
ml per ekor dan 1 kelompok kontrol yang tidak diinfeksi, masing-masing
kelompok uji dilakukan 3 kali ulangan.
Pasca infeksi ikan tersebut dimasukkan ke dalam akuarium dan diberi
makroskopis dan jumlah kematian ikan selama 72 jam. LD50 dihitung menurut
metode Dragsted-Behrens (Hubert, 1980). Nilai LD50 tersebut digunakan sebagai
dosis infeksi pada uji utama.
Uji Utama
Uji utama bertujuan untuk mengetahui tahapan perubahan jaringan ikan
lele (Clarias sp.) secara makroskopis dan mikroskopis akibat infeksi E. ictaluri
dengan menggunakan dosis infeksi LD50.
Ikan lele sebanyak 50 ekor diinfeksi E. ictaluri secara intraperitoneal
dengan konsentrasi kepadatan sesuai hasil uji LD50 sebanyak 0,1 ml per ekor.
Pasca infeksi ikandimasukkan ke dalam 5 buah akuarium dan diberi pakan pelet
steril. Tiap akuarium memiliki kepadatan jumlah ikan uji sebanyak 10
ekor/akuarium. Satu akuarium berisi 10 ekor ikan yang diinjeksi PBS bertindak
sebagai kelompok kontrol. Penggantian air dilakukan bila air keruh yaitu sehari
sekali selama pengujian berlangsung.
Pengamatan perubahan jaringan secara makroskopik (Patologi Anatomi)
dan mikroskopik (Histopatologi) dari ikan-ikan uji yang diinfeksi E. ictaluri
dengan cara mengambil 1 ekor ikan sampel dari masing-masing akuarium pada
jam ke-0, 2, 4, 8, 12, 24, 36, 48, dan 72 pasca infeksi (pi), sehingga setiap waktu
pengambilan sampel diperoleh 5 ekor ikan.
Pengamatan Gejala Klinis Ikan Uji
Pengamatan gejala klinis yang diamati lele meliputi tingkah laku ikan lele
berupa reaksi terhadap rangsangan dan gerakan renang. Pengamatan gerakan
renang dilakukan selama 72 jam, uji untuk mengetahui reaksi terhadap
rangsangan dilakukan pada jam ke 0, 2, 4, 8, 12, 24, 36, 48, dan 72 pi.
Pemeriksaan Makroskopis dan Mikroskopis
Setiap waktu pengambilan sampel dilakukan pemeriksaan makroskopis
terhadap perubahan pada organ eksternal dan internal tubuh ikan. Pengamatan PA
dilakukan terhadap bentuk, warna dan ukuran dari organ-organ tersebut. Untuk
lambung, usus, pankreas, hati, limpa dan ginjal difiksasi dalam larutan Buffer
Netral Formalin (BNF) 10%, selama 48 jam. Sampel selanjutnya di proses untuk
pembuatan sediaan histopatologi menggunakan automatic tissue processor
(Sakura®
,
Jepang), ditanam pada parafin menggunakan alat tissue embeddingconsole (Sakura®
,
Jepang) dan dipotong menggunakan mikrotom (Spencer®,USA) setebal 5 µm. Sediaan histopatologi diwarnai dengan pewarnaan
hematoxylin-eosin (HE) dan Giemsa (Lampiran 1).
Pengamatan makroskopis dan mikroskopis berdasarkan adanya lesio pada
kulit, otot, mata, insang, jantung, lambung, usus, pankreas, hati, limpa dan ginjal
ikan uji. Pengamatan dilakukan pada jam ke 2, 4, 8,12, 24, 36, 48, dan 72 pi.
Data-data yang diperoleh dari pengamatan patologi dianalisa secara
deskriptif, baik data mengenai perubahan patologi anatomi (PA) maupun
perubahan histopatologi (HP).
Pada pengamatan perubahan histopatologi (HP), frekuensi kejadian lesio
pada setiap organ ikan lele dihitung dengan cara :
Jumlah sampel ikan yang mengalami lesio
x 100 % Jumlah sampel ikan
Pengujian E. ictaluri Pada Ikan Sampel
Selama uji utama dilakukan pengujian adanya E. ictaluri pada jaringan
ikan sampel pada setiap pengamatan. Jaringan yang diambil yaitu ginjal, limpa
dan hati, selanjutnya dilakukan isolasi dan dikultur pada media TSA kemudian
diinkubasi pada suhu 27°C selama 24 jam, dan koloni yang tumbuh terpisah diuji
lanjut sifat-sifat morfologi dan biokimianya (gula-gula). Pengujian adanya E.
ictaluri pada ikan sampel dilakukan pada pengamatan jam ke-2, 4, 8, 12, 24, 36,
48, dan 72 setelah infeksi.
Penghitungan Jumlah Koloni Bakteri
Pada uji utama, dilakukan reisolasi bakteri pada limpa dan penghitungan
jumlah koloni E. ictaluri dengan tujuan untuk mengetahui tingkat perkembangan
metoda hitungan cawan (HC). Metode HC ini dilakukan dengan cara : 1 gram
limpa dimasukkan ke dalam 9 ml larutan bufer pepton water. Kemudian
ditumbuhkan pada media TSA diinkubasikan selama 24 jam pada suhu 27°C. Isolat 1 (satu) koloni bakteri dipindahkan dan dikultur ke dalam 10 ml BHI broth,
diinkubasikan selama 24 jam pada suhu 27°C. Kemudian 0,1 ml contoh yang telah mengalami satu seri pengenceran diulaskan dengan spatula pada permukaan
TSA sebanyak 2 cawan (duplo). Setelah inkubasi, dilakukan perhitungan jumlah
koloni dengan menggunakan Colony Counter (Fardiaz 1987). Penghitungan
koloni bakteri ini dilakukan pada pengamatan jam ke 2, 4, 8, 12, 24, 36, 48, dan
72 pi.
Penghitungan koloni bakteri dilakukan terhadap cawan yang mengandung
30 sampai 300 koloni. Jumlah bakteri yang terdapat dalam tabung asal ditentukan
dengan mengalikan jumlah koloni yang terbentuk dengan faktor pengenceran
pada cawan yang bersangkutan, dengan rumus sebagai berikut :
Faktor pengenceran = Pengencaran x Pengenceran x Jumlah yang
awal selanjutnya ditumbuhkan
1 Koloni per ml = Jumlah koloni x
Faktor Pengenceran
Kualitas Air
Kualitas air yang diamati pada uji utama terdiri dari Nitrit (test kit), Nitrat
(test kit), pH (test kit), Oksigen terlarut, dan Suhu (termometer). Pengamatan
nitrit dan nitrat dilakukan pada saat awal dan akhir uji. Sedangkan pengamatan
Uji Pendahuluan :
Uji Utama :
HASIL DAN PEMBAHASAN
Uji Pendahuluan
Pengembalian Virulensi E. ictaluri
Hasil uji biokimia (gula-gula) E. ictaluri menghasilkan enzim katalase,
memfermentasi glukosa, tidak memfermentasi laktosa, tidak memproduksi H2S,
tidak membentuk indol dari tryptophan, tidak mampu memproduksi asam
campuran dari fermentasi glukosa, tidak mampu membentuk
acetyl-methyl-carbinol, tidak menggunakan citrate sebagai sumber karbon, tidak menghasilkan
enzim urease, tidak menghasilkan gelatin, dapat menggunakan gula secara
fermentatif, dapat menggunakan gula secara oksidatif dan bakteri tergolong Gram
negatif (Tabel 1).
Karakteristik dari E. ictaluri adalah bergerak dengan flagella, tidak
berspora dan tidak berkapsul, batang, pleomorfik, Gram -, berukuran 0,75 – 2,5
µm, koloni kecil, bulat transparan, tidak berwarna, suhu optimum 28-30oC,
oksidase -, katalase +, H2S -, Indol - (dari tryptophan), fermentatif, 0/129 resistan,
lysin dekarboksilase +, arginin dihidrolase , ornithin +, Gelatin , Urea , Citrate
-, VP --, Glukosa +-, Inositol --, Sorbitol --, Rhamnose --, Mannitol --, Arabinose --,
Sukrose -, fakultatif anaerob (Austin and Austin 1987; Crumlish et al. 2002;
Anonim 2006a; Holt et al. 1994).
Isolasi E. ictaluri tidak menghasilkan H2S atau indol, atau fermentasi
glukosa dengan menghasilkan gas pada suhu 37°C (Hawke et al. 1981). Menurut
Holt et al. (1994) mengatakan hasil isolasi E. ictaluri yang diinkubasi pada suhu
37°C selama 48 jam tidak menghasilkan H2S, indol, sukrosa dan citrate.
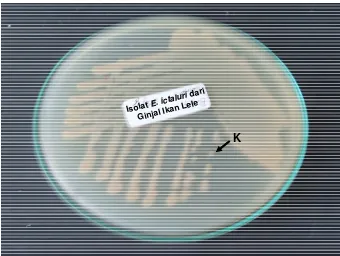
Koloni E. ictaluri secara morfologi terlihat sebagai koloni halus, tidak
berpigmen, konvek ramping, dan bundar (Gambar 6). Menurut Cooper et al.
(1996) mengatakan bahwa setelah inkubasi pada suhu 28° - 30°C selama 36 - 48
jam, koloni E. ictaluri terlihat mungil, halus, bundar (diameter 1-2 mm), penuh
dan dalam koloni tidak berpigmen, cembung ramping sampai keseluruhan tepi.
E. ictaluri merupakan Gram negatif berbentuk batang, sekitar 0,75-2,5 μm,
cytochrome oxidase negative. Bakteri ini tumbuh lambat atau tidak sama sekali
pada suhu 37°C.
K
IsolatE. ic
taluridari
Ginjal Ikan Lele
Gambar 6. Koloni E. ictaluri yang tumbuh di media TSA, hasil dari uji pengembalian virulensi bakteri yang diinfeksikan ke ikan lele.
K : Koloni tunggal E. ictaluri
Hasil LD50
Selama pengujian LD50 berlangsung, ikan lele menunjukkan gejala klinis
terinfeksi E. ictaluri. Tingkah laku ikan lele mengalami kelainan, ikan bergerak
berenang tidak normal dan berenang dengan kepala di atas permukaan air/vertikal.
Hasil pengamatan makroskopis, menunjukkan bintik-bintik merah pada kulit,
warna hati pucat, ginjal dan limpa berwarna lebih gelap.
Pada uji LD50, kematian ikan lele mulai muncul 1 hari setelah diinjeksi
bakteri. Kematian hari pertama dimulai dari ikan lele yang diinfeksi bakteri dosis
1010 cfu/ml, kemudian ikan lele yang diinfeksi bakteri dosis 108 cful/ml. Ikan lele
yang diinfeksi bakteri dosis 106 cfu/ml dan 104 cfu/ml mengalami kematian mulai
Tabel 2. Jumlah kematian ikan lele yang diinfeksi E. ictaluri pada uji LD50.
Jumlah Ikan yang Mati (ekor)
Total Mati
Untuk mengetahui nilai LD50 E. ictaluri, data pengamatan kematian ikan
lele pada Tabel 2 dihitung menurut metode Dregsted Behrens (Hubert, 1980)
seperti Tabel 3 di bawah ini :
Tabel 3. Perhitungan LD50 ikan lele yang diinfeksi E. ictaluri.
Konsentrasi Log
Perhitungan nilai LD50 :
dipergunakan untuk uji utama. Dalam salah satu penelitian, injeksi 1,5 x 103 cfu
E. ictaluri yang patogen dapat menyebabkan 100 % kematian catfish (Plumb dan
Sanchez 1983). Data lain menyebutkan bahwa nilai LD50 dari infeksi E. ictaluri
Uji Utama
Gejala Klinis
Selama penelitian dilakukan pengamatan terhadap gejala klinis yaitu
tingkah laku ikan lele meliputi reaksi terhadap rangsangan dan gerakan renang.
Hasil pengamatan reaksi terhadap rangsangan dan gerakan renang, pada jam
ke-0 ikan lele terlihat masih normal. Ikan lele mengalami kelainan gejala klinis
mulai jam ke-2 pi (Tabel 4).
Tabel 4. Hasil Pengamatan gejala klinis ikan lele yang diinfeksi E. ictaluri selama 72 jam infeksi.
No. Jam pengamatan
Gejala klinis
Gerakan renang Refleks terhadap rangsangan
Tingkah laku ikan lele mulai berubah pada pengamatan jam ke-2 pi yaitu
ikan lele mulai bergerak berenang tidak normal, ikan lele berenang dengan kepala
di atas permukaan air/vertikal (Tabel 4 dan Gambar 7). Hal ini sesuai dengan
penyataan Hawke et al. 1998 dan Francis-Floyd 1996 bahwa ikan yang terinfeksi
E. ictaluri akan berenang menggantung dengan kepala di atas dan ekor di bawah.
Refleks ikan lele terhadap rangsang mulai melemah pada pengamatan jam ke-12
Gambar 7. Gerak renang vertikal (tanda panah) yang teramati pada ikan lele yang diinfeksikan E. ictaluri mulai jam ke-2 pi.
Selain gejala klinis tersebut di atas, juga dilakukan pengamatan terhadap
jumlah kematian ikan lele. Pengamatan dilakukan pada jam ke-0, 2, 4, 8, 12, 24,
36, 48, dan 72 pi, Pada pengamatan jam ke-0 sampai dengan jam ke-12 pi,
terlihat belum ada kematian ikan pada akuarium. Kematian ikan dimulai pada
jam ke-24 sebanyak 4 ekor dari 50 ekor ikan yang diinfeksi pada dosis bakteri 1,3
x 104 cfu/ml (Tabel 5).
Tabel 5. Jumlah kematian ikan dari 50 ekor ikan lele yang diinfeksi E. ictaluri
1,3 x 104 cfu/ml.
No. Jam Pengamatan Jumlah Ikan yang Moribund dan Mati (ekor)
1 Jam ke- 0 pi 0
2 Jam ke- 2 pi 5
3 Jam ke- 4 pi 5
4 Jam ke- 8 pi 5
5 Jam ke- 12 pi 5
6 Jam ke- 24 pi 4
7 Jam ke- 36 pi 4
8 Jam ke- 48 pi 5
Pemeriksaan Makroskopis (Patologi Anatomi)
Pengamatan makroskopis dilakukan terhadap bentuk, warna, ukuran dan
perubahan patologi organ eksternal dan internal ikan lele. Organ eksternal ikan
yang diamati adalah kulit dan abdomen, sedangkan organ internal ikan yang
diamati adalah hati, limpa dan ginjal. Pengamatan makroskopis patologi anatomi
ikan lele yang diinfeksi E. ictaluri dilakukan pada jam ke-0, 2, 4, 8, 12, 24, 36, 48,
dan 72 pi. Hasil pengamatan disajikan pada Tabel 6.
Perubahan makroskopis pada kulit ikan lele dimulai pada jam ke-24 pi,
terjadi bercak-bercak merah terang (Tabel 6). Menurut Francis-Floyd (1996),
salah satu perubahan eksternal spesifik ikan yang terinfeksi E. ictaluri adalah
adanya lesio pada kulit berupa hemoragi. Lesio tersebut berupa ptekhie
hemoragik yang seringkali menjadi banyak (multifokus) pada kulit ikan dan
berwarna merah terang (Inglis et al. 1993)
Tabel 6. Pengamatan makroskopis ikan lele yang diinfeksikan E. ictaluri pada dosis 1,3 x 104 cfu/ml
No Jam
Pengamatan
Patologi Anatomi
Kulit Abdomen Hati Limpa Ginjal
1 Ke- 0 pi TAK TAK TAK TAK TAK
Abdomen ikan lele mulai mengalami perubahan pada jam ke-12 pi yaitu
ukurannya menjadi lebih besar atau dinamakan peritonitis / dropsy (Tabel 6 dan
Gambar 8a). Pembesaran pada abdomen disebabkan oleh pembengkakan organ
internal dan akibat adanya timbunan cairan eksudat atau pendarahan pada rongga
tubuh (Hawke et al. 1998; Inglis et al. 1993). Akumulasi cairan eksudat
peradangan pada rongga tubuh merupakan tanda non-spesifik dari penyakit ESC
(Francis-Floyd 1996; Anonim 2006a). Infeksi Vibrio anguillarum, Aeromonas
hydrophilla dan Renibacterium salmoninarum juga menyebabkan akumulasi
cairan eksudat peradangan pada rongga tubuh (Noga 1996; Roberts 1978; Inglis et
al. 1993).
Pada jam ke-36 pi, hati ikan lele mulai mengalami perubahan warna
menjadi lebih pucat (Tabel 6 dan Gambar 8b). Hati terlihat berwarna pucat atau
nampak belang merah dan pucat pada jaringan yang mengalami degenerasi
(Hawke et al. 1998).
Limpa ikan lele mulai mengalami perubahan pada jam ke-4 pi yaitu
berwarna menjadi agak gelap dan ukurannya membesar (Tabel 6). Hal ini sesuai
dengan Inglis et al. (1993), bahwa limpa catfish yang terinfeksi E. ictaluri akan
membesar dan berwarna merah gelap. Pembesaran ukuran limpa merupakan tanda
non-spesifik pada infeksi E. ictaluri (Anonim 2006a). Beberapa penyakit lain
seperti Aeromonas hydrophill, Yersinia ruckeri dan Mycobacterium marinum
menunjukkan pembengkakan limpa ((Noga 1996; Inglis et al. 1993).
Perubahan makroskopis ginjal ikan lele dimulai pada jam ke-4 pi. Ginjal
ikan lele mulai mengalami perubahan yaitu berwarna lebih gelap (Tabel 6).
Menurut Inglis et al. (1993), ginjal catfish yang terinfeksi E. ictaluri akan
a
b
Gambar 8. Perubahan makroskopis ikan lele yang diinfeksi E. ictaluri, a) abdomen ikan lele membesar, tanda panah; dan b) hati ikan lele pucat, tanda panah.
Pemeriksaan Mikroskopis (Histopatologi)
Hasil pengamatan mikroskopis menunjukkan ikan lele yang diinfeksi
buatan E. ictaluri secara intraperitoneal. akan menimbulkan lesio pada
organ-organ internal dan eksternal. Bakteri yang masuk rongga perut ikan akan
menginfeksi epitel selaput peritoneum dan masuk ke pembuluh darah
(bakteremia). Sebagai mikroorganisme bebas, bakteri akan menginfeksi mobile
cell (leukosit) menyebar ke organ tubuh seperti hati, limpa, kulit dan organ
internal lainnya (Mims 1987).
Infeksi alami dari E. ictaluri dapat terjadi melalui rute jaringan epitel
olfaktoris, insang dan saluran gastrointestinal, kemudian akan menyebar ke organ
tubuh melalui pembuluh darah (bakteriemia) secara akut (Nusbaum and Morrison
Adanya lesio pada organ-organ ikan lele terlihat mulai jam ke-2 pi, yaitu
pada jantung dan usus. Lesio pada mata, hati, pankreas dan limpa mulai jam ke-4
pi. Lesio pada ginjal mulai jam ke-8 pi, pada otak mulai jam ke-12 pi, pada kulit
mulai jam ke-24 pi, dan pada insang mulai jam ke-48 pi. Menurut Baldwin and
Newton (1993), ESC dicirikan oleh serangan septisemia yang cepat dengan
deteksi awal adanya E. ictaluri pada organ-organ internal dimulai 15 menit
mengikuti cairan sekresi lambung. Lesio mikroskopis dilaporkan muncul pada
hari ke-2 pi (Newton et al. 1989).
Histopatologi Mata
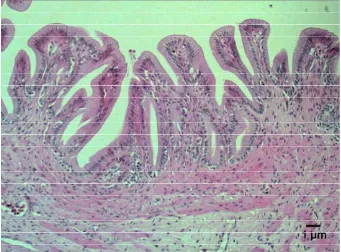
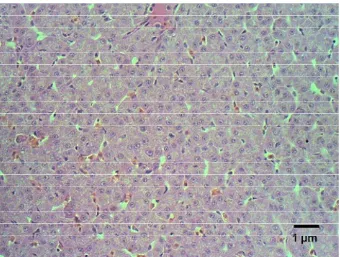
Dari hasil pengamatan histopatologi, sampai dengan jam ke-2 pi belum
nampak adanya perubahan lesio pada jaringan mata ikan lele, jaringan mata masih
nampak normal (Gambar 9). Pada jam ke-4 pi 60% sampel mulai menunjukkan
adanya perubahan mikroskopis pada mata ikan lele yaitu berupa edema di bagian
posterior mata (Gambar 10) dan meningkat menjadi 100% pada jam ke-72 pi.
Edema pada bagian posterior mata ikan lele berkaitan dengan peningkatan
permeabilitas vaskular, yang merupakan awal stadium peradangan (Damjanov
1997).
Gambar 10. Edema ditemukan di belakang jaringan mata ikan lele pada jam ke-4 pi E. ictaluri, Pewarnaan HE, skala 10 µm.
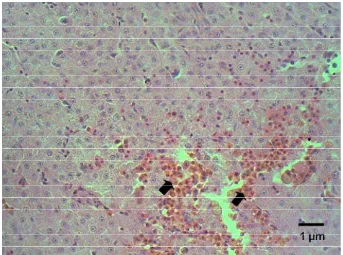
Pada jam 48 pi, 20% sampel menunjukkan reaksi pada jaringan mata
berupa adanya sel radang di bagian posterior mata ikan lele (Gambar 11) dan
menjadi 60% sampel pada jam ke 72 pi. Edema dan akumulasi sel radang di
posterior bola mata menyebabkan penonjolan bola mata atau eksophthalmus
secara makroskopis. Semakin banyak cairan edema dan sel radang yang
terakumulasi dalam ruang intraorbital, maka eksophthalmus semakin jelas
terlihat. Lesio eksophthalmus merupakan lesio non-spesifik dari infeksi E
ictaluri. Gangguan keseimbangan endokrin dan beberapa penyakit septisemia lain
seperti Aeromonas hydrophila dan Aeromonas salmonicida, Vibrio anguillarum
(Noga 1996; Inglis et al. 1993) menunjukkan lesio eksophthalmus juga.
Septisemia menyebabkan pembuluh darah khususnya pembuluh darah arteri yang
menyuplai bagian khoroid mengalami kerusakan endotel sehingga terjadi edema,
Gambar 11. Akumulasi sel radang ditemukan di otot belakang bola mata ikan lele pada jam ke-48 pi E.ictaluri (tanda panah). Pewarnaan HE, skala 10 µm.
Insert : Infiltrasi sel radang di antara otot di belakang bola mata. Pewarnaan HE, skala 1 µm
Histopatologi Kulit
Perubahan organ kulit akibat infeksi E. ictaluri memperlihatkan berbagai
kerusakan pada bagian epidermis dan dermis kulit ikan lele. Hasil pengamatan
terhadap sampel kulit ikan lele menunjukkan adanya : edema pada dermis, erosi
sel epitel dan sel radang pada lapisan subepidermis.
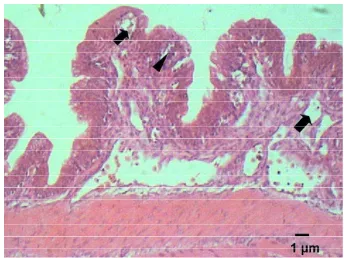
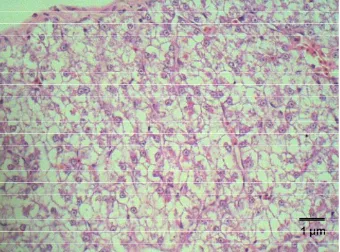
Dari hasil pengamatan histopatologi, sampai dengan jam ke-12 pi belum
nampak adanya perubahan lesio pada jaringan kulit ikan lele, jaringan kulit masih
nampak normal (Gambar 12). Pada jam ke-24 pi mulai terlihat edema pada
lapisan di bawah sel epitel epidermis dan di daerah otot (Gambar 13).
Edema adalah meningkatnya akumulasi cairan ekstraselular dan
ekstravaskular di sela-sela jaringan dan rongga tubuh. Edema dapat bersifat lokal
atau meluas di seluruh tubuh. Endotel kapiler merupakan suatu membran semi
permeabel yang dapat dilalui air dan elektrolit secara bebas, sedangkan protein
plasma hanya dapat lewat sedikit atau terbatas sekali. Tekanan osmotik darah
permeabilitas ini tergantung pada substansi semen yang mengikat sel-sel endotel
tersebut (Sudiono et al. 2003). Ada dua mekanisme kejadian edema, yaitu edema
hemodinamik dan edema permeabilitas. Edema hemodinamik terjadi akibat
tekanan yang meningkat pada pembuluh darah pada kondisi gangguan jantung
atau tekanan osmotik pembuluh darah yang berbeda dengan jaringan sekitarnya.
Edema permeabilitas biasanya terjadi akibat peradangan yang menyebabkan
endotel rusak pada beberapa bagian (Damjanov 1997). Edema pada lapisan di
bawah epidermis dan bagian dermis kulit ikan lele berkaitan dengan peningkatan
permeabilitas vaskular, yang merupakan awal stadium peradangan.
Gambar 13. Edema radang di bawah epidermis (tanda panah) dan otot (tanda kepala anak panah) pada jaringan kulit dan otot ikan lele yang diinfeksi E. ictaluri
pada jamke-24 pi. Pewarnaan HE, skala 2 µm.
Pada jam ke-24 pi, 60% sampel jaringan kulit dan otot mulai menunjukkan
erosi sel epidermis dan meningkat menjadi 100% pada jam ke-72 pi (Gambar 14).
Pada jam 36 pi, 20% sampel mulai memperlihatkan adanya sel radang di jaringan
subkutan (Gambar 15) dan meningkat menjadi 40% pada jam ke 72 pi.
Adanya sel radang di jaringan subkutan menyebabkan kejadian degenerasi
dan nekrosa pada epidermis dan dermis di bawahnya. Sel epidermis yang nekrosa
akan terlepas dari membran basalnya dan menyebabkan erosi yang meluas. Jika
nekrosa mencapai bagian dermis maka akan terbentuk ulkus atau luka terbuka.
Jaringan otot dibawah akumulasi sel radangpun turut mengalami perubahan
Gambar 14. Erosi sel epidermis kulit ikan lele pada jam ke-24 pi E. ictaluri (tanda panah), infiltrasi sel radang ringan terlihat pada bagian dermis (tanda kepala anak panah). Pewarnaan HE, skala 1µm
Peradangan kulit yang ulseratif merupakan lesio non-spesifik pada ikan
lele yang terinfeksi E ictaluri. Lesio tersebut merupakan perjalanan infeksi yang
bersifat sistemik atau septisemia. Agen yang beredar di pembuluh darah mencapai
bagian kulit, merusak endotel dan menimbulkan lesio perdarahan ptekhie, edema,
infiltrasi sel radang serta mengakibatkan erosi epidermis dan ulser. Infeksi
Aeromonas hydrophila, Pseudomonas fluorescens dan Vibrio anguillarum juga
menyebabkan lesio dermatitis ulseratif (Noga 1996; Roberts 1978; Inglis et al.
1993).
Histopatologi Insang
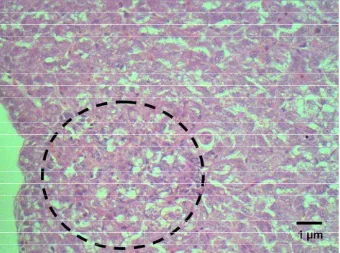
Dari hasil pengamatan histopatologi, sampai dengan jam ke-36 pi belum
nampak adanya perubahan lesio atau jaringan insang ikan lele masih nampak
normal (Gambar 16). Infiltrasi sel radang diantara lamella sekunder (brankhitis)
mulai terlihat pada 20% sampel jam ke-48 pi (Gambar 17) hingga 20% sampel
pada jam ke-72 pi.
Peradangan insang merupakan reaksi tidak spesifik terhadap E. ictaluri.
Lesio brankhitis juga dapat terjadi akibat kualitas air yang buruk dan infestasi
parasit. Infeksi Flavobacterium branchiophila, Amyloodinium sp. juga
menyebabkan peradangan insang (Noga 1996).
Gambar 17. Akumulasi sel radang pada lamella sekunder jaringan insang ikan lele (tanda panah) pada jam ke 36 pi E. ictaluri menyebabkan fusi dari lamela sekunder insang, Pewarnaan HE, skala 5 µm
Histopatologi Otak
Dari hasil pengamatan histopatologi, pada jam ke-8 pi belum nampak
adanya perubahan pada jaringan otak ikan lele (Gambar 18). Perubahan dimulai
pada jam ke-12 pi yaitu kongesti dan hemoragi (Gambar 19). Kongesti ditemukan
pada 20% dari sampel jam ke-12 pi sampai dengan jam ke-36 pi. Hemoragi
Gambar 18. Jaringan otak ikan lele yang normal pada jam ke-8 pi E ictaluri, Pewarnaan HE, Skala 1µm
Pada jam ke-24 pi tampak nekrosa neuron dan gliosis (Gambar 20) dan
aktifitas neuronofagia (Gambar 21). Gliosis dan aktifitas neuronofagia terjadi
mulai jam ke-24 hingga jam ke-72 pi.
Gambar 20. Nekrosa neuron , gliosis dan aktivitas neuronofagia pada jaringan otak jam ke-36 pi E. ictaluri (tanda panah), Pewarnaan HE, skala 1 µm
Gliosis terjadi ketika jaringan otak mengalami lesio nekrosis. Pada
permulaannya, terjadi respon eksudatif dengan aktivasi mikroglia lokal dan
pengerahan monosit fagositik untuk memfagositosis jaringan mati (Stevens et al.
Gambar 21. Nekrosa neuron, gliosis, aktivitas neuronofagia dan infiltrasi monosit pada jaringan otak jam ke-36 pi E. Ictaluri (tanda panah), Pewarnaan HE, skala 1 µm
Menurut Cheville (1999), neuronofagia merupakan proses fagositosis
sel-sel syaraf oleh mikroglia, sebaiknya dibedakan dari satelitosis, dimana
oligodendrogliosit berakumulasi di sekitar neuron. Dalam proses reaksi terhadap
lesio di otak, mikroglia mengalami pembesaran, hiperplasia dan otofagia.
Monosit yang berasal dari sirkulasi biasanya memasuki neuropil. Duapuluh
persen sampel pada jam ke-36 pi hingga jam ke-72 pi menunjukkan infiltrasi
monosit (Gambar 21). Nekrosis neuron mulai terlihat pada 20% sampel dari jam
ke-36 pi hingga 60% pada jam ke-72 pi.
Berdasarkan perubahan morfologi dimana ukuran neuron bertambah kecil
dengan sitoplasma yang gelap maka nekrosa neuron yang terjadi di golongkan
dalam nekrosa tipe iskhemia (Gambar 22). Iskhemik neuron terjadi akibat
gangguan suplai oksigen ke otak (McGavin et al. 2001). Infeksi sistemik dari E.
ictaluri telah menyebabkan kerusakan pembuluh darah sehingga suplai oksigen
terganggu dan menimbulkan lesio iskhemia. Neuron yang mengalami nekrosa
akan difagositosis oleh sel glia dan mengundang kehadiran monosit yang berasal
yang disebut sebagai perivaskular cuffing juga terlihat pada ikan lele penelitian ini
(Gambar 23).
Gambar 22. Area dengan nekrosa neuron tipe iskemia pada jaringan otak jam ke-72 pi (tanda panah) E. ictaluri, Pewarnaan HE, skala 1 µm