KERAGAMAN MIKROBA DAN METABOLISME RUMEN
SAPI PERANAKAN ONGOLE YANG MENGONSUMSI
PAKAN SILASE RUMPUT-LEGUM
RONI RIDWAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul Keragaman Mikroba dan Metabolisme Rumen Sapi Peranakan Ongole yang Mengonsumsi Pakan Silase Rumput-Legum adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Roni Ridwan
RINGKASAN
RONI RIDWAN. Keragaman Mikroba dan Metabolisme Rumen Sapi Peranakan Ongole yang Mengonsumsi Pakan Silase Rumput-Legum. Dibimbing oleh IMAN RUSMANA, YANTYATI WIDYASTUTI, KOMANG G. WIRYAWAN, dan BAMBANG PRASETYA.
Metana (CH4) adalah gas rumah kaca yang potensial berkontribusi terhadap
pemanasan global dan perubahan iklim. Sampai saat ini, emisi CH4 sudah
meningkat akumulasinya di atmosfer sekitar 2% per tahun. Ruminansia merupakan salah satu kontributor yang signifikan terhadap emisi enterik CH4 ke
lingkungan dari sektor peternakan. Secara alamiah CH4 dihasilkan selama
fermentasi dalam rumen yang merupakan suatu potensi kehilangan energi dan menurunkan produktivitas ruminansia.
Faktor yang paling membatasi pakan hijauan ruminansia adalah kecernaan dan kualitas nutrisinya. Kekurangan protein merupakan faktor paling penting menyebabkan rendahnya produktivitas ruminansia yang diberi pakan hijauan kualitas rendah. Calliandra calothyrsus merupakan leguminosa tropis digunakan sebagai pakan ruminansia, memiliki kandungan protein dan polifenol yang tinggi. Protein kasar mensuplai N untuk sintesis protein mikroba rumen dan polifenol digunakan sebagai strategi untuk menurunkan emisi enterik CH4 di ruminansia.
Pakan dengan kandungan protein tinggi seperti C. calothyrsus seharusnya dilakukan penyimpanan menggunakan metode pengawetan yang sesuai dengan kondisi geografi. Namun, legum tersebut pada umumnya mempunyai kandungan karbohidrat terlarut yang rendah dan tingginya kapasitas penyangga yang menyebabkan rendahnya kualitas pakan awetan (silase). Kombinasi rumput dan legum merupakan solusi untuk keberhasilan proses fermentasi silase dan meningkatkan kandungan protein pakan untuk produksi ruminansia yang berkelanjutan. Tujuan penelitian ini untuk mendapatkan keragaman mikroba dalam metabolisme rumen sapi yang mengonsumsi silase rumput-legum. Studi ini merupakan serangkaian penelitian yang terdiri atas tiga tahapan penelitian.
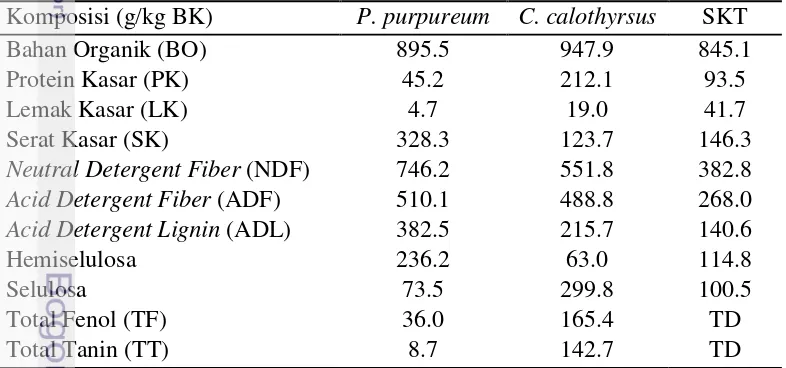
Penelitian tahap I untuk mendapatkan kualitas silase rumput-legum terbaik. Silase rumput-legum dibuat dalam rancangan acak lengkap dengan 5 perlakuan dan 3 ulangan sebagai berikut; (S0) Pennisetum purpureum 100%, (S1) P. purpureum 75% + C. calothyrsus 25%, (S2) P. purpureum 50% + C. calothyrsus
50%, (S3) P. purpureum 25% + C. calothyrsus 75%, dan (S4) C. calothyrsus
100%. Silase dibuat dalam silo plastik skala lab (600 g) dan diinkubasikan pada suhu ruangan (30oC) selama 30 hari. Silase rumput-legum di analisis karakteristik produk fermentasi dan keragaman mikrobanya.
Penelitian tahap II untuk mengetahui pengaruh silase rumput-legum pada mitigasi CH4 dan keragaman miroba rumen dalam fermentasi in vitro Hohenheim
Gas Test selama 24 jam. Penelitian ini menggunakan rancangan acak lengkap dengan 5 perlakuan dan 3 ulangan. Pakan perlakuan terdiri atas K; 100% konsentrat + tanin murni (1 mg/ml), T1; 25% silase (S2) + 75% konsentrat, T2; 50% silase (S2) + 50% konsentrat, T3; 75% silase (S2) + 25% konsentrat, dan T4; 100% silase (S2). Parameter yang diamati terdiri atas produksi gas total, CH4,
kecernaan bahan organik, VFA, pH, N-NH3, jumlah protozoa, dan keragaman
Penelitian tahap III untuk menurunkan aktivitas metanogenesis pada fermentasi rumen in vivo di sapi PO fistula. Penelitian ini menggunakan rancangan tukar ganti dengan 4 perlakuan dan 3 ulangan. Perlakuan pakan yang diberikan terdiri atas R0; 50% P. purpureum + 50 % konsentrat, R1; 20% P. purpureum + 50 % konsentrat + 30% silase rumput-legum (1:1), R2; 20% P. purpureum + 35 % konsentrat + 45% silase rumput-legum (1:1), dan R3; 20% P. purpureum + 20 % konsentrat + 60% silase rumput-legum (1:1). Cairan rumen dianalisis profil karakteristik fermentasi meliputi pH, VFAs, N-NH3, jumlah
protozoa dan keragaman serta dinamika populasi mikroba rumen menggunakan analisis T-RFLP, pustaka klon 16S rDNA, dan qPCR.
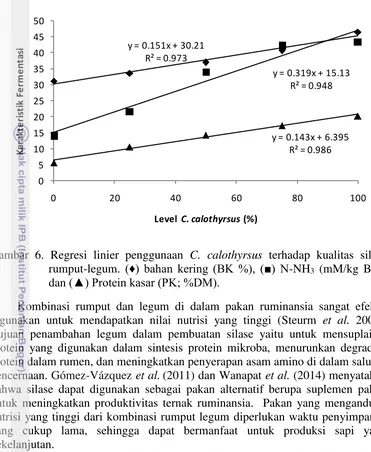
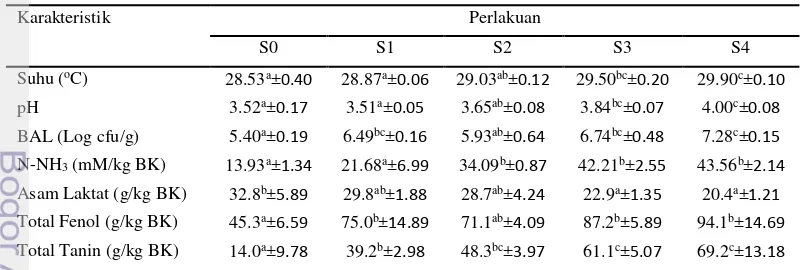
Hasil penelitian tahap I menunjukkan bahwa peningkatan C. calothyrsus
dalam silase rumput-legum berbeda nyata (P < 0.01) pada karakteristik produk fermentasi. Keragaman mikroba silase mengalami penurunan dan terhambat aktivitasnya seiring dengan peningkatan penggunaan C. calothyrsus. Komunitas mikroba silase terdiri atas Lactobacillus plantarum, L. casei, L. brevis,
Lactococcus lactis, Chryseobacterium sp., dan bakteri yang belum dapat dikulturkan. Pada penelitian tahap II menggambarkan bahwa peningkatan penggunaan silase rumput-legum pada fermentasi in vitro menurunkan produksi gas total, konsentrasi CH4, kecernaan bahan organik, keragaman bakteri, jumlah
protozoa, total metanogen dan populasi Metanobacteriales. Penggunaan 25%-50% silase rumput-legum menurunkan konsentrasi CH4, produksi gas total, dan
kecernaan bahan organik secara berurutan sebesar 11.43, 24.92, dan18.73%. N-NH3 dan VFA (kecuali butirat dan valerat) secara nyata menurun kandungannya
dengan peningkatan penggunaan silase rumput-legum. Hasil penelitian fermentasi
in vivo menunjukkan bahwa peningkatan pemberian silase rumput-legum secara nyata (P < 0.05) mempengaruhi peningkatan pH dan N-NH3, dan penurunan
populasi protozoa dan kandungan propionat. Komunitas bakteri dan metanogen cairan rumen sapi PO fistula didominasi oleh kelompok bakteri Prevotella brevis,
P. ruminicola, Succiniclasticum ruminis, dan kelompok metanogen
Methanobrevibacter ruminantium, M. smithii, M. thueri, dan M. millerae.
Penelitian ini menyimpulkan bahwa silase rumput-legum dengan kombinasi (1:1) P. purpureum dan C. calothyrsus menghasilkan karakteristik produk fermentasi yang baik dan komunitas mikrobanya didominasi oleh L. plantarum. Evaluasi silase rumput-legum pada fermentasi in vitro menggambarkan bahwa penggunaan 50% silase rumput-legum efisien dalam mitigasi produksi enterik CH4 dengan menurunkan total metanogen dan populasi Metanobacteriales, tetapi
masih memiliki pengaruh terhadap penurunan keragaman bakteri dan kecernaan bahan organik. Pada fermentasi rumen in vivo di sapi PO fistula menunjukkan bahwa peningkatan pemberian silase rumput-legum memiliki potensi menghambat metanogenesis secara langsung dengan menurunkan distribusi populasi Metanobacteriales dan tidak langsung dengan menurunkan keragaman bakteri dan populasi protozoa di rumen. Proporsi pemberian silase rumput-legum kurang dari 45% atau 5.2% dari total tannin efisien memberikan pengaruh terhadap keseimbangan metabolisme rumen dan berpotensi dalam mitigasi CH4 dengan
menurunkan distribusi relatif metanogen sebesar 6% di rumen.
SUMMARY
RONI RIDWAN. Microbial Diversity and Metabolisms in the Rumen Content of Ongole Breed Cattle Fed Grass-Legumes Silage. Supervised by IMAN RUSMANA, YANTYATI WIDYASTUTI, KOMANG G. WIRYAWAN, and BAMBANG PRASETYA.
Methane (CH4) is a potent greenhouse gases that contributes to global
warming and climate change. Until now, CH4 emissions had already accumulated
increased in the atmosphere by approximately 2% per year. Ruminant is one significant contributor to enteric CH4 emissions into the environment from
livestock sector. Naturally, CH4 produced during fermentation in rumen which is
an energy loss and reduce productivity for the ruminant.
The most limiting factors in feeding cattle with forage are digestibility and nutrient quality. Protein deficiency is the most important factor leading to low performance of ruminants fed low quality forages. Calliandra calothyrsus is a tropical legume used for ruminant feed, which contains high crude protein and polyphenolics contents. Crude protein supplies N for microbial protein synthesis in the rumen and polyphenolics for nutritional strategy to reduce CH4 emissions
from ruminants. Feed with a high protein content such as C. calothyrsus should be preserved using suitable methods; the method used depends on geographical location. However, legumes that have a low water soluble carbohydrates content and high buffer capacity do not produce good quality silage. Combination grasses and legumes are an alternative solution to the success of the ensiling process and for improving the crude protein content of feeds for sustainable ruminant production. The goals of this study was to investigate microbial diversity and metabolisms of rumen cattle fed different level of silages containing C. calothyrsus. This research was conducted with three parts of experiment.
The first experiment was to evaluate the quality of silage which contained different levels of C. calothyrsus by examining the fermentation characteristics and microbial diversity. Silage was made in a completely randomized design consisting of five treatments with three replications i.e.; (S0) Pennisetum purpureum 100%, (S1) P. purpureum 75% + C. calothyrsus 25%, (S2) P. purpureum 50% + C. calothyrsus 50%, (S3) P. purpureum 25% + C. calothyrsus
75%, and (S4) C. calothyrsus 100%. All silages were prepared using plastic jar silos (600 g) and incubated at room temperature for 30 days. Silages were analyzed for fermentation characteristics and microbial diversity.
Second experiment was to investigate the effects of silage based diets on CH4
mitigation and microbial diversity in a rumen fermentation system. The in vitro
fermentation was performed in glass syringes for 24 h using the Hohenheim Gas Test. The experiment was conducted in a completely randomized design with five treatments and three replications. The dietary treatments consisted of varying levels of silage containing 50% of C. calothyrsus as follows K; 100% concentrate + pure tannic acid of 1 mg/ml, T1; 25% silage + 75% concentrate, T2; 50% silage + 50% concentrate, T3; 75% silage + 25% concentrate, and T4; 100% silage. The fermentation parameters measured were total gas, CH4, in vitro organic matter
digestibility (IVOMD), VFAs, pH, N-NH3, numbers of protozoa, and microbial
Final experiment was to reduce the methanogens activities by in vivo
fermentation. Design of experiment was cross over with 4 treatments and 3 sampling periods as replication. The diets used in the experiment consisted of R0: 50% P. purpureum + 50 % concentrate, R1: 20% P. purpureum + 50 % concentrate + 30% grass-legume silage (1:1), R2: 20% P. purpureum + 35 % concentrate + 45% grass-legume silage (1:1), and R3; 20% P. purpureum + 20 % concentrate + 60% grass-legume silage (1:1). Rumen fluid samples were analyzed for rumen fermentation characteristics, including VFAs, pH, N-NH3, protozoa
population, diversity and microbial population dynamics using T-RFLP, 16S rDNA clone library, quantitative real time PCR (q-PCR).
The first results showed that increasing levels of C. calothyrsus in silage had a significant effect (P < 0.01) on the fermentation characteristics. The microbial diversity index decreased and activity was inhibited with increasing levels of C. calothyrsus. The microbial community indicated that there was a population of
Lactobacillus plantarum, L. casei, L. brevis, Lactococcus lactis, Chryseobacterium sp., and uncultured bacteria. Second results described that increasing levels of silages in a rumen in vitro fermentation system reduced total gas production, CH4 concentration, IVOMD, diversity index of bacteria, protozoa
numbers, total methanogens and Methanobacterales population. With 25% to 50% silage decreasing CH4 concentration, total gas production and IVOMD by 11.43,
24.92, and 18.73%, respectively. Ammonia N and VFAs (except butyrate and valerate) were significantly reduced (P < 0.01) by increasing level of silages. Final results indicated that increasing levels of silages gave significant effect (P < 0.05) on pH, protozoa population, N-NH3, and propionate (C3). Bacteria and
methanogen communities in the rumen, were dominated by Prevotella brevis, P. ruminicola, Succiniclasticum ruminis and Methanobrevibacter ruminantium, M. smithii, M. thueri, and M. millerae.
The result confirms that silage with a combination of grass and C. calothyrsus had good fermentation characteristics and microbial communities were dominated by L. plantarum. Evaluated in a rumen in vitro fermentation system confirmed that 50% silage containing C. calothyrsus has been efficient in mitigation enteric CH4 production by reducing total methanogens and
Methanobacteriales numbers, but has still negative effect on decreasing bacteria diversity and organic matter digestibility. Finaly, increasing level of silage diets in a rumen in vivo fermentation system suppress methanogenesis by reducing population distribution of Methanobacteriales directly and indirectly by reducing the diversity of bacteria and protozoal population in the rumen. Grass-Legumes silage diets less than 45% or 5.2% of total tannin give a metabolism balance and potent methane mitigation reduced by 6% in the relative distribution of methanogens in the rumen.
© Hak Cipta Milik IPB, Tahun 2014 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
KERAGAMAN MIKROBA DAN METABOLISME RUMEN
SAPI PERANAKAN ONGOLE YANG MENGONSUMSI
PAKAN SILASE RUMPUT-LEGUM
RONI RIDWAN
Disertasi
Sebagai salah satu syarat memperoleh gelar Doktor
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Penguji luar komisi pada ujian tertutup: Dr. Anuraga Jayanegara, SPt., MSc. Dr. Elizabeth Wina, MSc.
PRAKATA
Alhamdulillahhirobbil’alamiin, puji dan syukur penulis panjatkan kepada Alloh SWT atas segala rahmat dan karunia-Nya sehingga Disertasi dengan judul Keragaman Mikroba dan Metabolisme Rumen Sapi Peranakan Ongole yang Mengonsumsi Pakan Silase Rumput-Legum ini dapat diselesaikan. Penelitian yang dilaksanakan sejak bulan Januari-Desember 2013 dengan harapan dapat bermanfaat dalam memberikan gambaran keragaman mikroba dan efisiensi pakan pada ekologi rumen sapi.
Terima kasih penulis sampaikan kepada Dr. Ir. Iman Rusmana, MSi. selaku Ketua Komisi Pembimbing dan Prof. Dr. Ir. Komang G. Wiryawan, Dr. Yantyati Widyastuti, dan Prof. Dr. Ir. Bambang Prasetya, MSc. selaku Komisi Pembimbing Anggota, yang telah banyak meluangkan waktunya untuk memberikan bimbingan, arahan, dan kepada Pusat Penelitian Bioteknologi LIPI yang telah menyediakan Dana Penelitian Dipa 2013, Kementerian RISTEK RI yang telah memberikan beasiswa program S3, Dr. Mitsuo Sakamoto sebagai pembimbing saat penelitian di Jepang yang telah banyak membantu proses analisis, JST-JICA-LIPI SATREP RS4 dan JCM RIKEN Japan yang telah banyak membantu dalam memfasilitasi penelitian sehingga penulis dapat menyelesaikan studi ini, saya sampaikan banyak terima kasih. Terima kasih kepada Dr. Anuraga Jayanegara, SPt., MSc. dan Dr. Elizabeth Wina, MSc. selaku penguji luar komisi pada ujian tertutup, Dr. Sri Suharti, SPt., MSi. dan Dr. Tresnawati Purwadaria selaku penguji luar komisi pada ujian terbuka dan kepada Ketua Program Studi Mikrobiologi IPB yang telah memberikan banyak masukan dan saran untuk perbaikan penulisan disertasi ini.
Penulis juga menyampaikan terima kasih kepada Kepala Pusat Penelitian Bioteknologi-LIPI beserta jajarannya atas ijin dan kesempatan sehingga penulis dapat menempuh studi di Sekolah Pascasarjana IPB. Terima kasih kepada Dr. drh. Harry dan tim bedah FKH-IPB yang telah membuat fistula pada sapi penelitian ini. Kepada teman-teman di Laboratorium Mikrobiologi Terapan dan Laboratorium di lingkungan Pusat Penelitian Bioteknologi LIPI, Laboratorium Agrostologi, INTP dan Nutrisi Ternak Perah FAPET IPB, Laboratorium Pengujian BALITNAK Ciawi, PT. Perkebunan Nusantara VIII Gunung Mas, BTCC-LIPI, IPBCC dan Laboratorium dilingkungan MIK IPB, teman-teman MIK 2011 terima kasih atas segala bantuan teknis dan dukungannya, Dr. Chris McSweeney (CSIRO Australia) atas koreksi manuskrip jurnal, serta semua pihak yang telah berpartisipasi dalam terselesaikannya tulisan ini.
Rasa hormat dan penghargaan yang tulus, penulis sampaikan terima kasih kepada kedua orang tua di Cianjur dan di Sumedang, istriku Tika Sundari, serta Ketiga anakku Kania Dewi Shiyam, Muhamad Aqil Arrasyid, dan Aisha Dewi Humaira atas Do’a, dukungan dan waktunya.
Penulis berharap Disertasi ini dapat memberikan konstribusi pada ilmu pengetahuan dan teknologi yang bermanfaat bagi peneliti khususnya dan masyarakat pada umumnya.
Halaman
DAFTAR TABEL iii
DAFTAR GAMBAR iv
DAFTAR LAMPIRAN v
PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 2
Manfaat Penelitian 2
Kebaruan Penelitian (State of the Art) 3
Ruang Lingkup Penelitian 3
TINJAUAN PUSTAKA
Ekologi Rumen 4
Calliandra calothyrsus 5
Tannin 5
Silase 7
Metanogen Rumen 8
Teknik Ekologi Molekuler 9
METODE
Bahan 11
Waktu dan Tempat 11
Prosedur Analisis 11
Peremajaan Isolat dan Pembuatan Inokulum Silase 11
Penelitian Tahap I (Pembuatan Silase) 12
Penelitian Tahap II (Fermentasi in vitro) 12 Penelitian Tahap III (Fermentasi in vivo) 13
Analisis Kimia 14
Perhitungan Jumlah Protozoa 14
Ekstraksi DNA 15
Analisis T-RFLP 15
Analisis Pustaka Klon 16S rDNA 16
Analisis Quantitative Real Time PCR (qPCR) 16
Analisis Data 17
HASIL DAN PEMBAHASAN
Kualitas Silase Rumput-Legum 18
Keragaman Mikroba Silase Rumput-Legum 22
Fermentasi Rumen in vitro Menggunakan HGT 27
Keragaman Mikroba Pada Fermentasi HGT 31
Fermentasi Rumen Secara in vivo 35
Keragaman Bakteri dan Metanogen Pada Fermentasi Rumen
Secara in vivo 39
SIMPULAN DAN SARAN
Simpulan 53
Halaman 1 Sekuen spesifik primer qPCR untuk target mikroba rumen 17 2 Komposisi kima bahan baku silase rumput-legum 18 3 Komposisi nutrien dan fraksi serat silase rumput-legum 21
4 Karakteristik silase rumput-legum 21
5 Indeks keragaman mikroba dalam silase rumput-legum 23 6 Komposisi nutrien dan kimia dari pakan perlakuan yang
digunakan dalam fermentasi HGT
27 7 Kecernaan bahan organik dan produksi gas pada fermentasi
HGT
29
8 Profil hasil fermentasi rumen pada HGT 30
9 Indeks keragaman dan jumlah populasi mikroba rumen pada HGT
35 10 Komposisi nutrien dan kimia pakan pada fermentasi in vivo 36
11 Profil fermentasi rumen in vivo 37
12 Indeks keragaman mikroba rumen dan populasi protozoa 40 13 Identitas mikroba berdasarkan sequen pustaka klon 16S
rDNA rumen sapi PO
Halaman
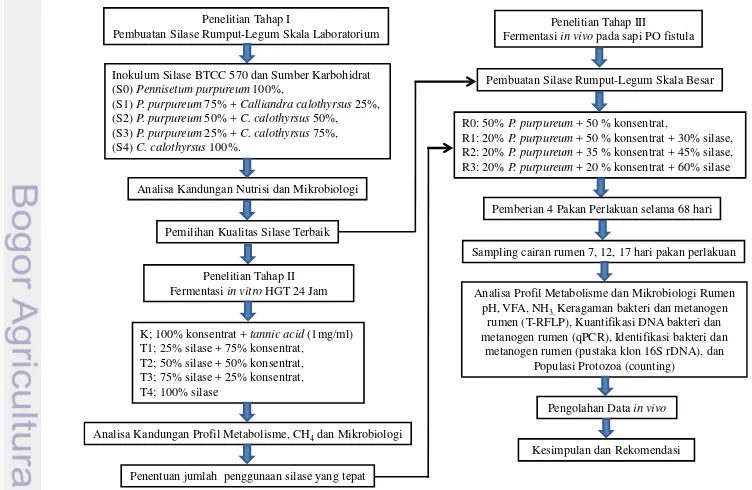
1 Bagan alur penelitian 3
2 Leguminosa pohon C. calothyrsus 5
3 Hubungan fitokimia tanaman terhadap metanogenesis dan metabolisme rumen
6
4 Gelas Syringe HGT pada water bath 12
5 Silase rumput-legum setelah 30 hari inkubasi 19 6 Regresi linier penggunaan level C. calothyrsus terhadap kualitas
silase rumput-legum.
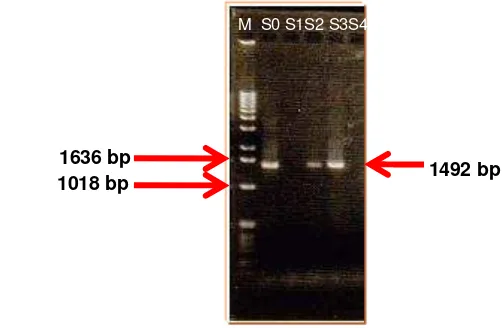
20 7 Amplifikasi 16S rDNA genom bakteri dalam silase rumput-legum 23
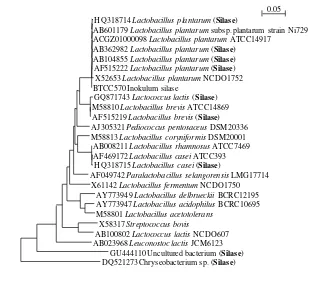
8 Kedekatan mikroba dalam silase rumput-legum 24
9 Hubungan filogenetik bakteri dalam silase rumput-legum 25 10 Pola T-RFLP dalam silase rumput-legum dan inokulum silase L.
plantarum BTCC570 setelah dipotong dengan enzim restriksi AluI.
26 11 Kinetika produksi gas dalam sistem fermentasi HGT 28 12 Hasil amplifikasi 16S rDNA pada DNA genom bakteri dan
metanogen
31 13 Kedekatan mikroba dalam HGT disusun menggunakan pendekatan
UPGMA.
32 14 Profil T-RFLP 16S rDNAs bakteri setelah dipotong dengan AluI. 33 15 Profil T-RFLP 16S rDNAs metanogen setelah dipotong dengan 17 Kedekatan profil populasi bakteri dan metanogen dari seluruh
sempel disusun berdasarkan metode UPGMA
40 18 Pola T-RFLP bakteri dan methanogen dari sempel rumen setelah
dipotong dengan enzim restriksi AluI
41 19 Hasil amplifikasi 16S rDNA dari genom bakteri dan metanogen
rumen sapi PO dalam analisis pustaka klon 16S rDNA
42 20 Hasil seleksi biru putih dari pustaka klon 16S rDNA genom bakteri
dan metanogen
43 21 Hasil amplifikasi 16S rDNA pada gen insert dari bakteri dan
metanogen
43 22 Hubungan filogenetik bakteri rumen dari pustaka klon 16S rDNA 45 23 Hubungan filogenetik metanogen rumen dari pustaka klon 16S
rDNA
46 24 Pola distribusi bakteri dan metanogen rumen dari setiap perlakuan
pakan berdasarkan pustaka klon 16S rDNA
48 25 Distribusi Bacteriodetes dari rumen sapi PO berdasarkan pustaka
klon 16S rDNA
49 26 Distribusi Firmicutes dari rumen sapi PO berdasarkan pustaka klon
16S rDNA
Halaman 1 Bakteri dan metanogen unculturable hasil pustaka klon 16S
rDNA
62 2 Contoh data sekuen No. Accession: AB935184 dari
DDBJ/EMBL/GenBank databases
PENDAHULUAN
Latar Belakang
Pada saat ini pemanasan global sudah mulai dirasakan dengan ditandai adanya perubahan iklim ekstrim di berbagai negara. Pemanasan global tersebut disebabkan oleh semakin tingginya polusi gas rumah kaca di atmosfir. Salah satu gas rumah kaca yang berkontribusi 21 kali lebih potensial daripada CO2 dalam
penyerapan infra merah adalah metan (CH4). Metan berpengaruh terhadap
pemanasan global dan perubahan iklim (Bodas et al. 2012; Patra 2014). Sampai saat ini CH4 dari berbagai sektor memberikan kontribusi 16% terhadap gas rumah
kaca dan 50% disumbangkan oleh sektor pertanian (Karakurt et al. 2012), serta mengalami peningkatan akumulasi di atmosfir sekitar 2% per tahun (Tianto et al. 2009). Ji and Park (2012) dan Patra (2014) mengatakan bahwa ruminansia memberikan kontribusi cukup besar terhadap pemanasan global tersebut melalui pengeluaran enterik CH4.
Metan secara alamiah diproduksi oleh metanogen di dalam rumen, dan menjadi salah satu penyebab rendahnya produktivitas ruminansia. Faktor yang paling membatasi pakan hijauan ruminansia adalah kecernaan dan kualitas nutrisi. Kekurangan protein merupakan faktor paling penting menyebabkan rendahnya produktivitas ruminansia yang diberi pakan hijauan kualitas rendah. Kualitas nutrisi yang tinggi dan ketersediaan pakan yang kontinyu serta keseimbangan mikroba rumen dapat meningkatkan produktivitas ternak ruminansia. Keseimbangan mikroba rumen dapat dilihat dari laju penyediaan N protein dan energi serta pemanfaatan protein yang terdegradasi untuk pertumbuhan mikroba rumen. Protein kasar (PK) disediakan untuk memasok N pada sintesis protein mikroba dalam rumen.
Salah satu bahan pakan sumber protein yang tersedia dan tersebar luas adalah leguminosa pohon, Calliandra calothyrsus, yang mengandung PK berkisar antara 17-30% (Norton 1994; Hess et al. 2006; Jayanegara et al. 2011a). Potensi lainnya dari C. calothyrsus yaitu mengandung metabolit sekunder tanaman (MST) berupa tanin sebesar 8.1% (Jayanegara et al. 2011a). Tanin ini bermanfaat dalam jumlah tertentu untuk ternak ruminansia dalam menghambat metanogenesis. Mekanisme kerjanya adalah menghambat aktivitas enzim dan pengurangan substrat, bekerja pada membran sel, dan mengurangi asupan ion logam terhadap mikroba tertentu (Scalbert 1991). Manfaat lain dari tanin yaitu komplek dengan protein di rumen untuk mensuplai kebutuhan protein pada saluran pencernaan setelah rumen dalam meningkatkan produktivitas sapi. Selain itu, tanin memiliki pengaruh antinutrisi terhadap protozoa dan metanogen.
Silase adalah pakan yang difermentasikan dalam bentuk segar oleh bakteri asam laktat (BAL) dan menghasilkan sebagian besar produknya berupa asam laktat. Asam laktat dapat berperan sebagai pengawet alami dan silase akan mempunyai daya simpan yang lama (McDonald et al. 1991). Selama ini bahan hijauan yang umum digunakan untuk pembuatan silase adalah rumput. Untuk meningkatkan PK pada silase rumput dapat ditambahkan C. calothyrsus,
kebutuhan nutrisi sapi dan dapat menurunkan produksi CH4 di rumennya. Silase
rumput-legum dengan kualitas nutrisi yang tinggi mensuplai kebutuhan N untuk sintesis protein mikroba rumen dan tanin menghambat proses metanogenesis baik secara langsung dan tidak langsung. Hal ini merupakan strategi dalam mengefisienkan penggunaan pakan untuk meningkatkan produktivitas ternak. Tujuan utama dalam meningkatkan produktivitas sapi adalah mencapai keseimbangan mikroba dalam rumen agar terjadi proses kecernaan pakan yang optimal dan penurunan CH4 (Lopez et al. 2010).
Metode kultur mikroba dapat digunakan untuk mengevaluasi keragaman mikroba rumen tetapi tingkat akurasinya rendah. Dengan keterbatasan ini, masih banyak mikroba yang tidak dapat diungkap karena belum dapat dikulturkan. Analisis molekuler berdasarkan 16S rDNA dapat menambah informasi keragaman mikoba rumen, karena dapat digunakan untuk mengamati mikroba yang belum dapat dikulturkan tersebut. Dengan tambahan informasi ini, maka analisis keragaman mikroba rumen dan pengelompokannya menjadi lebih lengkap. Beberapa metode yang dapat digunakan meliputi terminal-restriction fragment length polymorphism (T-RFLP) (Khafipour et al. 2009; Cadillo et al. 2008; Kaplan et al. 2001), pustaka klon 16S rDNA (Danielsson et al. 2012; Fernando et al. 2010), dan quantitative real time PCR (qPCR) (Tajima et al. 2001; Bustin et al. 2009).
Perumusan Masalah
Pertanyaan yang muncul dalam penelitian ini adalah 1) Apakah tanin dalam
C. calothyrsus memberi pengaruh terhadap kualitas silase rumput-legum yang dibuat, 2) Bagaimana profil bakteri pada silase rumput-legum, 3) Apakah ada perubahan struktur dan komposisi bakteri dan metanogen selama fermentasi silase rumput-legum dalam rumen in vitro dan in vivo, dan 4) Bagaimana dinamika populasi dan keragaman mikroba akibat adanya fermentasi silase rumput-legum dalam rumen.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan informasi nutrisi dan mikrobiologi silase rumput-legum dan evaluasi pemberiannya pada sapi potong. Adapun tujuan khususnya meliputi 1) Mempelajari karakteristik fermentasi dan keragaman populasi bakteri silase rumput-legum, 2) Menentukan taraf optimum pemberian silase rumput-legum pada sapi potong, 3) Mengidentifikasi keragaman mikroba rumen, dan 4) Mendapatkan profil metabolisme dan mitigasi CH4 di
rumen.
Hipotesis
Pemberian silase rumput-legum dapat mempengaruhi keragaman dan dinamika populasi mikroba rumen yang dapat digunakan sebagai parameter efisiensi pakan dalam metabolisme rumen.
Manfaat Penelitian
potong serta penurunan emisi enterik CH4 menuju sektor peternakan yang ramah
lingkungan.
Kebaruan Penelitian (State of the Art)
Penelitian studi keragaman mikroba rumen khususnya pada sapi potong secara in vivo di Indonesia belum ada. Penelitian ini melihat respon nilai kegunaan silase rumput-legum yang mengandung C. calothyrsus dalam pakan sapi potong terhadap keragaman mikroba dan profil metabolisme rumen, dan penurunan produksi enterik CH4. Pengaruh tanin dalam C. calothyrsus yang sudah
digunakan dalam beberapa penelitian saat ini di Indoneisa dengan cakupan penelitian terhadap penuruan CH4 secara in vitro, belum ada informasi secara detil
mengenai interaksi keragaman mikroba rumen terhadap profil metabolisme dan penurunan enterik CH4.
Ruang Lingkup Penelitian
Penelitian ini mengungkap interaksi mikroba pada silase, medium buffer dan rumen menggunakan analisis molekuler T-RFLP dan qPCR pada fermentasi in vitro serta ditambahkan dengan analisis pustaka klon 16S rDNA pada fermentasi
in vivo disajikan dalam alur penelitian (Gambar 1). Hasil dari penelitian ini dapat mengetahui dengan jelas penggunaan C. calothyrsus dalam silase yang memberikan pengaruh terhadap keragaman mikroba rumen, produktivitas ternak dan berkontribusi terhadap penurunan emisi CH4. Pembuktian dari hasil penelitian
menghubungkan keragaman mikroba rumen dengan parameter hasil metabolisme rumen meliputi VFA individual, N-NH3, pH, produksi gas total dan produksi CH4.
Hasil penelitian ini diharapkan mendapatkan profil keragaman dan dinamika mikroba rumen sapi potong yang mengonsumsi silase rumput-legum dan memberikan rekomendasi formulasi pakan pada peternakan sapi potong yang efisien dan ramah lingkungan.
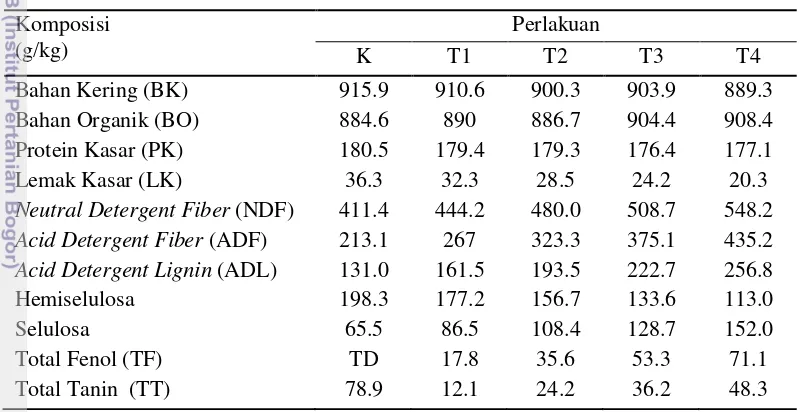
Inokulum Silase BTCC 570 dan Sumber Karbohidrat (S0)Pennisetum purpureum100%,
(S1)P. purpureum75% +Calliandra calothyrsus25%, (S2)P. purpureum50% +C. calothyrsus50%, (S3)P. purpureum25% +C. calothyrsus75%, (S4)C. calothyrsus100%. Fermentasiin vitro HGT 24 Jam
K; 100% konsentrat +tannic acid(1mg/ml) T1; 25% silase + 75% konsentrat, T2; 50% silase + 50% konsentrat, T3; 75% silase + 25% konsentrat, T4; 100% silase
Analisa Kandungan Profil Metabolisme, CH4dan Mikrobiologi
Penentuan jumlah penggunaan silase yang tepat
Penelitian Tahap III Fermentasi in vivo pada sapi PO fistula
R0: 50%P. purpureum+ 50 % konsentrat, R1: 20%P. purpureum+ 50 % konsentrat + 30% silase, R2: 20%P. purpureum+ 35 % konsentrat + 45% silase, R3: 20%P. purpureum+ 20 % konsentrat + 60% silase
Analisa Profil Metabolisme dan Mikrobiologi Rumen pH, VFA, NH3, Keragaman bakteri dan metanogen
rumen (T-RFLP), Kuantifikasi DNA bakteri dan metanogen rumen (qPCR), Identifikasi bakteri dan
metanogen rumen (pustaka klon 16S rDNA), dan Populasi Protozoa (counting) Pembuatan Silase Rumput-Legum Skala Besar
Sampling cairan rumen 7, 12, 17 hari pakan perlakuan Pemberian 4 Pakan Perlakuan selama 68 hari
Pengolahan Data in vivo
Kesimpulan dan Rekomendasi
TINJAUAN PUSTAKA
Ekologi Rumen
Peningkatan produktivitas ternak sapi dapat dilakukan melalui ketersediaan pakan berkualitas. Pakan merupakan faktor yang penting dalam mensuplai fungsi dan efisiensi kerja rumen. Mikroba rumen memegang peranan besar dalam mendegradasi pakan yang dikonsumsi untuk menghasilkan sumber energi utama berupa VFA. Tempat pencernaan pakan pada ruminansia terbagi menjadi 4 bagian yaitu di rumen, retikulum, omasum, dan abomasum. Tempat pencernaan pada ruminansia yang utama adalah rumen yang memiliki kapasitas tampung substrat sekitar 60-100 liter atau 10-15% dari bobot badannya. Rumen merupakan organ yang menarik untuk diteliti, terkait fungsinya sebagai tempat fermentasi utama pakan yang dikonsumsi. Rumen dihuni oleh konsorsium mikroba, sekitar 1010-12 cfu/ml bakteri, metanogen 106-8 cfu/ml, 105-6/ml protozoa dan sebagian kecil cendawan anaerob, yang bekerja secara sinergi dalam biokonversi pakan (Ogimoto and Imai 1981; Wallace and Newbold 1992; Stewart and Flint 1997). Keberadaan mikroba rumen terbagi menjadi tiga, yaitu menempel pada dinding rumen, menempel pada partikel pakan, dan berada dalam cairan rumen.
Bakteri rumen digolongkan ke dalam kemampuan menggunakan substrat dan hasil akhir fermentasinya. Bakteri rumen yang aktif dalam memanfaatkan karbohidrat seperti selulosa yaitu Ruminococcus albus, Fibrobacter succinegenes, Eubacterium cellulosolvens, hemiselulosa (Butyrivibrio fibrisolvens), pati (Streptococcus bovis), gula atau dextrin (Succinivibrio dextrinosolvens dan
Lactobacillus sp.), dan pektin (Treponema saccharophilum dan Lachnospira multiparus) (Stewart and Flint 1997). Sebagian bakteri lainnya yang aktif dalam memanfaatkan nitrogen, seperti degradasi protein yaitu Ruminibacter amylophilus, Clostridium sp. dan hidrolisis urea (Megasphaera elsdenii). Kelompok bakteri pengguna asam (Succiniclasticum ruminis), bakteri lipolitik, asetogenik, pendegradasi anti nutrisi, dan archaea dari kelompok metanogen yaitu
Methanobrevibacter ruminantium, Methanosarcina sp, Methanosphaera stadmanae, Methanoculleus bourgensis, Methanimicrococcus blatticola, dan masih banyak metanogen yang belum dapat dikulturkan melengkapi keragaman mikroba dalam ekosistem rumen (Stewart and Flint 1997; Huang et al. 2012; Singh et al. 2012).
Proses pencernaan pakan di rumen terjadi melalui kombinasi proses biokimia dan proses mekanis yang menghasilkan VFA sebagai produk akhir dari metabolisme dalam rumen. Kandungan utama VFA adalah asam asetat, propionat, butirat, valerat dan asam lemak bercabang lainnya seperti butirat dan iso-valerat dalam konsentrasi yang lebih kecil. VFA yang dihasilkan dalam rumen sangat beragam dan sebanyak 80-160 mM dibutuhkan untuk menunjang pertumbuhan yang optimum. Ekivalen kadar VFA yang diproduksi dalam rumen menyumbang 60-80% dari kebutuhan energi ternak ruminansia (Sutardi 2001). Apabila terdapat penurunan perbandingan asetat:propionat dan penurunan produksi CH4, hal ini mengindikasikan adanya pengaruh dari pemberian aditif
pakan dalam penurunan produksi CH4 dan meningkatkan penggunaan energi
Kecenderungan peningkatan asam propionat lebih menguntungkan karena dapat memasok energi pada ruminansia. Asam propionat merupakan VFA bersifat glukogenik yang dapat menjadi prekursor dalam sintesis glukosa melalui proses glukoneogenesis dan jalur asam laktat (McDonald et al. 1991). Pada sintesis asam propionat membutuhkan gas H2, sehingga gas H2 yang ada di rumen berkurang.
Berkurangnya gas H2 mengakibatkan rendahnya produksi CH4, sehingga
fermentasi mengarah pada pembentukan asam propionat yang lebih menguntungkan. Selain itu, potensi energi yang terbuang sebagai gas CH4
menjadi berkurang (Moss et al. 2000).
Calliandra calothyrsus
C. calothyrsus merupakan leguminosa pohon yang banyak dan tersebar luas di Indonesia (Gambar 2). C. calothyrsus dapat tumbuh pada ketinggian 0-1300 m dpl dan dengan curah hujan mencapai 700-3000 mm/tahun. Legum ini tidak toleran terhadap kekeringan, namun dapat tetap tumbuh dalam beberapa periode kekeringan yang berlangsung selama 2-6 bulan tetapi tetap memperoleh curah hujan yang tidak kurang dari 50 mm. C. calothyrsus biasa hidup atau ditanam dilereng-lereng bukit atau pengunungan sebagai tanaman penahan erosi. Daun dan ranting leguminosa ini sudah dikenal oleh masyarakat peternak sebagai pakan kambing, namun masih rendah proporsi pengunaannya untuk pakan sapi. Kandungan nutrisi C. calothyrsus cukup tinggi, terutama kandungan PK yang berkisar antara 17%-30% (Norton 1994; Hess et al. 2006; Jayanegara et al. 2011a). Tingginya kandungan PK yang terdapat pada legum ini banyak digunakan sebagai suplay N untuk sintesis mikroba di dalam rumen.
Gambar 2. Leguminosa pohon C. calothyrsus Tanin
C. calothyrsus memiliki kandungan polifenol yang tinggi. Tanin merupakan senyawa polifenol alami dari tanaman yang memiliki berat molekul yang beragam antara 500-3000 dalton. Tanin terbagi dua berdasarkan analisanya atau cara mendapatkannya yaitu tanin terhidrolisis dan tanin terkondensasi (Bhat et al.
1998). Tanin terhidrolisis seperti gallic (gallotannins) dan ellagic acid
terkondensasi atau proanthocyanidins contohnya catechin dan gallocatechin yang polymer utamanya tersusun dari unit flavan3-ol (epi) catechin dan (epi)
gallocatechin serta ditandai dengan adanya ikatan rangkap C-C pada C ke-8 dan ke-4. Tanin terkondensasi sampai saat ini belum ada informasi dapat didegradasi oleh mikroba rumen karena tingkat toksisitas yang tinggi dan ikatan komplek C-C yang kuat. Pengaruh anti nutrisi dari tanin ini adalah dapat bergabung secara komplek dengan protein, polimer seperti selulosa, hemiselulosa dan pektin, dan mineral.
Tanin secara umum dapat menghambat pertumbuhan beberapa mikroba namun masih belum jelas mekanisme kerja secara menyeluruh. Tanin sangat reaktif terhadap dinding sel dan enzim ekstra seluler yang disekresikan oleh bakteri yang selanjutnya menghambat transport nutrisi ke sel dan menghambat pertumbuhan. Manfaat tanin banyak diteliti dijadikan bahan pakan aditif dalam menurunkan emisi enterik CH4. Mekanisme penghambatan emisi enterik CH4 dari
MST dapat terjadi di rumen baik secara langsung dan tidak langsung dengan mekanisme sebagai berikut; 1) Secara langsung dapat menghambat proses metanogenesis dengan aktivitas sebagai anti metanogen, 2) Secara tidak langsung dengan memiliki aktivitas sebagai anti protozoa, metanogen dan protozoa diketahui memiliki hubungan endosimbion dalam hidupnya sehingga populasi protozoa berkurang dan metanogen secara tidak langsung mengalami penurunan, 3) Berperan sebagai anti bakteri dan anti cendawan, berkurangnya bakteri dan cendawan menyebabkan turunnya kecernaan pakan, sehingga substrat yang dibutuhkan untuk produksi CH4 mengalami penurunan (Kamra et al. 2012). Patra
and Saxena (2010) menggambarkan hubungan fitokimia sebagai MST terhadap proses metanogenesis dan metabolisme di rumen (Gambar 3).
Fitokimia Perubahan Pola Fermentasi
Gambar 3. Hubungan fitokimia tanaman terhadap metanogenesis dan metabolisme rumen. (-); pengaruh negatif, (+); pengaruh positif (Patra and Saxena 2010).
Enterik CH4 yang dihasilkan oleh ternak ruminansia di rumen diperkirakan
dapat menyumbangkan polutan sekitar 15% dari emisi CH4 total, dan potensi
kehilangan energi sebesar maksimal 15 % dari konsumsi energi bruto (Moss et al. 2000; Bodas et al. 2012). Tanin dari C. calothyrsus dapat menurunkan gas CH4
secara in vitro, menghasilkan produksi gas CH4 sekitar 11.2% dari total gas
pakan berkelanjutan. Tanin yang terkandung dalam silase rumput-legum masih perlu dicari proporsi pemberian untuk sapi potong, karena masih ada dampak negatif dari pemberian tanin terhadap penurunan kecernaan bahan organik di rumen (Jayanegara et al. 2010; Boer et al. 2011).
Tanin banyak digunakan sebagai pakan aditif alami yang aman untuk regulasi metanogenesis di rumen. Tanin dapat menurunkan metanogenesis melalui penghambatan protozoa rumen dan dapat menekan aktivitas metanogen. Aditif lainnya seperti minyak atsiri, senyawa organosulphur dan flavonoid memiliki pengaruh langsung terhadap metanogen dan tidak langsung terhadap pengurangan protozoa (Patra and Saxena 2010). Sejumlah leguminosa telah diketahui mengandung total fenol dan tanin yang bervariasi. Jayanegara et al. (2011a) melaporkan bahwa semua fraksi fenol menunjukkan kemampuan menurunkan emisi CH4 dari fermentasi in vitro. Pemakaian leguminosa untuk pakan
ruminansia yang dikombinasikan dengan rumput dapat bersifat saling melengkapi dimana rumput sebagai sumber serat kasar dan leguminosa sumber protein serta sumber MST. Pembuatan silase rumput-legum diharapkan mencukupi kebutuhan nutrisi yang dibutuhkan oleh sapi dan dapat memberikan manfaat terhadap lingkungan. Fermentasi in vitro menggunakan ekstrak tanin 15 mg tanin kondensasi/500 mg bahan kering dari Leucaena leucocephala menunjukkan pola penurunan terhadap total gas, produksi CH4, konsentrasi VFA total, metanogen
dan populasi protozoa. Penurunan tersebut sejalan dengan peningkatan penggunaan tanin, namun masih memiliki pengaruh negatif terhadap penurunan kecernaan bahan pakan (Tan et al. 2011; Jayanegara et al. 2010).
Silase
Prinsip pembuatan silase adalah fermentasi hijauan atau bahan pakan berbentuk segar oleh BAL. Fermentasi substrat oleh BAL sebagian besar menghasilkan asam laktat yang menjamin efisiensi fermentasi, sehingga dapat berperan sebagai zat pengawet alami (McDonald et al. 1991). Karbohidrat tersedia (WSC) dimanfaatkan oleh berbagai mikroba epifit pada saat awal fermentasi silase. Dominasi BAL tipe homofermentatif memegang peranan penting disaat awal fermentasi berlangsung dan dapat menentukan keberhasilan proses fermentasi silase. Jenis BAL ini menghasilkan asam laktat yang tinggi dan bermanfaat untuk menghambat pertumbuhan mikroba yang tidak diinginkan. Mikroba yang tidak diinginkan seperti clostridia dan enterobacter menghasilkan produk fermentasinya berupa butirat dan pH yang tinggi. Indikasi kehadiran dan pertumbuhan mikroba tersebut dapat menyebabkan kegagalan dalam pembuatan silase dan kehilangan sebagian kandungan nutrisinya.
1991; Norton 1994). Kombinasi rumput dan legum merupakan solusi untuk keberhasilan proses fermentasi silase. Bahan pakan dengan kandungan protein tinggi dapat diawetkan dengan silase, dan merupakan suatu potensi dalam menyediakan pakan ruminansia yang berkelanjutan (Sun et al. 2012; Gómez-Vázquezet al.2011; Wanapat et al. 2014).
Peranan lain dari inokulum BAL dapat berperan sebagai probiotik. Hal ini didukung oleh fenomena keberadaan inokulum BAL yang masih bertahan hidup pada bagian cairan rumen secara in vitro (Weinberg et al. 2003) dan kemampuan silase untuk meningkatkan produktivitas secara in vivo. Peningkatan kecernaan pakan merupakan strategi yang cukup baik dalam meregulasi enterik CH4 pada
ruminansia. Strategi tersebut diantaranya dengan pembuatan silase yang berkualitas dan rasio pemberian yang optimum antara konsentrat dan hijauan. Namun penambahan aditif tanin masih memberikan dampak yang ganda (Boer et al. 2011) dan dengan konsentrasi tanin yang tinggi dapat berpengaruh terhadap penurunan kecernaan bahan organik (Jayanegara et al. 2011a; Tiemann et al. 2008). Sehingga diperlukan penelitian lebih lanjut mengenai pemberian silase yang tepat terkait dengan interaksi mikroba rumen dan kecernaan bahan pakan serta produk metabolisme rumen.
Metanogen Rumen
Rumen merupakan ekosistem sangat komplek dengan mikroba yang beragam. Metanogen merupakan salah satu mikroba rumen yang sebagian besar memanfaatkan substrat CO2, H2 dan merupakan suatu potensi kehilangan energi
pada ruminansia dalam memproduksi enterik CH4. Metanogen yang sudah
berhasil dikulturkan dan umum ditemukan di rumen adalah Methanobrevibacter ruminantium, M. olleyae, M. millerae, Methanobacterium formicicum, Methanobacterium bryantii, Methanomicrobium mobile, dan sebagian kecil dari
Methanosarcina barkeri (Zhou et al. 2011; Withman et al. 2006).
Terjadinya proses metanogenesis di rumen dapat mengakibatkan rendahnya produktivitas dan memiliki pengaruh negatif terhadap produksi ruminansia (Kumar et al. 2009; Patra 2014). Proses biometanisasi merupakan suatu alur pembentukan CH4 dari hasil konsorsium mikroba yang saling berhubungan di
mana produk fermentasi dari satu populasi mikroba berfungsi sebagai substrat untuk mikroba berikutnya dalam menghasilkan CH4. Proses tersebut terbagi ke
dalam empat tahapan: hidrolisis pemecahan senyawa komplek, acidogenesis, acetogenesis dan tahap akhir metanogenesis oleh metanogen (Weiland 2010). Tiga proses awal (hidrolisis, acidogenesis dan acetogenesis) yang terjadi di rumen dilakukan oleh konsorsium mikroba rumen yang selanjutnya metanogen memanfaatkan H2 untuk mereduksi sebagian besar sustrat CO2 menghasilkan
CH4. Mikroba utama yang terlibat dalam proses metanogenesis menghasilkan CH4
adalah kelompok metanogen. Berhubungan dengan prekursor metabolik utama yang digunakan, metanogen dibagi menjadi dua kelompok yaitu metanogen aceticlastic yang dapat melakukan metabolisme asetat dengan keberadaannya sangat sedikit di dalam rumen dan metanogen hydrogenotrophic yang menggunakan H2 atau format sebagai donor elektron dan CO2 sebagai sumber
Metan merupakan salah satu gas rumah kaca, yang paling besar dampaknya yaitu memiliki 21 kali lebih potensial pada pemanasan global daripada CO2, dan
telah terjadi peningkatan akumulasi di atmosfir sekitar 2% per tahun (Tiantao et al. 2009). Oleh karena sangat berbahayanya dampak tersebut maka regulasi metanogen banyak dilakukan terhadap proses metanogenesis. Proses regulasi metanogen merupakan suatu upaya pengaturan proses metanogenesis melalui kompetitif substrat dan inhibitor CH4. Mikroba berkompetisi dalam
memanfaatkan substrat yang tersedia di rumen, sehingga kebutuhan substrat metanogen menjadi berkurang. Sebagian model penghambatan lainnya dengan adanya metabolit sekunder yang dihasilkan oleh mikroba rumen atau dengan penambahan inhibitor metanogenesis secara langsung. Substrat yang dapat digunakan untuk proses metanogenesis di rumen adalah H2, CO2 dan asam-asam
organik. Substrat tersebut juga dimanfaatkan secara kompetitif oleh mikroba rumen yang bermanfaat untuk proses-proses yang dapat menghasilkan energi untuk ternak, sehingga metanogen memiliki kesempatan yang terbatas dalam memanfaatkan substrat dan sebagian lagi terhambat karena ada MST yang digunakan sebagai bahan pakan (Bodas et al. 2012).
Pengurangan emisi CH4 baik secara langsung atau tidak langsung diperlukan
penelitian yang lebih luas untuk mencapai solusi yang nyata. Penelitian yang dilakukan harus komprehensif mencakup aspek berbeda dari metanogenesis rumen seperti filogenetik metanogen, ekologi mikroba rumen, faktor yang mempengaruhi emisi CH4 dan strategi mitigasi (Kumar et al. 2009).
Teknik Ekologi Molekuler
Pada saat ini, analisis keragaman mikroba berdasarkan metode kultur telah ditambahkan informasinya dengan teknik ekologi molekuler berdasarkan 16S rDNA. Teknik ini dapat mengklasifikasikan bakteri untuk melihat hubungan filogenetiknya (Zoetendal et al. 2004). Aplikasi analisis T-RFLP dalam menentukan komposisi mikroba yaitu dengan memanfaatkan fragmen sekuen DNA hasil potongan dengan enzim restriksi dari total komunitas mikroba (Ferrero
et al. 2004). Analisis T-RFLP menunjukkan akurasi hasil yang tinggi, sehingga membuat atraktif dalam mempelajari struktur komunitas mikroba (Osborn et al. 2000).
Analisis T-RFLP adalah suatu metode untuk menggambarkan profil komunitas mikroba berdasarkan polimorfisme fragmen DNA hasil amplifikasi yang dipotong dengan enzim restriksi endonuclease. Proses amplifikasi 16S rDNA pada analisis T-RFLP digunakan primer yang telah dilakukan pelabelan di
ujung 5’ forwad dengan FAM 6-carboxylfluoresens untuk mengamplifikasi
daerah gen target dari total DNA komunitas. Selanjutnya dilakukan analisis potongan sekuen dengan menggunakan genetic analyzer. Alat ini dapat membaca
potongan nukleotida yang berflouresen pada ujung 5’ dan ditangkap oleh sensor (Liu et al. 1997; Kaplan et al. 2001). Selanjutnya dilakukan pemasukan data scaner pada program untuk melihat kedekatan situs restriksinya dengan mikroorganisme pada GenBankdatabase.
yang komplek disuatu habitat (McSweeney et al. 2007). Klon DNA diligasikan pada vector dan ditansformasikan pada inang, kemudian gen target yang berhasil disisipkan pada daerah lacZ dikonfirmasi dengan seleksi biru putih dan di amplifikasi daerah 16S rDNA (Wright et al. 2005). Dinamika populasi mikroba pada suatu habitat dapat dimonitor pola perubahannya dengan metode kuantitatif qPCR. Prinsip analisa ini adalah dengan memanfaatkan mikroba rujukan sebagai standar DNA dan spesifik primer yang digunakan dalam menguantifikasi secara nyata jumlah copy DNA berdasarkan waktu amplifikasi (Tajima et al. 2001; Bustin et al. 2009). Proses mengamplifikasi gen pada qPCR ini sama halnya dengan PCR biasa, namun pada qPCR gen dapat diamati pada setiap tahapnya dan dapat diukur jumlah copy DNA yang telah teramplifikasi berdasarkan persamaan linier dari kurva standar DNA rujukan.
Aplikasi teknik molekuler digunakan untuk menambahkan dan mengonfirmasi keakuratan hasil yang didapatkan secara langsung saat jalannya proses metabolisme (Deng et al. 2008). Teknik molekuler 16S rDNA dapat melihat perbedaan genetik antar mikroba dan memberikan pengertian yang mendalam tentang struktur dan fungsi keberadaan suatu komunitas mikroba pada habitat tertentu (McSweeney et al. 2007). Komunitas mikroba dalam saluran pencernaan khususnya rumen sangat komplek dan mikroba yang berbeda-beda seperti bakteri, protozoa, cendawan anaerobik, dan metanogen. Bakteri dan metanogen menjadi sumber perhatian terkait dengan isu pencemaran enterik CH4
METODE
Bahan
Penelitian ini menggunakan bahan pakan dan ternak sebagai berikut; rumput raja (Pennisetum purpureum: hybrid) yang berasal dari kebun koleksi Pusat Penelitian Bioteknologi LIPI, C. calothyrsus yang diambil dari Laboratorium lapang Agrostologi Departemen INTP FAPET IPB untuk pembuatan silase dan dari PT. Perkebunan Nusantara VIII Gunung Mas Cisarua-Bogor untuk pembuatan silase pada fermentasi in vivo, tiga sapi PO fistula, konsentrat sapi potong, dan pakan silase rumput-legum. Bahan mikroba, medium dan analisis yang digunakan terdiri atas BAL Lactobacillus plantarum BTCC570, bakteri dan metanogen rujukan yang berasal dari JCM RIKEN Bioresouces Center Japan, primer universal bakteri 6FAM-27F dan 1492R, primer spesifik metanogen 6FAM-met86F dan met1340R, primer27F, bac520R, met86F dan met520R untuk pustaka klon, enzim restriksi AluI, HhaI, MspI dan RsaI (Takara Bio Inc.), dan bahan-bahan untuk PCR, T-RFLP, pustaka klon 16S rDNA, qPCR dan bahan kimia lainnya standar p.a.
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Januari-Desember 2013 di Laboratorium Mikrobiologi Terapan Pusat Penelitian Bioteknologi-Lembaga Ilmu Pengetahuan Indonesia dan di Japan Collection of Microorganisms RIKEN Bioresource Center-Japan.
Prosedur Analisis
Penelitian diawali dengan persiapan bahan meliputi; peremajaan isolat BAL, pembuatan inokulum silase, dan pembuatan lubang fistula pada ketiga sapi PO. Penelitian ini dilakukan dengan tiga tahapan yaitu tahap I pembuatan silase rumput-legum, tahap II fermentasi in vitro HGT dan tahap III fermentasi in vivo
pada sapi PO fistula. Sampel dari setiap penelitian dilakukan analisis nutrisi dan mikrobiologi. Data yang didapatkan dilakukan pengolahan dan analisis.
Peremajaan Isolat dan Pembuatan Inokulum Silase
Isolat L. plantarum BTCC570 yang digunakan sebagai inokulum silase ditumbuhkan dalam medium spesifik BAL yaitu deMan Rogosa Sharpe (MRS) pada suhu inkubasi 30oC±0.5 selama 18 jam. Isolat L. plantarum BTCC570 dalam MRS agar digunakan sebagai stok dalam pembuatan inokulum silase. Inokulum silase dibuat dengan menginokulasikan 2 ose dari stok L. plantarum
Penelitian Tahap I (Pembuatan Silase)
Silase yang dibuat dalam penelitian ini dengan perlakuan sebagai berikut (S0) Pennisetum purpureum 100%, (S1) P. purpureum 75% + C. calothyrsus
25%, (S2) P. purpureum 50% + C. calothyrsus 50%, (S3) P. purpureum 25% + C. calothyrsus 75%, dan (S4) C. calothyrsus 100%. Seluruh bahan hijauan sebelum digunakan terlebih dahulu dilayukan dengan diangin-anginkan selama 1 malam, dipotong-potong sekitar 5cm. Pada pembuatan silase ini ditambahkan 10% (w/w) sumber karbohidrat dan setelah bahan silase tercampur merata, kemudian ditambahkan inokulum silase L. plantarum BTCC570 dengan kepadatan populasi awal 106cfu/g bahan silase. Campuran bahan silase ditempatkan ke dalam silo toples plastik bervolume 1 kg (berat 600 g bahan silase) sambil dilakukan pemadatan sampai penuh. Silase diinkubasikan selama 30 hari pada suhu ruang (30oC). Setelah 30 hari inkubasi, silase dipanen dan dilakukan analisis nutrisi dan mikrobiologi. Parameter yang diamati adalah total BAL, pH, kandungan asam laktat total, total fenol dan tanin, N-NH3, proksimat, fraksi serat, dan keragaman
mikroba silase (T-RFLP). Silase dilakukan pemilihan kualitas terbaik berdasarkan karakteristik fermentasi dan kandungan nutrisinya, kualitas perlakuan silase terpilih selanjutnya digunakan pada penelitian tahap II fermentasi in vitro.
Penelitian Tahap II (Fermentasi in vitro) Substrat dan medium fermentasi
Substrat fermentasi in vitroHohenheim Gas Test (HGT) (Gambar 4) adalah silase terpilih dengan kualitas terbaik dari pembuatan silase yaitu S2 (50%
P.purpureum:50% legum). Silase setelah dipanen dilakukan pengering bekuan menggunakan freeze dryer selama 48 jam, kemudian dihaluskan dan disaring menggunakan saringan 0.5 mm.
Gambar 4. Gelas Syringe HGT pada water bath
ACUC 01-2013 IPB. Cairan rumen diperas, dicampur, dihomogenkan, disaring menggunakan dua lapis kain kasa steril kemudian dipindahkan ke gelas
Erlenmeyer dan secara konstan dialirkan CO2, kondisi ini dijaga dalam water bath
pada suhu 39oC.
Fermentasi in vitro HGT
Perlakuan yang digunakan dalam penelitian ini adalah rancangan acak lengkap dengan 5 perlakuan dan 3 ulangan. Perlakuan terdiri atas perbedaan penggunaan silase yang mengandung 50% (w/w) C. calothyrsus yaitu K; 100% konsentrat + tannic acid (1mg/ml) (Merck cat.no.1.00773), T1; 25% silase + 75% konsentrat, T2; 50% silase + 50% konsentrat, T3; 75% silase + 25% konsentrat, dan T4; 100% silase. Konsentrat yang digunakan adalah konsentrat komersial GT-03 dari PT. Indofeed dengan komposisi nutrisi disajikan pada Tabel 6. Fermentasi HGT menggunakan prosedur yang dijelaskan Lopez et al. (2010) berdasarkan metode Menke et al. (1979) dan modifikasi metode dari Castro-Montoya et al. (2011). Substrat fermentasi digunakan sebanyak 380 mg untuk setiap perlakuan dan dimasukan ke dalam 100 ml gelas syringe HGT. Sebanyak 30 ml medium buffer dari campuran 2x buffer dan cairan rumen (2:1) dimasukan ke dalam gelas gelas syringe HGT yang sudah ada di dalamnya substrat fermentasi dan diinkubasikan dalam water bath pada suhu 39oC selama 24 jam. Hasil terpilih dari percobaan in vitro ini selanjutnya digunakan sebagai sumber acuan persentase penggunaan silase rumput-legum dalam fermentasi in vivo.
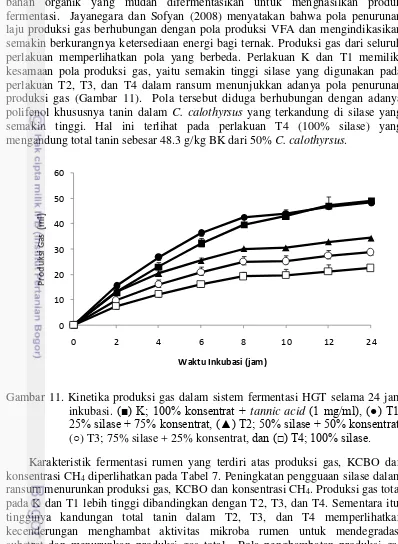
Pengamatan dan analisis sampel
Produksi gas diamati setiap 2 jam sekali sampai 12 inkubasi, dan pengamatan terakhir pada 24 jam inkubasi (2, 4, 6, 8, 10, 12, dan 24 jam inkubasi). Produksi gas total bersih diperhitungkan setelah dikurangi dengan total gas blanko. Gas total dikoleksi menggunakan 10 ml syringe steril pada 2 bagian waktu inkubasi yaitu pada 12 dan 24 jam, kemudian secara langsung dipindahkan ke 5 ml tabung vacuum Venoject. Konsentrasi CH4 dianalisis dari campuran
koleksi gas dari 2 waktu inkubasi. Setelah 24 jam inkubasi, medium buffer dikoleksi dan dibagi ke dalam tabung corning steril untuk dilakukan analisis kimia dan mikrobiologi. Nilai kecernaan bahan organik secara in vitro (KCBO) dihitung berdasarkan rumus persamaan, KCBO (mg/g): 148.8 + 8.893 produksi gas (ml) + 0.448 PK (g/kg BK) + 0.651 total abu (g/kg BK) (Menke and Steingass 1988). Parameter yang diukur terdiri atas pH, N-NH3, kecernaan KCBO, gas total, CH4,
VFAs, jumlah protozoa, kuantifikasi DNA total bakteri dan metanogen menggunakan qPCR, dan keragaman bakteri dan metanogen rumen menggunakan T-RFLP.
Penelitian Tahap III (Fermentasi in vivo)
tahap I. Silo yang digunakan dalam pembuatan silase ini adalah tong plastik biru berkapasitas 80 kg. Jumlah total silase yang dibuat sebanyak 1.800 kg.
Rancangan penelitian yang digunakan adalah Rancangan Tukar Ganti (Cross Over) dengan 4 perlakuan dan 3 ulangan (periode pengambilan sampel). Persentase pakan perlakuan yang digunakan mengacu pada penelitian tahap II yaitu mendekati penggunaan 50% silase. Perlakuan pakan yang digunakan adalah sebagai berikut; R0: 50% P. purpureum + 50 % konsentrat, R1: 20% P. purpureum + 50 % konsentrat + 30% silase, R2: 20% P. purpureum + 35 % konsentrat + 45% silase, R3: 20% P. purpureum + 20 % konsentrat + 60% silase. Setiap pakan perlakuan diberikan selama 17 hari secara berturut-turut bergantian dengan periode pengambilan sampel 7, 12, dan 17 hari. Tiga sapi fistula diberikan total konsumsi pakan lebih kurang 2% BK dari bobot badannya (245 kg).
Cairan rumen diambil secara teratur 3 jam setelah pemberian setiap pakan perlakuan. Sampel isi rumen yang diambil sebanyak 200 g ditempatkan pada tabung corning steril. Sebagian sampel langsung dilakukan pemerasan menggunakan 2 lapis kain kasa steril untuk analisa kimia dan mikrobiologi. Parameter yang diamati terdiri atas pH, N-NH3, VFAs, jumlah protozoa,
kuantifikasi DNA total bakteri dan metanogen menggunakan qPCR, dan keragaman bakteri dan metanogen rumen menggunakan T-RFLP dan pustaka klon 16S rDNA.
Analisis Kimia
Silase dan sampel pakan dianalisis menggunakan prosedur standar untuk proksimat dari AOAC (1997) dan VanSoest et al. (1991) untuk kandungan fraksi serat. Kandungan BK dan abu ditentukan secara berurutan menggunakan oven 105oC selama 4 jam (thermo scientific) dan tanur pada suhu 550oC selama 4 jam (Heraus). Protein kasar, lemak kasar (LK), dan serat kasar (SK) dianalisa masing-masing menggunakan FOSS (Kjeltec™ 8400 analyzer, Soxtec™ 2050, dan
Fibertec™ 2010, Sweden). Neutral detergent fiber (NDF), acid detergent fiber
(ADF), acid detergent lignin (ADL), dan selulosa dianalisis menggunakan alat
Fibertec (FOSS Fibertec™ 2010, Sweden). Total fenol (TF) dan total tanin (TT) dianalisis menggunakan metode Folin-Ciocalteu (Makkar 2003; Jayanegara et al. 2011a). Medium buffer in vitro dilakukan analisis terdiri atas pH (Cyberscan pH310 Eutech), N-NH3 (microdiffusion Conway, dianalisa di Laboratorium
Nutrisi Ternak Perah Departemen INTP FAPET IPB),VFAs (GC-FID, Bruker Scion 436, dianalisa di Balai Penelitian Ternak Ciawi), dan konsentrasi CH4
(GC-TCD, Shimadzu 8A, analisa dilakukan di Departemen Teknik Kimia Universitas Indonesia).
Perhitungan Jumlah Protozoa
Jumlah protozoa dalam medium buffer HGT dan cairan rumen diobservasi dengan mikroskop (Olympus CX41) dan dihitung menggunakan metode perhitungan langsung (Ogimoto and Imai 1981). Sampel dari perlakuan in vitro
suhu ruang (30oC) sampai analisis dilakukan. Jumlah protozoa dihitung tiga kali
ulangan dengan masing-masing volume sebesar 25 µl menggunakan counting chamber (Neubauer Marienfeld, Germany) dibawah mikroskop dengan pembesaran 500 kali. Jumlah total protozoa dihitung berdasarkan: (1000 x DF x TC x 40)/(0.1 x 0.0625 x 16 x 5), DF: factor pengenceran, TC: Jumlah total dari pengamatan.
Ekstraksi DNA
Ekstraksi total DNA dilakukan menggunakan Genomic DNA Mini Kit (Blood/Culture cell) berdasarkan protokol Buffy Coat (Geneaid) dengan modifikasi penambahan Proteinase K (konsentrasi akhir 2 mg/ml) dan RNAse A (konsentrasi akhir 10 mg/ml). Total DNA dari masing-masing ulangan untuk setiap perlakuan dilakukan penggabungan, untuk analisis T-RFLP didapatkan sampel gabungan DNA pada setiap perlakuan sebanyak 5 sampel dari pembuatan silase, 5 dari fermentasi in vitro, dan 12 dari fermentasi in vivo, untuk analisis qPCR sebanyak 5 sampel dari fermentasi in vitro dan 4 sampel dari fermentasi in vivo, dan untuk analisis pustaka klon 16S rDNA dilakukan hanya pada sampel fermentasi in vivo yaitu sebanyak 4 sampel.
Analisis T-RFLP
Analisis T-RFLP dilakukan dengan 4 tahap menggunakan metode Sakamoto
et al. (2006) dengan beberapa modifikasi. Tahap pertama, amplifikasi 16S rDNA dengan total volume reaksi PCR sebanyak 50 µl (5 µl total DNA (<1 µg/µl), 0.5 µl ExTaq (Takara, Shuzo), 5 µl 10X buffer, 4 µl dNTP mixture, 1 µl setiap primer F dan R (10 pmol/µl), dan 33.5 µl air destilasi (DW). Amplifikasi ini menggunakan primer berlabel 6FAM-27F dan 1492R untuk total bakteri (Lane 1991) dan primer berlabel 6FAM-Met86F dan Met1340R (Wright et al. 2004) untuk total metanogen. Amplifikasi 16S rDNA menggunakan Biometra Thermocycler TGradient dengan program untuk total bakteri; 95oC selama 3 menit, 30 siklus; 95oC selama 30 detik, 50oC selama 30 detik dan 72oC selama 1.5 menit, dengan perpanjangan akhir 72oC selama 10 menit dan untuk total
metanogen (Danielsson et al. 2012) dengan program: 5 menit pada suhu 94oC, 30 siklus; 94oC selama 30 detik, 57oC selama 30 detik, dan 68oC selama 1 menit; dan perpanjangan akhir selama 7 menit pada suhu 68 oC. Tahap kedua, hasil produk PCR dipurifikasi menggunakan purification Kit (Mo Bio Laboratories). Tahap berikutnya produk PCR murni dipotong dengan 4 enzim restriksi berbeda untuk bakteri dan metanogen (AluI, HhaI, MspI dan RsaI, TaKaRa Shuzo Japan). Total volume reaksi yang digunakan 10 µl terdiri dari DNA murni 2 µl, 1 µl 10X buffer, 5 µl DW, dan 2 µl enzim restriksi 20U (untuk setiap enzim restriksi AluI,
HhaI, MspI dan RsaI) dan untuk enzim restriksi MspI (DNA murni 2 µl, 1 µl 10X buffer, 4 µl DW, 1 µl BSA dan 2 µl enzim restriksi 20U), kemudian diinkubasikan pada 37oC selama 1 jam. Tahap terakhir, hasil produk pemotongan dianalisis panjang fragmennya (T-RF) menggunkan sekuenser ABI PRISM 3100
Genetic Analyzer (Applied Biosystems) pada mode GeneScan. Panjang T-RFs hasil GeneScan diestimasi menggunakan GeneMapper versi 4.0 dan Peak Scan
kedekatan mikroba setiap sampel disusun berdasarkan metode UPGMA. Identitas bakteri silase dan mikroba rumen pada fermentasi in vitro disusun berdasarkan ukuran T-RFs hasil analisis yang disejajarkan dengan database MiCA III (Shyu et al. 2007). Parameter keragaman mikroba ditentukan menggunakan Shannon indeks (Magurran 2004) atau indeks keragaman Evar(Blackwood et al. 2007).
Analisis Pustaka Klon 16S rDNA
Analisa pustaka klon 16S rDNA dilakukan menggunakan metode Sakamoto
et al. (2006) dengan beberapa modifikasi. Primer yang digunakan 27F (tanpa label FAM) dan 1492R untuk bakteri, dan 86Met-F (tanpa label FAM) dan 1340Met-R untuk metanogen. Tahap pertama total DNA genom dilakukan amplifikasi dengan kondisi yang sama pada analisa T-RFLP. Amplikon murni diligasikan dalam vector pCR® 2.1 pada suhu 14oC selama 1 malam dengan volume reaksi 10 µl. Kemudian hasil ligasi tersebut ditransformasikan pada sel kompeten E.coli INFαF’ menggunakan One Shot® Chemical Transformation original TA cloning kit (Invitrogen, San Diego, CA). Hasil transformasi ditumbuhkan pada medium LB yang mengandung ampicillin 100 µg/ml. Keberhasilan transformasi dan kloning ditandai dengan tumbuhnya koloni rekombinan putih resisten ampicillin hasil dari seleksi biru putih (X-Gal 40 µg/ml medium LB). Selanjutnya untuk mengetahui sisipan gen insert pada koloni rekombinan tersebut diamplifikasi menggunakan primer M13F dan M13R dengan metode PCR koloni. Volume reaksi PCR koloni sebanyak 20 µl dengan program sesuai kondisi untuk 16S rDNA bakteri dan metanogen. Komposisi reaksi PCR koloni 1 ml adalah 10X buffer 100 µl, dNTP mixture 80 µl, 10 µl setiap primer F dan R (10 pmol/µl), H2O
795 µl, dan ExTaq 5 µl. Produk PCR koloni selanjutnya dielektroforesis pada 1.5% agaros gel selama 30 menit. Positif koloni rekombinan ditandai dengan ukuran 1492 bp untuk bakteri dan 1340 bp untuk metanogen. Identifikasi insert yang dibawa oleh rekombinan koloni ditentukan dengan siklus sekuensing menggunakan primer 27F dan 520R untuk bakteri, primer 86Met-F dan 520Met-R untuk metanogen. Sekuen DNA hasil siklus sekuensing dianalisa menggunakan sekuenser ABI PRISM 3100 Genetic Analyzer (Applied Biosysytem). Semua sekuen DNA yang didapatkan diperiksa secara manual dan dialignment menggunakan BioEdit berdasarkan sekuen primer yang digunakan. Selanjutnya sekuen disejajarkan dengan GenBank database menggunakan BLAST search NCBI (Zhang et al. 2000) dan EzTaxon (Kim et al. 2012). Pohon filogenetik bakteri dan metanogen rumen disusun berdasarkan sekuen pustaka klon 16S rDNA dan data rujukan RDP II GenBank database (Cole et al. 2009). Sekuen bakteri dan metanogen hasil pustaka klon selanjutnya dianalisis situs pemotongannya menggunakan software BioEdit versi 7 pada bagian restriction map. T-RFs yang sama antara hasil pustaka klon 16S rDNA dan hasil T-RFLP digunakan sebagai identitas mikroba pada analisis T-RFLP dalam fermentasi in vivo.
Analisis Quantitative Real Time PCR (qPCR)
0.4 µl masing-masing spesifik primer F dan R (10 pmol/µl), 7.2 µl DW, dan 2 µl amplifikasi dengan primer spesifik sebagai dasar kuantifikasi qPCR. Kurva melting digunakan untuk mengetahui spesifisitas primer yang digunakan. Data kuantifikasi dianalisa menggunakan LightCycler3 analysis software versi 5.3 (Roche Diagnostic). Analisa qPCR menggunakan spesifik primer untuk menguantifikasi total bakteri, Methanobacteriales, Methanosarcinales, dan total metanogen (Tabel 1). Mikroba rujukan yang digunakan sebagai standar DNA total bakteri adalah E. coli JM109, dan standar DNA metanogen adalah
Methanobrevibacter ruminantium JCM13430, Methanosarcina barkeri
JCM10043. DNA mikroba tersebut sebelumnya di ekstrak dengan Kit Genomik DNA (Mo Bio Laboratories, Inc., Carlsbad, CA) dan diukur konsentrasinya dengan GenQuant (Thermo scientific). Standar DNA setiap mikroba rujukan dilakukan pengenceran konsentrasi secara serial 10-1, 10-2, 10-3, 10-4, dan 10-5 untuk menentukan kurva linier standar.
Tabel 1. Sekuen spesifik primer qPCR untuk target mikroba rumen
Primer Sekuen 5’- 3’ Sumber Pustaka
Total Bakteri For-CGGCAACGAGCGCAACCC
Rev-CCATTGTAGCACGTGTGTAGCC
Denman and McSweeney 2006
Total Metanogen For-TTCGGTGGATCDCARAGRGC
Rev-GBARGTCGWAWCCGTAGAATCC
Data yang didapatkan dari parameter kualitas silase dan parameter fermentasi